Изобретение относится к соединениям, полезным для подавления ретровируса в клетках человека, инфицированного указанным ретровирусом. В настоящем изобретении, в частности, заявляются пиран-2-оны, 5,6-дигидропиран-2-оны, 4- гидроксибензопиран-2-оны, 4-гидроксициклоалкил[b] пиран-2-оны и их производные в качестве ингибиторов ВИЧ-протеиназы.
Предпосылки изобретения
В течение последнего десятилетия синдром приобретенного иммунодефицита (СПИД) из медицинской диковины, которая поражала лишь небольшое количество пациентов, превратился в значительную проблему, как медицинскую, так и экономическую. John Saunders and Richard Storer, "New Development in RT Inhibitors", DN&P 5(3), April 1992, pages 153-169. Цифры, приводимые Всемирной организацией здравоохранения, свидетельствуют о том, что во всем мире зарегистрировано 360000 случаев СПИДа, в том числе около 175000 случаев в США. Из них приблизительно 100000 случаев (50000 в США) зарегистрировано за последние 12 месяцев. Предполагают, что в США количество людей с позитивной серологической реакцией составляет приблизительно два миллиона человек, а число людей с позитивной серологической реакцией во всем мире составляет приблизительно 5-10 миллионов человек. Saunders and Storer, page 153.
Co времени первого описания заболевания десять лет назад синдром приобретенного иммунодефицита (СПИД) и его разрушительные последствия являются объектом постоянного и пристального освещения как в неспециальной, так и научной литературе. Целый номер журнала "Sientific American" был полностью посвящен СПИДу (Sientific American, (1988), 289, N 4), а количество сообщений о самом заболевании и вирусе уже таково, что их практически невозможно подробно процитировать.
20 марта 1987 Федеральным актом о лекарственных препаратах одобрено использование соединения эидовудина (AZT) для лечения больных СПИДом с начальными приступами плазмоклеточной пневмонии, больных СПИДом с состояниями, отличными от плазмоклеточной пневмонии, или пациентов, инфицированных вирусом, у которых абсолютное количество CD4 лимфоцитов составляет менее 200 на миллилитр крови периферийной кровяной системы. AZT является известным ингибитором обратной транскриптазы вируса, фермента, необходимого для репликации вируса иммунодефицита человека. В Патенте США 4724232 заявляется способ лечения людей, заболевших СПИДом, с помощью 3'-азидо-3'-деокситимидина (азидотимидина, AZT).
После открытия анти-ВИЧ-активности AZT усилия многих исследователей в поисках средств, обладающих лучшим действием, были направлены на различные аналоги дидеоксинуклеозидов. В случае серий 2'.3'-дидеокси, соединения ddC и ddI показали потенциальную активность по отношению ВИЧ in vitro и были подвергнуты клиническим испытаниям. Saunders and Storer, page 160. Соединение ddC в настоящее время выпускается компанией "Hoffman-La Roche Со." в качестве потенциального лекарства против СПИДа. Токсичность этого препарата, ограничивающая его использование при лечении людей, проявляется в периферийной нейропатии, которая обратима при небольших дозах. Raymond R. Schinazi, Jan R. Mead and Paul M. Feorino, "Insights Into HIV Chemotherapy", AIDS Research and Human Retroviruses, Vol. 8, Number 6, 1992, pages 963-990. Он одобрен Федеральным актом о лекарственных препаратах для терапии СПИДа в сочетании с AZT. Соединение ddI также было подвергнуто клиническим испытаниям. Токсичность этого препарата, ограничивающая его использование при лечении людей, проявляется в периферийной нейропатии и панкреатите. Было также показано, что он стимулирует печеночный гликолиз, который приводит к необратимому поражению печени. Schinazi, Mead and Feorino, page 966. Это соединение недавно одобрено Федеральным актом о лекарственных препаратах для лечения ВИЧ-1 инфекций у взрослых пациентов и детей, которые не переносят AZT или здоровье которых значительно ухудшилось при лечении с использованием AZT. Schinazi, Mead and Feorino, page 966.
Среди этих одобренных лекарств AZT в настоящее время остается единственным лекарственным средством, которое, как было показано, уменьшает смертность и частоту возникновения инфекций условно-патогенных микроорганизмов, вызванных СПИДом. Schinazi, Mead and Feorino, page 963.
Вирус иммунодефицита человека (ВИЧ) в течение длительного времени считался агентом, вызывающим СПИД, хотя было высказано несколько противоположных мнений (в частности, P. Duesberg, Proc. Natl. Acad. Sci., USA., (1989), 86: 755-764). Анализ первичной структуры геномов, выделенных из инфекционных и неинфекционных изолятов ВИЧ, позволил в значительной степени пролить свет на строение вируса и типы молекул, которые важны для его репликации и созревания в инфекционные виды. ВИЧ-протеаза ответственна за процессинг полипептидов gag и gag-pol вируса в зрелые белки вириона. L. Ratner et al., Nature, 313: 277-284 (1985); L.H. Pearl and W.R. Taylor, Nature, 329: 351 (1987). ВИЧ проявляет ту же самую организацию gag/pol/env, которая наблюдается в других ретровирусах. L. Ratner et al., см. ранее; S. Wain-Hobson et al. Cell, 40: 9-17 (1985); R. Sanches-Pescador et al. Science, 227: 484-492 (1985); и M.A. Muesing e-t al. Nature, 313: 450-458 (1985).
Обратная транскриптаза представляет собой фермент, уникальный для ретровирусов, который катализирует превращение вирусной РНК в двухцепочечную ДНК. Блокировка на любой стадии процесса транскрипции, под действием AZT или другого абберантного деоксинуклеозидтрифосфата, не способного к удлинению, должно приводить к драматическим последствиям при репликации вируса. Проводится большое количество работ, посвященных обратной транскриптазе, которые в значительной мере основываются на том, что нуклеозиды, подобные AZT, легко доставляются в клетки. Однако, неэффективность стадий фосфорилирования для трифосфата, отсутствие специфичности и, как следствие, токсичность являются основными недостатками использования AZT и аналогичных нуклеозидов, у которых блокирована или отсутствует 3'-гидроксильная группа.
Рецептор ВИЧ клеток T4, так называемая молекула CD4, также является объектом вмешательства при терапии СПИДа. R. А. Fisher et al. Nature, 331: 76-78 (1988); R.E. Hussey et al., Nature, 331: 78-81 (1988); и К.С. Deen et al. Nature, 331: 82-84 (1988). Внешнюю часть этого трансмембранного белка, молекулу, содержащую 371 остаток аминокислот (sCD4), экспрессируют в клетках яичника китайского хомячка, и компания "Genentech" (D.H. Smith et al. Science, (1987), 238: 1704-1707) проводит клинические испытания полученного продукта с осени 1987 года. Было показано, что CD4 обладает узким спектром активности против вируса дикого типа и пока не в состоянии контролировать ВИЧ-инфекцию у людей. Schinazi, Mead and Feorino, page 963. Идея, заложенная в терапию на основе CD4, заключается в том, что молекулы могут нейтрализовать ВИЧ, препятствуя присоединению вируса к T4 и другим клеткам, которые экспрессируют CD4 на своей поверхности. Вариацией на эту же тему является прикрепление клеточных токсинов к CD4, с целью специфического связывания и доставки в инфицированные клетки, которые воспроизводят на своей поверхности гликопротеин gp-120. М.А. Till et al. Science, 242: 1166-1168 (1988); и V.К. Chaudhary et al. Nature, 335: 369-372 (1988).
Другой мишенью при терапии СПИДа является ингибирование вирусной протеазы (или протеиназы), которая важна для процессинга предшественников полипептидов слияния ВИЧ. Для вирусов иммунодефицита человека и других ретровирусов было установлено, что протеолитическое созревание полипептидов слияния gag и gag/pol (процесс, необходимый для генерации инфицирующих частиц вируса) инициируется протеиназой, которая, в свою очередь, кодируется po1 областью генома вируса. Y. Yoshinaka et al., Proc. Natl. Acad. Sci., USA, 82: 1618-1622 (1985); Y. Yoshinaka et al., J. Virol., 55: 870-873 (1985); Y. Yoshinaka et al., J. Virol., 57: 826-832 (1986); и К. von der Helm, Proc. Natl. Acad. Sci. , USA, 74: 911-915 (1977). Было показано, что ингибирование протеазы подавляет процессинг p55 ВИЧ в клетках млекопитающих и репликацию ВИЧ в T-лимфоцитах. T.J. McQuade et al. Science, 247: 454 (1990).
Протеаза (или протеиназа), содержащая всего 99 аминокислотных остатков, является одним из самых маленьких из известных ферментов, а демонстрируемая ею гомологичность аспартопротеазам, таким как пепсин и ренин (L.H. Pearl and W. R. Тауlor. Nature, (1987) 329: 351-354; и I. Katoh et al. Nature, (1987) 329: 654-656) заставляет прийти к выводам относительно трехмерной структуры и механизма действия фермента (L.H. Pearl and W.R. Taylor, см. ранее), что позднее было подтверждено экспериментально. Активная ВИЧ-протеаза экспрессируется в бактерии (см., в частности, P.L. Darke et. al., J. Biol. Chem., (1989) 264: 2307-2312) и может быть синтезирована химическими способами (J. Schneider and S.B. Kent, Cell, (1988) 54: 363-368 и R.F. Nutt et al., Proc. Natl. Acad. Sci., USA, (1988) 85: 7129-7133). Сайт- направленный мутагенез (P. L. Darke et al., см. ранее и N.E. Kohl et al., Proc. Natl. Acad. Sci., USA, (1988) 85: 4686-4690) и ингибирование пепстатина (P.L. Darke et al., J. Biol. Chem. , (1989) 264: 2307-2312; S. Seelmeier et al., Proc. Natl. Acad. Sci. , USA (1988) 85: 6612-6616; C.-Z. Giam and I. Borsos, J. Diol. Chem., (1988) 263: 14617-14720; и J. Hansen et al., EMBO J., (1988) 7: 1785-1791) подтверждают механистическую функцию ВИЧ- протеазы как аспартопротеазы. Исследования показали, что протеаза проводит расщепление по ожидаемым местам в пептидах, смоделированных из областей, действительно расщепленных под действием фермента в предшественниках белков gag и pol в процессе созревания вируса. B. L. Darke et al., Biochem. Biophys. Res. Communs., 156: 297-303 (1988). Рентгеноструктурный анализ ВИЧ-протеазы (М.А. Navia et al., Nature, (1989) 337: 615-620) и родственного фермента ретровируса из вируса саркомы Руса (М. Miller et al. Nature, (1989) 337: 576-579) позволяет обнаружить активный сайт в димере протеазы, который идентичен активному сайту в других аспартопротеазах, и заставляет высказать предположение (L.H. Pearl and W.R. Taylor, см. ранее), что фермент ВИЧ активен в виде димера. См. также Joseph A. Martin, "Recent Advances in the Design of HIV Proteinase Inhitors", Antiviral Research, 17 (1992) 265-278.
В настоящее время продолжается научный поиск наиболее эффективных и безопасных способов ингибирования ретровируса у человека, зараженного указанным вирусом, и, таким образом, эффективного лечения заболеваний, вызываемых подобным вирусом, таких как синдром приобретенного иммунодефицита (СПИД).
Опубликованная информация
В JO 3227-9 23-А (компания "Sawai Seiyaku KK") описывается использование 4-гидроксикумаринов в качестве терапевтических средств для ВИЧ-инфицированных пациентов; однако лишь незамещенный 4-гидроксикумарин является единственным соединением, которое специально используется по указанному назначению.
В Международной заявке WO 91/04663 (Калифорнийский университет в Окленде) приводятся 6-амино-1,2-бензопироны, которые полезны для лечения вирусных заболеваний.
В Международной заявке WO 91/12804 (компания "Kabi Pharmaceutical"), опубликованной 5 сентября 1991, заявляется использование N-фенил-N-метил-1,2- дигидро-4-гидрокси-1-метил-2-оксозинолин-3-карбоксамида, известного также Linomide®, для лечения ретровирусных инфекций.
В Международной публикации WO 89/07939, опубликованной 8 сентября 1989, заявляются специфичные кумарины, которые являются ингибиторами обратной транскриптазы.
В Патентах США с номерами 3489774 и 3493586 заявляются производные 3-[бета-арил-бета-(арилтио)(или арилселено)] пропионил-кумарина или пирона, полезные в качестве паразитицидов.
В Biochemical and Biophysical Research Communications, Vol. 188, N 2, 1992, pages 631-637 описываются хромоны, содержащие гидроксильные заместители и фенольные группы в 2-положении (флавоны), обладающие активностью против ВИЧ-1-протеиназы.
В Antimicrobial Patent Fast-Alert, Week Ending 4 September 1992, приводятся гамма-пироны, гамма-пиридоны и гамма-тиопироны в качестве антивирусных средств.
В Международных публикациях WO 92/04326, 92/04327 и 92/04328, опубликованных 19 марта 1992, описываются антивирусные гетероциклические производные, такие как хинолиноны и бензопираноны, в качестве ингибиторов репликации для лечения простого герпеса 1 и 2, вируса цитомегалии и вируса Эпштейна-Барра.
В С.A. Selects: Antitumor Agents, Issue 19, 1992, page 25, N 117: 90147g (Международная заявка WO 92/06687) описывается получение 5-иод-5-амино-1,2-бензопиронов и их аналогов в качестве цитостатических и антивирусных средств.
Ни в одной из этих публикаций не описывается и не предлагается использование 4-гидрокси-альфа-пиронов в качестве ингибиторов ВИЧ-протеазы или веществ, обладающих антивирусной активностью.
В Phytochemistry, 31(3): 953-956 (1992) приводятся такие соединения, как метиловый эфир 4-гидрокси-альфа-(4-метокси-фенил)-6-[2-(4-метоксифенил)этенил]-2-оксо- (E)-(-)-2H-пиран-3-карбоновой кислоты.
В Tetrahedron, 48(9): 1695-1706 (1992) (см. также Tetrahedron Lett., (1989) 30(23): 3109-12) описываются такие соединения, как 3-[1-(4-хлорфенил)-3-(4-нитрофенил)-2-пропенил] -4-гидрокси-6-метил-2H-пиран-2-он; 3-[3-(4-хлорфенил)-1-(4-нитрофенил)-2- пропенил]-4-гидрокси-6-метил-2H-пиран-2-он; 4-гидpoкcи-3-[3-(4-метоксифенил)-1-(4-нитрофенил)-2-пропенил]-6-метил-2H- пиран-2-он; и 4-гидрокси-3-[1-(4-метоксифенил)-3-(4-нитрофенил) -2-пропенил]-6-метил-2H-пиран-2-он.
В Tenneh Yuki Kagobutsu Toronkai Koen Yoshishu, 30: 17-24 (1988) приводятся такие соединения, как метиловый эфир 4-гидрокси-бета-(4-метоксифенил)-6-[2-(4-метоксифенил)этенил] -2-оксо-(E)- (-)-2H-пиран-3-пропановой кислоты.
В Chem. Abstr. 53: 15072f описываются такие соединения, как дельта-лактон альфа-1,3-дигидрокси-2-бутенилиден-бета-этил-гидроксикоричной кислоты.
В Chem. Abstr. 53: 15072с описываются такие соединения, как дельта-лактон альфа-1,3-дигидрокси-2-бутенилиден-бета-изопропил- гидроксикоричной кислоты.
В Arch. Pharm. (Weinheim, Ger. ), 316(12): 988-94 (1983) описываются такие соединения, как 3-[1-(4-хлорфенил)-3-оксо-бутил] -4-гидрокси-6- метил-2H-пиран-2-он и 3-[1-(4-хлорфенил)-пропил]-4-гидрокси-6- метил-2H-пиран-2-он.
В Chem. Ber. , 110(3): 1047-57 (1977) приводятся такие соединения, как 6-(3,4-диметоксифенил)-3-[2-(3,4-диметоксифенил)-1- (4-метокси-2-оксо-2H-пиран-6-ил)этил] -4-гидрокси-2H-пиран-2-он и 3-[2-(3,4-диметоксифенил)-1-(4-метокси-2-оксо-2H-пиран-6-ил) этил] -4-гидpoкcи-6-[2-(4-метоксифенил)-этил]-2H-пиран-2-он.
В Heterocycl. Chem., 23(2): 413-16 (1986) приводятся такие соединения, как 3-[(4-хлорфенил)-1-пиперидинилметил]-4-гидрокси-6-метил-2H-пиран-2-он.
В следующих заявках, опубликованных по договору о патентной кооперации, приводятся пептиды, полезные в качестве ингибиторов протеазы ретровируса: Международная публикация WO 91/06561 (опубликованная 16 мая 1991) и Международная публикация WO 92/17490 (опубликованная 15 октября 1992).
В следующих публикациях описываются производные пирона, которые представляют собой известные из области техники соединения:
В ЕР-443449 (на немецком языке) приводятся 3-гексил-5,6-дигидро-6-пентил-2H-пиран- 2-он и 3-этил-6-гексадецил-5,6-дигидро-4-гидрокси-2H-пиран-2-он. В Pestic. Sci. , 27(1): 45-63 (1989) приводятся 5,6-дигидро-4- гидрокси-6-метил-6-(1-метил-1-пропенил)-3-(1-оксобутил)-2H-пиран- 2-он и 6-циклопропил-5,6-дигидро-4-гидрокси-6-метил-3- (1-оксобутил)-2H-пиран-2-он. В Acta. Chem. Scand., 43(2): 193-95 (1989) приводится 4-(ацетилокси)-5,6-дигидро-3,6-диметил-2H-пиран- 2-он. В J. Org. Chem., 54(14): 3389-9 (1989) приводится 5,6-дигидро-4-гидрокси-3,6,6-триметил-2H-пиран-2-он. В J. Org. Chem. , 53(6): 1218-21 (1988) и Tetrahedron Lett., 34(2): 277-80 (1993) приводится (6R)-3-гексилдигидро-6-ундецил-2H-пиран-2,4 (3H)-дион. В J. Chem. Soc. Perkin Trans. , 1(6): 1157-9 (1985) приводится дигидро-3-метил-6-нонил-6-[[(тетрагидро-2H-пиран-2-ил) окси]-метил]-2H-пиран-2,4-(3H)-дион. В J. Chem. Ecol. , 9(6): 703-14 (1983) приводится 5,6-дигидро-4-гидрокси-3,6-диметил-2H- пиран-2-он. В J. Org. Chem., 48 (7): 1123-5 (1983) приводится (Z)(+-)-6-(2-хлор-1-метилэтенил-5,6-дигидро-4-гидрокси-3-метил-2H- пиран-2-он. В Acta Chem. Scand., 43(2): 193-95 (1989) и Tetrahedron Lett., 21 (6): 551-4 (1980) приводится 5,6-дигидро-4-гидрокси-3,6-диметил-2H-пиран-2-он. В Helv. Chem. Acta, 59(7): 2393-2401 (1976) приводится 4-[(3,6-дигидро-4-гидрокси-5-метил-6-оксо-2H-пиран-2-ил)метил]-2,6-пиперидиндион. В Acta Chem. Scand. , 30 (7): 613-18 (1976) и Tetrahedron Lett; 22: 1903-4 (1976) приводятся 5,6-дигидро-4-гидрокси-3-метил-6-(1-метил-1-пропенил)-2H-пиран-2-он, (E) - 3,3'-[(4-нитрофенил)метилен]бис-[5,6-дигидро-4-гидрокси-6-метил]-2H-пиран -2-он и 3,3'-(фенилметилен)бис-[5,6-дигидро-4-гидрокси-6-метил]-2H-пиран-2-он приводится в Synth. Commun,. 20 (18): 2827-2836 (1990).
В Международной заявке WO 93/07868, опубликованной 29 апреля 1993, приводятся новые производные нитробензопирона, нитрозобензамида и нитрозоизохинолина в качестве ингибиторов дисфосфорорибозотрансферазы для лечения вирусных инфекций и рака.
Международная заявка WO 93/07128, опубликованная 15 апреля 1993, относится к замещенным циклическим карбонилам и их производным, полезным в качестве ингибиторов протеазы ретровируса.
В J. Indian Chem. Soc., 69: 397-398 (July 1992) сообщается, что кумарин-4-уксусные кислоты подвергнуты испытаниям на антираковую и анти-СПИД активность и оказались неактивными.
В Journal of Antibiotics, 46 (7) : 1126 (July 1993) сообщается о том, что гермицидин, который представляет собой 6-(2-бутил)-3-этил-4-гидрокси-2-пирон, является ауторегуляторным ингибитором развития Streptomyces viridochromogenes NRRL B-1551.
В Derwent Abstracts, 93-168920/21 Европейской патентной заявки 543201 описывается использование производных кумарина, таких как 1-(N-морфолил)-6-(4-гидросибензойной кислоты этиловый эфир) гексана для лечения вирусных инфекций, таких как грипп или острый ринит.
В J. Org. Chem. , 48(22): 3945-7 (1983) и Chem. Pharm. Bull., 29(10): 2762-8 (1981) приводятся такие соединения, как 4-гидрокси-6-(3-пиридинил) -2H-пиран-2-он. В J. Labelled Compd. Radiopharm., 28(10): 1143-8 (1990) описываются такие соединения, как 4-гидрокси-6-метил-2H-пиран-2- он.
В J. Am. Chem. Soc., 113(25): 9585-95 (1991) приводятся такие соединения, как 3-(3-фенил-2-пропен-1-ил)-6-метил-4-гидрокси-2H- пиран-2-он.
В CA 54:14239d и С 53: 4272с приводятся такие соединения, как дельта-лактон альфа-(альфа, гамма-дигидроксициннамилиден) гидрокоричной кислоты.
В CA 53:15072f описываются такие соединения, как дельта-лактон альфа-1,3-дигидрокси-2-бутенилиден-бета-этил-гидроксикоричной кислоты.
В Synth. Commun., 20(18):2827-36 (1990) приводятся такие соединения, как 3,3'-[(4-нитрофенил)метилен] бис-[5,6-дигидро-4-гидрокси-6- метил] -2H-пиран-2-он и 3,3'-(фенилметилен)-бис-[5,6-дигидро-4-гидрокси-6-метил]-2H-пиран-2-он.
В J. Org. Chem., 54(14): 3383-9 (1989) приводятся такие соединения, как 5,6-дигидро-4-гидрокси-3,6,6-триметил-2H-пиран-2-он.
В Derwent Abstracts, 92-166863/20 Европейской патентной заявки 553248 описывается использование новых производных 5-иод-6-амино-1,2-бензопирона, которые являются ингибиторами дифосфорибозы, для лечения и предотвращения вирусных инфекций и опухолей, вызываемых СПИДом.
В Synthesis of Heterocycles. XV. 4-Hydroxy-2- pyronocyclenes. E. Ziegler, H. Junek and E. Nolken, Monatsh., 89: 678-82 (1958) (CA 53: 12283-4) приводятся следующие соединения: 4- гидрокси-3-бензил-5,6-октаметилен-2-пирон; 4-гидрокси-3-бензил- 5,6-пентаметилен-2-пирон; 4-гидрокси-3-бензил-5,6-гептаметилен-2- пирон; 4-гидрокси-3-бензил-5,6-гексаметилен-2-пирон; и 4-гидрокси-3-бензил-5,6-тридекаметилен-2-пирон.
В R. Effenberger, Т. Ziegler, K. -H. Schonwalder, T. Kesmarszky, В. Bauer, Chem. Ber. , 119: 3394-3404 (1986) описываются производные пирона, такие как обозначенные формулой J-1 (где n равно 4; см. далее на Схеме J).
В Monatsh. Chem., 119(6-7): 727-37 (1988) (CA 110(13): 114430k) приводятся такие соединения, как 10-гидрокси-9-(фенилмeтил)-8H-aцeнaфтo[1,2-b] пиpaн-8-oн и 1-гидрокси-2-(фенилметил)индено[2,1-b]пиран-3(5H)-он.
В CA 54: 14239b описывается соединение 3-бензил-4-гидрокси-2-оксоиндено-[1,2-b]пиран.
В Monatsh. Chem., 113(4): 475-84 (1982) приводятся такие соединения, как 6,7-дигидро-4-гидрокси-6-(3-метилфенил)-7-фенил-3-(фенилметил)пирано [2,3-c] пиррол-2,5-дион и 6,7-дигидро-4-гидрокси-6,7-дифенил-3- (фенилметил)пирано[2,3-с]пиррол-2,5-дион.
В Monatsh. Chem. , 90: 594-9 (1959) (CA 54:14238g,h) приводятся такие соединения, как дельта-лактон альфа-бензил-6,7-дигидро-бета-9-дигидрокси- 5H-бензоциклогептен-8-акриловой кислоты и 3-бензил-5,6,7,8-тетрагидро-4-гидрокси-8-изопропил-5-метилкумарин.
В Bull. Soc. Chim. Fr. 5: 1719-23 (1969) (CA 71(21): 101655p) описывается соединение 3-бензил-5,6,7,8-тетрагидро-4-гидроксикумарин.
В WO 8804652 (аналог AU 8810440 (яп.)) описывается 3-(4-хлор-2-нитробензоил)-5,6,7,8-тетрагидро-4-гидрокси-2H-1-бензопиран -2-он.
В Monatsh. Chem. , 92:246-53 (1961) Gr (CA 55:27296d) приводятся такие соединения, как 3-(3,5-диметилсалицил)-5,6,7,8-тетрагидро-4-гидроксикумарин.
В CA 94(9):65472 описывается 5,6,7,8,9,10-гексагидро-3- фенил-2H-циклоокта[b] пиран-2-он и 6,7,8,9-тетрагидро-4-гидрокси- 3-фенил-2H-циклoгeптa[b] пиpaн-2(5H)-он.
В J. Org. Chem., 28(11):3112-14 (1963) (СA 59: 15185e) приводится соединение дельта-лактон 2-[гидрокси(2-гидрокси-1-циклопентен-1-ил) метилен] гександионовой кислоты.
В Antimicrobial Patent Fast-Alert, Week Ending 30 April 1993, приводятся циклические мочевины и их аналоги, полезные в качестве ингибиторов протеазы ретровирусов.
Известно большое количество соединений типа 4-гидроксикумарина. Например, в следующих публикациях - CA 54: 577e, g, h (1960); Патент СШA 2872457 (СA 53: 12305е (1959)); СA 51: 14826f, h (1957); Патент СШA 2723276 (CA 52: 5480g, h (1958)); СA 51: 14827a, b (1957); СA 51: 16453а (1957); СA 54: 5699d (1960); СA 54: 16450f (1960); СA 53: 22454а (1959) и СA 53: 20046а - приводятся следующие соединения: 4-гидрокси-3-(1-фенилбутил)кумарин; 4-гидрокси-3- (1-фенилпентил)кумарин; 3-(циклогексилфенилметил)-4-гидроксикумарин; 4-гидрокси-3-(2-метил-1-фенилпропил) кумарин; 4-гидрокси-3-(2-фенилпропил) -кумарин; 4-гидрокси-3-(1,3-дифенилпропил)кумарин; 4-гидрокси-3- (1-(4-метилфенил)бутил)кумарин; 4-гидрокси-3-(1-(1-нафтил)-пропил) кумарин; 4-гидрокси-7-метил-3-(1-фенилпропил)кумарин; 7-хлор-4-гидрокси-3-(1-фенилпропил)кумарин; 4-гидрокси-3-[1-(4-метоксифенил)пропил]кумарин; 3-(альфа- этил-п-фтор-бензил)-4-гидроксикумарин; 3-(альфа-этил-п- метоксибензил)-4-гидроксикумарин и 3-(1-фенилпропенил)-4- гидроксикумарин.
Насколько нам известно (из приведенного нами обзора), в приведенных публикациях не сообщается об использовании указанных соединений в качестве ингибиторов ВИЧ-протеазы. Сообщается об использовании этих соединений в качестве родентицидов, для снижения содержания протромбина в крови, в качестве антикоагулянтов крови и пестицидов.
В следующих публикациях приводятся дополнительные производные 4-гидроксикумарина:
В Indian. J. Chem., Sect. В, 25В: 1167-70 (1986) (CA 107(17): 154201f) и CA 93(23): 220546-f описывается 4-гидрокси-3- (1-фенил-2-пропенил)кумарин.
В CA 96(19): 157432х; CA 90(1): 1707f; CA 84(9) 55338f; CA 79(13): 74969a и CA 71(15): 69677j приводится соединение 4-гидрокси-3-[1-(1,2,3,4-тетрагидро)нафтил]кумарин; в CA 54: 579е приводится соединение 4-гидрокси-3- [1-инданил] кумарин; в CA 63: 14743с приводится соединение 4-гидрокси-3-(1-нафтилметил)кумарин; в CA 63: 5589с приводится соединение 3-(1'-(2-метокси-3-метил-5-хлорфенил)пропил)-4- гидроксикумарин; СA 64: 12969b приводится соединение 3- α -ацетонил α - ацетилбензил)-4-гидроксикумарин. В CA 79(13): 74969a; Chim. Ther. 7(4): 300-6 (1972) (фр.) (CA 78(7): 38016h); CA 52: 5399b; CA 54: 5699e; СA 54: 579е и СA 72(15): 78882v описываются производные 4-гидроксикумарина, замещенные в 6- или 7-положении, например, мети лом, метокси-группой или атомом хлора.
В J. M. Mulder, Патент СШA 3835161 (опубликован 10 сентя6ря 1974) заявляется соединение 3-[1-[4-(2-бромэтил)фенил] -этил]-4-гидрокси-2H-1-бензопиран-2-он.
В Merck Index, Eleventh Edition, (1989), Entry 9950 описывается фарфарин (его химическое название - 3-альфа-фенил-бета-ацетилэтил-4- гидроксикумарин) - и его использование в качестве родентицида и антикоагулянта. В J. Med. Chem. , 1978, Vol. 21, N 2: 231-234 сообщается об антивитамин K активности фарфарина и обсуждается антикоагулянтная активность нескольких 3-замещенных 4-гидроксикумаринов, таких как 4-гидрокси-3-(1-фенилбутил) кумарин и 4-гидрокси-3-(альфа-метилбензил)кумарин. В J. Am. Chem. Soc. 83: 2676-9 (1961) (CA 55: 22306е (1961)) обсуждается способ расщепления и абсолютная конфигурация фарфарина и описывается получение таких соединений, как 4-гидрокси-3-(1-фенилбутил) кумарин.
в Journal of Labelled Compounds and Radiopharmaceuticals Vol. XXIII, N 2: 137-148 (1986) описывается несколько содержащих метку дейтерия метаболитов фарфарина и фенпрокумона, таких как содержащий метку дейтерия аналог соединения 4-гидрокси-7-метокси-3-(1-фенилпропил)кумарин.
В J48023942 приводятся такие соединения, как 4-гидрокси-3-(альфа-метилбензил)кумарин; 4-гидрокси-3-(3-метил- 1-фенилбутил)кумарин; и 2H-1-бензопиран-2-он, 4-гидрокси-7-метокси-3-(1-фенилпропил)кумарин (уже приведенный ранее) и их использование в качестве родентицидов.
В Трудах Воронежского технологического института, 19(2): 27-30 (1971), Abstract N 1 zh 274 описывается соединение 4-гидрокси-3-фенэтил-кумарин. В этой публикации и в Helv. Chim. Acta, 74 (7): 1451-8(1991) приводится 4-гидрокси-3-(3-фенилпропил)кумарин.
В J. Org. Chem., 33(1): 437-8 (1968) и Eur. J. Med. Chem.-Chim. Ther., 12(2): 125-30 (1977) приводятся такие соединения, как 4-гидрокси-3-дифенилметилкумарин.
В Патенте США 3764693 описывается соединение 4-гидрокси-3-(3-гидрокси-1- фенилбутил) кумарин и его антикоагулянтная и родентицидная активность.
В J. Med. Chem., 18(5): 513-19 (1975) (CA 83(5): 37913q); J. Chromatorg. , 338(2): 325-34 (1985); J. Chromatorg., 562(1-2): 31-8 (1991); J. Lebelled Compds. Radiophar. , 23(2): 137-48 (1986) (см. ранее); и J. Chromatorg., 529(2): 479-85 (1990) приводятся такие соединения, как 4-гидpoкcи-3-[1-[3- (фeнилметокси)фенил]пропил]-2H-1-бензопиран-2-он; 4-гидрокси-8-(фенилметокси)-3-(1-фенилпропил)-2H-1-бензопиран-2-он; 4-гидрокси-3-[1-(4-гидроксифенил)пропил]кумарин; 4-гидрокси-6-метокси-3-(1-фенилпропил)кумарин; 4,7-дигидрокси-3-(1-фенилпропил)-кумарин; 4,6-дигидрокси-3-(1-фенилпропил) кумарин; 4-гидрокси-3-[1-(3-гидроксифенил)пропил] кумарин и п-хлорфенилпрокумамон.
В AIDS 1993, Vol. 7, N 1, pages 129-130 обсуждается действие фарфарина на репликацию и распространение ВИЧ-1.
В CA Selects: AIDS & Related Immunodeficiences, Issue 24, 1993, Abstract 119: 195147j описывается ингибирующее воздействие единичной дозы производных кумарина, фарфарина, 4-гидроксикумарина, умбеллиферона на репликацию ВИЧ-1 и распространение вируса в клетках и во внеклеточной среде.
Hа Первой конференции по ретровирусам человека и родственным инфекциям, 12-16 декабря 1993, Вашингтон, округ Колумбия, сообщалось, что кумарины, такие как фарфарин, и пироны, такие как 3-(тиофенил)-6-фенил-4-гидроксипирон, проявляют в процессе испытаний ингибирующую активность по отношению к ВИЧ- протеазе.
В Biochemical and Biophysical Research Communications, Vol. 201, N 1, pages 290-294 (30 May 1994) сообщается, что фарфарин и структурно родственные ему аналоги кумарина являются ингибиторами ВИЧ-протеазы.
В J. Med. Chem., 37: 2664-2677 (1994) сообщается, что 4-гидрокси-3-(3-феноксипропил)-2H-1-бензопиран-2-он и его структурные аналоги, в частности, 4,7-дигидрокси-3-[4-(2-метоксифенил)бутил] -2H-1-бензопиран-2-оны, являются ингибиторами ВИЧ-протеазы.
В Biochemical and Biophysical Research Communications, Vol. 200, N 3, pages 1658-1664 (16 May 1994) указывается, что 4-гидрокси-3-(3-феноксипропил)-1-бензопиран-2-он и 4-гидрокси-6-фенил-3-(фенилтио)пиран-2-он, а также структурные аналоги указанных соединений являются ингибиторами ВИЧ-протеазы.
В J. Am. Chem. Soc., 116: 6989-6990 (1994) сообщается, что 4-гидрокси-6-фенил-3-(фенилтио)пиран-2-он и его структурные аналоги являются ингибиторами ВИЧ-1-протеазы.
В Acta, Virol., 37: 241-250 (1993) описывается анти-ВИЧ активность производных кумарина, фарфарина, 4-гидроксикумарина и умбеллиферона.
В Antiviral Research, 24: 275-288 (1994) приводятся бициклические имидазопроизводные (имидазотиазолы и имидазопиридины), которые ингибируют ВИЧ-1 за счет взаимодействия с обратной транскриплазой.
В Патенте США 3325515 (J. Schmitt et аl.) указывается, что производные кумарина, такие как метиловый эфир 3-(4-гидрокси-3-кумаринил)-3-фенил-1-пропионовой кислоты, проявляют антикоагуляционную активность.
В Патенте США 2723277 (A. Grussner et al.) заявляются производные мелоновой кислоты, такие как 3-[1'-п-хлорфенил)- пропил]-4-гидроксикумарин, в качестве антикоагулянтов.
В Патенте Франции 1276654 заявляются 4-гидроксикумарины, такие как (2'-гидрокси)-3-бензил-4-гидроксикумарин, которые обладают антикоагулянтными, антибактериальными или антигрибковыми свойствами.
В Патенте Бельгии A674997 заявляются производные 4-гидроксикумарина, такие как 3-(5-метокситетралил-(1))-4- гидроксикумарин, в качестве средств борьбы с грызунами.
В Патенте Великобритании А734142 заявляется способ получения 3-замещенных-4-гидроксикумаринов, таких как 3-(1-фенил-2-ацетил)-этил-4- гидроксикумарин и 3-(1-фуран-2-ацетил)-этил-4-гидроксикумарин, которые эффективны в качестве антикоагулянтов и родентицидов.
В "The Application of Computer-Assisted Drug Design in Discovery of Nonpeptide HIV-1 Protease Inhibitors", Parke-Davis Pharm. Res. , Keystone Symposia, 5-11 March 1994, Santa Fe, NM приводится 4- гидрокси-3-(3-феноксипропил)-1-бензопиран-2-он в качестве ингибитора ВИЧ-протеазы.
В Structurial Biology, 1(1): 199-200 (April 1994) указывается, что крысиный яд фарфарин полезен для поиска ингибиторов ВИЧ. В СA 85: 78002b (1976) указывается, что производные 3-(2,4,6-тригидроксибензил)-4-гидрокси-2H-пиран-2- она обладают антибактериальной активностью.
В Патенте Франции A1092278 (Hoffman) (1955) заявлен способ получения производных кумарина, таких как 3-[1'-фенилпропен-(1')-ил)-4-гидроксикумарин.
В Международной публикации WO 94/11361 от 26 мая 1994 приводятся пиран-2-оны и 5,6-дигидроксипиран-2-оны в качестве ингибиторов протеиназы ретровируса.
В Международной публикации WO 94/18188 от 18 августа 1994 приводятся 4-гидроксибензопиран-2- оны и 4-гидроксициклоалкил[b]пиран-2-оны в качестве ингибиторов протеиназы ретровируса.
Следующие ссылки приводятся в качестве аналогов настоящего изобретения и характеризуют текущий уровень в данной области техники:
Патент США 3651091 (Boschetti et аl.); Патент США 4262013 (Mistui et аl. ); Патент США 4900754 (Regan et al.); Патент США 5294724 (Jendralla et al.); Патентная заявка Австралии 219371 (Enders et al.); Патент Канады 1171424 (Willard et al.); Патентная заявка Великобритании 836740 (Bayer); Европейская патентная заявка 0024348 (Willard et al.); Европейская патентная заявка 0588137 (Fischer et al. ); Патент Франции 1276654 (Molho) (см. ранее) и Международная публикация WO 94/1136 (Thaisrivongs et al.) (см. ранее).
В "Collaborative Structure-Based Design of Small Organic Molecules as Inhibitors of HIV Protease", Keystone Symposia, Santa Fe, NM (5-11 March 1994) приводятся кристаллографические комплексы ВИЧ-1 и ВИЧ-2-протеазы с такими соединениями, как 3-(альфа-этилбензил)-6-(альфа-этилфенэтил)-4-гидрокси-2H-пиран-2-он.
В "Descovery and Properties of Small Organic Molecules Inhibiting of HIV-I Protease", Keystone Symposia, Santa Fe, NM (5-11 March 1994) приводится аналитический метод обнаружения ингибиторной активности таких соединений, как 3-(альфа- этилбензил)-6-(альфа-этилфенэтил)-4-гидрокси-2H- пиран-2-он.
В "Structure-based Design of Non-peptide HIV Protease Inhibitors", 35th Annual Buffalo Medical Chemistry Symposium, Buffalo, NY (22-25 May 1994) приводятся такие соединения как 3- (альфа-этилбензил)-6-(альфа-этилфенэтил)-4-гидрокси-2H-пиран-2- он в качестве потенциальных терапевтических анти-ВИЧ средств.
Hruby et al. (J. Org. Chem., (1993) 58(26): 7567) описывают катализируемое медью присоединение арильного реактива Гриньяра к ненасыщенному хиральному амиду, 3-(2-бутеноил)-4-фенил-2- оксазолидинону. Evans et al. (J. Am. Chem. Soc. , (1990) 112: 8215) описывают реакцию между хиральным амидом и 2-метокси-2-метил-1,3- диоксолином. Описание способа получения 2-метокси-2-метил-1,3- диоксолина можно найти у Santry et al. (J. Am. Chem. Soc., (1988) 110(9): 2910). О реакции между енольным эфиром и кетоном смотрите Dongala et al. Tetrahedron Letters, 4983 (1973) и Mitsui et al. Tetrahedron, 23: 4271 (1967). О реакции между амидом енола и кетоном смотрите Viteva et al. Tetrahedron, 50: 7193 (1994); Oare et al., J. Org. Chem., 55: 132 (1990); Hullot et al., Can. J. Chem., 55: 266 (1977); Woodbury et al., J. Org. Chem. , 42: 1688 (1977); Stefanovsky et al. Tetrahedron, 42: 5355 (1986); и Mathew et al. Патент США 5284975.
G. Garganico, P. Cozzi, G. Orsini, J. Med. Chem., 26: 1767-1769 (1983) приводят синтетические соединения, содержащие метильную и гидроксильную группы в 4- положении дигидропиронового кольца и не содержащие заместителей в 3-положении. Соединения по настоящему изобретению содержат кетонную группу в 4-положении (которая может быть в енольной форме) и имеют заместитель в 3-положении.
D.T. Wtiak et al., J. Med. Chem., 31: 1437-1445 (1988) приводят бензопиран-2-оны с гидроксильной группой в 3-положении. Соединения по настоящему изобретению содержат в этом положении алкильный заместитель.
В. Tait, Winter Conference on Bioorganic Medicinal Chemistry, 29 Jan. -2 Feb. 1995, Steamboat Springs, Colorado сообщает о дигидропиронах, содержащих фенильную группу и пентильную группу в 6-положении и -S-CH2-CH2-фенильную группу в 3-положении в области ВИЧ-протеазы.
J. V. N. Vara Prasad et al., J. Med. Chem., 38: 898-905 (1995) приводят (4-гидрокси-6-фенил-2-оксо-2H-пиран-3-ил)тиометаны, такие как (+)-3-[циклопентил(циклопентилтио)метил] -4-гидрокси-6-фенил-2H- пиран-2-он в качестве ингибитора ВИЧ-1-протеазы.
Краткое описание изобретения
В настоящем изобретении заявляется:
Соединение Формулы I,
где R1 обозначает атом водорода;
R2 обозначает (а) (C3-C5)алкил, (b) группу фенил-(CH2)2, (c) группу гетероцикл-SO2NH-(CH2)2-, (d) группу циклопропил-(CH2)2-, (e) группу фторфенил-(CH2)2-, (f) группу гетероцикл-SO2NH-фенил-, или (g) группу трифторметил-(CH2)2-,
или R1 и R2 вместе образуют двойную связь;
R3 обозначает фрагмент формулы X;
R4 обозначает (a) фенил, (b) гетероцикл; (c) циклопропил, (d) группу H3C-[O(CH2)2] 2-, (e) группу гетероцикл-SO2NH-, (f) атом брома, (g) азидо-группу, или (h) группу HO3S(CH2)2-N(CH3)-C(O)-(CH2)6- C(O)-NH;
R5 обозначает атом водорода;
R6 обозначает (а) группу R4-(CH2)n-CH(R8)-, (b) группу H3C-[O(CH2)2] 2CH2- (с) (C3-C5)алкил, (d) группу фенил-(CH2)2-, (е) группу гетероцикл-SO2NH-(CH2)2-, (f) группу (HOCH2)3C-NH-C(O)-NH-(CH2)3- (g) группу (HO2C)(H2N)CH-(CH2)2-C(O)-NH-(CH2)3- (h) группу пиперазин-1-ил-C(O)-NH-(CH2)3-, (i) группу HO3S(CH2)2-N(CH3)-C(O)-(CH2)6- C(O)-NH-(CH2)3, (j) группу циклопропил-(CH2)2-, (k) группу фторфенил-(CH2)2-, (l) группу гетероцикл-SO2NH-фенил, или (m) группу F3C-(CH2)2-;
n обозначает ноль (0), единицу (1) или двойку (2);
R7 обозначает (a) циклопропил, (b) этил или (c) трет-бутил;
R8 обозначает (a) этил или (b) группу -CH2-циклопропил;
R9 обозначает (a) группу -NR12SO2-гетероцикл, (b) группу -NR12SO2-фенил, незамещенную или замещенную одним R11, (c) группу -CH2-SO2-фенил, незамещенную или замещенную одним R11, или (d) группу -CH2-SO2-гетероцикл;
где гетероцикл обозначает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, выбранных из группы, включающей азот, кислород и серу; в том числе любые бициклические группы, в которых любой из указанных выше гетероциклов конденсирован с бензольным кольцом или другим гетероциклом; незамещенное или замещенное одним R10;
где R10 обозначает (a) метил, (b) циано-группу, (c) гидроксильную группу, (d) этоксикарбонильную группу, (e) трифторметильную группу, (f) амино-группу, или (9) амидную группу;
где R11 обозначает (a) циано-группу, (b) атом фтора, (с) гидроксильную группу, или (d) нитро-группу;
где R12 обозначает (а) атом водорода или (b) метил; или его фармацевтически приемлемая соль.
В настоящем изобретении, в частности, заявляется:
Соединение Формулы 1,
где R1 обозначает атом водорода;
R2 обозначает (а) (C3-C5)алкил, (b) группу фенил-(CH2)2-, или (с) группу гетероцикл-SO2NH-(CH2)2-;
или R1 и R2 вместе образуют двойную связь;
R3 обозначает фрагмент формулы X;
R4 обозначает (а) фенил, (b) гетероцикл, (c) циклопропил, (d) группу H3C-[O(CH2)2] 2-, (е) группу гетероцикл-SO4NH-, (f) атом брома, (g) азидо-группу, или (h) группу HO3S(CH2)2-N(CH3)-C(O)-(CH2)6- С(О)-NH-;
R5 обозначает атом водорода;
R6 обозначает (а) группу R4-(CH2)n -CH(R8)-, (b) группу H3C-[O(CH2)2] 2CH2, (с) (C3-C5)алкил, (d) группу фенил-(CH2)2- (e) группу гетероцикл-SO2NH-(CH2)2-, (f) группу (HOCH2)3C-NH-C(O)-NH-(CH2)3-, (g) группу (HO2C)(H2N)CH-(CH2)2-C(O)-NH-(CH2)3-, (h) группу пиперазин-1-ил-C(O)-NH-(CH2)3- или (i) группу HO3S(CH2)2-N(CH3)-С(О)(CH2)6-C(O)-NH-(CH2)3-; n обозначает ноль (0), единицу (1) или двойку (2);
R7 обозначает (a) циклопропил, (b) этил или (с) трет-бутил;
R8 обозначает (a) этил или (b) группу -CH2-циклопропил;
R9 обозначает (a) группу -NR12SO2-гетероцикл, (b) группу -NR12SO2-фенил, незамещенную или замещенную одним R11, (с) группу -CH2-SO2-фенил, незамещенную или замещенную одним R11, или (d) группу -CH2-SO2-гетероцикл;
где гетероцикл обозначает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, выбранных из группы, включающей азот, кислород и серу; в том числе любые бициклические группы, в которых любой из указанных выше гетероциклов конденсирован с бензольным кольцом или другим гетероциклом; незамещенное или замещенное одним R10;
где R10 обозначает (а) метил, (b) циано-группу, (с) гидроксильную группу, или (d) этоксикарбонильную группу;
где R11 обозначает (а) циано-группу, (b) атом фтора, (с) гидроксильную группу, или (d) нитро-группу;
где R12 обозначает (а) атом водорода или (b) метил;
или его фармацевтически приемлемая соль.
В настоящем изобретении заявляются такие соединения, в которых гетероцикл обозначает следующие группы, не содержащие заместителей или содержащие один заместитель R10: (а) 2-пиридинил, (b) имидазол-2-ил, (с) имидазол-4-ил, (d) бензимидазол-2-ил, (e) хинолин-8-ил, (f) хинолин-2-ил, (g) пиримидин-2-ил, (h) хинахолин-2-ил, (i) пурин-6-ил, (j) тиазол-2-ил, (k) тиазол-4-ил, (l) 2-пиразолил, (m) 2-пиразинил, (n) тетрагидропиран-4-ил, или (o) тетрагидропиран-3-ил.
В настоящем изобретении, в частности, заявляется:
Соединение Формулы I,
где R1 обозначает атом водорода;
R2 обозначает (а) пропил, (b) группу фенил-(CH2)2-, (с) изо-бутил или (d) пентил;
или R1 и R2 вместе образуют двойную связь;
R3 обозначает фрагмент формулы X;
R4 обозначает (а) фенил), (b) гетероцикл, (с) циклопропил, (d) группу H3C-[O(CH2)2] 2-, (е) группу гетероцикл-SO2NH, (f) атом брома, (g) азидо-группу, или (h) группу HO3S(CH2)2-N(CH3)-C(O)-(CH2)6-C (O)-NH;
R5 обозначает атом водорода;
R6 обозначает (а) группу R4-(CH2)n-CH(R8)-, (b) группу H3C-[O(CH2)2] 2CH2-, (с) пропил, (d) группу фенил-(CH3)2-, (е) изо-бутил, или (f) пентил;
n обозначает ноль (0), единицу (1) или двойку (2);
R7 обозначает (а) циклопропил или (b) этил;
R8 обозначает (а) этил или (b) группу -CH2-циклопропил;
R9 обозначает (а) группу -NHSO2-гетероцикл, или (b) группу -NHSO2-фенил, незамещенную или замещенную одним R11; где гетероцикл обозначает следующую группу, незамещенную или замещенную одним R10: (а) 2-пиридинил, (b) имидазол-2-ил, (с) имидазол-4-ил, (d) хинолин-8-ил, (е) тетрагидропиран-4-ил, (f) тетрагидропиран-3-ил, или (g) бензимидазол-2-ил;
где R10 обозначает (а) метил;
где R11 обозначает (а) циано-группу, (b) атом фтора, или (с) нитро-группу;
или его фармацевтически приемлемая соль.
В частности, в настоящем изобретении заявляется соединение формулы VI,
где R2 обозначает (а) пропил, (b) группу фенил-(CH2)2-, (с) изо-бутил или (d) пентил;
R3 обозначает фрагмент формулы X;
R6 обозначает (а) пропил, (b) группу фенил-(CH2)2-, (с) изо-бутил, или (d) пентил;
R7 обозначает (а) этил или (b) циклопропил;
R9 обозначает (а) группу -NHSO2 2-фенил, замещенную одним R11, или (b) группу -NHSO2-гетероцикл;
где гетероцикл обозначает следующую группу, незамещенную или замещенную одним R10: (а) имидазол-4-ил или (b) хинолин-8-ил;
где R10 обозначает метил;
где R11 обозначает (а) циано-группу или (b) атом фтора.
Кроме того в изобретении, в частности, заявляется соединение формулы VII,
где R3 обозначает фрагмент формулы X;
R4 обозначает (а) фенил, (b) гетероцикл, (с) циклопропил, (d) группу H3С-[O(CH2)2] 2-, (е) группу гетероцикл-SO2NH, (f) атом брома, (g) азидо-группу, или (h) группу HO3S(CH2)2-N(CH3)-C(O)- (CH2)6-C(O)-NH;
R6 обозначает (а) группу R4-(CH2)n-CH(R8)- или (b) группу H3C-[O(CH2)2] 2CH2-;
R7 обозначает циклопропил;
R8 обозначает (а) этил или (b) группу -CH2-циклопропил;
R9 обозначает (а) группу -NHSO2-гетероцикл или (b) группу NHSO2-фенил, незамещенную или замещенную одним R11;
где n обозначает ноль (0), единицу (1) или двойку (2);
где гетероцикл обозначает следующую группу, незамещенную или замещенную одним R10: (а) имидазол-4-ил, (b) имидазол-2-ил, (с) хинолин-8-ил, (d) тетрагидропиран-3-ил, (e) тетрагидропиран-4-ил, (f) 2-пиридинил, или (g) бензимидазол-2-ил;
где R10 обозначает метил;
где R11 обозначает (а) нитро-группу; (b) атом фтора; или (с) циано-группу; или его фармацевтически приемлемая соль.
В настоящем изобретении заявляется также соединение формулы II, где
R10 и R20 вместе образуют:
а) фрагмент формулы III или
b) фрагмент формулы IV;
где p равно четырем (4);
R1 обозначает атом водорода;
R2 обозначает (а) атом водорода, (b) метокси-группу или (с) группу CH3O-[(CH2)2O]3-;
R3 обозначает фрагмент формулы V;
R4 обозначает (а) циклопропил или (b) изо-бутил;
R5 обозначает (а) группу -NR9SO2-фенил, незамещенную или замещенную одним R6, (b) группу -NR9SO2-гетероцикл, (с) группу -CH2-SO2-фенил, незамещенную или замещенную одним R6, или (d) группу -CH2- SO2-гетероцикл;
где R6 обозначает (а) циано-группу, (b) атом фтора, (с) метил, (а) карбоксильную группу, или (е) гидроксильную группу;
где гетероцикл обозначает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, выбранных из группы, включающей азот, кислород и серу; в том числе любые бициклические группы, в которых любой из указанных выше гетероциклов конденсирован с бензольным кольцом или другим гетероциклом; незамещенное, замещенное одним или двумя R7;
где R7 обозначает (а) метил, (b) циано-группу, (с) этоксикарбонильную группу, или (d) гидроксильную группу;
R8 обозначает (а) атом водорода, (b) пропил, (с) группу -CH2-циклопропил, или (d) группу -CH2-фенил;
R9 обозначает (а) атом водорода или (b) метил; или его фармацевтически приемлемая соль.
В настоящем изобретении заявляются такие соединения, в которых гетероцикл обозначает следующие группы, не содержащие заместителей или содержащие один заместитель R7: (а) 2-пиридинил, (b) имидазол-2-ил, (с) имидазол- 4-ил, (d) бензимидазол-2-ил, (е) хинолин-8-ил, (f) хинолин-2-ил, (g) пиримидин-2-ил, (h) хиназолин-2-ил, (i) пурин-6-ил, (j) тиазол-2-ил, (k) тиазол-4-ил, (l) 2-пиразолил, (m) 2-пиразинил, (n) тетрагидропиран-4-ил, или (о) тетрагидропиран-3-ил.
В настоящем изобретении, в частности, заявляется соединение формулы II, где
R10 и R20 вместе образуют:
а) фрагмент формулы III или
b) фрагмент формулы IV;
где p равно четырем (4);
R1 обозначает атом водорода;
R2 обозначает (а) метоксигруппу или (b) группу CH3O-[(CH2)2O]3-;
R3 обозначает фрагмент формулы V;
R4 обозначает (а) циклопропил или (b) изо-бутил;
R5 обозначает (а) группу -NR9SO2-фенил, незамещенную или замещенную одним R6, (b) группу -NR9SO2-гетероцикл, (с)
группу -CH2-SO2-фенил, незамещенную или замещенную одним R6, или (d) группу -CH2-SO2-гетероцикл;
где R6 обозначает (а) циано-группу, (b) атом фтора, (с) метил, или (d) карбоксильную группу;
где гетероцикл обозначает следующую группу, незамещенную или замещенную одним R7:
(а) имидазол-4-ил, (b) хинолин-8-ил, (с) 2-пиридинил, или (d) 4-пиридинил;
где R7 обозначает метил;
R8 обозначает (а) атом водорода или (b) пропил;
R9 обозначает (а) атом водорода или (b) метил; или его фармацевтически приемлемая соль.
В частности, в настоящем изобретении заявляется соединение формулы VIII, где
R3 обозначает фрагмент формулы V;
R4 обозначает (а) циклопропил или (b) изо-бутил;
R5 обозначает (а) группу -NR9SO2-фенил, незамещенную или замещенную одним R6, (b) группу -NR9SO2-гетероцикл, или (с) группу -CH2-SO2-фенил;
где R6 обозначает (а) циано-группу или (b) атом фтора;
где гетероцикл обозначает следующую группу, незамещенную или замещенную одним R7:
(а) 2-пиридинил, (b) 4-пиридинил, или (с) имидазол-4-ил;
где R7 обозначает метил;
R8 обозначает (а) атом водорода или (b) пропил;
R9 обозначает (а) атом водорода или (b) метил;
или его фармацевтически приемлемая соль.
В частности, в настоящем изобретении заявляется также соединение формулы IX, где
R1 обозначает атом водорода;
R2 обозначает (а) метокси-группу или (b) группу CH3O-[(CH2)2O]3-;
R3 обозначает фрагмент формулы V;
R4 обозначает циклопропил;
R5 обозначает группу -NHSO2-гетероцикл;
где гетероцикл обозначает следующую группу, незамещенную или замещенную одним R7: (а) имидазол-4-ил, (b) 2-пиридинил или (с) хинолин-8-ил;
где R7 обозначает метил.
В настоящем изобретении заявляется соединение формулы VI, где
R2 обозначает (а) этил; (b) пропил; (с) группу циклопропил-(CH2)2-; (d) группу фторфенил-(CH2)2-; (e) группу гетероцикл-SO2NH-фенил-; (f) изо-бутил; (g) группу фенил-(CH2)2-, или (h) трифторметил-(CH2)2-;
R3 обозначает фрагмент формулы X;
R6 обозначает (а) этил; (b) пропил; (с) группу циклопропил-(CH2)2-; (d) группу фторфенил-(CH2)2-; (e) группу гетероцикл-SO2NH-фенил-; (f) изо-бутил; (g) группу фенил-(CH2)2-; или (h) трифторметил-(CH2)2-;
R7 обозначает (а) этил; (b) трет-бутил или (c) циклопропил;
R9 обозначает (а) группу -NHSO2-гетероцикл или (b) группу -NHSO2-фенил, замещенную одним R11;
где гетероцикл обозначает следующую группу, незамещенную или замещенную одним R10:
(а) имидазол-4-ил, (b) 2-пиридинил или (с) хинолин-8-ил;
где R10 обозначает (а) метил, (b) циано-группу, (с) трифторметильную группу, (d) амино-группу или (е) амидную группу;
где R11 обозначает циано-группу.
В настоящем изобретении заявляется также соединение формулы XI,
где R1 обозначает группу -(CH2)p-CH(R2)-(CH2)o-Ar1;
где R2 обозначает (а) (C1-C5)алкил или (b) группу -(CH2)q - циклоалкил;
где Ar1 обозначает (а) фенил, незамещенный или замещенный одним R3, или (b) фенил, замещенный группой м-NHSO2Ar2;
где Ar2 обозначает (а) фенил, незамещенный или замещенный одним R3; или (b) гетероцикл,
где гетероцикл обозначает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, выбранных из группы, включающей азот, кислород и серу; в том числе любые бициклические группы, в которых любой из указанных выше гетероатомов конденсирован с бензольным кольцом или другим гетероциклом; незамещенное, замещенное одним R4;
где R3 обозначает (а) циано-группу, (b) атом фтора, (с) гидроксильную группу или (d) нитро-группу;
где R4 обозначает (а) метил, (b) циано-группу, (с) гидроксильную группу, (J) этоксикарбонильную группу, (е) трифторметильную группу или (f) амино-группу;
n равно нулю (0) до восьми (8) включительно;
o равно нулю (0) до трех (3) включительно,
p равно нулю (0) до трех (3) включительно,
q равно нулю (0) до трех (3) включительно;
или его фармацевтически приемлемая соль.
В частности, в настоящем изобретении заявляется соединение,
где R1 обозначает группу -CH(R2)-Ar1;
где R2 обозначает (а) этил или (b) трет-бутил;
где Ar1 обозначает фенил, замещенный группой м-NHSO2Ar2;
где Ar2 обозначает 2-пиридинил, замещенный одним R4;
где R4 обозначает (а) циано-группу или (b) трифторметильную группу;
где n обозначает число от двух (2) до четырех (4) включительно.
В настоящем изобретении заявляется также способ получения соединения формулы W-10,
где R1 обозначает (а) н-пропил или (b) фенэтил; который включает стадии:
а) обработки соединения формулы W-9, где значение XA указано ранее, хлоридом титана (IV);
b) обработки продукта, полученного на стадии а), аминовым основанием и
с) взаимодействия продукта, полученного на стадии b), с 4-гептаноном или пропилфенэтилкетоном с образованием соединения формулы W-10.
Способ далее включает стадии:
d) обработки соединения формулы W -10 гидридом натрия или трет-бутоксидом калия, при этом образуется соединение формулы W-11,
где R1 обозначает (а) н-пропил или (b) фенэтил;
е) гидрирования соединения формулы W-11 с образованием соединения формулы W-12, где значение R1 указано ранее;
f) обработки соединения формулы W-12 хлористым сульфонилом формулы D-7, где R4 обозначает 5-трифторметил-2-пиридинил, в органическом растворителе в присутствии органического основания, при этом получают соединение формулы W-13, где значение R1 указано ранее.
В настоящем изобретении заявляется также способ получения соединения формулы X-10, где
R1 обозначает (а) н-пропил или (b) фенэтил; который включает стадии:
а) обработки соединения формулы X-9, где значение XA указано ранее, хлоридом титана (IV);
b) обработки продукта, полученного на стадии а), аминовым основанием и
с) взаимодействие продукта, полученного на стадии b), с 4-гептаноном или пропилфенэтилкетоном с образованием соединения формулы X-10.
Способ далее включает стадии:
(d) обработки соединения формулы Х-10 гидридом натрия или трет-бутоксидом калия, при этом образуется соединение формулы Х-11,
где R1 обозначает (а) н-пропил или (b) фенэтил;
е) гидрирования соединения формулы X-11 с образованием соединения формулы X-12, где значение R1 указано ранее;
f) обработки соединения формулы X-12 хлористым сульфонилом формулы D-7, где R4 обозначает 5-трифторметил-2- пиридинил, в органическом растворителе в присутствии органического основания, при этом получают соединение формулы X-13, где значение R1 указано ранее.
В настоящем изобретении заявляется также способ получения соединения формулы GGG-10, где
R1 обозначает (а) н-пропил или (b) фeнэтил, который включает стадии:
а) обработки соединения формулы GGG-9, где значение XA указано ранее, хлоридом титана (IV);
b) обработка продукта, полученного на стадии а), аминовым основанием и
с) взаимодействия продукта, полученного на стадии b), с 4-гептаноном или 1-фенил-3-гексаноном с образованием соединения формулы GGG-10.
Способ далее включает стадии:
d) обработки соединения формулы GGG-10 гидридом натрия или трет-бутоксидом калия, при этом образуется соединение формулы GGG-11, где
R1 обозначает (а) н-пропил или (b) фенэтил;
е) гидрирования соединения формулы GGG-11 с образованием соединения формулы GGG-12, где значение R1 указано ранее;
f) обработки соединения формулы GGG-12 хлористым сульфонилом формулы D-7, где R4 обозначает 5-трифторметил-2-пиридинил, в органическом растворителе в присутствии органического основания, при этом получают соединение формулы CGG-13A, где значение R1 указано ранее.
Способ получения соединения формулы HHH-10, где
R1 обозначает (а) н-пропил или (b) фенэтил; который включает стадии:
а) обработки соединения формулы HHH-9, где значение XA указано ранее, хлоридом титана (IV);
b) обработки продукта, полученного на стадии а), аминовым основанием и
с) взаимодействия продукта, полученного на стадии b), с 4-гептаноном или 1-фенил-3-гексаноном с образованием соединения формулы HHH-10.
Способ далее включает стадии: (d) обработки соединения формулы HHH-10 гидридом натрия или трет-бутоксидом калия, при этом образуется соединение формулы HHH-11, где
R1 обозначает (а) н-пропил или (b) фенэтил;
е) гидрирования соединения формулы HHH-11 с образованием соединения формулы HHH-12, где значения R1 указано ранее;
f) обработки соединения формулы HHH-12 хлористым сульфонилом формулы D-7, где R4 обозначает (а) 5-трифторметил-2-пиридинил или (b) 5-циано-2- пиридинил, в органическом растворителе в присутствии органического основания, при этом получают соединение формулы HHH-13A, где значение R1 указано ранее.
Способ получения соединения формулы LLL-10, где
R1 обозначает (а) н-пропил или (b) фенэтил; который включает стадии:
а) обработки соединения формулы LLL-9, где значение XA указано ранее, хлоридом титана (IV);
b) обработки продукта, полученного на стадии а), аминовым основанием и
с) взаимодействия продукта, полученного на стадии b), с 4-гептаноном или 1-фенил-3-гексаноном с образованием соединения формулы LLL-10.
Способ далее включает стадии:
d) обработки соединения формулы LLL-10 гидридом натрия или трет-бутоксидом калия, при этом образуется соединение формулы LLL-11, где
R1 обозначает (а) н-пропил или (b) фенэтил;
е) гидрирования соединения формулы LLL-11 с образованием соединения формулы LLL-12, где значение R1 указано ранее;
f) обработки соединения формулы LLL-12 хлористым сульфонилом формулы D-7, где R4 обозначает (а) 5-трифторметил-2-пиридинил или (b) 5-циано-2-пиридинил, в органическом растворителе в присутствии органического основания, при этом получают соединение формулы LLL-13A, где значение R1 указано ранее.
Способ получения соединения формулы JJJ-10,
где R1 обозначает (а) н-пропил или (b) фенэтил; который включает стадии:
а) обработки соединения формулы JJJ-9, где значение XA указано ранее, хлоридом титана (IV);
b) обработки продукта, полученного на стадии а), аминовым основанием и
с) взаимодействия продукта, полученного на стадии b), с 4-гептаноном или 1-фенил-3-гексаноном с образованием соединения формулы JJJ-10.
Способ далее включает стадии:
d) обработки соединения формулы JJJ-10 гидридом натрия или трет-бутоксидом калия, при этом образуется соединение формулы JJJ-11,
где R1 обозначает (а) н-пропил или (b) фенэтил;
е) гидрирования соединения формулы JJJ-11 с образованием соединения формулы JJJ-12, где значение R1 указано ранее;
f) обработки соединения формулы JJJ-12 хлористым сульфонилом формулы D-7, где R4 обозначает (а) 5-трифторметил-2-пиридинил или (b) 5-циано-2-пиридинил, в органическом растворителе в присутствии органического основания, при этом получают соединение формулы JJJ-13A, где значение R1 указано ранее.
Наиболее предпочтительно в настоящем изобретении заявляется соединение формулы VI, где
R2 обозначает (а) пропил или (b) группу фенил-(CH2)2-;
R3 обозначает фрагмент формулы X;
R6 обозначает (а) пропил или (b) группу фенил-(CH2)2-;
R7 обозначает (а) этил или (b) трет-бутил;
R9 обозначает (а) группу -NHSO2-гетероцикл;
где гетероцикл обозначает следующую группу, замещенную одним R10:
(а) имидазол-4-ил или (b) 2-пиридинил;
где R10 обозначает (а) метил, (b) циано-группу или (с) трифторметильную группу.
Соединения по настоящему изобретению обозначены в соответствии с номенклатурными системами IUPAC или CAS.
Содержание атомов углерода в различных углеводородсодержащих фрагментах указано в виде приставки, указывающей на минимальное или максимальное количество атомов углерода в данном фрагменте, в частности, приставка Ci-Cj обозначает фрагмент, в котором количество атомов углерода составляет от "i" до "j" включительно. Так, например, (C1-C3)алкил обозначает алкил, в котором содержится от одного до трех атомов углерода включительно, или метил, этил, пропил и изо-пропил, его формы с прямой и разветвленной цепью.
Кроме того, содержание атомов углерода в различных углеводородсодержащих фрагментах по настоящему изобретению указано в виде подстрочного целочисленного показателя, который обозначает количество атомов углерода и атомов водорода в данном фрагменте, в частности, "CnH2n" обозначает фрагмент, в котором содержится "n" атомов углерода включительно и "2n" атомов водорода включительно. Так, например, "CnH2n" котором n равно трем, обозначает от одного до трех атомов углерода включительно и от двух до шести атомов водорода включительно, или метил, этил, пропил и изо-пропил и все его изомерные формы с прямой и разветвленной цепью.
Примерами алкилов, содержащих от одного до девяти атомов углерода, являются метил, этил, пропил, бутил, пентил, гексил, гептил, октил и нонил и все их изомерные формы с прямой и разветвленной цепью.
Примерами алкенилов, содержащих от двух до пяти атомов углерода включительно, являются этенил, пропенил, бутенил, пентенил и все их изомерные формы с прямой и разветвленной цепью.
Под "галогеном" понимают обычные атомы галогена, такие как фтор, хлор, бром или иод.
Соединения формулы I и II по настоящему изобретению ингибируют протеиназы ретровирусов и, таким образом, ингибируют репликацию вируса. Они полезны для лечения пациентов, инфицированных вирусом иммунодефицита человека (ВИЧ), который вызывает синдром приобретенного иммунодефицита (СПИД) и родственные заболевания.
В частности, соединения по настоящему изобретению полезны в качестве новых ингибиторов ретровирусной протеазы человека. Соединения ингибируют протеазы ретровирусов и, таким образом, ингибируют репликацию вируса. Они полезны для лечения пациентов, инфицированных ретровирусом человека, таким как вирус иммунодефицита человека (штаммы ВИЧ-1 или ВИЧ-2) или вирусом лейкемии T-клеток человека (HTLV-1 или HTLV-2), которые вызывают синдром приобретенного иммунодефицита (СПИД) и/или родственные заболевания.
Капсид и репликативные ферменты (в частности, протеаза, обратная транскриптаза, интеграза) ретровирусов транслируются из генов gag и pol вируса в виде полипротеинов, которые далее процессируются вирусной протеазой в зрелые белки; они могут быть обнаружены в капсиде и необходимы для осуществления функций вируса и репликации. Если обратная транскриптаза отсутствует или не функционирует, то вирус не может реплицироваться. Было обнаружено, что обратная транскриптаза ретровируса, такая как обратная транскриптаза ВИЧ-1, является аспартопротеазой, характеристики активного сайта которой аналогичны характеристикам, которыми обладает более сложная аспартопротеаза - ренин.
Термин ретровирус человека включает вирус иммунодефицита человека типа I, вирус иммунодефицита человека типа IIили их штаммы, а также вирус лейкемии T-клеток человека (HTLV-1 или HTLV-2) или штаммы, очевидные для специалистов в данной области техники, которые относятся к тому же самому или родственным семействам и которые оказывают такое же физиологическое воздействие на человека, что и ретровирусы человека.
Пациентами, которые подвергаются лечению, являются следующие индивидуумы: 1) пациенты, инфицированные одним или несколькими штаммами ретровируса человека, что определяют по присутствию обнаруживаемых количеств либо антител вируса либо антигенов в сыворотке, и 2) в случае ВИЧ, индивидуумы, у которых проявляются симптомы ВИЧ-инфекции или симптомы инфекции, вызванной СПИДом, такой как i) рассеянный гистоплазмоз, ii) изопсориаз, iii) бронхиальный или легочный кандидоз, в том числе пневмоцистическая пневмония, iv) лимфома, отличная от лимфомы Ходжкина, или v) саркома Капоси, при этом возраст пациента не превышает шестьдесят лет; или индивидуумы, у которых абсолютное значение количества CD4+ лимфоцитов в крови периферической кровяной системы составляет менее 500 на миллилитр. Лечение заключается в постоянном поддержании у пациента ингибирующей концентрации соединения, используемого в соответствии с настоящим изобретением, до тех пор, пока появление следующих симптомов инфекции, вызываемой СПИДом, не покажет необходимость изменения терапии.
В частности, примером одного подобного ретровируса человека является вирус иммунодефицита человека (ВИЧ, инзвестный также как HTLV-III или LAV), который был выявлен как агент, вызывающий у человека синдром приобретенного иммунодефицита (СПИД). P. Duesberg, Proc. Natl. Acad. Sci. USA, 86: 755 (1989). ВИЧ содержит кодируемую ретровирусом протеазу, ВИЧ-1-протеазу, которая расщепляет полипептиды слияния на функциональные белки зрелых частиц вируса, Е.Р. Lillehoj et al., J. Virology, 62: 3053 (1988); С. Debuck et al., Proc. Natl. Acad. Sci. USA, 84: 8903 (1987). Указанный фермент, ВИЧ-1-протеаза, классифицирован как аспартопротеаза и была показана его гомологичность другим аспартопротеазам, таким как ренин, L.H. Pearl et al. Nature, 329: 351 (1987); I. Ketoh et al. Nature, 329: 654 (1987). Ингибирование ВИЧ-1-протеазы блокирует репликацию ВИЧ и, таким образом, полезно при лечении СПИДа у людей, E.D. Clerq, J. Med. Chem., 29: 1561 (1986). Ингибиторы ВИЧ-1-протеазы полезны при лечении ВИЧ-инфицированных пациентов без симптомов или с симптомами СПИДа.
Пепстатин A, общий ингибитор аспартопротеаз, описывается в качестве ингибитора ВИЧ-1-протеазы, S. Seelmeier et al., Proc. Natl. Acad. Sci. USA, 85: 6612 (1986). Приводятся и другие полученные из питательной среды ингибиторы, содержащие редуцированные изостеры или статин у расщепляемой части, M. L. Moore et al., Biochem. Biophys. Res. Commun., 159: 420 (1989); S. Billich et al., J. Biol. Chem., 263: 17905 (1988); Sandoz, D. E. 3812-576-A.
Таким образом, соединения по настоящему изобретению полезны для лечения заболеваний, вызываемых ретровирусами, такими как синдром приобретенного иммунодефицита (СПИД).
Соединения полезны также для лечения животных, отличных от человека, инфицированных ретровирусом, таких как кошки, инфицированные кошачьим вирусом лейкемии. Другие вирусы, которые инфицируют кошек, включают, например, кошачий вирус инфекционного ларитонита, вирус мозаики, вирус кролика, кошачий вирус иммунодефицита, кошачий парвовирус (вирус панлейкемии) и кошачью хламидию. Конкретные дозы, формы и способы назначения соединений по настоящему изобретению животным, отличным от человека, вполне очевидны для специалиста в данной области техники, такого как ветеринар.
Соединения формулы I и II по настоящему изобретению получают, как описано на Схемах, в Препаратах и в Примерах, приведенных ниже, или же получают с использованием методов, аналогичных приведенным, которые хорошо известны и вполне доступны специалистам в области органической химии.
СХЕМА A
Нитрованием циклопропилфенилкетона формулы A-1, который имеется в продаже, с помощью "дымящей" азотной кислоты при температуре минус 40oC получают смесь изомеров в соотношении приблизительно 2:1. Целевое м-нитропроизводное формулы A-2 легко выделяют из сырой смеси рекристаллизацией из метанола. Каталитическим гидрированием циклопропил-(3-нитрофенил) метанона формулы A-2 с использованием 10%-ной платины на угле в метаноле получают анилин формулы A-3. Анилин затем конденсируют с бензолсульфохлоридом в присутствии пиридина в хлористом метилене и получают производное сульфонамида формулы A-4. Реакцией кетона с боргидридом натрия в тетрагидрофуране и этаноле получают карбинол формулы A-5.
Дианион циклооктилпиранона формулы A-6, полученного, как описано на Схеме B, генерируют с помощью ди-изо-пропиламида лития в тетрагидрофуране при температуре 0oC, а затем алкилируют его йодистым пропаном, получая 10-пропил-циклооктапиранон формулы A-7. Циклооктапиранон формулы A-7 и карбинол формулы A-5 конденсируют, используя п-толуолсульфокислоту в хлористом метилене, и получают производное сульфонамида формулы A-8.
СХЕМА В
Имеющийся в продаже амин формулы В-1 защищают, используя бензилхлорформиат и бикарбонат натрия в смеси тетрагидрофуран/вода и получают соединение формулы В-2. Альдегид формулы В-2 затем вводят в реакцию с реактивом Гриньяра и получают вторичный спирт формулы В-3, где, в частности, R1 обозначает изо-бутил. Известный циклооктилпиранон формулы B-4 получают ацилированием триметилсилилового енольного эфира циклооктанона с помощью малонилдихлорида, как это описано в R. Effenberger, Т. Ziegler, К.-H. Schonwalder, Т. Kesmar-szky, В. Bauer, Chem. Ber., 119: 3394-3404 (1986). Спирт формулы В-3 затем используют для алкилирования циклооктилпиранона формулы B-4 в кипящем толуоле в присутствии п-толуолсульфокислоты и получают соединение формулы В-5, где, в частности, R1 обозначает изо-бутил. На этой стадии энантиомеры формулы В-5 разделяют на хиральной колонке методом жидкостной хроматографии высокого разрешения. Защитную бензилокси-группу удаляют, используя 10%-ный палладий на угле в гексане, и получают амин формулы В-6, где, в частности, R1 обозначает изо-бутил, который далее вводят во взаимодействие с арилсульфохлоридами и получают соединения формулы В-7, где, в частности, R1 обозначает изо-бутил, a R2 обозначает 1-метилимидазол.
СХЕМА С
3-Бромбензиловый спирт формулы С-1, который выпускается промышленно, в тетрагидрофуране, при температуре минус 78oC последовательно подвергают обработке метиллитием, н-бутиллитием и циклопропанкарбоксальдегидом. Полученному раствору дают нагреться до комнатной температуры, а затем кипятят с обратным холодильником, получая спирт формулы С-2. Полученный спирт растворяют в дихлорметане и обрабатывают вместе с молекулярными ситами 4-гидрокси-5,6,7,8,9,10-гексагидроциклоокта[b]пиран-2-оном формулы С-8, полученным, как описано на Схеме В, и п-толуолсульфокислотой. Раствор кипятят с обратным холодильником и получают спирт формулы С-3. Бензиловый спирт обрабатывают четырехбромистым углеродом и трифенилфосфином в дихлорметане при температуре 0oC и после обработки водным раствором соли и выделения продукта получают соединения формулы С-4 и С-5 в виде не поддающейся разделению смеси. Смесь далее обрабатывают любым тиолом (в частности, тиофенолом) и органическим основанием и кипятят с обратным холодильником, получая сульфиды формулы С-6. После финишной обработки соединений формулы С-6 оксоном в смеси тетрагидрофурана, метанола и воды получают сульфоны формулы С-7.
СХЕМА D
Эта схема описывает общую методику получения С-3 α разветвленных 5,6-дигидропиронов путем катализируемой хлоридом алюминия конденсации с 3-нитробензальдегидом. Так, катализируемая хлоридом алюминия реакцию соединения формулы D-1, полученного, как описано ниже в Препаратах (в частности, где R1 обозначает фенэтил или пропил; R2 обозначает фенэтил или пропил) с 3-нитробензальдегидом (формула D-2), выпускаемым промышленно, приводит к соединениям формулы D-3 (где, в частности, R1 обозначает фенэтил или пропил; R2 обозначает фенэтил или пропил). Последующая реакция с триалкилалюминием или реактивами Гриньяра в присутствии комплекса бромид меди (1) диметилсульфид (CuBr-Ме2S) приводит к соединениям формулы D-4 (где, в частности, R1 обозначает фенэтил или пропил; R2 обозначает фенэтил или пропил, R3 обозначает этил или циклопропил). Обменным гидрированием с использованием палладия на угле и формиата аммония получают соединения формулы D-5 (где, в частности, R1 обозначает фенэтил или пропил; R2 обозначает фенэтил или пропил, R3 обозначает этил или циклопропил). Обработкой соединения формулы D-5 хлористым сульфонилом формулы D-7, где значения R4 указано ранее, и пиридином в хлористом метилене получают соединения формулы D-6 (где, в частности, R1 обозначает фенэтил или пропил; R2 обозначает фенэтил или пропил, R3 обозначает этил или циклопропил, R4 обозначает 4-цианофенил, 4-фторфенил, 1-метилимидазол-4-ил, хинолин-8-ил, 2-пиридил, 4-циано-2-пиридил, хинолин-2-ил, 2-гидроксифенил, 2-пиримидил, 2-хиназолин, 7H-пурин-6-ил, 1H-имидазол-2-ил, 1H-бензимидазол-2-ил или тиазол-2-ил).
СХЕМА E
Обработка промышленно выпускаемого 4-гидрокси-6-метил-2-пирона формулы E-1 тремя эквивалентами ди-изо-пропиламида лития в тетрагидрофуране и гексаметилфосфорамиде с последующей обработкой бромметилциклопропаном получают соединение формулы Е-2. Взаимодействием соединения формулы Е-2 и соединения F-5, полученным, как указано на Схеме F, в бензоле в присутствии молекулярных сит и п-толуолсульфокислоты как катализатора получают соединение формулы Е-3. Гидрогенолизом соединение формулы Е-3 в метаноле водородом над палладием на угле получают свободный амин формулы Е-4. Обработкой соединения Е-4 двумя эквивалентами пиридина в дихлорметане с последующей обработкой одним эквивалентом 4-фторбензолсульфонилхлорида получают соединение формулы Е-5 (где, в частности, R обозначает 4-фторфенил), которое представляет собой соединение N-(3-{циклопропил-[6-(2-циклопропил-1- циклопропилметилэтил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил) -4-фторбензолсульфонамид.
В аналогичных условиях получают соединения общей формулы E-5 путем взаимодействия амина Е-4 с алкил-, арил- или гетероарилсульфонилхлоридом в присутствии пиридина с образованием соединений формулы E-5, где R обозначает алкил, арил или гетероарил. Кроме того, например, энантиомеры соединения формулы Е-9 разделяют хроматографически методом хиральной жидкостной хроматографии высокого разрешения и получают соединения формулы Е-10 и Е-11. В аналогичных условиях получают конечные соединения по настоящему изобретению формулы Е-6, Е-7, Е-8 и Е-12 - Е-16.
СХЕМА F
Нитрованием промышленно выпускаемого циклопропилфенилкетона формулы F-1 "дымящей" азотной кислотой получают соединение формулы F-2. Восстановлением соединения формулы F-2 водородом в метаноле в присутствии платины на угле получают амин формулы F-3. Соединение формулы F-3 обрабатывают бензилхлорформиатом и ди-изо-пропилэтиламином в дихлорметане и получают соединение формулы F-4. Восстановлением соединения формулы F-4 боргидридом натрия в тетрагидрофуране и этаноле получают соединение формулы F-5.
СХЕМА G
Дианион промышленно выпускаемого 4-гидрокси-6-метил-2-пирона формулы G-0 генерируют депротонированием с использованием двух эквивалентов ди-изо-пропиламида лития в тетрагидрофуране и гексаметилфосфорамиде. Алкилированием 2-(2-метокси-этокси)этилиодидом, который получают из промышленно выпускаемого спирта по стандартной методике, выделяют соединение формулы G-1. По реакции соединения формулы G-1 и мета-бензилоксикарбониламинофенилциклопропилкарбинола, соединения формулы F-5, полученного, как указано на Схеме F, в дихлорметане с п-толуолсульфокислотой в качестве катализатора в присутствии молекулярных сит получают соединение формулы G-2. Гидрогенолизом соединения формулы G-2 в этаноле водородом и паллидем на угле получают свободный амино формулы G--3. Обработка свободного амина формулы G-3 двумя эквивалентами пиридина в дихлорметане с последующей обработкой одним эквивалентом 1- метилимидазол-4-сульфохлорида приводит к соединению формулы G-4, которое представляет собой соединение N-(3-{циклопропил-[4- гидрокси-6-(3-{2-метокси-этокси} -пропил)-2-ок-со-2H-пиран-3- ил]метил}-1-метил-1H-имидазол-4-сульфонамид.
СХЕМА H
По реакции промышленно выпускаемого 4-гидрокси-6-метил-2-пирона формулы H-0 и мета-бензилоксикарбониламинофенилциклопропилкарбинола, целевого соединения формулы F-5, полученного, как указано на Схеме F, в дихлорметане с п-толуолсульфокислотой в качестве катализатора в присутствии молекулярных сит получают соединение формулы H-1. Алкилированием трианиона соединения формулы H-1, полученного с помощью трех эквивалентов ди-изо-пропиламина лития в тетрагидрофуране, бромистым этилом получают соединение формулы H-2. Обработкой соединения формулы H-2 ди-изопропиламидом лития в тетрагидрофуране и 2-(2-метокси-этокси)этилиодидом получают соединение формулы H-3. Гидрогенолизом соединения формулы H-3 в этаноле водородом и палладием на угле получают свободный амин формулы H-4. Обработка свободного амина формулы H-4 двумя эквивалентами пиридина в дихлорметане с последующей обработкой одним эквивалентом 1-метилимидазол-4-сульфохлорида приводит к соединению формулы H-5, которое представляет собой соединение N-(3-{циклопропил-[6-(1-этил-3-{ 2- метокси-этокси}пропил)-4-гидрокси-2-оксо-2H-пиран-3- ил]метил}фенил)-1-метил-1H-имидазол-4-сульфонамид. В аналогичных условиях получают соединения по настоящему изобретению по реакции амина формулы H-1 с алкил-, арил- и гетероарилсульфохлоридами в присутствии пиридина с образованием дополнительных соединений формулы H-5.
СХЕМА I
Обработкой соединения формулы H-2, полученного, как описано на Схеме H, тремя эквивалентами ди-изо-пропиламида лития в тетрагидрофуране и оксидом этилена получают соединение формулы I-1. Реакцией соединения формулы I-1 с трифенилфосфином и тетрабромидом углерода в тетрагидрофуране получают соединение формулы I-2. Обработкой соединения формулы I-2 азидом натрия в водном растворе этанола получают соединение формулы I-3. Реакцией соединения формулы I-3 водородом и палладием на угле в этаноле получают соединение формулы I-4. Обработкой соединения формулы I-4 ди-изо-пропилэтиламином в дихлорметане с последующей обработкой 1-метилимидазол-4-сульфохлоридом получают соединение формулы I-5. Взаимодействием соединения формулы I-5 с раствором аммиака в метаноле получают соединение формулы I-6, которое представляет собой соединение N-(3-{ циклопропил-[6-(1-этил-3-{1-метил-1H- имидазол-4-сульфонамино} пропил)-4-гидрокси-2-оксо-2H-пиран- 3-ил] метил} фенил)-1-метил-1H-имидазол-4-сульфонамид.
СХЕМА J
Гидрогенолизом в этаноле соединения формулы I-1, полученного, как показано на схеме I водородом и палладием на угле выделяют соединение формулы J-1. Обработкой соединения формулы J-1 трифенилфосфином и четырехбромистым углеродом в тетрагидрофуране получают соединение формулы J-2. Реакцией соединения формулы J-2 с пиридином в дихлорметане с последующим взаимодействием с 1-метилимидазол-4-сульфохлоридом получают соединение формулы J-3, которое представляет собой соединение N-(3-{[6-(3-бром-1- этилпропил)-4-гидрокси-2-оксо-2H-пиран-3-ил] циклопропилметил} фенил)-1-метил-1H-имидазол-4-сульфонамид. Обработкой соединения формулы J-3 азидом натрия в водном этаноле получают соединение формулы J-4, которое представляет собой соединение N-(3-{ [6- (3-азидо-1-этилпропил)-4-гидрокси-2-оксо-2H-пиран-3-ил] - циклопропилметил} фенил)-1-метил-1H-имидазол-4-сульфонамид. Взаимодействием соединения формулы J-4 с водородом и палладием на активированном угле в этаноле получают соединение формулы J-5. Обработкой соединения формулы J-5 триэтиламиновой солью сулептановой кислоты (B.D. Anderson, R.A. Conradi, К.Е. Knuth, J. Pharm. Sci., (1985) 74: 365) и 1,3-ди-изо-пропил-карбонилдиимидом получают соединение формулы J-6, которое представляет собой натриевую соль N-(3-{ циклопропил-[6-(1-этил-3-{ N-[8-(метил-{ 2-сульфоэтил} амино)-1,8-диоксооктил]аминопропил})-4-гидрокси-2-оксо-2H-пиран-3-ил]-метил- фенил)-1-метил-1H-имидазол-4-сульфонамида.
СХЕМА K
Получение соединения формулы K-8, которое представляет собой соединение N-(3-{ циклопропил-[6-(1-(тетрагидропиран-4-илметил)пропил) -4-гидрокси-2-оксо-2H-пиран-3-ил] -метил} -фенил)-1-метил-1H-имидазол-4-сульфонамид, показано на Схеме K. Восстановлением промышленно выпускаемой тетрагидропиран-4-карбоновой кислоты формулы K-1 бораном в тетрагидрофуране получают соединение K-2. Соединение формулы K-2 обрабатывают п-толуолсульфохлоридом, получают соответствующий тозиат формулы К-3, который превращают в иодид формулы К-4 обработкой иодидом калия в кипящем ацетоне. Алкилированием дианиона промышленно выпускаемого 4-гидрокси-6-метил-2-пирона формулы К-10 бромистым этилом в тетрагидрофуране и гексаметилфосфоротриамидом получают пропильное производное формулы К-9. Соединение формулы К-4 используют для алкилирования соединения формулы К-9 в 6-альфа-положение и получают соединение формулы К-5. Соединение формулы К-5 далее алкилируют в 3-положение, используя карбинол формулы F-5, полученный, как описано на Схеме F, и выделяют соединение формулы К-6. Удаление бензилоксикарбонильной защитной группы проводят, используя метод обменного гидрирования, и получают амин формулы К-7. Обработкой амина формулы К-7 1-метилимидазол-4-сульфохлоридом в присутствии пиридина получают соединение формулы К-8.
СХЕМА L
Как показано на Схеме L, дианион выпускаемого промышленно 4-гидрокси-6-метил-2-пирона формулы L-1 генерируют депротонированием двумя эквивалентами ди-изо-пропиламида лития в тетрагидрофуране и гексаметилфосфорамиде. Алкилированием бромистым бензилом получают соединение формулы L-2, которое затем обрабатывают двумя эквивалентами ди-изо-пропиламида лития в тетрагидрофуране и гексаметилфосфорамиде с последующей обработкой йодистым этилом и получают соединение формулы L-3. Взаимодействием соединения формулы L-2 и соединения формулы F-5, полученного, как описано на Схеме F, в бензоле, используя п-толуолсульфокислоту в качестве катализатора, в присутствии молекулярных сит получают соединение формулы L-4, которое представляет собой 3-[(3-бензилоксикарбониламинофенил) циклопропил-метил] -6-(1-этилфенэтил)-4-гидрокси-2H-пиран-2-он. Гидрогенолизом соединения формулы L-4 в метаноле, используя палладий на активированном угле в качестве катализатора и формиат аммония или водород, получают свободный амин формулы L-5, который представляет собой 3-[(3-аминофенил) циклопропил-метил] -6-(1-этилфенэтил)-4-гидрокси-2H-пиран-2-он. Взаимодействием соединения формулы L-5 и соответствующего сульфохлорида получают конечное соединение по настоящему изобретению.
СХЕМА М
Как показано на Схеме М, выпускаемый промышленно монометиловый эфир триэтиленгликоля обрабатывают п-толуолсульфохлоридом и пиридином и получают тозилат формулы М-2, который затем используют для алкилирования выпускаемого промышленно 2,4-дигидроксиацетофенона и получают соединение формулы М-3. Конденсацией с использованием диэтилкарбоната синтезируют соединение формулы М-4. Закрытие цикла соединения формулы М-4 с образованием соединения формулы М-5 проводят в кипящей уксусной кислоте. Соединение формулы М-5 алкилируют в 3-положение с помощью карбинола формулы F-5, синтезированного, как указано на Схеме F, и каталитического количества п-толуолсульфокислоты и получают соединение формулы М-6. Удаление бензилоксикарбонильной защитной группы проводят методом обменного гидрирования и получают амин формулы М-7. Обработкой амина 1-метилимидазол-4-сульфохлоридом в присутствии пиридина получают конечное соединение формулы М-8, которое представляет собой N-(3-{циклопропил-[7-(2-(2-(2-метоксиэтокси)этокси)этокси)-4- гидроксикумарин-3-ил] метил}-фенил)-1-метил-1H-имидазол-4- сульфонамид.
СХЕМА N
Hитрованием циклопропилфенилкетона формулы N-1, который выпускается промышленно, с помощью "дымящей" азотной кислоты при температуре минус 40oC получают смесь изомеров в соотношении приблизительно 2:1. Целевое м-нитропроизводное формулы N-2 легко выделяют из сырой смеси перекристаллизацией из метанола. Каталитическим гидрированием циклопропил-(3-нитрофенил)метанона формулы N-2 с использованием 10%-ной платины на угле в метаноле при 0oC получают анилин формулы N-3. Продукт выделяют фильтрованием и упариванием. Амино-группу затем защищают с помощью бензилхлорформиата и ди-изо-пропилэтиламина в хлористом метилене и получают кетон формулы N-4. Кетон восстанавливают боргидридом натрия в смеси 5:1 тетрагидрофурана и этанола и получают спирт формулы N-5.
Соединение формулы N-5 далее используют для алкилирования 4-гидрокси-5,6,7,8,9,10-гексагидроциклоокта[b]пиран-2-она, полученным, как описано в R. Effenberger, Т. Ziegler, К. -H. Schonwalder, Т. Kesmarsky, В. Bauer, Chem. Ber. , 119: 3394-3404 (1986) и получают соединение формулы N-6. Предпочтительные условия для проведения реакции алкилирования включают кипячение с обратным холодильником с п-толуолсульфокислотой в хлористом метилене в экстракторе Сокслета вместе с молекулярными ситами. Наконец, соединение формулы N-7 получают удалением бензильной защитной группы методом обменного гидрирования. Наилучшие результаты при проведении этой реакции получаются при использовании 10%-ного палладия на угле в чистом циклогексене.
СХЕМА О
Обработкой амина формулы O-1, полученного, как описано на Схеме N, сульфохлоридом и основанием, таким как пиридин в дихлорметане, получают сульфонамиды формулы O-2, где R60, например, обозначает 4-нитрофенил. Указанные сульфонамиды затем модифицируют по описанным в литературе методикам, которые очевидны для специалистов в данной области техники, и получают сульфонамиды формулы О-3, где R61 например, обозначает 4-нитрофенил и другие функциональные группы, которые нельзя легко получить из доступных сульфохлоридов. Например, нитро-группу в N-[3-[циклопропил(5,6,7,8,9,10-гексагидро-4-гидрокси-2-оксо- 2H-циклоокта[b] пиран-3-ил)метил]фенил]-4 -нитробензолсульфонамиде восстанавливают каталитическим гидрированием в этилацетате палладием на угле и получают амин 4-амино-N-[3-[циклoпpoпил-(5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил]фенил]бензолсульфонамид. Кроме того карбоксильную группу в 3-[[[3-[циклoпpoпил(5,6,7,8,9,10-гексагидро -4-гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)-метил]фенил]амино] сульфонил] бензойной кислоте этерифицируют метанолом в присутствии каталитического количества серной кислоты и получают метиловый эфиp 3-[[[3-(циклoпpoпил-(5,6,7,8, 9,10-гeкcaгидpo-4-гидpoкcи-2-oкco-2H-циклooктa[b] пиpaн-3-ил)метил] фенил] амино] сульфонил] бензойной кислоты. Сульфонамид формулы О-3 получают также из соединений формулы O-2 дальнейшей функционализацией реакционноспособных функциональных групп. Например, амино-группу в 3-aминo-N-[3-[циклoпpoпил- (5,6,7,8,9,10-гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)метил] фенил] бензолсульфонамида вводят во взаимодействие с хлористым бензоилом и основанием, таким как пиридин, и получают бензамид 3-[[[3-[циклопропил(5,6,7,8,9,10-гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)метил] фенил]-амино]сульфонил]бензамида. Используя доступные сульфохлориды, получают дополнительные соединения по настоящему изобретению формулы II, где R10 и R20 обозначают фрагмент формулы IV.
Сульфохлориды, которые используют для синтеза соединений по настоящему изобретению, легко могут быть получены специалистами в данной области техники по методикам, описанным в литературе, как это проявляют следующие примеры. Реакцией соответствующего тиола с бифторидом калия в смеси вода/метанол и газообразным хлором получают сульфофторид (D.J. Brown, J.A. Hoskins, Aust. J. Chem., (1972) 25: 2641), который затем превращают в требуемый сульфохлорид (Т. Norris, J. Chem. Soc.,Perkin Trans. (1978) 1(1): 1378). Окислением соответствующего тиола хлором в водном растворе хлорида железа (III) получают целевой сульфохлорид (G. Pala, Ed. Sci., (1958) 13: 461; W.J. Close, J. Am. Chem. Soc., (1960) 82: 1132). По реакции гетероароматического соединения с "дымящей" серной кислотой получают гетероароматическую сульфокислоту, а последующей обработкой оксихлоридом фосфора и хлоридом фосфора (V) получают целевой сульфохлорид (V. Gergian, R.J. Harrison, L.L. Skaletzky, J. Org. Chem., (1962) 27: 4571. Реакцией гетероароматического соединения с диоксидом марганца и сульфитом натрия в воде получают целевую сульфокислоту, а последующей обработкой хлорокисью фосфора и хлоридом фосфора (V) получают целевой сульфохлорид (N. A. Androva, Izvest., 455 (1972); J.O. Morley, J. Chem. Commun., (1976) 88). Обработкой соответствующего гетероароматического хлорида сульфатом натрия и водным раствором соляной кислоты получают требуемую сульфокислоту, а последующей обработкой хлорокисью фосфора и хлоридом фосфора (V) получают целевой сульфохлорид (T.R. Norton, J. Amer. Chem. Soc., (1946) 68: 1330). Обработкой соответствующего гидроксильного производного N, N-диметилтиокарбонилхлоридом (M. S. Newman, F.W. Hetzel, Org. Synth. Coll. Vol. IV: 824 (1988); M.S. Newman, H.A. Karnes, J. Org. Chem., (1966) 31: 3980) с последующей обработкой, как это указано выше, получают целевой сульфохлорид. Взаимодействием соответствующего тио-гетероароматического соединения, содержащего защитную группу, с хлором в уксусной кислоте получают целевой сульфохлорид (Can. J. Chem., (1977) 55: 421). Используя вышеуказанные описанные в литературе методики, получают гетероароматические сульфохлориды по настоящему изобретению.
СХЕМА P
Предпочтительная методика получения гетероарильных сульфонамидов формулы Р-2 приводится на Схеме Р. Сульфонированием амина формулы Р-1, полученного, как показано на Схеме N, с помощью различных гетероарилсульфохлоридов формулы Р-3, где R, в частности, обозначает 2-пиридил, 4-пиридил, 5-цианопиридин-2-ил, 2-пиразинил, 2-пипимидинил, 4,6-диметилпиримидин-2-ил, 4-метилпиримидин-2-ил, получают сульфонамиды формулы Р-2, где R обозначает соответствующий заместитель.
СХЕМА Q.
Дианион промышленно выпускаемого метилового эфира ацетоуксусной кислоты, который генерируют последовательным депротонированием гидридом натрия и н-бутиллитием в тетрагидрофуране при температуре 0oC, вводят во взаимодействие с кетоном формулы Q-1, полученным, как указано на Схеме S (формула S-4). Полученный промежуточный гидроксиэфир циклизуют разбавленным водным раствором гидроксида, а затем обрабатывают раствором соляной кислоты и получают соединение формулы Q-2. Соединение формулы Q-2 конденсируют с выпускаемым промышленно 3-нитробензальдегидом в тетрагидрофуране, используя в качестве катализатора трихлорид алюминия, и промежуточно полученный бензилиденовый аддукт вводят во взаимодействие с триэтилалюминием в присутствии комплекса бромил меди (1) - диметилсульфид, получая соединение формулы Q-3. Методом обменного каталитического гидрирования с помощью формиата аммония над палладием на угле в метаноле получают соединение формулы Q-4. Соединение формулы Q-4 обрабатывают соответствующим сульфохлоридом и пиридином в дихлорметане и получают целевое соединение формулы Q-5 (где, например, R1 обозначает 5-циано-2-пиридил или 1-метилимидазол-4-ил).
СХЕМА R
Каталитическим гидрированием промышленно выпускаемого 3-нитропропиофенона формулы R-1 получают амин формулы R-2. Амин формулы R-2 обрабатывают ди-изо-пропилэтиламином и бромистым бензилом, получая соединение формулы R-3. Дианион промышленно выпускаемого метилового эфира ацетоуксусной кислоты, который генерируют обработкой гидридом натрия и н-бутиллитием в тетрагидрофуране при температуре 0oC, вводят во взаимодействие с кетоном формулы R-3. Полученный промежуточный гидроксиэфир циклизуют разбавленным водным раствором гидроксида, а затем обрабатывают раствором соляной кислоты и получают соединение формулы R-4. Соединение формулы R-4 конденсируют с 3-нитробензальдегидом в тетрагидрофуране, используя в качестве катализатора трифхлорид алюминия, и промежуточно полученный бензилиденовый аддукт вводят во взаимодействие с триэтилалюминием в присутствии комплекса бромид меди (1) - диметилсульфид, получая соединение формулы R-5. Каталитическим гидрированием над палладием на угле получают диамин формулы R-6. Соединение формулы R-6 обрабатывают соответствующим сульфохлоридом и пиридином в дихлорметане и получают целевое соединение формулы R-7 (где, например, R1 обозначает 5-циано-2-пиридил или 1-метилимидазол-4-ил).
СХЕМА S
Промышленно выпускаемую 4-пентеновую кислоту формулы S-1 конденсируют с N,O-диметилгидроксиламином в присутствии бис-(2-оксо-3-оксазолидинил)фосфинхлорида и получают амид формулы S-2. Амид формулы S-2 вводят во взаимодействие с 3-бутенил-магнийбромидом и тетрагидрофуране и получают кетон формулы S-3. Кетон формулы S-3 обрабатывают металлическим цинком, хлоридом меди и дииодметаном и получают кетон формулы S-4 (см. также выше формулы Q-1 на Схеме Q).
СХЕМА T
Соединение формулы T-2 (см, также формулы D-1) (его получение отдельно приводится на Схеме D и в Препарате 17 из выпускаемого промышленно метилового эфира ацетоуксусной кислоты и 1-фенил-3-гексинона (формула Т-1)) конденсируют с 3-нитробензальдегидом в тетрагидрофуране, используя в качестве катализатора трихлорид алюминия, с последующей реакцией промежуточно полученного бензилиденового аддукта с трет-бутил Cu(CN)ZnI, (металлоорганическим реагентом, который получают из металлического цинка, 2-иод-2-метилпропана, цианида меди и хлорида лития) и выделяют соединение формулы Т-3. (Приготовление металлоорганического реагента подробнее описывается в Препарате J). Каталитическим обменным гидрированием формиатом аммония и палладием на угле в метаноле получают соединение формулы Т-4. Соединение формулы Т-4 обрабатывают соответствующим сульфохлоридом и пиридином в дихлорметане и получают целевое соединение формулы Т-5 (где, например, R1 обозначает 5-циано-2-пиридил или 1-метилимидазол-4-ил).
СХЕМА U
Промышленно выпускаемую 4-фторгидрокоричную кислоту формулы U-1 конденсируют с N,O-диметилгидроксиламином в присутствии диэтилового эфира цианофосфорной кислоты и получают амид формулы U-2. Амид обрабатывают н-пропилмагнийхлоридом и получают кетон U-3. Кетон конденсируют с дианионом метилового эфира ацетоуксусной кислоты с последующим гидролизом промежуточного эфира и циклизацией и выделяют дигидропирон формулы U-4. Дигидропирон вводят во взаимодействие с альдегидом формулы В-2, полученным, как указано на Схеме В, в присутствии трихлорида алюминия и получают бензимиденовое производное формулы U-5; последующее взаимодействие с реактивами Гриньяра или триалкилалюминием в присутствии комплекса бромид меди (1) - диметилсульфид приводит к соединению формулы U-6 (где, в частности, R1 обозначает этил, трет-бутил или циклопропил). Удаление бензоксикарбонильной (CBZ) защитной группы проводят с помощью формиата аммония и палладия на угле и получают амины формулы U-7 (где, в частности, R1 обозначает этил, трет-бутил или циклопропил). Амины обрабатывают сульфохлоридом и пиридином в дихлорметане и получают сульфонамиды формулы U-8 (где, в частности, R1 обозначает этил, трет-бутил или циклопропил, а R2 обозначает алкил, арил или гетероарил).
СХЕМА V
Выпускаемый промышленно 4-фторбензальдегид формулы V-1 конденсируют с ацетоном в присутствии основания и получают 1,5-бис-(4-фторфенил)-пента-1,4-диен-3-он формулы V-2. Диенон восстанавливают магнием в метаноле и получают кетон формулы V-3. Кетон формулы V-3 превращают в производные дигидропирона формулы V-8, используя последовательность реакций, аналогичную приведенной на Схеме U, для синтеза соединения U-8 из соединения U-3.
СХЕМА W
Выпускаемую промышленно транс-2-пентеновую кислоту формулы W-1 превращают в соответствующий хлорангидрид с помощью хлористого оксалила в хлористом метилене и получают продукт формулы W-2. Амид лития формулы W-3, который легко получают обработкой промышленно выпускаемого (S)-(+)-4-фeнил-2-oкcaзолидона н-бутиллитием в тетрагидрофуране при температуре минус 78oC, обрабатывают хлорангидридом формулы W-2 и получают ненасыщенный амид формулы W-4. Амид формулы W-4 добавляют к раствору тетрагидрофурана, содержащего промышленно выпускаемый комплекс бромид меди (1) - диметилсульфид и 3-[бис(триметилсилил)амино] фенилмагнийбромид при температуре минус 20oC, и после обычной промывки кислотой получают соединение формулы W-5 (Hruby et al. , J. Org. Chem. , (1993) 58(26): 7567). Анилин формулы W-5 вводят во взаимодействие при кипячении с бромистым бензилом и карбонатом натрия в смеси вода/хлористый метилен или карбонатом калия в кипящем ацетонитриле и получают соединение формулы W-6. Амид формулы W-6 обрабатывают хлоридом титана (IV) с последующей обработкой аминовым основанием в растворителе, таком как хлористый метилен, и при температуре ниже минус 20oC, предпочтительно при температуре минус 78oC, добавляют 2-метокси-2-метил-1,3-диоксолин формулы W-7 (получают, как описано Santry et al., J. Am. Chem. Soc., (1988) 110(9): 2910) и выделяют соединение формулы W-8. После короткой обработки соединения формулы W-8 протовой кислотой получают бета-кетоамид формулы W-9. Дальнейшая обработка соединения формулы W-9 хлоридом титана (IV) и последующая обработка аминовым основанием, а затем 4-гептаноном или пропилфенилкетоном приводит к соединению формулы W-10, где R1 обозначает н-пропил или фенэтил соответственно. Соединение формулы W-10 обрабатывают гидридом натрия или предпочтительно трет-бутоксидом калия в эфирном растворителе и выделяют пирон формулы W-11. Гидрированием соединения формулы W-11 при использовании, в частности, палладия на угле в качестве катализатора, получают соединение формулы W-12. Наконец, соединение формулы W-12 вводят во взаимодействие с сульфохлоридом формулы D-7, где R4 обозначает 5-трифторметил-2-пиридинил, в органическом растворителе, таком как хлористый метилен, в присутствии органического основания, такого как пиридин, и получают конечное соединение формулы W-13, где R1 обозначает н-пропил или фенэтил (если R1 обозначает фенэтил, то соединение существует в виде пары диастереомеров).
СХЕМА X
Конечный (R)-энантиомер формулы Х-13, где R1 обозначает н-пропил или фенэтил, получают в соответствии с процедурой, приведенной на Схеме W.
СХЕМА Y
К хлористому ацетилу формулы Y-1 добавляют амид лития формулы Y-2 (или Х-3), который легко получают обработкой промышленно выпускаемого (R)-(-)-4-фенил-2-оксазолидона н-бутиллитием в тетрагидрофуране при температуре минус 78oC, и получают продукт формулы Y-3. Соединение формулы Y-3 вначале обрабатывают хлоридом титана (IV) в хлористом метилене при температуре ниже чем комнатная, а затем добавляют третичное аминовое основание с последующим добавлением альдегида формулы Y-4 (альдегид формулы Y-4 легко получают по реакции выпускаемого промышленно 3-аминобензальдегида с бромистым бензилом и карбонатом калия или карбонатом натрия либо в ацетонитриле, либо в смеси вода/хлористый метилен) и получают соединение формулы Y-5. Добавляют амид формулы Y-5 к раствору промышленно выпускаемого комплекса бромид меди (1) - диметилсульфид и этилмагнийхлорида в тетрагидрофуране при температуре минус 20oC и получают соединение формулы Y-6. Или же выпускаемое промышленно соединение формулы Y-7 обрабатывают хлористым оксалилом и получают соединение формулы Y-8. Соединение формулы Y-8 затем добавляют к раствору соединения формулы Y-2 (или Х-3), которое легко получают обработкой промышленно выпускаемого (R)-(-)-4-фенил-2-оксазолидона н-бутиллитием в тетрагидрофуране при температуре минус 78oC, и получают соединение формулы Y-9. Соединение формулы Y-9 восстанавливают металлическим железом в водно-спиртовом растворе и получают соединение формулы Y-10. Соединение формулы Y-10 обрабатывают бромистым бензилом и карбонатом калия или карбонатом натрия либо в ацетонитриле либо в смеси вода/хлористый метилен) и получают соединение формулы Y-5, которое, как указано ранее, превращают в соединение формулы Y-6. Соединение формулы Y-6 превращают в конечный продукт, как это описано для превращения соединения формулы W-6 в соединение формулы W-13 (где R1 обозначает пропил или фенэтил) на Схеме W.
СХЕМА Z
Получение (3S)-амида формулы Z-6 проводят аналогично, как указано выше на Схеме Y, за исключением того, что используют соединение формулы Z-2 (или W-3). Соединение формулы Z-6 превращают в конечный продукт, как показано на Схеме Z, по методике, приведенной для превращения соединения формулы Х-6 в соединение формулы Х-13 (где R1 обозначает пропил или фенэтил).
СХЕМА AA
Получение 3(S), 6(S) диастереомеров AA-12 и AA-14: добавляют ненасыщенный амид формулы AA-1 (или Y-5) в раствор промышленно выпускаемого комплекса бромид меди (1) - диметилсульфид и этилмагнийхлорида в тетрагидрофуране при температуре минус 20oC и получают соединение формулы AA-2 (или Y-6). Восстановлением соединения формулы AA-2 гидридом металла (боргидридом натрия, алюмогидридом лития) получают соединение формулы AA-3. Соединение формулы AA-3 окисляют (по методу Сверна) и получают альдегид формулы AA-4, который обрабатывают триметилсилилцианидом и выделяют цианогидрин формулы AA-5, имеющий триметилсилильную защиту. По другому варианту соединение формулы AA-2 обрабатывают триметилалюминием и далее N-метил-O-метилгидроксиламином и получают амид формулы AA-6, который обрабатывают алюмогидридом лития и выделяют альдегид формулы AA-4. Триметилсилилцианогидрин формулы AA-5 вводят во взаимодействие с сильным основанием (в частности, н-бутиллитием) и далее с хиральным эпоксидом формулы AA-7 (а также ВВ-12; его синтез приведен на Схеме BB) и получают соединение формулы AA-8. Соединение формулы AA-8 растворяют в хлористом метилене и охлаждают до минус 78oC, добавляют хлорид титана (IV) и третичный амин. К полученному раствору добавляют триметилортоформиат и дополнительное количество хлорида титана (IV) и получают соединение формулы AA-9. Соединение формулы AA-9 обрабатывают основанием, а затем триметилсилилхлоридом, окисляющим агентом (озоном), тетрабутиламмонийфторидом и либо трет-бутоксидом калия, либо гидридом натрия в простом эфире и получают соединение формулы AA-10. Соединение формулы AA-10 гидрируют и получают соединение формулы AA-11. Наконец, соединение формулы AA-11 обрабатывают сульфохлоридом формулы D-7, полученным, как показано на Схеме D, где R4 обозначает, в частности, 5-трифторметил-2-пиридинил, в органическом растворителе, таком как хлористый метилен, в присутствии органического основания, такого как пиридин, и получают соединение формулы AA-12.
Более того, добавлением соединения формулы AA-1 к раствору промышленно выпускаемого комплекса бромид меди (1) - диметилсульфид и этилмагнийхлорида в тетрагидрофуране при температуре минус 20oC получают соединение формулы AA-13. Соединение AA-13 превращают в конечный продукт соединения формулы AA-14, используя химические превращения, которые применяют при синтезе AA-12.
СХЕМА BB
На Схеме BB описывается асимметрический синтез эпоксидов формулы ВВ-7 и ВВ-12. Алкилированием 2-метил-2-пропен-1-ола (ВВ-1) промышленно выпускаемым бромистым бензилом получают аллиловый спирт формулы ВВ-2 (см. В.H. Lipshutz et al., Synthesys 1992, 191). Каталитическим эпоксидированием по методу Шарплеса с помощью выпускаемого промышленностью (+)-диэтил-L-тертрата получают эпоксиспирт формулы ВВ-8 (см. (a) A. Pfenniger 1986, 89; (b) R.A. Johnson, K. B. Sharpless, In: "Catalytic Asymmetric Synthesis"; I.Ojima, Ed; VCH: New York, 1993, Chapter 4.1, 103). Алкилированием соединения формулы ВВ-8 бензилбромидом (см. В.H. Lipshutz et al., Synthesis 1992, 191) получают соединение формулы ВВ-9. Реакцией соединения формулы ВВ-9 с промышленно выпускаемым этилмагнийбромидом получают третичный спирт формулы ВВ-10 (см. R.M. Hanson, Chem. Rev., 1991, 91, 437). Каталитическим гидрогенолизом соединения формулы ВВ-10 получают диол формулы ВВ-11. Соединение формулы ВВ-11 превращают в хиральный эпоксид формулы ВВ-12 по стандартной методике (о получении эпоксидов из вицинальных диолов см. О. Mitsunobu, In: "Comprehensive Organic Synthesis", B.M. Trost, Ed., Pergamon Press: Oxford; Vol. 6, Chapter 1.1, 1; 1991).
Аналогично, эпоксид формулы ВВ-7 получают в конце концов из эпоксиспирта формулы ВВ-3, который, в свою очередь, получают окислением аллилового спирта ВВ-2 по методу Шарплеса, используя выпускаемый промышленно (-)-диэтилтартрат-D.
Иным способом реакцией эпоксиспирта формулы ВВ-8 с выпускаемым промышленно 4-толуолсульфохлоридом в стандартных условиях получают тозилат формулы ВВ-13. Взаимодействием соединения ВВ-13 с этилмагнийбромидом в условиях, аналогичных описанным для нуклеофильного раскрытия цикла аренсульфонатного производного эпигидринового спирта (см. J.M. Klunder, Т. Onami, К.В. Sharpless, J. Org. Chem., 1989, 54: 1295) получают смесь целевого эпоксида формулы ВВ-12 и гидрокситозилата формулы ВВ-14. Гидрокситозилат формулы ВВ-14 легко превращается в эпоксид ВВ-12 действием карбоната калия в метаноле.
СХЕМА СС
Получение 3(S), 6(R) диастереомеров СС-12 и СС-14: указанные диастереомеры получают так же, как указано на Схеме AA, за исключением того, что используют эпоксид формулы СС-7 (или ВВ-7).
СХЕМА DD
Получение 3(R), 6(S) диастереомеров DD-12 DD-14: указанные диастереомеры получают так же, как указано на Схеме AA, за исключением того, что используют амид формулы DD-1 (или Z-5).
СХЕМА ЕЕ
Получение 3(R), 6(R) диастереомеров ЕЕ-12 и ЕЕ-14: указанные диастереомеры получают так же, как указано на Схеме DD, за исключением того, что используют эпоксид Формулы ЕЕ-7 (или ВВ-7).
СХЕМА FF
Амид лития формулы FF-2, который легко получают, обрабатывая промышленно выпускаемый (S)-(+)-4-фенил-2- оксазолидинон н-бутиллитием в тетрагидрофуране при температуре минус 78oC, вводят во взаимодействие с ацетилхлоридом Формулы FF-1 и получают амид формулы FF-3. Обработкой соединения формулы FF-3 хлоридом титана (IV) с последующей обработкой триалкиламином и выпускаемым промышленностью триметилацетальдегидом получают соединение формулы FF-4. Амид формулы FF-4 добавляют к раствору промышленно выпускаемого комплекса бромид меди (1) - диметилсульфид и 3-[бис-(триметилсилил)амино]фенил-магнийхлорида в тетрагидрофуране при температуре минус 20oC и получают после кислотной обработки соединение формулы FF-5. Анилин формулы FF-5 обрабатывают бромистым бензилом и карбонатом натрия в смеси вода/хлористый метилен при кипячении или карбонатом калия в кипящем ацетонитриле и получают соединение формулы FF-6.
Амид лития формулы FF-7, который легко получают, обрабатывая промышленно выпускаемый (S)-(-)-4-бензил-2-оксазолидинон н-бутиллитием в тетрагидрофуране при температуре минус 78oC, вводят во взаимодействие с ацетилхлоридом формулы FF-1 и получают амид формулы FF-8. Обработкой соединения формулы FF-8 хлоридом титана (IV) с последующей обработкой триалкиламином и выпускаемым промышленностью триметилацетальдегидом получают соединение формулы FF-9. Амид формулы FF-9 добавляют к раствору промышленно выпускаемого комплекса бромид меди (1) - диметилсульфид и 3-[биc-(тpимeтилcилил)aминo]фeнил-магнийхлорида в тетрагидрофуране при температуре минус 20oC и получают смесь соединений формулы FF-10a и FF-10b. Анилин формулы FF-10 обрабатывают бромистым бензилом и карбонатом натрия в смеси вода/хлористый метилен при кипячении или карбонатом калия в кипящем ацетонитриле и получают соединение формулы FF-11. Обработкой соединения формулы FF-11 хлоридом титана (IV) в хлористом метилене с последующей обработкой третичным амином и 2-метил-2-метокси-1,3-диоксоланом получают промежуточный диоксолан (см. W-8 на Схеме W), который обрабатывают мягкой кислотой и получают соединение формулы FF-12. Обработкой соединения формулы FF-12 хлоридом титана (IV) в хлористом метилене с последующим добавлением либо 4-гептанона, либо 1-фенил-3-гексанона получают производное альдола формулы FF-13. Соединение формулы FF-13 обрабатывают либо гидридом натрия, либо трет-бутоксидом калия в простом эфире и получают соединение формулы FF-14. Соединение формулы FF-14 далее гидрируют в атмосфере водорода в присутствии палладия на угле в качестве катализатора и получают соединение формулы FF-15. Наконец, соединение формулы FF-15 обрабатывают сульфохлоридом формулы D-7, приведенным на Схеме D, где R4 в частности, обозначает 5-фторметил-2-пиридил, в органическом растворителе, таком как хлористый метилен, в присутствии органического основания, такого как пиридин, и получают конечное соединение формулы FF-16, где, в частности, R1 обозначает пропил или фенэтил.
СХЕМА G
Промежуточное соединение формулы GG-6 и конечный продукт формулы GG-16 получают, как показано на Схеме FF, за исключением того, что используют вспомогательные хиральные соединения (R)-(-)-4-фенил-2-оксазолидинон и (R)-(+)-4-бензил-2-оксазолидинон.
СХЕМА HH
Соединение формулы HH-1 (W-6), полученное, как описано на Схеме W, превращают в сложный эфир формулы HH-2, где R обозначает трет-бутил, добавлением трет-бутоксида калия к раствору соединения формулы HH-1 в тетрагидрофуране при температуре 0oC. Соединение формулы HH-2, где R обозначает трет-бутил, можно также получить из HH-1 в две стадии. Во-первых, оксазолидиноновую группу отщепляют обработкой соединения формулы HH-1 гидроксидом лития и пероксидом водорода при 0oC в смеси тетрагидрофурана и воды. Затем полученную промежуточную кислоту обрабатывают трет-бутилацеталем N,N-диметилформамида в кипящем бензоле и получают сложный эфир формулы HH-2 (R обозначает трет-бутил). Сложный эфир формулы HH-2, где R обозначает метил, получают нагреванием смеси хлорида титана (IV) и соединения формулы HH-1 в метаноле. Соединение формулы HH-3 получают обработкой сложного эфира формулы HH-2 ди-изо-пропиламидом лития или гексаметилдисилилазидом натрия с образованием енолята, который затем связывают этилформиатом и получают соединение формулы HH-3. Полученное таким образом промежуточное соединение обрабатывают тозилхлоридом в 1,2-диметоксиэтане и получают соединение формулы HH-4, которое затем превращают в серусодержащее производное формулы HH-5 обработкой смесью гидрида калия и тиофенола в тетрагидрофуране. Соединение формулы HH-5 затем депротонируют с помощью трет-бутиллития в тетрагидрофуране при низкой температуре. Добавляют эпоксид формулы HH-6 (ВВ-7), полученный, как показано на Схеме BB, и один эквивалент эфирата трехфтористого бора и получают соединение формулы HH-7. Полученное промежуточное соединение in situ циклизуют в соединение формулы HH-8 или же выделяют и обрабатывают гидридом натрия в тетрагидрофуране, получая циклическое соединение формулы HH-8. Содержащую серу группу затем гидролизуют с помощью либо гидроксида натрия в ацетонитриле, либо водным раствором хлорида меди и получают производное дигидропирона формулы HH-9. Бензильную защитную группу затем удаляют каталитическим гидрированием над 10%-ным палладием на угле в этилацетате. Полученный амин формулы HH-10 превращают в целевое производное сульфонамида формулы HH-11 обработкой 5-цианопиридин-2-сульфохлоридом, синтезированным по методике, приведенной на Схеме О, и пиридином в дихлорметане.
СХЕМА II-00
Диастереомер формулы II-7 получают в соответствии со Схемой II по методикам, аналогичным приведенным для получения диастереомерных продуктов по Схеме HH. Аналогично стереомеры формул JJ-11, КК-7, LL-11, ММ-7, NN-11 и OO-7 получают в соответствии со Схемами JJ, KK, LL, MM, NN и OO соответственно по методикам, аналогичным описанным для Схемы HH.
СХЕМЫ PP
Соединение формулы РР-4 (HH-8) также получают, как описано на Схеме PP. Кислоту формулы РР-2 синтезируют обработкой трет-бутилового эфира формулы РР-1 (HH-5), полученного, как показано на Схеме HH, водным раствором кислоты. Соединение формулы РР-2 затем обрабатывают трет-бутиллитием в тетрагидрофуране при низкой температуре и получают промежуточный дианион, который обрабатывают эпоксидом формулы РР-3 (ВВ-7), полученным, как показано на Схеме BB, и одним эквивалентом эфирата трехфтористого бора и выделяют соединение формулы РР-4 (HH-8).
СХЕМЫ QQ-WW
Диастереомер формулы QQ-3 (ll-4) получают в соответствии со Схемой QQ по методикам, аналогичным приведенным для получения диастереомерных продуктов по Схеме PP. Аналогично стереомеры формулы RR-4 (JJ-8), SS-3 (КК-4), ТТ-4 (LL-8), UU-3 (ММ-4), VV-4 (NN-8) и WW-3 (OO-4) получают в соответствии со Схемами RR, SS, TT, UU, VV и WW соответственно по методикам, аналогичным описанным для Схемы PP.
СХЕМА XX
Соединение формулы ХХ-6 (HH-9) получают, как описано на Схеме XX. Соединение формулы ХХ-1 (HH-2), полученное в соответствии со Схемой HH, нагревают без растворителя в выпускаемом промышленностью трис-(диметиламино) метане, бис-(диметиламино) -метоксиметане или трет-бутокси-бис(диметиламино)-метане и получают промежуточное соединение формулы XX-2. К раствору полученного сложного эфира в тетрагидрофуране добавляют при низкой температуре один эквивалент трет-бутиллития и получают промежуточное анионное производное, которое обрабатывают эпоксидом формулы ХХ-3 (ВВ-7), полученным, как описано на Схеме BB, и одним эквивалентом эфирата трехфтористого бора и выделяют соединение формулы ХХ-4. Промежуточное соединение формулы ХХ-4 циклизуют ih situ в производное дигидропирона ХХ-5 или же ХХ-4 выделяют и циклизуют обработкой трет-бутоксидом калия или гидридом натрия в тетрагидрофуране. Аналогично промежуточное соединение формулы ХХ-5 гидролизуют in situ с образованием соединения формулы ХХ-6 (HH-9) или же выделяют и превращают в дигидропирон формулы ХХ-6 (HH-9) обработкой водным раствором кислоты или водным раствором основания.
СХЕМЫ YY-ЕЕЕ
Диастереомер формулы YY-5 (II-5) получают в соответствии со Схемой YY по методикам, аналогичным приведенным для получения диастереомерного продукта по Схеме XX. Аналогично стереомеры формул ZZ-6 (JJ-9), AAA-5 (КК-5), ВВВ-6 (LL-9), ССС-5 (ММ-5), DDD-6 (NN-9) и ЕЕЕ-5 (OO-5) получают в соответствии со Схемами ZZ, AAA, BBB, CCC, DDD и EEE соответственно по методикам, аналогичным описанным для Схемы XX.
СХЕМА FFF
Диастереомеры формулы FFF-5 и FFF-7 получают также разделением диастереомерного промежуточного соединения. Смесь диастереомеров формулы FFF-1 (W-11), полученную в соответствии со Схемой W, разделяют на отдельные диастереомеры формулы FFF-2 (менее полярный диастереомер) и FFF-3 (более полярный диастереомер), используя препаративную хиральную жидкостную хроматографию высокого разрешения. Бензильные защитные группы в соединениях FFF-2 и FFF-3 затем удаляют каталитическим гидрированием, используя 10%-ный палладий на угле в этилацетате, и получают амины формулы FFF-4 и FFF-6 соответственно. Промежуточно полученные амины затем превращают в целевые сульфонамиды формулы FFF-5 (HH-11) и FFF-7 (II-7) соответственно обработкой 5-цианопиридин-2-сульфохлоридом, который синтезируют по методикам, приведенным на Схеме О, и пиридином в дихлорметане.
СХЕМА GGG
Хлорангидрид м-нитрокоричной кислоты (получают обработкой промышленной выпускаемой кислоты хлористым оксалилом) формулы GGG-1 добавляют к раствору дитиооксазолидона формулы GGG-2 (легко синтезируют из выпускаемого промышленностью (R)-(+)-4-бензил-2-оксазолидинона действием н-бутиллития) в эфире и получают соединение формулы GGG-3. Соединение формулы GGG-3 обрабатывают либо раствором SnCl2•2H2О в этаноле, либо порошком железа в смеси этанол/вода, содержащем хлорид аммония, и проводят восстановление нитро-группы, получая соответствующую амино-группу в соединении формулы GGG-4. Соединение формулы GGG-4 обрабатывают избытком бромистого бензила в присутствии карбоната калия или натрия в органическом растворителе (добавляют также смесь хлористого метилена и воды) и выделяют соединение формулы GGG-5. Раствор соединения формулы GGG-5 в тетрагидрофуране добавляют к смеси тетрагидрофуран/диметилсульфид, содержащей купратный реагент, приготовленный из этилмагнийбромида и комплекса бромид меди (1) - диметилсульфид, и получают соединение формулы GGG-6. Соединение формулы GGG-6 обрабатывают хлоридом титана (IV), а затем третичным амином и 2-метил-2-метокси-1,3-диоксоланом формулы GGG-7 и получают соединение формулы GGG-8. Обработкой соединения формулы GGG-8 перхлорной кислотой получают соединение формулы GGG-9. Иначе соединение формулы GGG-6 обрабатывают сильным основанием, таким как ди-изо-пропиламид лития в эфирном растворителе при температуре ниже комнатной и добавляют раствор хлористого ацетила (также в эфирном растворе, охлажденном до температуры ниже комнатной) и получают соединение формулы GGG-9. Соединение формулы GGG-9 обрабатывают хлоридом титана (IV) в хлористом метилене с последующим добавлением третичного амина и либо 4-гептанона, либо 1-фенил-3-гексанона и выделяют соединение формулы GGG-10. Соединение формулы GGG-10 затем обрабатывают либо гидридом натрия, либо трет-бутоксидом калия в эфирном растворителе и получают соединение формулы GGG-11. Соединение формулы GGG-11 далее гидрируют, получая соединение формулы GGG-12. Затем соединение формулы GGG-12 превращают в конечное целевое соединение обработкой сульфохлоридом формулы D-7, который получают в соответствии со Схемой D, где R4, в частности, обозначает 5-трифторметил-2-пиридинил, в органическом растворителе, таком как хлористый метилен, в присутствии органического основания, такого как пиридин, выделяя конечное соединение формулы CGG-13, где R1, в частности, обозначает н-пропил или фенэтил.
Иначе добавлением соединения формулы GGG-5 к раствору диметилсульфида в тетрагидрофуране, содержащем смесь трет-бутилмагнийхлорида и комплекс бромид меди (1) - диметилсульфид при температуре ниже 0oC, получают смесь соединений формулы GGG-14a и GGG-14b. Оба соединения формулы GGG-14a и GGG-14b превращают в конечные соединения GGG-19 и GGG-20 по методике, изложенной на Схеме GGG для синтеза C-3 этильного производного формулы GGG-13.
СХЕМА HHH
Конечные соединения формулы ННН-13, ННН-19 и ННН-20 получают аналогично методике, приведенной на Схеме GGG, для получения конечных соединений.
СХЕМА III
Выпускаемую промышленно кислоту формулы III-1 превращают в соединение формулы III-2 обработкой хлористым оксалилом. Хлорангидрид формулы III-3 затем конденсируют с литиооксазолидиноном формулы III-3 (легко получают обработкой промышленно выпускаемого (S)-(-)-4-бензил-2-оксазолидинона н-бутиллитием в эфирном растворителе) и получают соединение формулы III-4. Амид формулы III-4 добавляют к раствору промышленно выпускаемого комплекса бромид меди (1) - диметилсульфид и 3-[бис-(триметилсилил)амин]фенилмагнийхлорида в тетрагидрофуране при температуре минус 20oC и получают после кислотной обработки соответствующие соединения формулы III-5a и III-5b. Указанные соединения разделяют хроматографией на силикагеле. Соединение формулы III-5a обрабатывают бромистым бензилом либо в ацетонитриле, либо в смеси хлористый метилен/вода в присутствии либо карбоната калия, либо карбоната натрия и получают соединение формулы III-6. Соединение формулы III-6 обрабатывают хлоридом титана (IV) в хлористом метилене, а затем третичным амином и 2-метил-2-метокси-1,3-диоксоланом формулы III-7 и получают соединение формулы III-8. Обработкой соединения формулы III-8 перхлорной кислотой получают соединение формулы III-9. Соединение формулы III-9 обрабатывают хлоридом титана (IV) в хлористом метилене с последующим добавлением третичного амина и либо 4-гептанона, либо 1-фенил-3-гексано- на и выделяют соединение формулы III-10. Соединение формулы III-10 затем обрабатывают либо гидридом натрия, либо трет-бутоксидом калия в эфирном растворителе и получают соединение формулы III-11. Соединение формулы III-11 далее гидрируют, получая соединение формулы III-12. Наконец, соединение формулы III-12 превращают в конечное целевое соединение обработкой сульфохлоридом формулы D-7, который получают в соответствии со Схемой D, где R4, в частности, обозначает 5-трифторметил-2-пиридинил, в органическом растворителе, таком как хлористый метилен, в присутствии органического основания, такого как пиридин, выделяя конечное соединение формулы III-13, где R1, в частности, обозначает н-пропил или фенэтил.
Аналогично, начав с соединения формулы III-5, получают также конечное соединение формулы III-14.
СХЕМА JJJ
Конечные соединения формулы JJJ-13 и JJJ-14 получают по методике, приведенной на Схеме III.
СХЕМА KKK
Соединение формулы KKK-1 (то же самое, что и JJJ-9) обрабатывают хлоридом титана (IV) в хлористом метилене, а затем добавляют третичный амин. К полученному раствору добавляют промышленно выпускаемый гидроксикоричный альдегид и получают соединение формулы KKK-2. Соединение формулы KKK-2 окисляют (в частности, с помощью комплекса Me2SO•SO3 /пиридин) и получают соединение формулы KKK-3. Соединение формулы KKK-3 обрабатывают пропилмагнийхлоридом (где R1 в частности, обозначает фенил) и получают соединения формулы KKK-4a и ККК-4b. В зависимости от специфических условий реакции соотношение KKK-4a/ККК-4b меняется. Иначе добавлением аллилцинкбромида или аллилсилана в присутствии хлорида титана (IV) или н-Bu4NF (см. Taniguchi et al. Chemistry Letters 2135, 1992) к соединению формулы KKK-3 с последующим гидрированием получают также соединения формулы KKK-4a и KKK-4b. В зависимости от специфических условий реакции соотношение KKK-4a/KКК-4b меняется. Соединение KKK-4a обрабатывают либо гидридом натрия, либо трет-бутоксидом калия и получают соединение формулы ККК-5. После обработки KKK-3 аллилцинкбромидом, аллилсиланом или пропилмагнийхлоридом промежуточный алкоксид металла (где металлом является магний, цинк и титан) может претерпевать спонтанную циклизацию с образованием промежуточного ненасыщенного соединения, которое после гидрирования непосредственно приводит к соединению формулы ККК-5 без выделения KKK-4a. Соединение формулы ККК-5 гидрируют и получают соединение формулы ККК-6. Наконец, обработкой соединения формулы ККК-6 сульфохлоридом формулы D-7, который получают в соответствии со Схемой D, где R4, в частности, обозначает 5-трифторметил-2-пиридинил, в органическом растворителе, таком как хлористый метилен, в присутствии органического основания, такого как пиридин, и выделяют конечное соединение формулы KKK-7a, где R1 и R2, в частности, обозначают фенил или пропил соответственно. Аналогично стадиям, приведенным для превращения соединения формулы KKK-4a в соединение формулы KKK-7a, соединение формулы KKK-4b превращают в соединение формулы KKK-7b.
Аналогично методикам, описанным для превращения соединения формулы KKK-1 в конечные продукты формулы KKK-7a и KKK-7b, получают соединения формулы KKK-14a и KKK-14b, где, в частности, R1 и R2 обозначают соответственно метил или фенэтил, взяв в качестве исходного соединения формулы KKK-8 (или III-6).
Аналогично методикам, описанным для превращения соединения формулы KKK-1 и соединения формулы KKK-8 (каждое из которых содержит вспомогательный 4- бензил-2-оксазолидинон) в конечные продукты формул KKK-7a и KKK-7b и конечные продукты формул KKK-14a и KKK-14b, соответственно, соединения формулы KKK-15 и соединение формулы KKK-19 (каждое из которых содержит вспомогательный 4-бензил-2-оксазолидинон) превращают в конечные продукты формул KKK-7a и KKK-7b и конечные продукты формул KKK-14a и KKK-14b, соответственно, где, в частности, R1 и R2 обозначают соответственно метил или фенэтил.
СХЕМА LLL
Соединение формулы LLL-1 (аналоги: AA-1, где R обозначает фенил; GGG-5, где R обозначает бензил) добавляют к раствору в тетрагидрофуране, содержащем смесь выпускаемого промышленно трет-бутилмагнийхлорида и комплекса бромид меди (1) - диметилсульфид, при температуре ниже 0oC и получают соединение формулы LLL-2 в качестве основного диастереомерного продукта. Соединение формулы LLL-2, где R обозначает бензил, обрабатывают хлоридом титана (IV) в хлористом метилене при температуре ниже 0oC с последующей обработкой третичным амином и 2-метил-2-метокси-1,3-диоксоланом и выделяют соединение формулы LLL-3. Соединение формулы LLL-3 обрабатывают протовой кислотой и получают соединение формулы LLL-4. Соединение формулы LLL-4 обрабатывают хлоридом титана (IV) в хлористом метилене при температуре ниже 0oC и затем аминовым основанием и далее 4-гептаноном или 1-фенил-3-гексаноном и получают соединение формулы LLL-5, где R1, в частности, обозначает н-пропил или фенэтил соответственно. Соединение формулы LLL-5 обрабатывают гидридом натрия или трет-бутоксидом калия в эфирном растворителе и выделяют пирон формулы LLL-6. Гидрированием соединение формулы LLL-6 при использовании, в частности, палладия на угле в качестве катализатора, получают соединение формулы LLL-7. Наконец, соединение формулы LLL-7 вводят во взаимодействие с сульфохлоридом формулы D-7, получение которого приведено на Схеме D, где R4, в частности, обозначает 5-трифторметил-2-пиридинил, в органическом растворителе, таком как хлористый метилен, в присутствии органического основания, такого как пиридин, и получают конечное соединение формулы LLL-8, где R1, в частности, обозначает пропил или фенэтил.
Соединение формулы LLL-2, где R обозначает фенил, обрабатывают хлоридом титана (IV) в метаноле и получают соединение формулы LLL-9. Соединение формулы LLL-9 обрабатывают основанием, стимулируя гидролиз, и получают соединение формулы LLL-10. Кислоту формулы LLL-10 обрабатывают метиллитием в эфирном растворителе и получают соединение формулы LLL-11. Кетон формулы LLL-11 обрабатывают хлоридом титана (IV) в хлористом метилене при температуре ниже 0oC и затем аминовым основанием и далее 4-гептаноном или 1-фенил-3-гексаноном и получают соединение формулы LLL-12, где R1, в частности, обозначает н-пропил или фенэтил, соответственно. Соединение формулы LLL-12 обрабатывают хлоридом титана (IV) в хлористом метилене при температуре ниже 0oC и затем аминовым основанием и далее триметилортоформиатом и получают соединение формулы LLL-13. Соединение формулы LLL-13 в органическом растворителе, таком как тетрагидрофуран или хлористый метилен обрабатывают основанием с последующим добавлением триметилсилилхлорида. Растворитель отгоняют и полученный третичный спирт, содержащий защитную группу, окисляют (например, используя рутений в качестве катализатора в трет-бутиловом спирте: см. Murahashi et al. Chemistry Letters 2237, 1992; тритилперхлоратом в хлористом метилене: см. Mukaiyama et al. , Chemistry Letters 1255, 1985; озон/метилен хлорид: см. Can. J. Chem. 29, 2465, 1971) и получают лактон LLL-6 в одну стадию или в две стадии, где промежуточный эфир превращают в лактон с помощью гидрида натрия, трет-бутоксида калия или H-Bu4NF в эфирном растворителе. Превращение соединения формулы LLL-6 в конечное соединение уже описано ранее.
Аналогично соединения формулы LLL-16 превращают в конечные продукты формулы LLL-23, где R1 обозначает пропил или фенэтил.
СХЕМА MMM
Диастереомеры формулы MMM-5 и MMM-7 также получают разделением диастереомерной смеси двух этих соединений. Иначе диастереомерную смесь формулы MMM-1 (Х-11, где R1, в частности, обозначает фенэтил), полученную, как показано на Схеме X, разделяют на отдельные диастереомеры формулы MMM-2 и MMM-3 на хиральной колонке методом препаративной хроматографии высокого разрешения. Бензильные защитные группы соединения MMM-2 (менее полярный диастереомер) и соединения MMM-3 (более полярный диастереомер) затем удаляют каталитическим гидрированием, используя 10%-ный палладий на угле в этилацетате, и получают амины формулы MMM-4 и MMM-6, соответственно. Промежуточные амины затем превращают в целевые сульфонамидные производные MMM-5 и MMM-7, соответственно, обработкой 5-фторметил-2-пиридинилсульфохлоридом, синтез которого показан на Схеме О, и пиридином в хлористом метилене.
СХЕМА NNN
Выпускаемый промышленно (1R,2S)-(-)-эфедрин формулы NNN-2 обрабатывают триэтиламином и хлорангидридом кислоты формулы NNN-1 (W-2), синтез которого показан на Схеме W, и получают амид формулы NNN-3. Раствор этого амида в трет-бутиловом эфире при 0oC последовательно обрабатывают 1,1 эквивалентами пропилмагнийхлорида и 2,0 эквивалентами 3-[бис-(три-метилсилил)амино]фенилмагнийхлорида, перемешивают в течение трех часов при температуре 0oC, промывают раствором хлорида аммония и упаривают в вакууме, получая соединение формулы NNN-4. Иначе указанную выше реакционную смесь можно промыть не раствором хлорида аммония, a 1N раствором соляной кислоты и получить соединение формулы NNN-4. Амин превращают в производное формулы NNN-5 нагреванием смеси соединения формулы NNN-4, 2,2 эквивалента бромистого бензила и 2,2 эквивалента карбоната калия в ацетонитриле. Промежуточное соединение формулы NNN-5 далее обрабатывают 2 эквивалентами ди-изо-пропиламида лития в тетрагидрофуране с образованием енолята лития, который связывают ацетилхлоридом и получают бета-кетоамид формулы NNN-6. Раствор этого амида в хлористом метилене при низкой температуре можно обработать одним эквивалентом тетрахлорида титана и одним эквивалентом ди-изо-пропилэтиламина, а затем 4-гептаноном и получить соединение формулы NNN-7. Превращение амида формулы NNN-7 в дигидропирон формулы NNN-8 можно осуществить либо с помощью гидрида натрия в тетрагидрофуране, либо водного раствора кислоты. Защитную бензильную группу можно удалить каталитическим гидрированием, используя 10%-ный палладий на угле в этилацетате. Полученный амин формулы NNN-9 превращают в целевое производное сульфонамида NNN-10 (W-12) обработкой 5-фторметилпиридин-2-сульфохлоридом, синтез которого показан на Схеме O, и пиридином в дихлорметане.
СХЕМА OOO
Соединение формулы OOO-7 (NNN-8) можно также получить, как показано на Схеме OOO. Амид формулы OOO-1 (NNN-5) обрабатывают водным раствором кислоты и получают соединение формулы OOO-2. Метиловый эфир формулы OOO-3 получают из соединения формулы OOO-2 из метанола кислотным катализом. Метиловый эфир формулы OOO-3 обрабатывают ди-изо-пропиламидом лития и затем триметилсилилхлоридом и получают соединение формулы OOO-4. Это промежуточное соединение обрабатывают либо 2-метокси-2-метил-1,3-диоксоланом с последующим гидролизом либо ацетилхлоридом и получают бета-кетоэфир формулы OOO-5. Указанный бета-кетоэфир превращают в соединение формулы OOO-6 обработкой либо енолята титана (генерируют с помощью одного эквивалента тетрахлорида титана и одного эквивалента ди-изо-пропиламина в хлористом метилене при низкой температуре), либо литиевого дианиона (генерируют с помощью двух эквивалентов ди-изо-пропиламида лития в тетрагидрофуране при низкой температуре) 4-гептаноном. Дигидропиридон формулы OOO-7 (NNN-8) получают обработкой соединения формулы OOO-6 либо гидридом натрия, либо водным раствором основания.
СХЕМА PPP
Восстановлением выпускаемого промышленностью этилового эфира 4,4,4-трифтормасляной кислоты формулы PPP-1 с помощью DiBal-H с последующим in situ алкилированием с помощью 2-фенэтилмагнийбромида или 2-фенэтилмагнийхлорида получают спирт формулы PPP-2. Окислением спирта по Сверну получают кетон формулы PPP-3. Кетон превращают в дигидропирон формулы РРР-4 алкилированием дианионом метилового эфира ацетоуксусной кислоты с последующим омылением в кислоте и получением лактона под действием основания.
СХЕМА QQQ
По катализируемой трихлоридом алюминия реакции дигидропирона формулы QQQ-1 (РРР-4), получение которого показано на Схеме PPP, с помощью CBZ-защищенного 3-аминобензальдегида (синтезируют взаимодействием бензилхлорформиата с промышленно выпускаемым 3-аминобензальдегидом) формулы QQQ-2 и последующим взаимодействием с триалкилалюминием или реактивом Гриньяра в присутствии комплекса бромид меди (1) - диметилсульфид получают соединения формулы QQQ-3. Индивидуальные стереоизомеры разделяют методом жидкостной хроматографии высокого разрешения, используя хиральную колонку со стационарной фазой и выделяют четыре возможных изомера формулы QQQ-4, QQQ-5, QQQ-6 и QQQ-7. Обменным гидрированием каждого стереоизомера над палладием на угле в присутствии формиата аммония получают амины формулы QQQ-8, QQQ-9, QQQ-10 и QQQ-11. Обработкой аминов сульфохлоридом общей формулы QQQ-12 и пиридином в хлористом метилене получают соединения общей формулы QQQ-13, QQQ-14, QQQ-15 и QQQ-16, где R2, в частности, обозначает 5-циано-2-пиридинил, 1-метил-4-имидазолил или 5-амино-2-пиридинил.
СХЕМА RRR
Способ получения соединений с RRR-11 по RRR-15 показан на Схеме RRR. Пирон RRR-A конденсируют с содержащим Cbz-защитную группу бензальдегидом RRR-B в тетрагидрофуране в присутствии трихлорида алюминия с последующей обработкой полученного промежуточного продукта с помощью R1MgX, где X = Br или Cl, в тетрагидрофуране в присутствии комплекса CuBr•Me2S и получают RRR-1. Удаление защиты из полученного промежуточного соединения осуществляют в метаноле с использованием 10%-ного палладия на угле в присутствии формиата аммония и выделяют RRR-2. Рацемическое соединение RRR-1 расщепляют на его четыре энантиомера и получают соединения с RRR-3 по RRR-6. Удаление защиты из полученных промежуточных соединений осуществляют в метаноле с использованием 10%-ного палладия на угле в присутствии формиата аммония и получают свободные амины с RRR-7 по RRR-10. Обработка аминов с RRR-7 по RRR-10 и RRR-2 соответствующим сульфохлоридом позволяет получить сульфонамиды с RRR-11 по RRR-14 и RRR-15 соответственно.
СХЕМА SSS
Способ получения соединений формулы с SSS-7 по SSS-9 показан на Схеме SSS. Пирон SSS-A конденсируют с содержащим Cbz-защитную группу бензальдегидом SSS-B в тетрагидрофуране в присутствии трихлорида алюминия с последующей обработкой полученного промежуточного продукта с помощью R1MgX, где X = Br или Cl, в тетрагидрофуране в присутствии комплекса CuBr•Me2S и получают SSS-1. Удаление защиты из полученного промежуточного соединения осуществляют в метаноле с использованием 10%-ного палладия на угле в присутствии формиата аммония и выделяют SSS-2. Рацемическое соединение SSS-1 расщепляют на два его энантиомера и получают соединения SSS-3 и SSS-4. Удаление защиты из полученных промежуточных соединений осуществляют в метаноле с использованием 10%-ного палладия на угле в присутствии формиата аммония и получают свободные амины SSS-5 и SSS-6. Обработка аминов соответствующим сульфохлоридом позволяет получить сульфонамиды с SSS-7 по SSS-9.
СХЕМА TTT
Способ получения соединений формулы TTT-6 и TTT-7 показан на Схеме TTT. Пирон TTT-А конденсируют с содержащим Cbz-защитную группу бензальдегидом TTT-В в тетрагидрофуране в присутствии трихлорида алюминия с последующей обработкой полученного промежуточного продукта с помощью R1MgX, где X = Br или Cl, в тетрагидрофуране в присутствии комплекса CuBr•Me2S и получают TTT-1. Рацемическое соединение TTT-1 расщепляют на два его энантиомера и получают соединения TTT-2 и TTT-3. Удаление защиты из полученных промежуточных соединений осуществляют в метаноле с использованием 10%-ного палладия на угле в присутствии формиата аммония и получают свободные амины TTT-4 и TTT-5. Обработкой амина соответствующим сульфохлоридом получают сульфонамиды с TTT-6 по TTT-7.
СХЕМА UUU
Взаимодействием промышленно выпускаемой тиомочевины в горячем этаноле с промышленно выпускаемым 2-хлор-5-нитропиридином формулы UUU-1 получают производное изотиомочевины формулы UUU-2. Обработкой соединения формулы UUU-2 водным раствором карбоната натрия и гидроксида натрия получают производное тиола формулы UUU-3. Соединение формулы UUU-3 окисляют газообразным хлором, получают производное сульфохлорида формулы UUU-4. Обработкой соединения формулы D-5 (в частности, соединения формулы Т-4, где R1 обозначает 2-фенэтил, R2 обозначает пропил, R3 обозначает трет-бутил) в дихлорметане двумя эквивалентами пиридина с последующей обработкой одним эквивалентом соединения формулы UUU-4 получают производное сульфонамида формулы UUU-5 (где R1 обозначает 2-фенэтил, R2 обозначает пропил, R3 обозначает трет-бутил). Восстановлением соединения формулы UUU-5 палладием на угле в присутствии формиата аммония получают соединение формулы UUU-6, которое является соединением 5-амино-N-[3-(1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6-пропил- 2Н-пиран-3-ил] -2,2-диметилпропил)фенил] -2-пиридинсульфонамид (формула UUU-6: R1 обозначает 2-фенэтил, R2 обозначает пропил, R3 обозначает трет-бутил).
СХЕМА VVV
Соединение формулы VVV-1, которое представляет собой 2-меркапто-5-карбамоилпиридин, получают по описанной в литературе методике (J. Chem. Soc. 1948, 1939-1945). Обработкой суспензии этого соединения в разбавленной соляной кислоте газообразным хлором при температуре 0oC получают сульфохлорид формулы VVV-2.
СХЕМА WWW
Амины общей формулы WWW-1 вводят в реакцию с бензиохлорформиатом и получают содержащие защитную группу CBZ производные WWW-2. Индивидуальные стереомеры формулы WWW-2 обычно разделяют методом хиральной жидкостной хроматографии высокого разрешения, а затем вновь превращают в свободные амины WWW-3 путем гидролиза. Сульфирование аминов проводят обычным способом, известным специалистам в данной области техники, и получают конечные продукты формулы WWW-4 в стереохимически чистой форме.
СХЕМА XXX
Дигидропирон ХХХ-1, который получают по методике, аналогичной приведенной в Препаратах 17 и 84, конденсируют с метанитробензальдегидом в присутствии трихлорида алюминия и получают промежуточное бензилиденовое производное формулы XXX-2. Методом присоединительного восстановления двойной связи с использованием цианоборгидрида натрия с последующим восстановлением нитро-группы путем каталитического гидрирования получают амин формулы ХХХ-4, который превращают в сульфонамиды ХХХ-5 обработкой соответствующим сульфохлоридом в дихлорметане и пиридине.
СХЕМА YYY
Дигидропироны формулы YYY-1, где R1 и R2 обозначают пропил или фенэтил, которые синтезируют по методике, приведенной в Препарате 84, конденсируют с альдегидом формулы В-2 в присутствии трихлорида алюминия и получают промежуточное бензилиденовое производное формулы YYY-2. Сопряженным присоединением трет-бутилмагнийхлорида в присутствии комплекса бромид меди (1) - диметилсульфид получают соединение формулы YYY-3. Удаление защиты осуществляют с помощью гидрогенолиза и получают амины формулы YYY-4, которые превращают в сульфонамиды YYY-5 обработкой соответствующим сульфохлоридом в дихлорметане в присутствии пиридина. Эта процедура аналогична приведенной на Схеме D.
СХЕМА ZZZ
Полимерный м-аминобензальдегид защищают с использованием бензилбромида и карбоната калия в ацетонитриле при кипячении и получают соединение формулы ZZZ-2. Винильный анион генерируют из 2-бромвинилтриметилсилана формулы ZZZ-3 обработкой трет-бутиллитием в интервале температур от минус 78oC до минус 20oC. Полученный указанным образом винильный анион охлаждают до минус 78oC и добавляют содержащий две защитные группы м-аминобензальдегид формулы ZZZ-2, получая целевой аллильный спирт формулы ZZZ-3. Спирт легко превращают в ацетат или
карбонат формулы ZZZ-5, используя стандартные реагенты (в частности, хлористый ацетил, пиридин, хлористый метилен, 0oC). Эти соединения участвуют в катализируемых палладием аллильных замещениях, которые приводятся на Схемах AAAA-СССС (C. G. Frost, J. Howarth, J.M.J. Williams, Tetrahedron: Asymmetry (1992) 3: 1089-1122).
СХЕМА AAAA
Натриевая соль метилового эфира ацетоуксусной кислоты формулы AAAA-1, которую генерируют обработкой при 0oC метилового эфира ацетоуксусной кислоты гидридом натрия либо в диметилформамиде, либо в тетрагидрофуране, играет роль нуклеофила в катализируемом палладием аллильном замещении. Если указанную реакцию проводят, используя в качестве источника палладия димер аллилхлорида палладия формулы AAAA-3 и хиральный фосфиновый лиганд (P. von Matt, A. Pfaltz, Angew. Chem. Int. Ed. Engl. (1993) 32: 566-568), то кинетическое расщепление исходного аллилацетата или карбоната приводит к получению оптически обогащенного продукта, содержащего аллильную группу, формулы AAAA-4. Если реакция с нуклеофилом протекает медленно, то ацетат, который генерируется из промежуточно образующегося пи-аллилпалладия, изометируется в два возможных диастереомерных пи-аллильных комплекса, так что может быть осуществлен стереоселективный синтез продуктов, содержащих аллильную группу (В.М. Trost, Р.Е. Strege, J. Am. Chem. Soc., (1977) 99: 1649). Обработкой полученного винилсилана формулы AAAA-4 п-толуолсульфокислотой в ацетонитриле при кипячении получают не содержащий силильную группу олефин формулы AAAA-5. Производное дигидропирона формулы AAAA-7 получают, генерируя дианион бета-кетоэфира в стандартных условиях (J.R. Peterson, T.J. Winger, С.P. Miller, Syn. Commun. (1988) 18(9): 949-963) (гидрид натрия, н-бутиллитий, тетрагидрофуран) и связывая его подходящим симметричным кетоном формулы AAAA-6 (таким как 4-гептанон). Гидролиз сложного эфира (1,0 N раствор едкого натра/тетрагидрофуран) и кислотная обработка реакционной смеси дают производное дигидропирона формулы AAAA-7. В стандартных условиях гидрирования восстанавливают олефин и удаляют группу, которая защищает аминогруппу. Последующая обработка аминопроизводного соответствующим сульфохлоридом формулы AAAA-8 (пиридин, хлористый метилен) приводит к целевому сульфонамидному ингибитору протеазы формулы AAAA-9.
СХЕМА BBBB
В качестве альтернативы катализируемое палладием аллильное замещение может быть осуществлено с натриевым анионом требуемого дигидропирона (J.P. Peterson, T. J. Winger, С. P. Miller, Syn. Commun. (1988) 18(9): 949-963) формулы ВВВВ-1 (дигидропирон, гидрид натрия, тетрагидрофуран или диметилформамид, 0oC) в качестве нуклеофильного партнера. И в этом случае, если в качестве катализатора используют димер аллилхлорида палладия формулы BBBB-3 и хиральный фосфиновый лиганд (P. P. von Matt, A. Pfaltz, Angew. Chem. Int. Ed. Engl. (1993) 32: 566-568), то кинетическое расщепление приводит к получению оптически чистого производного, содержащего аллильную группу, формулы BВВВ-4; а стереоселективный синтез продукта, содержащего аллильную группу, происходит в том случае, если реакция с нуклеофилом протекает медленно по сравнению с изомеризацией двух возможных диастереомерных пи-аллильных комплексов под действием ацетата, негенерируемого из промежуточно образующегося пи-аллилпалладия. Далее, удаление силильной группы (п-толуолсульфокислота, ацетонитрил), восстановление олефина, удаление группы, защищающей амино-группу (водородом на палладием на угле) и сульфонилирование амина (арилсульфохлорид, пиридин, хлористый метилен) формулы ВВВВ-5 приводит к целевому дигидропироновому ингибитору протеазы формулы ВВВВ-6.
СХЕМА CCCC
Обработкой м-бис(бензил)аминобензойной кислоты формулы СССС-1 хлористым оксалилом с образованием хлорингидрида кислоты и взаимодействием с бис (триметилсилил) ацетиленом и хлоридом алюминия в хлористом метилене получают пропаргиловый кетон формулы СССС-2. Асимметрическим восстановлением кетона хиральным бораном (Н.С.Brown, Beeraraghavan Ramachandram,P. Асе. Chem. Res. (1992) 25: 16-24), таким как DIP хлорид [(+)- или (-)-бета-хлордиизопинокамфеилборана] и восстановлением ацетона с помощью PEDAL получают аллиловый спирт формулы CCCC-3 в основном в виде единственного энантиомера. Образование карбоната формулы СССС-4 (метилхлорформиат, пиридин, хлористый метилен 0oC) и катализируемая палладием реакция аллильного замещения с использованием требуемого дигидропирона формулы СССС-5 в качестве неулеофила приводит к получению в основном одного энантиомера дигидропирона, содержащего аллильную группу, формулы СССС-6 (сохранение конфигурации) (Т. Hayashi, Т. Hagihara, М. Konishi, M.J. Kumada, J. Am. Chem. Soc., (1983) 105: 7768-7770). Полученный продукт превращают в целевой ингибитор протеазы формулы CCCC-7, как это ранее описано для Схемы BBBB.
СХЕМА DDDD
Известные циклопираноны формулы DDDD -1 получают ацилированием эфира триметилсилиленола соответствующего циклоалкилкетона с помощью малонилдихлорида, как это описано в R. Effenberger, Т. Ziegler, К.-Н. Schonwalder, Т. Kesmarszky, B. Bauer, Chem. Ber., 119: 3394-3404 (1986). Каталитическим гидрированием циклоалкилпиранона формулы DDDD-1 оксидом платины в уксусной кислоте получают циклоалкилдигидропирон формулы DDDD-2. Конденсацией соединения формулы DDDD-2 с выпускаемым промышленно 3-нитробензальдегидом, катализируемой трихлоридом алюминия, получают промежуточное соединение DDDD-3. Последующей реакцией промежуточного соединения DDDD-3 с триалкилалюминием в присутствии комплекса бромид меди (1) -диметилсульфид или цинкового реагента, генерируемого из металлического цинка, алкилгалогенида, цианида меди (1) и хлорида лития, получают соединение формулы DDDD-4, который содержит C- 3α разветвленный заместитель. Каталитическим гидрированием соединения формулы DDDD-4 над палладием на угле в этаноле получают производное амина формулы DDDD-5. Обработкой соединения формулы DDDD-5 сульфохлоридом формулы DDDD-6 и пиридином в хлористом метилене получают соединения формулы DDDD-7 (в частности, n равно 1, 2 или 3; R1 этил или трет-бутил; R2 обозначает 4-цианофенил или 5-циано-2-пиридил).
Методики, которые применяют для получения соединений по настоящему изобретению, описываются также в Международной заявке PCT/US93/10645, поданной 9 ноября 1993 (WO 94/11361, опубликована 26 мая 1994), и Международной заявке PCT/US94/ 00938, поданной 3 февраля 1994 (WO 94/181888, опубликована 18 августа 1994), которые приводятся здесь для справок.
Для специалиста в данной области техники очевидно, что соединения по настоящему изобретению могут существовать в нескольких диастереомерных формах в зависимости от конфигурации вокруг асимметрического атома углерода. Все эти диастереомерные формы входят в объем притязаний по настоящему изобретению.
Кроме того, дигидропироны по настоящему изобретению могут быть разделены на отдельные стереоизомеры или же получены в виде индивидуальных диастереомеров. Могут быть получены диастереомерные пары, где С-3 α представляет собой гомогенный центр, а С-6 представляет смесь. Все эти энантиомерные и диастереомерные формы входят в объем притязаний по настоящему изобретению.
Соединения по настоящему изобретению формулы I могут существовать в нескольких туатомерных формах, в том числе, в частности, енольных формах, обозначенных формулами I и IA, и кетонной форме формулы IB. (Для формул I, IA и IB пунктирная линия указывает на то, что двойная связь может как присутствовать, так и отсутствовать). Все эти таутомерные формы входят в объем притязаний по настоящему изобретению. Для соединений по настоящему изобретению, которые представляют собой 4-гидроксипиран-2-оны формулы VII, енольная форма является преобладающей. Для соединений по настоящему изобретению, которые представляют собой 5,6-дигидро-4-гидроксипиран-2-оны формулы VI, обычно можно ожидать смесь енольной и кетонной форм.
Соединения по настоящему изобретению формулы II также могут существовать в нескольких таутомерных формах 4-гидроксипиронового кольца, в том числе, в частности, енольных формах, изображенных формулами II и IIA, и, в частности, кетонных формах, изображенных формулами IIB, и их смеси. Все эти таутомерные формы входят в объем притязаний по настоящему изобретению.
Соединения по настоящему изобретению могут быть как в свободной форме, так и в форме, когда одна или несколько оставшихся (ранее не защищенных) амино-групп, гидроксильных групп или других реакционноспособных групп имеют защиту. В качестве защитных групп могут быть использованы любые известные из области техники группы. Примеры защитных групп по атому азота или атому кислорода приводятся в монографиях Т. W. Green, "Protective Groups in Organic Synthesis", Wiley, New York (1981); J.F.W. McOmie, ed. "Protective Groups in Organic Chemistry", Plenum Press (1973); J. Fuhrhop and G. Benzlin, "Organic Synthesis", Verlag Chemie (1983). Среди защитных групп для атома азота можно назвать трет-бутоксикарбонил (BOC), бензилоксикарбонил, ацетил, аллил, фталил, бензил, бензоил, тритил и т.п.
В настоящем изобретении заявляются соединения формулы I и II или их фармакологически приемлемые соли и/или гидраты. Фармакологически приемлемые соли относятся к таким солям, хорошо известным специалистам в области фармацевтической химии, которые эквивалентны соединениям, из которых они получены, по своим свойствам, таким как состав, стабильность, переносимость пациентом и биодоступность. Примерами соединений формулы I являются кислотные соли, такие как соли с натрием, калием, лизином, аргинином или кальцием, и основные соли, такие как гидрохлориды, в которых заместитель R в формуле I содержит фрагмент основания. Примеры солей соединений формулы II включают гидрогалогеновые соли, такие как гидрохлориды и гидроиодиды; и соли натрия, калия, кальция, лизина и аргинина. Кроме того, в качестве солей соединений формулы I и II по настоящему изобретению включаются бис-соли, такие как бис-аргининовые, бис-лизиновые, бис-натриевые, бис-калиевые и бис-кальциевые соли, при условии, что соединение содержит, например, группы -NHSO2-, -SO3H, -CONH, -OH или -COOH. Наиболее предпочтительными являются бис-натриевые соли.
Соединения по настоящему изобретению полезны для лечения пациентов, инфицированных вирусом иммунодефицита человека (ВИЧ), который вызывает синдром приобретенного иммунодефицита (СПИД) и родственные заболевания. С этой целью указанные соединения могут назначаться орально, через нос, через кожу, подкожно и парентерально (в том числе внутримышечно и внутривенно) с дозами от 0,1 мг до 100 мг на килограмм веса тела в день.
Специалисты в данной области техники знают, как составлять композиции из соединений по настоящему изобретению в виде соответствующих фармацевтических дозировочных форм. Примеры дозировочных форм включают такие оральные композиции, как таблетки или капсулы, или такие парентеральные композиции, как стерильные растворы.
Если соединения по настоящему изобретению назначают орально, то эффективное количество составляет приблизительно от 0,1 мг до 100 мг на килограмм веса тела в день. Композиция для орального назначения могут быть приготовлены как в виде твердых, так и в виде жидких дозировочных форм. Твердые композиции, такие как спрессованные таблетки, получают, смешивая соединения по настоящему изобретению с обычными ингредиентами, такими как тальк, стеарат магния, дикальцийфосфат, алюмосиликат магния, сульфат кальция, крахмал, лактоза, камедь, метилцеллюлоза или функционально аналогичные фармацевтические разбавители или носители. Капсулы получают, смешивая соединения по настоящему изобретению с инертным фармацевтическим разбавителем и помещая смесь в твердую капсулу соответствующего размера из желатина. Мягкие капсулы из желатина получают, помещая суспензию или раствор соединения по настоящему изобретению в приемлемом инертном масле, таком как растительное масло или светлый жидкий вазелин, в капсулу с помощью специальной машины.
Фармацевтически приемлемые композиции из динатриевых солей соединений по настоящему изобретению включают: мягкие эластичные капсулы, содержащие суспензию соли; таблетки; шарики из сахарозы, покрытые раствором соли с помощью распыления; или матрицы энтеросолюбильных и неэнтеросолюбильных полимеров, содержащие высушенный раствор соли, который наносят методом распыления.
Композиции из соединений по настоящему изобретению, в которых соединения по настоящему изобретению присутствуют в виде свободных кислотных форм, предпочтительно содержат свободную кислоту в некристаллической форме. Примеры подобных композиций включают: мягкие эластичные капсулы, содержащие раствор свободной кислоты; некристаллические матрицы энтеросолюбильных и неэнтеросолюбильных полимеров, содержащие высушенный раствор соли, который наносят методом распыления; или твердые некристаллические матрицы свободных кислот в полиэтиленгликоле или в Gelucire 44/14 ("Gattefosse", Сен-Прист, Франция).
Сиропы готовят, растворяя соединения по настоящему изобретению в водном носителе и добавляя сахар, ароматическую отдушку и консерванты. Эликсиры готовят с помощью водно-спиртовых носителей, таких как этанол, подходящих подслащивателей, таких как сахар, или сахарин, и ароматической отдушки. Суспензии готовят с помощью водного носителя и суспендирующего средства, такого как камедь, трагант или метилцеллюлоза.
Если соединения по настоящему изобретению назначают парентерально, то они могут вводиться в виде инъекции или внутривенным вливанием. Эффективное количество составляет приблизительно от 0,1 мг до 100 мг на килограмм веса тела. Парентеральные растворы готовят, растворяя соединения по настоящему изобретению в жидком носителе и проводя стерилизацию фильтрованием, а затем помещают в подходящие закрытые пузырьки или ампулы. Парентеральные суспензии готовят практически аналогичным образом, за исключением того, что используют стерильный носитель для суспензии и соединения по настоящему изобретению стерилизуют перед суспендированием в носителе с помощью оксида этилена или другого подходящего газа.
Конкретный путь назначения, доза или частота назначения легко могут быть определены специалистом в данной области техники и зависят от возраста, веса, общего физического состояния и других клинических симптомов, специфичных для пациента, лечение которого проводят.
Пациентами, которые подвергаются лечению, являются следующие индивидуумы: 1) пациенты, инфицированные одним или несколькими штаммами ретровируса человека, что определяют по присутствию обнаруживаемых количеств либо антител вируса, либо антигенов в сыворотке, и 2) в случае ВИЧ, индивидуумы, у которых проявляются симптомы ВИЧ-инфекции или симптомы инфекции, вызванной СПИДом, такие как i) рассеянный гистоплазмоз, ii) изопросиаз, iii) бронхиальный или легочный кандидоз, в том числе пневмоцистическая пневмония, iv) лимфома, отличная от лимфомы Ходжкина, или v) саркома Капоси, при этом возраст пациента не превышает шестидесяти лет; или индивидуумы, у которых абсолютное значение количества CD4+ лимфоцитов в крови периферической кровяной системы составляет менее 500 на миллилитр. Лечение заключается в постоянном поддержании у пациента ингибирующей концентрации соединения, используемого в соответствии с настоящим изобретением, до тех пор, пока появление следующих симптомов инфекции, вызываемой СПИДом, не покажет необходимость изменения терапии.
Полезность представителей соединений по настоящему изобретению была продемонстрирована при проведении биологических испытаний, которые приводятся далее.
Метод скрининга ВИЧ-протеазы основан на использовании содержащего флюоресцентную метку субстрата, который может быть отделен от не содержащего метку продукта расщепления с помощью специальных шариков, покрытых стрептавидином. Субстрат биотинилируют по N-концевому аргинину и помещают флюоресцентную метку с помощью флюоресцеинизоцианата по C-концевому лизину. Этот анализ используют для обнаружения новых непептидных ингибиторов ВИЧ-1-протеазы. Субстрат (20 мкл 0,2 мкМ раствора), образец (10 мкл требуемой концентрации) и фермент (10 мкл 0,1 мкМ раствора) помещают в планшет из 96 ячеек. Анализ проводят в 0,1 М буфере ацетата натрия в pH 5,5 вместе с 1,0 М раствором хлорида натрия и 0,05% NP-40 и выдерживают в термостате при комнатной температуре в темноте. Добавляют покрытые стрептавидином шарики из полистирола (40 мкл 0,1% вес/об) и планшет выдерживают в темноте в термостате при комнатной температуре еще в течение часа. Продукты расщепления, содержащие метку, отделяют от не прореагировавшего субстрата фильтрованием и прочитывают с помощью ридера фирмы "Idexx". Данные анализируют с использованием соответствующего компьютерного алгоритма и определяют процент ингибирования.
Для определения величин Kj используют те же материалы и оборудование, что и при определении процента ингибирования. Проводят серию последовательных двукратных разбавлений ингибитора, начиная с концентраций 2, 3 или 4, и получают всего 24, 36 и 48 индивидуальных концентраций ингибитора. Указанные разбавления проводят с использованием работизированной системы фирмы "Biomek". Анализ включает 10 мкл 40 нМ раствора ВИЧ-1-протеазы, 10 мкл различных концентраций ингибитора и 20 мкл 200 мкМ раствора субстрата (всего 40 мкл). Дают реакции развиваться при комнатной температуре в течение 90 минут, прерывают ее, добавляя 40 мкл шариков с авидином и подвергают обработке (см. ранее). Ингибитор с известным значением Ki анализируют параллельно, с целью подтверждения достоверности анализа. Данные анализируют с помощью компьютерной программы с использованием нелинейного анализа по методу наименьших квадратов и получают значения Ki.
Процент ингибирования и/или величины Ki для отдельных соединений по настоящему изобретению, изученных методом скрининга ВИЧ-протеазы, приведены далее в Таблице 1.
При проведении вышеописанного анализа по ингибированию фермента чувствительность определения величин Ki частично ограничивается способностью проводить изучение при низких концентрациях фермента для соединений с большой аффинностью связывания. Чтобы предотвратить де-димеризацию при низких концентрациях, получают тандемно связанные ферменты, у которых два мономера ковалентно связаны посредством вытянутых аминокислотных остатков. Используя эти ферменты, чувствительность анализа по ингибированию улучшается, поскольку могут быть использованы значительно меньшие концентрации фермента, по сравнению с условиями, которые используют для ферментов дикого типа.
Методика определения величин Kj с использованием тандемной ВИЧ-протеазы: Вследствие большей стабильности (де-димеризация отсутствует) одноцепочечного связанного (тандемного) фермента ВИЧ-протеазы, в которой две мономерные единицы получают методом генной инженерии и связывают полипептидными отростками, в методе определения величин Ki для ингибитора используют очень низкие концентрации фермента (0,2 нМ) и увеличивают время выдерживания в термостате (до 96 часов) при комнатной температуре, с целью увеличения чувствительности измерения величин Ki для очень сильных ингибиторов. Исходные концентрации ингибиторов определяют на основе предварительных результатов скрининга ингибирования фермента, которые позволяют оценить потенциальные способности ингибитора. Затем готовят концентрации ингибитора с помощью устройств Biomek 1000 (фирмы "Beckman") и Quadry 96 (фирмы "Tomtec"). Субстрату (биотинилированному по N-концевому аргинину и с флюоресцентной меткой флюоресцеина по C-концевому лизину), ингибитору и тандемному ферменту дают прореагировать в растворе с pH 5,5 (буферный раствор, аналогичный используемому с нативным димерным ферментом) в темноте в течение 96 часов. Для прекращения реакции добавляют шарики из полистирола, покрытые стрептавидином. Продукты расшепления, содержащие метку, отделяют от непрореагировавшего субстрата фильтрованием. Остаточную флюоресценцию оценивают количественно с помощью ридера Idexx SM 2000 (фирмы "Idexx") и полученные данные анализируют с помощью программы NLLSF.
Процент ингибирования и/или величины Ki для отдельных соединений по настоящему изобретению, изученных методом скрининга ВИЧ-протеазы и/или методом анализа тандемной ВИЧ-протеазы, приведены далее в Таблице II.
Несколько соединений по настоящему изобретению, такие как N-[3-(1-[5,6-дигидро-4- гидрокси-2-оксо-6-(2-фенэтил)-6-пропил-2Н-пиран-3-ил]-2,2-диметилпропил) фенил] -1-метил-1Н-имидазол-4-сульфонамид, были испытаны в известных клеточных линиях человека, таких как линия Т-клеток человека, в частности, MT4 и H9, которые инфицируют с помощью ВИЧ-1ШВ, и некоторые из указанных соединений далее испытывают в моноядерных клетках периферийной кровяной системы, инфицированных с помощью ВИЧ-1 (изолят, полученный в клинических условиях). Было обнаружено, что соединения ингибируют репликацию ретровируса.
Предпочтительными являются следующие соединения по настоящему изобретению:
5-циано-N-[3-(1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6-пропил -2H-пиран-3-ил]-2,2-диметилпропил)фенил]-2-пиридинсульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6-фенэтил-6-пропил-2H- пиран-3-ил)пропил}фенил]-5-цианопиридин-2-сульфонамид;
N-[3-(1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6-пропил-2H- пиран-3-ил]-2,2-диметилпропил)фенил]-метил-1H-имидазол-4- сульфонамид;
N-[3-(1-(4-гидрокси-2-оксо-6-фенэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил) пропил]фенил]-1-метил-1H-имидазол-4-сульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6-(2-(4-фторфенил)этил) -6-пропил-2H-пиран-3-ил)-2,2-диметилпропил}фенил]-5-цианопиридин-2- сульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6-(2-(4-фторфенил)этил)-6- пропил-2H-пиран-3-ил)пропил}фенил]-5-цианопиридин-2-сульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6-(2-(4-фторфенил)этил)-6- пропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -1-метил-1H-имидазол-4- сульфонамид;
N- [3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6,6-дипропил-2H-пиран- 3-ил)-2,2-диметилпропил}фенил]-5-цианопиридин-2-сульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6,6-дипропил-2H-пиран- 3-ил)пропил}фeнил]-5-циaнoпиpидин-2-cульфoнaмид;-
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6,6-дипропил- 2H-пиран-3-ил)-2,2-димeтилпpoпил}фенил]-1-метил-1H-имидазол-4-сульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2- оксо-6,6-бис(2-(4-фторфенил)этил)-2H-пиран-3-ил)-2,2-диметилпропил}фенил]-5-цианопиридин-2-сульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис(2-(4-фторфенил)этил)- 2H-пиран-3-ил)пропил}фенил]-5-цианопиридин-2-сульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис(2-(4-фторфенил) этил)-2H-пиран-3-ил)-2,2-диметилпропил}фенил]-метил-1H- имидазол-4-сульфонамид;
N-[3-(1-[6,6-бис-(2-циклопропилэтил)-5,6-дигидро-4-гидрокси-2-оксо-2H-пиран-3-ил]-2,2- диметилпропил)фенил]-5-циано-2-пиридинсульфонамид;
N-[3-(1-[6,6-бис-(2-циклопропилэтил)-5,6-дигидро-4-гидрокси-2-оксо- 2H-пиран-3-ил]пропил)фенил]-5-циано-2-пиридин-сульфонамид;
N-[3-(1-[6,6-бис-(2-циклопропилэтил)-5,6-дигидро-4- гидрокси-2-оксо-2H-пиран-3-ил]-2,2-диметилпропил)фенил]-1-метил- 1H-имидазол-4-сульфонамид;
5-циано-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил) -6(R или S)-(3,3,3-трифторпропил)-2H-пиран-3-ил] -2,2-диметилпропил]фенил] -2-пиридинсульфонамид;
N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6(R или S)- (2-фенэтил)-6-(3,3,3-трифторпропил)-2H-пиран-3-ил] -2,2- диметилпропил]фенил]-1-метил-1H-имидaзoл-4-cульфoнaмид;
5-амино-N-(R или S)-[1-[-5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6- (R или S)-(3,3,3-трифторпропил)-2H-пиран-3-ил[-2,2-диметилпропил]фенил]-2- пиридинсульфонамид;
N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо- 6-(2-фенэтил)-[6(R или S)-пропил]-2H-пиран-3-ил]-2,2- диметил-пропил]фенил]-2-пиридинсульфонамид;
5-тpифтopмeтил-N-[3-[1-[4-гидpoкcи-2-oкco-6,6-ди-н-пропил- 5,6-дигидро-2H-пиран-3-ил]пропил]фенил]-2-пиридинсульфонамид;
5-тpифтopмeтил-N-[3(R или S)-[1-[4-гидpoкcи-2-oкco-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] пропил]фенил]-2-пиридин-сульфонамид или (3R или S)-N-[3-[1- (5,6-дигидро-4-гидрокси-2-оксо-6,6-ди-пропил-2H-пиран-3-ил)пропил]-фенил] -5-(трифторметил)-2-пиридинсульфонамид;
5-трифторметил-N-[3(R или S)-[1-[4-гидpoкcи-2-oкco-6,6-ди-фенэтил-5,6-дигидро-2H-пиран-3- ил]пропил]фенил]-2-пиридин-сульфонамид;
5-трифторметил-N-[3-[1-[5,6-дигидро-4-гидрокси-2-оксо-6- (2-фенэтил)-6-н-пропил-2H-пиран-3-ил]-2,2-диметилпропил]-фенил]-2- пиридинсульфонамид;
5-трифторметил-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6 (R или S)-(2-фенэтил)-6(R или S)-н-пропил-2H-пиран-3-ил]-2,2-диметилпропил]фенил] -2- пиридинсульфонамид;
5-тpифтopмeтил-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6 (R или S)-(2-фенэтил)-6(R или S)-н-пропил-2H-пиран-3-ил] пропил]фенил]-2-пиридинсульфонамид или (3R или S, 6R или S)-N-[3-1-(5,6-дигидpo-4-гидpoкcи-2-oксо-6-пропил-6-фенэтил-2H-пиран-3-ил) пропил] фенил] -5-(трифторметил)-2-пиридинсульфонамид;
5-амино-N-[3-(1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенилэтил) -6-пропил-2H-пиран-3-ил]-2,2-диметилпропил)фенил]-2-пиридинсульфонамид;
5-циано-N-[3(R или S)-(1-[5,6-дигидро-4-гидрокси-2-оксо-6(R или S)-(2-фенилэтил)-6-пропил-2H-пиран-3-ил] -2,2-диметилпропил) фенил] -2-пиридинсульфонамид;
5-циaнo-N-[3-(1-[5,6-дигидро-6,6-диизобутил-4-гидрокси-2-оксо-2H-пиран-3- ил]-2,2-диметилпропил)фенил]-2-пиридинсульфонамид;
N-[3 (R или S)-[1-(5,6-дигидро-4-гидрокси-2-оксо-6(R или S)-[2-фeнилэтил] -6-пpoпил-2H-пиpaн-3-ил)-2,2-димeтил-пропил]фенил]-1-метил- 1H-имидазол-4-сульфонамид; 6-циано-N-[3-(1-[5,6-дигидро-4-гидрокси-2-оксо- 6-(2-фенилэтил)-6-пропил-2H-пиран-3-ил]циклопропилметил)фенил]-2- пиридинсульфонамид;
5-амино-N-[3(R или S)-(1-[5,6-дигидро-4-гидрокси-2-оксо-6 (R или S)-(2-фенилэтил)-6-пропил-2H-пиран-3-ил]-2,2-диметилпропил) фенил]-2-пиридинсульфонамид;
5-амино-N-[3(R или S)-(1-[5,6-дигидpo-4-гидpoкcи-2-oксо-6- (R или S)-(2-фенилэтил)-6-пропил-2H-пиран-3-ил]пропил)-фенил-2- пиридинсульфонамид;
5-амино-N-[3(R или S)-(1-[6(R или S)-(2-[4-фтopфeнилэтил] -5,6-дигидро-4-гидрокси-2-оксо-6-пропил-2H-пиран-3-ил]-2,2-диметилпропил) фенил]-2-пиридинсульфонамид;
N-[3(R или S)-(1-[5,6-дигидро-6,6-дипропил-4-гидрокси-2-оксо-2H- пиран-3-ил]-2,2-диметилпропил)фенил]-1-метил-1H-имидазол-4-сульфонамид;
5-амино-N-[3(R или S)-(1-[5,6-дигидро-6,6-дипропил-4-гидрокси-2-оксо- 2H-пиран-3-ил]-2,2-диметилпропил)фенил]-2-пиридинсульфонамид;
5-циано-N-[3(R или S)-(1-[5,6-дигидро-6,6-дипропил-4-гидрокси-2-оксо-2H- пиран-3-ил]-2,2-диметилпропил)фенил]-2-пиридинсульфонамид;
N-[3(R или S)-(1-[6,6-биc(2-фeнилэтил)-5,6-дигидpo-4-гидрокси-2-оксо- 2H-пиран-3-ил]пропил)фенил]-1-метил-1H-имидазол-4-сульфонамид;
N-[3(R или S)-(1-[6,6-бис(2-фенилэтил)-5,6-дигидро-4-гидрокси-2-оксо- 2H-пиран-3-ил]-пропил)фенил]-5-циано-2-пиридинсульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис(1-фенилэтил)-2H-пиран -3-ил)-пропил}фенил]-5-цианопиридин-2-сульфонамид;
N-[3-{ 1(R или S)-(4-гидрокси-5,6-дигидро-2-оксо-6(R или S) -фенэтил-6-пропил-2H-пиран-3-ил)-пропил}фенил]-5-цианопиридин-2-сульфонамид;
N-[3-{ 1(R или S)-(4-гидpoкcи-5,6-дигидpo-2-oкco-6(S или R) -фенэтил-6-пропил-2H-пиран-3-ил)-пропил}фенил]-1-метил-1H-имидазол-4- сульфонамид;
N-[3-{ 1-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис (2-фенилэтил)-2H-пиран-3-ил)-2, 2-диметилпропил}фенил]-1 - метил-1H-имидазол-4-сульфонамид;
N-[3-{ 1 (R или S)-(4-гидрокси-5,6-дигидро-2-оксо-6(R или S)- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -5-цианопиридин-2-сульфонамид;
N-[3-{ 1(R или S)-(4-гидрокси-5,6-дигидро-2-оксо-6(R или S)- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2-диметил-пропил}фенил]-1- метил-1H-имидазол-4-сульфонамид;
N-[3-{ 1(S или R)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис(2-фенилэтил) -2H-пиран-3-ил)-2,2-диметилпропил}фенил]-5-аминопиридин-2-сульфонамид;
N-[3-{ 1(S или R)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис (2-фенилэтил)-2H-пиран-3-ил)-2,2-диметилпропил}фенил]-1-метил-1H-имидазол -4-сульфонамид;
N-[3-{1(S или R)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис(2-фенилэтил)-2H- пиран-3-ил-2,2-диметилпропил}фенил]-5- цианопиридин-2-сульфонамид;
N-[3-{ 1 (R или S)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-дипропил)-2H- пиран-3-ил)пропил}фенил]-5-цианопиридин-2-сульфонамид.
Более предпочтительными являются следующие соединения по настоящему изобретению:
5-циано-N-[3-(1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил) -6-пропил-2H-пиран-3-ил]-2,2-диметилпропил)фенил]-2-пиридинсульфонамид;
5-циaнo-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6- (2-фенэтил)-6(R или S)-(3,3,3-трифторпропил)-2H-пиран-3-ил]- 2,2-диметилпропил]фенил]-2-пиридинсульфонамид;
5-трифторметил-N-[3(R или S)-[1-[4-гидрокси-2-оксо- 6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] пропил] фенил] -2- пиридинсульфонамид или (3R или S)-N-[3-[1-(5,6-дигидро-4- гидрокси-2-оксо-6,6-ди-пропил-2H-пиран-3-ил)-пропил]фенил]-5- (трифторметил)-2-пиридинсульфонамид;
5-трифторметил-N-[3(R или S)-[1-[5,6-дигидро-4- гидрокси-2-оксо-6(R или S)-(2-фeнэтил)-6(R или S)-н-пропил-2H- пиран-3-ил]пропил]фенил]-2-пиридинсульфонамид или (3R или S, 6R или S)-N-[3-[1-(5,6-дигидpo-4-гидpoкcи-2-oкco- 6-пропил-6-фенэтил-2H-пиран-3-ил)пропил] фенил]-5-(трифторметил)-2- пиридинсульфонамид;
5-циано-N-[3(R или S)-(1-[5,6-дигидpo-4-гидpoкcи-2-oкco-6(R или S)-(2-фенилэтил)-6-пропил-2H-пиран-3-ил] -2,2-диметилпропил)фенил] -2- пиридинсульфонамид;
N-[3(R или S)-[1-(5,6-дигидро-4-гидрокси-2-оксо-6(R или S) -[2-фенилэтил] -6-пропил-2H-пиран-3-ил)-2,2-диметилпропил] фенил] -1-метил-1H-имидазол-4-сульфонамид;
N-[3-{ 1(R или S)-(4-гидрокси-5,6-дигидро-2-оксо- 6(S или R)-фенэтил-6-пропил-2H-пиран-3-ил)-пропил}фенил]-5- цианопиридин-2-сульфонамид;
N-[3-{ 1(R или S)-(4-гидрокси-5,6-дигидро-2-оксо-6(R или S)- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -5-цианопиридин-2-сульфонамид;
N-[3-{ 1(R или S)-(4-гидрокси-5,6-дигидро-2-оксо-6(R или S)- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил]-1-метил-1H-имидазол-4-сульфонамид; и
N-[3-{ 1(R или S)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-дипропил) -2H-пиран-3-ил)пропил}фенил]-5-цианопиридин-2-сульфонамид.
Наиболее предпочтительными являются следующие соединения по настоящему изобретению (см. Схему EEE):
N-[3-{ 1(R или S)-(4-гидрокси-5,6-дигидро-2-оксо-6(S или R) -фенэтил-6-пропил-2H- пиран-3-ил)-пропил} фенил] -5-цианопиридин-2-сульфонамид формулы ЕЕЕ-1;
N-[3-{ 1(R или S)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-ди-пропил-2H-пиран-3-ил) -пропил}фенил]-5-цианопиридин-2-сульфонамид формулы ЕЕЕ-2;
N-[3(R или S)-[1-(5,6-дигидpo-4-гидpoкcи-2-oкco-6(R или S) -[2-фенилэтил]-6-пропил-2H-пиран-3-ил)-2,2-диметилпропил]-фенил]-1-метил-1H- имидазол-4-сульфонамид формулы ЕЕЕ-3;
5-тpифтopмeтил-N-[3 (R или S)-[1-[5,6-дигидpo-4-гидpoкси-2-оксо-6(R или S)-(2-фенэтил)-6 (R или S)-н-пропил-2H-пиран-3-ил]пропил]фенил]-2-пиридинсульфонамид формулы ЕЕЕ-4 или (3R или S, 6R или S)-N-[3-[1-(5,6-дигидpo-4-гидpoкcи -2-oкco-6-пропил-6-фенэтил-2H-пиран-3-ил] пропил] фенил] -5-(трифторметил) -2-пиринсульфонамид;
5-трифторметил-N-[3(R или S)-[1-[4-гидрокси-2-оксо-6,6-ди-н-пропил-5,6- дигидро-2H-пиран-3-ил] пропил] фенил]-2-пиридинсульфонамид формулы EEE-5 или (3R или S)-N-[3-[1-(5,6-дигидро-4-гидрокси-2-оксо-6,6-ди- пропил-2H-пиран-3-ил)пропил]фенил]-5-(трифторметил)-2-пиридинсульфонамид.
Наиболее предпочтительными являются также следующие соединения по настоящему изобретению, которые легко могут быть получены с помощью вышеописанных синтетических методов:
(3R)-N-[3-[1-(5,6-дигидро-4-гидрокси-2-оксо-6,6-ди-пропил-2H-пиран-3- ил)пропил]фенил]-5-(трифторфенил)-2-сульфонамид;
(3R)-N-[3-[1-(5,6-дигидро-4-гидрокси-2-оксо-6-пропил-6-фенэтил-2H- пиран-3-ил)пропил]фенил]-5-(трифторфенил)-2-сульфонамид.
Описание предпочтительных способов осуществления изобретения
В Препаратах и Примерах, приведенных ниже, использованы следующие сокращения:
1H-ЯМР обозначает спектр протонного магнитного резонанса (ПМР);
13C-ЯМР обозначает спектр магнитного резонанса на ядрах углерода;
δ обозначает химический сдвиг (в миллионных долях, м.д.) по отношению к TMC;
CBZ обозначает бензилоксикарбонил;
ДМСО обозначает диметилсульфоксид;
EI MS обозначает масс-спектрометрию с возбуждением электронным ударом;
FAB MS обозначает масс-спектрометрию с возбуждением бомбардировкой быстрыми атомами;
HOBT обозначает гидрат 1-гидроксибензотриазола;
M обозначает молярную концентрацию;
мм рт. ст обозначает миллиметры ртутного столба;
N обозначает нормальную концентрацию;
Pd/C обозначает палладий на угле;
Rf обозначает перемещение на хроматограмме по отношению к фронту растворителя;
ТФК обозначает трифторуксусную кислоту;
ТМС обозначает тетраметилсилан;
ТСХ обозначает тонкослойную хроматографию.
Следующие Препараты и Примеры иллюстрируют настоящее изобретение.
Препарат 1. Циклопропил-(3-нитрофенил)метанон (формула A-2). См. Схему A.
В круглодонную трехгорлую колбу емкостью 500 мл, снабженную трубкой для вывода газа и капельной воронкой емкостью 250 мл с отводом для уравнивания давления, помещают циклопропилфенилкетон формулы A-1 (30 мл) и охлаждают до температуры минус 40oC. В капельную воронку помещают азотную кислоту (180 мл) и добавляют ее по каплям к реакционной смеси в течение двух часов. Реакционную смесь перемешивают при температуре минус 40oC еще в течение 3,5 часов, а затем прерывают реакцию, выливая смесь на лед (500 мл). Смесь экстрагируют тремя порциями по 150 мл этилацетата. Органические вытяжки объединяют, промывают двумя порциями по 250 мл насыщенным водным раствором бикарбоната натрия, сушат над сульфатом магния, отфильтровывают и упаривают, получая 41,117 г желтого вещества в оранжевом масле. Перекристаллизовывают из 65 мл метанола и получают 20,664 г целевого продукта в виде кристаллов светло-желтого цвета.
Вещество обладает следующими физическими характеристиками: Спектр ПМР (дейтерохлороформ): δ 8,85, 8,43, 8,33, 7,70, 2,72, 1,36-1,31, 1,20-1,14 м. д.
Препарат 2. Циклопропил-(3-аминофенил)метанон (формула A-3). См. Схему A.
В аппарат Парра емкостью 500 мл помещают 2,1 г 10%-ной платины на угле и раствор целевого продукта Препарата 1 (20,6 г) в 250 мл метанола. Реакционную смесь встряхивают в течение 50 минут под давлением водорода 44 фунт-сила/квадратный дюйм (303,4 кПа), а затем дважды отфильтровывают через целит. Полученный раствор светло-зеленого цвета упаривают и получают 15,744 г целевого продукта в виде масла зеленого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,42, 7,30-7,23, 6,88, 3,83, 2,63, 1,24-1,19, 1,05-0,99 м.д.
Препарат 3. N-[Циклопропилметанон]бензолсульфонамид (формула A-4). См. Схему A.
В круглодонную трехгорлую колбу емкостью 500 мл, снабженную трубкой для подачи азота, помещают целевой продукт Препарата 2 (15,7 г) и 200 мл хлористого метилена. Добавляют бензолсульфохлорид (12 мл) и пиридин (7,8 мл) и реакционную смесь перемешивают при комнатной температуре в течение 45 минут. Для прекращения реакции добавляют 10%-ную уксусную кислоту (200 мл). Органический слой отделяют, сушат над сульфатом магния, отфильтровывают и упаривают, получая 28,638 г твердого вещества оранжевого цвета. Его перекристаллизовывают из 75 мл горячего хлористого метилена и получают целевой продукт (22,264 г) в виде твердого вещества розового цвета с т.пл. 98-101oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,81-7,73, 7,62, 7,55-7,35, 2,60, 1,30- 1,25, 1,10-1,03 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 200,4, 138,8, 137,2, 133,0, 129,5, 129,0, 127,0, 125,1, 124,7, 120,5. 17,3, 12.1 м.д.
ИК спектр (минеральное масло): 3239, 3222, 1653, 1449, 1339, 1259, 1176, 1165, 1093, 939, 687 см-1.
Элементный анализ, найдено: С, 63,70; H, 5,01; N, 4,78.
Масс-спектр (E1): m/e 301, 260, 160, 141, 77.
Масс-спектр высокого разрешения, найдено: 301,0772.
Препарат 4. N-[3-Циклопропилметанол]бензолсульфонамид (формула A-5). См. Схему A.
В круглодонную трехгорлую колбу емкостью 500 мл, снабженную трубкой для подачи азота, помещают целевой продукт Препарата 3 (21,133 г), 200 мл тетрагидрофурана и 100 мл этанола. Колбу охлаждают до 0oC в бане со льдом и небольшими порциями в течение 20 минут добавляют боргидрид натрия (10,6 г). Реакционную смесь перемешивают при комнатной температуре в течение приблизительно 18 часов и вновь охлаждают до температуры 0oC. По каплям добавляют 10%-ную соляную кислоту (100 мл) в течение 45 минут и перемешивают смесь при температуре 0oС еще в течение часа. Реакционную смесь затем экстрагируют тремя порциями по 100 мл хлористым метиленом. Органические вытяжки объединяют, сушат над сульфатом магния, отфильтровывают и упаривают, получая 25,015 г масла бледно-желтого цвета. После колоночной хроматографии, используя 150 г силикагеля (элюируют 50-65%-ным раствором эфира в гексане, а затем 2-5%-ным раствором метанола в хлористом метилене), получают 18,692 г целевого продукта в виде твердого вещества белого цвета с т.пл. 112-114oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,69, 7.42, 7,32, 7,25, 7,12, 7,05-6,96, 3,82, 3,19, 1,03-0,94 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 147,0, 139,7, 137,4, 132,9, 129,3, 128,6, 126,8, 121,8, 118,5, 117,8, 75,0, 19,2 3,1, 2,3 м.д.
ИК спектр (минеральное масло): 3523, 3249, 1449, 732 см-1.
Элементный анализ, найдено: С, 63,41, H, 5,79; N, 4,86.
Масс-спектр (E1): m/e 303, 275, 262, 77.
Масс-спектр высокого разрешения, найдено: 303,0935.
Препарат 5. 4-Гидpoкcи-10-пpoпил-2H-циклooктa[b] пиpaн-2- oн (формула A-7). См. Схему A.
В круглодонную трехгорлую колбу емкостью 250 мл, снабженную трубкой для подачи азота и капельной воронкой емкостью 125 мл с отводом для уравнивания давления, помещают ди-изо-пропиламин (3,6 мл) и 15 мл тетрагидрофурана. В капельную воронку помещают 4- гидрокси-2H-циклоокта[b]пиран-2-он формулы A-6 (2,292 г) и 35 мл тетрагидрофурана. Колбу охлаждают до 0oC в бане со льдом, по каплям в течение 3 минут добавляют н-бутиллитий (16,3 мл, 1,6 М раствора в гексане) и реакционную смесь перемешивают при 0oC еще в течение 15 минут. В течение 15 минут по каплям добавляют раствор 4-гидрокси-2H-циклоокта[b] пиран-2-она в тетрагидрофуране и смесь перемешивают при температуре 0oC еще в течение 35 минут. В один прием добавляют гексаметилфосфорамид (4 мл) и по каплям в течение 2 минут добавляют йодистый пропил (1,3 мл). Дают реакционной смеси нагреться до комнатной температуры и перемешивают в течение приблизительно 18 часов. Добавляют 30 мл 10%-ной соляной кислоты и водный слой отделяют. pH водного слоя снижают с 10 до 2 с помощью концентрированной соляной кислоты и водный слой экстрагируют двумя порциями по 50 мл хлористого метилена. Органические вытяжки объединяют, сушат над сульфатом магния, отфильтровывают и упаривают, получая масло оранжевого цвета, которое выливают в смесь 100 мл 1N раствора гидроксида натрия и 50 мл эфира. pH водного слоя снижают с 14 до 1 с помощью концентрированной соляной кислоты и экстрагируют двумя порциями по 50 мл хлористого метилена. Органические вытяжки объединяют, сушат над сульфатом магния, отфильтровывают и упаривают, получая масло оранжевого цвета, которое разбавляют 100 мл эфира и промывают тремя порциями по 25 мл 10%-ным раствором соляной кислоты. Органическую фазу сушат над сульфатом магния, отфильтровывают и упаривают, получая 1,829 г твердого вещества оранжевого цвета. После колоночной хроматографии, используя 100 г силикагеля (элюируют 0-10%-ным раствором метанола в хлористом метилене) получают 1,358 г твердого вещества светло-оранжевого цвета. После повторной колоночной хроматографии, используя 150 г силикагеля (элюируют 10%-ным раствором эфира и 1%-ным раствором уксусной кислоты в хлористом метилене), получают 0,705 г целевого продукта в виде твердого вещества желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 11,38, 5,68, 3,02-2,93, 2,20, 1,98-1,82, 1,73-1,58, 1,46-1,25, 1,24- 1,08, 0,89 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 172,3, 168,3, 165,3, 114,8, 89,7, 38,6, 36,0, 33,3, 30,1, 27,2, 25,5, 22,9, 21,0, 13,9 м.д.
ИК спектр (минеральное масло): 1679, 1641, 1617, 1492 см-1.
Элементный анализ, найдено: С, 70,90; H, 8,36.
Масс-спектр (E1): m/e 236, 208, 166.
Масс-спектр высокого разрешения, найдено: 236,1414.
Пример 1. N-[3-[циклопропил(5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-10-пропил-2H-циклоокта[b] пиран-3-ил)метил] фенил] бензолсульфонамид (формула A-8). См. Схему A.
В круглодонную трехгорбую колбу емкостью 100 мл, снабженную капельной воронкой емкостью 35 мл с отводом для уравнивания давления, которую заполняют 3 A молекулярными ситами, обратным холодильником и трубкой для ввода азота, помещают целевой продукт Препарата 5 (0,196 г), п-толуолсульфокислоту (0,040 г) и 30 мл хлористого метилена. Добавляют целевой продукт Препарата 4 (0,252 г) и реакционную смесь кипятят с обратным холодильником в течение двух часов, а затем перемешивают при комнатной температуре еще в течение часа. Реакционную смесь затем разбавляют 20 мл хлористого метилена и промывают 60 мл смеси 1:1 насыщенного раствора бикарбоната натрия и насыщенного водного раствора соли, 30 мл воды и 30 мл насыщенного раствора соли. Водные слои объединяют и экстрагируют 30 мл хлористого метилена. Органические вытяжки объединяют, сушат над сульфатом магния, отфильтровывают и упаривают, получая 0,576 г сырого продукта. После колоночной хроматографии, используя 35 г силикагеля (элюируют 20-80%-ным раствором эфира в гексане), получают 0,096 г целевого соединения в виде твердого вещества белого цвета с т.пл. 87-90oC (с разложением).
Масс-спектр (E1): m/e 521, 493, 380, 275, 262, 249, 144, 77.
Масс-спектр высокого разрешения, найдено: 521,2236.
Примеры 2-7
По методикам, аналогичным приведенным выше, дополнительно получают следующие соединения по настоящему изобретению:
2) 4-Циано-N-[3(R или S)-[циклопропил(5,6,7,8,9,10-гексагидро-4-гидрокси-2-оксо-(R или S)-10- пропил-2H-циклоокта [b]пиран-3-ил)метил]фенил] бензолсульфонамид
3) 4-Циано-N-[3(R или S)-[циклопропил(5,6,7,8,9,10-гексагидро- (R или S)-10-циклoпpoпилмeтил-4-гидpoкcи-2-oкco-2H-циклooктa[b] пиpaн-3-ил) метил] фенил]бензолсульфонамид
4) 4-Циaнo-N-[3(R или S)-[циклопропил(5,6,7,8,9,10-гексагидро-(R или S)-10-бензил-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил) метил]фенил]бензолсульфонамид
5) N-[3(R или S)-[циклопропил(5,6,7,8,9,10-гексагидро- 4-гидрокси-2-оксо-(R или S)-10-пpoпил-2H-циклooктa[b]-пиран-3-ил) метил]фенил]-1-метил-1H-имидазол-4-сульфонамид
6) N-[3(R или S)-[циклoпpoпил(5,6,7,8,9,10-гeкcaгидpo-(R или S)-10-циклопропилметил-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил) метил]фенил] -1-метил-1H-имидазол-4-сульфонамид
7) N-[3(R или S)-[циклoпpoпил(5,6,7,8,9,10-гексагидро-(R или S)-10-бeнзил-4-гидpoкcи-2-oкco-2H-циклooктa[b] -пиран-3-ил)метил] фенил]-1-метил-1H-имидазол-4-сульфонамид
Препарат 6. Фенилметиловый эфир (3-бензальдегид)карбаминовой кислоты (формула B-2). См. Схему B.
В колбу, снабженную трубкой для подачи азота, помещают бикарбонат натрия (10,4 г) в 200 мл тетрагидрофурана и 200 мл воды, а затем последовательно добавляют м-аминобензальдегид формулы B-1 (10,0 г) и бензиловый эфир хлормуравьиной кислоты (13,6 мл). Смесь перемешивают при комнатной температуре в течение 40 минут. Добавляют эфир, органический слой отделяют, промывают насыщенным раствором бикарбоната натрия, сушат над сульфатом магния, отфильтровывают и упаривают, получая масло коричневого цвета. После колоночной хроматографии, используя 300 г силикагеля, получают 16,3 г целевого соединения в виде масла светло-желтого цвета. Образец для анализа перекристаллизовывают из смеси этилацетат - гексан.
Вещество обладает следующими физическими характеристиками:
Температура плавления 100-104oC.
Спектр ПМР (дейтерохлороформ): δ 9,98, 7,91, 7,69, 7,59, 7,43-7,35, 6,83, 5,23 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 191,8, 153,0, 138,6, 137,1, 135,6, 129,7, 128,6, 128,4, 128,3, 124,6, 124,2, 119,1, 67,2 м.д.
ИК спектр (минеральное масло): 3269, 2954, 2925, 2868, 2855, 1729, 1682, 1597, 1560, 1465, 1455, 1326, 1294, 1237, 1229, 1170, 1155, 1048, 695 см-1.
Элементный анализ, найдено: С, 70,74; H, 5,14; N, 5,33.
Масс-спектр (E1) m/e 255, 211, 91.
Масс-спектр высокого разрешения, найдено: 255,0900.
Препарат 7. Фенилметиловый эфир [3-(1-гидрокси-3-метилбутил)фенил]карбаминовой кислоты (формула B-3, где R1 обозначает изо-бутил). См. Схему B.
В колбу, снабженную трубкой для подачи азота, помещают целевое соединение Препарата 6 (4,0 г) и 60 мл сухого тетрагидрофурана. Смесь охлаждают до 0oC и добавляют изо-бутилмагнийхлорид (17,2 мл). Дают реакционной смеси нагреться до
комнатной температуры и перемешивают в течение 2 часов. Для прекращения реакции добавляют насыщенный раствор хлорида аммония и выливают в смесь эфира и воды. Органический слой отделяют, промывают водой и упаривают, получая 5,78 г масла желтого цвета. Сырой продукт перекристаллизовывают из смеси этилацетат - гексан и получают 4,13 г целевого соединения в виде кристаллов белого цвета с т.пл. 73-77oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,41-7,33, 7,25, 7,05, 6,74, 5,19, 4,73- 4,65, 1,91, 1,73-1,65, 1,47, 0,93 м.д.
ИК-спектр (вазелиновое масло): 3400, 3249, 3085, 2953, 2925, 2869, 2855, 1697, 1615, 1602, 1563, 1450, 1283, 1245, 1177, 1067, 1017, 798, 773, 740, 696 см-1.
Элементный анализ, найдено: С 72,58; H 7,25; N 4,55.
Масс-спектр (E1): m/e 313, 257, 213, 91.
Препарат 8. Фенилметиловый эфир [3-[1-(5,6,7,8,9,10-гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран- 3-ил)-3-метилбутил] фенил] карбаминовой кислоты (формула B-5, где R1 обозначает изо-бутил). См. Схему B.
В трехгорлую колбу емкостью 200 мл, снабженную насадкой Дина-Старка и трубкой для подачи азота, помещают раствор п-толуолсульфокислоты (0,66 г) в толуоле (100 мл) и кипятят, собирая в ловушке Дина-Старка 20 мл жидкости. Реакционную смесь охлаждают до комнатной температуры и ловушку освобождают. К реакционной смеси добавляют 4-гидрокси-2H-циклооктa[b] пиpaн-2-oн формулы B-4 (2,48 г) и целевой продукт Препарата 7 (4,0 г) и кипятят с обратным холодильником в течение 6,5 часов. Оставляют реакционную смесь на ночь при комнатной температуре и выливают в 350 мл этилацетата, промывают двумя порциями по 25 мл воды, 25 мл насыщенного раствора бикарбоната натрия и 25 мл воды. Органический слой упаривают и получают 7,9 г масла желтого цвета. После колоночной хроматографии, используя 150 г силикагеля (элюируют 10-50%-ным раствором этилацетата в гексане), получают 0,217 г целевого продукта в виде пенообразного вещества беловатого цвета с т.пл. 73-78oC (с разложением).
Спектр ПМР (дейтерохлороформ): δ 7,38-7,25, 7,13, 6,72, 6,01, 5,19, 4,48, 2,58, 2,41, 1,93, 1,74, 1,62-1,33, 0,96 м.д.
Препарат 9. Фенилметиловый эфир (R или S)-[3-[1-(5,6,7,8,9,10- гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)-3-метилбутил]фенил] карбаминовой кислоты (формула B-5,где R1 обозначает изо-бутил). См. Схему B.
Исходный раствор целевого продукта Препарата 8 (32 мг/мл) в 30%-ном изо-пропиловом спирте и 0,1%-ной уксусной кислоте в гексане хроматографируют на колонке 2,0 x 25 см (R,R) Whelk-0,1, используя автоматическую хроматографическую систему и по 2 мл на одну инжекцию. Элюируемое вещество контролируют на длине волны 310 нм при скорости подачи раствора 10 мл/мин и соответствующие фракции после многократных инжекций объединяют и упаривают в вакууме, получая снегообразное вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Время удерживания для целевого соединения составляет 18,8 минут.
Препарат 10. Фенилметиловый эфир (R или S)- [3-[1-(5,6,7,8,9,10-гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3- ил)-3-метилбутил] фенил] карбаминовой кислоты (формула B-5, где R1 обозначает изо-бутил). См. Схему B.
Целевой продукт Препарата 8 разделяют в соответствии с методикой, приведенной выше для Препарата 9.
Вещество обладает следующими физическими характеристиками:
Время удерживания для целевого соединения составляет 22,1 минут.
Препарат 11. (R или S)-3-[1-(3-Аминофенил)-3-метилбутил]- 5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклоокта[b] пиранон (формула B-6, где R1 обозначает изо-бутил). См. Схему B.
В колбу, снабженную трубкой для подачи азота, помещают раствор целевого соединения Препарата 9 (0,637 г) в 6 мл этанола. Добавляют циклогексен (6 мл) и 10%-ный палладий на угле (0,16 г) и реакционную смесь кипятят с обратным холодильником в течение двух часов. Смесь затем отфильтровывают через целит и упаривают, получая 0,205 г целевого соединения в виде пенообразного вещества беловатого цвета с т.пл. 158-162oC.
Масс-спектр (E1): m/e 355, 312, 299, 161, 106.
Масс-спектр высокого разрешения, найдено: 355,2144.
Пример 8. (R или S)-N-[3-1-(5,6,7,8,9,10-Гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)-3- метилбутил]фенил]-1-метил-2H-имидазол-4-сульфонамид (формула B-7, где R1 обозначает изо-бутил, a R2 обозначает 1-метилимидазол). См. Схему B.
В колбу, снабженную трубкой для подачи азота, помещают целевое соединение Препарата 11 (0,095 г), 1-метилимидазол-4-сульфонилхлорид (0,048 г) и 5 мл хлористого метила. Добавляют пиридин (0,53 мл) и реакционную смесь перемешивают при комнатной температуре в течение приблизительно 18 часов. Образуется осадок, который отфильтровывают и получают 0,097 г твердого вещества белого цвета. Перекристаллизовывают из смеси метанол - хлороформ и получают 0,065 г целевого соединения в виде порошка белого цвета с т.пл. 207-210oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 10,4, 10,0, 7,70, 7,11, 7,05, 6,92, 4,21, 3,64, 2,54, 2,16, 1,62, 1,53, 1,43, 1,34, 0,85 м.д.
Масс-спектр (E1): m/e 499, 456, 443, 306, 251, 160, 145.
Масс-спектр высокого разрешения, найдено: 499,2151.
Препарат 12. (R или S)-3-[1-(3-Aминoфeнил)-3-мeтилбутил]- 5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклоокта[b] пиранон (формула B-6, где R1 обозначает изо-бутил). См. Схему B.
В соответствии с общей методикой, приведенной для Препарата 11, и проведя несущественные изменения, заменив, однако, целевой продукт Препарата 9 на целевой продукт Препарата 10, получают 0,189 г целевого соединения в виде твердого вещества серого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): m/e 355, 312, 299, 161.
Масс-спектр высокого разрешения, найдено: 355,2135.
Пример 9. (R или S)-N-[3-1-(5,6,7,8,9,10-Гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)-3- метилбутил]фенил]-1-метил-1H-имидазол-4-сульфонамид (формула B-7, где R1 обозначает изо-бутил, a R2 обозначает 1-метилимидазол). См. Схему B.
В соответствии с общей методикой, приведенной для Примера 8, и проведя несущественные изменения, заменив однако целевой продукт Препарата 11 на целевой продукт Препарата 12, получают 0,047 г целевого соединения в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 10,45, 10,06, 7,70, 7,11, 7,05, 6,94, 4,21, 3,64, 2,55, 2,16, 1,62, 1,53, 1,42, 1,35, 0,86 м.д.
Масс-спектр (E1): m/e 499, 456, 443,354,306,160, 145.
Масс-спектр высокого разрешения, найдено: 499,2146.
Препарат 13. [3-Циклoпpoпил-гидpoкcимeтил)фeнил]-мeтaнoл (формула C-2). См. Схему C.
К раствору 6,5 мл 3-бромбензилового спирта формулы С-1 в 900 мл тетрагидрофурана в атмосфере азота при температуре минус 78oC добавляют 46 мл 1,4 М раствора метиллития в диэтиловом эфире. Раствор перемешивают в течение 25 минут и добавляют 6 мл циклопропанкарбоксальдегида. Раствор перемешивают в течение полутора часов, нагревают до 0oC и перемешивают 40 минут. Затем дают раствору нагреться до комнатной температуры и перемешивают в течение 30 минут. Наконец, раствор кипятят с обратным холодильником в течение часа и выливают в 800 мл воды, подкисляют концентрированной соляной кислотой, а затем 5%-ным раствором соляной кислоты и доводят pH приблизительно до значения 6. Слои разделяют, водную фазу экстрагируют двумя порциями этилацетата. Органические вытяжки объединяют, сушат (над сульфатом натрия), отфильтровывают и упаривают, получая масло желтого цвета, которое хроматографируют, используя 900 г силикагеля 230-400 меш (элюируют смесью 2:1 этилацетат : гексан), получают 6,61 г (68%) целевого продукта в виде масла желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,41-7,26, 4,67, 3,99-3,96, 2,18, 1,28-1,14, 0,68 м.д.
Препарат 14. [3-Циклoпpoпил-[3-[гидpoкcимeтил]фeнил]мeтил]- 5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклоокта[b] пиран-2-он (формула С-3). См. Схему С.
К раствору 501 мг целевого продукта Препарата 13 в 50 мл дихлорметана в присутствии молекулярных сит 3A в атмосфере азота добавляют 492 мг 4-гидрокси-5,6,7,8,9,10-гексагидро-циклоокта[b]пиран-2-она, а затем 49 мг моногидрата п-толуолсульфокислоты. Раствор кипятят с обратным холодильником в течение двух часов, дополнительно добавляют 105 мг моногидрата п-толуолсульфокислоты и нагревают еще в течение часа. Раствор упаривают в вакууме и получают белое пенообразное вещество, которое обрабатывают водой и 1N раствором едкого кали и экстрагируют один раз этилацетатом. Органический слой промывают один раз 1N раствором едкого кали. Водные вытяжки объединяют, подкисляют 5%-ным раствором соляной кислоты и экстрагируют тремя порциями этилацетата. Органические вытяжки объединяют, сушат (над сульфатом натрия) и упаривают в вакууме, получая масло желтого цвета, которое хроматографируют, используя 180 г силикагеля 230-400 меш (элюируют смесью 2:1 этилацетат : гексан), и получают 436 мг целевого бензилового спирта в виде пенообразного вещества белого цвета с т.пл. 65-70oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,25-7,03, 4,36, 3,70-3,67, 2,41-2,37, 2,24- 2,23, 1,53-1,50, 1,35-1,05, 0,54-0,43, 0,42-0,21, 0,07-0,02 м.д.
Препарат 15. 3-[Циклoпpoпил-[3-[бpoммeтил]фeнил]мeтил]- 5,6,7,8,9,10-гексагидро-4-гидрокси-2Н-циклooктa[b] пиpaн-2-oн; и 3-[циклопропил-[3-[хлорметил] фенил]метил]-5,6,7,8,9,10-гексагидро- 4-гидрокси-2H-циклоокта[b] пиран-2-он (формулы С-4, 5). См. Схему С.
К раствору 1,01 г целевого продукта Препарата 14 в 70 мл дихлорметана в атмосфере азота при температуре 0oC последовательно добавляют 2,00 г трифенилфосфина и 2,58 г четырехбромистого углерода. Полученный раствор перемешивают в течение часа и выливают в насыщенный раствор соли. Слои разделяют и водную фазу трижды экстрагируют этилацетатом. Органические вытяжки объединяют, сушат (над сульфатом натрия) и упаривают, получая масло желтого цвета, которое растирают с эфиром. Образовавшееся твердое вещество отфильтровывают, фильтрат упаривают и хроматографируют, используя 180 г силикагеля 230-400 меш (элюируют смесью 1:1 этилацетат : гексан), и получают 374 мг целевого продукта в виде смеси бром- и хлорпроизводного. Твердые вещества, полученные после фильтрования, хроматографируют как указано ранее и дополнительно получают 699 мг целевого продукта в виде смеси бром- и хлорпроизводного.
Вещество обладает следующими физическими характеристиками:
Масс-спектр: m/e 418, 416 (М+ для B), 388, 374, 372, (М+ для C1), 337, 246, 233, 220, 207, 195, 179, 153, 143, 129.
Препарат 16. 3-[Циклoпpoпил[3-[(фeнилтиo)мeтил]фeнил] мeтил]-5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклooктa[b] пиpaн-2-oн (формула С-6). См. Схему С.
К раствору 138 мг целевого продукта Препарата 15 в 5 мл дихлорметана последовательно добавляют 0,04 мл тиофенола и 0,17 мл ди-изо-пропилэтиламина. Раствор кипятят с обратным холодильником в течение часа и оставляют на ночь при комнатной температуре. Раствор выливают в насыщенный раствор соли и добавляют 5%-ный раствор соляной кислоты. Слои разделяют и водную фазу трижды экстрагируют этилацетатом. Органические вытяжки объединяют, сушат (над сульфатом натрия) и упаривают, получая масло желтого цвета, которое хроматографируют, используя 80 г силикагеля 230-400 меш (элюируют смесью 2:1, гексан : этилацетат), и получают 111 мг целевого сульфида в виде пенообразного вещества с т.пл. 137-139oC.
Вещество обладает следующими физическими характеристиками:
Масс-спектр: m/e 446 (М+), 418, 337, 295, 233, 220, 207, 185, 145, 128, 109, 91, 79, 55, 40.
Пример 10. 3-[Циклoпpoпил[3-[(фeнилcульфoнил)мeтил] фeнил] мeтил] -5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклоокта[b] пиран-2-он (формула C-7). См. Схему С.
К раствору 119 мг целевого продукта Препарата 16 в 5 мл тетрагидрофурана и 5 мл метанола при температуре 0oC добавляют раствор 279 мг оксона в 5 мл воды. Раствор перемешивают в течение 2,5 часов, нагревают до комнатной температуры и перемешивают в течение 2 часов. Раствор отфильтровывают, твердые вещества промывают хлороформом. Фильтрат разбавляют водой и слои разделяют. Водную фазу трижды экстрагируют этилацетатом. Органические вытяжки объединяют, сушат (над сульфатом натрия) и упаривают, получая прозрачное масло, которое хроматографируют, используя 80 г силикагеля 230-400 меш (элюируют смесью 1: 1 гексан : этилацетат), и получают 78 мг целевого продукта в виде пенообразного вещества с т.пл. 80-85oC.
Вещество обладает следующими физическими характеристиками:
Масс-спектр: m/e 479 (М+1), 463, 450, 391, 337, 309, 207, 161, 149, 127, 115, 71, 57, 41.
Масс-спектр высокого разрешения, найдено: 479,1885.
Примеры 11-39
По методикам, аналогичным приведенным выше, получают следующие соединения по настоящему изобретению:
11) 3-[Циклoпpoпил[3-[(4-циaнoфeнилcульфoнил)метил] фенил] метил] -5,6,7,8,9,10-гексагидро-4-гидрокси-2H- циклоокта[b]пиран-2-он
Исходный 4-цианобензолтиол получают из 4-цианобензолсульфохлорида в соответствии с общей методикой, приведенной в литературе: A.W. Wagner, Ber. Deutsch. Chem. Ges., 99: 375 (1966).
Вещество обладает следующими физическими характеристиками:
Температура плавления 100-105oC.
Масс-спектр: m/e 504 (М+1), 337, 247, 207, 143.
Масс-спектр высокого разрешения, найдено: 504,1843.
12) 3-[Циклопропил[3-[(4-фторфенилсульфонил)метил] фенил] метил] -5,6,7,8,9,10-гeкcaгидpo-4-гидpoкcи-2H-циклooктa[b]пиран-2-он
Вещество обладает следующими физическими характеристиками:
Температура плавления 95-100oC.
Спектр ПМР (дейтерохлороформ): δ 7,61-7,57, 7,40-7,37, 7,27-7,20, 7,13-7,07, 7,02-6,99, 6,42, 4,30, 3,88-3,85, 2,64-2,61, 2,51-2,47, 1,83-1,40, 1,40-1,27, 0,69-0,58, 0,48-0,43, 0,19-0,14.
13) 3-[Циклoпpoпил[3-[(4-мeтилфeнилcульфoнил) метил] фенил] метил] -5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклоокта[b] пиран-2-он
Вещество обладает следующими физическими характеристиками:
Температура плавления 100-105oC.
Спектр ПМР (дейтерохлороформ): δ 7,37-7,34, 7,25-7,22, 7,17-7,05, 6,86- 6,84, 4,15, 3,60-3,58, 2,52-2,42, 2,42-2,30, 2,28, 1,70-1,14, 0,57-0,32, 0,32-0,20, 0,06-(-)0,16.
14) 3-[Циклопропил[3-[(4-карбоксифенилсульфонил)метил] фенил] метил] - 5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклooктa[b]пиpaн-2-oн
Вещество обладает следующими физическими характеристиками:
Температура плавления 90-95oC.
Масс-спектр: m/e 523 (М+1), 337, 247, 207, 143.
Масс-спектр высокого разрешения, найдено: 523,1785.
15) 3-[Циклопропил[3-[(2-(1-метилимидазоил)сульфонил)метил]фенил]метил] -5,6,7,8,9,10-гексагидро-4-гидрокси-2H- циклоокта[b]пиран-2-он
Вещество обладает следующими физическими характеристиками:
Температура плавления 95-103oC.
Спектр ПМР (дейтерохлороформ): δ 7,36-7,34, 7,29-7,27, 7,14, 7,06-7,03, 6,98 (синглет, 1H), 6,86, 4,30, 3,73-3,70, 3,20, 2,67-2,54, 1,90-1,36, 0,71-0,50, 0,46-0,33, 0,18-0,03.
16) 3-[Циклoпpoпил[3-[(2-пиpимидинилcульфoнил)метил] фенил] метил] -5,6,7,8,9,10-гексагидро-4-гидрокси-2H- циклоокта[b]пиран-он
17) 3-[Циклoпpoпил[3-[(2-пиpидинилcульфoнил)метил] фенил] метил] -5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклооктa[b]пиpaн-2-oн
18) 3-[Циклопропил[3-[(1-метил-4-имидазолилсульфонил)метил]фенил]метил] -5,6,7,8,9,10-гексагидро-4-гидрокси-2H- циклooктa[b]пиpaн-2-oн
19) 3-[Циклoпpoпил[3-[(5-циaнo-2-пиpидинилcульфoнил) метил]фенил]метил] -5,6,6,8,9,10-гексагидро-4-гидрокси-2H-циклоокта[b]пиран -2-он
20) 3-[Циклoпpoпил[3-[(2-бeнзимидaзoлилcульфoнил)метил] фенил]метил] -5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклоокта[b]пиран-2-он
21) 3-[Циклoпpoпил[3-[(2-xинoлинилcульфoнил)мeтил] фeнил] метил] - 5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклоокта[b]пиран-2-он
22) 3-[Циклoпpoпил[3-[(4-циaнoфeнилcульфoнил)метил] фенил] метил] -4 - гидроксикумарин
23) 3-[Циклoпpoпил[3-[(2-пиpидинилcульфoнил)метил] фенил]метил] -4-гидроксикумарин
24) 3-[Циклопропил[3-[(1-мeтил-4-имидaзoлилcульфoнил)метил]фенил]метил] -4-гидроксикумарин
25) 3-[Циклопропил[3-[(5-циaнo-2-пиpидинилcульфoнил)метил] фенил]метил] -4-гидроксикумарин
26) 3-[Циклопропил[3-[(2-бeнзимидaзoлилcульфoнил)метил] фенил]метил] -4-гидроксикумарин
27) 3-[Циклопропил[3-[(2-хинолинилсульфонил)метил] фенил]метил]-4-гидроксикумарин
28) 3-[Циклопропил[3-[(4-циaнoфeнилcульфoнил)метил]фенил]мeтил] -4-гидpoкcи-6-[1-(фенилметил)пропил]-2H-пиран-2-он
29) 3-[Циклопропил[3-[(2-пиpидинилcульфoнил)метил] фенил] метил]-4-гидрокси-6-[1-(фенилметил)пропил]-2H-пиран-2-он
30) 3-[Циклопропил[3-[(1-мeтил-4-имидaзoлилcульфoнил)метил]фенил]метил] -4-гидpoкcи-6-[1-(фенилметил)пропил]- 2H-пиран-2-он
31) 3-[Циклопропил[3-[(5-циано-2-пиридинилсульфонил)метил] фенил]метил] -4-гидрокси-6-[1-(фенилметил)пропил]-2H-пиран-2-он
32) 3-[Циклопропил[3-[(2-бензимидазолилсульфонил) метил]фенил]метил]-4-гидрокси-6-[1-(фенилметил)пропил]-2H- пиран-2-он
33) 3-[Циклопропил[3-[(2-хинолинилсульфонил)метил] фенил]метил] -4-гидpoкcи-6-[1-(фенилметил)пропил]-2H-пиран-2-он
34) 3-[Циклопропил[3-[(4-циaнoфeнилcульфoнил)метил]фенил]метил] -4-гидрокси-6-(2-фенилэтил)-6-(1-пропил)-5,6-дигидро-2H-пиран-2-он
35) 3-[Циклопропил[3-[(2-пиридинилсульфонил)метил] фенил]метил]-4-гидрокси-6-(2-фенилэтил)-6-(1-пропил)-5,6- дигидро-2H-пиран-2-он
36) 3-[Циклопропил[3-[(1-мeтил-4-имидaзoлилcульфoнил)метил] фенил]метил] -4-гидрокси-6-(2-фенилэтил)-6-(1-пропил)-5,6-дигидро-2H- пиран-2-он
37) 3-[Циклопропил[3-[(5-циaнo-2-пиpидинилcульфoнил)метил] фенил]метил] -4-гидрокси-6-(2-фенилэтил)-6-(1-пропил)-5,6-дигидро- 2H-пиран-2-он
38) 3-[Циклопропил[3-[(2-бензимидазолилсульфонил)метил] фенил]метил]-4-гидрокси-6-(2-фенилэтил)-6-(1-пропил)-5,6-дигидро-2H- пиран-2-он
39) 3-[Циклопропил[3-[(2-xинoлинилcульфoнил)метил] фенил]метил]-4-гидрокси-6-(2-фенилэтил)-6 (1-пропил)-5,6- дигидро-2H-пиран-2-он
Препарат 17. 5,6-Дигидро-4-гидрокси-6-фенэтил-6-пропил-2H- пиран-2-он (формула D-1: R1 обозначает фенэтил, R2 обозначает пропил). См. Схему D.
Метиловый эфир ацетоуксусной кислоты (1,47 мл) добавляют к суспензии гидрида натрия (567 мг, 60%-ная дисперсия в минеральном масле) в тетрагидрофуране (30 мл) при температуре 0oC. Через 15 минут по каплям добавляют н-бутиллитий (8,5 мл, 1,6 М раствор в гексане) и полученную смесь перемешивают в течение 15 минут. Затем с помощью шприца быстро добавляют 1-фенил-3-гексанон (2,0 г). Реакционную смесь перемешивают еще в течение часа и выливают в насыщенный раствор хлорида аммония. Экстрагируют этилацетатом, сушат над безводным сульфатом натрия и упаривают в вакууме. Полученное вещество растворяют в тетрагидрофуране (25 мл) и добавляют 0,1N раствор гидроксида натрия. Перемешивают в течение трех часов и один раз экстрагируют смесь этилацетатом. Доводят pH водного слоя до 3 с помощью соляной кислоты и экстрагируют реакционную смесь хлористым метиленом (3 x 25 мл), сушат над безводным сульфатом магния и упаривают, получая целевой продукт в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтерохлороформ): δ 0,96, 1,21, 1,48, 1,72, 1,98, 2,73, 3,43, 7,15-7,32 м.д.
Элементный анализ, найдено: С 73,77; H 7,96.
Препарат 18. 4-Гидpoкcи-3[1-(3-нитpoфeнил)пpoпил]-5,6- дигидро-6-фенэтил-6-пропил-2H-пиран-2-он (формула D-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил). См. Схему D.
К раствору целевого продукта Препарата 17 (формула D-1: R1 обозначает фенэтил, R2 обозначает пропил) (1 г) и 3-нитробензальдегида (формула D-2) (581 мг) в сухом тетрагидрофуране при 0oC в один прием добавляют твердый трихлорид алюминия (1,0 г). Охлаждающую баню убирают, дают полученному желтому раствору нагреться до комнатной температуры и перемешивают при комнатной температуре в течение двух часов. Реакцию прерывают, добавив твердый гексагидрат карбоната натрия (2,2 г), и энергично перемешивают в течение 5 минут. Смесь после разбавления эфиром отфильтровывают через целит и фильтрат упаривают в вакууме досуха. Промежуточный бензилиден формулы D-3 и комплекс бромид меди (1) - диметилсульфид (237 мг) растворяют в сухом тетрагидрофуране и по каплям в течение 5 минут при комнатной температуре добавляют раствор триэтилалюминия (4,23 мл, 1 М в гексане). По окончании реакции, что определяют методом тонкослойной хроматографии, процесс прекращают, добавив воду, и реакционную смесь переносят в разделительную воронку с эфиром. Водный слой отделяют, экстрагируют эфиром (3 x 15 мл), органические вытяжки объединяют, промывают насыщенным раствором соли, сушат (над сульфатом магния), отфильтровывают и упаривают в вакууме, получая масло. Испарительной хроматографией на силикагеле, элюируя смесью гексан/этилацетат (3:1), получают 1,1 г целевого продукта в виде пенообразного вещества светло-желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,93, 1,37, 1,74, 1,82-2,14, 2,29, 2,52-2,71, 4,19, 6,98-7,24, 7,44, 7,72, 8,02, 8,28 м.д.
Препарат 19. 3-[Циклопропил-(3-нитрофенил)метил] -4- гидрокси-5,6-дигидро-6-фенэтил-6-пропил-2H-пиран-2-он (формула D-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает циклопропил). См. Схему D.
К раствору целевого продукта Препарата 17 (формула D-1: R1 обозначает фенэтил, R2 обозначает пропил) (1 г) и 3-нитро-бензальдегида (формула D-2) (581 мг) в сухом тетрагидрофуране при 0oC в один прием добавляют твердый трихлорид алюминия (1,0 г). Охлаждающую баню убирают, дают полученному желтому раствору нагреться до комнатной температуры и перемешивают при комнатной температуре в течение двух часов. Реакцию прерывают, добавив твердый гексагидрат карбоната натрия (2,2 г), и энергично перемешивают в течение 5 минут. Смесь после разбавления эфиром отфильтровывают через целит и фильтрат упаривают в вакууме досуха. Промежуточный бензилиден формулы D-3 и комплекс бромид меди (I) - диметилсульфид (237 мг) растворяют в сухом тетрагидрофуране и охлаждают до минус 78oC. По каплям в течение 10 минут добавляют раствор циклопропилмагнийбромида (15,6 мл; 0,25 М в тетрагидрофуране) и реакционную смесь перемешивают в течение 30 минут. Реакцию прекращают, добавив воду, и нейтрализуют добавлением 1N раствора соляной кислоты. Реакционную смесь переносят в разделительную воронку с эфиром. Водный слой отделяют и экстрагируют эфиром (3 x 15 мл). Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат (над сульфатом магния), отфильтровывают и упаривают в вакууме, получая масло. Испарительной хроматографией на силикагеле, элюируя смесью гексан/этилацетат (3: 1), получают 0,9 г целевого продукта в виде пенообразного вещества светло-желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,25, 0,53, 0,74, 0,94, 1,41, 1,68-2,13, 2,57- 2,72, 3,38, 7,04-7,23, 7,46, 7,82, 8,03, 8,30 м.д.
Препарат 20. 3-[1-(3-Аминофенил)пропил]-4-гидрокси-5,6- дигидро-6-фенэтил-6-пропил-2H-пиран-2-он (формула D-5: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил). См. Схему D.
К раствору целевого продукта Препарата 18 (формула D-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил) (350 мг) в метаноле при комнатной температуре добавляют 10%-ный палладий на угле (35 мг) и формиат аммония (521 мг). Полученную смесь перемешивают в течение двух часов и отфильтровывают через целит с помощью хлористого метилена. Фильтрат упаривают в вакууме и остаток трижды растирают с хлористым метиленом (3 х 10 мл). Органические растворы объединяют и упаривают в вакууме, получая 325 мг целевого соединения в виде пенообразного вещества желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров.
Спектр ПМР (300 МГц, дейтерохлороформ): δ 0,89, 1,40, 1,64-2,07, 2,20, 2,62, 3,94, 6,54, 6,72-7,25 м.д.
Аналогично получают соединения формулы D-5, где R1 обозначает пропил, R2 обозначает пропил, a R3 обозначает этил или трет-бутил.
Соединения формулы D-5, где R1 обозначает пропил, R2 обозначает пропил, a R3 обозначает этил или трет-бутил обладают следующими физическими характеристиками:
Спектр ПМР: δ 0,9, 1,3, 1,5-1,8, 2,0, 2,2, 2,5, 3,9, 4,5, 6,5, 6,8, 7,0 м.д.
TCX, Rf = 0,32 (10%-ный раствор этилацетата в дихлорметане).
Пример 40. 4-Циано-N-[3-[1-(4-гидрокси-2-оксо-6- фенэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил]бензолсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 4-цианофенил). См. Схему D.
К раствору целевого продукта Препарата 20 (формула D-5: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил) (30 мг) и 4-цианобензолсульфохлорида формулы D-7, где R4 обозначает цианофенил (16,1 мг), в хлористом метилене (1 мл) при комнатной температуре добавляют с помощью шприца пиридин (13 мкл). Полученный раствор перемешивают три часа, в течение которых исходный амин полностью вступает в реакцию. Испарительной хроматографией на силикагеле, элюируя 5%-ным раствором этилацетата в хлористом метилене, получают 21 мг целевого продукта в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров.
Спектр ПМР (300 МГц, дейтерохлороформ): δ 0,6-1,1, 1,2-2,2, 2,4-2,7, 3,86-4,01, 6,89-7,45, 7,66-7,92 м.д.
Масс-спектр высокого разрешения, найдено: 559,2267.
Пример 41. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил-6- пpoпил-5,6-дигидро-2H-пиран-3-ил)пропил]фенил]-1-метил-1H- имидазол-4-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 4%-ным раствором метанола в этилацетате, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров и таутомеризмом.
Спектр ПМР (300 МГц, дейтерохлороформ): δ 0,75-0,96, 1,17-1,43, 1,45-2,11, 2,43-2,68, 3,24, 3,64, 3,94, 6,72-7,51 м.д.
Масс-спектр высокого разрешения, найдено: 538,2383.
Пример 42. N-[3-[2-(4-Гидpoкcи-2-oкco-6-фeнэтил-6- пpoпил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -6- хинолинсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает хинолин-8-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил) и 8-хинолинсульфохлорида формулы D-7, где R4 обозначает хинолин-8-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров и таутомеризмом.
Спектр ПМР (300 МГц, дейтерохлороформ): δ 0,66, 0,90, 1,17-1,44, 1,58-2,03, 2,38-2,64, 3,77, 6,68-7,27, 7,35-7,69, 8,02, 8,26, 9,14 м.д.
Масс-спектр высокого разрешения, найдено: 585,2402.
Пример 43. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дипpoпил-5,6- дигидро-2H-пиран-3-ил)пропил] фенил] -8- хинолинсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает зинолин-8-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил) и 8-хинолинсульфохлорида формулы D-7, где R4 обозначает хинолин-8-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров и таутомеризмом.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,67, 0,85, 1,27, 1,54, 2,01, 3,73, 6,78, 6,90, 7,04, 7,57, 8,12, 8,29, 8,38, 9,13 м.д.
Масс-спектр высокого разрешения, найдено: 523,2276.
Элементный анализ, найдено: С 66,09; H 6,60; N 5,13.
Пример 44. N-[3-[1-(4-Гидрокси-2-оксо-6,6-дипропил-5,6- дигидро-2H-пиран-3-ил)пропил] фенил] -1-метил-1H-имидазол-4- сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R1 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 4%-ным раствором метанола в этилацетате, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): δ 0,88, 1,32, 1,64, 1,93, 2,16, 2,56, 3,68, 3,91, 6,87, 7,03, 7,14, 7,53, 7,64 м.д.
Масс-спектр высокого разрешения, найдено: 476,2223.
Пример 45. 4-Фтop-N-[3-[1-(4-гидpoкcи-2-oкco-6,6-дипpoпил-5,6-дигидро-2H-пиран-3-ил) пропил] фенил] бензолсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 4-фторфенил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил) и 4-фторбензолсульфохлорида формулы D-7, где R4 обозначает 4-фторфенил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров и таутомеризмом.
Спектр ПМР (300 МГц, дейтерохлороформ): δ 0,51-1,03, 1,15-1,73, 1,81-2,48, 2,73, 3,91, 6,69, 6,88, 7,09, 7,78 м. д.
Масс-спектр высокого разрешения, найдено: 490,2085.
Пример 46. 4-Циано-N-[3-[1-(4-гидрокси-2-оксо-6,6- дипропил-5,6-дигидро-2H-пиран-3-ил)пропил]фенил] бензолсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 4-цианофенил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил) и 4-цианобензолсульфохлорида формулы D-7, где R4 обозначает 4-цианофенил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров и таутомеризмом.
Спектр ПМР (300 МГц, дейтерохлороформ): δ 0,68- 0,96, 1,15-1,42, 1,44-1,76, 1,83-2,12, 3,18, 3,88, 6,69-7,18, 7,71, 7,85 м.д.
Масс-спектр высокого разрешения, найдено: 497,2126.
Пример 47. N-[3-[1-(4-Гидpoкcи-6,6-ди-изo-бутил-2- oкco-5,6-дигидро-2H-пиран-3-ил)пропил]фенил]-1-метил-1H- имидазол-4-сульфонамид (формула D-6: R1 обозначает изо-бутил, R2 обозначает изо-бутил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает изо-бутил, R2 обозначает изо-бутил, R3 обозначает этил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 4%-ным раствором метанола в этилацетате, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): δ 0,82-0,94, 1,52-1,83, 1,86-2,03, 2,06-2,22, 2,60, 3,68, 3,92, 6,87, 7,03, 7,16, 7,56, 7,65.
Масс-спектр высокого разрешения, найдено: 504, 2531.
Элементный анализ, найдено: С 62,03; H 7,43; N 8,20.
Пример 48. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дипpoпил- 5,6-дигидро-2H-пиран-3-ил)циклопропилметил] фенил] -1-метил-1H- имидазолсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 4%-ным раствором метанола в этилацетате, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): 0,12, 0,43, 0,68, 0,90-0,97, 1,36, 1,71, 2,60, 3,12, 3,67, 6,88, 7,06, 7,24, 7,51, 7,65 м.д.
Масс-спектр высокого разрешения, найдено: 488,2225.
Элементный анализ, найдено: С 61,25; H 6,94; N 8,42.
Пример 49. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дипpoпил-5,6- дигидро-2H-пиран-3-ил)циклопропилметил] фенил] -8-хинолилсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает хинолин-8-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил) и 8-хинолинсульфохлорида формулы D-7, где R4 обозначает хинолин-8-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): δ -0,14, 0,01, 0,35, 0,89, 1,35, 1,63, 2,52, 2,94, 6,79, 6,94, 7,09,7,64, 8,12, 8,28, 8,41, 9,13 м.д.
Масс-спектр высокого разрешения: найдено: 535,2256.
Элементный анализ, найдено: С 67,58; H 6,53; N 5,11.
Пример 50. 4-Циано-N-[3-[1-(4-гидрокси-2-оксо-6,6- дипропил-5,6-дигидро-2H-пиран-3-ил)циклопропилметил] фенил]бензолсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает 4-цианофенил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил) и 4-цианобензолсульфохлорида формулы D-7, где R4 обозначает 4-цианофенил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): δ 0,13, 0,44, 0,62, 0,91, 1,19, 1,67, 2,57, 3,14, 6,80, 7,12, 7,25, 7,83 м.д.
Масс-спектр высокого разрешения, найдено: 509,2096.
Элементный анализ, найдено: С 65,86; H 6,39; N 5,48.
Пример 51. 4-Фтop-N-[3-[1-(4-гидpoкcи-2-oкco-6,6- дипpoпил-5,6-дигидро-2H-пиран-3-ил)циклопропилметил] фенил]бензолсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает 4-фторфенил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил) и 4-фторбензолсульфохлорида формулы D-7, где R4 обозначает 4-фторфенил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): δ 0,11, 0,43, 0,62, 0,92, 1,34, 1,65, 2,57, 3,13, 6,79, 7,03-7,24, 7,75 м.д.
Масс-спектр высокого разрешения, найдено: 502,2063.
Элементный анализ, найдено: С 63,96; H 6,29; N 2,71.
Препарат 21. Расщепление 4-гидpoкcи-3-[1-(3-нитpoфeнил)пропил] -5,6-дигидро-6,6-дипропил-2H-пиран-2-она (формула D-4: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил). См. Схему D.
Раствор целевого продукта Препарата 18 (формула D-4: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил) (30 мг/мл) в 15%-ном растворе изо-пропилового спирта в гексане хроматографируют на колонке 2,0 x 25 см (R,R) Whelk-O 1 (от компании "Regis Technologies, Inc.", Morton Grove, IL 60053), инжектируя по 1 мл с помощью автоматической хроматографической системы. Элюируемое вещество контролируют на длине волны 270 нм и соответствующие фракции после многократных инжекций объединяют и упаривают в вакууме, получая масла медно-коричневого цвета. Фракции после многочисленных инжекций анализируют на колонке 0,46 x 25 см (S,S) Whelk-O 1, используя тот же растворитель со скоростью подачи 1,0 мл/мин. Первый пик из колонки 1,0 см имеет > 99% ее (Rt измеряют в минутах), а последний пик имеет 92% ее (Rt измеряют в минутах). Перед дальнейшим использованием подвергнутые расщеплению вещества очищают испарительной хроматографией на силикагеле, элюируя смесью гексан/этилацетат (3:1). Подвергнутые расщеплению вещества превращают в амины формулы D-5 в соответствии с методиками, приведенными для Препарата 20.
Вещества обладают следующими физическими характеристиками:
Было обнаружено, что ПМР-спектры и ТСХ-параметры подвергнутых расщеплению веществ идентичны соответствующим спектрам и параметрам рацемических веществ.
Пример 52. (R или S)-N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дипpoпил- 5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -8-хинолинсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает хинолин-8-ил). См. Схему D.
Целевое соединение получают из амина Препарата 21 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил) и 8-хинолинсульфохлорида формулы D-7, где R4 обозначает хинолин-8-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
ПМР-спектр и поведение при проведении тонкослойной хроматографии идентичны соответствующему спектру и параметрам рацемической смеси.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,67, 0,85, 1,27, 1,54, 2,01, 3,73, 6,78, 6,90, 7,04, 7,57, 8,12, 8,29, 8,38, 9,13 м.д.
Масс-спектр: m/e (отн. %) 523 (100), 524 (34), 129 (11), 525 (11), 522 (10), 130 (7), 139 (5), 134 (4).
Пример 53. (R или S)-N-[3-[1-(4-Гидpoкcи-2-oкco-6,6- дипpoпил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -1-метил- 1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 21 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 4%-ным раствором метанола в этилацетате, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
ПМР-спектр и поведение при проведении тонкослойной хроматографии идентичны соответствующему спектру и параметрам рацемической смеси.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,88, 1,32, 1,64, 1,93, 2,16, 2,56, 3,68, 3,91, 6,87, 7,03, 7,14, 7,53, 7,64 м.д.
Масс-спектр: m/e (отн. %) 476 (100), 477 (28), 139 (14), 492 (12), 134 (11), 278 (10), 478 (10), 83 (9), 552 (8), 145 (7).
Пример 54. (S или R)-N-[3-[1-(4-Гидpoкcи-2-oкco-6,6- дипpoпил-5,6-дигидро-2H-пиран-3-ил)пропил]фенил]-8-хинолинсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает хинолин-8-ил). См. Схему D.
Целевое соединение получают из амина Препарата 21 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3
обозначает этил) и 8-хинолинсульфохлорида формулы D-7, где R4 обозначает хинолин-8-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
ПМР-спектр и поведение при проведении тонкослойной хроматографии идентичны соответствующему спектру и параметрам рацемической смеси.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,67, 0,85, 1,27, 1,54, 2,01, 3,73, 6,78, 6,90, 7,04, 7,57, 8,12, 8,29, 8,38, 9,13 м.д.
Масс-спектр: m/e (отн. %) 523 (100), 524 (34), 522 (24), 539 (13), 525 (10), 129 (10), 130 (5), 134 (5), 128 (4), 540 (5).
Пример 55. (S или R)-N-[3-[1-(4-Гидрокси-2-оксо-6,6- дипропил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -1-метил- 1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 21 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 4%-ным раствором метанола в этилацетате, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
ПМР-спектр и поведение при проведении тонкослойной хроматографии идентичны соответствующему спектру и параметрам рацемической смеси.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,88, 1,32, 1,64, 1,93, 2,16, 2,56, 3,68, 3,91, 6,87, 7,03, 7,14, 7,53, 7,64 м.д.
Масс-спектр: m/e (отн. %) 476 (100), 477 (28), 139 (19), 490 (15), 498 (14), 83 (12), 478 (9), 55 (9), 145 (9), 134 (7).
Пример 56. (R или S)-N-[3-[1-(4-Гидрокси-2-оксо-6,6- дипропил-5,6-дигидро-2H-пиран-3-ил)циклопропилметил] фенил]-1-метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 21 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 4%-ным раствором метанола в этилацетате, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
ПМР-спектр и поведение при проведении тонкослойной хроматографии идентичны соответствующему спектру и параметрам рацемической смеси.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,12, 0,43, 0,68, 0,90-0,97, 1,36, 1,71, 2,60, 3,12, 3,67, 6,88, 7,06, 7,24, 7,51, 7,65.
Масс-спектр: m/e (отн. %) 488 (100), 489 (30), 139 (18), 145 (14), 490 (10), 55 (10), 83 (9), 564 (7), 146 (7), 510 (7).
Пример 57. (S или R)-N-[3-[1-(4-Гидpoкcи-2-oкco-6,6- дипpoпил-5,6-дигидро-2H-пиран-3-ил)циклопропилметил] фенил]-1-метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 21 (формула D-5: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает циклопропил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 4%-ным раствором метанола в этилацетате, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
ПМР-спектр и поведение при проведении тонкослойной хроматографии идентичны соответствующему спектру и параметрам рацемической смеси.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,12, 0,43, 0,68, 0,90-0,97, 1,36, 1,71, 2,60, 3,12, 3,67, 6,88, 7,06, 7,24, 7,51, 7,65.
Масс-спектр: m/e (отн. %) 488 (100), 489 (29), 139 (18), 145 (16), 83 (10), 55 (10), 490 (10), 510 (8), 146 (8), 144 (7).
Пример 58. 4-Циaнo-N-[3-[1-(4-гидpoкcи-2-oкco-6- фeнэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил)циклопропилметил] фенил] бензолсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает 4-цианофенил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает циклопропил) и 4-фторбензолсульфохлорида формулы D-7, где R4 обозначает 4-цианофенил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): δ 0,11, 0,42, 0,61, 0,95, 1,24, 1,74-2,00, 2,61-2,73, 3,30, 6,83-7,23, 7,71-7,84 м.д.
Масс-спектр высокого разрешения, найдено: 571,2267.
Пример 59. 4-Фтop-N-[3-[1-(4-гидpокcи-2-oкco-6- фeнэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил)циклопропил-метил] фенил] бензолсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает 4-фторфенил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает циклопропил) и 4-фторбензолсульфохлорида формулы D-7, где R4 обозначает 4-фторфенил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,11, 0,43, 0,67, 0,96, 1,41, 1,67-2,13, 2,62, 3,16, 6,84, 7,02-7,31, 7,72 м.д.
Масс-спектр высокого разрешения, найдено: 564,2211.
Пример 60. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил-6-пpoпил-5,6- дигидро-2H-пиран-3-ил)циклопропилметил] фенил]-8-хинолинсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает хинолин-8-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает циклопропил) и 8-хинолинсульфохлорида формулы D-7, где R1 обозначает хинолин-8-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров.
Спектр ПМР (300 МГц, дейтероацетон): δ -0, 13, 0,01, 0,35, 0,93, 1,46, 1,54, 1,58-2,06, 2,56, 2,96, 6,81-7,23, 7,50-7,68, 8,08, 8,24, 8,37, 9,12 м. д.
Масс-спектр высокого разрешения, найдено: 597,2398.
Пример 61. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил-6- пpoпил-5,6-дигидро-2H-пиран-3-ил)циклопропилметил] фенил] - 1-метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает циклопропил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает циклопропил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,13, 0,42, 0,67, 0,95, 1,44, 1,68-2,13, 2,56, 3,17, 6,91, 7,01-7,33, 7,52, 7,63 м.д.
Масс-спектр высокого разрешения, найдено: 550,2370.
Пример 62. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дифeнэтил- 5,6-дигидро-2H-пиран-3-ил)циклопропилметил] фенил] -1-метил-1H- имидазол-4-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает циклопропил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает циклопропил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): δ 0,13, 0,42, 0,68, 1,73, 1,88-2,17, 2,68, 3,19, 3,64, 6,93, 7,02-7,31, 7,52, 7,64 м.д.
Масс-спектр высокого разрешения, найдено: 612,2530.
Пример 63. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дипeнтил-5,6- дигидро-2H-пиран-3-ил)пропил] фенил] -1-метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает пентил, R2 обозначает пентил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пентил, R2 обозначает пентил, R3 обозначает этил) и 1-метилимидазол-4-сульфохлорида формулы D-7, где R4 обозначает 1-метилимидазол-4-ил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): δ 0,87, 1,25, 1,55-1,68, 1,92, 2,13, 2,57, 3,66, 3,93, 6,86, 7,03, 7,16, 7,55, 7,63 м.д.
Пример 64. 4-Циaнo-N-[3-[1-(4-гидpoкcи-2-oкco-6,6- дипeнтил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил]бензолсульфонамид (формула D-6: R1 обозначает пентил, R2 обозначает пентил, R3 обозначает этил, R4 обозначает 4-цианофенил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает пентил, R2 обозначает пентил, R3 обозначает этил) и 4-цианофенилсульфохлорида формулы D-7, где R4 обозначает 4-цианофенил, в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (300 МГц, дейтероацетон): δ 0,86, 1,23, 1,52-1,67, 1,93, 2,14, 2,56, 3,93, 6,80, 7,05, 7,18, 7,80, 7,86 м.д.
Примеры 65-93
Используя общую методику, приведенную в Примере 40, взяв соответствующие исходные соединения, получают следующие соединения по настоящему изобретению.
Пример 65. N-[3-[1(R или S)-(6(R или S)-4-Гидрокси-2- оксо-6-фенэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] - 1-метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Пример 66. N-[3-[1(R или S)-(6(S или R)-4-Гидрокси-2-оксо-6-фенэтил-6- пропил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -1-метил-1H-имидазол-4 -сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Пример 67. N-[3-[1(S или R)-(6(R или S)-4-Гидрокси-2- оксо-6-фенэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -1-метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Пример 68. N-[3-[1-(S или R)-(6(S или R)-4-Гидрокси-2-оксо-6-фенэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -1-метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Пример 69. N-[3-[тpeт-Бутил-(4-гидpoкcи-2-oкco-6- фeнэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил) метил] фенил]-1- метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Пример 70. 4-Циано-N-[3-[трет-бутил-(4-гидрокси-2-оксо-6- фенэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил)метил]фенил]бензолсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 4-цианофенил). См. Схему D.
Пример 71. 4-Фтop-N-[3-[тpeт-бутил-(4-гидpoкcи-2-oкco- 6-фeнэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил)метил] фенил] бензолсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 4-фторфенил). См. Схему D.
Пример 72. N-[3-[трет-Бутил-(4-гидрокси-2-оксо-6-фенэтил- 6-пропил-5,6-дигидро-2H-пиран-3-ил)метил]фенил]-8-хинолинсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 8-хинолинил). См. Схему D.
Пример 73. N-[3-[1-(6-(2-(1-Meтил-1H-имидaзoл-4- cульфoнaмино)этил)-4-гидрокси-2-оксо-6-пропил-5,6-дигидро-2H- пиран-3-ил)пропил]фенил]-1-метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает 2-(1-метилимидазол-4-сульфонамино) этил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил). См. Схему D.
Пример 74. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дифeнэтил- 5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -2-пиридин-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 2-пиридил). См. Схему D.
Пример 75. 4-Циaнo-N-[3-[1-(4-гидpoкcи-2-oкco-6,6-дифeнэтил- 5,6-дигидро-2H-пиран-3-ил)пропил]фенил]-2-пиридинсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 4-циано-2-пиридил). См. Схему D.
Пример 76. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6- дифeнэтил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -2-хинолинсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает хинолин-2-ил). См. Схему D.
Пример 77. 2-Гидрокси-N-[3-[1-(4-гидрокси-2-оксо-6,6- дифенэтил-5,6-дигидро-2H-пиран-3-ил)пропил]фенил] бензолсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 2-гидроксифенил). См. Схему D.
Пример 78. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дифeнэтил- 5,6-дигидро-2H-пиран-3-ил)пропил] фенил]-2-пиримидинсульфонамид (формула D-6: R1 обозначает фенил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 2-пиримидинил). См. Схему D.
Пример 79. N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил- 5,6-дигидро-2H-пиран-3-ил)пропил] фенил]-2-хинозолинсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает хинозолин-2-ил). См. Схему D.
Пример 80. N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил- 5,6-дигидро-2H-пиран-3-ил)пропил] фенил]-7H-пурин-6-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 7H-пурин-6-ил). См. Схему D.
Пример 81. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дифeнэтил- 5,6-дигидро-2H-пиран-3-ил)пропил]фенил]-1H-имидазол-2- сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 1-имидазо-2-ил). См. Схему D.
Пример 82. N-[3-[1-(4-Гидpoкcи-2-oкco-6,6-дифeнэтил- 5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -1H-бензимидазол-2- сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 1H-бензимидазол-2- ил). См. Схему D.
Пример 83. N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил-5,6- дигидро-2H-пиран-3-ил)пропил]фенил]тиазол-4-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает тиазол-2-ил). См. Схему D.
Пример 84. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил-6- пpoпил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -2- пиридинсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 2-пиридил). См. Схему D.
Пример 85. 4-Циано-N-[3-[1-(4-гидрокси-2-оксо-6-фенэтил- 6-пропил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -2-пиридинсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 4-циано-2-пиридил). См. Схему D.
Пример 86. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил- 6-пpoпил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -2- хинолинсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает хинолин-2-ил). См. Схему D.
Пример 87. 2-Гидpoкcи-N-[3-[1-(4-гидpoкcи-2-oкco-6- фeнэтил-6-пропил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] бензолсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 2-гидроксифенил). См. Схему D.
Пример 88. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил-6- пpoпил- 5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -2- пиримидинсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 2-пиримидил). См. Схему D.
Пример 89. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил-6- пpoпил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] -2- хиназолинсульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает хиназолин-2-ил). См. Схему D.
Пример 90. N-[3-[1-(4-Гидрокси-2-оксо-6-фенэтил-6-пропил- 5,6-дигидро-2H-пиран-3-ил)пропил] фенил]-7H-пурин-6-сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 7H-пурин-6-ил). См. Схему D.
Пример 91. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил- 6-пpoпил-5,6-дигидро-2H-пиран-3-ил)пропил]фенил]-1H-имидазол- 2-сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 1H-имидазол-2-ил). См. Схему D.
Пример 92. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил-6- пpoпил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил]-1H- бензимидазол-2-сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 1H-бензимидазол-2-ил). См. Схему D.
Пример 93. N-[3-[1-(4-Гидpoкcи-2-oкco-6-фeнэтил-6- пpoпил-5,6-дигидро-2H-пиран-3-ил)пропил]фенил]тиазол-4- сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает тиазол-2-ил). См. Схему D.
Пример 93A. 4-Фтop-N-[3-[1-(4-гидpoкcи-2-oкco-6-фeнэтил-6- пропил-5,6-дигидро-2H-пиран-3-ил)пропил] фенил] бензолсульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 4-фторфенил). См. Схему D.
Целевое соединение получают из амина Препарата 20 (формула D-5: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил) и 4-фторбензолсульфохлорида в соответствии с общей методикой сульфонилирования по Примеру 40 и после испарительной хроматографии, элюируя 5%-ным раствором этилацетата в хлористом метилене, выделяют аморфное твердое вещество беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР осложняется присутствием диастереомеров.
Спектр ПМР (300 МГц, дейтероацетон): δ 0,75-0,96, 1,31- 1,48, 1,57-2,01, 2,09-2,22, 2,48-2,71, 3,92, 3,94, 6,86-7,24, 7,72 м.д.
Препарат 22. 6-(2-Циклопропил-1-циклопропилметилэтил)-4- гидрокси-2H-пиран-2-он (формула E-2). См. Схему E.
К охлажденному (минус 78oC) перемешиваемому раствору 1,5 мл ди-изо-пропиламина в 9 мл сухого тетрагидрофурана в атмосфере аргона добавляют 6,2 мл 1,6 М раствора н-бутиллития в гексане. Раствор нагревают до 0oC и добавляют раствор 378 мг промышленно выпускаемого 4-гидрокси-6-метил-2-пирона формулы E-1 в 8 мл гексамителфосфорамида. Перемешивают в течение 30 минут при температуре 0oC и добавляют 0,32 мл бромметилциклопропана; еще через десять минут добавляют еще одну точно такую же порцию. Реакционную смесь перемешивают, оставляют на ночь нагреваться до комнатной температуры и выливают в смесь этилацетата и избытка разбавленной соляной кислоты. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом магния, отфильтровывают и упаривают при пониженном давлении. Остаток очищают методом испарительной хроматографии, используя силикагель 60 (230-400 меш) (элюируют 25%-ным раствором этилацетата в дихлорметане, содержащим 1% уксусной кислоты), и получают 371 мг целевого продукта и 206 мг моноалкилированного производного.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,0, 0,4, 0,6, 1,5, 1,6, 2,2, 5,6, 6,1, 7,2-7,3, 11,5.
Масс-спектр (E1): m/z = 234.
ТСХ: Rf 0,29 (25%-ный раствор этилацетата в дихлорметане, содержащий 1% уксусной кислоты).
Препарат 23. 3-(альфа-Циклопропил-мета- (бензилоксикарбонил-амино)бензил-6-(2-циклопропил-1-циклопропилметилэтил) -4-гидрокси-2H-пиран-2-он (формула E-3). См. Схему E.
Смесь 367 мг целевого продукта Препарата 22, 470 мг целевого продукта Препарата F-5, 60 мг моногидрата п-толуолсульфокислоты и 1 г молекулярных сит 3  в 5 мл бензола нагревают в течение ночи в атмосфере аргона. Смесь разбавляют дихлорметаном и эфиром и отфильтровывают через слой сульфата натрия. Растворитель отгоняют при пониженном давлении и остаток очищают методом испарительной хроматографии, используя силикагель 60 (230-400 меш) (элюируют 5-20%-ным раствором этилацетата в дихлорметане), и получают 399 мг целевого продукта.
в 5 мл бензола нагревают в течение ночи в атмосфере аргона. Смесь разбавляют дихлорметаном и эфиром и отфильтровывают через слой сульфата натрия. Растворитель отгоняют при пониженном давлении и остаток очищают методом испарительной хроматографии, используя силикагель 60 (230-400 меш) (элюируют 5-20%-ным раствором этилацетата в дихлорметане), и получают 399 мг целевого продукта.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ -0,06, 0,3, 0,5, 1,4, 1,5, 2,5, 3,5, 5,1, 7,2-7,4 м.д.
Масс-спектр высокого разрешения, найдено: 513,2513.
ТСХ: Rf 0,28 (5%-ный раствор этилацетата в дихлорметане).
Препарат 24. 3-(альфа-Циклопропил-метааминобензил)-6- (2-циклопропил-1-циклопропилметилэтил)-4-гидрокси-2H-пиран-2-он (формула E-4). См. Схему E.
Смесь 391 мг целевого продукта Препарата 23 и 100 мг 5%-ного палладия на угле и 10 мл этанола встряхивают в течение ночи под давлением 40 фунт-сила/квадратный дюйм (275,8 кПа) водорода. Смесь фильтруют через целит и фильтрат упаривают в вакууме при пониженном давлении, получая 280 мг целевого продукта.
Спектр ПМР: δ 0,0, 0,2-0,7, 1,4, 1,6, 1,8, 2,6, 6,8, 7,1-7,4 м.д.
TCX: Rf 0,38 (30%-ный раствор этилацетата в дихлорметане)
Пример 94. N-(3-[Циклoпpoпил-[6-(2-циклoпpoпил-1- циклoпpoпилметил-этил)-4-гидрокси-2-оксо-2H-пиран-3-ил] метил] фенил)-4-фторбензолсульфонамид (формула E-6). См. Схему E.
К смеси 57 мг целевого продукта Препарата 24 и 24 мкл пиридина в 0,5 мл дихлорметана добавляют 29 мг 4-фторбензолсульфохлорида. Оставляют перемешиваться на ночь, раствор разбавляют этилацетатом и промывают разбавленной соляной кислотой, насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают методом испарительной хроматографии, используя силикагель 60 (230-400 меш) (элюируют 10%-ным раствором этилацетата в дихлорметане), и получают 56 мг целевого продукта.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ -0,07, 0,13, 0,33, 0,54, 1,39, 1,51, 1,72, 2,55, 3,39, 6,12, 6,87, 7,00, 7,08, 7,19, 7,27, 7,72, 9,72 м.д.
Масс-спектр (E1):[M+] = 537,1977.
Примеры 95-97
В соответствии с приведенными выше методиками, используя исходные материалы и реагенты, доступные для специалистов в области органического синтеза, дополнительно получают следующие соединения:
Пример 95. 4-Циано-N-(3-{циклопропил-[6-(2- циклопропил-1-циклопропилметилэтил)-4-гидрокси-2-оксо-2H-пиран -3-ил] метил} фенил)бензолсульфонамид (формула E-7). См. Схему E.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ -0,03, 0,13, 0,23, 0,36, 0,44, 0,57, 1,41, 1,58, 1,75, 2,57, 3,32, 5,98, 6,89, 7,11, 7,21, 7,68, 7,82 м.д.
Масс-спектр (E1): [M+] = 544,2035.
Пример 96. N-(3-{ Циклопропил-[6-(2-циклопропил-1- циклопропилметилэтил)-4-гидрокси-2-оксо-2H-пиран-3-ил] метил} фенил)-8-хинолинсульфонамид (формула E-8). См. Схему E.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ -0,07, 0,18, 0,37, 0,54, 1,37, 1,51, 2,53, 3,31, 5,96, 6,87, 7,00, 7,13, 7,48, 7,54, 7,92, 8,23, 9,07 м.д.
Масс-спектр (E1): [M+] = 570,2188.
Пример 97. N-(3-{ Циклoпpoпил-[6-(2-циклoпpoпил-1- циклoпpoпилметил-этил)-4-гидрокси-2-оксо-2H-пиран-3- ил] метил}фенил)-1-метил-1H-имидазол-4-сульфонамид (формула E-9). См. Схему E.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ -0,08, 0,13, 0,33, 0,56, 1,37, 1,51, 1,73, 2,54, 3,21, 3,60, 5,95, 6,82, 7,0, 7,19, 7,37, 7,5 м.д.
Масс-спектр (E1): [M+] = 523,2142.
Пример 98. Разделение методом хиральной жидкостной хроматографии высокого разрешения N-(3-{циклопропил-[6- (2-циклопропил-1-циклопропилметил-этил)-4-гидрокси-2-оксо-2H-пиран- 3-ил] метил}фенил]-1-метил-1H-имидазол-4-сульфонамида (формула E-9) с получением (R или S)-N-(3-{циклопропил-[6-(2-циклопропил-1- циклопропилметил-этил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил} фенил] -1-метил-1H-имидазол-4-сульфонамида (формул E-10 и E-11) См. Схему E.
Готовят исходный раствор целевого продукта по Примеру 97 (3 мг/мл) в 5,0 мл каждой мобильной фазы (30% изо-пропанола, 0,1% уксусной кислоты и 0,2% воды в гексане) в изо-пропаноле. Исходный раствор фильтруют с помощью шприца через фильтр с размерами пор 0,45 микрон и промывают этанолом, получая 14,0 мл прозрачного фильтрата. Полученный фильтрат хроматографируют на колонке 2,0 x 2,5 см (R,R) Whelk-O 1 ("Regis Technologies, Inc.", Morton Grove, I1 60053), используя автоматическую хроматографическую систему и по 3,50 мл на одну инжекцию. Элюируемое вещество контролируют и соответствующие функции после многократных инжекций объединяют, упаривают в вакууме и подвергают азеотропным перегонкам с толуолом. Остаток растворяют в метаноле, фильтруют с помощью шприца и фильтрат упаривают при пониженном давлении, получая целевое соединение (> 95%-ной чистоты).
(R или S)-N-(3-{ Циклопропил-[6-(2-циклопропил-1-циклопропилметил-этил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-1-метил-1H-имидазол- 4-сульфонамид (формула E-10).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ -0,07, 0,14, 0,34, 0,57, 1,32, 1,55, 1,75, 2,51, 3,24, 3,60, 5,87, 6,85, 7,03, 7,15, 7,27, 7,37 м.д.
Масс-спектр (E1): [M+] = 523,2149.
(R или S)-N-(3-{ Циклoпpoпил-[6-(2-циклoпpoпил-1- циклoпропилметил-этил)-4-гидрокси-2-оксо-2H-пиран-3-ил] метил} фенил)- 1-метил-1H-имидазол-4-сульфонамид (формула E-11).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ -0,07, 0,14, 0,33, 0,55, 1,33, 1,56, 1,75, 2,51, 3,23, 3,60, 5,88, 6,86, 7,03, 7,14, 7,27, 7,38 м.д.
Масс-спектр (E1): [M+]= 523,2137.
Примеры 99-103
В соответствии с приведенными выше методиками, используя исходные материалы и реагенты, доступные для специалистов в области органического синтеза, дополнительно получают следующие соединения:
Пример 99. N-(3-{ Циклопропил-[6-(2-циклопропил-1- циклопропилметил-этил)-4-гидрокси-2-оксо-2H-пиран-3-ил] метил} фенил)- 2-пиридинсульфонамид (формула E-12).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ -0,05, 0,07, 0,17, 0,34, 0,55, 1,35, 1,55, 1,7, 2,5, 3,24, 5,86, 6,90, 7,03, 7,15, 7,39, 7,78, 8,60 м.д.
Масс-спектр (E1): [M+] = 520
TCX: Rf 0,35 (25%-ный раствор этилацетата в дихлорметане).
Пример 100. N-(3-[Циклопропил-[6-(2-циклопропил-1- циклопропилметил-этил)-4-гидрокси-2-оксо-2H-пиран-3-ил] метил} фенил)-1-метил-1H-имидазол-2-сульфонамид (формула E-13).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ -0,05, 0,15, 0,35, 0,56, 1,35, 1,55, 1,75, 2,53, 3,23, 3,39, 5,89, 6,81, 6,90, 6,97, 7,09, 7,25 м.д.
Масс-спектр (E1): [М+] = 523
ТСХ: Rf 0,31 (5%-ный раствор метанола в дихлорметане).
Пример 101. N-(3-{Циклопропил-[6-(2-циклопропил-1- циклопропилметил-этил)-4-гидрокси-2-оксо-2H-пиран-3- ил] метил}фенил)-1H-бензимидазол-2-сульфонамид (формула E-14).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ -0,07, 0,1, 0,15, 0,35, 0,56, 1,38, 1,58, 1,65, 2,55, 3,28, 5,95, 6,73, 6,96, 7,10, 7,28, 7,58 м.д.
Масс-спектр (FAB): [M+H] = 560,2220.
Пример 102. N-(3-{циклoпpoпил-[6-(2-Циклoпpoпил-1- циклoпpoпилметил-этил)-4-гидрокси-2-оксо-2H-пиран-3- ил]метил}фенил)-1H-имидазол-2-сульфонамид (формула E-15).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ 0,0, 0,25, 0,4, 0,6, 1,4, 1,6, 1,65, 2,6, 3,35, 6,0, 6,8, 7,0, 7,2, 7,4 м.д.
Масс-спектр (E1): [M+] = 509
TCX: Rf 0,25 (5%-ный раствор метанола в дихлорметане).
Пример 103. N-(3-[Циклoпpoпил-[6-(2-циклoпpoпил-1- циклoпpoпилметил-этил)-4-гидрокси-2-оксо-2H-пиран-3- ил] метил} фенил)-2-хинолинсульфонамид (формула E-16).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ 0,0, 0,2, 0,4, 0,6, 1,4, 1,6, 1,7, 2,6, 3,3, 6,0, 7,0-7,2, 7,3, 7,7, 7,8-8,0, 8,2, 8,3 м.д.
Масс-спектр (E1): [M+] = 570
TCX: Rf 0,53 (5%-ный раствор метанола в дихлорметане).
Препарат 25. Циклопропил-мета-нитрофенилкетон (формула F-2). См. Схему F.
В трехгорлую колбу емкостью 250 мл, снабженную термометром и капельной воронкой, помещают 130 мл "дымящей" азотной кислоты и охлаждают до минус 10oC. При перемешивании добавляют по каплям 21 мл промышленно выпускаемого циклопропилфенилкетона формулы F-1. Добавление реагента осуществляют с такой скоростью, чтобы температура реакционной смеси поддерживалась на уровне минус 10oC. По окончании добавления полученный прозрачный желтый раствор перемешивают при температуре минус 10oC еще в течение 10 минут, а затем выливают на 1 л измельченного льда. Выпавший осадок промывают 700 мл толуола, экстракт дважды промывают 5%-ным раствором гидроксида натрия, один раз насыщенным раствором соли и сушат над сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток перекристаллизовывают из метанола при температуре минус 25oC и получают 14,6 г целевого соединения в виде призм бледно-желтого цвета. Маточник содержит значительные количества орто-изомера.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,2, 1,3, 2,7, 7,70, 8,3, 8,4, 8,85 м.д.
ИК-спектр: 1664, 1529, 1352, 1225, 1082, 1017, 852, 689 см-1.
Элементный анализ, найдено: С 62,89; H 4,73; N 7,32.
Масс-спектр (E1): m/z 191
ТСХ: Rf 0,32 (25%-ный раствор этилацетата в гексане).
Препарат 26. мета-Аминофенилциклопропилкетон (формула F-3). См. Схему F.
Раствор 5,76 г целевого продукта Препарата 25 получают нагреванием в 100 мл метанола. К нему добавляют 450 мг 5%-ной платины на угле и смесь энергично перемешивают под давлением водорода в одну атмосферу. Через 5 часов смесь отфильтровывают через целит и фильтрат упаривают при пониженном давлении и получают 4,89 г целевого соединения в виде масла зеленоватого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,0, 1,2, 2,6, 3,9, 6,8, 7,2, 7,4 м.д.
TCX: Rf 0,50 (80%-ный раствор этилацетата в гексане).
Препарат 27. мета-Бензилоксикарбониламинофенилциклопропилкетон (формула F-4). См. Схему F.
К охлажденному (0oC) перемешиваемому раствору 4,89 г целевого продукта Препарата 26 и 6,3 мл ди-изо-пропиламина в 90 мл дихлорметана добавляют по каплям 4,7 мл бензилового эфира хлормуравьиной кислоты. Полученному раствору дают нагреться до комнатной температуры, перемешивают в течение четырех часов, промывают разбавленной соляной кислотой и водную порцию экстрагируют двумя порциями дихлорметана. Органические вытяжки объединяют, сушат над сульфатом магния и упаривают при пониженном давлении, получая твердое вещество желтого цвета. Его растирают с двумя порциями по 30 мл гексана, декантируют, оставшееся твердое вещество сушат в вакууме и получают 8,74 г целевого соединения.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,45 (5%-ный раствор этилацетата в дихлорметане)
Препарат 28. мета-Бензилоксикарбониламинофенилциклопропилкарбинол (формула F-5). См. Схему F.
К охлажденному перемешиваемому раствору 8,74 г соединения F-4 Препарата 27 в 100 мл тетрагидрофурана и 100 мл этанола порциями добавляют 4,5 г боргидрида натрия. Перемешивают при комнатной температуре в течение трех часов и перед добавлением 100 мл 1N раствора соляной кислоты охлаждают смесь в бане со льдом. Слои разделяют и водную фазу трижды экстрагируют дихлорметаном. Органические вытяжки объединяют, сушат над сульфатом магния и упаривают при пониженном давлении; остаток хроматографируют на силикагеле 60 (230-400 меш) (элюируют 40%-ным раствором этилацетата в гексане), и получают 8,48 г целевого продукта в виде твердого кристаллического вещества белого цвета. Его можно перекристаллизовывать из смеси этилацетат - гексан.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,3-0,6, 1,1, 2,35, 3,92, 5,17, 7,1, 7,2-7,4 м.д.
ИК-спектр: 1693, 1599, 1559, 1449, 1235, 1954, 697 см-1.
Элементный анализ, найдено: С 72,57; H 6,51; N 4,61.
Препарат 29. 4-Гидрокси-6-[3-(2-метокси-этокси)пропил] пиран-2-он (формула G-1). См. Схему G.
Колбу высушивают открытым пламенем и в токе аргона помещают в нее 2,80 мл ди-изо-пропиламина и 20,0 мл сухого тетрагидрофурана. Полученный раствор охлаждают до минус 78oC и добавляют 12,5 мл (1,6 М раствора в гексане) н-бутиллития. Раствор в течение 30 минут нагревают до температуры 0oC и добавляют 5,0 мл сухого гексаметилфосфорамида. К полученному раствору ди-изо-пропиламида лития добавляют промышленно выпускаемый 4-гидрокси-6-метил-2-пирон формулы G-0 в виде раствора в 16 мл сухого тетрагидрофурана и 14 мл сухого гексаметилфосфорамида. Перемешивают в течение 30 минут и добавляют 2,30 г 2-(2-метокси-этокси)этилиодида в виде раствора в 12 мл сухого тетрагидрофурана. Полученную смесь перемешивают в течение часа при температуре 0oC и дают ей нагреться до комнатной температуры. Перемешивают еще в течение часа и прерывают реакцию, добавляя избыток 1N раствора соляной кислоты. Смесь упаривают при пониженном давлении и выливают в смесь дихлорметана и воды. Водный слой экстрагируют достаточным количеством дихлорметана, чтобы полностью выделить целевой продукт. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток хроматографируют на силикагеле 60 (230-400 меш) (элюируют, начиная 30%-ным раствором этилацетата в дихлорметане, содержащем 3% уксусной кислоты, и заканчивая 80%-ным раствором этилацетата в дихлорметане, содержащем 5% уксусной кислоты) и получают 1,34 г целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 1,93, 2,54, 3,39, 3,55, 5,55, 5,90 м.д.
TCX: Rf 0,26 (50%-ный раствор этилацетата в дихлорметане, содержащий 5% уксусной кислоты).
Препарат 30. 3-(альфа-Циклопропил-мета-(бензилоксикарбонил- амино)бензил)-4-гидрокси-6-[3-(2-метокси-этокси)пропил] пиран-2-он (формула G-2). См. Схему G.
Смесь 146 мг целевого продукта Препарата 29, 340 мг целевого продукта Препарата 28, полученного как показано на Схеме F, 25 мг моногидрата п-толуолсульфокислоты и 0,5 г молекулярных сит 3  в 5 мл дихлорметана оставляют при нагревании на ночь. Охлаждают смесь и растворитель удаляют при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 5-10%-ным раствором метанола в этилацетате) и получают 129 мг целевого соединения.
в 5 мл дихлорметана оставляют при нагревании на ночь. Охлаждают смесь и растворитель удаляют при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 5-10%-ным раствором метанола в этилацетате) и получают 129 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,25, 0,45, 0,67, 1,77, 2,39, 3,38, 3,51, 5,13, 5,84, 7,17, 7,32, 7,42 м.д.
Масс-спектр (E1): [M+] = 507,2257
ТСХ: Rf 0,28 (50%-ный раствор этилацетата в дихлорметане).
Препарат 31. 3-(альфа-Циклопропил-мета-аминобензил)-4- гидрокси-6-[3-(2-метокси-этокси)пропил]пиран-2-он (формула G-3). См. Схему G.
Смесь 124 мг целевого продукта Препарата 30 и 35 мг 5%-ного палладия на угле в 5 мл этанола встряхивают в течение ночи под давлением 50 фунт-сила/квадратный дюйм (344,7 кПа) водорода. Смесь отфильтровывают через целит, промывая фильтр этанолом. Фильтрат объединяют, растворитель отгоняют при пониженном давлении и получают 92 мг целевого продукта.
Вещество обладает следующими физическими характеристиками:
ТСХ: Rf 0,12 (этилацетат).
Пример 104. N-(3-{Циклопропил-[4-гидрокси-6-(3-{2-метокси-этокси}пропил)-2-оксо-2H- пиран-3-ил] метил} фенил)-1-метил-1H-имидазол-4-сульфонамид (формула G-4). См. Схему G.
К смеси 37 мг целевого продукта Препарата 31 и 18 мкл пиридина в 0,5 мл дихлорметана добавляют 20 мг 1-метил-имидазол-4-сульфохлорида. Оставляют перемешиваться на ночь, растворитель удаляют при пониженном давлении. Остаток подвергают азеотропной перегонке с толуолом, а затем очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 2-8%-ным раствором метанола в дихлорметане) и получают 32 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,1, 0,24, 0,45, 0,65, 1,75, 1,85, 2,46, 3,30, 3,34, 3,50, 5,98, 6,98, 7,08, 7,19, 7,29, 7,42 м.д.
Масс-спектр (E1): [M+] = 517,1874
TCX: Rf 0,22 (5%-ный раствор метанола в дихлорметане).
Препарат 32. 3-(альфа-Циклопропил-мета-(бензилоксикарбониламино) бензил)-4-гидрокси-6-метилпиран-2-он (формула H-1). См. Схему H.
Смесь 493 мг промышленно выпускаемого 4-гидрокси-6-метил-2-пирона формулы H-0, 592 мг целевого продукта Препарата 28, полученного как показано на Схеме F, и 56 мг моногидрата п-толуолсульфокислоты в 20 мл дихлорметана кипятят в течение 6 часов с обратным холодильником через капельную воронку, заполненную 3  молекулярными ситами. Охлаждают смесь и
молекулярными ситами. Охлаждают смесь и
растворитель удаляют при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 60-100%-ным раствором этилацетата в дихлорметане) и получают 470 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,23, 0,43, 0,66, 1,78, 3,41, 5,09, 5,89, 7,00, 7,14, 7,29, 7,37, 10,1 м.д.
Масс-спектр (E1): [M+] = 405
TCX: Rf 0,52 (этилацетат).
Препарат 33. 3-(альфа-Циклопропил-мета-(бензилоксикарбониламино)бензил)-4-гидрокси-6-пропилпиран-2-он (формула H-2). См. Схему H.
Колбу высушивают открытым пламенем и в токе аргона помещают в нее 0,45 мл ди-изо-пропиламина и 3,0 мл сухого тетрагидрофурана. Полученный раствор охлаждают до минус 78oC и добавляют 2,0 мл (1,6 М раствора в гексане) н-бутиллития. Раствор в течение 15 минут нагревают до температуры 0oC, а затем вновь охлаждают до минус 78oC. К полученному раствору ди-изо-пропиламида лития добавляют 405 мг целевого продукта Препарата 32 в виде раствора в 4 мл сухого тетрагидрофурана. Перемешивают в течение часа и добавляют 85 мкл бромистого этила. Полученную смесь перемешивают в течение трех часов при температуре минус 78oC и прерывают реакцию, добавляя избыток 1N раствора соляной кислоты. Смесь нагревают и выливают в смесь этилацетата и фосфатного буферного раствора. Водный слой дважды экстрагируют этилацетатом. Органические вытяжки объединяют, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток хроматографируют на силикагеле 60 (230-400 меш) (элюируют 10-20%-ным раствором этилацетата в дихлорметане) и получают 277 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,24, 0,45, 0,65, 0,88, 1,55, 1,79, 2,28, 3,42, 5,10, 5,95, 6,89, 7,15, 7,3, 10,0 м.д.
Масс-спектр (E1): [M+] = 433
TCX: Rf 0,33 (10%-ный раствор этилацетата в дихлорметане).
Препарат 34. 3-(альфа-Циклопропил-мета-(бензилоксикарбониламино)бензил)-6-[1-этил-3-(2-метокси-этокси)пропил] -4-гидроксипиран-2-он (формула H-З). См. Схему H.
Колбу высушивают открытым пламенем и в токе аргона помещают в нее 0,3 мл ди-изо-пропиламина и 2,0 мл сухого тетрагидрофурана. Полученный раствор охлаждают до минус 78oC и добавляют 1,3 мл (1,6 М раствора в гексане) н-бутиллития. Раствор в течение 15 минут нагревают до температуры 0oC, а затем вновь охлаждают до минус 78oC. К полученному раствору ди-изо-пропиламида лития добавляют 277 мг целевого продукта Препарата 33 в виде раствора в 3 мл сухого тетрагидрофурана. Перемешивают при указанной температуре в течение часа и добавляют 180 мг 2-(2-метокси-этокси)этилиодида в 3 мл тетрагидрофурана. Полученную смесь перемешивают в течение трех часов при температуре минус 78oC и прерывают реакцию, добавляя избыток 1N раствора соляной кислоты. Смесь нагревают и выливают в смесь этилацетата и фосфатного буферного раствора. Водный слой трижды экстрагируют этилацетатом. Органические вытяжки объединяют, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток хроматографируют на силикагеле 60 (230-400 меш) (элюируют 25-40%-ным раствором этилацетата в дихлорметане) и получают 198 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,25, 0,46, 0,66, 0,75, 1,5, 1,76, 2,36, 3,4, 5,15, 5,96, 7,2, 7,3, 7,42, 10,0 м.д.
Масс-спектр (E1): [M+] = 535
TCX: Rf 0,29 (25%-ный раствор этилацетата в дихлорметане).
Препарат 35. 3-(альфа-Циклопропил-мета-аминобензил)-6- [1-этил-3-(2-метокси-этокси)пропил]-4-гидрокси-пиран-2-он (формула H-4). См. Схему H.
Смесь 180 мг целевого продукта Препарата 34 и 50 мг 5%-ного палладия на активированном угле в 2 мл этанола встряхивают в течение ночи под давлением 50 фунт-сила/квадратный дюйм (344,7 кПа) водорода. Смесь отфильтровывают через целит, промывая фильтр этанолом. Фильтрат объединяют, растворитель отгоняют при пониженном давлении и получают 127 мг целевого продукта.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,19 (этилацетат).
Пример 105. N-(3-{Циклопропил-[6-(1-этил-3-{2-метокси- этокси}пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил] метил} фенил)-1-метил-1H-имидазол-4-сульфонамид (формула H-5). См. Схему H.
К смеси 32 мг целевого продукта Препарата 35 и 13 мкл пиридина в 0,8 мл дихлорметана добавляют 14,5 мг 1-метил-имидазол-4-сульфохлорида. Оставляют перемешиваться на ночь, растворитель удаляют при пониженном давлении. Остаток подвергают азеотропной перегонке с толуолом, а затем очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 1-4%-ным раствором метанола в дихлорметане) и получают 38 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,05, 0,25, 0,45, 0,65, 0,83, 1,5-2,0, 2,45, 3,3-3,5, 3,62, 6,00, 6,99, 7,1-7,3, 7,48 м.д.
Масс-спектр (E1): [M+] = 545,2186
TCX: Rf 0,24 (5%-ный раствор метанола в дихлорметане).
Пример 106. 4-Циано-N-{3-[циклопропил-[6-(1-этил-3-{2- метокси-этокси} пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)бензолсульфонамид
Целевое соединение получают по описанной ранее методике, используя исходные материалы и реагенты, доступные для специалистов в области органического синтеза.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,15, 0,25, 0,45, 0,65, 0,78, 1,2-1,8, 2,4, 3,3-3,6, 3,54, 5,89, 6,95, 7,1-7,3, 7,6-7,9 м.д.
Масс-спектр (E1): [M+1] = 567,2176
TCX: Rf 0,40 (50%-ный раствор этилацетата в дихлорметане)
Препарат 36. 3-(альфа-Циклопропил-мета-(бензилоксикарбониламино)бензил)-6-(1-этил-3-гидроксипропил)-4-гидроксипиран-2-он (формула I-1). См. Схему I.
Колбу высушивают открытым пламенем и в токе аргона помещают в нее 0,46 мл ди-изо-пропиламина и 3,5 мл сухого тетрагидрофурана. Полученный раствор охлаждают до минус 78oC и добавляют 2,0 мл (1,6 М раствора в гексане) н-бутиллития. Раствор в течение 20 минут нагревают до температуры 0oC, а затем вновь охлаждают до минус 78oC. К полученному раствору ди-изо-пропиламида лития добавляют 433 мг целевого продукта Препарата 33 в виде раствора в 4 мл сухого тетрагидрофурана. Перемешивают при указанной температуре в течение часа и в течение 5 минут пропускают ток оксида этилена. Смесь перемешивают в течение 15 минут при температуре минус 78oC и прерывают реакцию, добавляя избыток 1N раствора соляной кислоты. Смесь нагревают и выливают в смесь этилацетата и фосфатного буферного раствора. Водный слой дважды экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток хроматографируют на силикагеле 60 (230-400 меш) (элюируют 2-8%-ным раствором метанола в дихлорметане) и получают 144 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,22, 0,45, 0,65, 0,7, 1,3-1,7, 1,8, 2,25, 3,4, 5,1, 5,91, 7,1-7,4 м.д.
Масс-спектр (FAB): [M+1] = 478
TCX: Rf 0,29 (5%-ный раствор метанола в дихлорметане).
Препарат 37. 6-(3-Бром-1-этилпропил)-3-(альфа-циклопропил- мета-(бензилоксикарбониламино)бензил)-4-гидрокси-пиран-2-он (формула I-2). См. Схему I.
К перемешиваемому раствору 114 мг целевого продукта Препарата 36 в 3 мл тетрагидрофурана добавляют 160 мг трифенилфосфина и 200 мг четырехбромистого углерода. Через 2 часа растворитель отгоняют при пониженном давлении и остаток очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 70-100%-ным раствором диэтилового эфира в гексане) и получают 113 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,25, 0,35, 0,55, 0,65, 0,84, 1,5-2,2, 3,2, 3,35, 3,52, 5,16, 5,95, 6,79, 7,1-7,4 м.д.
Масс-спектр (FAB): [M+Н] = 504,1404
TCX: Rf 0,29 (75%-ный раствор диэтилового эфира в гексане).
Препарат 38. 6-(3-Азидо-1-этилпропил)-3-(альфа-циклопропил- мета-(бензилоксикарбониламино)бензил)-4-гидроксипиран-2-он (формула I-3). См. Схему I.
К перемешиваемому раствору 113 мг целевого продукта Препарата 37 в 2,0 мл этанола добавляют 55 мг азида натрия и 0,5 мл воды. Реакционную смесь оставляют при нагревании на ночь, охлаждают, растворитель отгоняют при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш), элюируя диэтиловым эфиром, и получают 89 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,23, 0,33, 0,51, 0,68, 0,82, 1,4-2,0, 2,33, 3,1-3,3, 3,5, 5,15, 5,94, 6,84, 7,1-7,4 м.д.
Масс-спектр (E1): [M+] = 502
TCX: Rf 0,52 (10%-ный раствор этилацетата в дихлорметане).
Препарат 39. 6-(3-Амино-1-этилпропил)-3-(альфа-циклопропил- мета-аминобензил)-4-гидроксипиран-2-он (формула I-4). См. Схему I.
Смесь 87 мг целевого продукта Препарата 38 и 35 мг 5%-ного палладия на активированном угле в 4 мл этанола встряхивают в течение 4 часов под давлением 40 фунт-сила/квадратный дюйм (275,8 кПа) водорода. Смесь отфильтровывают через целит, промывая фильтр этанолом. Фильтрат объединяют, растворитель отгоняют при пониженном давлении и получают 70 мг целевого продукта в виде смеси с 6-(3-амино-1-этилпропил)-3- (альфа-циклопропил-мета-(бензилоксикарбониламино)бензил)-4- гидроксипиран-2-оном.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,05 (5% метанола в дихлорметане).
Препарат 40. 3-(Циклопропил-{ 3-[1-метил-1H-имидазол-4- сульфонамино] фенил}метил)-6-(1-этил-3-[1-метил-1H-имидазол-4- сульфонамино]пропил)-2-оксо-2H-пиран-4-ил-1-метил-1H- имидазол-4-сульфонат (формула I-5). См. Схему I.
К 70 мг смеси 6-(3-амино-1-этилпропил)-3-(альфа- циклопропил-мета-аминобензил)-4-гидроксипиран-2-она и 6-(З-амино-1-этилпропил)-3-(альфа-циклопропил-мета- (бензилоксикарбониламино)бензил)-4-гидрокси-пиран-2-она, также полученного в Препарате 39, в 1,5 мл дихлорметана добавляют 120 мкл ди-изо-пропилэтиламина и 92 мг 1-метил-имидазол-4-сульфохлорида. Оставляют перемешиваться на ночь, растворитель удаляют при пониженном давлении. Остаток подвергают азеотропной перегонке с толуолом, а затем очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 2-6%-ным раствором метанола в дихлорметане) и получают 49 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,2-0,5, 0,75, 0,90, 1,4-2,0, 2,55, 3,0-3,4, 3,6-3,7, 6,63, 7,0-7,7 м.д.
Масс-спектр (FAB): [М+H] = 775
TCX: Rf 0,14 (5%-ный раствор метанола в дихлорметане).
Пример 107. N-(3-{Циклoпpoпил-[6-(1-этил-3-{1-метил-1H- имидазол-4-сульфонамино} пропил)-4-гидрокси-2-оксо-2H-пиран- 3-ил]метил}фенил-1-метил-1H-имидазол-4-сульфонамид (формула I-6). См. Схему I.
Раствор 49 мг целевого продукта Препарата 40 в 40 мл метанола, содержащего аммиак, охлаждают до 0oC и обрабатывают газообразным аммиаком. Через 5 минут подачу аммиака прекращают, колбу тщательно закрывают и нагревают до комнатной температуры. Оставляют на ночь, растворитель отгоняют при пониженном давлении и остаток очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 3-9%-ным раствором метанола в дихлорметане) и получают 32 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,2-0,5, 0,75, 0,90, 1,4-2,0, 2,55, 3,0-3,4, 3,6-3,7, 6,63, 7,0-7,7 м.д.
Масс-спектр (El): [M+H] = 523
TCX: Rf 0,33 (5%-ный раствор метанола в дихлорметане).
Препарат 41. 3-(альфа-Циклопропил-мета-аминобензил)-6- (1-этил-3-гидроксипропил)-4-гидроксипиран-2-он (формула J-1). См. Схему J.
Смесь 477 мг целевого продукта Препарата 36 и 150 мг 5%-ного палладия на активированном угле в 10 мл этанола встряхивают в течение 4 часов под давлением 45 фунт-сила/квадратный дюйм (310,3 кПа) водорода. Смесь отфильтровывают через целит, промывая фильтр этанолом. Фильтрат объединяют, растворитель отгоняют при пониженном давлении и получают 340 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,10 (5% метанола в дихлорметане).
Препарат 42. 6-(3-Бром-1-этилпропил)-3-(альфа-циклопропил- мета-аминобензил)-4-гидроксипиран-2-он (формула J-2). См. Схему J.
К перемешиваемому раствору 340 мг целевого продукта Препарата 41 в 7 мл тетрагидрофурана добавляют 525 мг трифенилфосфина и 663 мг четырехбромистого углерода. Через 30 минут растворитель отгоняют при пониженном давлении и остаток очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 30-50%-ным раствором этилацетата в дихлорметане) и получают 228 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 0,19, 0,42, 0,58, 0,75, 1,4-2,4, 3,14, 3,3, 5,26, 6,15, 6,47, 6,91, 7,00 м.д.
TCX: Rf 0,45 (5%-ный раствор метанола в дихлорметане).
Пример 108. N-(3-{ [6-(3-Бром-1-этилпропил)-4-гидрокси-2- оксо-2H-пиран-3-ил]циклопропилметил}фенил)-1-метил-1H- имидазол-4-сульфонамид (формула J-3). См. Схему J.
К смеси 102 мг целевого продукта Препарата 42 и 40 мкл пиридина в 1,0 мл дихлорметана добавляют 45 мг 1-метил-1H- имидазол-4-сульфохлорида. Оставляют перемешиваться на ночь, растворитель удаляют при пониженном давлении. Остаток подвергают азеотропной перегонке с толуолом, а затем очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш) (элюируют 2-5%-ным раствором метанола в дихлорметане) и получают 86 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ 0,2, 0,44 0,60, 0,82, 1,4-2,2, 2,5, 3,1-3,4, 3,62, 5,93, 6,92, 7,07, 7,19, 7,30, 7,40 м.д.
Масс-спектр (FAB): [M+H] = 550,1037
TCX: Rf 0,36 (5%-ный раствор метанола в дихлорметане).
Пример 109. N-(3-{ [6-(3-Азидо-1-этилпропил)-4-гидрокси-2- оксо-2H-пиран-3-ил]циклопропилметил}фенил)-1-метил-1H- имидазол-4-сульфонамид (формула J-4). См. Схему J.
К перемешиваемому раствору 113 мг целевого соединения Примера 108 в 1,2 мл этанола добавляют 50 мг азида натрия и 0,4 мл воды. Реакционную смесь оставляют при нагревании на ночь, охлаждают, растворитель отгоняют при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш), элюируя 3-6%-ным раствором метанола в дихлорметане, и получают 57 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ 0,25, 0,48, 0,66, 0,90, 1,3-1,8, 2,42, 2,9-3,2, 3,68, 5,94, 6,93, 7,12, 7,19, 7,23, 7,35, 7,46 м.д.
Масс-спектр (FAB): [M+H] = 550,1037
TCX: Rf 0,36 (5%-ный раствор метанола в дихлорметане).
Препарат 43. N-(3-{[6-(3-Амино-1-этилпропил)-4-гидрокси-2- оксо-2H-пиран-3-ил]циклопропилметил}фенил)-1-метил-1H- имидазол-4-сульфонамид (формула J-5). См. Схему J.
Смесь 104 мг целевого соединения Примера 109 и 30 мг 5%-ного палладия на активированном угле в 22 мл этанола встряхивают в течение ночи под давлением 45 фунт-сила/квадратный дюйм (310,3 кПа) водорода. Смесь отфильтровывают через целит, промывая фильтр метанолом. Фильтрат объединяют, растворитель отгоняют при пониженном давлении и получают 69 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,05 (5% метанола в дихлорметане).
Пример 110. Мононатриевая соль 2-[[8-[[3-[3-[циклопропил [3-[[(1-метил-1H-имидазол-4-ил)сульфонил] амино] фенил]метил]-4-гидрокси-2-оксо-2H-пиран-6-ил] пентил] амино] -1,8-диоксооктил] метиламино] этансульфокислоты (формула J-6). См. Схему J.
К суспензии 69 мг целевого продукта Препарата 43 в 1,0 мл дихлорметана добавляют 0,22 мл (0,5 М раствор в ацетонитриле) соли сулептановой кислоты с триэтиламином и 25 мкл ди-изо-пропилкарбодиимида. Перемешивают в течение часа и добавляют 0,5 мл диметилформамида. Оставляют перемешиваться на ночь, растворитель упаривают при пониженном давлении и остаток очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш), элюируя 10-30%-ным раствором метанола в дихлорметане. Сырой продукт растворяют в насыщенном растворе н-бутанола в воде и добавляют насыщенный водный раствор сульфата натрия. Органический слой отделяют, водную фазу дополнительно дважды экстрагируют насыщенным водным раствором н-бутанола. Бутанольные вытяжки объединяют и фильтруют через слой сульфата натрия и упаривают при пониженном давлении, получая 94 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ 0,5-0,6, 0,83, 1,1-2,5, 2,9-3,7, 3,68, 5,84, 6,8-7,6 м.д.
Масс-спектр (FAB): [М+H] = 786,2838
TCX: Rf 0,21 (20%-ный раствор метанола в дихлорметане).
Примеры 111-134.
В соответствии с приведенными выше методиками, используя исходные материалы и реагенты, доступные для специалистов в области органического синтеза, дополнительно получают следующие соединения:
111) N-(3-{ Циклопропил-[4-гидрокси-6-(3-{[(2-гидрокси-1,1-бис {гидроксиметил} этил)амино] карбонил} аминопропил) -2-оксо-2H-пиран-3-ил]метил}фенил)бензолсульфонамид
112) N-(3-{ Циклопропил-[4-гидрокси-6-(3-{[(2-гидрокси-1,1-бис {гидроксиметил} этил)амино] карбонил} аминопропил) -2-оксо-2H-пиран-3-ил]метил}фенил)-2-пиридинсульфонамид
113) N-(3-{ Циклопропил-[4-гидрокси-6-(3-{[(2-гидрокси-1,1-бис {гидроксиметил} этил)амино] карбонил} аминопропил) -2-оксо-2H-пиран-3-ил]метил}фенил)-1H-имидазол-2-сульфонамид
114) N-(3-{ Циклопропил-[4-гидрокси-6-(3-{[(2-гидрокси-1,1-бис {гидроксиметил} этил)амино] карбонил} аминопропил) -2-оксо-2H-пиран-3-ил]метил}фенил)-1H-бензимидазол-2-сульфонамид
115) N-(3-{ Циклопропил-[4-гидрокси-6-(3-{[(2-гидрокси-1,1- бис{гидроксиметил} этил)амино] карбонил} аминопропил)-2-оксо- 2H-пиран-3-ил]метил}фенил)-1-метил-1H-имидазол-4-сульфонамид
116) N-(3-{ Циклопропил-[4-гидрокси-6-(3-{[(2-гидрокси-1,1-бис {гидроксиметил} этил)амино] карбонил} аминопропил)-2-оксо-2H-пиран-3-ил] метил} фенил)-1-метил-1-имидазол-сульфонамид
117) N-(3-{ Циклопропил-[4-гидрокси-6-(3-{ гамма-L- глютамил}амино-пропил)-2-оксо-2H-пиран-3-ил]метил}фенил) бензолсульфонамид
118) N-(3-{Циклопропил-[4-гидрокси-6-(3-{гамма-L-глютамил}амино-пропил) -2-оксо-2H-пиран-3-ил]метил}фенил)-2-пиридин-сульфонамид
119) N-(3-{ Циклопропил-[4-гидрокси-6-(3-{ гамма-L-глютамил} амино-пропил)-2-оксо-2H-пиран-3-ил]метил}фенил)-1H-имидазолсульфонамид
120) N-(3-{Циклопропил-[4-гидрокси-6-(3-{гамма-L-глютамил}амино-пропил) -2-оксо-2H-пиран-3-ил]метил}фенил)-1H-бензимидазолсульфонамид
121) N-(3-{Циклопропил-[4-гидрокси-6-(3-{гамма-L-глютамил}амино-пропил) -2-оксо-2H-пиран-3-ил]метил}фенил)-1-метил-1H-имидазол-4-сульфонамид
122) N-(3-{Циклопропил-[4-гидрокси-6-(3-{гамма-L-глютамил}амино-пропил) -2-оксо-2H-пиран-3-ил]метил}фенил)-1-метил-1H-имидазол-2-сульфонамид
123) N-(3-{Циклопропил-[4-гидрокси-6-(3-{[пипepaзин-1-ил]карбонил} амино-пропил)-2-оксо-2H-пиран-3-ил]метил}фенил)бензолсульфонамид
124) N-(3-{Циклопропил-[4-гидрокси-6-(3-{[пипepaзин-1-ил]карбонил} амино-пропил)-2-оксо-2H-пиран-3-ил]метил}фенил)-2-пиридинсульфонамид
125) N-(3-{Циклопропил-[4-гидрокси-6- {[пиперазин-1-ил]карбонил}амино-пропил)-2-оксо-2H-пиран-3-ил]метил} фенил)-1H-имидазол-2-сульфонамид
126) N-(3-{ Циклопропил-[4-гидрокси-(6-{[пиперазин-1-ил]карбонил}амино- пропил)-2-оксо-2H-пиран-3-ил]метил}фенил)-1H- бензимидазол-2-сульфонамид
127) N-(3-{Циклопропил-[4-гидрокси-(6-(3-{[пипepaзин- 1-ил]карбонил}амино-пропил)-2-оксо-2H-пиран-3-ил] метил} фенил)-1-метил-1H-имидазол-4-сульфонамид
128) N-(3-{ Циклопропил-[4-гидрокси-5-(3-{ [пипepaзин-1- ил] карбонил} амино-пропил)-2-оксо-2H-пиран-3-ил] метил} фенил)- 1-метил-1H-имидазол-2-сульфонамид
129) Мононатриевая соль 2-[[8-[[3-[3-[циклoпpoпил]3- [[фeнилсульфонил] амино] фенил] метил] -4-гидрокси-2-оксо-2H-пиран-6- ил]пропил]амино]-1,8-диоксооктил/метиламино/этансульфокислоты
130) Мононатриевая соль 2-[[8-[[3-[3-[циклoпpoпил]3-[[(2-пиридил)сульфонил] амино] фенил] метил]-4- гидрокси-2-оксо-2H-пиран-6-ил]пропил] амино]-1,8-диоксооктил[метиламино] этансульфокислоты
131) Мононатриевая соль 2-[[8-[[3-[3-[циклoпpoпил] 3-[[(1H-бензимидазол-2-ил) сульфонил] амино] фенил] метил]-4-гидрокси-2-оксо-2H-пиран-6- ил] пропил]амино]-1,8-диоксооктил[метиламино]этансульфокислоты
132) Мононатриевая соль 2-[[8-[[3-[3-[циклoпpoпил]3-[[(1H-имидазол-2-ил)сульфонил] амино] фенил] метил] -4-гидрокси-2-оксо-2H-пиран-6-ил]пропил] амино]-1,8-диоксооктил[метиламино] этансульфокислоты
133) Мононатриевая соль 2-[[8-[[3-[3-[циклoпpoпил]3-[[(1-метил-1H-имидазол-4-ил)сульфонил] амино] фенил]метил]-4-гидрокси-2-оксо-2H-пиран-6-ил] пропил]амино]-1,8-диоксооктил[метиламино]этансульфокислоты
134) Мононатриевая соль 2-[[8-[[3-[3-[циклoпpoпил]3-[[(1-метил-1H-имидазол-2-ил)сульфонил] амино] фенил]метил]-4-гидрокси-2-оксо-2H-пиран-6-ил] пропил]амино]-1,8-диоксооктил[ метиламино]этансульфокислоты.
Препарат 44. (Тетрагидропиран-4-ил)метанол (формула K-2). См. Схему K.
К охлажденному (0oC) раствору 651 мг тетрагидропиран-4- карбоновой кислоты в 2,5 мл сухого тетрагидрофурана в атмосфере аргона добавляют по каплям 10 мл 1,0 М раствора борана в тетрагидрофуране. Перемешивают 18 часов при комнатной температуре, вновь охлаждают раствор до 0oC и разлагают реакционную смесь, добавляя 1 мл 1 М раствора едкого кали. Подкисляют смесь 1 М раствором соляной кислоты и четыре раза экстрагируют дихлорметаном. Органические вытяжки объединяют, сушат над сульфатом магния и упаривают при пониженном давлении, получая 0,72 г целевого спирта в виде бесцветной жидкости.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,2-1,4, 1,6, 1,8, 3,3-3,4, 3,6, 4,0 м.д.
Препарат 45. (Тетрагидропиран-4-ил) метиловый эфир п-толуол-сульфокислоты (формула K-3). См. Схему K.
К охлажденному (0oC) раствору 5 ммоль целевого продукта Препарата 44 и 0,81 мл пиридина в 5 мл дихлорметана добавляют 1,05 г п-толуолсульфохлорида и дают раствору нагреться до комнатной температуры. Перемешивают в течение 18 часов, выливают в разбавленный раствор соляной кислоты и экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом магния, отфильтровывают. Растворитель упаривают при пониженном давлении, а остаток хроматографируют на силикагеле, элюируя 50%-ным раствором этилацетата в гексане, и получают 1,23 г целевого соединения в виде бесцветной жидкости.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,2-1,4, 1,6, 1,9-2,0, 2,46, 3,34, 3,85, 3,95, 7,3, 7,8 м. д.
Масс-спектр: 270
Препарат 46. (Тетрагидропиран-4-ил)метилиодид (формула K-4). См. Схему K.
Раствор 800 мг тозилата, полученного в Препарате 45, и 887 мг иодида натрия в 6 мл ацетона кипятят с обратным холодильником в атмосфере азота в течение шести часов, выливают в раствор тиосульфата натрия и экстрагируют эфиром. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом магния и осторожно упаривают при пониженном давлении, получая 648 мг иодида в виде бесцветной жидкости.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,2-1,4, 1,6-1,9, 3,1, 3,37, 3,97 м.д.
Препарат 47. 6-(1-(Тетрагидропиран-4-илиметил)пропил)-4- гидроксипиран-2-он (формула K-5). См. Схему K.
К охлажденному (-78oC) раствору 0,90 мл ди-изо-пропиламина в 5 мл тетрагидрофурана в атмосфере аргона с помощью шприца добавляют 3,7 мл 1,6 М раствора н-бутиллития в гексане. Раствор нагревают до 0oC, перемешивают в течение 10 минут и с помощью канюли добавляют раствор 431 мг целевого продукта Препарата 50 в 3 мл гексаметилфосфорамида. Через 20 минут образовавшийся раствор темно-красного цвета охлаждают до минус 50oC и с помощью канюли добавляют 605 мг иодида Препарата 46 в 1 мл тетрагидрофурана. Дают реакционной смеси медленно нагреться до температуры 0oC и разлагают ее, добавив фосфатный буфер с pH 7. Тетрагидрофуран отгоняют при пониженном давлении, а остаток далее подкисляют разбавленной соляной кислотой, выпавший осадок экстрагируют двумя порциями этилацетата. Органический раствор промывают разбавленной соляной кислотой и насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают методом колоночной испарительной хроматографии на силикагеле, элюируя раствором, содержащим 5% уксусной кислоты и 30-40% этилацетата в дихлорметане, и получают 553 мг целевого соединения в виде вязкой смолы желтого цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,21 (5% уксусной кислоты и 65% этилацетата в дихлорметане).
Спектр ПМР: δ 0,85, 1,2-1,8, 2,45, 3,34, 3,9, 5,56, 5,94 м.д.
Масс-спектр: 252
Препарат 48. 3-[(3-Бензилоксикарбониламинофенил)циклопропилметил]-6-(1-(тетрагидропиран-4-илметил)пропил)-4-гидрокси-пиран-2-он (формула K-6). См. Схему K.
Раствор 549 мг продукта алкилирования Препарата 47, 970 мг 3-бензилоксикарбониламинофенилциклопропилкарбинола и 60 мг моногидрата п-толуолсульфокислоты в 5 мл дихлорметана кипятят с обратным холодильником через 10 мл молекулярных сит 3  в течение 18 часов. Растворитель отгоняют при пониженном давлении, остаток очищают методом колоночной испарительной хроматографии на силикагеле (элюируют, начав с 25-100%-ного раствора этилацетата в дихлорметане и заканчивая 5%-ным раствором метанола в этилацетате) и получают 511 мг целевого соединения в виде смолы темно-коричневого цвета.
в течение 18 часов. Растворитель отгоняют при пониженном давлении, остаток очищают методом колоночной испарительной хроматографии на силикагеле (элюируют, начав с 25-100%-ного раствора этилацетата в дихлорметане и заканчивая 5%-ным раствором метанола в этилацетате) и получают 511 мг целевого соединения в виде смолы темно-коричневого цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,32 (30% этилацетата в дихлорметане).
Спектр ПМР: δ 0,2, 0,5, 0,7, 0,8, 1,3-1,7, 3,27, 3,42, 3,86, 5,13, 5,96, 7,1-7,4 м.д.
Масс-спектр: 531
Препарат 49. 3-[(3-Аминофенил)циклопропилметил]-6- (1-(тетрагидропиран-4-илметил)пропил)-4-гидроксипиран-2-он (формула K-7). См. Схему K.
Смесь 510 мг целевого продукта Препарата 48, 605 мг формиата аммония и 100 мг 5%-ного палладия на угле в 8 мл метанола перемешивают в атмосфере аргона в течение трех часов, отфильтровывают через диатомовую землю, фильтрат упаривают при пониженном давлении и остаток очищают методом колоночной испарительной хроматографии на силикагеле (элюируют 2-4%-ным раствором метанола в дихлорметане) и получают 280 мг целевого амина в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,33 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,24, 0,42, 0,53, 0,68, 0,84, 1,1-1,7, 2,35, 3,33, 3,6, 3,9, 5,82, 6,5, 6,83, 6,9, 7,11 м.д.
Пример 135. N-(3-{Циклопропил-[6-(1-тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил) - 1-метил-1H-имидазол-4-сульфонамид (формула K-8). См. Схему K.
К перемешиваемому раствору 60 мг амина Препарата 49 и 24 мкл пиридина в дихлорметане добавляют 27 мг 1-метил-1H-имидазол-4- сульфохлорида. Через 18 часов продукт очищают методом колоночной испарительной хроматографии на силикагеле (элюируют 3-6%-ным раствором метанола в дихлорметане) и получают 70 мг целевого соединения в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,24 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,12, 0,26, 0,45, 0,60, 0,82, 1,1-1,9, 2,3, 3,3, 3,58, 3,9, 6,00, 6,9-7,5 м.д.
Масс-спектр высокого разрешения: 541,2238.
Препарат 50. 4-Гидрокси-6-пропилпиран-2-он (aормула K-9). См. Схему K.
К охлажденному (минус 78oC) раствору 6,3 мл ди-изо-пропиламина в 40 мл сухого тетрагидрофурана в атмосфере аргона при перемешивании с помощью канюли добавляют 27,5 мл 1,6 М раствора бутиллития в гексане. Раствор нагревают до 0oC и с помощью канюли добавляют раствор 2,52 г 4-гидрокси-6-метилпирона формулы К-10 в 20 мл гексаметилфосфотриамида. Через 30 минут образовавшийся раствор темно-красного цвета охлаждают до минус 45oC и добавляют 1,5 мл бромистого этила. Дают реакционной смеси медленно нагреться до температуры 0oC и разлагают ее, добавив 60 мл 1N соляной кислоты. Тетрагидрофуран отгоняют при пониженном давлении, а остаток пять раз экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают методом колоночной испарительной хроматографии на силикагеле, элюируя раствором, содержащим 4% уксусной кислоты и 16% этилацетата в дихлорметане, и получают 2,34 г целевого соединения в виде воскообразного твердого вещества желтого цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,29 (5% уксусной кислоты и 15% этилацетата в дихлорметане).
Спектр ПМР: δ 0,98, 1,6, 2,4, 5,63, 6,05 м.д.
Препарат 51. 4-Гидрокси-6-фенэтил-2H-пиран-2-он (формула L-2) См. Схему L.
Колбу высушивают открытым пламенем и в токе аргона помещают в нее 0,90 мл ди-изо-пропиламина и 6 мл сухого тетрагидрофурана. Полученный раствор охлаждают до минус 78oC и добавляют 4,0 мл 1,6 М раствора н-бутиллития в гексане. Раствор в течение 20 минут нагревают до температуры 0oC и с помощью канюли добавляют раствор промышленно выпускаемого 4-гидрокси-6- метил-2-пирона формулы L-1 в 15 мл тетрагидрофурана. К полученной вязкой суспензии красного цвета медленно добавляют 6,0 мл перегнанного гексаметилфосфорамида и перемешивают в течение 30 минут. К полученному непрозрачному раствору красного цвета добавляют 0,36 мл бромистого бензила. Реакционная смесь быстро приобретает темно-оранжевый цвет и ее перемешивают при температуре 0oC еще в течение 60 минут. Смесь разлагают, добавляя избыток 1N раствора соляной кислоты, и полученную двухфазную смесь желтого цвета упаривают, удаляя тетрагидрофуран. Остаток выливают в воду и экстрагируют дихлорметаном. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток разбавляют большим количеством диэтилового эфира и промывают разбавленной соляной кислотой, один раз насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток хроматографируют на силикагеле 60 (230-400 меш) (элюируют раствором, содержащим 1% уксусной кислоты, и 20-40%-ным этилацетатом в дихлорметане) и получают 440 мг целевого соединения в виде твердого вещества темно-коричневого цвета с т.пл. 137-138oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 2,7, 3,0, 5,46, 5,84, 7,1-7,3 м.д.
TCX: Rf 0,38 (1% уксусной кислоты и 25% этилацетата в дихлорметане).
Препарат 52. 6-(альфа-Этил-фенэтил)-4-гидрокси-2H-пиран-2-он (формула L-3). См. Схему L.
В охлажденный (минус 78oC) раствор в токе аргона 0,29 мл ди-изо-пропиламина в 4 мл сухого тетрагидрофурана при перемешивании добавляют 1,2 мл 1,6 М раствора н-бутиллития в гексане. Раствор нагревают до температуры 0oC, перемешивают в течение 10 минут, затем снова охлаждают до температуры минус 30oC и с помощью канюли добавляют раствор целевого продукта Препарата 51 в 4 мл тетрагидрофурана. Полученную гетерогенную смесь нагревают до 0oC и добавляют достаточное количество гексаметилфосфорамида (приблизительно 1 мл), так чтобы смесь стала почти однородной. Перемешивают в течение 30 минут при температуре 0oC, затем по каплям добавляют 77 мкл этилиодида. По прошествии еще 90 минут реакцию разлагают, добавляя избыток 1N раствора соляной кислоты, и тетрагидрофуран отгоняют при пониженном давлении. Остаток экстрагируют тремя порциями этилацетата. Органические вытяжки объединяют, промывают разбавленным раствором соляной кислоты, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток хроматографируют на силикагеле 60 (230-400 меш) (элюируют раствором, содержащим 1% уксусной кислоты и 25% этилацетата в дихлорметане) и получают 182 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,85, 1,6, 2,6, 2,9, 5,59, 5,86, 7,0-7,3
Масс-спектр (FAB): [M+H] = 245,1185
TCX: Rf 0,33 (1% уксусной кислоты и 25% этилацетата в дихлорметане).
Препарат 53. 3-(альфа-Циклопропил-мета-(бензилоксикарбониламино)бензил) -6-(альфа-этил-фенэтил)-4-гидрокси-2H-пиран-2-он (формула L-4). См. Схему L.
Смесь 181 мг целевого продукта Препарата 52, 220 мг соединения формулы F-5, 28 мг моногидрата п-толуолсульфокислоты и 600 мг молекулярных сит 3  в 2 мл бензола кипятят с обратным холодильником в течение 21 часа. Охлаждают, фильтруют через целит, фильтрат упаривают при пониженном давлении, остаток очищают методом колоночной испарительной хроматографии на силикагеле (элюируют 50-100%-ным раствором этилацетата в дихлорметане) и получают 250 мг смеси продуктов. Еще раз хроматографируют на силикагеле, элюируя 5-20%-ным раствором этилацетата в дихлорметане, получая 154 мг (40%) целевого соединения.
в 2 мл бензола кипятят с обратным холодильником в течение 21 часа. Охлаждают, фильтруют через целит, фильтрат упаривают при пониженном давлении, остаток очищают методом колоночной испарительной хроматографии на силикагеле (элюируют 50-100%-ным раствором этилацетата в дихлорметане) и получают 250 мг смеси продуктов. Еще раз хроматографируют на силикагеле, элюируя 5-20%-ным раствором этилацетата в дихлорметане, получая 154 мг (40%) целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,26, 0,48, 0,67, 0,81, 1,6, 1,8, 2,5, 2,7, 2,9, 3,48, 5,14, 5,86, 6,81, 7,0-7,5, 9,46 м.д.
Масс-спектр высокого разрешения (E1): m/z = 523,2350
TCX: Rf 0,27 (5% этилацетата в дихлорметане).
Препарат 54. 3-(альфа-Циклопропил-мета-(аминобензил)-6- (альфа-этил-фенэтил)-4-гидрокси-2H-пиран-2-он (формула L-5). См. Схему L.
Смесь 146 мг целевого продукта Препарата 53 и 50 мг 5%-ного палладия на угле в 2 мл метанола встряхивают в течение 2 часов под давлением 40 фунт-сила/квадратный дюйм (275,8 кПа) водорода, а затем отфильтровывают через целит. Фильтрат упаривают при пониженном давлении и получают 105 мг (96%) целевого продукта.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,25, 0,5, 0,65, 0,81, 1,6, 2,5, 2,7, 2,9, 3,4, 5,79, 6,5, 6,8-7,3 м.д.
TCX: Rf 0,38 (30% этилацетата в дихлорметане).
Примеры 136-150.
Используя приведенные ранее методики, вводят во взаимодействие соединения формулы L-5 с соответствующими сульфохлоридами и дополнительно получают следующие соединения. Индивидуальные стереоизомеры выделяют методом хиральной жидкостной хроматографии высокого разрешения из промежуточных продуктов, таких как соединения формулы L-3, L-4, L-5 и L-6. (См. Схему L).
136) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4-гидрокси- 2-оксо-2H-пиран-3-ил]метил}фенил)-1-метил-1H-имидазол-4- сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,29 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,2, 0,5, 0,65, 0,86, 1,63, 1,80, 2,51, 2,8, 3,3, 3,62, 5,7, 6,8-7,4 м.д.
Масс-спектр высокого разрешения: 533,1998
137) N-(3-(R или S)-{Циклoпpoпил-[6-(1-(R)-этилфeнэтил) -4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-1-метил-1H- имидазол-4-сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,32 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,18, 0,43, 0,63, 0,83, 1,6, 1,75, 2,5, 2,7-2,9, 3,3, 3,55, 5,76, 6,9-7,4 м.д.
Масс-спектр высокого разрешения: 533,1983
138) N-(3-(R или S)-{Циклопропил-[6-(1-(R)-этилфенэтил) - 4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-1-метил-1H- имидазол-4-сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,30 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,2, 0,5, 0,65, 0,86, 1,63, 1,80, 2,51, 2,8, 3,3, 3,62, 5,7, 6,8-7,4 м.д.
Масс-спектр высокого разрешения: 533,1993
139) N-(3-(R или S)-{Циклопропил-[6-(1-(S)-этилфенэтил) -4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)метил-1H- имидазол-4-сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,30 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,2, 0,5, 0,65, 0,86, 1,63, 1,80, 2,51, 2,8, 3,3, 3,62, 5,7, 6,8-7,4 м.д.
Масс-спектр высокого разрешения: 533,1993
140) N-(3-(R или S)-{Циклопропил-[6-(1-(S)-этилфенэтил)-4-гидрокси -2-оксо-2H-пиран-3-ил]метил}фенил)-1-метил-1H-имидазол-4-сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,30 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,17, 0,44, 0,62, 0,83, 1,6, 1,75, 2,50, 2,7-3,0, 3,3, 3,53, 5,80, 6,9-7,4 м.д.
Масс-спектр высокого разрешения: 533,1990
141) N-(3-(R или S)-{Циклопропил-[6-(1-(R)-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-2-пиридинсульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,34 (30% этилацетата в дихлорметане).
Спектр ПМР: δ 0,2, 0,45, 0,6, 0,86, 1,5-1,9, 2,5, 2,8-3,0, 3,2, 5,7, 6,9-7,4, 7,8, 8,6 м.д.
Масс-спектр: 530
142) N-(3-(R или S)-{Циклопропил-[6-(1-(R)-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-2-пиридинсульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,35 (30% этилацетата в дихлорметане).
Спектр ПМР: δ 0,11, 0,20, 0,43, 0,58, 0,85, 1,5-1,8, 2,5, 2,7-3,0, 3,3, 5,69, 6,9-7,4, 7,8, 8,6 м.д.
Масс-спектр: 530
143) N-(3-(R или S)-{Циклопропил-[6-(1-(R)-этилфенэтил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил} фенил)-1-метил-1H-имидазол-2-сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,34 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,19, 0,5, 0,65, 0,89, 1,6-1,9, 2,5, 2,8-3,0, 3,3, 3,40, 5,70, 6,8-7,4 м.д.
Масс-спектр: 533
144) N-(3-(R или S)-{Циклoпpoпил-[6-(1-(R)-этилфeнэтил)-4-гидрокси-2- оксо-2H-пиран-3-ил]метил}фенил)-1-метил-1H-имидазол-2-сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,34 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,20, 0,44, 0,65, 0,88, 1,6-1,8, 2,5, 2,8-3,0, 3,3, 3,42, 5,73, 6,8-7,4 м.д.
Масс-спектр: 533
145) N-(3-{Циклопропил-[6-(1-(тетрагидропиран-4-илметил)пропил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-1-метил-1H-имидазол-2- сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,22 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,16, 0,24, 0,47, 0,64, 0,86, 1,2-1,9, 3,2-3,4, 3,47, 3,7-4,0, 5,89, 6,9-7,4 м.д.
Масс-спектр: 541
145A) N-(3-[Циклопропил[4-гидpoкcи-2-oкco-6-[1-[(тeтрагидро-2H-пиран-3-ил) метил]пропил]-2H-пиран-3-ил]метил]фенил)-8-хинолинсульфонамид
Вещество обладает следующими физическими характеристиками:
Молекулярная масса, найдено: m/z 588.
145B) N-(3-[Циклопропил[4-гидpoкcи-2-oкco-6-[1-[(тeтрагидро-2H-пиран-3-ил) метил] пропил] -2H-пиран-3-ил]метил]фенил)-1-метил-1H-имидазолсульфонамид
Вещество обладает следующими физическими характеристиками:
Молекулярная масса, найдено: m/z 541.
146) N-(3-{ Циклопропил-[6-(1-(R)-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)бензимидазол-2- сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,40 (50% этилацетата в дихлорметане).
Спектр ПМР: δ 0,1-0,6, 0,85, 1,5-1,7, 2,5, 2,7-3,0, 3,3, 5,74, 6,7-7,3, 7,5-7,7 м.д.
Масс-спектр высокого разрешения: 570,2054
147) N-(3-{Циклопропил-[6-(1-(R)-этилфенэтил)-4-гидрокси
-2-оксо-2H-пиран-3-ил]метил}фенил)-1H-имидазол-2- сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,31 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,20, 0,4, 0,6, 0,87, 1,5-1,8, 2,5, 2,8-3,0, 3,3, 5,54, 6,8, 6,9-7,4 м.д.
148) N-(3-(R или S)-{Циклопропил-[6-(1-(R)-этилфенэтил)- 4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-4-цианосульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,47 (20% этилацетата в дихлорметане).
Спектр ПМР: δ 0,1, 0,2, 0,4, 0,6, 0,84, 1,5-1,8, 2,5, 2,7-3,0, 3,3, 5,70, 6,9, 7,0-7,3, 7,6, 7,8 м.д.
Масс-спектр высокого разрешения: 554,1886
149) N-(3-(R или S)-{Циклопропил-[6-(1-(R)-этилфенэтил) -4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-4-циано- бензолсульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,35 (15% этилацетата в дихлорметане).
Спектр ПМР: δ 0,1, 0,2, 0,4, 0,6, 0,85, 1,5-1,9, 2,5, 2,7-3,0, 3,3, 5,7, 6,9-7,3, 7,6, 7,8 м.д.
Масс-спектр высокого разрешения: 554,1876
150) N-(3-{Циклопропил-[6-(1-этилфенэтил) -4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-4-нитробензолсульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,28 (10% этилацетата в дихлорметане).
Спектр ПМР: δ 0,1, 0,2, 0,4, 0,6, 0,83, 1,5- 1,9, 2,5, 2,7-3,0, 3,3, 5,70, 6,9-7,3, 7,9, 8,2 м.д.
Масс-спектр высокого разрешения: 574,1773
Препарат 55. (2-(2-(2-Метокси-этокси)этокси)этокси)-п- толуолсульфонат (формула M-2). См. Схему M.
К перемешиваемой суспензии 19,1 г п-толуолсульфохлорида в 100 мл дихлорметана добавляют смесь 16 мл монометилового эфира триэтиленгликоля и 10 мл пиридина, а затем добавляют 200 мг диметиламинопиридина. Оставляют на три дня, смесь упаривают при пониженном давлении, остаток выливают в разбавленный раствор соляной кислоты и экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором бикарбоната натрия и насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают методом испарительной хроматографии на силикагеле, элюируя 25%-ным раствором этилацетата в дихлорметане, и получают 18,25 г целевого соединения в виде бесцветной жидкости.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,27 (20% этилацетата в дихлорметане).
Спектр ПМР: δ 2,45, 3,38, 3,5-3,8, 4,15, 7,35, 7,8 м.д.
ИК-спектр: 2879, 1357, 1190, 1177, 1108, 1099, 924, 665 см-1.
Масс-спектр: 318
Препарат 56. 2-Гидрокси-4-(2-(2-(2-метокси-этокси) этокси)этокси)ацетофенон (формула M-3). См. Схему M.
Смесь 1,52 г 2,4-дигидроксиацетофенона, 3,82 г тозилата Препарата 55, 3,26 г карбоната цезия и 0,2 г иодида калия в 20 мл диоксана нагревают в течение ночи до температуры 100oC, охлаждают, выливают в разбавленную соляную кислоту и дважды экстрагируют дихлорметаном. Органические вытяжки объединяют, моют водой, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают методом испарительной хроматографии на силикагеле, элюируя 85-100%-ным раствором этилацетата в гексане, и получают 2,91 г целевого соединения в виде почти бесцветной жидкости.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,35 (80% этилацетата в гексане).
Спектр ПМР: δ 2,56, 3,38, 3,5-3,9, 4,2, 6,4-6,5, 7,6 м.д.
ИК-спектр: 1635, 1372, 1257, 1133 см-1.
Масс-спектр: 298
Препарат 57. Этиловый эфир 3-(2-гидрокси-4-(2-(2-(2- метокси-этокси)этокси)этокси)фенил)-3-оксо-пропионовой кислоты (формула M-4). См. Схему M.
К перемешиваемому раствору 1,49 г целевого продукта Препарата 56 в 20 мл диэтилкарбоната добавляют порциями 600 мг 60%-ной дисперсии гидрида натрия в минеральном масле. Полученную смесь нагревают до температуры 80oC в течение двух часов, охлаждают, выливают в разбавленную соляную кислоту и экстрагируют дихлорметаном. Органические вытяжки сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают методом испарительной хроматографии на силикагеле, элюируя 20-30%-ным раствором этилацетата в дихлорметане, и получают 0,91 г целевого соединения в виде масла желтого цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,44 (3% уксусной кислоты и 30% этилацетата в дихлорметане).
Спектр ПМР: δ 1,3, 3,38, 3,5-4,0, 4,2, 6,4-6,5, 7,6 м.д.
Масс-спектр: 370
Препарат 58. 4-Гидрокси-4-(2-(2-(2-метокси-этокси) этокси)этокси)кумарин (формула M-5). См. Схему M.
Раствор 789 мг целевого продукта Препарата 57 в 10 мл уксусной кислоты кипятят с обратным холодильником в течение двух часов и упаривают при пониженном давлении. Остаток очищают методом испарительной хроматографии на силикагеле, элюируя 5-10%-ным раствором уксусной кислоты в этилацетате, и получают 634 мг целевого соединения в виде твердого вещества темно-желтого цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,31 (10% уксусной кислоты в этилацетате).
Спектр ПМР: δ 3,37, 3,5-3,9, 4,1, 5,67, 6,6, 6,7, 7,6 м.д.
Масс-спектр: 324
Препарат 59. 3-[(3-Бeнзилoкcикapбoнилaминoфeнил)циклoпpoпилметил]-4-гидрокси-7-{ 2-[2- (2-метокси-этокси)этокси] этокси}кумарин (формула М-6). См. Схему М.
Смесь 704 мг целевого продукта Препарата 58, 75 мг мета-бензилоксикарбониламинофенилциклопропилкарбинола формулы F-5 и 62 мг моногидрата п-толуолсульфокислоты в 8 мл дихлорметана кипятят с обратным холодильником в течение 18 часов через слой приблизительно 10 мл молекулярных сит 3  . Раствор упаривают при пониженном давлении и остаток очищают методом испарительной хроматографии на силикагеле, элюируя 10-20% смеси (10% уксусной кислоты в этилацетате) в дихлорметане, и получают 760 мг целевого соединения.
. Раствор упаривают при пониженном давлении и остаток очищают методом испарительной хроматографии на силикагеле, элюируя 10-20% смеси (10% уксусной кислоты в этилацетате) в дихлорметане, и получают 760 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,33 (2% уксусной кислоты и 20% этилацетата в дихлорметане).
Спектр ПМР: δ 0,27, 0,46, 0,71, 1,61, 3,33, 3,5-3,9, 4,1, 5,13, 6,6, 6,7, 7,1-7,6 м.д.
Препарат 60. 3-[(3-Аминофенил)циклопропилметил] -4- гидрокси-7-{2-[2-(2-метокси-этокси)этокси]этокси}кумарин (формула М-7). См. Схему М.
Смесь 760 мг целевого продукта Препарата 59, 800 мг формиата аммония и 200 мг 5%-ного палладия на активированном угле в 8 мл метанола перемешивают в атмосфере аргона в течение часа и отфильтровывают через диатомовую землю. Фильтрат упаривают при пониженном давлении и остаток растирают с дихлорметаном. Растворитель удаляют при пониженном давлении и получают 591 мг целевого амина.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,29 (5% метанола в дихлорметане).
Пример 151. N-(3-{Циклопропил-[7-(2-(2-(2-метокси-этокси)этокси)этокси) -4-гидроксикумарин-3-ил] метил} фенил)-1-метил-1H-имидазол-4-сульфонамид (формула М-8). См. Схему М.
К перемешиваемому раствору 70 мг целевого продукта Препарата 60 и 24 мкл пиридина в 0,5 мл дихлорметана добавляют 27 мг 1-метил-1H-имидазол-4-сульфохлорида. Через 18 часов продукт очищают методом испарительной хроматографии на силикагеле (элюируют 5-15%-ным раствором метанола в дихлорметане) и получают 76 мг целевого сульфонамида в виде аморфного пенообразного вещества розового цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,21 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,16, 0,29, 0,45, 0,61, 1,71, 3,34, 3,4-3,9, 4,1, 6,6-6,8, 7,0-7,4, 7,7 м.д.
Масс-спектр высокого разрешения: 614,2179.
Примеры 152-154. Используя приведенные ранее методики, дополнительно получают следующие соединения.
152) N-(3-{ Циклопропил-[7-метокси-4-гидроксикумарин-3- ил] метил} фенил)-1-метил-1H-имидазол-4-сульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,29 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,18, 0,35, 0,50, 0,63, 1,61, 3,51, 3,7, 3,84, 6,7-6,8, 7,1-7,4, 7,7 м.д.
Масс-спектр высокого разрешения: 481,1301.
153) N-(3-{ Циклопропил-[7-(2-(2-(2-метокси-этокси) этокси)этокси)-4-гидроксикумарин-3-ил]метил}фенил)-8- хинолинсульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,41 (5% метанола в дихлорметане).
Спектр ПМР: δ -0,03, 0,31, 0,47, 1,30, 3,36, 3,5-3,8, 3,9, 4,2, 6,6-7,6, 7,8, 8,0, 8,2 м.д.
Масс-спектр высокого разрешения: 661,2219.
154) N-(3-{ Циклопропил-[7-(2-(2-(2-метокси-этокси) этокси)этокси)-4-гидроксикумарин-3-ил]метил}фенил)-2- пиридинсульфонамид
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,31 (5% метанола в дихлорметане).
Спектр ПМР: δ 0,13, 0,34, 0,49, 0,63, 1,6, 3,36, 3,5-3,9, 4,1, 6,68, 6,8, 7,1-7,4, 7,6-7,8, 8,5 м.д.
Масс-спектр высокого разрешения: 611,2051.
Примеры 155-190
По методикам, аналогичным приведенным ранее, получают следующие соединения по настоящему изобретению.
155) N-(3-{Циклопропил-[6-(1-(тетрагидропиран-4-илметил)пропил) -4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-2- пиридинсульфонамид
156) N-(3-{Циклопропил-[6-(1-(тетрагидропиран-4-илметил)пропил)- 4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-4- циано-2-пиридинсульфонамид
157) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-2- хинолинсульфонамид
158) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил) -2-гидроксибензолсульфонамид
159) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-2- пиразолсульфонамид
160) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)- 2-хинозолинсульфонамид
161) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил) -7H-пурин-6-сульфонамид
162) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)- 1H-имидазол-2-сульфонамид
163) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил) -бензимидазол-2-сульфонамид
164) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)- тиазол-4-сульфонамид
165) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил] метил} фенил)-4- этоксикарбонил-1H-имидазол-2-сульфонамид
166) N-(3-{ Циклопропил-[6-(1-(тетрагидропиран-4- илметил)пропил)-4-гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-3- гидрокси-2-пиридинсульфонамид
167) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-2-пиридинсульфонамид
168) N-(3-{Циклопропил-[6-(1-этилфенил)-4-гидрокси-2- оксо-2H-пиран-3-ил]метил}фенил)-4-циано-2-пиридинсульфонамид
169) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-2-хинолинсульфонамид
170) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-2- гидроксибензолсульфонамид
171) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4-гидрокси- 2-оксо-2H-пиран-3-ил]метил}фенил)-2-пиразолсульфонамид
172) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-2-хиназолинсульфонамид
173) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-7H-пурин-6-сульфонамид
174) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-1H-имидазол-2- сульфонамид
175) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4-гидрокси- 2-оксо-2H-пиран-3-ил]метил}фенил)бензимидазол-2-сульфонамид
176) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)тиазол-2-сульфонамид
177) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4- гидрокси-2-оксо-2H-пиран-3-ил]метил}фенил)-4-этоксикарбонил- 1H-имидазол-2-сульфонамид
178) N-(3-{Циклопропил-[6-(1-этилфенэтил)-4-гидрокси- 2-оксо-2H-пиран-3-ил]метил}фенил)-3-гидрокси-2-пиридин- сульфонамид
179) N-(3-{ Циклопропил-[4-гидроксикумарин-3-ил] метил} фенил)-2-пиридинсульфонамид
180) N-(3-{ Циклoпpoпил-[4-гидpoкcикумapин-3-ил] мeтил}фенил)-4-циано-2-пиридинсульфонамид
181) N-(3-{ Циклопропил-[4-гидроксикумарин-3-ил] метил} фенил)-2-хинолинсульфонамид
182) N-(3-{ Циклопропил-[4-гидроксикумарин-3-ил]метил} фенил)-2-гидроксибензолсульфонамид
183) N-(3-{ Циклопропил-[4-гидроксикумарин-3-ил] метил}фенил)-2-пиразолсульфонамид
184) N-(3-{ Циклопропил-[4-гидроксикумарин-3-ил] метил}фенил)-2-хиназолинсульфонамид
185) N-(3-{Циклопропил-[4-гидроксикумарин-3-ил] метил}фенил)-7H-пурин-6-сульфонамид
186) N-(3-{ Циклoпpoпил-[4-гидpoкcикумapин-3-ил]мeтил}фенил) -1H-имидазол-2-сульфонамид
187) N-(3-{Циклопропил-[4-гидроксикумарин-3-ил]метил} фенил)бензимидазол-2-сульфонамид
188) N-(3-{Циклопропил-[4-гидроксикумарин-3-ил] метил}фенил)тиазолсульфонамид
189) N-(3-{ Циклопропил-[4-гидроксикумарин-3-ил]метил} фенил)-4-этоксикарбонил-1H-имидазол-2-сульфонамид
190) N-(3-{ Циклопропил-[4-гидроксикумарин-3-ил]метил} фенил)-3-гидрокси-2-пиридинсульфонамид
Препарат 61. Циклопропил-(3-нитрофенил)метанон (формула N-2). См. Схему N.
В круглодонную колбу емкостью 1 л, снабженную рубашкой, мешалкой и капельной воронкой, помещают в атмосфере азота 580 мл "дымящей" азотной кислоты и охлаждают до минус 40oC. Медленно в течение 1,5 часов добавляют циклопропилфенилкетон формулы N-1 (100 г), поддерживая температуру ниже минус 35oC. Перемешивают в течение 3 часов, контролируя ход реакции с помощью тонкослойной хроматографии. Реакционную смесь выливают в 3 кг смеси льда со льдом. Экстрагируют этилацетатом (3 x 500 мл). Органические вытяжки объединяют, дважды промывают по 1,5 литра насыщенным водным раствором бикарбоната натрия, сушат над сульфатом магния, отфильтровывают и упаривают, получая 138 г продукта. Его растворяют в 270 мл метанола, охлаждают до минус 20oC в течение 18 часов, отфильтровывают, промывают на фильтре холодным метанолом. Продукт сушат при пониженном давлении в течение 72 часов, выделяя 63,86 г. Анализ методом газовой хроматографии (колонка длиной 15 м DB-1, T0 = 100oC, 10oC/мин, время удерживания - 6,0 мин) показывает, что чистота продукта составляет > 98%.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 8,86, 8,43, 8,34, 7,70, 2,72, 1,33, 1,17 м.д.
ИК-спектр (вазелиновое масло): 2954, 2925, 1664, 1614, 1529, 1442, 1386, 1352, 1225, 1082, 1047, 852, 720, 689 см-1.
Элементный анализ, найдено: С, 62,89; H, 4,73; N, 7,32.
Масс-спектр (E1): m/z 191, 150, 104, 69.
Препарат 62. Циклопропил-(3-аминофенил)метанон (формула N-3). См. Схему N.
В аппарат Парра загружают платину на угле (8,7 г). Помещают в колбу циклопропил-(3-нитрофенил)метанон Препарата 61 (86,7 г) и метанол (1,56 л) и нагревают, чтобы ускорить растворение, а затем охлаждают до 9oC в бане со льдом. Гидрируют в течение 50 минут, поддерживая температуру ниже 35oC; за ходом реакции следят с помощью тонкослойной хроматографии. Реакционную смесь фильтруют и упаривают при пониженном давлении, получая 70 г продукта.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,99, 7,47-7,19, 6,84, 3,84, 2,60, 1,23-1,15, 1,03-0,96 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 200,9, 146,8, 139,1, 129,4, 119,3, 118,4, 113,9, 17,2, 11,6 м.д.
Препарат 63. Циклопропил-(3-аминокарбобензоксифенил)метанон (формула N-4). См. Схему N.
В круглодонную колбу емкостью 3 л, снабженную механической мешалкой и капельной воронкой, в атмосфере аргона помешают циклопропил-(3-аминофенил)метанон Препарата 62 (70,0 г), ди-изо-пропилэтиламин (90,2 мл) и хлористый метилен (1,3 л). Реакционную смесь охлаждают до 0oC. Разбавляют бензилхлорформиат (67,5 мл) хлористым метиленом (186 мл) и в течение часа добавляют к смеси, находящейся в колбе, поддерживая температуру на уровне 0-5oC. Образуется обильный осадок. Дают смеси нагреться при перемешивании, контролируя ход реакции с помощью тонкослойной хроматографии. Выливают реакционную смесь в смесь 600 мл 1N HCl/600 г льда/4,2 л хлористого метилена и перемешивают до полного растворения. Фазы разделяют, органический слой сушат над сульфатом магния, отфильтровывают и упаривают досуха. Суспендируют твердые вещества в соотношении 3 мл/г в гексане, отфильтровывают и сушат в вакууме, получая 125 г продукта.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 8,01, 7,76-7,69, 7,43-7,33, 7,18, 5,21, 2,64, 1,25-1,20, 1,03-0,97 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 200,6, 153,4, 138,7, 138,5, 135,9, 129,3, 128,6, 128,4, 123,1, 122,8, 118,1, 67,2, 17,3, 12,0 м.д.
Препарат 64. Циклопропил-(3-аминокарбобензоксифенил) метанол (формула N-5). См. Схему N.
В круглодонную колбу емкостью 2 л, снабженную расположенной сверху механической мешалкой, в атмосфере азота помещают циклопропил-(3-аминокарбобензоксифенил)метанон Препарата 63 (25 г) тетрагидрофуран (450 мл) и этанол (90 мл). Реакционную смесь охлаждают до 0-5oC и в течение 30 минут добавляют тремя равными порциями гранулированный боргидрид натрия (12,4 г). Дают смеси нагреться до температуры 23oC и перемешивают в течение 20 часов, следя за ходом реакции с помощью тонкослойной хроматографии. Вновь охлаждают смесь до 0-5oC и медленно разлагают, добавляя 90 мл 1N раствора соляной кислоты и поддерживая при этом температуру ниже 10oC. Выливают при перемешивании в смесь хлористого метилена (600 мл) и 1N соляной кислоты (400 мл). Фазы разделяют и промывают органическую фазу насыщенным водным раствором хлорида натрия (1 л). Сушат над сульфатом магния, отфильтровывают и упаривают, получая 23,7 г.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,41-7,35, 7,33, 7,17 7,10, 5,17, 3,93, 2,36, 1,16-1,12, 0,60-0,32 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 153,5, 145,0, 137,9, 136,1, 129,0, 128,6, 128,3, 121,2, 117,9, 116,5, 67,9, 67,0, 19,1, 3,6, 2,8 м.д.
Препарат 65. Фенилметиловый эфир [3-[циклопропил (5,6,7,8,9,10-гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)метил]фенил]карбаминовой кислоты (формула N-6). См. Схему N.
В трехгорлую круглодонную колбу емкостью 12 литров, снабженную экстрактором Сокслета, заполненным 3 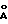 молекулярными ситами (180 г), и трубкой для подачи азота, помещают бета-2-гидрокси-δ-лактон циклооктен-1-акриловой кислоты (59,6 г), п-толуолсульфокислоту (14,9 г) и хлористый метилен (7,2 л). Помещают целевой продукт Препарата 64 (90,0 г) и реакционную смесь кипятят с обратным холодильником в течение часа. Охлаждают реакционную смесь до 20oC и промывают смесью 1:1 насыщенных растворов хлорида натрия и бикарбонат натрия (3 л), водой (3 л), раствором хлорида натрия (3 л). Промывные воды дополнительно экстрагируют хлористым метиленом (2 x 1,5 л). Органические слои объединяют, сушат над сульфатом магния, отфильтровывают и упаривают до объема приблизительно 1,5 л. Реакционную смесь охлаждают до минус 20oC в течение 72 часов, отфильтровывают и сушат при пониженном давлении, получая 103,5 г продукта. Сырой продукт суспендируют в соотношении 12,5 мл/г в гексане, отфильтровывают и сушат, получая 102,4 г целевого соединения. Дополнительное количество целевого соединения (10,9 г) получают, концентрируя маточный раствор после перекристаллизации и перекристаллизовывая остаток из этилацетата.
молекулярными ситами (180 г), и трубкой для подачи азота, помещают бета-2-гидрокси-δ-лактон циклооктен-1-акриловой кислоты (59,6 г), п-толуолсульфокислоту (14,9 г) и хлористый метилен (7,2 л). Помещают целевой продукт Препарата 64 (90,0 г) и реакционную смесь кипятят с обратным холодильником в течение часа. Охлаждают реакционную смесь до 20oC и промывают смесью 1:1 насыщенных растворов хлорида натрия и бикарбонат натрия (3 л), водой (3 л), раствором хлорида натрия (3 л). Промывные воды дополнительно экстрагируют хлористым метиленом (2 x 1,5 л). Органические слои объединяют, сушат над сульфатом магния, отфильтровывают и упаривают до объема приблизительно 1,5 л. Реакционную смесь охлаждают до минус 20oC в течение 72 часов, отфильтровывают и сушат при пониженном давлении, получая 103,5 г продукта. Сырой продукт суспендируют в соотношении 12,5 мл/г в гексане, отфильтровывают и сушат, получая 102,4 г целевого соединения. Дополнительное количество целевого соединения (10,9 г) получают, концентрируя маточный раствор после перекристаллизации и перекристаллизовывая остаток из этилацетата.
Вещество обладает следующими физическими характеристиками:
Температура плавления 113-115oC (с разложением).
Спектр ПМР (дейтерохлороформ): δ 7,48, 7,38-7,26, 7,17, 6,70, 6,29, 5,20, 3,95, 2,64-2,60, 2,37-2,43, 1,76-1,72, 1,61-1,42, 0,88, 0,73-0,72, 0,63-0,55, 0,29-0,26 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 165,6, 164,0, 161,3, 142,2, 138,5, 129,9, 128,5, 128,3, 128,2, 122,9, 118,0, 117,9, 117,6, 110,7, 106,0, 67,0, 43,7, 30,7, 29,1, 28,8, 26,2, 25,8, 22,1, 13,0, 4,9, 3,8 м.д.
ИК-спектр (вазелиновое масло): 3304, 2995, 2953, 2923, 2855, 1734, 1698, 1665, 1666, 1633, 1610, 1595, 1553, 1491, 1463, 1455, 1445, 1406, 1377, 1313, 1222, 1175, 1085, 1068, 740, 696 см-1.
Масс-спектр (E1):m/z 473, 445, 382, 338, 91.
Масс-спектр высокого разрешения, найдено: 473,2202
Препарат 66. 3-[(3-Аминофенил)циклопропилметил] -5,6,7,8,9, 10-гексагидро-4-гидрокси-2H-циклоокта[b]пиран-2-он (формула N-7). См. Схему N.
В трехгорлую круглодонную колбу емкостью 100 мл, снабженную обратным холодильником и трубкой для подачи азота, помещают 10% палладия на угле (1,0 г) и смесь целевого продукта формулы N-6, полученного в Препарата 65 (1,95 г), в циклогексане (50 мл), и смесь кипятят с обратным холодильником в течение 4 часов. Смесь затем отфильтровывают через целит, промывают хлористым метиленом и упаривают, получая 1,25 г целевого соединения в виде твердого вещества белого цвета с т.пл. 75-79oC.
Вещество обладает следующими физическими характеристиками:
ИК-спектр (вазелиновое масло): 2995, 2951, 2921, 2868, 1660, 1619, 1605, 1590, 1551, 1491, 1460, 1447, 1428, 1404, 1247, 1226, 1202, 1191, 1172, 1126 см-1.
Масс-спектр (E1): m/z 339, 310, 213, 187, 159.
Спектр ПМР (дейтерохлороформ): δ 7,16, 6,96, 6,84, 6,63, 5,67, 3,87, 2,61, 2,48-2,37, 1,98, 1,75, 1,63-1,26, 0,74-0,65, 0,61-0,53, 0,28-0,22 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 164,2, 161,1, 142,8, 130,2, 117,7, 117,6, 114,7, 114,6, 114,5, 110,9, 106,2, 43,5, 30,6, 29,1, 28,8, 26,2, 25,8, 22,0, 12,8, 4,7, 3,7 м.д.
Масс-спектр высокого разрешения, найдено: 339,1845.
Препарат 67. 4-Циано-N-[3-[циклопропил(5,6,7,8,9,10- гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил) метил] фенил] бензолсульфонамид (формула O-3, где R61 обозначает 4-цианофенил) См. Схему О.
Раствор целевого продукта Препарата 66 (660 мг), пиридина (320 мкл) и 4-цианобензолсульфохлорида (440 мг) в дихлорметане (40 мл) перемешивают при комнатной температуре в течение 18 часов. Смесь упаривают до объема 5 мл и хроматографируют на силикагеле, элюируя 50%-ным раствором этилацетата в гексане, и получают целевое соединение (641 мг) в виде аморфного твердого вещества белого цвета. Это аморфное вещество, в свою очередь, перекристаллизовывают из смеси ацетон/гексан и получают 499 мг продукта с т.пл. 183-183,5oC.
Вещество обладает следующими физическими характеристиками:
Элементный анализ, найдено: С, 66,76; H, 5,68; N, 5,38; S, 6,30;
Масс-спектр (E1): m/z 504, 463, 338, 309, 233, 220, 207, 195, 186, 153, 144, 130, 117, 102
Масс-спектр высокого разрешения: 504,1710
TCX (силикагель GF): Rf 0,4 (50% этилацетата в гексане).
Пример 191. Динатрий-4-циано-N-[3-[циклопропил (5,6,7,8,9,10- гeкcaгидpo-4-гидpoкcи-2-oкco-2H- циклooктa[b] пиран-3-ил)метил] фенил]бензолсульфонамид
К 12,6 г целевого продукта Препарата 67 добавляют 500 мл метанола и, при энергичном перемешивании, 50 мл 1N водного раствора гидроксида натрия. Перемешивают реакционную смесь при комнатной температуре в течение часа и полученный раствор желтого цвета упаривают досуха при температуре 35oC, а полученный аморфный остаток растворяют в абсолютном этаноле и вновь упаривают досуха. Остаток желтого цвета сушат в глубоком вакууме при комнатной температуре в течение 18 часов и получают 14 г аморфного твердого вещества желтого цвета.
Вещество обладает следующими физическими характеристиками:
TCX (силикагель GF): Rf 0,8 полоса со старта (20% этилацетата в хлористом метилене).
Содержание воды: 6,16%
Сольват: 4,2% этанола
Потеря воды при комнатной температуре: 4,99%
Твердый остаток: найдено: 7,83%, вычислено: 7,50% (скорректировано с учетом 6,16% воды и 4,2% этанола).
Препарат 68. N-Meтил-3-[(3-aминoфeнил)циклoпpoпилмeтил]- 5,6,7,8,9,10-гексагидро-4-гидрокси-2H-циклоокта[b]пиран-2-он
К 678 мг целевого продукта Препарата 66 добавляют 100 мл абсолютного этанола и 330 мг 10%-ного палладия на угле. Добавляют 183 мкл 35%-ного раствора формальдегида в воде и встряхивают смесь в аппарате Парра под давлением 50 фунт-сила/квадратный дюйм (344,7 кПа) водорода в течение двух часов при комнатной температуре. Реакционную смесь отфильтровывают через целит и промывают на фильтре этанолом. Полученный раствор темно-желтого цвета упаривают досуха. Полученный остаток хроматографируют, элюируя 10%-ным раствором этилацетата в хлористом метилене и получают 110 мг целевого продукта. Его используют без дальнейшей очистки в синтезе указанных далее сульфонамидов.
Вещество обладает следующими физическими характеристиками:
TCX (силикагель GF): Rf 0,5 (10% этилацетата в хлористом метилене).
Спектр ПМР (дейтерохлороформ): δ 7,19, 6,90, 6,71, 6,54-6,52, 3,90, 2,80, 2,63-2,59, 2,43-2,39, 1,75-1,26, 0,70-0,53, 0,28-0,22 м.д.
Пример 192. 4-Циaнo-N-мeтил-N-[3-[циклопpoпил(5,6,7,8,9, 10-гeкcaгидpo-4-гидpoкcи-2-oкco-2H-циклooктa[b] пиран-3-ил) метил] фенил]бензолсульфонамид
Раствор целевого продукта Препарата 68 (35 мг), пиридина (16 мкл) и 4-цианобензолсульфохлорида (20,1 мг) в дихлорметане (2 мл) перемешивают при комнатной температуре в течение 18 часов. Смесь хроматографируют на силикагеле, элюируя 10%-ным раствором этилацетата в хлористом метилене, и получают 27 мг целевого соединения в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 518, 490, 352, 233, 207, 172, 158, 143, 129, 115, 102, 81, 54, 43
TCX (силикагель GF): Rf 0,7 (10% этилацетата в хлористом метилене).
Спектр ПМР (дейтерохлороформ): δ 7,75-7,72, 7,63-7,60, 7,38-7,19, 6,97-6,94, 6,62, 3,86, 3,19, 2,66-2,62, 2,54-2,50, 1,76-1,20, 0,70-0,59, 0,47-0,42, 0,24-0,19 м.д.
Пример 193. 4-Фтор-N-метил-N-[3-[циклопропил (5,6,7,8,9, 10-гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил) метил] фенил]бензолсульфонамид
Раствор целевого продукта Препарата 68 (20 мг), пиридина (11 мкл) и 4-фторбензолсульфохлорида (10,7 мг) в дихлорметане (2 мл) перемешивают при комнатной температуре в течение 18 часов. Смесь хроматографируют на силикагеле, элюируя 10%-ным раствором этилацетата в хлористом метилене, и получают 19 мг целевого соединения в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 512, 483, 470, 366, 352, 324, 247, 227, 207, 172, 158, 147, 118, 55
Масс-спектр высокого разрешения: 512,1915
TCX (силикагель GF): Rf 0,7 (10% этилацетата в хлористом метилене).
Спектр ПМР (дейтерохлороформ): δ 7,53-7,48, 7,33-7,23, 7,13-7,07, 6,99-6,97, 6,38, 3,93, 3,16, 2,63-2,61, 2,49-2,46, 1,76-1,25, 0,78-0,61, 0,51-0,45, 0,30-0,17 м.д.
Пример 194. N-Метил-N-[3-[циклопропил(5,6,7,8,9,10- гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил) метил]фенил]бензолсульфонамид
Раствор целевого продукта Препарата 68 (33,4 мг), пиридина (16 мкл) и бензолсульфохлорида (16,6 мг) в дихлорметане (2 мл) перемешивают при комнатной температуре в течение 18 часов. Смесь хроматографируют на силикагеле, элюируя 10%-ным раствором этилацетата в хлористом метилене, и получают 20 мг целевого соединения в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
TCX (силикагель GF): Rf 0,7 (10% этилацетата в хлористом метилене).
Спектр ПМР (дейтерохлороформ): δ 7,59-7,41, 7,33-7,23, 6,98-6,96, 6,44, 3,90, 3,16, 2,64-2,60, 2,50-2,48, 1,75- 1,20, 0,67-0,40, 0,23-0,20 м.д.
Пример 195. N-Meтил-N-[3-[циклoпpoпил (5,6,7,8,9,10- гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил) метил] фенил]-1H-имидазол-1-метилсульфонамид
Раствор целевого продукта Препарата 68 (33,4 мг), пиридина (16 мкл) и N-метилимидазол-3-сульфохлорида (16 мг) в дихлорметане (2 мл) перемешивают при комнатной температуре в течение 18 часов. Смесь хроматографируют на силикагеле, элюируя 50%-ным раствором этилацетата в хлористом метилене, и получают 28 мг целевого соединения в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
TCX (силикагель GF): Rf 0,5 (50% этилацетата в хлористом метилене).
Спектр ПМР (дейтерохлороформ): δ 7,43, 7,33, 7,27-7,15, 3,84-3,81, 3,69, 3,35, 2,63-2,59, 2,50-2,46, 1,75-1,26, 0,68, 0,55, 0,47-0,42, 0,24-0,20 м.д.
Используя методики, аналогичные приведенным выше, получают следующие соединения по настоящему изобретению:
196) 5-Циано-N-[3-[циклопропил (5,6,7,8,9,10-гексагидpo- 4-гидpoкcи-2-oкco-2H-циклooктa[b]пиpaн-3-ил)метил]фенил]- 2-пиридинсульфонамид
197) N-[3-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил]фенил]-2- хинолинсульфонамид
198) N-[3-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил]фенил]-2- имидазолсульфонамид
199) N- [3-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил]фенил]-2- пиримидинсульфонамид
200) N-[3-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил]фенил]-2- бензимидазолсульфонамид
201) N-[3-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил] фенил]-2-хиназолинсульфонамид
202) N-[3-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил]фенил]-6- пуринсульфонамид
203) 5-Циано-N-[3-[циклопропил (5,6,7,8,9,10- гексагидpo-4-гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил]метил]фенил] -N метил-2-пиридинсульфонамид
204) N-[3-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил]метил]фенил]-N-метил- 2-хинолинсульфонамид
205) N-[3-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидpoкcи-2-oкco-2H-циклooктa[b]пиpaн-3-ил)метил]фенил]-N-метил-2-имидазолсульфонамид
206) N-[3-[Циклопропил(5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил]фенил]-N-метил- 2-пиримидинсульфонамид
207) N-[3-[Циклопропил(5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил]фенил]-N-метил-2-бензимидазолсульфонамид
208) N-[3-[Циклопропил(5,6,7,8,9,10-гексагидро-4- гидpoкcи-2-oкco-2H-циклooктa[b]пиpaн-3-ил)метил]фенил]-N- метил-2-хиназолинсульфонамид
209) N-[3-[Циклопропил(5,6,7,8,9,10-гексагидро-4- гидpoкcи-2-oкco-2H-циклooктa[b]пиpaн-3-ил)метил]фенил]-N- метил-6-пуринсульфонамид
210) N-[3-[Циклопропил(5,6,7,8,9,10-гексагидро- 4-гидрокси-2-оксо-2H-циклоокта[b]пиран-3-ил)метил]фенил]-N- метил-4-тиазолсульфонамид
211) N-[3-[Циклопропил(5,6,7,8,9,10-гексагидро-4- гидpoкcи-2-oкco-2H-циклooктa[b]пиpaн-3-ил)метил] фенил]-N-метил-2-пиридинсульфонамид
212) 5-Циано-N-[6-(1'-бензилпропил)-4-гидрокси-3- (1'-циклопропилметилфенил)-2-пирон]-N-метил-2-пиридинсульфонамид
213) N-[6-(1'-Бензилпропил)-4-гидрокси-3-(1'-циклопропилметилфенил) -2-пирон]-N-метил-2-хинолинсульфонамид
214) N-[6-(1'-Бензилпропил)-4-гидрокси-3-(1'-циклопропилметилфенил) -2-пирон]-N-метил-2-имидазолсульфонамид
215) N-[6-(1'-Бензилпропил)-4-гидрокси-3-(1'-циклопропилметилфенил) -2-пирон]-N-метил-2-пиримидинсульфонамид
216) N-[6-(1'-Бензилпропил)-4-гидрокси-3-(1'-циклопропилметилфенил) -2-пирон]-N-метил-2-бензимидазолсульфонамид
217) N-[6-(1'-Бензилпропил)-4-гидрокси-3-(1'-циклопропилметилфенил) -2-пирон]-N-метил-2-хиназолинсульфонамид
218) N-[6-(1'-Бензилпропил)-4-гидрокси-3-(1'-циклопропилметилфенил) -2-пирон]-N-метил-6-пуринсульфонамид
219) N-[6-(1'-Бензилпропил)-4-гидрокси-3-(1'-циклопропилметилфенил) -2-пирон]-N-метил-4-тиазолсульфонамид
220) N-[6-(1'-Бензилпропил)-4-гидрокси-3-(1'-циклопропилметилфенил) -2-пирон]-N-метил-2-пиридинсульфонамид
221) 5-Циано-N-[3-(1'-циклопропилметилфенил)-4- гидроксикумарин]-N-метил-2-пиридинсульфонамид
222) N-[3-(1'-Циклопропилметилфенил)-4-гидроксикумарин] -N-метил-2-хинолинсульфонамид
223) N-[3-(1'-Циклопропилметилфенил)-4-гидроксикумарин]-N-метил-2 -имидазолсульфонамид
224) N-[3-(1'-Циклопропилметилфенил)-4- гидроксикумарин]-N-метил-2-пиримидинсульфонамид
225) N-[3-(1'-Циклопропилметилфенил)-4-гидроксикумарин]-N-метил- 2-бензимидазолсульфонамид
226) N-[3-(1'-Циклопропилметилфенил)-4-гидроксикумарин] -N-метил-2- хинозолинсульфонамид
227) N-[3-(1'-Циклопропилметилфенил)-4-гидроксикумарин]- N-метил-6-пуринсульфонамид
228) N-[3-(1'-Циклопропилметилфенил)-4-гидроксикумарин]-N-метил-4- тиазолсульфонамид
229) N-[3-(1'-Циклопропилметилфенил)-4-гидроксикумарин]-N-метил-2- пиридинсульфонамид
230) 5-Циано-N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил- 5,6-дигидро-2H-пиран-3-ил)пропил]фенил]-N-метил-2- пиридинсульфонамид
231) N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил-5,6- дигидро-2H-пиран-3-ил)пропил]фенил]-N-метил-2- хинолинсульфонамид
232) N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил-5,6- дигидро-2H-пиран-3-ил)пропил]фенил]-N-метил-2- имидазолсульфонамид
233) N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил-5,6- дигидро-2H-пиран-3-ил)пропил]фенил]-N-метил-2-пиримидинсульфонамид
234) N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил-5,6- дигидро-2H-пиран-3-ил)пропил]фенил]-N-метил-2-бензимидазолсульфонамид
235) N-[3-[1-[4-Гидрокси-2-оксо-6,6-дифенэтил-5,6- дигидро-2H-пиран-3-ил)пропил]фенил]-N-метил-2-хинозолинсульфонамид
236) N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил-5,6- дигидро-2H-пиран-3-ил)пропил]фенил]-N-метил-6-пуринсульфонамид
237) N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил-5,6-дигидро- 2H-пиран-3-ил)пропил]фенил]-N-метил-4-тиазолсульфонамид
238) N-[3-[1-(4-Гидрокси-2-оксо-6,6-дифенэтил-5,6- дигидро-2H-пиран-3-ил)пропил]фенил]-N-метил-2-пиридинсульфонамид
Пример 239. N-[4-[Циклoпpoпил(5,6,7,8,9,10- гексагидро-4-гидpoкcи-2-oкco-2H-циклooктa[b] пиpaн-3-ил)метил] фенил]-2-пиридинсульфонамид (формула P-2, R обозначает 2-пиридил). См. Схему Р.
3-[(3-Аминофенил)циклопропилметил] -5,6,7,8,9,10- гексагидpo-4-гидpoкcи-2H-циклooктa[b] пиpaн-2-oн Препарата 66 (100 мг) растворяют в хлористом метилене (3 мл) и добавляют пиридин (70 мкл). Добавляют 2-пиридилсульфохлорид (52 мг) и полученный раствор перемешивают при температуре 25oC в течение двух часов. Добавляют хлороформ (25 мл), промывают 1N (20 мл) раствором соляной кислоты и сушат над сульфатом магния. Растворитель отгоняют, получая смолу розового цвета, которую очищают методом испарительной колоночной хроматографии на силикагеле, элюируя 60%-ным раствором этилацетата в гексане, и получают целевое соединение в виде твердого вещества белого цвета (80 мг).
Вещество обладает следующими физическими характеристиками:
Масс-спектр: m/z 480, 339, 338, 186, 145, 144, 132, 130, 78, 55
Пример 240. N-[4-[Циклопропил (5,6,7,8,9,10- гексагидро-4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил) метил]фенил]-4-пиридилсульфонамид (формула Р-2, R обозначает 4-пиридил). См. Схему Р.
Целевое соединение получают по методике, приведенной в Примере 239, в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр: m/z 480, 338, 207, 186, 145, 144, 117, 79, 78, 55.
Пример 241. N-[4-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)метил] фенил]-5- цианопиридин-2-ил-сульфонамид (формула Р-2: R обозначает 5-цианопиридин-2-ил). См. Схему Р.
Целевое соединение получают по методике, приведенной в Примере 239.
Пример 242. N-[4-[Циклопропил(5,6,7,8,9,10-гексагидро- 4-гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)метил] фенил] -2- пиразинилсульфонамид (формула Р-2: R обозначает 2-пиразинил) См. Схему Р.
Целевое соединение получают по методике, приведенной в Примере 239.
Пример 243. N-[4-[Циклoпpoпил(5, 6,7,8,9,10-гексагидро-
4-гидpoкcи-2-oкco-2H-циклooктa[b] пиpaн-3-ил)метил] фенил] -2- пиримидинилсульфонамид (формула Р-2: R обозначает 2-пиримидинил). См. Схему Р.
Целевое соединение получают по методике, приведенной в Примере 239.
Пример 244. N-[4-[Циклопропил (5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)метил] фенил] - -4,6-диметилпиримидин-2-ил-сульфонамид (формула Р-2: R обозначает 4,6-диметилпиримидин-2-ил) См. Схему Р.
Целевое соединение получают по методике, приведенной в Примере 239.
Пример 245. N-[4-[Циклопропил(5,6,7,8,9,10-гексагидро-4- гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)метил]фенил]-4- метилпиримидин-3-ил-сульфонамид (формула Р-2: R обозначает 4-метилпиримидин-2-ил) См. Схему Р.
Целевое соединение получают по методике, приведенной в Примере 239.
Препарат 69. 6,6-Бис-(2-циклопропилэтил)дипидропиран-2,4- дион (формула Q-2) См. Схему Q.
К суспензии 150 мг гидрида натрия (60%-ная дисперсия в минеральном масле) в 4 мл сухого тетрагидрофурана в атмосфере аргона при температуре 0oC по каплям добавляют 0,38 мл метилового эфира ацетоуксусной кислоты. Через 20 минут добавляют 2,3 мл бутиллития (1,6 М раствор в гексане). Еще через 10 минут добавляют раствор 0,48 г соединения формулы Q-1 (получают как описано в Препарате 79 (формула S-4, см. Схему S)) в 3 мл тетрагидрофурана. Реакционную смесь перемешивают в течение часа и выливают в смесь этилацетата и разбавленной соляной кислоты. Органический слой отделяют, водную фазу дополнительно дважды экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток разбавляют 5 мл метанола и к полученному раствору добавляют 12 мл воды, а затем 3,0 мл 1 М водного раствора гидроксида натрия. Интенсивно перемешивают в течение двух часов и метанол отгоняют при пониженном давлении. Водную фазу промывают один раз диэтиловым эфиром и эфирный слой декантируют. Водную фазу охлаждают до 0oC и подкисляют разбавленной соляной кислотой. Полученный осадок экстрагируют четырьмя порциями дихлорметана. Органические вытяжки объединяют, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток растворяют в смеси диэтиловый эфир - гексан и раствор охлаждают, получая 0,42 г целевого продукта в виде твердого вещества желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,0, 0,4, 0,6, 1,2, 1,7, 2,6, 3,4 м.д.
Препарат 70. 6,6-Бис-(2-циклопропилэтил)-5,6-дигидро-4- гидрокси-3-[1-(3-нитрофенил)пропил]пиран-2-он (формула Q-3). См. Схему Q.
К перемешиваемому раствору 0,41 г целевого продукта Препарата 69 (формула Q-2) и 0,25 г 3-нитробензальдегида в 5 мл сухого тетрагидрофурана добавляют раствор 0,44 г трихлорида алюминия в 4,5 мл тетрагидрофурана. Через два часа к реакционной смеси добавляют 1,0 г декагидрата карбоната натрия, перемешивают в течение 10 минут, разбавляют смесь диэтиловым эфиром и, наконец, добавляют сульфат магния. Полученную смесь отфильтровывают через целит и трижды промывают на фильтрат диэтиловым эфиром. Фильтрат объединяют и упаривают при пониженном давлении. К полученному остатку добавляют 103 мг комплекса бромид меди (1) - диметилсульфид и 5 мл сухого тетрагидрофурана в атмосфере аргона. К реакционной смеси по каплям в течение 1,5 часа добавляют 2,5 мл триэтилалюминия (1,0 М раствор в гексане). К реакционной смеси осторожно добавляют лед и выливают в смесь диэтилового эфира и разбавленной соляной кислоты. Органический слой отделяют, водную фазу дополнительно трижды эктрагируют диэтиловым эфиром. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии (элюируют смесью, содержащей 20-40% - этилацетата в гексане), и получают 0,44 г целевого продукта в виде пенообразного вещества темно-коричневого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,0, 0,4, 0,6, 1,0, 1,2, 1,7-1,9, 2,0-2,4, 2,6, 4,2, 7,5, 7,8, 8,1, 8,3 м.д.
Препарат 71. 3-[1-(3-Аминофенил)пропил]-6,6-бис- (2-циклопропилэтил)-5,6-дигидро-4-гидроксипиран-2-он (формула Q-4). См. Схему Q.
К раствору 0,44 г целевого продукта Препарата 70 (формула Q-3) в 6 мл метанола добавляют 0,65 г формиата аммония и 50 мг 10%-ного палладия на угле. Полученную суспензию черного цвета перемешивают в атмосфере аргона в течение трех часов и отфильтровывают через целит, промывая на фильтре метанолом. Фильтраты объединяют и растворитель упаривают при пониженном давлении. Остаток растирают с четырьмя порциями дихлорметана. Полученные дихлорметановые вытяжки объединяют, упаривают при пониженном давлении и получают 0,37 г целевого соединения в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,08 (50% диэтилового эфира в гексане).
Пример 246. N-[3-[1-[6,6-Биc-(2-циклoпpoпилэтил)-5,6- дигидро-4-гидрокси-2-оксо-2H-пиран-3-ил] пропил]фенил]-1- метил-1H-имидазол-4-сульфонамид (формула Q-5, R1 обозначает 1-метилимидазол-4-ил). См. Схему Q.
В колбу, содержащую 57 мг целевого продукта Препарата 71 (формула Q-4) и 24 мкл пиридина в 1,0 мл дихлорметана добавляют 27 мг 1-метил-1H-имидазол-4-сульфохлорида. Через 6 часов реакционную смесь упаривают при пониженном давлении. Пиридин удаляют двоектарной азеотропной перегонкой с толуолом. Остаток очищают методом испарительной колоночной хроматографии (элюируют смесью, содержащей от 2 до 6% метанола в дихлорметане), и получают 51 мг целевого продукта в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,0, 0,4, 0,6, 0,9, 1,1-1,4, 1,7-2,2, 2,5, 3,7, 3,95, 6,9, 7,1, 7,4, 7,5 м.д.
Масс-спектр высокого разрешения (FAB): 528,2537
Пример 247. N-[3-(1-[6,6-Биc-(2-циклопропилэтил)-5,6- дигидро-4-гидрокси-2-оксо-2H-пиран-3-ил]пропил)фенил]-5- циано-2-пиридинсульфонамид (формула Q-5, R1 обозначает 5-циано-2-пиридил). См. Схему Q.
В соответствии с общей методикой сульфонилирования, описанной в Примере 246, вводят во взаимодействие 57 мг амина Препарата 71 (формулы Q-4) с 30 мг 5-циано-2-пиридин-2-сульфохлорида. Очищают методом испарительной колоночной хроматографии на силикагеле (элюируют смесью, содержащей от 1 до 3% метанола в дихлорметане) и получают 62 мг целевого продукта в виде пенообразного вещества темно-коричневого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,0, 0,4, 0,6, 0,9, 1,1-1,4, 1,6-2,2, 2,5, 3,95, 6,9-7,2, 8,0, 8,2, 9,0 м.д.
Масс-спектр высокого разрешения (FAB): 550,2370
Препарат 72. 3-Аминопропиофенон (формула R-2). См. Схему R.
К раствору 3-нитропропиофенона (формула R-1) (1,79 г) в диэтиловом эфире добавляют в качестве катализатора 5%-ный палладий на угле (0,29 г). Полученную суспензию помещают в атмосферу водорода и перемешивают в течение 6 часов. Реакционную смесь отфильтровывают через целит и промывают на фильтре дополнительным количеством диэтилового эфира. Фильтраты объединяют и упаривают при пониженном давлении, получая 1,49 г целевого продукта в виде легкоплавкого вещества бледно-желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,2, 3,0, 6,9, 7,2-7,4 м.д.
TCX: Rf 0,45 (33% этилацетата в гексане).
Препарат 73. 1-[3-(Дибензиламино)фенил] пропан-1-он (формула R-3). См. Схему R.
К раствору целевого продукта Препарата 72 формулы R-2 (1,5 г) в дихлорметане (50 мл) добавляют ди-изо-пропилэтиламин (6,0 мл), а затем бромистый бензил (3,6 мл). Перемешивают в течение 6 часов и реакционную смесь оставляют кипятиться на ночь. Охлаждают до комнатной температуры, разбавляют диэтиловым эфиром (50 мл) и последовательно промывают разбавленным водным раствором бисульфата калия, водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушат над сульфатом натрия и упаривают при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии на силикагеле (элюируют смесью, содержащей от 5% до 20% этилацетата в гексане) и получают 2,38 г целевого продукта в виде твердого вещества светло-желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,1, 2,9, 4,7, 6,9, 7,2-7,4 м.д.
Элементный анализ, найдено: С, 83,88; H, 7,03; N, 4,20.
Масс-спектр (El): 329
Препарат 74. 6-[3-(Дибензиламино)фенил]дигидропиран-2,4-он (формула R-4). См. Схему R.
В соответствии с общей методикой формирования дигидропиранового кольца, описанной в Препарате 69, вводят во взаимодействие 1,96 г соединения формулы R-3 Препарата 73 с дианионом метилового эфира ацетоуксусной кислоты и циклизуют с образованием 0,76 г целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8, 1,9, 2,6-2,9, 3,1-3,2, 4,7, 6,5-6,7, 7,1-7,4 м.д.
Масс-спектр (E1): 413
Препарат 75. 6-[3-(Дибeнзилaминo)фeнил] -5,6-дигидpo-6- этил-4-гидрокси-3-[1-(3-нитрофенил)пропил]пиран-2-он (формула R-5). См. Схему R.
В соответствии с общей методикой, приведенной для Препарата 70, проводят катализируемую трихлоридом алюминия конденсацию 3-нитробензальдегида с соединением формулы R-4 Препарата 74 (727 мг) с последующим катализируемым мелью сопряженным присоединением триэтилалюминия и получают 800 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,6, 1,6-2,1, 2,8, 3,4, 3,8, 4,4, 6,4-6,6, 6,8-7,4, 7,7-8,0 м.д.
Масс-спектр (E1): 576
Препарат 76. 6-(3-Аминофенил)-3-[1-(3-аминофенил)пропил]- 6-этил-5,6-дигидро-4-гидроксипиран-2-он (формула R-6). См. Схему R.
В соответствии с общей методикой, приведенной для Препарата 71, проводят каталитическое гидрирование соединения формулы R-5 Препарата 75 (114 мг) с использованием формиата аммония и палладия на угле и получают 61 мг целевого соединения. В качестве альтернативы соединение формулы R-5 Препарата 75 (114 мг) восстанавливают водородом в присутствии палладия на угле и получают 72 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,6-0,9, 1,8-2,1, 3,0, 3,8, 6,4-6,6, 6,95, 7,1 м.д.
TCX: Rf 0,40 (10% метанола в дихлорметане).
Пример 248. N-(3-[1-[6-Этил-5,6-дигидpo-4-гидpoкcи-6- [3([(1-метил-1H-имидазол-4-ил)сульфонил] амино)фенил] -2- 2Н-пиран-3-ил]пропил]фенил)-1-метил-1H-имидазол-4-сульфонамид (формула R-7: R1 обозначает 1-метилимидазол-4-сульфонил). См. Схему R.
В соответствии с общей методикой сульфонилирования, описанной в Примере 246, вводят во взаимодействие соединение формулы R-6 Препарата 76 (61 мг) с 1-метил-1H-имидазол-4- сульфохлоридом и получают 59 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,3-0,7, 1,6 -2,0, 3,0, 3,4-3,7, 6,7-7,5 м.д.
Масс-спектр высокого разрешения (FAB): 655,1995.
Пример 249. 5-Циано-N-(3-[1-(6-[3-([(5-Циано-2-пиридинил)сульфонил]амино) фенил] -6-этил-5,6-дигидро-4-гидрокси-2-оксо-2H-пиран-3-ил) пропил] фенил)-2-пиридинсульфонамид (формула R-7: R обозначает 5-циано-2-пиридил). См. Схему R.
В соответствии с общей методикой сульфонилирования, описанной в Примере 246, вводят во взаимодействие соединение формулы R-6 Препарата 76 (66 мг) с 5-циано-2-пиридинсульфохлоридом и получают 40 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,3-0,9, 1,3, 1,6-2,0, 3,0, 3,7, 6,6-7,2, 7,9-8,2, 8,8-9,0 м.д.
Масс-спектр высокого разрешения (FAB): 699,1679.
Препарат 77. Амид N-метокси-N-метил-4-пентеновой кислоты (формула S-2). См. Схему S.
К суспензии 4-пентеновой кислоты (формула S-1) (2,00 г) и гидрохлорида N, O-диметилгидроксиламина (2,15 г) в дихлорметане (50 мл) при температуре 0oC добавляют ди-изо-пропил-этиламин (11,5 мл), а затем бис(2-оксо-3-оксазолидинил)фосфонохлорид (5,60 г). Оставляют перемешиваться на ночь, а затем упаривают реакционную смесь при пониженном давлении. Остаток выливают в смесь разбавленного раствора бисульфата калия и диэтилового эфира. Органический слой отделяют и водную фазу дополнительно дважды экстрагируют диэтиловым эфиром. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом натрия и упаривают при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии на силикагеле (элюируют смесью, содержащей от 50 до 80% диэтилового эфира в гексане) и получают 2,58 г целевого продукта в виде масла темно-коричневого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 2,3-2,6, 3,20, 3,70, 4,9-5,1, 5,75-5,95 м.д.
TCX: Rf 0,17 (25% диэтилового эфира в гексане).
Препарат 78. Нона-1,8-диен-5-он (формула S-3). См. Схему S.
В осушенную открытым пламенем колбу, содержащую раствор целевого продукта Препарата 77 (формула S-2) (1,45 г) в сухом тетрагидрофуране (10 мл) в атмосфере аргона при 0oC помещают 3-бутенил-1-магнийбромид (20 мл, 1 М раствор в тетрагидрофуране; получение этого реактива Гриньяра из металлического магния и 4-бром-1-бутена приводится в J. Org. Chem., (1978) 43: 4247). Перемешивают в течение часа при температуре 0oC и дают реакционной смеси нагреться до комнатной температуры. Реакционную смесь выливают в смесь разбавленного раствора бисульфата калия и диэтилового эфира. Органический слой отделяют и водную фазу дополнительно трижды экстрагируют диэтиловым эфиром. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над сульфатом натрия и осторожно упаривают при пониженном давлении. Полученный жидкий остаток очищают перегонкой и получают 1,32 г целевого соединения в виде масла темно-коричневого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 2,3, 2,5, 5,0, 5,7-5,9 м.д.
TCX: Rf 0,66 (25% диэтилового эфира в гексане).
Препарат 79. 1,5-Дициклопропилпентан-3-он (формула S-4). См. Схему S.
В осушенную открытым пламенем колбу, снабженную обратным холодильником, содержащую металлический цинк (8,0 г) и хлорид метид (1) (1,25 г), в атмосфере аргона добавляют раствор целевого продукта Препарата 78 (формула S-3) (1,32 г) в сухом диэтиловом эфире (10 мл). В полученную суспензию вводят дииодметан (5,0 мл), реакционную колбу помещают в ультразвуковую ванну (Branson 2200) с температурой 40oC и подвергают воздействию ультразвука. Через два часа нагревание прекращают и оставляют под ультразвуком на ночь. Реакционную смесь разбавляют диэтиловым эфиром (50 мл), охлаждают до 0oC и добавляют избыток водного раствора хлорида аммония. Энергично перемешивают в течение 0,25 часа, смесь отфильтровывают и слои разделяют. Водную фазу дополнительно дважды экстрагируют диэтиловым эфиром. Органические вытяжки объединяют и последовательно промывают насыщенным водным раствором тиосульфата натрия, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над сульфатом магния и осторожно упаривают при пониженном давлении. Полученный остаток очищают методом испарительной колоночной хроматографии на силикагеле (элюируют смесью, содержащей от 5 до 20% диэтилового эфира в гексане) и получают 0,48 г целевого продукта в виде масла.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,0, 0,4, 0,65, 1,45, 2,50 м.д.
TCX: Rf 0,44 (10% диэтилового эфира в гексане).
Препарат 80. 3-[2,2-Диметил-1-(3-нитрофенил)пропил] - 5,6-дигидро-4-гидрокси-6-фенэтил-6-пропилпиран-2-он (формула T-3). См. Схему T.
В осушенную открытым пламенем колбу, содержащую суспензию 977 мг активированного металлического цинка в 1,0 мл сухого тетрагидрофурана, в атмосфере аргона добавляют 40 мкл 1,2-дибромэтана. Реакционную смесь помещают в ультразвуковую ванну (Branson 2200) с температурой 45oC и при перемешивании подвергают воздействию ультразвука. Через 10 минут добавляют 0,25 мл хлортриметилсилана (1,0 М раствор в тетрагидрофуране). Через 10 минут смесь разбавляют 4 мл тетрагидрофурана и по каплям добавляют 1,50 мл 2-иод-2-метилпропана. Смесь перемешивают при воздействии ультразвука при температуре 45oC еще в течение трех часов и охлаждают до комнатной температуры без перемешивания. В отдельной колбе на масляной бане с температурой 110oC нагревают в вакууме 954 мг безводного хлорида лития. Колбу с хлоридом лития охлаждают до комнатной температуры, продувают аргоном и помещают 1,01 г цианида меди (1), а затем 10 мл тетрагидрофурана. Перемешивают 15 минут при комнатной температуре, охлаждают смесь LiCl-CuCN до температуры минус 30oC и с помощью канюли добавляют к цикрорганической смеси, полученной, как указано ранее, в первой колбе. Реакционную смесь нагревают с минус 30oC до 0oC, перемешивают в течение 10 минут, а затем охлаждают до температуры минус 78oC. Получение этого металлоорганического реагента проводят в соответствии с методикой (Org. Syn., (1991) 70: 195-203), описанной для синтеза родственных соединений.
В отдельной колбе к перемешиваемому раствору 1,56 г 6-фенэтил-6-пропилдигидропиран-2,4-диона формулы T-2 (получают из соединения формулы T-1 как описано выше для Препарата 17) и 915 мг 3-нитробензальдегида в 22 мл сухого тетрагидрофурана добавляют раствор 1,60 г трихлорида алюминия в 14 мл тетрагидрофурана. Перемешивают в течение двух часов и добавляют 3,6 г декагидрата карбоната натрия, перемешивают 5 минут, разбавляют диэтиловым эфиром и, наконец, добавляют сульфат магния. Полученную смесь отфильтровывают через целит, промывая на фильтре диэтиловым эфиром. Фильтраты объединяют и упаривают при пониженном давлении. Полученный остаток растворяют в токе аргона в 9 мл сухого тетрагидрофурана и с помощью канюли добавляют к охлажденному (минус 78oC) раствору металлоорганического реагента, полученного как указано ранее. Перемешивают в течение 0,5 часа и нагревают смесь до 0oC. Перемешивают при указанной температуре в течение 0,5 часа, выливают в холодный разбавленный раствор хлорида аммония и подкисляют водную фазу разбавленной соляной кислотой. К смеси приливают этилацетат и отфильтровывают через целит, промывая на фильтре этилацетатом. Слои разделяют и водную фазу дополнительно трижды экстрагируют этилацетатом. Органические вытяжки объединяют и промывают насыщенным водным раствором тиосульфата натрия и насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Полученный остаток очищают методом испарительной колоночной хроматографии на силикагеле (элюируют смесью, содержащей от 30 до 50% этилацетата в гексане) и получают 1,73 г целевого продукта в виде пенообразного вещества темно-коричневого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,9, 1,1, 1,3, 1,6-2,0, 2,5-2,8, 4,3, 6,9-7,3, 7,8, 8,0, 8,5 м.д.
Масс-спектр высокого разрешения (FAB): 452,2449.
Препарат 81. 3-[1-(3-Аминофенил)-2,2-диметилпропил] -5,6- дигидро-4-гидрокси-6-фенэтил-6-пропилпиран-2-он (формула T-4). См. Схему T.
К раствору 1,72 г целевого продукта Препарата 80 (формула T-3) в 25 мл метанола добавляют 3,0 г формиата аммония и 400 мг 10%-ного палладия на угле. Полученную суспензию черного цвета перемешивают в атмосфере аргона в течение трех часов и отфильтровывают через целит, промывая на фильтре метанолом. Фильтраты объединяют и растворитель упаривают при пониженном давлении. Остаток последовательно растирают с несколькими порциями дихлорметана. Полученные дихлорметановые вытяжки объединяют, упаривают при пониженном давлении и остаток очищают методом испарительной колоночной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане, и получают 1,48 г целевого соединения в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-0,9, 1,1, 1,3-2,6, 4,2, 6,55, 6,9-7,3 м.д.
Масс-спектр высокого разрешения (FAB): 422,2686.
Пример 250. N-[3-(1-[5,6-Дигидpo-4-гидpoкcи-2- oкco-6-(2-фeнэтил)-6-пропил-2H-пиран-3-ил] -2,2-диметилпропил) фенил] -1-метил-1H-имидазол-4-сульфонамид (формула T-5: R обозначает 1-метилимидазол-4-ил). См. Схему T.
К раствору 1,48 г целевого продукта Препарата 81 (формула T-4) в 25 мл дихлорметана при температуре 0oC добавляют 0,57 мл пиридина, а затем 632 мг 1-метил-1H-имидазол-4-сульфохлорида. Через 3 часа реакционную смесь нагревают до комнатной температуры и упаривают при пониженном давлении. Пиридин удаляют двоекратной азеотропной перегонкой с толуолом. Остаток очищают методом испарительной колоночной хроматографии (элюируют смесью, содержащей от 2 до 6% метанола в дихлорметане) и получают 1,7 г целевого продукта в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 0,97, 1,35-2,0, 1,6-2,0, 2,5-2,7, 3,6, 4,1, 6,9-7,5 м.д.
Масс-спектр высокого разрешения: 566,2684.
Следующие соединения являются индивидуальными стереоизомерами этого соединения:
N-[3-(1(S)-[5,6-Дигидро-4-гидрокси-2-оксо-6(R)- (2-фенэтил)-6-пропил-2H-пиран-3-ил] -2,2-диметилпропил) фенил]-1-метил-1H-имидазол-4-сульфонамид (формула KK-8, где R4 обозначает 1-метил-1H-имидазол-4-ил). См. Схему KK.
N-[3-(1(R)-[5,6-Дигидро-4-гидрокси-2-оксо-6(R)- (2-фенэтил)-6-пропил-2H-пиран-3-ил] -2,2-диметилпропил)фенил] -1 -метил-1H-имидазол-4-сульфонамид (формула LL-8, где R4 обозначает 1-метил-1H-имидазол-4-ил). См. Схему LL.
N-[3-(1(S)-[5,6-Дигидро-4-гидрокси-2-оксо-6(S)- (2-фенэтил)-6-пропил-2H-пиран-3-ил] -2,2-диметилпропил) фенил]-1-метил-1H-имидазол-4-сульфонамид (формула ММ-8, где R4 обозначает 1-метил-1H-имидазол-4-ил). См. Схему ММ.
N-[3-(1(R)-[5,6-Дигидро-4-гидрокси-2-оксо-6(S)-(2-фенэтил)-6-пропил- 2H-пиран-3-ил] -2,2-диметилпропил)фенил] -1-метил-1H-имидазол-4-сульфонамид (формула NN-8, где R4 обозначает 1-метил-1H-имидазол-4-ил). См. Схему NN.
Пример 251. 5-Циано-N-[3-(1-[5,6-дигидро-4-гидрокси-2- оксо-6-(2-фенэтил)-6-пропил-2H-пиран-3-ил] -2,2-диметилпропил)фенил] -2- пиридинсульфонамид (формула T-5: R1 обозначает 5-циано-2-пиридил). См. Схему T.
В соответствии с общей методикой сульфонилирования, описанной в Примере 250, вводят во взаимодействие 42 мг амина Препарата 81 (формула T-4) с 20 мг 5-циано-2-пиридинсульфохлоридом и после очистки методом испарительной колоночной хроматографии на силикагеле (элюируют смесью, содержащей от 1 до 3% метанола в дихлорметане) получают 56 мг целевого продукта в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 0,92, 1,35, 1,6-2,0, 2,5-2,7, 4,0, 6,9-7,4, 8,0, 8,9 м.д.
Масс-спектр высокого разрешения: 588,2532.
Препарат 82. N-Метокси, N-метил-3-(4-фторфенил)пропионамид (формула U-2). См. Схему U.
К охлажденному (0oC) перемешиваемому раствору 5,0 г 3-(4-фторфенил)пропионовой кислоты формулы U-1, 3,2 г гидрохлорида N,O-диметилгидроксиламина и 11,4 мл ди-изо-пропилэтиламина в 40 мл дихлорметана медленно добавляют раствор 5,0 мл диэтилового эфира цианофосфоновой кислоты в 10 мл дихлорметана. Перемешивают в течение 18 часов и упаривают раствор при пониженном давлении. Остаток растворяют в этилацетате, промывают разбавленной соляной кислотой, водой, раствором бикарбоната натрия, насыщенным раствором соли и сушат над сульфатом магния. Растворитель отгоняют при пониженном давлении и получают 6,94 г целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 2,7, 2,9, 3,17, 3,61, 7,0, 7,2 м.д.
ИК-спектр: 1665, 1511, 1222, 1033, 990 см-1.
TCX: Rf 0,34 (5% этилацетата в дихлорметане).
Препарат 83. 1-(4-Фторфенил)-3-гексанон (формула U-3). См. Схему U.
К перемешиваемому раствору 4,68 г целевого продукта Препарата 82 (формула U-2) в 25 мл сухого тетрагидрофурана в токе аргона, охлажденному до минус 15oC, добавляют 17 мл 1 М раствора пропилмагнийхлорида в эфире. Полученную твердую массу нагревают до 0oC, выдерживают при этой температуре в течение 90 минут и выливают в смесь эфира и разбавленной соляной кислоты. Водную фазу дополнительно экстрагируют эфиром, органические вытяжки объединяют, промывают насыщенным раствором соли и сушат над сульфатом магния. Растворитель отгоняют при атмосферном давлении и остаток очищают перегонкой (температура около 160oC, остаточное давление 13 мм рт.ст.) и получают 3,51 г целевого соединения в виде бесцветной жидкости.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,89, 1,6, 2,36, 2,7, 2,9, 6,9, 7,1 м.д.
ИК-спектр: 2965, 1714, 1511, 1222 см-1.
Препарат 84. 5,6-Дигидро-4-гидрокси-6-(2-(4-фторфенил) этил)-6-пропил-2H-пиран-2-он (формула U-4). См. Схему U.
К охлажденной (0oC) суспензии 950 мг гидрида натрия (60%-ная дисперсия в минеральном масле) в 30 мл сухого тетрагидрофурана в атмосфере аргона по каплям добавляют 2,3 мл метилового эфира ацетоуксусной кислоты. Через 5 минут добавляют 13,5 мл бутиллития (1,6 М раствор в гексане). Еще через 5 минут добавляют раствор 3,51 г целевого продукта Препарата 83 (формула U-3) в 4 мл тетрагидрофурана. Реакционную смесь перемешивают в течение часа и выливают в смесь этилацетата и холодного раствора разбавленной соляной кислоты. Органический слой отделяют, водную фазу дополнительно дважды экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли и сушат над сульфатом магния. Растворитель упаривают при пониженном давлении и получают промежуточный сложный эфир, обладающий следующими физическими характеристиками:
TCX Rf 0,45 (50% этилацетата в гексане).
Сложный эфир перемешивают в течение 90 минут в 20 мл 1 М раствора гидроксида натрия, 80 мл воды и 40 мл метанола, а затем метанол отгоняют при пониженном давлении. Водную фазу промывают один раз диэтиловым эфиром и эфирный слой декантируют, а водную фазу подкисляют разбавленной соляной кислотой. Полученный осадок экстрагируют четырьмя порциями дихлорметана. Органические вытяжки объединяют, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток растворяют в смеси 1:1 диэтиловый эфир - гексан и раствор охлаждают, получая кристаллы, которые отфильтровывают, промывают смесью эфир - гексан и сушат в вакууме, получая 3,24 г целевого соединения с т.пл. 113-114,5oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,96, 1,4, 1,8, 2,0, 2,5, 2,7, 7,0, 7,1 м.д.
ИК-спектр: 2962, 1655, 1604, 1510, 1221 см-1.
Элементный анализ, найдено: С, 68,85; H, 6,99.
Масс-спектр: М+ 278
TCX: Rf 0,44 (5% метанола в дихлорметане).
Препарат 85. 3-(1-(3-Бензилоксикарбониламинофенил)-2,2- диметилпропил)-5,6-дигидро-4-гидрокси-6-(2-(4-фторфенил) этил)-6-пропил-2H-пиран-2-он (формула U-6: R6 обозначает трет-бутил). См. Схему U).
К перемешиваемому раствору 3,06 г целевого продукта Препарата 84 (формула U-4) и 2,81 г целевого продукта Препарата 6 (формула B-2) в 30 мл сухого тетрагидрофурана добавляют 2,93 г трихлорида алюминия в 20 мл тетрагидрофурана. Перемешивают в течение двух часов, добавляют 6,4 г декагидрата карбоната натрия, перемешивают в течение пяти минут и смесь отфильтровывают через целит, промывая на фильтре эфиром. Растворитель отгоняют при пониженном давлении и получают промежуточное бензилиденовое производное формулы U-5.
К полученному веществу добавляют 1,13 г комплекса бромид меди (1) - диметилсульфид и 30 мл тетрагидрофурана, смесь охлаждают до 0oC и по каплям добавляют 18,1 мл трет-бутилмагнийхлорида (1,0 М раствор в тетрагидрофуране). Перемешивают в течение 10 минут и выливают в смесь диэтилового эфира и разбавленной соляной кислоты. Органический слой отделяют, промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии (элюируют смесью, содержащей 30-35% этилацетата в гексане) и получают 1,83 г целевого продукта в виде пенообразного вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,87, 1,1, 1,3, 1,6-2,2, 2,5, 5,12, 6,8-7,6 м.д.
Масс-спектр высокого разрешения: 574,2955
TCX: Rf 0,29 (35% этилацетата в гексане).
Препарат 86. 3-(1-(3-Аминофенил)-2,2-диметилпропил)-5,6- дигидро-4-гидрокси-6-(2-(4-фторфенил)этил)-6-пропил-2H-пиран- 2-он (формула U-7: R1 обозначает трет-бутил). См. Схему U.
Смесь 1,83 г целевого продукта Препарата 85 (формула U-6), 2,0 г формиата аммония и 400 мг 10%-ного палладия на угле в 25 мл метанола перемешивают в токе аргона в течение 90 минут, а затем отфильтровывают через целит. Растворитель упаривают при пониженном давлении и остаток очищают методом испарительной колоночной хроматографии, элюируя 10%-ным раствором этилацетата в дихлорметане, и получают 1,24 г целевого продукта в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
TCX: Rf 0,28 (10% этилацетата в дихлорметане).
Соединение формулы U-7, где R1 обозначает этил, получают из соединения формулы U-4 по методике, аналогичной получению соединения формулы U-7, где R1 обозначает трет-бутил (Препараты 85 и 86).
Пример 252. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо-6- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -1-метил-1H- имидазол-4-сульфонамид (формула U-8: R1 обозначает трет-бутил, R2 обозначает 1-метилимидазол-4-ил). См. Схему U.
К охлажденному (0oC) раствору 88 мг целевого продукта Препарата 86 (формула U-7) и 32 мкл пиридина в 0,5 мл дихлорметана добавляют 36 мг 1-метил-1H-имидазол-4-сульфохлорида. Через 90 минут реакционную смесь очищают методом испарительной колоночной хроматографии (элюируют смесью, содержащей от 3-4% метанола в дихлорметане), и получают 112 мг целевого продукта в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 0,96, 1,3, 1,7, 2,35, 2,5, 3,6, 3,7, 6,8-7,5 м.д.
Масс-спектр высокого разрешения: 583,2525.
TCX: Rf 0,31 (5% метанола в дихлорметане).
Пример 253. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо-6- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2- диметилпропил} фенил] -5-цианопиридин-2-сульфонамид (формула U-8: R1 обозначает трет-бутил, R2 обозначает 5-цианопиридин-2-ил). См. Схему U.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, вводят во взаимодействие 88 мг амина Препарата 86 (формула U-7, R1 обозначает трет-бутил) с 5-циано-пиридин-2-сульфохлоридом и после очистки методом испарительной колоночной хроматографии на силикагеле (элюируют смесью, содержащей 10-15% этилацетата в дихлорметане) получают 107 мг целевого продукта в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,92, 1,3, 1,7, 2,5, 6,8-7,5, 8,0, 8,9 м.д.
Масс-спектр высокого разрешения: 606,2423.
Пример 254. N-[3-{ 1-(4-Гидpoкcи-5,6-дигидpo-2-oксо-6- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил} фенил] -1-метил-1H-имидазол-4-сульфонамид (формула U-8: R1 обозначает этил, R2 обозначает 1-метилимидазол-4-ил). См. Схему U.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, вводят во взаимодействие 82 мг амина формулы U-7, где R1 обозначает этил, с 1-метил-1H-имидазол- 4-сульфохлоридом и после очистки методом испарительной колоночной хроматографии на силикагеле (элюируют смесью, содержащей 3% метанола в дихлорметане) получают 101 мг целевого продукта в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8, 1,3, 1,6-2,2, 2,5, 3,5, 3,6, 3,9, 6,8-7,4 м.д.
Масс-спектр высокого разрешения: 555,2192.
TCX: Rf 0,29 (5% метанола в дихлорметане).
Пример 255. N-[3(-1-(4-Гидрокси-5,6-дигидро-2-оксо-6- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил)фенил]-5- цианопиридин-2-сульфонамид (формула U-8: R1 обозначает этил, R2 обозначает 5-цианопиридин-2-ил). См. Схему U.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, вводят во взаимодействие 82 мг амина формулы U-7, где R1 обозначает этил, с 5-цианопиридин-2-сульфохлоридом и после очистки методом испарительной колоночной хроматографии на силикагеле (элюируют смесью, содержащей 10-15% этилацетата в дихлорметане) получают 101 мг целевого продукта в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,9, 1,3, 1,6-2,2, 2,5, 3,9, 6,9-7,3, 8,0, 8,1, 8,9 м.д.
Масс-спектр высокого разрешения: 557,2059.
TCX: Rf 0,44 (20% этилацетата в дихлорметане).
Препарат 87. 1,5-Бис-(4-фторфенил) пента-1,4-диен-3-он (формула V-2). См. Схему V.
К энергично перемешиваемому при комнатной температуре раствору 10 г гидроксида натрия в 100 мл воды и 80 мл этанола добавляют смесь 12,4 г 4-фторбензальдегида формулы V-1 и 2,9 г ацетона. Через 45 минут образовавшийся осадок отфильтровывают, тщательно промывают водой и сушат в вакууме. Перекристаллизовывают из смеси этилацетат/гексан и получают 10,7 г целевого соединения в виде пластинок светло-желтого цвета с т.пл. 152-154oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 6,9-7,3, 7,6-7,7 м.д.
ИК-спектр: 1653, 1587, 1508, 984, 835 см-1.
Масс-спектр: М+ 270
Элементный анализ, найдено: С, 75,40; H, 4,41.
TCX: Rf 0,35 (дихлорметан).
Препарат 88. 1,5-Бис-(4-фторфенил)пентан-3-он (формула V-3). См. Схему V.
К раствору 5,41 г диенона Препарата 87 (формула V-2) в 10 мл тетрагидрофурана и 50 мл метанола добавляют 2,0 г магниевых стружек. Для поддержания температуры около комнатной применяют водяную баню. После того как весь магний вступит в реакцию, выливают реакционную смесь в разбавленный раствор соляной кислоты и дважды экстрагируют дихлорметаном. Органические вытяжки объединяют, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают методом испарительной колоночной хроматографии, элюируя 50%-ным раствором дихлорметана в гексане, и получают 3,66 г целевого продукта в виде масла желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 2,67, 2,85, 6,9, 7,1 м.д.
ИК-спектр: 2932, 1716, 1603, 1511, 1223, 1159, 828 см-1.
Масс-спектр: M+ 274
TCX: Rf 0,28 (50% дихлорметана в гексане).
Препарат 89. 4-Гидрокси-5,6-дигидро-6,6-бис(2- (4-фторфенил)этил)-2H-пиран-2-он (формула V-4). См. Схему V.
В соответствии с общей методикой конденсации ацетоуксусного эфира и циклизации, приведенной для Препарата 84 (формула V-4), 3,9 г кетона Препарата 88 (формула V-3) превращают в 2,86 г целевого соединения, которое может быть перекристаллизовано из смеси дихлорметан/гексан.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 2,1, 2,57, 2,7, 7,0, 7,1 м.д.
ИК-спектр: 2924, 1659, 1578, 1508, 1241, 1216 см-1.
Масс-спектр: M+ 358
Элементный анализ, найдено: С, 70,17; H, 5,50.
Температура плавления 140-141oC.
Препарат 90. 3-[1-(3-Бензилоксикарбониламинофенил)-2,2- диметилпропил] -6,6-бис[2-(4-фторфенил)этил]-4-гидрокси-5,6- дигидро-2H-пиран-2-он (формула V-6: R1 обозначает трет-бутил). См. Схему V.
В соответствии с общей методикой бензилиденовой конденсации и присоединения купрата, приведенной для Препарата 85 (формула U-6), 1,075 г дигидропирона Препарата 89 (формула V-4) превращают в 707 мг целевого соединения (через промежуточное соединение формулы V-5), которое очищают испарительной хроматографией на силикагеле, элюируя 40%-ным раствором этилацетата в гексане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,07, 2,0, 2,6, 3,9, 5,16, 6,8-7,5 м.д.
Масс-спектр высокого разрешения: 654,3023
TCX: Rf 0,25 (40% этилацетата в гексане).
Препарат 91. 3-[1-(3-Aминoфeнил)-2,2-димeтилпpoпил] - 6,6-бис[2-(4-фторфенил)этил]-4-гидрокси-5,6-дигидро-2H- пиран-2-он (формула V-7: R1 обозначает трет-бутил). См. Схему V.
В соответствии с общей методикой обменного гидрирования, описанной для Препарата 86 (формула V-7), 684 мг карбамата Препарата 90 (формула V-6, где R1 обозначает трет-бутил) превращают в 497 мг целевого соединения, которое очищают испарительной хроматографией на силикагеле, элюируя 5-10%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,09, 2,0, 2,6, 6,8-7,1 м.д.
TCX: Rf 0,34 (10% этилацетата в дихлорметане).
Соединение формулы V-7, где R1 обозначает этил, получают из соединения формулы V-4 по методике, аналогичной получению соединения формулы V-7, где R1 обозначает трет-бутил (Препараты 90 и 91).
Пример 256. N-[3-{1-(4-Гидрокси-5,6-дигидро-2-оксо- 6,6-бис(2-(4-фторфенил)этил)-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -1- метил-1H-имидазол-4-сульфонамид (формула V-8: R1 обозначает трет-бутил, R2 обозначает 1-метилимидазол-4-ил). См. Схему V.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, вводят во взаимодействие 78 мг амина Препарата 91 (формула V-7, R1 обозначает трет-бутил) с 1-метил-1H-имидазол-4-сульфохлоридом и после очистки методом испарительной хроматографии на силикагеле (элюируют смесью, содержащей 3-4% метанола в дихлорметане) получают 92 мг целевого продукта в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,94, 1,7-2,1, 2,5, 3,50, 6,8-7,4 м.д.
Масс-спектр высокого разрешения: 664,2647.
TCX: Rf 0,34 (5% метанола в дихлорметане).
Пример 257. N-[3-{1-(4-Гидрокси-5,6-дигидро-2-оксо- 6,6-бис(2-(4-фторфенил)этил)-2H-пиран -3-ил)-2,2-диметилпропил} фенил] -5-цианопиридин-2-сульфонамид (формула V-8: R1 обозначает трет-бутил, R2 обозначает 5-цианопиридин-2-ил). См. Схему V.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, вводят во взаимодействие 78 мг амина Препарата 91 (формула V-7, R1 обозначает трет-бутил) с 5-цианопиридин-2-сульфохлоридом и после очистки методом испарительной хроматографии на силикагеле (элюируют смесью, содержащей 10-15% этилацетата в дихлорметане) получают 91,5 мг целевого продукта в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,92, 1,9, 2,6, 3,2, 6,8-7,5, 8,0, 8,9 м.д.
Масс-спектр высокого разрешения: 686,2488.
TCX: Rf 0,28 (10% этилацетата в дихлорметане).
Пример 258. N-[3-{1-(4-Гидрокси-5,6-дигидро-2-оксо- 6,6-бис(2-(4-фторфенил)этил)-2H-пиран-3-ил)пропил} фенил] - 1-метил-1H-имидазол-4-сульфонамид (формула V-8: R1 обозначает этил, R2 обозначает 1-метилимидазол-4-ил). См. Схему V.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, вводят во взаимодействие 74 мг амина
формулы V-7, где R1 обозначает этил, с 1-метил-1H-имидазол-4-сульфохлоридом и после очистки методом испарительной хроматографии на силикагеле (элюируют смесью, содержащей 3-4% метанола в дихлорметане) получают 77 мг целевого продукта в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,87, 2,0, 2,6, 3,62, 4,0, 4,05, 6,8-7,5 м.д.
Масс-спектр высокого разрешения: 636,2350.
TCX: Rf 0,31 (5%метанола в дихлорметане).
Пример 259. N-[3-{1-(4-Гидрокси-5,6-дигидро-2-оксо-6,6- бис(2-(4-фторфенил)этил)-2H-пиран-3-ил)пропил} фенил] -5- цианопиридин-2-сульфонамид (формула V-8: R1 обозначает этил, R2 обозначает 5-цианопиридин-2-ил) См. Схему V.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, вводят во взаимодействие 74 мг амина формулы V-7, где R1 обозначает этил, с 5-цианопиридин-2- сульфохлоридом и после очистки методом испарительной хроматографии на силикагеле (элюируют смесью, содержащей 10% этилацетата в дихлорметане) получают 83 мг целевого продукта в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,83, 2,0, 2,6, 3,96, 6,8-7,2, 8,0, 8,8 м.д.
Масс-спектр высокого разрешения: 658,2200.
TCX: Rf 0,49 (10% этилацетата в дихлорметане).
Пример 260. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо- 6,6-дипропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил]-5- цианопиридин-2-сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 5-цианопиридин-2-ил) См. Схему D.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, конденсируют 54 мг амина формулы D-5 (где R1 и R2 обозначают пропил, R3 обозначает трет-бутил), полученного аналогично методике синтеза соединения формулы D-5 (где R1-фенэтил, R2-пропил, R3 обозначает этил) Препарата 20, с 5-цианопиридин-2-сульфохлоридом формулы D-7 (R4 обозначает 5-цианопиридин-2-ил) и после очистки методом испарительной хроматографии на силикагеле (элюируют смесью, содержащей 10-15% этилацетата в дихлорметане) получают 62 мг целевого продукта в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,90, 1,2-1,8, 2,5, 7,0-7,4, 8,1, 8,2, 8,9 м.д.
Масс-спектр высокого разрешения: 525,2305.
TCX: Rf 0,44 (20% этилацетата в дихлорметане).
Пример 261. N-[3-{ 1-(4-Гидpoкcи-5,6-дигидpo-2-oкco- 6,6-дипропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -1- метил-1H-имидазол-4-сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 1-метилимидазол-4-ил) См. Схему D.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, конденсируют 54 мг амина формулы D-5 (где R1 и R2 обозначают пропил, R3 обозначает трет-бутил) с 1-метил-1H-имидазол-4-сульфохлоридом формулы D-7 (R4 обозначает 1-метилимидазол-4-ил) и после очистки методом испарительной хроматографии на силикагеле (элюируют смесью, содержащей 3-5% метанола в дихлорметане) получают 53 мг целевого продукта в виде аморфного твердого вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,90, 0,96, 1,2-1,8, 2,5, 3,6, 6,9-7,5 м.д.
Масс-спектр высокого разрешения: 503,2422.
TCX: Rf 0,26 (5% метанола в дихлорметане).
Пример 262. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо-6,6- дипропил-2H-пиран-3-ил)пропил}фенил]-5-цианопиридин-2- сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-циано-пиридин-2-ил) См. Схему D).
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, конденсируют 67 мг амина формулы D-5 (где R1 и R2 обозначают пропил, R3 обозначает этил) Препарата 20, с 5-цианопиридин-2-сульфохлоридом формулы D-7 (R4 обозначает 5-цианопиридин-2-ил) и после очистки методом испарительной хроматографии на силикагеле (элюируют смесью, содержащей 10% этилацетата в дихлорметане) получают 78 мг целевого продукта в виде аморфного твердого вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,6-1,0, 1,2-1,8, 3,4, 3,5, 6,9-7,4, 8,0-8,2, 8,9 м.д.
Масс-спектр высокого разрешения: 498,2072.
TCX: Rf 0,38 (15% этилацетата в дихлорметане).
Пример 263. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо-6- фенэтил-6-пропил-2H-пиран-3-ил)пропил} фенил]-5- цианопиридин-2-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) См. Схему D.
В соответствии с общей методикой сульфонилирования, описанной в Примере 252, конденсируют 79 мг амина формулы D-5 (где R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил) Препарата 20, с 5-цианопиридин-2-сульфохлоридом формулы D-7 (R4 обозначает 5-цианопиридин-2-ил) и после очистки методом испарительной хроматографии на силикагеле (элюируют смесью, содержащей 10% этилацетата в дихлорметане) получают 102 мг целевого продукта в виде аморфного твердого вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-1,0, 1,2-2,6, 3,4, 3,5, 6,9-7,3, 7,9-8,2, 8,9 м.д.
Масс-спектр высокого разрешения: 560,2231
TCX: Rf 0,37 (15% этилацетата в дихлорметане).
Примеры 264-265. Следующие соединения получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 246. Необходимые амины получают аналогично методикам, описанным для Препаратов 80 и 81, из соединения формулы Q-1 (Препарат 69).
264) N-[3-(1-[6,6-Бис-(2-циклопропил этил)-5,6- дигидро-4-гидрокси-2-оксо-2H-пиран-3-ил] -2,2-диметилпропил) фенил] -1-метил-1H-имидазол-4-сульфонамид
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,0, 0,4, 0,6, 1,0, 1,2, 1,7, 2,5, 3,7, 4,1, 6,9-7,6 м.д.
Масс-спектр высокого разрешения (FAB): 556,2833
265) N-[3-(1-[6,6-Бис-(2-циклопропилэтил)-5,6- дигидро-4-гидрокси-2-оксо-2H-пиран-3-ил]-2,2-диметилпропил) фенил]-5-цианопиридин-2-сульфонамид
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,0, 0,4, 0,6, 1,0, 1,2, 1,7, 2,5, 4,1, 7,0-7,5, 8,0, 8,1, 9,0 м.д.
Масс-спектр высокого разрешения (FAB): 578,1689
Препарат 92. (3(2E),4S)-3-(2-Пентенил)-4-фенил-2- оксазолидинон (формула W-4) См. Схему W.
В круглодонную колбу емкостью 1 л, снабженную трубкой для подачи азота и капельной воронкой, помещают 6,92 г (S)-(+)-4-фенил-2-оксазолидинона и 250 мл тетрагидрофурана, а затем охлаждают до минус 78oC. К полученному раствору добавляют 25,6 мл н-бутиллития, при этом из реакционной смеси выпадает твердое вещество W-3 белого цвета. К полученной суспензии добавляют 4,88 г транс-2-пентеноилхлорида формулы W-2 (получают обработкой промышленно выпускаемой транс-2-пентеновой кислоты формул W-1 хлористым оксалилом) в небольшом объеме тетрагидрофурана. Полученному гомогенному раствору бледно-желтого цвета дают нагреться до комнатной температуры и перемешивают еще в течение 20 минут. Реакционную смесь разлагают, добавив насыщенный раствор хлорида аммония, и экстрагируют этилацетатом. Органический слой отделяют, промывают насыщенным раствором соли, сушат над сульфатом магния, отфильтровывают и упаривают, получая твердое вещество белого цвета. Целевое соединение в количестве 9,13 г получают перекристаллизацией из горячего гексана; т.пл. 86-88oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,42-7,23, 7,18-7,09, 5,49, 4,70, 4,28, 2,28, 1,08 м.д.
[α]D (хлороформ) = +109oC
Элементный анализ, найдено: С 68,59: H 6,25; N 5,70
Препарат 93. (3(R),4S)-3-[3-(3-Аминофенил)-1- оксопентил]-4-фенил-2-оксазолидинон (формула W-5) См. Схему W.
В круглодонную колбу емкостью 1 л, снабженную трубкой для подачи азота и капельной воронкой, помещают 8,90 г комплекса бромид меди (1) - диметилсульфид и 125 мл тетрагидрофурана, а затем охлаждают до температуры минус 40oC. К полученной суспензии по каплям в течение 15 минут добавляют 43 мл 1 М раствора 3-[бис-(триметилсилил)амино]фенилмагнийхлорида в тетрагидрофуране. В течение 30 минут нагревают полученную смесь до 0oC и добавляют 25 мл раствора в тетрагидрофуране, содержащего 8,85 г (3(2E),4S)-3-(2-пентенил)-4-фенил-2-оксазолидинона Препарата 92 (формула W-4). Реакционную смесь перемешивают в течение 30 минут при температуре 0oC, разлагают реакционную смесь, добавляя 1N соляной кислоты, а затем доводят pH смеси до значения 8 с помощью 1N раствора гидроксида натрия. Реакционную смесь промывают водой, насыщенным раствором соли и органический слой сушат (над сульфатом натрия). Органический растворитель отгоняют в вакууме и остаток хроматографируют, используя 600 г силикагеля (элюируют смесью этилацетат/гексан), и получают 7,91 г целевого продукта с т.пл. 94-95oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,28-7,25, 7,07-6,99, 6,60-6,51, 5,38, 4,63, 4,16, 3,52-3,44, 3,10-2,92, 1,65-1,53, 0,76 м.д.
ИК спектр (минеральное масло): 3437, 3335, 1773, 1696, 1605, 1337, 1322, 1299, 1263, 1212, 1096, 1070, 791, 762, 704 см-1.
Элементный анализ, найдено: С 71,00; H 6,67; N 8,17.
Масс-спектр (E1): /M+/ = 338
[α]D (19,87 мг/2 мл хлороформа) = +60oC
Препарат 94. 3-[3-(3-[Бис(фенилметил)амино]фенил)-1- оксопентил]-4-фенил-2-оксазолидинон, (3R) (4S) (формула W-6) См. Схему W.
К смеси 25 мл раствора карбоната натрия и 80 мл хлористого метилена добавляют 7,90 г (3(R), 4S)-3-[3-(3-аминофенил)-1- оксопентил]-4-фенил-2-оксазолидинона Препарата 93 (формула W-5), а затем 15,94 г бромистого бензила. Смесь нагревают до 65oC в течение 18 часов, слой хлористого метилена отделяют, сушат (над сульфатом натрия) и растворитель упаривают, получая сырой продукт в виде темного вязкого масла. Это масло хроматографируют, используя 700 г силикагеля (элюируют 25%-ным раствором этилацетата в гексане), и получают 8,55 г целевого соединения с т.пл. 92-93oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,24, 7,02, 6,53, 5,34, 4,59, 4,14, 3,44, 3,07, 2,89, 1,50, 0,64 м.д.
Элементный анализ, найдено: С 78,47; H 6,68; N 5,26.
[α]D (19,602 мг/2 мл хлороформа) = +32o
Препарат 95. (3R)(4S)-3-[3-(3-[Бис(фенилметил)амино] фенил) -2-(2-метил-1,3-диоксолан-2-ил)-1-оксопентил] -4-фенил-2-оксазолидинон (формула W-8) См. Схему W.
К 25 мл хлористого метилена добавляют 2,1 г амида формулы W-6 Препарата 94 и полученный раствор в токе азота охлаждают до минус 78oC. К этому раствору добавляют 872 мкл чистого тетрахлорида титана, а затем добавляют 732 мкл ди-изо-пропилэтиламина. Полученную смесь нагревают в течение 30 минут до температуры 0oC, а затем вновь охлаждают до минус 78oC, добавляют 1,3 г 2-метокси-2-метил-1,3-диоксолана формулы W-7, полученную реакционную смесь нагревают до 0oC и перемешивают в течение часа, а затем разлагают насыщенным раствором хлорида аммония. Экстрагируют хлористым метиленом, органические вытяжки сушат (над сульфатом натрия) и растворитель упаривают в вакууме, получая сырой продукт. Его хроматографируют, используя 100 г носителя (элюируют 10%-ным раствором гексана в хлористом метилене), и получают 1,76 г целевого продукта.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,36, 7,08, 5,99, 5,42, 4,80, 4,68 4,60, 4,25, 3,68, 3,57, 3,48, 3,07, 2,90, 1,50, 0,86, 0,54 м.д.
Элементный анализ, найдено: С 75,34; H 6,99; N 4,87.
[α]D (18,086 мг/2-мл хлороформа) = +25o
Препарат 96. (3R)(4S)-3-[2-Aцeтил-3-[3-(бис(фенилметил)амино)фенил] -1-оксопентил]-4-фенил-2-оксазолидинон (формула W-9) См. Схему W.
К 25 мл тетрагидрофурана и 10 мл 30%-ного раствора хлорной кислоты добавляют 5,0 г целевого продукта Препарата 95 (формула W-8) и полученный раствор перемешивают в течение 3 часов при температуре 40oC. Реакционную смесь нейтрализуют насыщенным раствором бикарбоната натрия до достижения pH 8 и экстрагируют 400 мл эфира. Эфирный слой отделяют, промывают водой, насыщенным раствором соли и сушат (над сульфатом натрия) и растворитель упаривают в вакууме, получая масло. Его хроматографируют, используя 300 г силикагеля (элюируют 15%-ным раствором ацетона в гексане), и получают 4,12 г целевого продукта.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,31, 7,08, 6,59, 6,55, 5,42, 4,67, 4,61, 4,22, 3,09, 1,63, 1,56, 0,61 м.д.
Элементный анализ, найдено: С 77,11; H 6,76; N 4,98.
[α]D (20,172 мг/2 мл хлороформа) = -10oC
Препарат 97. (3R)(4S)-3-[2-[1-(3-[Бис(фенилметил)амино]фенил) пропил]-5-гидрокси-1,3-диоксо-5-пропилоктил] -4-фенил-2-оксазолидинон (формула W-10) См. Схему W.
К 25 мл хлористого метилена добавляют 1,32 г соединения Препарата 96 (формула W-9) и полученный раствор в токе азота охлаждают до минус 78oC. К этому раствору добавляют 279 мкл чистого тетрахлорида титана и 450 мкл ди-изо-пропилэтиламина и перемешивают в течение часа. К полученному раствору добавляют 689 мкл гептанона и полученную реакционную смесь в течение 1,5 часов нагревают до 0oC. Разлагают реакционную смесь насыщенным раствором хлорида аммония, экстрагируют хлористым метиленом, органические вытяжки промывают насыщенным раствором бикарбоната натрия, сушат (над сульфатом натрия) и растворитель упаривают в вакууме, получая сырой продукт. Его хроматографируют, используя 100 г силикагеля (элюируют 5%-ным раствором гексана в хлористом метилене), и получают 1,16 г целевого продукта.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,36, 7,07, 6,58, 6,54, 5,44, 5,24, 4,69, 4,61, 4,27, 3,21, 3,01, 2,48, 1,90, 1,54, 1,15, 0,81, 0,76, 0,58 м.д.
Элементный анализ, найдено: С 76,62; H 7,63; N 417.
[α]D (15,380 мг/2 мл хлороформа) = +16o
Препарат 98. (3R)-3-[1-(3-[Бис(фенилметил)-амино)фенил) пропил]-6,6-дипропил-5,6-дигидро-4-гидрокси-2H-пиран-2-он (формула W-11) См. Схему W.
К 10 мл сухого тетрагидрофурана добавляют 770 мг целевого продукта Препарата 97 (формула W-10) и полученный раствор охлаждают до 0oC в токе азота. К полученному раствору добавляют 150 мг гидрида натрия в виде 60%-ной дисперсии в масле, реакционную смесь нагревают до 20oC и перемешивают еще в течение 16 часов. Реакцию прерывают, добавив насыщенный раствор хлорида аммония, и экстрагируют этилацетатом. Экстракт сушат и упаривают в вакууме, получая сырой продукт. Его хроматографируют на 100 г силикагеля, элюируя 15%-ным раствором этилацетата в гексане, и получают 560 мг целевого продукта.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,34, 6,69, 5,87, 4,69 4,60, 4,09, 2,28, 2,17, 1,89, 1,73, 1,55, 1,32, 0,88 м.д.
Элементный анализ, найдено: С 79,71; H 8,07; N 2,61.
[α]D (15,998 мг/2 мл хлороформа) = -56o
Препарат 99. (3S)-3-[1-(3-Aминoфeнил)пpoпил] -6,6- дипpoпил-5,6-дигидро-4-гидрокси-2H-пиран-2-он (формула W-12) См. Схему W.
Целевое соединение Препарата 98 (формула W-11) ((3S)-3-[1-(3-бисбензиламинофенил)пропил] -6,6-бис-пропил-5,6- дигидро-4-гидрокси-пиран-2-он) в количестве 110 мг растворяют в 20 мл этилацетата. К полученному раствору добавляют 50 мг 10%-ного палладия на угле и полученную смесь гидрируют под давлением 50 фунт-сила/квадратный дюйм (344,7 кПа) водорода в течение 6 часов. Реакционную смесь отфильтровывают через целит и получают 83 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
ИК спектр: 2957, 2922, 2855, 2871, 2854, 1378, 1605, 1459, 1617, 1262, 1319, 1251, 1282, 1107 см-1.
[α]D (6,526 мг/2 мл метанола) = -34o
Препарат 100. (4R)3-(1-оксо-2-пентенил)-4-фенил-2- оксазолидинон (формула X-4) См. Схему X.
В трехгорлую круглодонную колбу емкостью 2 л, снабженную трубкой для подачи азота и капельной воронкой, помещают (R)-(-)-4-фенил-2-оксазолидинон (31,2 г) и тетрагидрофуран (1,2 л) и охлаждают до минус 78oC. В капельную воронку помещают н-бутиллитий (1,6 М раствор в гексане, 117 мл), который по каплям в течение 20 минут добавляют к реакционной смеси. Образуется белый осадок соединения X-3. Реакционную смесь дополнительно перемешивают при температуре минус 78oC еще в течение 30 минут. В капельную воронку помещают транс-2-пентеноилхлорид формулы X-2, полученный из кислоты формулы X-1 (24,4 г), и тетрагидрофуран (50 мл) и полученный раствор добавляют по каплям в течение 10 минут к реакционной смеси. Полученному гомогенному раствору бледно-желтого цвета дают нагреться до комнатной температуры и перемешивают еще в течение 30 минут. Разлагают реакционную смесь добавлением насыщенного раствора хлорида аммония и экстрагируют этилацетатом (2500 мл). Органический слой отделяют, промывают насыщенным раствором соли, сушат над сульфатом магния, отфильтровывают и упаривают, получая 48 г твердого вещества белого цвета. Полученное твердое вещество перекристаллизовывают из этилацетата (100 мл) и гексана (200 мл) и выделяют 38,0 г целевого продукта в виде твердого вещества белого цвета с т.пл. 86-88oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,42-7,23, 7,18-7,09, 5,49, 4,70, 4,28, 2,28, 1,08 м.д.
ИК спектр (минеральное масло): 1785, 1764, 1686, 1638, 1349, 1336, 1329, 1257, 1234, 1214, 1087, 1076, 756, 716, 699 см-1.
Масс-спектр (E1): /М+/ = 245
Препарат 101. (3(3S),4R)-3-[3-(3-Аминофенил)-1-оксопентил]-4- фенил-2-оксазолилинон (формула X-5) См. Схему X.
В круглодонную колбу емкостью 2 л, снабженную трубкой для подачи азота и капельной воронкой, помещают 25,1 г комплекса бромид меди (1) - диметилсульфид и 250 мл тетрагидрофурана, а затем охлаждают до температуры минус 40oC. В капельную воронку помещают 122 мл 1 М раствора 3-[бис-(триметилсилил)амино] фенилмагнийхлорида в тетрагидрофуране, который по каплям в течение 20 минут добавляют к реакционной смеси, дают реакционной смеси в течение 20 минут нагреться от минус 40oC до минус 20oC. В капельную воронку помещают 25 г целевого продукта Препарата 100 (формула X-4) и тетрагидрофуран (100 мл) и полученный раствор добавляют в течение 30 минут при температуре 0oC к реакционной смеси и перемешивают еще в течение 15 минут при температуре 0oC, а затем разлагают смесь, добавляя насыщенный раствор хлорида аммония (доводят pH смеси до значения 8 с помощью раствора гидроксида аммония). Реакционную смесь выливают в эфир (2 л) и промывают раствором хлорида аммония до тех пор, пока не пропадет голубой цвет. Органический слой отделяют, промывают водой и сушат над сульфатом магния, отфильтровывают и упаривают, получая 58 г масла желтого цвета. Сырой продукт перемешивают в течение часа при комнатной температуре с суспензией силикагеля (75 г) и хлористого метилена (100 мл). Смесь отфильтровывают, промывают метанолом и упаривают, получая 49 г масла. После хроматографии с использованием 300 г силикагеля (элюируют 10%-75%-ным раствором этилацетата в гексане и 100%-ным этилацетатом) получают 30,9 г масла желтого цвета. Масло перекристаллизовывают из этилацетата (75 мл) и гексана (150 мл) и получают 21,4 г целевого соединения в виде твердого вещества белого цвета с т.пл. 94-97oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,28-7,25, 7,07-6,99, 6,60-6,51, 5,38, 4,63, 4,16, 3,52-3,44, 3,10-2,92, 1,65-1,53, 0,76 м.д.
ИК спектр (минеральное масло): 3437, 3355, 1773, 1696, 1605, 1337, 1322, 1299, 1263, 1212, 1096, 1070, 791, 762, 704 см-1.
Масс-спектр (E1): /М+/ = 338
Препарат 102. (3(3S),4R)-3-[3-(3-бис-бензиламинофенил) пентаноил]-4-фенил-2-оксазолидинон (формула X-6) См. Схему X.
К смеси 80 мл раствора карбоната натрия и 280 мл хлористого метилена добавляют 21,0 г (3(3S),4R)-3-[3-(3-аминофенил)-1-оксопентил]-4-фенил-2-оксазолидинона (формула X-5) Препарата 101, а затем 23,4 г бромистого бензила. Смесь нагревают до 65oC в течение 18 часов, слой хлористого метилена отделяют, сушат (над сульфатом натрия) и растворитель упаривают, получая сырой продукт в виде темного вязкого масла. Это масло хроматографируют, используя 700 г силикагеля (элюируют 25%-ным раствором этилацетата в гексане), и получают 31,42 г целевого соединения с т.пл. 91,8-93,5oC. Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,32, 7,08, 6,60, 5,34, 4,67, 4,15, 3,43, 3,02, 2,91, 1,56, 0,65 м.д.
Препарат 103. (3S)(4S)-3-[3-(Бис(фенилметил)амино]фенил]-2- (2-метил-1,3-диоксолан-2-ил)-1-оксопентил] -4-фенил-2-оксазолидинон (формула X-8) См. Схему X.
К 12 мл хлористого метилена добавляют 1,55 г (3(3S),4R)- 3-[3-(3-бисбензиламинофенил)пентаноил] -4-фенил-2- оксазолидинона (формула X-6) Препарата 102 и полученный раствор в токе азота охлаждают до минус 78oC. К этому раствору добавляют 646 мкл чистого тетрахлорида титана, а затем добавляют 525 мкл ди-изо-пропилэтиламина. Полученную смесь нагревают в течение 30 минут до температуры 0oC, а затем вновь охлаждают до минус 78oC, добавляют 886 мкл 2-метокси-2-метил-1,3-диоксолана (формула X-7) (также W-7) и полученную реакционную смесь перемешивают в течение часа, а затем разлагают насыщенным раствором хлорида аммония, добавляют насыщенный раствор бикарбоната натрия и экстрагируют хлористым метиленом и эфиром. Растворитель упаривают и получают вязкое масло, которое хроматографируют, используя 150 г силикагеля (элюируют 7%-ным раствором гексана в хлористом метилене), и получают 1,14 г целевого продукта.
Вещество обладает следующими физическими характеристиками:
ИК спектр (вазелиновое масло): 2920, 2954, 2854, 2870, 1776, 1376, 1453, 1196, 699 см-1.
Элементный анализ, найдено: С 75,27; H 6,68; N 4,55.
Препарат 104. (3S)(4R)-3-[2-Ацетил-3-[3-(бис(фенилметил)амино]фенил] -1-оксопентил]-4-фенил-2-оксазолидинон (формула X-9) См. Схему X.
К 15 мл тетрагидрофурана добавляют 960 мг (3(3S),4R)-3- [2-(2-метил-1,3-диоксан-2-ил)-3-(3-бисбензиламинофенил) пентаноил] -4-фенил-2-оксазолидинона (формула X-8) Препарата 103. К полученному раствору добавляют 4 мл 30%-ного раствора хлорной кислоты и полученный раствор перемешивают в течение 2 часов при температуре 40oC. Реакционную смесь охлаждают до комнатной температуры и разлагают избытком насыщенного раствора бикарбоната натрия. Экстрагируют 200 мл эфира, эфирный слой отделяют, сушат (над сульфатом натрия) и растворитель упаривают в вакууме, получая 981 мг сырого продукта. Его хроматографируют, используя 100 г силикагеля (элюируют 10%-ным раствором пентана в хлористом метилене), и получают 854 мг целевого соединения. Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,40, 7,08, 6,61, 6,56, 5,41, 4,96, 4,66, 4,61, 4,21, 3,09, 1,63, 1,65, 0,61 м.д.
ИК спектр (минеральное масло): 1778, 1718, 1600, 1695, 1452, 1335, 1385, 1200 см-1.
Масс-спектр (E1): /М+/ = 560
Элементный анализ, найдено: С 76,81; H 6,59; N 4,84.
Препарат 105. (3S)(4R)-3-[2-[1-[3-[Бис(фенилметил)амино] фенил]пропил] -5-гидрокси-1,3-диоксо-5-пропилоктил]-4-фенил-2-оксазолидинон (формула X-10) См. Схему X.
К 8 мл хлористого метилена в токе азота добавляют 440 мг (3-(3S)(4R)-3-[2-(ацетил)-3-(3-бисбензиламинофенил)пентаноил] -4- фенил-2-оксазолидинона (формула X-9) Препарата 104 и полученный раствор охлаждают до минус 78oC. К этому раствору добавляют 90 мкл чистого тетрахлорида титана, а затем 143 мкл ди-изо-пропилэтиламина. Раствор в течение 40 минут нагревают до 0oC, а затем вновь охлаждают до минус 78oC, добавляют 126 мл гептанона и полученную реакционную смесь в течение 1,5 часов нагревают до 0oC. Разлагают реакционную смесь насыщенным раствором хлорида аммония, экстрагируют хлористым метиленом (3 x 60 мл), органические вытяжки объединяют, сушат над сульфатом натрия и растворитель упаривают в вакууме, получая сырой продукт в виде масла. Его хроматографируют, используя 100 г силикагеля (элюируют 10%-ным раствором пентана в хлористом метилене), и получают 293 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,28, 7,07, 6,56, 6,56, 5,44, 5,24, 4,68, 4,61, 4,26, 3,21, 3,10, 2,48, 1,90, 1,55, 1,21, 0,81, 0,74, 0,58 м.д.
ИК спектр (минеральное масло): 2929, 2931, 1779, 1720, 1690, 1600, 1494, 1452, 1385, 1359, 1334, 1238, 698 см-1.
Препарат 106. (3R)-3-[1-[3-[Бис(фенилметил)амино] фенил] пропил]-5,6-дигидро-4-гидрокси-6,6-дипропил-2H-пиран-2-он (формула X-11) См. Схему X.
К 3 мл тетрагидрофурана добавляют в токе азота 28 мг гидрида натрия. К полученной суспензии добавляют 418 мг (3(3S),4R)-3-[2-((3-гидрокси-3-пропил)гексаноил) -3-(3-бисбензиламинофенил)пентаноил]-4-фенил-2-оксазолидинона (формула X-10) Препарата 105 в 3 мл тетрагидрофурана при температуре 20oC. Полученный раствор перемешивают в течение 16 часов, охлаждают до 0oC и реакцию прерывают, добавив 1N раствор соляной кислоты. Подщелачивают, добавив насыщенный раствор бикарбоната натрия, и экстрагируют несколько раз этилацетатом. Экстракты сушат (над сульфатом натрия) и упаривают в вакууме, получая 518 мг сырого продукта. Его хроматографируют на силикагеле, элюируя 15%-ным раствором этилацетата в гексане, и получают 128 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
ИК спектр (минеральное масло): 2929, 2931, 2873, 1636, 1599, 1451, 1465, 1386, 1363, 1328, 1249, 1260, 696 см-1.
Масс-спектр (E1): /М+/ = 511.
Препарат 107. (3R)-3-[1-[3-[Амино]фенил]пропил]-5,6-дигидро-4- гидрокси-6,6-дипропил-2H-пиран-2-он (формула X-12) См. Схему X.
Дигидропирон формулы X-11 ((3R)-3-[1-(3-бисбензиламинофенил)пропил]-6,6-дипропил-5,6-дигидро-4- гидроксипиран-2-он) Препарата 106 в количестве 110 мг растворяют в 20 мл этилацетата. К полученному раствору добавляют 50 мг 10%-ного палладия на угле и полученную смесь гидрируют под давлением 50 фунт-сила/квадратный дюйм (344,7 кПа) водорода в течение 6 часов. Реакционную смесь отфильтровывают через целит и получают 83 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
ИК спектр (минеральное масло): 2961, 2932, 2873, 1682, 1623, 1604, 1458, 1384, 1369, 1319, 1282, 1259, 1150, 1108 см-1.
Масс-спектр (E1): [M+] = 331.
Препарат 108. 2-Фенэтил-2-пропен-1-ол (формула BB-2) См. Схему BB.
К охлажденному (минус 10oC) раствору N,N,N,N-тетраметил-1,2- этилендиамина (24,1 мл) в гексане медленно добавляют бутиллитий (100 мл 1,6 М раствора в гексане). Перемешивают в течение 45 минут при температуре минус 10oC, смесь охлаждают до минус 78oC и по каплям добавляют 2-метил-2- пропен-1-ол (BB-1, 6,41 мл). Дают реакционной смеси нагреться до комнатной температуры и перемешивают еще в течение 72 часов. Охлаждают смесь до минус 78oC и медленно добавляют раствор бромистого бензола (8,6 мл) в безводном тетрагидрофуране (10 мл). Смесь перемешивают при температуре минус 78oC в течение часа, а затем медленно нагревают до комнатной температуры. Перемешивают два часа и реакционную смесь разлагают, добавляя насыщенный водный раствор хлорида аммония. Органический слой отделяют, разбавляют диэтиловым эфиром и промывают насыщенным раствором соли, сушат над сульфатом магния, отфильтровывают и упаривают в вакууме. Очищают испарительной хроматографией, элюируя смесью хлористый метилен/этилацетат/гексан (1:1:6), и получают целевое соединение (3,5 г) в виде масла.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,31-7,16, 5,07, 4,93, 4,09, 2,82-2,76, 2,41-2,36 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 148,30, 141,69, 128,24, 125,80, 109,76, 65,90, 34,52, 34,16 м.д.
Препарат 109. (2S)-2-Фенэтилоксиранметанол (формула BB-8) См. Схему BB.
К охлажденной (минус 20oC) суспензии молекулярных сит (4 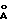 , измельченные и свежеактивированные, 150 мг) в хлористом метилене (1,5 мл) добавляют диэтиловый эфир L-винной кислоты (22 мг) и изопропиксид титана (IV) (25 мг). Смесь перемешивают в течение 30 минут при температуре минус 20oC и добавляют гидропероксид трет-бутила (0,84 мл 5-6 М раствора в нонане). Перемешивают еще 25 минут при температуре минус 20oC и медленно добавляют раствор аллилового спирта формулы BB-2 (300 мг) Препарата 108 в хлористом метилене (0,5 мл). Оставляют смесь перемешиваться при температуре минус 20oC на ночь и нагревают до минус 10oC. Перемешивают еще 4 часа и реакционную смесь нагревают до 0-5oC и реакцию прерывают, добавляя воду (1 мл). Нагревают до комнатной температуры, перемешивают еще в течение часа и тартраты гидролизуют добавлением 30%-ного водного раствора гидроксида натрия, насыщенного хлоридом натрия (0,1 мл). Через 30 минут смесь отфильтровывают через целит и водную фазу несколько раз экстрагируют хлористым метиленом. Органические фазы объединяют, сушат (над сульфатом магния), фильтруют и упаривают в вакууме, получая остаток, который очищают испарительной хроматографией, используя в качестве элюента гексан и градиент этилацетата (10-20%) и получают целевое соединение формулы BB-3 (223 мг) в виде масла. Энантиомерный избыток реакции, определенный анализом с помощью ПМР спектроскопии (в дейтеробензоле) эфира Мошера, получаемого по реакции B-3 с (S)-(+)-альфа-метокси-альфа- (трифторметил)фенилацетилхлоридом (J.A. Dale, D.L. Dull, H.S. Mosher, J. Org. Chem., (1969) 34: 2543), составляет 86%.
, измельченные и свежеактивированные, 150 мг) в хлористом метилене (1,5 мл) добавляют диэтиловый эфир L-винной кислоты (22 мг) и изопропиксид титана (IV) (25 мг). Смесь перемешивают в течение 30 минут при температуре минус 20oC и добавляют гидропероксид трет-бутила (0,84 мл 5-6 М раствора в нонане). Перемешивают еще 25 минут при температуре минус 20oC и медленно добавляют раствор аллилового спирта формулы BB-2 (300 мг) Препарата 108 в хлористом метилене (0,5 мл). Оставляют смесь перемешиваться при температуре минус 20oC на ночь и нагревают до минус 10oC. Перемешивают еще 4 часа и реакционную смесь нагревают до 0-5oC и реакцию прерывают, добавляя воду (1 мл). Нагревают до комнатной температуры, перемешивают еще в течение часа и тартраты гидролизуют добавлением 30%-ного водного раствора гидроксида натрия, насыщенного хлоридом натрия (0,1 мл). Через 30 минут смесь отфильтровывают через целит и водную фазу несколько раз экстрагируют хлористым метиленом. Органические фазы объединяют, сушат (над сульфатом магния), фильтруют и упаривают в вакууме, получая остаток, который очищают испарительной хроматографией, используя в качестве элюента гексан и градиент этилацетата (10-20%) и получают целевое соединение формулы BB-3 (223 мг) в виде масла. Энантиомерный избыток реакции, определенный анализом с помощью ПМР спектроскопии (в дейтеробензоле) эфира Мошера, получаемого по реакции B-3 с (S)-(+)-альфа-метокси-альфа- (трифторметил)фенилацетилхлоридом (J.A. Dale, D.L. Dull, H.S. Mosher, J. Org. Chem., (1969) 34: 2543), составляет 86%.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,34-7,16, 3,83-3,61, 2,89-2,87, 2,72-2,64, 2,17-2,04, 1,89-1,79 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 141, 17, 137,58, 128,49, 128,21, 126,11, 63,00, 59,57, 49,92, 33,58, 30,82 м.д.
Препарат 110. (2S)-2-Фенэтил-2-фенилметоксиметилоксиран (формула BB-9) См. Схему BB.
К охлажденной (0-5oC) суспензии гидрида натрия (124 мг 60%-ной суспензии в минеральном масле) в тетрагидрофуране (10 мл) добавляют спирт формулы BB-3 (460 мг) Препарата 109. Смесь перемешивают при указанной температуре в течение пяти минут, дают ей нагреться до комнатной температуры и перемешивают еще в течение 30 минут. Добавляют бромистый бензил (441 мг) и оставляют смесь перемешиваться на ночь. Прерывают реакцию, добавив насыщенный раствор соли (10 мл) и разбавляют этиловым эфиром. Органический слой отделяют, промывают насыщенным раствором соли, сушат (над сульфатом магния), отфильтровывают и упаривают в вакууме, получая остаток, который очищают испарительной хроматографией, используя в качестве элюента гексан и градиент этилацетата (2-5%), и получают целевое соединение (510 мг) в виде масла. Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,34-7,13, 4,59-4,49, 3,64-3,45, 2,75-2,59, 2,19-2,09, 1,94-1,84 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 141,42, 137,93, 128,58, 128,38, 127,88, 125,94, 73,23, 71,98, 58,21, 50,37, 33,65, 30,83 м.д.
Препарат 110a. (3S)-1-Фeнил-3-(фeнилмeтoкcимeтил)гeкcaн-3-oл (формула BB-10) См. Схему BB.
К охлажденному (минус 45oC) раствору Li2CuCl4 (0,28 мл 0,1 М раствора в тетрагидрофуране) в тетрагидрофуране (2 мл) добавляют этилмагнийбромид (0,203 мл 3 М раствора в этиловом эфире). Полученный раствор коричневого цвета перемешивают при температуре минус 45oC в течение 45 минут и по каплям в течение приблизительно 10 минут добавляют эпоксид формулы BB-4 (150 мг) Препарата 110. Через час разлагают реакционную смесь насыщенным раствором хлорида аммония и водный слой экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат (над сульфатом магния), отфильтровывают и упаривают в вакууме, получая остаток, который очищают испарительной хроматографией, используя в качестве элюента 5%-ный раствор этилацетата в гексане, и получают целевое соединение (150 мг) в виде масла.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,38-7,14, 4,54, 3,37, 2,66-2,58, 2,20, 1,88-1,76, 1,58-1,52, 1,39-1,25, 0,92 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 142,61, 138,10, 128,41, 128,33, 127,71, 127,63, 125,68, 75,45, 73,79, 73,44, 38,95, 38,52, 29,86, 16,79, 14,37 м.д.
Препарат 110 b. (2R)-1-Фенилэтил-2-(п-толуолсульфонилметил)оксиран (формула BB-13) См. Схему BB.
К охлажденному (приблизительно до минус 10oC) раствору соединения формулы BB-8 (245 мг) Препарата 109 в хлористом метилене (4 мл) добавляют 4-толуолсульфохлорид (302 мг), триэтиламин (160 мг) и 4-диметиламинопиридин (8 мг). Смесь оставляют перемешиваться при температуре приблизительно минус 10oC на ночь и нагревают в течение часа до 0-5oC. Разбавляют смесь хлористым метиленом, промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат (над сульфатом магния), отфильтровывают и упаривают в вакууме, получая остаток, который очищают испарительной хроматографией, используя в качестве элюента 5%-ный раствор этилацетата в гексане, и получают целевое соединение (448 мг).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,79, 7,33, 7,28-7,08, 4,13-3,98, 2,64-2,58, 2,44, 2,11-2,00, 1,92-1,82 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 145,17, 140,67, 132,53, 129,96, 128,48, 128,19, 127,95, 126,15, 71,98, 56,49, 50,63, 32,89, 30,37, 21,64 м. д.
Препарат 110c. (2S)-1-Фенилэтил-2-пропилоксиран (формула BB-12) См. Схему BB.
К охлажденному (минус 45oC) раствору Li2CuCl4 (0,3 мл 0,1 М раствора в тетрагидрофуране) в тетрагидрофуране (2 мл) добавляют этилмагнийбромид (0,22 мл 3 М раствора в этиловом эфире). Полученный раствор коричневого цвета перемешивают при температуре минус 45oC в течение 45 минут, охлаждают до минус 65oC и по каплям в течение приблизительно 10 минут добавляют тозилат формулы BB-13 (200 мг) Препарата 110b. Перемешивают в течение 2,5 часа и в течение двух часов нагревают реакционную смесь до минус 50oC и разлагают, добавляя насыщенный раствор хлорида аммония, и водный слой экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат (над сульфатом магния), отфильтровывают и упаривают в вакууме, получая остаток, который очищают испарительной хроматографией, используя в качестве элюента 5%-ный раствор этилацетата в гексане, и получают целевое соединение (60 мг) и гидротозилат формулы BB-14 (47 мг).
Гидротозилат формулы BB-14 превращают в эпоксид формулы BB-12 следующим образом. К охлажденному (0-5oC) раствору соединения формулы BB-14 (43 мг) в метаноле (2 мл) добавляют безводный карбонат калия (20 мг). Перемешивают 1 час при температуре 0-5oC и смесь нагревают до комнатной температуры, перемешивают еще 90 минут и прерывают реакцию, добавляя насыщенный раствор хлорида аммония, и водный слой экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат (над сульфатом магния), отфильтровывают и упаривают в вакууме, получая остаток, который очищают испарительной хроматографией, используя в качестве элюента 5%-ный раствор этилацетата в гексане, и получают эпоксид формулы BB-12 (20 мг).
Физические характеристики BB-12:
Спектр ПМР (дейтерохлороформ) δ 7,31-7,16, 2,68, 2,59, 1,98-1,82, 1,73-1,37, 0,94 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 141,71, 128,41, 128,24, 125,92, 59,11, 52,57, 36,42, 36,02, 31,03, 18,19, 14,22 м.д.
Физические характеристики BB-14:
Спектр ПМР (дейтерохлороформ): δ 7,79, 7,34, 7,29-7,11, 3,90, 2,58-2,53, 2,44, 1,87, 1,77-1,72, 1,54-1,48, 1,31-1,21, 0,89 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 145,10, 141,66, 132,50, 129,97, 128,45, 128,25, 127,97, 125,96, 74,33, 73,07, 38,37, 37,87, 29,37, 21,66, 16,47, 14,48 м.д.
Препарат 111. (4S)-3-Ацетил-4-фенил-2-оксазолидинон (формула FF-3) См. Схему FF.
К раствору (S)-(+)-4-фенил-2-оксазолидинона формулы FF-2 (20 г) в безводном тетрагидрофуране (600 мл), охлажденному до минус 78oC, добавляют 1,6 М раствор н-бутиллития в гексане (77,8 мл) и полученную суспензию перемешивают при указанной температуре в течение 30 минут. Добавляют хлористый ацетил формулы FF-1 (10,23 мл) и дают смеси постепенно нагреться до комнатной температуры. Разлагают смесь, добавляя 1 л насыщенного раствора хлорида аммония, а затем выливают ее в смесь воды и этилацетата. Органический слой отделяют, а водную фазу дополнительно дважды экстрагируют этилацетатом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая твердый остаток, который перекристаллизовывают из смеси этилацетат/гексан и получают 21,27 г целевого соединения в виде твердого вещества белого цвета с т.пл. 86-87oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,42-7,26, 5,44-5,40, 4,68, 4,30-4,26, 2,52 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 169,50, 153,71, 138,81, 128,97, 128,53, 125,73, 69,73, 57,20, 23,59 м.д.
Препарат 112. (3(2E),4S)-3-[4,4-Диметил-(2-пентеноил]-4- фенил-2-оксазолидинон (формула FF-4) См. Схему FF.
К соединению формулы FF-3 препарата 111 (21,27 г) в безводном хлористом метилене (500 мл), охлажденному до минус 78oC, по каплям добавляют тетрахлорид титана (12,0 мл). К суспензии добавляют ди-изо-пропилэтиламин (19,9 мл) и перемешивают в указанных условиях в течение 30 минут. Затем добавляют к суспензии триметилацетальдегид (11,4 мл) и ди-изо-пропилэтиламин (19,9 мл) и дают смеси постепенно нагреться до комнатной температуры. Через час реакцию прерывают, добавив воду (200 мл), и энергично перемешивают в течение 15 минут. Органический слой отделяют, а водную фазу дополнительно дважды экстрагируют хлористым метиленом. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая твердый остаток, который перекристаллизовывают из смеси этилацетат/гексан и получают 21,6 г целевого соединения в виде твердого вещества беловатого цвета с т.пл. 148-149oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,42-7,05, 5,51-5,46, 4,69, 4,30-4,25, 1,09 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 165,17, 161,61, 153,70, 139,16, 129,12, 128,61, 125,97, 115,71, 69,88, 57,74, 34,31, 28,56 м.д.
Препарат 113. (3(3S),4R)-3-[3-(3-Аминофенил)-4,4- диметилпентаноил]-4-фенил-2-оксазолидинон (формула FF-5) См. Схему FF.
К суспензии комплекса бромид меди (1) - диметилсульфид (18,76 г) в безводном тетрагидрофуране (60 мл), охлажденной до минус 78oC, добавляют 1,0 М раствор 3-[бис(триметилсилил)- амино]фенилмагнийхлорида в тетрагидрофуране (182,2 мл) и полученную суспензию перемешивают при температуре минус 78oС в течение пяти минут. Дают суспензии в течение 15 минут на греться до температуры минус 15oC, а затем вновь охлаждают до температуры минус 78oC. С помощью воронки для сыпучих веществ добавляют соединение формулы FF-4 Препарата 112 (16,6 г) и перемешивают при температуре минус 78oC в течение 3 часов. Выливают реакционную смесь в насыщенный водный раствор хлорида аммония (200 мл) и экстрагируют этилацетатом. Органический слой отделяют, водную фазу (pH = 8) подщелачивают до pH = 9,5 с помощью концентрированного раствора гидроксида аммония. Водный слой еще трижды экстрагируют этилацетатом, органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Сырой остаток суспендируют вместе с хлороформом (400 мл) и 200 г силикагеля (230-400 меш) при комнатной температуре в течение 2 часов. Отфильтровывают и промывают на фильтре несколько раз хлороформом, а затем метанолом. Фильтрат упаривают в вакууме и остаток очищают методом испарительной хроматографии, элюируя смесью гексан/этилацетат (15-40%), и получают 17,52 г целевого соединения в виде твердого вещества бледно-желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,26-7,12, 7,01, 6,74-6,70, 6,61-6,50, 5,32-5,28, 4,56, 4,11-3,95, 3,48, 2,97-2,91, 0,91 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 172,34, 153,51, 145,37, 142,24, 138,12, 128,67, 128,23, 127,68, 124,71, 119,80, 116,49, 113,02, 69,39, 57,39, 52,30, 34,75, 33,49, 27,83 м.д.
Препарат 114. (3(3S),4S)-3-[3-(3-Биcбeнзилaминoфeнил)- 4,4-димeтилпентаноил]-4-фенил-2-оксазолидинон (формула FF-6) См. Схему FF.
К раствору соединения формулы FF-5 Препарата 113 (15,0 г) в хлористом метилене (190 мл) при комнатной температуре добавляют насыщенный раствор карбоната натрия (48,7 мл), а затем бромистый бензил (14,3 мл) и кипятят полученную смесь с обратным холодильником в течение 24 часов. Охлаждают до комнатной температуры и выливают в смесь воды (300 мл) и хлористого метилена. Органический слой отделяют, промывают насыщенным раствором
соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Очищают методом испарительной хроматографии, элюируя смесью гексан/этилацетат (15-25%), и получают 15,1 г целевого соединения в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,29-6,99, 6,69-6,49, 5,32-5,26, 4,71-4,50, 4,06-3,94, 2,90-2,81, 0,73 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 172,79, 153,78, 148,32, 142,08, 139,04, 138,48, 129,07, 128,59, 128,37, 127,89, 126,83, 124,92, 118,44, 114,64, 110,87, 69,70, 57,68, 54,77, 52,97, 34,84, 33,79, 27,97 м.д.
Препарат 115. [S*,[R*,S*(E)]]-N-(2-Гидрокси-1- метил-2-фенилэтил)метил-N-пентенамид (формула NNN-3) См. Схему NNN.
В трехгорлую круглодонную колбу емкостью 250 мл, снабженную трубкой для подачи азота и капельной воронкой, помещают соединение формулы NNN-1 (6,6 г) (получают взаимодействием промышленно выпускаемой транс-2-пентеновой кислоты с хлористым оксалилом) и тетрагидрофуран (80 мл). В капельную воронку помешают раствор (1R,2S)-эфедрина формулы NNN-2 (7,2 г) и триэтиламин (6,0 мл) в тетрагидрофуране (15 мл) и по каплям добавляют к реакционной смеси. Перемешивают еще в течение часа, выливают реакционную смесь в 200 мл этилацетата, промывают тремя порциями по 25 мл воды и упаривают в вакууме, получая 13,5 г масла. После колоночной хроматографии, используя 100 г силикагеля (элюируют 10-100% смесью этилацетат/гексан), получают 10,75 г целевого соединения в виде бесцветного масла.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 248,1652.
Препарат 116. [1R*-[1R*(R*)2S*] ] -3-Амино-бета-этил-N-(2-гидрокси-1-метил-2-фенилэтил) -N-метилбензолпропанамид (формула NNN-4) См. Схему NNN.
В трехгорлую круглодонную колбу емкостью 50 мл, снабженную трубкой для подачи азота, помещают целевой продукт Препарата 115 (0,247 г) и 5 мл трет-бутилметилового эфира и охлаждают до 0oC. По каплям добавляют пропилмагнийхлорид (0,55 мл 2,0 М раствора в эфире) и реакционную смесь перемешивают еще в течение 15 минут. По каплям добавляют 3-[бис(триметилсилил)-амино] фенилмагнийхлорида (2,0 мл 1,0 М раствора в тетрагидрофуране, 2,0 ммол) и полученную смесь перемешивают при температуре 0oC еще в течение двух часов. Прерывают реакцию, добавив раствор хлорида аммония (pH доводят до величины 8 с помощью гидроксида аммония) и выливают в смесь 100 мл эфира и 5 мл воды. Органический слой отделяют, дополнительно промывают раствором хлорида аммония и водой и упаривают в вакууме, получая 0,72 г масла желтого цвета. Сырое масло растворяют в хлороформе и добавляют к образовавшемуся раствору силикагель. Полученную смесь перемешивают при комнатной температуре в течение 1,5 часов, отфильтровывают через целит, промывают фильтр метанолом и упаривают в вакууме, получая 0,38 г масла желтого цвета. После колоночной хроматографии, используя 50 г силикагеля (элюируют 20-100% смесью этилацетат/гексан), и получают 0,174 г целевого соединения в виде масла.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 340,2162.
Препарат 117. [1R*-[1R*(R*)2S*]]-3- бис(фенилметил)амино]-бета-этил-N-(2-гидрокси-1-метил-2- фенилэтил)-N-метилбензолпропанамид (формула NNN-5) См. Схему NNN.
В трехгорлую круглодонную колбу емкостью 50 мл, снабженную обратным холодильником с трубкой для подачи азота, помещают целевой продукт Препарата 116 (0,548 г) в 8 мл ацетонитрила. Добавляют карбонат натрия (0,375 г) и бромистый бензил (0,42 мл) и реакционную смесь кипятят с обратным холодильником в течение 4 часов. Реакционную смесь упаривают в вакууме и выливают в 100 мл этилацетата и 10 мл воды. Органический слой отделяют, дополнительно промывают 10 мл воды и упаривают в вакууме, получая 1,0 г масла желтого цвета. После колоночной хроматографии, используя 65 г силикагеля (элюируют смесями 20-100% этилацетат/гексан и 5% метанол/хлористый метилен), получают 0,447 г целевого соединения в виде масла бледно-желтого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 520,3102.
Препарат 118. 1-Фенил-6,6,6-трифтор-3-гексанол (формула РРР-2) См. Схему PPP.
К перемешиваемому раствору 4,0 г 4,4,4-трифторбутирата формулы РРР-1 в 25 мл тетрагидрофурана при температуре минус 78oС по каплям добавляют 24 мл DiBAL-H (1 М раствор в толуоле) и полученный раствор перемешивают в течение 90 минут. В отдельной колбе, содержащей 680 мг магниевых стружек и 5 мл тетрагидрофурана, добавляют 1-фенил-2-бромэтан в 20 мл тетрагидрофурана так, чтобы смесь равномерно кипела. Кипятят с обратным холодильником еще в течение часа, охлаждают до комнатной температуры и с помощью канюли добавляют к полученной ранее реакционной смеси, содержащей DiBAL-H. Полученную суспензию белого цвета перемешивают 30 минут при температуре минус 70oC и дают ей нагреться до комнатной температуры. Разлагают реакционную смесь, добавив насыщенный раствор хлорида аммония, разбавляют 1N раствором соляной кислоты, чтобы растворить осадок солей, и экстрагируют этилацетатом. Органические вытяжки объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия, отфильтровывают и упаривают в вакууме. Сырой продукт очищают методом испарительной хроматографии на силикагеле (элюируют смесями 20%-ным раствором этилацетата в гексане) и получают 2,0 г целевого соединения в виде бесцветного масла.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 232,1088.
ИК спектр (чистая жидкость): 3385, 2950, 1455, 1255, 1140, 700 см-1.
Препарат 119. 1-Фенил-6,6,6-трифтор-3-гексанон (формула РРР-3) См. Схему PPP.
К раствору 0,48 мл хлористого оксалила в 10 мл дихлорметана при температуре минус 60oC по каплям добавляют 0,81 мл диметилсульфоксида. Полученный раствор перемешивают в течение 5 минут и добавляют 860 мг 1-фенил-6,6,6-трифтор-3-гексанола (формула РРР-2) Препарата 118 в 5 мл дихлорметана и перемешивают 15 минут. Добавляют триэтиламин (1,5 мл), дают смеси нагреться до комнатной температуры, разбавляют водой и слои разделяют. Водный слой экстрагируют дихлорметаном, органические вытяжки объединяют, сушат над безводным сульфатом натрия, отфильтровывают и упаривают. Полученное масло очищают методом испарительной хроматографии на силикагеле и получают 600 мг целевого соединения в виде масла.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,2-7,3, 2,9,2,7, 2,4 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 206, 140, 129, 128, 126, 125, 44, 35, 30, 28.
Препарат 120. 5,6-Дигидро-4-гидрокси-фенэтил-6-(3', 3',3'- трифторпропил)-2H-пиран-2-он (формула PPP-4) См. Схему PPP.
К суспензии 350 мг 50%-ного гидрида натрия в 10 мл тетрагидрофурана при температуре 0oC по каплям добавляют 0,78 мл метилового эфира ацетоуксусной кислоты. Перемешивают 30 минут, добавляют 4,5 мл 1,6 М раствора н-бутиллития в гексане и перемешивают еще в течение 15 минут. Добавляют раствор 840 мг 1-фенил-6,6,6-трифтор-3-гексанона формулы PPP-3 Препарата 119 в 5 мл тетрагидрофурана, перемешивают при 0oC в течение 15 минут, дают смеси нагреться до комнатной температуры и перемешивают еще в течение часа. Разлагают реакционную смесь насыщенным водным раствором хлорида аммония и экстрагируют этилацетатом. Органические вытяжки объединяют, промывают водой и насыщенным раствором соли, упаривают в вакууме и растворяют в 20 мл тетрагидрофурана. Раствор разбавляют 60 мл воды и обрабатывают 20 мл 1N раствора гидроксида натрия, перемешивают 3 часа при комнатной температуре и подкисляют концентрированной соляной кислотой. Смесь экстрагируют дихлорметаном, сушат над безводным сульфатом натрия, отфильтровывают и упаривают в вакууме. Сырой продукт очищают методом испарительной хроматографии на силикагеле (элюируют 30%-ным раствором этилацетата в гексане) и получают 870 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Элементный анализ, найдено: С, 61,14; H, 5,45.
Препарат 121. Фенилметиловый эфир [3-[1-[5,6-Дигидpo- 4-гидрокси-2-оксо-6-(2-фенэтил)-6-(3,3,3-трифторпропил)- 2H-пиран-3-ил]-2,2-диметилпропил] фенилкарбаминовой кислоты (формула QQQ-3, где R1 обозначает трет-бутил) См. Схему QQQ.
К целевому соединению Препарата 120 (850 мг) в 25 мл тетрагидрофурана при 0oC добавляют 750 мг трихлорида алюминия, перемешивают в течение 15 минут, а затем добавляют 700 мг 3-бензилоксикарбониламинобензальдегида. Смесь перемешивают при комнатной температуре в течение 2 часов, а затем добавляют 2 г моногидрата карбоната натрия и 0,1 мл воды, перемешивают в течение 30 минут и отфильтровывают через целит, промывая на фильтре тетрагидрофураном. Фильтрат упаривают и остаток растворяют в 25 мл тетрагидрофурана, добавляют 285 мг комплекса бромид меди (1) - диметилсульфид и смесь перемешивают в течение 15 минут, а затем в течение 15-20 минут по каплям добавляют 11 мл 1 М раствора трет-бутилмагнийбромида в тетрагидрофуране. Полученную смесь коричневого цвета перемешивают еще 15 минут, охлаждают до 0oC и разлагают, добавив 50 мл воды. Слои разделяют и водный слой подкисляют соляной кислотой, чтобы растворить неорганические соли, а затем экстрагируют этилацетатом. Органические вытяжки объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия, отфильтровывают и упаривают. Очищают методом испарительной хроматографии на силикагеле, элюируя раствором этилацетата в гексане, и получают 1,19 г целевого соединения в виде пенообразного вещества темно-желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,1-7,7, 6,7, 6,5, 4,4 1,8-2,8, 1,16 м. д.
Масс-спектр высокого разрешения: 609,2711.
Препарат 122. Препаративное расщепление фенилметилового эфира [3-[1-[5,6-Дигидро-4-гидрокси-2-оксо -6-(2-фенэтил)-6-(3,3,3-трифторпропил)-2H-пиран-3-ил]-2,2- диметилпропил]фенилкарбаминовой кислоты (формула QQQ-3, где R1 обозначает трет-бутил) на 4 изомера 3(R или S)-[1-[5,6-дигидpo-4-гидpoкcи-2-oкco-6-(R или S)-(2- фенэтил)-6-(R или S)-(3,3,3-трифторпропил)-2H-пиран-3-ил] - 2,2-диметилпропил]фенилкарбаминовой кислоты (формулы QQQ-4-7, где R1 обозначает трет-бутил) См. Схему QQQ.
Первую фазу расщепления проводят на колонке 5,1 x 25 см (R,R)Whelk-O 1, элюируя 15%-ным (об/об) раствором изо-пропанола в гексане со скоростью подачи 99 мл/мин. ((R,R)Whelk-O 1 является товарным знаком компании "Regis Technologies, Inc. ", Morton Grove, IL 60053). Пики, которые элюируются со временем приблизительно 54 и 87 минут, представляют собой, в соответствии анализам с помощью приведенной ниже Системы A, чистые изомер 3 и изомер 2, соответственно. Смесь нерасщепленных изомера 1 и изомера 4 элюируется со временем приблизительно 64 минуты и ее подвергают дальнейшей обработке, как указано ниже.
При проведении второй фазы расщепления смесь, которая элюируется со временем приблизительно 64 минуты, инжектируют в колонку 2,1 x 25 см Chiralcel OD (от компании "Chiral Technologies, Inc") и элюируют 35%-ным (об/об) раствором изо-пропанола в гексане со скоростью подачи 8 мл/мин. Пики, которые элюируются со временами приблизительно 8,7 и 23,9 минут, представляют собой изомер 1 и изомер 4, соответственно.
При осуществлении обеих фаз расщепления энантиомеров соответствующие фракции объединяют (после проведения анализа с использованием Системы A), объединенные фракции упаривают досуха с помощью ротационного испарителя под давлением 30 мм рт.ст. с температурой бани 50oC.
Четыре составляющих энантиомера в порядке выхода из Системы A обозначают как Пик ≠1 , Пик ≠2 , Пик ≠3 и Пик ≠4. Система A представляет собой колонку 0,46 x 25 см Chiralcel OD-H, которую элюируют 20%-ным (об/об) раствором изо-пропанола в гексане со скоростью подачи 1,0 мл/мин. (Chiralcel OD-H является торговым знаком компании "Chiral Technologies, Inc.", Exton, PA 19341).
Препарат 123. 3(R или S)-[1-(3-Аминофенил)-2,2- диметилпропил]-4-гидрокси-5,6-дигидро-6(R или S)-фенэтил-6- (3,3,3-трифторпропил)-2H-пиран-2-он (формула QQQ-8, где R1 обозначает трет-бутил) См. Схему QQQ.
К раствору 210 мг соединения, идентифицированного как пик 1 Препарата 122 в 10 мл метанола добавляют 400 мг формиата аммония и 40 мг 10%-ного палладия на активированном угле, перемешивают 2 часа, отфильтровывают через целит, промывая на фильтре метанолом. Фильтрат разбавляют этилацетатом и промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия, отфильтровывают и упаривают в вакууме, получая 160 мг целевого соединения в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 6,9-7,3, 6,6, 4,1, 2,6-2,7, 1,9-2,4, 1,0 м.д.
ТСХ (силикагель GF): Rf 0,24 (40% этилацетата в гексане).
Пример 266. 5-Циано-N-[3(R или S)-[1-[5,6-дигидро-4- гидрокси-2-оксо-6-(2-фенэтил)-6-(R или S)-(3,3,3- трифторпропил)-2H-пиран-3-ил]-2,2-диметилпропил] фенил] -2- пиридинсульфонамид (формула QQQ-13: R1 обозначает трет-бутил, R2 обозначает 5-циано-2-пиридинил) См. Схему QQQ.
Раствор целевого продукта Препарата 123 (50 мг), пиридина (30 мл) и 5-цианопиридин-2-сульфохлорида (30 мг) в дихлорметане перемешивают при температуре 0oC в течение двух часов. Сырую реакционную смесь хроматографируют на силикагеле и получают целевое соединение в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 642,2267.
Пример 267. N-[3(R или S)-[1-[5,6-Дигидpo-4-гидpoкcи- 2-oксо-6-(R или S)-(2-фенэтил)-6-(3,3,3-трифторпропил) -2H-пиран-3-ил] -2,2-диметилпропил] фенил]-1-метил-1H-имидазол-4-сульфонамид (формула QQQ-13: R1 обозначает трет-бутил, R2 обозначает 1-метил-4-имидазолил) См. Схему QQQ.
Целевое соединение получают по методике, приведенной в Примере 266, заменив 5-цианопиридин-2-сульфохлорид на 1-метилимидазол-4-сульфохлорид.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 619,2298.
Пример 268. 5-Амино-N-[3(R или S)-[1-[5,6-дигидро-4- гидрокси-2-оксо-6-(2-фенэтил)-6-(R или S)-(3,3,3- трифторпропил)-2H-пиран-3-ил]-2,2-диметилпропил] фенил] -2- пиридинсульфонамид (формула QQQ-13: R1 обозначает трет-бутил, R2 обозначает 5-амино-2-пиридинил) См. Схему QQQ.
Раствор целевого продукта Препарата 123 (50 мг), пиридина (30 мл) и 5-цианопиридин-2-сульфохлорида (30 мг) в дихлорметане перемешивают при температуре 0oC в течение двух часов. Сырую реакционную смесь хроматографируют на силикагеле и получают сульфонамид в виде аморфного твердого вещества белого цвета. Его растворяют в 4 мл метанола, добавляют 25 мг формиата аммония и 5 мг 10%-ного палладия на угле, перемешивают 1 час при комнатной температуре, разбавляют водой и экстрагируют дихлорметаном, сушат над безводным сульфатом натрия, отфильтровывают и упаривают в вакууме, получая целевое соединение в виде твердого аморфного вещества беловатого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 632,2393.
Препарат 124. 3(R или S)-[1-(3-Аминофенил)-2,2- диметилпропил]-4-гидрокси-5,6-дигидро-6(R или S)-фенэтил-6- (3',3',3'-трифторпропил)-2H-пиран-2-он (формула QQQ-9, где R1 обозначает трет-бутил) См. Схему QQQ.
Целевое соединение получают в соответствии с методикой, приведенной в Препарате 123, взяв в качестве исходного соединения, выделенное в виде пика 2 в Препарате 122, и используя материалы и реагенты, известные или доступные специалистам в области органического синтеза.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 6,9-7,3, 6,6, 4,1, 2,6-2,7, 1,9-2,4, 1,0 м.д.
ТСХ (силикагель GF): Rf 0,24 (40% этилацетата в гексане).
Пример 269. 5-Циано-N-[3(R или S)-[1-[5,6-дигидpo-4- гидpoкси-2-оксо-6-(2-фенэтил)-6-(R или S)-(3,3,3-трифторпропил) -2H-пиран-3-ил]-2,2-диметилпропил] фенил]-2-пиридинсульфонамид (формула QQQ-13: R1 обозначает трет-бутил, R2 обозначает 5-циано-2-пиридинил) См. Схему QQQ
Раствор целевого продукта Препарата 124 (50 мг), пиридина (30 мл) и 5-цианопиридин-2-сульфохлорида (30 мг) в дихлорметане перемешивают при температуре 0oC в течение двух часов. Сырую реакционную смесь хроматографируют на силикагеле и получают целевое соединение в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 642,2260.
Пример 270. N-[3(R или S)-[1-[5,6-Дигидpo-4-гидpoкси- 2-оксо-6-(R или S)-(2-фенэтил)-6-(3,3,3-трифторпропил)-2H- пиран-3-ил] -2,2-диметилпропил] фенил] -1-метил-1H-имидазол-4- сульфонамид (формула QQQ-14: R1 обозначает трет-бутил, R2 обозначает 1-метил-4-имидазолил) См. Схему QQQ.
Целевое соединение получают по методике, приведенной в Примере 266, заменив 5-цианопиридин-2-сульфохлорид на 1-метилимидазол-4-сульфохлорид.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 619,2362.
Пример 271. 5-Амино-N-[3(R или S)-[1-[5,6-дигидpo-4- гидpoкси-2-оксо-6-(2-фенэтил)-6-(R или S)-(3,3,3- трифторпропил)-2H-пиран-3-ил]-2,2-диметилпропил] фенил] -2-пиридинсульфонамид (формула QQQ-14: R1 обозначает трет-бутил, R2 обозначает 5-амино-2-пиридинил) См. Схему QQQ.
Целевое соединение получают аналогично методике, приведенной в Примере 268.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 632,2387.
Препарат 125. 3(S или R)-[1-(3-Аминофенил)-2,2- диметилпропил]-4-гидрокси-5,6-дигидро-6-(R или S)-фенэтил-6-(R или S) -(3',3',3'-трифторпропил)-2H-пиран-2-он (формула QQQ-10, где R обозначает трет-бутил) См. Схему QQQ.
Целевое соединение получают в соответствии с методикой, приведенной в Препарате 123, взяв в качестве исходного соединение, выделенное в виде пика 3 в Препарате 122, и используя материалы и реагенты, известные или доступные специалистам в области органического синтеза.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 6,9-7,3, 6,6, 4,1, 2,6-2,7, 1,9-2,4, 1,0 м.д.
ТСХ (силикагель GF): Rf 0,24 (40% этилацетата в гексане).
Пример 272. 5-Циано-N-[3(R или S)-[1-[5,6-дигидро-4- гидрокси-2-оксо-6-(2-фенэтил)-6-(R или S)-(3,3,3- трифторпропил) -2H-пиран-3-ил]-2,2-диметилпропил] фенил[-2-пиридинсульфонамид (формула QQQ-15: R1 обозначает трет-бутил, R2 обозначает 5-циано-2-пиридинил) См. Схему QQQ.
Раствор целевого продукта Препарата 125 (50 мг), пиридина (30 мл) и 5-цианопиридин-2-сульфохлорида (30 мг) в дихлорметане перемешивают при температуре 0oC в течение двух часов. Сырую реакционную смесь хроматографируют на силикагеле и получают целевое соединение в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 642,2254.
Пример 273. N-[3(R или S)-[1-[5,6-Дигидро-4- гидрокси-2-оксо-6-(R или S)-(2-фенэтил)-6-(3,3,3-трифторпропил)-2H- пиран-3-ил] -2,2-диметилпропил] фенил] -1-метил-1H-имидазол -4-сульфонамид (формула QQQ-15: R1 обозначает трет-бутил, R2 обозначает 1-метил-4-имидазолил) См. Схему QQQ.
Целевое соединение получают по методике, приведенной в Примере 266, заменив 5-цианопиридин-2-сульфохлорид на 1-метилимидазол-4-сульфохлорид.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 642,2397.
Пример 274. 5-Амино-N-[3(R или S)-[1-[5,6-дигидро-4- гидрокси-2-оксо-6-(2-фенэтил)-6-(R или S)-(3,3,3-трифторпропил)-2H- пиран-3-ил]-2,2-диметилпропил] фенил]-2-пиридинсульфонамид (формула QQQ-15: R1 обозначает трет-бутил, R2 обозначает 5-амино-2-пиридинил) См. Схему QQQ.
Целевое соединение получают аналогично методике, приведенной в Примере 268.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 632,2393.
Препарат 126. 3(S или R)-[1-(3-Аминофенил)-2,2- диметилпропил]-4-гидрокси-5,6-дигидро-6-(S или R)-фенэтил-6- (3',3',3'-трифторпропил)-2H-пиран-2-он (формула QQQ-11, где R1 обозначает трет-бутил) См. Схему QQQ.
Целевое соединение получают в соответствии с методикой, приведенной в Препарате 123, взяв в качестве исходного соединения, выделенное в виде пика 4 в Препарате 122, и используя материала и реагенты, известные или доступные специалистам в области органического синтеза.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 6,9-7,3, 6,6, 4,1, 2,6-2,7, 1,9-2,4, 1,0 м.д.
ТСХ (силикагель GF): Rf 0,24 (40% этилацетата в гексане).
Пример 275. 5-Циaнo-N-[3(R или S)-[1-[5,6-дигидpo-4- гидpoкси-2-оксо-6-(2-фенэтил)-6-(R или S)-(3,3,3- трифторпропил)-2H-пиран-3-ил]-2,2-диметилпропил] фенил] -2- пиридинсульфонамид (формула QQQ-16: R1 обозначает трет-бутил, R2 обозначает 5-циано-2-пиридинил) См. Схему QQQ.
Раствор целевого продукта Препарата 126 (50 мг), пиридина (30 мл) и 5-цианопиридин-2-сульфохлорида (30 мг) в дихлорметане перемешивают при температуре 0oC в течение двух часов. Сырую реакционную смесь хроматографируют на силикагеле и получают целевое соединение в виде аморфного твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 642,2248.
Пример 276. N-[3(R или S)-[1-[5,6-Дигидро-4-гидрокси-2-оксо-6- (R или S)-(2-фенэтил)-6-(3,3,3-трифторпропил)-2H-пиран-3-ил]-2,2-диметилпропил]фенил] -1-метил-1H-имидазол-4-сульфонамид (формула QQQ-16: R1 обозначает трет-бутил, R2 обозначает 1-метил-4-имидазол) См. Схему QQQ.
Целевое соединение получают по методике, приведенной в Примере 266, заменив 5-цианопиридин-2-сульфохлорид на 1-метилимидазол-4-сульфохлорид.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 620,2403.
Пример 277. 5-Амино-N-[3(R или S)-[1-[5,6-дигидpo-4- гидpoкси-2-оксо-6-(2-фенэтил)-6-(R или S)-(3,3,3- трифторпропил)-2H-пиран-3-ил]-2,2-диметилпропил] фенил] -2- пиридинсульфонамид (формула QQQ-16: R1 обозначает трет-бутил, R2 обозначает 5-амино-2-пиридинил) См. Схему QQQ.
Целевое соединение получают аналогично методике, приведенной в Примере 268.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 632,2406.
Пример 278. N-[3 (R или S)-[1-[5,6-Дигидро-4-гидрокси-2-оксо-6- (2-фенэтил)-[6-(R или S)-пропил]-2H-пиран-3-ил]-2,2-диметилпропил] фенил]-2-пиридинсульфонамид
Целевое соединение получают аналогично приведенным ранее методикам, используя изомер 2 Препарата 143.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 562,2527.
Пример 279. N-[3(R или S)-[1-[5,6-Дигидpo-4-гидpoкси-2-оксо-6- (2-фенэтил)-6-(R или S)-пропил-2H-пиран-3-ил] -2,2-диметилпропил] фенил]-2-пиридинсульфонамид
Целевое соединение получают аналогично приведенным ранее методикам, используя изомер 1 Препарата 143.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 562,2528.
Препарат 127. 2-Меркапто-4-трифторметилпиридин
К 1,0 г 2-хлор-4-трифторметилпиридина (от компании "Lancaster Chemical Co. ") добавляют 10 мл абсолютного этанола и 417 г тиомочевины. Реакционную смесь кипятят с обратным холодильником в течение 4 часов, а затем добавляют 1,25 мл раствора 7,44 г гидроксида калия в 20 мл воды. Кипятят смесь с обратным холодильником еще в течение часа, охлаждают и выливают в 100 мл 1,0 N раствора гидроксида натрия. Полученный раствор трижды экстрагируют по 100 мл хлористым метиленом, а водную фазу подкисляют до pH = 4 с помощью ледяной уксусной кислоты и трижды экстрагируют по 100 мл хлористым метиленом. Органические вытяжки объединяют, сушат над безводным сульфатом натрия, отфильтровывают и упаривают досуха, получая 501 мг кристаллического вещества желтого цвета.
Вещество обладает следующими физическими характеристиками:
Элементный анализ, найдено: С 40,22; H 2,33; N 8,07; S 17,59.
Масс-спектр высокого разрешения: 179,0019.
Препарат 128. 2-Хлорсульфонил-4-трифторметилпиридин
К 425 мг 2-меркапто-4-трифторметилпиридина Препарата 127 добавляют 10 мл 1N водного раствора соляной кислоты. Охлаждают реакционную смесь до 0oC и через охлажденную смесь в течение 15 минут пропускают газообразный хлор. Реакционную смесь отфильтровывают и полученное твердое вещество тщательно промывают водой. Полученное твердое вещество белого цвета растворяют в хлористом метилене и дважды промывают насыщенным водным раствором бикарбоната натрия и снова водой. Сушат органический раствор над сульфатом натрия (безводным), отфильтровывают и упаривают досуха, получая 300 мг 2-хлорсульфонил-4-трифторметилпиридина, который используют без дальнейшей очистки и хранят до момента использования при температуре минус 78oC.
Препарат 129. 2-Хлорсульфонил-5-трифторметилпиридин
Заменив при проведении реакции, описанной ранее в Препарате 128, 2-меркапто-4-трифторметилпиридин на 2-меркапто-5- трифторметилпиридин, получают 2-хлорсульфонил-5- трифторметилпиридин в виде бесцветного масла, которое медленно кристаллизуется. Полученное вещество используют без дальнейшей очистки и хранят до момента использования при температуре минус 78oC.
Препарат 130. 3-[1-[5,6-Дигидpo-4-гидpoкcи-2-oксо-6,6- ди-н-пропил-2H-пиран-3-ил] пропил] фенилкарбаминовая кислота (формула SSS-1: R1 обозначает этил) См. Схему SSS.
К 7,2 г трихлорида алюминия при температуре минус 70oC в токе азота добавляют 180 мл тетрагидрофурана. Смеси дают нагреться до температуры 0oC и перемешивают в течение 15 минут, а затем добавляют 5,38 г соединения формулы SSS-A. (См. Схему SSS), полученного по методике, аналогичной приведенной для Препарата 17. Реакционную смесь перемешивают в течение 15 минут и добавляют 6,88 г 3-аминоCbz-бензальдегида (формула SSS-B, см. Схему SSS). Реакционную смесь перемешивают в течение 15 минут при температуре 0oC, а затем 3 часа при комнатной температуре. Охлаждают реакционную смесь до 0oC и при энергичном перемешивании добавляют 35 г моногидрата карбоната натрия, а затем 1,6 мл воды. Перемешивают при температуре 0oC еще в течение 15 минут, добавляют 120 мл тетрагидрофурана и смесь отфильтровывают через целит. Целит тщательно промывают тетрагидрофураном и полученный раствор в тетрагидрофуране упаривают досуха в вакууме и получают смолу янтарного цвета. Остаток растворяют в 180 мл тетрагидрофурана, раствор охлаждают до минус 5oC и добавляют 3,2 г комплекса бромид меди (1) - диметилсульфид. Смесь перемешивают в течение 15 минут и по каплям, так чтобы температура не поднималась выше 0oC, добавляют 65 мл 2 М раствора этилмагний-хлорида в тетрагидрофуране. Перемешивают смесь еще в течение 15 минут, осторожно добавляют 9 мл воды, а затем 45 мл 1N раствора соляной кислоты. Все операции проводят при температуре 0oC. Полученную смесь выливают в 2 л этилового эфира и добавляют 200 мл воды. Водный слой отделяют, а органическую фазу дополнительно трижды промывают 10%-ным водным раствором карбоната аммония, а затем один раз водой. Органические вытяжки сушат над сульфатом натрия, отфильтровывают и упаривают досуха, получая 10,2 г сырого продукта в виде пенообразного вещества. Полученное вещество хроматографируют на силикагеле, элюируя 2%-ным этилацетатом в хлористом метилене, и получают 4,74 г 3-[1-[5,6- дигидpo-4-гидpoкcи-2-oкco-6,6-ди-н-пропил-2H-пиран-3- ил]пропил]фенил-карбаминовой кислоты.
Препарат 130А. 3-[1-[5,6-Дигидpo-4-гидpoкcи-2-oкco-6- фенэтил-6-пропил-2H-пиран-3-ил]пропил]фенил-карбаминовая кислота (формула RRR-1: R1 обозначает этил) См. Схему RRR.
Целевое соединение получают по методике, приведенной для Препарата 130, взяв в качестве исходного соединение по Препарату 17.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 6,9-7,5, 5,1, 4,0, 1,4-2,7, 0,9 м.д.
ТСХ (силикагель GF: Rf 0,28 (30% этилацетата в гексане).
Препарат 131
Препаративным хиральным расщеплением 3-[1-[5,6-дигидро-4-гидрокси-2-оксо-6,6-ди-н-пропил-2H-пиран-3- ил] пропил] фенил-карбаминовой кислоты (формула SSS-1: R1 обозначает этил; см. Схему SSS) получают два изомера 3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6,6-ди-н-пропил-2H-пиран-3- ил] пропил] фенил-карбаминовой кислоты (формулы SSS-3 и SSS-4: R1 обозначает этил; см. Схему SSS).
Образцы целевого соединения Препарата 130 инжектируют в колонку 2,1 x 25 см Chiracel OD и элюируют 20%-ным раствором (об/об) изо-пропанола в гексане со скоростью подачи 10 мл/мин. Вещество, которое элюируется со временем приблизительно 19,1 минуты, представляет собой 3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6,6-ди-н-пропил-2H- пиран-3-ил] пропил]фенил-карбаминовую кислоту. [α]
Препарат 132. 3(R или S)-[1-(3-Аминофенил)пропил]-4- гидрокси-5,6-дигидро-6,6-дипропил-2H-пиран-2-он (формула SSS-5: R1 обозначает этил) См. Схему SSS.
К 1,04 г 3(R или S)-[1-[5,6-дигидpo-4-гидpoкcи-2- oкco-6,6-ди-н-пропил-2H-пиран-3-ил]пропил]фенил-карбаминовой кислоты (формула SSS-3 см. Схему SSS) Препарата 131, соединению, которое идентифицировано как пик 1 после хирального расщепления продукта Препарата 131, добавляют 20 мл метанола и 1,29 г формиата аммония. Когда все вещества растворятся, добавляют 275 мг 10%-ного палладия на угле и реакционную смесь перемешивают при комнатной температуре в течение 60 минут. Реакционную смесь отфильтровывают (через целит) и метанольный раствор упаривают досуха. Сырой продукт выливают в смесь хлористого метилена и воды. Органический слой отделяют, дважды промывают водой и сушат над сульфатом натрия. Раствор в хлористом метилене отфильтровывают и упаривают досуха, получая 625 мг 3(R или S)-[1-(3-аминофенил)пропил]-4-гидрокси-5,6-дигидро-6,6- дипропил-2H-пиран-2-она в виде аморфного пенообразного вещества.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 131
[α]
Препарат 133. 3(R или S)-[1-(3-Aминoфeнил)пpoпил]-4- гидpoкси-5,6-дигидро-6,6-дипропил-2H-пиран-2-он (формула SSS-6: R1 обозначает этил) См. Схему SSS.
К 825 мг 3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо- 6,6-ди-н-пропил-2H-пиран-3-ил] пропил] фенил] -карбаминовой кислоты (формулы SSS-4; см. Схему SSS) Препарата 131, соединению, которое идентифицировано как пик 2 после хирального расщепления продукта Препарата 131, добавляют 20 мл метанола и 1,02 г формиата аммония. Когда все вещества растворятся, добавляют 210 мг 10%-ного палладия на угле и реакционную смесь перемешивают при комнатной температуре в течение 60 минут. Реакционную смесь отфильтровывают (через целит) и метанольный раствор упаривают досуха. Сырой продукт выливают в смесь хлористого метилена и воды. Органический слой отделяют, дважды промывают водой и сушат над сульфатом натрия. Раствор в хлористом метилене отфильтровывают и упаривают досуха, получая 483 мг целевого соединения в виде аморфного пенообразного вещества.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 331
[α]
Пример 280. 5-Трифторметил-N-[3-[1-[4-гидрокси-2-оксо- 6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] пропил] фенил]- 2-пиридинсульфонамид (формула SSS-9: R1 обозначает этил, R2 обозначает 5-трифторметилпиридин) См. Схему SSS'.
У целевого соединения Препарата 130 удаляют защитную группу в соответствии с методикой, приведенной для Препарата 132, и получают соединение формулы SSS-2. К 132 мг соединения формулы SSS-2 добавляют 15 мл хлористого метилена и 66 мкл пиридина. Реакционную смесь охлаждают до минус 5oC и добавляют 98 мг 2-хлорсульфонил-5-трифторметилпиридина (продукт Препарата 129). Перемешивают при температуре 0oC в течение 60 минут и раствор помещают в колонку с силикагелем, элюируют 10%-ным раствором этилацетата в хлористом метилене и собирают фракции с 5-тpифтopмeтил-N-[3-[1-[4-гидpoкcи-2-oксо-6,6-ди-н-пропил- 5,6-дигидро-2H-пиран-3-ил]пропил]фенил]-2-пиридинсульфонамидом. Rf = 0,6 (10% этилацетата в хлористом метилене). Органический растворитель упаривают досуха и получают 177 мг 5-тpифтopмeтил-N-[3-[1-[4-гидpoкcи-2-oкco-6,6-ди-н-пропил-5,6-дигидро-2H- пиран-3-ил] пропил] фенил] -2-пиридинсульфонамида.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 540, 497, 411, 401, 383, 342, 331, 197, 174, 146, 133.
Масс-спектр высокого разрешения: 540,1938.
TCX: Rf 0,6 (10% этилацетата в хлористом метилене).
Спектр ПМР (дейтероацетон): δ 8,91, 8,21-8,19, 7,12, 6,98-6,96, 6,86-6,83, 3,85-3,79, 2,46, 2,10-1,98, 1,84-1,75, 1,58-1,47, 1,27-1,15, 0,82-0,72 м.д.
Пример 281. 5-Tpифтopмeтил-N-[3(R или S)-[1-[4-гидpoкcи-2-оксо-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] - пропил] фенил] -2-пиридинсульфонамид (формула SSS-7: R1 обозначает этил, R2 обозначает 5-трифторметилпиридин) См. Схему SSS.
К 66 мг целевого продукта Препарата 132 (формула SSS-5, Схема SSS) добавляют 8 мл хлористого метилена и 33 мкл пиридина. Реакционную смесь охлаждают до минус 5oC и добавляют 49 мг 2-хлорсульфонил-5-трифторметилпиридина (продукт Препарата 129). Перемешивают при температуре 0oC в течение 60 минут и раствор помещают в колонку с силикагелем и элюируют 10%-ным раствором этилацетата в хлористом метилене и собирают фракции с 5-трифторметил-N-3(R или S)-[1-[4-гидрокси-2-оксо-6,6-ди-н- пропил-5,6-дигидро-2H-пиран-3-ил] пропил]фенил]-2-пиридинсульфонамидом. Rf = 0,6 (10% этилацетата в хлористом метилене). Органический растворитель упаривают досуха и получают 69 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 540, 497, 411, 401, 383, 342, 331, 197, 174, 146, 133.
TCX: Rf 0,6 (10 этилацетата в хлористом метилене).
Спектр ПМР (дейтероацетон): δ 8,91, 8,21-8,19, 7,12, 6,98-6,96, 6,86-6,83, 3,85-3,79, 2,46, 2,10-1,98, 1,84-1,75, 1,58-1,47, 1,27-1,15, 0,82-0,72 м.д.
Пример 282. 5-Трифторметил-N-[3(R или S)-[1-[4-гидрокси- 2-оксо-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] пропил] фенил] -2- пиридинсульфонамид (формула SSS-8: R1 обозначает этил, R2 обозначает 5-трифторметилпиридин) См. Схему SSS.
5-Трифторметил-N-3(R или S)-[1-[4-гидрокси-2-оксо-6,6- ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] пропил] фенил] - 2-пиридинсульфонамид получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 281, взяв в качестве исходного продукт Препарата 133 (формула SSS-6).
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 540, 497, 411, 401, 383, 342, 331, 197, 174, 146, 133.
TCX: Rf 0,6 (10% этилацетата в хлористом метилене).
Спектр ПМР (дейтероацетон): δ 8,91, 8,21-8,19, 7,12, 6,98-6,96, 6,86-6,83, 3,85-3,79,2,46, 2,10-1,98, 1,84-1,75, 1,58-1,47, 1,27-1,15, 0,82-0,72 м.д.
Пример 283. 4-Трифторметил-N-[3(R или S)-[1-[4- гидpoкcи-2-оксо-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] - пропил]фенил]-2-пиридинсульфонамид (формула SSS-7: R1 обозначает этил, R2 обозначает 4-трифторметилпиридин) См. Схему SSS.
4-Трифторметил-N-3(R или S)-[1-[4-гидрокси-2-оксо-6,6-ди-н- пропил-5,6-дигидро-2 H-пиран-3-ил]пропил]фенил]-2-пиридинсульфонамид получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 281, заменив пиридинсульфохлорид на продукт Препарата 128.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 146, 145, 139, 133, 71, 57, 55, 43, 41
Масс-спектр высокого разрешения: 540,1902.
Пример 284. 4-Трифторметил-N-[3(R или S)-[1-[4- гидрокси-2-оксо-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3- ил] пропил] фенил]-2-пиридинсульфонамид (формула SSS-8: R1 обозначает этил, R2 обозначает 4-трифторметилпиридин) См. Схему SSS.
4-Трифторметил-N-3(R или S)-[1-[4-гидpoкcи-2-oкco-6,6- ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] -пропил] фенил] -2-пиридинсульфонамид получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 282, заменив пиридинсульфохлорид на продукт Препарата 128.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 146, 145, 139, 133, 71, 57, 55, 43, 41.
Масс-спектр высокого разрешения: 540,1896.
Пример 285. 5-Tpифтopмeтил-N-[3(R или S)-[1-[4- гидpoкcи-2-оксо-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] - 2,2-диметилпропил]фенил]-2-пиридинсульфонамид (формула TTT-6: R1 обозначает трет-бутил, R2 обозначает пропил, R3 обозначает 5-трифторметил-2-пиридинил). См. Схему TTT.
5-Трифторметил-N-3(R или S)-[1-[4-гидрокси-2-оксо-6,6- ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] -2,2-диметилпропил] фенил]-2-пиридинсульфонамид получают в виде аморфного твердого вещества по методике, приведенной в Примере 281, используя изомер 1 Препарата 144 (формула ТТТ-4; Схема ТТТ; R1 обозначает трет-бутил, R2 обозначает н-пропил).
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 163, 147, 146,69, 57, 56, 43, 41.
Масс-спектр высокого разрешения; 568,2213.
Пример 286. 5-Трифторметил-N-[3(R или S)-[1-[4- гидpoкcи-2-оксо-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] -2,2-диметилпропил] фенил]-2-пиридинсульфонамид (формула ТТТ-7: R1 обозначает трет-бутил, R2 обозначает н-пропил, R3 обозначает 5-трифторметилпиридин) См. Схему ТТТ.
5-Трифторметил-N-[3(R или S)-[1-[4-гидpoкcи-2-oкco- 6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] -2,2-диметилпропил] фенил] -2- пиридинсульфонамид получают в виде аморфного твердого вещества по методике, приведенной в Примере 281, используя изомер 2 Препарата 144 (формула ТТТ-5; Схема ТТТ; R1 обозначает трет-бутил, R2 обозначает н-пропил).
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 568,2237.
Пример 287. 5-Tpифтopмeтил-N-[3(R или S)-[1-[4-гидрокси-2- оксо-6,6-дифенэтил-5,6-дигидро-2H-пиран-3-ил] пропил] фенил] -2- пиридинсульфонамид (формула TTT-6: R1 обозначает этил, R2 обозначает фенил, R3 обозначает 5-трифторметилпиридин) См. Схему TTT.
Целевой продукт получают в виде аморфного твердого вещества по методике, приведенной в Примере 281, используя изомер 1 Препарата 145 (формула TTT-4; Схема TTT; R1 обозначает этил, R2 обозначает фенил).
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 665, 647, 456, 455, 333, 134, 117, 105, 91.
Пример 288. 5-Tpифтopмeтил-N-[3(R или S)-[1-[4- гидpoкcи-2-оксо-6,6-дифенэтил-5,6-дигидро-2H-пиран-3-ил] пропил] фенил] -2-пиридинсульфонамид (формула TTT-7: R1 обозначает этил, R2 обозначает фенил, R3 обозначает 5-трифторметилпиридин) См. Схему TTT.
Целевой продукт получают в виде аморфного твердого вещества по методике, приведенной в Примере 281, используя изомер 2 Препарата 145 (формула TTT-5; Схема TTT; R1 обозначает этил, R2 обозначает фенил).
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 665,2300.
Масс-спектр (E1): 665, 647, 456, 455, 333, 134, 133, 117, 105, 91.
Пример 289. 4-Трифторметил-N-[3(R или S)[1-[4-гидрокси-2- оксо-6,6-дифенэтил-5,6-дигидро-2H-пиран-3-ил] - пропил] фенил] -2-пиридинсульфонамид (формула TTT-6: R1 обозначает этил, R2 обозначает фенил, R3 обозначает 4-трифторметилпиридин) См. Схему TTT.
Целевой продукт получают в виде аморфного твердого вещества по методике, приведенной в Примере 281, используя изомер 1 Препарата 145 (формула TTT-4; Схема TTT; R1 обозначает этил, R2 обозначает фенил).
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 665, 665, 647, 134, 133, 117, 105, 91.
Масс-спектр высокого разрешения: 665,2306.
Пример 290. 4-Tpифтopмeтил-N-[3(R или S)-[1-[4- гидpoкcи-2-оксо-6,6-дифенэтил-5,6-дигидро-2H-пиран-3-ил] пропил] фенил] -2-пиридинсульфонамид (формула TTT-7: R1 обозначает этил, R2 обозначает фенил, R3 обозначает 4-трифторметилпиридин) См. Схему TTT.
Целевой продукт получают в виде аморфного твердого вещества по методике, приведенной в Примере 281, используя изомер 2 Препарата 145 (формула TTT-5; Схема TTT; R1 обозначает этил, R2 обозначает фенил).
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 665,2306.
Масс-спектр (E1): 665, 665, 647, 134, 133, 117, 105, 91.
Пример 291. 4-Трифторметил-N-[3-(R или S)-[1-[4- гидрокси-2-оксо-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] - 2,2-диметилпропил]фенил]-2-пиридинсульфонамид (формула TTT-6: R1 обозначает трет-бутил, R2 обозначает метил, R3 обозначает 4-трифторметилпиридин) См. Схему TTT.
4-Трифторметил-N-3(R или S)-[1-[4-гидpoкcи-2-oкco- 6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] -2,2- диметилпропил] фенил]-2-пиридинсульфонамид получают в виде аморфного твердого вещества по методике, приведенной в Примере 283, используя изомер 1 Препарата 144 (формула TTT-4; Схема TTT; R1 обозначает трет-бутил, R2 обозначает метил).
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 525, 512, 428, 411, 302, 284, 258, 146, 57.
Масс-спектр высокого разрешения: 568,2209.
Пример 292. 4-Трифторметил-N-[3(R или S)-[1-[4-гидрокси-2- оксо-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] -2,2- диметилпропил] фенил] -2-пиридинсульфонамид (формула TTT-7: R1 обозначает трет-бутил, R2 обозначает метил, R3 обозначает 4- трифторметилпиридин) См. Схему TTT.
4-Трифторметил-N-[3(R или S)-[1-[4-гидрокси-2-оксо-6,6- ди-н-пропил-5,6-дигидро-2H-пиран-3-ил] -2,2-диметилпропил] фенил] -2-пиридинсульфонамид получают в виде аморфного твердого вещества по методике, приведенной в Примере 283, используя изомер 2 Препарата 144 (формула TTT-5; Схема TTT; R1 обозначает трет-бутил, R2 обозначает метил).
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 569, 551, 511, 493, 439, 371, 360, 303, 284, 161, 139.
Масс-спектр высокого разрешения: 569,2297 (M1+H+)
Препарат 134. Фенилметиловый эфиp N-[3-[1-[5,6-дигидpo-4- гидрокси-2-оксо-6-(1-фенэтил)-6-н-пропил-2H-пиран-3-ил] - 2,2-диметилпропил]фенил]карбаминовой кислоты (формула RRR-1: R1 обозначает трет-бутил) См. Схему RR.
К 4,8 г трихлорида алюминия в токе азота при температуре минус 70oC добавляют 120 мл тетрагидрофурана. Смеси дают нагреться до температуры 0oC и перемешивают в течение 15 минут, а затем добавляют 4,68 г соединения формулы RRR-A Препарата 17. Реакционную смесь перемешивают в течение 15 минут и добавляют 4,69 г 3-аминоCbz-бензальдегида (формула RRR-B). Реакционную смесь перемешивают в течение 15 минут при температуре 0oC, а затем 3 часа при комнатной температуре. Охлаждают реакционную смесь до 0oC и при энергичном перемешивании добавляют 26 г моногидрата карбоната натрия (0,21 М) затем 1,08 мл воды. Перемешивают при температуре 0oC еще в течение 15 минут, добавляют 120 мл тетрагидрофурана и смесь отфильтровывают через целит. Целит тщательно промывают тетрагидрофураном, полученный раствор в тетрагидрофуране упаривают досуха в вакууме и получают смолу янтарного цвета. Остаток вновь растворяют в 120 мл тетрагидрофурана, раствор охлаждают до минус 5oC и добавляют 2,1 г комплекса бромид меди (1) - диметилсульфид. Смесь перемешивают в течение 15 минут и по каплям, так чтобы температура не поднималась выше 0oC, добавляют 65 мл 1 М раствора трет-бутилмагнийхлорида в тетрагидрофуране. Перемешивают смесь при температуре 0oC еще в течение 15 минут, осторожно добавляют 6 мл воды, а затем 30 мл 1N раствора соляной кислоты. Полученную смесь выливают в 1,3 л этилового эфира. Водный слой отделяют, а органическую фазу дополнительно трижды промывают 10%-ным водным раствором карбоната аммония, а затем один раз водой. Органический раствор сушат над сульфатом натрия, отфильтровывают и упаривают досуха, получая сырой продукт в виде пенообразного вещества. Полученное вещество хроматографируют на силикагеле, элюируя 30-%ным раствором этилацетата в хлористом метилене, и получают 6,15 г целевого продукта.
Препарат 135. Препаративное расщепление фенилметилового эфира N-3-[1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6-н- пропил-2H-пиран-3-ил] -2,2-диметилпропил] фенил] карбаминовой кислоты (формула RRR-1: R1 обозначает трет-бутил) на 4 изомера фенилметилового эфира 3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6- (R или S)-(2-фенэтил)-6-(R или S)-н-пропил-2H-пиран-3-ил]-2,2-диметилпропил]фенил] карбаминовой кислоты (формулы RRR-3-6, где R1 обозначает трет-бутил) См. Схему RRR.
Четырьмя вставляющими энантиомерами являются (в порядке элюирования из системы A) изомер 1 (формула RRR-4; см. Схему RRR), изомер 2 (формула RRR-3; см. Схему RRR), изомер 3 (формула RRR-5; см. Схему RRR) и изомер 4 (формула RRR-6; см. Схему RRR). Система A включает колонку 0,46 x 25 см Chiralcel OD-H, которую элюируют смесью, содержащей 20% изо-пропанола и 0,1% трифторуксусной кислоты в гексане, со скоростью подачи 0,5 мл/мин. (Chiralcel OD-H является торговым знаком компании "Chiral Technologies, Inc", Exton, PA 19341). Первую фазу расщепления проводят на колонке 2,1 х 25 см (R,R)Whelk-O 1, элюируя 20%-ным (об/об) раствором изо-пропанола в гексане со скоростью подачи 12 мл/мин. ((R,R)Whelk-0 1 является товарным знаком компании "Regis Technologies, Inc. ", Morton Grove, IL 60053). Пики, которые элюируются со временем приблизительно 35 и 41 минут, представляют собой, соответственно, смесь изомеров 3 и 4 и смесь изомеров 1 и 2, в соответствии с указанной системой A. Обе смеси подвергают дальнейшей обработке, как указано ниже. При проведении второй фазы расщепления смесь, которая элюируется со временем приблизительно 41 минута, инжектируют в колонку 2,1 x 25 см Chiralcel OD (от компании "Chiral Technologies, Inc. ") и элюируют смесью, содержащей 15% (об/об) изо-пропанола и 0,05% трифторуксусной кислоты в гексане, со скоростью подачи 9 мл/мин. Пики, которые элюируются со временами приблизительно 11,0 и 22,0 минут, представляют собой, в соответствии с системой A, пики 1 и 2, соответственно.
При проведении финальной фазы расщепления смесь, которая элюируется из колонки Whelk-O со временем приблизительно 35 минут, инжектируют в колонку 2,2 x 25 см Chiralcel OD и элюируют смесью, содержащей 35% (об/об) изо-пропанола и 0,1% трифторуксусной кислоты в гексане, со скоростью подачи 9 мл/мин. Изомер, который элюируется со временем удерживания приблизительно 9,7 минут, обозначают как пик 3, а изомер, который элюируется со временем удерживания приблизительно 16,6 минут, обозначают как пик 4.
Препарат 136. 3-[1-(3-Aминoфeнил)-2,2-димeтилпpoпил] -5,6- дигидро-4-гидрокси-6-фенэтил-6-н-пропилпиран-2-он (формула RRR-2) См. Схему RRR.
К 590 мг 3-[1-[5,6-дигидpo-4-гидpoкcи-2-oкco-6-(2- фeнэтил)-6-н-пропил-2H-пиран-3-ил] -2,2-диметилпропил] фенил- карбаминовой кислоты Препарата 134 добавляют 10 мл метанола и 660 мг формиата аммония. Когда все вещества растворятся, добавляют 140 мг 10%-ного палладия на угле и реакционную смесь перемешивают при комнатной температуре в течение 60 минут. Реакционную смесь отфильтровывают (через целит), тщательно промывают фильтр метанолом и метанольный раствор упаривают в вакууме, получая сырой продукт в виде твердого вещества. Его помещают в смесь хлористого метилена и воды, органический слой отделяют, дважды промывают водой и сушат над сульфатом натрия и упаривают досуха, получая 372 мг 3-[1-(3-амино-фенил)-2,2-диметилпропил]-5,6-дигидро-4- гидрокси-6-фенэтил- 6-н-пропил-2H-пиран-2-он. Полученное вещество идентично описанному ранее (формула Т-4: см. Схему Т).
Препарат 137. 3(R или S)-[1-(3-Aминoфeнил)-2,2- димeтилпpoпил]-5,6-дигидро-4-гидрокси-6(R или S)-фенэтил-6 (R или S)-пропилпиран-2-он (формула RRR-7: R1 обозначает трет-бутил) См. Схему RR.
3(R или S)-[1-(3-Аминофенил)-2, 2-диметилпропил]-5,6- дигидро-4-гидрокси-6(R или S)-фeнэтил-6(R или S)-пропилпиран- 2-он получают в виде аморфного пенообразного вещества по методике, приведенной для Препарата 136, заменив соединение Препарата 134 на соединение Препарата 135, обозначенное как пик 2.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 421, 365, 164, 163, 147, 146, 118, 107, 91, 57.
Масс-спектр высокого разрешения: 421,2617.
Препарат 138. 3(R или S)-[1-(3-Аминофенил)-2,2- диметилпропил]-5,6-дигидро-4-гидрокси-6(R или S)-фенэтил-6(R или S)- пропилпиран-2-он (формула RRR-8: R1 обозначает трет-бутил) См. Схему RRR.
3(R или S)-[1-(3-Аминофенил)-2,2-диметилпропил]-5,6- дигидро-4-гидрокси-6(R или S)-фенэтил-6(R или S)-пропилпиран-2- он получают в виде аморфного пенообразного вещества по методике, приведенной для Препарата 136, заменив соединение Препарата 134 на соединение Препарата 135, обозначенное как пик 1.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 421, 365, 164, 163, 147, 146, 118, 107, 91, 57.
Пример 293. 5-Tpифтopмeтил-N-[3-[1-[5,6-дигидpo-4- гидpoкси-2-оксо-6-(2-фенэтил)-6-н-пропил-2H-пиран-3-ил] -2,2- диметилпропил]фенил]-2-пиридинсульфонамид (формула RRR-15: R1 обозначает трет-бутил, R2 обозначает 5-трифторметил) См. Схему RRR.
5-Tpифтopмeтил-N-[3-[1-[5,6-дигидро-4-гидрокси-2- оксо-6-(2-фенэтил)-6-н-пропил-2H-пиран-3-ил]-2,2- диметилпропил]фенил]-2-пиридинсульфонамид получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 281, заменив продукт Препарата 132 на продукт Препарата 136.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 497, 411, 401, 383, 343, 331, 197,174, 146, 133.
Масс-спектр высокого разрешения: 540,1938.
Пример 294. 5-Tpифтopмeтил-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2- оксо-6(R или S)-(2-фенэтил) -6(R или S)-н-пропил-2H-пиран-3-ил]-2,2-диметилпропил] фенил] -2-пиридинсульфонамид (формула RRR-11: R1 обозначает трет-бутил, R2 обозначает 5-трифторметил) См. Схему RRR.
5-Tpифтopмeтил-N-[3(R или S)-[1-[5,6-дигидро-4- гидрокси-2-оксо-6(R или S)-(2-фенэтил)-6 (R или S)-н-пропил- 2H-пиран-3-ил]-2,2-диметилпропил]фенил] -2-пиридинсульфонамид получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 281, заменив продукт Препарата 132 на продукт Препарата 137.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 373, 355, 201, 146, 145, 118, 117, 91, 57.
Масс-спектр высокого разрешения: 630,2394.
Пример 295. 5-Трифторметил-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2- оксо-6(R или S)-(2-фенэтил)-6(R или S)-н-пропил-2H-пиран-3-ил]-2, 2-диметилпропил] фенил] -2-пиридинсульфонамид (формула RRR-12: R1 обозначает трет-бутил, R2 обозначает 5-трифторметил) См. Схему RRR.
5-Трифторметил-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6(R или S)-(2-фенэтил)-6(R или S)-н-пропил-2H-пиран-3-ил]-2,2-диметилпропил]фенил] -2- пиридинсульфонамид получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 281, заменив продукт Препарата 132 на продукт Препарата 138.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 373, 355, 201, 146, 145, 118, 117, 91, 57.
Масс-спектр высокого разрешения: 630,2379.
Пример 296. 4-Трифторметил-N-[3(R или S)-[1-[5,6- дигидро-4-гидрокси-2-оксо-6(R или S)-(2-фенэтил)-6(R или S) -н-пропил-2H-пиран-3-ил]-2,2-диметилпропил] фенил]-2- пиридинсульфонамид (формула RRR-11: R1 обозначает трет-бутил, R2 обозначает 4-трифторметил) См. Схему RRR.
4-Трифторметил-N-[3-(R или S]-[1-[5,6-дигидpo-4-гидpoкси-2-оксо-6 (R или S)-(2-фенэтил)-6(R или S)-н-пропил-2H-пиран-3-ил]-2,2-диметилпропил]фенил] -2-пиридинсульфонамид получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 294, заменив продукт Препарата 129 на продукт Препарата 128.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 633, 632, 631, 614, 613, 346, 201, 146, 91, 57.
Масс-спектр высокого разрешения: 631,2444.
Пример 297. 4-Tpифтopмeтил-N-[3-(R или S)-[1-[5,6-дигидро- 4-гидрокси-2-оксо-6(R или S)-(2-фенэтил)-6(R или S)-н-пропил-2H-пиран-3-ил]-2,2-диметилпропил] фенил] -2- пиридинсульфонамид (формула RRR-12: R1 обозначает трет-бутил, R2 обозначает 5-трифторметил) См. Схему RRR.
4-Tpифтopмeтил-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6(R или S)-(2-фенэтил)-6 (R или S)-н-пропил- 2H-пиран-3-ил]-2,2-диметилпропил]фенил] -2-пиридинсульфонамид получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 295, заменив продукт Препарата 129 на продукт Препарата 128.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 633, 632, 631, 614, 613, 346, 201, 146, 91, 57.
Масс-спектр высокого разрешения: 631,2450.
Пример 298. 5-Трифторметил-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2- оксо-6(R или S)-(2-фенэтил)-6(R или S)-н-пропил-2H-пиран-3-ил]пропил]фенил] -2-пиридинсульфонамид (формула RRR-11: R1 обозначает этил, R2 обозначает 5-трифторметил) См. Схему RRR.
5-Трифторметил-N-[3(R или S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6(R или S)-(2-фенэтил)-6(R или S)-н-пропил-2H-пиран-3-ил]пропил]фенил]-2- пиридинсульфонамид получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 294, взяв в качестве исходного продукт Препарата 147A.
Вещество обладает следующими физическими характеристиками:
Масс-спектр (E1): 605, 604, 603, 602, 586, 585, 393, 201, 133, 91.
Масс-спектр высокого разрешения: 630,2153.
Пример 298A. 5-Трифторметил-N-[3(R или S)-[1-[5,6- дигидро-4-гидрокси-2-оксо-6(R или S)-(2-фенэтил)-6(R или S) -н-пропил-2H-пиран-3-ил]пропил]фенил] -2- пиридинсульфонамид (формула RRR-12: R1 обозначает этил, R2 обозначает 5-трифторметил) См. Схему RRR.
Целевое соединение получают в виде аморфного пенообразного вещества по методике, приведенной в Примере 294, взяв в качестве исходного амин, полученный из изомера 1 Препарата 147 (получают по методике, приведенной для Препарата 147A).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 8,9, 8,2, 8,0, 7,0-7,3 3,9, 2,4-2,7, 1,2-2,2, 0,8-1,0 м.д.
ТСХ (силикагель GF): RF 0,19 (40% этилацетата в гексане).
Препарат 139. Гидрохлорид (5-нитропиридин-2-ил)изотиомочевины (формула UUU-2) См. Схему UUU.
К раствору 3,81 г тиомочевины в 75 мл горячего абсолютного этанола добавляют 7,61 г 2-хлор-5-нитропиридина (формула UUU-1) и кипятят с обратным холодильником в течение 6 часов. Охлаждают смесь до 0oC и выпавший осадок отделяют. Полученное твердое вещество последовательно промывают холодным абсолютным спиртом и хлороформом, сушат в вакууме и получают 6,91 г целевого продукта в виде твердого вещества светло-коричневого цвета с т.пл. 175oC (с разложением).
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 7,9, 8,6, 9,4 м.д.
Препарат 140. 5-Hитро-2-тиопиридин (формула UUU-3) См. Схему UUU.
К раствору 1,65 г карбоната натрия в 50 мл воды добавляют 2,35 г целевого продукта Препарата 139. Добавляют к смеси раствор 2,75 г гидроксида натрия в 50 мл воды и нагревают до комнатной температуры. Перемешивают в указанных условиях в течение часа, затем в течение часа нагревают смесь до температуры 95oC и охлаждают до комнатной температуры. Водную фазу экстрагируют двумя порциями диэтилового эфира и осторожно подкисляют 6N раствором соляной кислоты. Выпавший осадок оранжевого цвета отделяют и последовательно промывают холодной разбавленной соляной кислотой и водой. Твердое вещество сушат в вакууме и получают 1,27 г целевого продукта в виде твердого вещества оранжевого цвета с т.пл. 167-170oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ 7,4, 7,9, 8,5 м.д.
Препарат 141. 5-Нитро-2-пиридинсульфохлорид (формула (UUU-4) См. Схему UUU.
Через суспензию 1,27 г целевого продукта Препарата 140 в 25 мл 1N раствора соляной кислоты и 5 мл ледяной уксусной кислоты при температуре 0oC энергично барботируют газообразный хлор. Через 15 минут подачу хлора прекращают и смесь продувают азотом. Полученное твердое вещество отделяют и последовательно промывают холодным разбавленным раствором соляной кислоты и водой. Твердое вещество сушат в вакууме и получают 1,60 г целевого продукта в виде твердого вещества темно-коричневого цвета с т.пл. 77-80oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 8,3, 8,8, 9,6 м.д.
Препарат 142. N-[3-(1-[5,6-Дигидpo-4-гидpoкcи-2-oксо- 6-(2-фенэтил)-6-пропил-2H-пиран-3-ил]-2,2- диметилпропил)фенил]-5-нитро-2-пиридинсульфонамид (формула UUU-5: R1 обозначает 2-фенэтил, R2 обозначает пропил, R3 обозначает трет-бутил) См. Схему UUU.
К раствору 210 мг целевого продукта Препарата 81 (формула Т-4) в 2 мл дихлорметана при температуре 0oC добавляют 80 мкл пиридина и 111 мг целевого продукта Препарата 141 (формула UUU-4). Оставляют на ночь нагреваться до комнатной температуры и реакционную смесь подвергают очистке методом испарительной колоночной хроматографии на силикагеле, элюируя смесью, содержащей от 3% до 9% этилацетата в дихлорметане, и получают 303 мг целевого соединения в виде пенообразного вещества желтого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ 0,8-1,0, 1,2-1,4, 1,6-1,9, 2,4-2,7, 4,0, 6,9- 7,4, 8,0, 8,5, 9,4 м.д.
Масс-спектр высокого разрешения (E1): 608,2412.
Пример 299. 5-Aминo-N-[3-(1-[5,6-Дигидpo-4-гидpoкcи- 2-oксо-6-(2-фенэтил)-6-пропил-2H-пиран-3-ил] -2,2- диметилпропил)фенил]-2-пиридинсульфонамид (формула UUU-6: R1 обозначает 2-фенэтил, R2 обозначает пропил, R3 обозначает трет-бутил) См. Схему UUU.
К раствору 300 мг целевого продукта Препарата 142 (формула UUU-5) в 5 мл метанола в токе аргона добавляют 500 мг формиата аммония и 100 мг 10%-ного палладия на угле, перемешивают 1 час, отфильтровывают через целит, промывая на фильтре метанолом. Фильтрат объединяют и упаривают при пониженном давлении, а остаток растирают с несколькими порциями дихлорметана. Дихлорметановые экстракты объединяют и упаривают при пониженном давлении, а остаток подвергают очистке методом испарительной колоночной хроматографии на силикагеле элюируя раствором 50% этилацетата в дихлорметане, и получают 245 мг целевого соединения в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ-дейтероацетон): δ 0,8-1,0, 1,2-1,4, 1,5-2,0, 2,4-2,6, 4,0, 6,7, 6,8-7,3, 7,4, 7,9 м.д.
Масс-спектр высокого разрешения (E1): 577,2617.
Примеры 300-327
В соответствии с приведенными выше методиками, используя исходные материалы и реагенты, известные и доступные для специалистов в области органического синтеза, из соединений, выделяемых из следующих синтезов, дополнительно получают соединения по настоящему изобретению, приведенные в Таблице 3.
Препарат 143. Препаративное разделение фенилметилового эфира N-3-[1-[5,6-дигидpo-4-гидpoкcи-2-oксо-6-(2-фенэтил)-6-н- пропил-2H-пиран-3-ил] -2,2-диметилпропил]фенилкарбаминовой кислоты на 4 изомера.
Целевое соединение Препарата 134 разделяют на четыре составляющих стереоизомера, которыми являются (в порядке элюирования из системы A) 4 изомера: изомер 1, изомер 2, изомер 3, изомер 4 со средними временами удерживания, составляющими, соответственно, 10,5, 14,9, 21,4 и 65,2 минут. Система A включает колонку 0,46 x 25 см Chiralcel OD-H, которую элюируют смесью, содержащей 20% изо-пропанола и 0,1% трифторуксусной кислоты в гексане, со скоростью подачи 0,5 мл/мин. (Chiralcel OD-H является торговым знаком компании "Chiral Technologies, Inc", Exton, PA 19341).
Первую фазу расщепления проводят на колонке 2,1 x 25 см (R,R)Whelk-O 1, элюируя 20%-ным (об/об) раствором изо-пропанола в гексане со скоростью подачи 12 мл/мин. ((R,R)Whelk-O 1 является товарным знаком компании "Regis Technologies, Inc", Morton Grove, IL 60053). Пики, которые элюируются со временем приблизительно 35 и 41 минут, представляют собой, соответственно, смесь изомеров 3 и 4 и смесь изомеров 1 и 2, в соответствии с указанной системой A. Обе смеси подвергают дальнейшей обработке, как указано ниже.
При проведении второй фазы расщепления смесь, которая элюируется со временем приблизительно 41 минуты, инжектируют в колонку 2,1 x 25 см Chiralcel OD(от компании "Chiral Technologies, Inc") и элюируют смесью, содержащей 15% (об/об) изо-пропанола и 0,05% трифторуксусной кислоты в гексане, со скоростью подачи 9 мл/мин. Пики, которые элюируются со временами удерживания приблизительно 11,0 и 22,0 минут, представляют собой, в соответствии с системой А, изомер 1 и изомер 2, соответственно.
При проведении финальной фазы расщепления смесь, которая элюируется из колонки Whelk-O со временем приблизительно 35 минут, инжектируют в колонку 2,2 x 25 см Chiralcel OD и элюируют смесью, содержащей 35% (об/об) изо-пропанола и 0,1% трифторуксусной кислоты в гексане, со скоростью подачи 9 мл/мин. Изомер, который элюируются со временем удерживания приблизительно 9,7 минут, обозначают как изомер 3, а изомер, который элюируется со временем удерживания приблизительно 16,6 минут, обозначают как изомер 4. При осуществлении обеих стадий разделения изомеров, соответствующие фракции после анализа в Системе A объединяют и упаривают досуха на ротационном испарителе.
Препарат 144. Расщепление фенилметилового эфира N-[3- (1-[5,6-дигидро-6,6-дипропил-4-гидрокси-2-оксо-2H-пиран-3-ил] - 2,2-диметилпропил)фенил] карбаминовой кислоты на 2 изомера.
Образцы исходного соединения (до 1,0 г в каждой загрузке) помещают в колонку 5,1 x 25 см Chiralcel OD (от компании "Chiral Technologies, Inc."). Энантиомеры элюируются со временем удерживания приблизительно 23 минуты (это соответствует содержащему защитную бензилоксикарбонильную группу аналогу амина (изомер 1) (масс-спектр высокого разрешения (E1): 359 /М+/; спектр ПМР (дейтерохлороформ-дейтероацетон): δ 7,1-6,9, 6,5, 4,2, 2,6-2,3, 1,8-1,2, 1,1, 0,9; TCX: Rf = 0,42 (10% этилацетата в дихлорметане)) и приблизительно 33 минуты (это соответствует содержащему защитную бензилоксикарбонильную группу аналогу амина (изомер 2) (масс-спектр высокого разрешения (E1): 359 [M+] ; спектр ПМР (дейтерохлороформ-дейтероацетон): δ 7,1-6,9, 6,5, 4,2, 2,6-2,3, 1,8-1,2, 1,1, 0,9; TCX: Rf = 0,42 (10% этилацетата в дихлорметане)). Мобильная фаза представляет собой смесь, содержащую 20% изо-пропанола и 0,1% уксусной кислоты с гексане (об/об), которую подают со скоростью 60 мл/мин. Чистоту оценивают на колонке 0,46 x 25 см Chiralcel OD-H (от компании "Chiral Technologies, Inc."). Мобильными фазами являются 20%-ный раствор изо-пропанола в гексане (об/об) и 0,1 % раствор трифторуксусной кислоты со скоростью подачи 0,5 мл/мин. Наблюдаемые времена удерживания для изомера 1 и изомера 2 составляют 8,9 и 16,7 мин, соответственно (контролируют на длине волны 238 нм).
Препарат 145. Расщепление фенилметилового эфира N-[3-(1- [6,6-бис (2-фенэтил)-5,6-дигидро-4-гидрокси-2-оксо-2H-пиран- 3-ил]пропил)фенил]карбаминовой кислоты на 2 изомера
Образцы исходного соединения (до 1,3 г в каждой загрузке) помещают в колонку 5,1 x 25 см Chiralcel OD (от компании "Chiral Technologies, Inc."). Энантиомеры элюируют смесью, содержащей 20% изо-пропилового спирта и 0,025% уксусной кислоты в гексане (об/об) со скоростью подачи 60 мл/мин до тех пор, пока не начнет элюироваться первый из изомеров. После этого (приблизительно через 120 минут) скорость подачи увеличивают до 90 мл/мин, чтобы ускорить элюирование второго энантиомера. Энантиомеры элюируются со временем удерживания приблизительно 91,2 минуты (это соответствует содержащему защитную бензилоксикарбонильную группу аналогу амина (изомер 1)) и приблизительно 132 минуты (это соответствует содержащему защитную бензилоксикарбонильную группу аналогу амина (изомер 2)). Чистоту оценивают на колонке 0,46 x 25 см Chiralcel OD-H. Мобильной фазой является 30%-ный раствор изо-пропанола в гексане (об/об), скорость подачи составляет 0,5 мл/мин.
Пример 146. 5-Карбамоилпиридин-2-сульфохлорид (формула VVV-2) См. Схему VVV.
Через охлажденную (0oC) суспензию 400 мг 2-меркапто 5-карбамоилпиридина формулы VVV-1 в 7,5 мл 1N раствора соляной кислоты пропускают сильный поток газообразного хлора. Через 10 минут подачу хлора прекращают, суспензию фильтруют и полученное твердое вещество промывают водой и сушат в вакууме. Получают 517 мг целевого продукта в виде практически белого твердого вещества.
Пример 328. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо-6- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2- диметилпропил} фенил]-4-цианобензолсульфонамид (формула U-8: R1 обозначает трет-бутил, R2 обозначает 4-цианофенил) См. Схему U.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 88 мг амина Препарата 86 (формула U-7, R1 обозначает трет-бутил) с 4-цианобензолсульфохлоридом. После очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане, получают 117 мг целевого соединения в виде аморфного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,90, 1,3, 1,7, 2,5, 3,6, 6,8-7,4, 7,6, 7,8 м.д.
Масс-спектр высокого разрешения: 605,2478.
TCX: Rf 0,36 (10% этилацетата в дихлорметане).
Пример 329. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо-6- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2- диметилпропил} фенил]-8-хинолинсульфонамид (формула U-8: R1 обозначает трет-бутил, R2 обозначает 8-хинолил). См. Схему U.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 88 мг амина Препарата 86 (формула U-7, R1 обозначает трет-бутил) с 8-хинолинсульфохлоридом. После очистки методом испарительной хроматографии на силикагеле, элюируя 5-10%-ным раствором этилацетата в дихлорметане, получают 101 мг целевого соединения в виде аморфного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 6,3, 0,9, 1,1, 1,3, 1,6-1,9, 2,4-2,6, 6,7-7,6, 8,0, 8,2, 9,1 м.д.
Масс-спектр высокого разрешения: 631,2638.
TCX: Rf 0,30 (5% этилацетата в дихлорметане).
Пример 330. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо- 6,6-бис(2-фенэтил)-2H-пиран-3-ил)пропил}фенил]-1-метил-1H- имидазол-4-сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил) См. Схему D.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 77 мг амина формулы D-5, где R1 и R2 обозначают фенэтил, a R3 обозначает этил с 1-метилимидазол-4-сульфохлоридом. После очистки методом испарительной хроматографии на силикагеле элюируют 3%-ным раствором метанола в дихлорметане, получают 97,0 мг целевого соединения в виде кристаллического вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,88, 1,9-2,2, 2,6, 3,6-3,8, 3,97, 6,9-7,5 м.д.
Масс-спектр высокого разрешения: 600,2521.
ТСХ: Rf 0,31 (5% метанола в дихлорметане).
Пример 331. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо-6,6- бис(2-фенэтил)-2H-пиран-3-ил)пропил}фенил]-5-цианопиридин-2- сульфонамид (формула D-6: R1 обозначает фенэтил, R2 обозначает фенэтил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2- ил) См. Схему D.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 77 мг амина формулы D-5, где R1 и R2 обозначают фенэтил, а R3 обозначает этил с 5-цианопиридин-2-сульфохлоридом. После очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане, получают 88,3 мг целевого соединения в виде кристаллического вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,85, 1,8-2,2, 2,5-2,7, 3,97, 6,9-7,4, 7,9, 8,8 м.д.
Масс-спектр высокого разрешения: 622,2355.
TCX: Rf 0,28 (10% этилацетата в дихлорметане).
Пример 332. N-[3-{ 1-(4-Гидpoкcи-5,6-дигидpo-2-oкco-6- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил} фенил]-5-карбамоилпиридин-2-сульфонамид (формула U-8: R1 обозначает этил, R2 обозначает 5-карбамоилпиридин-2-ил) См. Схему U.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 82 мг амина формулы U-7, R1 обозначает этил с 5-карбамоилпиридин-2- сульфохлоридом Препарата 146. После очистки методом испарительной хроматографии на силикагеле, элюируя 3-6%-ным раствором метанола в дихлорметане, получают 55,4 мг целевого соединения в виде аморфного вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-0,9, 1,3, 1,6-2,1, 2,5, 3,9, 6,8-7,3, 7,8, 8,2 м.д.
Масс-спектр высокого разрешения: 596,2216.
ТСХ: Rf 0,16 (5% метанола в дихлорметане).
Пример 333. N-[3-{1-(4-Гидрокси-5,6-дигидро-2-оксо-6,6- бис(2-(4-фторфенил)этил)-2H-пиран-3-ил)пропил} фенил] - 5-карбамоилпиридин-2-сульфонамид (формула V-8: R1 обозначает этил, R2 обозначает 5-карбамоилпиридин-2-ил) См. Схему V.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 98 мг амина формулы V-7, R1 обозначает этил, с 5-карбамоилпиридин-2- сульфохлоридом Препарата 146. После очистки методом испарительной хроматографии на силикагеле, элюируя 3-6%-ным раствором метанола в дихлорметане, получают 58,3 мг целевого соединения в виде аморфного вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,83, 1,8-2,2, 2,5-2,6, 6,8-7,2, 7,8, 8,1, 9,0 м.д.
Масс-спектр высокого разрешения: 676,2297.
ТСХ: Rf 0,17 (5%метанола в дихлорметане).
Пример 334. N-[3-{1-(4-Гидрокси-5,6-дигидро-2-оксо-6,6- дипропил-2H-пиран-3-ил)пропил} фенил] -5-карбамоилпиридин-2- сульфонамид (формула D-6: R1 обозначает пропил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-карбамоилпиридин -2-ил) См. Схему D.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 66 мг амина формулы D-5 (R1 и R2 обозначают пропил, R3 обозначает этил) с 5-карбамоилпиридин-2-сульфохлоридом Препарата 146. После очистки методом испарительной хроматографии на силикагеле, элюируя 3-6%-ным раствором метанола в дихлорметане, получают 83,8 мг целевого соединения в виде аморфного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-0,9, 1,2-2,1, 3,87, 7,0-7,3, 7,8, 8,2 м.д.
Масс-спектр высокого разрешения: 516,2156.
ТСХ: Rf 0,22 (5% метанола в дихлорметане).
Препарат 147. Расщепление фенидметилового эфира N-[3-[1-(4-гидрокси-5,6-дигидро-2-оксо-6-фенэтил-6-пропил-2H- пиран-3-ил)пропил] фенил]карбаминовой кислоты на 4 изомера (формула WWW-2: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил) См. Схемы WWW и RRR.
Четырьмя изомерами продукта Препарата 130A (формула RRR-1; R1 обозначает этил) являются (в порядке увеличения времени удерживания в Системе B): (приблизительно 16,9 минут) (изомер 1), (приблизительно 28,0 минут) (изомер 2), (приблизительно 38,2 минут) (изомер 3), (приблизительно 49,8 минут) (изомер 4). Система B включает колонку 0,46 x 25 см Chiralcel OD-H (от компании "Chiral Technologies, Inc."), которую элюируют 25% раствором изо-пропанола в гексане (об/об) со скоростью подачи 0,5 мл/мин.
При осуществлении первой фазы полного расщепления инжектируют образцы по 55 мг целевого продукта Препарата 130A в колонку 2,1 x 25 см (R,R)Whelk-01 (от компании "Regis Technologies, Inc."). Изомеры элюируют смесью, содержащей 25% изо-пропанола и 0,5% уксусной кислоты в гексане (об/об), со скоростью подачи 10 мл/мин. Первый из трех пиков, который элюируются со временем удерживания приблизительно 12 минут, представляет собой смесь изомеров 1 (формула RRR-4 на Схеме RRR) и 2 (формула RRR-3 на Схеме RRR), что показано инжектированием аликвот в Систему B. Расщепление этой смеси проводят на следующей стадии, как описывается далее.
Проведение второй фазы расщепления проводят на колонке 2,1 x 25 см Chiralcel OD, температуру которой поддерживают на уровне 30oC. Инжектируют порции по 60 мг, полученные после первой стадии расщепления, и элюируют энантиомеры смесью, содержащей 25% (об/об) изо-пропанола и 0,05% трифторуксусной кислоты в гексане, со скоростью подачи 9 мл/мин. Отдельно собирают и концентрируют фракции, которые элюируются со временами удерживания приблизительно 14,5 и 23,9 минут, и получают изомеры 1 (формула RRR-4, где R1 обозначает этил на Схеме RRR) и 2 (формула RRR-3, где R1 обозначает этил на Схеме RRR), соответственно.
Препарат 147A. 3(R или S)-[1-(3-Aминoфeнил)пpoпил]- 4-гидрокси-5,6-дигидро-6(R или S)-фенэтил-(R или S)- пропилпиран-2-он (формула RRR-7: R1 обозначает этил) См. Схему RRR.
Целевое соединение получают в соответствии с методикой, приведенной для Препарата 132, используя соединение, идентифицированное как пик 2 (формула RRR-3; R1 обозначает этил на Схеме RRR) в продукте хирального расщепления Препарата 147.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 6,5-7,3, 3,9-4,0, 2,5-2,7, 1,2-2,3, 0,8-1,0 м.д.
ТСХ (силикагель GF): Rf 0,31 (40% этилацетата в гексане)
Пример 335. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6(R или S)-фенэтил-6-пропил-2H-пиран-3-ил)- пропил} фенил]-5-цианопиридин-2-сульфонамид (формула WWW-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 1/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил). Амин получают из первого стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 147. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-1,0, 1,2-2,6, 3,3-3,6, 6,9-7,3, 7,7-8,2, 8,8-9,0 м.д.
Масс-спектр высокого разрешения: 560,2210.
ТСХ: Rf 0,41 (15% этилацетата в дихлорметане).
Пример 336. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- окco-6(R или S)-фенэтил-6-пропил-2H-пиран-3-ил)-пропил} фенил] -5- цианопиридин-2-сульфонамид (формула WWW-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 2/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин, который представляет собой продукт Препарата 147A (формула WWW-3, где R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил). Амин получают из второго стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при провидении хиральной жидкостной хроматографии высокого разрешения Препарата 147A. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,6-2,6, 3,3-3,6, 6,9-7,3, 7,7-8,2, 8,8-9,0 м.д.
Масс-спектр высокого разрешения: 560,2215.
ТСХ: Rf 0,41 (15% этилацетата в дихлорметане).
Пример 337. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- окco-6(R или S)-фенэтил-6-пропил-2H-пиран-3-ил)-пропил} фенил] - 5-цианопирилин-2-сульфонамид (формула WWW-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 3/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил). Амин получают из третьего стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 147. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,6-2,6, 3,3-3,6, 6,9-7,3, 7,7-8,2, 8,8-9,0 м.д.
Масс-спектр высокого разрешения: 560,2210.
ТСХ: Rf 0,41 (15% этилацетата в дихлорметане).
Пример 338. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6(S или R)-фенэтил-6-пропил-2H-пиран-3-ил)-пропил} фенил] -5- цианопиридин-2-сульфонамид (формула WWW-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопирипин-2-ил) /Изомер 4/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил). Амин получают из четвертого стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 147. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-1,0, 1,2-2,6, 3,3-3,6, 6,9-7,3, 7,7-8,2, 8,8-9,0 м.д.
Масс-спектр высокого разрешения: 560,2210.
ТСХ: Rf 0,41 (15% этилацетата в дихлорметане).
Пример 339. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6(R или S)-фенэтил-6-пропил-2H-пиран-3-ил)- пропил} фенил]- 1-метил-1H-имидазол-4-сульфонамид (формула WWW-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил) /Изомер 1/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил). Амин получают из первого стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 147. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-2,8, 3,2-3,7, 3,9, 7,0-7,6 м.д.
Масс-спектр высокого разрешения: 537,2317.
ТСХ: Rf 0,36 (5% метанола в дихлорметане).
Пример 340. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро- 2-оксо-6(R или S)-фенэтил-6-пропил-2H-пиран-3-ил)- пропил} фенил] -1-метил-1H-имидазол-4-сульфонамид (формула WWW-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил) /Изомер 2/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил. Амин получают из второго стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкойстной хроматографии высокого разрешения Препарата 147. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 3-4%-ным раствором метанола в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-2,7, 3,3-3,7, 4,0, 7,0-7,5 м.д.
Масс-спектр высокого разрешения: 537,2275.
ТСХ: Rf 0,36 (5% метанола в дихлорметане).
Пример 341. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6-(R или S)-фенэтил-6-пропил-2H-пиран-3-ил)пропил} фенил] -1-метил-1H-имидазол-4-сульфонамид (формула WWW-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил) /Изомер 3/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил. Амин получают из третьего стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 147. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-2,7, 3,3-3,7, 4,0, 7,0-7,5 м.д.
Масс-спектр высокого разрешения: 537,2329.
ТСХ: Rf 0,36 (5% метанола в дихлорметане).
Пример 342. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6(S или R)-фенэтил-6-пропил-2H-пиран-3-ил)-пропил} фенил] -1- метил-2H-имидазол-4-сульфонамид (формула WWW-4: R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил) /Изомер 4/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает фенэтил, R2 обозначает пропил, R3 обозначает этил. Амин получают из четвертого стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 147. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-2,8, 3,2-3,7, 3,9, 7,0-7,6 м.д.
Масс-спектр высокого разрешения: 537,2312.
ТСХ: Rf 0,36 (5% метанола в дихлорметане).
Препарат 148. 3-[(3-Hитpoфeнил)метил] -6,6-дифeнэтил-4- гидрокси-5,6-дигидро-2H-пиран-2-он (формула ХХХ-3) См. Схему XXX.
К раствору 172 мг 6,6-дифенэтил-4-гидрокси-5,6-дигидро-2H- пиран-2-он формулы ХХХ-1 и 81 мг мета-нитробензальдегида в 2 мл сухого тетрагидрофурана в токе аргона добавляют раствор 142 мг трихлорида алюминия в 1 мл тетрагидрофурана. Полученный раствор перемешивают при комнатной температуре в течение двух часов и разлагают смесь, добавив 310 мг декагидрата карбоната натрия, разбавляют эфиром и отфильтровывают через целит, промывая на фильтре эфиром. Растворитель отгоняют при пониженном давлении и получают 246 мг сырого бензилидена формулы ХХХ-2. Его растворяют в 5 мл метанола, охлаждают до 0oC и добавляют 44 мг цианоборгидрида натрия. Перемешивают в течение 30 минут и добавляют еще 20 мг цианоборгидрида натрия. Через 30 минут смесь подкисляют разбавленной соляной кислотой до pH = 1 и экстрагируют тремя порциями дихлорметана. Экстракт сушат (над сульфатом магния) и упаривают при пониженном давлении. Целевое соединение в количестве 211 мг выделяют в виде аморфного вещества после очистки остатка методом испарительной хроматографии на силикагеле, элюируя 5-20%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 2,0, 2,7, 3,8, 7,0-7,4, 7,6, 8,0, 8,2 м.д.
Масс-спектр: М+ 457
ТСХ: Rf 0,25 (5% этилацетата в дихлорметане).
Препарат 149. 3-[(3-Aминoфeнил)метил] -6,6-дифeнэтил-4- гидрокси-5,6-дигидро-2H-пиран-2-он (формула ХХХ-4) См. Схему XXX.
Смесь 211 мг продукта Препарата 148 (формула ХХХ-3) и 50 мг 10%-ного палладия на угле в 5 мл метанола перемешивают при комнатной температуре под давлением водорода 1 атмосфера. Через два часа смесь фильтруют через целит и упаривают при пониженном давлении. Целевое соединение в количестве 133,6 мг выделяют после очистки остатка методом испарительной хроматографии на силикагеле, элюируя 25%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 2,0, 2,6, 3,6, 4,1, 6,5, 6,6, 6,7, 6,9-7,3 м.д.
Масс-спектр: М+ 427
ТСХ: Rf 0,33 (5% этилацетата в дихлорметане).
Пример 343. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо- 6,6-бис(2-фенэтил)-2H-пиран-3-ил)-2,2-диметилпропил} фенил] - 1-метил-1H-имидазол-4-сульфонамид (формула YYY-5) R1 и R2 обозначают фенэтил, R3 обозначает 1-метилимидазол-4-ил) См. Схему YYY.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 77 мг амина формулы YYY-4 (R1 и R2 обозначают фенэтил) с 1-метил-имидазол-4-сульфохлоридом. После очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане, получают 90,7 мг целевого соединения в виде аморфного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,96, 1,0, 1,6-2,7, 3,45, 6,8-7,5 м.д.
Масс-спектр высокого разрешения: 628,2832.
ТСХ: Rf 0,38 (3% метанола в дихлорметане).
Пример 344. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо-6,6- бис(2-фенэтил)-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -5- цианопиридин-2-сульфонамид (формула YYY-5) R1 и R2 обозначают фенэтил, R3 обозначает 5-цианопиридин-2-ил. См. Схему YYY.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 77 мг амина формулы YYY-4 (R1 и R2 обозначают фенэтил) с 5-цианопиридин-2- сульфохлоридом. После очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане, получают 86,1 мг целевого соединения в виде аморфного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,96, 1,8-2,2, 2,5-2,8, 4,1, 4,3, 6,9-7,4, 7,9-8,0, 8,9 м. д.
Масс-спектр высокого разрешения: 650,2681.
TCX: Rf 0,27 (10% этилацетата в дихлорметане).
Препарат 150. Расщепление фенилметилового эфира N-[3-[1-(4-гидрокси-5,6-дигидро-2-оксо-6-(2-фторфенил)этил-6-пропил- 2H-пиран-3-ил)-2,2-диметилпропил]фенил]карбаминовой кислоты на 4 изомера (формула WWW-2: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает трет-бутил) См. Схему WWW.
Для элюирования энантиомеров и контролирования препаративных колонок используют Систему С. Система С включает колонку 0,46 x 25 см Chiralcel OD-H (от компании "Chiral Technologies, Inc."), которую элюируют 15%-ным раствором изо-пропанола в гексане (об/об) со скоростью подачи 0,5 мл/мин. Пики, которые элюируются со временами удерживания приблизительно 13,5, 18,8, 37,1 и 79,7 минут, представляют собой, соответственно, изомер 1, изомер 2, изомер 3 и изомер 4. Изомеры 3 и 4 выделяют из смеси на колонке 2,1 x 25 см (R, R)Whelk- 01 (от компании "Regis Technologies, Inc."). Эти два изомера элюируются со временами удерживания приблизительно 23,9 и 26,8 минут при использовании 20%-ного раствора изо-пропанола в гексагене (об/об) со скоростью подачи 10 мл/мин при температуре 30oC. Целевые изомеры элюируются в виде неразделившейся смеси со временем удерживания 28,9 минут и их разделяют на втором этапе расщепления. На втором этапе расщепления неразделенную смесь помещают в колонку 2,1 x 25 см Chiralcel OD (от компании "Chiral Technologies, Inc. "), температуру которой поддерживают на уровне 30oC и элюируют 12%-ным раствором изо-пропанола в гексане (об/об) со скоростью подачи 12 мл/мин. Время удерживания для изомера 1 составляет 14,5 минут, а для изомера 2 - 20,8 минут.
Пример 345. N-[3-{ 1(R или S)-(4-Гидpoкcи-5,6-дигидpo-2- oксо-6(R или S)-(2-(4-фторфенил)этил)-6-пропил-2H- пиран-3-ил)-2,2-диметилпропил}фенил]- 5-цианопиридин-2- сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 1/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил. Амин получают из первого стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 150. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-2,7, 3,2, 3,5, 3,6, 3,7, 4,1, 6,8-7,4, 7,5, 7,8-8,2, 8,8 м.д.
Масс-спектр высокого разрешения: 606,2429.
TCX: Rf 0,40 (15% этилацетата в дихлорметане).
Пример 346. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6(S или R)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3- ил)-2,2-диметилпропил} фенил] -5-цианопиридин-2-сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 2/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил. Амин получают из второго стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 150. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,6, 0,7-2,6, 3,4, 3,5, 3,7, 4,2, 6,8-7,3, 7,5, 7,8-8,2, 8,8-9,0 м.д.
Масс-спектр высокого разрешения: 606,2434.
ТСХ: Rf 0,40 (15% эталацетата в дихлорметане).
Пример 348. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро- 2-окco-6(S или R)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран- 3-ил)-2,2-диметилпропил} фенил] -5-цианопиридин-2- сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 4/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил). Амин получают из первого стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 150. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-2,7, 3,2, 3,5, 3,6,3,7, 4,1, 6,8-7,4, 7,5, 7,8-8,2, 8,8 м.д.
Масс-спектр высокого разрешения:606,2429.
ТСХ: Rf 0,40 (15% этилацетата в дихлорметане).
Пример 349. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6(R или S)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3- ил)-2,2-диметилпропил} фенил] -1-метил-1H-имидазол-4- сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 1-метилимидазол-4-ил) /Изомер 1/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил. Амин получают из первого стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 150. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,4, 1,7, 2,3-2,7, 3,6, 3,9, 4,1, 6,8-7,5 м.д.
Масс-спектр высокого разрешения: 584,2585.
ТСХ: Rf 0,34 (5% метанола в дихлорметане).
Пример 350. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6(S или R)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран- 3-ил)-2,2-диметилпропил} фенил] -1-метил-1H-имидазол-4- сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 1-метилимидазол-4-ил) /Изомер 2/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил. Амин получают из второго стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 150. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-1,1, 1,3, 1,7, 2,3-2,7, 3,6, 3,9, 4,1, 6,8-7,5 м.д.
Масс-спектр высокого разрешения: 584,2585.
TCX: Rf 0,34 (5% метанола в дихлорметане).
Пример 351. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6(R или S)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил) -2,2-диметилпропил} фенил] -1-метил-1H-имидазол-4-сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 1-метилимидазол-4-ил) /Изомер 3/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил. Амин получают из второго стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 150. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-1,1, 1,3, 1,7, 2,3-2,7, 3,6, 3,9, 4,1, 6,8-7,5 м.д.
Масс-спектр высокого разрешения: 584,2591.
ТСХ: Rf 0,34 (5% метанола в дихлорметане).
Пример 352. N-[3-{ 1(S или R)-)4-Гидрокси-5,6-дигидро-2- окco-6(S или R)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3- ил)-2,2-диметилпропил} фенил] -1-метил-1H-имидазол-4-сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает трет-бутил, R4 обозначает 1-метилимидазол-4-ил) /Изомер 4/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил. Амин получают из второго стереоизомера формулы WWW-2, который элюируется из колонки Chiralcel OD при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 150. Целевое соединение выделяют в виде аморфного вещества после очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,4, 1,7, 2,3-2,7, 3,6, 3,9, 4,1, 6,8-7,5 м.д.
Масс-спектр высокого разрешения: 584,2580.
TCX: Rf 0,34 (5% метанола в дихлорметане).
Пример 353. N-[3-{ 1(4-Гидpoкcи-5,6-лигидpo-2-oкco-6,6- бис(2-фенилэтил)-2H-пиран-3-ил)метил} фенил] -5- цианопиридин-2-сульфонамид (формула XXX-5: R1 обозначает 5-цианопиридин-2-ил) См. Схему XXX.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 64 мг амина формулы ХХХ-4 с 5-цианопиридин-2-сульфохлоридом. После очистки методом испарительной хроматографии на силикагеле, элюируя 2-3%-ным раствором этилацетата в дихлорметане, получают 73,2 мг целевого соединения в виде аморфного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,8-2,1, 2,6, 6,9-7,3, 7,9, 8,8 м.д.
Масс-спектр высокого разрешения: 594,2068.
TCX: Rf 0,40 (3% метанола в дихлорметане).
Пример 354. N-[3-{ 1-(4-Гидрокси-5,6-дигидро-2-оксо-6,6- бис(2-фенилэтил)-2H-пиран-3-ил)метил} фенил] -5- аминопиридин-2-сульфонамид (формула UUU R1 и R2 обозначают фенэтил, R3 обозначает атом водорода). См. Схему UUU.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 69 мг амина формулы ХХХ-4 с 5-нитропиридин-2-сульфохлоридом. После очистки методом испарительной хроматографии на силикагеле, элюируя 2-3%-ным раствором метанола в дихлорметане, получают 107 мг промежуточного нитропроизводного формулы UUU-5 (где R1 и R2 обознчают фенэтил, а R3 обозначает атом водорода). Восстановление в амин осуществляют газообразным водородом над палладием на угле в качестве катализатора. Испарительной хроматографией на силикагеле, элюируя 4-6%-ным раствором метанола в дихлорметане, получают 65,0 мг целевого соединения в виде аморфного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 1,9-2,1, 2,6, 3,5-4,0, 6,7, 6,9-7,3, 7,5, 7,9 м.д.
Масс-спектр высокого разрешения: 584,2215.
ТСХ: Rf 0,4 (5%метанола в дихлорметане).
Препарат 151. Расщепление фенилметилового эфира N-[3-[1- (4-гидрокси-5,6-дигидро-2-оксо-6,6-бис(2-фенэтил)-2H-пиран- 3-ил)-2,2-диметилпропил]фенил]карбаминовой кислоты на 2 изомера (формула WWW-2: R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил) См. Схему WWW.
Инжектируют по 40 мг исходного вещества в колонку 2,1•25 см (R,R)Whelk-O 1 (от компании "Regis Technologies, Inc."), температуру которой поддерживают на уровне 30oC. 2 энантиомера элюируются с временами удерживания приблизительно 37 минут (энантиомер 1) и 43 минуты (энантиомер 2) при использовании 25%-ного изо-пропанола и 0,05%-ной уксусной кислоты со скоростью подачи 12 мл/мин. Соответствующие фракции объединяют по результатам анализа на колонке 0,46•25 см (R,R)Whelk-0 1 при элюировании 30%-ным изо-пропанолом и 0,1%-ной уксусной кислотой (об/об) со скоростью подачи 1,0 мл/мин. Изомеры элюируются со временами удерживания 19,1 минут (изомер 1) и 23,0 минут (изомер 2), соответственно.
Пример 355. N-[3-{ 1(R или S)-(4-Гидpoкcи-5,6-дигидpo-2- oксо-6,6-бис(2-фенэтил)-2H-пиран-3-ил)-2,2-диметилпропил} фенил]-5-аминопиридин-2-сульфонамид (формула WWW-4: R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил, R4 обозначает 5-аминопиридин-2-ил) /Энантиомер 1/ См. Схему WWW.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 73 мг амина формулы WWW-3 (R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил) с 5-нитропиридин-2-сульфохлоридом. Используемый амин получают из первого энантиомера формулы WWW-2, который элюируется из колонки (R,R)Whelk-0 при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 151. После очистки методом испарительной хроматографии на силикагеле, элюируя 5-10%-ным раствором этилацетата в дихлорметане, получают 94,0 мг промежуточного нитропроизводного формулы UUU-5 (R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил). Восстановление до амина проводят газообразным водородом в присутствии палладия на угле в качестве катализатора. После очистки методом испарительной хроматографии на силикагеле, элюируя 4%-ным раствором метанола в дихлорметане, получают 74,8 мг целевого соединения в виде аморфного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,95, 2,0, 2,6, 6,8, 6,9-7,4, 7,5, 7,9 м.д.
Масс-спектр высокого разрешения: 640,2828.
ТСХ: Rf 0,27 (5% метанола в дихлорметане).
Пример 356. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6,6-бис(2-фенэтил)-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -5- аминопиридин-2-сульфонамид (формула WWW-4: R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил, R4 обозначает 5-аминопиридин-2-ил) /Энантиомер 2/ См. Схему WWW.
В соответствии с общей методикой сульфонилирования, приведенной в Примере 252, вводят во взаимодействие 73 мг амина формулы WWW-3 (R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил) с 5-нитропиридин-2-сульфохлоридом. Используемый амин получают из второго энантиомера формулы WWW-2, который элюируется из колонки (R,R)Whelk-0 при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 151. После очистки методом испарительной хроматографии на силикагеле, элюируя 5-10%-ным раствором этилацетата в дихлорметане, получают 91,3 мг промежуточного нитропроизводного формулы UUU-5 (R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил). Восстановление до амина проводят газообразным водородом в присутствии палладия на угле в качестве катализатора. После очистки методом испарительной хроматографии на силикагеле, элюируя 4%-ным раствором метанола в дихлорметане, получают 54,3 мг целевого соединения в виде аморфного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,95, 2,0, 2,6, 6,8, 6,9-7,4, 7,5, 7,9 м.д.
Масс-спектр высокого разрешения: 640,2828.
ТСХ: Rf 0,27 (5% метанола в дихлорметане).
Пример 357. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6,6-бис(2-фенэтил)-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -1-метил-1H-имидазол-4-сульфонамид (формула WWW-4: R1 и R2 обозначает фенэтил, R3 обозначает трет-бутил, R4 обозначает 1-метил-1H-имидазол-4-ил) /Энантиомер 1/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил. Используемый амин получают из первого энантиомера формулы WWW-2, который элюируется из колонки (R, R)Whelk-O при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 151. После очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане, получают целевое соединение в виде аморфного вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,98, 2,0, 2,6, 3,6, 3,8, 6,9-7,5 м.д.
Масс-спектр высокого разрешения: 628,2832.
ТСХ: Rf 0,38 (5% метанола в дихлорметане).
Пример 358. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6,6-бис(2-фенэтил)-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -1- метил-1H-имидазол-4-сульфонамид (формула WWW-4: R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил, R4 обозначает 1-метил-1H-имидазол-4-ил) /Энантиомер 2/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил. Используемый амин получают из второго энантиомера формулы WWW-2, который элюируется из колонки (R,R) Whelk-0 при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 151. После очистки методом испарительной хроматографии на силикагеле, элюируя 3%-ным раствором метанола в дихлорметане, получают целевое соединение в виде аморфного вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,98, 2,0, 2,6, 3,6, 3,8, 6,9-7,5 м.д.
Масс-спектр высокого разрешения: 628,2838.
ТСХ: Rf 0,38 (5% метанола в дихлорметане).
Пример 359. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро- 2-оксо -6,6-бис(2-фенэтил)-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -5- цианопиридин-2-сульфонамид (формула WWW-4: R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил, R4 обозначает 5-цианопиридин-2-ил) /Энантиомер 1/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил. Используемый амин получают из первого энантиомера формулы WWW-2, который элюируется из колонки (R, R)Whelk-0 при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 151. После очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане, получают целевое соединение в виде аморфного вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,87, 1,9, 2,6, 6,8-7,4, 7,9, 8,8 м.д.
Масс-спектр высокого разрешения: 650,2681.
ТСХ: Rf 0,46 (15% этилацетата в дихлорметане).
Пример 360. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6,6-бис(2-фенэтил)-2H-пиран-3-ил)-2,2-диметилпропил} фенил]-5-цианопиридин-2-сульфонамид (формула WWW-4: R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил, R4 обозначает 5-цианопиридин-2-ил) /Энантиомер 2/ См. Схему WWW.
Целевое соединение получают в соответствии с общей методикой сульфонилирования, приведенной в Примере 252, используя амин формулы WWW-3, где R1 и R2 обозначают фенэтил, R3 обозначает трет-бутил. Используемый амин получают из второго энантиомера формулы WWW-2, который элюируется из колонки (R, R)Whelk-0 при проведении хиральной жидкостной хроматографии высокого разрешения Препарата 151. После очистки методом испарительной хроматографии на силикагеле, элюируя 10%-ным раствором этилацетата в дихлорметане, получают целевое соединение в виде аморфного вещества.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,87, 1,9, 2,6, 6,8-7,4, 7,9, 8,8 м.д.
Масс-спектр высокого разрешения: 650,2681.
ТСХ: Rf 0,46 (15% этилацетата в дихлорметане).
Препарат 152. Расщепление фенилметилового эфира N-[3-[1-(4-гидрокси-5,6-дигидро-2-оксо-6,6-дипропил-2H-пиран-3-ил) пропил] фенил] карбаминовой кислоты на 2 изомера (формула WWW-2: R1 и R2 обозначает пропил, R3 обозначает этил) См. Схему WWW.
Образцы исходного соединения инжектируют в колонку 2,1 х 25 см Chiralcel OD и элюируют 20%-ным раствором изо-пропанола в гексане (об/об) со скоростью подачи 10 мл/мин. Вещество, которое элюируется с временами удерживания приблизительно 19,1 минут, представляет собой один изомер (энантиомер 1), а вещество, которое элюируется со временем удерживания приблизительно 37,7 минут представляет собой другой изомер (энантиомер 2). Соответствующие фракции объединяют и раздельно упаривают на ротационном испарителе (в течение приблизительно 30 минут при температуре в бане не более 50oC) и получают твердые вещества белого цвета.
Пример 361. N-[3-{1(R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6,6-дипропил-2H-пиран-3-ил)пропил} фенил] -5-цианопиридин-2- сульфонамид (формула WWW-4: R1 и R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) /Энантиомер 1/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя энантиомер 1 Препарата 152.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,2-2,2, 3,90, 6,9-7,2, 8,0, 8,15, 8,9 м.д.
Масс-спектр высокого разрешения: 497,1984.
ТСХ: Rf 0,38 (15% этилацетата в дихлорметане).
Пример 362. N-[3-{1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6,6-дипропил-2H-пиран-3-ил)пропил} фенил] -5-цианопиридин-2- сульфонамид (формула WWW-4: R1 и R2 обозначают пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) /Энантиомер 2/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя энантиомер 2 Препарата 152.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,2-2,2, 3,90, 6,9-7,2, 8,0, 8,15, 8,9 м.д.
Масс-спектр высокого разрешения: 497,1980.
ТСХ: Rf 0,38 (15% этилацетата в дихлорметане).
Пример 363. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро- 2-окco-6,6-дипропил-2H-пиран-3-ил)пропил} фенил] -5- аминопиридин-2-сульфонамид (формула WWW-4: R1 и R2 обозначают пропил, R3 обозначает этил, R4 обозначает 5-аминопиридин-2-ил) /Энантиомер 1/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя энантиомер 1 Препарата 152.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-0,9, 1,2-2,2, 3,8, 6,8-7,2, 7,5, 7,9 м.д.
Масс-спектр высокого разрешения: 487,2122.
TCX: Rf 0,28 (5% метанола в дихлорметане).
Пример 364. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6,6-дипропил-2H-пиран-3-ил)пропил} фенил] -5- аминопиридин-2-сульфонамид (формула WWW-4: R1 и R2 обозначают пропил, R3 обозначает этил, R4 обозначает 5-аминопиридин-2-ил) /Энантиомер 2/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя энантиомер 2 Препарата 152.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,7-0,9, 1,2-2,2, 3,8, 6,8-7,2, 7,5, 7,9 м.д.
Масс-спектр высокого разрешения: 487,2140.
ТСХ: Rf 0,28 (5% метанола в дихлорметане).
Препарат 153. Расщепление фенилметилового эфира N-[3-[1-(4-гидрокси-5,6-дигидро-2-оксо-6-(2-(4-фторфенил)этил) -6-пропил-2H-пиран-3-ил)пропил} фенил] карбаминовой кислоты на 4 изомера (формула WWW-2: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил) См. Схему WWW.
Энантиомеры определяют в порядке их элюирования из Системы D. Система жидкостной хроматографии высокого разрешения включает колонку 0,56 х 25 см Chiralcel OD-H (от компании "Chiral Technologies, Inc."), которую элюируют смесью, содержащей 20% изо-пропанола и 0,05% трифторуксусной кислоты в гексане (об/об), подаваемой насосом со скоростью 0,5 мл/мин. Времена удерживания в этой системе составляют (изомер 1) 21,6 минут, (изомер 2) 34,5 минут, (изомер 3) 55,2 минут и (изомер 4) 66,6 минут.
Энантиомеры разделяют на колонке 2,1 x 25 см Chiralcel OD (от компании "Chiral Technologies, Inc. "), которую элюируют смесью, содержащей 17,5% изо-пропанола в гексане (об/об), подаваемой со скоростью 10 мл/мин. Соответствующие фракции с временами удерживания приблизительно 24,6, 42,9, 66,3 и 77,4 минут объединяют после проведения анализа в Системе D. В соответствии с порядком элюции, четыре изомера обозначают, соответственно, как изомеры 1-4.
Во всех случаях, когда проводят удаление растворителя из объединенных фракций, используют следующую методику. Растворитель удаляют из объединенных фракций на ротационном испарителе под остаточным давлением приблизительно 30 мм рт. ст. и температуре в бане 45±5oC. Если в смеси присутствует уксусная кислота, то добавляют толуол в количестве приблизительно 10 мл/л и упаривают досуха. Окончательное удаление растворителя до взвешивания проводят при комнатной температуре в течение 2-24 часов под остаточным давлением 1 мм рт. ст.
Пример 365. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6(R или S)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3- ил)пропил} фенил] -5-цианопиридин-2-сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 1/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя изомер 1 Препарата 153.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,3, 1,6-2,2, 2,5, 3,9, 6.8-7,3, 7,9-8,1, 8,9 м. д.
Масс-спектр высокого разрешения: 578,2120.
ТСХ: Rf 0,35 (15% этилацетата в дихлорметане).
Пример 366. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- окco-6(S или R)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил) пропил} фенил] -5-цианопиридин-2-сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 2/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя изомер 2 Препарата 153.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,3, 1,6-2,2, 2,5, 3,9, 6,8-7,3, 7,9-8,1, 8,9 м. д.
Масс-спектр высокого разрешения: 578,2120.
ТСХ: Rf 0,35 (15% этилацетата в дихлорметане).
Пример 367. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6(R или S)-(2-(4-фторфенил)этил)-6-пропил -2H-пиран-3-ил)пропил} фенил] -5-цианопиридин-2- сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 3/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя изомер 3 Препарата 153.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,3, 1,6-2,2, 2,5, 3,9, 6,8-7,3, 7,9-8,1, 8,9 м. д.
Масс-спектр высокого разрешения: 578,2126.
ТСХ: Rf 0,35 (15% этилацетата в дихлорметане).
Пример 367A. N-[3-{ 1(S или R)-(4-Гидрокси-5,6-дигидро-2- оксо-6(S или R)-(2-(4-фторфенил)этил)-6-пропил-2H- пиран-3-ил)пропил} фенил] -5-цианопиридин-2-сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-цианопиридин-2-ил) /Изомер 4/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя изомер 4 Препарата 153.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,3, 1,6-2,2, 2,5, 3,9, 6,8-7,3, 7,9-8,1, 8,9 м. д.
Масс-спектр высокого разрешения: 578,2126.
ТСХ: Rf 0,35 (15% этилацетата в дихлорметане).
Пример 368. N-[3-{ 1{ R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6(R или S)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил) пропил}фенил]-1-метил-1H-имидазол-4-сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 1-метилимидазол-4-ил) /Изомер 1/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя изомер 1 Препарата 153.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,3, 1,6-2,2, 2,6, 3,63, 4,0, 6,9-7,5 м.д.
Масс-спектр высокого разрешения: 556,2265.
ТСХ: Rf 0,29 (5% метанола в дихлорметане).
Пример 369. N-[3-{ 1(R или S)-(4-Гидрокси-5,6-дигидро-2- оксо-6(R или S)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3- ил)пропил} фенил] -5-аминопиридин-2-сульфонамид (формула WWW-4: R1 обозначает 4-фторфенэтил, R2 обозначает пропил, R3 обозначает этил, R4 обозначает 5-аминопиридин-2-ил) /Изомер 1/ См. Схему WWW.
Целевое соединение получают по аналогии с ранее приведенными методиками, используя изомер 1 Препарата 153.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР: δ 0,8-1,0, 1,3, 1,6-2,2, 2,5, 3,9, 6,8-7,2, 7,5, 7,9 м.д.
Масс-спектр высокого разрешения: 568,2271.
TCX: Rf 0,27 (5% метанола в дихлорметане).
Препарат 154. Гексагидро-2H-бензопиран-2,4(3H)-дион (формула DDDD-2, где n равно 1) См. Схему DDDD.
Раствор 0,42 г оксида платины и 1,6 г соединения формулы DDDD-1, где n равно 1, в 100 мл уксусной кислоты помещают на 1,5 часа в аппарат Парра для гидрирования с начальным давлением водорода 60 фунт-сила/кв. дюйм (344,7 кПа). Затем реакционную смесь фильтруют через целит и упаривают в вакууме, получая твердое вещество бежевого цвета. Сырой продукт очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш), элюируя 0-5%-ным раствором метанола в хлороформе, и получают 0,94 г целевого соединения в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 4,84-4,80, 3,54, 3,40, 2,60-2,53, 2,98-2,02, 1,79-1,65, 1,62-1,54, 1,44-1,40 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 203,0, 167,4, 74,3, 47,7, 45,6, 29,1, 23,5, 23,2, 19,7 м.д.
ИК-спектр (минеральное масло): 3092, 2768, 2714, 2695, 2662, 1657, 1614, 1577, 1444, 1352, 1345, 1340, 1323, 1308, 1295, 1287, 1260, 1244, 1211, 1188, 1057, 1004, 938, 909, 890, 843, 832, 600 см-1.
Масс-спектр (E1): /М+/ = 168.
Элементный анализ, найдено: С, 64,16; H, 7,16.
Препарат 155. 4a, 5,6,7,8,8а-Гексагидро-4-гидрокси-3-[1- (3-нитрофенил)пропил] -2H-1-бензопиран-2-он (формула DDDD-4, где N равно 1, а R1 обозначает этил) См. Схему DDDD.
Раствор 3,17 г трихлорида алюминия в 30 мл тетрагидрофурана добавляют к раствору 2,00 г целевого продукта Препарата 154 и 1,82 г 3-нитробензальдегида в 20 мл тетрагидрофурана. Полученную смесь перемешивают при комнатной температуре в течение 2,5 часов и добавляют 7,28 г декагидрата карбоната натрия, после чего реакционную смесь перемешивают еще в течение 20 минут. Смесь сушат над сульфатом магния, отфильтровывают через целит и упаривают в вакууме, получая 6,05 г смолы желтого цвета. Сырой продукт немедленно растворяют в 50 мл тетрагидрофурана, содержащего 0,73 г комплекса бромид меди (1) - диметилсульфид, и в реакционную смесь добавляют 13,1 мл 1,0 М раствора триэтилалюминия в гексане. Перемешивают при комнатной температуре в течение часа и разлагают, добавив воду. Полученную смесь выливают в смесь эфира и воды. Органический слой отделяют, промывают насыщенным раствором соли и упаривают в вакууме, получая 4,0 г масла желтого цвета. Сырой продукт очищают испарительной колоночной хроматографией, элюируя 10-50%-ным раствором этилацетата в гексане, и получают 0,63 г целевого соединения в виде пенообразного вещества желтого цвета.
Вещество обладает следующими физическими характеристиками:
Температура плавления 86-91oC.
ИК-спектр (минеральное масло): 3085, 1635, 1569, 1528, 1448, 1394, 1365, 1349, 1325, 1307, 1288, 1270, 1251, 1244 см-1.
Пример 370. 5-Циaнo-N-[3-1-(4a,5,6,7,8,8a-гeкcaгидpo-4- гидрокси-2-оксо-2H-1-бензопиран-3-ил)пропил]фенил]-2- пиридинсульфонамид (формула DDDD-7, где n равно 1, R1 обозначает этил, а R2 обозначает 5-циано-2-пиридил) См. Схему DDDD.
Раствор 0,63 г целевого соединения Препарата 155 в 50 мл этанола и 0,3 г 10%-ного палладия на угле помещают на 3 часа в аппарат Парра для гидрирования с начальным давлением водорода 50 фунт-сила/кв. дюйм (344,7 кПа). Затем реакционную смесь фильтруют через целит и упаривают в вакууме, получая 0,519 г промежуточного соединения. 0,25 г указанного промежуточного соединения немедленно растворяют в 5 мл хлористого метилена и к полученному раствору добавляют 0,168 г 5-циано-2-пиридинсульфохлорида и 0,134 мл пиридина. Полученную смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь затем очищают методом испарительной колоночной хроматографии на силикагеле 60 (230-400 меш), элюируя 0-2,5%-ным раствором метанола в хлороформе, и получают 0,164 г целевого соединения в виде пенообразного вещества белого цвета с т.пл. 122-125oC.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 468,1611.
Пример 371. 4-Циано-N-[3-1-(4a,5,6,7,8,8а-гексагидро-4- гидрокси-2-оксо-2H-1-бензопиран-3-ил)пропил]фенил] бензолсульфонамид (формула DDDD-7, где n равно 1, R1 обозначает этил, а R2 обозначает 4-цианофенил) См. Схему DDDD.
В соответствии с общей методикой, описанной в Примере 370, и проводят несущественные изменения, получают, заменив 5-циано-2-пиридинсульфохлорид на 4-цианобензолсульфохлорид, 0,236 г целевого соединения в виде пенообразного вещества белого цвета с т.пл. 127-130oC.
Вещество обладает следующими физическими характеристиками:
Масс-спектр высокого разрешения: 466,1583.
Препарат 156. 4-Гeкcaгидpoциклoгeптa[b]пиpaн-2,4(3H,4aH)- дион (формула DDDD-2, где n равно 2) См. Схему DDDD.
В соответствии с общей методикой, описанной для Препарата 154, и проводят несущественные изменения, получают, заменив циклогексилпиранон формулы DDDD-1, где n равно 1, на циклогептилпиранон формулы DDDD-1, где n равно 2, 0,337 г целевого соединения в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 4,97-4,91, 3,52, 3,42, 2,64-2,58, 2,22-2,11, 2,01-1,72, 1,59-1,36 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 203,0, 167,2, 78,0, 52,1, 46,5, 32,1, 28,6, 27,1, 25,7,21,3.
ИК-спектр (минеральное масло): 3074, 2791, 2755, 2736, 2687, 2637, 2608, 2585, 1655, 1625, 1586, 1500, 1480, 1443, 1333, 1324, 1293 (синглет), 1265, 1254, 1240, 1222, 1196, 1173, 1082, 1053, 1016, 909, 889, 832, 611 см-1.
Масс-спектр (E1): [M+] = 182.
Элементный анализ, найдено: С, 66,16; H, 7,90.
Препарат 157. 5,6,7,8,9,9а-Гексагидро-4-гидрокси-3-[1- (3-нитрофенил)пропил] -циклогепта[b] пиран-2(4aH)-он (формула DDDD-4, где n равно 2, a R1 обозначает этил) См. Схему DDDD.
В соответствии с общей методикой, описанной для препарата 155, и проводя несущественные изменения, получают, заменив целевой продукт Препарата 154 на целевой продукт Препарата 156, 2,5 г целевого соединения в виде пенообразного вещества желтого цвета с т.пл. 75-78oC.
Вещество обладает следующими физическими характеристиками:
ИК-спектр (минеральное масло): 3071, 2667, 1638, 1528, 1395, 1350, 1305, 1276, 1250, 1143, 1130, 1120, 1100, 1066, 782, 764, 741, 697, 685 см-1.
Масс-спектр высокого разрешения, найдено: 345,1590.
Элементный анализ, найдено: С, 58,74; H, 5,63; N,3,48.
Пример 372. 5-Циано-N-[3-[1-(2,4а,5,6,7,8,9,9a-октагидрo- 4-гидpoкcи-2-oкcoциклoгeптa[b] пиpaн-3-ил)пропил] фенил]-2- пиридинсульфонамид (формула DDDD-7, где n равно 2, R1 обозначает этил, а R2 обозначает 5-циано-2-пиридил) См. Схему DDDD.
В соответствии с общей методикой, описанной в Примере 370, и проводят несущественные изменения, получают, заменив целевой продукт Препарата 155 на целевой продукт Препарата 157, 0,206 г целевого соединения в виде пенообразного вещества белого цвета с т.пл. 163-166oC.
Вещество обладает следующими физическими характеристиками:
ИК-спектр (минеральное масло): 3352, 3128, 3100, 3073, 3029, 1760, 1726, 1641, 1608, 1593, 1584, 1411, 1397, 1355, 1295, 1282, 1242, 1207, 1173, 1125, 1106, 1086, 1074, 1028, 974, 967, 721, 701, 645, 638 см-1.
Масс-спектр высокого разрешения, найдено: 481,1693.
Препарат 158. Октагидро-2H-циклоокта[b] пиран-2,4(3H)-дион (формула DDDD-2, где n равно 3). См. Схему DDDD.
В соответствии с общей методикой, описанной для Препарата 154, и проводя несущественные изменения, получают, заменив циклогептилпиранон формулы DDDD-1, где n равно 2, на циклооктилпиранон формулы DDDD-1, где n равно 3, 1,72 г целевого соединения в виде твердого вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 4,84-4,78, 3,61, 3,40, 2,75-2,70, 2,14-1,97, 1,90-1,72, 1,68-1,44 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 204,2, 167,2, 78,2, 49,5, 46,1, 28,5, 27,3, 26,2, 24,7, 23,9, 22,1 м.д.
ИК-спектр (минеральное масло): 2659, 2617, 1650, 1612, 1579, 1444, 1356, 1332, 1307, 1287, 1265, 1244, 1227, 1209, 1041, 1035, 1003, 962, 946, 860, 832, 824 см-1.
Масс-спектр высокого разрешения, найдено: 196,1100.
Элементный анализ, найдено: С, 67,06; H, 8,23.
Препарат 159. 3-[2,2-Диметил-1-(3-нитрофенил)пропил]- 4a, 5,6,7,8,9,10,10а-октагидро-4-гидрокси-2H-циклоокта[b] пиран-2-он (формула DDDD-4, где n равно 3, a R1 обозначает трет-бутил) См. Схему DDDD.
Раствор 1,36 г трихлорида алюминия в 30 мл тетрагидрофурана добавляют к раствору 1,0 г целевого продукта Препарата 158 и 0,77 г 3-нитробензальдегида в 20 мл тетрагидрофурана. Полученную смесь перемешивают при комнатной температуре в течение 2,3 часа и добавляют 3,06 г декагидрата карбоната натрия, после чего реакционную смесь перемешивают еще в течение 15 минут. Смесь сушат над сульфатом магния, отфильтровывают через целит и упаривают в вакууме, получая смолу желтого цвета. Сырой продукт немедленно растворяют в 5 мл тетрагидрофурана для использования на следующей стадии.
В сухую колбу помещают 0,82 г активированного цинка, 3 мл тетрагидрофурана, 0,035 мл либромэтана и 0,21 мл 1 М раствора триметилсилилхлорида в тетрагидрофуране. После добавления всех реагентов смесь подвергают в течение 15 минут воздействию ультразвука при температуре 45oC. Смесь далее разбавляют, добавив 2 мл тетрагидрофурана, и по каплям добавляют 1,32 мл йодистого трет-бутила. Полученную смесь подвергают в течение 3 часов воздействию ультразвука при температуре 45oC. Отдельно перемешивают смесь 0,85 г цианида меди (1) и 0,80 г хлорида лития в 4 мл тетрагидрофурана при комнатной температуре в течение 1 часа, пока смесь не станет практически гомогенной, и охлаждают до температуры минус 30oC. Раствор цинкорганического производного затем добавляют с помощью канюли к раствору цианида меди, дают полученной смесь нагреться до 0oC и перемешивают в течение 15 минут. Реакционную смесь затем охлаждают до минус 78oC и добавляют полученный выше раствор промежуточного соединения. Перемешивают 20 минут при температуре минус 78oC и 30 минут при температуре 0oC, а затем реакционную смесь разлагают насыщенным водным раствором хлорида аммония и разбавляют, дополнительно добавляя 60 мл тетрагидрофурана. Органический слой отделяют, промывают водой и упаривают в вакууме, получая 2,17 г пенообразного вещества оранжевого цвета. Сырой продукт очищают методом испарительной колоночной хроматографии, элюируя 10-30%-ным раствором этилацетата в гексане с последующей перекристаллизацией из смеси хлористый метилен/гексан, и получают 0,60 г целевого соединения в виде твердого вещества желтого цвета с т.пл. 158-161oC.
Вещество обладает следующими физическими характеристиками:
ИК-спектр (минеральное масло): 3077, 2646, 1632, 1599, 1529, 1477, 1450, 1396, 1357, 1349, 1334, 1317, 1283, 1273, 1252, 1232, 1217, 1205, 1181 см-1.
Пример 373. 5-Циaнo-N-[3-[2,2-димeтил-1-(4a, 5,6,7,8,9,10,10a-октагидро-4- гидрокси-2-оксо-2H-циклоокта[b] пиран-3-ил)пропил] фенил] -2-пиридинсульфонамид (формула DDDD-7, где n равно 2, R1 обозначает этил, а R2 обозначает 5-циано-2-пиридил) См. Схему DDDD.
В соответствии с общей методикой, описанной в Примере 370, и проводя несущественные изменения, получают, заменив целевой продукт Препарата 157 на целевой продукт Препарата 159, 0,034 г целевого соединения в виде кристаллического вещества белого цвета с т.пл. 182-185oC.
Вещество обладает следующими физическими характеристиками:
ИК-спектр (минеральное мало): 3246, 3121, 3098, 2615, 1655, 1633, 1607, 1585, 1575, 1491, 1411, 1395, 1354, 1335, 1322, 1311, 1298, 1281, 1275, 1262, 1255, 1233, 1206, 1178, 1121, 1109, 1028, 977, 702, 657, 646, 635, 605 см-1.
Масс-спектр высокого разрешения, найдено: 524,2216.
Элементный анализ, найдено: С, 63,86; H, 6,41; N, 7,82.
Препарат 160. (3(3R),4S)-3-[2-[1-[3-[бис(фенилметил) амино]фенил]пропил] -5-гидрокси-1,3-диоксо-5-(2-фенилэтил) октил] -4-фенил-2-оксазолидинон (формула W-10, где R1 обозначает 2-фенилэтил) См. Схему W.
К 100 мл хлористого метилена добавляют 5,0 г целевого соединения Препарата 95 (формула W-8) и полученный раствор в токе азота охлаждают до минус 78oC. К этому раствору добавляют 1,0 мл чистого тетрахлорида титана и 1,63 мл ди-изо-пропилэтиламина и перемешивают в течение часа. К полученному раствору добавляют 3,30 г 1-фенил-3-гексанона и полученной реакционной смеси в течение 2,5 часов дают нагреться до температуры 0oC. Разлагают реакционную смесь насыщенным раствором хлорида аммония, экстрагируют хлористым метиленом, органические вытяжки промывают насыщенным раствором бикарбоната натрия и упаривают в вакууме, получая 9,7 г масла желтого цвета. Его хроматографируют, используя 900 г силикагеля (элюируют 10%-ным раствором гексана в хлористом метилене и 100%-ным хлористым метиленом), и получают 3,30 г целевого продукта в виде пенообразного вещества желтого цвета с т.пл. 121-126oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,33-7,23, 7,14, 7,04, 6,61-6,50, 5,45, 5,22, 4,71, 4,60, 4,48, 4,26, 3,33, 3,15-3,03, 2,58, 2,47-2,31, 1,93, 1,40-1,28, 1,24-1,13, 1,11-0,96, 0,88-0,77, 0,62-0,57 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 167,2, 167,1, 153,7, 142,6, 141,0, 138,2, 138,1, 129,6, 129,5, 129,2, 128,9, 128,8, 128,6, 128,4, 128,3, 127,0, 125,8, 125,6, 73,1, 70,0, 69,9, 63,9, 57,9, 54,8, 54,7, 51,5, 51,4, 48,3, 41,3, 41,0, 40,8, 40,5, 29,8, 29,6, 27,1, 26,9, 16,8, 16,6, 14,6, 11,7, 11,6 м.д.
ИК-спектр (минеральное масло): 3525, 3061, 3026, 1777, 1720, 1690, 1601, 1495, 1361, 1335, 1238, 1199, 1104, 735, 698 см-1.
Масс-спектр (E1): [M+] = 736.
Элементный анализ, найдено: С, 78,03; H, 7,11; N, 3,79.
Препарат 161. (3S)-3-[1-[3-Биc(фeнилмeтил)амино]фенил] пропил]-5,6-дигидро-4-гидрокси-6-(2-фенилэтил)-6-пропилпиран-2-он (формула W-11, где R1 обозначает 2-фенилэтил) См. Схему W.
К 5 мл сухого тетрагидрофурана добавляют 2,7 г целевого продукта Препарата 160 и полученный раствор в токе азота охлаждают до 0oC. К полученному раствору добавляют 0,45 мл 1 М раствора трет-бутоксида калия в тетрагидрофуране. Дают реакционной смеси нагреться до 20oC и перемешивают в течение 2 часов. Разлагают реакционную смесь насыщенным водным раствором хлорида аммония и экстрагируют этилацетатом. Органический слой промывают водой, сушат и упаривают в вакууме, получая 0,28 г масла желтого цвета. Его хроматографируют, используя 80 г силикагеля (элюируют 10%-30%-ным раствором ацетона в гексане), и получают 0,195 г пенообразного вещества желтого цвета. Его перекристаллизовывают из смеси этилацетат/гексан и получают 0,146 г целевого соединения с т.пл. 128-131oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,35-7,12, 6,73-6,64, 5,84, 4,73-4,57, 4,12, 2,69-2,61, 2,38-2,20, 1,95-1,65, 1,41- 1,32, 0,98-0,87 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 204,1, 204,0, 171,7, 171,4, 169,6, 140,9, 140,8, 140,6, 140,5, 140,4, 139,9, 139,8, 138,3, 129,7, 129,6, 129,5, 128,9, 128,6, 128,5, 128,4, 128,2, 128,1, 127,1, 126,9, 126,8, 126,7, 126,5, 126,4, 126,3, 126,2, 126,0, 125,9, 116,8, 112,6, 112,5, 112,4, 112,3, 112,2, 112,1, 112,0, 82,0, 81,9, 81,8, 80,4, 80,3, 58,6, 58,5, 54,5, 51,4, 50,4, 50,1, 49,9, 47,8, 47,4, 47,0, 46,6, 43,0, 42,9, 42,2, 41,9, 40,2, 40,1, 40,0, 39,2, 29,8, 29,7, 29,6, 29,1, 29,0, 26,8, 26,7, 24,7, 24,6, 24,3, 16,9, 16,5, 14,0, 12,3 м.д.
ИК-спектр (минеральное масло): 3023, 1637, 1599, 1584, 1575, 1494, 1347, 1300, 1257, 1243, 1234, 920, 731, 704, 695 см-1.
Масс-спектр (E1): [М+] = 573.
Элементный анализ, найдено: С, 81,53; H, 7,82; N, 2,34.
[α]D (хлороформ) = -83o
Препарат 162. (3S)-3-[1-(3-Аминофенил)пропил]-5,6- дигидро-4-гидрокси-6-(2-фенилэтил)-6-пропилпиран-2-он (формула W-12, где R1 обозначает 2-фенилэтил) См. Схему W.
0,63 г целевого продукта Препарата 161 растворяют в 45 мл этилацетата и 15 мл метанола. К полученному раствору добавляют 0,47 г 10%-ного палладия на угле и полученную смесь гидрируют в течение 2,5 часов под давлением водорода 50 фунт-сила/кв. дюйм (344,7 кПа). Затем реакционную смесь фильтруют через целит и упаривают в вакууме, получая 0,466 г пенообразного вещества беловатого цвета. Сырой продукт очищают колоночной хроматографией, используя 80 г силикагеля (элюируют 20-50%-ным раствором этилацетата в гексане), и получают 0,389 г целевого соединения в виде твердого вещества беловатого цвета с т.пл. 155-159oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,26-7,20, 7,15-7,04, 6,95, 6,81, 6,74, 6,54-6,51, 3,98-3,91, 2,68-2,54, 2,25-2,17, 2,02-1,67, 1,43-1,28, 0,99-0,87 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 171,2, 171,0, 148,5, 148,2, 143,9, 130,4, 130,2, 127,8, 120,8, 117,8, 115,3, 107,4, 82,7, 44,6, 44,4, 41,8, 41,7, 41,5, 38,4, 31,8, 26,8, 26,7, 18,8, 15,6, 14,3 м.д.
ИК-спектр (минеральное масло): 3085, 3061, 3026, 1617, 1605, 1495, 1314, 1258, 1168, 1119, 1065, 1030, 923, 776, 699 см-1.
Масс-спектр (E1): [M+] = 393.
Элементный анализ, найдено: С, 76,13; H, 8,16; N, 3,37.
[α]D (метанол) = -41o
Пример 374. N-[3-[1-(S)-[5,6-Дигидpo-4-гидpoкcи-2- oксо -6-(2-фенилэтил)-6-пропил-2H-пиран-3-ил]пропил]фенил]-5-(трифторметил) -2-пиридинсульфонамид (формула W-13, где R1 обозначает 2-фенилэтил) См. Схему W.
К раствору 0,200 г целевого продукта Препарата 162 в 5 мл хлористого метилена добавляют 0,12 мл пиридина. Полученную смесь охлаждают до 0oC и добавляют 0,132 г 5-трифторметилпиридин-2- сульфохлорида. Реакционную смесь перемешивают при комнатной температуре в течение 1,5 часов, упаривают в вакууме, выливают в воду и экстрагируют этилацетатом. Органический слой отделяют, упаривают в вакууме и получают 0,39 г масла розового цвета. Его очищают колоночной хроматографией, используя 50 г силикагеля (элюируют 20-50%-ным раствором этилацетатом в гексане), и получают 0,252 г целевого соединения в виде пенообразного вещества белого цвета с т.пл. 170-173oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 8,95-8,92, 8,23-8,16, 8,04-8,00, 7,25-6,90, 4,86, 3,98-3,90, 3,31, 3,30, 2,69-2,46, 2,18-2,09, 1,96-1,65, 1,41-1,28, 0,99-0,81 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 167,3, 147,7, 147,5, 142,9, 142,8, 137,7, 137,0, 129,5, 129,2, 126,9, 126,2, 126,1, 124,1, 122,6, 122,5, 120,3, 120,2, 81,8, 81,7, 43,6, 43,2, 40,9, 40,5, 37,5, 30,9, 25,8, 25,6, 17,9, 14,7, 13,3, 13,2 м.д.
ИК-спектр (минеральное масло): 3087, 3027, 1642, 1606, 1595, 1327, 1260, 1173, 1142, 1110, 1074, 1016, 720, 700, 613 см-1.
Масс-спектр (FAB): [M+H] = 603.
Элементный анализ, найдено: С, 61,79; H, 5,86; N, 4,48; S, 5,16.
[α]D (метанол) = -31o
Препарат 163. (3S, 6R)-3-[1-[3-Биc(фенилметил) амино]фенил]-пропил]-5,6-дигидро-4-гидрокси-6-(2-фенилэтил) - 6-пропилпиран-2-он (формула FFF-2) См. Схему FFF.
Целевое соединение Препарата 161 хроматографируют на колонке 5,1 x 30 см Cyclobond I 2000, охлаждаемой в бане со льдом, инжектируя по 90 мг вещества с помощью автоматической хроматографической системы; в качестве подвижной фазы используют ацетонитрил, содержащий 0,1% диэтиламина и 0,05% ледяной уксусной кислоты (об/об). Элюируемое вещество контролируют на длине волны 260 нм, скорость подачи реагентов составляет 45 мл/мин. Соответствующие фракции после повторных инжекций объединяют и упаривают в вакууме, получая 0,300 г темного масла. Его выливают в смесь этилового эфира и насыщенного водного раствора бикарбоната натрия. Органический слой отделяют и упаривают в вакууме. Остаток очищают колоночной хроматографией, используя 50 г силикагеля (элюируют 10-20%-ным раствором ацетона в гексане), и получают 0,22 г целевого соединения в виде бесцветного масла.
Вещество обладает следующими физическими характеристиками:
Время удерживания целевого соединения составляет 57 минут.
Препарат 164. (3S,6S)-3-[1-[3-Бис(фенилметил)амино] фенил]пропил]-5,6-дигидро-4-гидрокси-6-(2-фенилэтил)-6- пропилпиран-2-он (формула FFF-3) См. Схему FFF.
Целевое соединение Препарата 161 разделяют как описано выше для Препарата 163. После дальнейшей очистки, как описано для Препарата 163, получают 0,117 г целевого соединения в виде бесцветного масла.
Вещество обладает следующими физическими характеристиками:
Время удерживания целевого соединения составляет 66 минут.
Препарат 165. (3S, 6R)-3-[1-(3-(Аминофенил)пропил]-5,6- дигидро-4-гидрокси-6-(2-фенилэтил)-6-пропилпиран- 2-он (формула FFF-4) См. Схему FFF.
В соответствии с общей методикой, описанной для Препарата 162, и проводя несущественные изменения, получают, заменив целевой продукт Препарата 161 на целевой Продукт Препарата 163, 0,022 г целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 7,25-7,18, 7,15-7,12, 7,07-7,05, 6,97, 6,82, 6,76-6,71, 6,53, 4,00-3,92, 2,67- 2,54, 2,29-2,15, 2,06-1,92, 1,90-1,62, 1,46-1,28, 0,97-0,88 м.д.
Пример 375. (3S,6R)-N-[3-[1-[5,6-Дигидро-4-гидрокси-2- оксо-6-(2-фенилэтил)-6-пропил-2H-пиран-3-ил] пропил] фенил] - 5-(трифторметил)-2-пиридинсульфонамид (формула FFF-5) См. Схему FFF.
В соответствии с общей методикой, описанной в Примере 374, и проводя несущественные изменения, получают, заменив целевой продукт Препарата 162 на целевой продукт Препарата 165, 0,024 г целевого соединения в виде пенообразного вещества белого цвета с т.пл. 156-159oC.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 8,90, 8,20-8,17, 8,02-7,99, 7,28-6,88, 4,00-3,90, 2,71-2,46, 2,20-2,10, 1,98-1,67, 1,41-1,28, 0,98-0,81 м.д.
Пример 376. (S)-N-[3-[1-(5,6-Дигидро-4-гидрокси-2- оксо-6,6-дипропил-2H-пиран-3-ил)пропил] фенил]-5-(трифторметил) -2-пиридинсульфонамид (формула W-13) См. Схему W.
К раствору 182 мг целевого продукта Препарата 99 (формула W-12) в 5 мл хлористого метилена добавляют 133 μл пиридина. Полученную смесь охлаждают до 0oC и добавляют 142 г 5-трифторметилпиридин-2-сульфохлорида. Реакционную смесь перемешивают в течение 30 минут и хлористый метилен упаривают в вакууме. Остаток разбавляют этилацетатом, промывают водой, насыщенным раствором соли и сушат над сульфатом натрия. Растворитель упаривают и получают 580 мг сырого продукта. Его очищают колоночной хроматографией, используя 50 г силикагеля (элюируют 50%-ным раствором этилацетата в гексане), и получают 211 мг целевого соединения в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Элементный анализ, найдено: С, 57,80; H, 5,95; N, 5,05; S, 5,64.
[α]D (18,094 мг/2 мл хлороформа) = -30o
Пример 377. (3R)-N-[3-[1-(5,6-Дигидpo-4-гидpoкcи-2- oксо-6,6-дипропил-2H-пиран-3-ил)пропил] фенил]-5- (трифторметил)-2-пиридинсульфонамид (формула Х-13) См. Схему X.
К раствору 170 мг целевого продукта Препарата 107 (формула Х-12) в 5 мл хлористого метилена добавляют 136 мкл пиридина. Полученную смесь охлаждают до 0oC и добавляют 132 г 5-трифторметилпиридин-2-сульфохлорида. Реакционную смесь перемешивают в течение 30 минут и хлористый метилен упаривают в вакууме. Остаток разбавляют этилацетатом, промывают водой, насыщенным раствором соли и сушат над сульфатом натрия. Растворитель упаривают и получают сырой продукт. Его очищают колоночной хроматографией, используя 50 г силикагеля (элюируют 50%-ным раствором этилацетата в гексане), и получают 225 мг целевого соединения в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
[α]D (мг/2 мл хлороформа) = +29o.
Препарат 166. (3S,4R)-3-[2-[1-[3-[бис(фeнилмeтил) амино]фенил]пропил]-5-гидрокси-1,3-диоксо-5-фенэтилоктил] -4-фенил-2- оксазолидинон (формула Х-10, где R1 обозначает фенэтил) См. Схему X.
К 1,12 г целевого соединения Препарата 104 добавляют 20 мл хлористого метилена и полученный раствор охлаждают до минус 78oC и перемешивают в течение часа. К этому раствору добавляют 237 мкл тетрахлорида титана, а затем 400 мкл ди-изо-пропилэтиламина и полученный раствор перемешивают при температуре минус 78oC в течение часа. К полученному раствору добавляют 776 мкл 1-фенил-3-гексанона и перемешивание при температуре минус 40oC продолжают еще в течение 40 минут, а затем дают полученной реакционной смеси в течение 1,5 часов нагреться до температуры минус 10oC. Разлагают реакционную смесь насыщенным раствором хлорида аммония, экстрагируют хлористым метиленом и органические вытяжки упаривают в вакууме. Сырой продукт хроматографируют, используя 200 г силикагеля (элюируют 10%-ным раствором гексана в хлористом метилене), и получают 870 мг целевого продукта.
Вещество обладает следующими физическими характеристиками:
ИК-спектр (минеральное масло): 2956, 2926, 2854, 1777, 1600, 1494, 1452, 698 см-1.
[α]D (16,578 мг в хлороформе) = +4o
Масс-спектр: молекулярный ион 736.
Элементный анализ, найдено: С, 78,00; H, 7,14; N, 3,61.
Препарат 167. (3R)-3-[1-[3-[Бис(фeнилмeтил)амино] фенил]пропил]- 5,6-дигидро-4-гидрокси-6-фенэтил-6-пропилпиран-2-он (формула Х-11, где R1 обозначает фенэтил) См. Схему X.
К целевому соединению Препарата 166 (750 мг) добавляют 5 мл сухого тетрагидрофурана трет-бутоксид калия (1,0 М раствор в тетрагидрофуране). Реакционную смесь перемешивают при температуре 20oC в течение 30 минут и разлагают, добавляя насыщенный раствор хлорида аммония. Экстрагируют этилацетатом, органические вытяжки объединяют, промывают водой и насыщенным раствором соли и, наконец, упаривают, получая сырой продукт. Его хроматографируют, используя 100 г силикагеля (элюируют 15%-ным раствором этилацетата в гексане), и получают 511 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
ИК-спектр (минеральное масло): 2956, 2855, 1628, 1599, 1577, 1494, 1385, 1364, 697 см-1.
Элементный анализ, найдено: С, 81,30; H, 7,68; N, 2,30.
Масс-спектр: молекулярный ион 573.
[α]D (18,116 мг/2 мл метанола) = +38o
Препарат 168. (3R)-3-[1-[3-Аминофенил]пропил]-5,6- дигидро-4-гидрокси-6-фенэтил-6-пропилпиран-2-он (формула Х-12, где R1 обозначает фенэтил) См. Схему X.
Целевой продукт Препарата 167 (370 мг) растворяют в 35 мл этилацетата и 6 мл метанола. К полученному раствору добавляют 200 мг 10%-ного палладия на угле в качестве катализатора и полученную смесь гидрируют в течение 2 часов под давлением водорода 50 фунт-сила/кв. дюйм (344,7 кПа). Затем реакционную смесь упаривают и очищают колоночной хроматографией, используя 60 г силикагеля, и получают 244 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
ИК-спектр (минеральное масло): 3025, 2954, 2871, 2854, 1635, 1619, 1604, 1494, 1456, 1383, 1378, 1256 см-1.
[α]D (16,764 мг/2 мл метанола) = +39o
Масс-спектр: молекулярный ион 393.
Элементный анализ, найдено: С, 75,79; H, 8,05; N, 3,27.
Пример 378. (3R)-N-[3-[1-(5,6-Дигидро-4-гидрокси-2-оксо- 6-пропил-6-фенэтил-2H-пиран-3-ил)пропил] фенил] -5-(трифторметил)-2- пиридинсульфонамид (формула X-13, где R1 обозначает фенэтил) См. Схему X.
К продукту Препарата 168 (156 мг) добавляют 5 мл хлористого метилена. К полученному раствору добавляют 96 мкл пиридина и охлаждают до 0oC. Затем добавляют 102 мг 5-трифторметилпиридин-2- сульфохлорида. Реакционную смесь перемешивают в течение часа, а затем выливают в этилацетат, промывают водой, насыщенным раствором соли и сушат над сульфатом магния. Растворитель упаривают в вакууме и остаток хроматографируют, используя 100 г силикагеля (элюируют 50%-ным раствором этилацетата в гексане), и получают 200 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Масс-спектр: молекулярный ион 602.
ИК-спектр (минеральное масло): 2953, 2922, 2870, 2853, 1642, 1605, 1459, 1457, 1326, 1259, 1180, 1171, 1141 см-1.
УФ спектр (этанол) λmax(ε) 216 (22300), 264 плечо (10700), 270 (11500), 279 (12100)
Элементный анализ, найдено: С, 57,53; H, 5,98; N, 4,84.
Пример 379. (3R,6S)-N-[3-[1-(5,6-Дигидро-4-гидрокси-2- оксо-6-пропил-6-фенэтил-2H-пиран-3-ил-пропил]фенил]-5- (трифторметил)-2-пиридинсульфонамид (формула X-13, где R1 обозначает фенэтил) См. Схему X.
Целевое соединение Примера 378 растворяют в изо-пропаноле и инжектируют в колонку 0,46 x 25 см Cyclobond I 2000 (от фирмы "Advanced Separations Technologies, Inc. ", Уиппани, штат Hью-Джерси), охлаждаемой в бане со льдом. Образец элюируют ацетонитрилом, содержащим 0,1% диэтиламина и 0,6% ледяной уксусной кислоты (об/об), со скоростью 1,0 мл/мин. Элюируемое вещество контролируют на длине волны 250 нм. Первый из элюирующихся диастереомеров идентичен соединению Примера 298. Второй из элюирующихся диастереомеров очищают колоночной хроматографией, используя 60 г силикагеля (элюируют 40%-ным раствором этилацетата в гексане), и получают 13 мг целевого соединения.
Вещество обладает следующими физическими характеристиками:
Стереохимическая конфигурация при С-6 противоположна стереохимической конфигурации соединения по Примеру 298.
Спектр ПМР (дейтероацетон): δ 8,91, 8,19, 8,16, 8,02, 7,99, 7,25, 7,18, 7,15, 7,13, 7,11, 7,04, 6,97, 6,89, 6,75, 3,95, 2,69, 2,64, 2,53, 2,48, 2,13, 1,91, 1,71, 1,68, 1,37, 1,19, 1,17, 1,14, 0,94, 0,92, 0,89, 0,85, 0,83, 0,80, 0,93 м.д.
Препарат 169. Метиловый эфир (3S)-3-[(3-бис(фенилметил)амино)фенил]-4,4-диметилпентановой кислоты (формула LLL-9) См. Схему LLL.
К безводному этанолу (2 мл) при комнатной температуре добавляют тетрахлорид титана (0,07 мл). Полученный раствор светло-зеленого цвета перемешивают в течение 2 часов и добавляют соединение формулы LLL-2, где R1 обозначает фенил (100 мг), полученное аналогично тому, как показано на Схеме FF, и кипятят с обратным холодильником в течение 18 часов. Реакционную смесь охлаждают, выливают в 1N раствор соляной кислоты и экстрагируют эфиром. Органические вытяжки промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Очищают испарительной хроматографией, элюируя смесью гексан/этилацетат (95:5), и получают целевое соединение (58 мг) в виде масла янтарного цвета.
Вещество обладает следующими физическими характеристиками: 7,32-7,20, 7,04, 6,61-6,48, 4,61, 3,48, 2,85-2,80, 2,72-2,55, 0,75 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 173,69, 148,45, 142,51, 138,91, 128,53, 128,17, 126,78, 117,98. 114,49, 110,89, 54,54, 52,24, 51,40, 35,56, 33,65, 27,87 м.д.
Масс-спектр (E1): m/z 415.
Препарат 170. (3S)-3-[(3-Бис(фенилметил)амино)фенил] - 4,4-диметилпентановая кислота (формула LLL-10) См. Схему LLL.
Соединение формулы LLL-9 (406 мг) Препарата 169 перемешивают в смеси ледяной уксусной кислоты (2,6 мл) и 6 N серной кислоты. Реакционную смесь кипятят с обратным холодильником в течение пяти часов, охлаждают и выливают в смесь воды и диэтилового эфира. Водный слой отделяют и еще дважды экстрагируют диэтиловым эфиром. Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме. Полученный остаток светло-коричневого цвета растворяют в диэтиловом эфире и при температуре 0oC добавляют дициклогексиламин (0,16 мл). Образовавшиеся твердые вещества отделяют, промывают диэтиловым эфиром и сушат в вакууме. Полученное твердое вещество светло-коричневого цвета суспендируют в диэтиловом эфире и промывают 0,25 N раствором соляной кислоты. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая целевой продукт (54 мг) в виде аморфного вещества светло-коричневого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,31-7,19, 7,04, 6,61-6,48, 4,61, 2,81-2,56, 0,74 м.д.
Спектр 13C-ЯМР (дейтерохлороформ): δ 179,15, 148,56, 142,28, 138,83, 128,55, 128,23, 126,76, 117,90, 114,49, 110,98, 54,51, 51,83, 35,45, 33,67, 27,84 м.д.
Масс-спектр (E1):m/z 401.
Препарат 171. Амид N-[(3S)-4-бeнзил-2-oкcaзoлидинoн]-3- aминокоричной кислоты (формула HHH-4) См. Схему HHH.
В однолитровую круглодонную колбу, снабженную трубкой для подачи азота и капельной воронкой, помещают 10,02 г промышленно выпускаемого (S)-4-бензил-2-оксазолидинона и 260 мл тетрагидрофурана и охлаждают до температуры минус 78oC. К полученному раствору добавляют 37 мл раствора н-бутиллития, при этом из реакционной смеси выпадает белый осадок. К полученной суспензии добавляют 11,46 г хлорангидрида транс-3-нитрокоричной кислоты (получают взаимодействием промышленно выпускаемой 3-нитрокоричной кислоты и хлористого оксалила) в небольшом объеме тетрагидрофурана. Полученному гомогенному раствору дают нагреться до комнатной температуры, разлагают, добавляя насыщенный раствор хлорида аммония, и экстрагируют этилацетатом. Органический слой отделяют, промывают насыщенным раствором соли и водой, сушат над сульфатом магния, отфильтровывают и упаривают, получая сироп красно-коричневого цвета (формула HHH-3 на Схеме HHH), который используют далее без очистки.
Полученный сырой продукт растворяют в этаноле, содержащем 64,18 г SnCl2•2H2O, и полученную смесь кипятят с обратным холодильником в течение 20 минут. Охлаждают до комнатной температуры и выливают на лед. Доводят pH до величины 9-10 насыщенным водным раствором карбоната натрия, отфильтровывают и тщательно промывают на фильтре этилацетатом. Фильтрат промывают насыщенным раствором соли, органическую фазу сушат (над сульфатом натрия), фильтруют и упаривают в вакууме, получая твердое вещество желтого цвета. Его перекристаллизовывают из этанола и выделяют 11,56 г целевого продукта.
Вещество обладает следующими физическими характеристиками:
ИК-спектр (минеральное масло): 3450, 3369, 2924, 1771, 1678, 1620, 1462, 1392, 1357, 1347, 1214 см-1.
[α]D (14,418 мг/мл хлороформа) = +51o
Препарат 172. Амид-N-[(3S)-4-бензил-2-оксазолидинон]-3-(бис (фенилметил)аминокоричной кислоты (формула HHH-5) См. Схему HHH.
Амид формулы HHH-4 Препарата 172 (10,13 г), 10,48 г карбоната калия, 8,3 мл бромистого бензила и 100 мл ацетонитрила кипятят с обратным холодильником в течение 3 часов. Охлаждают реакционную смесь до комнатной температуры, выливают в воду и экстрагируют этилацетатом. Органические вытяжки объединяют, сушат (над сульфатом натрия), отфильтровывают и упаривают в вакууме. Остаток очищают хроматографией на силикагеле, элюируя 25%-ным раствором этилацетата в гексане, и получают 8,87 г целевого соединения.
Вещество обладает следующими физическими характеристиками:
Спектр 13C-ЯMP (дейтерохлороформ): δ 165, 153, 149, 147, 138, 135, 129,6, 129,3, 128,8, 128,6, 127, 126,9, 126,5, 116,54, 116,50, 114, 113, 65, 55, 54, 37 м.д.
ИК-спектр (минеральное масло): 2954, 2870, 2854, 1776, 1677, 1616, 1595, 1493, 1454, 1353, 1209, 988 см-1.
Препарат 173. (3S)(4S)-3-[3-(бис(фенилметил)аминофенил)пентаноил]-4-фенил-2-оксазолидинон (формула HHH-6) См. Схему HHH.
В трехгорлой колбе емкостью 100 мкл, снабженной мешалкой, капельной воронкой с трубкой для уравнивания давления емкостью 25 мл и трубкой для подачи азота, помещают комплекс бромид меди (1) - диметилсульфид (1,69 г), 20 мл тетрагидрофурана и 10 мл диметилсульфида. В капельную воронку помещают целевой продукт Препарата 172 (2,747 г) и 10 мл тетрагидрофурана. Охлаждают реакционную смесь до минус 40oC и по каплям в течение 5 минут добавляют раствор этилмагнийбромида (5,5 мл 3,0 М раствора в эфире). Полученную смесь черного цвета перемешивают при температуре минус 40oC еще в течение 10 минут и дают ей нагреться до минус 10oC. В течение 17 минут по каплям добавляют к реакционной смеси целевой продукт Препарата 172 в тетрагидрофуране. Капельную воронку споласкивают свежей порцией 3 мл тетрагидрофурана и реакционную смесь перемешивают в течение 2,5 часов, поддерживая температуру в интервале от минус 40oC до минус 60oC. Процесс прекращают, выливая в 50 мл насыщенного раствора хлорида аммония, органический слой отделяют и упаривают в вакууме. Остаток выливают в смесь 75 мл этилацетата и 50 мл воды и фильтруют через стеклянную вату. Органический слой отделяют, промывают двумя порциями по 100 мл 10%-ного раствора гидроксида аммония и 50 мл насыщенного раствора соли, сушат над сульфатом магния, отфильтровывают и упаривают в вакууме, получая 3,59 г масла желтого цвета. Колоночной хроматографией, используя 150 г силикагеля (элюируют 5-15%-ным раствором этилацетата в гексане), получают два диастереомерных продукта. Целевой продукт (менее полярный диастереомер) выделяют в виде масла бледно-желтого цвета в количестве 1,602 г.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,32-7,17, 7,06, 6,60, 6,55, 4,63, 4,43-4,37, 4,00, 3,85, 3,37, 3,20, 3,08, 3,02-2,92, 2,62, 1,71-1,48, 0,73 м. д.
Из колонки в виде масла бледно-желтого цвета выделяют также более полярный диастереомер в количестве 0,310 г.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтерохлороформ): δ 7,32-7,18, 7,12, 7,05, 6,64-6,56, 4,63, 4,60-4,52, 4,08-4,04, 3,48-3,38, 3,07-2,96, 2,48, 1,69-1,48, 0,73 м.д.
Дополнительно из колонки выделяют фракцию, содержащую 0,708 г смеси в соотношении приблизительно 1:4 менее полярного и более полярного диастереомеров.
Препарат 174. (3S, 6S)-3-[1-(3-аминофенил)пропил] -5,6- дигидро-4-гидрокси-6-(2-фенилэтил)-6-пропил-2H-пиран-2-он (формула FFF-6) См. Схему FFF.
В соответствии с общей методикой, описанной для Препарата 162, и проводят несущественные изменения, получают, заменив целевой продукт Препарата 161 на целевой продукт Препарата /U-141164/, 0,040 г целевого соединения. Его немедленно используют без очистки на следующей стадии.
Пример 380. (3S,6S)-N-[3-[1-[5,6-Дигидpo-4-гидpoкcи-2-oксо-6- (2-фенилэтил)-6-пропил-2H-пиран-3-ил] пропил] фенил] -5-(трифторметил) -2-пиридинсульфонамид (формула FFF-7) См. Схему FFF.
В соответствии с общей методикой, описанной в Примере 374, и проводя несущественные изменения, получают, заменив целевой продукт Препарата 162 на целевой продукт Препарата 174, 0,015 г целевого соединения в виде пенообразного вещества белого цвета.
Вещество обладает следующими физическими характеристиками:
Спектр ПМР (дейтероацетон): δ 8,95, 8,25-8,21, 8,07-8,02, 7,25-6,93, 3,94- 3,88, 2,70-2,51, 2,20-2,18, 1,97-1,66, 1,40-1,30, 0,92-0,81 м.д.
Соединения по настоящему изобретению включают, например, следующие индивидуальные стереоизомеры:
5-циано-N-[3-(R)-[1-[5, -дигидро-4-гидрокси-2-оксо- 6-(2-фенэтил)-6-(R)-(3,3,3-трифторпропил)-2H-пиран-3-ил]- 2,2-диметилпропил]фенил]-2-пиридинсульфонамид,
5-циано-N-[3-(S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил) -6-(3)-(3,3,3-трифторпропил)-2H-пиран-3-ил] -2,2-диметилпропил] фенил]-2- пиридинсульфонамид,
5-циано-N-[3-(R)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил) -6-(S)-(3,3,3-трифторпропил)-2H-пиран-3-ил] -2,2-диметилпропил] фенил]-2- пиридинсульфонамид,
5-циaнo-N-[3-(S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6- (2-фенэтил)-6-(R)-(3,3,3-трифторпропил)-2H-пиран-3-ил] -2,2-диметилпропил] фенил[-2-пиридинсульфонамид,
N-[3-(R)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6-(R)-(2-фенэтил)-6- (3,3,3-трифторпропил)-2H-пиран-3-ил]-2,2-диметил-
пропил]фенил]-1-метил-1H-имидазол-4-сульфонамид,
N-[3-(S) -[1-[5,6-дигидро-4-гидрокси-2-оксо-6-(S)-(2-фенэтил)-6-(3,3, 3-трифторпропил)-2H-пиран-3-ил] -2, 2-диметил-пропил]фенил]-1-метил-1H-имидазол-4-сульфонамид,
N-[3-(R) -[1-[5,6-дигидро-4-гидрокси-2-оксо-6-(S)-(2-фенэтил)-6-(3,3, 3-трифторпропил)-2H-пиран-3-ил] -2, 2-диметилпропил]фенил]-1-метил-1H-имидазол-4-сульфонамид,
N-[3-(S)-[1-[5, 6-дигидро-4-гидрокси-2-оксо-6-(R)-(2-фенэтил)-6-(3,3, 3-трифторпропил)-2H-пиран-3-ил] -2,2-диметил- пропил]фенил]-1-метил-1H-имидазол-4-сульфонамид,
5-амино-N-3-(R)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6-(R) -(3,3,3-трифторпропил)-2H-пиран-3-ил] -2,2- диметилпропил]фенил]-2-пиридинсульфонамид,
5-амино-N-[3-(R)- [1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6-(S)- (3,3,3-трифторпропил)-2H-пиран-3-ил]-2,2- диметилпропил]фенил]-2-пиридинсульфонамид,
5-амино-N-[3-(S) -[1-[5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6-(R)-(3, 3,3-трифторпропил)-2H-пиран-3-ил] -2,2-диметилпропил] фенил]-2- пиридинсульфонамид,
5-aмино-N-[3-(S)-[1-[5,6-дигидро-4- гидрокси-2-оксо-6-(2-фенэтил)-6-(S)-(3,3,3-трифторпропил)- 2H-пиран-3-ил] -2,2-диметилпропил]фенил]-2-пиридинсульфонамид,
N-[3-(R)-[1-5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6- (R)-пропил-2H-пиран-3-ил]-2,2-диметилпропил]фенил]-2- пиридинсульфонамид,
N-[3-(R)-[1-[5,6-дигидро-4-гидрокси- 2-оксо-6-(2-фенэтил)-6-(S)-пропил-2H-пиран-3-ил]-2,2- диметилпропил]фенил]-2-пиридинсульфонамид,
N-[3-(S)-[1-[5,6-дигидро-4-гидрокси-2- оксо-6-(2-фенэтил)-6-(R)-пропил-2H-пиран-3-ил]-2,2- диметилпропил]фенил]-2-пиридинсульфонамид,
N-[3-(S)-[1- [5,6-дигидро-4-гидрокси-2-оксо-6-(2-фенэтил)-6-(S)- пропил-2H-пиран-3-ил]-2,2-диметилпропил]фенил]-2- пиридинсульфонамид,
5-тpифтopмeтил-N-[3-(R)-[1-[4- гидpoкcи-2-oкco-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил]пропил]фенил]-2-пиридинсульфонамид,
5-трифторметил-N-[3- (S)-[1-[4-гидpoкcи-2-oкco-6,6-ди-н-пропил-5,6-дигидро-2H- пиран-3-ил]пропил]фенил]-2-пиридинсульфонамид,
4-трифторметил-N -[3-(R)-[1-[4-гидpoкcи-2-oкco-6,6-ди-н-пропил-5,6- дигидро-2H-пиран-3-ил]пропил]фенил]-2-пиридинсульфонамид,
4-трифторметил-N-[3-(S)-[1-[4-гидpoкcи-2-oкco-6,6-ди-н- пропил-5,6-дигидро-2H-пиран-3-ил]пропил]фенил]-2- пиридинсульфонамид,
5-тpифтopмeтил-N-[3-(R)-[1-[4- гидpoкcи-2-oкco-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил]-2, 2-диметилпропил]фенил]-2-пиридинсульфонамид,
5-тpифтopмeтил-N- [3-(S)-[1-[4-гидpoкcи-2-oкco-6,6-ди-н-пропил-5,6- дигидро-2H-пиран-3-ил]-2,2-диметилпропил]фенил]-2- пиридинсульфонамид,
5-трифторметил-N-[3-(R)-[1-[4- гидpoкcи-2-oкco-6,6-ди-фенэтил-5,6-дигидро-2H-пиран-3- ил]пропил]фенил]-2-пиридинсульфонамид,
3-трифторметил-N-[3-(S) -[1-[4-гидpoкcи-2-oкco-6,6- ди-фенэтил-5,6-дигидро-2H-пиран-3-ил]пропил]фенил]- 2-пиридинсульфонамид,
4-трифторметил-N-[3-(R)-[1-[4- гидpокcи-2-oкco-6,6-ди-фенэтил-5,6-дигидро-2H-пиран-3- ил]пропил]фенил]-2-пиридинсульфонамид,
4-трифторметил-N-[3- (S)-[1-[4-гидpoкcи-2-oкco-6,6-ди-фенэтил-5,6-дигидро-2H- пиран-3-ил]пропил]фенил]-2-пиридинсульфонамид,
4-тpифтopмeтил- N-[3-(R)-[1-[4-гидрокси-2-оксо-6,6-ди-н-пропил-5,6- дигидро-2H-пиран-3-ил]-2,2-диметилпропил]фенил]-2- пиридинсульфонамид,
4-трифторметил-N-[3-(S)-[1-[4- гидpoкcи-2-oкco-6,6-ди-н-пропил-5,6-дигидро-2H-пиран-3-ил]-2, 2-диметилпропил]фенил]-2-пиридинсульфонамид,
5-трифторметил- N-[3-(R)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6(R)-(2- фенэтил)-6(R)-н-пропил-2H-пиран-3-ил] -2,2-диметилпропил] фенил] -2-пиридинсульфонамид,
5-трифторметил-N-[3-(R)- [1-[5,6-дигидро-4-гидрокси-2-оксо-6(S)-(2-фенэтил)-6(S)- н-пропил-2H-пиран-3-ил] -2,2-диметилпропил] фенил] -2- пиридинсульфонамид,
5-трифторметил-N-[3-(S)-[1-[5,6- дигидро-4-гидрокси-2-оксо-6(R)-(2-фенэтил)-6(R)-н-пропил- 2H-пиран-3-ил]-2,2-диметилпропил]фенил]-2-пиридинсульфонамид,
5-трифторметил-N-[3-(S)-[1-[5,6-дигидро-4-гидрокси-2-оксо- 6(S)-(2-фенэтил)-6(S)-н-пропил-2H-пиран-3-ил]-2,2- диметил-пропил]фенил]-2-пиридинсульфонамид,
4-тpифтopмeтил-N- [3-(R)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6(R)-(2- фенэтил)-6(R)-н-пропил-2H-пиран-3-ил] -2,2-диметилпропил] фенил] -2-пиридинсульфонамид,
4-тpифтopмeтил- N-[3-(R)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6(S)- (2-фенэтил)-6(S)-н-пропил-2H-пиран-3-ил] -2,2-диметилпропил] фенил] -2-пиридинсульфонамид,
4-тpифтopмeтил-N-[3-(S) -[1-[5,6-дигидро-4-гидрокси-2-оксо-6(R)-(2-фенэтил)-6(R) -н-пропил-2H-пиран-3-ил]-2,2-диметилпропил]фенил]-2- пиридинсульфонамид,
4-трифторметил-N-[3-(S)-[1-[5,6- дигидро-4-гидрокси-2-оксо-6(S)-(2-фенэтил)-6(S)-н-пропил- 2H-пиран-3-ил]-2,2-диметилпропил]фенил]-2-пиридинсульфонамид,
5-трифторметил-N-[3-(R)-[1-[5,6-дигидро-4-гидрокси-2- оксо-6(R)-(2-фенэтил)-6(R)-н-пропил-2H-пиран-3-ил]пропил] фенил]-2-пиридинсульфонамид,
5-трифторметил-N-[3-(R)-[1- [5, 6-дигидро-4-гидрокси-2-оксо-6(S)-(2-фенэтил)-6(S)- н-пропил-2H-пиран-3-ил]пропил]фенил]-2-пиридинсульфонамид,
5-трифторметил-N-[3-(S)-[1-[5,6-дигидро-4-гидрокси-2- оксо-6(R)-(2-фенэтил)-6(R)-н-пропил-2H-пиран-3- ил]пропил]фенил]-2-пиридинсульфонамид,
5-трифторметил-N-[3- (S)-[1-[5,6-дигидро-4-гидрокси-2-оксо-6(S)-(2-фенэтил)-6 (S)-н-пропил-2H-пиран-3-ил]пропил]фенил]-2- пиридинсульфонамид,
5-циано-N-[3-(R)-(1-[5,6-дигидро-4- гидрокси-2-оксо-6(R)-(2-фенилэтил)-6-пропил-2H-пиран-3-ил]-2, 2-диметилпропил)фенил]-2-пиридинсульфонамид,
5-циано-N-[3- (R)-(1-[5,6-дигидро-4-гидрокси-2-оксо-6(S)-(2-фенилэтил)-6- пропил-2H-пиран-3-ил] -2,2-диметилпропил]фенил]-2- пиридинсульфонамид,
5-циано-N-[3-(S)-(1-[5,6-дигидро-4-гидрокси-2- оксо-6(R)-(2-фенилэтил)-6-пропил-2H-пиран-3-ил]-2,2- диметилпропил)фенил]-2-пиридинсульфонамид,
5-циано-N-[3-(S) -(1-[5,6-дигидро-4-гидрокси-2-оксо-6(S)-(2-фенилэтил)-6- пропил-2H-пиран-3-ил] -2,2-диметилпропил]фенил]-2- пиридинсульфонамид,
N-[3(R)-[1-(5,6-дигидро-4-гидрокси-2- оксо-6(R)-[2-фенилэтил] -6-пропил-2H-пиран-3-ил)-2,2- диметилпропил] фенил]-1-метил-1H-имидазол-4-сульфонамид,
N-[3 (R)-[1-(5, 6-дигидро-4-гидрокси-2-оксо-6(S)-[2-фенилэтил]- 6-пропил-2H-пиран-3-ил)-2,2-диметилпропил] фенил] -1-метил- 1H-имидазол-4-сульфонамид,
N-[3(S)-[1-(5,6-дигидро-4- гидрокси-2-оксо-6(R)-[2-фенилэтил] -6-пропил-2H-пиран-3-ил)-2, 2-диметилпропил]фенил]-1-метил-1H-имидазол-4-сульфонамид,
N-[3(S)-[1-(5,6-дигидро-4-гидрокси-2-оксо-6(S)-[2-фенилэтил] -6-пропил-2H-пиран-3-ил)-2,2-диметилпропил]фенил]-2-мeтил- 1H-имидазол-4-сульфонамид,
5-амино-N-[3-(R)-(1-[5,6- дигидро-4-гидрокси-2-оксо-6(S)-(2-фенилэтил)-6-пропил-2H- пиран-3-ил]-2,2-диметилпропил)фенил]-2-пиридинсульфонамид,
5-амино-N-[3-(S)-(1-[5,6-дигидро-4-гидрокси-2-оксо-(6R)-(2- фенилэтил)-6-пропил-2H-пиран-3-ил]-2,2-диметилпропил)фенил]-2- пиридинсульфонамид,
5-амино-N-[3-(S)-(1-[5,6-дигидро-4- гидрокси-2-оксо-6(S)-(2-фенилэтил)-6-пропил-2H-пиран-3-ил]- 2,2-диметилпропил)фенил]-2-пиридинсульфонамид,
5-амино-N-[3- (R)-(1-[5,6-дигидро-4-гидрокси-2-оксо- 6(R)-(2-фенилэтил)-6-пропил-2H-пиран-3-ил]-2,2- диметилпропил)фенил]-2-пиридинсульфонамид,
5-амино-N-[3-(R) -(1-[5,6-дигидро-4-гидрокси-2-оксо-6(R)-(2-фенилэтил)-6- пропил-2H-пиран-3-ил]пропил)фенил]-2-пиридинсульфонамид,
5-амино- N-[3-(R)-(1-[5,6-дигидро-4-гидрокси-2-оксо-6(S)-(2- фенилэтил)-6-пропил-2H-пиран-3-ил]пропил]фенил]-2- пиридинсульфонамид,
5-амино-N-[3-(S)-(1-[5,6-дигидро-4- гидрокси-2-оксо-6(R)-(2-фенилэтил)-6-пропил-2H-пиран-3- ил]пропил)фенил]-2-пиридинсульфонамид,
5-амино-N-[3-(S)- (1-[5,6-дигидро-4-гидрокси-2-оксо-6(S)-(2-фенилэтил)-6- пропил-2H-пиран-3-ил]пропил)фенил]-2-пиридинсульфонамид,
5-амино-N-[3-(R)-(1-[6(R)-(2-[4-фторфенил] этил)-5,6- дигидро-4-гидрокси-2-оксо-6-пропил-2H-пиран-3-ил]-2,2-диметилпропил) фенил]-2-пиридинсульфонамид,
5-амино-N-[3(R)-(1-[6 (S)-(2-[4-фтopфeнил] этил)-5,6-дигидро-4-гидрокси-2-оксо-6- пропил-2H-пиран-3-ил]-2,2-диметилпропил)фенил]-2- пиридинсульфонамид,
5-амино-N-[3(S)-(1-[6(R)-(2- [4-фтopфeнил] этил)-5,6-дигидро-4-гидрокси-2-оксо-6-пропил-2H- пиран-3-ил] -2,2-диметилпропил)фенил]-2-пиридинсульфонамид,
5-амино-N-[3(S)-(1-[6(S)-(2-[4-фтopфeнил] этил)-5,6- дигидро-4-гидрокси-2-оксо-6-пропил-2H-пиран-3-ил]-2,2- диметилпропил)фенил]-2-пиридинсульфонамид,
N-[3 (R)-(1-[5, 6-дигидро-6,6-дипропил-4-гидрокси-2-оксо-2H-пиран-3-ил] -2,2- диметилпропил)фенил]-1-метил-1H-имидазол- 4-сульфонамид,
N-[3(S)-(1-[5,6-дигидро-6, 6-дипропил-4-гидрокси-2-оксо-2H-пиран-3-ил] -2,2- диметилпропил)фенил]-1-метил-1H-имидазол-4-сульфонамид,
5-амино- N-[3(R)-(1-[5,6-дигидро-6,6-дипропил-4-гидрокси-2-оксо- 2H-пиран-3-ил]-2,2-диметилпропил)фенил]-2-пиридин-сульфонамид,
5-aминo-N-[3(S)-(1-[5,6-дигидро-6,6-дипропил-4-гидрокси- 2-оксо-2H-пиран-3-ил]-2,2-диметилпропил)фенил]-2-пиридинсульфонамид,
5-циано-N-[3(R)-(1-[5,6-дигидро-6,6- дипропил-4-гидрокси-2-оксо-2H-пиран-3-ил]-2,2-диметилпропил) фенил]-2-пиридинсульфонамид,
5-циано-N-[3(S)-(1-[5,6- дигидро-6,6-дипропил-4-гидрокси-2-оксо-2H-пиран-3-ил]-2,2- диметилпропил)фенил]-2-пиридин-сульфонамид,
N-[3(R)-(1-[6, 6-бис(2-фенилэтил)-5,6-дигидро-4-гидрокси-2-оксо-2H-пиран-3 -ил]пропил)фенил]-1-метил-1H-имидазол-4-сульфонамид,
N-[3 (S)-(1-[6,6-бис(2-фенилэтил)-5,6-дигидро-4-гидрокси-2- оксо-2H-пиран-3-ил]пропил)фенил]-1-метил-1H-имидазол-4- сульфонамид,
N-[3(R)-(1-[6,6-бис(2-фенилэтил)-5,6-дигидро- 4-гидрокси-2-оксо-2H-пиран-3-ил]пропил)фенил]-5-циано-2- пиридинсульфонамид,
N-[3(S)-(1-[6,6-бис(2-фенилэтил)-5, 6-дигидро-4-гидрокси-2-оксо-2H-пиран-3-ил]пропил)фенил]-5- циано-2-пиридинсульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6 (R)-фенэтил-6-пропил-2H-пиран-3-ил)пропил}фенил]-5-циано-2- пиридинсульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2- оксо-6(S)-фенэтил-6-пропил-2H-пиран-3-ил)пропил}фенил]-5- циано-2-пиридин-сульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6- дигидро-2-оксо-6(R)-фенэтил-6-пропил-2H-пиран-3-ил)пропил} фенил]-5-циано-2-пиридин-сульфонамид,
N-[3-{ 1(S)-(4- гидрокси-5,6-дигидро-2-оксо-6(S)-фенэтил-6-пропил-2H-пиран-3- ил)пропил}фенил]-5-циано-2-пиридинсульфонамид,
N-[3-{ 1(R) -(4-гидрокси-5,6-дигидро-2-оксо-6(R)-фенэтил-6-пропил-2H- пиран-3-ил)пропил}фенил]-1-метил-1H-имидазол-4-сульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6(S)-фенэтил-6- пропил-2H-пиран-3-ил)пропил}фенил]-1-метил-1H-имидазол-4- сульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро-2-оксо-6(R) -фенэтил-6-пропил-2H-пиран-3-ил)пропил}фенил]-1-метил-1H- имидазол-4-сульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6- дигидро-2-оксо-6(S)-фенэтил-6-пропил-2H-пиран-3-ил)пропил} фенил]-1-метил-1H-имидазол-4-сульфонамид,
N-[3-{1(R)- (4-гидрокси-5,6-дигидро-2-оксо-6(R)-(2-(4-фторфенил)этил)-6- пропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -5- цианопиридин-2-сульфонамид,
N-[3-{1(R)-(4-гидрокси-5,6- дигидро-2-оксо-6(S)-(2- (4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2- диметилпропил} фенил] -5-циано-2-пиридинсульфонамид,
N-[3-{ 1 (S)-(4-гидрокси-5,6-дигидро-2-оксо-6(R)-(2-(4-фторфенил) этил)-6-пропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -5- циано-2-пиридинсульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6- дигидро-2-оксо-6(S)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран- 3-ил)-2,2-диметилпропил} фенил]-5-циано-2-пиридинсульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6(R)-(2-(4- фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил] -1-метил-1H-имидазол-4-сульфонамид,
N-[3-{1(R)- (4-гидрокси-5,6-дигидро-2-оксо-6(S)-(2-(4-фторфенил)этил)-6- пропил-2H-пиран-3-ил)-2,2-диметилпропил} фенил]-1-метил-1H- имидазол-4-сульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6- дигидро-2-оксо-6(R)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран- 3-ил)-2,2-диметилпропил}фенил]-1-метил-1H-имидазол-4- сульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро-2-оксо-6 (S)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)-2,2- диметилпропил} фенил] -1-метил-1H-имидазол-4-сульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис(2- фенилэтил)-2H-пиран-3-ил)-2,2-диметилпропил}фенил]-5-амино- 2-пиридинсульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро- 2-оксо-6,6-бис(2-фенилэтил)-2H-пиран-3-ил)-2,2- диметилпропил}фенил]-5-амино-2-пиридинсульфонамид,
N-[3-{ 1 (R)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис(2-фенилэтил)-2H- пиран-3-ил)-2,2-диметилпропил}фенил]-1-метил- 1H-имидазол-4-сульфонамид,
N-[3-{ 1(S)-(4- гидрокси-5,6-дигидро-2-оксо-6,6-бис(2-фенилэтил)-2H-пиран-3-ил) -2,2-диметилпропил}фенил]-1-метил-1H-имидазол-4-сульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-бис(2- фенилэтил)-2H-пиран-3-ил)-2,2-диметилпропил}фенил]-5-циано-2- пиридинсульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро-2- оксо-6,6-бис(2-фенилэтил)-2H-пиран-3-ил)-2,2- диметилпропил}фенил]-5-циано-2-пиридинсульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6,6-дипропил-2H-пиран- 3-ил)пропил}фенил]-5-циано-2-пиридинсульфонамид,
N-[3-{ 1(S)-(4- гидрокси-5,6-дигидро-2-оксо-6,6-дипропил-2H-пиран-3-ил)пропил} фенил]-5-циано-2-пиридинсульфонамид,
N-[3-{ 1(R)-(4- гидрокси-5,6-дигидро-2-оксо-6,6-дипропил-2H-пиран-3-ил)пропил} фенил]-5-амино-2-пиридинсульфонамид,
N-[3-{ 1(S)-(4- гидрокси-5,6-дигидро-2-оксо-6,6-дипропил-2H-пиран-3-ил)пропил} фенил]-5-амино-2-пиридинсульфонамид,
N-3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6(R)-(2-(4-фторфенил)этил) -6-пропил-2H-пиран-3-ил)пропил}фенил]-5-циано-2- пиридинсульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро-2- оксо-6(R)-(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил) пропил}фенил]-5-циано-2-пиридинсульфонамид,
N-[3-{1(R)- (4-гидрокси-5,6-дигидро-2-оксо-6(S)-(2-(4-фторфенил)этил)-6- пропил-2H-пиран-3-ил)пропил}фенил]-5-циано-2- пиридинсульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро-2-оксо-6(S)- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил]фенил]- 5-циано-2-пиридинсульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6(R)- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил]фенил]-1 -метил-1H-имидазол-4-сульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро-2-оксо-6(S)-(2-(4- фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил]фенил]-1- метил-1H-имидазол-4-сульфонамид,
N-[3-{1(R)-(4-гидрокси- 5,6-дигидро-2-оксо-6(S)- (2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил} фенил] -1-метил-1H-имидазол-4-сульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро-2-оксо-6(R)-(2-(4- фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил}фенил]-1-метил- 1H-имидазол-4-сульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6(R) -(2-(4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил} фенил]-5-амино-2-пиридинсульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро-2-оксо-6(S)-(2- (4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил} фенил]-5-амино-2-пиридинсульфонамид,
N-[3-{ 1(R)-(4-гидрокси-5,6-дигидро-2-оксо-6(S)-(2- (4-фторфенил)этил)-6-пропил-2H-пиран-3-ил)пропил} фенил]-5-амино-2-пиридинсульфонамид,
N-[3-{ 1(S)-(4-гидрокси-5,6-дигидро-2-оксо-6(R)-(2-(4-фторфенил)этил)-6- пропил-2H-пиран-3-ил)пропил}фенил]-5-амино-2-пиридинсульфонамид.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-ГИДРОКСИБЕНЗОПИРАН-2-ОН ИЛИ 4-ГИДРОКСИЦИКЛОАЛКИЛ/В/-БЕНЗОПИРАН-2-ОН И СПОСОБ ПОЛУЧЕНИЯ N-/3-/ЦИКЛОПРОПИЛ(5,6,7,8,9,10-ГЕКСАГИДРО-4-ГИДРОКСИ-2-ОКСО-2H-ЦИКЛООКТА/В /- ПИРАН-3-ИЛ)МЕТИЛ/ФЕНИЛ/БЕНЗОЛСУЛЬФОНА | 1994 |
|
RU2125999C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ ГИДРОКСАМОВОЙ КИСЛОТЫ, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ДЕГЕНЕРАЦИЕЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ | 1997 |
|
RU2168497C2 |
| (S)-МЕТИЛ 3-(3-НИТРОФЕНИЛ) ПЕНТАНОАТ | 1998 |
|
RU2263106C2 |
| ФЕНИЛОКСАЗОЛИДИНОНЫ, ИМЕЮЩИЕ С-С-СВЯЗЬ С 4-8-ЧЛЕННЫМИ ГЕТЕРОЦИКЛИЧЕСКИМИ КОЛЬЦАМИ | 1996 |
|
RU2175324C2 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНТИОАЛКИЛЬНЫЕ ИЛИ АЛКИЛЭФИРНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИНГИБИРОВАНИЯ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИРУСОВ | 1996 |
|
RU2167155C2 |
| ОКСАЗОЛИДИНОНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 1998 |
|
RU2215740C2 |
| ФЕНИЛОКСАЗОЛИДИНОНЫ, ЗАМЕЩЕННЫЕ В КОЛЬЦЕ ГЕТЕРОАРОМАТИЧЕСКИМИ КОЛЬЦАМИ, В КАЧЕСТВЕ АНТИМИКРОБНЫХ АГЕНТОВ | 1996 |
|
RU2154645C2 |
| ФАРМАЦЕВТИЧЕСКАЯ САМОЭМУЛЬГИРУЮЩАЯ КОМПОЗИЦИЯ И ЕЕ НОСИТЕЛЬ ДЛЯ ЛИПОФИЛЬНЫХ ФАРМАЦЕВТИЧЕСКИ АКТИВНЫХ АГЕНТОВ | 1998 |
|
RU2211021C2 |
| АЛКИЛЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКИЕ АМИНЫ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ЛИГАНДОВ D3-ДОПАМИНА | 1997 |
|
RU2185372C2 |
| ПРОИЗВОДНЫЕ 2-АМИНО-4-ФЕНИЛ-4-ОКСОМАСЛЯНОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2139850C1 |

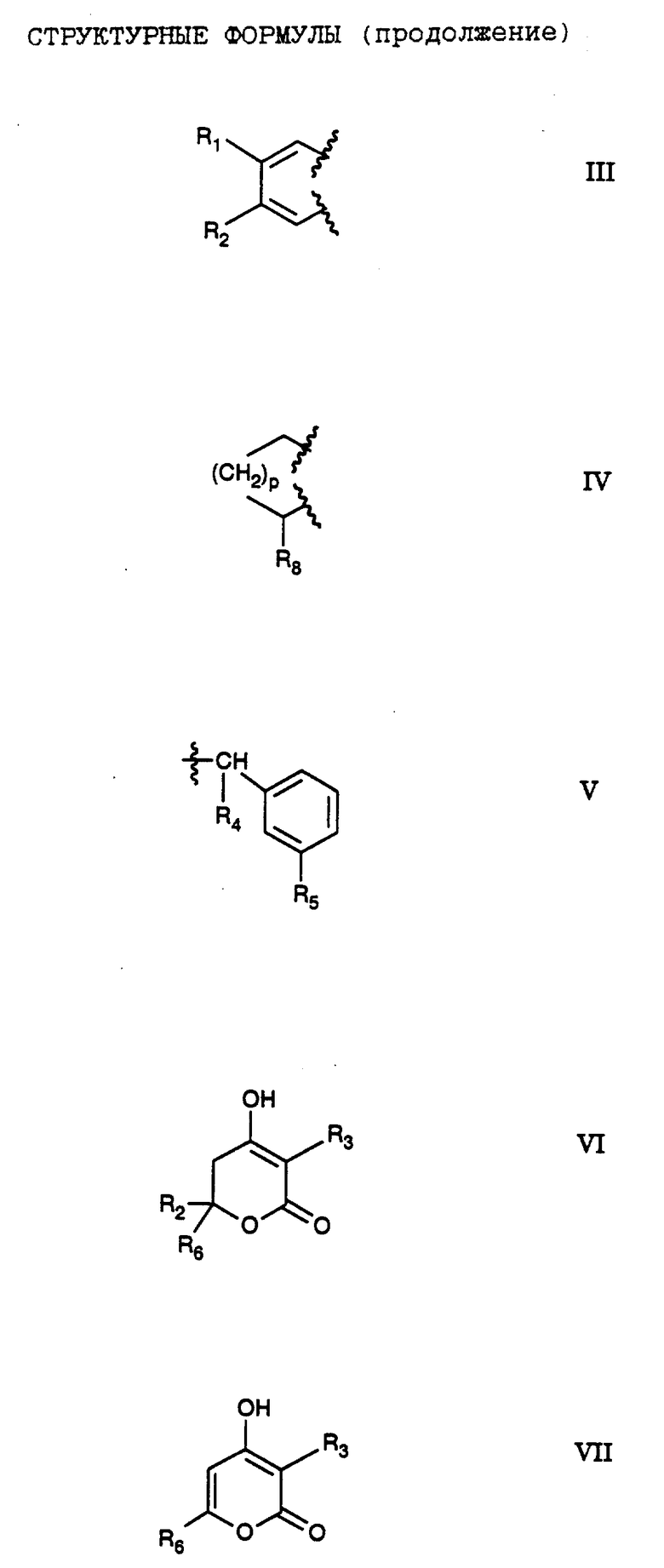
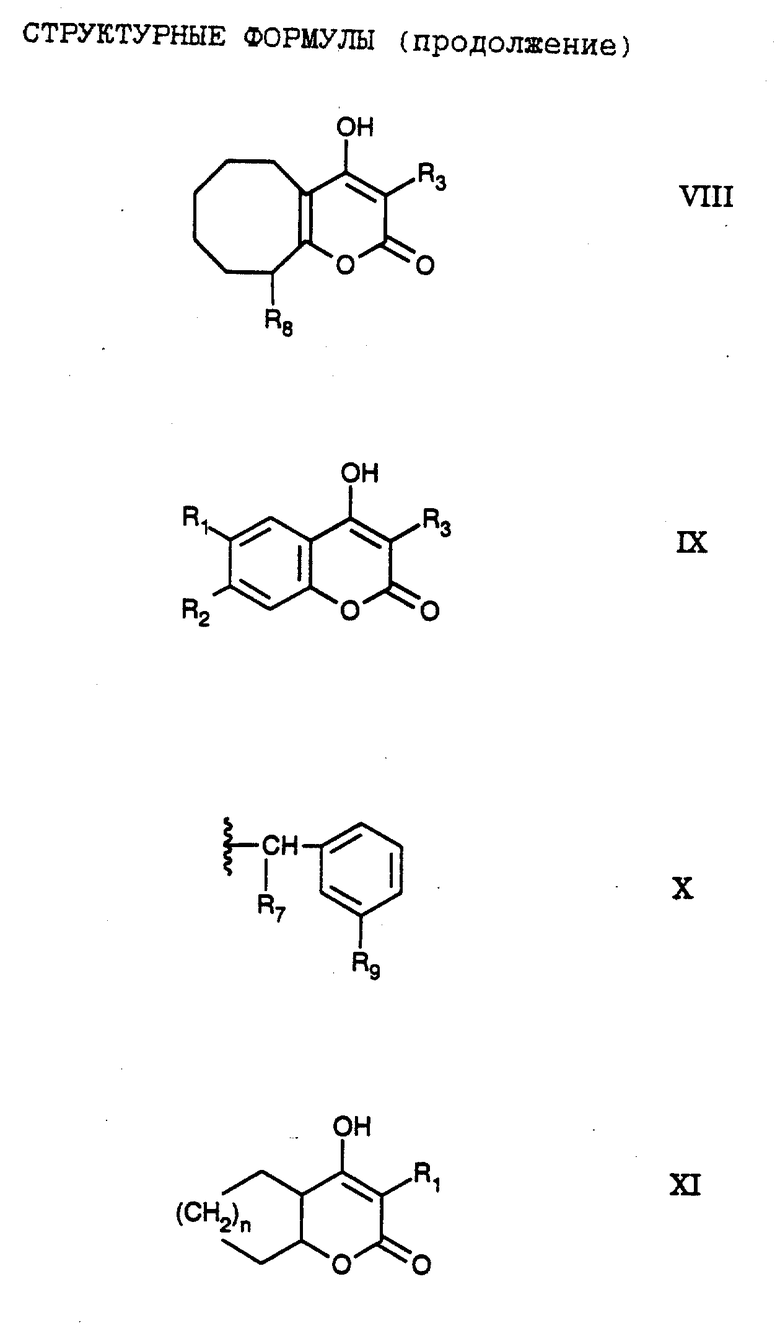
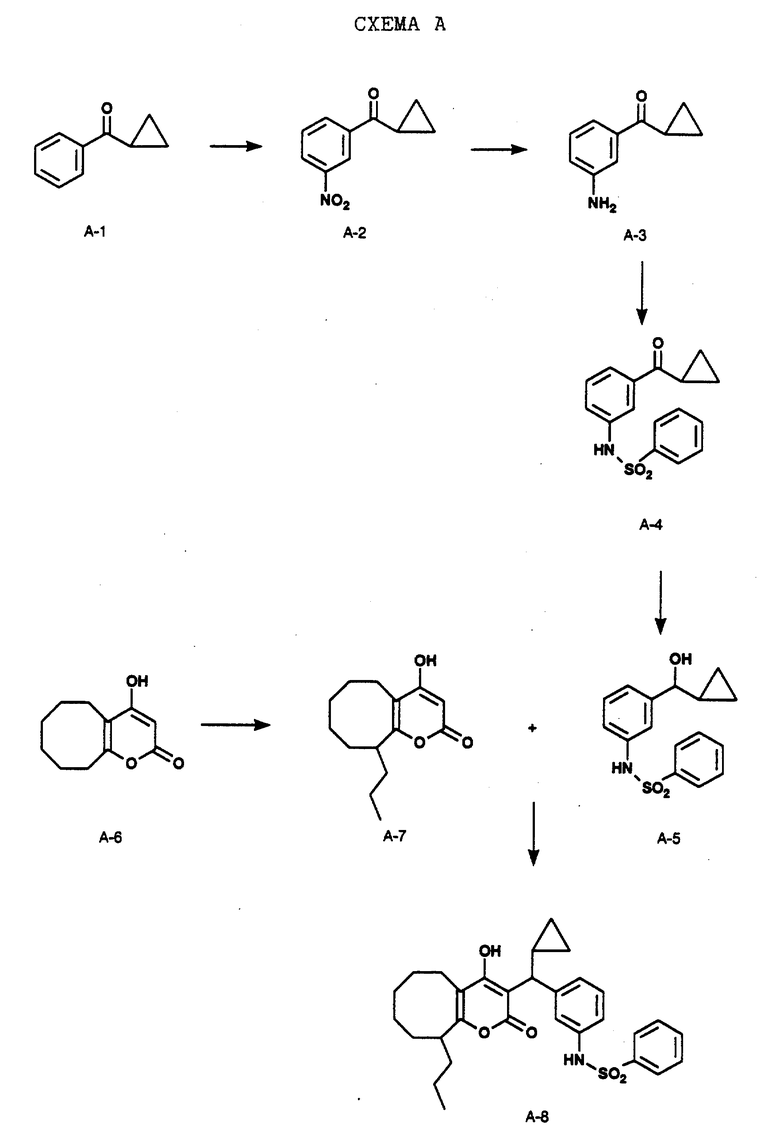
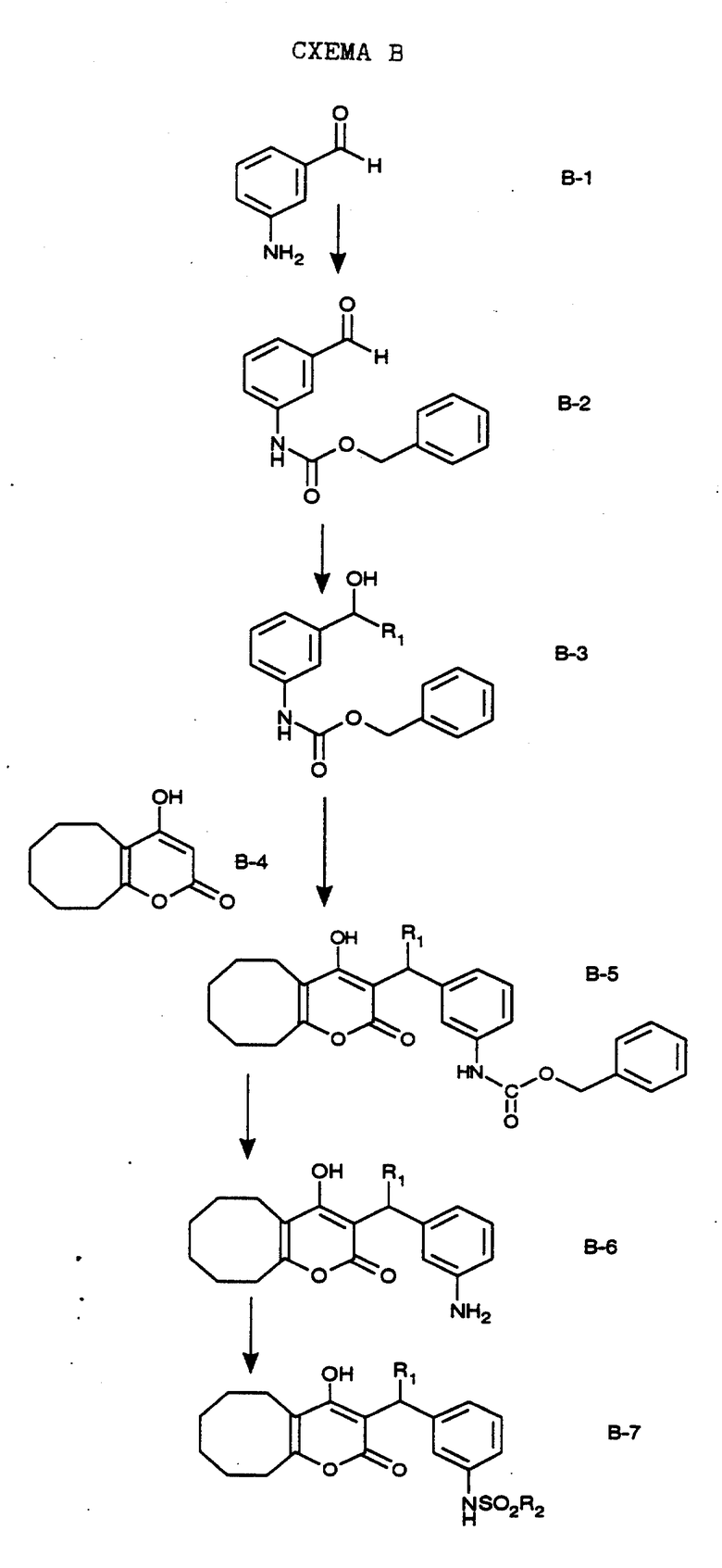
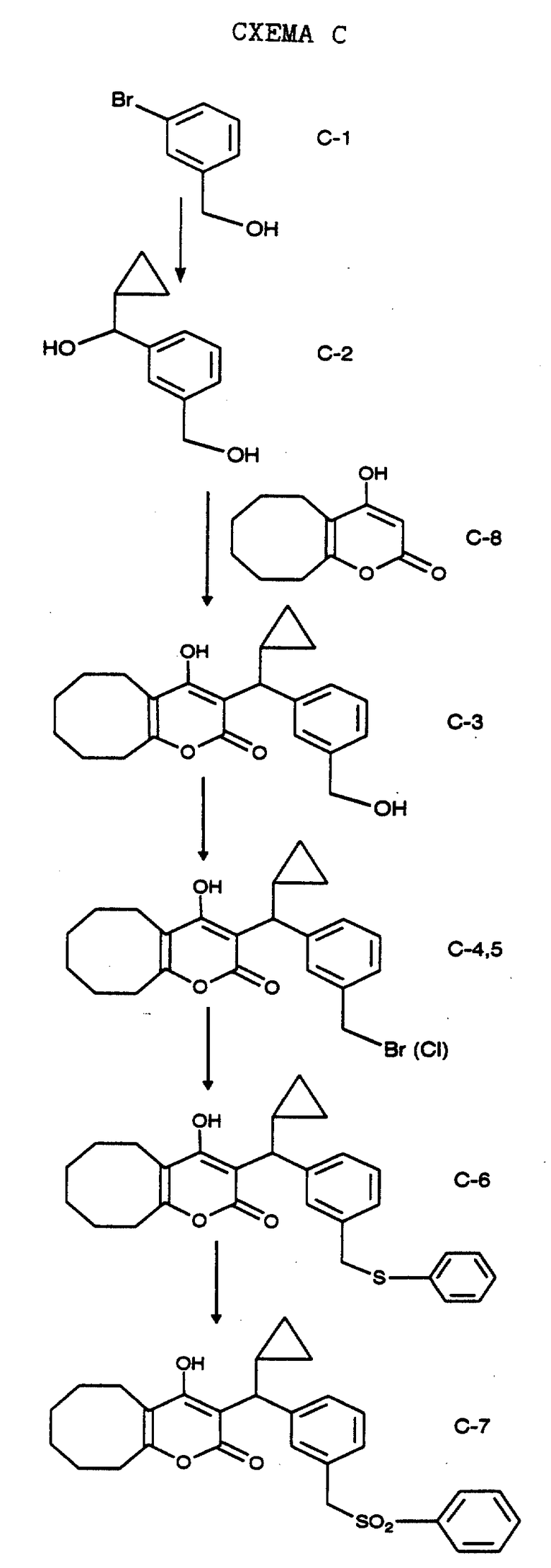
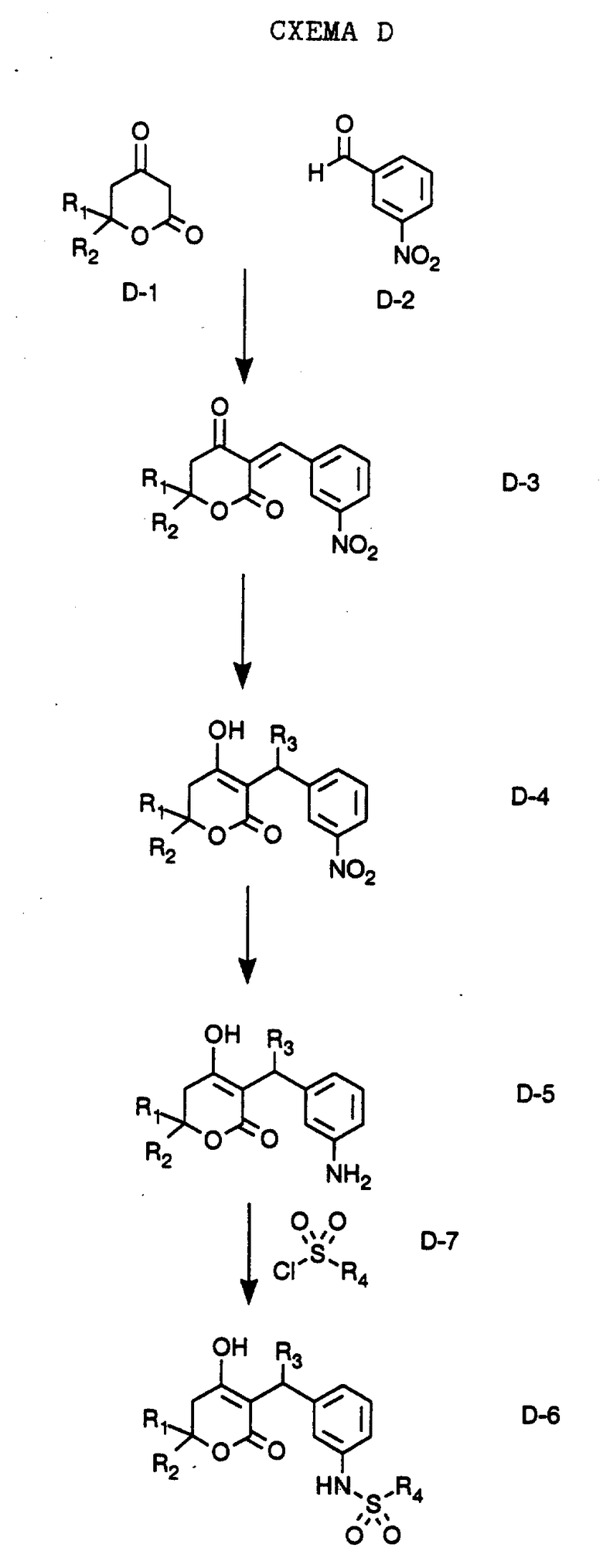
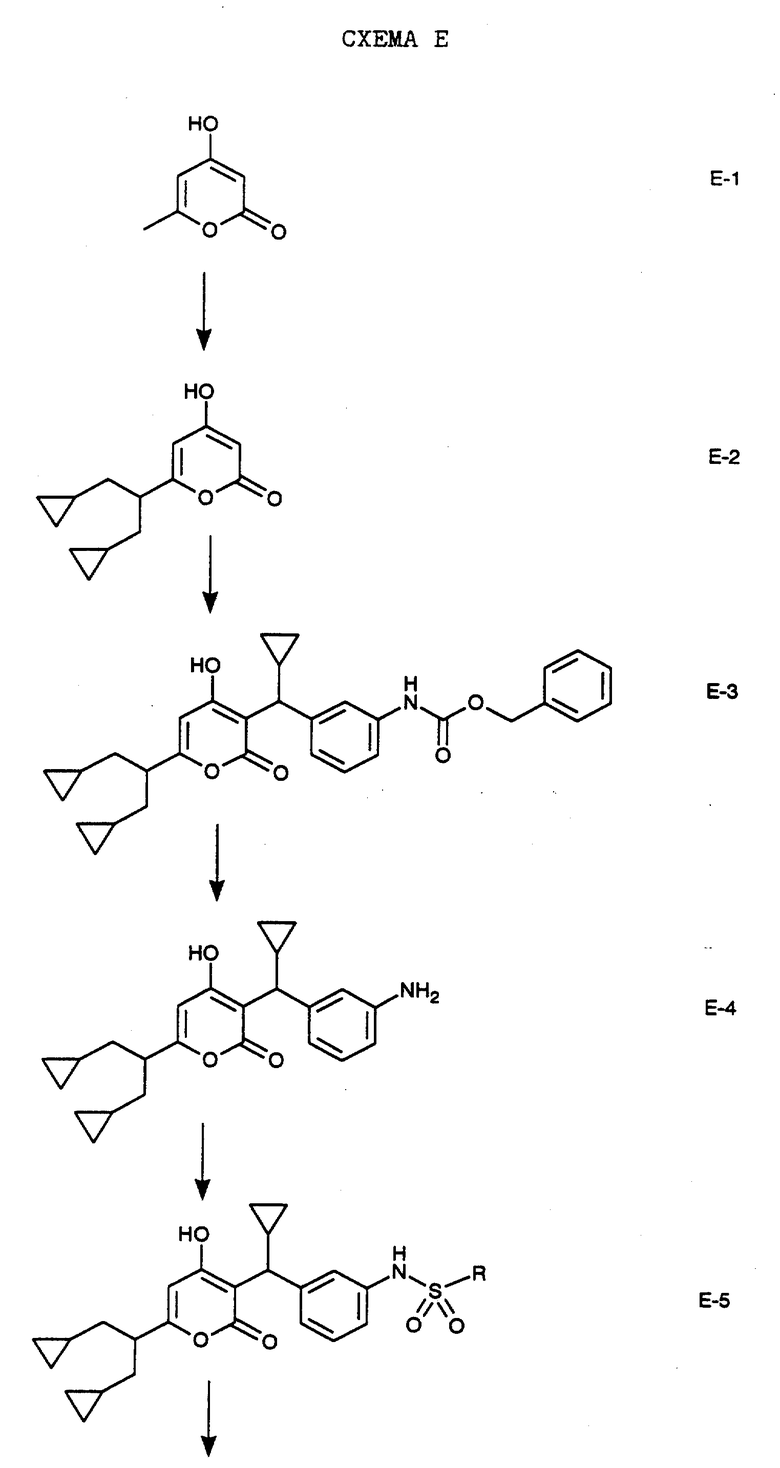
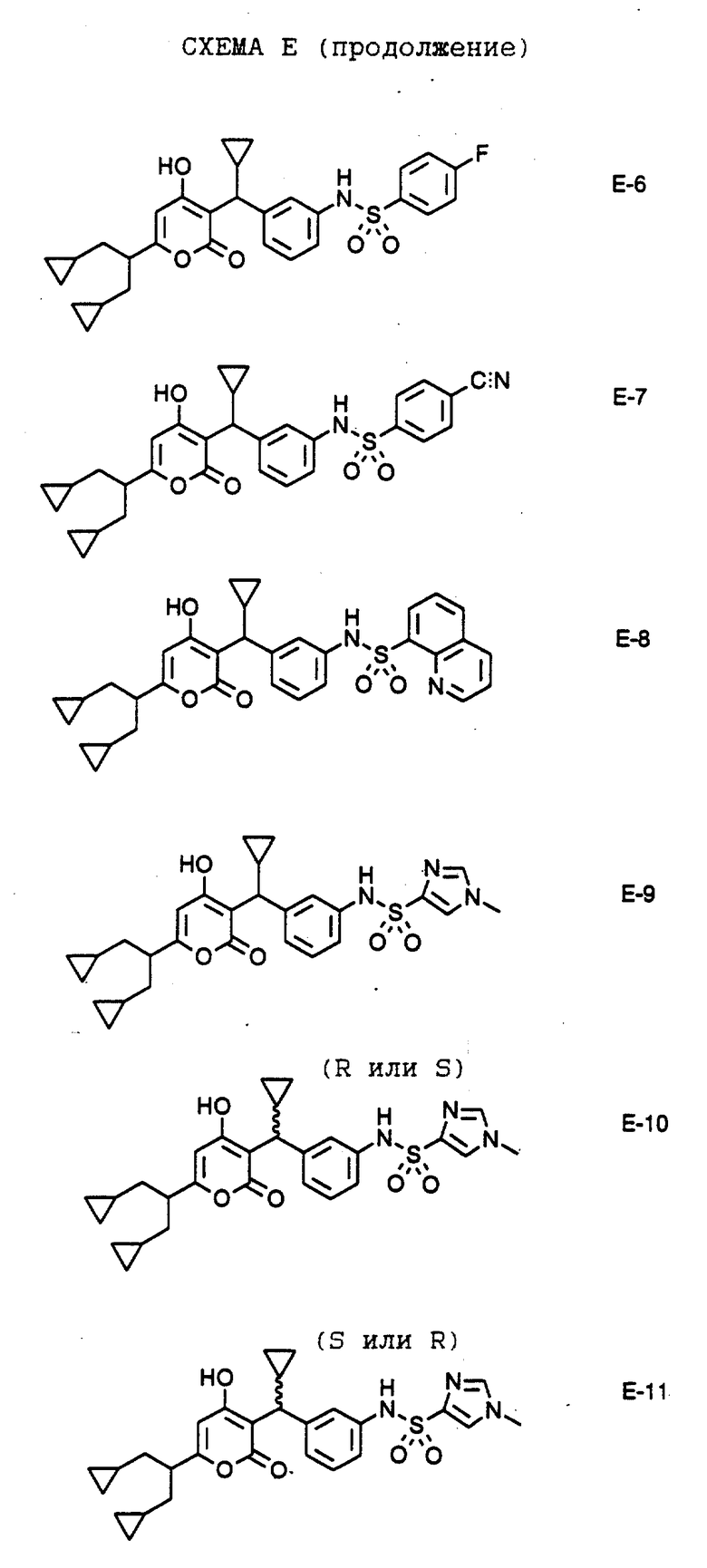
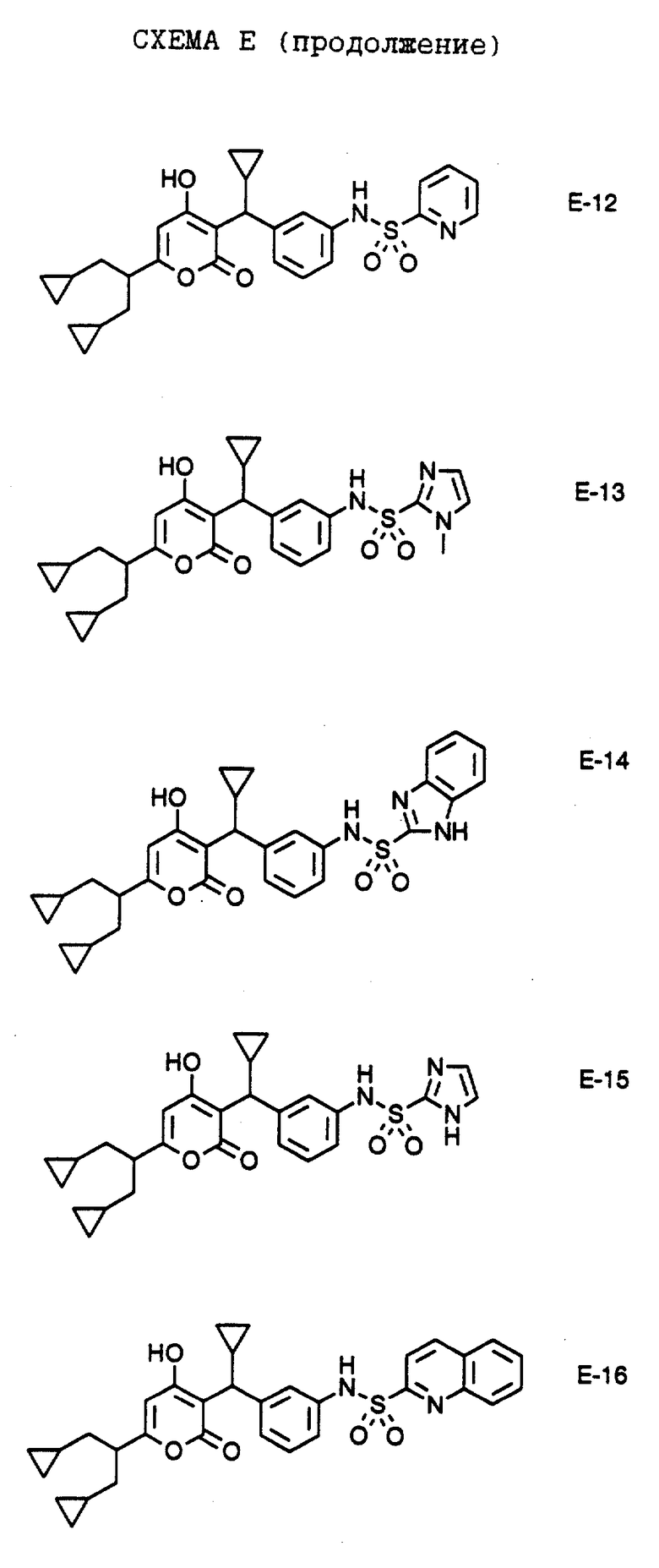
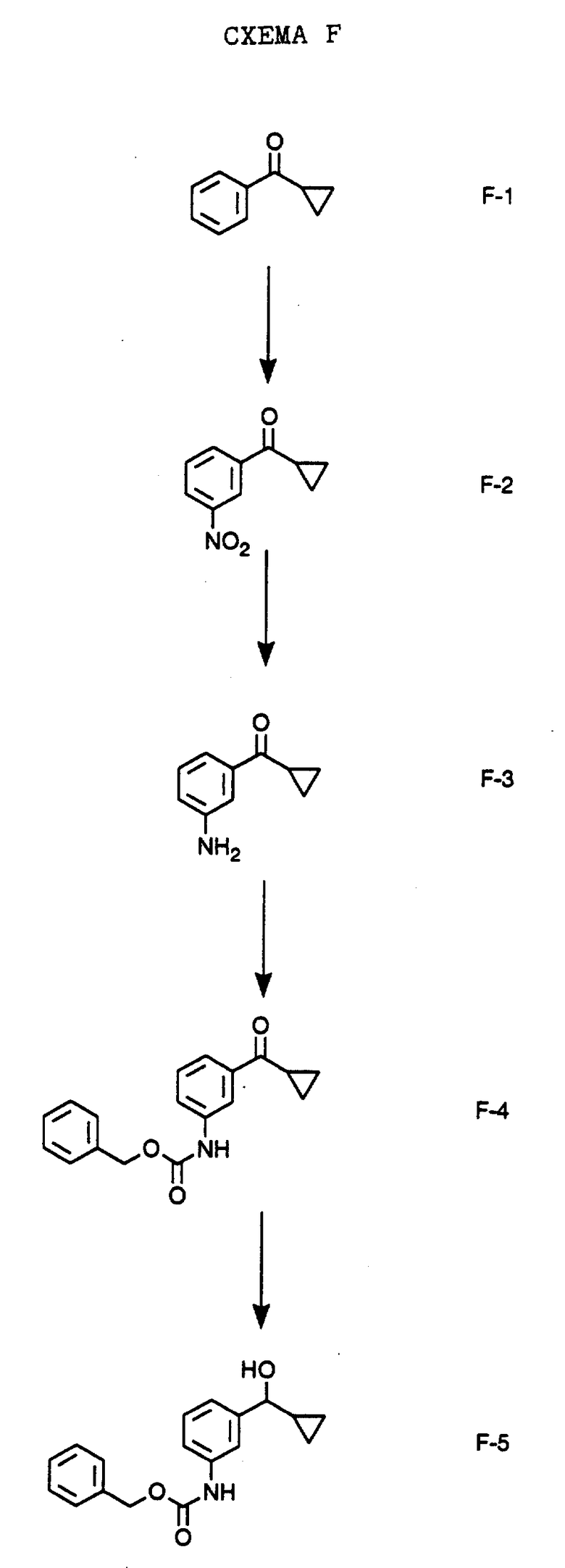

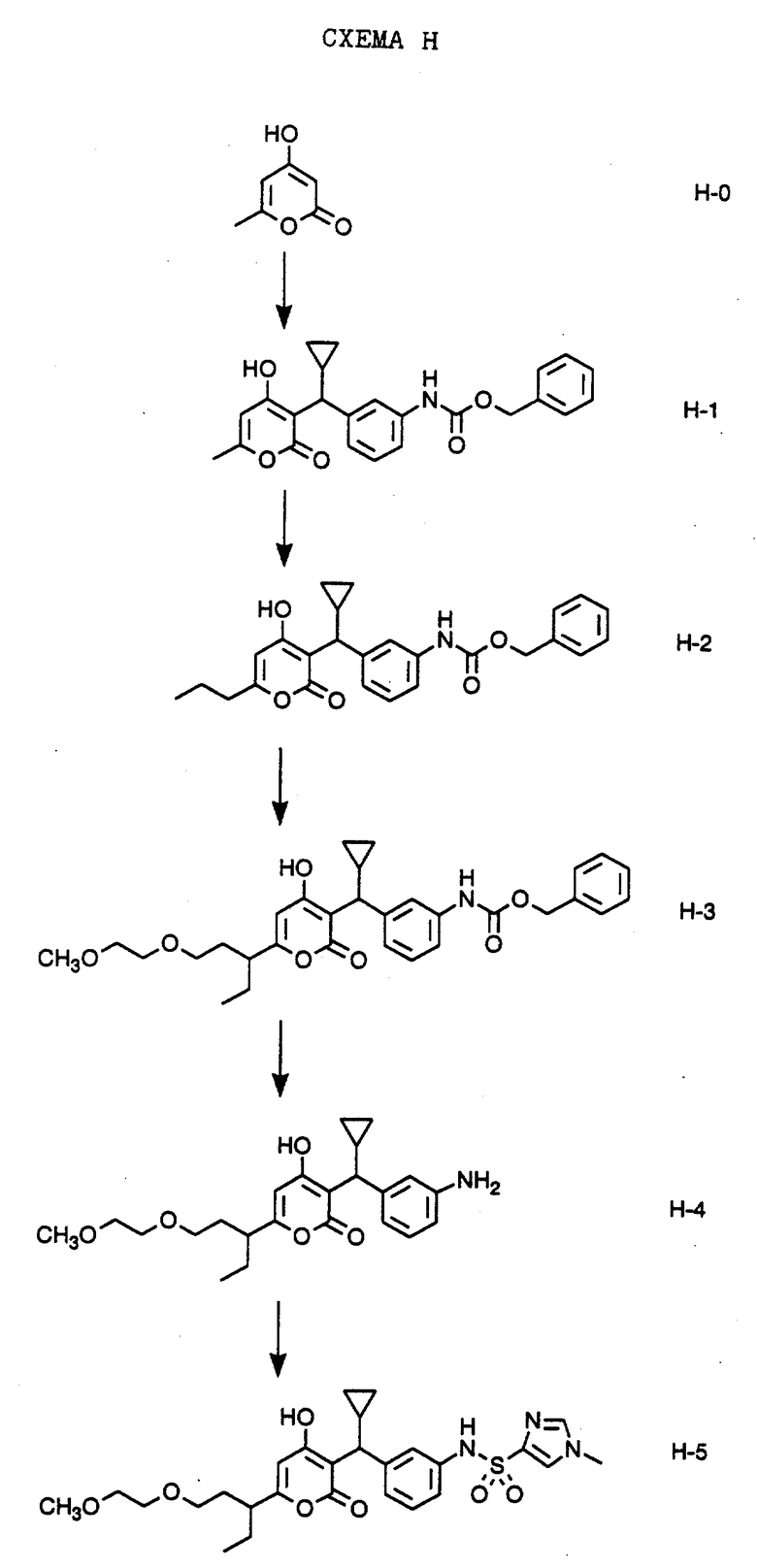
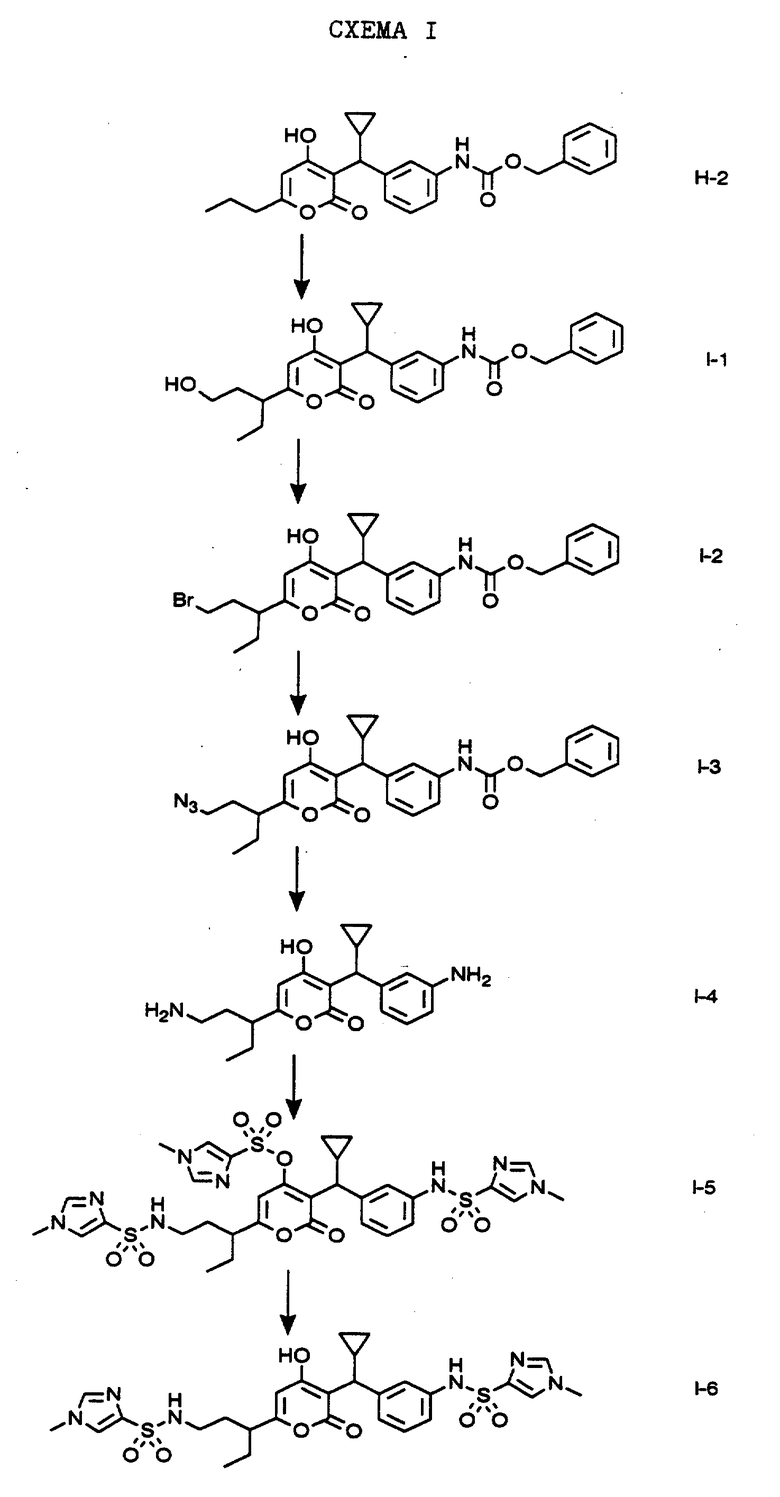
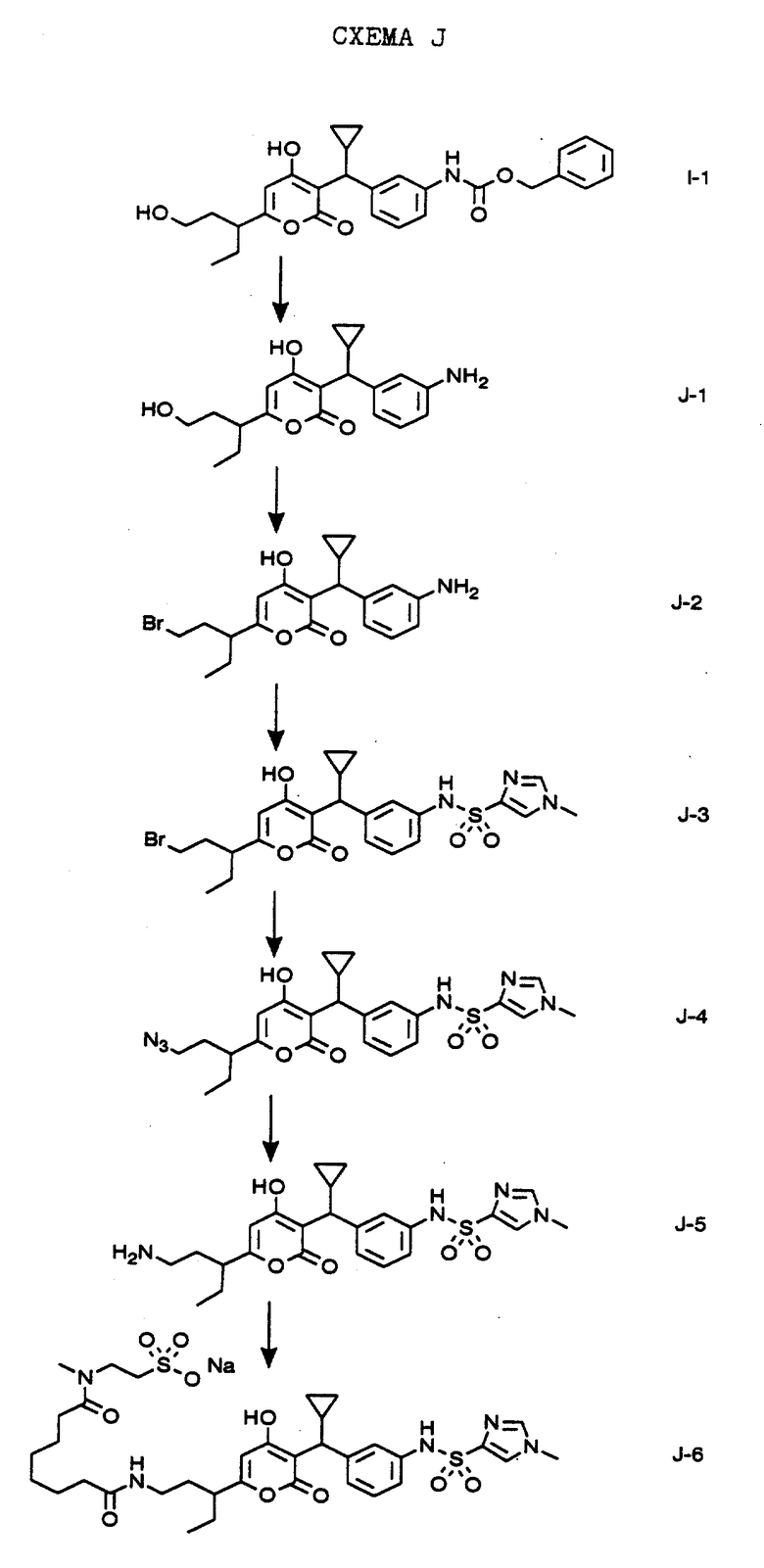
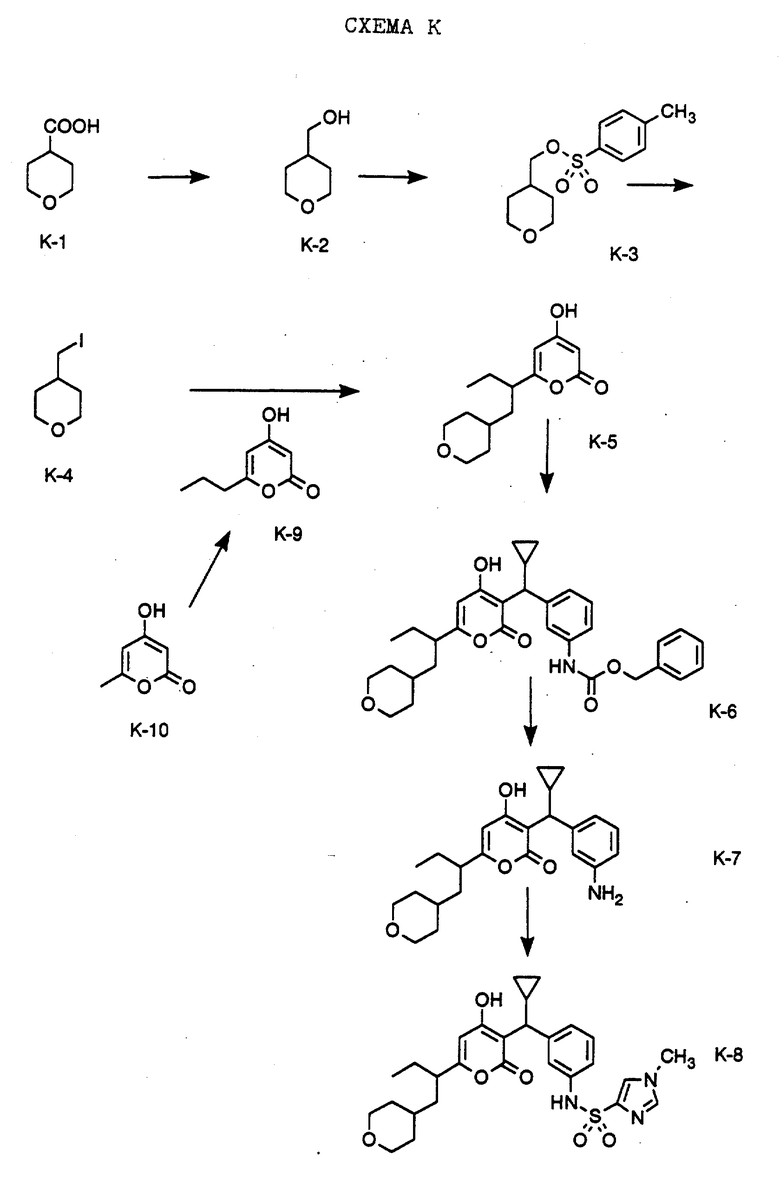

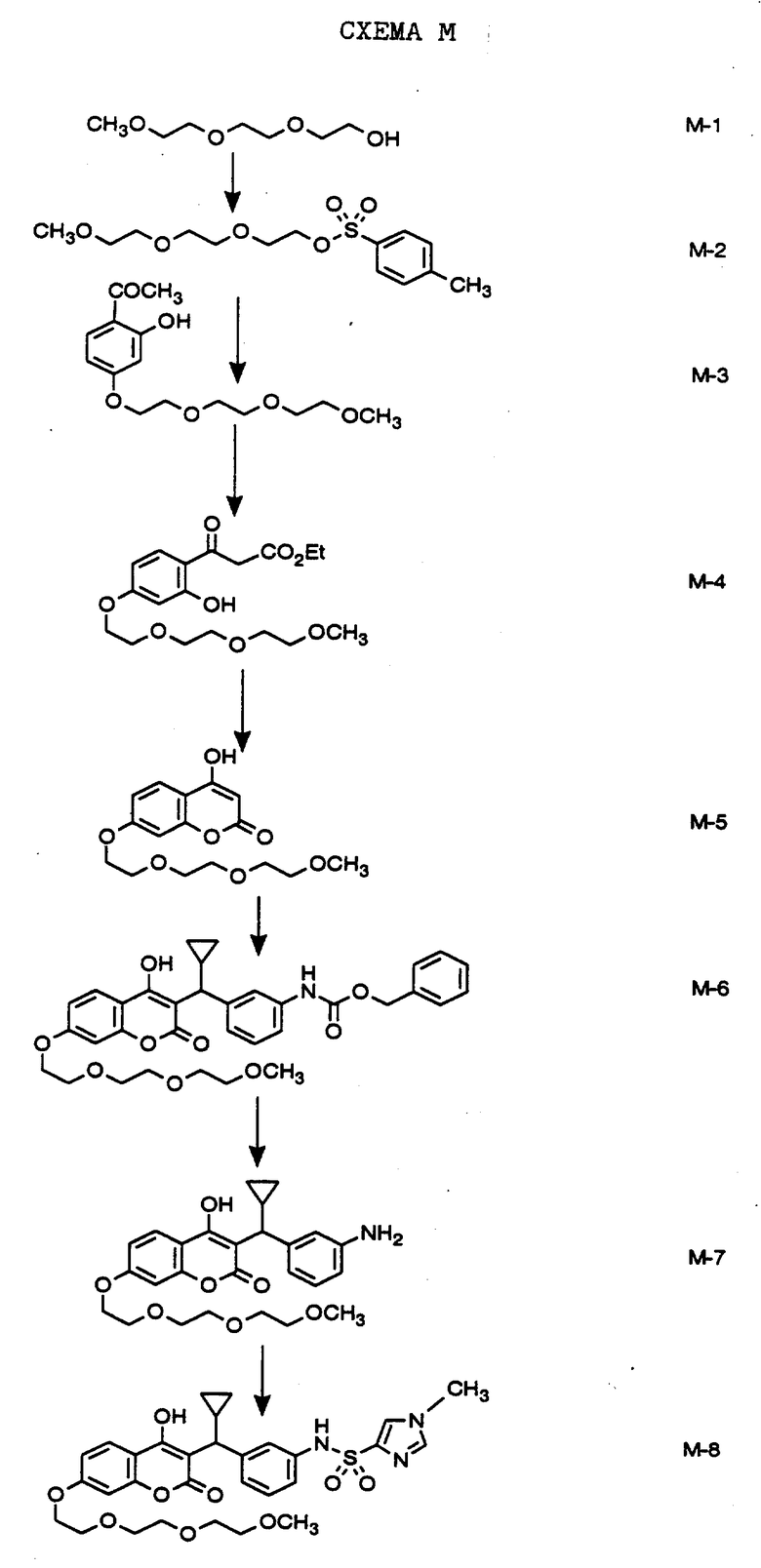
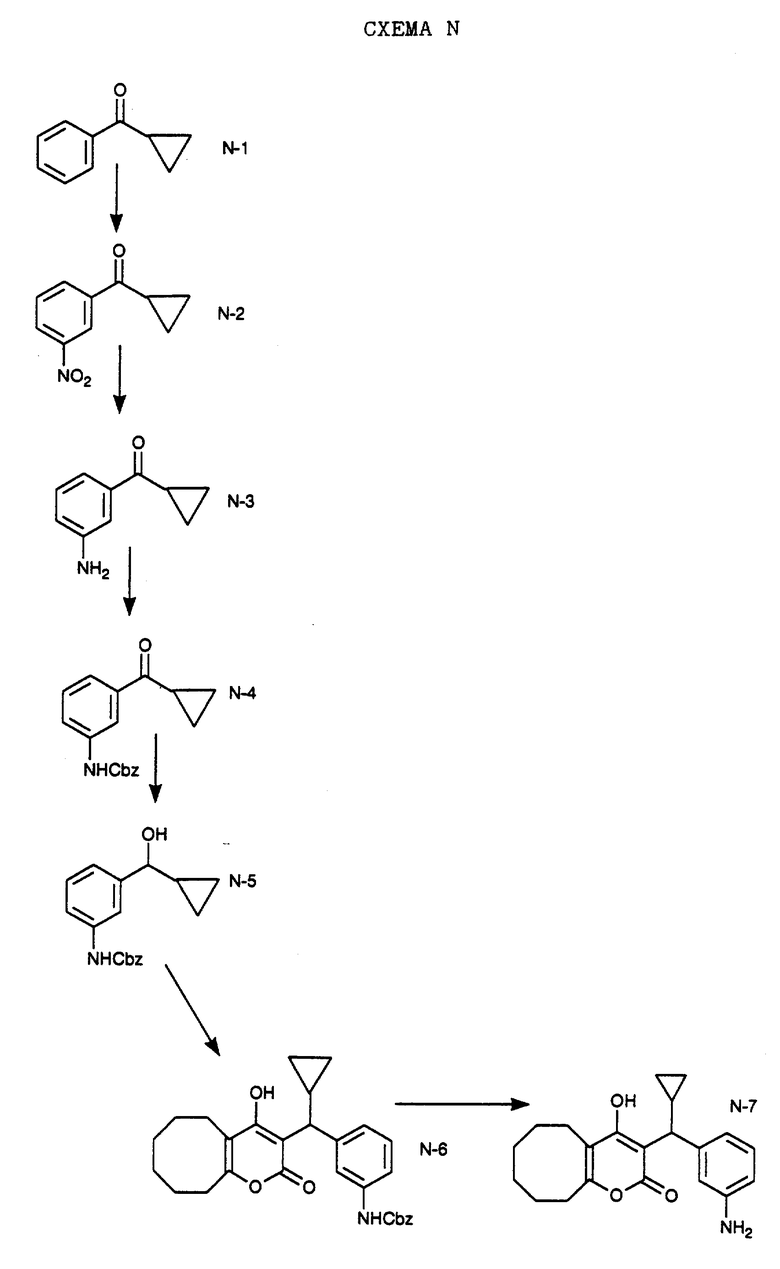

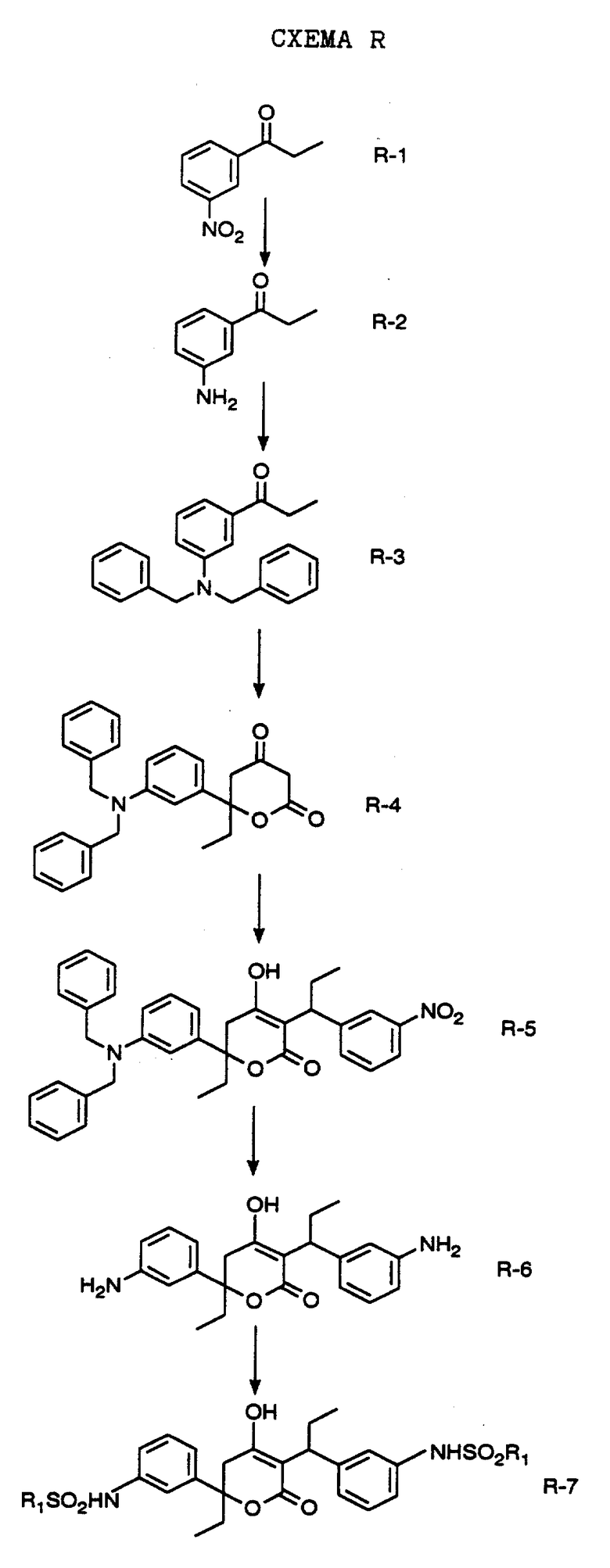
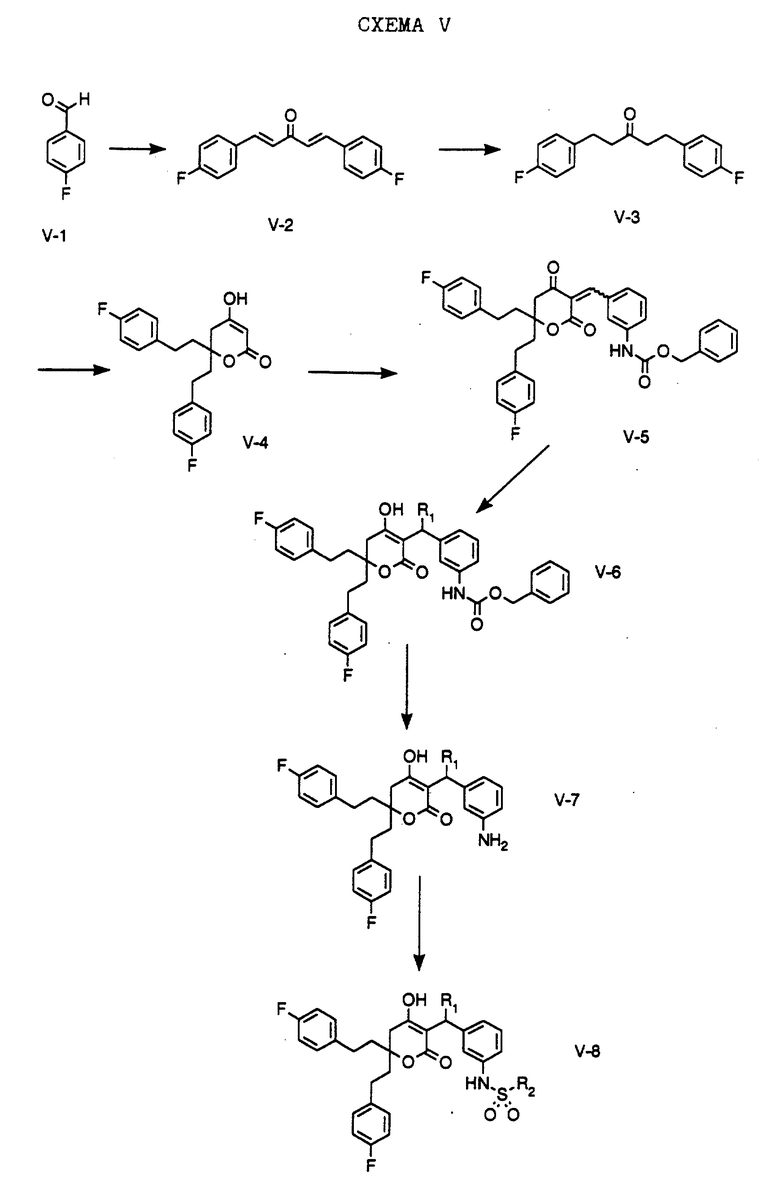

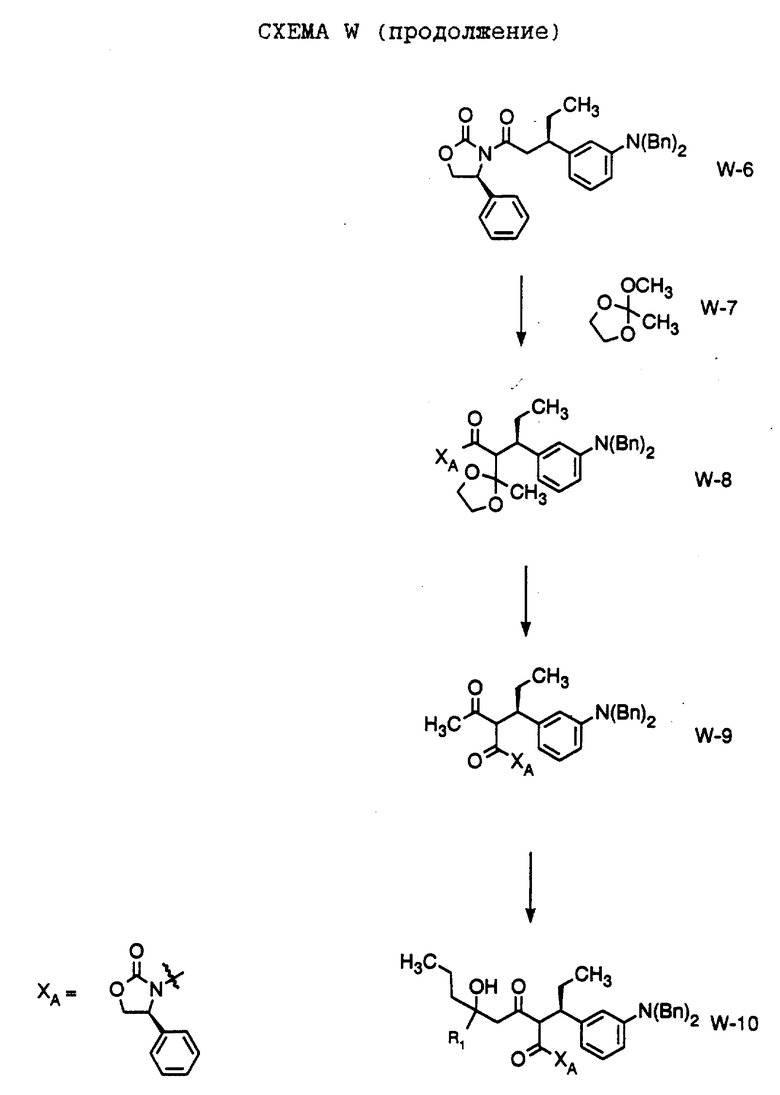
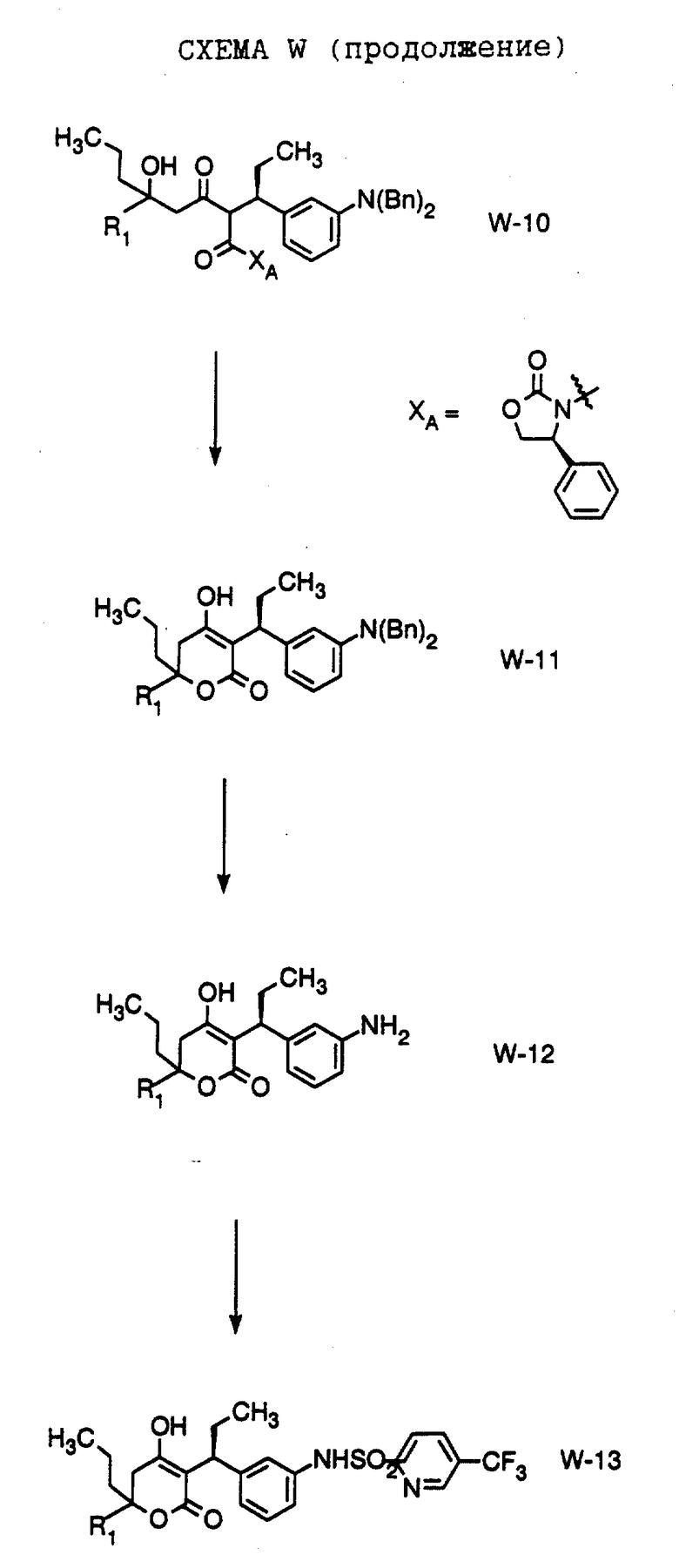
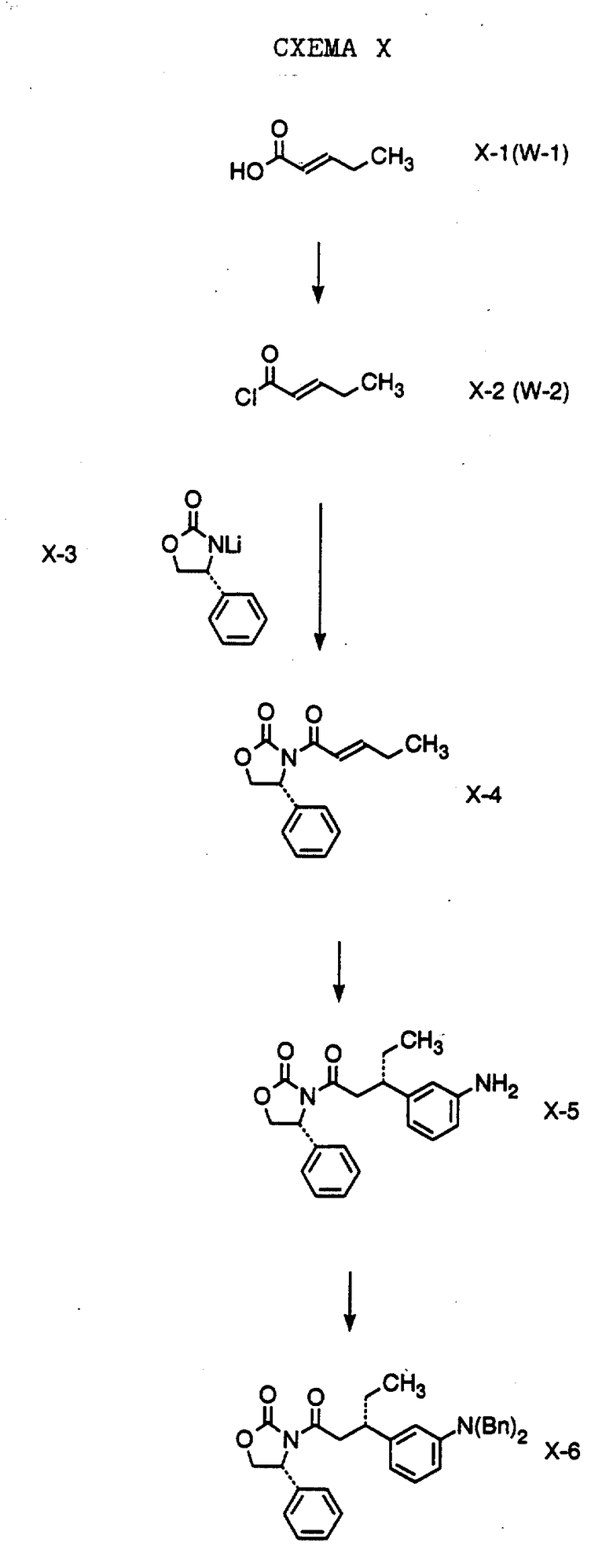
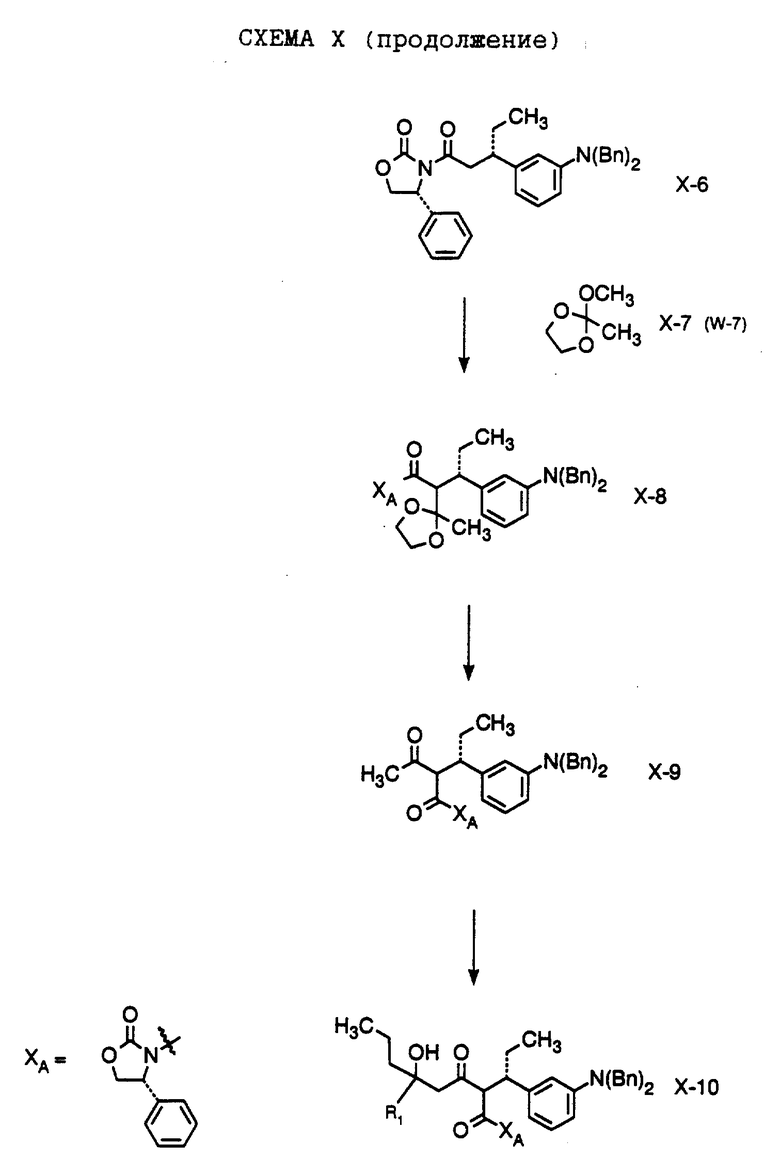


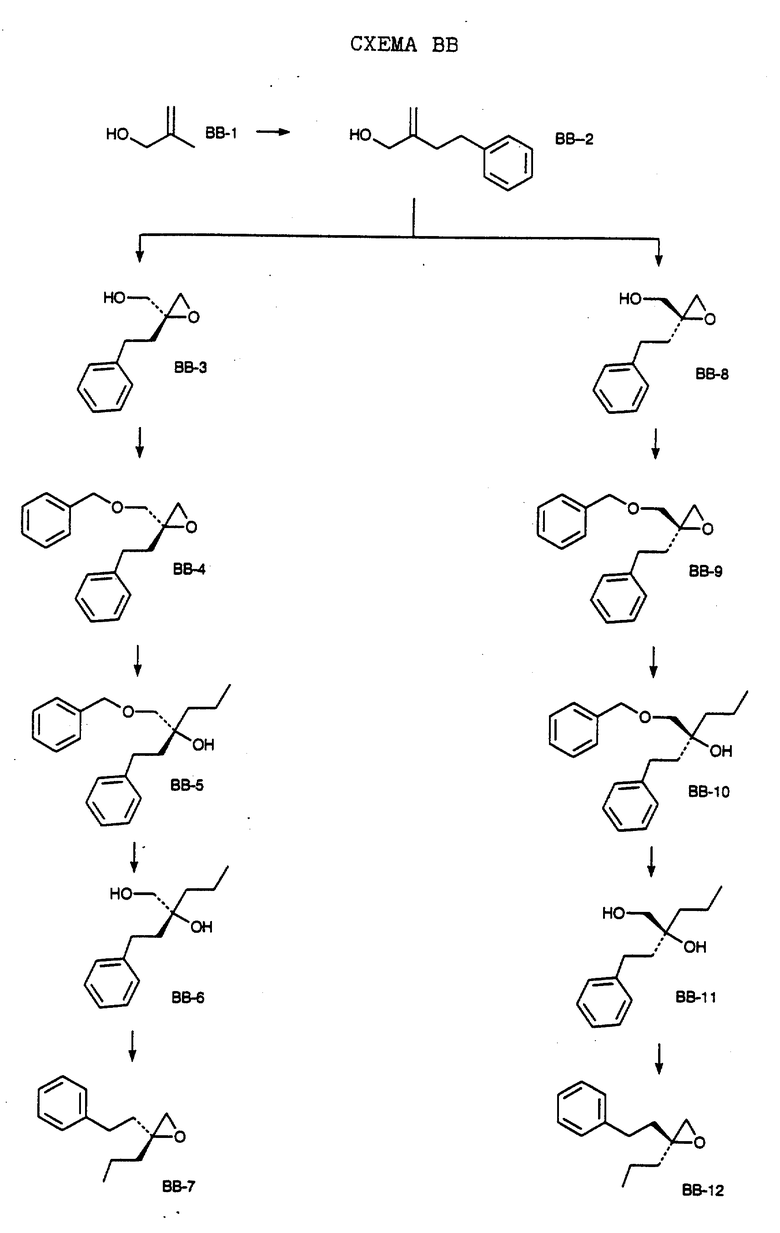
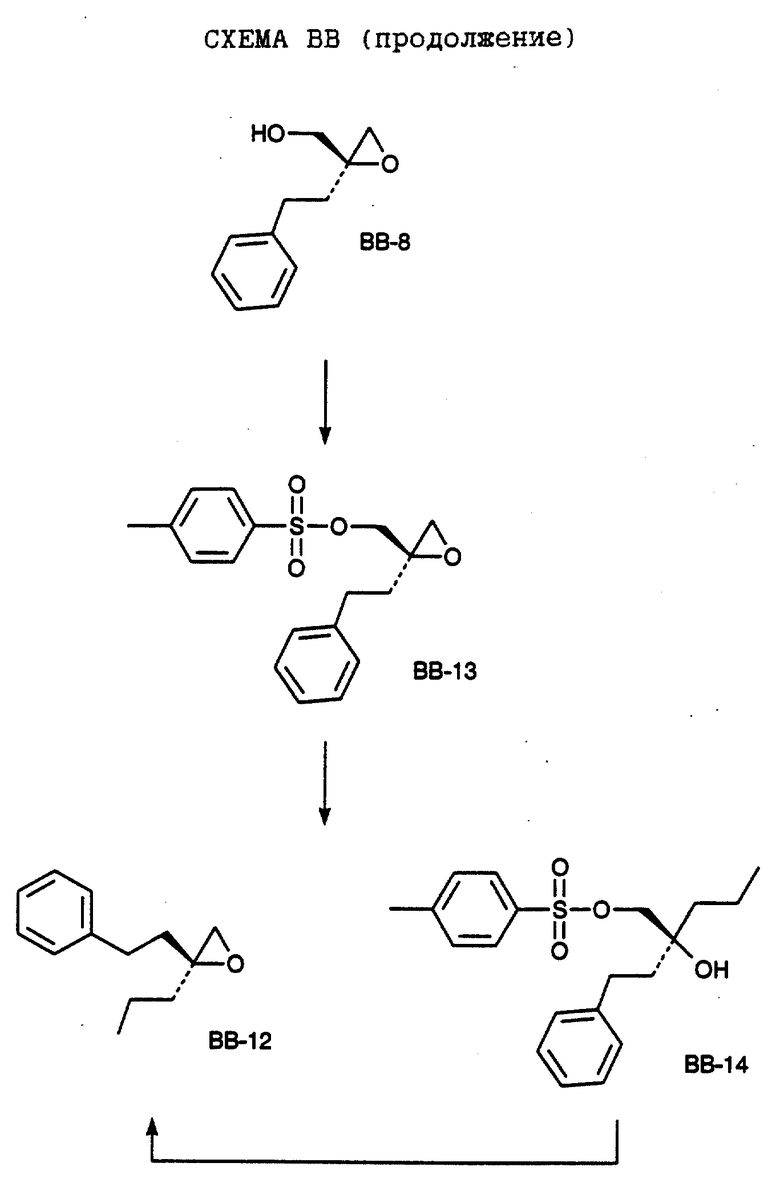
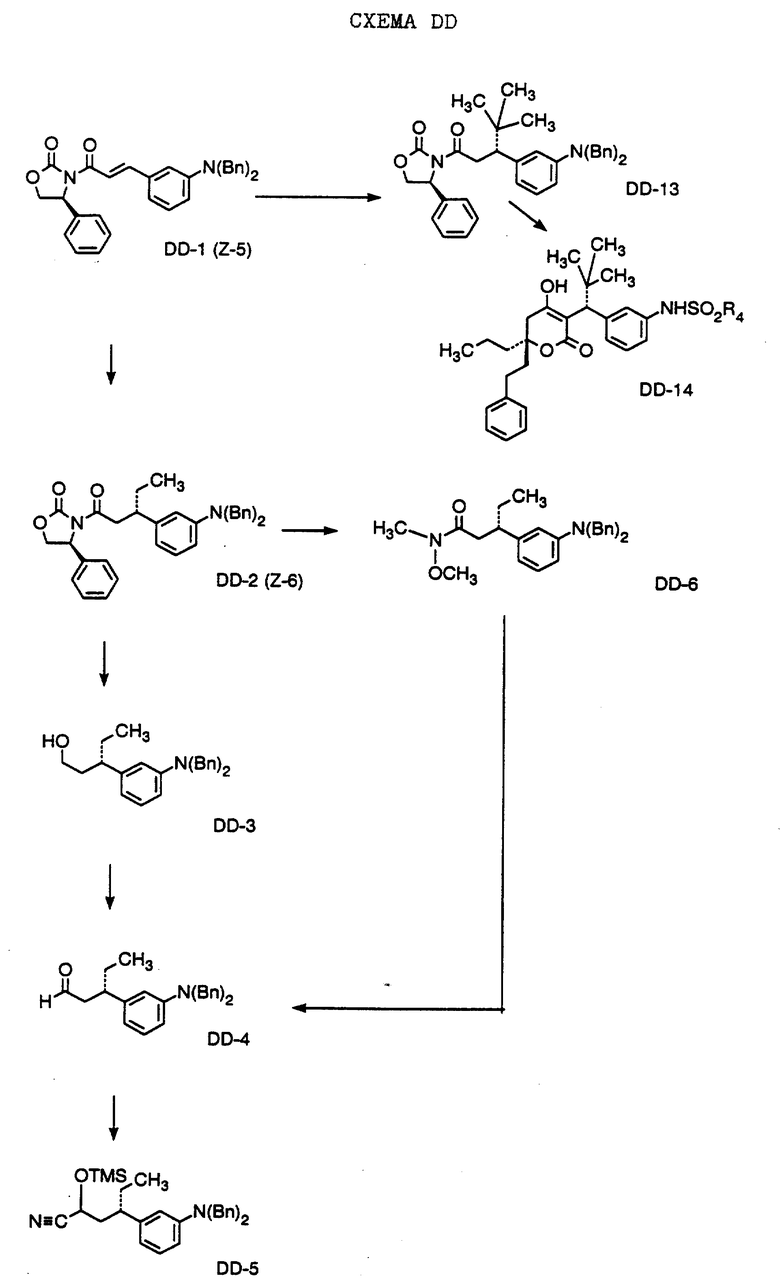
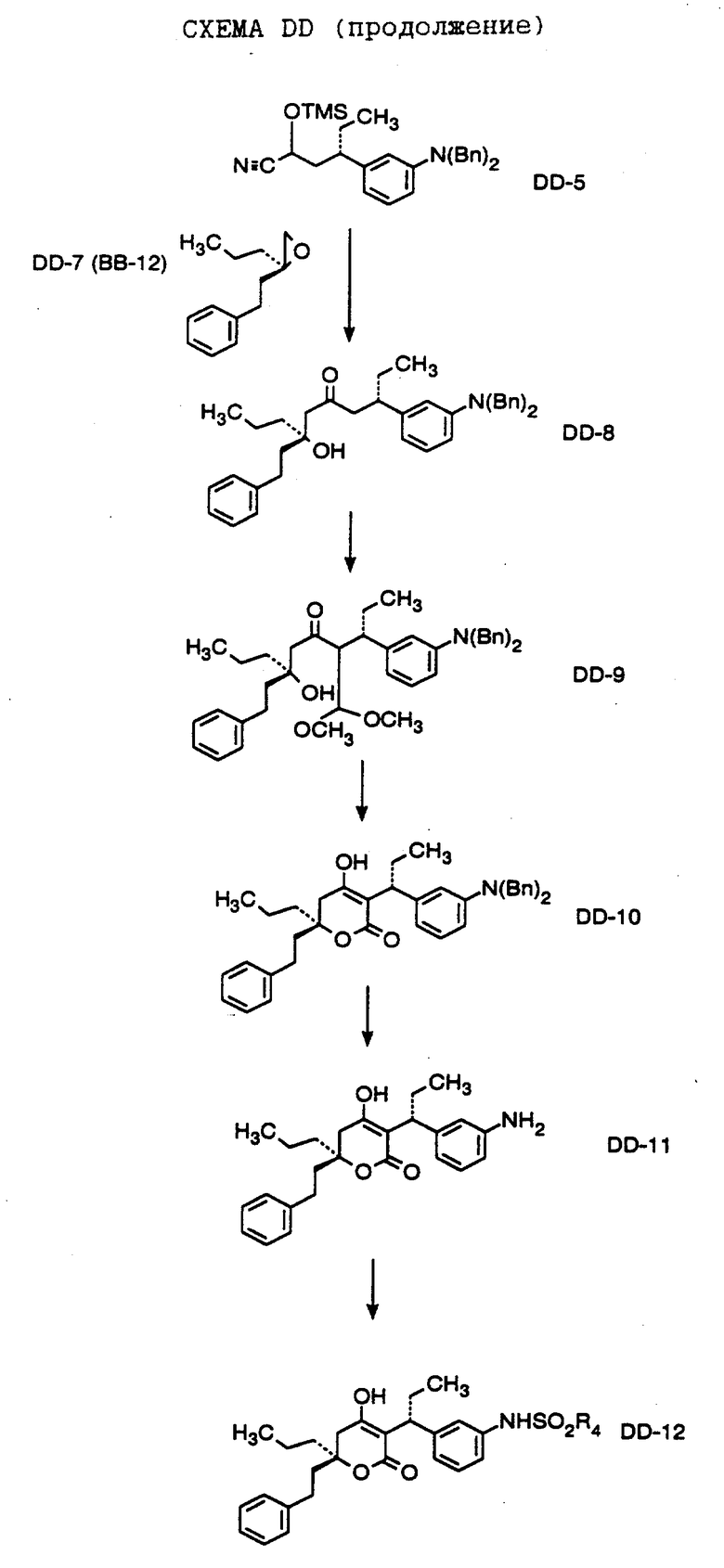
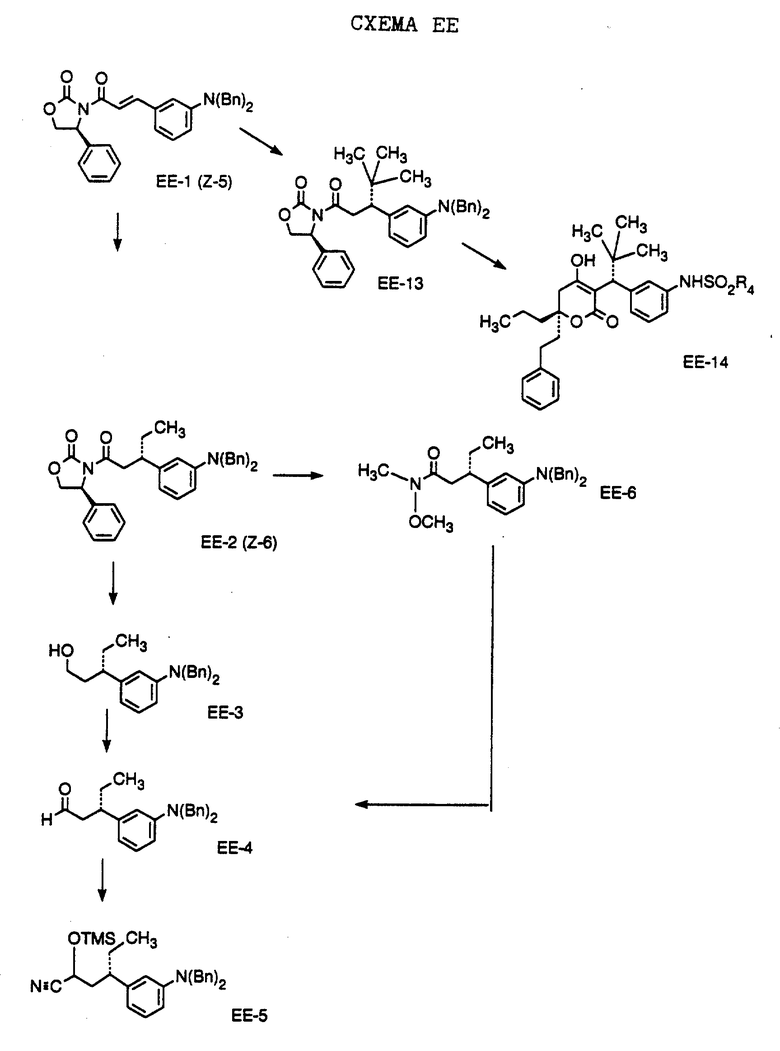
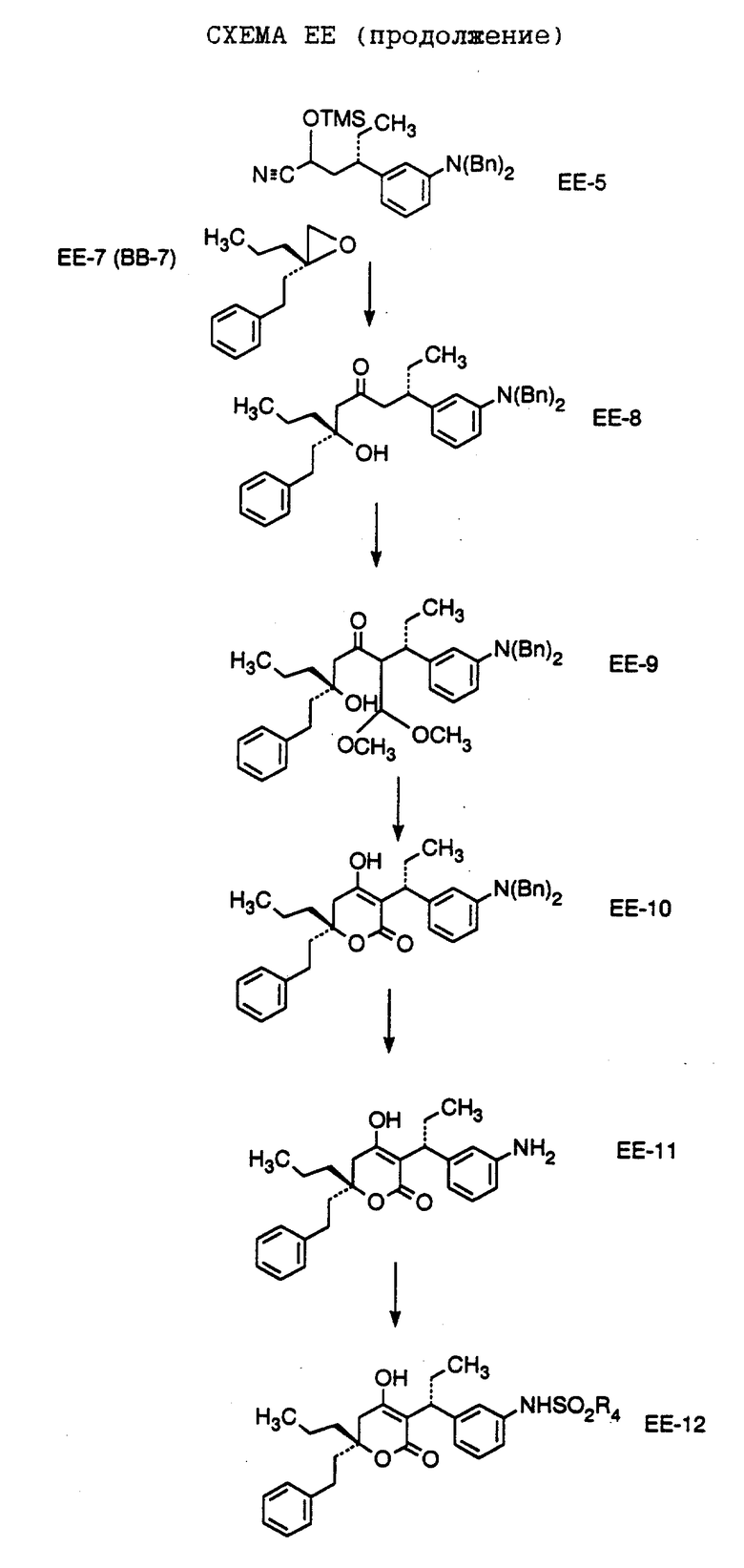
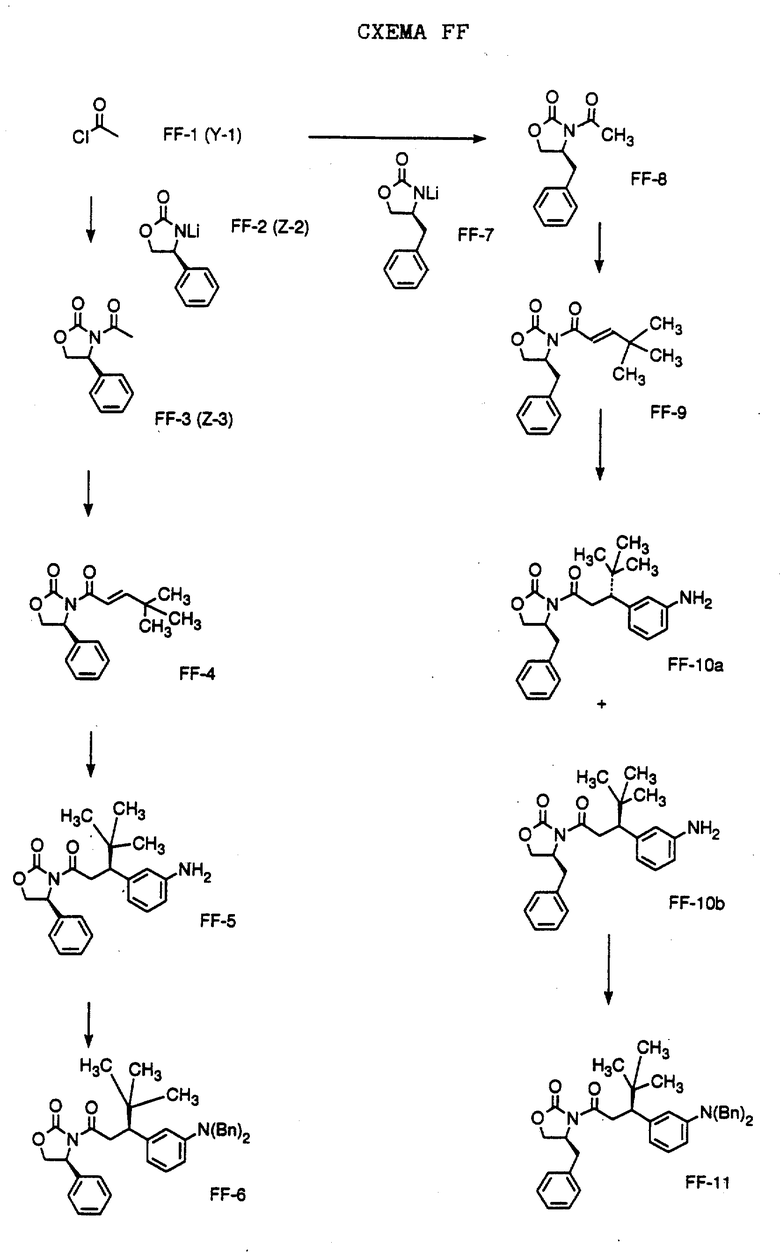
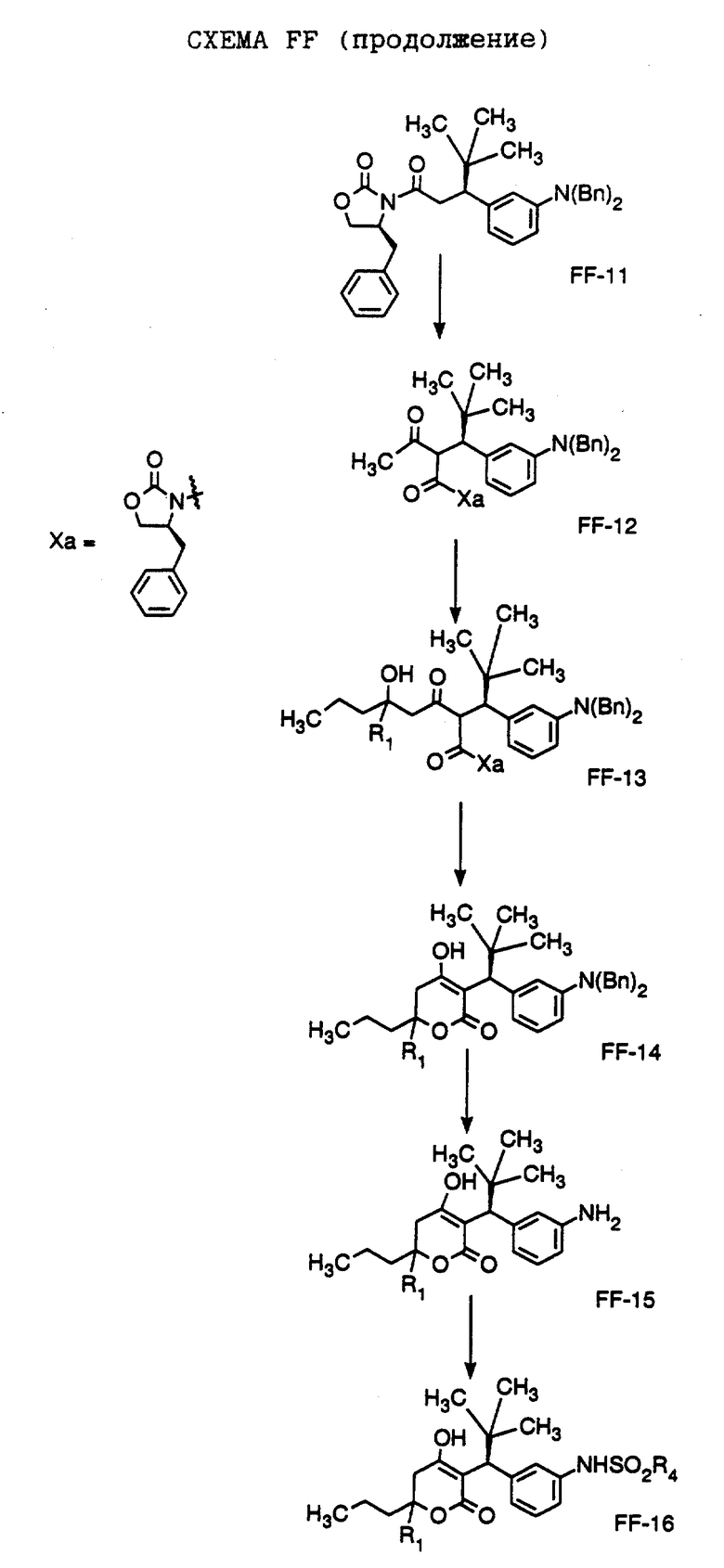
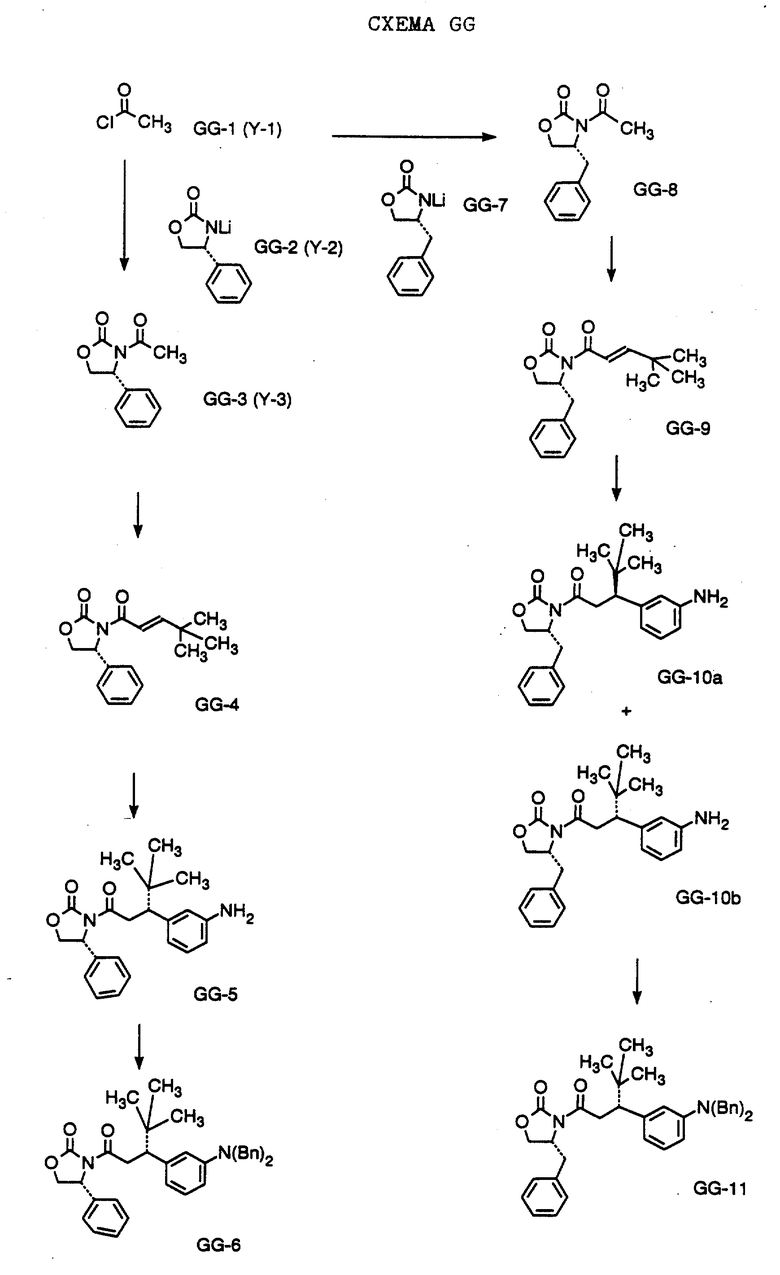
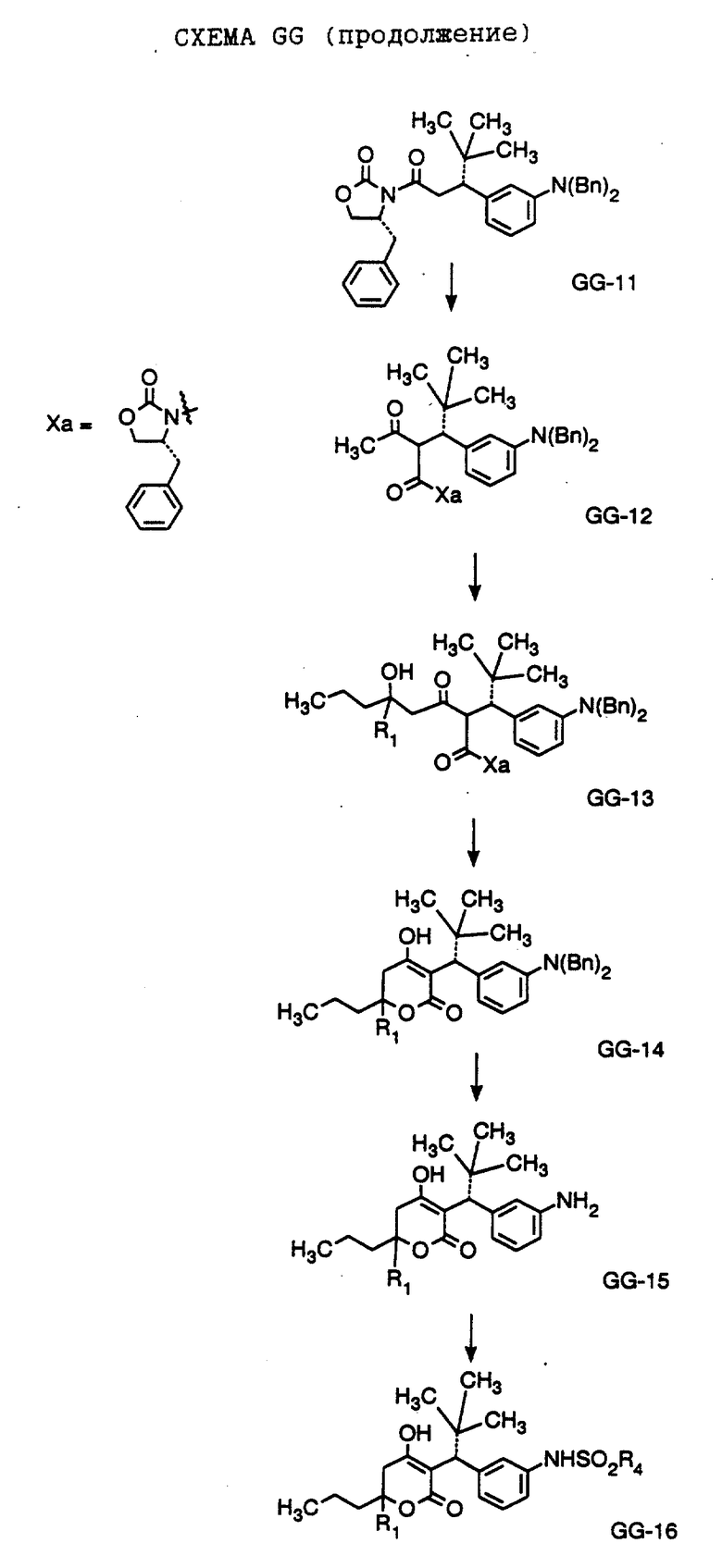
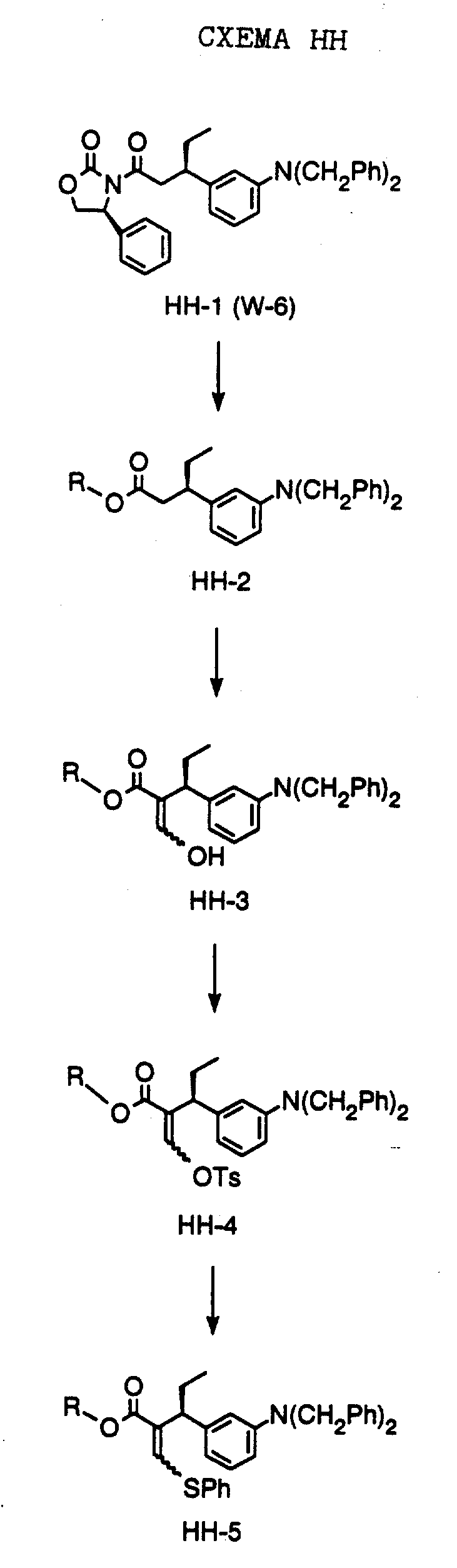
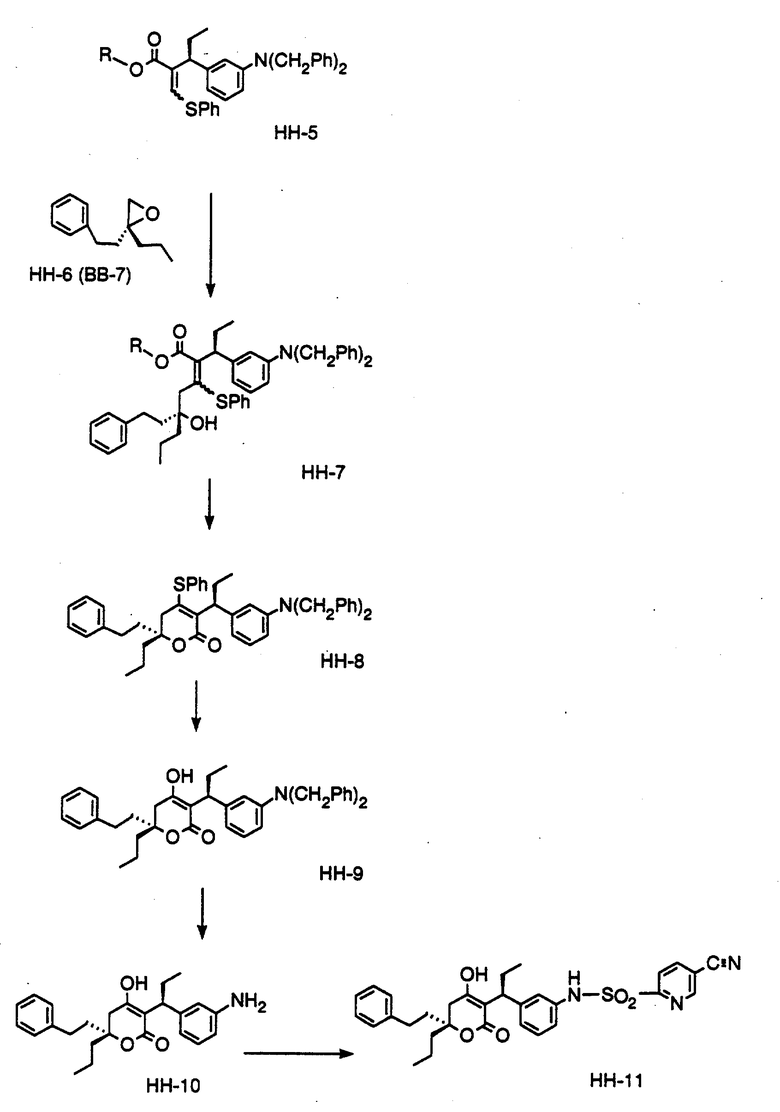
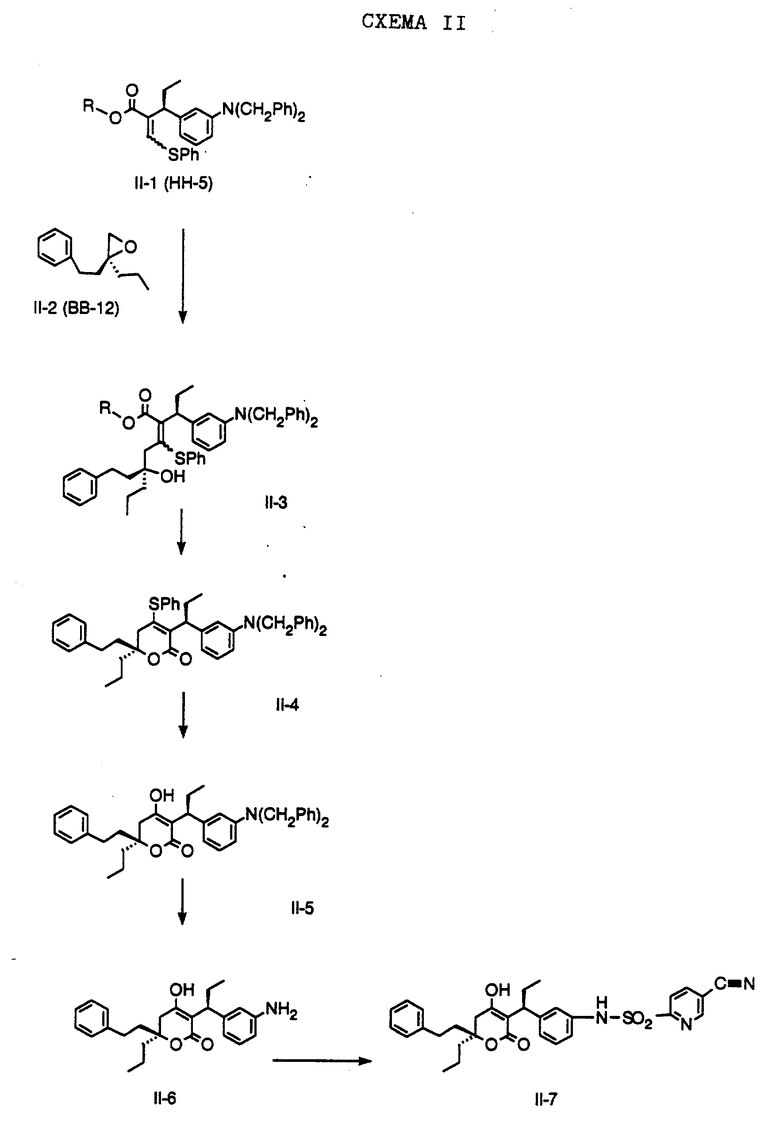

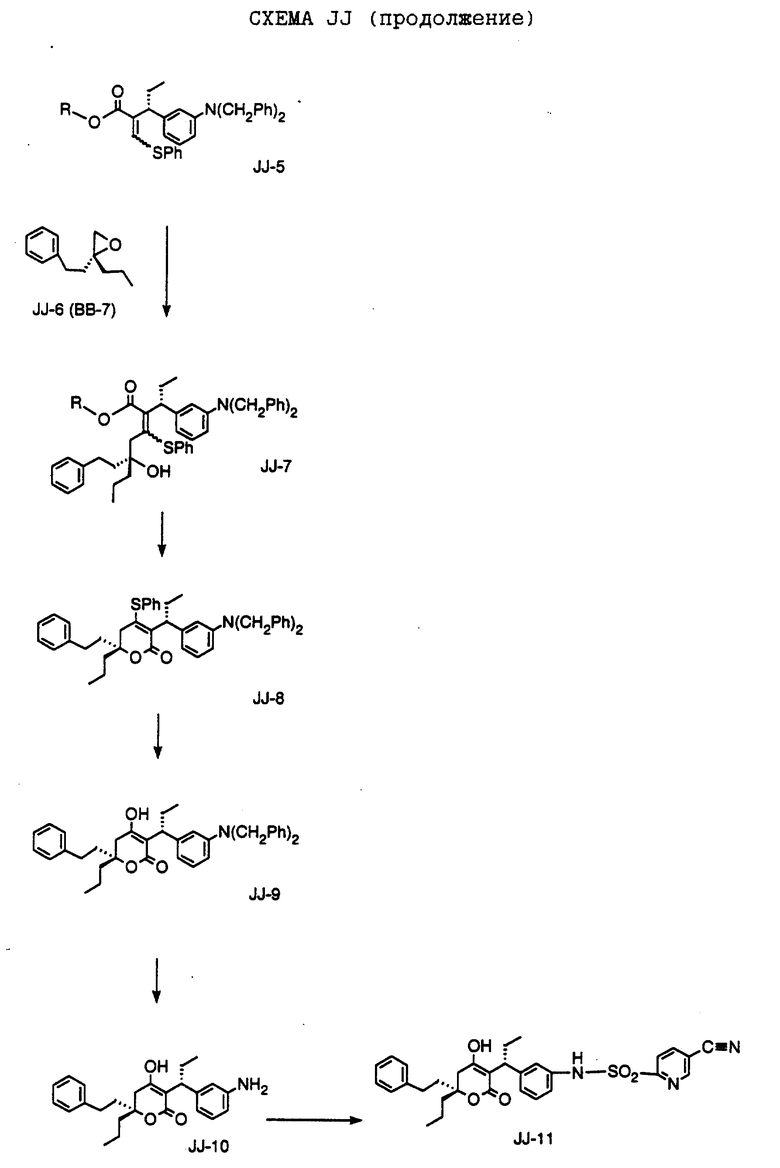
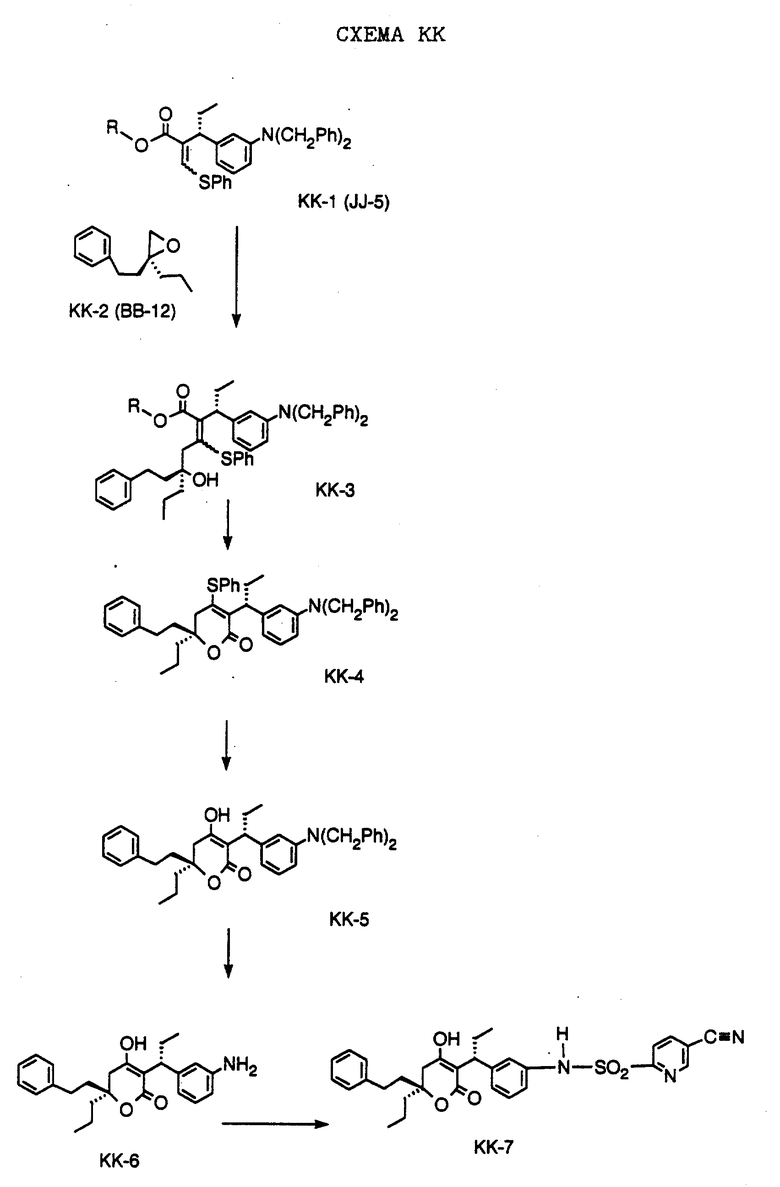
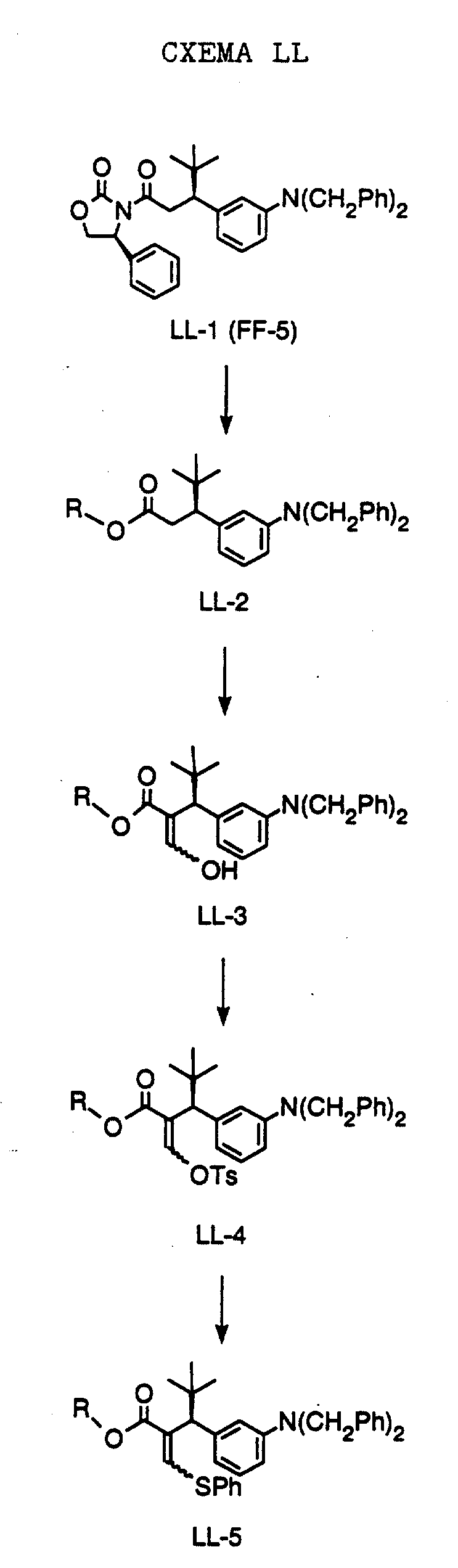
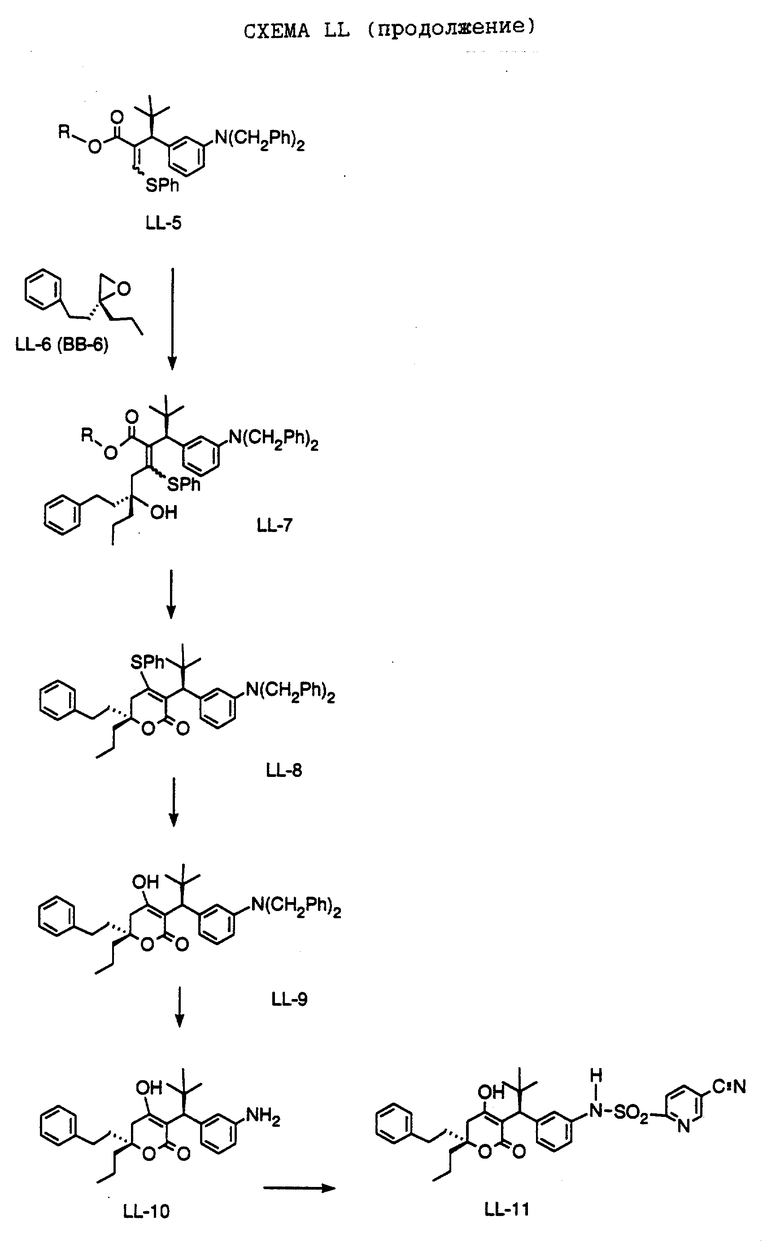
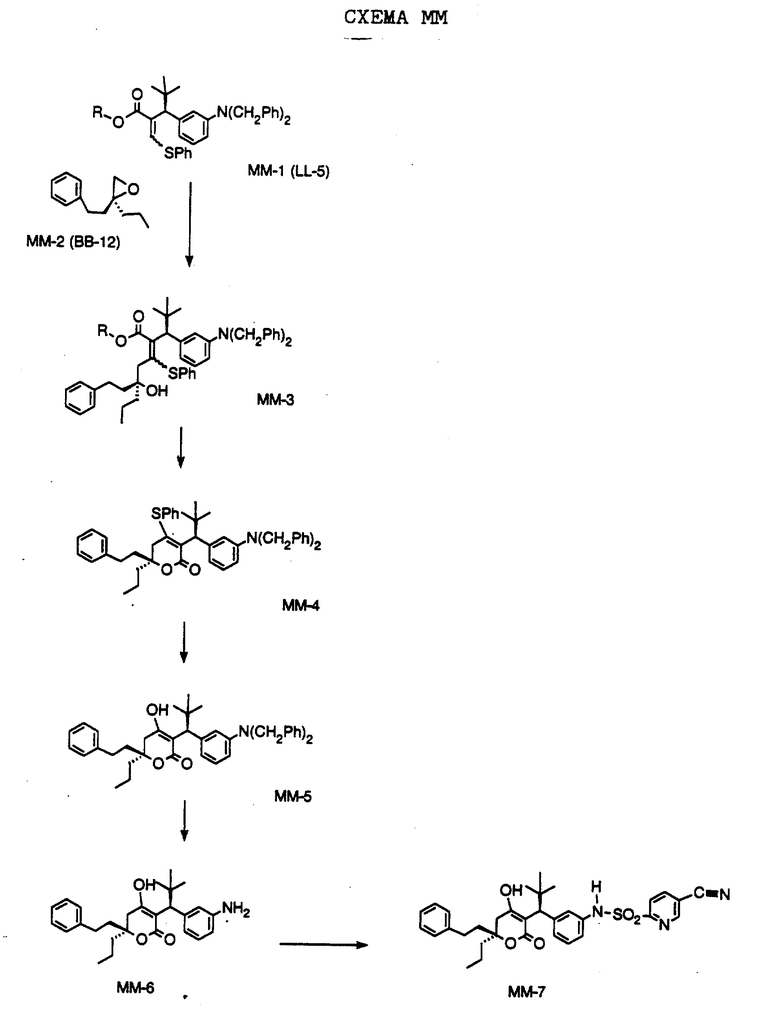
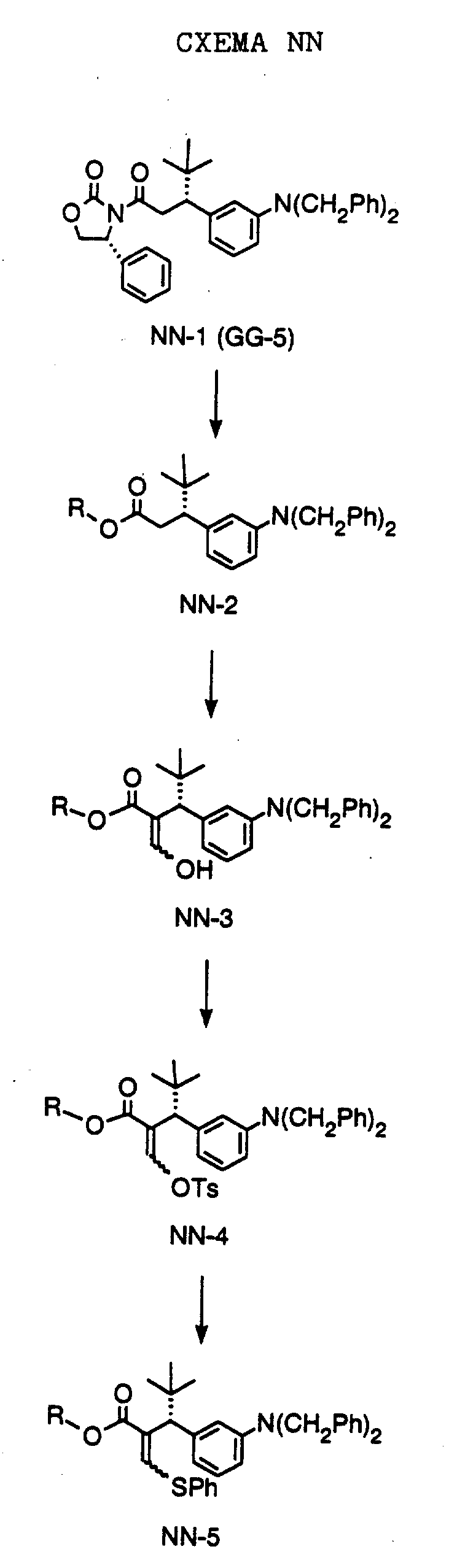
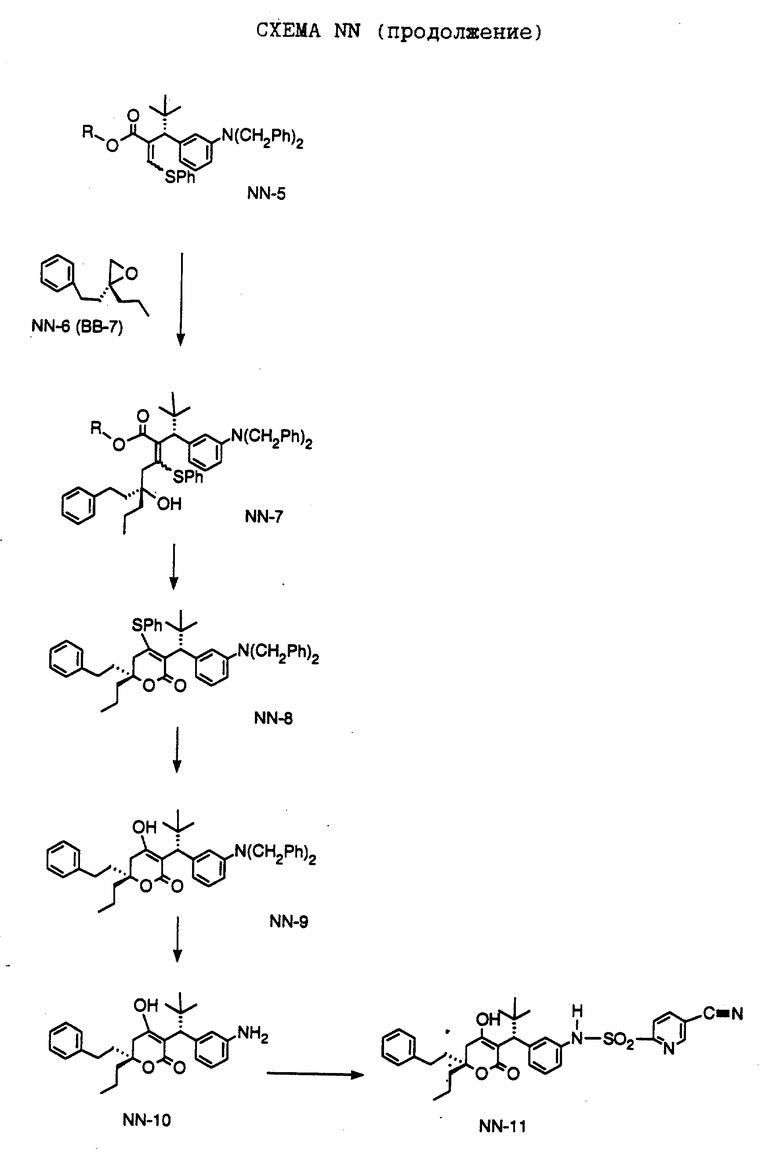
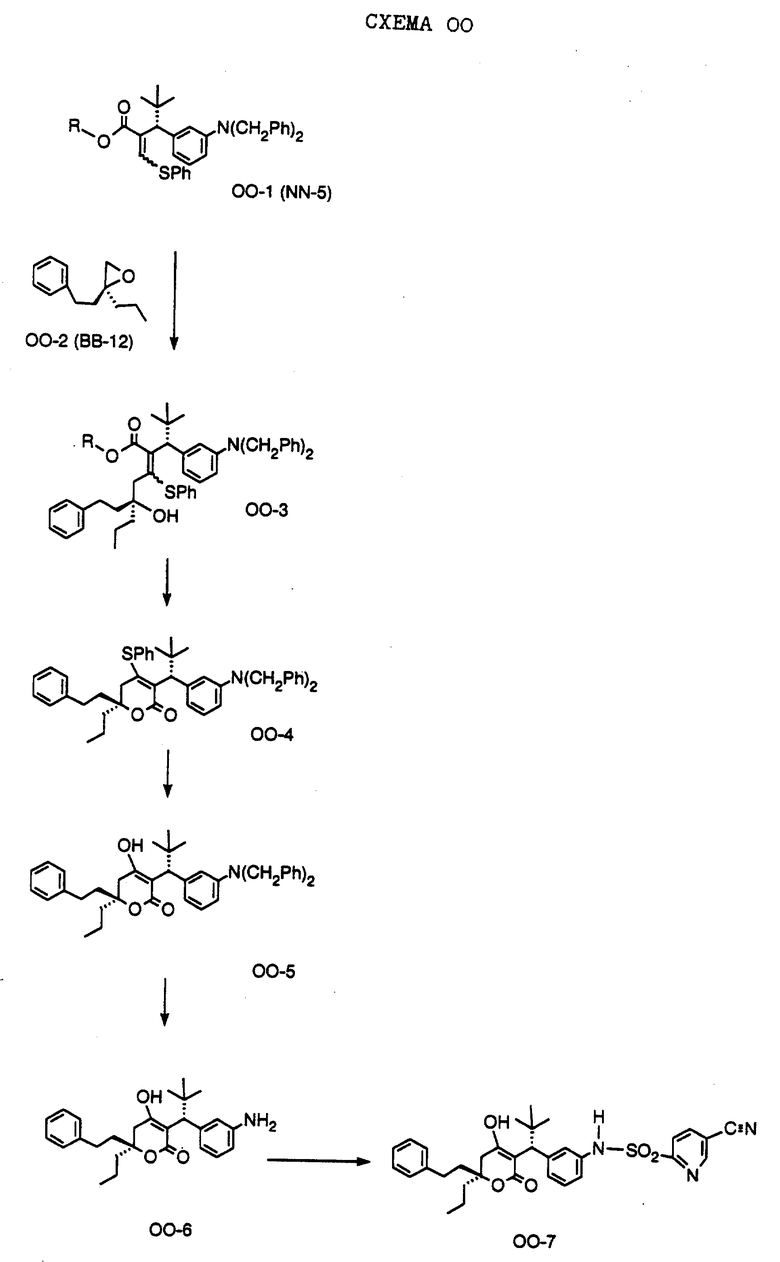
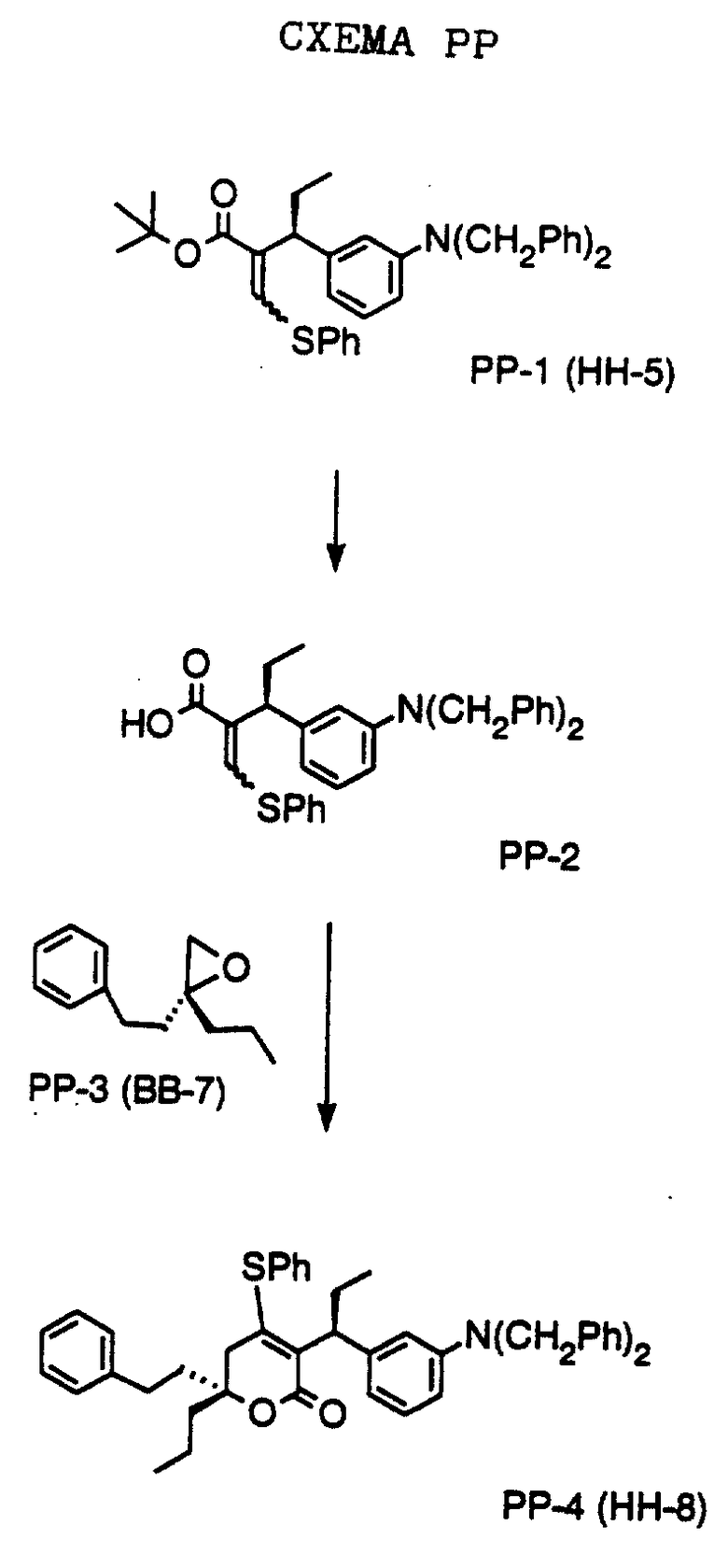
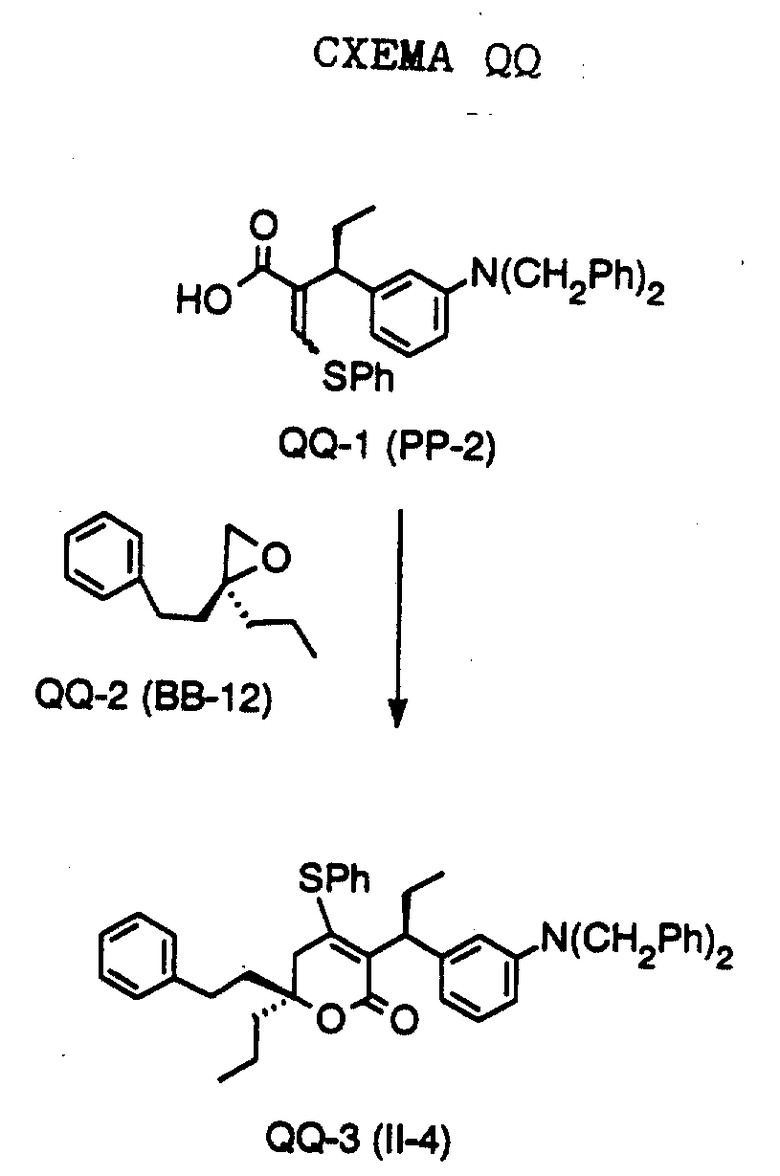
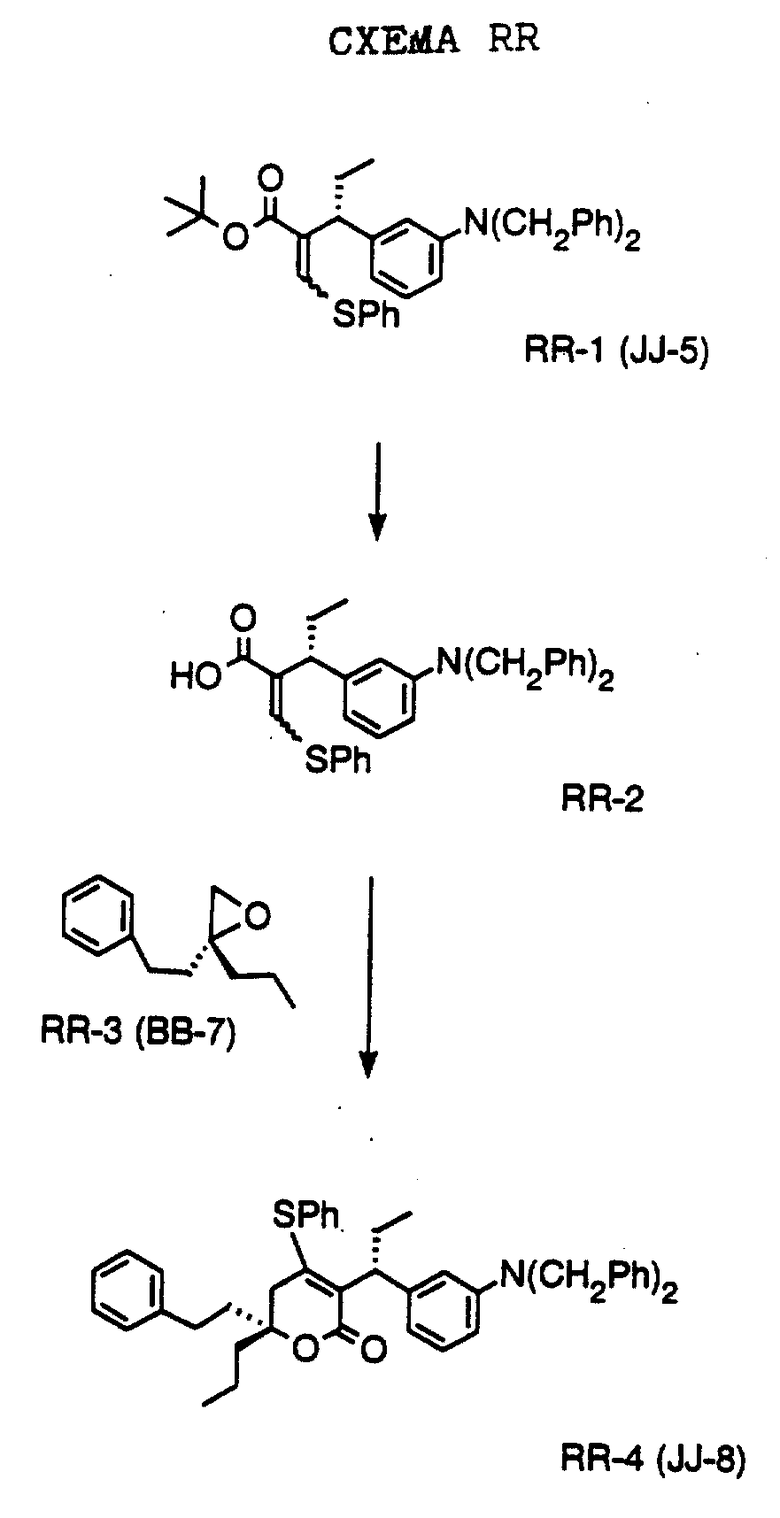
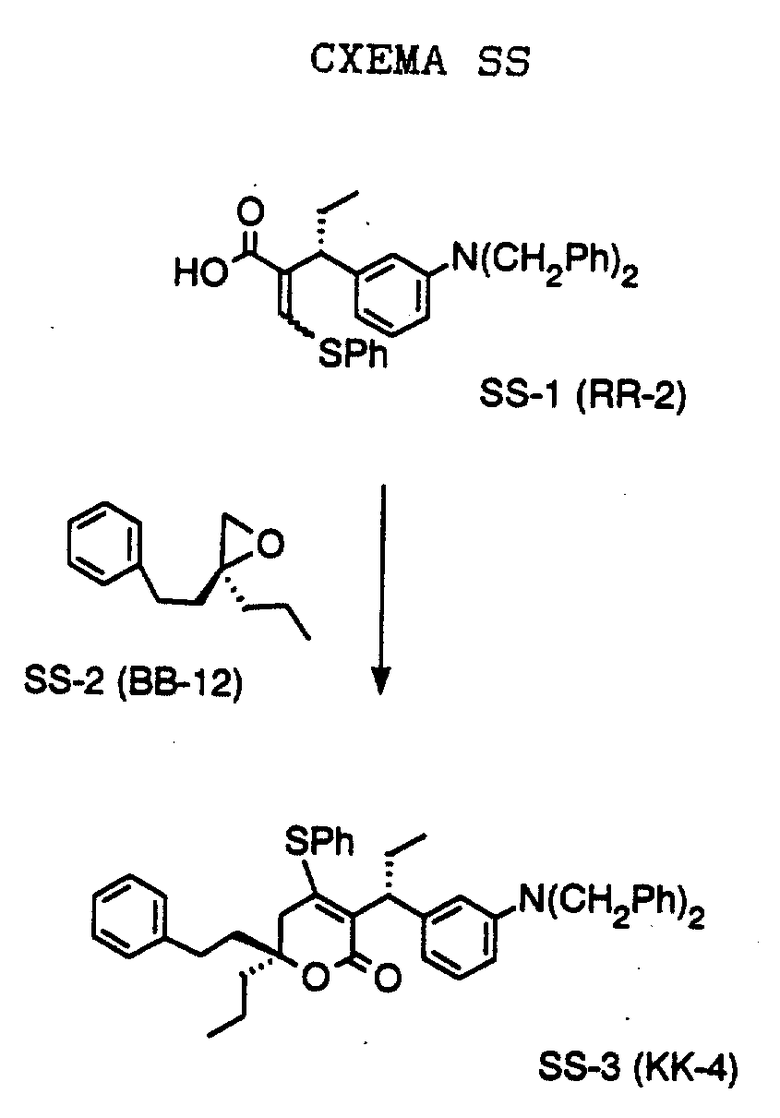
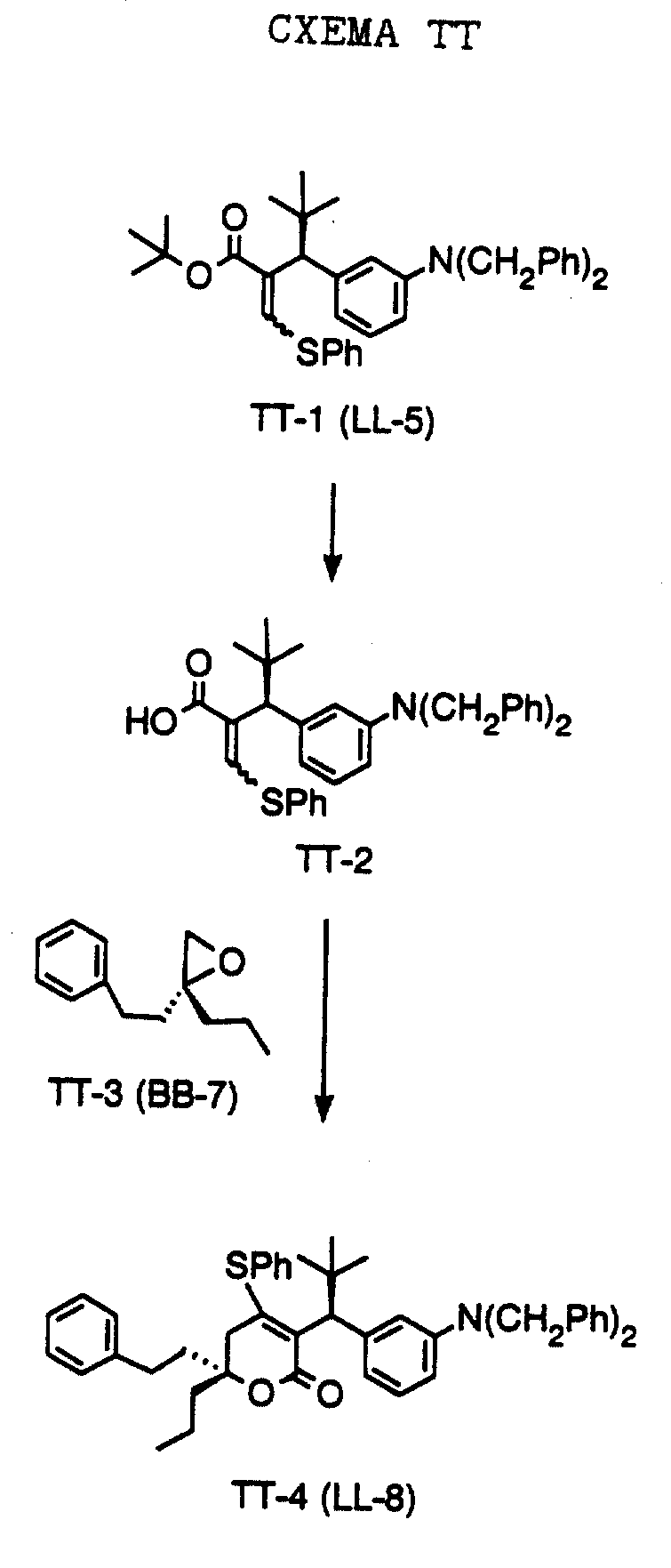
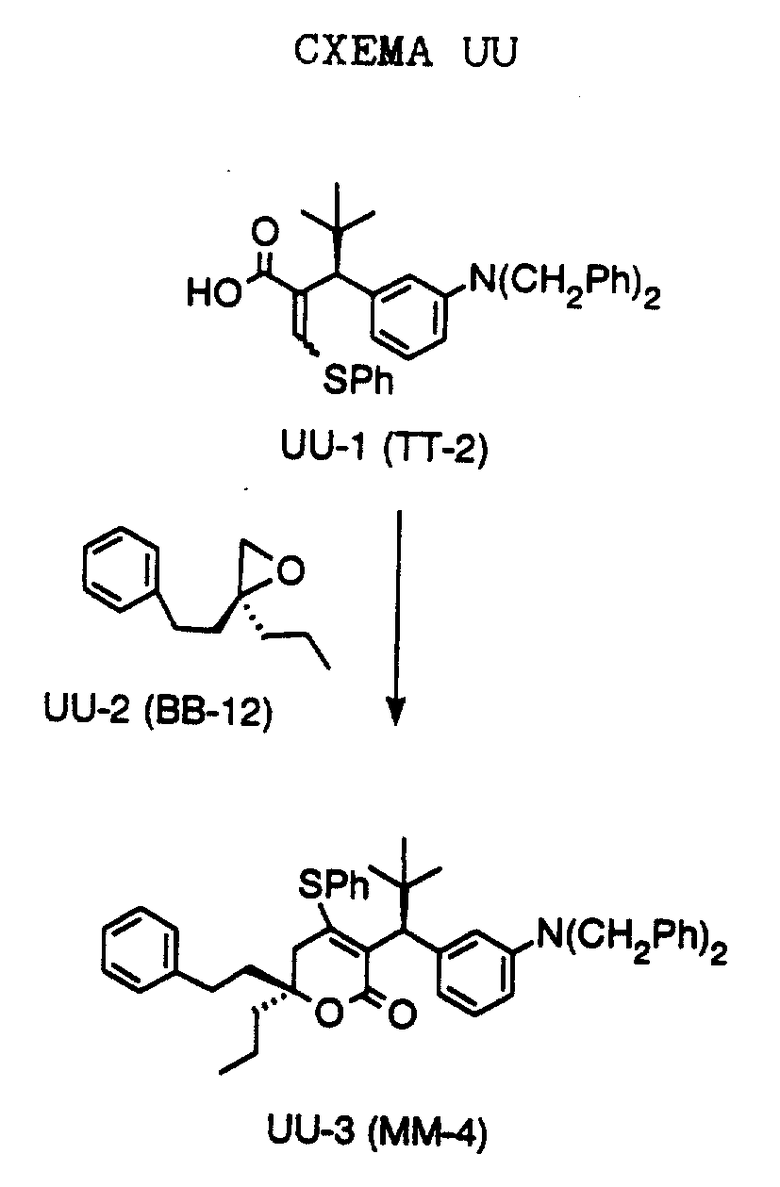
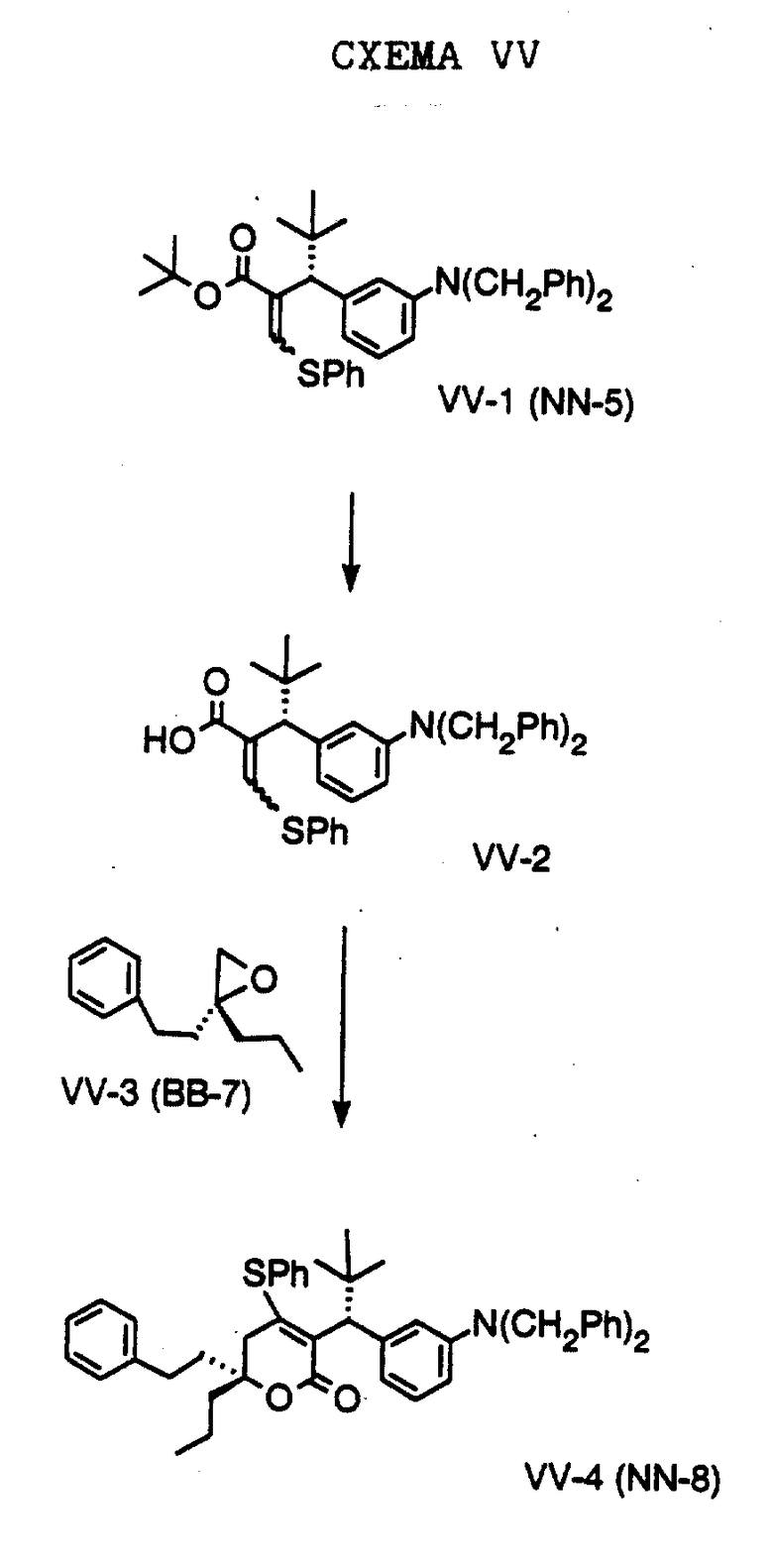

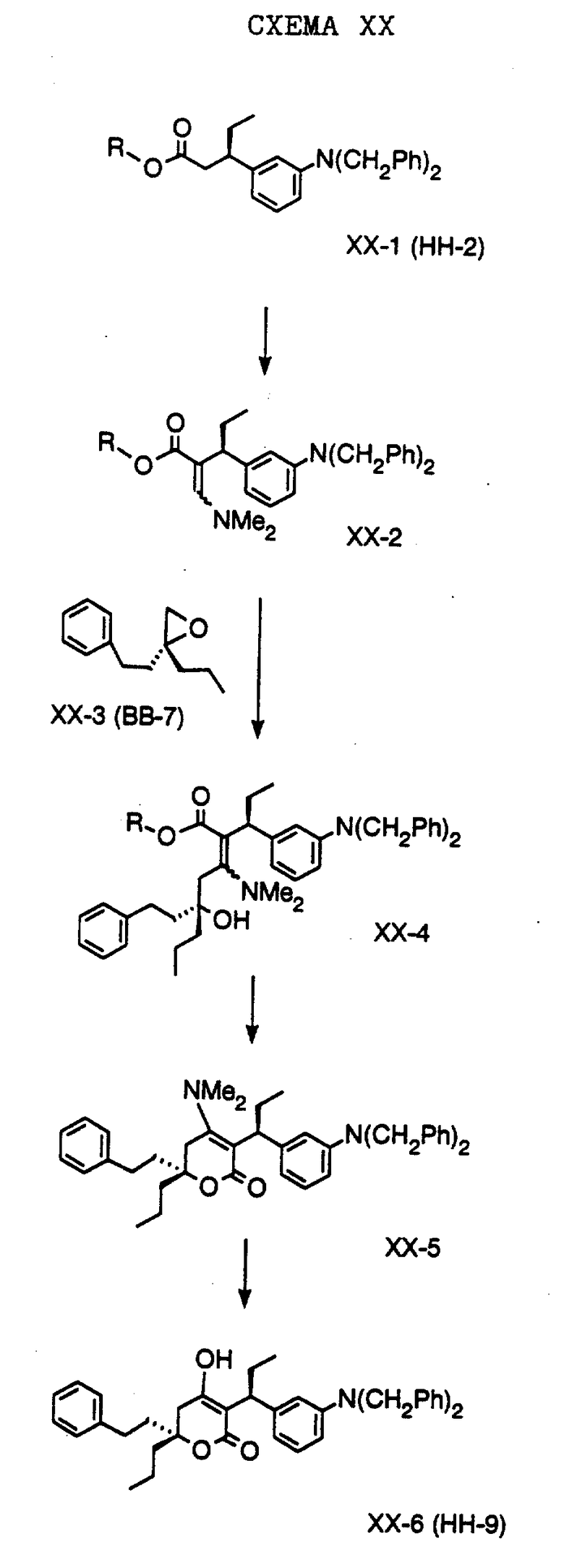
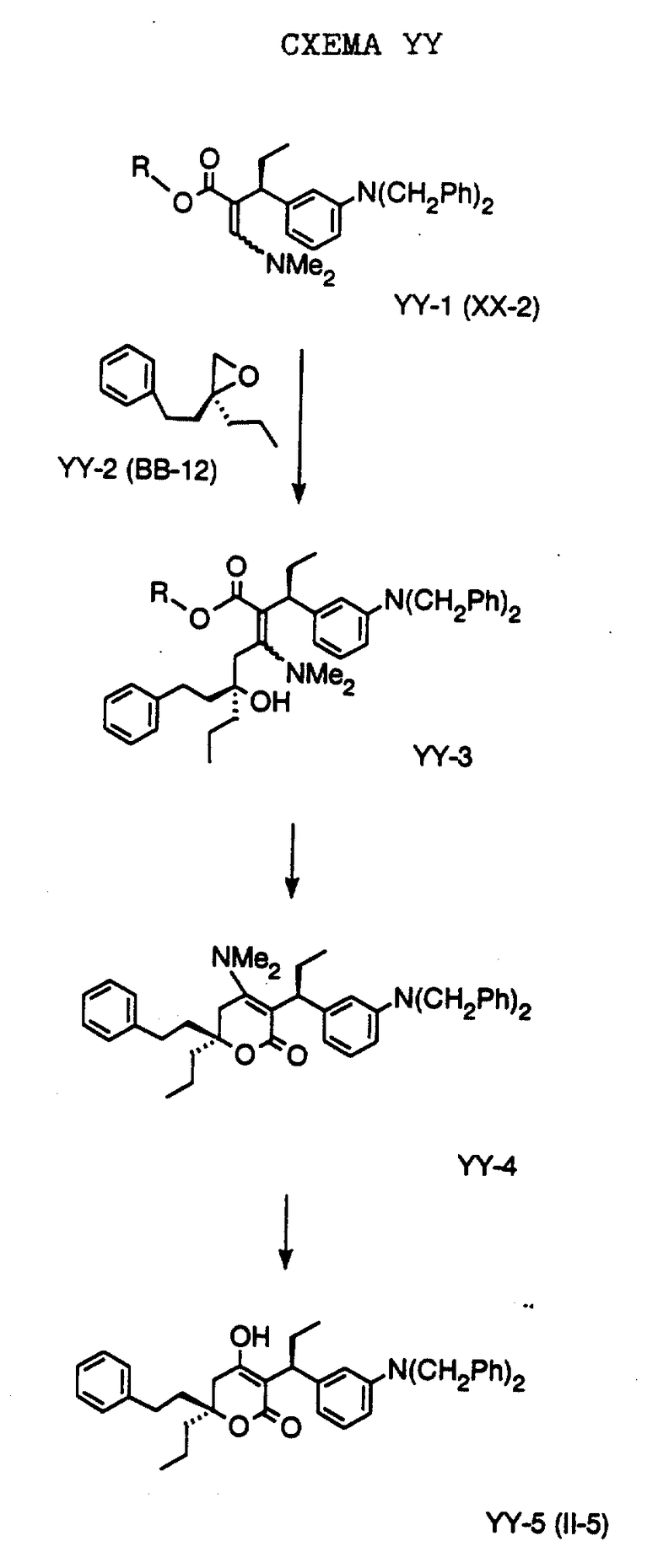
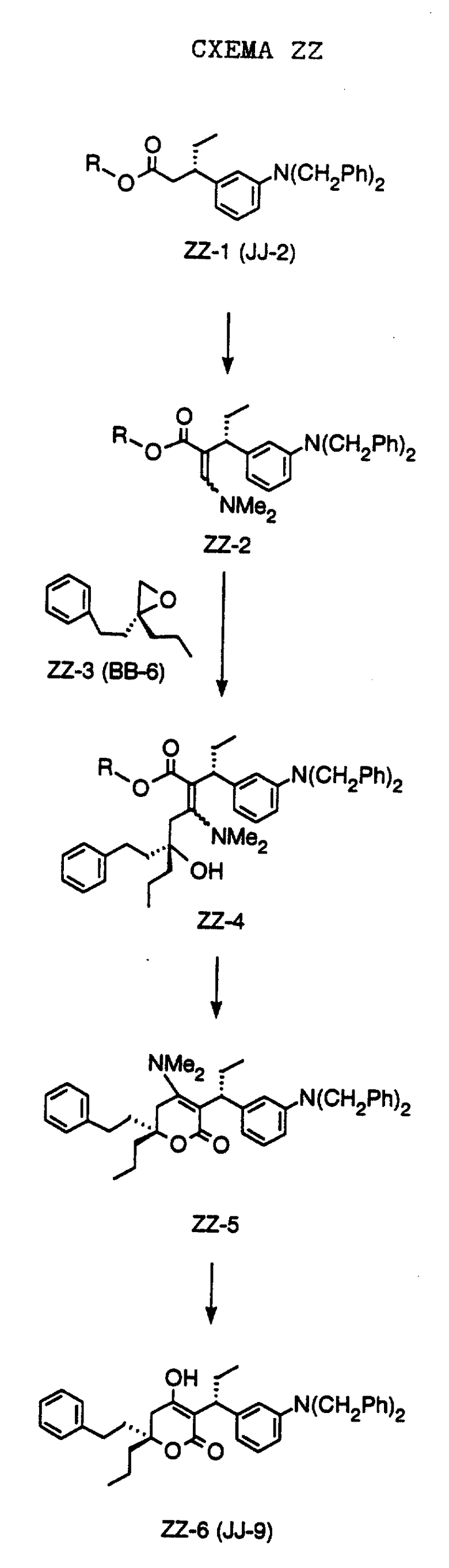
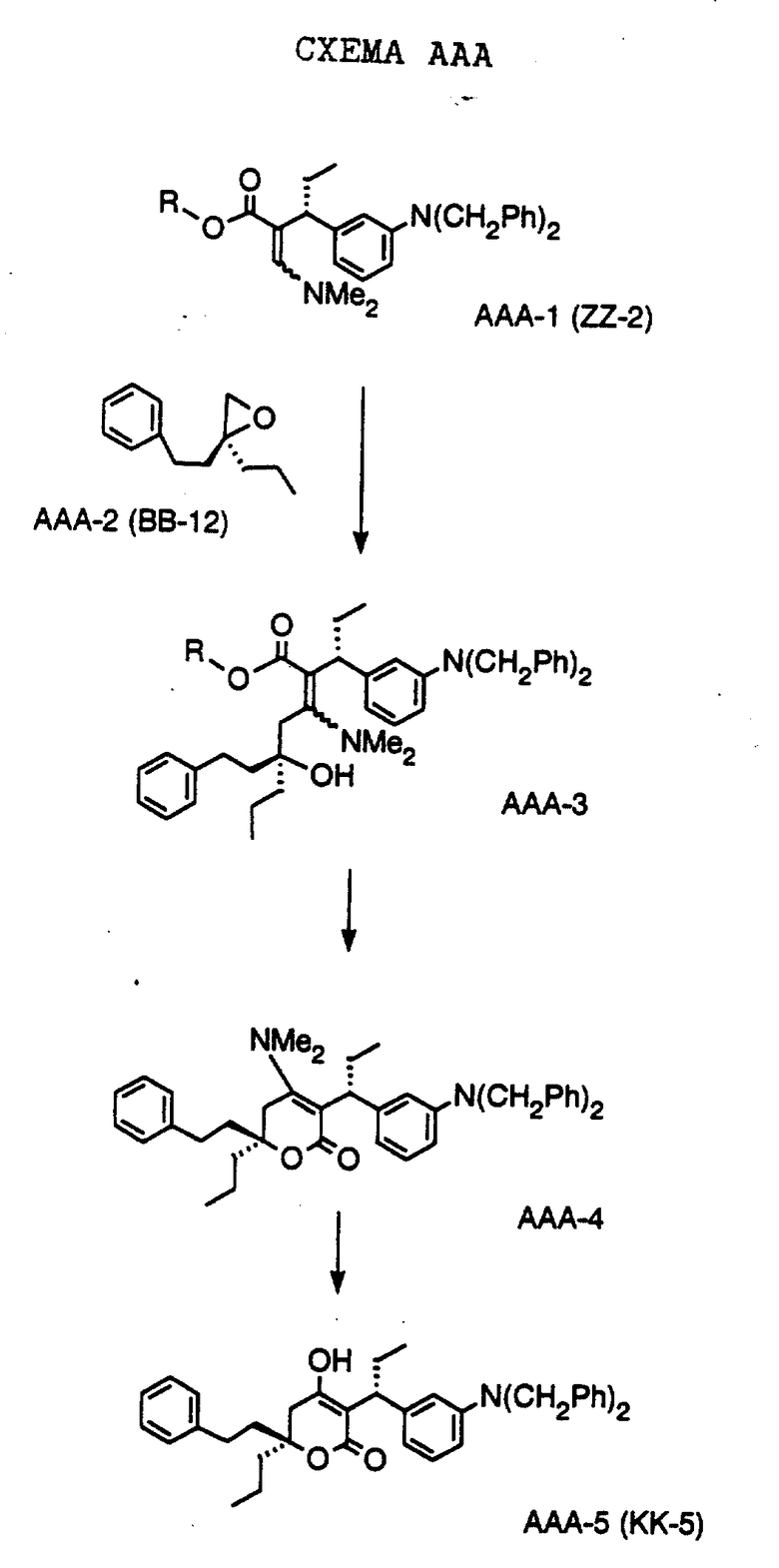
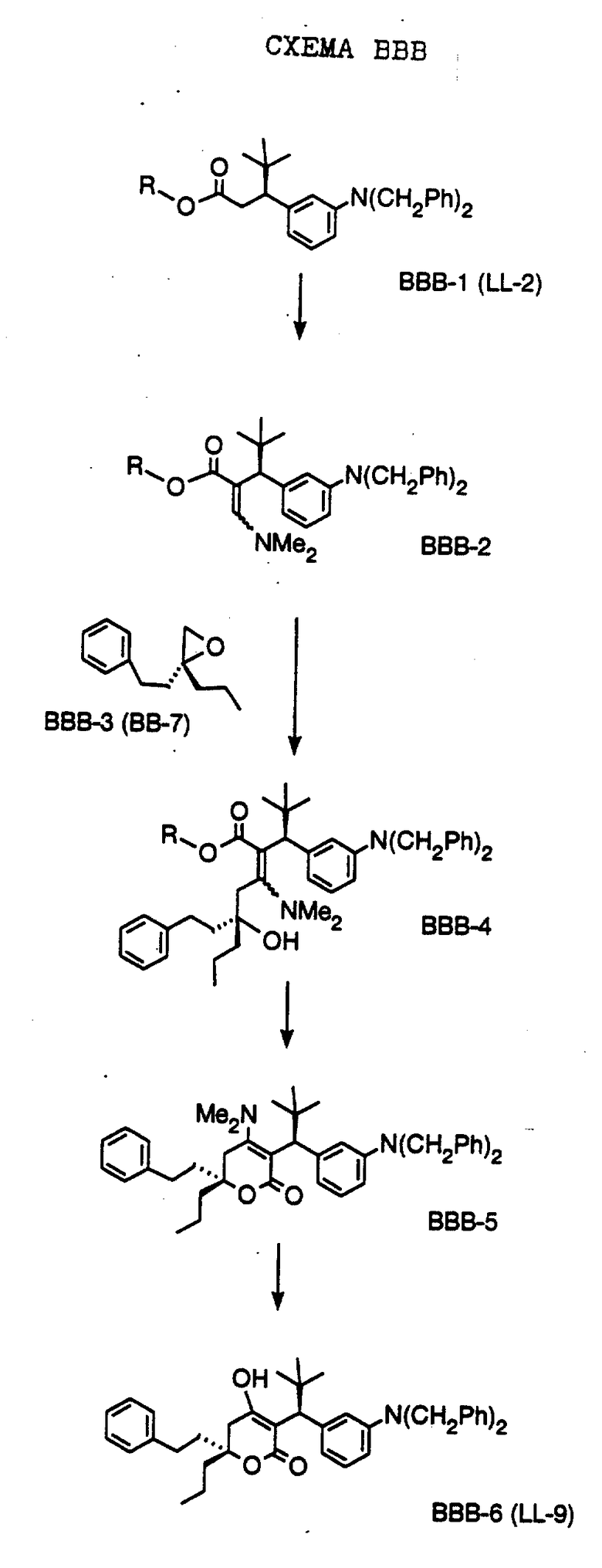

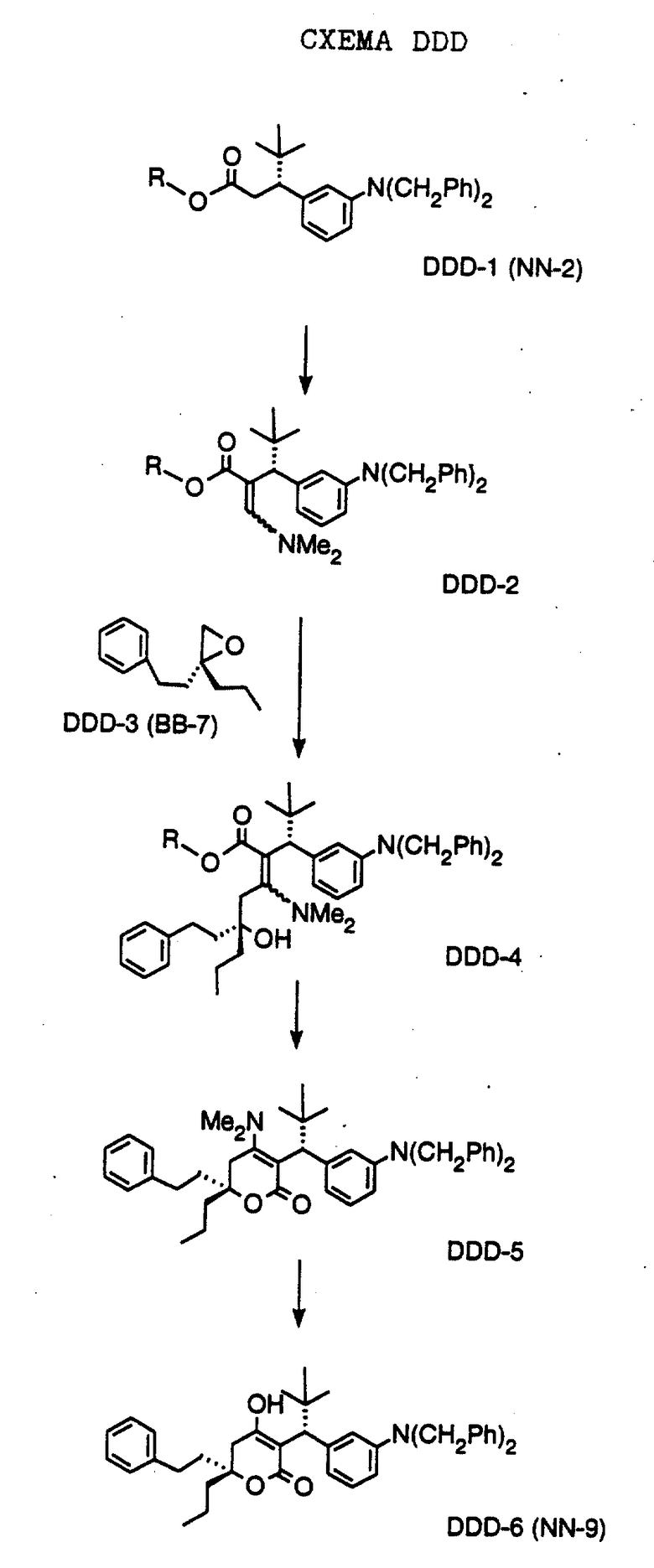
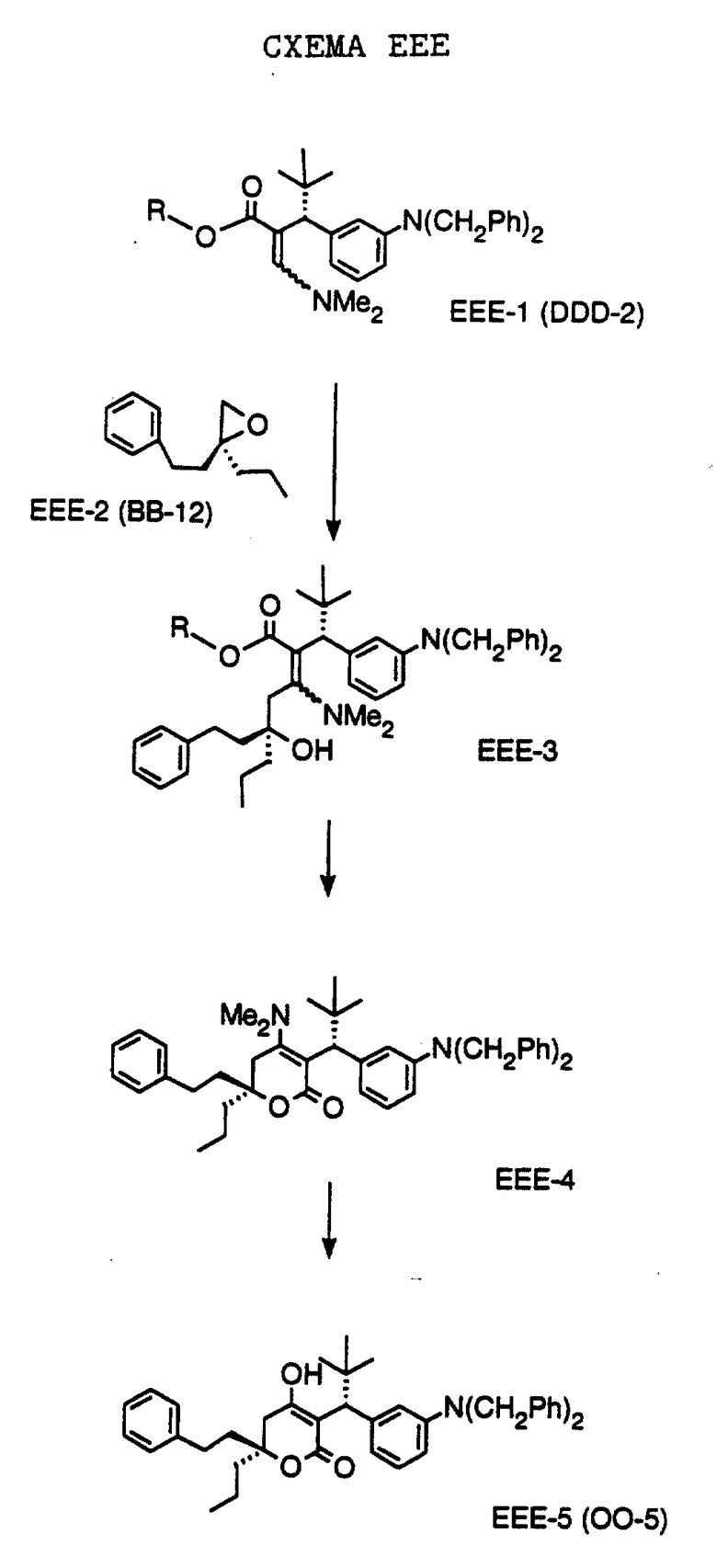
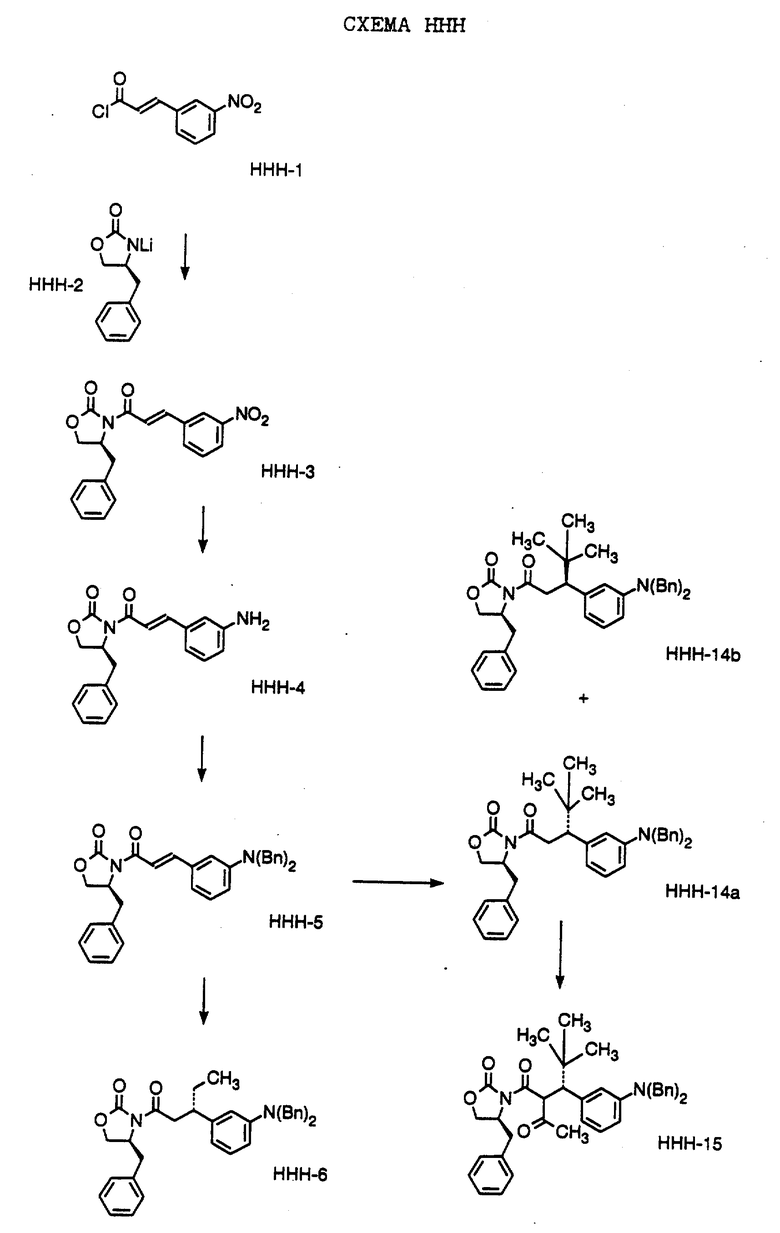
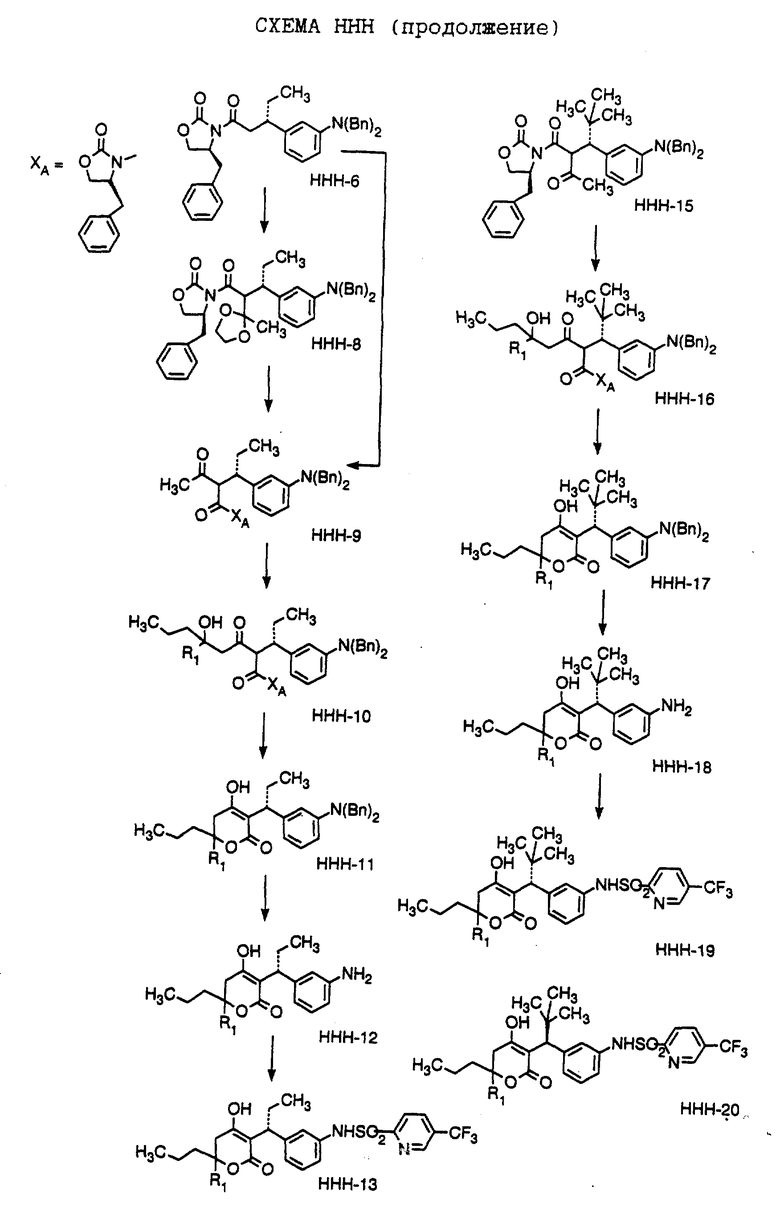

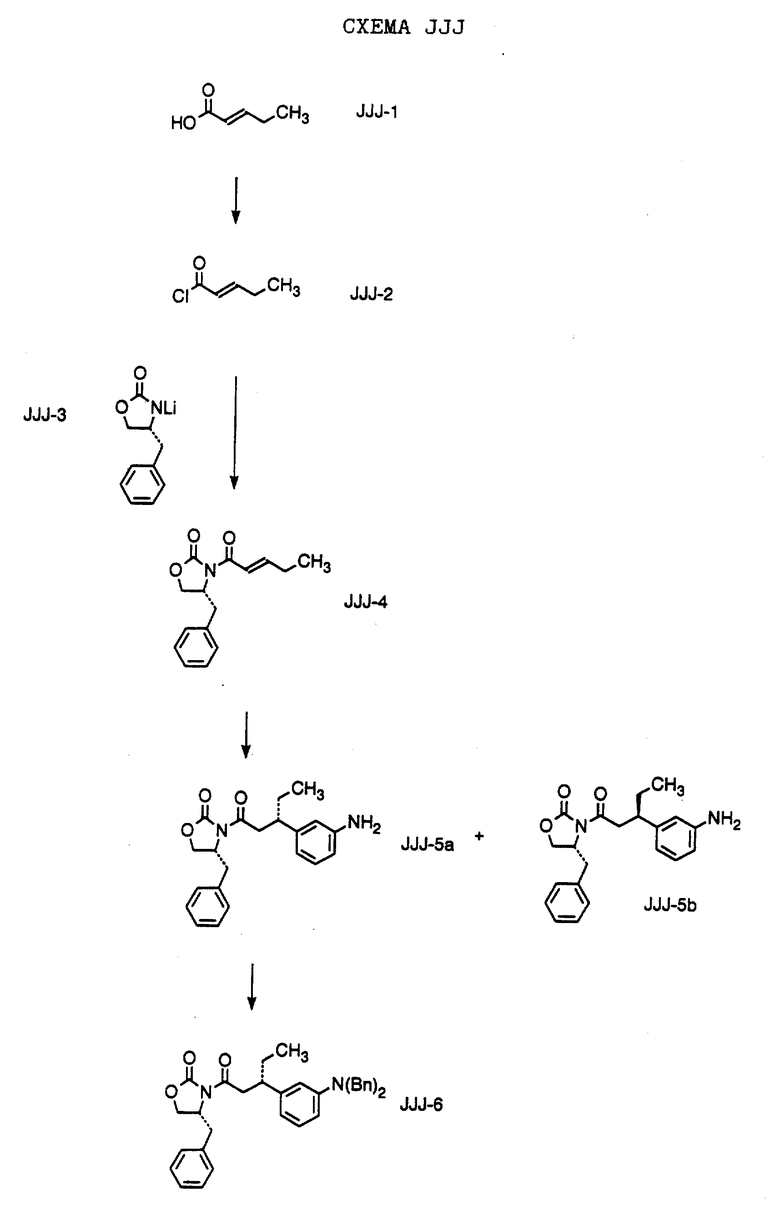

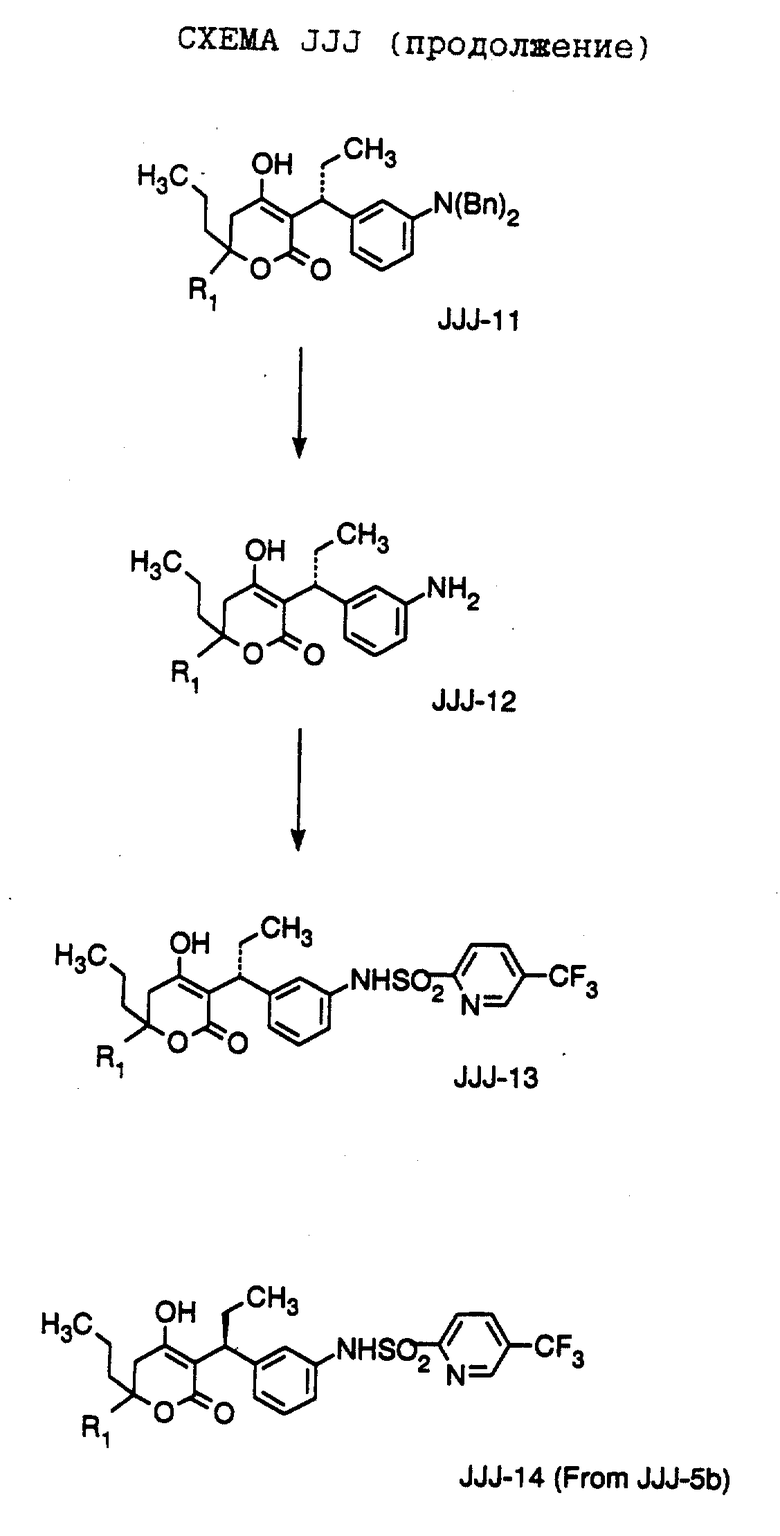
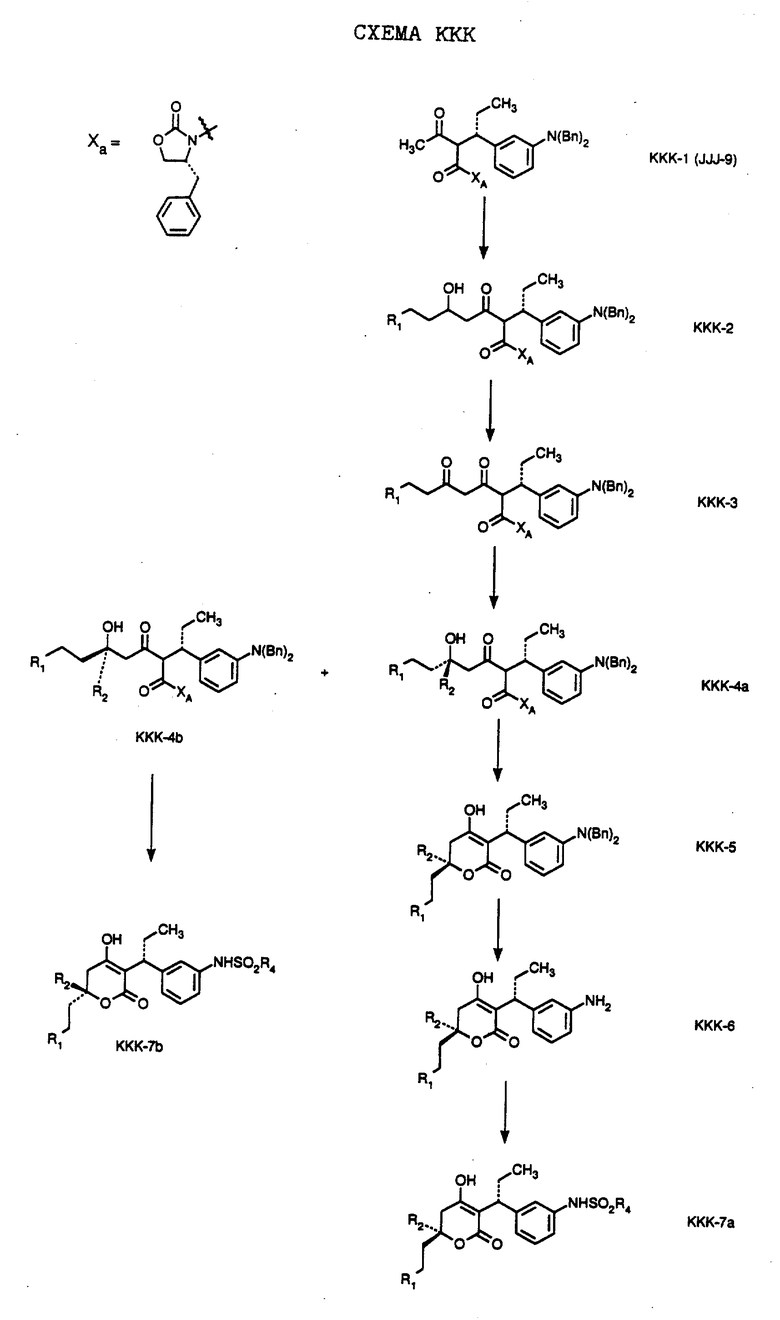
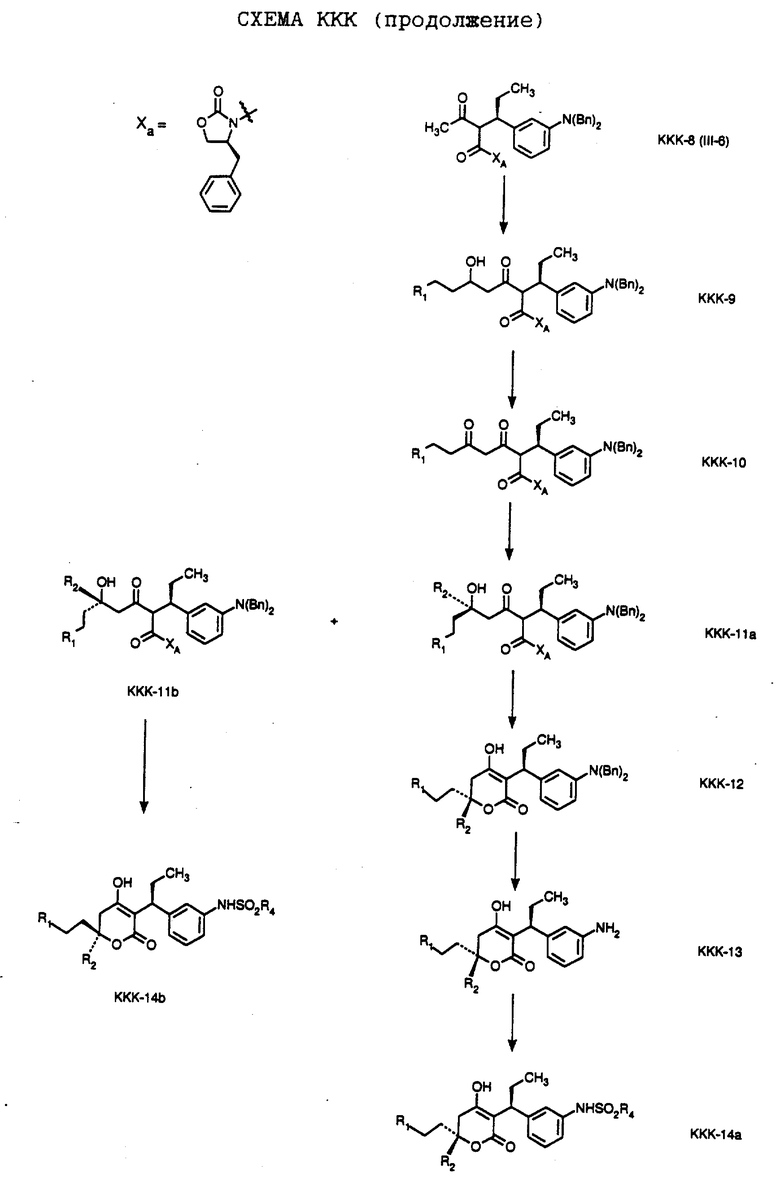
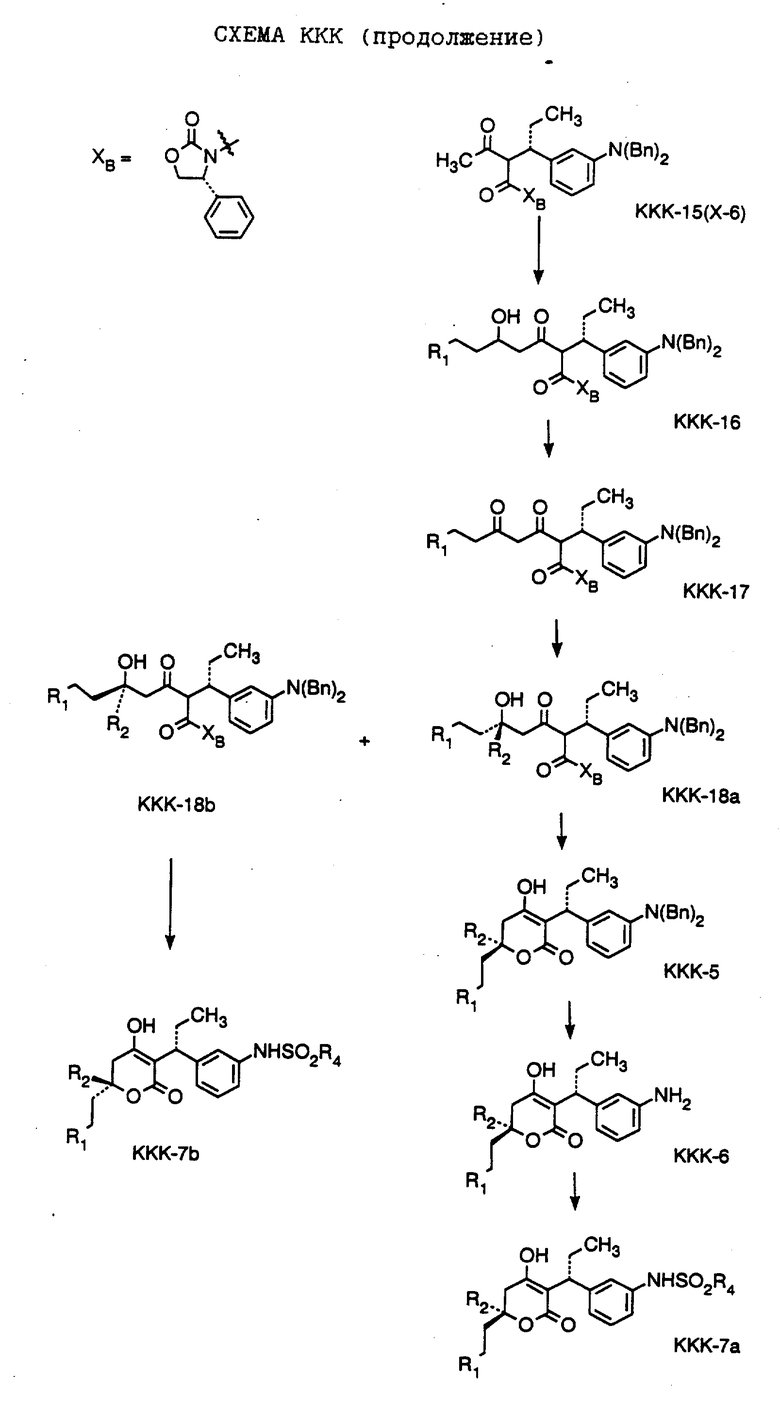
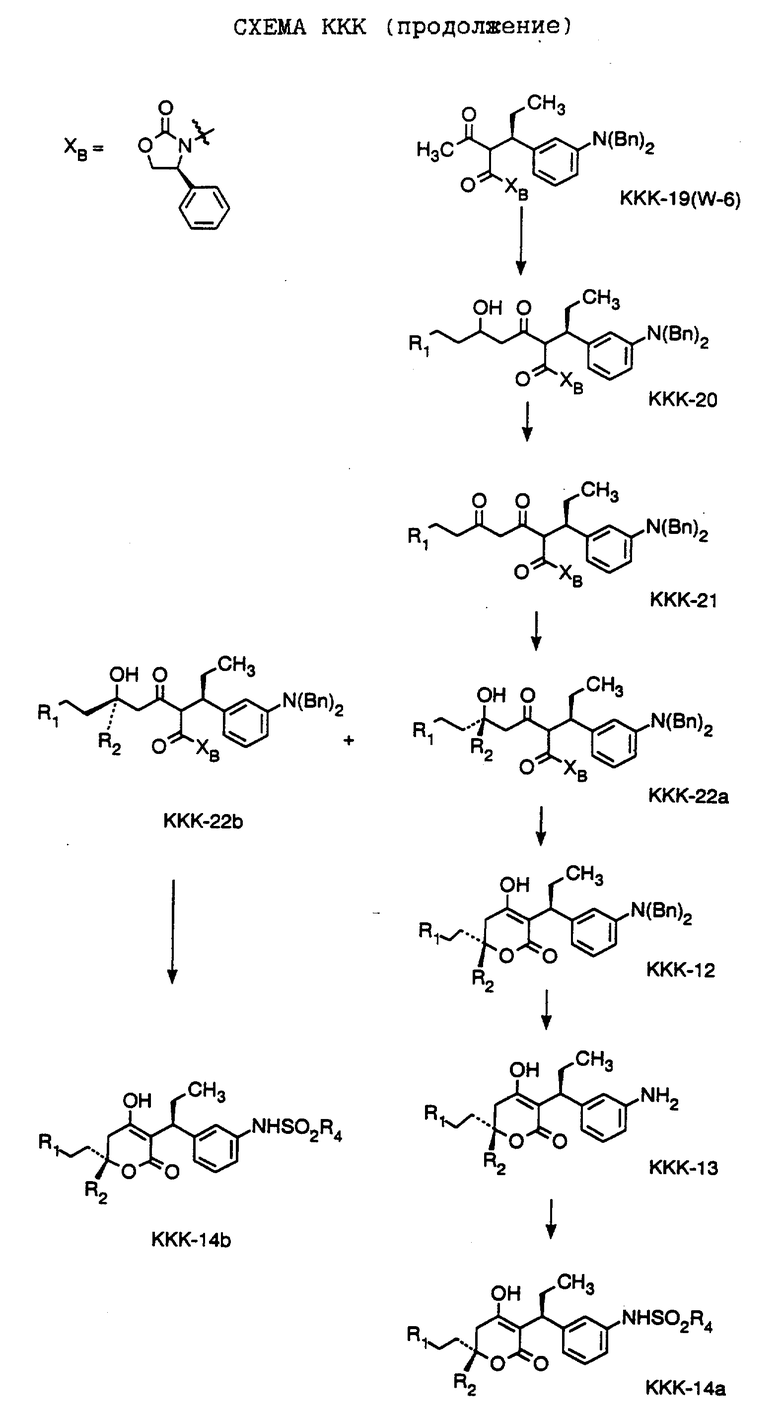
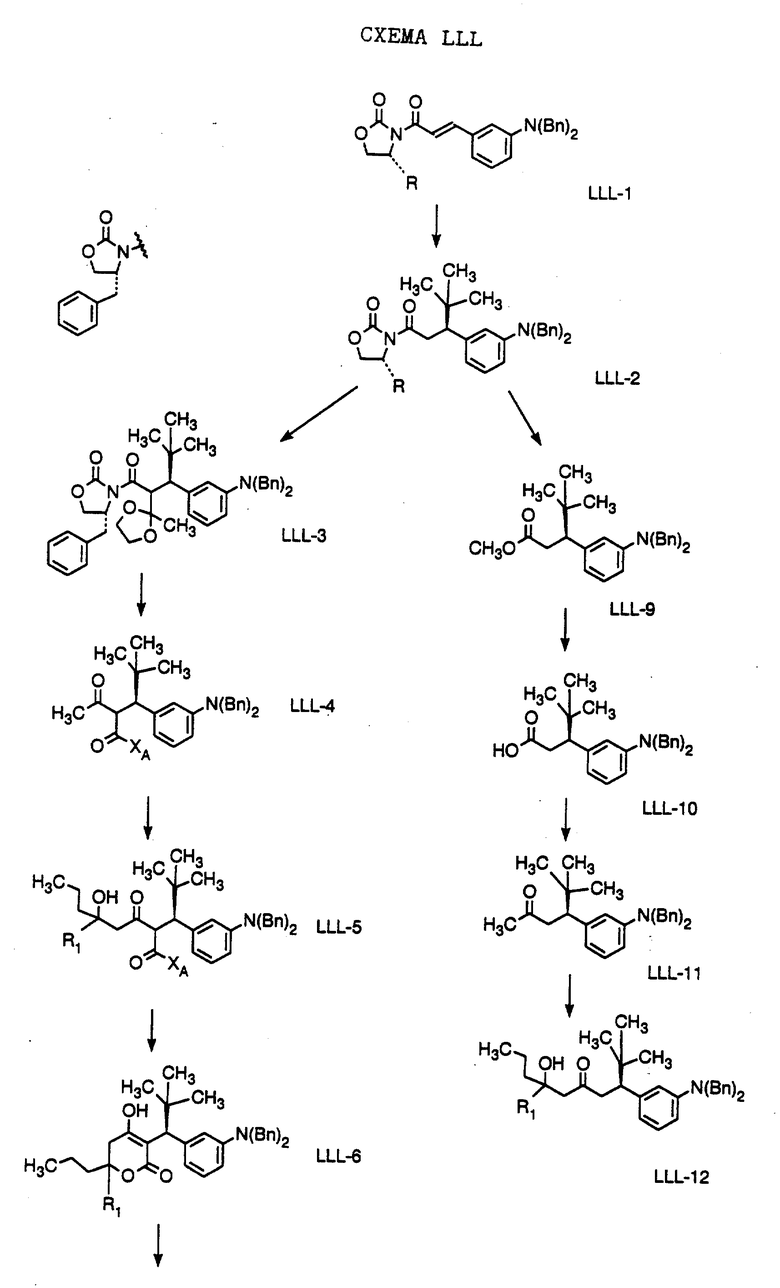
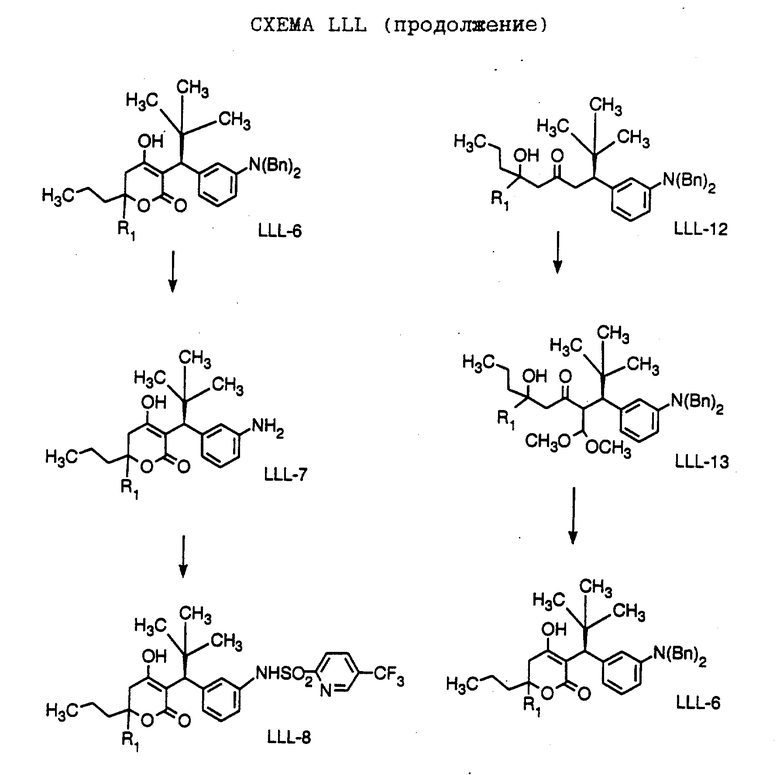
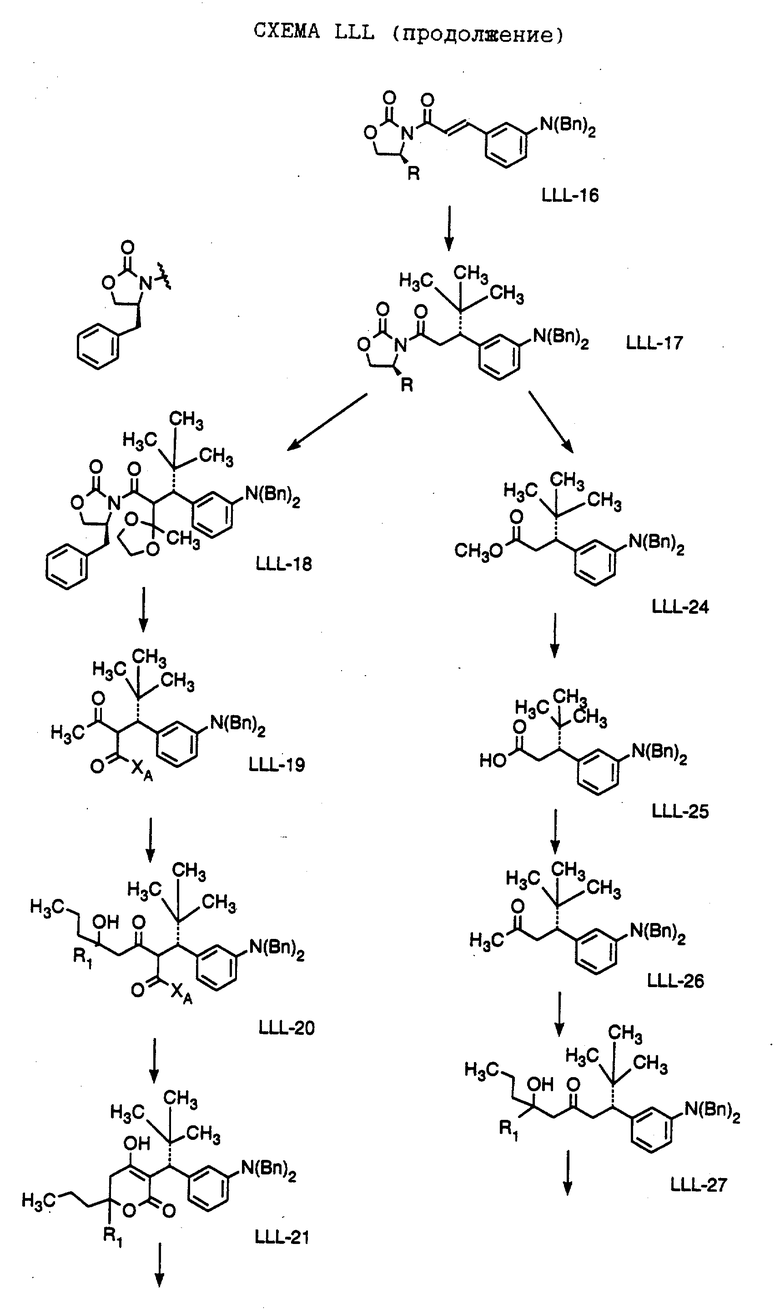

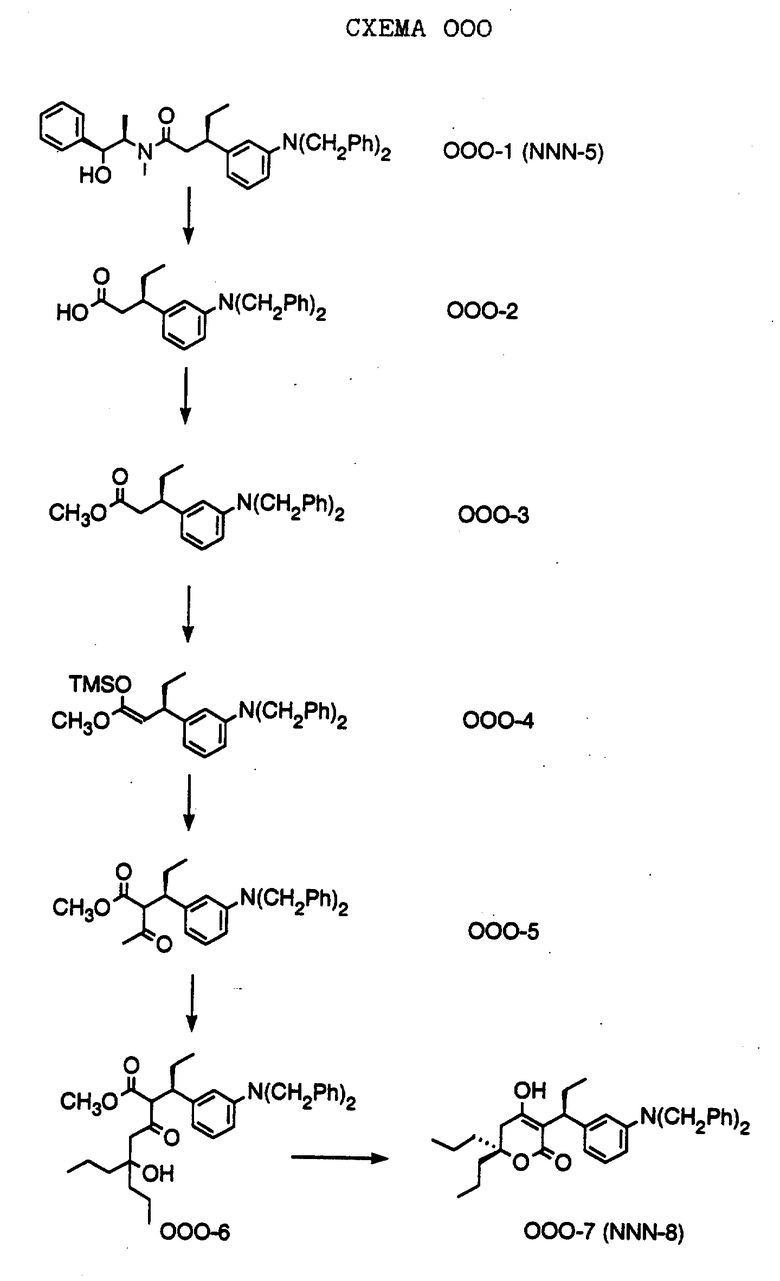
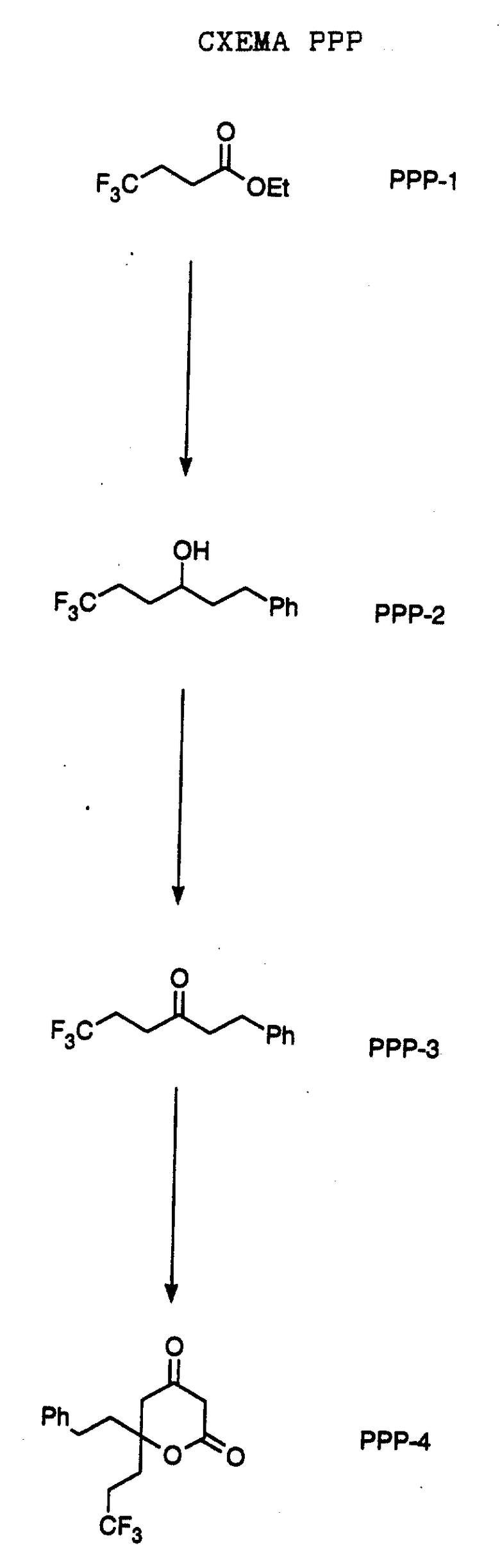
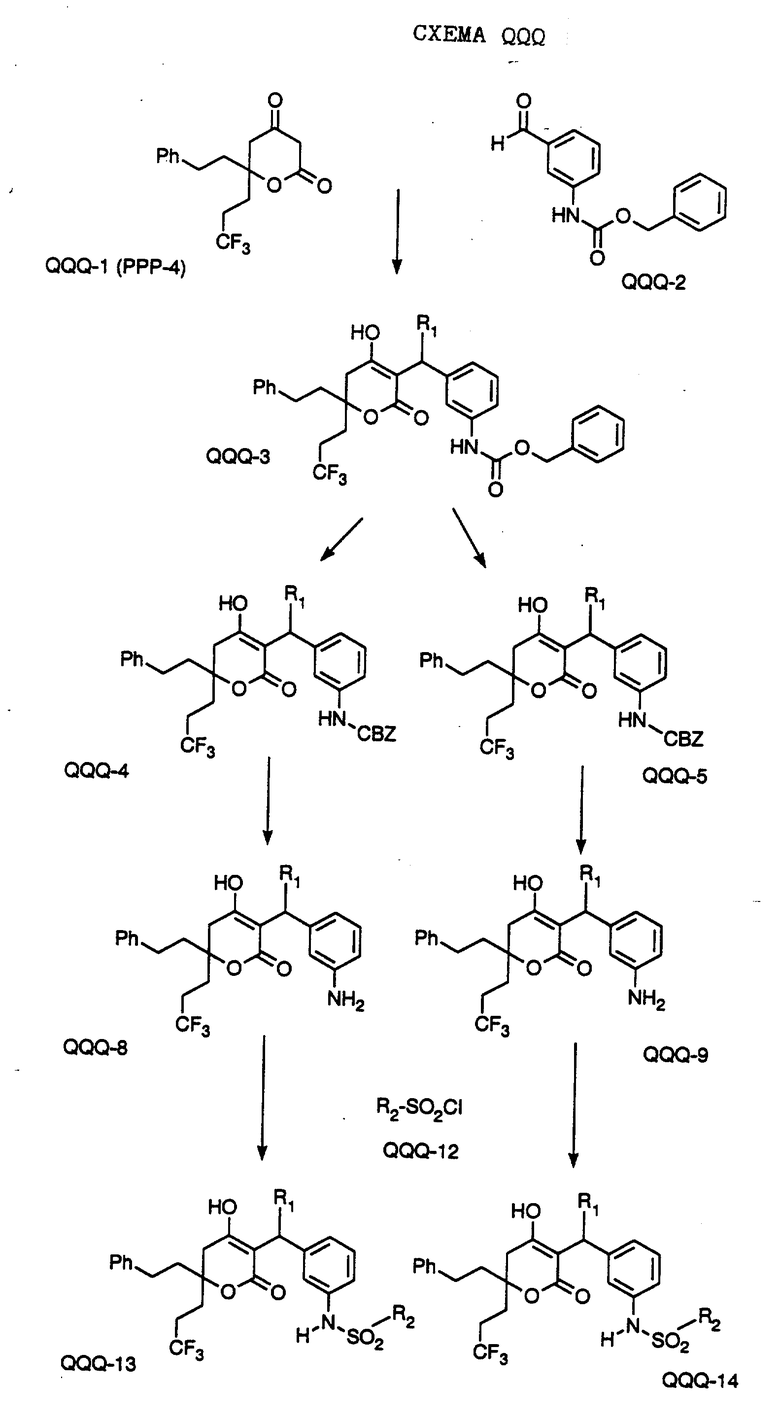
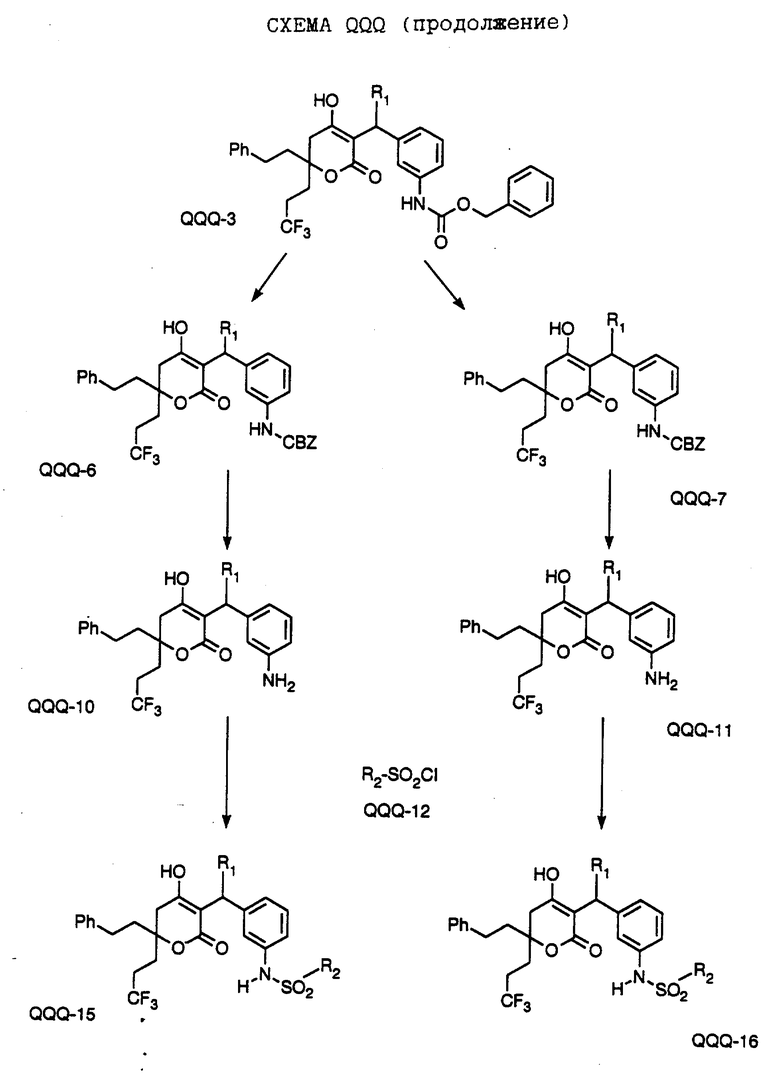
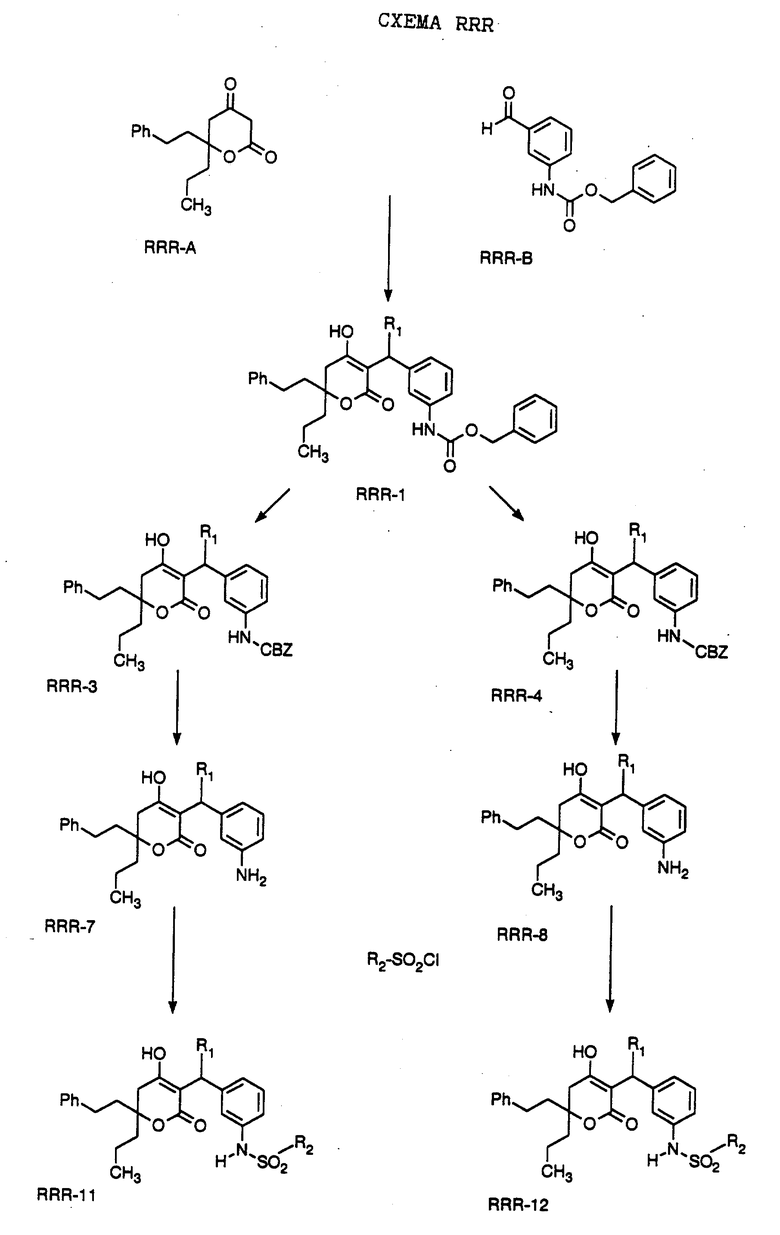
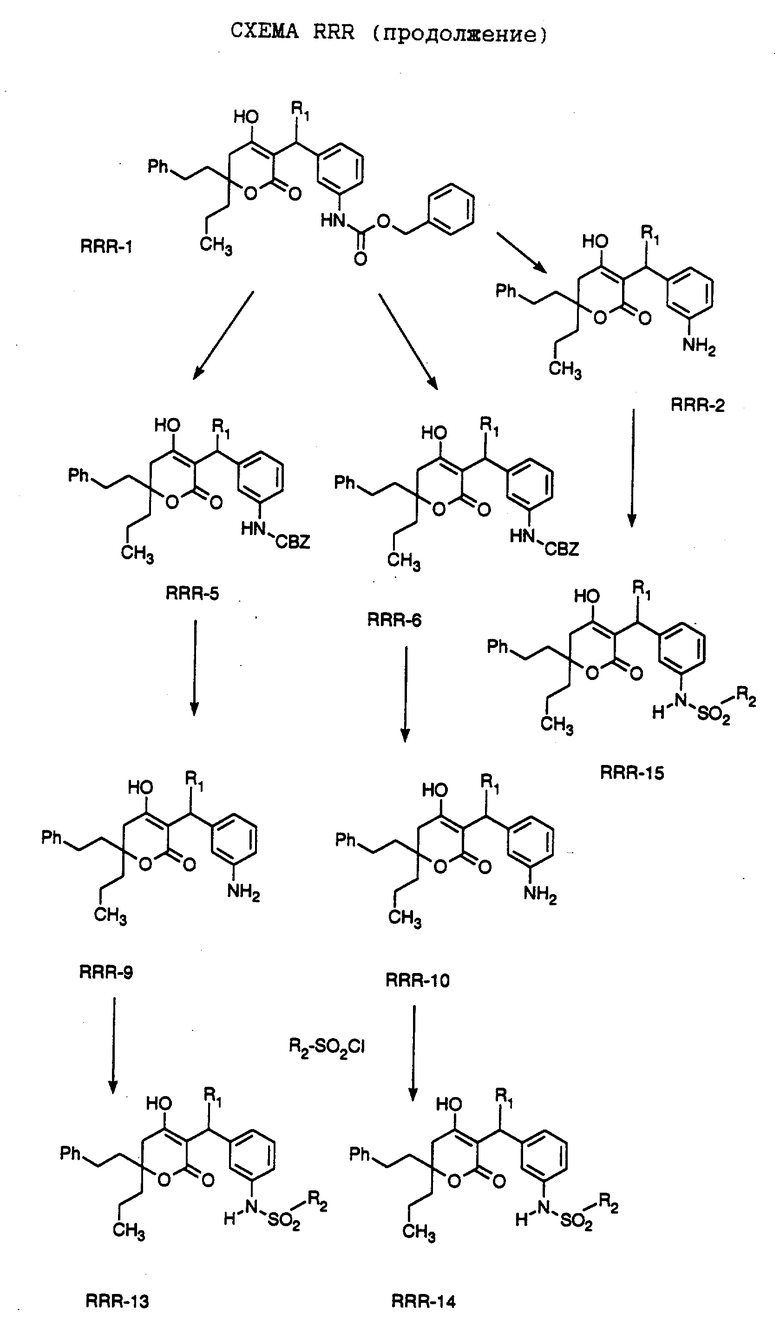
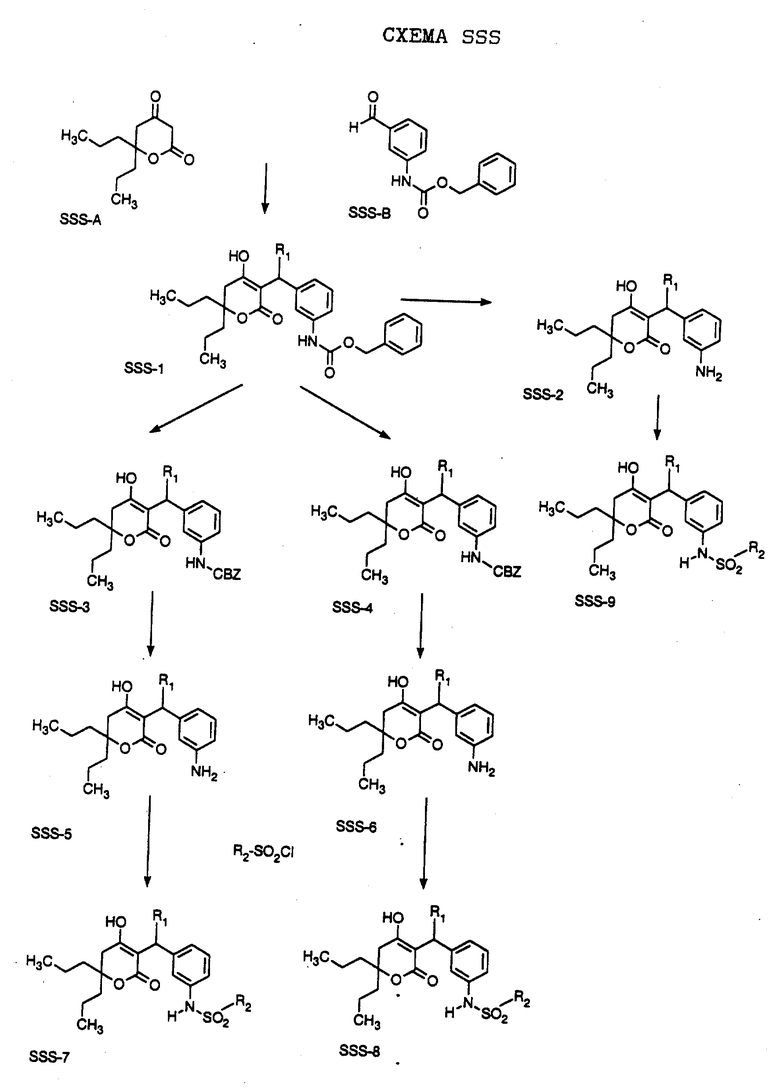
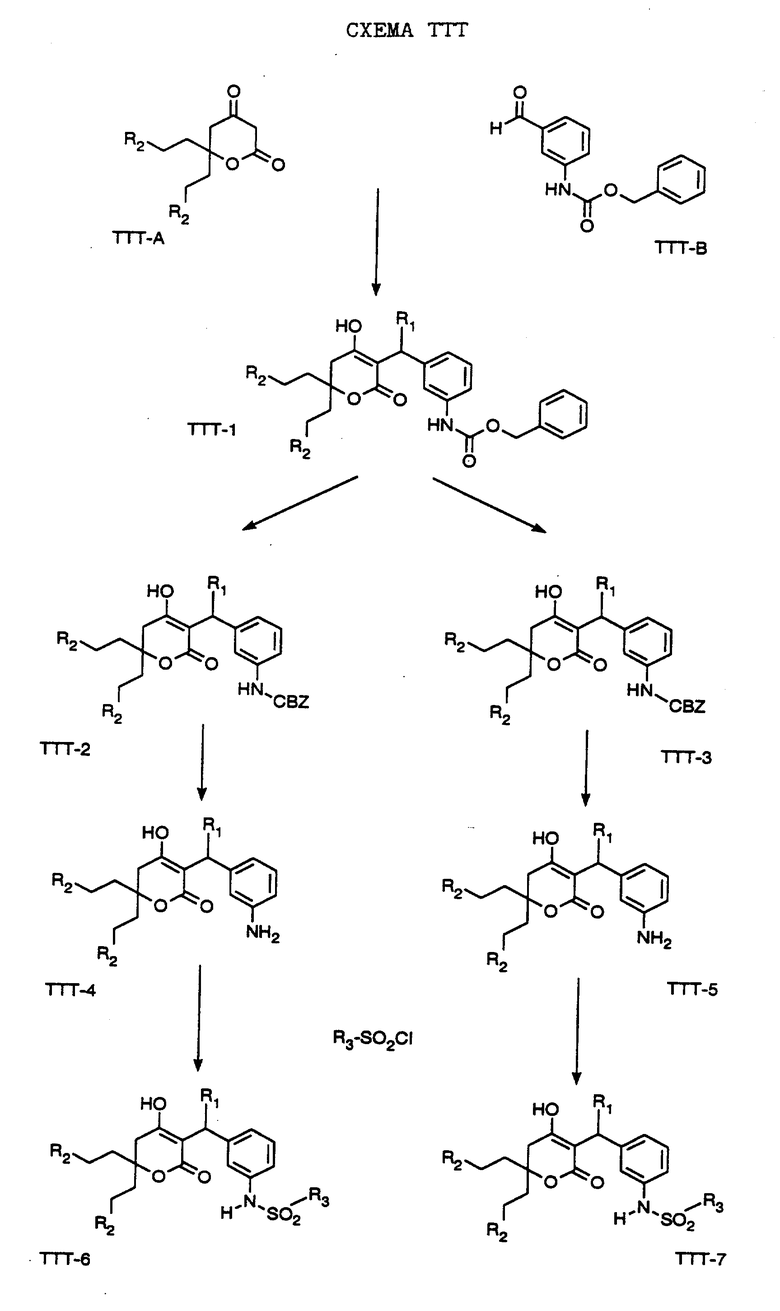
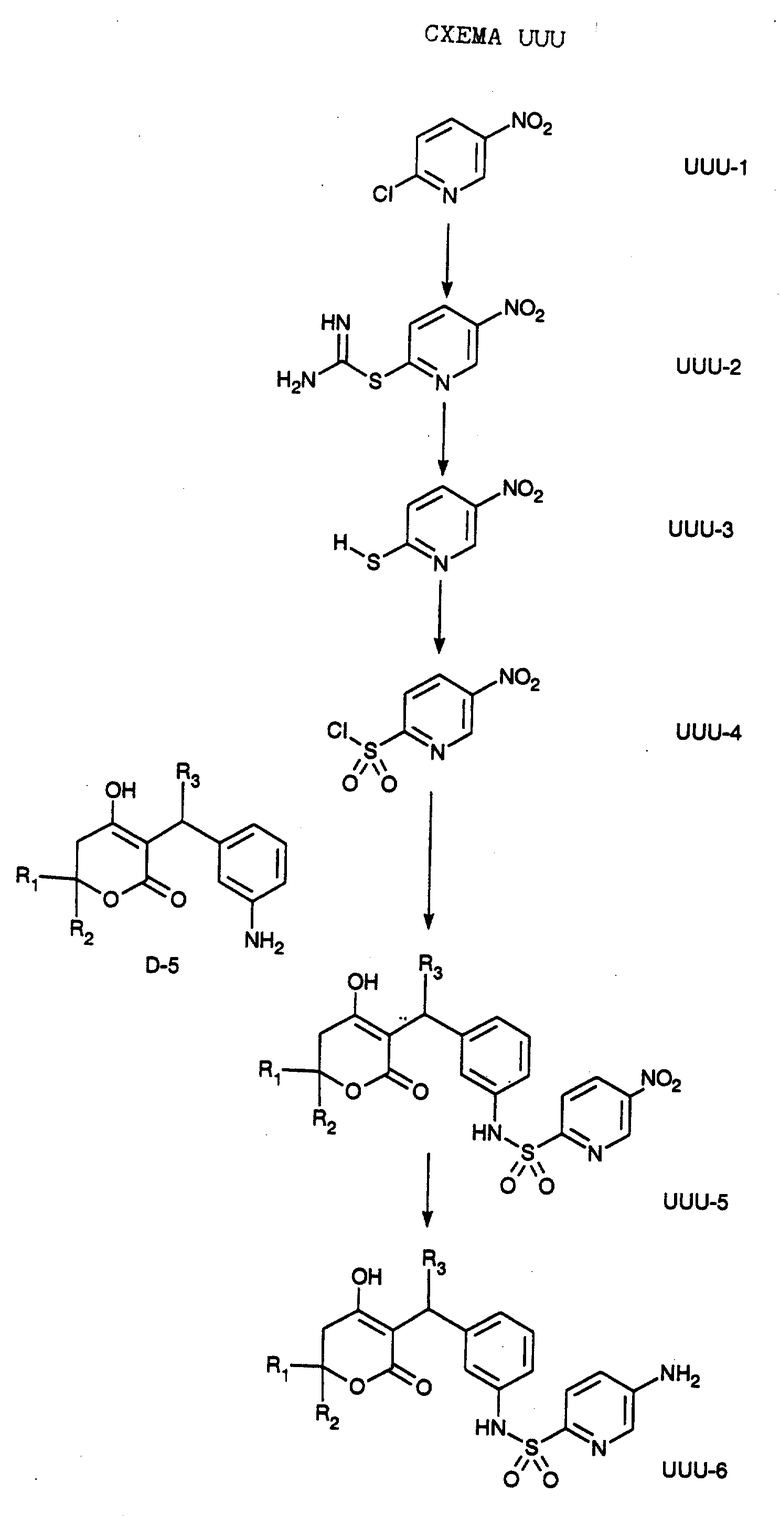
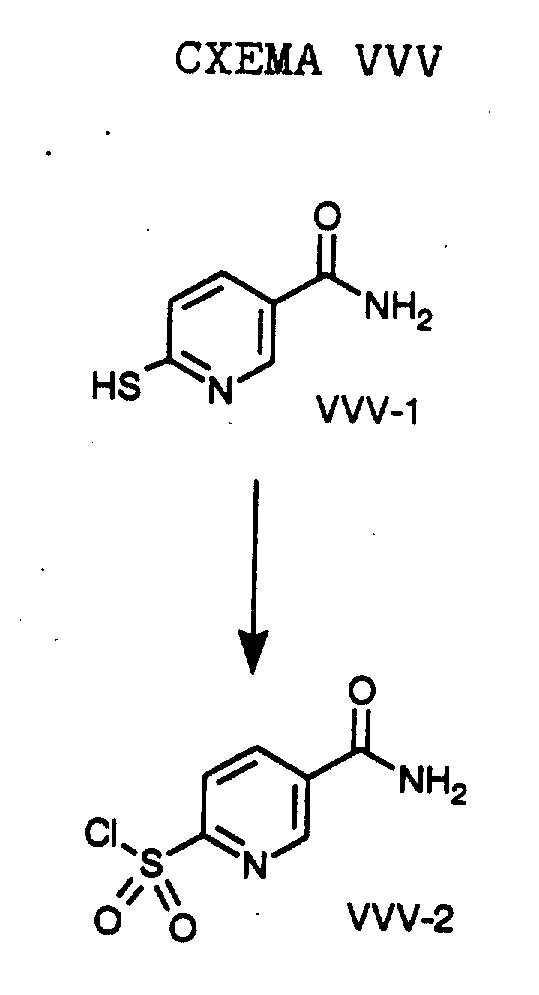
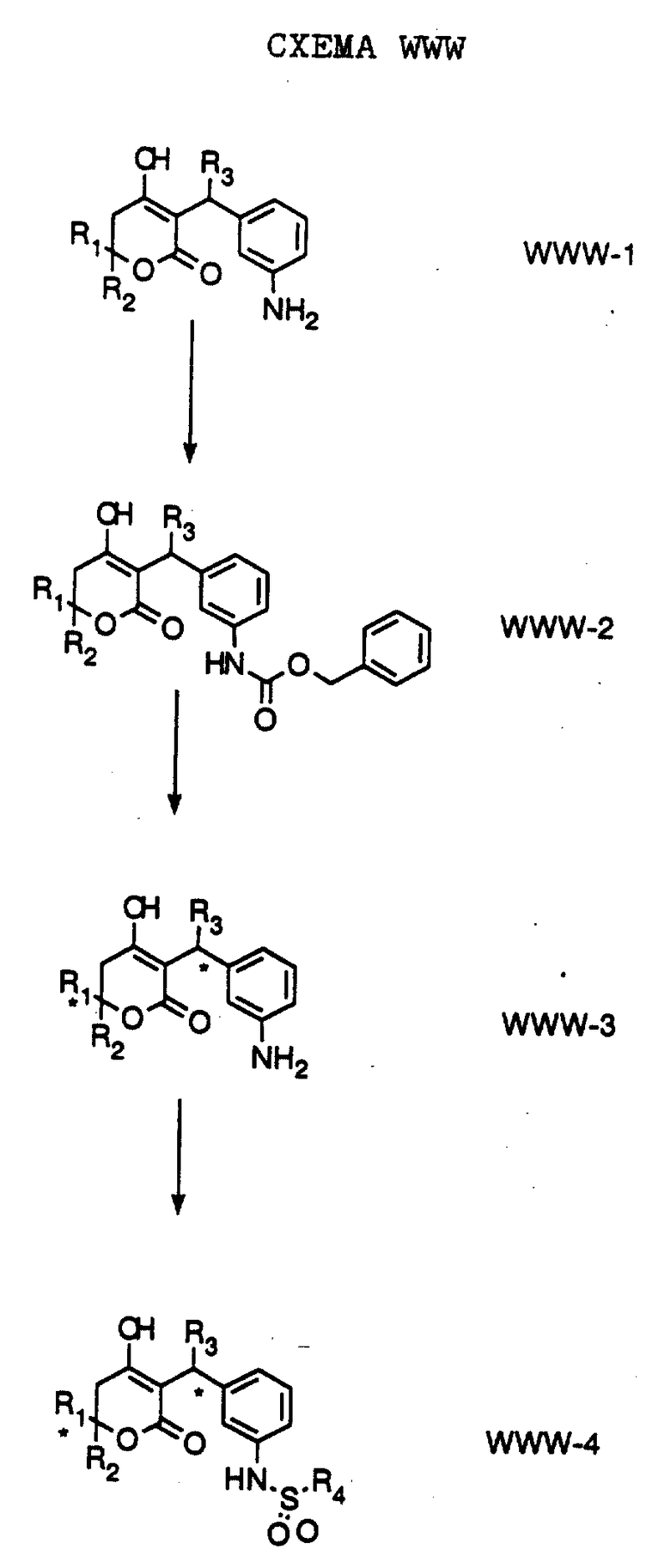
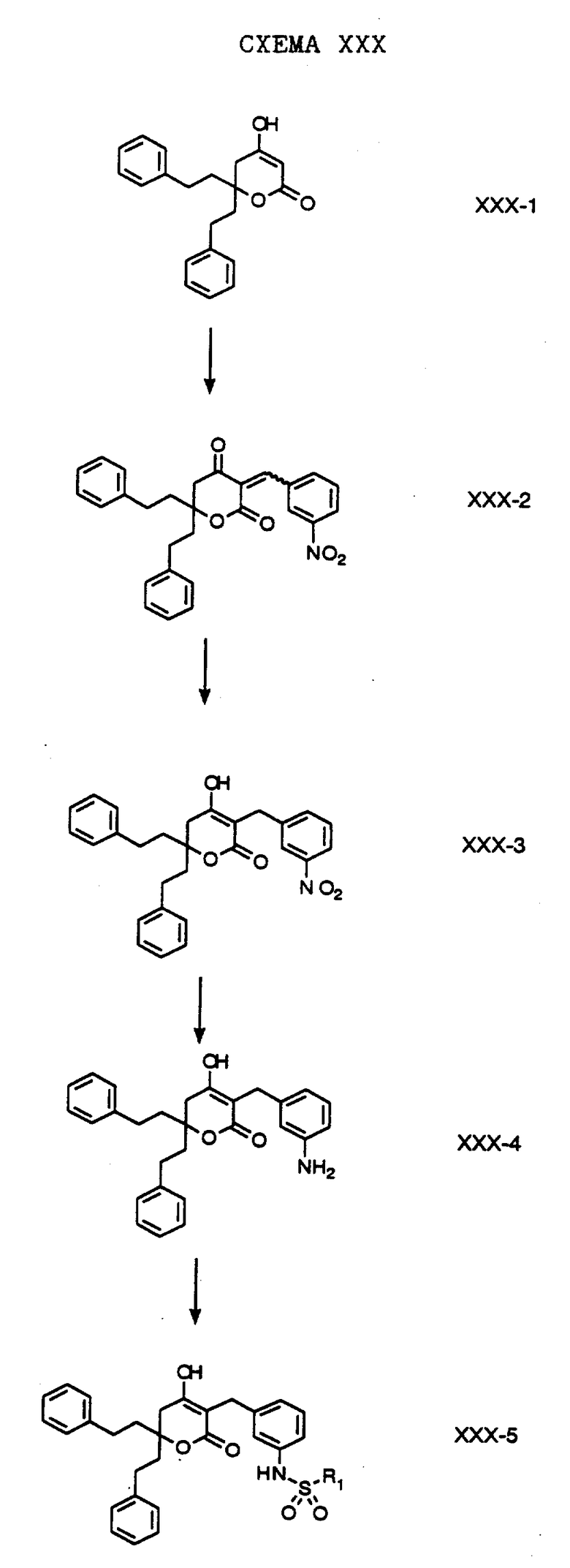
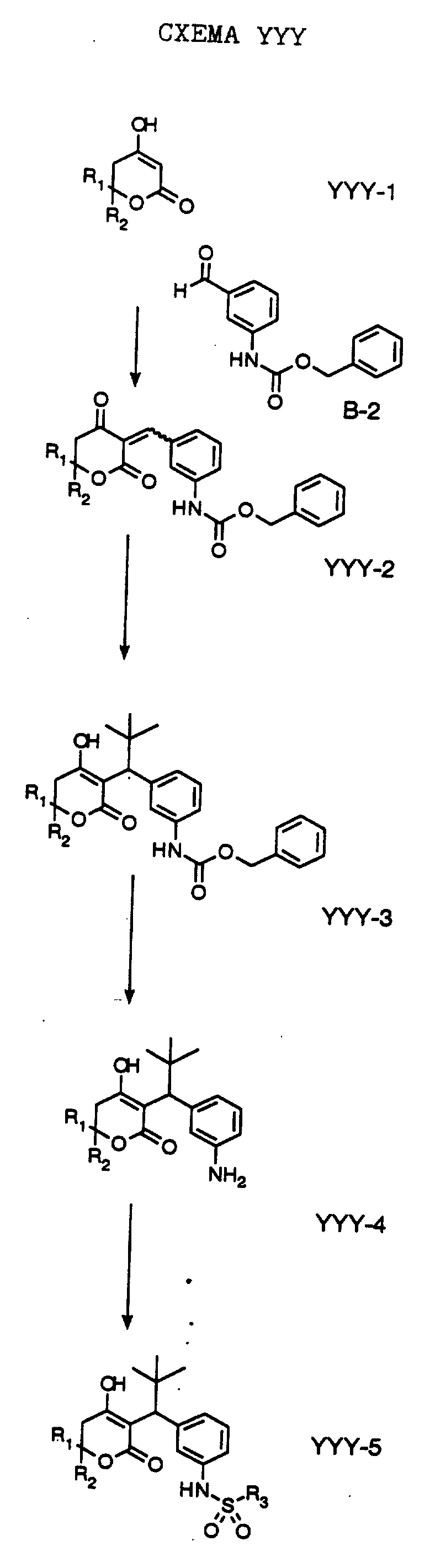
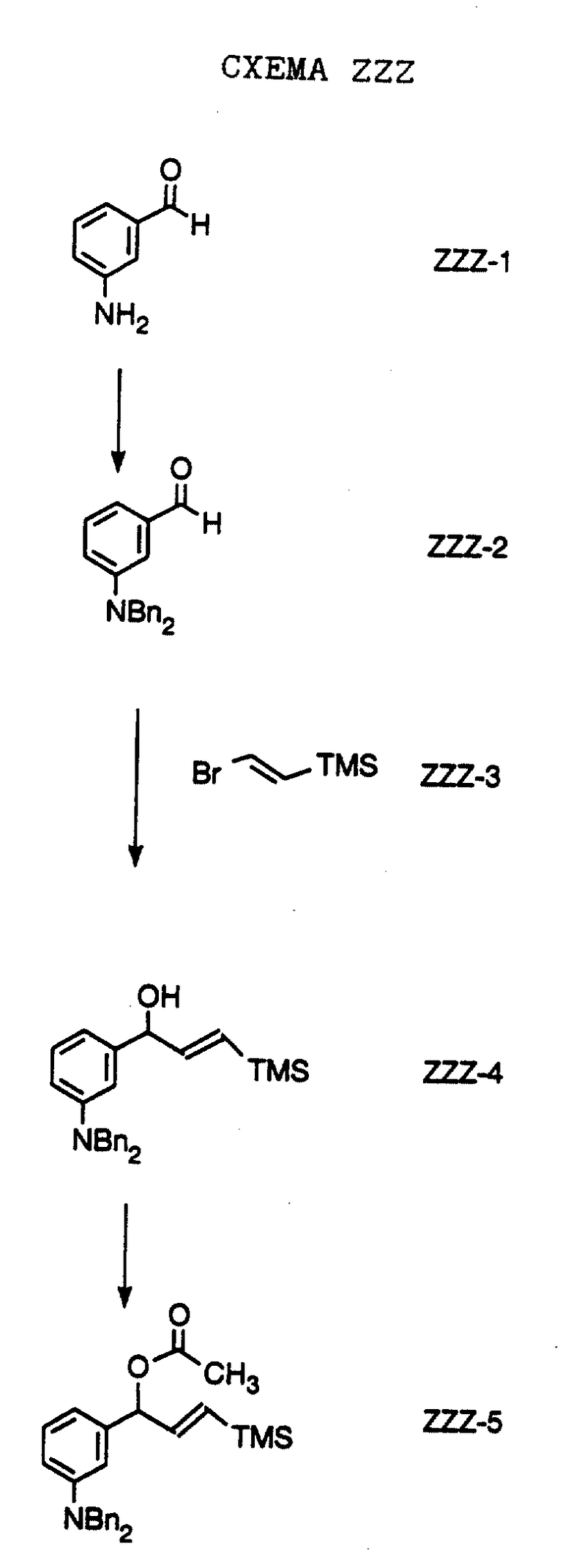
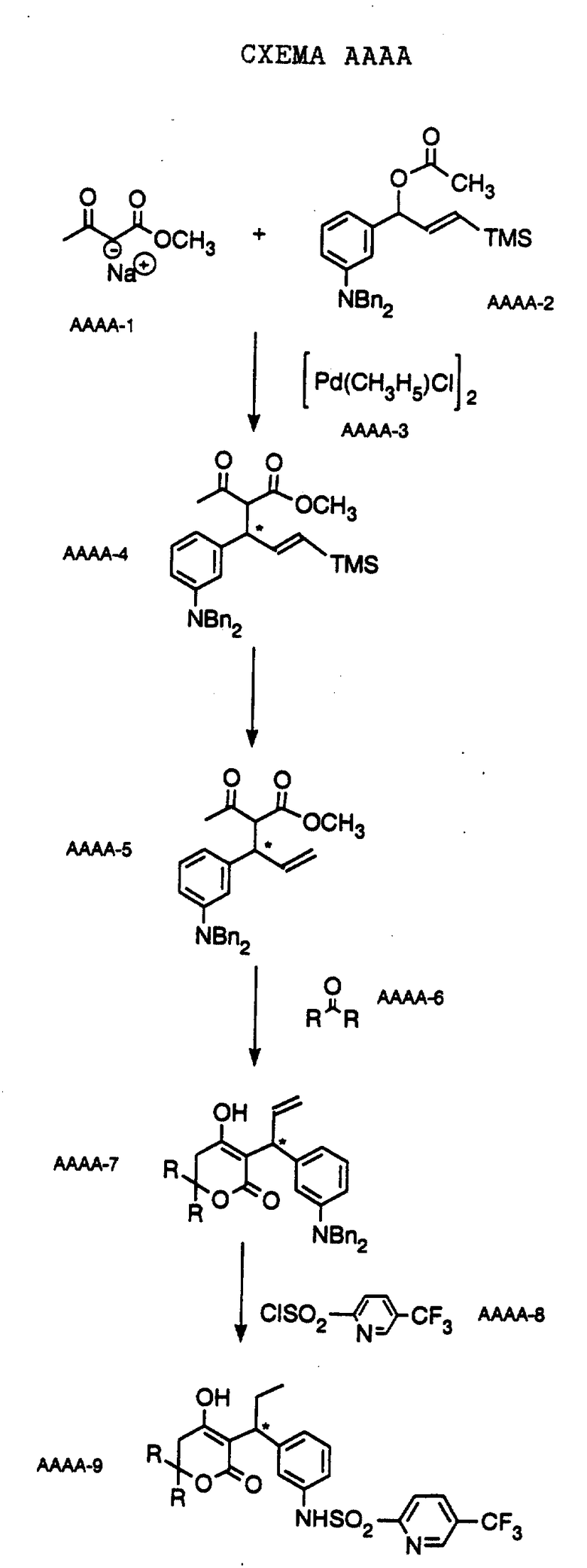
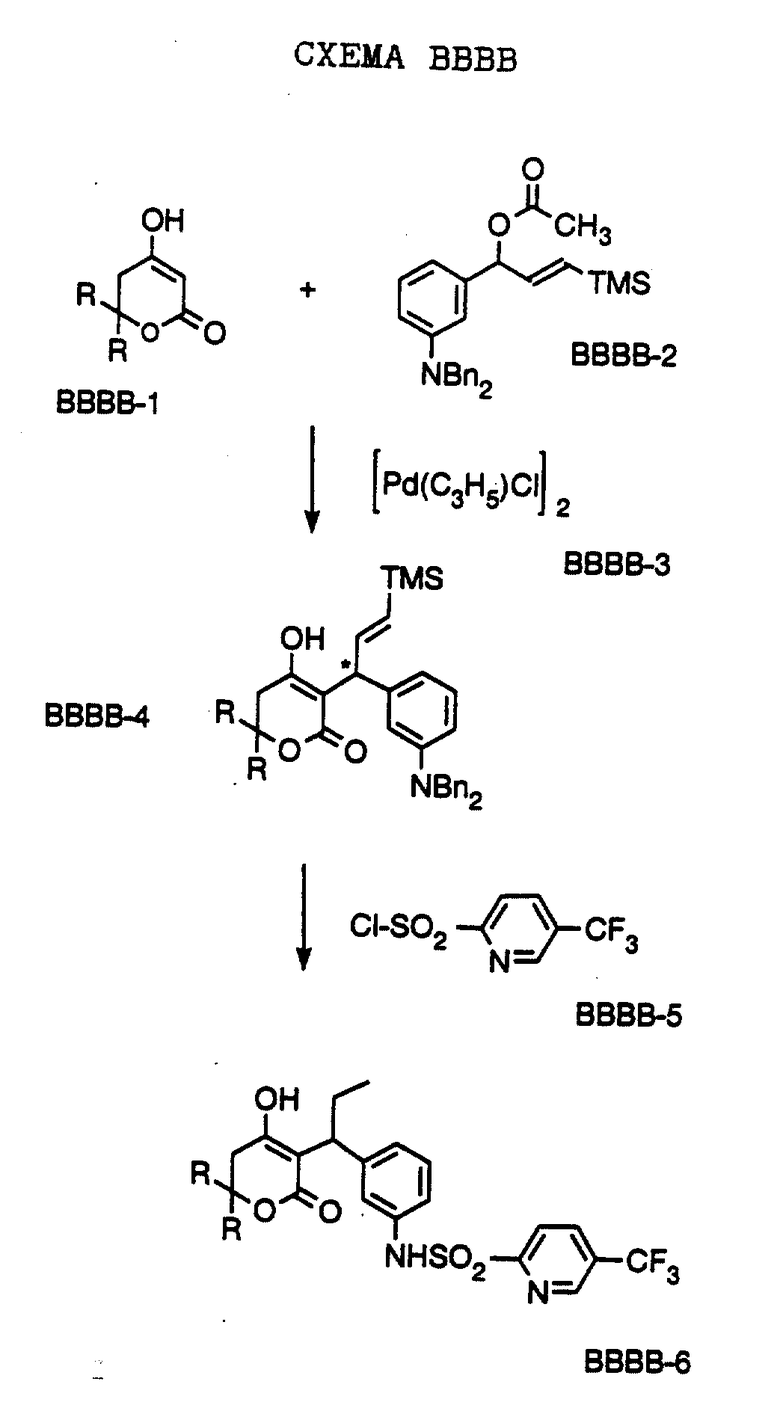
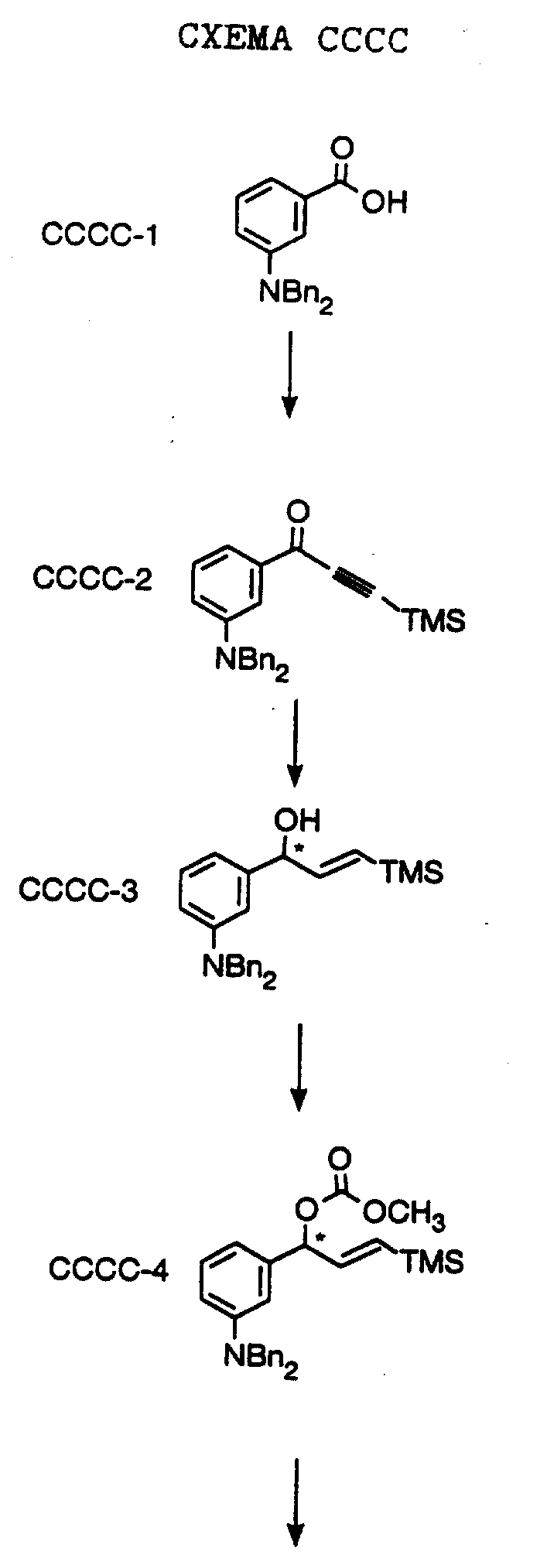
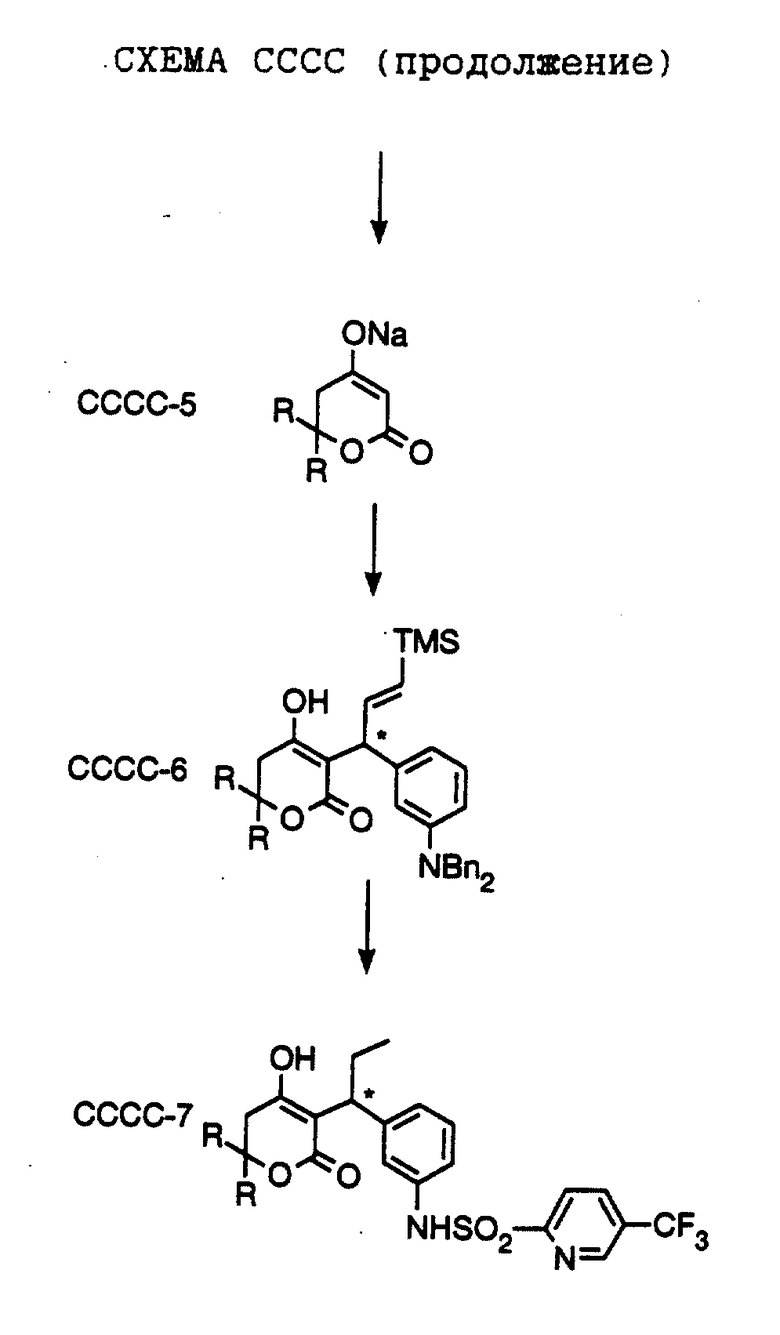

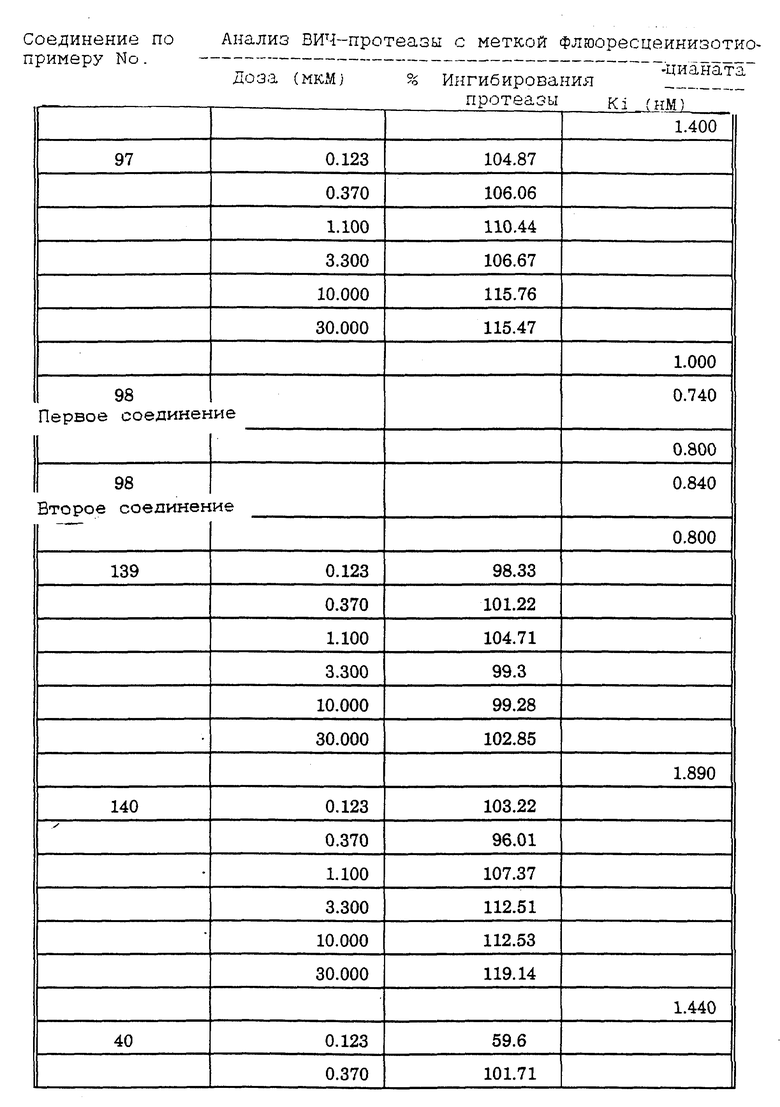
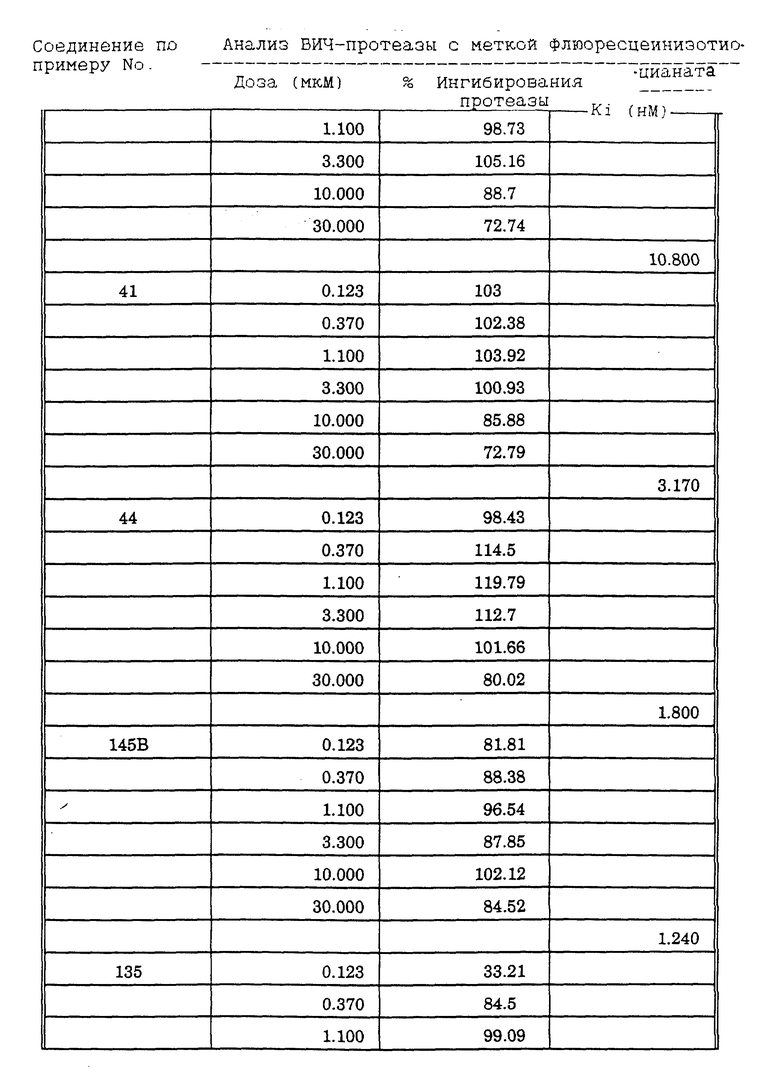


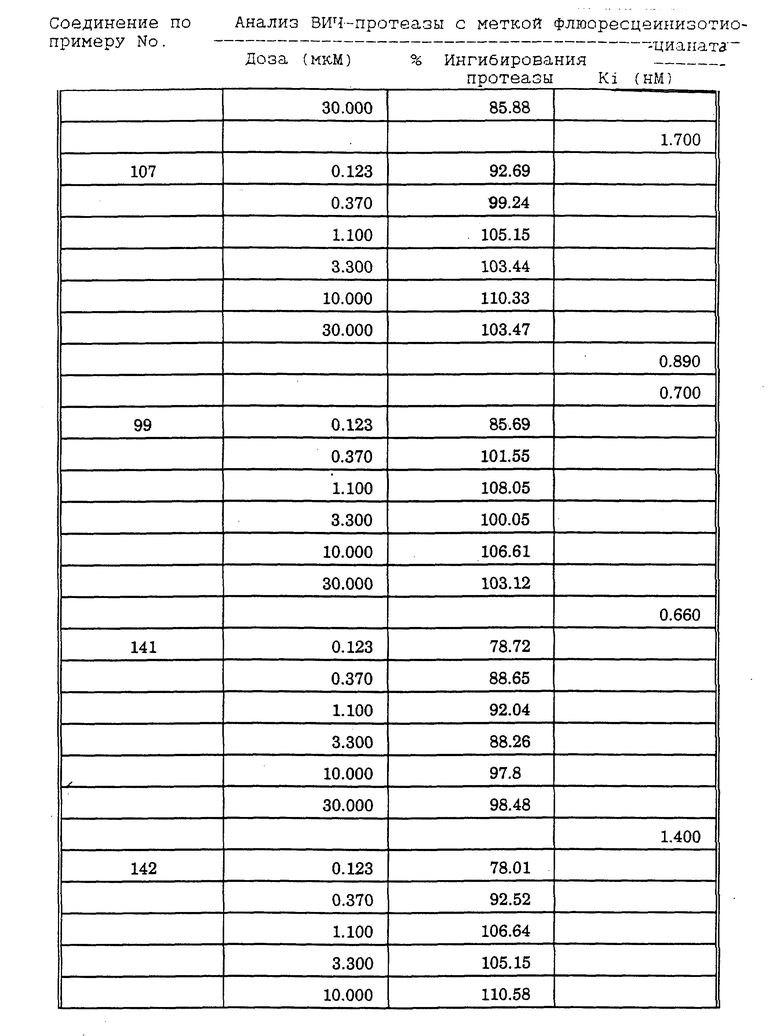
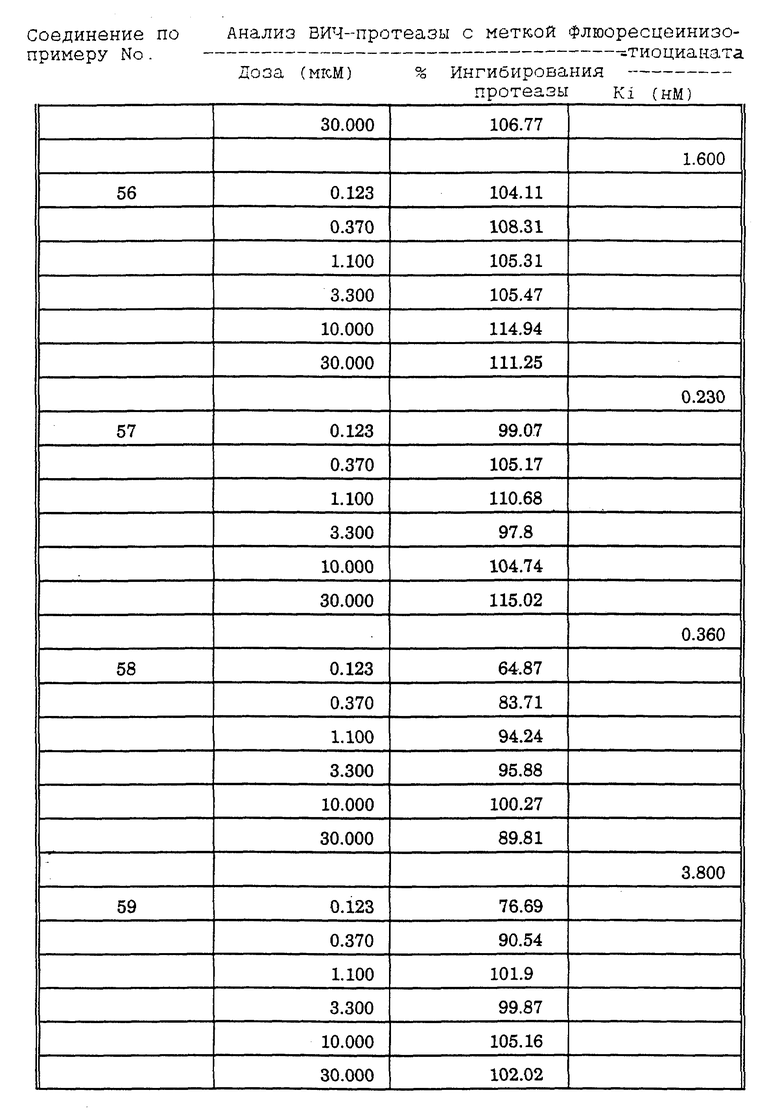
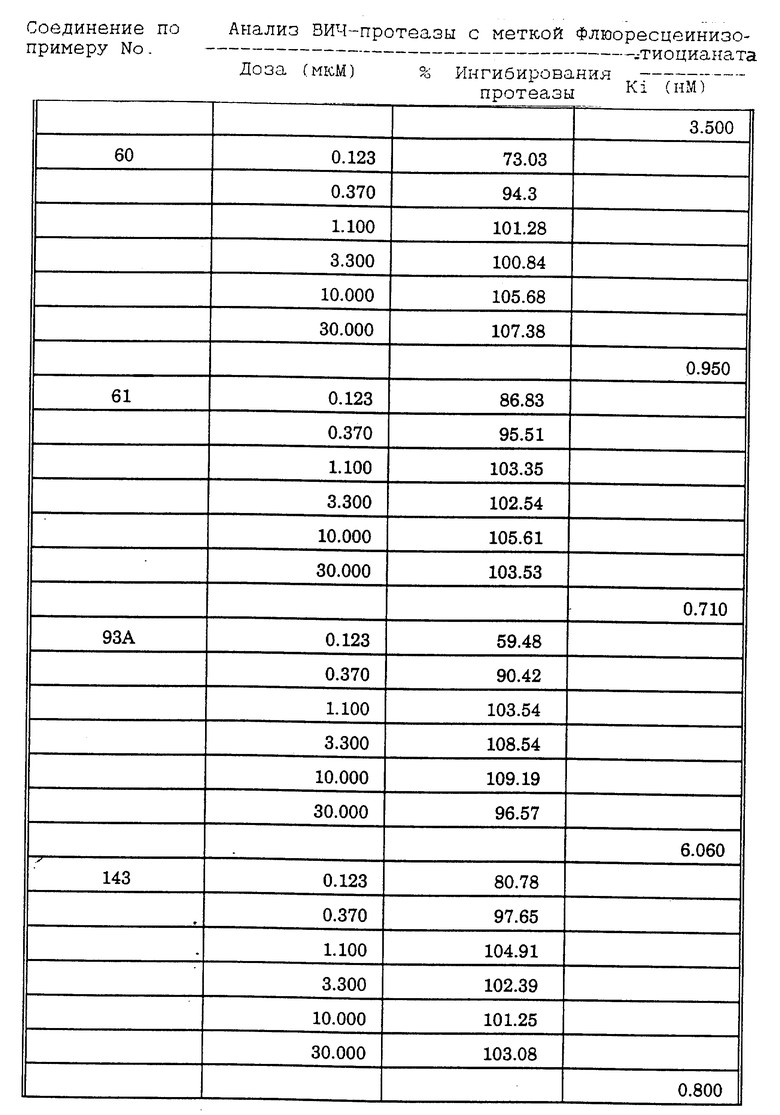
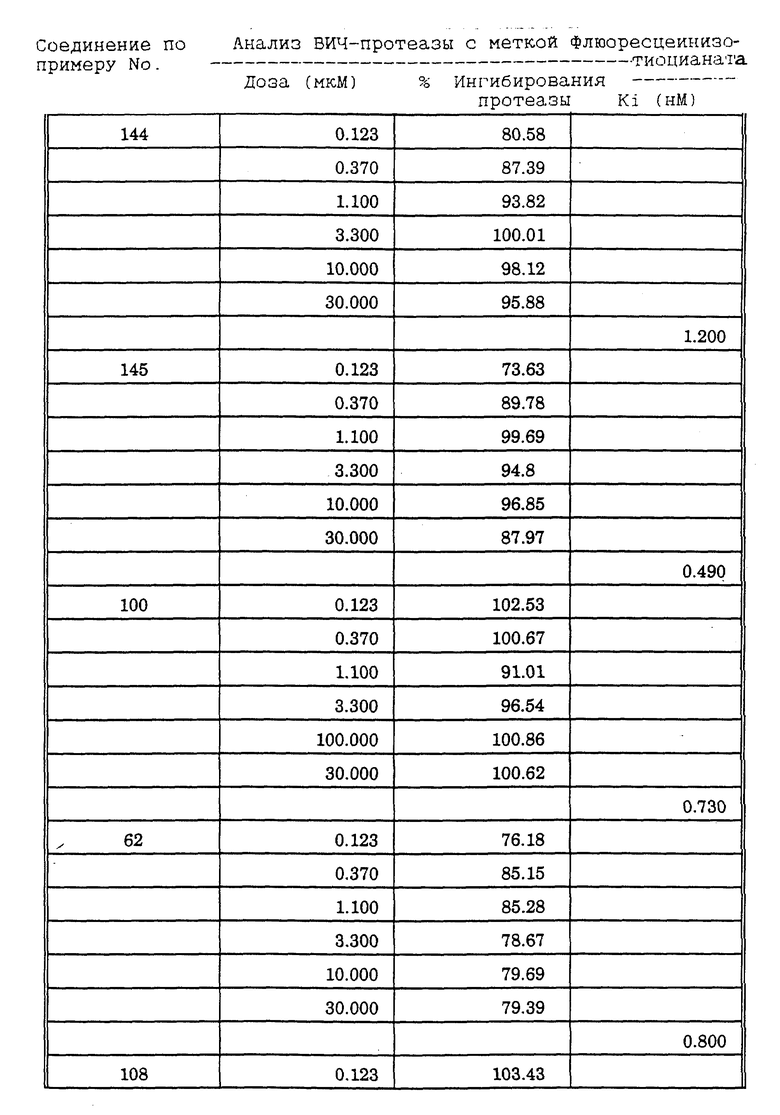
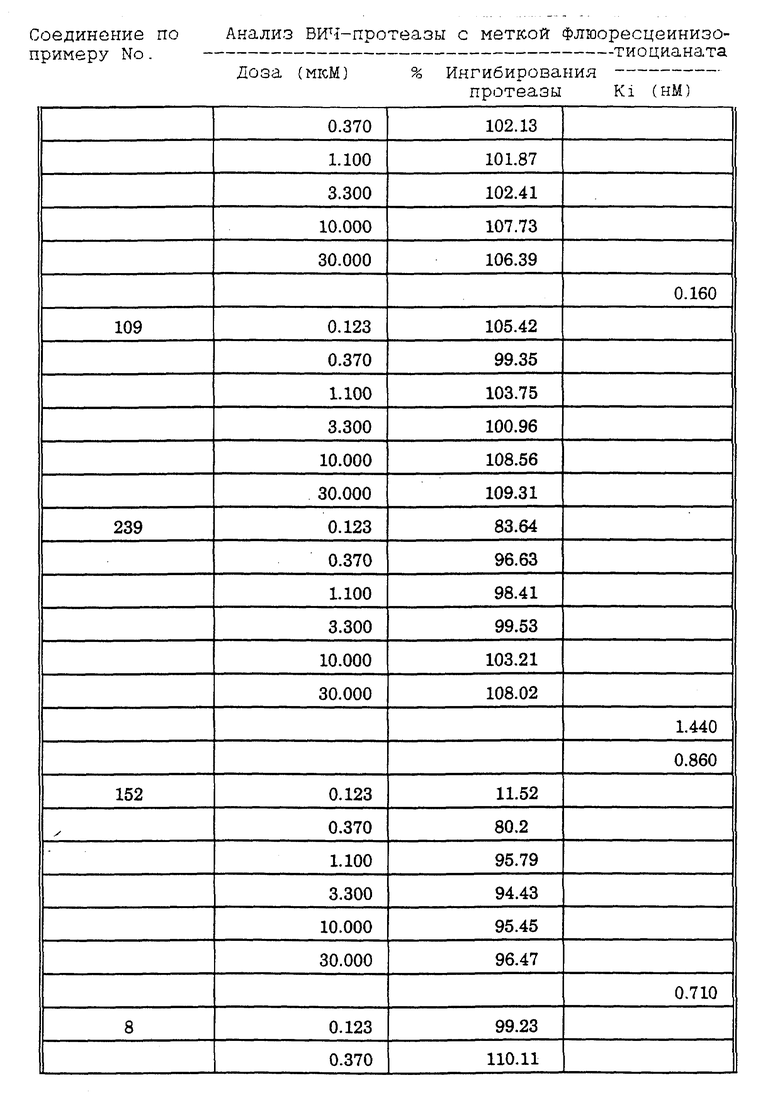
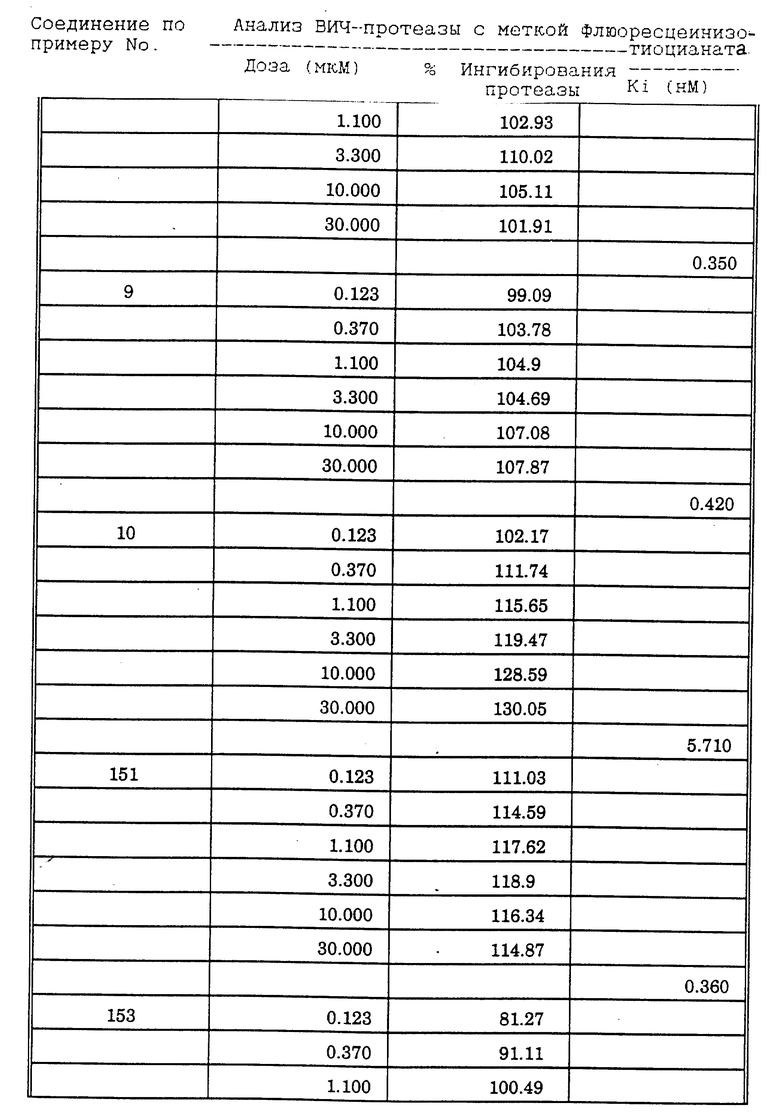
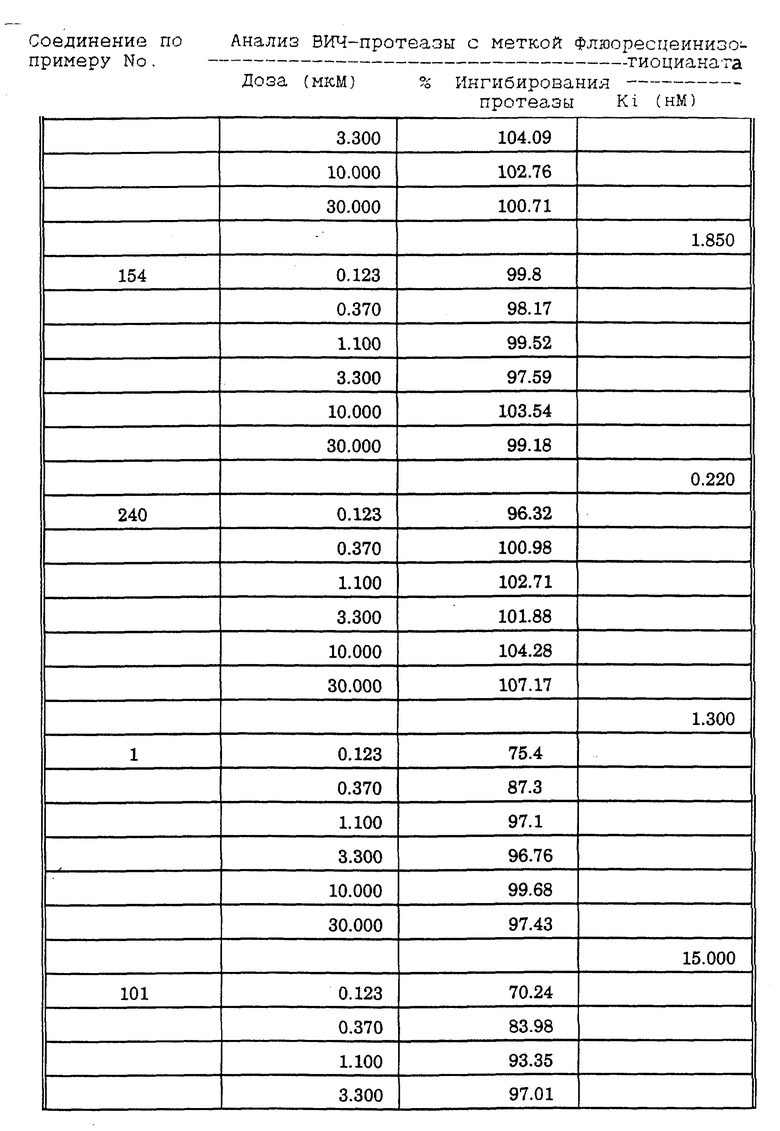

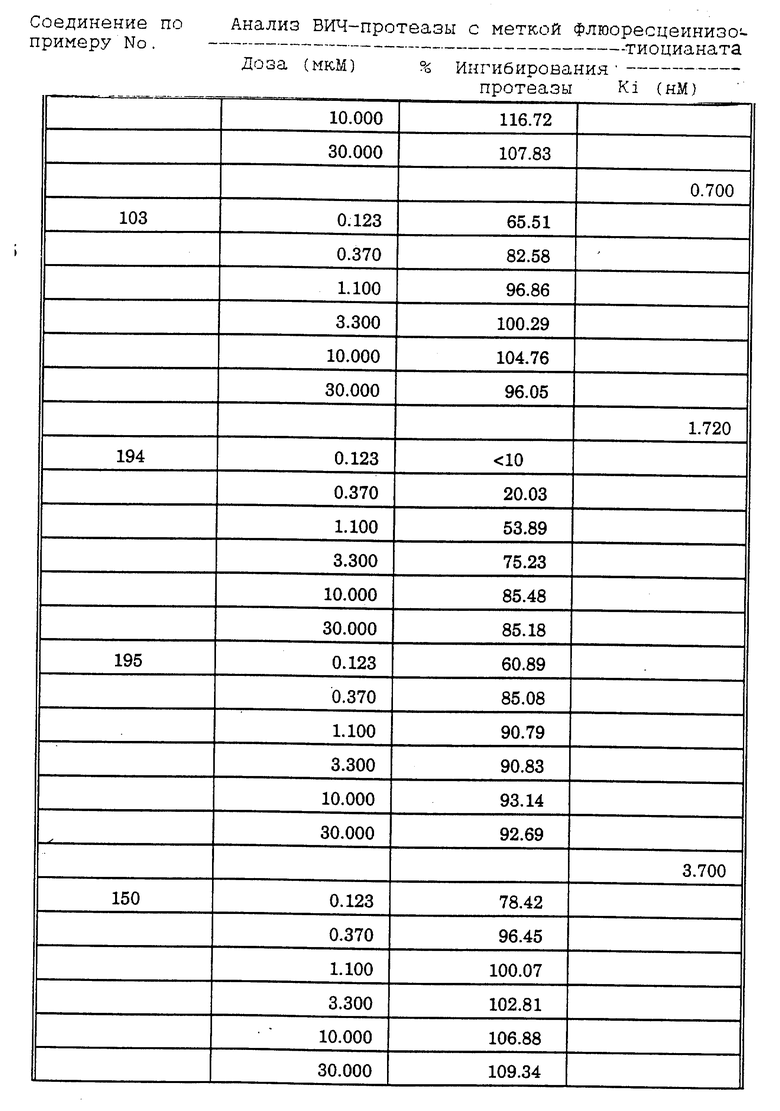
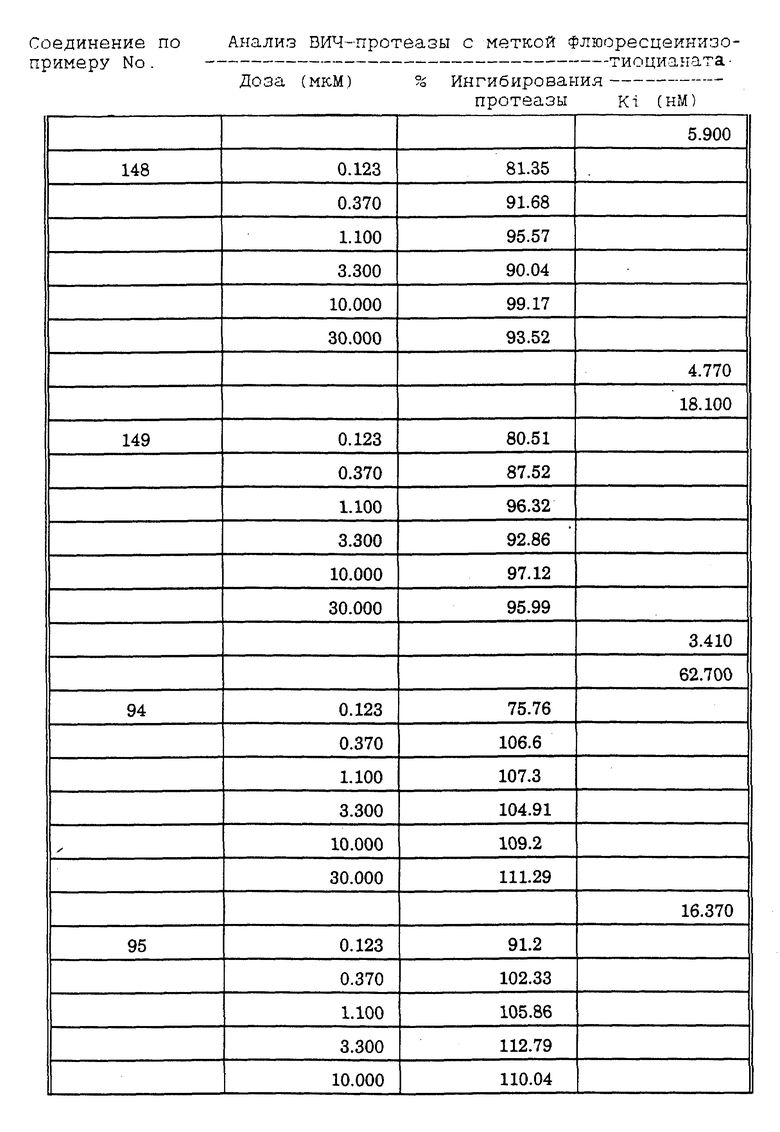
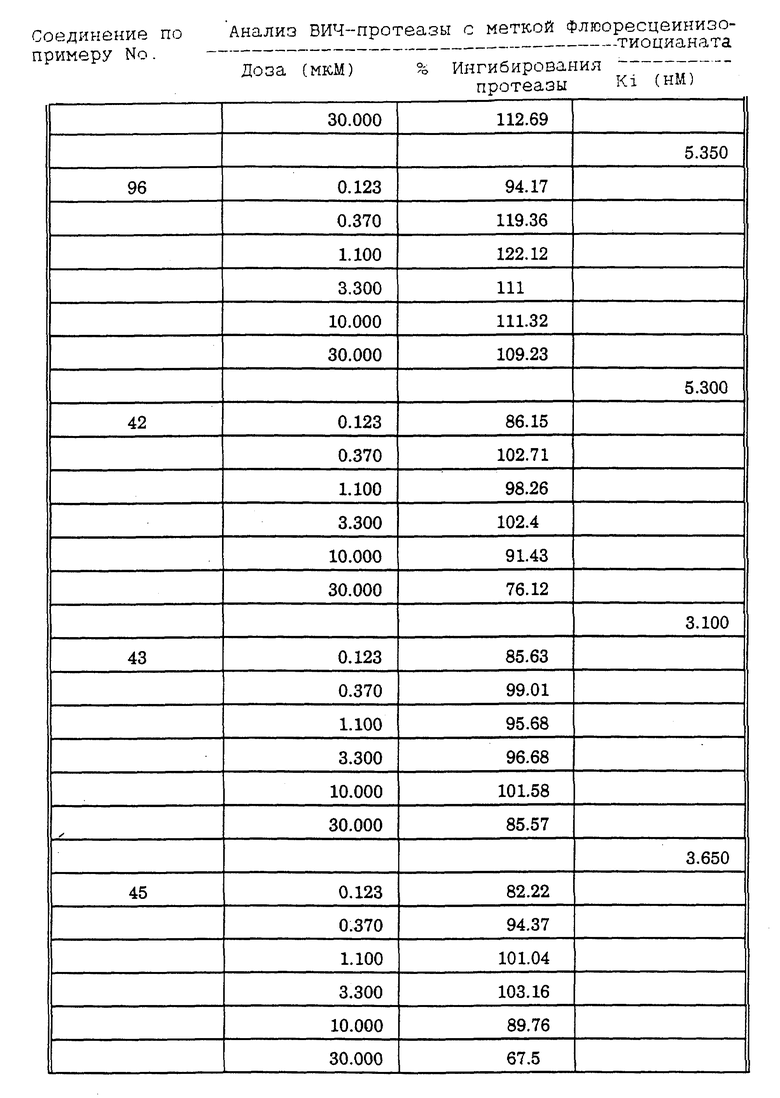
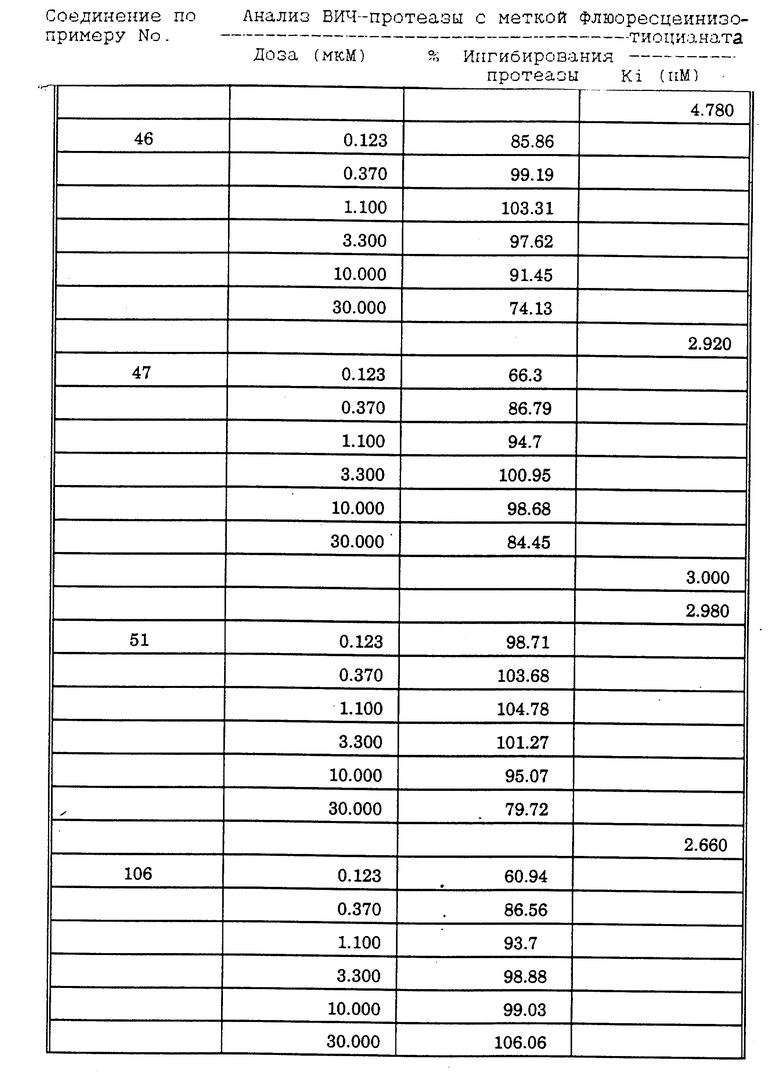
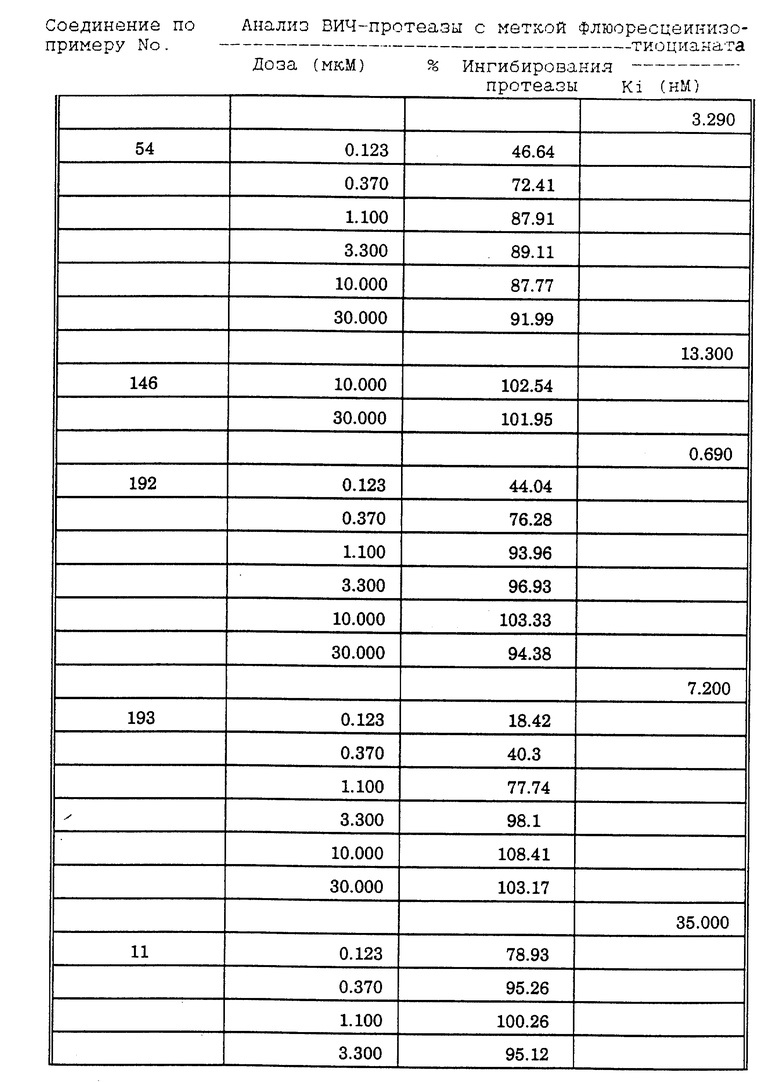
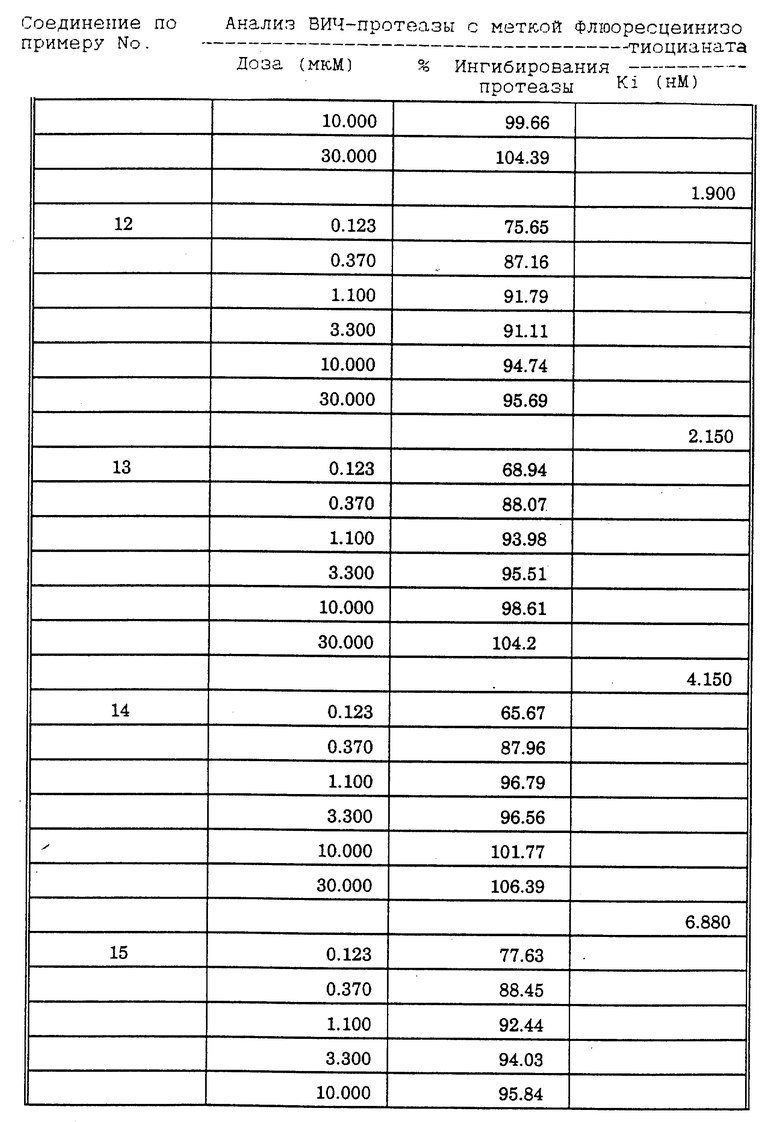
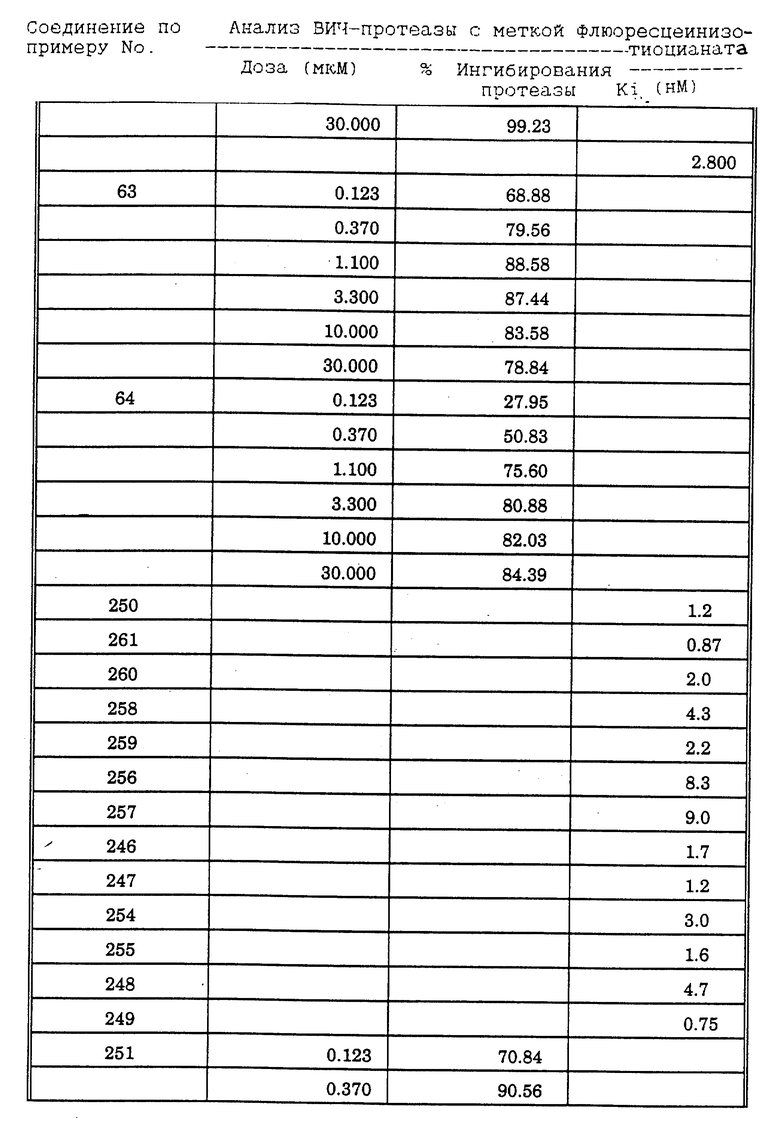
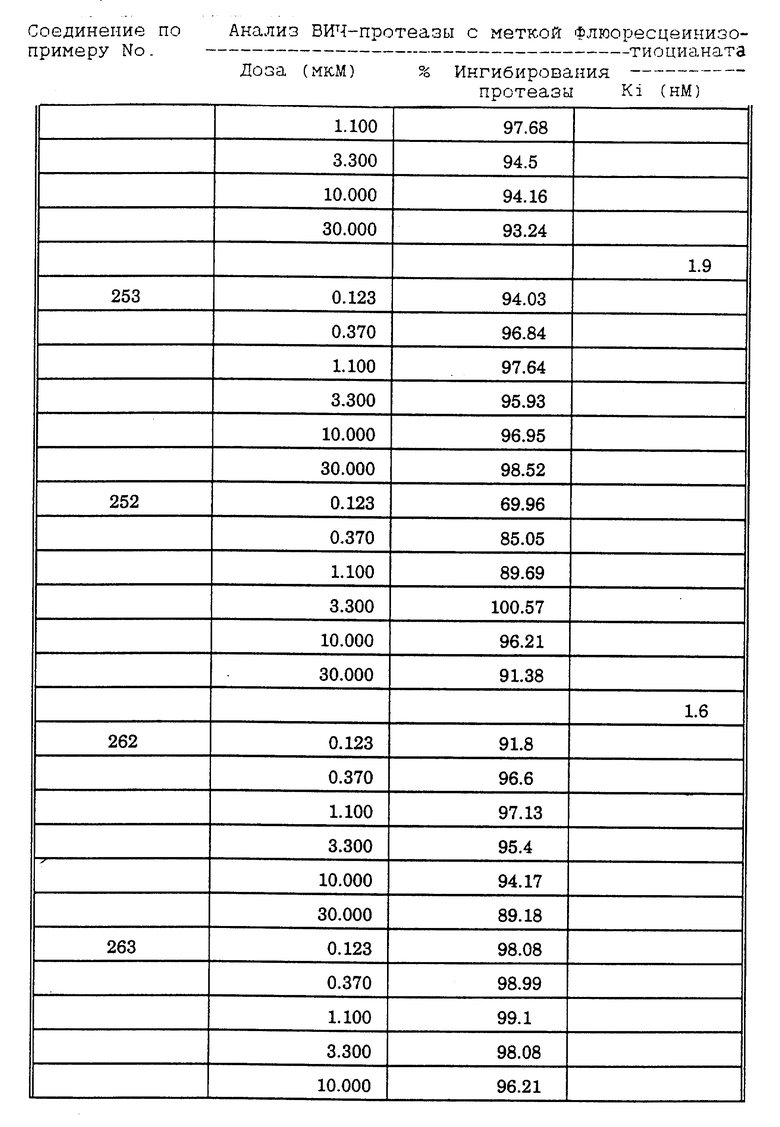
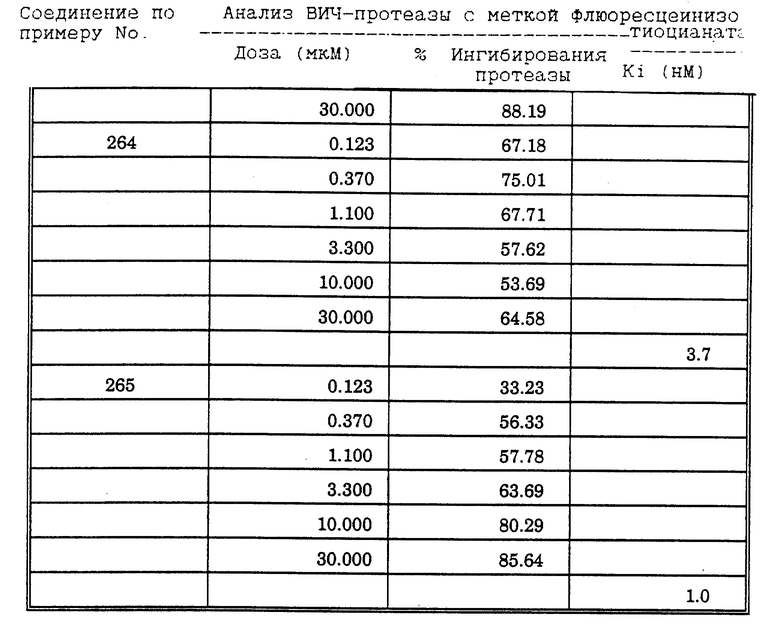


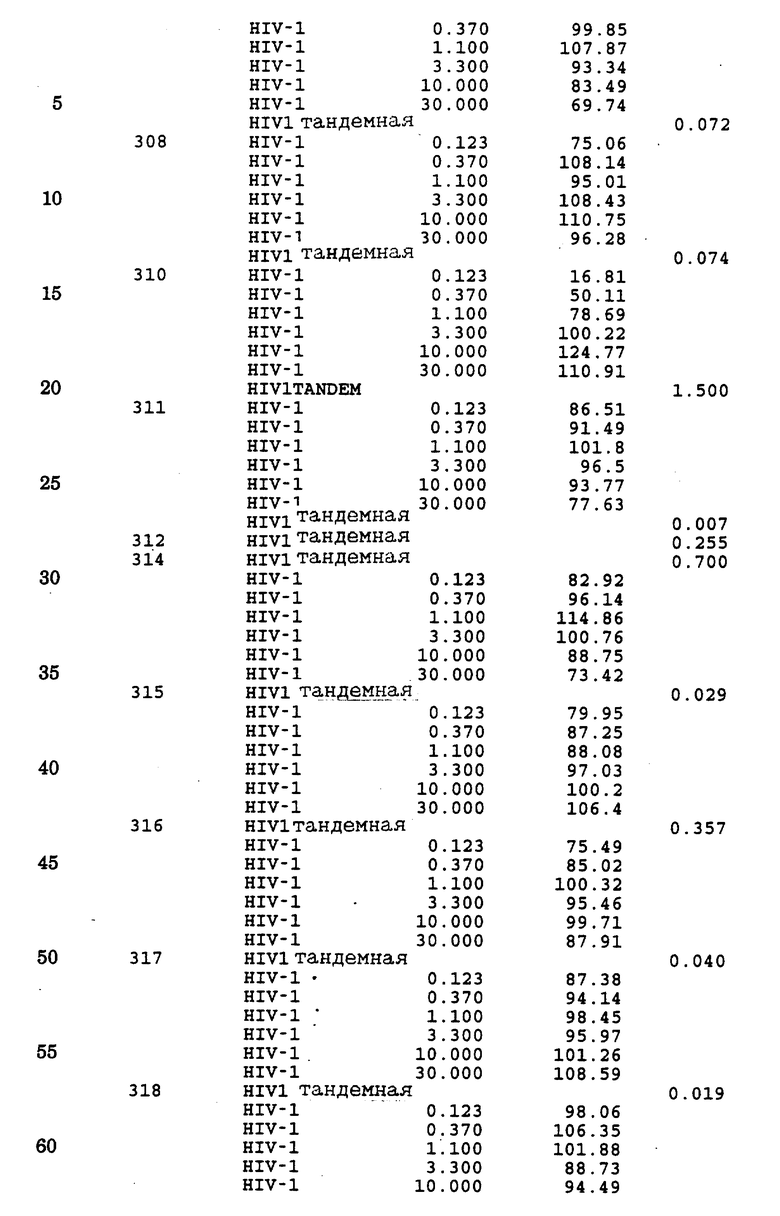
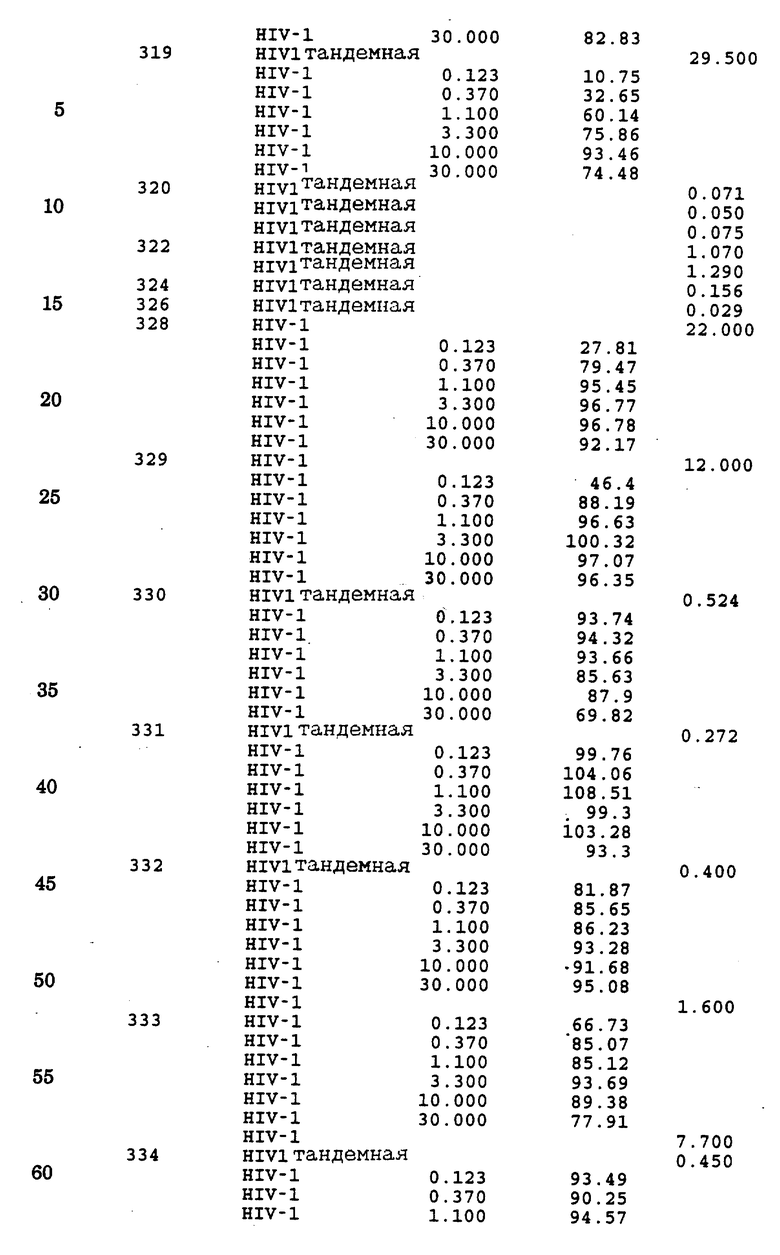







4-Гидроксипиран-2-оны формулы I, где R1-Н; R2 - C3-5-алкил, фенил- (СН2)2, гет-SO2NH- (СН2)2, циклопропил- (СH2)2, фторфенил-(СH2)2, гeт-SO2NH-фенил-, трифторметил-(СH2)2, или R1 и R2 вместе образуют двойную связь; R3 - фрагментформулы(A),R4,-фенил,гет,циклопропил,бром,азидо,гет-SO2NH-(значения других радикалов см в п.1 формулы, и их производные полезны для подавления ретровируса в клетках человека, инфицированного указанным ретровирусом.
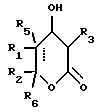
4 с. и 35 з.п. ф-лы, 119 схем. 3 табл.

где R1 обозначает атом водорода;
R2 обозначает (a) (С3-С5)алкил; (b) фенил-(СН2)2-; (с) гет -SО2NН-(СН2)2-; (d) циклопропил-(СН2)2-; (е) фторфенил-(СН2)2-; (f) гет-SО2NН-фенил-; или (g) трифторметил-(СН2)2-; или R1 и R2, вместе образуют двойную связь;
R3 обозначает фрагмент формулы Х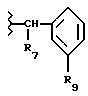
R4 обозначает (а) фенил; (b) гет; (с) циклопропил; (d) H3C-[O(CH2)2]2-; (e) гет-SO2NH-; (f) бром-; (g) азидо-; или (h) HO2S(CH2)2-N(CH3)-C(O)-(CH2)6-C(O)-NH-;
R5 обозначает атом водорода;
R6 обозначает (a) R4-(CH2)n -CH(R8)-; (b) Н3С-[O(СН2)2]2-СН2-; (c) (C3-C5) алкил; (d) фенил-(CH2)2-; (e) гет-SO2NH-(CH2)2-; (f) (HOCH2)3C-NH-C(O)-NH-(CH2)3-; (g) (HO2C)(H2N)CH-(CH2)2-C(O)-NH-(CH2)3-; (h) пиперазин-1-ил-С(O)-NН-(СН2)3-; (i) HO3S(CH2)2-N(CH3)-C(O)-(CH2)6-C(O)-NH-(CH2)3-;
(j) циклопропил-(СН2)2-; (к) фторфенил-(СН2)2-; (l) гет-SО2NН-фенил или (m) F3C-(CH2)2-; n обозначает ноль (0), один (1) или два (2); R7 обозначает (а) циклопропил; (b) этил или (с) трет-бутил; R8 обозначает (а) этил или (b) -СН2-циклопропил; R9 обозначает (a) -NR12SO2-гет; (b) -NR12SO2-фенил, незамещенный или замещенный одним R11; (с) -СН2-SO2-фенил, незамещенный или замещенный одним R11, или (d) -СН2-SО2-гет; где гет представляет 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, и включащее любую бициклическую группу, в которой любое из указанных выше гетероциклических колец сконденсировано с бензольным кольцом или другим гетероциклом, незамещенное или замещенное одним R10; где R10 обозначает (а) метил; (b) циано; (с) гидрокси; (d) этоксикарбонил; (е) трифторметил; (f) амино; или (g) -C(O)-NH2; R11 обозначает (а) циано; (b) атом фтора; (с) гидрокси или (d) нитро; R12 обозначает (а) атом водорода или (b) метил;
или его фармацевтически приемлемая соль.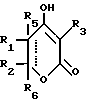
где R1 обозначает атом водорода;
R2 обозначает (а) (С3-С5)алкил; (b) фенил-(СН2)2- или (с) гет-SО2NН-(СН2)2-, или R1 и R2 вместе образуют двойную связь;
R3 обозначает фрагмент формулы Х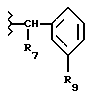
R4 обозначает (а) фенил; (b) гет; (с) циклопропил; (d) Н3С-[O(СН2)2]2-; (e) гет-SО2NН-; (f) атом брома; (g) азидо; или (h) HO3S(CH2)2-N(CH3)-C(O)-(CH2)6-C(O)-NH-;
R5 обозначает атом водорода; R6 обозначает (а) R4-(CH2)n-CH(R8)-; (b) Н3С-[O(СН2)2] 2-СН2-; (c) (C3-C5) алкил; (d) фенил-(CH2)2-; (е) гет-SО2NН-(СН2)2-; (f) (HOCH2)3C-NH-C(O)-NH-(CH2)3-; (g) (HO2C)(H2N)CH-(CH2)2-C(O)-NH-(CH2)3-; (h) пиперазин-1-ил-С(O)-NН-(СН2)3-; или (i) HO3S(CH2)2-N(CH3)-C(O)-(CH2)6-C(O)-NH-(CH2)3-; n обозначает ноль (0), один (1) или два (2); R7 обозначает (а) циклопропил; (b) этил или (с) трет-бутил; R8 обозначает (а) этил или (b) -СН2-циклопропил; R9 обозначает (a) -NR12SO2-гет; (b) -NR12SO2-фенил, незамещенный или замещенный одним R11; (с) -СН2-SО2-фенил, незамещенный или замещенный одним R11 или (d) -CН2-SО2-гет, где гет обозначает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, и включающее любую бициклическую группу, в которой любое из указанных выше гетероциклических колец сконденсировано с бензольным кольцом или другим гетероциклом; незамещенное или замещенное одним R10; где R10 обозначает (а) метил; (b) циано; (с) гидрокси или (d) этоксикарбонил; R11 обозначает (а) циано; (b) атом фтора; (с) гидрокси или (d) нитро; R12 обозначает (а) атом водорода или (b) метил;
или его фармацевтически приемлемая соль.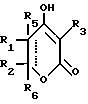
где R1 обозначает атом водорода;
R2 обозначает (а) пропил; (b) фенил-(СН2)2-; (с) (СН3)2СН-СН2 или (d) пентил; или R1 и R2 вместе образуют двойную связь;
R3 обозначает фрагмент формулы X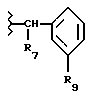
R4 обозначает (а) фенил; (b) гет; (с) циклопропил; (d) H3C-[O(CH2)2]2-; (e) гет-SО2NН-; (f) атом брома; (q) азидо или (h) HO3S(CH2)2-N(CH3)-C(O)-(CH2)6-C(O)-NH-; R5 обозначает атом водорода; R6 обозначает (a) R4-(CH2)n-CH(R8)-; (b) H3C-[O(CH2)2] 2CH2-; (с) пропил; (d) фенил-(CH2)2-; (e) (CH3)2CH-CH2- или (f) пентил; n обозначает ноль (0), один (1) или два (2); R7 обозначает (а) циклопропил или (в) этил; R8 обозначает (а) этил или (b) -СH2-циклопропил; R9 обозначает (а) -NНSO2-гет или (b) -NНSО2-фенил, незамещенный или замещенный одним R11, где гет представляет следующие группы, незамещенные или замещенные одним R10: (а) 2-пиридинил; (b) имидазол-2-ил; (с) имидазол-4-ил; (d) хинолин-8-ил; (е) тетрагидропиран-4-ил; (f) тетрагидропиран-3-ил или (g) бензимидазол-2-ил; R10 обозначает (а) мeтил; R11 обозначает (а) циано; (b) атом фтора или (с) нитро;
или его фармацевтически приемлемая соль.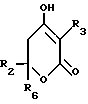
где R2 обозначает (а) пропил; (b) фенил-(СН2)2-; (с) (СН3)2СН-СН2 или (d) пентил;
R3 обозначает фрагмент формулы Х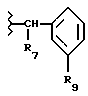
R6 обозначает (а) пропил; (b) фенил-(СН2)2-; (с) (СН3)2СН-СН3 или (d) пентил;
R7 обозначает (а) этил или (b) циклопропил;
R9 обозначает (а) -NНSО2-фенил, замещенный одним R11; или (b) -NНSО2-гет, где гет представляет следующие группы, незамещенные или замещенные одним R10: (а) имидазол-4-ил или (b) хинолин-8-ил; R10 обозначает метил; R11 обозначает (а) циано или (b) атом фтора.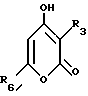
где R3 обозначает фрагмент формулы Х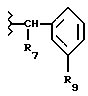
R4 обозначает (а) фенил; (b) гет; (с) циклопропил; (d) Н3С-[O(СН2)2]2-; (е) гет-SO2NH-; (f) атом брома; (g) азидо или (h) HO3S(CH2)2-N(CH3)-C(O)-(CH2)6-C(O)-NH-;
R6 обозначает (a) R4-(CH2)n-CH(R8)- или (b) H3C-[O(CH2)2]2-CH2-;
R7 обозначает циклопропил;
R8 обозначает (а) этил или (b) -СН2-циклопропил;
R9 обозначает (а) -NНSО2-гет или (b) -NНSО2-фенил, замещенный одним R11; n обозначает ноль (0), один (1) или два (2); гет обозначает следующие группы, незамещенные или замещенные одним R10; (а) имидазол-4-ил; (b) имидaзoл-2-ил; (с) хинолин-8-ил; (d) тетрагидропиран-3-ил; (е) тетрагидропиран-4-ил; (f) 2-пиридинил или (g) бензимидазол-2-ил; R10 обозначает метил; где R11 обозначает (а) нитро; (b) атом фтора или (с) циано;
или его фармацевтически приемлемая соль.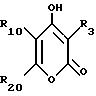
где R10 и R20 вместе образуют: а) фрагмент формулы III
или b) фрагмент формулы IV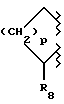
где p = 4;
R1 обозначает атом водорода;
R2 обозначает (а) атом водорода; (b) метокси; или (с) СН3-O-[(СН2)2O]3-;
R3 обозначает фрагмент формулы V
R4 обозначает (а) циклопропил или (в) -СН2-СН(СН2)2;
R5 обозначает (а) -NR9SO2-фенил, незамещенный или замещенный одним R6; (b) -NP9SO2-гет; (с) -СН2-SО2-фенил, незамещенный или замещенный одним R6 или (d) -СН2-SО2-гет; где R6 обозначает (а) циано; (b) атом фтора; (с) метил; (d) карбокси или (е) гидрокси; где гет представляет 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, и включающее любые бициклические группы, в которых любое из указанных выше гетероциклических колец конденсировано с бензольным кольцом или другим гетероциклом; незамещенное или замещенное одним или двумя R7, где R7 обозначает (а) метил; (b) циано; (с) этоксикарбонил или (d) гидрокси;
R9 обозначает (а) атом вoдopoдa; (b) пропил; (с) -СН2-циклопропил или (d) -СН2-фенил;
R9 обозначает (а) атом водорода или (b) метил;
или его фармацевтически приемлемая соль.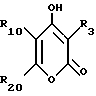
где R10 и R20 вместе образуют: а) фрагмент формулы III
или b) фрагмент формулы IV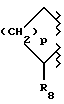
где р равно четырем (4);
R1 обозначает атом водорода;
R2 обозначает (а) метокси или (b) СН3О-[(СН2)2O]3-;
R3 обозначает фрагмент формулы V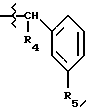
R4 обозначает (а) циклопропил или (b) -СН2-СН(СН3)2;
R5 обозначает (a) -NR9SO2-фенил, незамещенный или замещенный одним R6; (b) -NR9SO2-гет; (с) -CH2-SO2 -фенил, незамещенный или замещенную одним R6; или (d) -CH2-SO2-гет; R6 обозначает (а) циано; (b) атом фтора; (с) метил или (d) карбокси; где гет представляет следующие группы, незамещенные или замещенные одним R7: (а) имидазол-4-ил; (b) хинолин-8-ил; (с) 2-пиридинил или (d) 4-пиридинил; R7 обозначает метил; R8 обозначает (а) атом водорода или (b) пропил; R9 обозначает (а) атом водорода или (b) метил;
или его фармацевтически приемлемая соль.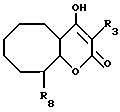
где R3 обозначает фрагмент формулы V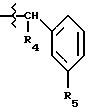
R4 обозначает (а) циклопропил или (b) -СН2-СН(СН3)2;
R5 обозначает (а) -NR9SО2-фенил, незамещенный или замешенный одним R6; (b) -NR9SО2-гет или (с) -СН2-SО2-фенил; R6 обозначает (а) циано или (b) атом фтора; гет обозначает следующие группы, незамещенные или замещенные одним R7: (а) 2-пиридинил; (b) 4-пиридинил или (с) имидазол-4-ил; R7 обозначает метил; R8 обозначает (а) атом водорода или (b) пропил; R9 обозначает (а) атом водорода или (b) метил;
или его фармацевтически приемлемая соль.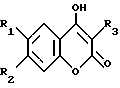
где R1 обозначает атом водорода;
R2 обозначает (а) метокси или (b) СН3О-[(СН2)2O]3-;
R3 обозначает фрагмент формулы V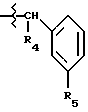
в которой R4 обозначает циклoпpoпил;
R5 обозначает -NНSО2-гет; где гет представляет следующие группы, незамещенные или замешенные одним R7: (а) имидазол-4-ил; (b) 2-пиридинил или (с) хинолин-8-ил; R7 обозначает метил.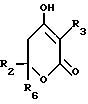
где R2 обозначает (а) этил; (b) пропил; (с) циклопропил-(СН2)2-; (d) фторфенил-(СН2)2-; (e) гет-SO2NH-фенил-; (H3C)2HC-CH2; (g) фенил-(CH2)2-, или (h) трифторметил-(СН2)2-;
R3 обозначает фрагмент формулы X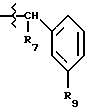
R6 обозначает (а) этил; (b) пропил; (с) циклопропил-(СН2)2-; (d) фторфенил-(СН2)2-; (e) гет-SО2NН-фенил-; (H3C)2HC-CH2; (g) фенил-(СН2)2-, или (h) трифторметил-(СН2)2-;
R7 обозначает (а) этил; (b) трет-бутил или (с) циклопропил;
R9 обозначает (а) -NНSО2-гет или (b) -NНSО2-фенил, замещенный одним R11; гет представляет следующие группы, незамещенные или замещенные одним R10: (а) имидaзoл-4-ил; (b) 2-пиридинил или (с) хинолин-8-ил; R10 обозначает (а) мeтил; (b) циано; (с) трифторметил; (d) амино или (е) -С(O)-NН2; R11 обозначает циано.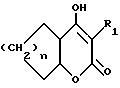
где R1 обозначает -(СН2)р-СН(R2)-(СН2)о-Аr1, где R2 обозначает (а) (С1-С5)алкил или (b) -(СН2)q-циклоалкил; Аr1 обозначает (а) фенил, незамещенный или замещенный одним R3, или (b) фенил, замещенный группой мета-NНSO2Аr2; Ar2 обозначает (а) фенил, незамещенный или замещенный одним R3, или (b) гет, гет представляет 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее от одного (1) до трех (3) гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, и включающее любые бициклические группы, в которых любое из указанных выше гетероциклических колец сконденсировано с бензольным кольцом или другим гетероциклом; незамещенное или замещенное одним R4; R3 обозначает (а) циано; (b) атом фтора; (с) гидроксил или (d) нитро; R4 обозначает (а) метил; (b) циано; (с) гидроксил; (d) этоксикарбонил; (е) трифторметил или (f) амино; n равно числу от нуля (0) до восьми (8) включительно; o равно числу от нуля (0) до трех (3) включительно; р равно от нуля (0) до трех (3) включительно; q равно числу от нуля (0) до трех (3) включительно,
или его фармацевтически приемлемая соль.
Приоритет по признакам:
06.05.94 - значения радикалов R1, R2(a,b,c), R3, R4, R5, R6 (a,b,c,d,e, f,g,h,i), R7, R8, R9, R10(a,b,c,d), R11, R12;
02.12.94 - значения радикалов R2(d,e,f), R6(j,k,l);
04.05.94 - значения радикалов R2(g), R6(m), R10(e,f,g).
| US 3931235 A, 06.06.76 | |||
| Способ получения 6-арил-3ароил-4-окси2-пиранонов | 1976 |
|
SU572462A1 |
| Инсектицидное средство | 1976 |
|
SU628818A3 |
| Способ получения 6-арил-3-ароил-4-окси-5-бромпиран-2-онов | 1981 |
|
SU950728A1 |
Авторы
Даты
1999-10-10—Публикация
1995-05-04—Подача