Изобретение относится к новому антибактериальному средству из класса производных 4-оксо-хинолинкарбоновых кислот, которое представляет собой 1-циклопропил-6-нитро-7-(4-метил-пиперазинил)-4-ок- со-1,4-дигидрохинолин-3-карбоновую кислоту (Ia) или его гидрохлорид (Iб).
H3C-N · n · HCl
· n · HCl
n=0 (Ia)
n=1 (Iб)
Поиски новых антибактериальных препаратов, несмотря на большое число уже синтезированных антибактериальных веществ, до сих пор являются одной из важнейших задач и проблем химиотерапии бактериальных инфекций. Имеющиеся в арсенале врача препараты (антибиотики, синтетические антимикробные агенты) не решают проблемы лечения тяжелых форм генерализованных гнойных бактериальных инфекций, в том числе вызванных синегнойной палочкой (Ps. aeruginosa). Большие трудности связаны с лечением сепсиса и гнойных процессов в оболочках и ткани мозга (менингиты, менингоэнцефалиты). Препятствием для эффективной терапии известными препаратами являются случаи тяжелых форм бактериальных инфекций, вызванные штаммами бактерий, устойчивыми (приобретенная устойчивость) к применяющимся средствам, в том числе штаммами с множественной лекарственной устойчивостью. Важное значение приобретают поиски хорошо растворимых и малотоксичных соединений, которые могли бы применяться парентерально (под кожу, внутривенно), когда необходима экстренная эффективная терапия, в том числе в детской практике.
Производные 4-оксохинолин-3-карбоновой кислоты представляют значительный интерес с точки зрения поиска новых антибактериальных агентов, так как активные соединения этого ряда веществ не имеют перекрестной устойчивости с антибиотиками различных химических групп и синтетическими антибактериальными препаратами из других классов химических веществ. Созданные в указанном ряду фторпроизводные [1, 2] наряду с высокой активностью характеризуются рядом побочных реакций и противопоказаны детям в возрасте до 12-15 лет. В связи с этим особенно актуален поиск активных малотоксичных соединений, не содержащих фтор, что и явилось основной целью данного изобретения.
Заявляемые соединения Ia и Iб в связи с установленной нами впервые их высокой антибактериальной активностью и низкой токсичностью представляют интерес как новые антибактериальные препараты для применения (таблетки, капсулы), парентерально (внутримышечно, под кожу, внутривенно, Iб) в виде инъекционных растворов, местно (Iб) в виде растворов, мазей и свечей.
В патенте ФРГ, 1984 г. имеются данные о способе получения некоторых 6-нитропроизводных хинолинкарбоновой кислоты (описаны общей структурной формулой), для которых указано, что они обладают слабой фунгистатической активностью; среди этих веществ, описанных общей формулой, упоминается и соединение Iа (основание). Никаких данных об антибактериальной активности ни в описании изобретения, ни в экспериментальной части для данного основания (Ia) не приводится. Какие-либо указания на возможность получения растворимых соединений этого ряда веществ с высокой антибактериальной активностью в патенте также отсутствуют.
Растворимое заявляемое соединение Iб получено нами впервые и описано в одновременно подаваемой во ВНИИГП заявке (кл. С 07 D 401/04).
Соединения Ia и Iб впервые изучены нами на антибактериальную активность.
Соединения Iа и Iб были впервые исследованы нами на антибактериальную активность:
в опытах in vitro в отношении грамотрицательных и грамположительных бактерий (табл. 1, 2, 3);
в опытах in vivo на инфицированных белых мышах при инфекциях, вызванных возбудителями бактериальных заболеваний (табл. 4, 5, 6, 7);
в модельных опытах in vitro по влиянию на уровень угнетения синтеза ДНК в клетках кишечной палочки (табл. 8);
в модельных опытах in vitro с использованием метода электронной микроскопии с целью изучения влияния веществ на ультраструктуру бактериальной клетки в опытах со стафилококком (табл. 9);
в опытах на интактных и инфицированных животных оценивали переносимость и токсичность Ia и Iб при введении внутрь (Ia и Iб) и парентерально (Iб).
При оценке активности и практической значимости соединений исходили в первую очередь из эффективности Ia и Iб в опытах ин виво на моделях генерализованных бактериальных инфекций, вызванных "проблемными" возбудителями гнойных процессов (синегнойная палочка, полирезистентный стафилококк) и возбудителями брюшного тифа (вызывает у человека тяжелую генерализованную инфекцию, серьезные трудности возникают при лечении хронического брюшно-тифозного бактерионосительства).
Антибактериальную активность заявляемых соединений сравнивали с оксолиниевой кислотой - известным антибактериальным препаратом из группы производных 4-оксохинолин-3-карбоновой кислоты (5). Препарат более 15 лет применяется в медицинской практике, главным образом в урологии для лечения инфекций мочевых путей. Кроме того, в опытах проводили сравнение с активностью препаратов, применяющихся для лечения инфекции, вызванной синегнойной палочкой:
с диоксидином (на модели септикопиемии) и с диоксидином и гентамицином (на модели менингоэнцефалита), а при инфекции, вызванной стафилококком;
с активностью препаратов, применяющихся при стафилококковой инфекции;
эритромицином, оксациллином, бензилпенициллином.
Изучение активности Iа и Iб в опытах ин витро.
Активность ин витро изучена в отношении II видов патогенных бактерий; всего использовано 55 штаммов, в том числе референс-штаммы (получены из ГКИ им. Л.А. Тарасевича) и ряд клинических штаммов, в том числе высокоактивных для экспериментальных животных.
Оценка активности заявляемых соединений ин витро проведена в отношении пяти референс-штаммов в опытах на жидкой питательной среде (бульон Хоттингера, 120 мг.% аминного азота) методом двукратных серийных разведений в диметилформамиде. Инокулят - 1х105 колониеобразующих единиц (КОЕ) в 1 мл среды. Величину минимальной подавляющей концентрации (МПК) оценивали через 18-20 ч после культивирования при 35-37оС. Как видно из табл. 1, заявляемые соединения высокоактивны в отношении всех пяти видов бактерий. Наибольший интерес представляет активность в отношении B.aeruginosa, S. aureus, Bac. subtilis (МПК в пределах 1-4 мкг/мл); Iб (растворимое соединение) более активно, чем Iа.
Спектр действия и диапазон степени активности заявляемых соединений ин витро изучены в опытах на твердой агаризованной среде в отношении 9 видов бактерий и 48 штаммов. Использован агар АГВ и метод серийных двукратных разведений. Посев бактерий проводился с применением штампа-репликатора (по Steers); концентрация микробных клеток в пятне при посеве репликатором 104 КОЕ/мл. Посевы инкубировали при 35-37оС 18-20 ч.
Как видно из табл. 2, заявляемые соединения характеризуются высокой активностью в отношении изученных бактерий. Для большинства видов и штаммов МПК90 не более 4 мкг/мл; Iа (нерастворимое соединение) несколько менее активно, чем Iб (растворимые). Оба вещества проявляют высокий эффект и в отношении большинства штаммов Ps. aeruginosa: наиболее активно растворимое соединение Iб (МПК50 - 2 мкг/мл). Активность в отношении Ps. aeruginosa несколько уступает активности в отношении других изученных бактериальных видов.
Сравнение активности ин витро заявляемых соединений с активностью препарата сравнения - оксолиниевой кислотой - проведено в опытах с высоковирулентными штаммами бактерий, которые в дальнейшем были использованы в опытах ин виво (табл. 3). Опыты на жидкой питательной среде при величине инокулята, в 10 раз больший (1х106 КОЕ/мл), чем в первой серии экспериментов (табл. 1). В опытах со стафилококком эксперименты проведены с 4 штаммами, в том числе три-полирезистентные (178, 191, 18б), в том числе устойчивые к метициллину и оксациллину.
Как видно из табл. 3, оба заявляемых соединения были высокоактивны в отношении всех 6 высоковирулентных штаммов. Наибольшая активность отмечена в отношении S.typhi. Эффективность в опытах со S.aureus и Ps.aeruginosa была сравнимой. Оксолиниевая кислота была менее активна, чем заявляемые соединения; это различие было велико в опытах со стафилококком и особенно значительно в опытах с Ps.aeruginosa.
Изучение активности заявляемых соединений Ia и Iб в опытах на моделях острых бактериальных инфекций белых мышей (табл. 4, 5, 6, 7)
Опыты проведены с Ps.aeruginosa 165, S.typhi 4446 и Saureus 178 на 1750 белых беспородных мышах массой 15-16 на моделях острых бактериальных инфекций с внутрибрюшинным заражением животных ("Методы экспериментальной химиотерапии". М., "Медицина", 1971) и заражением интрацеребрально (опыты с Ps. aeruginosa. Сб. трудов ВНИХФИ, вып. V, 1976 г., стр. 143). Использованы инфицирующие дозы, вызывавшие гибель 80-100% контрольных нелеченых животных через 24-48 ч после заражения.
Заявляемое соединение Ia (основание) вводили per os Iб (хлоргидрат) - под кожу или per os; оксолиниевую кислоту (нерастворимое соединение) вводили per os. Изучали активность веществ в диапазоне доз от 6,25 до 600 мг/кг однократно при условии введения через 30 мин после заражения. Длительность наблюдения за животными 10 сут. Оценку активности проводили на основании выживаемости и продолжительности жизни леченых животных. Кроме того, в опытах с Ps. aeruginosa в качестве препаратов сравнения использовали диоксидин и гентамицин (на модели менингоэнцефалита), показанные для лечения генерализованных инфекций, вызванных этим возбудителем. В опытах со S. aureus для сравнения использовали бензилпенициллин, оксациллин и эритромицин.
Как видно из табл. 4, заявляемые соединения высокоактивны при септикопиемии мышей, вызванной Ps. aeruginosa. Растворимое соединение Iб (хлоргидрат) более активно, чем основание Iа и проявляет высокий защитный эффект при введении per os в дозах 200-400 мг/кг, при введении под кожу в дозах от 100 мг/кг и выше (выживаемость 80%); при введении в дозе 50 мг/кг выживает 50% леченых животных. Оба соединения существенно превосходят по активности при этой инфекции оксолиниевую кислоту; Iб (хлоргидрат) существенно превосходит по активности и диоксидин: выживаемость животных при применении Iб в дозе 100 мг/кг под кожу - 83 %, при применении диоксидина в этой же дозе выживаемость в случае введения препарата внутрь или под кожу только 25-30%.
Весьма важным является то, что соединение Iб (хлоргидрат) проявляет активность при инфекции, вызванной Ps. aeruginosa, и на модели гнойного менингоэнцефалита мышей (инфекция вызвана внутримозговым заражением, табл. 5). На указанной модели Iб имеет преимущества в активности: 1) по сравнению с оксолиниевой кислотой, которая практически не активна в данном эксперименте; 2) по сравнению с гентамицином в случае применения высоких (400 мг/кг) доз препарата за счет лучшей переносимости; Iб хорошо переносится в дозе 400 мг/кг, для гентамицина - эта доза токсична. При сравнении эффектов Iб с активностью диоксидина на указанной модели следует учитывать, что по переносимости препаратов существенное преимущество имеет Iб. Диоксидин, обеспечивая в дозе 400 мг/кг однократно, практически зависит по выживаемости. Эффект с соединением Iб на 10-ые сутки вызывает у мышей в этой дозе повреждающее действие на надпочечные железы, и, как следствие, возможна отдаленная (на 30-ые сут) гибель животных.
Как видно из табл. 6, заявляемые соединения оказались высокоактивными на модели септицемии мышей, вызванной S. typhi, как при введении per os (Iа), так и при парентеральном введении (Iб), и существенно превышали по активности оксолиниевую кислоту, которая оказывает высокий химиотерапевтический эффект в дозах 50-100 мг/кг. Заявляемые соединения при брюшно-тифозной инфекции высокоактивны, начиная с дозы 6,25 мг/кг (выживаемость 80-100%).
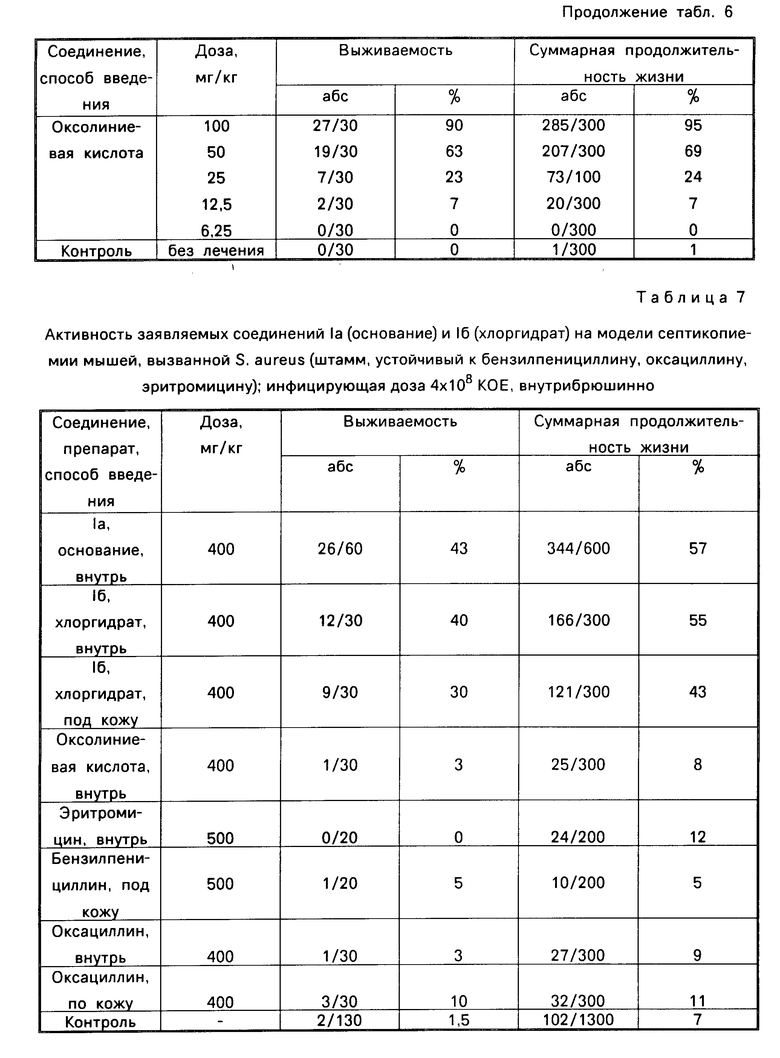
Как видно из табл. 7, заявляемые соединения Iа и Iб проявляют химиотерапевтическую активность при экспериментальной стафилококковой инфекции как при введении под кожу Iб, так и при введении per os Ia и Iб.
На данной модели заявляемые соединения существенно более активны, чем оксолиниевая кислота. Из табл. 7 видно также, что Ia и Iб активны при однократном введении при инфекции, вызванной штаммом стафилококка, устойчивым к бензилпенициллину, оксациллину и эритромицину. Эти антибиотики в данных условиях эксперимента не проявляют химиотерапевтического эффекта, несмотря на применение в очень высоких дозах (400-500 мг/кг). Развитие у бактерий лекарственной устойчивости является одним из основных препятствий при лечении инфекционных процессов. В наших наблюдениях со стафилококком это очень демонстративно на примере инфекции, вызванной полирезистентным штаммом (отсутствие эффекта у антибиотиков, для которых стафилококковая инфекция является одной из первых по показаниям к применению.
Изучение влияния заявляемых соединений Iа и Iб на биосинтез ДНК.
В опытах in vitro с E.coli (штамм К-12) на модели репликации ДНК изучено влияние заявляемых соединений Iа и Iб на биосинтез ДНК сравнительно с оксолиниевой кислотой.
Использовали культуру E.coli К-12 в фазе логарифмического роста. Состояние биосинтеза ДНК оценивали по включению Н3 тимидина в кислотонерастворимую фракцию клеток E.coli. Культуру E.сoli К-12 выращивали на синтетической среде до содержания 5х108 КОЕ мл, охлаждали до 0оС (для остановки роста), добавляли НЗ-тимидин до конечной концентрации 2 мкг/мл, инкубировали с Iа или с Iб, или с оксолиниевой кислотой в концентрациях 0,1; 1; 10 и 100 мкг или в течение 30 мин при 37оС с встряхиванием. После окончания инкубации отбирали пробы (по 1 мл), к которым добавляли 1 мл 10%-ной трихлоруксусной кислоты (ТХУ). Пробы фильтровали (на миллипоровых фильтрах), высушивали, помещали во флаконы с толуольным сцинтиллятором. Радиоактивность проб измеряли в жидкостно-сцинтилляционном счетчике (Delta (Tracor, США) на основании специально разработанного жидкостно-сцинтилляционного метода измерения радиоактивности ДНК в присутствии 6-нитро-производных хинолон-карбоновой кислоты. Уровень ингибирования биосинтеза ДНК определяли по снижению включения НЗ-тимидина.
Как видно из табл. 8 заявляемые соединения Iа (основание) по степени ингибирирования синтеза ДНК соответствуют оксолиниевой кислоте, относящегося к высокоактивным ингибиторам; Iб (хлоргидрат) - растворимая форма - значительно превосходит по степени ингибирования Iа (основание) и оксолиниевую кислоту.
Изучение влияния заявляемых соединений на ультраструктуру бактериальной клетки.
С использованием электронной микроскопии изучено влияния заявляемых соединений Ia и Iб на ультраструктуру клеток стафилококка сравнительно с оксолиниевой кислотой.
Суточную культуру клеток стафилококка (штамм S. aureus 178, полирезистентный, высоковирулентный для мышей) подвергали воздействию Ia, Iб и оксолиниевой кислоты при концентрации микробных клеток в среде 1х106 КОЕ мл, исследовали влияние указанных выше соединений в концентрациях 1,5 и 10 мкг/мл. Ультраструктурные изменения в клетках стафилококка изучали в динамике при экспозиции 24, 48, 72 и 96 ч. Для электронной микроскопии клетки S. aureus фиксировали в 2,5% растворе глютарового альдегида в течение 30 мин и в 1%-ном растворе осмиевой кислоты в течение 15 мин, затем по общепринятой методике (7) заключали в смолу эпон-аральдит. Оценивали следующие структурные изменения в микробной клетке:
незначительные изменения в виде вакуолизации цитоплазмы;
утолщение клеточной стенки;
нарушение процесса деления клеток (формирование цепочек);
образование гигантских клеток (несбалансированный рост),
образование клеток фестонтатой формы с истонченной клеточной стенкой и разрушенной мембраной;
пикноз цитоплазмы;
деспирализация ДНК и вакуолизация нуклеоида;
лизис клеток.
Рассчитывали частоту развития указанных изменений в % по отношению к 100 учитываемым клеткам S. aureus.
Заявляемые соединения Iа и Iб вызывали ряд структурных изменений в бактериальной клетке. Эти изменения были особенно интенсивно выражены под действием растворимой формы - Iб (хлоргидрат). Как видно из табл. 9, у 50-60% клеток при воздействии Iб имела место деспирилизация ДНК с частичной фрагментацией и распадом вещества нуклеоида, у 30-35% клеток развивалось утолщение клеточной стенки, в 20-25% случаях формировались цепочки неразъединенных клеток. В 30-45% случаев наблюдались фестончатой формы с утонченной клеточной стенкой и разрушенной мембраной, в 30-40% встречались гигантские клетки; при воздействии максимальной концентрации в 30% случаев отмечен полный лизис клеток. Нерастворимая форма - Iа (основание) в меньшей степени влияет на развитие структурных изменений в клетках.
Фестончатые клетки, клетки с несбалансированным ростом (гигантские), лизис клеток - свидетельствуют о грубых необратимых изменениях в клетках S. aureus под действием соединения Iб. Этот процесс в значительно меньшей степени выражен при воздействии на клетку в тех же условиях опыта соединением Iа или оксолиниевой кислотой.
Деспирализация ДНК под действием Iб наблюдается у 50-60% обследованных клеток (действующие дозы 5-10 мкг/мл), под действием Iа и препарата сравнения оксолиниевой кислоты в этой же дозе - 30-40% случаев (табл. 9). Различие в степени эффекта особенно демонстративно при оценке действия по этому показателю в действующей дозе 5 мг.
Заявляемые соединения Iа и Iб малотоксичны и хорошо переносятся интактными белыми беспородными мышами массой 15-16 г в дозах до 500 мг/кг однократно, Iа при введении per os, Iб при введении per os и под кожу. В этой же дозе соединения хорошо переносятся и инфицированными животными.
Для растворимого соединения Ia ЛД50 при введении per os в опытах на мышах составляет 2100 мг/кг (1858-2378), при введении внутрибрюшинно - ЛД50 580 мг/кг (517-649,6), что характеризует его как вещество с очень малой токсичностью.
Препарат сравнения оксолиниевая кислота - малотоксична, ЛД50 при введении внутрь в опытах на мышах - 10000 мг/кг, при введении внутрибрюшинно (в виде взвеси в 1%-ном растворе крахмала) 3600 мг/кг (2400-5400).
Таким образом, проведенные исследования показывают высокую антибактериальную активность заявляемых соединений Ia и Iб, и особенно растворимой формы Iб, в опытах на инфицированных животных при генерализованных инфекциях, вызванных синегнойной палочкой (Ps. aeruginosa), брюшно-тифозной палочкой (S. typhi) и золотистым стафилококком (S. aureus), устойчивым к действию антибиотиков.
Весьма важным свойством является активность соединений при инфекции, вызванной синегнойной палочкой как при введении per os (Ia и Iб), так и при парентерально (под кожу, Iб). Следует учесть, что лечение генерализованных инфекций, вызванных Ps. aeruginosa, является одной из очень сложных проблем химиотерапии. Эффективность Iб на модели гнойного менингита говорит о способности Iб проникать через гематоэнцефалический барьер, что является необходимым свойством препаратов, рекомендующихся для лечения гнойных менингитов.
Не менее важным является эффективность Iа и Iб при генерализованной инфекции, вызванной штаммом стафилококка, устойчивым к антибиотикам. Полирезистентные штаммы часто характеризуются и высоковирулентными свойствами, что еще более затрудняет эффективность лечения.
Высокая активность препарата на модели брюшно-тифозной инфекции обосновывает возможность использования заявляемых соединений для лечения брюшного тифа и сальмонеллезов. Арсенал терапевтических средств для лечения этих заболеваний крайне невелик, а эффективные средства для радикального излечения хронического брюшно-тифозного бактерионосительства практически отсутствуют.
Очень важно, что заявляемые соединения малотоксичны, в том числе Iб как при введении per os, так и парентерально.
Заявляемые соединения высокоактивны ин витро. Очень важно, что они оказывают выраженное повреждающее действие на клетки бактерий, особенно Iб; это соединение одновременно является и очень высокоактивным ингибитором синтеза бактериальной ДНК. В связи с этим растворимое заявляемое соединение может быть весьма перспективным в качестве средства для местного лечения гнойно-воспалительных процессов, вызванных грамположительными и грамотрицательными бактериями.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРОХЛОРИД 1- ЦИКЛОПРОПИЛ -6- НИТРО-7-(4-МЕТИЛПИПЕРАЗИНИЛ) -4- ОКСО -1,4- ДИГИДРОХИНОЛИН -3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЙ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 1988 |
|
SU1545546A1 |
| 1-ЭТИЛ-6-НИТРО-7-(4-МЕТИЛПИПЕРАЗИНИЛ)-4-ОКСО-1,4-ДИГИДРОХИНОЛИН-3-КАРБОНОВАЯ КИСЛОТА ИЛИ ЕЕ ГИДРОХЛОРИД, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 1986 |
|
SU1389234A1 |
| 11β -АЦИЛОКСИ- 17α -ГИДРОПЕРОКСИ- 16α -МЕТИЛПРЕГНАНЫ, ОБЛАДАЮЩИЕ МЕСТНОЙ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2030421C1 |
| 3-ФЕНИЛ-1ОН-4,5-ДИГИДРОПИРАЗОЛО[4,3-А]КАРБАЗОЛ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ И АНТИЛЕЙКОЗНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2007394C1 |
| ПРОИЗВОДНЫЕ ИНДОЛИНОНА-3, ОБЛАДАЮЩИЕ АНТИГИПЕРТЕНЗИВНОЙ АКТИВНОСТЬЮ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2008308C1 |
| N -ФОСФОРИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ 3- β -ФЕНИЛИЗОПРОПИЛСИДНОНИМИНА, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2036914C1 |
| АРИЛГИДРАЗОНЫ 5,6,7,8-ТЕТРАГИДРОХИНОЛИНДИОНЫ-2,5, ОБЛАДАЮЩИЕ КАРДИОТОНИЧЕСКОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2009129C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ИНТЕРФЕРОНИНДУЦИРУЮЩЕЙ И ИММУНОМОДУЛИРУЮЩЕЙ (ИММУНОСТИМУЛИРУЮЩЕЙ) АКТИВНОСТЬЮ | 1987 |
|
RU2033157C1 |
| 3-БЕНЗИЛАМИНОМЕТИЛЕНПИРРОЛИДИН-2,4-ДИОН И ПРОТИВОСУДОРОЖНОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 1997 |
|
RU2144918C1 |
| ПРОИЗВОДНЫЕ 4-АЦЕТИЛ-ИМИДАЗО(4,5-В)ИНДОЛ-2-ТИОНА, ОБЛАДАЮЩИЕ ПРОТИВОГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ И ВИРУСИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ВЕНЕСУЭЛЬСКОГО ЭНЦЕФАЛОМИЕЛИТА ЛОШАДЕЙ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2091382C1 |






Изобретение относится к новому антибактериальному средству из класса 4-оксо-хинолин-3-карбоновых кислот, а именно 1-циклопропил-6-нитро-7-(4-метилпиперазинил)-4-оксо-1, 4-дигидрохинолин-3-карбоновой кислоты или ее гидрохлорид. Целью изобретения является новое малотоксичное производное 4-оксохинолин-3-карбоновой кислоты, не содержащее атома фтора в хинолиновом ядре. Поставленная цель достигается структурой нового антибактериального средства, а именно 1-циклопропил-6-нитро-7-(4-метилпиперазинил)-4-оксо-1, 4-дигидрохинолин-3-карбоновой кислоты и ее гидрохлорида для применения внутрь (таблетки, капсулы), парентерально (внутримышечно, под кожу, внутривенно), в виде инъекционных растворов, местно в виде растворов, мазей и свечей. 9 табл.
Применение 1-циклопропил-6-нитро-7-(4-метилпиперазинил)-4-оксо 1,4-дигидрохинолин-3-карбоновой кислоты или ее гидрохлорида общей формулы ·nHCl
·nHCl
где n = 0 или 1,
в качестве антибактериального средства.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Патент ФРГ N 3248507, 1984. | |||
Авторы
Даты
1994-12-15—Публикация
1988-01-20—Подача