Изобретение относится к способам получения сложных алкиловых эфиров 3-хлорантраниловой кислоты путем хлорирования соответствующих сложных эфиров антраниловой кислоты. Более конкретно изобретение относится к селективному хлорированию алкилантранилатов с помощью 1,3-дихлор-5,5-диметилгидантоина.
Алкил-3-хлорантранилаты являются полезными интермедиатами при производстве различных химических продуктов, включая сельскохозяйственные химикаты (см. Патент США N 4954163).
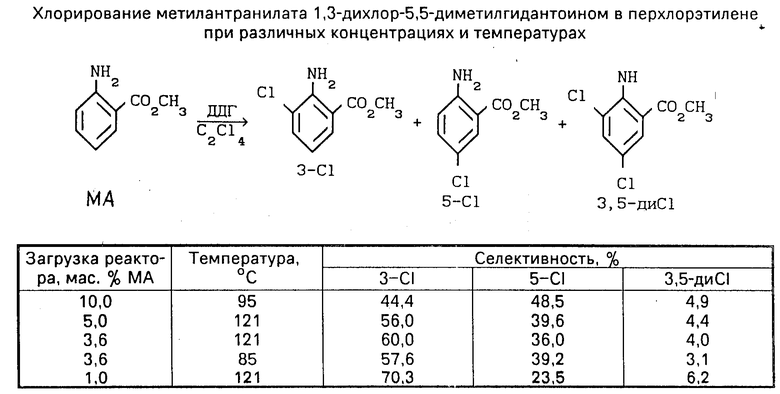
Попытки прямого хлорирования антранилатов в 3-хлоризомер не увенчались большим успехом. Например, хлорирование метилантранилата молекулярным хлором дает преимущественно метил-5-хлорантранилат при одновременном образовании заметных количеств дихлорпроизводного. Для различных субстратов в качестве хлорирующего агента применялся N-хлорсукцинимид, но этот способ дает совершенно непредсказуемые результаты в отношении пропорции образующихся целевого и побочного продуктов. Использование N-хлорсукцинимида для хлорирования анилина и N-алкилированных или алкилированных в кольцо анилинов приводит к получению парахлорированных анилинов или к смесям орто- и пара-хлорированных анилинов (смотри Буу-Хои Н. - J.Chem. Soc., 2815 (1958); Чао Т. - J. Org. Chem., 26, 1079 (1961); Нил Р. - J. Org. Chem., 29, 29, 3390 (1064); и Пол Д. - J. Org. Chem., 41, 3170 (1976). Хотя и имеет место орто-хлорирование, преобладает образование пара-хлорированного продукта.
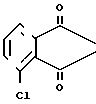
Вследствие этой непредсказуемости процесса электрофильного хлорирования, были предложены другие подходы к получению алкил-3-хлорантранилатов. Например, в патенте США N 4306074 раскрывается получение смеси алкил-3-хлорантранилата и алкил-6-хлорантранилата в соотношении 3:1 из 3-хлорфталевого ангидрида путем аминирования, расщепления по Гофману и этерификации.
 O
O 
Этот способ требует осуществления трех отдельных стадий, не считая разделения смеси, получаемой в результате введения хлора в исходное соединение. Желательно иметь способ, в котором алкил-3-хлорантранилат получается с высоким выходом (по отношению к другим, менее желательным изомерам) непосредственно из соответствующего алкилантранилата.
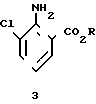
Изобретение относится к способам получения сложных алкиловых эфиров 3-хлорантраниловой кислоты формулы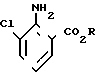 , где R -алкильная группа с неразветвленной или разветвленной цепью с числом атомов углерода от 1 до 4, отличающийся тем, что он включает в себя реакцию сложного алкилового эфира антраниловой кислоты формулы
, где R -алкильная группа с неразветвленной или разветвленной цепью с числом атомов углерода от 1 до 4, отличающийся тем, что он включает в себя реакцию сложного алкилового эфира антраниловой кислоты формулы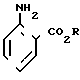 где R имеет указанные значения, с 1,3-дихлор-5,5-диметилгидантоином в среде инертного растворителя при 0-150оС и выделение алкил-3-хлорантранилата из полученной смеси.
где R имеет указанные значения, с 1,3-дихлор-5,5-диметилгидантоином в среде инертного растворителя при 0-150оС и выделение алкил-3-хлорантранилата из полученной смеси.
Другая отличительная особенность изобретения относится к способу отделения сложного эфира 3-хлорантраниловой кислоты от побочно образующегося сложного эфира 5-хлорантраниловой кислоты путем селективного ацетилирования и удаления 5-хлорантранилата. Более конкретно эта отличительная особенность изобретения относится к способам отделения алкил-3-хлорантранилатов от соответствующих 5-хлорантранилатов, который отличается тем, что включает в себя приведение в контакт смеси алкил-5-хлорантранилата и алкил-3-хлорантранилата с 1,0-1,2 экв. уксусного ангидрида, в расчете на 1 экв. 5-хлорантранилата, с образованием смеси алкил-N-ацетил-5-хлорантранилата и алкил-3-хлорантранилата, и отделение ацетилированного 5-хлоризомера от неацетилированного 3-хлоризомера.
Таким образом, изобретение позволяет осуществлять получение и выделение сложных алкиловых эфиров 3-хлорантраниловой кислоты в качестве основного продукта путем хлорирования алкилантранилатов.
Низшие сложные алкиловые эфиры антраниловой кислоты, которые являются исходными веществами в способе согласно изобретению, являются хорошо известными и коммерчески доступными соединениями. Аналогично, 1,3-дихлор-5,5-диметилгидантоин (ДДГ) также является легкодоступным.
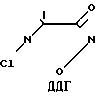

ДДГ способен выделять 2 экв. хлора на один моль реагента. На 1 экв. антранилата используют от около 0,4 до около 0,75 мол. экв. ДДГ; предпочтительно использовать от около 0,45 до около 0,6 экв. ДДГ.
Обычно хлорирование проводят в растворителе, который является инертным в условиях проведения реакции, например, в алифатическом или ароматическом углеводороде или в галогенированном углеводороде. Наиболее предпочтительными инертными растворителями, используемыми в способе согласно изобретению, являются галогенированные углеводороды, такие как галогеноалканы, например, ССl4, CHCl3, CH2Cl2, C2Cl4, и т.д. Наиболее предпочтительным является перхлорэтилен.
Количество растворителя не является существенным, но в разбавленных растворах может быть достигнуто повышение селективности по 3-хлорантранилату. Однако это преимущество следует оценивать в сравнении с затратами на регенерацию и рециркуляцию возросших количеств растворителя. Например, при определенных условиях, уменьшая концентрацию антранилата от около 5 до около 1 мас.%, можно увеличить содержание 3-хлорантранилата в конечной смеси продуктов с около 56 до около 70%. Как правило, используют от около 5 до около 100 мас.ч. растворителя на одну массовую часть антранилата.
Хлорирование проводят при температуре в интервале от 0 до 150оС. Часто бывает удобно проводить реакцию при температуре кипения растворителя. В особенности это удобно в случае предпочтительных растворителей - четыреххлористого углерода и перхлорэтилена.
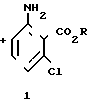
Хлорирование неизбежно приводит к получению смеси продуктов, содержащей 3-хлорантранилат и переменные количества 5-хлорантранилата и 3,5-дихлорантранилата.
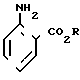 ____→
____→ 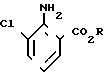 +
+ 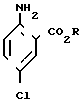 +
+
Даже несмотря на то, что изобретение обеспечивает возможность получения алкил-3-хлорантранилата в качестве основного продукта, он, тем не менее, должен быть выделен из этой смеси. Для облегчения выделения алкил-3-хлорантранилата из смеси, менее желательный 5-хлоризомер может быть селективно ацетилирован и выделен благодаря тому, что после ацетилирования его физические свойства, такие как растворимость и летучесть, становятся сильно отличающимися от исходных. Например, обработкой реакционной смеси 1,0-1,2 экв. уксусного ангидрида в расчете на 1 моль 5-хлорантранилата, присутствующего в реакционной смеси, 5-хлоризомер селективно превращают в ацетанилид, который нерастворим в углеводородных растворителях.
Таким образом, изобретение может быть осуществлено согласно следующему предпочтительному варианту. Алкилантранилат, 1,3-дихлор-5,5-диметилгидантоин (ДДГ) и хлорированный углеводородный растворитель перемешивают при повышенной температуре до тех пор, пока хлорирование не пройдет до конца. Затем реакционную смесь обрабатывают достаточным количеством уксусного ангидрида для того, чтобы ацетилировать содержащийся в ней 5-хлорантранилат. После охлаждения смесь фильтруют для удаления 5,5-диметилгидантоина, образующегося при расходовании ДДГ. Диметилгидантоин можно снова прохлорировать и вернуть в процесс. Из фильтрата упаривают растворитель и остаток суспендируют в углеводородном растворителе. Фильтрованием удаляют твердый алкил-N-ацетил-5-хлорантранилат и снова концентрируют фильтрат. Алкил-3-хлорантранилат выделяют из органического концентрата и отделяют от 3,5-дихлорантранилата вакуумной перегонкой.
П р и м е р 1. Раствор 0,50 г (3,3 ммоль) метилантранилата в 8 мл четыреххлористого углерода при комнатной температуре обрабатывают 0,36 г (1,8 ммоль) 1,3-дихлор-5,5-диметилгидантоина (ДДГ) и полученную смесь кипятят с обратным холодильником в течение 24 ч. После охлаждения смесь разделяют между эфиром и водой и анализируют состав органической фазы методом газовой хроматографии (ГХ): метилантранилат 8,7%, метил-3-хлорантранилат 46,1%, метил-5-хлорантранилат 33,5%, метил-3,5-дихлорантранилат 1,8%.
П р и м е р 2. Методику примера 1 повторяют, используя в качестве растворителя перхлорэтилен. Варьируют температуру реакции и концентрацию. Результаты приведены в таблице.
П р и м е р 3. Раствор 100,0 г (661,5 ммоль) метилантранилата в 1130 мл перхлорэтилена при комнатной температуре обрабатывают 68,42 г (347,3 ммоль) 1,3-дихлор-5,5-диметилгидантоина, и полученную смесь в течение 50 мин нагревают до температуры кипения растворителя, после чего 2 ч кипятят при этой температуре с обратным холодильником. После охлаждения до 100оС добавляют 31,3 мл (331 ммоль) уксусного ангидрида и в течение 30 мин кипятят полученную смесь с обратным холодильником. После охлаждения до комнатной температуры твердый продукт (5,5-диметилгидантоин) удаляют фильтрованием и концентрируют фильтрат в вакууме, получая 134,6 г темного твердого вещества. Это вещество в течение 30 мин перемешивают в 600 мл гексана, получая после фильтрования и сушки на воздухе 54,5 г (36%-ная примесь) метил-N-ацетил-5-хлорантранилата. Фильтрат концентрируют в вакууме, получая 78,5 г темно-янтарного масла, которое очищают вакуумной перегонкой, получая 60,8 г (49,6% ) масла, которое затвердевает при стоянии, т.кип. 80-85оС при 13 Па (0,1 мм рт.ст.), т.пл. 33-35оС.
1Н-ЯМР (СDCl3) , δ: 7,80 (1H, д., J=8 Гц, 6-Н), 7,40 (1н, д., J=8 Гц, 4-Н), 6,58 (1Н, т., J=8 Гц, 5-Н), 6,26 (2Н, широкий с., -NH2) и 3,88 (3Н, с., -СН3).
Сущность изобретения: сложные алкиловые эфиры 3-хлор-антраниловой кислоты, в которых алкил имеет разветвленную или неразветвленную цепь с числом атомов 1 - 4 получают путем реакции соответствующих сложных алкиловых эфиров антраниловой кислоты с 1,3-дихлор-5,5-диметилгидантоином в среде инертного растворителя при 0 - 150°С и отделением из смеси продуктов целевого. Предпочтительно отделяют целевой продукт от содержащегося в смеси соответствующего 5-хлоризомера селективным ацетилированием последнего 1,0 - 1,2 экв. уксусного ангидрида с образованием N-ацетил-5-хлоризомера. 3 з.п. ф-лы, 1 табл.
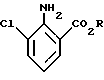
где R - алкильная группа с неразветвленной или разветвленной цепью с числом атомов углерода 1 - 4,
отличающийся тем, что осуществляют реакцию сложного алкилового эфира антраниловой кислоты общей формулы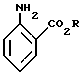
где R имеет указанное значение,
с 1,3-дихлор-5,5-диметилгидантоином в среде инертного растворителя при 0 - 150oС и отделяют сложные алкиловые эфиры 3-хлорантраниловой кислоты из смеси продуктов.
| Патент США N 4306074, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-01-09—Публикация
1992-06-12—Подача