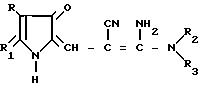
Изобретение относится к новым производным 2-метил-3-этоксикарбонил-5-(2'-циано-3'-аминопроп-2'-енилиден)пирролин- 2-она-4 или 2-(2'-циано-3'-аминопроп-2'-енилиден)индолинона-3 общей формулы 1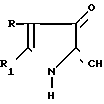

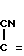
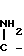
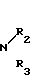

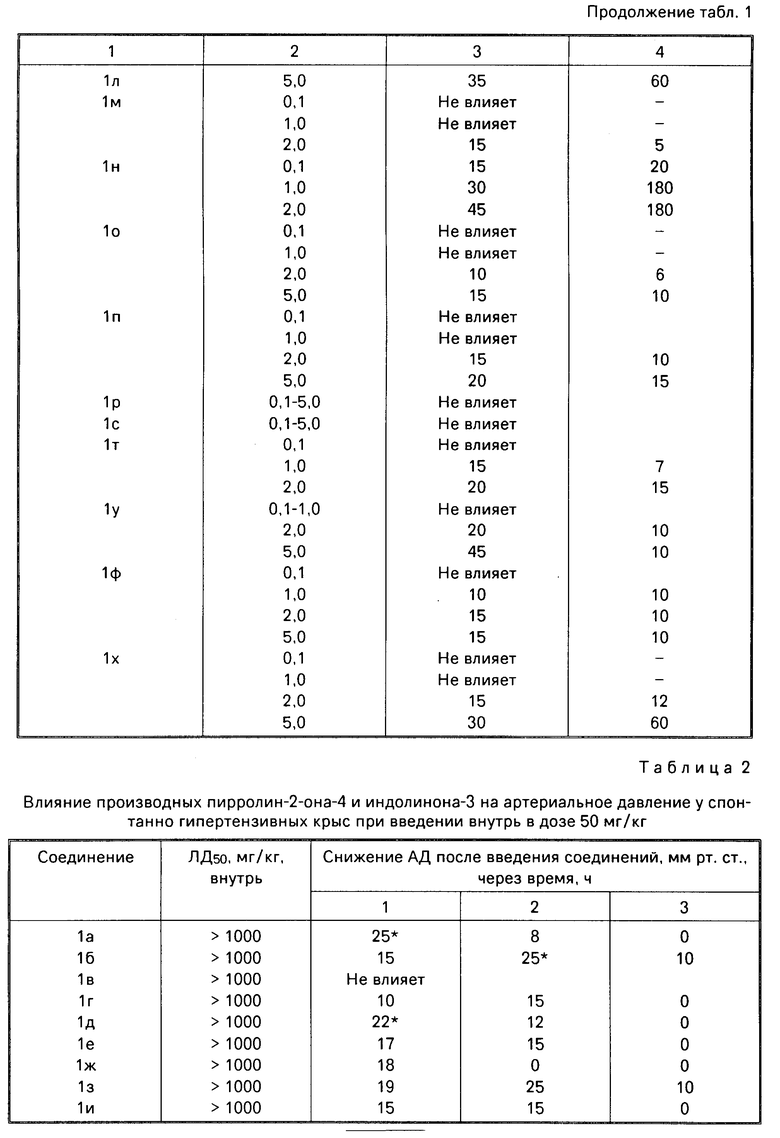
где, если R = COOC2H5, R1 = CH3, то R2 + R3 = (CH2)5 (a) R2 + R3 = CH2CH2OCH2CH2 (б) R2 = H, R3 = CH2C6H5 (в) R2 = H, R3 = CH2C6H4OCH3-4 (г) R2 = H, R3 = CH2C6H3(OCH3)-3,4 (д) R + R1 = CH = CH-CH = CH R2 = R3 = H (е) R2 = H, R3 = (CH2)6 (ж) R2 = H, R3 = CH2CH2N(C2H5)2 (з) R2 = H, R3 = CH2CH(OH)CH2OH (и) R2 + R3 = CH2CH2OCH2CH2 (к) R2 + R3 = CH2CH2N(CH3)CH2CH2 (л) R2+R3=CH2CH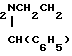 (м) R2 = H, R3 = CH2C6H5 (н)
(м) R2 = H, R3 = CH2C6H5 (н)
R2 = H, R3 = CH2C6H4OCH3-4 (o) R2 = H, R3 = CH2C6H3(OCH3)-3,4 (п) R2 = H, R3 = CH(CH3)C6H5 (p) R2 = H, R3 = CH2CH2C6H5 (c) R2 = H, R3 = CH2СH2C6H3(OCH3)-3,4 (т) R2 = H, R3 = CH(CH3)CH2C6H5 (у) R2 = H, R3 = C6H5 (ф) R2 = H, R3 = C6H4OCH3-4 (x) обладающим антигипертензивной активностью.
В ряду пирролин-2-онов-4 и их бензаналогов не описаны соединения, обладающие антигипертензивными свойствами.
В связи с этим в качестве фармакологического и структурного аналога соединений I выбрано соединение, в структуру молекулы которого входит бензопиррольный фрагмент.
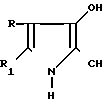
Таким соединением является 1,2-диметил-3-этоксикарбонил-5- оксииндол формулы
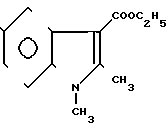 Известный в медицинской практике под названием димекарбин и обладающий антигипертензивными свойствами [1].
Известный в медицинской практике под названием димекарбин и обладающий антигипертензивными свойствами [1].
Димеркабин - малотоксичный препарат, обладает относительно умеренным антигипертензивным действием.
Цель изобретения - поиск в ряду производных пирролин-2-онов-4 и их бензоаналогов веществ, обладающих антигипертензивной активностью и способ их получения.
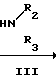
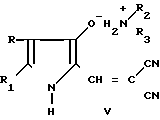
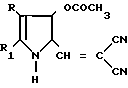
Поставленная цель достигается новыми производными 2-метил-3-этоксикарбонил-5-(2'-циано-3'-аминопроп-2'-енилиден) пирролин-2-она-4 и 2-(2'-циано-3'-аминопроп- 2'-енилиден)индолинона-3 общей формулы 1, которые получают взаимодействием производных пирролил- или индолилакриловой кислоты общей формулы II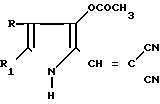 где R и R1 имеют указанные значения, с соответствующими аминами общей формулы III
где R и R1 имеют указанные значения, с соответствующими аминами общей формулы III
HN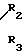 где R2 и R3 имеют указанные значения, в среде низшего спирта (такого как изопропиловый) или ароматического углеводорода (такого, как бензол), при 80-100оС.
где R2 и R3 имеют указанные значения, в среде низшего спирта (такого как изопропиловый) или ароматического углеводорода (такого, как бензол), при 80-100оС.
Схема способа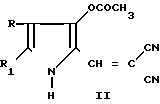
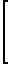
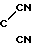 ____→
____→
___→  ___→
___→ 

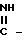
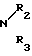
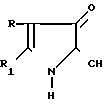

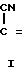
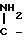
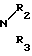
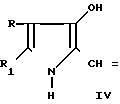
В литературе известен способ получения пирролин-2- онов-4 и индолинонов-3, содержащих группировку, где у атома углерода имеется одна аминная группа, заключающийся в том, что 2-метил-3-этоксикарбонилпирролин-2-он-4 или N-ацетилиндоксил подвергают взаимодействию с ацеталями амидов кислот в среде изопропилового спирта или бензола при кипячении [2]. Однако отсутствуют сведения о получении соединений, относящихся к ряду пирролин-2-онов-4 и индолинонов-3, содержащих группировку, в которой при одном углеродном атоме имеются две аминные функции. Так же как и отсутствуют сведения о том, что соединения, имеющие в качестве структурного фрагмента группировку формулы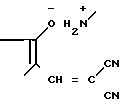 при нагревании в растворителях превращаются в амидины.
при нагревании в растворителях превращаются в амидины.
Условия проведения способа согласно изобретению впервые позволяли осуществить прямое нуклеофильное присоединение к С=N-связи с образованием соединений общей формулы I, что оказалось неожиданным. Неожиданной была и возможность выделения этих соединений из реакционной среды без их дальнейших превращений, т. к. известно, что производные α -циано-β-3-оксииндолилакриловой кислоты (сходные по структуре с соединениями формулы V, используемые в синтезе соединений 1) в сходных условиях (кипячение в толуоле) превращаются в трициклические пирроло[1,2-a]индолы.
П р и м е р 1. Получение 2-метил-3-этоксикарбонил-5(2'-циано- 3'-амино-3'-пиперидинопроп-2'-енилиден)пирролин-2-она-4(1а) без выделения промежуточной соли Va.
Смесь 0,5 г (1,74 моль) нитрила α -циано-β -(2-метил-3-этоксикарбонил-4-ацетоксипиррол-5-ил)акриловой кислоты, 30 мл изопропилового спирта и 0,3 г (3,48 ммоль)пиперидина кипятят 2 ч. Охлаждают, выпавший осадок отфильтровывают, промывают изопропиловым спиртом и эфиром.
Получают 0,27 г (47%) 2-метил-3-этоксикарбонил-5-(2'-циано- 3'-амино-3'-пиперидинопроп-2'-енилиден)пирролин-2-она-4, т.пл. 213-5оС (из ДМФА).
П р и м е р 2. Получение 2-метил-3-этоксикарбонил-5-(2'-циано- 3'-амино-3'-пиперидинопроп-2'-енилиден)пирролин-2-она-4 (1а).
а) Получение пиперидиновой соли нитрила α -циано-β -(2-метил-3-этоксикарбонил-4-оксипиррол-5-ил)-акриловой кислоты (Va).
Смесь 0,45 г (1,57 ммоль) нитрила α -циано-β -(2-метил-3-этоксикарбонил-4-ацетоксипиррол-5-ил)акриловой кислоты (II) и 0,53 г (6,27 ммоль) пиперидина в 15 мл бензола кипятят 20 мин. Охлаждают, выпавший осадок отфильтровывают, промывают бензолом.
Получают 0,4 г (78% ) пиперидиновой соли нитроила α -циано-β -(2-метил-3-этоксикарбонил-4-оксипиррол-5-ил)акриловой кислоты (Va). Соединение не имеет четкой т.пл.
ИК-спектр, ν, см-1: 3280, 3160 (NH), 2710-2380 (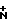 H2), 2210, 2190 (CN), 1700 (СООС2Н5), 1600 (С=С).
H2), 2210, 2190 (CN), 1700 (СООС2Н5), 1600 (С=С).
ЯМР1 Н-спектр (ДМСО- d6, δ, м.д.): 4,08 (2Н, кв. СН2СН3), 2,42 (3Н, С, 2-СН3), 2,21 (3Н, тр., СН2СН3), 1,63 (6Н, м, β,β,γ , -метиленовые протоны пиперидинового фрагмента), 3.01 м. д. )4Н, тр. α,α,-метиленовые протоны пиперидинового фрагмента).
Найдено, %: С 61,86; Н 6,63; N 16,92. М+ 245
С17Н22N4O3
Вычислено, %: C 61,80; H 6,71; N 16,96. М 330.
б) Получение 2-метил-3-этоксикарбонил-5-(2'-циано-3'-амино-3'- пиперидинопроп-2'-енилиден)пирролин-2-она-4 (1а).
Раствор 1,62 г (5 ммоль) пиперидиновой соли Va в 230 мл изопропилового спирта кипятят 2 ч. Охлаждают, выпавший осадок отфильтровывают, промывают изопропиловым спиртом и эфиром.
Получают 1,4 г (87,5%) 2-метил-3-этоксикарбонил-5-(2'-циано- 3'-амино-3'-пиперидинопроп-2'-енилиден)пирролин-2-она-4, т. пл. 213-5о(из ДМФА). Температура плавления смешанной пробы вещества с образцом, полученным в условиях примера 1, не показывает депрессии.
П р и м е р 3. Получение 2-метил-3-этоксикарбонил-5-(2'-циано- 3'-амино-3'-морфолинопроп-2'-енилиден)пирролин-2-она-4 (1б).
а) Получение нитрила α -циано-β -(2-метил-3-этоксикарбонил-4-оксипиррол-5-ил)акриловой кислоты (IV).
Раствор 0,25 г (0,76 ммоль) пиперидиновой соли нитрила α -циано-β -(2-метил-3-этоксикарбонил-4-оксипиррол-5-ил)акрило- вой кислоты (Vб), полученной в условиях примера 2а в 15 мл метанола, охлаждают до +10о, подкисляют 1н раствором соляной кислоты до слабокислой реакции по универсальному индикатору. Выпавший осадок отфильтровывают, промывают водой и метанолом.
Получают 0,15 г (81%) нитрила α -циано-β -(2-метил-3-этоксикарбонил-4-оксипиррол-5-ил) акриловой кислоты, т.пл. 242-243оС (из смеси метанол-диоксан, 4:1).
ИК-спектр, ν , см-1: 3280 (NH), 2200 (СN), 1680 (СООС2Н5), 1600 (С=С).
ЯМР 1Н спектр (ДМСО-d6, δ ,м.д.): 7,52 (1Н, с, СН), 4,22 (2Н, кв., СН2СН3), 2,51 (3Н, с, 2-СН3), 1,27 м.д. (3Н, тр., СН2СH3).
Найдено, %: C 58,66; H 4,42; N 16,95. М+ 245
С12Н11N3O3.
Вычислено, %: C 58,77; H 4,52; N 17,14. М 245.
б) Получение 2-метил-3-этоксикарбонил-5-(2'-циано-3'амино- 3'-морфолинопроп-2'-енилиден)пирролин-2-она-4 (1б).
Смесь 0,5 г (2,04 ммоль) нитрила α -циано-β -(2-метил-3-этоксикарбонил-4-оксипиррол-5-ил)акриловой кислоты (IV) и 0,22 г (2,5 ммоль) морфолина в 35 мл изопропилового спирта кипятят 2 ч. Выпавший осадок отфильтровывают, промывают изопропиловым спиртом и эфиром.
Получают 0,52 г (67,7%) 2-метил-3-этоксикарбонил-5-(2'-циано-3'- амино-3'-морфолинопроп-2'-енилиден)пирролин-2-она-4, т. пл. 208-210оС (из ДМФА),
П р и м е р 4. 2-Метил-3-этоксикарбонил-5-(2'-циано-3'-амино- 3'-бензиламинопроп-2'-енилиден)пирролин-2-он-4 (1в).
2-метил-3-этоксикарбонил-5-[2'-циано-3'- амино- 3'(4-метоксибензиламино) проп-2'-енилиден]пирролин-2-он-4 (1г). 2-метил-3-этоксикарбонил-5-[2'-циано-3'-амино-3'(3,4-диметоксибензиламино) проп-2'-енилиден] пирролин-2-он-4 (1д) получают из нитрила α -циано-β -(2-метил-3-этоксикарбонил-4-оксипиррол-5-ил)акриловой кислоты (IV, 2,04 ммоль), синтезированного в условиях примера 3 а и 2,5-3 ммоль бензиламина, 2,5-3 ммоль 4-метоксибензиламина, 2,5-3 ммоль 3,4-диметоксибензиламина соответственно в условиях примера 3б.
Получают 1в - 0,55 г (76%), т.пл. 233-235оС (разложение из изопропилового спирта),
1г - 0,4 г (50%), т.пл. 258-260оС (из ДМФА),
1д - 0,47 г (56%), т.пл. 254-255оC (из ДМФА).
П р и м е р 5. Получение 2-(2'-циано-3',3'-диаминопроп-2'енилиден)индолинона-3 (1е).
а) Получение аммонийной соли α -циано-β -(3-оксииндолил-2)акриловой кислоты (Ve).
Способ 1.
В суспензию 2,5 г (10 ммоль) нитрила α -циано-β -(2-ацетоксииндолил-2)акриловой кислоты в 100 мл бензола при кипячении и перемешивании пропускают аммиак в течение 2,5 ч. Затем, охлаждают, осадок отфильтровывают, промывают бензолом и эфиром.
Получают 2 г (88,5%) аммонийной соли нитрила α -циано-β -(3-оксииндолил-2)акриловой кислоты, т.пл. 140оС (разл.).
Масса-спектр: М+ 209.
Брутто-формула С12Н10N4O М 226
Способ 2.
К суспензии 5 г (20 ммоль) нитрила α -циано-β -(3-ацетоксииндолил-2) акриловой кислоты в 200 мл бензола добавляют 10 мл насыщенного раствора аммиака в метаноле. Кипятят при перемешивании 1 ч. Охлаждают, осадок отфильтровывают, промывают бензолом и эфиром.
Получают 3,8 г (84%) аммонийной соли нитрила α -циано-β -(3-оксииндолил-2)акриловой кислоты, т.пл. 140оС (разл.). Температура плавления смешанной пробы вещества с образцом, полученным по способу 1, не показывает депрессии.
б) Получение 2-(2'-циано-3', 3'-диаминопроп-2'-енилиден)индолинона-3) (1е).
Раствор 2 г аммонийной соли Ve в 50 мл изопропилового спирта кипятят при перемешивании 1 ч. Охлаждают, осадок отфильтровывают, промывают изопропиловым спиртом и эфиром.
Получают 1 г (44%) 2-(2'-циано-3',3'-диаминопроп-2'-енилиден) индолинона-3, т.пл, 263оС (разл., из метанола).
П р и м е р 6. Получение 2-(2'-циано-3'-амино-3'-циклогексиламинопроп-2'-енили- ден) индолинона-3 (1ж).
а) Получение циклогексиламмонийной соли нитрила α -циано-β -(3- оксииндолил-2)-акриловой кислоты (Vж).
Смесь 5 г (20 ммоль) нитрила α -циано-β -(3-ацетоксииндолил-2)акриловой кислоты, 200 мл бензола и 4,96 г (50 ммоль) циклогексиламина кипятят при перемешивании 1 ч. Охлаждают, осадок отфильтровывают, промывают бензолом и эфиром.
Получают 5,5 г (90%) циклогексиламмонийной соли нитрила α -циано-β -(3-оксииндолил-2)акриловой кислоты, т.пл. 180оС (разл.).
ИК-спектр, ν , см-1: 3440, 3080 (NH), 2700-2500 (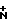 H3), 2180, 2170 (2СN), 1610, 1590 (С=С).
H3), 2180, 2170 (2СN), 1610, 1590 (С=С).
Масс-спектр: М+ 209.
С18 Н20N4O М 308.
б) Получение 2-(2'-циано-3'-амино-3'-циклогексиламинопроп-2'- енилиден)-индолинона-3 (1ж).
Из 5,5 г циклогексиламмонийной соли Vж в условиях примера 5б получают 2,6 г (42%) 2-(2'-циано-3'-амино-3'-циклогексиламинопроп-2'-енилиден)индолинона-3, т.пл. 263оС (разл., из Н2О-ДМФА, 1:1).
П р и м е р 7. Получение 2-[2'-циано-3'-амино-3' -(β-диэтиламиноэтил) аминопроп-2'-енилиден]индолинона-3 (1з).
Смесь 7,53 г (30 ммоль) нитрила α -циано-β -(3-ацетоксииндолил-2) акриловой кислоты, 230 мл бензола и 7,16 г (60 ммоль) β-диэтиламино-этиламина кипятят при перемешивании 20 мин. Охлаждают, осадок отфильтровывают, промывают бензолом и эфиром.
Получают 5,75 г (59%) 2-[2'-циано-3'-амино-3'(β -диэтиламиноэтил)- аминопроп-2'-енилиден] ндолинона-3, т.пл. 218-223оС (разл., из метанола).
П р и м е р 8. Получение 2-[2'-циано-3'-амино-3'( β,γ -дигидроксипропил)аминопроп-2'-енилиден]идолинона-3 (Iи).
Смесь 5 г (20 ммоль нитрила α -циано-β - (3-ацетоксииндолил-2) акриловой кислоты, 200 мл бензола и 4,5 г (49 ммоль) аминопропан-2,3-диола кипятят при перемешивании 0,5 ч. Охлаждают, бензол декантируют, к остатку добавляют 100 мл изопропилового спирта и кипятят при перемешивании 1,5 ч. Охлаждают, осадок отфильтровывают, промывают изопропиловым спиртом и эфиром.
Получают 2,6 г (43% ) 2-[2'-циано-3'-амино-3' ( β, γ -дигидроксипропил)аминопроп-2'-енилиден]индолинона-3, т.пл. 199оС (разл., из метанола).
П р и м е р 9. Получение 2-(2'-циано-3' амино-3'-фениламинопроп-2'-енилиден)ин- долинона-3 (Iф).
Смесь 0,5 г (2 ммоль) нитрила α -циано-β -(3-ацетоксииндолил-2) акриловой кислоты, 10 мл изопропилового спирта и 0,74 г (8 ммоль) анилина кипятят 45 мин. Охлаждают, осадок отфильтровывают, промывают изопропиловым спиртом и эфиром.
Получают 0,35 г (58%) 2-(2'-циано-3'-амино-3'-фениламинопроп-2'-енилиден) индолинона-3, т.пл. 226-227оС (разл., из Н2О-ДМФА, 1:1).
Температура плавления смешанной пробы вещества с образцом, полученным в условиях примера 7, не показывает депрессии.
П р и м е р 10. Получение 2-[2'-циано-3'-амино-3'(n-метоксифенил)аминопроп-2'-енилиден]индолинона-3 (Iх).
Получают из 5 г (20 ммоль)нитрила α -циано-β -(3-ацетоксииндолил-2) акриловой кислоты, 5 г (40 ммоль) n-анизидина и 200 мл изопропилового спирта в условиях примера 9.
Получают 2,8 г (42%) 2-(2'-циано-3'-амино-3'-(n-метоксифенил) аминопроп-2'-енилиден]индолинона-3, т.пл. 213оС (разл., из Н2О-ДМФА, 1:1).
Температура плавления смешанной пробы вещества с образцом, полученным в условиях примера 7, не показывает депрессии.
В условиях примера 7 из нитрила α -циано-β -(3-ацетоксииндолил-2) -акриловой кислоты (II) и соответствующих аминов получают:
2-[2'-циано-3'-амино-3'-морфолинопроп -2'-енилиден] индолинон-3 (Iк). Выход 95%, т.разл. 203оС.
2-[2'-циано-3'-амино-3'-(N-метилпипе-разино)проп-2'-енилиден] индолинон-3 (Iл), 87%, т.разл. 240оС;
2-[2'-циано-3'-амино-3'-бензгидрилпиперазинопроп-2'-енилиден) индолинон-3 (Iм), 86%, т.разл. 227-228оС;
2-(2'-циано-3'-амино-3'-бензиламино-проп-2'-енилиден) индолинон-3 (Iн), 86%, т.разл. 259-260oC
2-[2'-циано-3'-амино-3'-(4-метоксибен-зиламино)-проп-2'-енилиден] индолинон-3 (Iо), 79%, т.разл, 249оС;
2-[2'-циано-3'-амино-3'-(3,4-диметоксибензиламино)проп-2'- енилиден]индолинон-3 (Iп), 79%, т.разл. 260оС;
2[2'-циано-3'-амино-3'-(α -фенилэтиламино)проп-2'-енилиден]индолинон-3 (Iр), 69%, т.разл. 249оС;
2-[2'-циано-3'-амино-3'-(β -фенилэтиламино)проп-2'-енилиден] индолинон-3 (Ic), 80%, т.разл. 249оС;
2-[2'-циано-3'-амино-3'-(β-3,4-диметокси- фенилэтиламино)проп-2'- енилиден]индолинон-3 (Iт), 79%, т.разл. 230-232оС;
2-[2'-циано-3'-амино-3'-(α -метил- β-фенилэтиламино)проп-2'-енилиден] инолинон-3 (Iу), 65%, т.разл. 236оС;
2-[2'-циано-3'-амино-3'-фениламино- проп-2'-енилиден) индолинон-3 (Iф), 36%, т.разл. 226-227оС;
2-[2'-циано-3'-амино-3'-(4-метоксифени- ламино)проп-2'- енилиден]индолинон-3 (Iх), 61%, т.разл. 213оС.
Биологические испытания.
Производные пирролин-2-она-4 и индолинона изучены по влиянию на артериальное давление (АД), определена также их острая токсичность (ЛД50).
Острую токсичность производных указанных химических рядов определяли на мышах-самцах массой 18-20 г при введении внутрь. В результате экспериментов установлено, что ЛД50 соединений превосходит 1000 мг/кг, что позволяет отнести их к малотоксичным веществам (по классификации Сидорова К.К., 1973).
Изучение антигипертензивной активности соединений было проведено на спонтанно гипертензивных крысах линии Оkamoto Aori при использовании методов прямой и непрямой регистрации АД.
а) Прямую регистрацию АД проводили у наркотизированных уретаном (1 мг/кг, внутрибрюшинно) спонтанно гипертензивных (СГ) крыс) обоего пола, массой 280-300 г в левой общей сонной артерии животных.
Исследованные соединения вводили в яремную вену через катетер в диапазоне доз от 0,1 до 5,0 мг/кг.
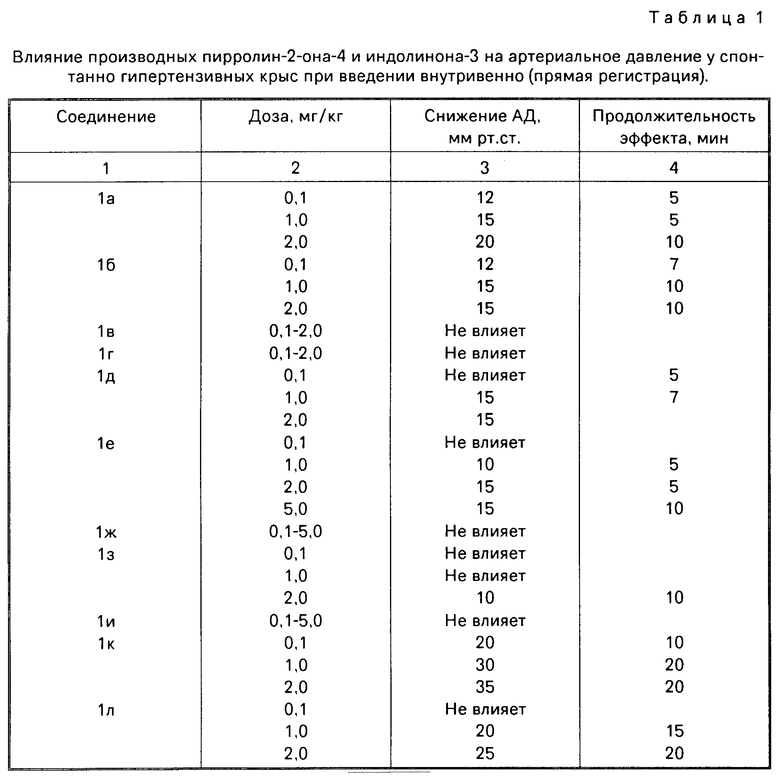
Результаты исследования производных пирролин-2-она-4 (1а-д) и производных индолинона-3 (Ie-x) на АД у СГ крыс при внутривенном введении представлены в табл.1.
Как видно из табл. 1, большинство изученных соединений при внутривенном введении оказывают в разной степени выраженный антигипертензивный эффект у СГ крыс. В то же время соединения Iв и Iг (производные пирролин-2-она-4) и 4 производных индолинона-3 (Iж, и, р, с) в изученном диапазоне доз не оказывали заметного влияния на уровень АД у СГ крыс.
Среди производных индолинона-3 наиболее активны были соединения Iк и Iн, вызывающие снижение АД у СГ крыс, начиная с дозы 0,1 мг/кг (внутривенно). При повышении дозы указанных соединений до 1,0 и 2,0 мг/кг наблюдалось дозозависимое усиление антигипертензивного эффекта и увеличение его продолжительности (см.табл.1).
Несколько менее активными среди производных указанного ряда были соединения Iл, т, у, ф, х, антигипертензивное действие которых проявлялось при введении в высоких дозах: 1,0-5,0 мг/кг (внутривенно); их эффект был менее выражен и непродолжителен (от 10 до 30 мин) после введения.
Среди производных пирролин-2-она-4 наиболее активны были соединения Iа, б, д, однако по выраженности антигипертензивного эффекта и продолжительности действия эти соединения уступают производным индолинона-3.
б) На ненаркотизированных СГ крысах обоего пола, массой 230-250 г изучали влияние производных пирролин-2-она-4 и индолинона-3 на АД при введении внутрь. Измерение АД проводили бескровным методом регистрации в хвостовой артерии животных с помощью фотоэлектрических датчиков давления. Соединения вводили однократно внутpь в дозе 50 мг/кг, в виде водных растворов или суспензий с добавлением Твин-80.
В качестве препарата сравнения в этих экспериментах был использован димекарбин (в дозе 50 мг/кг, внутрь), имеющий элементы структурного сходства с производными пирролин-2-она-4 и индолинона-3.
В опытах регистрировали исходный уровень АД (до введения соединений и препарата сравнения) и АД через 1, 2 и 3 ч после введения. Во время эксперимента животные находились в камере при температуре воздуха 28оС, количество животных в каждой группе - 6.
Результаты экспериментов по изучению влияния производных индолинона 3 и пирролин-2-она-4 на АД при введении внутрь, а также значение их ЛД50представлены в табл.2. В этих экспериментах были подтверждены данные о наличии у ряда производных индолинона-3 и пирролин-2-она-4 антигипертензивных свойств.
Как следует из приведенных в табл.2 данных, наибольшей антигипертензивной активностью среди исследованных соединений обладают производные индолинона-3: Iк, Iн, вызывающие при введении внутрь в дозе 50 мг/кг снижение АД у СГ крыс на 30-40 мм рт.ст., в течение 3 ч эксперимента. Менее активны в указанном химическом ряду соединения Iл, п, т, у, ф, х - снижение АД составляло 20-25 мм рт.ст., продолжительность действия - 2 ч после введения. Производные индолинона-3 Iе, ж, и, м, о, р, с при введении внутрь в использованной дозе не вызывали достоверного снижения АД у СГ крыс. Среди производных пирролин-2-она-4 антигипертензивное действие оказывали соединения Iа, б, д, по выраженности и продолжительности эффекта производные пирролин-2-она-4 в целом уступали производным индолинона-3, однако, и менее активные производные индолинона-3 и производные пирролин-2-она-4, обладающие антигипертензивной активностью, были сопоставимы по действию и продолжительности эффекта с препаратом сравнения димекарбином. Наиболее активные производные индолинона-3 - Iк, Iн - по выраженности антигипертензивного эффекта превосходили димекарбин в 2-2,5 раза и обладали большей продолжительностью действия, следует отметить, что эти же соединения были наиболее активны при внутривенном введении.
Таким образом, среди новых производных индолинона-3 и пирролин-2-она-4 обнаружены малотоксичные соединения, обладающие антигипертензивной активностью как при внутривенном введении, так и при введении внутрь, и не уступающие (или превосходящие) по эффективности препарату сравнения димекарбину.
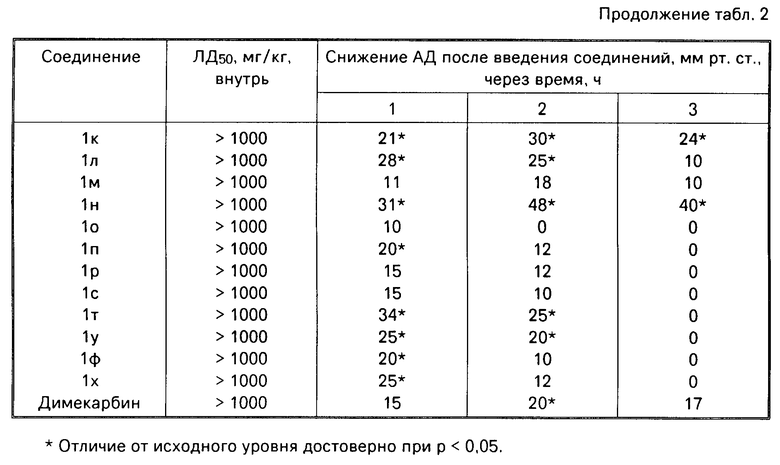
Использование: в качестве веществ, обладающих антигипертензивной активностью. Сущность изобретения: продукт - производные пирролин-2-она-4 или индолина-3 общей формулы I (а - х) - : где R- COOC2H5 , R1 и CH3 ; R2+ R3 - (CH2)5 (а), R2+R3 - CH2CH2OCH2CH2 (б), R2 - H, R3 - CH2C6H3 (в), R2 - H, R3 - CH2C6H4-OCH3-4 (г), R2 -H, R3 - CH2C6H3-(OCH3)2-3,4 (д), R + R1 -CH-CH-CH-CH R2=R3 -H (е), R2 -H, R3 - (CH2)6 (ж), R2 -H, R3 - CH2CH2N(C2H5)2 (з), R2 -H, R3 - CH2CH(OH)CH2OH (и), R2+R3 - CH2CH2OCH2CH2 (к), R2+R3 - CH2CH2N(CH3)CH2CH2 (л), R2+R3 - 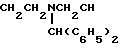 (м), R2 -H, R3 - CH2C6H5/ (н), R2 -H, R3 - CH2C6H5-OCH3-4 (о), R2 -H, R3 - CH2C6H3(OCH3)2- 3,4 (п), R2 -H, R3 - CH(CH3)C6H5 (р), R2 -H, R3 - CH2CH2C6H5 (с), R2 -H, R3=CH2CH2C6H3(OCH3)2 -3,4 (т), R2 -H, R3 - CH(CH3)CH2C6H5 (у), R2 -H, R3= C6H5 (ф), R2 -H, R3 - C6H4(OCH3) - 4 (х). Реагент 1: производные пирролил- или индолилакриловой кислоты общей формулы II, где R и R1 имеют указанные значения. Реагент 2: амины общей формулы: NH(R2)(R3) , где R2 и R3 имеют указанные значения. Условия реакции: в среде низшего спирта, такого как изопропиловый, или ароматического углеводорода, такого как бензол, при 80 - 100°С. 2 с.п. ф-лы, 2 табл.
(м), R2 -H, R3 - CH2C6H5/ (н), R2 -H, R3 - CH2C6H5-OCH3-4 (о), R2 -H, R3 - CH2C6H3(OCH3)2- 3,4 (п), R2 -H, R3 - CH(CH3)C6H5 (р), R2 -H, R3 - CH2CH2C6H5 (с), R2 -H, R3=CH2CH2C6H3(OCH3)2 -3,4 (т), R2 -H, R3 - CH(CH3)CH2C6H5 (у), R2 -H, R3= C6H5 (ф), R2 -H, R3 - C6H4(OCH3) - 4 (х). Реагент 1: производные пирролил- или индолилакриловой кислоты общей формулы II, где R и R1 имеют указанные значения. Реагент 2: амины общей формулы: NH(R2)(R3) , где R2 и R3 имеют указанные значения. Условия реакции: в среде низшего спирта, такого как изопропиловый, или ароматического углеводорода, такого как бензол, при 80 - 100°С. 2 с.п. ф-лы, 2 табл.
ПРОИЗВОДНЫЕ ПИРРОЛИН-2-ОНА-4 ИЛИ ИНДОЛИНОНА-3, ОБЛАДАЮЩИЕ АНТИГИПЕРТЕНЗИВНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ.
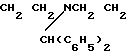 ;
;
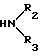
| Рябова С.Ю | |||
| и др | |||
| Ацетали лактамов и амидов кислот | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
Авторы
Даты
1995-01-09—Публикация
1991-06-28—Подача