Изобретение относится к новым химическим соединениям, конкретно к 2-ариламино-3-циклоалкиламино-1,4-нафтохино- нам общей формулы (I) где Х = м-COOCH3, п-COOCH3, п-COOC2H5, м-CF3, п-COCH3, Y = -N
(I) где Х = м-COOCH3, п-COOCH3, п-COOC2H5, м-CF3, п-COCH3, Y = -N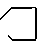 , -N
, -N , -N
, -N O .
O .
2-Ариламино-3-циклоалкиламино-1,4-нафтохиноны могут применяться для получения фоторезистивной пленки путем вакуумного осаждения. Указанные соединения, их свойства и получение в литературе не описаны.
В качестве вакуумного фоторезиста известно использование пигмента зеленовато-голубого фталоцианинового "У".
К недостаткам этого соединения относится высокая температура испарения 400-420оС, что делает невозможным использование его в технологических процессах при формировании топологических рисунков в функциональных слоях, имеющих низкую температуру разложения (< 400оС). Кроме того, субмикронное разрешение (т. е. < 1 мкм) можно получить лишь при использовании жесткого УФ-излучения с λ = 266 нм.
Задачей предлагаемого изобретения является синтез 2-ариламино-3-циклоалкиламино-1,4-нафтохинонов, которые могут быть использованы в технологических процессах получения фоторезистивной пленки путем вакуумного осаждения при температуре ниже температуры плавления предлагаемых соединений (см. табл. 1) - около 120оС, использования для экспонирования стандартных источников излучения (например, ртутная лампа ДРШ-300), а также возможность проявления как в условиях вакуумного напыления (т.е. 120оС), так и при комнатной температуре, применяя для проявления органические углеводороды (гексан, гептан, петролейный эфир, уайт-спирит и др.).
Целью изобретения является синтез 2-ариламино-3-циклоалкиламино-1,4-нафто-хинонов, которые могли бы быть использованы в технологических процессах получения фоторезистивной пленки путем вакуумного осаждения.
2-Ариламино-3-циклоалкиламино-1,4-нафтохиноны указанной общей формулы I получают путем последовательного нуклеофильного замещения атомов хлора в 2,3-дихлорнафтохиноне на ариламиногруппу и остаток циклического амина: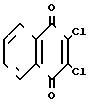

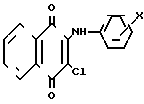
 где Х = м-СOOCH3, п-COOCH3, п-COOC2H5, м-CF3, п-COCH3; Y = -N
где Х = м-СOOCH3, п-COOCH3, п-COOC2H5, м-CF3, п-COCH3; Y = -N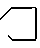 , -N
, -N , -N
, -N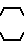 O .
O .
В предложенном способе используют следующие ароматические амины: м- и п-карбометокси- и п-карбоэтоксианилины, м-трифторанилин и п-аминоацетофенон. В качестве циклических аминов используют пиперидин, морфолин, пирролидин.
Для замещения атомов хлора в 2,3-дихлорнафтохиноне на остаток ароматического амина реакцию проводят при длительном кипячении в спирте (20-25 ч) с добавкой или без нее в качестве катализатора третичного амина. Замещение второго атома хлора происходит при кипячении в 2-3-кратном избытке амина либо при нагревании в сильнополярных растворителях - диметилсульфоксиде, диметилформамиде.
Для лучшего понимания данного изобретения приводятся следующие примеры получения 2-ариламино-3-циклоалкиламино-1,4-нафтохинонов.
П р и м е р 1. Получение 2-(3'-карбометоксианилино)-3-морфолино-1,4-нафтохи-нона.
10 г 2,3-дихлорнафтохинона, 12 г метилового эфира 3-аминобензойной кислоты и 50 мл этилового спирта кипятили 6 ч. Выпавший осадок отфильтровывали, промывали спиртом. Получали 14,2 г 2-(3'-карбометоксианилино)-3-хлор-1,4-нафтохинона.
4 г 2-(3'-карбометоксианилино)-3-хлор-1,4-нафтохинона, 20 мл морфолина выдерживали при 100оС 3 ч. После охлаждения реакционную массу выливали в воду, выпавший осадок отфильтровывали, промывали водой, высушивали на воздухе. Получили 3,56 г 2-(3'-карбометоксианилино)-3-морфолино-1,4-нафтохинона.
П р и м е р 2. Получение 2-(3'-карбометоксианилино)-3-пирролидино-1,4-нафтохи- нона.
3,5 г 2-(3'-карбометоксианилино)-3-хлор-1,4-нафтохинона, 2 мл пирролидина, 50 мл диметилформамида выдерживали при комнатной температуре 1 ч. Реакционную смесь обрабатывали аналогично примеру 1. Получили 3,35 г 2-(3'-карбометоксианилино)-3-пирролидино-1,4-нафтохинона.
П р и м е р 3. Получение 2-(4'-карбометоксианилино)-3-морфолино-1,4-нафтохи- нона.
12 г 2,3-дихлорнафтохинона, 16,5 г метилового эфира 4-аминобензойной кислоты, 150 мл этилового спирта, 1 мл N,N'-диэтиланилина кипятили 15 ч. Образовавшийся осадок отфильтровывали, промывали спиртом. Получили 17,05 г 2-(4'-карбометоксианилино)-3-хлор-1,4-нафтохинона.
5 г 2-(4'-карбометоксианилино)-3-хлор-1,4-нафтохинона, 80 мл диметилсульфоксида, 3 мл морфолина выдерживали при 80оС 5 ч. Реакционную смесь обрабатывали аналогично примеру 1. Получили 4,58 г 2-(4'-карбометоксианилино)-3-морфолино-1,4-наф-тохинона.
П р и м е р 4. Получение 2-(4'-карбоэтоксианилино)-3-морфолино-1,4-нафтохинона.
10 г 2,3-дихлорнафтохинона, 15 г этилового эфира 4-аминобензойной кислоты, 150 мл этилового спирта кипятили 20 ч. Выпавший осадок отфильтровывали, промывали спиртом. Получили 14,5 г 2-(4'-карботоэтоксианилино)-3-хлор-1,4-нафтохинона.
5 г 2-(4'-карбоэтоксианилино)-3-хлор-1,4-нафтохинона, 20 мл морфолина выдерживали при 100оС 3 ч. Реакционную смесь обрабатывали аналогично примеру 1. Получили 5,71 г 2-(4'-карбоэтоксианилино)-3-морфолино-1,4-нафтохинона.
П р и м е р 5. Получение 2-(3'-трифторметиланилино)-3-морфолино-1,4-нафтохи-нона.
5 г 2,3-дихлорнафтохинона, 6,5 г 3-аминобензотрифторида, 50 мл этилового спирта кипятили 6 ч. Выпавший осадок отфильтровывали, промывали спиртом. Получили 7,56 г 2-(3'-трифторметиланилино)-3-хлор-1,4-нафтохинона.
6 г 2-(3'-трифторметиланилино)-3-хлор-1,4-нафтохинона, 5 мл морфолина, 40 мл диметилформамида выдерживали при 100оС 5 ч. Реакционную смесь обрабатывали аналогично примеру 1. Получили 3,8 г 2-(3'-трифторметиланилино)-3-морфолино-1,4-нафтохинона.
П р и м е р 6. Получение 2-(4'-ацетилфениламино)-3-пиперидино-1,4-нафтохинона.
40 г 2,3-дихлорнафтохинона, 53 г 4-аминоацетофенона, 10 мл триэтиламина, 200 мл этилового спирта кипятили 30 ч. Выпавший осадок отфильтровывали, промывали спиртом, высушивали на воздухе. Получили 49,6 г 2-(4'-ацетилфениламино)-3-хлор-1,4-нафтохинона.
0,3 г 2-(4'-ацетилфениламино)-3-хлор-1,4-нафтохинона, 5 мл пиперидина выдерживали при 100оС 3 ч. Реакционную смесь обрабатывали аналогично примеру 1. Получили 0,35 г 2-(4'-ацетилфениламино)-3-пиперидино-1,4-нафтохинона.
Выводы и характеристики 2-ариламино-3-циклоалкиламино-1,4-нафтохинонов приведены в табл.1.
Получение фоторезистивной пленки выполняли согласно следующим технологическим процессам. Напыление слоя фоторезиста на основе 2-ариламино-3-циклоалкиламино-1,4-нафтохинона проводили в следующем режиме: рабочее давление составляло 1-3.10-5 торр, температура испарения 120оС, масса навески 30-40 мг, расстояние от подложки до испарителя 100 мм, время напыления 3-5 мин, толщина пленки после напыления 0,6-0,8 мкм. Экспонирование проводилось на установке ЭМ 5006 (лампа ДРШ-300). Время экспонирования 1,5-6 мин в зависимости от строения соединения. Проявление проводили в уайт-спирите при комнатной температуре в течение 10 с. Остаточная толщина практически равнялась толщине после напыления. Разрешение элементов составляло 1 мкм. Результаты испытаний по каждому соединению приведены в табл.2.
Таким образом, предлагаемые соединения в отличие от прототипа имеют значительно более низкую температуру испарения ( 120оС), могут проявляться как органическими растворителями, так и возгонкой в вакууме при температуре плавления соединений, используемых в качестве вакуумного фоторезиста; для получения субмикронных размеров можно использовать ртутную лампу ДРШ-300 и любые другие источники света - лампы накаливания и лазерное излучение.
Использование: в качестве вакуумного фоторезиста. Сущность: продукт - 3-замещенные-2-ариламино-1,4-нафтохиноны ф-лы I, где X м-COOCH3 п-COOCH3 п-COOC2H5 м-CF3 п-COCH3 Y = морфолино, пиперидино, пирролидиногруппа. Реагент 1: 2,3-дихлорнафтолинон. Реагент 2: NH2C6H4X где значения x указаны выше. Условия реакции: в среде этанола при кипячении, с последующей обработкой пиперидином, морфолином или пирролидином соответственно. 2 табл., Ф-ла I: 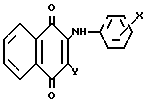 .
.
3-ЗАМЕЩЕННЫЕ 2-АРИЛАМИНО-1,4-НАФТОХИНОНЫ В КАЧЕСТВЕ ФОТОРЕЗИСТОВ ДЛЯ ВАКУУМНОГО ОСАЖДЕНИЯ.
3-Замещенные 2-ариламино-1,4-нафтохиноны общей формулы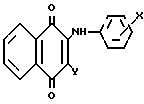
где X = m - COOCH3, p - COOCH3, p - COOC2H5, p - COCH3, m - CF3,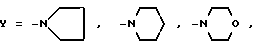
в качестве фоторезистов для вакуумного осаждения.
| Вакуумный фоторезист | 1983 |
|
SU1126581A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
Авторы
Даты
1995-01-27—Публикация
1991-06-26—Подача