Изобретение относится к неописанным ранее 2,8 - диметил-3,7-диалкокси-5-R-фуро[c; b] тропилиевым солям общей формулы (1), где R = атом водорода; стирил;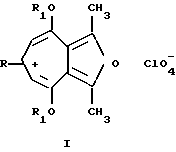 арил незамещенный или замещенный на моно- или дигидрокси, моно- или ди(C1 - C10) алкокси, метилендиокси, ди(C1 - C6)алкиламино, галоген, нитро-группы; R1 = C1-C6 алкил, которые являются потенциально биологически активными соединениями, так как большинство известных тропон(олон)овых систем и фуротропон(олон)овых систем проявляют различные виды физиологической активности [1], обладают противовоспалительной (Muth C. W. , Streiniger D.O., Papanstrassion Z.B.// J. Am.Chem. Soc. 1955. Vol. 77, p. 3393), канцеростатической (Pfan A.S., Plattner P.A. //Helv. Chim. Acta. 1940, Vol. 23, р. 768) и бактериостатической активностью (Anderson A. G. , Tazyma I.I.// J. Am. Chem. Soc. 1953, Vol. 75, р. 4479), входят в состав природных соединений, проявляющих биологически активные свойства (Marshall J.A., Conrow R.E. //J. Am. Chem. Soc. 1980, Vol.102, р. 4274 -4277), объектами для специальных физико-химических исследований (Олехнович Л.П., Курбатов С.В., Тихонова М.Е., Волошин Н.А., Сухоленко Е.В., Рыскина Т. А. , Жданов Ю. А., Минкин В.И.// ЖОрХ, 1990, т. 26. Вып. 9, с. 1829-1838), специфичными лигандами в металлорганической химии переходных металлов, синтезе п-комплексов переходных металлов, получении селективных катализаторов - комплексных соединений фуротропонов с переходными металлами (т. н. металлокомплексный катализ) (El Borai M., Guillard R., Fournari P., Dussausoy U., Protas J. // Bull. Soc. Chim. Fr, 1977, р. 75) для гидрирования, изомеризации, полимеризации, карбонелирования олефинов и ацетиленов, окисления олефинов, алкилароматических углеводородов и др., могут быть использованы как синтоны для производства различных новых соединений фуро[с;b] тропилиевого ряда, также потенциально обладающих ценными физиологическими и физико-химическими свойствами и способу их получения.
арил незамещенный или замещенный на моно- или дигидрокси, моно- или ди(C1 - C10) алкокси, метилендиокси, ди(C1 - C6)алкиламино, галоген, нитро-группы; R1 = C1-C6 алкил, которые являются потенциально биологически активными соединениями, так как большинство известных тропон(олон)овых систем и фуротропон(олон)овых систем проявляют различные виды физиологической активности [1], обладают противовоспалительной (Muth C. W. , Streiniger D.O., Papanstrassion Z.B.// J. Am.Chem. Soc. 1955. Vol. 77, p. 3393), канцеростатической (Pfan A.S., Plattner P.A. //Helv. Chim. Acta. 1940, Vol. 23, р. 768) и бактериостатической активностью (Anderson A. G. , Tazyma I.I.// J. Am. Chem. Soc. 1953, Vol. 75, р. 4479), входят в состав природных соединений, проявляющих биологически активные свойства (Marshall J.A., Conrow R.E. //J. Am. Chem. Soc. 1980, Vol.102, р. 4274 -4277), объектами для специальных физико-химических исследований (Олехнович Л.П., Курбатов С.В., Тихонова М.Е., Волошин Н.А., Сухоленко Е.В., Рыскина Т. А. , Жданов Ю. А., Минкин В.И.// ЖОрХ, 1990, т. 26. Вып. 9, с. 1829-1838), специфичными лигандами в металлорганической химии переходных металлов, синтезе п-комплексов переходных металлов, получении селективных катализаторов - комплексных соединений фуротропонов с переходными металлами (т. н. металлокомплексный катализ) (El Borai M., Guillard R., Fournari P., Dussausoy U., Protas J. // Bull. Soc. Chim. Fr, 1977, р. 75) для гидрирования, изомеризации, полимеризации, карбонелирования олефинов и ацетиленов, окисления олефинов, алкилароматических углеводородов и др., могут быть использованы как синтоны для производства различных новых соединений фуро[с;b] тропилиевого ряда, также потенциально обладающих ценными физиологическими и физико-химическими свойствами и способу их получения.
Близкими по структуре для солей 2,8-диметил-3,7-диалкокси-5-R-фуро[c;b] тропилия (1) являются производные 2-тиониазуленов (IV - VI, X = S) [3] и производные 2-азониазуленов (IV-VI, X = N-C6H5) [4].
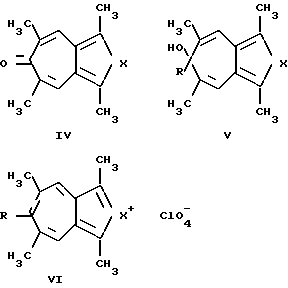
Однако данные соединения являются представителями другого класса анелированных гетероциклов, а именно не фурана, а пиррола и тиофена, а также не могут быть использованы в качестве простых, удобных и доступных синтонов для одностадийных либо однореакторных синтезов различных потенциально биологически активных соединений ряда фуро[c;b]тропилия.
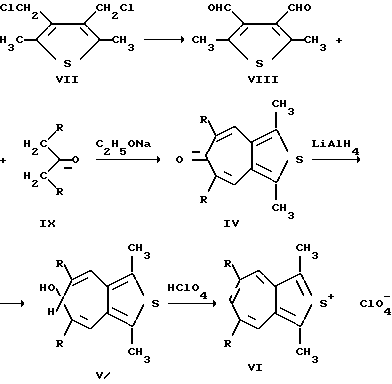
Способ получения 2-тиониазуленов (тиенотропонов) (IV-VI, X=S) заключается во взаимодействии диальдегидов (VIII) с кетонами (IX) в присутствии этилата натрия с образованием тиенотропона (IV), восстановлении алюмогидридом лития соединений (IV) с образованием карбинолов (V) и обработке эфирных растворов (V) хлорной кислотой с образованием с выходом 30-45% соединений (VI).
Способ получения 2-азониазуленов (IV-VI, X = N-C6H5) заключается во взаимодействии N-фенил-2,5-диметилпирроло-3,4-диальдегида (XI) (образуется при длительном нагревании N-фенил-2,5-диметилпиррола (Х) (100oC, 12-15 ч) с диметилформамидом в присутствии POCl3) с кетонами (IX) в присутствии этилата натрия в инертной атмосфере (аргон).
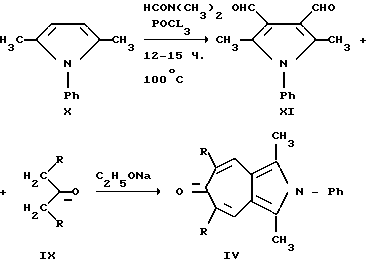
Однако данные способы также не позволяют получать соединения общей формулы (I). Кроме того, известно, что замещенные 2-тиониазулены (VI) вступают в некоторые реакции с нуклеофильными реагентами (Ельцов А.В., Гинесина А. А. // ЖОрХ. 1967. Вып. 3, с. 191), но при этом в большинстве случает реакция проходит неоднозначно, и образуется, как правило, с низким выходом несколько изомерных (XII, XIII) продуктов (Гинесина А.А., Ельцов А.В. // ЖОрХ. Т. IV. Вып. 6, с. 1096 - 1104), что ограничивает препаративность этого метода в синтезе производных 2-тиони(азони)азуленов (IV - VI) и сферу применения этих соединений в качестве синтонов для дальнейших синтезов различных производных данных гетероазуленов.
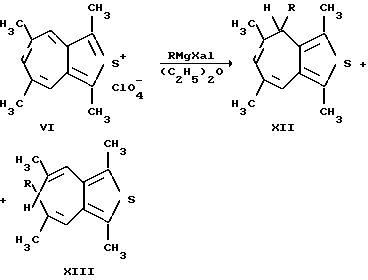
Наиболее близким по структуре являются производные фуро[4,5-c]тропона общей формулы (XIV) 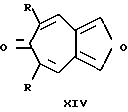 , где R = H, алкил [2].
, где R = H, алкил [2].
Способ получения соединений (XIV) заключается в альдольной конденсации метил(метилен)содержащих кетонов (IX) и фурано-3,4-диальдегида (XV) под действием оснований.
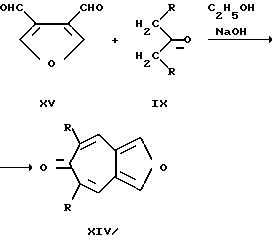
Недостатком данного способа получения фуро[4,5-c]тропонов (XIV) является малый выход соединений общей формулы (XIV) (30 - 35%), длительность проведения процесса и ограниченные возможности широты варьирования вводимых в реакцию альдегидов и кетонов и, как следствие этого, ограниченное число соединений этого ряда, синтезируемых данным методом. Кроме этого, данные фуро[4,5-c] тропоны (XIV) являются, по сравнению с 2,8-диметил-3,7-диалкокси-5-R-фуро[c; b]тропилиевыми солями (I), менее реакционноспособными соединениями и не могут быть использованы как синтоны в синтезе различных производных фуро[c; b] тропилия, что значительно снижает применимость соединений общей формулы (XIV).
Техническим результатом (целью) изобретения являются производные нового ряда соединений, а именно ряда фуро[c;b]тропилия - производные 2,8-диметил-3,7-диалкокси-5-R-фуро[c; b] тропилиевых солей (I), являющихся потенциально биологически активными соединениями, синтонами для производства различных производных ряда фуро[c; b]тропилия, потенциально обладающих ценными физиологическими и физико-химическими свойствами, а также способ их получения.
Технический результат (цель) достигается соединениями общей формулы (I) и способом их получения.
Способ получения соединений общей формулы (1) заключается в том, что 3,4-диацетилгександион-2,5 (II) вводят во взаимодействие с алифатическими или ароматическими альдегидами (III) в присутствии смеси хлорной кислоты и уксусной кислоты с последующей обработкой триалкилортоформиатами.
Формирование соединений общей формулы (I) вероятно включает в себя стадию образования протонированной формы 3,4-диацетилгександиона-2,5 ( П
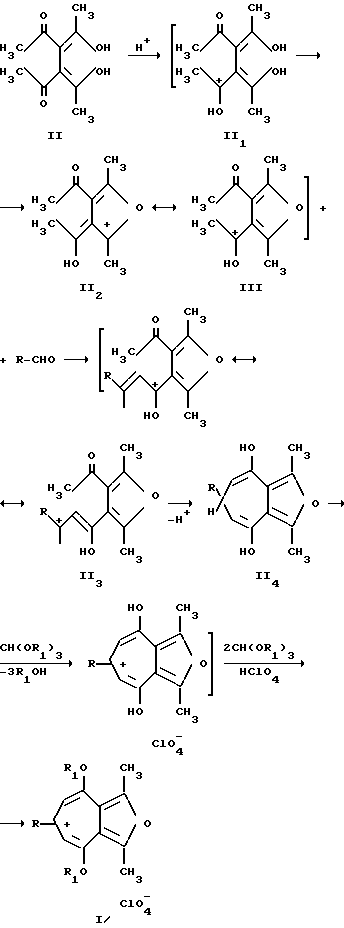
Соединения общей формулы (I), а также способ их получения обладают изобретательским уровнем, так как являются производными нового ряда соединений фуро[c;b]тропилия, обладают потенциально биологически активными свойствами и являются синтонами для получения производных фуротропона и фуротрополона, в ряду которых известны биологически активные соединения, при этом возможность их получения является не очевидной.
Ранее не была изучена кислотно-катализируемая реакция конденсации 3,4-диацетилгександиона-2,5 (II) и алифатических или ароматических альдегидов (III) с последующим действием триалкилортоформиатов.
Известно, что в зависимости от условий проведения реакции и применяемых реагентов 3,4-диацетилгександион-2,5 (II) образует либо тетраацетилэтилен (XVI), либо 3,4-диацетил-2,5-диметилфуран (XVII), либо 3,4-диацетил-2-бром(хлор)метил-5-метилфуран (XVIII) (Asembri G., De Sio F., Nesi R., Scotton M. // J. Chem. Soc. (C). 1970, p. 1536 - 1540).
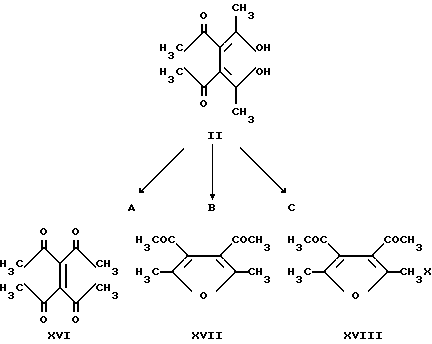
Реагенты - A: EtOTl; I2; B: H+; C: N-хлор- (X = Cl) или N-бром- (X = Br) сукцинимид.
Совместное поведение 3,4-диацетилгександиона-2,5 (II) и альдегидов (III) в кислых средах с последующей обработкой триалкилортоформиатами не известно.
Также известно, что при действии на 3,4-диацетилгександион-2,5 (II) гидразингидрата, в зависимости от соотношения реагентов образуются либо 5,7-дигидро-1,4,5,7-тетраметилфуро[3,4-d] пиридазин (XIX), либо пирролопиридазин (XX), либо 1,4,5,8-тетраметилпиридазино[4,5-d] пиридазин (XXI) (Adembri G. , De Sio F., Nesi R., Scotton M. // J. Chem/ Soc/ (C). 1970, p. 1536 - 1540).
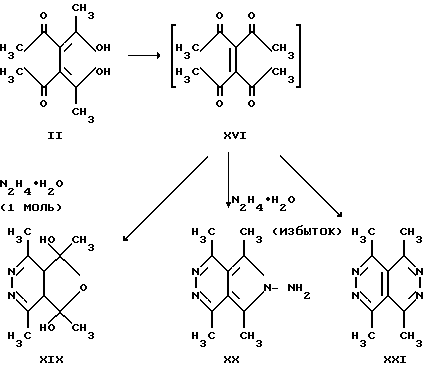
Формирование тропилиевого цикла либо гетероазуленовой системы в данных условиях не возможно.
В аналогичных условиях из 3,4-диацетил-2-бром(хлор)метил-5-метилфурана (XVIII) и гидразингидрата (1 моль) этими же авторами получен 5-гидроксиметил 1,4,7-триметилфуро[3,4-d]пиридазин (XXII).
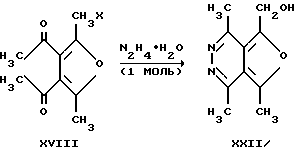
Совместное поведение 3,4-диацетилфуранов (XVII, XVIII) и альдегидов (III) в кислых средах с последующей обработкой триалкилортоформиатами не известно.
Таким образом, ранее не известна и не изучена реакция кислотно-катализируемой конденсации 3,4-диацетилгександиона-2,5 (II) с алифатическими или ароматическими альдегидами с последующим действием триалкилортоформиатами, приводящая к новым, неописанным ранее производным ряда фуро[c;b]тропилия общей формулы (I).
Ниже приведены примеры получения соединения (1a-p), их константы (R, Выходы, Температуры плавления, Элементный анализ, Данные спектроскопии ИК и ПМР) в табл. 1 и 2.
Спектры ИК образцов получены на спектрометре Specord IR-71 в вазелиновом масле. Спектры ПМР записаны на спектрометре Varian VXR-300 (300 МГц) в дейтерохлороформе.
Пример 1. Получение перхлората 2,8-диметил-3,7-диэтокси-5-фенилфуро[c;b] тропилия (Iа)
К 1,98 г (0,01 моль) 3,4-диацетилгександиона-2,5 (II) в 4 мл уксусной кислоты прибавляют при перемешивании 1,06 г (0,01 моль) бензальдегида и 5 мл (0,01 моль) 16%-ного раствора хлорной кислоты в уксусной кислоте (получен добавлением 57%-ной хлорной кислоты в рассчитанное количество уксусного ангидрида, охлаждаемого в ледяной бане), при этом наблюдая самопроизвольное разогревание реакционной смеси. После самопроизвольного охлаждения массы до комнатной температуры (5-10 мин) прибавляют при перемешивании 20 мл триэтилортоформиата и нагревают реакционную смесь до начала кипения. Убирают нагревание и дают самопроизвольно охладиться до 20-25oC, выпавшие кристаллы отфильтровывают, промывают этилацетатом (2 раза по 10 мл) и эфиром (2 раза по 10 мл). Очищают перекристаллизацией из уксусной кислоты. Выход: 3,4 г (80,5%), Т. пл. 242-243oC. Данные о элементном анализе, спектроскопии ИК и ПМР приведены в табл. 1 и 2.
Пример 2. Получение перхлората 2,8-диметил-3,7-диметокси-5-(4-метоксифенил)-фуро[с;b]тропилия (1б)
Получают аналогично соединению (Iа) из 1,98 г (0,01 моль) 3,4-диацетилександиона-2,5 (II), 1,36 г (0,01 моль) анисового альдегида, 5 мл (0,01 моль) 16%-ной хлорной кислоты и 20 мл триметилортоформиата. Светло-коричневые иглы (из ледяной уксусной кислоты). Выход: 3,3 г (77,8%), Т.пл. 237-238oC. Данные о элементном анализе, спектроскопии ИК и ПМР приведены в табл. 1 и 2.
Другие соединения общей формулы (Iв-р) получены аналогично соединениям (Iа, б) (примеры 1 и 2). Их константы также приведены в табл. 1 и 2.
Ниже приведены примеры использования перхлоратов 2,8-диметил-3,7-диалкокси-5-R-фуро[c,b]тропилия (I) как синтонов в простых одностадийных синтезах различных неописанных ранее производных фуро[c;b]тропона (XXIII), фуро[c; b]трополона (XXIV) и 3-арил(гетарил)-иминофуро[c;b]тропона (XXV), являющихся потенциально биологически активными соединениями, реакцией соединений общей формулы (I) с нуклеофильными реагентами (пример 3-5).
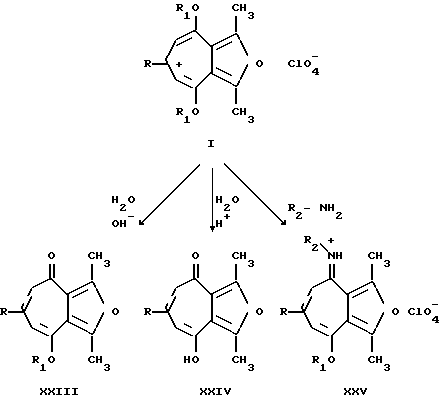
где R, R1, X имеют вышеприведенные значения;
R2 - арил, гетарил.
Спектры ИК образцов получены на спектрометре Specord IR-71 в вазелиновом масле. Спектры ПМР записаны на спектрометре Varian VXR-300 (300 МГц), для соединений (XXIII, XXIV) - в дейтероацетонитриле, а для соединений (XXV) - в дейтерохлороформе.
Пример 3. 2,8-диметил-5-(4-метоксифенил)-7-метоксифуро[c, b] тропон-3 (XXIIIв)
К 0,01 моль соединения (Iб) в 20 мл ацетона добавляют 0,012 моль ацетата натрия в 20 мл воды. Смесь нагревают при перемешивании на водяной бане до упаривания ацетона. Охлаждают до комнатной температуры, желтые кристаллы отфильтровывают и промывают водой. Очищают перекристаллизацией из водного (1:5) метанола.
Пример 4. 2,8-диметил-5(4-метоксифенил)-фуро[c,b]трополон-3,7 (XXIVб)
0,01 моль соединений (Iб) либо соединений (1в) в 20 мл 5%-ной хлорной кислоты нагревают до кипения и кипятят 5-10 мин. Охлаждают до комнатной температуры, образовавшиеся кристаллы отфильтровывают и промывают водой. Очищают перекристаллизацией из пропанола-2, фуро[c;b]тополоны (XXIV), полученные из соединений (Iб) и (Iв) по физико-химическим характеристикам идентичны, проба смешения депрессии Т.пл. не дает.
Пример 5. Перхлорат 2,8-диметил-5-(4-метоксифенил)-7-этоксифуро[c;b]-3-N-морфолинотропилия (XXVa)
К 0,01 моль перхлората фуро[c;b]тропилия (Iв) в 20 мл хлороформа прибавляют при перемешивании 0,87 г (0,01 моль) морфолина. Смесь кипятят 5 мин и охлаждают. Разбавляют равным объемом эфира, выделившийся продукт отфильтровывают, промывают этилацетатом и эфиром. Очищают переосаждением из нитрометана эфиром.
Пример 6. Гидроперхлорат 2,8-диметил-5-(4-метоксифенил)-7-этоксифуро[c; b]-3-(4-метилфенил)иминотропона (XXVд)
К 0,01 моль перхлората 2,8-диметил-3,7-диэтокси-5-(4-метоксифенил)фуро[c; b]тропилия (Iв) в 20 мл уксусной кислоты добавляют при перемешивании 0,01 моль пара-толуидина. Смесь кипятят 5 мин и охлаждаю. Разбавляют равным объемом эфира, выделившиеся продукты отфильтровывают, промывают этилацетатом и эфиром. Очищают перекристаллизацией из минимального количества уксусной кислоты.
Контакты, выходы, данные элементного анализа, спектроскопии ИК и ПМР приведены в табл. 3-6. Другие соединения общей формулы (XXIII-XXV), вошедшие в табл. 3-6, получены аналогично соединениям (XXIII-XXV) (примеры 3-5).
Антимикробное действие соединения XXIIIв проводят методом десятикратных серийных разведений в мясо-пептонном агаре (T.Coli, Ps. aeruginosa, St. aurens) и в среде Китт-Тароции (Cl. perfringens). В качестве растворителя используют физраствор. В качестве тест-микроорганизмов используют следующие микроорганизмы: E. coli, Ps. aeruginose, St. aureus, Cl. perfringeni (культуры, выделенные от больных животных, патогенны для лабораторных животных). Минимальная ингибирующая концентрация соединения XXXIIIв для всех микроорганизмов 10 мкг/мл.
Таким образом, получены ранее неописанные соединения ряда 2,8-диметил-3,7-диалкокси-5-R-фуро[c; b] тропилиевых солей общей формулы (Ia-p) с достаточно высокими выходами, которые могут быть использованы как синтоны в органическом синтезе, в частности в синтезе новых потенциально биологически активных соединений фуро[c;b]тропилиевого ряда.
Все описанные соединения (Ia-p) получены одностадийно и с высоким (70-85%) выходом. Соединения (Ia-p), а также их растворы в полярных и неполярных растворителях устойчивы при длительном хранении. Растворы окрашены в интенсивный оранжево-красный цвет.
Таким образом, соединения (I) являются новыми производными в новом ряду солей фуро[c; b]тропилия, получаются из доступных исходных веществ простым, одностадийным, способом. Соединения (I) являются потенциально биологически активными веществами, стабильны и вместе с тем обладают высокой химической активностью в реакциях с различными нуклеофильными реагентами, и могут быть использованы как синтоны в органическом синтезе потенциально биологически активных производных фуро[c; b]тропилия, в частности фуро[c;b]тропона, фуро[c;b]трополона и 3-арил(гетарил)иминофуро[c;b]тропона.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СОЛЕЙ 1,3-ДИМЕТИЛ-4,8-ДИАЛКОКСИ-6-R-ПИРРОЛО-(ТИЕНО)-[C] ТРОПИЛИЯ | 1997 |
|
RU2131871C1 |
| 7-АЛКОКСИ-8,9-ДИГИДРОКСАНТИЛИЕВЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2100353C1 |
| ПРОИЗВОДНЫЕ 8,9-ДИГИДРОКСАНТЕНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2106350C1 |
| ПЕРХЛОРАТЫ ДИФЕНИЛЭТОКСИПОЛИМЕТИНЦИАНИНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2087459C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИБЕНЗО (В,Е)ПИРАНО(3,2-В)-1-БЕНЗОПИРИЛИЕВЫХ СОЛЕЙ | 1995 |
|
RU2082715C1 |
| ДИБЕНЗО(В,Е) ПИРАНО(3,2-В)-1-БЕНЗОПИРИЛИЕВЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2084455C1 |
| ДИГИДРОХЛОРИД 1-ДИЭТИЛАМИНОПРОПИЛ-2-ФЕНИЛИМИДАЗО[1,2-А]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 1999 |
|
RU2148057C1 |
| ДИГИДРОХЛОРИД 1-(3-ПИРРОЛИДИНОПРОПИЛ)-2-ФЕНИЛИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160265C1 |
| ДИГИДРОХЛОРИД 2-ТРЕТБУТИЛ-1-(3-ДИЭТИЛАМИНОПРОПИЛ)ИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ И АНТИАРИТМИЧЕСКИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160262C1 |
| ДИГИДРОХЛОРИД 2-ТРЕТ-БУТИЛ-1-(3-ЦИКЛОГЕКСИЛАМИНОПРОПИЛ)-ИМИДАЗО [1,2-А]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2000 |
|
RU2160264C1 |
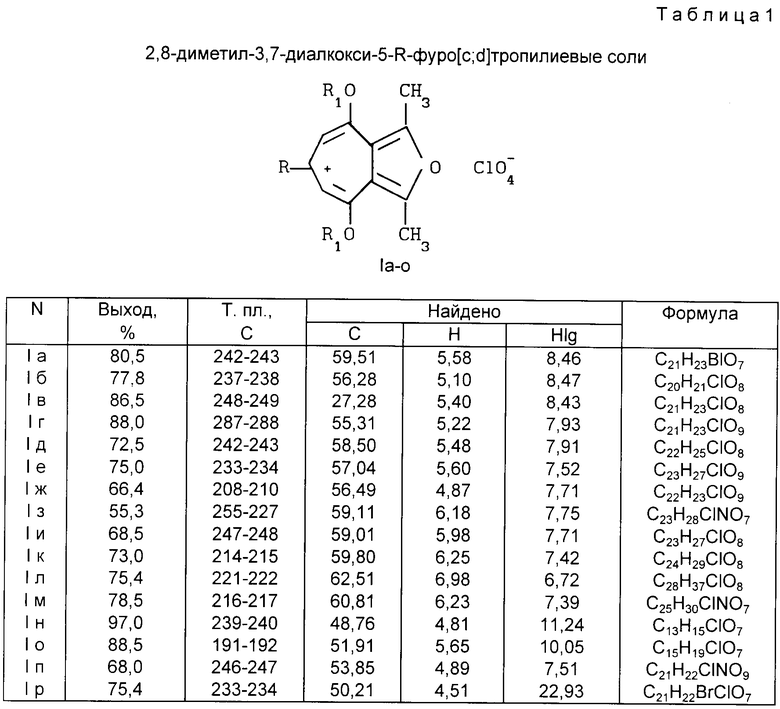
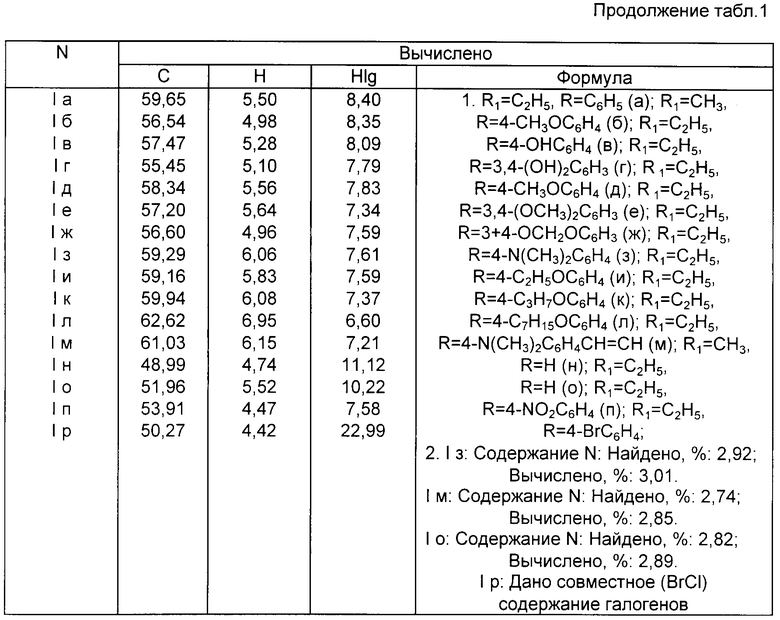



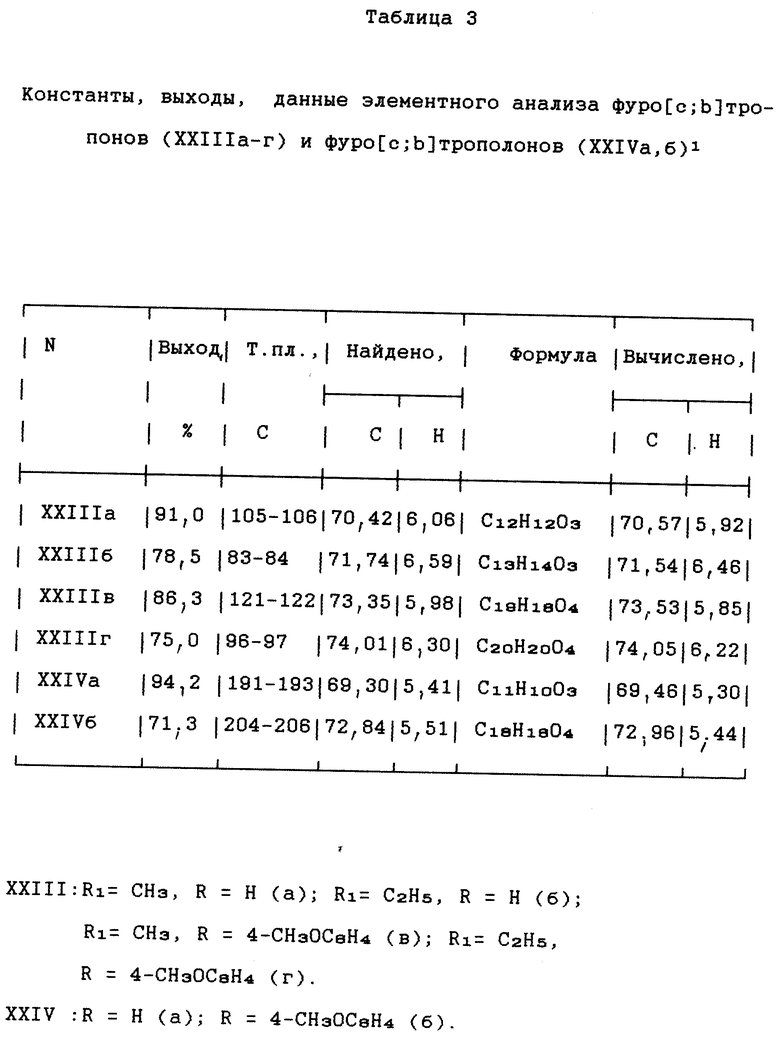





Соединения общей формулы (I), где R = атом водорода; стирил; фенил, незамещенный или замещенный на моно- или дигидрокси, моно- или ди(C1 - C10) алкокси, метилендиокси, ди(C1 - C 6)алкиламино, галоген, нитрогруппы; R1 = С1 - С6 алкил, являются потенциально биологически активными соединениями, обладают высокой реакционной способностью во взаимодействиях с нуклеофилами и являются синтонами для производства различных новых потенциально биологически активных соединений ряда фуро[c;b]тропилия. Способ получения соединений (I) заключается в том, что 3,4-диацетилгександион-2,5 вводят во взаимодействие с алифатическими или ароматическими альдегидами в присутствии смеси хлорной кислоты и уксусной кислоты с последующей обработкой триалкилортоформиатами. Даны: N; R1; R; Выход (%); Т.пл. (oC); Формула; Спектр ИК (v, см-1); Спектр ПМР (с, м. д. ): Ia; R1 = С2H5, R = C6H5; 80,3; 242-243; C21H23ClO7; 1100, 1220, 1586, 1606; 1,58 т (6H), 2,90 с (6H), 4,60 к (4H), 6,80 с (2H), 7,64 м (3H), 7,80 т (2H), Iб; R1 = CH3, R = 4-CH3OC6H4; 78,5; 237-238; C20 H21ClO8; 1100, 1220, 1500, 1580; 2,85 c (6H), 3,92 c (3H), 4,30 с (6H), 6,80 с (2H), 7,15 д (2H), 7,90 д (2H), Iв; R1 = C2H5, R = 4-OHC6H4; 85,0; 248-249; C21H23Cl8, 1100, 1220, 1566, 3233; 1,60 т (6H), 2,89 c (6H), 4,58 к (4H), 6,79 c (2H), 7,05 д (2H), 7,75 д (2H), 8,05 т (1H), Iг; R1= С2H5, R = 3,4-(OH)2C6H3; 89,4; 287-288; C21H23ClO9; 1080, 1253, 3260, 3380, 1,66 т (6H), 2,91 с (6H), 4,80 к (4H), 7,00 с (2H), 7,44 м (3H), 8,52 с (1H), 9,18 с (1H) Iд; R1= C2H5, R = 4-CH3OC6H4; 76,2; 242 - 243; C22H25ClO8; 1100, 1206, 1566, 1606; 1,65 т (6H), 2,85 с (6H), 3,83 с (3H), 4,60 к (4H), 6,72 c (2H), 7,05 д (2H), 7,80 д (2H). 2 с.п. ф-лы, 6 табл.
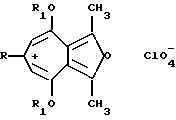
где R атом водорода, стирил, фенил, незамещенный или замещенный на моно- или дигидрокси, моно- или ди-C1 C1 0-алкокси, метилендиокси, ди-С1 С8-алкиламино, галоген, нитрогруппы;
R1 C1 C8-алкил.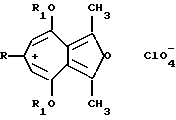
где R атом водорода, стирил, фенил, незамещенный или замещенный на моно- или дигидрокси, моно- или ди-С1 С1 0-алкокси, метилендиокси, ди-С1 С8-алкиламино, галоген, нитрогруппы;
R1 C1 C8-алкил,
отличающийся тем, что 3,4-диацетилгександион-2,5 общей формулы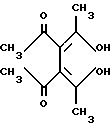
вводят во взаимодействие с алифатическими или ароматическими альдегидами общей формулы
R6 CHO,
где R имеет указанные значения,
в присутствии смеси хлорной кислоты и уксусной кислоты с последующей обработкой триалкилортоформиатами общей формулы
HC(OR1)3,
где R1 имеет указанные значения.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Loper de Lerma J | |||
| et al, Tetrahedron Lett., 1980, p | |||
| Способ расщепления слюды | 1924 |
|
SU1273A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Cook M.J | |||
| et al, Tetrahedron, 1968, v | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| РУЧНОЙ СТАНОК С ВРАЩАЮЩИМСЯ СТОЛОМ ДЛЯ ФОРМОВАНИЙ СЫРЦА | 1926 |
|
SU4501A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Ельцов А.В., Гинесина А.А | |||
| - Органическая химия, 1967, т.III, вып.1, с | |||
| Устройство непрерывного автоматического тормоза с сжатым воздухом | 1921 |
|
SU191A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Ельцов А.В., Гинесина А.А | |||
| - Органическая химия, 1968, т.IY, вып | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| ВОДЯНОЕ КОЛЕСО | 1923 |
|
SU907A1 |
Авторы
Даты
1998-01-27—Публикация
1996-03-11—Подача