Предложенная система может использоваться в медицине, в частности в медицинской технологии и фармакологии.
Природный дицептид карнозин (β-аланил-L-гистидин) предложен и запатентован в качестве основного компонента ряда лекарственных рецептур: глазных капель, инъекционных растворов, мазей, свечей. В СССР разработан и запатентован метод промышленного получения карнозина из мяса крупного рогатого скота, который является основой для глазных капель с названием "севитин". Еcтеcтвенно, что каждая серия карнозина из мяса крупного рогатого скота, производящаяся на заводе, должна проходить биологическое тестирование и проверку чистоты получаемого препарата.
В литературе нет описанных модельных систем для определения антиокислительной активности и чистоты карнозина.
Согласно известной работе антиокислительная активность исследуемого вещества оценивается по задержке развития сверхслабого свечения суспензии однослойных липосом, к которым добавили соли железа и антиоксидант. Липосомы формируют из яичного лецитина.
Целью изобретения является повышение качества системы за счет ускорения определения и расширения круга исследуе- мых веществ.
Это достигается тем, что излучается хемилюминесценция реакции пероксида водорода с гипохлорид-анионом в присутст- вии различных серий карнозина.
При взаимодействии перекиси водорода с гипохлорид-анионом происходит генерация синглетного кислорода, на который может оказывать тушащее действие карнозин.
Согласно современной точке зрения токсическое действие синглетного кислорода может являться одной из основных причин ряда заболевания катаракты, воспаления и др. Следовательно, вещества, способные утилизировать синглетный кислород, рассматриваются как антиоксиданты. Согласно исследованиям, карнозин, подобно таким же активным тушителям синглетного кислорода как азид натрия или гистидин, уменьшает интенсивность сверхслабого свечения. Очевидно, что антивоспалительные и другие терапевтические эффекты карнозина (как и α-токоферола) могут в значительной степени быть обусловлены именно этим свойством карнозина в отношении синглетного кислорода. Поэтому предложили этот способ определения антиокислительной активности изучение различных серий карнозина в хемилюминесцетной реакции перекиси водорода с гипохлорид-анионом.
Изучение разных серий карнозина, полученного синтетическим (коммерческий препарат) и экстракционным методами, в хемилюминесцентной реакции перекиси водорода с гипохлорид-анионом позволило также предложить и одновременный экспресс-способ определения частоты карнозина. Дело в том, что малейшие количества примесей в синтетическом карнозине или в препарате, получаемом из мяса, существенно изменяют кинетику хемилюминесценции описанной реакции. Именно характер регистрируемых хемилюминограмм может служить критерием чистоты получаемого карнозина.
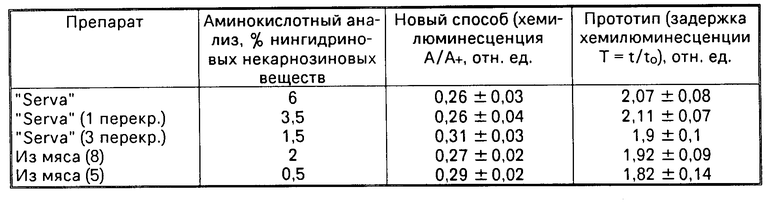
Способ осуществляется следующим образом: карнозин растворяют в дистиллированной воде до конечной концентрации 10 мМ. Причем объем раствора карнозина, требуемый для исследования, составляет 0,15 мл, это означает, что для тестирования каждой серии требуется всего около 0,16 мг вещества. О биологической эффективности карнозина судят по параметру A=A/A+, где A светосумма гемилюминесценции реакции спустя 3 с от момента добавления к перекиси водорода гипохлорида натрия, A+ светосумма хемилюминесценции реакции спустя 3 с от момента добавления к перекиси водорода гипохлорида натрия в присутствии 2,5 мМ карнозина. Чем выше это отношение, тем больше биологическая эффективность препарата карнозин.
О чистоте получаемого карнозина свидетельствует свечение на 4-10 с от впрыскивания гипохлорида натрия. Малейшие количества примесей в синтетическом препарате вызывают усиление хемилюминесценции, а в природном (из мяса) уменьшение свечения на 4-10 с относительно свечения за первые 3 с от быстрого введения гипохлорида натрия в систему перекись водорода анализируемая серия карнозина. Для этого вычисляется абсолютная величина параметра В  0,77-(В4 10/А+)
0,77-(В4 10/А+) , где В4-10 и А+ светосумма гемилюминесценции реакции за период спустя 4-10 и 3 с соответственно от момента добавления к перекиси водорода гипохлорида натрия в присутствии 2,5 мМ карнозина. Чем меньше это отношение, тем больше чистота препарата карнозин. Нетрудно рассчитать для идеально чистого образца карнозина, исходя из идеальной формы кривой свечения, В4-10/А+ 0,77. Поэтому формула расчета параметра В приобрела такой вид:
, где В4-10 и А+ светосумма гемилюминесценции реакции за период спустя 4-10 и 3 с соответственно от момента добавления к перекиси водорода гипохлорида натрия в присутствии 2,5 мМ карнозина. Чем меньше это отношение, тем больше чистота препарата карнозин. Нетрудно рассчитать для идеально чистого образца карнозина, исходя из идеальной формы кривой свечения, В4-10/А+ 0,77. Поэтому формула расчета параметра В приобрела такой вид:  0,77 (В4-10/А+)
0,77 (В4-10/А+)
П р и м е р 1. Для исследования взят карнозин фирмы Serva (США), который использовался в исследованиях без какой-либо предварительной очистки. Приготовлено 0,15 мл 10 мМ раствора карнозина (расход препарата 0,16 мг), к полученному раствору добавили 0,15 мл раствора 3% перекиси водорода, после чего регистрировали светосумму гемилюминесценции реакции в течение 10 с от момента добавления к полученной смеси 5 мМ раствора гипохлорида натрия. Отдельно ставился контроль: 0,15 мл дистиллированной воды + 0,15 мл раствора 3% перекиси водорода, после чего быстро вводили к полученной смеси 5 мМ раствора гипохлорида натрия и регистрировали светосумму хемилюминесценции реакции в течение 10 с. Для коммерческого карнозина фирмы Serva (США) был получен параметр А 0,26 ± 0,03 и параметр В 4,2 ± 0,6 относительных единиц. Анализ занял около 1 мин, состоял из двух операций.
Параллельно определению хемилюминесценции для карнозина фирмы Serva (США) проводила тестирование препарата на антиокислительную активность согласно способу-прототипу.
В качестве контроля использовали окисление той же сыворотки без добавления карнозина. Об эффективности препарата судили по величине подавления им в описанной системе ТБК-активных продуктов перекисного окисления:  (Fi / (Fi+)/n, где Fi интенсивность флуоресценции контроля за i-й промежуток времени окисления; Fi+ интенсивность опытного образца (с 2,2 мМ карнозина) за i-й промежуток времени окисления; n количество измерений. Чем выше эта сумма, тем больше биологическая эффективность препарата карнозин. Точность данного метода зависит от времени проведения анализа: для статически достоверных различий достаточно уже взять четыре пробы, то есть достаточно проводить окисление в присутствии карнозина в течение 80 мин. Для карнозина фирмы Serva (США), который использовали в исследованиях без какой-либо предварительной очистки
(Fi / (Fi+)/n, где Fi интенсивность флуоресценции контроля за i-й промежуток времени окисления; Fi+ интенсивность опытного образца (с 2,2 мМ карнозина) за i-й промежуток времени окисления; n количество измерений. Чем выше эта сумма, тем больше биологическая эффективность препарата карнозин. Точность данного метода зависит от времени проведения анализа: для статически достоверных различий достаточно уже взять четыре пробы, то есть достаточно проводить окисление в присутствии карнозина в течение 80 мин. Для карнозина фирмы Serva (США), который использовали в исследованиях без какой-либо предварительной очистки  1,81. Суммарный расход кар- нозина для такого анализа составлял 5 мг, ингибирующая концентрация в суммарном растворе сыворотки и FeSO4 2,2 мМ, время анализа 3,5 ч, количество операций 5.
1,81. Суммарный расход кар- нозина для такого анализа составлял 5 мг, ингибирующая концентрация в суммарном растворе сыворотки и FeSO4 2,2 мМ, время анализа 3,5 ч, количество операций 5.
Параллельно определению чистоты карнозина фирмы Serva (США) по хемилюминесценции (см.параметр В, приведенный выше) оценивали чистоту препарата согласно способу (см. Comp.Biochem.Biophys 1988, 89,8, р.245-50). С этой целью проводили спектрофотометрию 10 мМ образца препарата карнозин в ультрафиолетовой области (при 260-290 нм). На чертеже приведен спектр поглощения образца с характерными для карнозина полосами поглощения. Расход карнозина около 3,5 мг, время анализа 10 мин.
В таблице суммируются данные по определению антиокислительной активности разных по источникам и чистоте карнозину.
Как видно из таблицы, новый способ не хуже известного позволяет определять антиокислительную активность разных по качеству образцов дипептида, однако новый способ более качествен, так как позволяет еще и оценить чистоту карнозина, более быстр в осуществлении около 1 мин по сравнению с прототипом не менее 15-17 мин.
На чертеже приведены спектры поглощения разных серий карнозина: 1 карнозин фирмы Serva без какой-либо очистки, 2 карнозин фирмы Serva после одной перекристаллизации, 3 карнозин фирмы Serva после трех перекристаллизаций, 4 карнозин, полученный из мяса крупного рогатого скота (партия N 8), 5 карнозин, полученный из мяса крупного рогатого скота (партия N 5), 6 карнозин фирмы Sigma (США) без какой-либо очистки. Можно убедиться, что коммерческие препараты фирмы Serva и Sigma (США), без какой-либо предварительной очистки являются наиболее загрязнены примесями, которые обусловливают поглощение образов при 268-284 нм. По мере перекристаллизации препарата фирмы Serva происходит уменьшение вклада в спектр этих примесей. Однако уже первая перекристаллизация коммерческого препарата приводит к резкому уменьшению поглощения при 268-284 нм так, что согласно этому способу-прототипу коммерческий препарат уже нельзя отличить от карнозина, извлекаемого из мяса, в то же время по хемилюминесценции согласно предлагаемому способу существует статически достоверное различие по чистоте между этими образцами. Для доказательства того, что новый способ более точно отражает чистоту препарата, использовали широко распространенный метод аминокислотного анализа с проявлением примесей нингидрином (Exp. Eye Res. 1987, v44, р.165-169). В результате проведенного анализа показано, что в препаратах фирм без перекристаллизации количество примесей значительно больше, чем в карнозине из мяса, или в коммерческом карнозине с дополнительной очисткой, кроме того, одна перекристаллизация существенно очищает препарат, но не на столько, чтобы не были заметны различия между чистотой коммерческого препарата и вещества, получаемого из мяса.
Следовательно, новый метод более точно отражает чистоту получаемого препарата. Он также требует более чем в двадцать раз меньший расход вещества, короче в осуществлении.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения антиокислительной активности карнозина | 1990 |
|
SU1807353A1 |
| Способ определения антиокислительной активности вещества | 1981 |
|
SU1045127A1 |
| СПОСОБ ПОЛУЧЕНИЯ L-КАРНОЗИНА И ЕГО ГОМОЛОГОВ | 1992 |
|
RU2084457C1 |
| Способ определения проокислительной активности химических веществ | 1989 |
|
SU1665305A1 |
| СПОСОБ ЭКСПРЕСС-ОЦЕНКИ КАЧЕСТВА И БИОЛОГИЧЕСКОЙ ЦЕННОСТИ КУМЫСА | 2013 |
|
RU2521976C1 |
| СРЕДСТВО ОЦЕНКИ АНТИОКИСЛИТЕЛЬНОЙ АКТИВНОСТИ ХИМИЧЕСКИХ СОЕДИНЕНИЙ И БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ | 2007 |
|
RU2337359C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУММАРНОЙ АНТИОКСИДАНТНОЙ АКТИВНОСТИ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ | 2003 |
|
RU2238554C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИГИПОКСИЧЕСКОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2001 |
|
RU2191592C1 |
| Способ диагностики лекарственной аллергии | 1982 |
|
SU1120967A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА У БОЛЬНЫХ УВЕИТАМИ | 2001 |
|
RU2192009C1 |

Использование: в области медицинской технологии и фармакологии. Сущность изобретения: измеряется светосумма хемилюминесценции реакции спустя 3 с от момента добавления к перекиси водорода гипохлорида натрия в присутствии биологически активного вещества в сравнении с контролем. Способ позволяет ускорить анализ и расширить круг исследуемых веществ. 1 ил., 1 табл.
МОДЕЛЬНАЯ СИСТЕМА ДЛЯ ОЦЕНКИ АНТИОКИСЛИТЕЛЬНОЙ АКТИВНОСТИ БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА, содержащая среду инкубации, индуктор сверхслабого свечения и исследуемое вещество, отличающаяся тем, что, с целью повышения качества системы за счет ускорения определения и расширения круга исследуемых веществ, в качестве индуктора сверхслабого свечения используют смесь перекиси водорода и гипохлорид-аниона с конечной концентрацией 3% и 5 мМ соответственно.
| Владимиров Ю.А | |||
| и Потапенко А.Я | |||
| Физико-химические основы фотобиологических процессов | |||
| М.: Высшая школа, 1989, с.182. |
Авторы
Даты
1995-04-20—Публикация
1990-10-24—Подача