Изобретение относится к области высокомолекулярных химических соединений, обладающих противоопухолевой и иммуностимулирующей активностью.
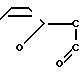
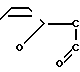
Известно аналогичное по структуре соединение: сополимер соли малеиновой кислоты с фураном (СФМК) следующей формулы: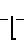
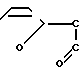 H
H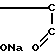 H
H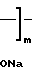 (I) где m 10-60,
(I) где m 10-60,  2300-13600, но в отличие от заявленного соединения не содержащее комплексно-связанной платины. Имеются сведения о слабой противоопухолевой активности соединений формулы (I) [1] Однако эффективность противоопухолевого действия испытанного соединения формулы (1) низка и не представляет интереса для практической химиотерапии опухолей (см.табл.1). Соединение проявляет также слабую иммуностимулирующую активность [2]
2300-13600, но в отличие от заявленного соединения не содержащее комплексно-связанной платины. Имеются сведения о слабой противоопухолевой активности соединений формулы (I) [1] Однако эффективность противоопухолевого действия испытанного соединения формулы (1) низка и не представляет интереса для практической химиотерапии опухолей (см.табл.1). Соединение проявляет также слабую иммуностимулирующую активность [2]
Ближайшим аналогом по противоопухолевой активности является цис-диаминодихлорплатина(II) (цисплатин), имеющая структурную формулу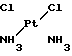 (II)
(II)
Цисплатин широко применяется в клинической практике лечения онкологических заболеваний. По механизму действия относится к цитостатикам, подавляющим синтез ДНК опухолевых клеток.
Однако при проведении противоопухолевой терапии цисплатин, как и другие цитостатики, помимо действия на злокачественные новообразования, оказывают значительное токсическое влияние на организм. Цисплатин в высокой степени токсическое вещество (ЛД50 12-14 мг/кг для мышей и крыс). Главным фактором, который лимитирует терапевтический курс и вынуждает прервать лечение повреждение в разной степени (в зависимости от дозы) извитых канальных почек [3]
Одним из серьезных недостатков применяющихся в настоящее время противоопухолевых препаратов, в том числе и цисплатина, является их иммунодепрессантное действие на организм (см.табл.2).
Целью изобретения является создание нового полимерного комплекса платины, обладающего иммуностимулирующей и противоопухолевой активностью с широким интервалом терапевтических доз при низкой нефротоксичности.
Соединение представляет собой аморфный порошок желтого цвета, хорошо растворимый в воде и физиологическом растворе, плохо растворимый в спиртах и нерастворимый в ацетоне, хлороформе, диэтиловом эфире и углеводородах.
При нагревании указанный комплекс разлагается без плавления при температуре 190оС.
Полимерный комплекс получают взаимодействием сополимера Na-соли малеиновой кислоты и фурана формулы II с цис-диаминодигидроксоплатиной (П) формулы [Pt(NH3)2(OH)2] (NО3)2, взятые в мольных соотношениях от 8:1 до 2:1 (избыток полимерного компонента) в водном растворе.
Состав продуктов реакции (параметр х в формуле III) регулируют путем изменения молярного соотношения платинусодержащего и полимерного реагентов реакционной смеси (см.примеры).
Структуру полученных полимерных комплексов подтверждают методами элементного анализа, атомно-адсорбционной спектроскопии и ИК-спектроскопии.
Заявляемое соединение формулы (III) характеризуется следующими колебательными частотами в ИК-спектрах (полученных на приборе Specord М-80), см-1:
1590-1600 валентные колебания С=0 связи ионизированных СООН-групп;
1070-1110 валентные колебания связей С-0;
517-490 валентные колебания связи Рt N.
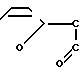
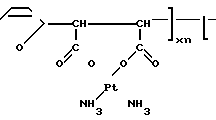
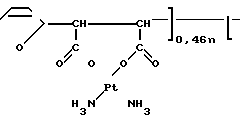
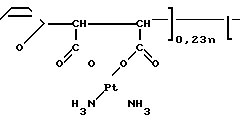
Вышеприведенные спектральные данные, а также данные элементного анализа и атомно-адсорбционной спектроскопии (см.примеры) указывают на то, что полимерный комплекс имеет следующее строение: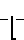
 H
H H
H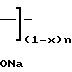 (III) где х 0,11-0,46 (определяется по данным элементного анализа и атомно-адсорбционной спектроскопии), n 20-25,
(III) где х 0,11-0,46 (определяется по данным элементного анализа и атомно-адсорбционной спектроскопии), n 20-25,  =5000-12000 (определяют по молекулярной массе использованного для синтеза соединения сополимера Na-соли малеиновой кислоты и фурана) и содержанию Рt в образце.
=5000-12000 (определяют по молекулярной массе использованного для синтеза соединения сополимера Na-соли малеиновой кислоты и фурана) и содержанию Рt в образце.
Для синтеза берут в качестве исходного сополимер с  =4500-5500, так как при
=4500-5500, так как при  < 4500 биологическая активность соединения заметно снижается, а при
< 4500 биологическая активность соединения заметно снижается, а при  > 5500 сильно возрастает токсичность.
> 5500 сильно возрастает токсичность.
Получение комплекса иллюстрируется следующими примерами.
П р и м е р 1. В дистилированной воде (100 мл) растворяют 0,18 г (0,0006 моль) Рt (NН3)2Cl2 и добавляют водный раствор 0,204 г (0,0012 моль) AgNO3 (реакция 1)
Pt(NH3)2Cl2+2AgNO3 ____→ 2AgCl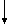 +
+ 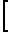 (Pt(NH3)2(OH)
(Pt(NH3)2(OH)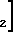 (NO3)2 (1)
(NO3)2 (1)
Выпавший осадок AgCl отфильтровывают, а фильтрат приливают при перемешивании к раствору сополимера Na-соли малеиновой кислоты и фурана 0,28 к (0,0012 моль в расчете на сомономерное звено), растворенному в 100 мл дистиллированной воды (реакция 2)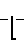
 H
H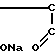 H
H +
+ 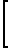
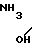 Pt
Pt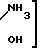 (NO3)2___→
(NO3)2___→
(2) ___→ 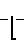
 H
H H
H
Для очистки от низкомолекулярных примесей (NaNO3, непрореагировавший платиновый комплекс) водный раствор комплексного соединения платины с сополимером подвергают ультрафильтрации, выделяют из раствора путем лиофильной сушки и досушивают в вакууме до постоянного веса.
Количества реагентов, взятых для реакции, соответствуют мольному соотношению 2:1 (избыток полимерного компонента). Выход 0,230 г (73,5% от теор. ).
Элементный состав полученного продукта:
Вычислено, С 30,04, Н 2,82, N 4,38, Pt 30,5, Nа 7,2.
Найдено, C 31,02, H 2,95, N 4,87, Pt 26,07, Na 6,5.
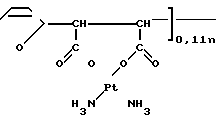
Получено комплексное соединение следующей формулы:
 H
H H
H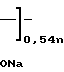 где х 0,46; r 25;
где х 0,46; r 25;  12000.
12000.
П р и м е р 2. Условия получения комплексного соединения платины с сополимером аналогичны условиям, описанным в примере 1. Для реакции берут 0,276 г (0,0012 моль) сополимера Na-соли малеиновой кислоты и фурана, 0,09 г (0,0003 моль) Рt (NН3)2Сl2 и 0,117 г (0,0006 моль) AgNO3, что соответствует соотношению СФМК:ЦП=4:1 (избыток сополимера). Выход 0,233 г (71,2% от теор. ).
Элементный состав полученного продукта:
Вычислено, 35,1; Н 2,7; N 2,6; Pt 17,8; Na 12,6.
Найдено, C 36,2; H 2,8; N 2,5; Pt 16,7; Na 11,5.
Получено следующее соединение:
 H
H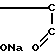 H
H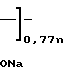 где х 0,23;
где х 0,23;  8100; n 20.
8100; n 20.
П р и м е р 3. Условия реакции аналогичны описанным в примере 1. Для получения полимерного комплекса берут 0,28 г сополимера Na-соли малеиновой кислоты и фурана, 0,045 (0,00015 моль) Рt(NH3)2Cl2, и 0,058 г (0,0003 моль) AgNO3, что соответствует соотношению реагентов 8:1 (избыток полимерного компонента). Выход 0,216 г (72,3% от теор.).
Элементный состав полученного продукта:
Вычислено, C 38,26; H 2,61; N 1,39; Pt 9,7; Na 16,0.
Найдено,С: 37,5; H 2,7; N 1,42; Pt 8,9; Na 15,0.
Получено соединение формулы _
_  _
_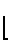 _
_ 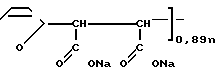 где х 0,11;
где х 0,11;  5000; n20.
5000; n20.
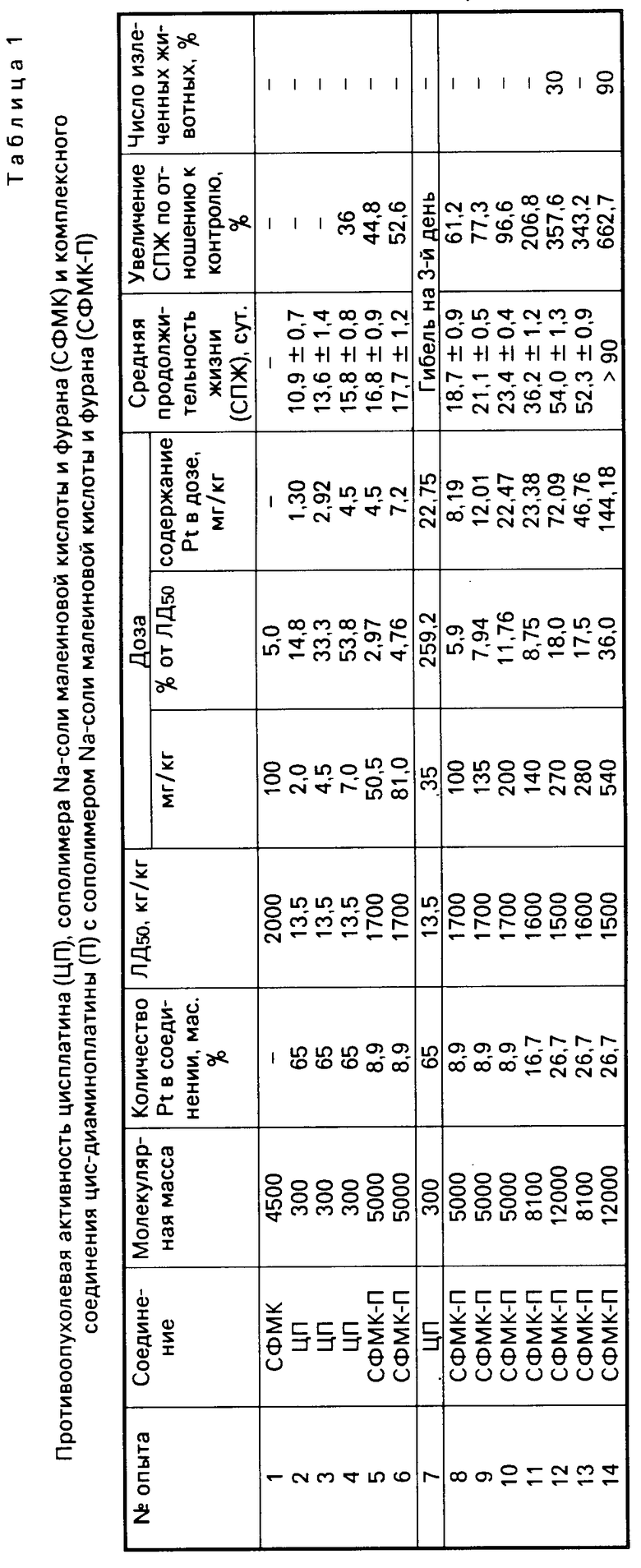
Определение острой токсичности соединений проводят по методу В.Б.Прозоровского [2] Установлено, что ЛД50 испытуемых веществ составляла от 1500 до 1700 мг/кг в зависимости от процентного содержания платины в полимерном комплексе. Следует также отметить, что даже при использовании дозы с высоким содержанием платины (в пересчете на металл) видимых токсических явлений не наблюдается (пример 13 табл.1).
Изучение противоопухолевой активности полимерных комплексов платины проводят в эксперименте на беспородных мышах (самках массой 20-25 г) с привитой внутрибрюшинно аденокарциномой Эрлиха. Асцитная карцинома Эрлиха опухоль, относительно устойчивая к действию широко применяемого в настоящее время в клинике цисплатина формулы II рекомендована Фармкомитетом СССР в качестве одной из моделей для испытания новых химиопрепаратов.
Перевивку опухоли осуществляют внутрибрюшинно введением 0,5 мл асцитической жидкости. Препараты растворяют в физиологическом растворе и вводят животным внутрибрюшинно однократно через сутки после перевивки опухоли. Эффективность проведенной терапии оценивают на основании изменения средней продолжительности жизни животных (СПЖ) в опыте по сравнению с контролем и по числу излеченных животных. Результаты испытаний представлены в табл.1.
Изучена противоопухолевая активность СФМК-П на модели лимфолейкоза Р-388, также рекомендованного Фармкомитетом СССР для испытаний новых химиопрепаратов. Испытания противоопухолевой активности на этой модели показали, что комплекс заметно более активен по сравнению с ЦП при значительно меньшей токсичности эффективных доз. Так, при введении мышам с экспериментальным лимфолейкозом Р-388 СФМК-П в дозе 600 мг/кг наблюдалось увеличение СПЖ на 128% по сравнению с контролем, в то время как введение ЦП в максимально переносимой дозе 7 мг/кг приводит к увеличению СПЖ только на 30%
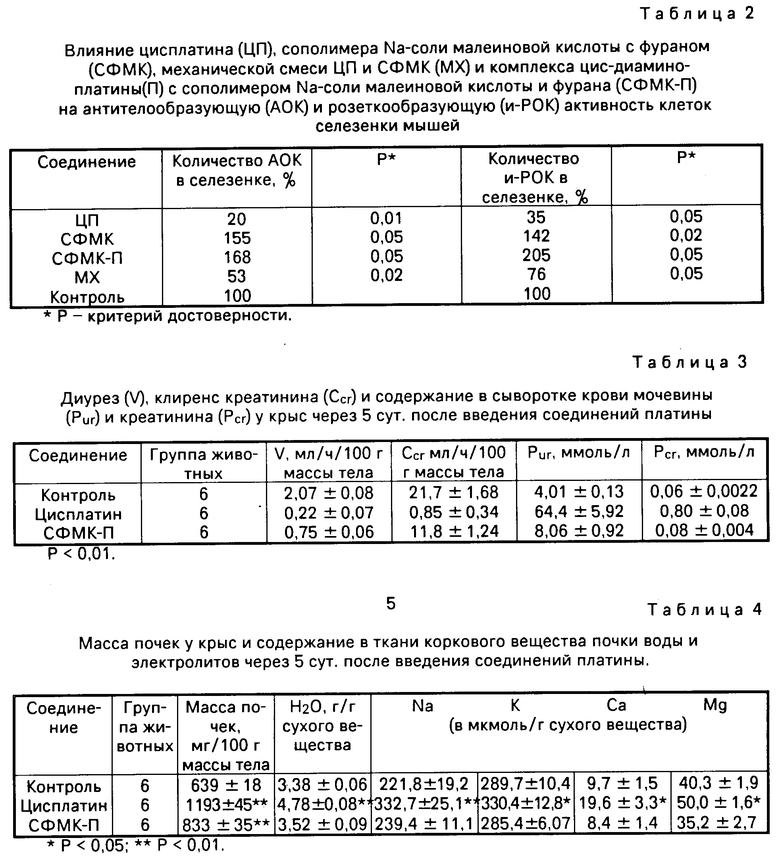
Изучено влияние полимерных комплексов платины на некоторые показатели иммунного ответа. Исследования проводят на мышах-самках линии СВА. В эксперименте используют пять групп животных, каждой из которых вводят, соответственно, цисплатин (аналог по биологической активности), сополимер фурана и Na-соли малеиновой кислоты (аналог по структуре), их механическую смесь, а также комплексное соединение платины.
ЦП вводят в максимально переносимой дозе 7 мг/кг (содержащей 4,5 мг/кг платины). Механическую смесь составляют из расчета 42 мг/кг СФМК и 7 мг/кг ЦП (4,5 мг/кг платины). Препараты растворяют в физиологическом растворе и вводят животным внутрибрюшинно. Одновременно вводят антиген, в качестве которого используют эритроциты барана. В процессе исследований изучают следующие показатели: изменение антителообразующей активности клеток селезенки (АОК) и розеткообразующую активность лимфоидных клеток селезенки (И-РОК). Полученные результаты представлены в табл.2.
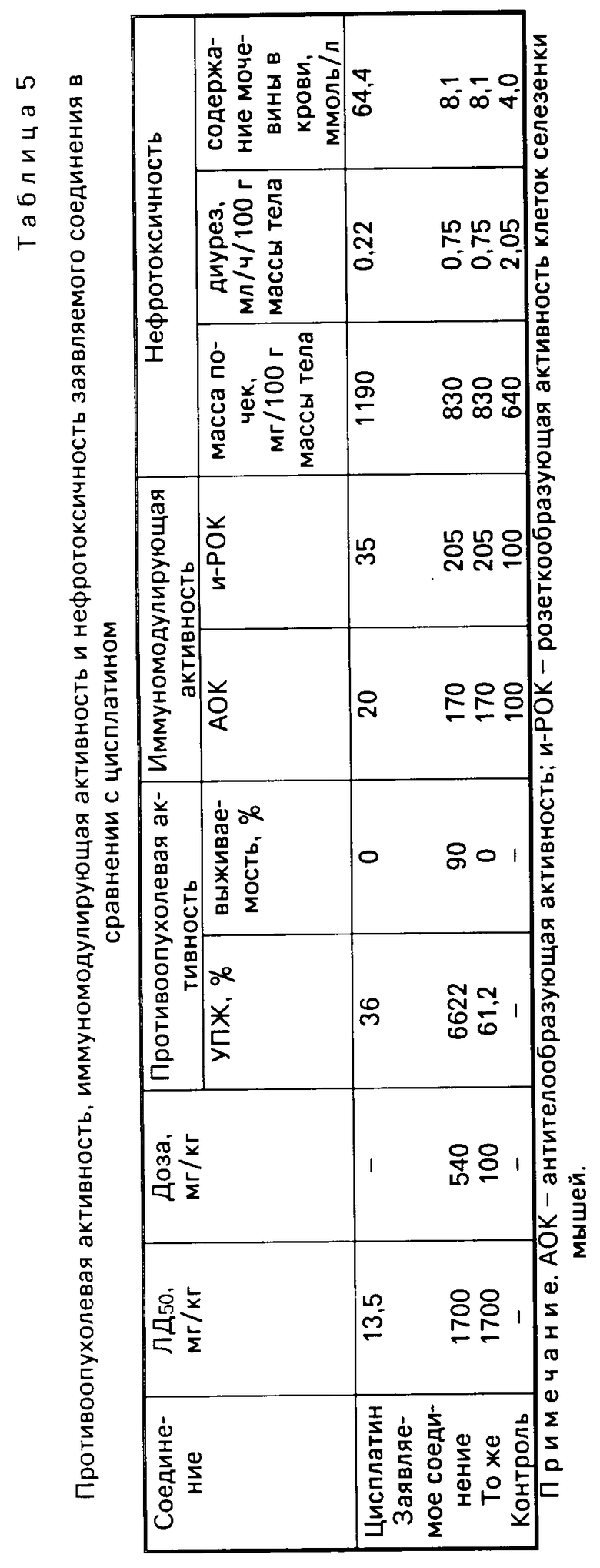
Изучено действие полимерного комплекса платины на почки. Опыты проводят на белых крысах-самках линии Вистер массой 180-200 г. Исследуемые соединения, растворенные в физиологическом растворе, вводят животным внутрибрюшинно. Влияние заявленного соединения на функцию почек сравнивают с действием на них цисплатина. Через 5 суток после введения цисплатина в дозе 5 мг/кг (3,5 кг в пересчете на чистый металл) у крыс выявляется типичная картина острой почечной недостаточности: отмечается выраженное нарушение экскреторной функции почки резко падает диурез, более чем в 20 раз снижается клубочковая фильтрация, определяемая по клиренсу эндогенного креатинина, концентрация мочевины в сыворотке крови увеличивается в 15 раз, равно как и содержание креатинина (табл. 3,5). Существенные изменения наблюдаются и в ткани почки вес органа увеличивается почти в 2 раза, развивается массивный отек почечной ткани, в ней повышается содержание Na, К, Са и Mg (см.табл.4).
Иная картина наблюдается при введении крысам заявленного комплексного соединения платины в дозе 100 мг/кг (9,3 мг/кг платины в пересчете на чистый металл).
Из данных, представленных в табл.3,4,5 видно, что заявляемый комплекс в дозе 100 мг/кг по всем показателям значительно менее токсичен, чем цисплатин, несмотря на высокое (в 3 раза выше, чем в цисплатине) содержание платины в пересчете на чистый металл.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКСНОЕ СОЕДИНЕНИЕ ЦИС-ДИАММИНОПЛАТИНЫ (П) С СОПОЛИМЕРОМ NA-СОЛИ МАЛЕИНОВОЙ КИСЛОТЫ И 1,4-ДИИЗОПРОПОКСИБУТЕНА-2, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ С ШИРОКИМ ИНТЕРВАЛОМ ТЕРАПЕВТИЧЕСКИХ ДОЗ ПРИ ПОЛНОМ ОТСУТСТВИИ НЕФРОТОКСИЧНОСТИ И ИММУНОДЕПРЕССАНТНОГО ДЕЙСТВИЯ | 1990 |
|
RU2034856C1 |
| СРЕДСТВА, ПОДАВЛЯЮЩИЕ РОСТ РАКОВЫХ КЛЕТОК | 1993 |
|
RU2098096C1 |
| ЦИС-ХЛОРДИАММИН-1,3-ДИМЕТИЛКСАНТИНПЛАТИНЫ (II) ХЛОРИД ДИГИДРАТ, ПРОЯВЛЯЮЩИЙ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 1990 |
|
SU1790190A1 |
| Соли сополимера малеиновой кислоты с циклооктен-4-карбоновой кислотой, обладающие противовирусными свойствами | 1989 |
|
SU1692988A1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2025125C1 |
| СРЕДСТВО ДЛЯ МЕСТНОГО ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 1992 |
|
RU2083200C1 |
| ПОЛИКОМПЛЕКСЫ 2-ХЛОРЭТИЛФОСФОНОВОЙ КИСЛОТЫ С N-СОДЕРЖАЩИМИ ПОЛИМЕРАМИ В КАЧЕСТВЕ ДЕФОЛИАНТОВ | 1994 |
|
RU2079512C1 |
| Сополимеры малеинового ангирдида с алленовыми углеводородами,обладающие противовирусными свойствами | 1980 |
|
SU900599A1 |
| Сополимеры N,N-диалкил-N,N диаллиламмонийхлорида с метакриловой кислотой, обладающие флокулянтными и обессоливающими свойствами | 1980 |
|
SU910664A1 |
| НАНОСОЕДИНЕНИЯ ПЛАТИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2538199C2 |
Изобретение относится к области высокомолекулярных химических соединений, обладающих противоопухолевой и иммуностимулирующей активностью. Использование: в медицине при лечении онкологических заболеваний. Комплексное соединение цис-диаминопластины (П) с сополимером Na-соли малеиновой кислоты и фурана обладает иммуностимулирующей и противоопухолевой активностью при низкой нефротоксичности. 5 табл.
Комплексное соединение цис-диаминоплатины (II) с сополимером Na-соли малеиновой кислоты и фурана общей формулы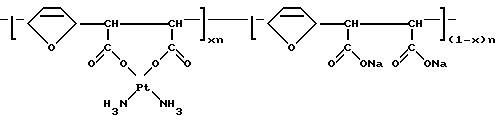
где X 0,11 0,46;
n 20 25,
с мол.м. 5000 12000,
обладающее иммуностимулирующей и противоопухолевой активностью, с широким интервалом терапевтических доз при низкой нефротоксичности.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Преснов М.А., Коновалова А.Л., Корольчук В.П | |||
| Комплексные соединения платины в химиотерапии злокачественных опухолей | |||
| Вестник Академии медицинских наук СССР, 1979, N 2, с.68. | |||
Авторы
Даты
1995-04-30—Публикация
1990-01-29—Подача