Изобретение относится к новым производным замещенной бензоилбензол-, бифенил- и 2-оксазолалкановой кислоты, обладающим ингибирующим действием в отношении липоксигеназы, фосфолипазы А2 и являющимися антагонистами лейкотриенов; производным, которые пригодны для использования в качестве противовоспалительных, противоаллергических средств, а также в качестве цитопротекторов.
В настоящее время твердо установлено, что метаболизм арахидоновой кислоты (АА) у млекопитающих осуществляется двумя различными путями. Метаболизм арахидоновой кислоты ферментами циклооксигеназы приводит к образованию простагландинов и тромбоксанов. Известно, что простагландины образуются из эндопероксидов РGG2 и PGH2 в процессе метаболизма арахидоновой кислоты, вызванного циклооксигеназой. Эти эндопероксиды являются также предшественниками тромбоксанов (Тх/A2 и В2. ТхА2 это вазоконстриктор), сосудосуживающее средство, стимулирующее агрегирование тромбоцитов. В нормальном состоянии сосудосуживающие свойства и способность вызвать агрегирование тромбоцитов тромбоксанами сбалансирована другим продуктом, образующимся из эндопероксидов в циклооксигеназном цикле, простациклином (PGI2), который представляет собой вазодилятор (сосудорасширяющее средство), обладающий способностью подавлять (ингибировать) агрегирование тромбоцитов. В случае уменьшения синтеза простациклина и/или усиления активности тромбоцитов наблюдается тромбоз и сужение кровеносных сосудов. Роль простаноидов в гемостазе и тромбозе рассмотрена в работе P.I.Gryglewski, CRC Crit. Rev. Biochem. 7, 291 (1980) и I. B.Smith, Am.I.Pathol 99, 743 (1980). Известно, что циклооксигеназные метаболиты принимают непосредственное участие в ответе на воспаление (см. Higgs и др. AaоCca Peeac, 16, 287-299, 1984). Это проявляется через их сосудорасширяющую активность, их участие в увеличении проницаемости сосудов для пептидных медиаторов боли и лихорадочного возбуждения, и участие в образовании отека. И наконец, различные аспекты клеточно-опосредованного иммунитета связаны с циклооксигеназными продуктами.
Другое направление (цикл) метаболизма АА включает ферменты липоксигеназы и приводит к образованию ряда окисленных продуктов, называемых лейкотриенами. Последние обозначают LT номенклатурной системой, и большинство важных продуктов липоксигеназного цикла метаболизма АА представляют лейкотриены В4, С4 и D4. Было установлено, что вещество, обозначающее медленно-действующую компоненту анафилаксии (SRS-A) представляет смесь лейкотриенов, с LTC4 и LTD4 в качестве первичных продуктов и содержащую различные количества других лейкотриеновых метаболитов (Bach и др. I.Immunology 215, 115-118, 1980, Biochem. Biophys. Res, Commun. 93, 1121-1126, 1980).
Значение этих лейкотриенов, подтвержденное большим количеством фактов, состоит в том, что эти лейкотриены участвуют в воспалительных реакциях, проявляют хемотактическую активность, стимулируют лизосомальное выделение (секрецию) фермента и действуют как важный фактор в непосредственной аллергической реакции. Установлено, что LTC4 и LTD4 это эффективные бронхоконстрикторы бронхов человека (см. Dahlen и др. Nature 288, 484-486, 1980 и Piper, Int. Arc. Appl. Immunol. 76, прил.1, 43, 1985, которые стимулируют in vitro выделение слизи из дыхательных путей (Maron и др. Am. Rev. Resp. Dis. 126, 449, 1982), они являются также сильнодействующими факторами сосудорасширения в коже (см. Bisgaard и др. Prostaglandins 23, 797, 1982) и ответственны за образование волдырей и внезапное обострение болезни (Самр и др. Br. I. Pharmacol. 80, 497, 1983). Непептидный лейкотриен, LTB4, это сильнодействующий хемотактический фактор для лейкоцитов (см. A.W. Ford Hutchinson, I.Roy Soc. Med. 74, 831-833, 1981), стимулирующий аккумуляцию клеток и поражающий сосуды гладких мышц (см. Bray, Br. Med. Bull. 39, 249, 1983). Активность лейкотриенов как медиаторов воспалительных процессов и аллергии весьма широко подтверждается данными обзора Bailey и Casey Ann. Reports. Med. Chem. 19, 87, 1986).
Фосфолипаза А2 (ФЛА2) это фермент, который определяет скорость процессов цикла арахидоновой кислоты, поскольку он ответственен за гидролиз сложноэфирной связи АА с фосфолипидами в С-2 положении мембраны. В результате этой реакции гидролиза образуется два продукта (1)-свободная арахидоновая кислота (АА), которая становится доступной для последующего метаболизма либо по циклооксигеназному направлению, либо по липоксигеназному направлению, и (2)-лизофосфолипид. При действии на ФЛА2 алкиларахидоноилглицерофосфатидилхолина инициируется образование тромбоцитактивирующего фактора (ТАФ); ТАФ это про-возбудитель воспаления (см. Wedmore и др. Br. I. Phapmacol. 74, 916-917, 1981). В этой связи следует отметить, что, по-видимому, противовоспалительные стероиды ингибируют эйкозаноидный синтез за счет того, что индуцируют синтез протеина, ингибирующего ФЛА2, обозначаемого как макрокортин или липомодулин (см. Flower и др. Nature, Лондон, 278, 456, 1979 и Hirata и др. Proc. Nat. Acad. Sci. USA, 77, 2533, 1980).
Как начальная стадия, приводящая к последующему превращению АА в различные эйкозаноиды в результате циклооксигеназного и липоксигеназного направлений, выделение АА из фосфолипидов мембраны, катализируемое ФЛА2, представляет собой стадию, определяющую протекание различных физиологических проявлений, связанных с активностью эйкозаноидов и/или ТАФ. Так как ФЛФ2, как было установлено, необходим для агрегирования тромбоцитов (Pickett и др. Biochem. I. 160, 405, 1976), сокращения сердечной мышцы и возбуждения (Geisler и др. Pharm. Res. Commun. 9, 117, 1977), также как и синтеза простагландинов (Vogt. Adv. Prostagl. Thromb. Res. 3, 89, 1978), то ингибирование ФЛА2 связывают с терапевтическим действием на физиологические проявления, вызванные ТАФ или продуктами циклооксигеназного и/или липоксигеназного метаболизма АА.
Имеется также свидетельство того, что продукты циклооксигеназного (липоксигеназного) метаболизма играют ключевую роль как в патогенезе разрушения слизистой желудка, вызываемого как внеклеточными (содержимое желудка и кишечника, микроорганизмы и т.п.) или внутриклеточными (ишемия, вирусы, и т. п.) агентами, так и в защите клеток против такого разрушения. Таким образом, с одной стороны, простагландины проявляют цитозащитное действие в отношении слизистой желудка (см. Robert, Gastroenterology, 77, 761-767, 1979), и это действие простагландинов, особенно серии Е, рассматривают как важный фактор при лечении желудочно-кишечных язв (см. Isselbacher, Drugs 33, (прил.) 38-46, 1987). С другой стороны, эксперименты ex vivo, показывают, что ткань слизистой желудка крыс, предварительно обработанных этиловым спиртом, способна генерировать LTC4, и что это продуцирование LTC4 количественно связывается с тяжестью разрушения, вызываемого этанолом (см. Lange и др. Naunyn Schmiedeberg Arch. Pharmacol. Suppl. 330, Р 27, 1985). Также было показано, что LTC4 может индуцировать сужение как венозных, так и артериолярных сосудов подслизистой у крыс (см. Whittle, IUPHAR, 9-й Int. Cong. of Pharm. S 30-2, Лондон, Англия, 1984). Это очень важно, поскольку поражение слизистой, вызванное этиловым спиртом, может носить многофакторный характер, например, может быть связано со стазом потока крови в желудке, вносящим существенную долю в развитие гемморагических некротических процессов пораженной (обожженной ткани) (см. Guth и др. Gastroenterology, 87, 1083-1090, 1984). Более того, у анестезированных кошек, экзогенный LTD4 вызывает как увеличение секреции пепсина, так и уменьшение трансжелудочного потенциала (Pendleton и др. Eur. J. Pharmacol. 125, 297-99, 1986). В этой связи следует упомянуть значительный, недавно установленный факт, ингибиторы 5-липоксигеназы и некоторые антагонисты лейкотриенов защищают слизистую желудка от повреждений, вызываемых оральным или парэнтеральным введением большинства противовоспалительных лекарств нестероидной природы (см. Rainsford, Agentsand Actions, 21, 316-319, 1987). Тромбоцит активирующий фактор также причастен, как медиатор, к желудочно-кишечным повреждениям, и недавно было установлено, что ингибиторы 5-липоксигеназы ингибируют, индуцированные ТАФ, поражения слизистой желудка (Gastroenterology, 96, А55, А434, 1989). Таким образом значительная часть доказательств свидетельствует о причастности продуктов липоксигеназной активности к развитию патологических признаков, связанных с поражением слизистой желудка, таких, например, как те, что вызваны действием этилового спирта и принятием противовоспалительных лекарственных средств нестероидной природы. Соединения, которые ингибируют биологическое действие лейкотриенов и ТАФ и/или контролируют биосинтез этих веществ, например, путем ингибирования 5-липоксигеназы, рассматриваются как вещества, представляющие ценность в качестве цитопротекторных средств.
Соответственно биологическая активность лейкотриенов и SRS, и липоксигеназы, как фермента, обусловливающего метаболизм АА в лейкотриены, указывает на то, что рациональный выбор лекарственной терапии в целях предотвращения, подавления или улучшения симптомов аллергии, анафилаксии, астмы и воспалительных процессов, а также в качестве желудочных цитопротекторов, должен базироваться либо на блокировании выделения медиаторов посредников таких состояний, либо на противодействии их влиянию. Соединения, ингибирующие биологическое действие лейкотриенов и SRS и/или контролирующие биосинтез этих веществ, например, путем ингибирования ФЛА2, участвующей в выделении арахидоновой кислоты из фосфолипидов мембраны, или путем ингибирования липоксигеназы, рассматриваются как вещества, представляющие ценность в качестве лекарственных средств, применяемых при лечении аллергической бронхиальной астмы, аллергических ринитов, также как и других промежуточных аллергических реакций, а также в обеспечении цитозащиты желудка.
В настоящее время установлено, что некоторые новые производные бензоилбензол-, бифенил- и 2-оксазолалкaновой кислоты ингибируют ФЛА2 и липоксигеназу и противодействуют влиянию продуктов липоксигеназного направления метаболизма АА, поэтому эти соединения пригодны для использования в качестве противовоспалительных, противоаллергических и цитозащитных средств. Изобретение обеспечивает новые соединения следующей формулы: A/CH2/nO-B, в котором А это феноксиэтил, феноксифенил или группа формулы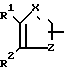 в которой Х это -N- или
в которой Х это -N- или 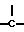 R3 Z это
R3 Z это 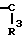 =
= 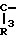
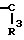 = N
= N ,
,  N
N 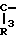 ,
, 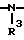 , -S- или -0-
, -S- или -0-
R1 это водород, низший алкил или фенил;
R2 это водород или низший алкил; или R1 и R2, объединенные вместе, образуют бензольное кольцо; R3 это водород или низший алкил;
n равно 1-2; В это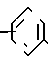
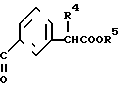
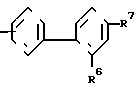
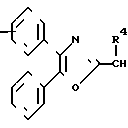 (CH2)mCOOR5 или
(CH2)mCOOR5 или 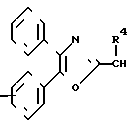 (CH2)mCOOR5
(CH2)mCOOR5
в которых R4 и R5 каждый, независимо друг от друга, представляет водород или низший алкил; R6 это галоид или нитро-группа; R7 это -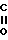 -R8 или -
-R8 или -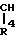 COOR5 R8 это низший алкил; m равно 0-3; и фармакологически приемлемые соли этих соединений.
COOR5 R8 это низший алкил; m равно 0-3; и фармакологически приемлемые соли этих соединений.
Под термином "низший алкил" подразумеваются группировки содержащие 1-6 углеродных атомов в цепочке. Термин "галоид" относится к фтору, хлору или брому.
Группа А охватывает, interalio, 5- или 6-членные ненасыщенные азот-, серу- или кислородсодержащие моно- или бензоконденсированные гетероциклы, возможно замещенные низшим алкилом или фенилом. Под предшествующее определение подпадают следующие гетероциклические группировки: фурил, пирролил, тиенил, оксазолил, тиазолил, имидазолил, пиридил, пиразинил, пиримидинил, бензофуранил, бензотиенил, бензотиазолил, индолил, бензоксазолил, хинолинил, бензимидазолил, хиноксалинил, хиназолинил и т.п. Наиболее предпочтительны хинолинил, бензотиазолил и бензимидазолил.
Соединения изобретения могут образовывать фармакологически приемлемые соли с фармакологически приемлемыми органическими и неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная, фосфорная, азотная, малеиновая, фумаровая, бензойная, аскорбиновая, памоиновая, янтарная, метансульфокислота, сульфоновая кислота, уксусная, пропионовая, винная, лимонная, яблочная, молочная, миндальная, коричная, пальмитиновая, итаконовая кислоты и бензолсульфокислота. Соединения, которые являются карбоновыми кислотами способны образовывать соли щелочных металлов и карбоксилаты щелочно-земельных металлов, а также карбоксилаты фармакологически приемлемых катионов, полученных из аммиака или основных аминов. К последним относятся, но не ограничиваются этими примерами, ион аммония, моно-, ди- и триметиламмоний, моно-, ди- и триэтиламмоний, бензилдиметиламмоний, циклогексиламмоний, бензиламмоний, дибензиламмоний, пиперидиний, 1-изопропилпиперидиний, морфолиний, пирролидиний, пиперазиний, 1-метилпиперидиний, 4-этилморфолиний, 1-изопропилпирролидиний, 1,4-диметилпиперазиний, 1-н-бутилпиперидиний, 2-метилпиперидиний, 1-этил-2-метилпиперидиний, моно-, ди- и триэтаноламмоний, этилдиэтиламмоний, н-бутилмоноэтаноламмоний, трис(гидроксиметил)метиламмоний, фенилмоноэтаноламмоний и т.п.
Соединения изобретения могут быть получены согласно следующим реакционным схемам. Когда необходимо получить соединение формулы
A(CH2)nO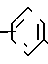
 реакции подвергают 4-метоксибензонитрил с 3-бромтолуолом, затем полученное соединение бромируют в этиленбромиде и получают промежуточное соединение 3-бромометил-4-метокси бензофенон.
реакции подвергают 4-метоксибензонитрил с 3-бромтолуолом, затем полученное соединение бромируют в этиленбромиде и получают промежуточное соединение 3-бромометил-4-метокси бензофенон.



Полученное бромпроизводное затем подвергают реакции с цианидом натрия, в результате чего получают промежуточный продукт цианопроизводное, которое гидролизуют в присутствии основания и получают карбоновую кислоту, которую деметилируют и получают гидроксикарбоновую кислоту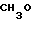
CH3O

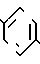
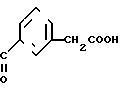
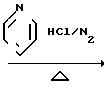

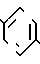
Полученный промежуточный продукт гидроксикарбоновую кислоту превращают в метиловый эфир при взаимодействии с метиловым спиртом в присутствии пара-толуолсульфокислоты, затем обрабатывают соединением соответствующего галоидного алкила, в котором значение А определено и Hal это галоид, в результате получают требуемый продукт в виде метилового эфира
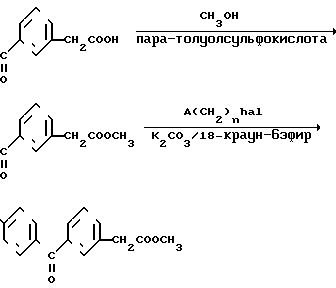
Полученный метиловый эфир может быть гидролизован традиционными способами, в результате получают нужный продукт в виде свободной карбоновой кислоты.
Соединения изобретения формулы
A(CH2)nO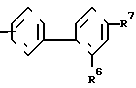 R6 это нитрогруппа и R7 это -C-R8, могут быть получены следующим образом, например, 4-бромо-3-нитроацетофенон запускают в реакцию с 4-иоданизолом в присутствии медной бронзы, в результате этой реакции получают промежуточный метоксисодержащий бифенил, который затем диметилируют бромидом алюминия и получают гидроксипромежуточное соединение. Последнее затем запускают в реакцию с соединением соответствующего галоидалкилa А, в котором значение А определено выше, Hal это галоид и, в результате, получают конечный требуемый продукт.
R6 это нитрогруппа и R7 это -C-R8, могут быть получены следующим образом, например, 4-бромо-3-нитроацетофенон запускают в реакцию с 4-иоданизолом в присутствии медной бронзы, в результате этой реакции получают промежуточный метоксисодержащий бифенил, который затем диметилируют бромидом алюминия и получают гидроксипромежуточное соединение. Последнее затем запускают в реакцию с соединением соответствующего галоидалкилa А, в котором значение А определено выше, Hal это галоид и, в результате, получают конечный требуемый продукт.


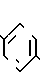
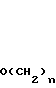
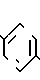

Соединения, в которых R6 это галоид и R7 это CHCOOR6, могут быть получены по способу, в котором используется 4-метоксибифенилсодержащее промежуточное соединение, полученное в предыдущей схеме. 4-Ацетил-4-метокси-2-нитробифенил промежуточный продукт предыдущей схемы восстанавливают хлоридом двухвалентного олова и получают промежуточный продукт аминопроизводное, в котором затем аминогруппу замещают на галоид. Например, аминогруппа может быть замещена на фтор через стадию получения переходного промежуточного продукта диазонийфторобората, который получают из аминопроизводного при взаимодействии с нитритом натрия в присутствии тетрафтороборной кислоты. Полученный ацетилфторометоксибифенил затем превращают в соответствующую карбоновую кислоту посредством деметилирования бромистым водородом и получают в результате 2-фторо-4-гидрокси-1,1-бифенил-4-уксусную кислоту

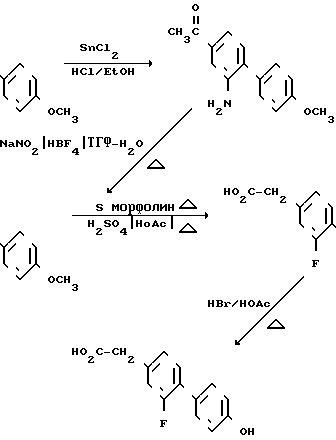
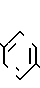

Последнее промежуточное соединение карбоновой кислоты этерифицируют метанолом в присутствии пара-толуолсульфокислоты, полученный продукт затем взаимодействует с соответствующим соединением галоидалкила А, в котором А определен выше, а Hal это галоид, в результате получают требуемый продукт в виде метилового эфира
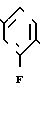
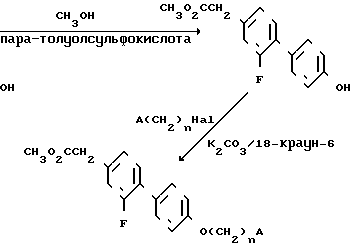
Полученный эфир может быть гидролизован традиционными способами с получением нужного продукта в виде карбоновой кислоты.
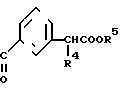
Соединения изобретения формулы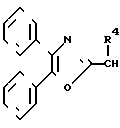 (CH2)mCOOR5 или
(CH2)mCOOR5 или 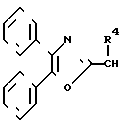 (CH2)mCOOR5
(CH2)mCOOR5
могут быть получены следующим образом. В реакцию запускают бензальдегид и 4-метоксибензальдегид и получают 4-метоксибензоин, который затем превращают в полусукцинат по реакции с янтарным ангидридом. Полусукцинат затем запускают в реакцию с мочевиной и уксусной кислотой и получают промежуточный продукт 4-(4-метоксифенил)-5-фенил-2-оксзолпропионовую кислоту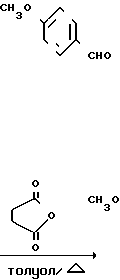
Последний промежуточный продукт деметилируют бромистым водородом и этерифицируют метанолом, получают гидрокси метиловый эфир промежуточный продукт, который затем подвергают реакции с соответствующим соединением галоидного алкила А, в котором А определен выше, Hal это галоид, и получают требуемый конечный продукт в виде метилового эфира
 CH2COOH
CH2COOH
Полученный эфир может быть гидролизован традиционными способами с получением требуемого конечного продукта в виде карбоновой кислоты.
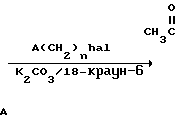
Соответствующие исходные вещества, используемые в реакционных схемах приведенных выше, коммерчески доступны или могут быть синтезированы согласно способам, хорошо известным специалистам в данной области. Например, промежуточное соединение 2-бромометилхинолин может быть получен в соответствии со следующей реакционной схемой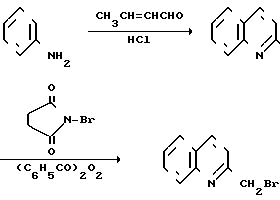
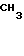
Бензоконденсированные гетероциклические соединения, использованные в приведенных последовательностях реакций, также могут быть коммерчески доступны или могут быть получены известными способами. Например, такие производные, как 1-метил-2-хлорметилбензимидазол, 2-хлорометилбензтиазол и 2-хлорметилбензоксазол могут быть получены в соответствии со следующей реакционной схемой:
R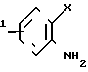
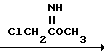 R
R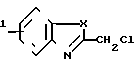
где Х это -0- или NCH3. Реакцию предпочтительно проводить при контролируемой низкой температуре в органическом растворителе, таком как метиленхлорид.
Соединения изобретения, благодаря их способности ингибировать активность фермента ФЛА2, также как и фермента липоксигеназы и оказывать противодействие медиаторам, образующимся в результате ферментативного метаболизма, пригодны для использования при лечении заболеваний, проводниками которых являются продукты окисления арахидоновой кислоты. Таким образом, соединения изобретения показаны при лечении таких заболеваний, как ревматоидные артриты, воспаления пищеварительного тракта, остеоартриты, тендиниты, бурситы, псориазы (и родственные кожные воспаления) и сходные заболеваний, включающие воспалительные процессы. Кроме того, благодаря их способности оказывать противодействие LTC4, LTD4 и LTE4, которые представляют собой заместители SRS-A, они полезны в процессах ингибирования симптомов, индуцируемых этими лейкотриенами. Следовательно, соединения изобретения показаны для предотвращения и лечения тех болезненных состояний, причиной которых являются LTC4, LTD4и LTE4, например аллергических ринитов, аллергической бронхиальной астмы и других, провоцируемых лейкотриенами, назо-бронхиальных обструктивных заболеваний дыхательных путей, а также других промежуточных аллергических реакций, например аллергических конъюктивитов. Эти соединения особенно ценны в качестве препаратов для предотвращения и лечения аллергической бронхиальной астмы.
Соединения изобретения представляют собой цитопротекторные средства и рассматриваются как средства, особенно полезные для совместного приема с традиционными противовоспалительными лекарственными средствами нестероидной природы, вызывающими вследствие их основного побочного действия болезненное раздражение желудочно-кишечного тракта. Цитозащитное действие данных соединений в значительной степени снижает гастрораздражающее воздействие традиционных противовоспалительных лекарственных средств. Это защитное действие основано не только на способности соединений изобретения ингибировать биологическое действие лейкотриенов и/или контролировать биосинтез этих веществ путем ингибирования липоксигеназы, но также на эффекте шунтирования, в результате которого отключается липоксигеназное окисление арахидоновой кислоты и переключается на циклоокигеназный цикл превращения арахидоновой кислоты, что приводит к увеличению образования цитопротекторных простангландинов. Подобные биологические эффекты делают соединения изобретения особенно полезными при лечении таких заболеваний, как эрозионный эзофагит, воспаление пищеварительного тракта и индуцированные гемморагические повреждения, подобные тем, которые вызываются алкоголем и нестероидными противовоспалительными лекарственными средствами (NSAID), печеночная ишемия, повреждение или некроз ткани печени, поджелудочной железы, почек, миокарда, вызванный действием ядовитого вещества; разрушение паренхимы печени, вызванное гепатоксинами, такими как тетрахлорид углерода и Д-галактозоамин; почечная ишемия; заболевания, вызванные разрушением (повреждением печени; желчно-солевой панкреатит или желудочное расстройство; распад клеток; вызванный травмой или стрессом; и почечная недостаточность, вызванная глицерином.
Когда соединения изобретения используются при лечении аллергических заболеваний дыхательных путей, как противовоспалительные средства и/или цитопротекторные средства, то их можно включать в оральные выпускные формы, такие как таблетки, капсулы и т.п. Соединения можно вводить сами по себе или в сочетании с подходящими носителями (наполнителями), таким как карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза, натрий карбоксиметилцеллюлоза, воск с низкой температурой плавления, масло какао и т.п. Разбавители, отдушки, солюбилизирующие средства, лабриканты, суспендирующие средства, связующие, средства для дезинтеграции таблеток и т.п. средства могут быть использованы в выпускной форме. Соединения могут быть инкапсулированы с или без других носителей. Во всех случаях доля активного ингредиента в названных композициях, как в жидких, так и в твердых, должна быть, по крайней мере, в таком количестве, чтобы проявить требуемую активность при оральном приеме. Соединения изобретения можно вводить также парэнтерально, в этих случаях их используют в виде стерильных растворов, содержащих другие растворенные вещества, например, в достаточном количестве соль или глюкозу, для того, чтобы вводимый раствор был изотоническим. Для введения путем ингаляции или инсуфляции (вдувания) данные соединения могут введены в составы в виде водных или частично водных растворов, таких, которые затем можно будет использовать в форме аэрозолей.
Требования к дозировке варьируются в зависимости от конкретных используемых составов, способов введения пиепарата, тяжести заболевания (симптомов) и конкретного субъекта, который будет подвергнут лечению. Лечение, как правило, следует начинать с малых доз, меньших чем оптимальная доза данного соединения. Затем дозировку увеличивают до достижения оптимального при данных обстоятельствах эффекта. Как правило, соединения изобретения наиболее желательно вводить в концентрации, которая обычно будет давать эффективный результат, не вызывая при этом нежелательных (вредных) или разрушительных побочных действий, и их можно вводить в виде одноразовой дозы или, если в этом есть необходимость, эта доза может быть разделена на подходящие субдозы, которые вводятся в подходящее время суток.
Действие соединений изобретения как ингибиторов ФЛА2 и липоксигеназы, антагонистов лейкотриенов, также как средств, обладающих противовоспалительным действием и оказывающих потенциальное действие на гастрораздражители желудочных раздражителей, может быть продемонстрировано стандартными способами фармакологии, которые более полно будут описаны в приводимых примерах.
Эти фармакологические процедуры, interalia, определяют специфичность действия соединений изобретения, как ингибиторов ФЛА2измеряемого по способности этих соединений ингибировать синтез LTB4 и PGE2 гликогенизвлеченными полиморфоядерными лейкоцитами крыс, также как и их способность ингибировать выделение арахидоновой кислоты, осуществляемое с помощью ФЛА2, источником которого является человек. Фармакологические исследования дополнительно демонстрируют способность соединений изобретения ингибировать in vivo липоксигеназное и циклооксигеназное направления превращения (метаболизма) арахидоновой кислоты.
Примеры иллюстрируют способы получения и фармакологическое исследование соединений изобретения.
П р и м е р 1. 1-[2-нитро-4'-(2-хинолинилметокси)-[1,1I'-бифенил]-4-ил-этанон.
А. 4-Ацетил-4'-метокси-2-нитробифенил.
Перемешиваемую смесь 4-иодоанизола (43,65 г, 0,187 моль), 4-бромо-3-нитроацетофенона (40,6 г, 0,116 моль) и медного порошка (медная бронза, 36 г, 0,567 моль), хранящуюся в атмосфере азота, поместили в масляную баню, нагретую до 80оС. Температуру медленно подняли до 110оС, затем смесь выдерживали при этой температуре в течение 5 дней (ТСХ, 8:2 гексан-этилацетат). После охлаждения смесь растворили в дихлорметане и отфильтровали через прокладку из целита. Фильтрат и промывные воды упарили, а оставшееся густое масло темно-коричневого цвета пропустили через флеш-хроматографию (силикагель марки Merck 60, предварительно пропитанный дихлорометаном, элюирование проводили, использовав смесь 9:1 гексан-этилацета, для удаления примесей, а для выделения основного продукта смесь 8:2 гексан-этилацетат), в результате получили 16,2 г (32% выход) озаглавленного соединения (твердое вещество желтого цвета, т.пл. 124-126оС).
ЯМР (СDCl3, 400 МГц): δ 2,67 (С, 3Н, СОСН3), 3,85 (с, 3Н, ОСН3), 6,97 (д, 2Н, J 8,74 Гц, ArН), 2,27 (д, 2Н, J 8,74 Гц, ArH), 7,56 (д, 1Н, J 8 Гц, ArH), 8,15 (д, 1Н, J 8 Гц, ArH), 8,34 (с, 1Н, ArH). МС/ЭИ, м/з/:271/M+/.
В. 4-Ацетил-4'-гидрокси-2-нитробифенил.
К перемешиваемому раствору бромида алюминия AlBr 3(12,6 г, 47,4 ммоль) в бензоле (45 мл) по каплям в атмосфере азота добавляют раствор метилового эфира (5 г, 18,45 ммоль) вещества стадии А в бензоле (12 мл) в течение 30 мин. Полученный раствор перемешивают при комнатной температуре в течение 3,5 ч (ТСХ, 8: 2 гексан-этилацетат). Смесь охлаждают в ледяной бане, и образовавшийся комплекс разрушают, добавляя по каплям 6 н.HCl (примерно 37 мл). Отделяют органический слой и водную фазу реэкстрагируют эфиром (3х), объединенные вытяжки концентрируют до малого объема и экстрагируют снова 2,5 г. NaOH (2х50 мл + 1х10 мл). Щелочные экстракты охлаждают и подкисляют концентрированной HCl (до рН 2). Твердое вещество собирают и высушивают (4,27 г, 90%). Его используют в следующей стадии без дальнейшие очистки.
ЯМР (CDCl3, 400 МГц): δ 2,67 (с, 3Н, СОСН3), 5,03 (уширение, 1Н, ОН), 6,91 (д, 2Н, J 8,56 Гц, ArH), 7,23 (д, 2Н, J 8,57 Гц, ArH), 7,55 (д, 1Н, J 7,9 Гц, ArH), 8,15 (д, 1Н, J 8,1 Гц, ArH), 8,34 (с, 1Н, ArH).
МС (ЭИ, м(з): 257(6.р. М+).
С. 1-[2-нитро-4'-[2-хинолинил)-1,1'-бифенил-4-ил]этанон.
Смесь фенола (4,4 г, 17,12 ммоль), полученного в стадии В, порошкообразного карбоната калия (2,37 г, 17,12 ммоль), 18-краун-6 эфира (0,453 г, 1,71 ммоль) и ацетонитрила (38 мл) перемешивают при комнатной температуре в атмосфере азота в течение 15 мин. 2-Хлорметилхинолин (3,34 г, 18,83 ммоль), свободное, свежеприготовленное из хлористоводородной соли, основание добавляют, и полученную смесь нагревают с обратным холодильником в течение 10 ч (ТСХ, 7: 3 гексан-этилацетат). Добавляют 10% избыток карбоната калия, 18-краун-6 и хлорметилхинолина, кипячение продолжают еще в течение 4 ч. Растворитель отгоняют, и остаток разбавляют водой и экстрагируют этилацетатом (3х). Экстракты промывают и сушат над безводным сульфатом магния. Остаток подвергают флеш-хроматографированию (силикагель марки Merck 60, предварительно пропитанный дихлорметаном и проэлюированный для увеличения полярности смесями 7: 3, 1: 1 и 1:3 гексан-этилацетат, а затем чистым этилацетатом). После флеш-хроматографии получили 2,59 г чистого продукта названного соединения. После перекристаллизации из толуола получили твердое вещество желтого цвета с т.пл. 160-162оС (2,05 г, 30%).
ЯМР (CDCl3, 400 МГц): δ 2,66 (с, 3Н, СООН3), 5,43 (с, 2Н, ОСН2Ar), 7,10 (д, 2Н, J 8,7 Гц, ArH), 7,27 (д, 2Н, J 8,7 Гц, ArH), 7,56 (м, 2Н, ArH), 7,68 (д, 1Н, J 8,49 Гц, ArH), 7,75 (дт, 1Н, ArH), 7,84 (д, 1Н, J 8,1 Гц, ArH), 8,09 (д, 1Н, J 8,5 Гц, ArH), 8,14 (дд, 1Н, ArH), 8,22 (д, 1Н, J 8,49 Гц, ArH), 8,34 (с, 1Н, ArH). МС (ЭИ, м(з): 398(М+), 256,158,142.
Анализ на С24Н18N2О4
Рассчитано, С 72,35; Н 4,55. N 7,03.
Найдено, С 71,96; Н 4,75; N 6,80.
П р и м е р 2. 2-фторо-4'-(2-хинолинилметокси)-[1,1'-бифенил]-4-уксусная кислота.
А. 4-Ацетил-4'-метокси-2-аминобифенил.
К перемешиваемому теплому раствору хлорида двухвалентного олова (49,4 г, 218,9 ммоль) в смеси концентрированной HCl (72 мл) и этанола (99 мл) добавляют в течение 45 мин нитропроизводного примера 1 А (10,7 г, 39,5 ммоль). Полученный раствор желтого цвета нагревают с обратным холодильником в течение 3,5 ч (ТСХ, 1:1 гексан-этилацетат). Этиловый спирт удаляют, и остаток выливают в смесь 50% NaOH (360 мл) и льда. Образовавшийся твердый продукт экстрагируют (дихлорметан, 3х), экстракты промывают водой и сушат над безводным сульфатом натрия. После удаления растворителя получают твердое вещество желтого цвета (9,31 г, 97,8%), т.пл. 152-154оС.
ЯМР (CDCl3, 400 МГц): δ 2,59 (с, 3Н, СОСН3), 3,80 (с, 3Н, ОСН3), 6,97 (д, 2Н, J 8,7 Гц, ArH), 7,23 (д, 1Н, J 7,4 Гц, ArH), 7,40 (д, 2Н, J 8,7 Гц, ArH), 7,48 (д, 1Н, J 7,3 Гц, ArH), 7,49 (с, 1Н, ArH). МС (ЭИ, м/з/:(М-СН3)+, 226, (М-СН3)+, 198 (М-СОСН3)+, 83.
В. 4-Ацетил-4'-метокси-2-фторобифенил.
К перемешиваемой охлаждаемой льдом смеси анилина (9,2 г, 38,2 ммоль) в тетрагидрофуране (26 мл), воды (9,8 мл) и HBF4 (49% 35,1 мл) медленно добавляют раствор нитрита натрия (2,82 г, 48,85 ммоль) в воде (5 мл). В процессе добавления температура снаружи поддерживается ниже 5оС. Смесь затем перемешивают дополнительно в течение 20 мин при 0-5оС. Образовавшийся диазоний фтороборат отфильтровывают и промывают 10%-ным раствором HBF4 и 10%-ным раствором метанола в эфире и высушивают в вакууме. Соль разлагают при нагревании при 70оС в ксилоле (95 мл). После прекращения разложения смесь нагревают с обратным холодильником еще 2,5 ч (ТСХ, 1:1 гексан-этилацетат, УФ). Ксилол удаляют, и остаток экстрагируют этилацетатом (3х) и эфиром. Объединенные экстракты промывают 10%-ным раствором карбоната натрия, высаливают и сушат над безводным сульфатом магния. Удаление растворителя приводит к образованию масла янтарного цвета (6,03 г), которое подвергают очистке методом флеш-хроматографии (силикагель марки Merck 60, предварительная пропитка дихлорметаном, элюирование смесью 95:5 гексан-этилацетат). Названное соединение получили в виде твердого вещества желтого цвета в количестве 3,12-4,75 г (33-51% в зависимости от опыта); т.пл. 100-101оС.
ЯМР (CDCl3, 400 МГц): δ 2,62 (с, 3Н, СОСН3), 3,86 (с, 3Н, ОСН3), 7,00 (д, 2Н, J 8,9 Гц, ArH), 7,50-7,80 (м, 5Н, ArH).
МС (ЭИ/м(з): 244(М)+, 229(b.p. М-СН3)+.
С. 2-Фторо-4'-метокси-[1,1'-бифенил]-4-уксусная кислота.
Смесь серы (0,468 г, 14,6 ммоль), морфолина (2,57 мл) и кетона, полученного в стадии А (3,95 г, 16,2 ммоль) нагревают в течение 17 ч с обратным холодильником (ТСХ, обработанный кислотой слой силикагеля, 8:2 гексан-этилацетат). При охлаждении добавляют ледяную уксусную кислоту (9,9 мл), серную кислоту (1,6 мл) и воду (4 мл) и продолжают нагревание с обратным холодильником в течение 30 ч. Затем добавляют воду и смесь экстрагируют эфиром (3х). Объединенные экстракты концентрируют до небольшого объема и экстрагируют 10% -ным раствором карбоната натрия. Щелочные экстракты осторожно подкисляют на холоду, добавляли концентрированную HCl (до рН 2). Кислоту, название которой дано в заголовке, экстрагируют эфиром (3х), и экстракты промывают и высушивают над безводным сульфатом магния. После удаления растворителя получают твердое вещество коричневого с рыжеватым оттенком цвета (2,37 г, 56,3% т.пл. 140-142оС).
ЯМР (CDCl3, 400 МГц): δ 3,68 (с, 2Н, СН2СОО), 3,85 (с, 3Н, ОСН3), 6,96-7,50 (м, 7Н, ArH). МС (ЭИ/м(з): 260(М)+, 215 (b,p. М-СООН)+.
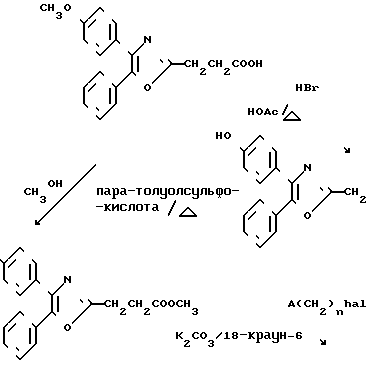
D. 2-Фторо-4'-гидрокси-[1,1'-бифенил]-4-уксусная кислота.
К раствору метилового эфира (1,31 г, 5,04 ммоль) стадии С в ледяной уксусной кислоте (17 мл) по каплям добавили 48%-ный раствор HBr в уксусной кислоте (25 мл), и смесь нагревали с обратным холодильником в течение 4,5 ч (ТСХ, 7:3 гексанэтилацетат). Добавили немного воды, и смесь проэкстрагировали эфиром (3х). Экстракты промыли, высушили над безводным сульфатом магния. После удаления растворителя получили указанное соединение в виде коричневато-рыжеватого вещества (1,13 г, 92%), т.пл. 208-210оС.
ЯМР (DMCO-d6, 400 МГц): δ 3,61 (с, 2Н, СН2СОО), 6,83 (д, 2Н, J 8,64 Гц, ArH), 7,1-7,42 (м, 5Н, ArH), 9,61 (с, 1Н, СООН). МС(CI м(з): (М)+ 246, 201 (М-СООН)+.
Е. 2-Фторо-4'-гидрокси-[1,1'-бифенил]-4-уксусной кислоты метиловый эфир.
Раствор кислоты из стадии D (1,1 г, 4,47 ммоль) в метиловом спирте (10 мл), содержащий пара-толуолсульфокислоту. Н2О (0,159 г) нагревают с обратным холодильником в течение 1,5 ч (ТСХ, обработанный кислотой слой силикагеля, гексан-этилацетат 7:3). Растворитель удалили, остаток растворили в этилацетате, промыли рассолом и высушили над безводным сульфатом магния. Твердое вещество коричневато-рыжеватого цвета (1,16 г, т.пл. 115-118оС, количественный выход) используют в следующей стадии без дальнейшей очистки.
ЯМР (CDCl3, 400 МГц): δ 3,65 (с. 2Н, СН2СОО), 3,73 (с, 3Н, СООСН3), 6,88 (д, 2Н, J 8,8 Гц, ArH), 7,10 (м, 2Н, ArH), 7,32-7,44 (м, 3Н, ArH).
МС (ЭИ, м(з): 260 (М)+, 201 (b.p. М-СООСН3)+.
F. 2-Фторо-4'-(2-хинолинилметокси)-[1,1'-бифенил]-4-уксусной кислоты метиловый эфир.
Смесь фенола из стадии Е (1,16 г, 4,46 ммоль), порошкообразного безводного карбоната калия (0,616 г, 4,46 ммоль), 18-краун-6 (0,118 г, 0,445 ммоль) и ацетонитрила перемешивали при комнатной температуре в атмосфере азота в течение 15 мин. Затем к ней добавили 2-хлорметилхинолин (0,871 г, 4,9 ммоль) в виде свободного основания, свежеприготовленного из хлористоводородной соли, и смесь поместили в масляную баню, нагретую до 65оС, на 5 ч. Добавили 10%-ный избыток карбоната калия, 18-краун-6 и хлорометилхинолина, и нагревание продолжали еще 6 ч (ТСХ, 19:1 дихлорметан-метанол или 7:3 гексан-этилацетат). Удалили растворитель и остаток разбавили водой и проэкстрагировали (3х) этилацетатом. Экстракты промыли и высушили над безводным сульфатом магния. После удаления получают твердое вещество желтовато-коричневатого цвета, которое очищают методом флеш-хроматографии (силикагель марки Merck 60, предварительно обработанный дихлорметаном, элюирование 7:3 гексан-этилацетат). Полученное таким образом указанное соединение (1,55 г, 87%) перекристаллизовывали из метанола. Получили твердый продукт почти белый с т. пл. 99-101оС.
ЯМР (CDCl3, 400 МГц): δ 3,64 (с, 2Н, СН2СОО), 3,72 (с, 3Н, СООСН3), 5,43 (с, 2Н, ОСН2Ar), 7,1 (М, 4Н, ArH), 7,35 (т, 1Н, ArH), 7,47 (д, 2Н, ArH), 7,55 (т, 1Н, ArH), 7,69 (д, 1Н, ArH), 7,74 (т, 1Н, ArH), 7,84 (д, 1Н, ArH), 8,09 (д, 1Н, ArH), 8,20 (д, 1Н, ArH)=МС (ЭИ, м(з): 401 М+, 142, 114.
Анализ на С25Н20FNO3.
Рассчитано, С 74,80; Н 5,02; N 3,49.
Найдено, С 74,68; Н 4,65; N 3,49.
G. 2-Фтор-4'-(хинолинилметокси)-[1,1'-бифенил]-4-уксусная кислота.
Раствор эфира (1,69 г, 4,21 ммоль) стадии F в сухом тетрагидрофуране (20 мл) обработали в атмосфере азота, по каплям добавляя 1н. LiOH (12,6 мл), и смесь перемешивали при комнатной температуре в течение 3 ч (ТСХ, 19:1 дихлорметан-метанол или 1: 1 гексан-этилацетат). Удалили растворитель и остаток обработали водой и нейтрализовали 10%-ной уксусной кислотой до рН 6,5. Кислоту проэкстрагировали этилацетатом (требуется большой объем), и экстракты высушивали над безводным сульфатом магния, после чего упарили до получения почти белого сухого остатка (1,65 г, количественный выход, т.пл. 190-193оС (разложение). Перекристаллизовывали из этилацетата и получили белое твердое вещество (1,3 г, 80% выход, т.пл. 195-196оС с разл.). Образец для анализа высушили в вакууме при 40оС.
ЯМР (DMCO-d6, 400 МГц): δ 3,62 (с, 2Н, СН2СОО), 5,41 (с, 2Н, СН2OAr), 7,15 (м, 4Н, ArH), 7,41 (т, 1Н, J 8 Гц, ArH), 7,48 (д, 2Н, ArH), 7,61 (т, 1Н, ArH), 7,69 (д, 1Н, ArH), 7,78 (дт, 1Н, ArH), 8,01 (м, 2Н, ArH), 8,42 (д, 1Н, ArH), 12,42 (с, СООН).
МС (+ ПАБ, м(з): 388 (М)+.
Анализ на С24Н18FNO3.
Рассчитано, С 74,41; Н 4,68; N 3,62.
Найдено, С 74,28; Н 4,48; N 3,69.
П р и м е р 3. 3-[4-(2-Хинолинилметокси(бензоил]бензол уксусная кислота.
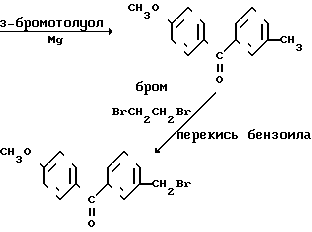
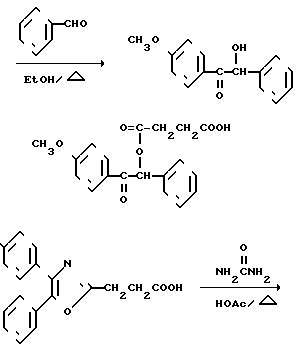
А. 3-Метил-[4'-метокси]бензофенон.
В трехгорлую колбу, снабженную холодильником, механической мешалкой и капельной воронкой, в токе азота загрузили 1,925 г (79,19 ммоль) магниевой стружки и эфир в количестве достаточном для того, чтобы покрыть стружки. Добавили несколько капель раствора бромотолуола (15,79 г, 92,28 ммоль) в эфире (40 мл) вместе с кристаллом иода для инициирования реакции. Затем добавляли по каплям оставшийся раствор, и смесь нагревали с обратным холодильником до полного растворения магниевых стружек. После охлаждения добавили одной порцией раствор 4-метоксибензонитрила (10 г, 75,1 ммоль), высушенного в вакууме над Р2О5).
Смесь нагревали в течение 2 ч (ТСХ, отсутствие исходных реагентов), охладили (ледяная баня) и медленно обработали холодной водой (130 мл), затем разбавленной Н2SO4 (1:1 об./об. 25 мл). Разложение комплекса завершают нагреванием смеси с обратным холодильником в течение 4 ч (контроль методом ТСХ, 8: 2 эфир-этилацетат). Затем продолжают перемешивание в течение ночи при комнатной температуре, слой отделяют и экстрагируют эфиром (3х). Экстракты промывают 5% -ным раствором NaHCO3, сушат над безводным сульфатом магния и упаривают до сухости. Неочищенный продукт (янтарного цвета масло, 13,93 г) очищают методом флеш-хроматографии (силикагель марки Merck 60, элюирование 8:2 петролейный эфир-этилацетат), в результате получают соединение, название которого дано в заголовке, в виде масла светло-желтого цвета (12,5 г, 73,5% выход).
ЯМР (CDCl3, 400 МГц): δ 2,4 (с, 3Н, СН3), 3,9 (с, 3Н, ОСН3), 6,96 (д, J 8,8 Гц, 2Н, ArH), 7,38 (м, 2Н, ArH), 7,53 (д, J 6,9 Гц, АrH), 7,57 (с, 1Н, ArH), 7,82 (д, J 8,7 Гц, 2Н, ArH).
МС (ЭИ, м(з): 226(М)+, 135 (ушир.пик), 91.
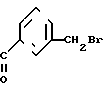
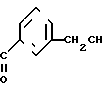
В. 3-Бромометил-[4'-метокси]бензофенон.
Раствор бензофенона (17,5 г, 77,4 ммоль) стадии А в этиленбромиде (26,5 мл), содержащем небольшое количество перекиси бензоила, нагревают с обратным холодильником. По каплям в течение 30 мин в процессе облучения смеси фотолампой 300 Вт к нему добавляют раствор брома (12,7 г, 79,6 ммоль) в этиленбромиде (15 мл). Нагревание с обратным холодильником продолжают в течение 17 ч (ТСХ, 9:1, петролейный эфир-этилацетат, следы исходного материала еще присутствуют). Растворитель отгоняют в вакууме, и остаток (масло коричневого цвета), очищают методом флеш-хроматографии (силикагель марки Merck 60, предварительно адсорбированный в дихлорметане, элюирование 9:1 петролейный эфир этилацетат), в результате получили непрореагировавший исходный материал (2,59 г, примерно 15%) и требуемый продукт (14,36 г, 61% или 71,5% исходя из выделенного непрореагировавшего исходного материала), а также некоторое количество смешанных фракций (примерно 5,20 г). Твердый продукт желтого цвета плавится при 58-61оС, и используется этот материал без дальнейшей обработки в следующей стадии.
ЯМР (CDCl3, 400 МГц): δ 3,88 (с, 3Н, ОСН3), 4,52 (с, 2Н, СН2Br), 6,96 (д, J 8,8 Гц, 2Н, ArH), 7,44 (т, J 7,6 Гц, 1Н, ArH), 7,58 (д, J 7,8 Гц, 1Н, ArH), 7,66 (д, J 7,6 Гц, 1Н, ArH), 7,76 (с, 1Н, ArH), 7,81 (д, J 8,8 Гц, 1Н, ArH), МС (ЭИ, м(з): 306/304/1 бром, М+ 225, 135 (ушир.пик).
Следы бромопроизводного при 386/384/382.
С. 3-Цианометил-[4'-метокси]бензофенон.
Бромпроизводное (14 г, 45,9 ммоль) на стадии В растворили в диоксане (30 мл) и добавили раствор NaCN (7 г) в воде (28,5 ил). Смесь нагревали с обратным холодильником в течение 6 ч (ТСХ, петролейный эфир-этилацетат 8:2), затем пропустили через активированный уголь, если в этом была необходимость, и проэкстрагировали эфиром (3х). Экстракты высушили над безводным сульфатом магния и упарили до сухости, в результате получили масло коричневого цвета (13,44 г). Неочищенный продукт очистили методом флеш-хроматографии (силикагель марки Merck 60, предварительно адсорбированный в дихлорметане) элюирование 6: 4 гексан-этилацетат), в результате получили чистый продукт (10,69 г, 92% выход), в виде светло-желтого масла, которое отверждается при стоянии. Практически бесцветный твердый продукт плавится при 70-71оС.
ЯМР (CDCl3, 400 МГц): δ 3,80 (с, 2Н, СН2CN), 3,87 (с, 3Н, ОСН3), 6,95 (д, J 8,6 Гц, ArH), 7,48 (т, J 7,7 Гц, 1Н, ArH), 7,54 (д, J 7,6 Гц, 1Н, ArH), 7,68 (с+д, J 7,6 Гц, 2Н, ArH), 7,79 (д, J 8,6 Гц, 2Н, ArH).
МС (ЭИ, м(з): 251 (М)+, 135 (ушир.пик).
D. 3-[4-Метоксибензоил]-фенилуксусная кислота.
Нитрил (4 г, 15,9 ммоль) стадии С растворили в 40%-ном растворе NaOH (40 мл), и раствор нагревали с обратным холодильником в токе азота в течение 7 ч (ТСХ, толуол-метанол 9: 1). В процессе охлаждения на ледяной бане добавили воду. Раствор промыли этилацетатом и затем подкислили на холоду концентрированной HCl до рН 2. Кислоту проэкстрагировали этилацетатом (3х), и экстракты высушили над безводным сульфатом магния, а затем упарили до сухости, получив неочищенный продукт (твердое вещество желтого цвета, 3,56 г, выход 82%), т.пл. 138-140оС.
ЯМР (CDCl3, 400 МГц): δ 3,72 (с, 2Н, СН2СОО), 3,88 (с, 3Н, ОСН3), 6,95 д, J 8,8 Гц, 2Н, ArH), 7,43 (т, 1Н, ArH), 7,48 (д, 1Н, ArH), 7,65 д, 1Н, ArH), 7,68 (с, 1Н, ArH), 7,81 (д, J 8,6 Гц, 2Н, ArH).
МС (ЭИ, м(з): 270 (М)+, 211 (М-СН2СООН)+, 135 (ушир.пик), 107.
Е. 3-[4-Гидроксибензоил]фенилуксусная кислота.
Однородную смесь кислоты (8,1 г, 0,030 ммоль) стадии D и пиридина (13,87 г, 0,120 ммоль) перемешивали в токе азота при нагревании на масляной бане при 200-210оС в течение 7 ч (ТСХ, толуол-метанол 9:1, дихлорметан-метанол 9: 1). После охлаждения смесь растворили в дихлорметане. Раствор проэкстрагировали 1н. раствором NaOH, экстракт подкислили на холоду концентрированной HCl и проэкстрагировали этилацетатом (3х). После высушивания над безводным сульфатом магния растворитель удалили и получили в результате неочищенное соединение, название которого дано в заголовке, в виде коричневато-желтоватого твердого вещества (7,61 г, количественный выход), т.пл. 147-149оС.
ЯМР (DMCO-d6, 400 МГц): δ 3,67 (с, 2Н, СН2СОО), 6,88 (д, J 8,84 Гц, 2Н, ArH), примерно 7,5 (м, 4Н, ArH), 7,65 (д, J 8,8 Гц, 2Н, ArH), 10,4 (с, 1Н, ОН), пр. 12,3 (с, 1Н, СООН).
МС (м(з): 257 (М+Н)+, 217, 131, 91 (ушир.пик).
F. 3-[4-Гидроксибензоил]фенилуксусной кислоты метиловый эфир.
Смесь кислоты (8,56 г, 33,4 ммоль) стадии Е и моногидрата паратолуолсульфокислоты (1,05 г, 5,6 ммоль) в метаноле (70 мл) нагревали в течение 2,5 ч с обратным холодильником (ТСХ, метанол-толуол 1:9). Метанол упарили, и остаток растворили в этилацетате и промыли рассолом. После высушивания над безводным сульфатом магния растворитель удалили, получив коричневато-рыжеватый твердый продукт 8,68 г, 96,2% выход), т.пл. 111-113оС. Этот неочищенный продукт был использован в следующей стадии.
ЯМР (CDCl3, 400 МГц): δ 3,69 (с, 2Н, СН2СОО), 3,69 (с, 3Н, СООСН3), 6,86 (д, J 8,4 Гц, 2Н, ArH), 7,41 (т, 1Н, J 7,58 Гц, 1Н, ArH), 7,47 (д, J 7,56 Гц, 1Н, ArH), 7,62 д, J 7,4, 1Н, ArH), 7,64 (с, 1Н, ArH), 7,74 (д, 2Н, J 8,4 Гц, ArH).
МС (м (з)271 ( М+ H) +,217,131,91 (ушир.пик).
G. 3-[4-(2-Хинолинилметокси)бензоил] бензолуксусной кислоты метиловый эфир.
Смесь фенола (4 г, 14,8 ммоль), стадии F, порошкообразного безводного К2СО3 (2,05 г, 14,8 ммоль) и 18-краун-6 (0,4 г, 1,48 ммоль) в ацетонитриле (35 мл) перемешивали при комнатной температуре в атмосфере азота в течение 15 мин. Затем одной порцией добавили 2-хлорметилхинолин (2,9 г, 16,28 ммоль, свежеприготовленный из его хлористоводородной соли), и смесь нагревали на масляной бане, поддерживая температуру при 65-70оС в течение 8 ч (ТСХ, толуол-метанол 9:1). Добавили 10% избыток К2СО3, краун-эфира и хлорметилхинолина и нагревание продолжили еще в течение 8 ч. Ацетонитрил отогнали, а остаток разделили между водой и этилацетатом. Органический слой высушили над безводным сульфатом магния и упарили, в результате получили коричневато-желтоватый продукт твердый (6,57 г). Сырой продукт очистили методом флеш-хроматографии (силикагель) марки Merck 60, предварительно адсорбированный в дихлорометане, элюирование-петролейный эфир этилацетат 7:3), и получили названное соединение в виде светло-желтого твердого вещества (5,03 г, выход 82,7%), т.пл. 93-95оС.
ЯМР (CDCl3, 400 МГц): δ 3,67 (с, 5Н, СН2СОО+ОСН3), 5,45 (с, 2Н, ArCH2O), 7,08 (д, J 8,8 Гц, 2Н, ArH), 7,40 (т, J 7,8 Гц, 1Н, ArH), 7,46 (д, J 7,7 Гц, 1Н, ArH), 7,55 (т, J 7,3 Гц, 1Н, ArH), 7,6-7,7 (м, 3Н, ArH), 7,7-7,82 (м, 4Н, ArH), 8,07 (д, 1Н, ArH), 8,20 (д, J 8,4 Гц, 1Н, ArH).
МС (ЭИ, м(з): 411 (М)+, 142, 121 (ушир.пик).
Н. 3-[4-(2-Хинолинилметокси(бензоил]бензол уксусная кислота.
К раствору эфира (5 г, 12,16 ммоль) стадии G в сухом тетрагидрофуране (66 мл) добавили 1М LiOH (37 мл, 37 ммоль), и смесь перемешивали в атмосфере азота при комнатной температуре в течение 2,5 ч (ТСХ, толуол-метиловый спирт 9: 1). Тетрагидрофуран упарили и остаток разбавили водой, подкислили до рН 6,5 10% -ной уксусной кислотой и проэкстрагировали этилацетатом (3х). Экстракты промыли рассолом, высушили над безводным сульфатом магния и упарили до сухости. Неочищенный продукт (4,94 г, бледно-желтого цвета) перекристаллизовали из этилацетата и получили 3,65 г (75% выход) чистого названного вещества (белое твердое вещество, т.пл. 146-147оС).
ЯМР (DMCO-d6, 400 МГц): 3,68 (с, 2Н, СН2СОО), 5,48 (с, 2Н, ArCH2O), 7,22 (д, 2Н, 8,8 Гц, ArH), 7,47 (м, 1Н, ArH), 7,53 (м, 2Н, ArH), 7,62 (м, 2Н, ArH), 7,69 (д, J 8,4 Гц, 1Н, ArH), 7,74-7,82 (м, 3Н, ArH), 8,2 (м, 2Н,г ArH), 8,43 (д, J 8,5 Гц, 1Н, ArH), 12,39 (1Н, СООН).
МС (ЭИ, м(з): 397, (М)+, 380г (М-ОН)+, 142.
Анализ для С25Н19NO4.
Рассчитано, С 75,57; Н 4,78; N 3,53.
Найдено, С 75,22; Н 4,76; N 3,39.
П р и м е р 4. 3-[4-2-Нафталинилметокси(бензоил]бензол уксусная кислота
А. 3-[4-(2-Нафталинилметокси(бензоил] бензол уксусной кислоты метиловый эфир.
Смесь фенола (1 г, 3,7 ммоль) примера 3 F, порошкообразного безводного К2СО3 (0,48 г, 3,7 ммоль), 18-краун-6 эфира (0,098 г, 0,37 ммоль) и ацетонитрила (10 мл) перемешивали в атмосфере азота в течение 15 мин. К смеси добавили 2-бромометилнафталин (0,496 г, 4,07 ммоль) поместили на масляную баню и нагревали в течение 10 ч, поддерживая температуру при 65-70оС (ТСХ, дихлорметан-этилацетат 8:2). Добавили 10% избыток К2СО3, краун-эфира и бромометилнафталина, и нагревание продолжили еще 4 ч. Ацетонитрил отогнали, а остаток растворили в воде и проэкстрагировали этилацетатом (3х). Экстракты промыли 1М NaOH и рассолом, высушили над безводным сульфатом магния и упарили до сухости. Неочищенный продукт (1,49 г, воскообразное твердое вещество) использовали без дальнейшей обработки в следующей стадии.
ЯМР (CDCl3, 400 МГц): δ 3,7 (с, 5Н, ОСН3 + СН2СОО), 5,32 (с, 2Н, А СН2О), 7,08 (д, J 8,7 Гц, 2Н, ArH), 7,4-7,56 (м, 5Н, ArH), 7,63-7,68 (м, 2Н, ArH), 7,82-7,92 (м, 6Н, ArH). МС (м(з): 410 (М)+, 141 (ушир.пик).
В. 3-[4-(2-Нафталинилметокси)бензоил]бензол уксусная кислота.
Раствор эфира (1,29 г, 3,15 ммоль) стадии А обработали, добавляя по каплям 1М раствор LiOH, и смесь перемешивали в атмосфере азота в течение ночи. Растворитель упарили, а остаток растворили в воде, докислили на холоду 10% уксусной кислотой до рН 3 и проэкстрагировали этилацетатом (3х). Экстракты высушивали над безводным сульфатом магния и упарили до сухости. Остаток (1,24 г, количественный выход) перекристаллизовали путем растворения в относительно большом количестве) объеме теплого раствора этилацетат-дихлорметана, вслед за тем сконцентрировали до половины исходного объема. Осадок собрали и высушили в вакууме при 45оС (0,610 г, 48,8 выход), т.пл. 150-152оС.
ЯМР (DNCO-d6, 400 МГц): 3,70 (с, 2Н, СН2СОО), 5,40 (с, 2Н, А СН2), 7,20 (д, 2Н, ArH), 7,45-7,60 (м, 7Н, ArH), 7,75 (д, 2Н, ArH), 7,95 (м, 3Н, ArH), 8,02 (с, 1Н, ArH), 12,47 (уш.с. 1Н, СООН).
МС (+ ПАВ, м(з): 397 (М+Н)+, 217, 141.
Анализ для С26Н20О4
Рассчитано, С 78,78; Н 5,09.
Найдено, С 78,12; Н 5,13.
П р и м е р 5. 5-Фенил-4-[4-(2-хинолинилметокси)фенил]-2-оксазол пропановая кислота.
А. 4-Метоксибензоин.
К раствору KCN (5 г) в воде (35 мл) добавили 4-метоксибензальдегид (27,2 г, 0,2 моль), бензальдегид (21,2 г, 0,2 моль) и 95% этанол (70 мл). Смесь нагревали с обратным холодильником в атмосфере азота в течение 4,5 ч, а затем отогнали в вакууме этиловый спирт. Добавили 200 мл воды к остатку и затем отогнали при пониженном давлении (для удаления непрореагировавшего бензальдегида). Процедуру повторили дважды, и остаточную воду перевили в азеотропную смесь с этиловым спиртом. Неочищенный продукт (56,3 г, полутвердый продукт оранжевого цвета) очистили методом флеш-хроматографии (силикагель марки Merck 60, предварительно адсорбированный в дихлорметан-этилацетате, элюирование гексан-этилацетат 8:2). в результате получили твердое вещество светло-желтого цвета (20,1 г, 41,5%), т.пл. 99-101оС.
ЯМР (CDCl3, 400 МГц): δ 3,82 (с, 3Н, ОСH3), 4,62 (уш.с. 1Н, ОН), 5,88 (с, 1Н, СНOH), 6,86 (д, 2Н, J 8,94 Гц, ArH), 7,22-7,38 (м, 5Н, ArH), 7,91 (д, 2Н, J 8,94 Гц, ArH), МС (ЭИ, м(з): 243 ( М+Н)+, 225, 197, 137 (М-PhCO)+.
В. 4-Метоксибензоин полусукцинат.
Смесь 4-метоксибензоина (20 г, 0,083 моль) и янтарного ангидрида (9,1 г, 0,091 моль) в толуоле (6 мл) нагревали в течение 7 ч в атмосфере азота при 135оС (наружная температура). Раствор вылили в 0,5 н. раствор NaHCO3, органический слой отделили и вновь проэкстрагировали 0,5 М NaHCO3. Объединенные экстракты промыли эфиром и затем подкислили на холоду концентрированной соляной кислотой. Выделившееся масло проэкстрагировали этилацетатом (3х), экстракты промыли водой и высушили над безводным сульфатом магния. Удалили избыток растворителя и получили твердое вещество желтого цвета (20,89 г, 73,8% выход), т.пл. 104-108оС. Этот продукт использовали в следующей стадии без дальнейшей очистки.
ЯМР (CDCl3, 400 МГц): δ 2,72-2,82 (мм, 4Н, СН2СН2СОО, 3,82 (с, 3Н, ОСН3), 6,86 (д, 2Н, J 9,1 Гц, ArH), 7,34-7,46 (м, 5Н, ArH), 7,92 (д, 2Н, J 9,1 Гц, ArH).
МС (ЭИ), м(з): 342 (М)+, 135 (ушир,пик).
С. 4-(4-Метоксифенил)-5-фенил-2-оксазол-пропановая кислота.
Смесь неочищенного 4-метоксибензоин полусукцината (20,8 г, 0,061 моль) стадии В, мочевины (8,7 г, 0,146 моль) и уксусной кислоты (60 мл) нагревали с обратным холодильником в атмосфере азота в течение 5,5 ч. Смесь охладили и вылили в ледяную воду. Выделившееся масло проэкстрагировали этилацетатом (3х). Экстракты промыли водой до нейтральности и затем проэкстрагировали насыщенным раствором карбоната натрия. Объединенные водные экстракты осторожно подкислили на холоду концентрированной хлористоводородной кислотой HCl и проэкстрагировали этилацетатом. Органический экстракт высушили над безводным сульфатом магния и упарили до сухости, в результате получили воскообразное маслянистое вещество желтого цвета (19,6 г). Полученный остаток очистили методом флеш-хроматографии (силикагель марки Merck 60, элюэнт дихлорметан-этилацетат 8:2), результат твердое вещество бледно-желтого цвета (14,3 г, 72,7% выход), т.пл. 100-101оС.
ЯМР (CDCl3, 400 МГц): δ 2,96 (т, 2Н, СН2С), 3,20 (т, 2Н, СН2СОО), 3,83 (с, 3Н, ОСН3), 6,90 (д, 2Н, ArH), 7,28-7,38 (м, 3Н, ArH), 7,54-7,62 (м, 4Н, ArH).
МС (ЭИ, м(з): 323 (М)+, 278 ( М-СООH)+, 152, 77.
D. 4-(4-Гидроксифенил)-5-фенил-2-оксазол-пропановая кислота.
К раствору метоксиуксусной кислоты (5,6 г, 17,3 ммоль) стадии С в уксусной кислоте (55 мл) добавили 48% раствор HBr (84 мл), и смесь нагревали с обратным холодильником в атмосфере азота в течение 8 ч (ТСХ, 1:1 гексан-этилацетат). После охлаждения добавили воду, и раствор проэкстрагировали этилацетатом (3х). Экстракт высушили над безводным сульфатом магния и упарили до сухости. Остаток (коричневое воскообразное масло, 5,25 г, 99% выход) использовали в следующей стадии без дальнейшей очистки. Для аналитических целей небольшой образец подвергли флеш-хроматографированию (силикагель марки Merck 60, элюент: дихлорметан-метанол 98-2 и 95:5).
ЯМР (DMCO-d6, 400 МГц): δ 2,75 (т, 2Н, J 7,14 Гц, СН2С), 3,02 (т, 2Н, J 7,1 Гц, СН2СОО), 6,77 (д, 2Н, J 8,7 Гц, ArH), 7,35 (д, 2Н, J 8,55 Гц, ArH), 7,41 (т, 3Н, J 7,12 Гц, ArH), 7,50 (д, 2Н, J 7 Гц, ArH), 9,64 (уширенный синглет, обменное взаимодействие).
МС (ЭИ, м(з): 300(М)+, 264 (М-СООН)+, 121, 105, 77.
Е. 5-Фенил-4-[4-гидроксифенил] -2-оксазол-пропановой кислоты метиловый эфир.
Раствор неочищенной кислоты (5 г, 16,18 ммоль) стадии D в метаноле (40 мл), содержащий небольшое количество пара-толуолсульфокислоты моногидрата (0,58 г) нагревали с обратным холодильником в течение 2,5 ч. Метанол отогнали, и остаток разделили между двумя фазами-этилацетатом и 20%-ным раствором NaCl. Экстракты промыли, высушили над безводным сульфатом магния и упарили, получив густое масло (примерно 4,8 г). Полученный остаток очистили методом флеш-хроматографии (силикагель марки Merck 60, предварительно адсорбированный в дихлорметане, элюировали раствором дихлорметан-этилацетат в градиенте от 90:10 до 75:25), в результате получили белое твердое вещество (3,56 г, 68% выход) т.пл. 115-116оС.
ЯМР (CDCl3, 400 МГц): δ 2,92 (т, 2Н, J 7,4 Гц, СН2С), 3,20 (т, 2Н, J 7,4 Гц, СН2СОО), 3,71 (с, 3Н, ОСН3), 6,74 (д, 2Н, J 8,59 Гц, ArH), 7,26-7,36 (м, 3Н, ArH), 7,40 (д, 2Н, J 8,7 Гц, ArH), 7,54 (д, 2Н, J 7,56 Гц, ArH).
МС (ЭИ, м(з): 323 (М)+, 264 (М-СООСН3)+, 105, 77 (ушир.пик).
F. 5-Фенил-4-[4-(2-хинолинилметокси)фенил]-2-оксазол пропановой кислоты метиловый эфир.
Смесь эфира (2,46 г, 7,61 ммоль) стадии F, порошкообразного безводного карбоната калия (1,05 г, 7,60 ммоль), 18-краун-6 эфира (0,223 г, 0,843 ммоль) и ацетонитрила (33 мл) перемешивали при комнатной температуре в атмосфере азота в течение 15 мин 2-хлорметалихинолин (свободное основание, свежеприготовленное из хлористоводородной соли, 1,35 г, 7,60 ммоль) добавили к смеси, поместили ее на масляную баню и нагревали в течение 10 ч при 65оС (примечание через 6 ч добавили 10% избыток хлорметилхинолина, 18-краун-6-эфира и К2СО3). Растворитель удалили, а остаток распределили между двумя фазами этилацетатом и водой. Экстракты промыли рассолом, высушили над безводным сульфатом магния и упарили, получив твердое вещество желтого цвета. Сырой продукт очистили методом флеш-хроматографии (силикагель марки Merck 60, элюент: толуол и затем толуол-метанол 97:5:2,5), и получили соединение, название которого дано в заголовке (3,5 г, выход количественный).
ЯМР (CDCl3, 400 МГц): δ 2,90 (т, 2Н, J примерно 7,2 Гц, СН2С), 3,16 (т 2Н, J 7,2 Гц, СН2СОО), 3,72 (с, 3Н, ОСН3), 5,41 (с. 2Н, ArCH2O), 7,02 (д, 2Н, J 8,8 Гц, ArH), 7,29-7,36 (м, примерно 4Н, ArH), 7,54-7,84 (м, примерно 6Н, ArH), 7,83 (д, 1Н, J 8,1 Гц, ArH), 8,08 (т, 1Н, J 8,5 Гц, ArH), 8,19 (д, 1Н, J 8,5 Гц, ArH).
МС (+ПАБ, м(з): 487 (М+а)+, 465 (М+Н)+.
G. 5-Фенил-4-[4-(2-хинолинилметоксифенил]-2-оксазол пропановая кислота
Раствор эфира (3,4 г, 7,32 ммоль) стадии F в сухом тетрагидрофуране (37 мл) обработали, по каплям добавляя 1М раствор LiOH (21,98 мл 3 экв.) в атмосфере азота, и затем перемешивали при комнатной температуре в течение 3 ч (ТСХ, дихлорметанол 97:3 или толуолметанол 95:5). Растворитель упарили, остаток растворили в воде, нейтрализовали на холоду 10% раствором уксусной кислоты до рН 5 и проэкстрагировали этилацетатом. Экстракты промыли рассолом, высушили над безводным сульфатом магния и упарили, получили в результате твердый продукт бледно-желтого цвета (3,18 г, количественный выход). Неочищенный продукт перекристаллизовывали из теплого этилацетата (содержащего дихлорметан в количестве достаточном для того, чтобы получить прозрачный раствор), получив первую партию кристаллов (2,63 г, т.пл.) 192-194оС, разл. ). Вторую партию выделили, сконцентрировав маточный раствор (0,327 г, т. пл. 192-193оС, разл. ). Суммарный выход составил 85,8% ИСК (KBr, см-1): 1720 (СО).
ЯМР (DMCO-d6, 400 МГц): δ 2,76 (т, 2Н, J 7 Гц, СН2С), 3,03 (т, 2Н, J 7 Гц, СН2СОО), 5,38 (с, 2Н, ArCH2O), 7,11 (д, 2Н, J 8,8 Гц, ArH), 7,36-7,56 (м, 7Н, ArH), 7,61 (т, 1Н, ArH), 7,69 (д, 1Н, J 8,5 Гц, ArH), 7,78 (т, 1Н, ArH), 8,00 (т, J 7,9 Гц, 2Н, ArH), 8,42 (д, 1Н, J 8,5 Гц, ArH).
МС (ЭИ или C/I, м(з): 451 (М+Н)+, 310 (ушир.пик).
Анализ для С28Н22N2O4
Рассчитано, С 74,65; Н 4,92; N 6,22.
Найдено, С 74,20; Н 4,86; N 6,00.
П р и м е р 6. 4-[4-[2-Нафталинилметокси]фенил]-5-фенил-2-оксазол пропановая кислота.
А. 4-[4-(2-Нафталенилметокси]фенил]-5-фенил-2-оксазол пропановой кислоты метиловый эфир.
Смесь гидроксиэфира (1,5 г, 4,6 ммоль) примера 5Е, порошкообразного безводного карбоната калия (0,636 г, 4,6 ммоль), 18-краун-6 эфира (0,123 г, 0,46 ммоль) и ацетонитрила (18 мл) перемешивали при комнатной температуре в атмосфере азота в течение 15 мин. Добавили 2-бромометилнафталин (1,13 г, 5,1 ммоль), и смесь поместили на масляную баню и нагревали при 70оС в течение 8-9 ч (ТСХ, гексан-этилацетат 9:1 или дихлорметан-метанол 9:1). Растворитель упарили, и остаток растворили в воде, проэкстрагировали затем этилацетатом. Экстракты промыли и высушили над безводным сульфатом магния. После удаления растворителя получили коричневато-желтоватое вещество твердое (2,17 г, количественный выход). Образец перекристаллизовали из метанола (содержащего дихлорметан в количестве достаточном для получения прозрачного раствора), сконцентрировав до небольшого объема и охладив на ледяной бане. Белый твердый продукт собрали и сушили в течение ночи в условиях вакуума, т.пл. 134-135оС.
ИКС (KBr, см-1): 1740 (СО)
ЯМР (CDCl3, 400 МГц): δ 2,89 (т, 2Н, J 7,5 Гц, СН2С), 3,16 (т, 2Н, J 7,5 Гц, СН2СОО), 3,71 (с, 3Н, ОСН3), 5,2 (с, 2Н, А СН2О), 7,00 (д, J 8,6 Гц, ArH), 7,25-7,35 (м, 3Н, ArH), 7,46-7,58 (м, 7Н, ArH), 7,8-7,9 (м, 4Н, ArH).
МС (CI, м(з): 464 (М+Н)+, 324.
Анализ для С30Н25NO4
Рассчитано, С 77,73; Н 5,44; N 3,02.
Найдено, С 77,44; Н 5,36; N 3,03.
В. 4-[4-(2-Нафталинилметокси)фенил]-5-фенил-2-оксазол пропановая кислота.
Раствор эфира (1,49 г, 3,21 ммоль) стадии А в сухом тетрагидрофуране (18 мл), содержащий 1М LiOH (9,6 мл) перемешивали при комнатной температуре в атмосфере азота в течение ночи (ТСХ, 75:25 гексанэтилацетат). Растворитель упарили, остаток растворили в воде и подкислили до рН 5 разбавленной HCl. Смесь проэкстрагировали этилацетатом, экстракты высушили над безводным сульфатом магния и упарили, получив 1,39 г, т.пл. 145-150оС. Для очистки полученного продукта его растворили в горячем этилацетате (содержащем дихлометан в количестве достаточном для получения прозрачного раствора), сконцентрировали полученный раствор до половины исходного объема и осадили эфиром. Твердое вещество белого цвета плавится при 151-152оС (1,07 г, 58%).
ИКС (KBr, см-1): 1720 (СО)
ЯМР (DMCO-d6), 400 МГц): δ 2,78 (т, 2Н, СH2С), 3,03 (т, 2Н, J 7 Гц, СН2СОО), 5,29 (с, 2Н, ArCH2COO), 7,10 (д, 2Н, J 8,9 Гц, ArH), 7,34-7,60 (м, 10Н, ArH), 7,90-8,00 (м, 4Н, ArH), 12,28 (с, 1Н, СООН).
Анализ для С29Н23NO4.
Рассчитано, С 77,48; Н 5,15; N 3,11.
Найдено, С 76,40; Н 5,16; N 3,04.
П р и м е р 7. 4-[4-(1-Метил-1 Н-бензимидазол-2-ил)метокси]фенил]-5-фенил-2- оксазол пропановая кислота.
А. 4-[4-(1-Метил-1 Н-бензимидазол-2-ил)метокси]фенил]-5-2-оксазол пропановой кислоты метиловый эфир.
Смесь эфира (0,5 г, 1,55 ммоль) примера 5Е, порошкообразного безводного карбоната калия (0,214 г, 1,55 ммоль), 18-краун-6-эфира (0,041 г, 0,155 ммоль) и ацетонитрила (6 мл) перемешивали в атмосфере азота при комнатной температуре в течение 15 мин. Затем добавили 2-хлорметил-1-метилбензимидазол (0,307 г, 1,7 ммоль), и смесь поместили на масляную баню и нагревали при 65-70оС в течение 4 ч (ТСХ, дихлорметан-этилацетат 9:1, проявление иодом). В этой точке добавили 10% избыток К2СО3, 2-хлорметил-1-метилбензимидазола и 18-краун-6 и продолжали нагревание еще в течение 10 ч. Растворитель затем упарили, остаток растворили в воде и проэкстрагировали этилацетатом. Экстракты промыли, высушили над безводным сульфатом магния и упарили до сухости. Остаток (1,64 г) очистили методом флеш-хроматографии (силикагель марки Merck 60, предварительно адсорбированный в дихлорметане, содержащем небольшое количество метанола, проэлюировали смесью дихлорметан-этилацетат 8:2), получили в результате 1,03 г (71,2% выход) светло-желтого твердого продукта, т. пл. 142-144оС.
ЯМР (CDCl3, 400 МГц): δ 2,87 (т, 2Н, J 7,1 Гц, СН2С), 3,16 (т, 2Н, J 7,8 Гц, СН2СОО), 3,72 (с, 3Н, СООСH3), 3,90 (с, 3Н, NСН3), 5,41 (с, 2Н, ArCH2COO), 7,07 (д, 2Н, J 8,8 Гц, ArH), 7,25-7,40 (м, 7Н, ArH), 7,5-7,6 (м, 3Н, ArH), 7,78 (д, 1Н, ArH).
МС (+СI, м(з): 468 (М+Н)+, 324, 293, 147.
В. 4-[4-[(1-Метил-1Н-бензимидазол-2-ил(метокси] -5-фенил-2-оксазол пропановая кислота
Раствоp эфира (1 г, 2,14 ммоль) стадии А в тетрагидрофуране (13 мл), содержащий 1М LiOH (6,42 мл) перемешивали в атмосфере азота при комнатной температуре в течение 1 ч (ТСХ, дихлорметан-этанол 9:1). Растворитель упарили, добавили воду и рН раствора довели до значения 6,5 добавлением 10%-ной уксусной кислоты. Собрали светло-желтый осадок, промыли водой и высушили в вакууме. Затем вновь растворили в горячем этилацетате, содержащем метанол, в количестве, достаточном для получения прозрачного раствора), сконцентрировали до небольшого объема и охладили на ледяной бане, выделившиеся кристаллы собрали и высушили (0,642 г, выход 66,2% т.пл. 222-224оС).
ЯМР (DMCO-d6, 400 Мгц): δ 2,76 (т, 2Н, J 7 Гц, СH2С), 3,03 (т, 2Н, J 7 Гц, СH2СОО), 3,86 (с, 3Н, NCH3), 5,43 (с, 2Н, ArCH2O), 7,14-7,66 (м, 13Н, ArH).
МС (CI, м(з): 454 (М+Н)+, 147 (ушир.пик).
Анализ для С27Н23N3O4
Рассчитано, С 71,51; Н 5,11; N 9,27.
Найдено, С 71,62; Н 5,17; N 9,40.
П р и м е р 8. 2-Фтор-4'-(2-хинолинилметокси[1,1'-бифенил]-4-уксусная кислота, 2-амино-2-гидроксиметил-1,3-пропандиол.
Раствор соединения из примера 2 (3,17 г, 8,2 ммоль) и 2-амино-2-гидроксиметил-1,3-пропандиола [TRIS, 0,99 г, 8,2 ммоль] в 60 мл метанола концентрируют до сиропа. Затем разбавляют этилацетатом (250 мл) и кристаллический осадок собирают и высушивают до получения 3,18 г искомой соли. Продукт измельчают на микронной коллоидной мельнице до получения тонкого белого порошка, температура плавления 168-169оС (выход 77,5%).
Анализ на С28Н29FN2O6.
Рассчитано, С 66,13; Н 5,75; N 5,51.
Найдено, С 65,75; Н 5,79; N 5,49.
П р и м е р 9. 5-Фенил-4-[4-хинолинилметокси)фенил]-2-оксазолпропионовая кислота, 2-амино-2-гидроксиметил-1,3-пропандиол.
В раствор соединения из примера 5 (0,359 г, 0,796 ммоль) в кипящем этаноле (35 мл) добавляют 2-амино-2-гидроксиметил-1,3-пропандиола [TRIS, 0,0965 г, 0,796 ммоль] в 0,5 мл воды. Спустя 2 ч смесь замораживают. Кристаллический осадок собирают и высушивают до получения 0,396 г искомой соли, температура плавления 170-171оС.
Анализ на С32Н33N3О7.
Рассчитано, С 67,00; Н 5,75; N 7,32;
Найдено, С 66,68; Н 5,77; N 7,31.
П р и м е р 10. 4'-(2-Бензотиазолилметокси)-4-дифенилуксусная кислота, этиловый эфир.
А. 4'-Гидрокси-4-дифенилуксусная кислота, этиловый эфир.
Раствор, содержащий 4'-гидрокси-4-дифенилуксусную кислоту (6,7, 28,0 ммоль); абсолютный этанол (300 мл) и концентрированную серную кислоту (5 мл) перегоняют с обратным холодильником в течение 2 ч. Затем реакционную смесь охлаждают до комнатной температуры, концентрируют под пониженным давлением, разбавляют водой (200 мл) и экстрагируют этилацетатом (200 мл, три раза). Комбинированный этилацетатный экстракт промывают 1н. гидроксида натрия (200 мл), водой (200 мл) и рассолом (200 мл), высушивают безводным сульфатом магния и концентрируют под пониженным давлением до получения 6,9 г неочищенного твердого вещества. Твердое вещество очищают хроматографией (силикагель; 30% этилацетат в гексане) до получения 6,7 г (95,0%) белого кристаллического продукта, температура плавления 125-127оС.
Анализ на С16Н16О3.
Рассчитано, С 74,98; Н 6,29.
Найдено, С 74,62; Н 6,2.
В. 4'-(2-Бензотиазолилметокси)-4-дифенилуксусная кислота, этиловый эфир.
Шлам, содержащий 4'-гидрокси-4-дифенилуксусную кислоту, этиловый эфир (6,7 г, 26,0 ммоль, часть А) и карбонат цезия (9,0 г, 28,0 ммоль) в диметилсульфоксиде (150 мл) перемешивают при комнатной температуре. Спустя 30 мин добавляют 2-(хлорметил)бензотиазол (4,2 г, 27,0 ммоль) и смесь перемешивают в течение 18 ч. Реакционную смесь выливают в ледяную воду (200 мл) и экстрагируют этилацетатом (300 мл, 3 раза). Комбинированный этилацетатный экстракт промывают последовательно 0,1н.гидроксидом натрия (200 мл), водой (200 мл) и рассолом (200 мл), высушивают безводным сульфатом магния и концентрируют под пониженным давлением до получения 8,0 г неочищенного твердого вещества.
Твердое вещество очищают хроматографией (силикагель; 30% этилацетат в гексане) до получения 4,0 г (39,2%) белого кристаллического продукта, температура плавления 133-134оС.
Анализ на С24Н21NO3S.
Рассчитано, С 71,44; Н 5,25; N 3,47.
Найдено, С 71,36, Н 5,25; N 3,35.
П р и м е р 11. 4'-(Бензотиазолилметокси)дифенилуксусная кислота этилового эфира (4,0 г, 10,0 ммоль), 1н. гидроксида натрия (15 мл, 15,0 ммоль), метанола (200 мл) и тетрагидрофурана (200 мл) нагревали с обратным холодильником в течение 18 ч. Затем реакционную смесь охлаждали, концентрировали под пониженным давлением, разбавляли водой (500 мл) и при перемешивании подкисляли 2н.соляной кислотой. После перемешивания в течение 2 ч продукт собирали фильтрацией, а после высушивания под вакуумом получали 3,8 г (99%) твердого вещества. Часть этого вещества (0,5 г) рекристаллизовывали из уксусной кислоты, температура плавления 208-209оС.
Анализ на С22Н17NO3S.
Рассчитано, С 70,38; Н 4,56; N 3,73.
Найдено, С 70,04; Н 4,56; N 3,72.
П р и м е р 12. Соединения 5- и 12-гидроксиэйкозатетраеновой кислоты.
(5-НЕТЕ и 12-НЕТЕ) и LTB4 это продукты окисления арахидоновой кислоты на начальную стадиях липоксигеназного цикла, которые, как было установлено, являются проводниками некоторых аспектов воспалительного и аллергического ответа реакции. Это в особенности справедливо для 5,12-диНЕТЕ, которое также обозначено как LTB4 (см. Fordand Hitchinson, J.Roy. Soc. Med. 74, 831, 1981). Соединения, которые ингибируют обуславливаемое фосфолипазой ФЛА2 выделение арахидоновой кислоты, при этом эффективно влияют на процесс предотвращения окисления арахидоновой кислоты в различные продукты типа лейкотриенов, осуществляющийся в липоксигеназном цикле. Соответственно специфичность действия ингибиторов ФЛА2 может быть определена по активности тестируемых соединений в таком анализе, который измеряет способность соединений ингибировать синтез LTB4 гликогенизвлеченными полиморфоядерными лейкоцитами (ПМЯ) в присутствии эксогенного субстрата.
Этот анализ проводят следующим образом.
Полиморфоядерные лейкоциты крыс (ПМЯ) получают из самок крыс линии Wistar (масса 150-200 г), которым была сделана инъекция 6%-ного раствора гликогена (10 мл внутрь брюшины). Крыс умерщвляли через 18-24 ч после инъекции путем асфиксии СО2, а выделенные из брюшины клетки орошали, используя физиологический раствор (0,9% -ный раствор NaCl). Эксудат центрифугировали, и осажденные клетки ресуспендировали до концентрации, составляющей 2,0 х 107 клеток/мл в HBSS, содержащем ионы Са++ и Mg++ и 10 мкМ L-цистеина.
К аликвотам объемом по 1 мл клеточной суспензии добавляли тестируемые лекарственные препараты или наполнитель, затем предварительно инкубировали при 37оС в течение 10 мин. После этого добавили А 23187 (1 мкМ), [3H]-АА (3,0 мкMCl (мл) и несвязанный АА (1 мкМ), и образцы инкубировали далее еще в течение 10 мин. Реакцию останавливают путем центрифугирования и осаждения клеток. Супернатантные слои затем анализируют методом ВЭЖХ, используя колонку размером 15 см х 4,6 мм с сорбентом SupelcosilLc/Supelco/ /3М/, и систему двух растворителей со скоростью потока 1,4 м суммарного потока.
Растворитель А: 70:30 17,4 мМ Н3РО4:СН3СN
Растворитель В: CH3CN
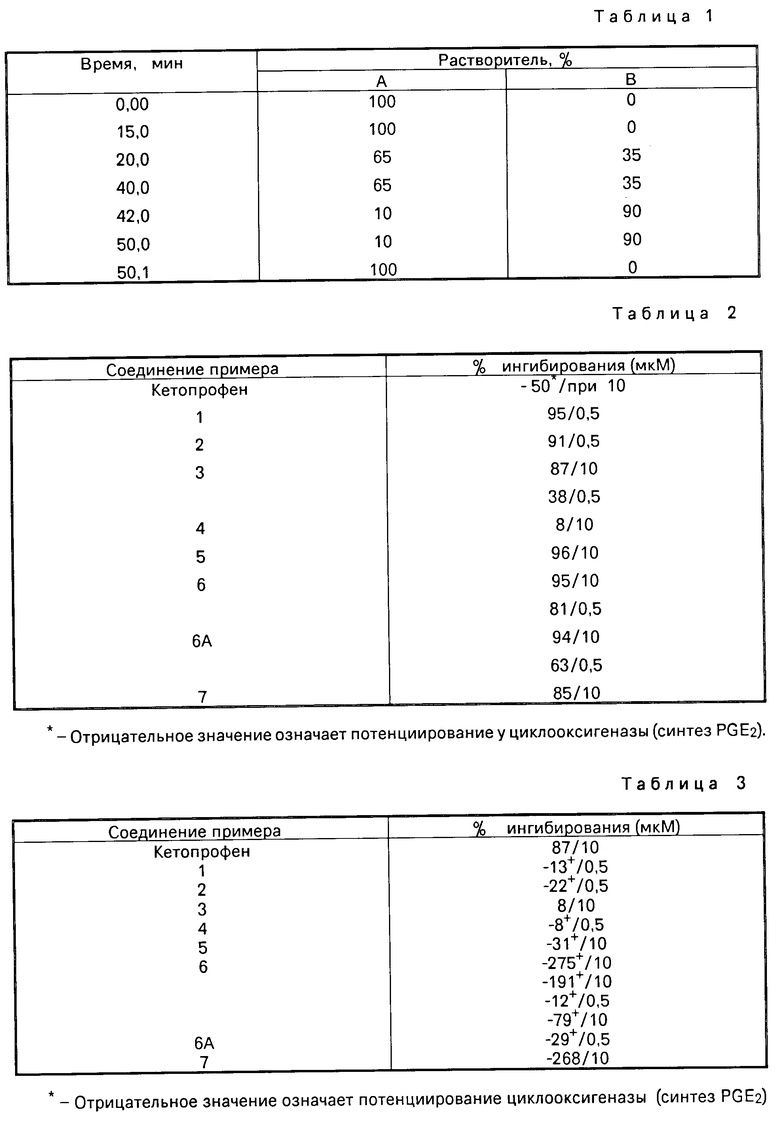
Градиент (систему уравновешивают растворителем А) (см. табл.1).
Изменения процентного содержания растворителя описывается линейной зависимостью
Инъекции: 140 л каждого супернатанта вводят непосредственно в колонку и продукты метаболизма 3Н-арахидоновой кислоты определяют, используя встроенный в систему детектор радиоактивности (Ramona, IN/US, Fairfield, NJ).
Стандартные растворы: 104 2,0 х 104 dpm (число распадов в минуту) эйкозаноидов, представляющих интерес, вводят в виде коктейля в 90 л этилового спирта.
Процент ингибирования определяли путем сравнительного хроматографирования сред стимулированных ПМЯ, обработанных лекарственным препаратом, и сред стимулированных клеток, не подвергавшихся лекарственной обработке. В качестве внутреннего стандарта использовали 3Н лейкотриен В4(LTB4).
Полученные результаты представлены либо как процент ингибирования данным соединением, либо как ИК50.
Тестируемые соединения изобретения в данном анализе показали следующие результаты (см. табл.2).
П р и м е р 13. Процедура примера 12 также используется для определения степени ингибирования соединениями изобретения синтеза арахидоновой кислоты продуктом циклооксигеназного окисления PGE2.
В этом анализе процедура примера 12 осуществляется как описано. Однако для определения циклооксигеназной активности образцы хроматографируют совместно с аутентичным (3Н)-PGE2.
Результаты, обработанные также, как в примере 8, представлены в табл.3.
П р и м е р 14. Соединения изобретения тестированных in vitro в опыте с изолированной фосфолипазой А2 для определения способности тестируемых соединений ингибировать выделение арахидоновой кислоты из субстрата, содержащего арахидоновую кислоту, под действием фермента фосфолипазы А2, источником которой может служить как человек, так и могут быть использованы другие источники.
Этот анализ проводился следующим образом. В полипропиленовую пробирку объемом 15 мл добавили компоненты, представленные в табл.4.
Инкубируют 100 мкл реакционной смеси в течение 10 мин при 37оС во встряхиваемой водяной бане. Реакцию завершают путем добавления 2 мл тетрагидрофурана с последующим энергичным перемешиванием. NH2 колонки (100 мг/мл Analytichem International) обрабатывают 0,5 мл тетрагидрофурана, а затем смесью 0,5 мл тетрагидрофурана и воды (2 мл 0,1 мл).
Образец загружают в колонку и медленно протягивают через нее. Гидролизованная арахидоновая кислота, оставшаяся в колонке, элюируется из колонки 1 мл смеси тетрагидрофурана и ледяной уксусной кислоты (2%). Арахидоновую кислоту переносят в сцинтилляционные ампулы и проводят количественное определение методом β -подсчета. Суммарный счет образца получают путем внесения пипеткой 25 мкл 3Н-арахидонатом меченой E.coli прямо в сцинтилляционную ампулу, в которую добавляют 1 мл тетрагидрофурана. Ко всем образцам добавляют по 10 мл аквасоля (сцинтилляционного коктейля).
Расчеты:
гидролиза 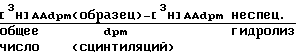
изменения 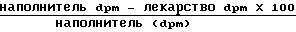
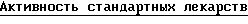 :
:
ИК50 /МК/
_________________________________
ФЛА2тромбоцитов ФЛА2 синовиальной
человека жидкости человека
_________________________________ Лекарство: Арахидоновая кислота 8/6 3/2
Моноалид 25/2 0/14
При тестировании в этом опыте предлагаемых соединений были получены результаты, данные в табл.5.
П р и м е р 15. Соединения изобретения оцениваются по их способности ингбировать липоксигеназный и/или циклооксигеназный путь метаболизма арахидоновой кислоты in vivo на мышах в опыте с перитонитом, вызываемым ферментативным распадом ткани. Этот опыт проводят следующим образом.
Самцы мышей линии СД (возраст 8 недель) помещают по шесть штук в пластмассовые коробки. Животным вводят по 1 мл внутрь брюшины либо 1%-ный раствор зимозаны в апирогенном 0,9% солевом растворе, либо солевого раствора (контрольный нестимулируемый вариант). Соединения изобретения дают животным перорально за 1 ч до инъекции зимозана. Через 20 мин после инъекции зимозана животных умерщвляют путем асфикции в атмосфере СО2. Затем в перитональную полость обрабатывают 2 мл охлажденного льдом сбалансированного солевого раствора Hauks (HBSS), не содержащего CaCl2, MgSO4 ˙7H2O, и MgCl2 ˙6H2O. Перитональную промывную жидкость от каждой мыши забирают шприцем и помещают в 5 мл изготовленные из пластмассы, пробирки для тестирования, находящиеся во льду и отмечают объем. Подготовку образцов для проведения оценки по методу ELISA, осуществляют следующим образом: образцы центрифугируют при 800q в течение 15 мин; 1 мл супернатанта добавляют к 8 мл охлажденного льдом метанола и выдерживают в течение ночи при 70оС для осаждения протеина; затем образцы снова центрифугируют при 800q в течение 15 мин, затем сушат в скоростном вакуумном концентраторе Savant. Образцы восстанавливают, добавляя 1 мл буфера ELISA, охлажденного льдом и хранят при -70оС до проведения анализа. Определение эйкозаноидов (LTC4 и 6-кето-PGF1α ) проводят в соответствии со стандартными процедурами ELISA твердофазный иммуноферментный анализ).
Соединения, которые тестируют путем орального приема, суспендируют в 0,5% Твине 80. Соединения, которые тестируют путем внутрибpюшинных инъекций, суспендируют в 0,5% растворе метилцеллюлозы в 0,9% солевом растворе.
Суммарное количество метаболитов в промывной жидкости брюшинной полости мыши подсчитывают и определяют значение путем анализа отклонений сравнением с контрольным вариантом (p ≅0,05). Действие лекарственного препарата выражают в виде процента отклонений от контрольных значений.
Активность стандартных лекарственных препаратов показана в табл.6.
Соединение изобретения при тестировании в этом опыте и противовоспалительное средство этодолак дали следующие результаты: соединение примера 5, доза 10 мг/кг (введение внутрь брюшины (интраперитонеально), ингибирование 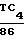
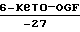 (отрицательные величины означают потенциирование).
(отрицательные величины означают потенциирование).
Полученные результаты свидетельствуют о том, что предлагаемое соединение проявляет ингибирующее действие в отношении липоксигеназного пути метаболизма, но не оказывает ингибирующего действия на циклооксигеназное направление.

Использование: в медицине, в качестве веществ-антагонистов лейкотриенов и ингибиторов липоксигеназы. Сущность изобретения: производные замещенной бензоил-, бифенил- или 2-оксазолалкановой кислоты ф-лы I: A (CH2)n O - B, где A - группа ф-лы I, где X -N- или C(R3)-; 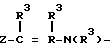 или -S-, при условии, что когда X--C(R3)-, Z
или -S-, при условии, что когда X--C(R3)-, Z 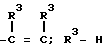 или низший алкил, n - равно 1 - 2, b - группа ф-л II, III, IV, V, где R4, R5, R6, R7, m - имеют соответствующие значения, или их соли. Соединения ф-лы I получают взаимодействием соединения ф-лы HO2-B с соединением ф-лы A(CH2)n-X, где X - отщепляемая группа. Структура ф-л II, III, IV, V (см. чертеж). 2 с. и 8 з.п. ф-лы, 1 ил. , 6 табл.
или низший алкил, n - равно 1 - 2, b - группа ф-л II, III, IV, V, где R4, R5, R6, R7, m - имеют соответствующие значения, или их соли. Соединения ф-лы I получают взаимодействием соединения ф-лы HO2-B с соединением ф-лы A(CH2)n-X, где X - отщепляемая группа. Структура ф-л II, III, IV, V (см. чертеж). 2 с. и 8 з.п. ф-лы, 1 ил. , 6 табл.
A(CH2)n O B,
где A группа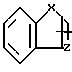
где X -N- или 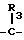 ;
;
Z 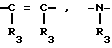 или -S-, при условии, что когда X
или -S-, при условии, что когда X 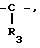 Z
Z 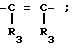
R3 водород или низший алкил;
n 1 2;
В 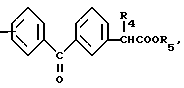
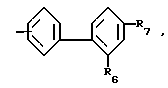
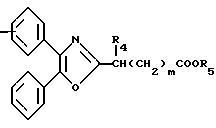
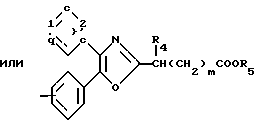
где R4 и R5 каждый, независимо друг от друга, водород или низший алкил;
R6 это галоид или нитрогруппа;
R7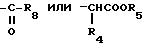
R8 это низший алкил;
m 0 3,
или их фармакологически приемлемые соли.
A(CH2)n O B,
где значения A, n, B имеют указанные значения,
отличающийся тем, что осуществляют реакцию взаимодействия соединения общей формулы
НО В,
где В имеет указанные значения,
с соединением формулы A(CH2)n X, где A и n имеют указанные значения;
X отщепляемая группа,
и, при необходимости, осуществляют гидролиз полученного продукта с образованием соединения формулы I, в котором R5 водород или низший алкил, и, при желании, превращают полученное соединение в его фармакологически приемлемую соль.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Керамический стержень | 1970 |
|
SU315399A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-06-19—Публикация
1992-04-24—Подача