Изобретение относится к новым биологически активным соединениям пуринил- или пиримидинилпроизводным метиленциклопентила, обладающим антивирусной активностью, которые могут найти применение в медицине.
Поставлена задача поиск в ряду производных пурина и пиримидина новых соединений активных в отношении различных вирусов, например: HSV-1, HSV-2, VZV, HCMV.
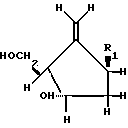
Задача решается описываемыми пуринил- или пиримидинилпроизводными метиленциклопентила формулы I
HOC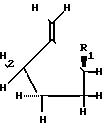 (I) где R1 представляет собой
(I) где R1 представляет собой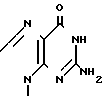 ,
,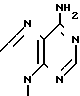
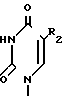
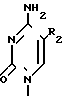 R2 фтор, хлор, бром, йод, метил, этил, н-пропил или группа H
R2 фтор, хлор, бром, йод, метил, этил, н-пропил или группа H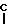
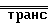 C
C где группа R3 хлор, бром или иод.
где группа R3 хлор, бром или иод.
Соединения формулы I (описываемые соединения) являются антивирусными агентами и могут найти применение для лечения вирусной инфекции у млекопитающих, таких как домашние животные (собаки, кошки, лошади и пр.), у домашней птицы (куры, индюшки), а также у людей. Соединения формулы I, где R1: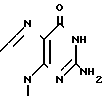 ,
,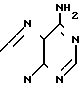

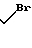
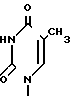
 ,
,

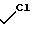
 эффективны против одного или нескольких из следующих вирусов: вирус 1 и 2 герпес симплекс, вирус ветряной оспы и лишая, цитомегаловирус и человеческий вирус иммуно-дефицита. Они также активны против множества других ДНК и ретровирусов. Примеры ДНК вирусов, кроме названных, включают другие вирусы herpes (например, вирус Эпштейна-Барра, вирус ложного бешенства, человеческий вирус herpes 6 и другие), вирусы оспы (например, вирус коровьей оспы, обезьянья оспа и миома), паповавирусы (например, вирусы папилломы), вирус гепатита В и аденовирусы. Примеры ретровирусов, кроме названных, включают те, которые патогенны для человека, такие как человеческие Т-клеточные лимфотропные вирусы -I и -II и также патогенные для других животных, такие как кошачий вирус лейкемии, и вирус инфекционной анемии и оспы у лошадей. Считается, что все другие соединения формулы I активны против одного или нескольких вирусов из следующих: вирус herpes simplez 1 и 2, вирус ветряной оспы опоясывающего лишая, цитомегаловируса и ретровирусы и другие ДНК вирусы, описанные выше.
эффективны против одного или нескольких из следующих вирусов: вирус 1 и 2 герпес симплекс, вирус ветряной оспы и лишая, цитомегаловирус и человеческий вирус иммуно-дефицита. Они также активны против множества других ДНК и ретровирусов. Примеры ДНК вирусов, кроме названных, включают другие вирусы herpes (например, вирус Эпштейна-Барра, вирус ложного бешенства, человеческий вирус herpes 6 и другие), вирусы оспы (например, вирус коровьей оспы, обезьянья оспа и миома), паповавирусы (например, вирусы папилломы), вирус гепатита В и аденовирусы. Примеры ретровирусов, кроме названных, включают те, которые патогенны для человека, такие как человеческие Т-клеточные лимфотропные вирусы -I и -II и также патогенные для других животных, такие как кошачий вирус лейкемии, и вирус инфекционной анемии и оспы у лошадей. Считается, что все другие соединения формулы I активны против одного или нескольких вирусов из следующих: вирус herpes simplez 1 и 2, вирус ветряной оспы опоясывающего лишая, цитомегаловируса и ретровирусы и другие ДНК вирусы, описанные выше.
Соединения этого изобретения можно назначать парентерально (например, внутривенно, внутрибрюшинно или внутримышечно), орально или наружно. Соединения можно назначать орально или парентерально в количестве, эффективном для лечения инфекции. Дозировка будет зависеть от серьезности инфекции и составлять в пределах от 1,0 до 50 мг/кг массы тела. Необходимую дозу можно назначать ежедневно несколько раз через определенные интервалы.
При инфекциях глаз или других наружных инфекциях (например, рта и кожи) композиции можно применять к инфицированной части тела пациента наружно в виде мази, крема, аэрозоли, геля, порошка, лосьена, суспензии или раствора (например, глазные капли). Результаты испытаний приведены в таблице.
П р и м е р 1. [1S-(1α3α,4β)]-2-Амино-1,9-дигидро-9-[4-гидрокси-3-(гидрокси-метил)-2-метилен- циклопентил]-6Н-пурин-6-он.
А. (-)-Диизопинокамфеилборан.
(-)-Диизокамфеилборан был получен в соответствии с процедурой Н.С. Brown et al. J. Org. Chem. 49, 945 (1984), исходным соединением был (1R)-(+)-α -пинен с [ α]D23 +48о (в чистом виде). (1R)-(+)-α -пинен (158,8 мл, 1 моль) добавлялся к перемешанному раствору 10М боранметилсульфид комплекса в метилсульфиде и 1000 мл сухого тетрагидрофурана при 0оС в аргоне. После добавления колба закупоривалась и выстаивалась при 5оС. После 16 ч добавлялось дополнительное количество (1R)-(+)-α -пинена (15,8 мл, 1 моль), и суспензия перемешивалась 8 ч при 5оС. Растворители удалялись каняляцией и оставшийся твердый осадок промывался затем тремя 130 мл порциями сухого эфира (через канюлю) и высушивался в вакууме до получения 205 г (-)-диизопинокамфеилборана.
В. (1S-транс)-2-[(Фенилметокси)метил]-3-циклопентен-1-ол.
Соединение с известным названием и соединения с названиями в разделах С и D были получены модификацией способа К. Biggadike et al. J. Chem. Soc. Perkin Trans. 1, 549 (1988). Циклопентадиен (28,68 г, 0,434 моль), поддерживающийся при температуре -30оС, добавлялся в течение 1 ч к перемешанной смеси 22,5 г 40% натриевого песка в минеральном масле (0,391 г˙ат) в сухой тетрагидрофуран (156 мл) при -10оС в азоте. После добавления смесь пропускалась к дополнительной воронке при 0оС и добавлялась в течение 1,3 ч к перемешанному раствору бензилхлорметилэфира (65,2 мл, 0,469 моль) в тетрагидрофуране (130 мл) при -50оС в азоте. После добавления реакции перемешивалась при -45оС 1,3 ч и затем охлаждалась до -60оС. Тетрагидрофуран (390 мл) добавлялся к реакционной смеси, а затем добавлялся вышеописанный препарат (-)-диизопинокамфеилборана (136 г, 0,477 моль). Реакционная смесь перемешивалась в течение 1 ч при -60оС, согревалась до -10оС в течение 1,5 ч, затем перемешивалась 16 ч при 5оС. После концентрации реакционной смеси в вакууме к половине ее первоначального объема был добавлен эфир (390 мл). Перемешанная смесь охлаждалась до 0оС, а затем в течение 45 мин при поддержании температуры при 0оС добавлялось 3 н. гидроокиси натрия (156 мл, 0,469 моль). Затем в течение 1 ч при поддержании температуры ниже 12оС добавлялась 30% перекись водорода (156 мл). После добавления реакция перемешивалась 1 ч при 10оС, затем слои разделялись. Водный слой промывался эфиром (300 мл), все другие слои объединялись, промывались водным хлоридом натрия, высушивались (сульфат натрия), и концентрировались в вакууме до остатка. Хроматография остатка на силикогелевой колонне Мерка (5000 мл) с использованием петролейного эфира-эфира (2:1) дала 10 г фракцию нужного продукта с примесями, 15,72 г фракцию чистого нужного продукта и 2,7 г фракцию нужного продукта с примесями. Фракции в 10,0 г и 2,7 г соединялись с 4,7 г нужного продукта с примесями из нескольких таких же реакций и смесь хроматографировалась на 1500 мл силикагеля Мерка с использованием петролейного эфира эфира (2:1 и затем 1:1), чтобы получить дополнительно 8,00 г чистого нужного продукта.
С. [1S-(1α 2α3β5α )]-2-[(Фенилметокси)-метил]-6-оксабицикло[3.1.0]гексан-3-ол.
Раствор 3М т-бутил гидроперикси в 2,2,4-триметилпентане (87 мл, 0,261 моль) был добавлен к раствору (1S-транс)-2-[(фенилметокси)метил]-3-циклопентен-1-ола (29,63 г, 0,145 моль) и ванадил ацетилацетонату (400 мг) в сухом дихлорметане (60 мл) в азоте в течение 75 мин при поддержании температуры при 25оС. Смесь перемешивалась при комнатной температуре 16 ч и затем охлаждалась до 0оС. В течение 1 ч при поддержании температуры ниже 20оС добавлялся насыщенный водный сульфит натрия (150 мл), и реакционная смесь перемешивалась при комнатной температуре 1,5 ч. Слои разделялись и водный слой экстрагировался дихлорметаном (50 мл). Органические слои объединялись, промывались водой (50 мл), высушивались (сульфат натрия) и концентрировались в вакууме до остатка. Хроматография этого остатка на силикогелевой колонне Мерка (2000 мл), элюированного градиентом 33 50% эфира в петролейном эфире, дала выход 24,19 г чистого искомого продукта. Такая же хроматография неочищенных фракций на силикагеле Мерка (400 мл) с использованием петролейного эфира эфира (1:1) дала дополнительно 2,71 г нужного продукта при общем выходе 26,90 г. Желаемый продукт имел [α]D22 +44,6о (с, 1,0, CHCl3) и оптическую чистоту СА. 87% (см. К. Biggardike et al. J. Chem. Soc. Perkin Trans, 1, 549 (1988).
D. [1S-(1α2α3β5α )]-3-(Фенилметокси)-2-[(фенилметокси)метил]-6-оксаби- цикло-[3.1.0] гексан.
К смеси 60% гидрида натрия в минеральном масле (5,11 г, 0,128 ммоль) в сухом тетрагидрофуране (247 мл) при комнатной температуре в азоте по каплям в течение 20 мин добавлялся раствор [1S-(1α2α3β 5α )]-2-[(фенилметокси)-метил] -6-оксабицикло[3.1.0] гексан-3-ола (25,58 г, 0,116 моль) в тетрагидрофуране (123 мл). Смесь перемешивалась при комнатной температуре 2 ч и при 40оС 1 ч, затем охлаждалась до комнатной температуры. Добавлялись бензил бромид (15,2 мл, 0,128 моль) и йодид тетрабутиламмония (412 мг) и реакция перемешивалась 3 ч при комнатной температуре. Был добавлен этанол (20 мл) и после 10 мин растворители удалялись в вакууме. Остаток заливался водой (200 мл) и эфиром (200 мл) и слои разделялись. Водный слой экстрагировался эфиром (200 мл) и органические слои объединялись, высушивались (сульфат натрия) и концентрировались в вакууме до остатка. Хроматография этого остатка на силикогелевой колонне Мерка (2000 мл) с использованием градиента 33 50% эфира в петролейном эфире дала 27,21 г нужного продукта.
Е. [1S-(1α 2α 3β5α)]-5-[2-Амино-6-(фенилметокси)-9Н-пурин-9-ил]-3-(фенилме- токси)-2- [(фенилметокси)метил]циклопентанол
Гидрид лития (80 мг, 10 ммоль) добавлялся к перемешанному раствору [1S-(1α 2α 3β5α )]-3-(фенилметокси)-2-[(фенилметокси)метил]-6-оксобицикло[3.1.0] гекса-на (6,2 г, 20 ммоль) и 2-амино-6-(фенилметокси)-9Н-пурина (9,64 г, 40 ммоль) в сухом диметилформамиде (80 мл) при 60оС в азоте. Температура увеличивалась до 125оС и реакция перемешивалась при этой температуре 10 ч, а затем при комнатной температуре 6 ч. Добавлялась уксусная кислота (572 л, 10 ммоль) и после 10 мин реакционная смесь концентрировалась в вакууме до остатка. Хроматография этого остатка на силикогелевой колонне Мерка (2000 мл) с использованием градиента дихлорметана к 5% метанолу в дихлорметане дала 9,03 г чистого очищенного нужного продукта. Хроматография этого материала на колонне SilicaRCC-7 (1000 мл) с использованием градиента хлороформа к 12% этанолу в хлороформе дала 6,63 г чистого искомого продукта.
F. [1S-(1α2α3β5α )]-5-[2-[(4-Метоксифенил)-дифенилметил]амино]-6-(фен- илметокси)-9Н- пурин-9-ил] -3-(фенилметокси)-2-[(фенилметокси)метил]циклопентанол.
п-Анизилхлордифенилметан (3,37 г, 10,9 ммоль), триэтиламин (2,35 мл, 16,8 ммоль) и 4-диметиламинопиридин (40 мг) добавлялись к раствору [1S-(1α2α 3β 5α )] -5-[2-амино-6-(фенилметокси)-9Н-пурин-9-ил] -3-фенилметокси)-2- [(фенилметокси)метил)]циклопентанола (5,45 г, 9,89 ммоль) в сухом дихлорметане (75 мл) в азоте, и смесь перемешивалась при комнатной температуре 3 ч. Реакция промывалась 5% водным бикарбонатом натрия (30 мл) и затем водой (10 мл), высушивалась (сульфат натрия) и концентрировалась в вакууме до остатка. Хроматография этого остатка на колонне SilicaARCC-7 (600 мл) с насадкой (наполненной хлороформом) в хлороформе и элюированной хлороформом этанолом (99: 1) дала 1,5 г чистого искомого продукта. Хроматография неочищенных фракций на колонне Silica AR CC-7 (700 мл) с насадкой в хлороформе и элюированной хлороформом-этанолом (99,5:0,5), позволила получить дополнительно 4,54 г чистого нужного продукта.
G. [2R-(2α 3β 5α )]-5-[2-[[(4-Метоксифенил)-дифенилметил]амино]-6-(фенилмет- окси)- 9Н-пурин-9-ил]-3-(фенилметокси)-2-[(фенилметокси)метил]-1- циклопентанон.
К раствору [1S-( 1α2α3β5α)]-5-[2-[[(4-метоксифенил)дифенилметил]амино] -6-(фенилметокси)- 9Н-пурин-9-ил]-3-(фенилметокси)-2-[(фенилметокси)метил] циклопентанола (4,10 г, 4,88 ммоль), высушенному концентрацией в вакууме из сухого толуола в сухом диметилсульфоксиде (12 мл) при комнатной температуре в азоте добавлялись 1,3-дициклогексилкарбодиимид (3,09 г, 14,9 ммоль) и метилфосфиновая кислота (0,239 г, 2,49 ммоль). Смесь перемешивалась при комнатной температуре 4 ч, и затем выстаивалась при -20оС 16 ч. После согревания до комнатной температуры добавлялся дигидрат щавелевой кислоты (60 мг) в метаноле (8 мл), и смесь перемешивалась 2,5 ч. Реакция фильтровалась и фильтрат разбавлялся дихлорметаном и водой. Органический слой промывался водой (3х70 мл), высушивался сульфат натрия и концентрировался в вакууме до остатка. Остаток заливался дихлорметаном (10 мл), фильтровался и концентрировался в вакууме до остатка. (1Н ЯМР спектр указывал присутствие непрореагировавшего 1,3-дициклогексилкарбодиимида). Остаток растворялся в диметилсульфоксиде (9 мл) и затем обрабатывался метилфосфиновой кислотой (150 мг) в метаноле (6 мл) и дигидратом щавелевой кислоты (60 мг). Смесь перемешивалась при комнатной температуре 4 ч и доводилась как описано ранее, чтобы получить сырой искомый продукт в качестве остатка (3,73 г).
Н. Цинк-титан тетрахлорид-дибромметановый комплекс (препарат 1).
Этот комплекс готовился в соответствии с процедурой L.Lоmbardo, Tetr. Let. 23, 4293 (1982). Тетрахлорид титана (11,5 мл, 0,105 моль) медленно по каплям добавлялся к перемешанной смеси цинковой пыли (28,76 г, 0,44 моль) и дибромметана (10,1 мл, 0,143 моль) в сухом тетрагидрофуране (300 мл) при -40оС в азоте. Смесь согревалась до 5оС 30 мин, затем перемешивалась при 5оС 4 дня в аргоне. Суспензия хранилась при -20оС в азоте и согревалась до комнатной температуры перед использованием.
I. [1S-(1α3α4β )]-N-[(4-метоксифенил)дифенилметил]-6-(фенилметокси)-9-[2-метилен- 4-фенилметокси)-3-[(фенилметокси)метил]-циклопентил]-9Н-пурин-2- амин.
К раствору [2R-(2α3β5α )]-5-[2-[[(4-метоксифенил)дифенилметил]амино]-6-(фе- нилметокси)-9Н- пурин-9-ил]-3-(фенилметокси)-2-[(фенилметокси)метил] -1- циклопентанону (1,80 г, 2,19 ммоль) в сухом дихлорметане (40 мл) в азоте добавлялась суспензия из цинк титан тетрахлорид дибромметанового комплекса в тетрагидрофуране (препарат 1, пример 1Н) (40 мл, 12,3 ммоль). Смесь перемешивалась при комнатной температуре 3 ч и медленно выливалась в смесь насыщенного водного бикарбоната натрия (200 мл) и дихлорметана (200 мл). После перемешивания 20 мин смесь фильтровалась через Celite. Celite промывался дихлорметаном и слои в фильтрате разделялись. Водный слой экстрагировался дихлорметаном, и объединенные органические слои выушивались (сульфат магния) и выпаривались до остатка. Остаток помещался в дихлорметан и фильтровался через Celite. Концентрация фильтрата давала сырой искомый продукт в виде остатка (1,43 г).
J. [1S-(1α3β4α )]-2-Амино-1,9-дигидро-9-[2-метилен-4-(фенилметокси)-3- [(фенил- метокси)-метил]циклопентил]-6H-пурин-6-он.
Смесь сырого [1S-(1α 3β 4α )]-N-[(4-метоксифенил)дифенилметил]-6-(фенилме-токси)-9-[2-метилен-4-(фенилм еток[(фенилметокси)-метил циклопентил] -9Н-пурин-2-амина (2,5 г), тетрагидрофурана (25 мл), метанола (25 мл) и 3 н. соляной кислоты (12,5 мл) нагревалась при 50оС 2,5 ч и охлаждалась до комнатной температуры. рН доводилось до 7,3 1 н. гидроокисью калия и смесь экстрагировалась этилацетатом (3 х 120 мл). Экстракт этилацетата высушивался (сульфат натрия) и концентрировался в вакууме до остатка, который подавался на силикагелевую колонну Мерка (340 мл) с насадкой в 3% этаноле в хлороформе. Элюирование градиентом 3-20% этанола в хлороформе дало 316 мг искомого продукта в качестве остатка.
К. [1S-(1α3β4α )]-2-Амино-1,9-дигидро-9-[4-гидрокси-3-гидроксиметил)-2-ме- тилен- циклопентил]-6Н-пурин-6-он.
К перемешанному раствору [1S-(1α 3β4α )]-2-амино-1,9-дигидро-9-2-метилен-4-(фенилметокси)-3-[фенилметокси) метил]циклопентил]-6Н-пурин-6-ону (304 мг, 0,673 ммоль) в сухом дихлорметане (12 мл) при -78оС в азоте добавлялось 1М трихлорида бора в дихлорметане (6,7 мл, 6,7 ммоль). Реакция перемешивалась при -78оС 2 ч, и затем при -40оС 30 мин. После охлаждения реакции до -78оС медленно в течение 10 мин добавлялся метанол (60 мл). После согревания до комнатной температуры смесь концентрировалась в вакууме и затем концентрировалась 4 раза из 40 мл порций метанола. Остаток растворялся в метаноле (5 мл), рН доводилось до 6,8 с использованием 1 н. гидроокиси калия. После концентрации в вакууме полученная суспензия подавалась в колонну 16 мл СНР-20Р со смолой (Mitsubishi chemical Industries Ltd. 75 150 микрон) с насадкой в воде. Элюирование градиентом воды к 3% ацетонитриду в воде и концентрация фракцией в вакууме позволило получить желаемый продукт в виде твердого вещества (115 мг) с т.пл. > 220оС и [ α]D22 +34о (с, 0,3, вода).
Рассчитано для C12H15N5O3 ˙0,9 H2O,
C 49,12; H 5,77; N 23,87.
Получено, C 49,17; H 5,87; N 23,81.
П р и м е р 2. [1S-(1α3α4β )]-1-[4-Гидрокси-3-(гидроксиметил)-2-метиленци- клопентил]-5-метил- 2,4-(1H,3H)-пиримидиндион.
А. [1S-(1α, 2β,3α4β )]-1-[2-Гидрокси-4-(фенилметокси)-3-[(фенилметокси)метил]циклопентил] -5-метил-2,4)1Н,3Н)-пиримидиндион
Смесь из 3,10 г (10 ммоль) [1S-(1α2α 3β5α )]-3-(фенилметокси)метил-6-оксабицикло[3.1.0]гексана (высушенного концентрацией в вакууме из трех 10 мл порций сухого полуола) и тиамина (2,52 г, 20 ммоль) в 40 мл сухого диметилформамида в аргоне помещалась в масляную баню при 55оС и перемешивалась 5 мин. Добавлялся гидрид натрия (240 мг 60% гидрида натрия в минеральном масле, 6 ммоль), температура доводилась до 140оС. После 62 ч смесь охлаждалась до комнатной температуры и остужалась добавлением 0,45 мл ледяной уксусной кислоты. Растворитель удалялся в вакууме (55о/1 мм) и остаток растирался в порошок дихлорметаном и фильтровался. Испарение фильтрата дало остаток (4,95 г), который подавался на силикогелевую колонну Мерка (140 г) с насадкой в дихлорметане. Элюирование дихлорметаном и затем 3% метанолом в дихлорметане дало 1,89 г чистого искомого продукта и 2,03 г неочищенного продукта. Хроматография фракции 2,03 г на 120 г силикогеля Мерка с использованием дихлорметана и затем 3% метанола в дихлорметане дала 0,90 г дополнительно чистого продукта, что в общем итоге составило 2,79 г.
В. [1S-(1α3α4β )]-5-Метил-1-[2-оксо-4-(фенилметокси)-3-[(фенилметокси)ме-тил] циклопентил]-2,4(1Н,3Н)-пиримидиндион.
К раствору 2,74 г (6,28 ммоль) [1S-(1α2β3α4 β)]-1-[2-гидрокси-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил]-5-метил-2,4-(1Н,3Н)-пиримидиндиона (высушенного концентрацией в вакууме из двух порций в 25 мл сухого толуола) в 12,5 мл сухого диметилсульфоксида при комнатной температуре в аргоне было добавлено 3,88 г (18,8 ммоль) 1,3-дициклогексилкарбодиимида и 0,301 г (3,14 ммоль) метилфосфиновой кислоты. Реакция перемешивалась при комнатной температуре 3 ч, выдерживалась при -20оС всю ночь и перемешивалась при комнатной температуре 2 ч. Добавлялись метанол (2,5 мл) и дигидрат щавелевой кислоты (25 мг) и реакция перемешивалась 4 ч. Реакционная смесь фильтровалась и твердые вещества промывались дихлорметаном. Фильтрат разбавлялся до 250 мл дихлорметаном, промывался водой (3 х 100 мл), высушивался (сульфат натрия) и выпаривался до остатка (3,64 г). (1Н ЯМР анализ показал часть неразложившегося 1,3-дициклогексилкарбодиимида). Остаток высушивался концентрацией в вакууме из 25 мл сухого толуола. К высушенному остатку добавлялось 12 мл сухого диметилсульфоксида, 83 мг (0,86 ммоль) метилфосфиновой кислоты, 6 мл сухого метанола и 25 мг дигидрата щавелевой кислоты. Смесь перемешивалась при комнатной температуре в аргоне 4 ч, фильтровалась и промывалась дихлорметаном. Фильтрат разбавлялся дихлорметаном до 250 мл, промывался водой (5 х 100 мл), высушивался (сульфат натрия) и выпаривался до получения 2,83 г сырого искомого продукта в качестве остатка.
С. [1S-(1α3α4β )-5-Метил-1-[2-метилен-4-(фенилметокси)-3-[(фенилметокси)ме- тил] циклопентил]-2,4-(1Н,3Н)-пиримидиндион.
К сырому [1S-(1α3α4β )]-5-метил-1-[2-оксо-4-(фенилметокси)-3-[(фенилметокси) метил] циклопентил] -2,4(1Н, 3Н)пиримидиндиону (2,81 г) (высушенному концентрацией в вакууме из трех порций в 25 мл сухого толуола) в 100 мл сухого дихлорметана в аргоне добавлялось 41 мл суспензии из комплекса цинк титан тетрахлорид дибромметан в тетрагидрофуране (препарат 1, пример 1Н) (12,6 ммоль). Реакция перемешивалась при комнатной температуре 4 ч, затем удалялось 0,7 мл аликвоты. К аликвоте добавлялся насыщенный водный раствор бикарбоната натрия (1 мл) и смесь перемешивалась при комнатной температуре 5 мин. Смесь экстрагировалась дихлорметаном (3х), и экстракт дихлорметана высушивался (сульфат магния) и выпаривался до остатка. Остаток заливался дихлорметаном, фильтровался через Celite и выпаривался до остатка, ИК-спектр которого (дихлорметан) показывал слабую полосу при 1755-1745 см-1, указывающую о наличии исходного кетона. К реакции добавлялся дополнительно комплекс цинк титан тетрахлорид дибромметан (10 мл, 3 ммоль) и перемешивание продолжалось 1,5 ч. Исследование реакции ИК-анализом показало очень слабую полосу при 1755-1745 см-1.
Реакция выливалась в 250 мл насыщенного водного раствора бикарбоната натрия и дихлорметана (250 мл), энергично перемешивалась 15 мин и фильтровалась через Celite. Слои в фильтрате разделялись и водный слой экстрагировался дихлорметаном. Объединенные экстракты дихлорметана высушивались (сульфат магния) и выпаривались до остатка, кторый заливался дихлорметаном. После фильтрации дихлорметан концентрировался до остатка (2,44 г), который подавался на силикогелевую колонну Мерка (200 г) с насадкой в хлороформе. Элюирование колонны хлороформом (1000 мл) и затем этилацетат-хлороформом (15:85) дало 690 мг искомого продукта в виде остатка.
D. [1S-(1α3α4β )]-1-[4-Гидрокси-3-(гидроксиметил)-2-метиленциклопентил] -5-метил- 2,4(1Н,3Н)-пиримидиндион.
К перемешанному раствору [1S-(1α, 3α 4β )]-5-метил-1-[2-метилен-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил]-2,4(1Н,3Н)-пиримидиндиона (463 мг, 1,07 ммоль) в 19 мл сухого дихлорметана при -70оС в аргоне в течение 5 мин добавлялось 10,7 мл 1М трихлорида бора в дихлорметане. Реакция подогревалась до -40оС в течение 2,5 ч и затем охлаждалась до -70оС. В течение 5 мин по каплям добавлялся сухой метанол (20 мл), затем охлаждающая ванна убиралась. После 30 мин перемешивания реакция концентрировалась в вакууме до остатка. Остаток концентрировался 4 раза из порций в 20 мл сухого метанола и затем растворялся в метаноле (10 мл) и воде (6 мл). рН доводилось до 7,0 с применением 0,5 и гидроокиси калия, и метанол удалялся в вакууме. Водная суспензия подавалась на колонну (32 мл) СНР 20Р с насадкой в воде. Элюирование водой, и затем 5% и 10% метанолом в воде давало 194 мг искомого продукта в виде аморфного остатка. Этот остаток объединялся с дополнительными 70 мг нужного продукта из другой реакции и лиофилизировался из воды для получения 215 мг нужного продукта с т.пл. 52-60оС и [ αD22 +59о (с, 0,3, вода).
Рассчитано для С12H16H2O4 ˙0,4 H2O,
C 55,53; H 6,53; N 10,80.
Получено, C 55, 49; H 6,29; N 10,84.
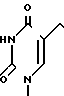
П р и м е р 3. [1S-(1α3α4β )]-4-Амино-1-[4-гидрокси-3-гидроксиметил)-2-мети-ленциклопентил] 2(1Н)-пиримидинон.
А. [1S-(1α2β3α4 β)]-1-[2-Гидрокси-4-(фенилметокси)-3-[(фенилметокси)ме- тил] циклопентил]-2,4(1Н,3Н)-пиримидиндион.
К раствору [1S-(1α2α3β5α )]-3-(фенилметокси)-2-[(фенилметокси)метил]-6-оксабицикло[3.1.0] гексана (3,28 г, 10,6 ммоль) в сухом диметилформамиде (40 мл) добавлялся урацил (2,37 г, 21,2 ммоль) и 60% гидрид натрия в минеральном масле (254 мг, 6,34 ммоль). Суспензия держалась при 140оС 5 дней в азоте и затем охлаждалась до комнатной температуры. Добавлялась уксусная кислота (1,2 мл) и растворители удалялись в вакууме. Хроматография остатка на силикогелевой колонне Мерка (400 мл с насадкой в дихлорметане, элюированного градиентом дихлорметана к 5% метанолу в дихлорметане) дала 2,68 г нуного продукта в виде остатка.
В. [1S-(1α 3α4 β)]-1-[2-Оксо-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил] -2,4(1Н,3Н)-пиримидиндион.
Раствор [1S-(1α 2β3α4β )]-2-гидрокси-4-[(фенилметокси)-3-[(фенилметок- си)метил] циклопентил]-2,4(1Н,3Н)-пиримидиндиона (2,58 г, 6,11 ммоль) высушенный концентрацией в вакууме из сухого толуола), 1,3-дициклогексилкарбодиимида (3,77 г, 18,3 ммоль) и метилфосфиновой кислоты (293 мг, 3,05 ммоль) в сухом диметилсульфоксиде (15 мл) перемешивался при комнатной температуре в азоте 5 ч. Добавлялся дигидрат щавелевой кислоты (75 мг) в метаноле (10 мл), реакция перемешивалась 4 ч и фильтровалась. Осадок промывался дихлорметаном (80 мл), и фильтрат и промывка объединялись, экстрагировались водой (3 х 50 мл), высушивались (сульфат натрия) и концентрировались в вакууме до остатка. Остаток растворялся в 20 мл хлороформа, фильтровался через Celite и концентрировался в вакууме для получения 2,62 г сырого нужного продукта.
С. [1S-(1α3α4 β)]-1-[2-Метилен-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил]-2,4(1Н,3Н)-пиримидиндион.
Суспензия из комплекса цинк титан тетрахлорид дибромметан в тетрагидрофуране (препарат 1, пример 1Н) (45 мл, 13,5 ммоль) добавлялась к раствору сырого [1S-(1α3α4 β)]-1-[2-оксо-4-(фенилметокси)-3-[(фенилметокси)метил]-циклопентил] 2,4(1Н,3Н)-пиримидиндиона (2,61 г, высушенного концентрацией в вакууме из сухого толуола) в сухом дихлорметане (40 мл), и смесь перемешивалась 3 ч в азоте при комнатной температуре. Добавлялось дополнительно 0,3М комплекса цинк титан тетрахлорид дибромметан (10 мл) и реакция перемешивалась 3 ч при комнатной температуре и затем выстаивалась при -80оС 16 ч. Реакция согревалась до комнатной температуры и выливалась в насыщенный водный бикарбонат натрия (250 мл) и дихлорметан (250 мл). Смесь перемешивалась 1 ч и фильтровалась через Celite. Слои в фильтрате разделялись и органический слой экстрагировался водой (2 х 100 мл). Все органические слои объединялись, высушивались (сульфат натрия) и концентрировались в вакууме до остатка (2,5 г). Хроматография этого остатка на силикагеле Мерка (400 мл, с насадкой в хлороформе) элюированием градиентом хлороформа к 30% этилацетату в хлороформе дало 700 мг нуного продукта в виде остатка.
D. [1S-(1α3α4 β)]-1-[2-Метилен-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил]-4-(1Н-1,2,4-триазол-1-ил)-2 (1Н)-пиримидион.
К перемешанному раствору [1S-(1 α, 3α4β )]-1-[2-метилен-4-(фенилметокси)-3-[(фенилметокси)-метил] циклопентил]-2,4(1Н,3Н)-пиримидиндиона (494 мг, 1,18 ммоль) в сухом пиридине (4 мл) при комнатной температуре в азоте добавлялся 4-хлорфенил дихлорфосфат (518 л, 3,19 ммоль). После 5 мин добавлялся 1,2,4-триазол (448 мг, 6,49 ммоль) и реакция перемешивалась 5 дней. Растворители удалялись в вакууме и остаток растворялся в дихлорметане (100 мл) и экстрагировался водой (2 х 20 мл) и 5% бикарбонатом натрия (2 х 20 мл). Органический слой высушивался (сульфат натрия) и концентрировался в вакууме для получения 586 мг сырого искомого продукта.
Е. [1S-(1α3α4 β)]-4-Амино-1-[2-метилен-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил]-2(1Н)-пиримидинон.
Концентрированная гидроокись аммония (12 мл) добавлялась к раствору сырого [1S-(1α 3α4 β)]-1-[2-метилен-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил] -4-(1Н-1,2,4-триазол-1-ил)-2(1Н)-пи-римидинона (586 мг) в диоксане (12 мл, очищенного пропусканием через основной глинозем). Реакция перемешивалась при комнатной температуре в азоте 16 ч. Добавлялась еще гидроокись аммония (1 мл) и реакция перемешивалась еще 3 ч. После удаления растворителей в вакууме остаток растворялся в дихлорметане (75 мл). Раствор дихлорметана экстрагировался 5% гидроокисью натрия (2 х 20 мл), высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Хроматография этого остатка на колонне Мерка (100 мл, с насадкой в хлороформе) с элюированием градиентом 2% к 8% метанола в хлороформе дала 177 мг нужного продукта в виде остатка.
F. [1S-(1α 3 α,4β )]-4-Амино-1-[4-гидрокси-3-гидроксиметил)-2-метиленцикло- пентил] 2(1Н)-пиримидион.
К раствору [1S-(1α 3α4β )]-4-амино-1-[2-метилен-4-(фенилметокси)-3-[(фенилме- токси)-метил] циклопентил] -2(1Н)-пиримидинона (164 мг, 0,393 ммоль) в сухом дихлорметане (8 мл) при -78оС в азоте добавлялся в течение 3 мин 1М трихлорида бора в дихлорметане (3,93 мл, 3,93 ммоль). Реакция перемешивалась 1,5 ч при -78оС, затем в течение 5 мин добавлялся метанол. После согревания реакции до комнатной температуры 20 мин растворители удалялись в вакууме и остаток концентрировался из метанола (3 х 15 мл). Остаток растворялся в воде и метаноле и рН доводилось до 7 с использованием 1 н. гидроокиси калия. Метанол удалялся в вакууме и водная суспензия подавалась к колонне СНР 20Р с насадкой в воде (70 мл). Элюирование колонны градиентом воды к 20% метанолу в воде дало 48 мг нужного продукта в виде твердого вещества с т.пл. 75-78оС и [ α]D22 +51о(с, 0,29, вода).
Рассчитано для C11H15N3O3 ˙1,34 H2O,
C 50,56; H 6,82; N 16,08.
Получено, C 50,58; H 6,31; N 16,06.
П р и м е р 4. [1S-(1α3α4β )]-1-[4-Гидрокси-3-(гидроксиметил)-2-метиленцик- лопентил]-5- йодо-2,4(1Н,3Н)-пиримидиндион.
А. [1S-(1α2β3α4β )]-1-[2-Гидрокси-4-(фенилметокси)-3-[(фенилметокси)ме- тил циклопентил]-5-йодо-2,4(1Н,3Н)-пиримидиндион.
К раствору [1S-(1α2β3α4β )]-1-[2-гидрокси-4-(фенилметокси)-3-[(фенилметок- си)-метил] циклопентил] -2,4(1Н,3Н)-пиримидиндиона (1,32 г, 3,12 ммоль) в сухом диоксане (50 мл) добавлялся йодин (1,59 мг, 6,25 ммоль) и 0,8 н. азотная кислота (4,1 мл, 3,34 ммоль). Реакция нагревалась при 90оС 3 ч и после охлаждения реакции до комнатной температуры добавлялся насыщенный раствор тиосульфата натрия до получения слегка оранжевого цвета. Добавлялась вода (50 мл) и смесь экстрагировалась дихлорметаном (3 х 70 мл). Органический экстракт высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Хроматография этого остатка на силикогелевой колонне Мерка (100 мл с насадкой в дихлорметане) с использованием градиента дихлорметан к 3% этанолу в дихлорметане дала 895 мг нужного продукта в виде остатка.
В. [1S-(1α3 α,4 β)]-5-йодо-1-[2-оксо-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил]-2,4(1Н,3Н)-пиримидиндион.
Раствор [1S-(1α2β3 α,4 β)]-1-[2-гидрокси-4-(фенилметокси)-3-[(фенилметок- си)метил] циклопентил]-5-йодо-2,4(1Н,3Н)-пиримидиндиона (687 мг, 1,25 ммоль, высушенного концентрацией в вакууме из сухого толуола) в сухом дихлорметане (4 мл) добавлялся к суспензии пиримидин дихромата (801 мг, 2,13 ммоль, высушенного в вакууме над пентоксидом фосфора) и пропущенный через 3А молекулярные сита (801 мг, высушенный при 325оС). Реакция перемешивалась при комнатной температуре в азоте 2 ч и фильтровалась через фильтровальную бумагу Ватмана-1. Осадок промывался дихлорметаном и фильтрат концентрировался в вакууме до остатка, который обрабатывался звуком в 30 мл этилацетата. Фильтрация смеси через 0,2 м нейлоновый фильтр (Rainin 66) c Celite и стекловолокном и концентрация в вакууме дали 544 мг сырого нужного продукта в виде остатка.
С. Комплекс цинк тетин тетрахлорид дибромметан (препарат 2).
Этот комплекс был получен модификацией процедуры L.Lombardo, Tetr. Let. 23, 4293 (1982). Тетрахлорид титана медленно по каплям (5,75 мл, 0,0523 ммоль) добавлялся к перемешанной смеси цинковой пыли (10,59 г, 0,162 ммоль) и дибромметана (4,96 мл, 0,071 ммоль) в сухом тетрагидрофуране (150 мл) при -40оС в азоте. После добавления смесь согревалась до 5оС в течение 30 мин и затем перемешивалась при 5оС в аргоне 4 дня. Суспензия хранилась при -20оС в аргоне и согревалась до комнатной температуры перед использованием.
D. [1S-(1α3α4 β)-5-Йодо-1-[2-метилен-4-(фенилметокси)-3-[(фенилметокси)ме- тил] циклопентил]-2,4(1Н,3Н)-пиримидиндион.
К раствору [1S-(1α 3α 4 β)] -5-йодо-1-[2-оксо-4-(фенилметокси)-3-[(фенилметокси) метил] циклопентил]-2,4(1Н,3Н)-пиримидиндиона (428 мг, 0,783 ммоль, высушенному концентрацией в вакууме из сухого толуола и тетрагидрофурана) в сухом дихлорметане (9,5 мл) добавлялась суспензия комплекса цинк титан тетрахлорид дибромметан в тетрагидрофуране (препарат 2, пример 4С) (7,83 мл, 2,35 ммоль). Смесь перемешивалась при комнатной температуре в азоте 3 ч и затем медленно выливалась в смесь насыщенного бикарбоната натрия (100 мл) и дихлорметана (75 мл). Смесь перемешивалась 1 ч и фильтровалась через Celite с использованием дихлорметана. Слои в фильтрате разделялись и водный слой экстрагировался этилацетатом. Органические слои соединялись, высушивались (сульфат натрия) и концентрировались в вакууме до остатка. Хроматография остатка на силикогелевой колонне Мерка (100 мл с насадкой в дихлорметане) с использованием градиента 1% к 5% этанола в дихлорметане обеспечило получение 243 мг нужного продукта в виде остатка.
Е. [1S-(1α3α4β )]-1-[4-Гидрокси-3-(гидроксиметил)-2-метиленциклопентил] -5-йодо- 2,4(1Н,3Н)-пиримидиндион.
К раствору [1S-(1α 3α 4 β)]-5-йодо-1-[2-метилен-4-(фенилметокси)-3-[(фенилме-токси)метил] циклопентил] -2,4(1Н,3Н)-пиридиндиона (200 мг, 0,368 ммоль, высушенному концентрацией из толуола) в дихлорметане (7,5 мл) при -78оС в азоте добавлялся в течение 3 мин 1М трихлорид бора в дихлорметане (3,68 мл, 3,68 ммоль). Реакция перемешивалась 2 ч при -78оС и затем за 5 мин добавлялся метанол (10 мл). Реакция согревалась до комнатной температуры 20 мин и выпаривалась в вакууме до остатка. Остаток концентрировался из метанола (3 х 10 мл) и растворялся в метаноле и воде. рН доводилось до 7,1М с использованием 0,1 М гидроокиси калия, и смесь концентрировалась для удаления метанола и подавалась на колонну СНР 20Р со смолой (50 мл) с насадкой в воде. Элюирование градиентом воды к 50% метанолу в воде дало 69 мг нужного продукта в виде твердого вещества, который объединялся с 9 мг дополнительно полученного продукта из реакции с меньшим объемом, что дало 78 мг нужного продукта в виде твердого вещества с т.пл. 180оС (разл.) и [ α]D22 +63о (с, 0,29, метанол).
Рассчитано для C11H13IN2O4 ˙0,32 H2O,
C 35,72; H 3,72; N 7,58.
Получено, C 35,97; H 3,55; N 7,32.
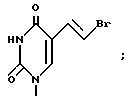
П р и м е р 5. [1S-1α (Е),3α4β )]-5-(2-Бромэтилен)-1-[4-гидрокси-3-(гидроксиме-тил)-2- метиленциклопентил]-2,4(1Н,3Н)-пиримидиндион.
А. [1S-1α (E), 2β 3α 4 β)]-3-[1,2,3,4-тетрагидро-1-[2-гидрокси-4-(фенилметокси)-3- [(фенилметокси)метил]циклопентил]-2,4-диоксо-5-пиримидинил]-2- акриловая кислота, метилэфир.
Смесь палладий (11) ацетата (0,195 г, 0,871 ммоль), трифенилфосфина (0,456 г, 1,74 ммоль) и триэтиламина (2,56 мл, 0,0183 М) в диоксане (200 мл, очищенном на основании глинозема и дегазированном в вакууме) нагревалась 10 мин при 90оС в азоте, добавлялись раствор [1S-(1α2 β,3α4β )]-1-[2-гидрокси-4-(фенилметокси)-3-[(фенил- метокси)-метил] циклопентил]-5-йодо-2,4(1Н, 3Н)-пиримидиндиона (6,70 г, 0,0122 ммоль, высушенного концентрацией в вакууме из сухого толуола) и метилакрилат (3,23 мл, 0,0366 ммоль) в дегазированном диоксане (20 мл), и реакция нагревалась при 90оС 4,5 ч. Добавлялся Celite (5 г) и после перемешивания при 90оС 15 мин горячая суспензия фильтровалась через Celite и промывалась хлороформом (80 мл). Фильтрат и промывка объединялись и концентрировались в вакууме до остатка, который растворялся в хлороформе (400 мл). Хлороформ промывался водой (100 мл), высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Хроматография остатка на силикогелевой колонне Мерка (800 мл, с насадкой в дихлорметане) элюированием градиентом хлороформа к 5% этанолу в хлороформе дала 2,21 г нужного продукта в виде остатка.
В. [1S-1α (Е), 2β 3α 4 β)]-3-[1,2,3,4-Тетрагидро-1-[2-гидрокси-4-(фенилметокси)- 3- [(фенилметокси)метил]циклопентил]-2,4-диоксо-5-пиримидинил]-2- акриловая кислота.
Раствор [1S-[1α (E), 2β3α4β )]-3-[1,2,3,4-тетрагидро-1-[2-гидрокси-4-(фенил- метокси)-3- [(фенилметокси)метил]циклопентил]-2,4-диоксо-4-пиримидинил]-2- акриловой кислоты, метилового эфира (2,98 г, 5,88 ммоль), тетрагидрофурана (45 мл) и 2 н. гидроокиси калия (29,4 мл, 58,8 ммоль) перемешивались при комнатной температуре в азоте 2,5 ч. После охлаждения смеси до 0оС рН доводилось до 2, с использованием 6 н.соляной кислоты. Тетрагидрофуран удалялся в вакууме и смесь разбавлялась водой и экстрагировалась этилацетатом (3 х 200 мл). Экстракт этилацетата высушивался (сульфат натрия) и концентрировался в вакууме для получения 3,14 г нужного продукта в виде остатка.
С. [1S-1α (Е),2β3α4β )]-5-(2-Бромэтенил)-1-[2-гидрокси-4-(фенилметокси)-3- [(фенилметокси)метил] циклопентил]-2,4(1Н, 3Н)-пиримидиндион.
Бикарбонат калия (1,76 г, 17,64 ммоль) и N-бромосукцинимид (1,05, 5,88 ммоль) добавлялись к раствору [1S-[1α (E),2β3α 4β )]-3-[1,2,3,4-тетрагидро-1-[2-гидрокси-4-(фенилметокси)-3- [(фенилметокси)метил] циклопентил] -2,4-диоксо-5-пиримиди-нил] -2- акриловой кислоты (2,89 г, 5,88 ммоль, высушенной концентрацией в вакууме из сухого диметилформамида) (35 мл), и смесь перемешивалась при комнатной температуре в азоте 2 ч. Фильтрация реакционной смеси и концентрация фильтрата в вакууме дала осадок, который был хроматографирован на силикогелевой колонне Мерка (400 мл, с насадкой в дихлорметане) элюированием градиентом дихлорметана к 5% этанолу в дихлорметане, чтобы получить 1,59 г фракцию, состоящую из сырого нужного продукта. Хроматография фракции в 620 мг на силикогелевой колонне Мерка (100 мл в дихлорметане), с использованием вышеупомянутого градиента, дала фракцию, содержащую 120 мг нужного продукта и сукцинимида. Фракция 1,59 г и 120 мг растворялись в дихлорметане (100 мл) и раствор промывался разбавленным тиосульфатом натрия (50 мл), 1М бикарбонатом калия (3 х 50 мл) и водой (50 мл), высушивался (сульфат натрия) и концентрировался в вакууме для получения 1,56 г чистого нужного продукта.
D. [1S-[1α (E), 3α4 β]-5-(2-Бромэтенил)-1-[2-оксо-4-(фенилметокси)-3-[(фенил-метокси) метил]циклопентил]-2,4(1Н,3Н)-пиримидиндион.
1,3-Дициклогексилкарбодиимид (1,55 г, 7,5 ммоль) и метилфосфиновая кислота (120 мг, 1,25 ммоль) добавлялись к раствору [1S-[1α (E),2β3 α,4 β] -5-(2-бромэтенил)-1-[2-гидрокси-4-(фенилметокси)-3- [(фенилметокси) метил] циклопентил] -2,4(1Н, 3Н)-пиримидиндиона (1,32 г, 2,5 ммоль, высушенному концентрацией в вакууме из сухого толуола) в сухом диметилсульфоксиде (10 мл), и смесь перемешивалась при комнатной температуре в азоте 5 ч. Добавлялся раствор дигидрата щавелевой кислоты (30 мг) в метаноле (4 мл), и перемешивание продолжалось 2 ч. Реакция фильтровалась и осадок промывался дихлорметаном. Объединенный фильтрат и промывка (са. 80 мл) промывались водой (4 х 40 мл), высушивались (сульфат натрия), и концентрировались в вакууме для получения 1,45 г сырого нужного продукта в виде остатка.
Е. [1S-[1α (E),3α4β-5-(2-Бромоэтенил)-1-[2-метилен-4-(фенилметокси)-3- [(фенилметокси)метил]циклопентил]-2,4(1Н,3Н)-пиримидиндион.
К раствору [1S-[1α (E),3α4β-5-(2-бромэтенил)-1-[2-оксо-4-(фенилметокси)-3- [(фенилметокси) метил]циклопентил]-2,4(1Н,3Н)-пиримидиндиона (1,45 г сырого, высушенного концентрацией в вакууме из сухого толуола) в сухом дихлорметане (30 мл) была добавлена суспензия комплекса цинк титан тетрахлорид дибромметан в ТГФ (препарат 2, пример 4С) (25 мл, 7,5 ммоль). Рекция перемешивалась при комнатной температуре в азоте 5 ч и выливалась в смесь насыщенного бикарбоната натрия (200 мл) и дихлорметана (200 мл). После перемешивания 45 мин смесь фильтровалась через Celite. Слои в фильтрате разделялись, органический слой промывался водой (200 мл), высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Хроматография остатка на колонне Мерка (600 мл, с насадкой в хлороформе) с использованием градиента хлороформа к 15% этилацетату в хлороформе дала 400 мг твердого вещества, состоящего из 362 мг нужного продукта и 38 мг 1,3-дициклогексилмочевины.
F. [1S-[1α (E),3α4β-5-(2-Бромэтенил)-1-[4-гидрокси-3-(гидроксиметил)-2- метиленциклопентил-2,4(1Н,3Н)-пиримидин-дион.
К раствору указанного препарата, содержащего 362 мг (0,769 ммоль) [1S-1α (E),3α 4β-5-(2-бромэтенил)-1-[2-метилен-4-(фенилметокси)-3- [(фенилметокси)метил] циклопентил] -2,4(1Н, 3Н)-пиримидиндиона, (высушенного концентрацией в вакууме из сухого толуола) в 10 мл сухого дихлорметана при -78оС в азоте был добавлен 1М трихлорида бора в дихлорметане (7,69 мл, 7,69 ммоль). Смесь перемешивалась при -78оС 1 ч, а затем медленно добавлялся метанол (12 мл). После согревания раствора до комнатной температуры свыше 30 мин растворители удалялись в вакууме, оставляя осадок, который концентрировался в вакууме из метанола (2 х 20 мл). Остаток погружался в метанол и воду, рН доводилось до 7 с использованием 0,1 н. гидроокиси калия. После концентрации в вакууме для удаления метанола водная суспензия подавалась на колонну СНР 20Р со смолой (40 мл, с насадкой в воде). Элюирование колонны градиентом воды к 50% метанол-воде дало 78 мг чистого нужного продукта и 92 мг неочищенного материала. Хроматография 92 мг фракции на СНР 20Р со смолой (40 мл с насадкой в воде) с использованием градиента 30-60% метанола в воде дала еще 21 мг чистого нужного продукта с т.пл. > 220оС и [ α]D22+62о (с, 0,3, метанол).
Рассчитано для C13H15N2O4Br˙1,5 H2O,
C 44,81; H 4,51; N 8,04.
Получено, C 44,94; H 4,31; N 7,91.
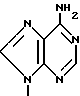
П р и м е р 6. [1R-(1α3α5β )]-3-(6-Амино-9Н-пурин-9-ил)-5-гидрокси-2-мети-ленциклопентанметанол.
А. [1S-(1α2β3α,5β )]-5-(6-Амино-9Н-пурин-9-ил)-3-(фенилметокси-2-(фенил- метокси) метил-циклопентанол.
К [1S-(1α2α3β,5α )]-3-(фенилметокси)-2-[(фенилметокси)метил]-6-оксаби- цикло[3.1.0] гексану (1,82 г, 5,85 ммоль, высушенному концентрацией в вакууме из сухого толуола) в 41 мл сухого диметилформамида в аргоне было добавлено 1,58 г (11,7 ммоль) аденина с последующим добавлением 31 мг (3,9 ммоль) гидрида лития. Перемешанная смесь помещалась в баню при 60оС и температура увеличивалась до 130оС. После 19 ч при 130оС смесь охлаждалась до 40оС и затем добавлялась уксусная кислота (0,29 мл, 5 ммоль). Диметилформамид удалялся в вакууме и остаток растирался в порошок дихлорметаном. Фильтрация порошка дала 1,60 г нерастворимых веществ и 3,01 г остатка из концентрации фильтрата. Хроматография фракции 3,01 г на силикогелевой колонне Мерка (160 г, наполненной дихлорметаном) элюированием дихлорметаном и затем 3% этанолом в дихлорметане дало 1,26 г нужного продукта в виде остатка. Растирание в порошок 1,60 г фракции дихлорметаном, фильтрация и выпаривание фильтрата дали 77 мг дополнительно нужного продукта.
В. [1S-(1α2β3α5β )]-5-[6-(Ацетиламино)-9Н-пурин-9-ил]-3-(фенилметокси)-2- [фенилметокси)метил]циклопентанол.
К перемешанному раствору [1S-(1α 2β3α5β )]-5-(6-амино-9Н-пурин-9-ил)-3-(фенилметокси)-2-[(фенилметокси) метил] циклопентанолу (33 г, 3 ммоль), высушенному концентрацией в вакууме из сухого пиридина (15 мл) при комнатной температуре в азоте по каплям добавлялся хлортриметилсилан (1,91 мл, 15 ммоль). После 30 мин добавлялся уксусный ангидрид (1,41 мл, 15 ммоль) и смесь перемешивалась при комнатной температуре 3 ч. Смесь охлаждалась до 0-5оС и по каплям добавлялась вода. Перемешивание продолжалось 5 мин и смесь концентрировалась в вакууме до остатка, который помещался в дихлорметан и 5% водный бикарбонат калия. Слои разделялись и водный слой экстрагировался (рН 7,5) дихлорметаном (3х). Слои дихлорметана комбинировались, промывались 5% бикарбонатом калия, высушивались (сульфат натрия) и концентрировались в вакууме до остатка. Хроматография этого остатка на колонне Мерка (130 г, наполненной дихлорметаном) элюированием градиентом дихлорметана к 5% метанолу в дихлорметане дала 1,23 г нужного продукта в виде остатка.
С. [2R-(2α3β5α )]-5-[6-(Ацетиламино)-9Н-пурин-9-ил]-3-(фенилметокси)-2- [(фенилметокси)метил]циклопентанон.
1,3-Дициклогексилкарбодиимид (773 мг, 3,75 ммоль) и метилфосфиновая кислота (60 мг, 0,63 ммоль) добавлялась к раствору [1S-(1α2β3α5β )]-5-[6-(ацетиламино)-9Н-пурин-9-ил] -3-(фенилметокси)-2- [(фенилметокси)метил]циклопентанола (610 мг, 1,25 ммоль, высушенному концентрацией в вакууме из сухого дихлорметан-толуола (1:1) в 2 мл сухого диметилсульфоксида, и смесь перемешивалась при комнатной температуре в аргоне. После 4 ч добавлялись сухой метанол (1,5 мл) и дигидрат щавелевой кислоты (15 мг), и смесь выстаивалась при -20оС в азоте 16 ч. Затем она перемешивалась при комнатной температуре в аргоне 4 ч и фильтровалась с использованием дихлорметана. Испарение фильтрата дало остаток, который помещался в дихлорметан. Раствор дихлорметана промывался водой, высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Добавление дихлорметана с последующей фильтрацией и концентрацией в вакууме дало 629 мг сырого нужного продукта в виде остатка.
D. [1S-(1α3α4β )]-9-[2-Метилен-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил]-9Н-пурин-6-амин.
К раствору [2R-(2α 3β 5 α)] -5-[6-(ацетиламино)-9Н-пурин-9-ил]-3-(фенилметокси)- 2- [(фенилметокси)метил]циклопентанона, (629 мг, высушенного концентрацией в вакууме из сухого тетрагидрофуран-толуола (1:1)) в 20 мл сухого дихлорметана при комнатной температуре в аргоне было добавлено 12,5 мл суспензии комплекса цинк титанхлорид дибромметан в тетрагидрофуране (препарат 1, пример 1Н) (3,75 ммоль). Смесь перемешивалась 4 ч и выливалась в насыщенный бикарбонат натрия (80 мл). Добавлялся дихлорметан (80 мл) и смесь перемешивалась при комнатной температуре 50 мин. Смесь фильтровалась через Celite с использованием дихлорметана, и слои в фильтрате разделялись. Водный слой экстрагировался дихлорметаном и все слои дихлорметана объединялись, высушивались (сульфат магния) и концентрировались в вакууме до остатка. Хроматография остатка на силикогелевой колонне Мерка (38 г, наполненной дихлорметаном), элюированием градиентом дихлорметана к 3% метанолу в дихлорметане дала 48 мг чистого продукта и 173 мг неочищенного продукта. Хроматография 173 мг на колонне Мерка (13 г) с использованием вышеупомянутого градиента дала дополнительно 28 мг нужного продукта в виде остатка, что всего составило 76 мг продукта.
Е. [1R-(1α3α5β )]-3-(6-Амино-9Н-пурин-9-ил)-5-гидрокси-2-метиленциклопен-танметанол.
Раствор 1М трихлорида бора в дихлорметане (3,2 мл, 3,2 ммоль) добавлялся по каплям в течение 4 мин к перемешанному раствору [1S-(1α3 α,4 β)]-9-[2-метилен-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил]-9Н-пурин-6-амина (142 мг, 0,32 ммоль) в 6,5 мл сухого дихлорметана при -70оС в аргоне, и смесь перемешивалась при -70оС 1,5 ч. Сухой метанол добавлялся в течение 3 мин и затем смесь согревалась до комнатной температуры и концентрировалась в вакууме до остатка. Остаток концентрировался в вакууме из трех порций метанола в 6 мл и затем помещался в метанол (4 мл) и воду (2 мл). рН доводилось до 8,8 с использованием 1 н. гидроокиси калия, и смесь концентрировалась до остатка, которая подавалась в виде суспензии в воде к колонне СНР-20Р, наполненной смолой (17 мл, наполненной водой). Элюирование градиентом воды к 20% метанолу в воде после лиофилизации дало 35 мг нужного продукта в виде твердого вещества с т.пл. 52-58оС.
П р и м е р 7. [1S-(1α(E),3α4β )]-1-[4-Гидрокси-3-(гидроксиметил)-2-метиленцик- лопентил]-5-(2- йодоэтенил)-2,4(1Н,3Н)-пиримидиндион.
А. (-)-Диизопинокамфеилборан.
(-)-Диизокамфеилборан был получен с использованием [(1R)-(+)-α -пинена с оптической чистотой 98+% ([ α]D23 +50,7о (в чистом виде)). Раствор из 616 мл 1,0 М комплекса боран тетрагидрофуран добавлялся к (1R)-(+)- α-пинену (185 г, 1,36 ммоль) при 0-5оС в азоте и реакция перемешивалась всю ночь при 5оС, чтобы получить нужный продукт в виде кристаллической суспензии.
В. [(1S-транс)-2-[(Фенилметокси)метил]-3-циклопентен-1-ол.
Циклопентадиен (39 г, 0,59 ммоль) при -20оС добавлялся в течение 35 мин к перемешанной смеси 31,9 г 40% песка натрия в минеральном масле (0,54 г˙ат) в 264 мл сухого ТГФ при -15оС. Смесь перемешивалась при -10оС 1,5 ч, подогревалась до 0оС и подавалась через канюлю к дополнительной воронке при 0оС. Затем в течение 30 мин она добавлялась к перемешанному раствору бензил хлорметилового эфира (100 г, 0,64 ммоль) в 200 мл. ТГФ при -50 до -55оС. Смесь перемешивалась при -55 до -40оС 1 ч и затем охлаждалась до -65оС. К ней в течение 5 мин через канюлю была добавлена кристаллическая суспензия (-)-диизопинокамфеилборана из стадии А, который был охлажден до -60оС. Реакция перемешивалась при -60оС 1 ч, подогревалась до -10оС и выдерживалась при -20оС ночь. Реакционная смесь перемешивалась 1 ч при 5оС и концентрировалась в вакууме до половины своего первоначального объема. Добавлялся эфир (600 мл) и перемешанная смесь охлаждалась до 0оС. По каплям в течение 1 ч добавлялась холодная 30% перекись водорода (188 мл) с поддержанием температуры ниже 12оС, затем смесь перемешивалась еще 1 ч при поддержании температуры ниже 12оС. Слои разделялись и водный слой промывался эфиром. Эфирные экстракты объединялись, высушивались (сульфат натрия) и концентрировались в вакууме до остатка (337 г). Хроматография этого остатка на силикогелевой колонне Мерка (2300 г, наполненной петролейным эфиром эфиром (2:1) с использованием петролейного эфира эфира (2:1) и затем (1:1), дала фракцию А (17,56 неочищенного продукта), фракцию В (11,03 г чистого нужного продукта), и фракцию С (3,52 г неочищенного продукта). Подобная хроматография фракции А на 800 г силикогеля и фракции С на 140 г силикогеля дала 8,08 г и 2,33 г соответственно, дополнительного чистого продукта в общем количестве 21,44 г нужного соединения.
С. [1S-(1α2α3 β,5 α)]-2-[(Фенилметокси)метил]-6-оксабицикло[3.1.0]гексан- 3-ол
Данное соединение было получено по процедуре примера 1С, но с использованием препарата [(1Sтранс)-2-[(фенилметокси)метил] -3-циклопентен-1-ол] из стадии В выше. Это позволило получить искомое соединение с [α]D22 +48,0о (с, 1,0, CHCl3) и оптической чистотой 94% См. S.K.Biggadike te al. J. Chem. Soc. Perkin Trans, 1, 549 (1988).
D. [1S-(1α2α3 β,5α )]-3-(Фенилметокси)-2-[(фенилметокси)метил]-6-оксаби- цикло[3.1.0] гексан.
Искомое соединение было получено по процедуре примера 1, но с использованием препарата [1S-(1α 2α3 β,5α )]-2-[(фенилметокси)метил]-6-оксабицикло[3.1.0]гек- сан-3-ол из стадии С.
Е. [1S-(1α2β3α4 β)]-1-[2-гидрокси-4-(фенилметокси)-3-(фенилметокси)ме-тил циклопентил]-2,4(1Н,3Н)-пиримидиндион.
Искомое соединение было получено по процедуре в примере 3А, но с использованием препарата [1S-(1α2α3 β,5α )] -3-(фенилметокси)-2-[(фенилметокси)метил]-6-оксабицикло[3.1.0] гексан из указанной стадии.
F. [1S-(1α2β3α4β )]-1-[2-гидрокси-4-(фенилметокси)-3-[фенилметокси)ме-тил] циклопентил]-5-йодо-2,4(1Н,3Н)-пиридиндиол.
К раствору [1S-(1α2β3α4β)]-1-[2-гидрокси-4-(фенилметокси)-3-[фенилметок- си)метил] циклопентил] -2,4(1Н,3Н)-пиридиндина из стадии Е (11,99 г, 28,41 ммоль) в сухом диоксане (455 мл) добавлялись иодин (14,44 г, 56,85 ммоль) и 0,8 н. азотной кислоты (59,6 мл, 30,3 ммоль). Реакция нагревалась при 90оС 2 ч и охлаждалась до комнатной температуры. Добавлялся насыщенный раствор тиосульфата натрия (25 мл) до появления слегка оранжевого цвета. Добавлялась вода (450 мл), смесь экстрагировалась дихлорметаном (3 х 500 мл) и объединенные экстракты дихлорметана промывались насыщенным раствором хлорида натрия (100 мл), высушивались (сульфат натрия) и концентрировались в вакууме до остатка. Хроматография этого остатка на 1200 мл силикагелевой колонне Мерка с использованием этилацетат-хлороформа (1:1) дала получение 9,5 г нужного продукта в виде твердого вещества с т.пл. 165оС.
G. [1S-[1α (E), 2β 3 α,4β )]-3-[1,2,3,4-тетрагидро-1-[2-гидрокси-4-(фенилметокси)-3- [(фенилметокси)метил]циклопентил]-2,4-диоксо-5-пиримидинил] 2-акриловая кислота, метиловый эфир.
Смесь палладия (11) ацетата (168 мг, 0,752 ммоль), трифенилфосфина (400 мг, 1,52 ммоль) и триэтиламина (1,1 мл, 7,8 ммоль) в диоксане (100 мл, очищенного на основном глиноземе и дегазированном в вакууме) нагревалась с перемешиванием 15 мин при 85оС в азоте. К раствору красного цвета добавлялся [1S-(1α 2β 3α4β )]-1-[2-гидрокси-4-(фенилметокси-3-[(фенилме-токси)метил] циклопентил] -5-йодо-2,4(1Н,3Н)-пиримидиндион из стадии (2,90 г, 5,28 ммоль, высушенный в вакуууме над пентоксидом фосфора при 50оС 2 ч) и метилакрилат (1,40 мл, 15,6 ммоль). Смесь перемешивалась 7 ч при 80оС, 2 ч при 90оС и затем в течение ночи при комнатной температуре. Смесь фильтровалась через Celite и Celite промывался хлороформом (200 мл). Объединенные фильтраты концентрировались в вакууме до остатка, который растворялся в хлороформе (200 мл). Хлороформ промывался водой, высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Хроматография этого остатка на силикогелевой колонне Мерка (600 мл, наполненной дихлорметаном) элюированием градиента дихлорметана к 5% этанолу в дихлорметане дала получение 1,54 г нужного продукта в виде пенообразного твердого вещества.
Н. [1S-1α (E), 2β, 3α 4β )]-3-[1,2,3,4-тетрагидро-1-[2-гидрокси-4-(фенилметокси)-3- [(фенилметокси)метил]циклопентил]-2,4-диоксо-5-пиримидинил]-2- акриловая кислота.
Данное соединение было получено по процедуре примера 5В, но с использованием препарата [1S-1α (E),2β,3α4β, )]-3-[1,2,3,4-тетрагидро-1-[2-гидрокси-4-(фенил- метокси)-3- [(фенилметокси)метил]циклопентил]-2,4-диоксо-5-пиримидинил]-2- акриловой кислоты, метилового эфира из стадии С.
I. [1S-[1α (E),2β,3α4β,-1-[2-гидрокси-4-(фенилметокси)-3-[(фенилметокси)ме- тил] циклопентил]-5-(2-иодоэтенил)-2,4-(1Н,3Н)-пиримидиндион.
К перемешанному раствору [1S-[1α (E),2β3α4β-3-[1,2,3,4-тетрагидро-1-[2-гидрокси-4-(фенилметокси)-3- [(фенилметокси)метил] циклопентил] -2,4-диоксо-5-пири-мидинил] -2- акриловой кислоты из стадии Н (500 мг, 1,0 ммоль, высушенной концентрацией в вакууме из сухого диметилформамида) в 10 мл сухого диметилформамида в аргоне был добавлен ацетат калия (1,97 г, 20,0 ммоль). Смесь перемешивалась при комнатной температуре 30 мин, затем добавлялся N-йодосукцинимид (225 мг, 1,0 ммоль). Смесь перемешивалась при 50оС 4 ч, добавлялось дополнительное количество N-йодосукцинимида (113 мг, 0,5 ммоль) и нагревание при 50оС продолжалось еще 4,5 ч. Смесь перемешивалась ночь при комнатной температуре и затем фильтровалась. Твердые вещества промывались диметилформамидом (20 мл) и объединенные фильтраты концентрировались в вакууме до остатка. Остаток помещался в хлороформ (125 мл) и раствор хлороформа промывался 1М бикарбонатом калия (3 х 20 мл) и водой (25 мл), высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Хроматография остатка на силикогелевой колонне Мерка (75 мл), наполненной дихлорметаном) элюированием градиентом дихлорметана к 3% метанолу в дихлорметане дала выход 350 мг нужного продукта в виде пенообразного твердого вещества.
J. [1S-[1α (E), 3α 4β-5-(2-йодоэтенил)-1-[2-оксо-4-(фенилметокси)-3-[(фенил-метокси) метил]-циклопентил]-2,4(1Н,3Н)-пиримидиндион.
1,3-Дициклогексилкарбодиимид (868 мг, 4,2 ммоль) и метилфосфиновая кислота (67,2 мг, 0,7 ммоль) добавлялись к раствору [1S-[1α (E),2β3α4 β]-1-[2-гидрокси-4-(фенилметокси)-3-[(фенилметокси)метил] циклопентил]-5-(2-йодоэтенил)-2,4(1Н, 3Н)-пиримидиндиона (805 мг, 1,4 ммоль, высушенному концентрацией в вакууме из сухого толуола) в сухом диметилсульфоксиде (5,6 мл), и смесь перемешивалась при комнатной температуре в азоте 6 ч. Добавлялся раствор дигидрата щавелевой кислоты (16,8 мг) в метаноле (2,2 мл) и перемешивание продолжалось 2 ч. Реакция фильтровалась, осадок промывался дихлорметаном (30 мл) и объединенный фильтрат промывался водой (4 х 25 мл), высушивался (сульфат натрия) и концентрировался в вакууме для получения 930 мг сырого нужного продукта в виде пенообразного остатка.
K. [1S-1α (E),3α4β )]-5-(2-Йодоэтенил)-1-[2-метилен-4-(фенилметокси)-3-[(фе-нилметокси) метил]циклопентил]-2,4(1Н,3Н)-пиримидиндион.
К раствору сырого препарата [1S-[1α (E),3α4β-5-(2-йодоэтенил)-1-[2-оксо-4-(фенилметокси)-3-[(фенилметокси) метил]-циклопентил]-2,4(2Н,3Н)-пиримидиндиона из стадии J (930 мг, высушенному концентрацией в вакууме из сухого толуола) в сухом дихлорметане (17 мл) добавлялась суспензия 0,3 М цинк титан тетрахлорид дибромметан комплекса в ТГФ (препарат 2, пример 4С) (14 мл, 4,2 ммоль). Реакция перемешивалась при комнатной температуре в азоте 5 ч и выливалась в смесь насыщенного бикарбоната натрия (112 мл) и дихлорметана (112 мл). После перемешивания 35 мин смесь фильтровалась через Celite. Слои в фильтрате разделялись и органический слой промывался водой (2 х 50 мл), высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Хроматография остатка на колонне Мерка (100 мл, наполненной хлороформом) с использованием градиента хлороформа к 15% этилацетату в хлороформе дала 400 мг твердого вещества, состоящего из 299 мг нужного продукта и 101 мг 1,3-дициклогексилмочевины.
L. [1S-[1α (E), 3 α,4 β]-1-[4-Гидрокси-3-(гидроксиметил)-2-метиленциклопентил]-5-(2- йодоэтенил)-2,4(1Н,3Н)-пиримидиндион.
К раствору 400 мг препарата из стадии К, содержащему 299 мг (0,525 ммоль) [1S-[1α (E),3α4β-5-(2-йодоэтенил)-1-[2-метилен-4-(фенилметокси)-3-[(фенилметокси) метил]циклопентил]-2,4(1Н,3Н)-пиримидин- диона (высушенного концентрацией в вакууме из сухого толуола), в 7,5 мл сухого дихлорметана при -78оС в азоте было добавлено 1М трихлорда бора в дихлорметане (5,76 мл, 5,76 ммоль). Смесь перемешивалась при -78оС 1 ч и затем медленно добавлялся метанол (9 мл). После согревания раствора до комнатной температуры в течение 30 мин растворители удалялись в вакууме, оставляя осадок, который концентрировался в вакууме из толуола (3 х 10 мл). Остаток помещался в метанол (24 мл) и воду (18 мл) и рН доводилось до 7 с использованием 1,0 н. гидроокиси калия. После концентрации в вакууме для удаления метанола, водная суспензия (15 мл) подавалась на колонну СНР 20Р, наполненную смолой (48 мл с водой). Элюирование колонны градиентом воды к 40% метанолу в воде и концентрации соответствующих фракций в вакууме дали 99 мг нужного продукта в виде вязкого твердого вещества. Это вещество и 10 мг такого же продукта из другой реакции объединялись и растворялись в 60% метаноле в воде. Концентрация этого раствора до приблизительно 8 мл дала твердое вещество, которое собиралось и высушивалось в вакууме с получением 89 мг нужного продукта с т.пл. 180-185оС разлож. и [α]D22 +75,7о (с, 0,3, метанол).
Рассчитано для С13H15IN2O4,
C 40,02; H 3,87; N 7,18.
Получено, С 39,81; H 3,61; N 7,01.
П р и м е р 8. [1S-[1α (E),3α4β-5-(2-Хлорэтенил)-1-[4-гидрокси-3-(гидроксиме-тил)-2- метиленциклопентил]-2,4(1Н,3Н)-пиримидиндион.
А. [1S-[1α (E),2β3α4β-5-(2-Хлорэтенил-1-[2-гидрокси-4-(фенилметокси)-3- [(фенилметокси)метил]циклопентил]-2,4(1Н, 3Н)-пиримидиндион.
Бикарбонат калия (1,55 г, 15,5 ммоль) и N-хлоросукцинимид (760 мг, 5,69 ммоль) добавлялись к раствору [1S-[1α (E),2β3α 4 β]-3-[1,2,3,4-тетрагидро-1-[2-гидрокси-4-(фенилметокси)-3- [(фенилметокси)метил] циклопентил]-2,4-диоксо-5-пиримиди-нил] 2-акриловой кислоты (полученной по примеру 7Н, 2,54 г, 5,17 ммоль, высушенной концентрацией в вакууме из сухого диметилформамида) в сухом диметилформамиде (52 мл), и смесь перемешивалась при комнатной температуре в азоте 17 ч. Смесь охлаждалась до комнатной температуры и фильтровалась и фильтрат концентрировался в вакууме до остатка. Остаток растворялся в этилацетате (750 мл) и воде (250 мл) и рН доводилось до 2 с использованием 0,1 н. соляной кислоты. Этилацетатный слой промывался водой, высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Хроматография этого остатка на колонне Мерка (150 мл, наполненной дихлорметаном) элюированием градиентом дихлорметана к 3% этанолу в дихлорметане позволила получить 596 мг нужного продукта в виде пенообразного вещества.
В. [1S-[1α (E), 3α 4β-5-(2-Хлорэтенил)-1-[2-оксо-4-(фенилметокси)-3-[(фенил-метокси) метил]-циклопентин]-2,4(1Н,3Н)-пиримидиндион.
1,3-Дицклогексилкарбодиимид (806 мг, 3,0 ммоль) и метилфосфиновая кислота (62,4 мг, 0,65 ммоль) добавлялись к раствору [1S-[1α (E),2β3α4β-5-(2-хлорэтенил)-1-[2-гидрокси-4-(фенилметокси)-3-[(фенилме-токси)метил] - цикл(631 мг, 1,3 ммоль, высушенному концентрацией в вакууме из сухого толуола) в сухом диметилсульфоксиде (5,2 мл), и смесь перемешивалась при комнатной температуре в азоте 5 ч. Был добавлен раствор дигидрата щавелевой кислоты (15,6 мг) в метаноле (2,1 мл) и перемешивание продолжалось 3 ч. Реакция фильтровалась и осадок промывался дихлорметаном (3 х 130 мл). Объединенный фильтрат и промывка промывались водой (4 х 40 мл), высушивались (сульфат натрия) и концентрировались в вакууме для получения 850 мг сырого проудкта в виде пенообразного остатка.
С. [1S-[1α (E),3 α4β-5-(2-Хлорэтенил)-1-[2-метилен-4-(фенилметокси)-3-[(фе-нилметокси) метил]циклопентил]-2,4(1Н,3Н)-пиримидиндион.
К раствору сырого препарата [1S-[1α (E),3α4 β]-5-(2-хлорэтенил)-1-[2-оксо-4-(фенилметокси)-3-[(фенилметокси) метил]циклопентил]-2,4(1Н,3Н)-пиримидинди- она из стадии В (850 мг, высушенному концентрацией в вакууме из сухого толуола) в сухом дихлорметане (15,6 мл) была добавлена суспензия 0,3М цинк титан тетрахлорид дибромметан комплекса в ТГФ (препарат 2, пример 4С) (13 мл, 3,9 ммоль). Реакция перемешивалась при комнатной температуре в азоте 5 ч и выливалась в смесь насыщенного бикарбоната натрия (145 мл) и дихлорметана (145 мл). После перемешивания 80 мин смесь фильтровалась через Celite. Слои в фильтрате разделялись, органический слой промывался водой (2 х 250 мл), высушивался (сульфат натрия) и концентрировался в вакууме до остатка. Хроматография остатка на силикагелевой колонне Мерка (110 мл, наполненной хлороформом) элюированием градиентом хлороформа к 4% этанолу в хлороформе позволила получить 554 мг твердого вещества, состоящего в основном из нужного продукта (приблизительно 310 мг) и 1,3-дициклогексилмочевины.
D. [1S-[1α (E),3 α4β-5-(2-Хлорэтенин)-1-[4-гидрокси-3-(гидроксиметил)-2- метиленциклопентил]-2,4(1Н,3Н)-пиримидин- дион.
К раствору 554 мг препарата стадии С, содержащему приблизительно 310 мг (0,65 ммоль) [1S-[1α (E),3 α4β-5-(2-хлорэтенил)-1-[2-метилен-4-(фенилметокси)-3-[(фе-нилметокси) метил]циклопентил]-2,4(1Н,3Н)-пиримидиндиона (высушенного концентрацией в вакууме из сухого толуола) в 10 мл сухого дихлорметана при -78оС в азоте было добавлено 1М трихлорида бора в дихлорметане (7,2 мл, 7,2 ммоль). Смесь перемешивалась при -78оС 1 ч и затем медленно добавлялся метанол (5,5 мл). После согревания раствора до комнатной температуры 30 мин растворители удалялись в вакууме, оставляя осадок, который концентрировался в вакууме из метанола (4 х 5,5 мл) и затем толуола (2 х 8 мл). Остаток помещался в метанол (26 мл) и воду (20 мл) и рН доводилось до 7,2 с использованием 1 н. гидроокиси калия. Раствор концентрировался в вакууме до суспензии (15 мл), которая подавалась на колонну СНР 20Р со смолой (48 мл, наполненную водой). Элюирование колонны градиентом воды к 60% метанолу в воде и концентрация объединенных фракций до приблизительно 10 мл дали твердое вещество, которое собиралось и высушивалось в вакууме для получения 65 мг нужного продукта в виде твердого вещества белого цвета с т.пл. 221-223оС (разл.) и [ αD22 +80,7о (с, 0,3, метанол).
Рассчитано для C13H15ClN2O4,
C 52,27; H 5,06; N 9,38.
Получено, C 52,03; H 4,87; N 9,28.
П р и м е р 9. Лечение вирусной инфекции в клеточной культуре in vitro.
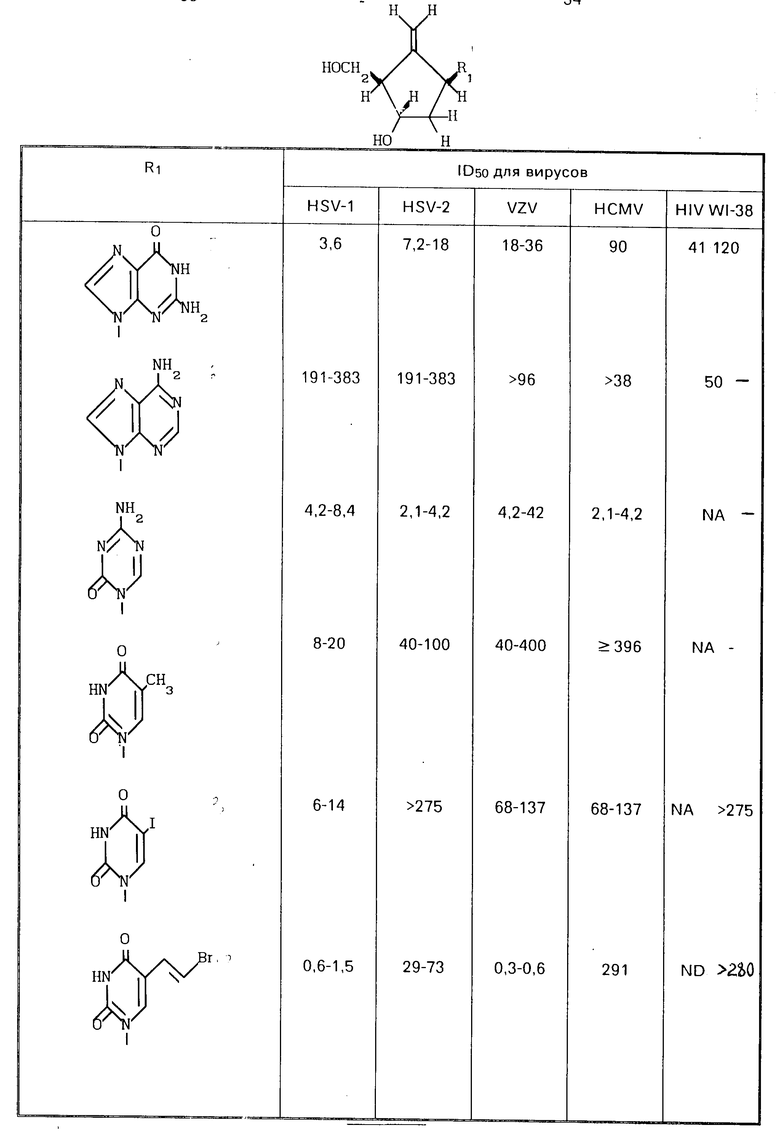
Опыты проводились на системах клеточных культур для определения концентраций соединений, которые эффективны в профилактике некоторых видов вирусных инфекций. Результаты представлены в таблице.
Сокращения:
HSV-1 (вирус герпес симплекс тип 1, штамм Шулера), HSV-2 (вирус герпес симплекс тип 2, штамм 186), VZV (вирус ветряной оспы и опоясывающего лишая, штамм HCMV) человеческий цитомегаловирус, штамм AD 169, HIV (человеческий вирус иммуно-дефицита, штамм HTLV-111B).
Опытные клеточные культуры:
Опыты проводились на вирусах HSV-1, HSV-2, HCMV и VZV. Вирус помещался в 6 чашек с монослойной клеточной культурой 2-38 (Costar, Cambridye МА) за 1 ч до добавления среды, содержащей одинаковые концентрации растворов испытуемого соединения. Ингибирование развития пятна оценивалось на фиксированных и окрашенных монослоях после 4 дней инкубации при 37оС для HSV-1 и HSV-2, и после 5-7 дней инкубации при 37оС для HCMV и VZV. ID50 величины определялись из концентрации лекарства, которая обеспечивала по меньшей мере 50% уменьшения пятна по сравнению с контролем вируса.
Опыт на антивирусную активность по отношению к HIV: Суспензии клеток МТ-2 (S. Harada, et al. Science, 229, 563 (1985)) были заражены множественным заражением 0.03 TLID50 (клетку HIV (штамм HTLV-III B). После адсорбции в течение 1-2 ч при 37оС зараженные клетки разбавлялись в среде роста (PPMI 1640, содержащим антибиотики пенициллин плюс стрептомицин и 10% плодную сыворотку теленка), чтобы получить окончательную концентрацию в клетке 1 х 104 живых клеток (канал культуры в присутствии серийных разбавлений испытуемого соединения, начиная с 100 г/мл). Для каждой концентрации лекарства использовались три образца. Культуры незараженных клеток МТ-2 были подготовлены так же и инкубировались серийными разбавлениями испытуемого соединения в двойном экземпляре. Все опыты проводились в чашках для клеточных культур с 96 канальными углублениями разового пользования. Необработанные (зараженные и незараженные) клетки также присутствовали в качестве контрольных. Все культуры инкубировались в течение 7 дней при 37оС и в увлажненной атмосфере, содержащей 5% СО2. После инкубации в каждом углублении просчитывались количества живых клеток с использованием колориметрического анализа, следующего за инкубацией клеток ХТТ-РМ раствором (ХТТ реагент тетразола плюс феназин метосульфат PМS).
Процентное снижение вирусного цитопатического эффекта (СРЕ) в зараженных вирусом обработанных лекарством клетках по сравнению с необработанными клетками и процентное снижение жизнеспособности клеток в обработанных лекарством незараженных клетках по сравнению с необработанными контрольными клетками рассчитывались и указывались напротив испытуемых концентраций лекарства. Из этих указаний рассчитывались ID50 (минимальная концентрация лекарства, которая замедляет СРЕ на 50%) для каждого лекарства. 2',3'-Дидеоксицитидин и 3'-азидо-3'-деокситимидин использовались в качестве положительного контроля лекарства.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИС(ГИДРОКСИМЕТИЛ)ЦИКЛОБУТИЛ ПУРИНОВ ИЛИ ПИРИМИДИНОВ | 1989 |
|
RU2041213C1 |
| СЕРУЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ МЕВИНОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2041205C1 |
| 7-ОКСАБИЦИКЛОГЕПТИЛЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ АМИДЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ ТРОМБОКСАНА | 1991 |
|
RU2015980C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТРИФТОРМЕТИЛМЕРКАПТАНА | 1991 |
|
RU2024504C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2026296C1 |
| ПРОИЗВОДНЫЕ БЕНЗАЗЕПИНА ИЛИ БЕНЗОТИАЗЕПИНА | 1989 |
|
RU2090562C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ АКТИВНОСТЬ АНГИОТЕНЗИНА II, И СПОСОБ ЛЕЧЕНИЯ ГИПЕРТОНИИ У МЛЕКОПИТАЮЩИХ | 1991 |
|
RU2111208C1 |
| БИФЕНИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ХИНОЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ | 1993 |
|
RU2122540C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРАНИЛ-ЦИАНОГУАНИДИНА | 1990 |
|
RU2057129C1 |
| ПРОИЗВОДНЫЕ ИНДОЛА | 1992 |
|
RU2061694C1 |
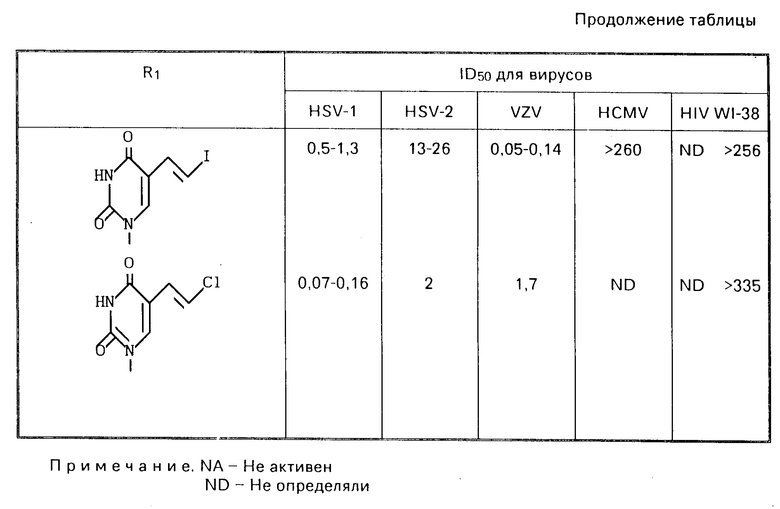
Использование: в медицине, в частности антивирусного вещества. Сущность изобретения: продукт - пуринил- или пиримидинилпроизводные метиленциклопентила ф-лы 1: 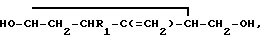 где R1 - группа ф-лы: 2/
где R1 - группа ф-лы: 2/  3/
3/ 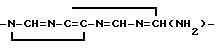 4/
4/ 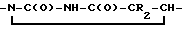 5/
5/ 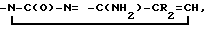 R2 галоид, C1-C3 алкил, -CH=CHR3 R3 - хлор, иод, бром. Реагент 1: производные пурина или пиримидина. Реагент 2: гидроксиметиленциклопентил. Условия реакции: процесс ведут в присутствии основания - гидрида лития, натрия или калия, в среде апротонного растворителя - диметилформамиде, диметилсульфоксиде или сульфолане. 16 з. п. ф-лы, 1 табл.
R2 галоид, C1-C3 алкил, -CH=CHR3 R3 - хлор, иод, бром. Реагент 1: производные пурина или пиримидина. Реагент 2: гидроксиметиленциклопентил. Условия реакции: процесс ведут в присутствии основания - гидрида лития, натрия или калия, в среде апротонного растворителя - диметилформамиде, диметилсульфоксиде или сульфолане. 16 з. п. ф-лы, 1 табл.
где R1 представляет собой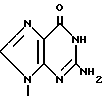
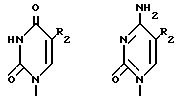
где R2 фтор, хлор, бром, йод, метил, этил, н-пропил или группа 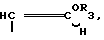 где R3 хлор, бром, йод.
где R3 хлор, бром, йод.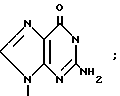
3. Пуринилпроизводные метиленциклопентила по п.1, где R1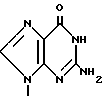
4. Пуринилпроизводные метиленциклопентила по п.1, где R1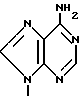
5. Пиримидинилпроизводное метиленциклопентила по п.1, где R1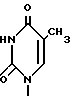
6. Пиримидинилпроизводные метиленциклопентила по п.1, где R1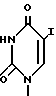
7. Пиримидинилпроизводные метиленциклопентила по п.1, где R1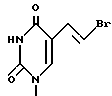
8. Пиримидинилпроизводные метиленциклопентила по п.1, где R1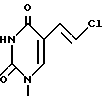
9. Пиримидинилпроизводные метиленциклопентила по п.1, где R1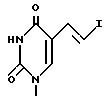
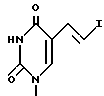
10. Пуринилпроизводное метиленциклопентила по п.1, представляющее собой [1S=(1α, 3α, 4β)] -2-амино- 1,9-дигидро 9 -(4-гидрокси 3 -)-гидроксиметил(-2-метиленциклопентил)- 6Н-пурин-6-он.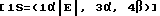 -5-(2-бромэтинил) -1-[4-гидрокси -3-(гидроксиметил) -2-метиленциклопентил] -2,4(1Н,3Н) -пиримидиндион.
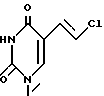
-5-(2-бромэтинил) -1-[4-гидрокси -3-(гидроксиметил) -2-метиленциклопентил] -2,4(1Н,3Н) -пиримидиндион.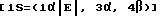 -5-(2-хлорэтинил) -1-[4-гидрокси -3-(гидроксиметил) -2-метиленциклопентил] -2,4(1Н,3Н) пиримидиндион.
-5-(2-хлорэтинил) -1-[4-гидрокси -3-(гидроксиметил) -2-метиленциклопентил] -2,4(1Н,3Н) пиримидиндион. -1-[4-гидрокси- (гидроксиметил) -2-метиленциклопентил] -5-(2-йодоэтинил) -2,4-(1Н,3Н) пиримидиндион.
-1-[4-гидрокси- (гидроксиметил) -2-метиленциклопентил] -5-(2-йодоэтинил) -2,4-(1Н,3Н) пиримидиндион.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| УСТРОЙСТВО для ИЗМЕРЕНИЯ СКОРОСТИ ДВИЖЕНИЯ | 0 |
|
SU291230A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
Авторы
Даты
1995-06-19—Публикация
1991-10-17—Подача