Изобретение касается новых замещенных имидазолов, полезных в качестве противогипертонических средств.
Описаны новые соединения, которые ингибируют действие гормона ангиотензина II.
Эти соединения имеют общую формулу I: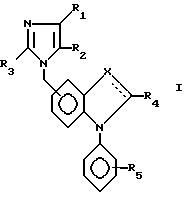
включая их фармацевтически приемлемые соли и пролекарства, где X может быть -N- или 
если X является N, то всегда присутствует двойная связь, R1 представляет собой водород, галоген-. NO2, галоидный алкил или -CN,
R2 представляет собой атом водорода, CN, алкил с 1-10 углеродными атомами, алкенил с 3-10 углеродными атомами или те же самые группы, замещенные фтором, фенилалкенил, в котором алифатическая часть содержит 2-6 углеродных атомов, -(CH2)m- имидазол-1-ил, -(CH2)m-1,2,3-триазолил, необязательно замещенный одной или двумя группами, выбранными из CO2R7 или алкила с 1-4 углеродными атомами, -(CH2)-тетразолил, -(CH2)nOR6,(CH2)n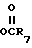 , -(CH2)nSR8, -CH = CH(CH2)s
, -(CH2)nSR8, -CH = CH(CH2)s , -CH = CH(CH2)s
, -CH = CH(CH2)s
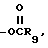 -CH = CH(CH2)s
-CH = CH(CH2)s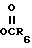 , -(CH2)s
, -(CH2)s , -(CH2)n
, -(CH2)n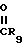 , -(CH2)n
, -(CH2)n NHR10, -CH2)nNR6
NHR10, -CH2)nNR6 -(CH2)nNR6CNHR10, -(CH2)nNR6SO2R10, -(CH2)n
-(CH2)nNR6CNHR10, -(CH2)nNR6SO2R10, -(CH2)n -(CH2)nF, -(CH2)mONO2,
-(CH2)nF, -(CH2)mONO2,
-(CH2)mN3, -(CH2)mNO2, -(CH2) - 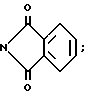
или R1 и R2, взятые вместе в атомами углерода имидазольного ядра, к которому они присоединены, могут образовать бензимидазол следующей формулы: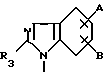 ,
,
где A может быть водородом, алкилом CxF2x+1, C6F5, галогеном C1-C6-алкокси, -(CH2)x-OC1-4-алкилом, -(CH2)x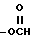 , -(CH2)x
, -(CH2)x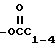 -алкилом или -COR9 и B может быть водородом, алкилом, CxR2x+1, C6F5, галогеном или C1-C6-алкокси,
-алкилом или -COR9 и B может быть водородом, алкилом, CxR2x+1, C6F5, галогеном или C1-C6-алкокси,
R3 представляет собой алкил с 2-10 углеродными атомами, алкенил или алкенил с 3-10 углеродными атомами или такие же группы, замещенные фтором или CO2R7 циклоалкил с 3-8 атомами углерода, циклоалкилалкил 4-10 углеродными атомами, циклоалкилалкенил или циклоалкилалкинил с 5-10 углеродными атомами, (CH2)sZ(CH2)mR' (где R' является атомом водорода, C1-C6-алкилом, C3-C6-циклоалкилом, C2-C4-алкенилом или C2-C4-алкинилом), необязательно замещенный атомом фтора или CO2F7, бензил или замещенный бензил на фенильном кольце одним или двумя галогенами, алкокси с 1-4 углеродными атомами, алкилом с 1-4 углеродными атомами или нитрогруппой, R4 и R4' независимо друг от друга выбраны среди водорода, галогена, галоидалкила, алкинила, арила, циклоалкила, аралкила, 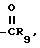 ,
,
R5 представляет собой водород, 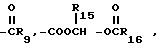 -NHSO2CF3,
-NHSO2CF3, 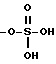 , -SO3H, -C(CF3)2OH,
, -SO3H, -C(CF3)2OH, 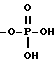
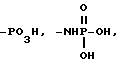 , -NHSO2CF3, -CONHOR15,
, -NHSO2CF3, -CONHOR15, 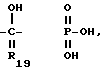
 CONHNHSO2CF3,
CONHNHSO2CF3, 
R6 представляет собой атом водорода, алкил с 1-6 углеродными атомами, циклоалкил с 3-6 углеродными атомами, фенил или бензил,
R7 представляет собой атом водорода, алкил или пефторалкил с 1-8 углеродными атомами, циклоалкил с 3-6 углеродными атомами, фенил или бензил,
R8 представляет собой атом водорода, алкил с 1-6 углеродными атомами, циклоалкил с 3-6 углеродными атомами, фенил, бензил, ацил, с 1-4 углеродными атомами, фенацил,
R9 представляет собой атом водорода, алкил с 1-6 углеродными атомами, циклоалкил с 3-6 углеродными атомами, (CH2)pC6H5, OR11 или NR12R13,
R10 представляет собой алкил с 1-6 углеродными атомами или пефторалкил с 1-6 углеродными атомами, 1-адамантил, 1-нафтил, 1-(1-нафтил)-этил или (CH2)pC6H5,
R11 представляет собой атом водорода, алкил с 1-6 углеродными атомами, циклоалкил с 3-6 углеродными атомами арил, арилалкил, 5-7-членное карбоциклическое кольцо, которое может иметь другое 5-7-членное карбоциклическое кольцо, конденсированное к нему.

R12 и R13 независимо друг от друга представляют собой атом водорода, алкил с 1-4 углеродными атомами, фенил, бензил, α- -метилбензил или вместе взятые образуют кольцо формулы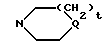

где Q является NR14, O или CH2,
R14 и R15 независимо друг от друга представляют собой атом водорода, алкил, арил: аралкил или циклоалкил,
R16 представляет собой C1-C6-алкил, -NR17R18 или 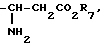
R17 и R18 независимо друг от друга представляют собой атом водорода, алкил с 1-6 углеродными атомами, бензил или вместе взятые составляют 3-6 углеродных атомов, образующих 4-7-членное кольцо с атомом азота, к которому они присоединены,
R19 представляет собой атом водорода C1-C5-алкил, фенил,
R20 представляет собой -CH, -NO2 -CO2R7, в которых R21 представляет собой атом водорода, алкил, циклоалкил, арил, или арилалкил, и R22 представляет собой атом водорода, алкил, циклоалкил, арил, арилалкил или алкокси, R21 и R22 вместе являются -(CH2)2-, -(CH2)3-, -CH=CH- или 
Y является атомом кислорода или атомом серы,
Z является атомом кислорода, NR6 или атомом серы, m равно от 1 до 5, n равно 1-10, p=0-3, q=2-3, r=0-2, s=0-5, t является нулем или единицей и x - целое число от единицы до 6.
Настоящее изобретение касается соединения формулы I, фармацевтических композиций и методов применения таких соединений.
Термин "арил", применяемый в описании либо как таковой, или как часть более крупной группы относится к фенилу или фенилу, замещенному галогеном, алкилом, алкокси, алкилтио, окси, алканоилом, нитро, амино, диалкиламино или трифторметилом. Предпочтительны фенил и монозамещенный фенил и наиболее предпочтителен фенил.
Термин "алкил", применяемый в описании либо как таковой, или как часть более крупной группы, относится к группам, имеющим от 1 до 10 углеродных атомов. Предпочтительны алкильные группы, имеющие от 1 до 4 углеродных атомов.
Термин "циклоалкил", используемый в описании либо как таковой, или как часть более крупной группы, относится к группам, имеющим от 3-7 углеродных атомов.
Термин "алкокси", используемый в описании либо как таковой, или как часть более крупной группы, касается групп, имеющих от 1 до 8 углеродных атомов. Предпочтительны алкоксигруппы, имеющие 1-3 углеродных атома.
Термин "галоген", используемый как таковой, или как часть более крупной группы, относится к фтору, хлору, брому и йоду, при этом предпочтительны фтор и хлор.
Следует иметь в виду, что настоящее изобретение включает пролекарственные формы, т.е. сложные эфиры, ацетали и/или смешанные ацетальные производные соединений формулы I. Например, такие производные приведены в Design of Prodrugs, изданного A. Bundgard (Elsevier, 1985) и в Methods in Ensymology т.42, 309-396, изданных K. Wrobder et. al. (Academic Press, 1985).
Поскольку пролекарственные формы соединения формулы I обычно представлены соединениями, в которых одна или более групп R11 (где R11 не является атомом водорода) присутствуют при R2, R4 и/или R5, то становится понятным, что любая часть молекулы при R11, которая будет расщеплена in vivo с получением соединений формулы I, где R11 является водородом, подпадает в объем и отвечает идее этого изобретения.
Чтобы получить соединения формулы I, в которых R4 является атомом водорода, R4 является атомом водорода и присутствует двойная связь. X является -C- и где R1 и R2 не образуют бензольного кольца, соединение формулы II
где R1 является галоидным алкилом, или соединение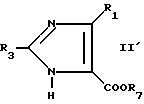 формулы II'
формулы II'
подвергают взаимодействию с соединением формулы III
в которой L является удаляемой группой, такой как галоген, в присутствии связующего агента, например, гексаметилдисилазана калия в растворителях, таких как тетрагидрофуран и диметилформамид, чтобы получить соединение формулы IV или IV'

Продукт формулы IV' может превращаться в продукты, имеющие иные значения R2, с помощью известных приемов, например ацилирования и алкилирования.
Альдегид формулы IV после этого может быть обработан восстановителем, таким как боргидрид натрия, в растворителе, таком как этанол, чтобы получить соединение формулы Ia
т. е. соединение формулы I, в котором R2 является -CH2-OH. Используя известные методы, соединения формулы I, в которых R2 отличается от -CH2-OH, могут быть получены из соединения формулы Ia. Например, спирты формулы Ia могут быть алкилированы или ацилированы, чтобы получить соответствующие соединения формулы I. Альтернативно соединения формулы I могут быть получены из соединений формулы IV гомологизацией альдегида по Виттигу.
Имидазольный альдегид формулы II (т.е. соединение, в котором R1 отличается от галоидного алкила), может быть получен обработкой соединения формулы V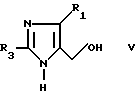
окислителем, например окисью магния, в пиридине.
Соединения формулы III могут быть получены взаимодействием соединения формулы VI
с соединением формулы VII
где X является атомом галогена, например брома в пиридине и в присутствии окиси меди, чтобы получить соединение формулы VIII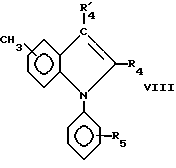
Удаляемая группа L, например галоген, такой как бром, может быть введена известными методами для получения соединения формулы IIIa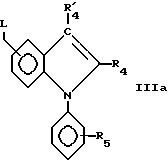
Соединения формулы VI могут быть получены известными методами, например, описанными в J. Heterocyclic Chem., 25.1. (1988).
Соединения формулы I, в которых X является атомом азота, могут быть получены взаимодействием формулы IX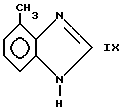
полученного, как описано Mathias et al, Synthetik Communications, 5,461-469 (1975) с соединением формулы X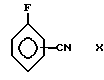
в присутствии основания, например карбоната калия, и в растворителе, например диметилформамиде, с получением соединения формулы XI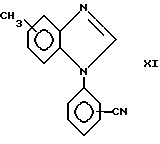 .
.
Соединение формулы XI затем может быть образовано N-бромсукцинимидом и инициатором радикальной реакции, например, 2,2' - азобисизобутиронитрилом в растворителе, например, четыреххлористым углероде для получения соединения формулы XII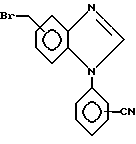
Промежуточное соединение формулы XII может быть соединено с альдегидом формулы II с получением соединения формулы XIII
Альдегид формулы XIII может быть обработан как альдегид IV выше с получением соединения формулы XIV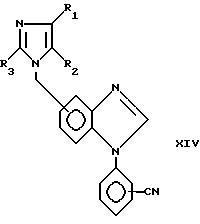
Соединение XIV может быть подвергнуто затем взаимодействию с соединением формулы (н-Bu)3SnN3 с получением соединения формулы I, в котором X является азотом и R5-группой формулы .
.
Соединения формулы I, в которых X является азотом и R3 является группой, отличной от группы формулы
могут быть получены с использованием промежуточного соединения формулы VII вместо соединения формулы X выше.
Соединения формулы I, в которых R1 и R2 вместе образуют имидозольным ядро, которому они присоединены, образуют бензимидазол, могут быть получены, используя технологию по патенту США N 4880804.
Соединения формулы II'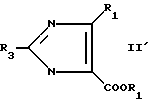
(т. е. соединения, в которых R1 является галоид алкилом) могут быть получены сначала обработкой соединения формулы XV
галоидалкил  - CH2-COOR7 XII,
- CH2-COOR7 XII,
например нитритом натрия, и кислотой, например уксусной кислотой, с получением промежуточного соединения формулы XVI
галоалкил 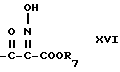 .
.
Это соединение затем может быть обработано альдегидом, таким как альдегид формулы XVII
R3CHO XVII,
и в присутствии гидроокиси аммония, с получением соединения формулы XVIII
которое после восстанавливают, например, треххлористым титаном в присутствии буфера, например, ацетата натрия, с получением соединения формулы II.
Соединения формулы I, в которых X является азотом, могут быть получены сочетанием соединения формулы IIIb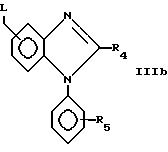
с соединением формулы II или II', как описано выше, для сочетания соединений формулы II и III.
Соединения формул IIIb могут быть получены с использованием известных методов. Например, чтобы получить соединение формулы IIIb, в котором R4 является галоидалкилом, сначала соединение формулы XIX: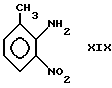
подвергают взаимодействию с соединением формулы XX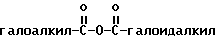 XX,
XX,
(например, CF3-C-O-C-CF3) в растворителях, например, диоксане и пиридине, с получением промежуточного соединения формулы XXI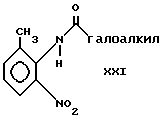
Соединение формулы XXI может быть обработано восстановителем, таким как цинк, в присутствии кислоты, такой как серная кислота, в растворителе, например воде и метаноле, с получением соединения формулы XXII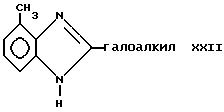
Соединение формулы XXII после этого может быть обработано как соединения IX, XI, XII, XIII и XIV выше для получения соответствующих соединений формулы I.
Соединения формулы IIIb, в которых R4 является галогеном, например атомом фтора или брома, могут быть получены обработкой соединения формулы IX азотзащитной группой, например (CH3)3CH2-CH2-OCH2Cl в присутствии основания, например гидрида натрия, и в растворителе, например тетрагидрофуране, чтобы получить, например, соединение формулы XXIII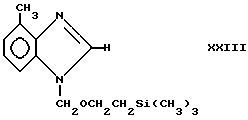
Соединение формулы XXIII обрабатывают затем основанием, таким как н-бутиллитий, с последующей обработкой простым эфиром формулы XXIV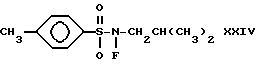
(получен, как описано W.E. Barnette, J. Amer. Chem. Soc., т. 106, с. 452 - 454 (1984) для промежуточных соединений, в которых R4 является атомом фтора, или N-бромсукцинимидом, R4 является атомом брома, чтобы получить соответствующие промежуточные соединения формулы XXVa
и формулы XXVb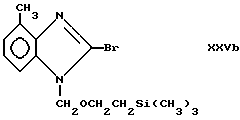
Используя известную технологию, например обработку фтористым н-тетрабутиламмонием в тетрагидрофуране, соединения формул XXVa и XXVb, могут быть превращены в соединения формулы XXVIa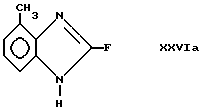
и формулы XXVIb
Полученные таким образом промежуточные соединения после этого могут быть подвергнуты описанной выше обработке для получения соответствующих соединений формулы I.
Полученные соединения формулы I могут быть представлены в общем как соединения формулы I'
или соединения формулы I''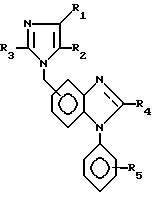
где R1 - R5 имеют определенные для формул I выше значения.
Наиболее предпочтительными являются те соединения формулы I', в которых:
R1 представляет собой водород, галоген или галоидалкил,
R2 представляет собой -CH2-OH,-CHO или -COORII,
R3 представляет собой C2-10-алкил или C/-C10-алкенил,
R4 представляет собой водород или -COOH и
R5 представляет собой орто- тетразол, который может быть замещен R11 или COOR11, или соединения формулы I'', в которых
R1 представляет собой атом водорода, галогена или галоидалкил,
R2 представляет собой - CH2OH, -CHO или - COOR11,
R3 представляет собой C2-C10-алкил или C3-C10-алкил или C3-C10-алкенил,
R4 представляет собой атом водорода, атом галогена (предпочтительно брома или фтора) или галоид алкил (предпочтительно CF3) и
R5 представляет собой орто- тетразол, который может быть замещен R11 или - COOR11.
Настоящие изобретения формулы I ингибируют действие гормона ангиотензина II (A - II) и поэтому полезны в качестве противогипертонических средств.
Действие фермента ренина на ангиотензиноген, псевдоглобулин плазмы крови вызывает продуцирование ангиотензина I. Ангиотензин I превращается в ангиотензин II ферментом, преобразующим ангиотензин II является активным сосудосуживающим веществом, вовлеченным в качестве причинного фактора в различные формы гипертонии у различных видов млекопитающих, например у людей. Соединения согласно изобретению ингибируют действие ангиотензина II на его рецепторах в клетках-мишенях и таким образом предотвращают повышение кровяного давления, вызванного этим взаимодействием гормона с рецепторами. Поэтому введением композиции, содержащей одно из (или сочетание) соединений, согласно изобретению, облегчается положением страдающих обусловленной ангиотензином гипертонией вида млекопитающих (например, людей). Однократная доза или предпочтительно две-четыре дробных дозы на основе 0,1 - 100 мг на 1 кг веса тела в день, предпочтительно от 1 до 15 мг на 1 кг веса тела в день достаточны для снижения кровяного давления. Вещество предпочтительно вводят перрорально, но могут быть также применены внутриносовые, чрезкожные и парентеральные пути введения, такие как подкожные, внутримышечные, внутривенные или внутрибрюшинные. Соединения согласно изобретению полезны также при лечении врожденной сердечной недостаточности и гипертрофии сердца.
Соединения согласно изобретению могут быть также приготовлены в лекарственные формы с диуретиком для лечения гипертонии. Комбинированное средство, содержащее соединение согласно изобретению и диуретик, может быть введено в эффективном количестве, которое составляет общую дневную дозу от 30 до 600 мг, предпочтительно 30 - 330 мг соединения согласно изобретению и от 15 до 300 мг, предпочтительно от 15 до 200 мг диуретика особи млекопитающего, нуждающегося в нем. Примеры диуретиков, рассматривающиеся для использования в сочетании с пептидом согласно изобретению, включают триазидные диуретики, например хлортриазид, гидрохлортриазид, флуметиазид, гидрофлуметиазид, бендрофлуметиазид, метилхлортиазид, трихлорметиазид, политиазид или бензтиазид, а также этакриновая кислота, тикринафен, хлорталидон, фуроземид, музолимин, буметанид, триамтерен, амилорид и спиронолактон и соли таких соединений.
Соединения формулы I могут быть приготовлены в лекарственных формах для использования при снижении кровяного давления в композициях, таких как таблетки, капсулы или эликсиры для перорального введения, в стерильных растворах или суспензиях для парентерального введения или введения в нос или в чрезкожных включениях.
От 10 до 500 мг соединения формулы I смешивают с физиологически приемлемым носителем, наполнителем, разбавителем, связкой, консервантом, стабилизатором, ароматическим веществом и так далее в единую дозированную форму, как диктует приемлемая фармацевтическая практика. Количество активного вещества в этих композициях или препаратах таково, что обеспечивает получение подходящей дозы в указанном интервале.
Настоящее изобретение далее может быть пояснено на следующих примерах.
Пример 1. Двулитиевая соль -5-{/2-бутил-5-(гидроксиметил)-1H-имидазол-1-ил/-метил}-1- (2-карбоксифенил)-1H-индол-2-карбоновой кислоты.
A. Этиловый эфир 2-/(4-метилфенил)-гидразино/-пропановой кислоты.
Пара-толилгидразид (1,2024 г, 9,84 ммоля, 1,0 экв.) смешивали с этиловым эфиром пировиноградной кислоты (1,08 мл, 9,84 ммоля, 1,0 экв) и цеолитом с диаметром пор 3A (3,6 г, 300 мас.%) в хлористом метилене (9,8 мл, 1,0 M) при комнатной температуре. Через 30 мин реакционную смесь фильтровали через безводный сульфат магния, концентрировали и получали соединение, указанное в названии пункта A (2,095 г), которое использовали на следующей стадии без очистки или идентификации.
B. Этиловый эфир 5-метил-1H-индол-2-карбоновой кислоты.
Целевое соединение, полученное на стадии A (2,095 г, 9,51 ммоля, 1,0 экв) растворяли в абсолютном этиловом спирте (9,8 мл, 1 M) и через реакционную смесь барботировали газообразную хлористоводородную кислоту до тех пор, пока в реакционной среде не оставалось исходного материала (45 мин). Затем реакционный раствор концентрировали, растворяли в этилацетате, один раз промывали водным насыщенным бикарбонатом натрия. Затем органическую фазу сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле (60 г), элюируя толуолом с последующим элюированием смесью хлороформ-гексан в отношении 1:4, затем смесью эфир-гексан в отношении 2:3 и получали целевое соединение, указанное в названии стадии B (1,5187 г)
C. Этиловый эфир 2-бромбензойной кислоты.
2-Бромбензойную кислоту (2,005 г, 9,47 ммоля, 1,0 экв) смешивали с йодистым метаном (1,60 мл, 19,9 ммоля, 2,0 экв) и бикарбонатом натрия (1, 68 г, 1 М) и перемешивали при комнатной температуре в общем 4 дня. Затем реакционную смесь разбавляли водой (20 мл) и экстрагировали смесью эфир-гексан в отношении 1: 1, три раза по 20 мл. Объединенные органические экстракты промывали водным 10%-ным бисульфитом натрия (20 мл), водой (20 мл), и водным насыщенным раствором хлористого натрия (20 мл). Затем органические экстракты сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле (50 г), элюируя смесью эфир-гексан в отношении 1:6 и получали указанное в названии стадии C целевое соединение (2,17 г).
D. Этиловый эфир 1-/2-(этоксикарбонил)-фенил/5-метил-1H-индол-2- карбоновой кислоты.
Целевое соединение, полученное на стадии B (603 мг, 2,97 ммоля, 1,0 экв), смешивали с целевым соединением, полученным на стадии C (1,669 г, 7,42 ммоля, 2,5 экв) и окисью меди (I) (424 мг, 2,97 ммоля, 1,0 экв) в пиридине (3,0 мл, 1 М) и нагревали при 130oC в течение 8 ч. Затем реакционную смесь охлаждали, разбавляли этилацетатом, объединяли с более ранними погонами целевого соединения, полученного на этой стадии D, и фильтровали через целит. Фильтрат промывали водой (3 раза по 30 мл), 0,5 н. хлористоводородной кислотой (два раза по 30 мл) и насыщенным водным бикарбонатом натрия (один раз, 30 мл). Затем органический раствор сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле (45 г), элюируя смесью эфир-гексан в отношении 1:8, и получали соединение, указанное в названии стадии D (1,0246 г).
E. Этиловый эфир 5-(бромметил)-1-/2-(этоксикарбонил)-фенил/-1H- индол-2-карбоновой кислоты.
Соединение, полученное на стадии D (1,0084 г, 2,87 ммоля, 1,0 экв), смешивали с N-бромсукцинимидом (531,4 мг, 2,96 ммоля, 1,03 экв) и азобисбутиронитрилом (20,2 мг, 2 вес.%) в четыреххлористом углероде (47,8 мл, 0,06 М) и нагревали при 80oC в течение 2 ч. Затем реакционную смесь охладили до 0oC, фильтровали и концентрировали. Остаток хроматографировали на силикагеле (45 г), элюируя смесью эфир-гексан в отношении 1:8, затем в отношении 1:5 и получали указанное в названии стадии E целевое соединение (1,0524 г).
F. Гидрохлорид этилового эфира пентанимидиновой кислоты
Газообразный хлористый водород барботировали в тарированный раствор валеронитрилов (92,0 г, 1,08 моля) в абсолютном этаноле (64 мл, 1,08 моля) в колбе с круглым дном, емкостью 1 л, охлажденной до 0oC. Колбу периодически взвешивали и газообразный хлористый водород продолжали барботировать до тех пор, пока приращение веса составляло больше 39 г (1,08 моля). Затем смесь закупоривали и хранили при 0oC в течение шести дней. Затем добавляли эфир (650 мл, охлажденный) и смесь хранили при -30oC в течение 24 ч. Полученное твердое вещество собирали на воронке Бюхнера, быстро переносили в большой химический стакан, быстро растирали с холодным эфиром и собирали воронкой Бюхнера. Твердое вещество сушили затем и получали целевое соединение, указанное в названии стадии F, в виде свободно текущего твердого вещества белого цвета (95 г).
G. 2-бутил-4-(гидроксиметил)-имидазол.
Реактор высокого давления Парра, емкостью 300 мл из нержавеющей стали, содержащий димер диоксиацетана (5,0 г, 55 ммолей), охлаждали в ванне с сухим льдом в течение 1 ч.
В процессе охлаждения крышку реактора закрывали и удерживали на месте приложения небольшого вакуума: металлические детали, служащие для удержания крышки на месте под давлением не охлаждались (чтобы облегчить обращение с реактором позднее). Когда реактор был достаточно охлажден, жидкий аммиак конденсировали в трехгорлой колбе, емкостью 250 мл, снабженной холодильником на сухом льде при -78oC. Охлажденный реактор затем открывали заполнением вакуума и добавляли целевое соединение, полученное на стадии Г (9,1 г, 55 ммоля), с последующим немедленным добавлением жидкого аммиака из 250 мл колбы (добавляли приблизительно 55 мл аммиака). Реактор герметизировали соответствующими элементами, удаляли из ванны с сухим льдом и нагревали до комнатной температуры. Затем реактор погружали примерно наполовину в масляную ванну и нагревали до 75oC за 3 ч, в течение которых давление повышалось до 22,5 кг/см2. Нагревание затем прекращали и реактор охлаждали до комнатной температуры. Когда давление падало ниже 7 кг/см2, медленно открывали спускной клапан высокого давления и аммиак испарялся (охлаждение при испарении помогало охлаждению реактора). Когда давление полностью уравновешивалось, реактор открывали и содержимое переносили в обычную колбу, используя ацетонитрил для смывания остатка. Смесь концентрировали в вакууме и остаток очищали испарительной хроматографией на силикагеле (1500 г), элюируя смесью хлороформ-метанол-гидроокись аммония в отношении 80:20:1. Фракции, содержащие основной продукт (Rf = 0,5), объединяли и концентрировали. Затем остаток кристаллизовали из ацетонитрила (200 мл) и получали целевое соединение, указанное в названии стадии G, в виде белого кристаллического вещества (5,74 г), точка плавления 92-93oC.
H. 2-Бутил-1H-имидазол-5-карбоксальдегид.
Целевое соединение, полученное на стадии C (3,0 г, 19,5 ммоля, 1,0 экв), растворяли в пиридине (100 мл, 0,2 М) и нагревали до 100oC. Добавляли окись магния (IV) (20 г, 230 ммолей, 11,8 экв) и реакционную смесь перемешивали при 100oC 1 ч. Затем реакционную смесь фильтровали и концентрировали. Остаток растирали с эфиром и получали целевое соединение, указанное в названии стадии H, (2,0 г), точка плавления 113,5-114,5oC.
I. Этиловый эфир 5-/(2-бутил-5-формил-1H-имидазол-1-ил)метил/- 1-/2-токсикарбонил)-фенил/-1H-индол-2-карбоновой кислоты.
Целевое соединение, полученное на стадии H (207,4 мг, 1,36 ммоля, 1,1 экв), растворяли в тетрагидрофуране (1,03 мл, 1,3 М), охлаждали до 0oC и обрабатывали гексаметилдисилазаном калия (1,90 мл, 1,42 ммоля, 1,15 экв. в 0,75 М толуола). Реакционную смесь перемешивали 10 мин при 0oC, нагревали до комнатной температуры и затем добавляли соединение, полученное на стадии E (533 мг, 1,24 ммоля, 1,0 экв) в тетрагидрофуране (2,0 мл, 0,6 М). Реакционную смесь перемешивали 4 ч., реакцию прекращали насыщенным водным раствором хлористого аммония и три раза экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле (20 г), элюируя смесью толуол-ацетон в отношении 8:1 и получали целевое соединение, указанное в названии стадии j (517 мг).
J. Этиловый эфир 2-{/-бутил-5-(гидроксиметил)-1H-имидазол-1- мл/метил} -1-/2-(этоксикарбонил)-фенил/-1H-индол-2-карбоновой кислоты.
Целевое соединение, полученное на стадии I (517 мг, 1,03 ммоля, 1,0 экв), растворяли в абсолютном этиловом спирте (10,3 мл, 0,1 М), охлаждали до 0oC и обрабатывали боргидридом натрия (38,8 мг, растворенных в 3,9 мл абсолютного этилового спирта, 1,03 ммоля, 1,0 экв). Реакционную смесь перемешивали при 0oC в течение 20 мин, реакцию прекращали 1 н. хлористоводородной кислотой при pH 4,0 и концентрировали. Остаток растворяли в воде и три раза экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле (20 г), элюируя смесью хлороформ-метанол-гидроокись аммония в отношении 30:1, 2:0,05, и получали целевое соединение, указанное в названии стадии J (345 мг).
K. Дилитиевая соль 5-{ /2-бутил-5-(гидроксиметил)-1H-имидазол-1- мл/метил}-1-/2-(карбоксифенил)-1H-индол-2-карбоновой кислоты.
Целевое соединение, полученное на стадии J (345 мг, 0,68 ммолей, 1,0 экв), растворяли в метаноле (5,0 мл, 0,14 М) и обрабатывали водной 1 н. гидроокисью лития (5,0 мл, 5,0 ммолей, 7,3 экв). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч и концентрировали. Остаток растворяли в воде и хроматографировали на HP.20 (20 г), элюируя водой (100 мл), 1%-ным ацетоном в воде (120 мл) 3%-ным ацетоном в воде (120 мл) и 5%-ным ацетоном в воде (120 мл). Смесь концентрировали примерно до объема 50 мл и лиофилизировали. После получения спектров ядерного магнитного резонанса на ядрах углерода и протоне продукт растворяли в воде, фильтровали через поликарбонатную мембрану, лиофилизировали и получали целевое соединение, указанное в названии стадии K (277,4 мг).
Пример 2. Монолитиевая соль 2-/5-{/2-бутил-5-(гидроксиметил)- 1H-имидазол-1-ил/метил}-1H-индол-1-ил/-бензойной кислоты.
A. Этиловый эфир 2-(5-метил-1H-индол-1-ил)-бензойной кислоты.
5-Метилиндол (730,6 мг, 5,57 ммоля, 1,0 экв) смешивали с целевым соединением, полученным на стадии C примера 1 (3,186 г, 13,9 ммоля, 2,5 экв), и окисью меди (I) (797 мг, 5,57 ммоля, 1,0 экв) в пиридине (5,6 мл, 1 М). Реакционную смесь нагревали при 120oC 3 ч, охлаждали до комнатной температуре, разбавляли этилацетатом и фильтровали через целит. Фильтрат два раза промывали водой, два раза водной 1н. хлористоводородной кислотой и один раз водным насыщенным бикарбонатом натрия. Затем органическую фазу сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле (50 г), элюируя смесью гексан-эфир в отношении 40: 1, затем в отношении 20:1 и получали 848 г целевого соединения, полученного на стадии A.
B. Этиловый эфир 2-/3-(или 2,3-ди)-бром-5-(бромметил)-1H-индол- 1-ил/бензойной кислоты.
Целевое соединение, полученное на стадии B примера 1 (834,7 мг, 2,99 ммоля, 1,0 экв), смешивали с N-бромсукцинимидом (1,074 г, 6,04 ммоля, 2,02 экв) и азобисизобутиронитрилом (25,0 мг, 3 вес.%) в четыреххлористом углероде (49,8 мл, 0,06 М) и нагревали при 80oC в течение 2,5 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток растворяли в хлороформе (5 мл) и в смеси эфир-гексан в отношении 1:1 (50 мл), фильтровали и концентрировали. Продукт хроматографировали на силикагеле (50 г), элюируя смесью гексан-эфир в отношении 30:1, затем в отношении 15:1 и получали 747,7 мг смеси дибромированного и трибромированного целевого соединения, указанного в названии стадии B.
C. Этиловый эфир 2/-3-(или 2,3-ди)-бром-5-/2-бутил-5-формил-1H- имидазол-1-ил)-метил/-1H-индол-1-ил/-бензойной кислоты.
Целевое соединение, полученное на стадии H примера 1 (273,7 мг, 1,80 ммоля, 1,15 экв), растворяли в тетрагидрофуране (3,90 мл, 0,46 М) и диметилформамиде (1,30 мл, 1,4 М), охлаждали до 0oC и обрабатывали гексаметилдисилазаном калия (2,68 мл, 1,88 ммоля, 1,2 экв, 0,7 М в толуоле). Реакционную смесь нагревали до комнатной температуры за 15 мин, охлаждали до 0oC и затем добавляли полученную на стадии B настоящего примера смесь соединения (607,1 мг, 1,56 ммоля, 1,0 экв) в тетрагидрофуране (1,56 мл, 1 М). Лед в ледяной бане таял и смесь перемешивали до комнатной температуры в общем три дня. Реакцию прекращали водным насыщенным раствором хлористого аммония (15 мл) и экстрагировали этилацетатом (3 раза по 15 мл). Органические экстракты сушили над сульфатом натрия, фильтровали через сульфат магия и концентрировали. Остаток хроматографировали на силикагеле (35 г), элюируя смесью толуол-ацетон в отношении 14:19, затем в отношении 10:1 и получали 469,2 кг смеси монобромированного и дибромированного целевого соединения, указанного в названии стадии C.
D. Этиловый эфир 2-/3- (или 2,3-ди)-бром-5-{/2-бутил-5- (гидроксиметил)-1H-имидазол-1-ил/метил}-1H-индол-1-ил/бензойной кислоты.
Смесь соединений, полученная на стадии C выше (469,2 мг 1,02 ммоля, 1,0 экв), растворяли в абсолютном этиловом спирте (10,2 мл, 0,1 М) и обрабатывали при комнатной температуре боргидридом натрия (38,6 мг, растворенных в 3,9 мл абсолютного этилового спирта, 1,02 ммоля, 1,0 экв). Реакционную смесь перемешивали при комнатной температуре 1 ч, реакцию прекращали 1н. хлористым водородом до получения кислой среды и концентрировали. Остаток растворяли в воде и экстрагировали три раза этилацетатом. Органические экстракты сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле (18 г), элюируя смесь хлороформметанол-гидроокись аммония в отношении 30:0,8:0,05), затем в отношении 30:1: 0,05, далее в отношении 30:2:0,05 и получали 446,1 мг в смеси монобромированного и дибромированного целевого соединения, полученного на стадии D.
E. Этиловый эфир 2-/5-{ /2-бутил-5-(гидроксиметил)-1H-имидазол-1- ил/метил}-1H-индол-1-ил/бензойной кислоты.
Целевое соединение, полученное на стадии D (420 мг, 0,823 ммоля, 1,0 экв), смешивали с триэтиламином (0,34 мл, 2,47 ммоля, 3,0 экв) и гидроокисью палладия на угле (84 мг, 20 вес.%) в абсолютном этиловом спирте (16,4 мл, 0,05 М) и помещали под баллоном с газообразным водородов при комнатной температуре на 45 мин. Затем реакционную смесь разбавляли этанолом, фильтровали через регенерированную целлюлозу и концентрировали. Остаток хроматографировали на силикагеле (10 г), элюируя смесь гексан-ацетон-гидроокись аммония в отношении 20:10:0,05 и получали целевое соединение на стадии E (321,3 мг).
F. Монолитиевая соль - 2-/5-{/2-бутил-5-(гидроксиметил-)-1H- имидазол-1-ил/метил}-1H-индол-1-ил/-бензойной кислоты.
Целевое соединение, полученное на стадии E (252,7 мг, 0,586 ммоля, 1,0 экв), растворяли в метаноле (1 мл, 0,6 М) и обрабатывали водной 1 н. гидроокисью лития (1,0 мл, 1,0 ммоля, 1,7 экв). Реакционную смесь перемешивали при комнатной температуре три дня и концентрировали. Остатки растворяли в воде и хроматографировали на HP-20, элюировали водой (100 мл), 2%-ным ацетоном в воде (75 мл), 5%-ным ацетоном в воде (75 мл), 10%-ным ацетоном в воде (100 мл) и 20%-ным ацетоном в воде (100 мл). Смесь концентрировали приблизительно до 50 мл и лиофилизировали. После получения спектров ядерного магнитного резонанса на ядрах углерода и водорода продукт растворяли в воде (20 мл), фильтровали через поликарбонатную мембрану, лиофилизировали и получали 184,1 мг целевого соединения, указанного в названной стадии F.
Пример 3. Монолитиевая соль 5-{/2-бутил-5-(гидроксиметил)-1H- имидазол-1-ил/-метил}-1-фенил-1H-индол-2-карбоновой кислоты.
A. Этиловый эфир 5-метил-1-фенил-1H-индол-2-карбоновой кислоты.
Целевое соединение, полученное на стадии B примера I (1,016 г, 5,0 ммолей, 1,0 экв), и бромбензол (1,32 мл, 12,5 ммоля, 2,5 экв) растворяли в пиридине (5 мл, 1 М) и обрабатывали окисью меди (I) (715 мг, 5,0 ммолей, 1,0 экв). Смесь нагревали при 35oC в общей сложности 5,5 ч. Через 2,5 ч от начала нагревания добавляли дополнительный бромбензол (0,4 мл) и окись меди (I) (215 мг). После охлаждения смесь разбавляли этилацетатом и фильтровали через целит. Фильтрат промывали водой (три раза по 5 мл), 0,5 н. хлористоводородной кислотой (два раза по 50 мл) и насыщенным раствором бикарбоната натрия (50 мл), сушили над безводным сульфатом магния и освобождались от растворителя в вакууме. Коричневый остаток хроматографировали на силикагеле, элюируя 10%-ным эфиром в гексане, и получали целевое соединение, указанное в названии стадии A (1,107 г). Тонкослойная хроматография: Rf=0,48, силикагель, смесь гексан-эфир в отношении 3:1.
B. Этиловый эфир 5-(бромфенил)-1-фенил-1H-индол-2-карбоновой кислоты.
Смесь соединений, полученных на стадии A (1,105 г, 3,96 ммоля, 1,0 экв), N-бромсукцинимид (726 мг, 4,08 ммоля, 1,03 экв) и азобисизобутиронитрил (22 мг, 2 вес.%) в четыреххлористом водороде (40 мл, 0,1 М) нагревали в масляной бане при 80 - 90oC в течение 75 мин. Смесь охлаждали до 0oC. Твердое вещество удаляли фильтрацией и промывали холодным четыреххлористым углеродом. Фильтрат выпаривали досуха в вакууме. Остаток хроматографировали на силикагеле, элюируя 10%-ным эфиром в гексане, и получали целевое соединение, указанное в названии стадии B (872 мг). Тонкослойная хроматография: Rf=0,42, силикагель, смесь эфир-гексан в отношении 1:3.
C. Этиловый эфир 5-/(2-бутил-5-формил-1H-имидазол-1-ил)метил/1- фенил-1H-индол-2-карбоновой кислоты.
Имидазольный альдегид, полученный на стадии H примера 1 (105 мг, 0,69 ммоля, 1,15 экв), растворяли в дистиллированном тетрагидрофуране (1,44 мл) и диметилформамиде (0,48 мл, 0,3 М) в атмосфере аргона. Раствор охлаждали на ледяной бане и по каплям к нему добавляли раствор калийгексаметилдисилазана (0,7 н. в толуоле, 1,03 мл, 0,72 ммоля, 1,2 экв). Охлаждающую ванну удаляли и смесь перемешивали 20 мин. После повторного охлаждения в ледяной бане добавляли раствор соединения, полученного на стадии B (215 мг, 0,6 ммоля, 1,0 экв) в тетрагидрофуране (1 мл) и смесь нагревали до комнатной температуры, оставляя на ночь при перемешивании. Реакцию прекращали добавлением насыщенного раствора гидроокиси аммония. Продукт экстрагировали в этилацетат (3 раза по 30 мл). Объединенные экстракты сушили над безводным сульфатом магния и освобождали от растворителя в вакууме. Остаток хроматографировали на силикагеле, элюируя смесью ацетон-толуол в отношении 1:15, затем в отношении 1: 12 и затем 1:10, и получали целевое соединение, указанное в названии стадии C (251 мг). Тонкая хроматография: Rf=0,30, силикагель, смесь ацетон-толуол в отношении 1:4.
D. Этиловый эфир 5-{/2-бутил-5-(оксиметил)-1H-имидазол-1-ил/метил}- 1-фенил-1H-индол-2-карбоновой кислоты.
Соединение, полученное на стадии C (251 мг, 0,58 ммоля, 1,0 экв), растворяли в этаноле (5,8 мол, 0,1 М) и обрабатывали раствором боргидрида натрия (22 мг, 0,58 ммоля, 1,0 экв) в этаноле (2 мл). Реакцию прекращали через 75 мин добавлением 1 н. хлористоводородной кислоты до pH 4,0. Растворитель удаляли в вакууме. Добавляли воду и раствор подщелачивали твердым бикарбонатом натрия. Продукт экстрагировали в этилацетате (три раза по 20 мл), сушили над безводным сульфатом магния и освобождали от растворителя в вакууме. Остаток хроматографировали на силикагеле, элюируя смесью гексан-ацетон в отношении 1: 1, затем в отношении 1:2, содержащей 0,05% гидроокиси аммония, и получали соединение, указанное в названии стадии D (219 мг). Тонкослойная хроматография: Rf= 0,31, силикагель, смесь гексан-ацетон в отношении 1:2, плюс гидроокись аммония.
E. Монолитиевая соль - 5-{ /2-бутил-5-(оксиметил)-1H-имидазол- 1-ил/метил}-1-фенил-1H-индол-2-карбоновой кислоты.
Соединение, полученное на стадии D (218 мг, 0,507 ммоля, 1,0 экв), растворяли в метаноле (2,5 мл) и добавляли 1 н. раствор гидроокиси лития (1,5 мл), вызывающий выпадение осадка. Мутную смесь перемешивали, оставляя на ночь при комнатной температуре. Растворитель удаляли в вакууме. Остаток растворяли в воде и вводили в колонку, упакованную HP-20 (20 мл). Колонку элюировали водой (около 250 мл) до тех пор, пока элюат не становился нейтральным, затем элюировали водой с увеличивающимся содержанием ацетона (100 мл 5%-ного ацетона, 100 мл 10%-ного ацетона и 100 мл 15%-ного ацетона). Продукт элюировали и 10 н. и 15%-ным ацетоном. Фракции объединяли и концентрировали до малого объема в вакууме. После лиофилизации материал использовали для получения спектра ЯМР, выделяли, растворяли в воде, снова лиофилизировали и получали соединение, указанное в названии стадии E (164 мг).
Пример 4. Монолитиевая соль - 2-/4-{/2-бутил-5-(гидроксиметил)- 1H-имидазол-1-ил/метил}-1H-индол-1-ил/-бензойной кислоты.
A. 2-/2-(2-метил-6-нитрофенил)-этилиден/-гидразинкарбоксамид.
3-Нитро-орто-ксилил (1,77 мл, 13,23 ммоля, 1,0 экв) смешивали с диметилацеталем диметилформамида (2,11 мл, 15,88 ммоля, 1,2 экв), диметилформамидом (7,35 мл, 1,8 М) и пирролидином (1,352 мл, 15,88 ммоля, 1,2 экв) и нагревали до 110oC в течение 8 ч. Реакционную смесь затем охлаждали до комнатной температуры и концентрировали. Остаток растворяли в диэтилформамиде (7,35 мл, 1,8 М) и обрабатывали при комнатной температуре раствором гидрохлорида семикарбазида (1,55 г, 13,79 ммоля, 1,05 экв) в концентрированной хлористоводородной кислоте (1,2 мл, 14,55 ммоля, 1,1 экв) в воде (16,5 мл, 0,8 М). Смесь перемешивали при комнатной температуре 30 мин, охлаждали до 0oC и фильтровали. Остаток промывали водой (30 мл), холодным этанолом (15 мл) и этиловым эфиром (25 мл), затем сушили в вакууме и получали соединение, указанное в названии стадии A (2,44 г).
B. 4-метил-1H-индол.
Соединение, полученное на стадии A (206,6 мг, 0,875 ммоля, 1,0 экв), смешивали с этанолом (1,75 мл, 0,5 М) и 10%-ным палладием на угле (41,3 мг, 20 вес.%) и помещали в вибратор Парра в атмосфере водорода (4,2 кг/см2) на 5 ч. Затем реакционную смесь разбавляли метанолом, фильтровали через регенерированную целлюлозу и концентрировали. Остаток хроматографировали на силикагеле Merck (5 г), элюируя смесь хлороформ-гексан в отношении 4:1, затем в отношении 3: 1 и получали соединение, указанное в названии стадии B (101,7 мг).
C. Этиловый эфир 2-(4-метил-1H-индол-1-ил)-бензойной кислоты.
Соединение, полученное на стадии B (101,5 мг, 0,774 ммоля, 1,0 экв), смешивали с орто- бромэтилбензоатом (443 мг, 1,93 ммоля, 2,5 экв) (как получено в примере I, соединение на стадии C) и окисью меди (I) (132,9 мг, 0,928 ммоля, 1,2 экв) в пиридине (0,77 мл 1М) и нагревали при 130oC в течение 2 ч. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Фильтрат два раза промывали водой, два раза 1 н. хлористоводородной кислотой и один раз насыщенным водным кислым карбонатом натрия. Затем раствор сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле (10 г), элюируя смесью толуол-гексан в отношении 1 : 2, затем смесью эфир-гексан в отношении 1 : 10. Продукт снова хроматографировали на силикагеле Merck (10 г), элюируя смесью эфир-гексан в отношении 1 : 40, затем в отношении 1 : 10 и получали целевое соединение, указанное в названии стадии C (154 мг).
D. Этиловый эфир 2-/3-(или 2,3-ди)-бром-4-(бромметил)-1H-индол-1-ил/бензойной кислоты.
Соединение, полученное на стадии C (146,8 мг, 0,526 ммоля, 1,0 экв), смешивали с N-бромсукцинидом (188,9 мг, 1,06 ммоля, 2,02 экв) и азобисизобутиронитрилом (4,4 мг), 3 вес.%, поставленным Chemical Dynomics Corp, в четыреххлористом углероде (8,8 мл, 0,06 М) и нагревали при 60oC в течение 30 мин. Капелька смеси в это время показывала отрицательную реакцию крахмала на йодистый калий. Реакционную смесь охлаждали затем до 0oC, фильтровали и концентрировали. Остаток хроматографировали на силикагеле Merck (10 г), элюируя смесью эфир-гексан в отношении 1 : 40, затем в отношении 1 : 10 и получали целевое соединение, указанное в названии стадии B, (112,7 мг) в виде смеси ди- и трибромидов.
E. Этиловый эфир 2-/3-(или 2,3-ди)-бром-4-/(2-бутил-5-формил-1H-имидазол-1-ил)-метил/-1H-индол-1- ил/бензойной кислоты.
Соединение, полученное на стадии D (112,7 мг, 0,258 ммоля, 1,0 экв), смешивали с соединением, полученным на стадии H примера 1 (43,2 мг, 0,284 ммоля, 1,1 экв), и растворяли в трет-бутаноле (0,52 мл, 0,5 М) и тетрагидрофуране (0,26 мл, 1М). Затем раствор обрабатывали трет-бутилатом калия (36,5 мг, 0,309 ммоля, 1,2 экв) и перемешивали при комнатной температуре 4 ч. Добавляли еще трет-бутанол (0,26 мл) и реакционную смесь нагревали при 60oC в течение 30 мин. Раствор охлаждали до комнатной температуры, реакцию прекращали насыщенным водным раствором хлористого аммония и водой и три раза экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле Merck (5 г), элюируя смесью толуол-ацетон в отношении 12 : 1 и получали соединение, указанное в названии стадии E (128 мг).
F. Этиловый эфир 2-/3-(или 2,3-ди)-бром-4-{/2-бутил-5- (гидроксиметил)-1H-имидазол-1-ил-/метил}-1H-индол-1-ил/бензойной кислоты.
Соединение, полученное на стадии E (123,3 мг, 0,242 ммоля, 1,0 экв), растворяли в этаноле (2,4 мг, 0,1 М) и обрабатывали при комнатной температуре боргидридом натрия (9,2 мг, 0,242 ммоля, 1,0 экв), растворенным в этаноле (0,95 мл). Реакционную смесь перемешивали при комнатной температуре 1ч, реакцию прекращали 1 н. хлористоводородной кислотой и концентрировали. К остатку добавляли насыщенный водный бикарбонат натрия и водную смесь три раза экстрагировали этилацетатом. Органические экстракты фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле Merck (5 г), элюируя смесью хлороформ-метанол-гидроокись аммония в отношении 30 : 0,8 : 0,05, и получали соединение, указанное в названии стадии F (125,2 мг).
G. Этиловый эфир 2-/4-{/2-бутил-5-(гидроксиметил)-1H- имидазол-1-ил-/метил}-1H-индол-1-ил/бензойной кислоты.
Соединение, полученное на стадии F (117,4 мг, 0,230 ммолей, 1,0 экв), смешивали с гидроокисью палладия на угле (23,5 мг, 20 вес.%), триэтиламином (0,10 мл, 0,690 ммолей, 3,0 экв) и этанолом (4,6 мл, 0,05 М) и помещали под баллоном с газообразным водородом на 45 мин. Затем реакционную смесь разбавляли этанолом, фильтровали через регенерированную целлюлозу и концентрировали. Остаток хроматографировали на силикагеле Merck (5 г), элюируя смесью хлороформ-метанол-гидроокись аммония в отношении 30 : 0,7 : 0,05, и получали соединение, указанное в названии стадии O (65,2 мг).
H. Монолитиевая соль 2-/4-{/2-бутил-5-(гидроксиметил)-1H-имидазол- 1-ил-/метил}-1H-индол-1-ил/бензойной кислоты.
Соединение, полученное на стадии G (65,2 мг, 0,151 ммоля, 1,0 экв), растворяли в этаноле (1 мг) и водной 1 н. и гидроокиси лития (1 мл). Реакционную смесь перемешивали при комнатной температуре три дня и концентрировали. Остаток хроматографировали на HP-20 йонообменной смоле (10 г), элюируя водой (100 мл), 5%-ным ацетном в воде (80 мл), 10%-ным ацетоном в воде (80 мл), 20%-ным ацетоном в воде (80 мл) и 35%-ным ацетоном в воде (80 мл). Собирали продукт, элюированный водным ацетоном с содержанием 10 - 35%. Фракции концентрировали примерно до объема 25 мл и лиофилизировали. После получения спектров ЯМР продукт растворяли в воде (15 мл), фильтровали через поликарбонатную мембрану, лиофилизировали и получали целевое соединение (64,7 мг), указанное в названии стадии H.
Пример 5. Дилитиевая соль-5-{/2-бутил-4-хлор-5-(гидроксиметил)- 1H-имидазол-1-ил-/метил} -1-/2-(1H-тетразол-5-ил)-фенил/-2H-индол- 2-карбоновой кислоты.
A. Этиловый эфир 1-(2-цианофенил)-5-метил-1H-индол-2-карбоновой кислоты.
Смесь соединения, полученного на стадии B примера 1 (2,027 г, 9,975 ммоля, 1,0 экв), полученного, как описано на стадии B примера 1, порошкообразный карбонат калия (2,76 г, 19,95 ммоля, 2,0 экв), 2-фторбензонитрил (2,71 мл, 24,9 ммоля, 2,5 экв) и 18-краун-6 (263 мг, 0,99 ммоля, 0,1 экв) в диметилформамиде (20 мл, 0,5 М) перемешивали и нагревали в масляной бане, поддерживая температуру 150 ± 5oC. Через 3,5 ч добавляли дополнительный 2-фторбензонитрил (1,1 мл, 9,975 ммоля, 1,0 экв) и 18-краун (263 мг, 0,1 экв) через 18 ч. После нагревания в течение 28 ч смесь охлаждали, разбавляли водой и экстрагировали смесью эфир-гексан в отношении 1 : 1 (3 раза по 100 мл). Объединенные экстракты промывали один раз водой, один раз насыщенным раствором хлористого натрия, сушили над безводным сульфатом магния и удаляли растворитель в вакууме. Продукт очищали хроматографией на силикагеле (150 г), вымывали подвижные примеси смесью толуол-гексан в отношении 2 : 1, затем желаемый продукт элюировали толуол-гексан в отношении 2 : 1, затем желаемый продукт элюировали толуолом и получали указанное в названии стадии A целевое соединение (1,88 г). Тонкослойная хроматография : Rf = 0,41, силикагель, 5%-ный этилацетат в толуоле, УФ.
B. Этиловый эфир 5-(бромметил)-1-(2-цианофенил)-1H-индол-2- карбоновой кислоты.
Соединение, полученное на стадии A (1,88 г, 6,17 ммоля, 1,0 экв), растворяли в четыреххлористом углероде (62 мл, 0,1 М), и обрабатывали N-бромсукцинимидом (1,13 г, 6,36 ммоля, 1,03 экв) и азобисизобутиронитрилом (38 мг, 2 мас. %, поставляется Chemical Dynamics Corp.). Смесь нагревали с обратным холодильником 5 ч. Капелька смеси показывала отрицательную реакцию в тесте крахмал-йодистый калий к этому времени. После охлаждения в ледяной бане твердое вещество удаляли фильтрацией и промывали холодным четыреххлористым углеродом. Фильтрат выпаривали досуха в вакууме. Остаток хроматографировали на силикагеле (180 г). Подвижные примеси элюировали 5%-ным ацетоном в гексане. Желаемое бромистое соединение затем элюировали 10%-ным ацетоном в гексане и получали целевое соединение, указанное в названии стадии B (1,54г). Тонкослойная хроматография: Rf = 0,29, силикагель, 20%-ный ацетон в гексане, УФ.
C. 2-бутил-4-хлор-5-формилимизаол.
Раствор соединения, полученного на стадии C примера 1 (6,15 г, 39,9 ммоля), в смеси абсолютного этилового спирта (40 мл) и тетрагидрофурана (80 мл), охлаждали в ледяной бане. К охлажденному раствору добавляли N-хлорсукцинимид (5,9 г, 44,4 ммоля) небольшими порциями в течение 60 мин. Полученную смесь перемешивали 30 мин в ледяной бане, затем 30 мин при 25oC, после чего реакция йодистого калия на крахмал была отрицательной. Смесь концентрировали в вакууме и получали остаток, который растирали с эфиром (400 мл) и получали твердое коричневое вещество. Маточный раствор от растирания концентрировали и остаток снова растирали с эфиром (40 мл) и получали еще некоторое количество твердого коричневого вещества. Твердые вещества смешивали, растворяли в пиридине (200 мл) и нагревали до 100oC. К теплому раствору добавляли двуокись марганца (20 г) и полученную темную смесь перемешивали при 100oC 1 ч. Горячий раствор фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (500 г), элюируя смесью гексанэтилацетат в отношении 3:1, и получали основной продукт, имеющий Rf 0,4. Продукт растирали с петролейным эфиром и получали целевое соединение, указанное в названии стадии C, в виде белого кристаллического вещества (3,9 г), точка плавления 96-97oC.
D. Этиловый эфир 5-/2-бутил-4-хлор-5-формил-1H-имидазол-1- ил)-метил/-1-(2-цианофенил)-1H-индол-2-карбоновой кислоты.
Раствор соединения, полученного на стадии B (1,16 г, 3,026 ммоля, 1,0 экв), и соединения, полученного на стадии C (621 мг, 3,33 ммоля, 1,1 экв) в диметилформамиде (15,1 мл, 0,2M) в атмосфере аргона, обрабатывали трет-бутилатом калия (462 мг, 3,78 ммоля, 1,25 экв) и 18-крауном-6 (160 мг, 0,6 ммоля, 0,2 экв) и смесь перемешивали при комнатной температуре 27 ч). Реакцию гасили насыщенным раствором хлористого аммония и разбавляли водой. Продукт экстрагировали в этилацетат (3 раза по 50 мл), сушили над безводным сульфатом магния и растворитель удаляли в вакууме. Остаток хроматографировали на силикагеле (120 г). Непрореагировавший исходный имидазольный материал вымывали 10%-ным ацетоном в гексане. Желаемый продукт элюировали 20%-ным ацетоном в гексане и получали соединение, указанное в названии стадии D (815 мг). Тонкослойная хроматография: Rf = 0,34, силикагель, 30%-ный ацетон в гексане, УФ.
E. Этиловый эфир 5-{/2-бутил-4-хлор-5-(гидроксиметил)-1H- имидазол-1-ил/-метил}-1-(2-цианофенил)-1H-индол-2-карбоновой кислоты.
Соединение, полученной на стадии D (815 мг, 1,67 ммоля, 1,0 экв) растворяли в этаноле (17 мл, 0,1M) и обрабатывали раствором боргидрида натрия (63 мг, 1,67 ммоля, 1,0 экв в этаноле (5 мл). Смесь перемешивали при комнатной температуре 1 ч, затем подкисляли до pH 4,0 с помощью 1н. хлористоводородной кислоты и перемешивали при комнатной температуре 30 мин. Растворитель удаляли в вакууме. Добавляли расплавленный бикарбонат натрия и продукт экстрагировали в этилацетат (три раза по 50 мл). Объединенные органические экстракты сушили над безводным сульфатом магния и растворитель удаляли в вакууме. Остаток хроматографировали на силикагеле (70 г). Менее полярные примеси вымывали смесью эфир-гексан в отношении 1:1, затем в отношении 2:1. Желаемый спирт элюировали эфиром и получали соединение, указанное в названии стадии E, (569 мг). Тонкослойная хроматография Rf = 0,48, силикагель, этиловый эфир, УФ.
F. Этиловый эфир 5-{/2-бутил-4-хлор-5-(гидроксиметил)-1H- имидазол-1-ил/-метил}-1-/2-(2-тетразол-5-ил)-фенил/ 1H-индол-2-карбоновой кислоты.
Соединение, полученное на стадии F (72,2 мг, 0,1429 ммоля, 1,0 экв) и азид трибутилолова (71,2 мг, 0,214 ммоля, 1,5 экв) растворяли в ксилоле (1,4 мл, 0,1M) и нагревали в масляной бане, поддерживая температуру 140-150oC. Через 6 ч добавляли дополнительный азид трибутилолова (47,5 мг, 0,1429 ммоля, 1,0 экв) и нагревание продолжали в общей сложности 12 ч. После охлаждения растворитель удаляли в вакууме, и остаток хроматографировали на силикагеле (13 г), элюируя 3%-ным метанолом в дихлорметане, содержащем 0,2% уксусной кислоты, затем 5%-ным метанолом в дихлорметане с 0,2% уксусной кислоты и получали соединение, указанное в названии стадии F, (55 мг). Тонкослойная хроматография: Rf = 0,28, силикагель, 7%-ный метанол в дихлорметане, содержащий уксусную кислоту (две капли на 10 мл, УФ).
G. Дилитиевая соль-5-{/2-бутил--4-хлор-5-(гидроксиметил)-1H- имидазол-1-ил/-метил}-1-/2-(1H-тетразол-5-ил)-фенил-2H-индол- 2-карбоновой кислоты.
Соединение, полученное на стадии F (55 мг, 0,102 ммоля, 1,0 экв), растворяли в метаноле (1 мл) и обрабатывали 1 н. раствором гидроокиси лития (1 мл). Смесь перемешивали при комнатной температуре 20 ч. Растворитель удаляли в вакууме. Остаток объединяли с остатком, полученным от аналогичной реакции, проведенной с 0,04 ммолями упомянутого соединения, очищали на колонке, набитой 12 мл ионообменной смолы HP-20. Сначала колонку элюировали водой, затем 20%-ным ацетоном в воде. Желаемый продукт, который начинал вымываться после примерно 50 мл воды, пропускали через колонку и элюирование ускоряли добавкой и ацетона. Фракции, содержащие желаемый продукт, собирали, концентрировали до небольшого объема и лиофилизировали. Продукт использовали для получения спектров ЯМР, выделяли, растворяли в воде (10 мл), пропускали через поликарбонатный фильтр, повторно лиофилизировали и получали соединение, указанное в названии стадии (55 мг).
Пример 6. Этиловый эфир, мононатриевая соль 5-{/2-бутил-4-хлор- 5-(гидроксиметил)-1H-индол-имидазол-1-ил/-метил} -1-/2-(2H-тетразол- 5-ил)-фенил/-1H-индол-2-карбоновой кислоты.
Соединение, полученное на стадии F примера 5 (82 мг, 0,158 ммоля, 1,0 экв), растворяли в метаноле (5 мл) и обрабатывали 1н. раствором бикарбоната натрия (0,31 мл, 2,0 экв). Смесь перемешивали несколько минут при комнатной температуре, затем выпаривали досуха в вакууме. Остаток выводили в колонку, упакованную ионообменной смолой HP-20 (10 мл). Колонку элюировали сначала водой, затем все возрастающими количествами ацетона в воде с 5%-ным приращениями. Продукт реакции элюировали 15- и 20%-ным ацетоном в воде. Фракции, содержащие желаемый продукт, объединяли и лиофилизировали. Продукт использовали для получения спектра ЯМР, выделяли, растворяли в воде (10 мл), пропускали через поликарбонатную мембрану, снова лиофилизировали и получали соединение, указанное в названии примера (63,5 мг).
Пример 7. Монолитиевая соль 2-бутил-4-хлор-1-{/1-/2-(2H- тетразол-5-ил)-фенил)-1H-индол-4-ил}-метил/-1H-имидазол-5- метанола.
A. 1-(2-циклофенил)-4-метил-1H-индол.
Соединение, полученное на стадии B примера 4 (1,042 г, 7,94 ммоля, 1,0 экв), объединяли с фторбензонитрилом (1,29 мл, 11,9 ммоля, 1,5 экв) и карбонатом калия (2,195 г, 15,88 ммоля, 2,0 экв) в диметилформамиде (7,94 мл, 1M) и нагревали при 150oC 4 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и три раза экстрагировали этилацетатом. Органические экстракты промывали водой и водным насыщенным хлористым натрием, сушили над сульфатом магния и концентрировали. Остаток хроматографировали на силикагеле Merck (50 г), элюируя смесью хлороформ-гексан в отношении 1:3, затем в отношении 1:1 и получали соединение, указанное в названии стадии A (1,57 г).
B. 2-/3-( или 2,3-ди)-бром-4-(бромметил)-1H-индол-1-ил/ бензонитрил.
N-бромсукцинимид (3,615 г, 20,11 ммоля, 3,0 экв) добавляли к раствору соединения, полученного на стадии A (1,557 г, 6,70 ммоля, 1,0 экв) в четыреххлористом углероде (134 мл, 0,05M) и бензоле (26,8 мл, 0,25 M) и реакционную смесь помещали вблизи яркой лампы при комнатной температуре на 3 ч. Затем смесь разбавляли хлороформом (134 мл, 0,05 M охлаждали до 0oC, фильтровали и концентрировали. Остаток хроматографировали на силикагеле Merck (100 г), элюируя смесью гексанхлороформ в отношении 1:1, затем 2:3 в отношении 1:2 и получали соединение, указанное в названии стадии B (2,268 г).
C. 2-/3-( или 2,3-ди)-бром-4-/(2-бутил-4-хлор-5-формил- 1H-имидазол-1-ил)-метил/-1H-индол-1-ил/-бензонитрил.
Соединение, полученное на стадии B (2,268 г, 4,84 ммоля, 1,0 экв), смешивали с соединением, полученным на стадии C примера 5 (993 мг, 5,32 ммоля, 1,1 экв), и растворяли в трет-бутаноле (9,7 мл, 0,5 M) и диметилформамиде (9,7 мл, 0,5 M). Затем раствор обрабатывали трет-бутилатом калия (671 мг, 5,80 ммоля, 1,2 экв) и нагревали при 60oC в течение 90 мин. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли водой (40 мл) и экстрагировали этилацетатом (три раза по 30 мл). Органические экстракты промывали водой (20 мл) и водным насыщенным хлористым натрием (20 мл), сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле Merck (100 г), элюируя смесью толуол-этилацетат в отношении 25:1, и получали соединение, указанное в названии стадии C (1,865 г).
D. 2-/3-( или 2,3-ди)-бром-4-{/2-бутил-4-хлор-5 (гидроксиметил)-1H-имидазол-1-ил/-метил}-1H-индол-1-ил/бензонитрил.
Соединение, полученное на стадии C (1,65 г, 3,24 ммоля, 1,0 экв), растворяли в этаноле (32,4 мл, 0,1 M) и обрабатывали при комнатной температуре боргидридом натрия (124 мг, 3,24 ммоля, 1,0 экв), растворяли в этаноле (32,4 мл, 0,1M) и обрабатывали при комнатной температуре боргидридом натрия (124 мг, 3,24 ммоля, 1,0 экв), растворенным в этаноле (12,4 мл). Реакционную смесь перемешивали при комнатной температуре 1 ч, реакцию гасили 1н. хлористоводородной кислотой и концентрировали. К остатку добавляли насыщенный водный бикарбонат натрия в воду и водную смесь три раза экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия, фильтровали через сульфат магния и концентрировали. Остаток хроматографировали на силикагеле Merck (50 г), элюируя смесью хлороформ-эфир в отношении 10:1, затем 5:1 и получали соединение, указанное в названии стадии D (1,638 г).
E. 2-/4-{ /2-бутил-4-хлор-5-(гидроксиметил)-1H-имидазол-1- ил/-метил}-1H-индол-1-ил/-бензонитрил.
Соединение, полученное на стадии D (1,638 г, 2,84 ммоля, 1,0 экв), смешивали с гидроокисью палладия на угле (328 мг, 20 мас.%), триэтиламином (1,19 мл, 8,52 ммоля, 3,0 экв) и этанолом (56,8 мл, 0,05 M) и помещали под баллоном с газообразным водородом на 45 мин. Затем реакционную смесь разбавляли метанолом (60 мл), фильтровали через регенерированную целлюлозу и концентрировали. Остаток хроматографировали на силикагеле Merck (35 г), элюируя смесью хлороформ-этилацетат в отношении 4:1, и получали целевое соединение, указанное в названии стадии E (1,188 г).
F. 2-бутил-4-хлор-1-{/2-(2H-тетразол-5-ил)-фенил/-1H-индол- 4-ил/-метил} -1H-имидазол-5-метанол.
Соединение, полученное на стадии E (1,119 г, 2,67 ммоля, 1,0 экв) и азид трибутилолова (2,218 г, 6,68 ммоля, 2,5 экв), растворяли в ксилоле (10,7 мл, 0,25 M) и нагревали при 150oC в течение 5 ч. Затем реакционную смесь нагревали до комнатной температуры и концентрировали. Остаток хроматографировали на силикагеле Mercr (75 г), элюируя смесью хлороформ-метанол-уксусная кислота в отношении 30:1,5:0,05, затем в отношении 30:3:0,05 и получали целевое соединение, указанное в названии стадии F (940 мг).
G. Монолитиевая соль 2-бутил-4-хлор-1-{/1-/2-(2H-тетразол-5-ил)-фенил-/1H-индол-4-ил}-метил/ -1H-имидазол-5-метанола.
Соединение, полученное на стадии F (940 мг, 2,03 ммоля, 1,0 экв), растворяли в метаноле (10 мл, 0,2 M) и водной 1н гидроокиси лития (10 мл, 0,2 М). Реакционную смесь перемешивали при комнатной температуре 30 мин и концентрировали. Остаток хроматографировали на ионообменной смоле НР-20(50 г), элюируя водой (400 мл), 5%-ным ацетоном в воде (400 мл), 10%-ный ацетоном в воде (400 мл), 20%-ным ацетоном в воде (400 мл) и 30%-ным ацетоном в воде (400 мл). Продукт элюирован 20-30%-ным ацетоном. Фракции концентрировали до объема приблизительно 50 мл и лиофилизировали. После получения спектров ЯМР продукт растворяли в воде (50 мл), фильтровали через поликарбонатную мембрану, лиофилизировали и получали целевое соединение (708 мг).
Пример 8. Монолитиевая соль 2-бутил-4-хлор-1-{1-/2-(2H-тетразол-5-ил)-фенил/-1H-бензимидазол-4-ил}-метил/ -1H-имидазол-5-метанола.
A. 4-Метил-1H-бензимидазол.
2,3-диаминотолуол (675 мг, 5,53 ммоля) растворяли в 10 мл сухого тетрагидрофурана и добавляли триэтиламин (0,77 мл, 5,53 ммоля). Смесь охлаждали до 0oC и добавляли 1,1-дихлорметил-метиловый эфир (0,50 мл, 5,33 моля) и реакционную смесь нагревали до комнатной температуры. Через 20 ч реакцию прекращали бикарбонатом натрия. Водную фазу экстрагировали этилацетатом, сушили над сульфатом магния, фильтровали, растворитель удаляли и получали 730 мг целевого соединения A в виде коричневого твердого вещества, которое использовали на следующей стадии без очистки.
B. 2-(4-метил-1H-бензимидазол-1-ил)-бензонитрил.
Соединение, полученное на стадии A (133 мг, 1,01 ммоля) 2-фторбензонитрил (164 мкл, 1,51 ммоля), и тонкодисперсный карбонат калия (279 мг, 2,02 ммоля) смешивали в 1 мл N,N-диметилформамида и нагревали до 80oC. После перемешивания в течение 20 ч диметилформамид удаляли в вакууме и коричневый твердый остаток распределяли между бикарбонатом натрия и этилацетатом. Водную фазу экстрагировали этилацетатом и объединенные органические экстракты сушили над сульфатом магния, фильтровали и растворитель удаляли. Остаток очищали тонкослойной хроматографией (20 мг силикагеля, элюатом служил 50%-ный этилацетат, гексан) и получали 160 мг целевого соединения в виде белого твердого вещества.
C. 2-/4-(бромметил)-1H-бензимидазол-1-ил/ бензонитрил.
Соединение, полученное на стадии B (71 мл, 0,30 ммоля), растворяли в 5 мл и 50%-ного четыреххлористого углерода и бензола. Добавляли азобисизобутиронитрил (10 мг, 0,06 ммоля) N-бромсукцинимид (65 мг, 0,36 ммоля) и смесь нагревали до 75oC за 4 ч. Растворитель удаляли и остаток очищали тонкослойной хроматографией (20 г силикагеля, элюат - 10%-ный ацетон в тоулоле) и получали 79 мг целевого соединения, указанного в названии стадии C в виде твердого белого вещества, точка плавления 135oC (разлагается).
D. 2-{4/(2-бутил-4-хлор-5-формил-1H-имидазол-1-ил)-метил/-1H- бензимидазол-1-ил}-бензонитрил.
Соединение, полученное на стадии C (1,296 г, 4,15 ммоля) и 2-бутил-4-хлор-1H-имидазол-5-карбоксальдегид (949 мг, 4,15 ммоля) (получен на стадии C примера 5), растворяли в атмосфере аргона в 20 мл дихлорметана. Добавляли 1,8-диазабицикло-(5,4,0)-ундец-7-ен (0,621 мл, 4,15 ммоля) и реакционную смесь перемешивали 15 ч при комнатной температуре. Затем растворитель удаляли в вакууме и оставшееся оранжевое масло очищали тонкослойной хроматографией (145 г силикагеля, 10%-ный ацетон в толуоле) и получали 1,0563 г целевого соединения D в виде желтого твердого вещества, точка плавления 117-135oC.
E. 2-/4-{/2-бутил-4-хлор-5-(гидроксиметил-1H-имидазол-1-ил/метил}-1H -бензимидазол-1-ил/-бензонитрил.
Соединение, полученное на стадии D (757 мг, 1,81 ммоля), суспендировали в 8 мл этанола и добавляли боргидрид натрия (69 мг, 1,81 ммоля). Реакционную смесь перемешивали при комнатной температуре 50 мин, за это время твердое вещество растворялось. Этанол удаляли и остаток (желтое масло) распределяли между этилацетатом и 1н. гидроокисью натрия. Водную фазу экстрагировали этилацетатом и объединенные органические экстракты сушили над сульфатом магния, фильтровали и растворитель удаляли. Остаток очищали тонкослойной хроматографией (110 г силикагеля, 7%-ный изопропанол в толуоле) и получали 675 г целевого соединения E в виде белого твердого вещества.
F. Соединение, полученное на стадии E (600 мг, 1,42 ммоля) и азид трибутилолова (949 мг, 2,86 ммоля), растворяли в 4 мл ксилола под аргоном и нагревали до 110oC за 20 ч. Ксилол удаляли в вакууме и получали коричневое масло, которое очищали тонкослойной хроматографией (165 г силикагеля, 5% уксусной кислоты, 5% метанола, 50% толуола, 40% этилацетата) и получали масло с нарастворимым белым осадком. Этот остаток растворяли в метаноле, фильтровали и получали 494 мг коричневого масла. Масло растворяли в 2 мл 1н. гидроокиси лития и очищали колоночной хроматографией (100 мл ионообменной смолы HP-20, элюированной каждый раз 100 мл воды с последующим приращением по 5% ацетона до 45% ацетона) и получали 255 мг целевого соединения в виде рыхлого белого вещества с температурой плавления 240-270oC.
Пример 9. Дилитиевая соль 2-бутил-4-хлор-1-{ /1-/2-(2H-тетразол-5-ил)фенил-/1H-индол-4-ил}-метил/ -1H-имидазол-5-карбоновой кислоты
A. 2-/2,3-дибром-4-(бромметил)-1H-индол-1-ил/бензонитрил.
К 2-(4-метил-1H-индол-1-ил)-бензонитрилу (2,323 г, 0,01 моля, 1,0 экв) (получен как соединение на стадии A примера 7) в 200 мл четыреххлористого углерода и 40 мл бензола при комнатной температуре добавляли N-бромсукцинимид (5,340 г, 0,03 моля, 3,0 экв) и помещали вблизи яркой лампы. Смесь перемешивали при комнатной температуре в общем 5 ч. На третьем и на четвертом часу добавляли дополнительный N-бромсукционимид (0,534 г, 0,003 ммоля, 0,3 экв и 0,277 г, 0,0015 ммоля, 0,15 экв соответственно). Добавляли хлористый метилен (200 мл) и реакционную смесь охлаждали до 0oC и фильтровали. Фильтрат концентрировали, остаток хроматографировали на силикагеле, элюируя смесью гексан-хлористый метилен в отношении 1:1, и получали соединение, указанное в названии стадии A (3,28 г). Тонкослойная хроматография : Rf = 0,65, толуол-этилацетат в отношении 10:1 УФ.
B. 2-{ 2,3-дибром-4-/(2-бутил-4-хлор-5-формил-1H-индол-1-ил)-метил /-1H-индол-1-ил}-бензонитрил.
К раствору 2-бутил-4-хлор-1H-имидазол-5-карбоксальдегида (679 мг, 3,636 ммоля, 1,1 экв) (получен на стадии C примера 5) в смеси трет-бутоксид-диметилформамид (в отношении 1: 1, 13,2 мл, 0,25 M) добавляли трет-бутилат калия (445 мг, 3,966 ммоля, 1,2 экв) и смесь перемешивали при комнатной температуре 25 мин. Затем добавляли твердое вещество, полученное на стадии A (1550 мг, 3,305 ммоля, 1,0 экв). После перемешивания при комнатной температуре в течение 5 ч смесь добавляли в 30 мл воды и экстрагировали хлористым метиленом (30 мл три раза). Экстракты промывали водой (10 мл) и насыщенным хлористым натрием, сушили над сульфатом магния, фильтровали и концентрировали. Остаток хроматографировали на силикагеле, элюируя смесью метиленхлорид-этилазетат в отношении 100:1, и получали целевое соединение, указанное в названии стадии B (1335 мг). Тонкослойная хроматография: Rf = 0,4, смесь толуол-этилацетат в отношении 10:1, УФ.
C. 2-Бутил 24-хлор-1-{ (2-цианофенил)-1H-индол-4-ил/ метил}-1H-имидазол-5-карбоновая кислота.
К соединению, полученному на стадии B (1455 мг, 2,532 ммоля, 1,0 экв), и сульфаминовой кислоте (860 мг, 8,862 ммоля, 3,5 экв) в тетрагидрофуране (24 мл, 0,1 M) при 0oC добавляли по каплям хлористый натрий (801 мг, 8,862 ммоля, 3,5 экв) в воде (24 мл, 0,1 M). После перемешивания при 0oC в течение 30 мин в реакционную смесь добавляли 30 мл хлористого метилена. Водный слой экстрагировали хлористым метиленом (три раза по 30 мл). Органические экстракты промывали водой, сушили над сульфатом магния, концентрировали и получали 2-бутил-4-хлор-1-{ /2,3-дибром-1-(2-цианофенил)-1H-индол-4-ил/-метил} -1H-имидазол-5-карбоновую кислоту.
К 2-бутил-4-хлор-1-1{/2,3-дибром-1-(2-цианофенил)-1H-индол-4-ил/-метил} -1H-имидазол-5-карбоновой кислоте в этаноле (50,6 мл, 0,05 M) добавляли 1н. гидроокись натрия (8,86 мл, 8,86 ммоля, 3,5 экв) и гидроокись палладия на угле (299 мг, 20 мас.%). Реакционную смесь помещали под баллоном с газообразным водородом на 1 ч. 15 мин. На 45-й минуте добавляли дополнительную гидроокись палладия на угле (100 мг, 6,7 вес.%). Добавляли воду 50 мл и хлористый метилен (200 мл) и реакционную смесь фильтровали. К фильтрату добавляли 1н. хлористый водород до установления pH фильтрата 4,0-5,0. Водный слой экстрагировали хлористым метиленом. Органические экстракты промывали насыщенным хлористым натрием, сушили над безводным сульфатом магния и концентрировали. Остаток хроматографировали на силикагеле, элюируя смесью хлористый метилен-метанол-уксусная кислота в отношении 100:2:0,1, и получили целевое соединение, указанное в названии стадии C (940 мг). Тонкослойная хроматография: Rf=0,3 этилацетат-метанол в отношении 5:1, УФ.
D. Дилитевая соль 2-бутил-4-хлор-1-{/1-/2-(2H-тетразол-5-ил)фенил/-1H-индол-4-ил} -метил/-1H-имидазол-5-карбоновой кислоты.
Смесь соединения, полученного на стадии C (916 мг, 2,116 ммоля, 1 экв) азида трибутилолова (Bu3 SnN3) (2108 мг, 6,348 ммоля, 3,0 экв) и ксилола (26,45 мл, 0,08 M), нагревали при 120oC в течение 49 ч. После охлаждения до комнатной температуры добавляли метанол (13,2 мл) и уксусную кислоту (0,485 мл, 4,0 экв) и смесь перемешивали при комнатной температуре три дня. Смесь концентрировали и остаток хроматографировали на силикагеле, элюируя этилацетат пиридин-уксусная кислота-вода в отношении 40:1:1:0,5, и получали 2-бутил-4-хлор-2-{ /1-/2-(2H-тетразол-5-ил)-фенил/-1H-индол-4-ил} -метил/-1H-имидазол-5-карбоновую кислоту.
2-Бутил-4-хлор-1-{ /1-/2-(2H-тетеразол-5-ил)-фенил/-1H- индол-4-ил}-метил/-1H-имидазол-5-карбоновую кислоту растворяли в метаноле (20 мл, 0,1 M). Добавляли раствор гидроокиси лития (1 н. 5,29 мл, 5,29 ммоля, 2,5 экв). После перемешивания при комнатной температуре в течение 30 мин большую часть растворителя выпаривали в вакууме. Остаток хроматографировали на смоле HP-20, элюируя 5-15%-ным ацетоном в воде, и получали целевое соединение, указанное в названии примера (472 мг). Тонкослойная хроматография: Rf=0,31, смесь этилацетат-пиридин-уксусная кислота-вода в отношении 10:1:0,5, УФ.
Пример 10. Дилитиевая соль-2-бутил-4-хлор-1-{/1-/2-(2H-тетразол-5-ил)-фенил/ -бензимидазол-4-ил}-1H-имидазол-5-карбоновой кислоты.
А. 2-бутил-4-хлор-1-{ /1-(2-цианофенил)-1H-бензимидазол-4-ил/ -метил}-1H-имидазол-5-карбоксальдегид 2-/4-(бромметил)-1H-бензимидазол-1-ил/-бензонитрил (0,65 г, 2,08 ммоля, полученный, как описано на стадии C примера 8) и 2-бутил-4-хлор-1H-имидазол-5-карбоксальдегид (0,409 г, 2,19 ммоля, полученный, как описано на стадии C примера 5) помещали в 20,8 мл безводного диметилформамида. Затем добавляли свежемолотый карбонат цезия (1,02 г, 3,12 ммоля), реакционную смесь перемешивали при комнатной температуре 16 ч. Затем реакционную среду распределяли между этилацетатом водой и органическую фазу промывали рассолом, сушили и концентрировали. Неочищенное масло очищали тонкослойной хроматографией (кремнезем, смесь гексан-ацетон в отношении 80:20) и получали целевое соединение, указанное в названии стадии A (0,68 г), в виде белого твердого вещества.
B. 2-Бутил-4-хлор-1-{ /1-(2-циклофенил)-1H-бензимидазол-4-ил/ метил}-1H-имидазол-5-карбоновая кислота.
Целевое соединение, полученное на стадии A (0,636 г, 1,52 ммоля), и сульфаминовую кислоту (0,369 г, 3,80 ммоля ) растворяли в 10,0 мл сухого тетрагидрофурана и раствор охлаждали до 0oC. Затем добавляли раствор хлористого натрия (0,361 г, 4,0 ммоля) в 4,0 мл воды и реакционную смесь перемешивали при 0oC в течение 45 мин. Затем реакционную среду распределяли между хлористым метиленом и водой и органическую фазу сушили и концентрировали. Сырое масло очищали тонкослойной хроматографией (кремнезем, смесь ацетон-гексан-метанол-уксусная кислота в отношении 60:25:10:5 и получали соединение, указанное в названии стадии B (0,474 г)
C. 2-Бутил-4-Хлор-1-{ /1-/2-(2H-тетразол-5-ил/-фенил/ 1н-бензимидазол-4-ил}-метил/-1H-имидазол-5-карбоновая кислота.
Соединение, полученное на стадии B (0,462 г, 1,06 ммоля) и азид бутилолова (1,41 г, 4,24 ммоля), смешивали в 6,0 мл ксилола и реакционную смесь нагревали до 100oC за 18 ч. Затем реакционную смесь концентрировали до половины первоначального объема и нагревали еще 18 ч. Затем реакционную смесь очищали тонкослойной хроматографией (кремнезем, смесь толуол-ацетон-уксусная кислота в отношении 70:23:7) и получали целевое соединение, указанное в названии стадии C.
D. Дилитиевая соль 2-бутил-4-хлор-1-{/1-/2-(2H-тетразол-5-ил)фенил/- бензимидазол-4-ил} -метил/-1H-имидазол-5-карбоновой кислоты.
К соединению, полученному на стадии C (0,435 г, 0,912 ммоля), добавляли 2,1 мл 1,0 M гидроокиси лития в воде. Добавляли еще 7 мл воды и 0,5 метанола для ускорения растворения. Затем раствор очищали, используя колонку со смолой HP-20, элюируя водой, водой с добавлением метанола по 2% до 20% метанола и 80% воды, каждый раз по 500 мл. Продукт собирали, пропускали через миллипористый фильтр, лиофилизировали и получали целевое соединение, указанное в названии примера, в виде белого твердого вещества (0,377 г), точка плавления выше 280oC.
Пример 11. Монокалиевая соль, бутиловый эфир 2-бутил-4-хлор-1-{/1-/2-(2H-тетразол-5-ил)-фенил-/-1H-индол-ил} - метил/-1H-имидазол-5 карбоновой кислоты.
A. Бутиловый эфир 2-бутил-4-хлор-1-{/1-(2-цианофенил) 1H-индол-4-ил-/метил}-1H-имидазол-5-карбоновой кислоты.
К 2-бутил-4-хлор-1-{ /1-(2-цианофенил)-1H-индол-4-ил/метил} -1H-имидазол-5-карбоновой кислоты (661 мг, 1,527 ммоля), полученной, как описано на стадии C примера 9, в количестве 1,0 экв) и иодистому н-бутилу (562 мг, 3,054 ммоля, 2,0 экв) в диметилформамиде (3,05 мл, 05 M) под аргоном добавляли карбонат цезия (1244 мг, 3,818 ммоля, 2,5 экв). Реакционную смесь перемешивали при комнатной температуре 2,5 ч. Добавляли этилацетат и смесь фильтровали. Фильтрат промывали буфером с pH около 4,0 и насыщенным хлористым натрием, сушили над безводным сульфатом магния и концентрировали. Остаток хроматографировали на силикагеле, элюируя смесью гексан-этилацетат в отношении 5: 1, и получали соединение, указанное в названии стадии A (671 мг). Тонкослойная хроматография: Rf-0,21, смесь гексан-этил ацетат вы отношении 3:1.
B. Бутиловый эфир, монокалиевая соль 2-бутил-4-хлор-1-{/1-/2- (2H-тетразол-5-ил)-фенил/-1H-индол-4-ил/-метил} -1H-имидазол-5-карбоновой кислоты.
Смесь соединения, полученного на стадии A (693 мг, 1,417 ммоля, 1,0 экв) азида трибутилолова (2,353 г, 7,086 ммоля, 5,0 экв) и ксилола (1 мл), нагревали при 100oC, оставляя на ночь. Реакционную смесь хроматографировали на силикагеле, элюируя смесью гексан-этилацетат-уксусная кислота в отношении 100:8-15:1 и затем смесью гексан-этилацетат-уксусная кислота в отношении 60: 40: 1 и получали 2-бутил-4-хлор-1-{/1-/2-(2H-тетразол-5-ил) -фенил/1H-индол-4-ил}-метил/-1H-имидазол-5-карбоновую кислоту.
2-Бутил-хлор-1-{ /1-/2-(2H-тетразол-5-ил)-фенил/-1H-индол-4-ил} -метил /-1H-имидазол-5-карбоновую кислоту растворяли в метаноле (28 мл, 0,05 M) и добавляли водный раствор бикарбоната калия (1н., 1,84 мл, 1,84 ммоля, 1,3 экв). Смесь перемешивали при комнатной температуре 20 мин. Добавляли 10 мл воды и часть растворителя испаряли в вакууме. Остаток хроматографировали на колонке, упакованной ионообменной смолой HP-20, элюируя водой, затем смесью вода-ацетон в отношении 100:25-40, и получали целевое соединение, указанное в названии стадии B (581 мг).
Пример 12. Дилитиевая соль 2-бутил-4-хлор-1-{/2,3-дибром-1-/2- (1H-тетразол-5-ил)-фенил/-1H-индол-4-ил}-метил /-1H-имидазол-5-карбоновой кислоты.
2-Бутил-4-хлор-1-{ /2,3-дибром-1-(2-цианофенил)-1H-индол-4-ил/-метил} -1H-имидазол-5-карбоновую кислоту (0,3 г, 0,51 ммоля, полученную как описано в примере 9, стадия C) и азид трибутилолово (0,51 г, 1,5 ммоля) растворителя в 0,3 мл толуола и нагревали при 80oC в течение 15 ч. Сырую реакционную смесь хроматографировали непосредственно через силикагель Merck (80 г), используя систему растворяли гексан-этилацетат-уксусная кислота в отношении 60:40:0,2. Нужные фракции собирали, концентрировали в вакууме и растворяли в 4 мл смеси метанол-1н. гидроокись лития в отношении 1:1. Этот материал хроматографировали через 80 мл смолы HP-20, используя водную систему, содержащую 15% ацетона. Нужные фракции собирали, концентрировали до 100 мл, фильтровали через миллипористый фильтр и лиофилизировали. Продукт лиофилизации сушили над пятиокисью фосфата и получали целевое соединение (0,24 г) в виде белого твердого вещества.
Пример 13. 2-Метил-1-(2-метил-1-оксопропокси)-пропиловый эфир, монокалиевая соль 2-бутил-4-хлор-1-{ /1-/2-(2H-тетразол-5-ил) фенил-/-1H-имидазол-4-ил}-метил/-1H-имидазол-5-карбоновой кислоты.
A. 1-Метилэтиловый эфир 2-хлор-3-метилбутановой кислоты.
К свежеконденсированному хлористому цинку (27,3 мг) и изобутирилхлориду (4,92 мл, 46,9 ммоля) в хлористом метилене (10 мл) при 10oC добавляли по каплям изобутилальдегид (свежедистиллированный) (4,26 мл, 46,9 ммоля), поддерживая температуру ниже 25oC. После окончания добавки реакционную смесь перемешивали при комнатной температуре 2,5 ч. Реакционную смесь затем промывали 20%-ным ацетилатом натрия, сушили над безводным сульфатом магния, фильтровали, концентрировали в вакууме и получали целевое соединение, указанное в названии стадии A (6,0 г), в виде прозрачной жидкости.
B. 2- Метил-1-(2-метил-1-оксопропокси)-пропиловый эфир 2-бутил-4-хлор-1-{ /1-(2-цианофенил)-1H-индол-4-ил/-метил} -1H-имидазол-5-карбоновой кислоты.
2-Бутил-4-хлор-1-{ /1-(2-цианофенил)-1H-индол-4-ил/-метил} -1H -имидазол-5-карбоновую кислоту (630 мг, 1,46 ммоля, полученную как описано на стадии C примера 9), целевое соединение, полученное на стадии A (1,04 г, 5,84 ммоля), иодистый натрий (438 мг, 2,92 ммоля), карбонат цезия (2,14 г, 6,57 ммоля) и диметилформамид (3,2 мл) смешивали и перемешивали при 60oC в течение 7 ч. Реакционную смесь разбавляли этилацетатом и фильтровали. Органическую фазу промывали буфером с pH 4,0 (два раза по 25 мл), буфером с pH 7,0 (два раза по 25 мл), насыщенным хлористым натрием (один раз, 25 мл), сушили над безводным сульфатом магния, фильтровали, концентрировали и получали прозрачное масло. Очисткой хроматографией на силикагеле Merck (240 мл), элюируя смесью этилацетат-гексан в отношении 2:7, получали целевое соединение (451 мг).
C. 2-Метил-1-(2-метил-1-оксопропил)-пропиловый эфир 2-бутил-4-хлор-1-{ /I-/2-(2H-тетразол-5-ил)-фенил 1H-индол-4-ил/-метил} -1H-имидазол-5-карбоновой кислоты.
Целевое соединение, полученное на стадии B (451 мг, 0,784 ммоля), и азид трибутилолова (1,3 г, 3,9 ммоля) в ксилоле (0,45 мл), перемешивали в закупоренной колбе при 93oC в течение 17 ч. Реакционную смесь вводили непосредственно на силикагель Merck (46 г) для хроматографии, элюируя смесью этилацетат-гексан-уксусная кислота в отношении 40:59:1. Продукт, содержащий нужные фракции, собирали и снова очищали на силикагеле Merck, элюируя смесью этилацетат-уксусная кислота-гексан в отношении 35:1:64. Целевое соединение (435 мг) получали в виде масла.
D. 2-Метил-1-(2-метил-1-оксопропокси)-пропиловый эфир, монокалиевая соль 2-бутил-4-хлор-1-{ /1-/2-(2H-тетразол-5-ил) -фенил-/1H-индол-4-ил} -метил/1H-имидазол-5-карбоновой кислоты.
К целевому соединению, полученному на стадии C (424 мг, 0,70 ммоля), в ацетоне добавляли 1 M бикарбоната калия (0,75 мл, 0,75 ммоля) до pH 8,0. Тонкослойная хроматография показала некоторое разложение к этому времени. Раствор концентрировали в вакууме и очищали на ионообменной смоле HP-20. Продукт, элюированный в 25-30%-ном ацетоне в воде, фильтровали и лиофилизировали примерно 30 мл этанола и получали целевое соединение, указанное в названии стадии D, в виде белого продукта лиофилизации (280 мг).
Пример 14. 1-(2,2-диметил-1-оксопропокси)-2-метилпропиловый эфир 2-бутил-4-хлор-1-{ /1-/2-(2H-тетразол-5-ил)-фенил/-1H- индол-4-ил}-метил/-1H-имидазол-5-карбоновой кислоты.
A. 1-хлор-2-метилпропиловый эфир 2,2-диметилпропановый кислоты.
К свежеконденсированному хлористому цинку (27,3 мг) и триметилацетилхлориду (5,11 мл, 41,5 ммоля) в хлористом метилене (10 мл) при 10oC добавляли по каплям изобутиральдегид (свежедистиллированный) (3,77 мл, 41,5 ммоля), поддерживая температуру ниже 25oC. По окончании добавки реакционную смесь перемешивали при комнатной температуре 1 ч. Затем реакционную смесь промывали 20%-ным ацетатом натрия, сушили над безводным сульфатом магния, фильтровали, концентрировали в вакууме и получали соединение, указанное в названии стадии A (3,25 г), в виде прозрачной жидкости.
B. 2-метил-1-(2,2-диметил-1-оксопропокси)-пропиловый эфир -2-бутил-4-хлор-1-{ /1-(2-цианофенил)-1H-индол-ил/метил} -1H-имидазол-5-карбоновой кислоты.
Смесь, содержащую 2-бутил-4-хлор-1-{/1-(2-цианофенил)- 1H-инлол-4-ил/-метил} -1H-имидазол-5-карбоновой кислоты (550 мг, 1,27 ммоля, полученной как описано на стадии C примера 9), целевое соединение, полученное на стадии A этого примера, (979 мг, 5,08 ммоля) иодистый натрий (381 мг, 2,54 ммоля) и карбонат цезия (1,86 г, 5,72 ммоля) в 2,5 мл диметилформамида, нагревали при 60oC в течение 7 ч в закупоренной колбе. После охлаждения реакционную смесь разбавляли 110 мл этилацетата и фильтровали. Органический экстракт ополаскивали тремя порциями буфера по 15 мл с pH 4,0, 20 мл смеси вода-рассол в отношении и 30 мл рассола, затем сушили над безводным сульфатом магния, концентрировали в вакууме и получали 1,3 г сырого продукта. Хроматографией на 75 г силикагеля, элюируя смесью гексан-этилацетат в отношении 4:1, получали 576 мг целевого соединения B.
C. 1-(2,2-диметил-1-оксопропокси)-2-метилпропиловый эфир, монокалиевая соль 2-бутил-4-хлор-1-{/1-/2-(2H-тетразол- 5-ил)-фенил-1H-индол-4-ил}-метил/-1H-имидазол-5-карбоновой кислоты.
Соединение, полученное на стадии B настоящего примера (553 мг, 0,939 ммоля), азид трибутилолова (1,56 г, 4,69 ммоля) и ксилол (1,0 мл) смешивали и нагревали в закрытой колбе при 93oC в течение 18 ч. Затем реакционную смесь охлаждали и непосредственно хроматографировали на 100 г силикагеля, элюируя смесью этилацетат-уксусная кислота-гексан в отношении 40:1:80. Продукт, содержащий нужные фракции, накапливали с толуолом и получали 533 мг исходной кислотной формы целевого соединения (0,843 ммоля). Кислоту обращали в соответствующую соль калия добавлением бикарбоната калия (101 мг, 1,01 ммоля) и воды к исходной кислоте, растворенной в минимальном количестве метанола. Очистка обращенно-фазовой хроматографией на смоле HP-20 с использованием водно-ацетонового элюирования давала выход целевого соединения (0,49 г).
Пример 15. 2-(Диэтиламино)-2-оксоэтиловый эфир, монокалиевая соль 2-бутил -4-хлор-1-{/1-/2-тетразол-5-ил)-фенил/-1H-индол-4-ил/ -метил}-1H-имидазол-5-карбоновой кислоты.
A.2-хлор-N,N-диэтилацетамид.
К раствору хлоруксусной кислоты (10 г, 0,11 моля) в хлористом метилене (530 мл) при 0oC добавляли гидрохлорид диэтиламина (15,3 г, 0,14 ммоля), гидрохлорид-1-(3-диметиламинопропил)-3- этилкарбодиимида (26,4 г, 0,14 ммоля) и 4-метилморфолин (29 мл, 0,27 моля). После перемешивания реакционной смеси в течение 1 ч при 0oC ее перемешивали при комнатной температуре 4 ч. Затем реакционную смесь промывали водой, 1н. хлористоводородной кислотой (до получения бесцветной водной фазы) и насыщенным хлористым натрием, сушили над безводным сульфатом магния, фильтровали, концентрировали и получали соединение, указанное в названной стадии A, в виде желтого масла (9,3 г).
B. 2-(диэтиламино)-2-оксоэтиловый эфир 2-бутил-4-хлор- 1-{/1-(2-цианофенил)-1H-индол-4-ил/-метил}-1H- имидазол-5-карбоновой кислоты.
2-бутил-4-хлор-I-{ /1-(2-цианофенил)-1H-индол-4-ил/- метил} -1H-имидазол-5-карбоновую кислоту (331 мг, 0,77 ммоля, полученную как описано на стадии C примера 9), целевое соединение, полученное на стадии A настоящего примера (229 мг, 1,53 ммоля), иодистый натрий (172 мг, 1,15 ммоля), карбонат цезия (622 мг, 1,91 ммоля) и диметилформамид (1,5 мл) смешивали и перемешивали при комнатной температуре 5,5 ч. Реакционную смесь разбавляли этилацетатом и фильтровали. Органическую фазу промывали буфером с pH 4,0 (три раза по 30 мл), с pH 7,0 (3 раза по 30 мл) насыщенным хлористым натрием (один раз, 30 мл), сушили над безводным сульфатом магния, фильтровали, концентрировали и получали желтое масло. Хроматографической очисткой на силикагеле Merck (250 г), элюируя 40%-ным этилацетатом в гексане, получали 401 мг целевого соединения B.
C. 2-(Диэтиламино)-2-оксоэтиловый эфир 2-бутил-4-хлор-1 {/1-/2-/2-тетразол-5-ил)-фенил/-1H-индол-4-ил}-метил/ -1H-имидазол-5-карбоновой кислоты.
Целевое соединение B (401 мг, 0,79 ммоля) и азид трибутиолова (0,8 г, 2,4 ммоля) в ксилоле (0,8 мл) перемешивали в закрытой колбе при 100oC в течение 24 ч. Реакционную смесь непосредственно помещали на силикагель (46 г) для хроматографирования, элюируя смесью этилацетат-гексан-уксусная кислота в отношении 70:29:1. Отбирали две фракции, которые раздельно очищали на силикагеле Merck, элюируя каждую смесь этилацетат-уксусная кислота-гексан в отношении 60: 1: 39. Получали целевое соединение C (484 мг) в виде твердого вещества.
D. 2-(Диэтиламино)-2-оксоэтиловый эфир, монокалиевая соль 2- бутил-4-хлор-I-{ /1-/2-(2H-тетразол-5-ил)-фенил /-1H- индол-4-ил}-метил/-1H-имидазол-5-карбоновой кислоты.
К целевому соединению C (484 мг, 0,82 ммоля) в метаноле (1 мл) добавляли 1 M бикарбоната калия (0,9 мл, 1,1 моля) до pH 8,0. Раствор концентрировали в вакууме и очищали обращенно-фазовой хроматографией на смоле HP-20. Фракции продукта, элюированные 20-30%-ным ацетоном в воде, фильтровали: лиофилизировали и получали целевое соединение D в виде светло-желтого продукта лиофилизации (270 мг).
Пример 16. (2-Бутил-1-{/1-/2-(2H-тетразол-5-ил)-фенил/-1H-индол-4-ил/-метил}-1H- имидазол-5-карбоновая кислота.
A. 2-Бутил-1-{ /2,3-дибром-1-(2-цианофенил)-1H-индол-4-ил/-метил} -1H- имидазол-5-карбоксальдегид.
К 2-бутил-1H-имидазол-5-карбоксальдегиду (161 мг, 1,058 ммоля, 1,0 экв, полученному как описано на стадии H примера 1) и 2-/2,3-дибром-4-(бромметил)-1H-индол-1-ил/-бензонитрилу (546 мг, 1,164 ммоля, 1,1 экв, полученному как описано на стадии C примера 9) в диметилформамиде (4,4 мл, 0,24 М) добавляли карбонат цезия (862 мг, 2,646 ммоля, 2,5 экв). Смесь перемешивали при 50oC 2 ч. Добавляли хлористый метилен и смесь фильтровали. Фильтрат промывали водой, сушили над безводным сульфатом магния и концентрировали. Остаток хроматографировали на силикагеле, элюируя смесью толуол-этиловый эфир в отношении 4:1 и получали целевое соединение A (451 мг). Тонкослойная хроматография: Rf = 0,4, силикагель, смесь гексан-этилацетат в отношении 2:3.
B. 2-Бутил-1-{/1-(цианофенил)-1H-индол-4-ил/-метил}-1H-имидазол-5- карбоновая кислота.
К целевому соединению A (451 мг, 0,835 ммоля, 1,0 экв) и сульфаминовой кислоте (284 мг, 2,922 ммоля, 3,5 экв) в тетрагидрофуране (8,4 мл, 0,1 М) при 0oC добавляли раствор хлористого натрия (264 мг, 2,922 ммоля, 3,5 экв) в воде (8,4 мл, 0,1 М). Реакционную смесь перемешивали при 0oC в течение 30 мин. Добавляли воду (15 мл). Смесь экстрагировали 10%-ным метанолом в хлористом метилене. Экстракт сушили над безводным сульфатом магния, концентрировали и получали 2-бутил-1-{/2,3-бром-1-(2-цианофенил)-1H- индол-4-ил/-метил}-1H-имидазол-5-карбоновую кислоту.
К 2-бутил-1-{/2,3-дибром-1-(2-цианофенил)-1H-индол-4-ил/-метил}-1H- имидазол-5-карбоновой кислоте в этаноле (26 мл, 0,032 М) добавляли раствор гидроокиси натрия в воде (1 н., 2,923 мл, 2,923 ммоля, 3,5 экв) и гидроокись палладия на угле (186 мг). Смесь помещали под баллон с газообразным водородом и перемешивали при комнатной температуре. Через 1,5 ч добавляли 20 мл воды и 40 мл метанола и реакционную смесь фильтровали. Фильтрат концентрировали до 20 мл и подкисляли 1 н. хлористоводородной кислотой до pH около 2,0. Смесь экстрагировали 10%-ным метанолом в хлористом метилене. Экстракт промывали рассолом и концентрировали. Остаток хроматографировали на силикагеле, элюируя смесью этилацетат-пиридин-уксусная кислота-вода в отношении 40:1:0,5, и получали целевое соединение B (200 мг).
C. 2-Бутил-1-{ /1-2-(2H-тетразол-5-ил)-фенил/-1H-индол-4-ил}-метил/-1H- имидазол-5-карбоновой кислоты.
Смесь целевого соединения B (184 мг, 0,462 ммоля, 1,0 экв), азида трибутилолова (613 мг, 1,847 ммоля, 4,0 экв) и ксилола (4,6 мл, 0,1 М) перемешивали при 120oC в течение 24 ч. После охлаждения смесь концентрировали, остаток хроматографировали на силикагеле, элюируя смесью этилацетат-уксусная кислота в отношении 100:1, и затем смесью этил ацетат-пиридин-уксусная кислота-вода в отношении 100:10:10:5 и получали твердое вещество, которое очищали жидкостной хроматографией высокого давления на колонке УМС 5-10 ODS, элюируя смесью, состоящей из 50% воды-метанола-трифтор-уксусной кислоты в отношении 90:10:0,1 и 50% воды-метанола-трифторуксусной кислоты в отношении 90:800:0,9 и получали целевое соединение, указанное в названии стадии C (140 мг).
Пример 17. (1-(Ацетилокси)-этиловый эфир, монокалиевая соль 2-бутил-4-хлор-1-{ /1-/2H- тетразол-5-ил/-фенил/-1H-индол-4-ил/-метил}-1H-имидазол-5-карбоновой кислоты.
A. 1-хлорэтиловый эфир уксусной кислоты.
К свежеконденсированному хлористому цинку (0,25 г) и ацетилхлориду (11 мл, 150,0 ммолей) при 10oC добавляли по каплям ацетальдегид (8,4 мл, 150,0 ммолей), поддерживая температуру ниже 20oC. По окончании добавки реакционную смесь перемешивали при комнатной температуре 2 ч. Реакционную смесь распределяли между хлористым метиленом и 20%-ным ацетилатом натрия перед концентрированием в вакууме до коричневой жидкости. Очистка дистилляцией при 28 мм рт. ст. и 37-39oC давала целевое соединение A (4,2 г) в виде прозрачной жидкости.
B. 1-(Ацетилокси)-этиловый эфир 2-бутил-4-хлор-1-{/1-(2-цианофенил)-1H- индол-4-ил/-метил}-1H-имидазол-5-карбоновой кислоты.
2-Бутил-4-хлор-1-{/1/(2-цианофенил)-1H-индол-4-ил/-метил}-1H-имидазол-5- карбоновую кислоту (910 мг, 2,1 ммоля, полученную как описано на стадии C примера 9), целевое соединение B (930 мг, 5,03 ммоля), карбонат цезия (2,6 г, 7,98 ммоля) и диметилформамид (4,0 мл) смешивали и перемешивали при комнатной температуре 16 ч. Реакционную смесь разбавляли этилацетатом и фильтровали. Органическую фазу два раза промывали буфером с pH 4,0, один раз буфером с pH 7,0, один раз насыщенным хлористым натрием, сушили над безводным сульфатом магния, фильтровали, концентрировали и получали коричневое масло. Очистка хроматографией на силикагеле Merck (250 г), элюируя смесью гексан-этилацетат в отношении 8:2, дает целевое соединение B (1,06 г)
C. 1-(Ацетилокси)-этиловый эфир 2-бутил-4-хлор-1-{/1-2-(2H-тетразол-5- ил)-фенил/-1H-индол-4-ил}-метил/-1H-имидазол-5-карбоновой кислоты.
Целевое соединение B (943,0 мг, 1,82 ммоля), азид трибутилолова (2,41 г, 7,27 ммоля) и ксилол (0,9 мл) нагревали при 65oC в течение 42 ч. Добавляли еще азид трибутилолова (0,7 г, 2,11 ммоля) и реакционную смесь нагревали еще 4 ч при 70oC. Неочищенную реакционную смесь разбавляли 1 мл хлористого метилена и быстро хроматографировали на 130 г силикагеля Merck, элюируя смесью этилацетат-уксусной кислота-гексан в отношении 35:1:65, затем в отношении 50:5:50 и получали целевое соединение C.
D. 1-(Ацетилокси)-этиловый эфир, монокалиевая соль 2-бутил-2-хлор-1-{ /1-/2-тетразол-5-ил)-фенил/-1H-индол-4-ил/-метил} -1H- имидазол-5-карбоновой кислоты.
К целевому соединению, полученному на стадии C (783 мг, 1,32 ммоля) в абсолютном этиловом спирте (1 мл), добавляли 1 М бикарбоната калия (1,45 ммоля, 1,1 мл) до pH 8,0. Раствор концентрировали в вакууме и два раза очищали обращенно-фазовой хроматографией на смоле HP-20. Фракции продукта, элюированные при 25-40% этанола в воде, собирали, фильтровали, лиофилизировали и получали указанное в названии стадии D соединение (534 мг) в виде белого твердого вещества.
Пример 18. 2,3-Дигидро-1H-инден-5-иловый эфир-2-бутил-5,5-хлор-{/1-/2-(2H-тетразол-5-ил)-фенил/-1H-индол-4-ил/-метил} - -1H-имидазол-5-карбоновой кислоты
A. 5-инданиловый эфир 2-бутил-4-хлор-1-{/1-(2-циано-фенил)-1H-индол-4- ил/-метил}-1H-имидазол-5-карбоновой кислоты.
К смеси, содержащей 2-бутил-4-хлор-1-{/1-(2-циано-фенил)-1H-индол-4-ил/- метил} -1H-имидазол-5-карбоновую кислоту (903 мг, 2,03 ммоля, полученную как описано на стадии C примера 9), 5-инданол (307 мг, 2,29 ммоля) 2,6-диметиламинопиридин (50,8 мг, 0,416 ммоля) и триэтиламин (0,377 мл, 2,70 ммоля) в 9 мл дихлорметана, охлажденного на ледяной бане, добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этил карбомида (519 мг, 2,70 ммоля). Закупоренную реакционную смесь оставляли на ночь для нагрева до комнатной температуры, затем разбавляли хлористым метиленом и ополаскивали насыщенным водным раствором хлористого натрия. Органический экстракт сушили над безводным сульфатом магния, концентрировали в вакууме и получали 1,83 г неочищенного продукта. Быстрой хроматографией на 75 г силикагеля, элюированного смесью гексан-этилацетат в отношении 8:2, получали 1,03 г целевого соединения A.
B. 2,3-Дигидро-1H-инден-5-иловый эфир 2-бутил-4-хлор-1-{/1-/2-(2H- тетразол-5-ил/-фенил/-1H-индол-4-ил/-метил}-1H-имидазол-5-карбоновой кислоты.
Смесь целевого соединения, полученного на стадии A (1,03 г, 1,88 моля), азида трибутилолова (1,87 г, 5,63 ммоля) и ксилола (2 мл), нагревали в закрытой колбе при 88oC 19 ч, и нагревание продолжали 6 ч. Затем реакционную смесь охлаждали и непосредственно хроматографировали на 200 г силикагеля, элюированного смесью этилацетат-уксусная кислота-гексан в отношении 35:1:65. Фракции, содержащие нужный продукт, собирали, концентрировали в вакууме, выпаривали с толуолом и получали 940 мг целевого соединения.
Пример 19.-2-Метил-1-(1-оксопропокси)-пропиловый эфир, монокалиевая соль 2-бутил-4-хлор-1-{ /1-/2-(2H-тетразол-5-ил) -фенил/-1H-индол-4-ил/-метил}-1H-имидазол-5-карбоновой кислоты.
A. 1-Хлор-2-метилпропиловый эфир пропановой кислоты.
К свежеконденсированному хлористому цинку (41 мг) в хлористом метилене (10 мл) добавляли хлористый пропионил (5,0 г, 54, 0 ммоля). Реакционную смесь охлаждали до 10oC и по каплям добавляли изобутиральдегид (3,89 г, 54,0 ммоля), поддерживая температуру при 25oC. По завершении добавки реакционную смесь перемешивали 1 ч при комнатной температуре. Реакционную смесь промывали 20%-ным ацетилатом натрия и органическую фазу концентрировали в вакууме, чтобы получить целевое соединение A.
B. 2-Метил-1-(1-оксопропокси)-пропиловый эфир 2-бутил -4-хлор-1-{/1-(2-цианофенил)-1H-индол-4-ил/-метил}-1H- имидазол-5-карбоновой кислоты.
2-Бутил-4-хлор-1-{ /1-(2-цианофенил)-1H-индол-4-ил/- метил} -1H-имидазол-5-карбоновую кислоту (870 мг, 2,01 ммоля, полученную как описано на стадии C примера 9), целевое соединение A(1,16 г, 7,03 ммоля), иодистый натрий (745 мг, 5,03 ммоля, карбонат цезия (2; 3 г, 7,03 ммоля) и диметилформамид) 4,4 мл) смешивали и нагревали до 80oC за 6 ч. Реакционную смесь разбавляли этилацетатом, фильтровали, промывали буфером с pH 4,0 водой и рассолом, сушили над безводным сульфатом магния и концентрировали в вакууме до 1,50 г сырого продукта. Быстрой хроматографией на 70 г силикагеля Merck, элюированном смесью гексан-этилацетат, получали целевое соединение B (0,84 г).
C. 2-Метил-1-(1-оксопропокси)-пропиловый эфир 2-бутил-4- хлор-1-{/1-/2-(2H-тетразол-5-ил)-фенил /-1H-индол-4-ил) -метил} -1H-имидазол-5-карбоновой кислоты.
Целевое соединение B ( 840 мг, 1,50 ммоля), азид трибутилолова ( 1,99 г, 6 ммолей) и ксилол (2 мл) нагревали при 80oC 27 ч в закрытой колбе. Реакционную смесь охлаждали до комнатной температуры и непосредственно хроматографировали на 144 г силикагеля Merck, элюированного смесью этилацетат-уксусная кислота-гексан в отношении 35:1:65. Накапливание фракций, содержащих продукт, давало 682 мг целевого соединения.
D. 2-Метил-1-(1-оксопропокси)-пропиловый эфир, монокалиевая соль 2-бутил-4-хлор-1-{ /1-/2-(2H-тетразол-5-ил/-фенил 1H- индол-4-ил/-метил}-1H-имидазол-5-карбоновой кислоты.
К соединению, полученному на стадии C ( 682 мг, 1,06 ммоля) в абсолютном этиловом спирте (1 мл), добавляли 1 M бикарбоната калия ( 1,11 мл, 1,11 ммоля) до pH 8,0. Раствор концентрировали в вакууме и очищали обращенно-фазовой хроматографией на смоле HP-20. Фракции продукта, элюированные 35-40%-ным этанолом в воде, собирали, фильтровали, лиофилизировали и получали целевое соединение в виде твердого белого вещества (517 мг).
Пример 20. Этиловый эфир, монокалиевая соль 2-бутил-4-хлор-1- {1/-/2(H-тетразол-5-ил)-фенил/-1H-индол-4-ил/-метил} -1H-имидазол -5-карбоновой кислоты.
A. Этиловый эфир 2-бутил-4-хлор-1-{/1-(2-цианофенил) 1H-индол-4-ил/-метил}-1H-имидазол-5-карбоновой кислоты.
Иодистый этил (561,5 мг, 3,60 ммоля) и карбонат цезия (1,5 г, 4,5 ммоля) добавляли к раствору 2-бутил-4-хлор-1-{/1-(2- цианофенил)-1H-индол-4-ил/-метил} -1H-имидазол-5-карбоновой кислоты (779,2 мг, 1,80 ммоля, полученной как описано на стадии C примера 9) в диметилформамиде (3,72 мл).
Через 1,5 ч при комнатной температуре реакционную смесь разбавляли этилацетатом и фильтровали для удаления карбоната цезия. Этилацетат промывали буфером с pH 4,0 ( два раза по 20 мл), буфером с pH 7,0 (2 раза по 25 мл), насыщенным хлористым натрием (20 мл) и сушили над безводным сульфатом магния, концентрировали до получения желтого масла (890 мг). Очистка экспресс-хроматографией ( силикагель 83 г, элюат гексан-этилацетат в отношении 8:2) давала 662 мг соединения, указанного в названии стадии A.
B. Этиловый эфир 2-бутил-4-хлор-1-{/1-/2-(2H-тетразол-5- ил)-фенил/-1H-индол-4-ил/-метил}-1H-имидазол-5-карбоновой кислоты.
Соединение, полученное на стадии A ( 598, 8 мг, 1,3 ммоля) и азид трибутилолова (1,73 г, 5,2 ммоля) в ксилоле (6,64 мл), перемешивали, выдерживали при 100oC в течение 30 ч. Добавляли еще азид трибутилолова (0,65 г, 1,95 ммоля) и нагревание продолжали 18 ч. Реакционную смесь непосредственно помещали на силикагель Merck (228 мл) для очистки, элюируя смесью этилацетат-гексан-уксусная кислота в отношении 35:64:1. Целевое соединение B (585,3 мг) получали в виде желтого твердого вещества
C. Этиловый эфир, монокалиевая соль 2-бутил-4-хлор-1-{1-/2- (2H-тетразол-5-ил)-фенил-/1H-индол-4-ил/-метил} 1H-имидазол -5-карбоновой кислоты.
К соединению, полученному на стадии B (584 мг, 1,19 ммоля), в абсолютном этаноле (1 мл) добавляли 1 M бикарбоната калия (1,31 мл, 1,31 ммоля) до pH 8,0. Раствор концентрировали в вакууме и очищали ионообменной смолой HP-20. Продукт, элюированный в 25-40%-ном этаноле в воде, фильтровали, лиофилизировали и получали целевое соединение (510 мг) в виде белого твердого вещества.
Пример 21. Этиловый эфир 2-бутил-1-{/1-/2-(2H-тетразол- 5-ил)-фенил/-1H-индол-4-ил/-метил}-4-(трифторметил)-1H- имидазол-5-карбоновой кислоты.
A. Этиловый эфир 4,4,4-трифтор-2 (гидроксиимино)-бутановой кислоты.
Раствор нитрита натрия (0,29 ммоля) в 35 мл воды по каплям добавляли в течение 50 мин к перемешиваемому, охлажденному льдом раствору 22,8 г этилового эфира, 4,4,4,-трифторацетоуксусной кислоты (0,12 ммоля) в 30 мл уксусной кислоты. Реакцию продолжали 2 ч с постепенным нагревом до 15oC. Добавляли воду и уксусную кислоту удаляли при пониженном давлении (азеотропно с толуолом). Неочищенный продукт распределяли между этилацетатом и насыщенным водным раствором бикарбоната калия. Слои разделили. Этилацетатный слой промывали насыщенным водным раствором бикарбоната калия и рассолом, сушили над сульфатом натрия, концентрировали до получения выхода соединения A 21,4 г в виде светло-желтого масла.
B. Этиловый эфир 2-бутил-1-гидрокси-4-(трифторметил)-1H- имидазол-5-карбоновой кислоты.
Раствор валеральдегида (9,87 мл, 92,9 ммоля) в 150 мл насыщенного этанолового аммония охлаждали до 0oC и добавляли к соединению, полученному на стадии A (19,8 г, 92,9 ммоля). Оранжево-красный раствор перемешивали в атмосфере аргона 30 мин и затем оставляли при комнатной температуре и перемешивали на ночь. Растворитель удаляли при пониженном давлении и совместным испарением с эфиром. Остаток растворяли в 150 мл эфира и 0,1 г нерастворимого материала удаляли фильтрацией. Концентрированием фильтрата при пониженном давлении получали 27,7 г светлого желто-оранжевого вещества. Экспресс-хроматография на 750 г силикагеля элюирования 2 мл хлористого метилена с последующим элюированием смесью хлористый метилен-метанол-уксусная кислота в отношении 98: 1: 1 давала целевое соединение B ( 9,8 г в виде светлого желтого твердого вещества, точка в плавлении 77,5-80,5oC).
C. Этиловый эфир 2-бутил-4-(трифторметил)-1H-имидазол-5- карбоновой кислоты.
К смеси целевого соединения, полученного на стадии B (4,25 г, 15,00 ммолей), и ацетата натрия (15 г) в метаноле (50 мл) и воде (50 мл) при температуре ледяной бани по каплям добавляли раствор хлористого титана (50 мл, 20%-ного раствора) в течение 20 мин при перемешивании. Через 1 ч при 0oC реакционную смесь нагревали до комнатной температуры и перемешивали 1 ч. Продукт реакции экстрагировали этилацетат (два раза по 300 мл). Объединенный органический слой промывали лимонной кислотой (100 мл 5%-ного раствора), затем водным раствором бикарбоната натрия (100 мл), сушили над безводным сульфатом магния, концентрировали в вакууме и получали соединение, указанное в названии стадии C (3,42 г в виде твердого вещества, точка плавления 51,0-53,0oC).
D. Метиловый эфир 1H-имидазол-4-карбоновой кислоты.
К раствору этилового эфира 2-бутил-1-окси-4-(трифторметил) -1H-имидазол-5-карбоновой кислоты (506 мг, 3,14 ммоля), растворенной в смеси 5 мл метанола и 10 мл диэтилового эфира, добавляли эфирный диазометан до исчезновения исходной кислоты, определяемой тонкослойной хроматографией. Затем добавляли безводный сульфат магния и раствор фильтровали и концентрировали в вакууме. Экспресс-хроматографии на 10 г силикагеля Merck, элюированного смесью хлороформ-гексан в отношении 2:1, затем смесью хлороформ-диэтиловый эфир в отношении 10: 1, давала целевое соединение, указанное в названии стадии D ( 540 мг).
E. Метиловый эфир 1-(2-цианофенил)-1H-индол-4-карбоновой кислоты.
Смесью целевого соединения, полученного на стадии D (40,6 мг, 0,232 ммоля), 2-фторбензонитрила (38 мкл, 0,348 ммоля), карбонат калия ( 64, 1 мг, 0,464 ммоля) и 18-краун-6-(6,1 мг, 0,0232 ммоля) в 0,23 мл диметилформамида, нагревали при 150oC в течение 150 мин. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом, фильтровали и ополаскивали буфером с pH 4,0. Водный слой далее экстрагировали еще двумя порциями этилацетата и объединенный органический экстракт ополаскивали рассолом, сушили над сульфатом натрия, фильтровали через безводный сульфат магния и концентрировали в вакууме. Экспресс-хроматография на 5 г силикагеля Merck, элюированного смесью хлороформ-гексан в отношении 5:1 с последующим элюированием 100% хлороформ, давала целевое соединение, указанное в названии стадии E (61,6 мг).
F. Соединение, полученное на стадии E (8,0 г, 28,95 ммоля), 1н. гидроокись натрия (43,4 мл, 43,4 ммоля), метанол (43,4 мл, 43,4 ммоля) и тетрагидрофуран (43,4 мл) смешивали и нагревали при 50oC. Через 4 ч 10 мин реакционную смесь охлаждали до комнатной температуры и добавляли 10%-ную хлористоводородную кислоту (около 50 мл), чтобы выпало в осадок белое твердое вещество. Смесь фильтровали и продукт собирали в виде твердого белого вещества 7,2 г.
C. 2-/4-(гидроксиметил)-1H-индол-1-ил/-бензонитрил.
Комплекс боран-тетрагидрофуран (1 М, в тетрагидрофуране 27,3 мл) добавляли к раствору соединения, полученного на стадии F (7,17 г, 27,3 ммоля) в тетрагидрофуране (дистиллированный, 27,3 мл) при - 20oC, нагревали до комнатной температуры и перемешивали 21 ч. Раствор охлаждали до 0oC и реакцию гасили 1н. гидроокисью натрия до pH 14,0. Раствор экстрагировали эфиром (три раза по 100 мл), промывали хлористым натрием, сушили над безводным сульфатом магния, фильтровали и концентрировали до светло-зеленого твердого вещества. Твердое вещество перекристаллизовывали два раза из смеси этилацетат-гексан и получали соединение, указанное в названии стадии G (5,34 г).
H. 2-/4-(бромметил)-1H-индол-1-ил/бензонитрил.
К раствору соединения, полученного на стадии G (5,46 г 22 ммоля) в хлористом метилене (дистиллированный, 60 мл) при 0oC, добавляли четырехбромистый углерод (10,2 г, 30,8 ммоля) и трифенилфосфин (7,5 г, 28,6 ммоля). Реакционную смесь перемешивали при 0oC в течение 15 мин, затем нагревали до комнатной температуры. Через 2,5 ч реакционную смесь разбавляли хлористым метиленом и помещали непосредственно на колонку с силикагелем Merck (66 г), элюируя смесью толуол-гексан в отношении 1:1 для очистки. Фракции продукта собирали, концентрировали, затем растирали с холодным этилацетатом и получали соединение, указанное в названии стадии H (5,8 г).
I. Этиловый эфир 2-бутил-1-{/1-(2-цианофенил)-1H-индол-4-ил/-метил}-4-(трифторметил)-1H- имидазол-5-карбоновой кислоты.
Смесь соединения, полученного на стадии C (470 мг, 1,78 ммоля) и карбоната цезия (585 мг, 1,8 ммоля) в диметилформамиде 4 мл), перемешивали при комнатной температуре 15 мин. К этой реакционной смеси добавляли соединение, полученное на стадии H (555 мг, 1,78 ммоля). Полученную смесь перемешивали при комнатной температуре 3 ч. Твердое вещество отфильтровывали и промывали этилацетатом. Фильтрованный раствор концентрировали в вакууме и остаток очищали экспресс-хроматографией (кремнезем, смесь этилацетат-гексан в отношении 1 : 2 и получали соединение, указанное в названии стадии I (870 мг) в виде масла.
J. Этиловый эфир 2-бутил-1-{/1-/2-(2H-тетразол-5-ил)-фенил-1H-индол-4-ил/-метил}-4- (трифторметил)-1H-имидазол-5-карбоновой кислоты.
Раствор соединения, полученного на стадии I (800 мг, 1,62 ммоля), и азида трибутилолова (1,88 г, 5,66 ммоля) в ксилоле (5 мл) перемешивали при 100 - 110oC в течение 24 ч. Реакционную смесь концентрировали в вакууме и остаток очищали препаративной хроматографией. Фракции, содержащие желаемый продукт, объединяли, концентрировали и получали целевое соединение, указанное в названии примера (675 мг), точка плавления 93,0 - 95,0oC.
Пример 22. Смесь этилового эфира 2-бутил-1-{/1-/2-(2H-тетразол-5-ил)-фенил/-1H-индол-4-ил/-метил} -4- (трифторметил)-1H-имидазол-5-карбоновой кислоты (400 мг, 0,744 ммоля) и водную гидроокись натрия (2н., 1,5 мл) в метаноле (5 мл) и перемешивали при комнатной температуре, оставляя на ночь. Реакционную смесь концентрировали в вакууме и остаток пропускали через колонку со смолой HP-20, элюируя водой, затем 30% метанола в воде. Фракции, содержащие желаемый продукт, концентрировали в вакууме и получали целевое соединение (387 мг), точка плавления выше 250oC.
Примеры 23 - 82. Используя описанную в заявке технологию и процедуры, приведенные в примерах выше, получали следующие дополнительные соединения (см. табл. 1):
Наименование соединений, которые были испытаны (см. табл. 2):
Пример 23. 2-Бутил-1-[[1-(2-(2H-тетразол-5-ил)фенил]-1H- индол-4-ил]-метил/-4-хлоро-1H-имидазол-5-карбоновая кислота, дилитиевая соль.
Пример 24. 2-Бутил-1-[[1-2-(2-(2H-тетразол-5-ил)фенил]-1H- индол-4-4-ил] -метил] -4-хлоро-1H-имидазол-5-карбоновая кислота, этиловый эфир, монолитиевая соль.
Пример 27. 2-бутил-1-[[1-(2-(2H-тетразол-5-ил)фенил]-1H-индол- 4-ил]-метил]-4-трифторметил-1H-имидазол-5-карбоновая кислота, динатриевая соль.
Пример 28. (2-Бутил-1-[[1-(2-(2H-тетразол-5-ил)фенил/1H-индол- -4-ил/-метил/-4-трифторметил-1H-имидазол-5-карбоновая кислота, этиловый эфир, монолитиевая соль.
Пример 31. 2-Бутил-1-[[1-(2-(2H-тетразол-5-ил)фенил/1H-индол-4- ил]-метил]-4-перфторэтил-1H-имидазол-5-карбоновая кислота, дилитиевая соль.
Пример 32. 2-Бутил-1-[[1-(2-(2H-тетразол-5-ил)фенил/-1H-индол-4- ил]-метил]-4-перфторэтил-1H-имидазол-5-карбоновая кислота, этиловый эфир.
Пример 33. 2-Бутил-[[1-(2-(2H-тетразол-5-ил)фенил]-1H-индол-4- ил]-метил] -4-перфторэтил-1H-имидазол-5-карбоновая кислота 2-метил- -1-(1-оксопропоксил)пропиловый эфир.
Пример 35. 2-бутил-1-[[1-(2-(2H-тетразол-5-ил)фенил]-2- трифторметил-1H-индол-4-ил] -метил] -4-хлоро-1H-имидазол-5-карбоновая кислота, дилитиевая соль.
Материалы и методы (Определение Kd)
Меченый ангиотензин II был закуплен в New England Nuclear, Boston MA, США. Пептиды: ангиотензин II (человеческий), /Sar', IIe8/ - ангиотензин II были получены в лаборатории Peninsula Labs, Belmont, CA США.
BMS 180, 560 и D и P 753 были синтезированы в отделении химии сердечно-сосудистых болезней фармацевтического института фирмы Бристоль-Майерз Сквибб Ко. Продукты "Dulbecco's modified Eagle's Medium" были закуплены в лаборатории GibcoLabs, Grand Island, NY, США.
RASM - клетки были любезно предоставлены доктором М.Рунге из кардиологического отделения Университета Emory, GA, США. B.C.A.-протеин-аналитический реагент был закуплен у фирмы Pierce, Rocrford IL, США. Альбумин бычьей сыворотки, 1,10-фенантролин, апротинин (из бычьего легкого), фетал телячьей сыворотки (дезактивированный нагреванием) были получены от фирмы Sigma Chemical Co, St Louis, Mo, США.
Приготовление мембран. Кора надпочечников крыс.
Крысы были убиты асфиксией CO2, надпочечники были удалены, кора была отделена от сердцевины при 4oC и помещена в охлаждаемый льдом буфер A(0,2 М сахарозы, 1 ммоль ЭДТА, 10 • моль Трис-HCl pH 7,4) и гомогенизирована в 10 объемах буфера A при 4oC, используя гомогенизатор фирмы Brinkmann Polytron. Гомогенизированный продукт центрифугировали при 1000 g в течение 10 мин при 4oC, супернатант повторно центрифугировали при 100000 g в течение 1 ч при 4oC. Таблетка была суспендирована в 50 ммоль Трис-HCl pH 7,4, 5 ммоль Mg Cl2 (2,5 объема буфера на исходный сырой вес) путем мягкой гомогенизации, используя гомогенизатор фирмы Potter-Elvehjem - стекло/телефон. Аликвоты (5 мл) приготовленных мембран были заморожены при концентрации протеина 0,1 мг протеина на 1 мл и хранились замороженными при -80oC до использования.
Клетки гладких мышц аорты крыс (RASM).
RASM - клетки выращивались при 37oC в колбах Т-75 во влажном воздухе (95% влажности), с содержанием CO2 5% в среде Dulbecco's (DMEM), содержащей буфер Hepes 10%-ный фетал бычьей сыворотки, 50 U/мл пенициллина и 50 мкг/мл стрептомицина (из лаборатории Gibco Labs).
RASM - клетки были использованы между превращениями 5-24. Приблизительно 90-100% слияния (5-7 дней) клетки были подвергнуты действию трипсина (2 мл 0,25% трипсина на 1 ммоль ЭДТА). Затем клетки собирали в буфер (0,1 ммоль фенилметилсульфанил фторида, 10 мкг/мл ингибитора на основе трипсина соевых бобов, 20 ммоль буфера Hepes с pH 7,4, растворенного в DMEM) при концентрации 3-4 • 105 клеток/мл. Клетки суспензии были промыты этим буфером и гомогенизированы в смеси из 50 ммоль Трис-HCl, 1 ммоль EGTA, 10 ммоль MgCl2, 0,24 TI единицы/мл апротинина, 0,1 мг/мл 1,10-фенантролина гомогенизатором фирмы Brinkmann Polytron (установка 7,3 по 6 с). Продукт гомогенизации был пропущен через два слоя марли и центрифугирован при 40000 в течение 20 мин при 4oC. Супернатант отбрасывали, а мембраны пересуспендированы в буфере и промыты три раза. Таблетка была пересуспендирована в этом буфере при концентрации 0,2-0,8 мг протеина на 1 мл раствора. Клетки продукта гомогенизации хранили в 1 мл аликвоты при -80oC до начала использования.
Связывание ангиотензина II и анализ радиометрическим методом.
Анализ проводили в общем объеме 250 мл в штативе для микротитрования. Инкубационная смесь содержала 50 мкл [125|JS|-A|| (80-200 pM, 70.000-180.000 cpm); 25 μl перемещенного лекарства или ангиотензина II, с тем, чтобы определить неспецифичное связывание (1 мкмоль); и инкубационный буфер. Связывание с мембранами из RASM - клеток проводилось в следующем буфере для анализа: 50 ммоль Трис - HCl pH 7,4, 5 ммоль MgCl2, 0,1% альбумина бычьей сыворотки, 1 ммоль PMSF, 0,24 TI единиц/мл апротинина, 0,1 мг/мл 1,10-фенантролина. Связывание с RAC мембранами проводилось обычным образом в следующем буфере для анализа: 50 ммоль Трис - HCl pH 7,4, 5 ммоль MgCl2, 0,22% BSA. В некоторых случаях концентрация BSA изменялась до 0,07 или 0,01%. Реакция связывания инициировалась добавлением 100 μl мембраны (7-12 мкг протеина), разбавленного в инкубационном буфере. Пробирки инкубировали при 37oC (для мембран из RASM клеток) или при 22oC (для RAC - мембран) в течение 2 ч при непрерывном встряхивании. Связанные и свободные радиолиганды отделялись при равновесии одновременным фильтрованием на коллекторе клеток в комбинации с фильтр-подложкой B, которая предварительно была вымочена в течение 1 ч в 0,1%-ном полиэтиленимине (PEI) для снижения неспецифического связывания. Фильтр-подложка был отмыт от избытка PEI во время предварительного цикла промывания, мембраны были профильтрованы и промыты 150 ммоль NaCl 5 ммоль Трис-HCl pH 7,4 при 4oC. Фильтр-подложка был удален и обработан микроволновым излучением в СВЧ-печи с верхней стороны мембраны при полной мощности 3 х 2 мин. Высушенный фильтр-подложку помещали в сборник для образцов, пластинку твердого сцинтилляционного воска Мелтилекс помещали на фильтр со стороны мембраны и вплавляли в подложку, используя устройство для запайки (Wallac, Pharmacia). Импрегнированный лист был подвергнут счету в жидком сцинтилляционном счетчике с эффективностью 60%.
Белковый анализ был выполнен на полученных мембранах с использованием реагента B.C.A. и сывороткой бычьего альбумина в качестве стандарта.
Испытание in vitro для антагонистов рецепторов ангиотензина II (определение KB),
Первичный скрининг на аорте кролика.
Сущность метода.
Ангиотензин II (A II) - пептидный гормон, вызывающий сужение сосудов при связывании его рецепторов на гладких мышцах сосудов (Chiu et al, 1989). Неуместно высокие уровни A II или возрастающая чувствительность сосудов к A II связаны с повышением тонуса сосудов и повышенным кровяным давлением. Разработаны пептидные антагонисты, предотвращающие связывание A II его рецепторами и вызывающие гипотензивный эффект на некоторых животных моделях. Тем не менее, как было показано, эти пептидные антагонисты имеют малое время жизни и ведут себя как частичные антагонисты (Wong et al 1989). Для содействия в открытии нового непептидного антагониста рецептора A II был проведен скрининг на изолированных мышцах аорты кролика с целью мониторинга за действием новых соединений на сокращение по отношению к A II.
Методики анализа. Растворы физиологической соли (PSS). PSS с бикарбонатным буфером содержали (в ммоль): 118,4 NaCl, 4,7 KCl, 1,2 MgSO4, 1,2 KH2PO4, 1,9 CaCl2 25,0 NaHCO3, 10,1 D - глюкозы и 0,01 ммоль Na2EDTA. Содержащие буфер растворы PSS используются для хранения ткани и содержат (в ммоль): 140,0 NaCl, 4,7 KCl, 1,2 Na2HPO4, 2,0 MOPS, 0,02 Na2EDTA, 1,6 CaCl2, 1,2 MgSO4 и 5,6 D - глюкозы.
Исследуемые соединения. Концентрированные (10 ммоль) исходные растворы исследуемых соединений готовятся ежедневно и серийно разбавляются до соответствующих концентраций. Водные растворы соединений используются непосредственно в мускульных камерах. Растворы нерастворимых в воде соединений готовятся в 50% или 100% ДМСО. A II растворяют в дистиллированной воде и в виде замороженных аликвот хранят при -4oC.
Приготовление тканей. Самцы новозеландских белых кроликов (2 - 3 кг) были убиты сверхдозами Бревиталя (1 - 1,5 мл: 50 мг/мл-раствора) инъекциями в маргинальную ушную вену. Грудная аорта быстро, но осторожно удалялась, отмывалась от крови, и осторожно очищалась от соединительной ткани в MOPS с буфером PSS, охлаждаемом льдом. Ткани сохраняли полную жизнеспособность в течение 4 дней, что обеспечивалось хранением их охлажденными в большом объеме буферного раствора MOPS - PSS, который ежедневно менялся.
Периферические полоски аорты (3,5 - 5,0 мм шириной) подвергались регистрации на изометрическое усилие между двух золотых зажимов в индивидуальной мускульной камере с рубашкой, содержащей PSS с бикарбонатным буфером, аэрировались газовой смесью 95% O2 - 5% CO2 и выдерживались при 37oC. Один из зажимов соединяли с микрометром для контроля длины ткани, а другой - с силовым датчиком и полиграфом. Полоски уравновешивали не менее 1 ч до натяжения с нагрузкой в 4 г, а затем подвергали сокращению с 80 ммоль KCl (из 4 М исходного раствора) для проверки на жизнеспособность. После максимального развития усилия полоски промывали раствором PSS с бикарбонатным буфером каждые 10 мин в течение 30 - 40 мин, для осуществления полной релаксации.
Получен кумулятивный концентрационный отклик кривой на A II (0,1 - 100 нМ). При каждой концентрации давали постоянное усилие (около 5 мин) перед добавлением следующей порции раствора. Вслед за порцией A II, вызывающей максимальное сокращение, полоски промывались PSS с бикарбонатным буфером каждые 15 мин в течение не менее 60 мин или до полной релаксации. Единственная порция (10 мкмоль) исследуемого соединения затем добавляется в раствор и инкубируется 15 мин, прежде чем повторяется концентрационный отклик кривой на A II. Один раз было получено максимальное силовое воздействие, когда 80 ммоль KCl добавляли при продолжительном присутствии A II и тестового соединения. Индуцированные с помощью KCl сокращения использовались в первую очередь для того, чтобы показать, что испытуемое соединение не вызывает неспецифических затуханий в отклике сокращений. Любое исследуемое соединение с KB ≤ 100 пМ исследовалось повторно при концентрации 0,1 мкмоль для подтверждения первоначального определения KB.
Статистика. Данные наносились на график как среднее значение для 4 различных животных. Значения EC50 вычислены для каждой ткани из уравнения прямой линии, соединяющей точки, соответствующие наибольшей концентрации, обеспечивающей менее чем 50%-ное сокращение, и наименьшей концентрации, обеспечивающей более чем 50%-ное сокращение. Величину единичной концентрации KB вычисляли по следующему уравнению:
где SQ представляет проверенную концентрацию SQ; - значение EC50, определенное в отклике к A II отдельно (Ariens and Var Rossum 1957, Arunlakshana и Schild 1959). Для соединений, проявляющих значительную блокирующую способность, график Шилда строится исходя из средних соотношений доз
- значение EC50, определенное в отклике к A II отдельно (Ariens and Var Rossum 1957, Arunlakshana и Schild 1959). Для соединений, проявляющих значительную блокирующую способность, график Шилда строится исходя из средних соотношений доз 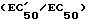 при нескольких концентрациях антагониста. Результаты представляют в виде значений pA2,
при нескольких концентрациях антагониста. Результаты представляют в виде значений pA2,  и KB. Величину pA2 вычисляют как отрезок, проходящий через средние соотношения доз на графике, где
и KB. Величину pA2 вычисляют как отрезок, проходящий через средние соотношения доз на графике, где  - простая трансформация величины pA2. KB выражается в виде среднего значения от всех индивидуальных значений KB и используется как справочная величина в различных химических синтезах.
- простая трансформация величины pA2. KB выражается в виде среднего значения от всех индивидуальных значений KB и используется как справочная величина в различных химических синтезах.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИФЕНИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ХИНОЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ | 1993 |
|
RU2122540C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИС(ГИДРОКСИМЕТИЛ)ЦИКЛОБУТИЛ ПУРИНОВ ИЛИ ПИРИМИДИНОВ | 1989 |
|
RU2041213C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТРИФТОРМЕТИЛМЕРКАПТАНА | 1991 |
|
RU2024504C1 |
| ПУРИНИЛ- ИЛИ ПИРИМИДИНИЛПРОИЗВОДНЫЕ МЕТИЛЕНЦИКЛОПЕНТИЛА | 1991 |
|
RU2037496C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2124503C1 |
| 7-ОКСАБИЦИКЛОГЕПТИЛЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ АМИДЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ ТРОМБОКСАНА | 1991 |
|
RU2015980C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРАНИЛ-ЦИАНОГУАНИДИНА | 1990 |
|
RU2057129C1 |
| ПРОИЗВОДНЫЕ БЕНЗАЗЕПИНА ИЛИ БЕНЗОТИАЗЕПИНА | 1989 |
|
RU2090562C1 |
| СЕРУЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ МЕВИНОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2041205C1 |
| ПРОИЗВОДНЫЕ ИНДОЛА | 1992 |
|
RU2061694C1 |

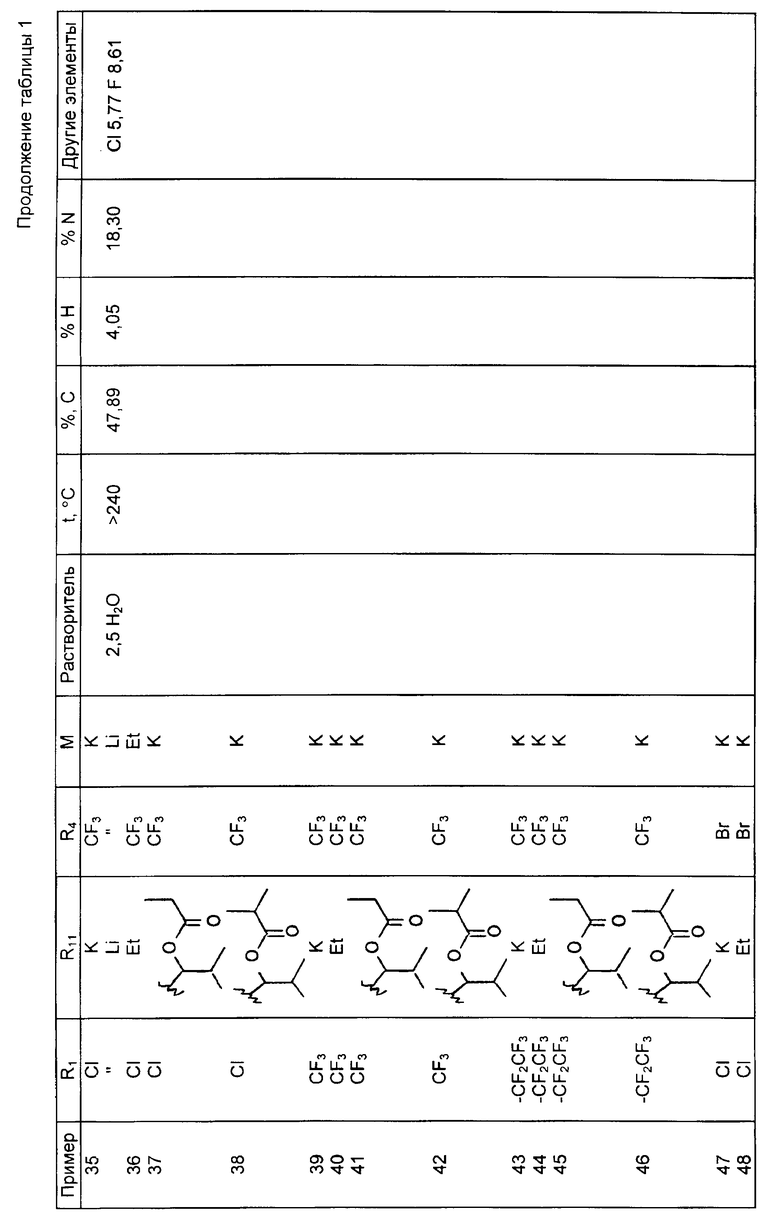




Описаны новые соединения, имеющие формулу I, в которой X, R1, R2, R3, R4,  и R5 определены в описании. Эти соединения ингибируют действие ангиотензина II и поэтому полезны, например, в качестве противогипертонических средств. Формула I приведена в описании. 19 з. и 2 с.п. ф-лы, 2 табл.
и R5 определены в описании. Эти соединения ингибируют действие ангиотензина II и поэтому полезны, например, в качестве противогипертонических средств. Формула I приведена в описании. 19 з. и 2 с.п. ф-лы, 2 табл.
qqqqС
| US, 4880804, A 61 K 31/535, 1989. |
Авторы
Даты
1998-05-20—Публикация
1991-10-30—Подача