Данная заявка является частичным продолжением заявки США N 07/837.782 от 14 февраля 1992 г.
Настоящее изобретение относится к новым замещенным хинолинам, которые могут использоваться как препараты, снижающие артериальное давление.
В соответствии с настоящим изобретением раскрываются новые соединения, подавляющие активность ангиотензина II. Эти соединения общей формулы I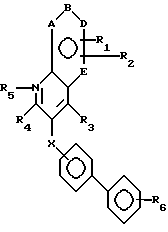
и их фармацевтически приемлемые соли и пролекарства.
В формуле I и далее в описании к заявке символы имеют следующие значения:
A, B, D и E обозначают атомы углерода или один из A, B, D и E является атомом азота;
X означает -O-, -CH2-, -S-, -SO-, -SO2-, -NH- или 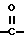
R1 и R2 являются заместителями у A, B, D или E, если A, B, D или E являются углеродом, и независимо отбираются из: водорода; алкила с 1-4 атомами углерода, замещенными, по желанию, заместителями, выбранными из амино, гидрокси или алкокси с 1-4 атомами углерода; алкокси с 1-4 атомами углерода, галогена; гидрокси; галоалкила; циано; нитро; амино; алкиламино или диалкиламино, имеющего до 6 атомов углерода; (диалкиламино)алкила с 3-8 атомами углерода; алканоила с 1-4 атомами углерода; карбамоила; (N-алкил)карбамоила или ди(N-алкил)карбамоила, имеющего до 7 атомов углерода; карбокси; алкоксикарбонила с 1-4 атомами углерода; алкилтио с 1-6 атомами углерода; алкилсульфинила с 1-6 атомами углерода; алкилсульфонила с 1-6 атомами углерода; алкилсульфонила с 1-6 атомами углерода;
R3 является -CO2H, -CO2R7, -CH2OH, -CHO, -CONHOR10, -CONHR8, -CONR8R8, -CONH2 или -CONHSO2CF3;
R4 является водородом, алкилом, алкенилом, алкинилом, арилалкилом, циклоалкилом, (циклоалкил)алкилом, фенилом или алкилом, замещенным 1 или более атомами фтора;
R5 является факультативным атомом кислорода;
R6 является азотом, -CO2R9, -NHSO2CF3, 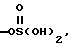 , -SO3H, -C(CF3)2OH,
, -SO3H, -C(CF3)2OH, 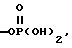 , -PO3H2,
, -PO3H2, 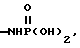 , -CONHSO2CF3, -CONHOR10,
, -CONHSO2CF3, -CONHOR10,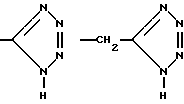
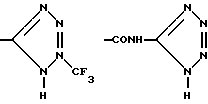 ,
,
-CONHOR10,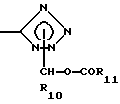
R7 является алкилом, арилом, арилалкилом, арилоксиалкилом, -CH2-COOR8, 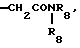

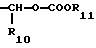 или инданилом;
или инданилом;
R8 и R8' являются независимо низшим алкилом;
R9 является водородом, алкилом, перфторалкилом с 1-8 атомами углерода, циклоалкилом с 3-6 атомами углерода, фенилом, бензилом, 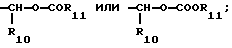
R10 является водородом, алкилом, арилом, арилалкилом или циклоалкилом;
R11 является алкилом, арилом, алкиларилом, арилалкилом или циклоалкилом;
R12 является водородом, алкилом с 1-5 атомами углерода или фенилом; и
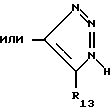
R13 является -CN, -NO2 или -CO2R9.
Настоящее изобретение относится к соединениям формулы I, к фармацевтическим композициям с такими соединениями и к способам применения таких соединений. Ниже перечислены определения различных терминов, использовавшихся для описания соединений настоящего изобретения. Эти определения даны для терминов в таком значении, как они используются во всем описании к заявке (если они не меняют значения в конкретных случаях), либо по отдельности, либо как часть большей группы.
Термин "алкил" относится к группам как с неразветвленными, так и с разветвленными цепями, имеющим 1-10 атомов углерода. Предпочтительными являются алкильные группы с 1-4 атомами углерода.
Термины "алкенил" и "алкинил" относятся к группам как с неразветвленной, так и с разветвленной цепью. Предпочтительными являются те группы, которые имеют 2-10 атомов углерода.
Термин "циклоалкил" относится к группам, имеющим 3-8 атомов углерода.
Термин "алкокси" относится к группам, имеющим 1-8 атомов углерода. Предпочтительными являются группы с 1-3 атомами углерода.
Термин "галоген" или "гало" относится к фтору, хлору, брому и йоду, предпочтительными являются фтор и хлор.
Термин "галоалкил" относится к таким алкильным группам, как описано выше, у которых один или более атомов водорода замещены хлором, бромом или фтором, так, как в трифторметиле, пентафторэтиле, 2,2,2-трихлорэтиле, хлорметиле, бромметиле; предпочтительным является трифторметил.
Термин "арил" относится к фенилу или нафтилу, или к замещенным фенилу или нафтилу с заместителями, выбранными из галогенов, алкильной, алкокси-, карбокси-, алкилтио-, гидрокси-, алканоил-, нитро-, амино-, алкиламино-, диалкиламино- или трифторметиловой групп. Предпочтительными арильными группами являются фенил и однозамещенный фенил и фенил.
Термин "гетероцикло" относится к полностью насыщенным или ненасыщенным кольцам из 5 или 6 атомов, содержащим 1-4 атома азота, или один атом кислорода, или один атом серы, или один атом кислорода и один или два атома азота, или один атом серы и один или два атома азота. Предпочтительные моноциклические гетероциклические группы включают 2- и 3-тиенил, 2- и 3-фурил, 2-, 3- и 4-пиридил и имидазолил. Гетероцикл может также иметь заместитель, выбранный из алкила с 1-4 атомами углерода, карбокси, алкокси с 1-4 атомами углерода и алкилтио с 1-4 атомами углерода, у свободного атома углерода. Термин гетероцикло- также включает бициклические кольца, в которых пяти- или шестичленное кольцо, содержащее атомы кислорода, серы и азота, сопряжено с бензольным кольцом, и бициклическое кольцо присоединяется через свободный атом углерода в бензольном кольце. Предпочтительные бициклические гетероциклогруппы включают 4-, 5-, 6- или 7-индолил, 4-, 5-, 6- или 7-изоиндолил, 5-, 6-, 7- или 8-хинолинил, 5-, 6-, 7- или 8-изохинолинил, 4-, 5-, 6- или 7-бензотиазолил, 4-, 5-, 6- или 7-бензоксазолил, 4-, 5-, 6- или 7-бензимидазолил, 4-, 5-, 6- или 7-бензоксадиазолил и 4-, 5-, 6- или 7-бензфуранил. Предпочтительные сопряженные гетероциклы включают тиенил, фурил, пиридил и имидазолил, факультативно замещенные, как описано выше.
Термин "замещенная амино-" относится к группе формулы -NZ1Z2, в которой Z1 является водородом, алкилом или арил-(CH2)p- и Z2 является алкилом или арил-(CH2)p-, или Z1 и Z2 вместе с атомом азота, к которому они присоединены, образуют 1-пирролидинил, 1-пиперидинил, 1-азепинил, 4-морфолинил, 4-тиаморфолинил, 1-пиперазинил, 4-алкил-1-пиперазинил, 4-арилалкил-1-пиперазинил, 4-диарилалкил-1-пиперазинил или 1-пирролидинил, 1-пиперидинил или 1-азепинил, замещенные алкил, алкокси, алкилтио, гало, трифторметил или гидрокси.
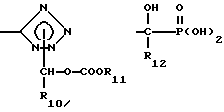
Нужно принять во внимание, что настоящее изобретение включает формы пролекарства, такие, как эфир, в особенности, (5-замещенные 2-оксо-1,3-диоксолен-4-ил)метиловые эфиры, например, такой структуры: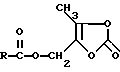
(F. Sakamoto, S. Ikeda, G. Tsukamoto, Chem Pharm Bull, Voll. 32, pp. 2241-2248, 1984), ацетальные и/или смешанные ацетальные производные соединений формулы I. Например, такие производные даны в Design of Prodruqs п/ред. H. Bundgard (Elsevier, 1985) и Methods in Enzymology, Vol 42, p. 309-396, п/ред. K. Widder et al. (Academic Press, 1985). Далее, понятно, что любая часть у R3 и/или R6, которая будет отщеплена in vivo, с образованием кислой части R3 и/или R6, соответствует духу и рамкам этого изобретения.
Примерный способ получения соединений формулы I, где A, B, D и E - атомы углерода, R1 и R2 - водород и X - кислород, включает реакцию фенола формулы II
с галокетоном формулы III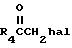
где
Hal обозначает галоген, в присутствии основания, такого, как углекислый калий, с образованием кетонов формулы IV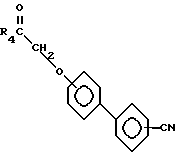
Соединения формулы IV затем вступают в реакцию с изатином (так, как это показано в "Advances in Heterocyclic Chemistry", п/ред. A.R. Katritzky, A.J. Boulton. Vol. 18, глава, написанная F.D. Popp., p. 1 - 58, (1975)), в воде (или в воде с добавлением органического сорастворителя, такого, как этанол) в присутствии основания, такого, как едкий кали, образуя амиды формулы V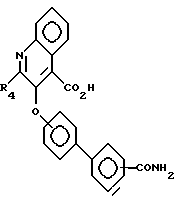
Соединения формулы V затем вступают в реакцию с дегидратирующим веществом, таким, как трифторуксусный ангидрид, в органическом растворителе, таком, как диоксан, в присутствии основания, такого, как пиридин, образуя соединения формулы VI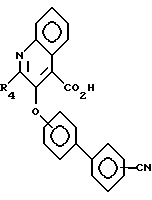
Соединения формулы VI затем вступают в реакцию с азидом, таким, как трибутилтиназид, в органическом растворителе, таком, как ксилол, образуя соединения формулы I, где R6 - 5-тетразолил.
Соединения формулы VI могут, в порядке альтернативы, вступать в реакцию с азидом, таким, как трибутилтиназид, образуя соединения формулы VIа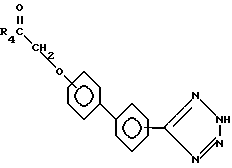
Соединения формулы VIa могут вступать в реакцию с факультативно замещенным изатином в воде, в присутствии основания, такого, как едкий кали, образуя соединения формулы I, где R6 - 5-тетразолил.
Соединения формулы II получаются при реакции соединений формулы VII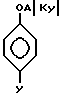
где
Y - бром или хлор, с алкил-литием, таким, как бутиллитий, затем - с солью цинка, такой, как хлорид цинка, в органическом растворителе, таком, как тетрагидрофуран, давая соединения формулы VIII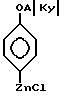
которые затем реагируют с арилгалидом, таким, как 2-бромбензонитрил, в присутствии катализатора, такого, как тетракис (трифенилфосфин)палладий(O), образуя соединения формулы IX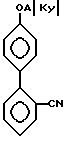
которые затем реагируют с кислотой, такой, как трибромид бора, в органическом растворителе, таком, как метиленхлорид.
Соединения формулы III могут быть получены при реакции соединения формулы X
с диазометаном, образуя промежуточный диазокетон, который превращается в соединения формулы III при реакции с сухим газообразным галоидоводородом (H-hal).
Примерный способ получения соединений формулы I, где A, B, D - атомы углерода и E - атом азота, R1 и R2 - водород и X - кислород, включает реакцию кетона формулы IV с соединением формулы XI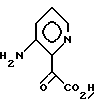 или XIa
или XIa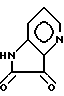
в воде (или в воде с органическим сорастворителем, таким, как этанол) в присутствии основания, такого, как едкий кали, с образованием амидов формулы XII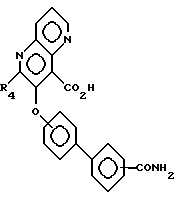
Соединения формулы XII затем реагируют с дегидратирующим веществом, таким как трифторуксусный ангидрид, в органическом растворителе, таком, как диоксан, в присутствии основания, такое как пиридин, образуя соединения формулы XIII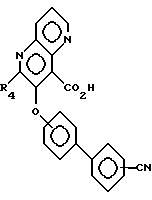
Соединения формулы XIII вступают затем в реакцию с азидом, таким, как трибутилтиназид, в органическом растворителе, таком, как ксилол, образуя соединения формулы I, где R6 - 5-тетразолил и E - атом азота.
Альтернативно, соединения формулы I, где A, B, D - углерод и E - азот, и R1 и R2 - водород, могут быть получены при реакции соединения формулы IVa с соединением формулы XIa в воде (или в воде с органическим сорастворителем, таким, как этанол) в присутствии основания, такого, как едкий кали, с образованием соединений формулы I, где R6 - 5-тетразолил и E - азот.
Соединения формулы XI или XIa получаются при реакции соединения формулы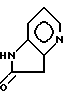
(синтез соединения формулы XIV описали Finch, N.; Robinson, M.M.; Valerio, M. P., Journal of Organic Chemistry (1972), Vol., 37, pp. 51 - 54) с бромирующим веществом, таким, как N-бромсукцинимид, в растворителе, таком, как трет-бутанол, с образованием соединения формулы XV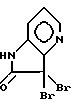
Соединение формулы XV можно подвергнуть гидролизу до соединения формулы XI в реакции с серебряной солью, такой, как трифторацетат серебра, в органическом растворителе, таком, как ацетонитрил, с последующей обработкой водой.
Примерный способ получения соединений формулы I, где A - атом азота, B, D и E - атомы углерода, R1 и R2 - водород и X - кислород, включает реакцию кетона формулы IV с соединением формулы XVI или XVIa
или XVIa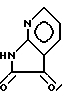
в воде (или в воде с органическим сорастворителем, таким, как этанол) в присутствии основания, такого, как едкий кали, с образованием амидов формулы XVII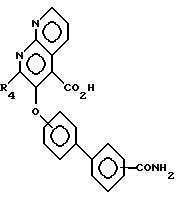
Соединения формулы XVII затем вступают в реакцию с дегидратирующим веществом, таким, как трифторуксусный ангидрид, в органическом растворителе, таком, как диоксан, в присутствии основания, такого, как пиридин, образуя соединения формулы XVIII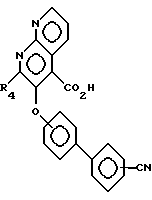
Затем соединения формулы XVIII вступают в реакцию с азидом, таким, как трибутилтиназид, в органическом растворителе, таком, как ксилол, образуя соединения формулы I, где R6 - 5-тетразолил и A- атом азота.
Другим способом можно получить соединения формулы I, где A - атом азота, и B, D, E - атомы углерода, и R1 и R2 - атомы водорода, при помощи реакции соединения формулы IVa с соединением формулы XVIa в воде (или в воде с органическим сорастворителем, таким, как этанол) в присутствии основания, такого, как едкий кали; получаются соединения формулы I, где R6 - 5-тетразолил и A - азот.
Соединение формулы XVI получают при реакции соединения формулы XIX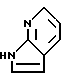
с бромирующим веществом, таким, как пиридин-бромид пербромид (как описывается Marfat, A; Carta, M.P.; Tetrahedron Letters (1987), Vol. 28, pp. 4027-4030)
Образуется соединение формулы XX
Соединение формулы XX может затем подвергнуться гидролизу до соединения формулы XVI или XVIA, путем реакции с серебряной солью, такой, как трифторацетат серебра, в органическом растворителе, таком, как ацетонитрил, с последующей обработкой водой.
Примерный способ получения соединения формулы I, где R3 - -CO2R7 и R7 - 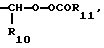 включает реакцию соединения формулы I, где R6 - 5-тетразолил и R3 - -CO2H, с трифенилхлорметаном в присутствии основания, такого, как триэтиламин, в растворителе, таком, как ацетон; получаются соединения формулы XXI
включает реакцию соединения формулы I, где R6 - 5-тетразолил и R3 - -CO2H, с трифенилхлорметаном в присутствии основания, такого, как триэтиламин, в растворителе, таком, как ацетон; получаются соединения формулы XXI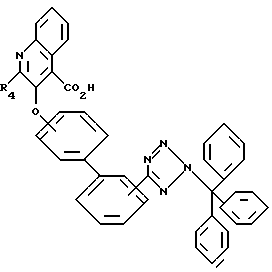
Соединения формулы XXI могут затем вступать в реакцию с соединением формулы XXII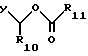
где
Y - галоген,
в органическом растворителе, таком, как диметилформамид, с основанием, таким, как углекислый цезий, образуя соединения формулы XXIII
Соединения формулы XXIII могут затем реагировать с кислотой, такой, как водная соляная кислота, в растворителе, таком как тетрагидрофуран, давая соединения формулы I, где R6 - 5-тетразоил.
Соединения формулы XXII можно создать при помощи реакции алкила соляной кислоты, такого, как пропионилхлорид, с солью цинка, такой, как хлорид цинка, с последующим добавлением алкилальдегида, такого, как изобутиральдегид.
Примерный способ получения соединений формулы I, где A, B, D и E - атомы углерода, R1 и R2 - водород, R6 - 5-тетразолил и X - сера, включает реакцию тиофенола формулы XIV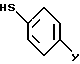
где
Y - бром или хлор,
с метилйодидом, в присутствии основания, такого, как углекислый калий, в растворителе, таком, как диметилформамид, с образованием продукта формулы XXV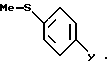
Соединения формулы XXV реагируют затем с алкил-литием, таким, как бутил-литий, потом - с солью цинка, такой, как хлорид цинка, в органическом растворителе, таком, как тетрагидрофуран, давая соединения формулы XXVI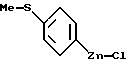
которые затем вступают в реакцию с арилгалидом, таким, как 2-бромбензонитрил, в присутствии катализатора, такого, как тетракис(трифенилфосфин)палладий(O), давая соединения формулы XXVII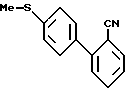
Соединения формулы XXVII затем последовательно вступают в реакцию с окислителем, таким как m-хлорпербензойная кислота, потом - с ангидридом, таким, как трифторуксусный ангидрид, и, наконец, с раствором триэтиламина в метаноле, что дает продукты формулы XXVIII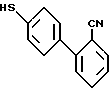
(процесс описан у R.N. Young, J.Y. Gauthier, and W. Coombs, Tetrahedron Lett, (1984), Vol. 25, 1753).
Соединения формулы XXVIII затем вступают в реакцию с галокетоном формулы III в присутствии основания, такого, как углекислый калий, в растворителе, таком, как диметилформамид, образуя арилтиокетоны формулы XXIX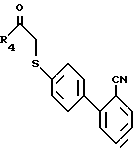
которые могут вступать в реакцию с триалкилтиназидовым реактивом, таким, как три-н-бутилиназид, образуя тетразол-кетоновые продукты формулы XXX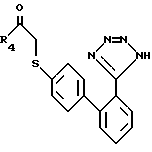
Затем соединения формулы XXX вступают в реакцию с факультативно-замещенным изатином (так, как это описано в "Advances in Heterocyelic Chemistry, п/ред. A. R. Ketritsky, A.J. Boulkon, Vol. 18, глава, написанная F.D. Popp, pp. 1 - 580 (1975)) в воде (или в воде с органическим сорастворителем, таким, как этанол), в присутствии основания, такого, как едкий кали, образуя соединения формулы XXXI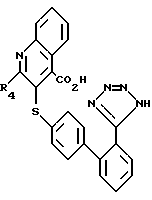
Как было показано ранее, а-арилтио-замещенные кетоны участвуют в пфитцингеровском синтезе хинолина (Badische Anilin - und Soda-Fabrik, Ger. Pet. 335, 197; Cem. Abstr (1923), Vol. 17, 1802).
Для получения соединений формулы I, у которых X - -SO- (сульфоксидная функциональная группа), можно последовать процессу получения соединений формулы XXXI, за исключением того, что соединение формулы XXX заменяется соединением формулы XXXII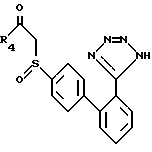
которое можно получить обработкой соединения формулы XXX одним эквивалентом окислителя, такого, как мета-хлорпербензойная кислота.
Для получения соединений формулы I, у которых X - -SO- (сульфоновая функциональная группа), можно последовать процессу получения соединений формулы XXXI, за исключением того, что соединение формулы XXX заменяется соединением формулы XXXIII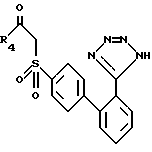
которое можно получить обработкой соединения формулы XXX двумя эквивалентами окислителя, такого, как мета-хлорпербензойная кислота.
Примерный способ получения соединений формулы I, где A, B, D и E - атомы углерода, R1 и R2 - водород, R6 - 5-тетразолил и X - N - H, включает реакцию амина формулы XXXIV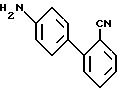
с галокетоном формулы III, где hal галоген, в присутствии основания, такого, как углекислый калий, в органическом растворителе, таком, как N,C-диметилформамид; образуются кетоны формулы XXXV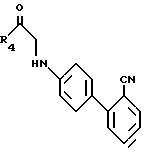
Соединения формулы XXXV могут затем вступать в реакцию с азидом, таким, как три-н-бутилтиназид, в органическом растворителе, таком, как ксилол, образуя соединения формулы XXXVI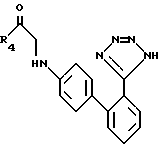
Соединения формулы XXXVI вступают затем в реакцию с факультативно-замещенным изатином (так, как это показано в "Advances in Heterocyclic Chemistry", п/ред. A.R. Katritsky, A.J. Boultor, Vol. 18, глава, написанная E.D. Popp, pp. 1 - 58, (1975)) в воде (или в воде с органическим сорастворителем, таким, как этанол), в присутствии основания, такого, как едкий кали, образуя соединения формулы I, где X - N - H и R6 - 5-тетразолил. Как было показано ранее, а-аминокетоны участвуют в пфитцингеровском синтезе хинолина (H. De Diesboch, E. Moser, Helv. Chim. Acta (1937), Vol. 20, 132).
Соединения формулы XXXIV можно получить при реакции соединений формулы XXXVII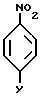
где
y - бром или хлор, с алкил-литием, таким, как н-бутил-литий, потом с солью цинка, такой, как хлорид цинка, в органическом растворителе, таком, как тетрагидрофуран, что дает соединения формулы XXVIII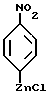
которые затем вступают в реакцию с арилгалидом, таким, как 2-бромбензонитрил, в присутствии катализатора, такого, как тетракис(трифенилфосфин)палладий(O) с образованием соединений формулы XXXIX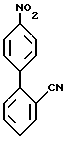
которые можно затем восстановить при помощи восстановителя, такого, как водород, и катализатора, такого, как 10% палладий на углероде, в органическом растворителе, таком, как этилацетат, до образования соединений формулы XXXIV.
Примерный способ получения соединений формулы I, где A, B, D и E- атомы углерода, R1 и R2 - водород, R6 - тетразолил и X - -CO-, включает реакцию бромида формулы XL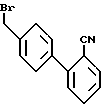
с диметилсульфоксидом в присутствии основания, такого, как бикарбонат натрия, с образованием альдегида формулы XLI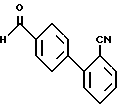
Процесс получения бромида формулы XL описан у D.J. Carini et al., J. Med. Chem. (1991), Vol. 34, 2525.
Соединение формулы XLI вступает в реакцию с кетоном формулы XLII
R4-CO-CH3
в присутствии основания, такого, как диизопропиламид лития, в органическом растворителе, таком, как тетрагидрофуран, с образованием кетонов формулы XLIII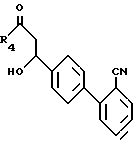
которые затем можно защитить реакцией с хлорметилметилэфиром в присутствии основания, такого, как диизопропилэтиламин, в органическом растворителе, таком, как дихлорметан, чтобы получить соединения формулы XLIV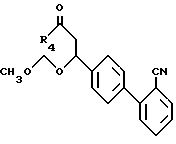
Соединения формулы XLIV подвергаются затем реакции с азидом, таким, как три-н-бутилтиназид, в органическом растворителе, таком, как ксилол, чтобы образовать соединения формулы XLV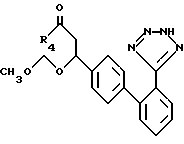
Соединения формулы XLV вступают затем в реакцию с факультативно-замещенным изатином (так, как описано в "Advances in Heterocyclic Chemistry", п/ред. A. R. Katritsky, A.J. Boulton, Vol. 18, глава, написанная E.D. Popp, pp. 1 - 58 (1975)), в воде (или в воде с органическим сорастворителем, таким, как этанол), в присутствии основания, такого, как едкий кали, чтобы образовать соединения формулы XLVI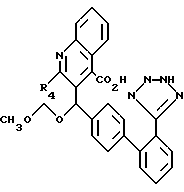
Затем соединения формулы XLVI реагируют с кислотой, такой, как соляная кислота, в органическом растворителе, таком как метанол, образуя соединения формулы XLVII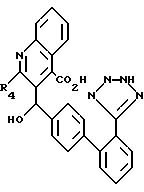
которые можно окислить при помощи таких окислителей, как диметилсульфоксид и оксалил хлорид, в присутствии основания, такого, как диизопропилэтиламин, в органическом растворителе, таком, как дихлорметан, чтобы получить соединения формулы I, где X - -CO- и R6 - 5-тетразолил.
Чтобы получить соединения формулы I, где A, B, D и E - атомы углерода, R1 и R2 - водород, R6 - 5-тетразолил и X - -CH2-, спирт формулы XLVII восстанавливается такими восстановителями, как водород в присутствии катализатора, такого, как 10% палладий на углероде.
Предпочтительными соединениями настоящего изобретения являются те, у которых
R1 и R2 являются независимо: водородом, метил-, метоксихлоридом или бромом;
R3 - -COOH, -COOR7, где R7 - этил, пропил, бутил, 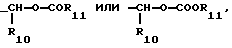
где R10 и R11 независимо, являются метилом, этилом, изопропилом или трет-бутилом;
R4 - метил, этил, пропил, бутил, пентил, циклопропил, трифторметил или пентафторэтил;
R5 - является кислородом или отсутствует;
R6 - 5-тетразолил, или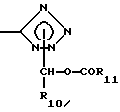

где R10 и R11 - такой же, как указано выше;
X - кислород, сера или -SO2; и
A, B, D и E - все представлены углеродом или A или E - азотом.
Самыми предпочтительными являются соединения формулы I, где
R1 и R2 - независимо являются водородом, бромом или хлором;
R3 - COOH или -COOR7, 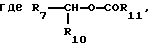
где R10 - метил или изопропил и R11 - метил, этил, трет-бутил или изопропил;
R4 - метил, этил, пропил или циклопропил;
R5 - кислород или отсутствует;
R6 - 5-тетразолил;
X - кислород; и
A, B, D и E - все представлены углеродом, или A, B и D представлены углеродом, а E - азотом.
Предпочтительными пролекарствеными формами соединений формулы I являются эфиры, в особенности, (5-замещенный 2-оксо-1,3-диоксолен-4-ил)метиловый эфир.
Представленные соединения формулы I тормозят действие гормона ангиотензина П (А-П) и поэтому полезны, например, как средства, снижающие артериальное давление.
Ангиотензин I образуется под действием фермента ренина на псевдоглобулин плазмы крови - ангиотензиноген. Под действием ангиотензин-конвертирующего фермента (АКФ) ангиотензин I превращается в А-П. Последний является активным прессорным веществом, которому приписывается причинная роль при некоторых формах гипертензии у различных видов млекопитающих, напр. у людей. Соединения этого изобретения ингибируют действие А-П на его рецепторы на клетках-мишенях и таким образом предупреждает повышение кровяного давления, создаваемое взаимодействием этого гормона с рецептором. Таким образом, введением композиции, содержащей одно (или комбинацию) из соединений этого изобретения, облегчается ангиотензин-зависимая гипертензия у страдающих ею некоторых видов млекопитающих (напр. у людей). Однократная доза, или предпочтительно два-четыре приема лекарства в день, установленные из расчета приблизительно 0,1 - 100 мг/кг массы тела в сутки, предпочтительно, около 1 - 15 мг/кг массы тела в сутки, достаточна, чтобы снизить артериальное давление. Вещество предпочтительно вводить перорально, но могут использоваться также интраназальный, трансдермальный и парэнтеральный способы введения, такие как подкожное, внутримышечное, внутривенное или интраперитонеальное. Соединения этого изобретения также полезны при лечении застойной сердечной недостаточности и гипертрофии миокарда. К тому же, с точки зрения роли этих соединений в ренин-ангиотензиновой системе, описанной выше, раскрытые здесь соединения-антагонисты А-П должны быть, как ожидается, полезны при тех же или подобных показаниях, что и разработанные для ингибиторов АКФ.
Соединения этого изобретения могут также прописываться в сочетании с диуретиками при лечении гипертензии. Комбинированный препарат, состоящий из соединения этого изобретения и диуретика, может вводиться в эффективной дозе, составляющей общую суточную дозу около 30 - 600 мг, предпочтительно, около 30 - 330 мг соединения этого изобретения, и около 15 - 300 мг, предпочтительно, около 15 - 200 мг диуретика, при необходимости, любому виду млекопитающих. Для применения в сочетании с соединениями данного изобретения рассматривались тиазидовые диуретики, напр. хлортиазид, гидрохлортиазид, флуметиазид, гидрофлуметиазид, бендрофлуметиазид, метилхлортиазид, трихлорметиазид, политиазид или бензтиазид, а также этакриновая кислота, тикринафен, хлорталидон, фуросемид, музолимин, буметанид, триамтерен, амилорид и спиронолактон, и соли этих соединений.
Соединения формулы I можно прописывать для снижения кровяного давления в композициях, таких как таблетки, капсулы или эликсиры для перорального введения, в стерильных растворах или суспензиях для парэнтерального или интраназального введения, или в накладках для чрескожного введения. Около 10 - 500 мг соединения формулы I, вместе с физиологически приемлемыми наполнителями, носителем, связующим веществом, скрепляющим средством, консервантом, стабилизатором, вкусовой добавкой и т.д., составляют унифицированную форму выпуска лекарственной дозировки, как требуется в общепринятой фармацевтической практике. Количество активного начала в этих композициях или препаратах достаточно для достижения нужной дозировки в указанных пределах.
Следующие примеры и препараты описывают способ и порядок воплощения и применения изобретения и являются скорее иллюстративными, чем ограничительными. Нужно учесть, что возможны другие воплощения, соответствующие духу и рамкам этого изобретения, как определяется прилагающимися пунктами.
Пример 1
2-Пропил-3-[[2'-(2H-тетразол-5-ил)1,1'-бифенил]-4-ил]окси]-4- хинолинкарбоновая кислота, дилитиевая соль
A. 1-Хлор-2-пентанон
Бутирилхлорид (10 мл, 97 ммоль) растворялся в сухом диэтилэфире (100 мл) и охлаждался до 0oC. Раствор диазометана в эфире (194 ммоль) добавлялся, и реакция проводилась в течение 16 часов при -10oC. Затем светло-желтый раствор обрабатывали газообразным хлористым водородом до обесцвечивания. Эфир удалялся, и остаток перегоняли в вакууме (50 - 56oC/10 - 15 мм рт. ст.), чтобы получить заданное соединение в виде бесцветной жидкости (7,4 г, выход 64%).
B. 4'-Гидрокси[1,1'-бифенил]-2-карбонитрил
К раствору 4-броманизола (18,7 г, 0,1 моль) в безводном тетрагидрофуране (200 мл) при -78oC добавлялся раствор n-BuLi (2,5 молярный раствор, 40 мл) в гексане. После перемешивания в течение 30 минут, добавлялся раствор хлорида цинка в эфире (1 молярный раствор, 100 мл). Смесь перемешивалась в течение 1 часа при -78oC, затем добавляли Pd (Ph3P)4 (0,85 г, 0,73 ммоль) и 2-бромбензонитрил (18,2 г, 0,1 моль). Реакционная смесь перемешивалась при комнатной температуре в течение ночи, а затем концентрировалась в вакууме. Остаток разделялся на части между этилацетатом (400 мл) и 1 н. соляной кислотой (100 мл). Органический раствор промывали раствором соли и высушивали над сульфатом магния. Концентрация в вакууме давала промежуточный продукт 4'-метокси[1,1'-бифенил] -2-карбонитрил, который непосредственно использовался на следующей стадии (соединение можно растереть в порошок с эфиром, чтобы получить чистый сухой продукт). К раствору промежуточного продукта в метиленхлориде (150 мл) при -78oC добавлялся трибромид бора (1 молярный раствор, 200 мл) в метиленхлориде. Образовавшийся раствор перемешивался при комнатной температуре в течение ночи. Реакцию останавливали очень медленным добавлением 100 мл метанола с температурой -78oC. Затем смесь вливали в ледяную воду. К водной смеси добавляли этилацетат (300 мл), органический слой промывали водой и осушали над сульфатом магния. Сгущение в вакууме давало сухой продукт, который растирали в порошок с эфиром, чтобы получить названный продукт (11,5 г, выход 59%). При необходимости продукт можно очистить в колонке с силикагелем, элюируя смесью толуол/этилацетат (4: 1); точка плавления 177 - 178oC.
C. 4'-(2-Оксопентилокси)[1,1'-бифенил]-2-карбонитрил
Йодид калия (30 мг, 0,17 ммоль) растворяли в ацетоне (1,5 мл). Соединение A (185 мг, 1,54 ммоль) добавлялось к раствору, за ним - соединение B (200 мг, 1,02 ммоль) и углекислый калий (212 мг, 154 ммоль). Реакционная смесь коричневого цвета нагревалась до 50oC в течение 6,5 часов, затем ее перемешивали при комнатной температуре в течение 16 часов. После этого смесь адсорбировали на силикагеле и очищали тонкослойной хроматографией на силикагеле и элюировали смесью 5% ацетона, 45% толуола, 50% гексана; полученное соединение имело вид коричневого масла (260 мг, 91%).
D. 3-[[2'(аминокарбонил)[1,1'-бифенил] -4-ил]окси]-2-пропил-4- хинолинкарбоновая кислота
Из соединения C (120 мг, 0,43 ммоль) с едким кали (1,1 мл, 30% воды) готовили взвесь, добавляли изатин (63 мг, 0,43 ммоль), реакция шла при нагревании до 105oC в течение 8 часов. Смесь подкисляли соляной кислотой и экстрагировали этилацетатом. Органические экстракты объединяли, осушали над сульфатом магния и удаляли растворитель. Остаток очищали тонкослойной хроматографией на силикагеле, элюировали смесью 5% уксусной кислоты, 20% ацетона и 75% толуола, получали соединение в виде желтой массы (111 мг, 61%), т. пл. 230oC.
E. 3-[(2'-циано[1,1'-бифенил]-4-ил)окси]-2-пропилхинолинкарбоновая кислота
Соединение D (103 мг, 0,24 ммоль) растворяли в диоксане (1,3 мл) и добавляли трифторуксусный ангидрид (68 мкл, 0,48 ммоль) и пиридин (59 мл, 0,73 ммоль). Смесь перемешивали 25 часов при комнатной температуре. Дополнительное количество трифторуксусного ангидрида добавляли через 20 часов (17 мкл, 0,12 ммоль) и после 23 часов (10 мкл, 0,071 ммоль). Реакцию останавливали соляной кислотой (1 н. водный раствор) и экстрагировали этилацетатом. Органические экстракты объединяли, осушали над сульфатом магния и удаляли растворитель; получали заданное сухое вещество (91 мг, 93%).
F. 2-Пропил-3-[[2'-(2H-тетразол-5-ил)[1,1'бифенил-4-ил] -окси]- 4-хинолинкарбоновая кислота, дилитиевая соль
Соединение E (85 мг, 0,21 ммоль) суспендировали в параксилоле (400 мкл), добавляли трибутилтиназид (242 мг, 0,73 ммоль) (H.R.Kricheldorf, E.Leppert, Synthesis, 329 (1976)). Реакцию проводили при нагревании до 110oC в течение 72 часов. Реакционную смесь коричневого цвета охлаждали до комнатной температуры и размешивали с метанолом 30 минут. Затем смесь адсорбировали на 2 г силикагеля и очищали при тонкослойной хроматографии на 25 г силикагеля, элюируя смесью 5% уксусной кислоты, 25% ацетона, 70% толуола; получали 65 мл бледно-желтого сухого вещества. Этот материал растворяли в смеси из 800 мкл гидроксида лития (1 н. водный раствор), 800 мкл воды и 400 мкл метанола и очищали в хроматографической колонке с HP20 полистиролом (объем колонки 20 мл), элюировали водой, 5% водным ацетоном и 10% водным ацетоном, по 50 мл каждого. Фракции, содержащие продукт, объединяли и лиофилизировали; получали литиевую соль в виде белого сухого вещества (50 мг, 53%); т. пл. >270oC.
Анализ элементов по формуле C26H19N5O3Li2•3,57H2O
Расчетные величины: C 59,18; H 4,99; N 13,27.
Полученные показатели: C 59,21; H 4,78; N 13,10.
Пример 2
2-Этил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси] - 4-хинолинкарбоновая кислота, дилитиевая соль
A. 4'-(2-оксобутилокси)[1,1'-бифенил]-2-карбонитрил
Смесь, содержащую соединение B из примера 1 (3 г, 15,4 ммоль), 1-бром-2-бутанон (3,47 г, 23 ммоль) и углекислый цезий (10 г, 30,7 ммоль) в диметилформамиде (22 мл) нагревали в течение ночи в закупоренном флаконе. Большую часть диметилформамида удаляли при сгущении в вакууме. Продукт экстрагировался этиловым эфиром, промывался водой и солевым раствором, осушался (сульфат магния) и концентрировался в вакууме; получали промежуточный продукт (5 г). Очищали тонкослойной хроматографией на мерк-силикагеле (180 г), элюировали смесью 6:1 гексаны/этилацетат; получали соединение в виде желтого масла (1,74 г, 43%).
B. 3-[[2'-(Аминокарбонил)[1,1'-бифенил] -4-ил] окси-2-этил- 4-хинолинкарбоновая кислота
Смесь соединения A (1,55 г, 5,84 моль) и изатина (860 мг, 5,84 ммоль) в водном растворе едкого кали (15 мл, 30%) нагревали при 105oC 4,5 часа в закупоренном флаконе. Затем охлажденный материал подкисляли 1 г. водной соляной кислотой и экстрагировали этилацетатом. Органический экстракт промывали водой и солевым раствором, осушали (сульфат магния) и сгущали в вакууме, получая промежуточное соединение (2,12 г, 88%).
C. 3-[(2'-Циано[1,1'-бифенил]-4-ил)окси]-2-этил-4-хинолинкарбоновая кислота
Промежуточный продукт B (2,12 г, номинально 5,14 ммоль) растворяли в смеси диоксана (12,8 мл) с пиридином (6,4 мл). В атмосфере аргона раствор охлаждали в ванне со льдом и обрабатывали трифторуксусным ангидридом (3,2 мл). Вынимали из ледяной ванны и продолжали реакцию при комнатной температуре в течение 2,5 часов. В перемешивающуюся смесь вливали 1 н. водный раствор соляной кислоты (150 мл) и этилацетат (150 мл). Отделяли органический слой, и водную часть экстрагировали этилацетатом. Объединенные органические экстракты промывали 1 р. соляной кислотой (50 мл) и 5:1 (объем/объем) водой/солевым раствором (60 мл), солевым раствором (150 мл), затем высушивали (сульфат магния) и сгущали в вакууме, получая промежуточный продукт. Тонкослойная хроматография на Мерксиликагеле (140 г), элюация смесью 5:4:0,1 гексаны:этилацетат:уксусная кислота. Выход продукта 0,98 г, 48%.
D. 2-Этил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил]-4-ил]окси]- 4-хинолинкарбоновая кислота, дилитиевая соль
Смесь соединения C (300 мг, 0,761 ммоль), трибутилтиназида (1,01 г, 3,04 ммоль) и ксилолов (0,5 мл) нагревали до 100oC в закупоренном флаконе 18 часов, затем обрабатывали дополнительным количеством трибутилтиназида (0,5 г) и вновь нагревали в течение 24 часов. К концу срока добавляли еще 0,1 г азидного реактива и продолжали нагревание в течение ночи. Охладив до комнатной температуры продукт обрабатывали метанолом (2 мл), перемешивали 30 минут и сгущали в вакууме, получая промежуточный продукт тетразола. Промежуточный материал очищали тонкослойной хроматографией (диоксид кремния, 75: 20: 5 толуол:ацетон:уксусная кислота), получая очищенный тетразол (290 мг). Гидроксид лития (1,6 мл, 1 М) добавляли к тетразолу с 6 мл воды и 1 мл метанола, чтобы образовался раствор. Этот раствор помещали в колонку HP-20 (60 мл), хроматографировали, элюируя водой (500 мл), затем по 250 мл растворов 5-15% ацетон/вода с нарастанием по 5%. Продукт концентрировали, пропуская через миллипористый фильтр, и лиофилизировали. Получали очищенный продукт (258 мг, 75%); т. пл. >270oC.
Анализ элементов по формуле C25H17N5O3Li2•3,47H2O
Расчетные величины: C 58,67; H 4,71; N 13,68.
Полученные показатели: C 58,33; H 4,21; N 13,36.
Пример 3
2-Пропил-3-[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси]- 4-хинолинкарбоновая кислота, этиловый эфир, монолитиевая соль
A. 3-(2'-Циано[1,1'-бифенил]-4-илокси)-2-пропил-4-хинолинкарбоновая кислота, этиловый эфир
Соединение E из примера 1 (0,320 г, 0,783 ммоль) и свеженанесенный карбонат цезия (0,640 г, 1,96 ммоль) смешивали в безводном диметилформамиде (1,6 мл). Йодэтан (0,244 г, 1,57 ммоль) добавляли и смесь перемешивали в течение 18 часов при комнатной температуре. Смесь разделяли этилацетатом и водой, водную фазу подкисляли 1 н. соляной кислотой. Органическую фазу высушивали и сгущали, получая промежуточный этиловый эфир (0,395 г, 100%), который использовали на следующей стадии без дальнейшего очищения.
B. 2-Пропил-3-[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил-окси]- 4-хинолинкарбоновая кислота, этиловый эфир
Соединение A (0,341 г, 0,781 ммоль) и три-н-бутилтиназид (1,05 г, 3,1 ммоль) соединяли в безводном ксилоле и нагревали при 100oC в течение 96 часов. Продукт реакции сгущали и очищали тонкослойной хроматографией на силикагеле, элюируя гексан:этилацетат:уксусная кислота (75:20:5), получая заданное соединение (0,370 г, 99%).
C. 2-Пропил-3-[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил]окси]- 4-хинолинкарбоновая кислота, этиловый эфир, монолитиевая соль
К соединению B добавляли 0,1 M карбоната лития (5,0 мл, 0,5 ммоль) и метанол (5,0 мл), образуя раствор. Реактивы затем сгущались до общего объема около 5 мл и разгонялись на колонке HP-20 при помощи порций по 300 мл смеси ацетон: вода 0 - 40% с повышением концентрации ацетона на 10% в каждой следующей порции. Продукт сгущали до объема около 50 мл и пропускали через миллипоровый фильтр и лиофилизировали. Получали соединение в виде белого сухого вещества (0,247 г, 66%); т. пл. 175oC - 185oC.
Анализ элементов по формуле C28H24N5O3Li 1,75 H2O
Расчетные величины: C 65,05; H 5,36; N 13,55;
Полученные величины: C 65,33; H 5,03; N 13,25.
Пример 4
2-Пропил-3-[2'-(2H-тетразол-5-мл) [1,1'-бифенил] -4-ил]окси]-4-хинолинкарбоновая кислота, этиловый эфир, 1-оксид, монолитиевая соль
Соединение примера 3 (0,102 г, 0,197 ммоль) растворяли в метиленхлориде (10,0 мл) и прибавляли при комнатной температуре 3-хлорпероксибензойную кислоту (0,074 г, 0,43 ммоль). Смесь перемешивали при комнатной температуре 2 часа и затем в течение 2 часов нагревали до 35oC. Реактивы затем охлаждали и разделяли 1 н. соляной кислотой и метиленхлоридом, органическую фазу осушали и сгущали. Промежуточный продукт преабсорбировали на силикагеле и разгоняли на силикагеле, элюируя гексан: этилацетат: уксусной кислотой (65:30:5), получая очищенный N-оксид (69,3 мг, 71%). Очищенный материал соединяли с таким же, полученным ранее, и суспендировали в 0,1 M водном растворе карбоната лития (2,0 мл). Добавляя воду (1,0 мл) и метанол (1,0 мл), получали раствор. Этот раствор размешивали 15 минут и затем хроматографировали на колонке HP-20, элюируя водой (200 мл) и затем порциями по 100 мл 5 - 40% ацетон: вода с 5% возрастанием. Продукт концентрировали, пропуская через миллипоровый фильтр, и лиофилизировали; получали литиевую соль (67 мг, 70%); т.пл. 187 - 200oC.
Анализ элементов по формуле: C28H24N5O4Li • 2,75 H2O
Расчетные величины: C 61,03; H 5,40; N 12,71;
Полученные величины: C 61,33; H 5,02; N 12,41.
Пример 5
2-Пропил-2-[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси] -4-хинолинкарбоновая кислота, 2-метил-1-(1-оксопропокси)пропиловый эфир, монолитиевая соль
А. Пропановая кислота, 1-хлор-2-метилпропиловый эфир
К только что соединенным хлориду цинка (41 мг) с метиленхлоридом (10 мл) добавляли пропионилхлорид (5,0 г, 54,0 ммоль). Охлаждали до 10oC и добавляли по каплям, при температуре, поддерживавшейся на уровне 25oC, изобутиральдегид (3,89 г, 54,0 ммоль). По окончании добавления смесь перемешивали 1 час при комнатной температуре. Реакционную смесь промывали 20% раствором уксуснокислого натрия, органическую фазу концентрировали в вакууме и получали продукт удовлетворительной чистоты.
В. 3-(2'-циано[1,1'-бифенил]-4-ил]окси)-2-пропил-4-хинолинкарбоновая кислота, 2-метил-1-(1-оксопропокси)пропиловый эфир, монолитиевая соль
Соединение E примера 1 (600 мг, 4,47 ммоль) растворяли в N,N-диметилформамиде (5 мл). Соединение A (846 мг, 5,14 ммоль), карбонат цезия (1,68 г, 5,14 ммоль) и йодид натрия (770 мг, 5,14 ммоль) добавляли к раствору и нагревали смесь до 90oC в течение 5 часов. Добавляли еще хлорид (545, мг, 3,31 ммоль) и нагревали еще 2 часа. Демитилформамид удалялся в вакууме, и остаток распределялся между этилацетатом и насыщенным водным раствором хлорида аммония. Водный слой экстрагировался этилацетатом, осушался над сульфатом магния, растворитель удаляли и получали желтое масло (1,23 г). После очищения тонкослойной хроматографией на силикагеле (150 г) и элюации 15% этилацетатом, гексаном получали бесцветное масло (683 мг, 87%).
С.2-Пропил-3-[2'-(2H-тетразол-5-ил)[1,1'бифенил]-4-ил]окси] 4-хинолинкарбоновая кислота, 2-метил-1-(1-оксопропокси)пропиловый эфир, монолитиевая соль
Соединение B (680 мг, 1,27 ммоль) суспендировали в параксилоле (1,4 мл). Добавляли трибутилтиназид (1,4 мл, 5,07 ммоль) и нагревали смесь до 85oC в течение 70 часов. Коричневую реакционную смесь охлаждали до комнатной температуры и смешивали с метанолом 30 минут. Смесь адсорбировали на силикагеле (2 г) и очищали тонкослойной хроматографией на силикагеле (125 г), элюируя уксусной кислотой (5%), ацетоном (5%), толуолом (90%). Получали бледно-желтое сухое вещество (238 мг). Этот материал растворяли в смеси карбоната лития (2 мл, 0,1 M водный раствор), метанола (1 мл) и очищали при помощи хроматографической колонки с HP-20 полистиролом (объем колонки 40 мл), элюируя порциями по 100 мл воды с ацетоном, доводя до 60% концентрации водного ацетона 5%-ными увеличениями. Фракции, содержащие продукт, объединяли и лиофилизировали. Получали литиевую соль в виде белого сухого вещества (100 мг, 14%); т. пл. 145oC - 165oC.
Анализ элементов по формуле C33H32N5O5Li • 2,3 H2O
Расчетные величины: C 63,21; H 5,88; N 11,17;
Полученные величины: C 62,93; H 5,37; N 10,81.
Пример 6
2-Циклопропил-3-[[2-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси] -4-хинолинкарбоновая кислота, дилитиевая соль
А. 2-Хлор-1-циклопропилэтанон
Раствор эфирного диазометана, содержащий номинально 0,373 моль приблизительно в 700 мл (примерно 73% выхода по MNNG, Fieser & Fieser, 2 Reagents for Оrganic Synthesis, V. 1" 1) готовился следующим образом: к быстро перемешиваемой смеси едкого кали (210 мл, 40% водный раствор) с эфиром (700 мл), охлажденной в ванне со льдом, добавляли частями 1-метил-3-нитро-1-нитозогуанидин (MNNG, 75 г, 0,510 моль). Образование диазометана немедленно проявлялось в виде светло-желтого слоя эфира, который отделялся от воды замораживанием в ванне, заполненной смесью сухого льда с ацетоном, до температуры ниже точки замерзания воды. Эфирный диазометан отфильтровывался с несколькими промывками эфиром во флакон емкостью 2 л, охлажденный в ванне со льдом. Циклопропанкарбонилхлорид (22 г, 0,210 моль), растворенный в эфире (200 мл), вливали в раствор эфир/диазометан и оставляли для реакции на ночь при -20oC. Реакционная смесь еще раз охлаждалась в ванне со льдом, и через раствор пропускали газообразную хлористоводородную кислоту до исчезновения желтого окрашивания. Органический раствор переносился в разделительную воронку и промывался смесью равных количеств (1:1:1) воды: солевого раствора: насыщенного раствора бикарбоната натрия до тех пор, пока водный слой сохранял pH 9, затем - солевым раствором до нейтрального pH. Органический экстракт осушали (сульфат магния) и концентрировали в вакууме, получая соединение, указанное в заглавии (23,55 г, 94%).
В. 4'-(2-Циклопропил-2-оксоэтокси)[1,1'-бифенил]-2-карбонитрил
Смесь хлоркетона (соединение A, 9,6 г, 80,9 ммоль), бифенилнитрил (соединение B примера 1, 10,5 г, 53,1 ммоль), карбоната калия (11,4 г, 82,5 ммоль) и K1 (3,2 г, 19,2 ммоль) в ацетоне (50 мл) нагревали, перемешивали, в закупоренном флаконе при 50oC в течение 5 часов, потом охлаждали до комнатной температуры, разводили этилацетатом до объема 500 мл и фильтровали. Фильтрат промывали бисульфитом натрия (300 мл, 5%) и солевым раствором, затем осушали (сульфат магния) и концентрировали в вакууме до консистенции клея. Промежуточный продукт экстрагировали 400 мл противоточного диизопропилового эфира, который фильтровали в горячем виде и оставляли в сторону до наступления кристаллизации. Первая порция давала 11,7 г соединения, вторая - 0,42 г, общий выход - 12,2 г (83%); т.пл. 82 - 84oC.
Анализ элементов по формуле C18H15NO2
Расчетные величины: C 77,96; H 5,45; N 5,05;
Полученные величины: C 77,60; H 5,35; N 4,74.
C.1-Циклопропил-2-[[2'-(2H-тетразол-5-ил)-[1,1'-бифенил] -4-ил]окси]-этанон
Смесь нитрила (соединение B, 11,1 г, 40 ммоль) и трибутилтиназида (40 г, 120 ммоль) в ксилолах (13 мл) нагревали в закупоренном флаконе до 110oC в течение 22 часов, затем охлаждали до комнатной температуры и перемешивали с метанолом (100 мл) в течение одного часа, потом концентрировали в вакууме. Осадок поднимали толуолом (250 мл) и экстрагировали с избытком 1 н. водного раствора едкого натра (около 170 мл) до тех пор, пока тонкослойная хроматография не показывала, что в органическом слое не осталось продукта. Водный экстракт энергично перемешивали с этилацетатом (500 мл) и подкисляли до pH 1 - 210% водным раствором соляной кислоты. Органическую фазу отделяли, а водную экстрагировали дальше двумя порциями по 100 мл этилацетата. Объединенный органический экстракт промывали водой и солевым раствором, затем оставляли при комнатной температуре на ночь. Из раствора этилацетата выкристаллизовывалось в общем 5,8 г заданного соединения (т.пл. 190-191oC). Материнский раствор затем осушался (сульфатом натрия) и сгущался в вакууме, что давало вторую порцию в 5,2 г (т.пл. 188-190oC). Так же получали третью порцию, равную 0,71 г (т.пл. 184-185oC), доводя общее количество заданного вещества до 11,7 г (91%). Проба перекристаллизированного из ацетонитрила вещества имела точку плавления, равную 190oC, и следующие данные микроанализа:
Анализ элементов по формуле C18H16N4O2 • 0,05 H2O
Расчетные величины: C 67,31; H 5,05; N 17,44;
Полученные величины: C 67,20; H 4,80; N 17,55.
D. 2-Циклопропил-3-[[2-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота
Изатин (2,35 г, 16 ммоль) добавляли к 30% водному едкому кали (41 мл) и раствор перемешивали при комнатной температуре 5 минут. Добавляли тетразолкетон (соединение C, 5,12 г, 16 моль) и смесь перемешивали и нагревали при 110oC на масляной бане в течение трех часов, затем охлаждали до комнатной температуры и подкисляли до pH 1-2 10% соляной кислотой в присутствии этилацетата (200 мл). Органический слой отделяли, а водный далее экстрагировали этилацетатом. Объединенный органический экстракт промывали водой и соляным раствором, затем высушивали (сульфат магния) и концентрировали в вакууме до образования желтого сухого остатка (7 г). После растирания в противотоке ацетонитрила (200 мл) выход соединения составлял 6,75 г (93%); т.пл. 239oC.
Анализ элементов по формуле C26H19N5O3 • H2O 0,3
Расчетные величины: C 69,28; H 4,32; N 15,91;
Полученные величины: C 69,19; H 4,25; N 16,06.
E. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил)-[1,1'-бифенил]-4-ил]окси]-4- хинолинкарбоновая кислота, дилитиевая соль
Соединение D (602 мг, 1,34 ммоль) нейтрализовали 1 н. водным раствором гидроксида лития (2,95 мл) и очищали на колонке НР-20 емкостью 50 мл с градиентной элюцией от воды до 5% ацетона в воде. Фракции, содержащие продукт, собирали вместе и лиофилизировали, получая заданное соединение (466 мг, 69%) в виде гидрата с 2,5 молекулами воды (не правится ниже 250oC).
Анализ элементов по формуле C26H17N5O3 2 • 2,5 H2O
Расчетные величины: C 61,67; H 4,38; N 13,83;
Полученные величины: C 61,61; H 4,21; N 13,54.
Пример 7
2-Этил-3-[2'-(2H-тетразол-5-ил) [1,1'-бифенил-4-ил] окси] -4- хинолинкарбоновая кислота, 2-метил-1-(1-оксопропокси)пропиловый эфир, монокалийная соль
A. 2-Этил-3-[2'-[2-(трифенилметил)-2H-тетразол-5-ил] [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота
К смеси, содержащей 278 мг (0,636 ммоль) соединения примера 2 и 186 мг ( 0,668 ммоль) трифенилметилхлорида в 3,2 мл ацетона добавляли 97,5 микролитров (0,699 ммоль) триэтиламина. Реакция шла два дня, после чего реакционную смесь разводили метиленхлоридом и образовавшийся органический раствор промывали водой. Получалась эмульсия, которую нужно было экстрагировать несколькими порциями этилацетата. Объединенные органические экстракты высушивались сульфатом натрия и сульфатом магния и концентрировались до получения сухого продукта. Из водного раствора отфильтровывали еще плотную часть, которую затем экстрагировали толуол: метанолом (10:1), чтобы получить больше продукта. Совокупный выход продукта составлял 436 мг.
B. 2-Этил-3-[2'-[2-(трифенилметил)-2-H-тетразол-5-ил] [1,1'-бифенил]-4-илокси] -4-хинолинкарбоновая кислота, 2-метил-1-(1-оксопропокси)пропиловый эфир
Смесь, содержащую 0,636 ммоль соединения A, 0,37 мл (2,22 ммоль) соединения A из примера 5, 127 мг (0,763 ммоль) KI, 132 мг ( 0,954 ммоль) карбоната калия и 33,6 мг (0,127 ммоль) 18-крон-6 в 1,27 мл диметилформамида нагревали до 90oC в течение двух часов, затем охлаждали до комнатной температуры и разводили этилацетатом и фильтровали. Органический раствор промывали 5% водным раствором бисульфата натрия и соляным раствором, высушивали над сульфатом натрия и сульфатом магния и концентрировали. Хроматография на 25 г силикагеля после элюции толуолом:эфиром (40:1) давала заданное соединение (401 мг), идентифицированное протонным и C-13 ЯМР и масс-спектрограммой.
C. 2-Этил-3-[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4-илокси] -4- хинолинкарбоновая кислота, 2-метил-1-(1-оксопропокси)пропиловый эфир, монокалийная соль
К раствору 401 мг (0,496 ммоль) соединения B в смеси из 9,9 мл этанола и 9,9 мл тетрагидрофурана добавляли 9,9 мл 2 н. раствора водной соляной кислоты. Перемешивали 2 часа 15 минут при комнатной температуре, затем нейтрализовали до pH 7 20% водным раствором бикарбоната калия. Образовавшуюся смесь отфильтровывали через нейлоновую мембрану и концентрировали, чтобы удалить большую часть органических растворителей. Хроматография на НР-20 полистироле толщиной 15 мл с градиентной водно-ацетоновой элюцией давала, после лиофилизации, 114 мг заданного соединения, идентифицированного протонным и C-13 ЯМР, масс-спектром и микроанализом. Это вещество имело т.пл., равную 125-138oC.
Анализ элементов по формуле C23H30N5O5K • 1,35 H2O
Расчетные величины: C 61,20; H 5,25; N 11,15;
Полученные величины: C 61,54; H 4,82; N 10,68.
Пример 8
7-Хлор-2-(циклопропил)-3-[[2'-2H-тетразол-5-ил)-[1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, двухкалийная соль
6-Хлоризатин (A.E.Senear, H.Savqenf, J.F.Mead, J.B.Koepfli, J. Am. Chem Soc. , 68, 2695 (1946) (0,2 г, 1,1 ммоль) и соединение С из примера 6 (0,32 г, 1 ммоль) в 30% растворе едкого кали (4 мл) нагревали до 105oC в течение двух часов. Реакционную смесь подкисляли 10% соляной кислотой, экстрагировали этилацетатом (дважды по 150 мл), и этилацетатный экстракт промывали соляным раствором, высушивали (сульфат натрия) и концентрировали в вакууме. Образовавшееся плотное вещество вновь растворяли в 1 н. едком кали (4 мл) и метаноле (1 мл) и хроматографировали через НР-20 (40 мл) с водой (200 мл) и с последующей водой, содержащей 5% ацетона (200 мл). Соответствующие фракции объединяли и концентрировали, чтобы получить белое твердое вещество (0,33 г, 58%); т.пл. >250oC.
Анализ элементов по формуле C26H16N5O3 ClK2 • 0,77 H2O
Расчетные величины: C 54,42; H 3,08; N 12,20; Cl 6,18;
Полученные величины: C 54,58; H 3,12; N 12,04; Cl 6,16.
Пример 9
2-Циклопропил-6-фтор-3-[[2'-(2H-тетразол-5-ил)-[1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, двухкалийная соль
5-фторизатин (0,19 г, 1 ммоль) и соединение C из примера 6 (0,32 г, 1 моль) в едком кали (4 мл, 30%) нагревали до 105oC в течение четырех часов. Реакционную смесь подкисляли 10% соляной кислотой, экстрагировали этилацетатом (дважды по 200 мл) и этилацетатный экстракт промывали водой, соляным раствором, высушивали (сульфат натрия) и концентрировали в вакууме. Осадок повторно растворяли в 1 н. едком кали (4 мл) и метаноле (0,5 мл) и хроматографировали через НР-20 (40 мл) применяя воду (200 мл) и следом 5% ацетон в воде (200 мл). Соответствующие фракции объединялись, смешивались с углем (1 г) в течение одного часа, фильтровались через селит и лиофилизировались. Выход заданного соединения 0,28 г (60%); т.пл. 250oC.
Анализ элементов по формуле C26H16N5O3FK2 • 1,8 H2O
Расчетные величины: C 54,20; H 3,43; N 12,16; F 3,30;
Полученные величины: C 54,16; H 3,33; N 12,20; F 3,317.
Пример 10
2- Циклопропил-8-метил-3-[[2-(2H-тетразол-5-ил)-[1,1'-бифенил] -4-ил] окси]- 4-хинолинкарбоновая кислота, двухкалийная соль
A. 2,3-Дигидро-7-метил-1H-индол-2,3-дион
Оксалилхлорид (5,8 г, 46 ммоль) в тетрагидрофуране (2 мл) нагревали до кипения и добавляли порциями ортотолуидингидрохлорид в течение десяти минут. После добавления реакционную смесь кипятили с обратным охлаждением в течение четырех часов и выпаривали в вакууме, чтобы получить 1-хлор-2-[(2-метилфенил)амино] этандион. Этот промежуточный продукт растворяли в хлороформе (4 мл) и добавляли порциями хлорид алюминия (2,6 г). Реакционную смесь кипятили с обратным охлаждением в течение ночи и хроматографировали через силикагель Мерка (100 г), используя (9:1:0,1) толуол: ацетон: уксусная кислота - систему растворителей. Соответствующие фракции объединяли и выпаривали до получения соединения, указанного в заголовке (90 мг, 5,6%).
B. 2- Циклопропил-6-фтор-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил] окси-]4-хинолинкарбоновая кислота, двухкалийная соль
Вышеупомянутый изатин (соединение A, 88 мг, 0,55 ммоль) и соединение C из примера 6 соединяли в едком кали (2 мл, 30%) и нагревали до 105oC шесть часов. Реакционную смесь подкисляли 6 н. соляной кислотой и экстрагировали этилацетатом (трижды по 80 мл). Экстракты промывали тетрагидрофураном с соляным раствором, осушали (сульфат натрия), выпаривали и остаток хроматографировали (дважды) через силикагель Мерка (50 г). Соответствующие фракции объединяли и выпаривали, получая соединение, загрязненное небольшой примесью неизвестного побочного продукта. Этот осадок растворяли в 1 н. едком кали (0,5 мл) и хроматографировали через HP-20, элюируя водой (100 мл) с последующей промывкой 5% ацетоном в воде (200 мл). Соответствующие фракции объединяли, выпаривали до объема 30 мл, фильтровали через миллипоровый фильтр и лиофилизировали. Выход продукта 70 мг (24,3%); т.пл.250oC.
Анализ элементов по формуле C27H19N5O3K2 • 2,14 H2O
Расчетные величины: C 56,09; H 4,06; N 12,11;
Полученные величины: C 56,50; H 3,74; N 11,70.
Пример 11
2-Циклопропил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил]окси] -4,5-хинолиндикарбоновая кислота, трехкалийная соль
A. 3,3-Дибром-2,3-дигидро-2-оксо-1H-индол-4-карбоновая кислота, метиловый эфир
2,3-Дигидро-2-оксо-1H-индол-4-карбоновая кислота, метиловый эфир (C.A. Grob and Weissbach, Helv.Chim. Acta, vol. 44, p.1736, 1961) (2 г, 11,4 ммоль) растворяли в трет-бутилгидроксиде (120 мл), содержащем 0,5 мл воды. Добавляли пиридин • бромистый водород • бром (14,6 г, 45,7 ммоль) и смесь перемешивали при комнатной температуре в течение 16 часов. Реакцию останавливали добавлением воды, и трет-бутилгидроксид отгонялся. Образовавшийся осадок распределяли между водой и этилацетатом, этилацетат осушали сульфатом магния, фильтровали и выпаривали в вакууме. Выход соединения 3,92 г (98%).
B. 2,3-Дигидро-2,3-диоксо-1H-индол-4-карбоновая кислота, метиловый эфир
Соединение A (3,49 г, 10 ммоль) в ацетонитриле (150 мл) с водой (10 мл) перемешивали с трифторацетатом серебра (4,5 г, 20 ммоль) при 80oC в течение полутора часов. Реакционную смесь выпаривали в вакууме и хроматографировали через силикагель Мерка (180 г) с системой растворителей 3:7 ацетон:гексан. Соответствующие фракции объединяли и выпаривали, получая заданное соединение в виде оранжево-коричневого осадка.
C. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил)-[1,1'-бифенил] -4-ил]окси]-4,5- хинолиндикарбоновая кислота трехкалийная соль
Соединение B (0,1 г, 0,49 ммоль) и соединение C из примера 6 в 30% едком кали (3 мл) нагревали при 108oC в течение ночи. Добавляли 1 н. соляную кислоту (2 мл) и экстрагировали продукт этилацетатом (4 раза по 50 мл). Этилацетатные экстракты промывали соляным раствором, осушали (сульфат натрия) и выпаривали в вакууме. Образовавшийся осадок дважды пропускали через силикагель Мерка (50 г) с ацетоном, содержащим 1% уксусной кислоты. Соответствующие фракции объединяли, выпаривали и осадок растворяли в 1 н. едком кали (0,9 мл). Этот раствор дважды пропускали через HP-20 (20 мл), пользуясь водой. Соответствующие фракции объединяли и выпаривали. Выход заданного соединения 60 мг (25%). Т.пл. > 250oC.
Анализ элементов по формуле C27H16N5O5K3 • 2,8 H2O
Расчетные величины: C 49,27; H 3,31; N 10,64;
Полученные величины: C 49,62; H 3,03; N 10,28.
Пример 12
2-Пропил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил-4-ил] окси] -4- хинолинкарбоновая кислота, бутиловый эфир, однокалийная соль
A. 3-[[2'-Циано[1,1'-бифенил] -4-ил]окси]-2-пропил-4- хинолинкарбоновая кислота, бутиловый эфир
Раствор соединения E из примера 1 (0,50 г, 1,22 ммоль) и н-бутилйодида (0,27 мл, 2,45 ммоль) в сухом диметилформамиде (2,7 мл, комнатная температура, аргон) перемешивали с карбонатом цезия (1,19 г, 3,67 ммоль) в течение шести часов и 30 минут. Реакцию останавливали быстрым добавлением 30 мл 0,25 М раствора бисульфата калия и 25 мл этилацетата. После разделения слоев водный слой промывался один раз этилацетатом (25 мл), объединенные этилацетатные слои промывались 3 раза 0,25 М раствором бисульфата калия (по 15 мл), соляным раствором, осушались над сульфатом натрия и выпаривались до получения вязкого масла (0,55 г). После тонкослойной хроматографии на силикагеле (33 г) и элюции 2 л 95:5 гексанов: этилацетата, получали заданное соединение в виде вязкого желтого масла (0,39 г, 69%).
B. 2-Пропил-3-[[2'-(2H-тетразол-5-ил)-[1,1'-бифенил]-4-ил]окси]-4- хинолинкарбоновая кислота, бутиловый эфир
Раствор соединения A (0,39 г, 0,84 ммоль) и три-н-бутилтиназида (0,76 г, 2,3 ммоль) в орто-ксилоле (0,40 мл) нагревали до 108oC в течение 79 часов. После охлаждения до комнатной температуры добавляли метанол (20 мл) и перемешивали раствор в течение 20 минут. Метанол удалялся в вакууме, осадок растворялся в этилацетате (20 мл), промывался 1,0 М раствором трехзамещенного цитрата натрия три раза, соляным раствором, осушался над сульфатом натрия и выпаривался до образования темно-золотистого масла (1,40 г). Тонкослойная хроматография на силикагеле (84 г), элюция 1 л 7:3 гексаны: этилацетат, 1,2 л 7:2,9:0,1 гексаны:этилацетат:уксусная кислота давали выход заданного соединения в виде светло-желтого стекловидного вещества (0,35 г, 82%).
C. 2-Пропил-3-[[2'-(1H-тетразол-5-ил) [1,1'-бифенил]-4-ил]-окси]-4-хинолинкарбоновая кислота, бутиловый эфир, однокалийная соль
Раствор соединения B (0,35 г, 0,69 ммоль) в тетрагидрофуране (2,4 мл) обрабатывали раствором бикарбоната калия (82,8 мг, 0,83 ммоль) в воде (1,8 мл). Мутный раствор перемешивали 45 минут. Тетрагидрофуран удаляли в вакууме, из осадка удаляли соль и очищали его при обращенно-фазовой хроматографии в колонке HP-20 со смолой (15 мл влажного объема), элюируя водой (60 мл) и водой:ацетонитрилом 9:1 (50 мл) чтобы получить, после лиофилизации, заданное соединение в виде белого твердого вещества (0,27 г, 70%); т.пл. 98- 116,5oC с вспениванием.
Анализ элементов по формуле C30H28N5O3K • 0,73 H2O
Расчетные величины: C 64,47; H 5,31; N 12,53;
Полученные величины: C 64,47; H 5,22; N 12,45.
Пример 13
2-Пропил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси]-4- хинолинокарбоновая кислота, 2-(1,1-диметилэтокси)-2-оксиэтиловый эфир, однокалийная соль
A. 3-[[2'-Циано[1,1'-бифенил] -4-ил]окси]-2-пропил- 4-хинолинкарбоновая кислота, 2-(1,1-диметил-этокси)-2-оксоэтиловый эфир
Раствор соединения E из примера 1 (0,50 г, 1,2 ммоль) в диметилформамиде (2,7 мл, комнатная температура, аргон) с карбонатом цезия (1,19 г, 3,7 ммоль) обрабатывали трет-бутил-бромацетатом (0,40 мл, 2,45 ммоль). Розовую реакционную смесь перемешивали в течение шести часов. Реакцию останавливали быстрым добавлением 30 мл 0,25 М раствора бисульфатом калия и 25 мл этилацетата. После разделения на слои водный слой однократно промывали этилацетатом (25 мл), объединенные этилацетатные слои промывали три раза 0,25 М раствором бисульфата калия (по 15 мл), соляным раствором, осушали над сульфатом натрия и выпаривали до получения темно-красного масла (0,84 г). Тонкослойная хроматография на силикагеле (38 г), элюция 1 л 98:2, 1 л 96:4 и 1 л 85:15 гексаны:этилацетат давала 0,40 г (63%) соединения.
B. 2-Пропил-3-[[2'-2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси]- 4-хинолинкарбоновая кислота, 2-(1,1-диметилэтокси)-2-оксоэтиловый эфир
Раствор соединения A (0,40 г, 0,77 ммоль) в три-н-бутилтиназиде (0,76 г, 2,3 ммоль) и орто-ксилоле (0,40 мл) нагревали в герметичном флаконе (предварительно наполненном аргоне) при 108oC в течение 79 часов. После охлаждения до комнатной температуры добавляли метанол (20 мл) и раствор перемешивали 20 минут. После удаления метанола в вакууме осадок растворяли в этилацетате (20 мл), промывали 1,0 М раствором трехзамещенного цитрата натрия три раза, потом - соляным раствором, осушали над сульфатом натрия и выпаривали до получения светло-золотистого масла (1,15 г). Тонкослойная хроматография на силикагеле (69 г), элюция гексанами:этилацетатом в соотношениях 90: 10 и 70:30 и гексанами: этилацетатом-уксусной кислотой 70:29:1, давала заданное соединение (0,32 г, 73%); т. пл. 70,5 - 135,0oC со вспениванием.
C. 2-Пропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]- 4-ил]окси]-4-хинолинкарбоновая кислота, 2-(1,1-диметилэтокси)- 2-оксоэтиловый эфир, однокалийная соль
Раствор соединения B (0,32 г, 0,57 ммоль) в тетрагидрофуране (2,0 мл)/воде (1,5 мл, комнатная температура, аргон) обрабатывали раствором бикарбоната калия (68,1 мг, 0,68 ммоль) в воде (1,5 мл). Мутноватый реакционный раствор перемешивали 30 минут. Тетрагидрофуран удаляли в вакууме и мутный водный раствор очищали и освобождали от соли в колонке НР-20 с обращенно-фазовой смолой (20 мл влажного объема), элюируя водой с возрастающим содержанием метанола. После удаления метанола (в вакууме) и последующей лиофилизации получали заданное соединение в виде белого плотного вещества (0,14 г, 41%); т. пл. 130 - 145oC со вспениванием.
Анализ элементов по формуле C32H30N5O5K • 1,79 H2O
Расчетные величины: C 60,44; H 5,32; N 11,01;
Полученные величины: C 60,69; H 5,07; N 10,76.
Пример 14
2-Этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4-ил]окси]- 4-хинолинкарбоновая кислота, 2-(1,1-диметилэтокси)-2-оксоэтиловый эфир, однокалийная соль
A. 3-[(2'Циано[1,1'бифенил]-4-ил]окси]-2-этил-4- хинолинкарбоновая кислота, 2-(1,1-диметилэтокси)-2-оксоэтиловый эфир
Смесь соединения C из примера 2 (500 мг, 1,27 ммоль), трет-бутилбромацетата (0,41 мл, 2,5 ммоль) и карбоната цезия (975 мг, 3,0 ммоль) и диметилформамиде (5 мл) перемешивали при 25oC в течение 18 часов. Затем смесь вливали в соляной раствор, экстрагировали этилацетатом, осушали (сульфат магния) и выпаривали в вакууме. Осадок очищали тонкослойной хроматографией на силикагеле (315 г), элюируя гексаном:этилацетатом 3:1. Фракции, содержащие главный продукт, объединяли и выпаривали, и осадок растирали с гексан/эфиром, получая заданное соединение в виде белого твердого вещества (440 мг, 70%); т. пл. 83 - 85oC.
B. 2-Этил-3-[[2'-(2H-тетразол-5-ил) [1,1'бифенил] -4-ил]окси]- 4-хинолинкарбоновая кислота, 2-(1,1-диметилэтокси)-2-оксоэтиловый эфир, однокалийная соль
Смесь соединения A (400 мг, 0,80 ммоль) и трибутилтиназида (800 мг, 2,4 ммоль) в орто-ксилоле (0,8 мл) перемешивали при 100oC в течение 20 часов, после чего хроматографировали непосредственно на силикагеле в колонке (65 г, сорбсил). Фракции элюировали 6:4:1 гексаном:этилацетатом:уксусной кислотой; те, которые содержали главный поглощающий УФ компонент, объединяли и выпаривали. Осадок растворяли в метаноле (5 мл) и разводили 0,1 н. раствором карбоната калия (5 мл). Образовавшийся раствор наносили на колонку с макроретикулярным полистиролом (J - Gel, 30 х, 500 мм) и элюировали сначала водой (1000 мл), затем - линейным градиентом от 0 до 100% водного метанола в течение 15 минут (50 мл/минуту). Фракции, содержащие главный поглощающий УФ компонент, объединяли, выпаривали и лиофилизировали, получая нужное соединение в виде белого твердого вещества (125 мг, 25%); т. пл. 152 - 8oC.
Анализ элементов по формуле C31H28N5O5K • 0,73 H2O
Расчетные величины: C 61,77; H 4,93; N 11,62;
Полученные величины: C 61,77; H 4,76; N 11,44.
Пример 15.
2-Этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4- ил]окси]-4-хинолинкарбоновая кислота, бутиловый эфир, однокалийная соль.
A. 3-[(2'-Циано [1,1'-бифенил] -4-ил]окси]-2-этил-4- хинолинкарбоновая кислота, бутиловый эфир
Смесь соединения C из примера 1 (500 мг, 1,27 ммоль), н-бутилйодида (0,28 мл, 2,5 ммоль) и карбоната цезия (975 мг, 3,0 ммоль) в диметилформамиде (5 мл) перемешивали при 25oC в течение 20 часов. Затем смесь вливали в соляной раствор, экстрагировали этилацетатом, осушали (сульфат магния) выпаривали в вакууме. Осадок очищали тонкослойной хроматографией на силикагеле (300 г), элюируя 3:1 гексан:этилацетатом. Фракции, содержащие главный продукт, объединяли и выпаривали до получения названного соединения в виде масла (425 г, 74%).
B. 2-Этил-3-[[2'-(2H-тетразол-5-ил) [1,1'бифенил[-4- ил]окси]-4-хинолинкарбоновая кислота, бутиловый эфир, однокалийная соль.
Смесь соединения A (400 мг, 0,89 ммоль) и трибутилтиназида (1,0 г, 3,0 ммоль) в орто-ксилоле (0,8 мл) перемешивали при 90oC в течение 72 часов, после чего ее непосредственно хроматографировали на колонке с силикагелем (65 г, сорбил). Фракции элюировали гексан:этилацетат:уксусной кислотой в соотношении 15: 10: 1, те, что содержали главный поглощающий УФ компонент, объединялись и выпаривались. Осадок подвергался повторной хроматографии, элюции 20: 1 этилацетат: (пиридин 20: уксусная кислота 6: вода 11) давала масло. Это масло растворяли в метаноле (10 мл) и разводили 0,1 н. раствором карбоната калия (7 мл). Образовавшийся раствор наносили на колонку с макроретикулярным полистиролом (J-Ciel 30 x, 500 мм) и элюировали сначала водой (1000 мл), затем - линейным градиентом от 0 до 100% водного метанола в течение 15 минут (50 мл/минуту). Фракции, содержащие главный поглощающий УФ компонент, объединяли, выпаривали и лиофилизировали, получая белое твердое вещество (190 мг, 40%); т. пл. 204 - 208oC.
Анализ элементов по формуле C29H26N5O3K • 0,36 H2O
Расчетные величины: C 64,73; H 4,93; N 13,01;
Полученные величины: C 65,11; H 5,10; N 12,56.
Пример 16
2-Этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4-ил]окси]- 4-хинолинкарбоновая кислота, 1(2,2-диметил-1-оксопропокси)-2- метилпропиловый эфир, однокалийная соль.
A. 2-Этил-3-[[2'-2-(трифенилметил)-2H-тетразол-5-ил] [1,1'бифенил]-4-ил] окси]-4-хинолинкарбоновая кислота
Смесь соединения, озаглавленного в примере 2, дилитиевой соли 2-этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4-ил] -окси]-4- хинолинкарбоновой кислоты (700 мг, 1,6 ммоль), триэтиламина (245 микролитров, 1,76 ммоль), трифенилметилхлорида (468 мг, 1,68 ммоль) и ацетона (8 мл) перемешивали при комнатной температуре в течение 36 часов. Смесь выпаривали в вакууме, получая промежуточный продукт восковидной консистенции (1,35 г, 100%).
B. 2,2-Диметилпропановая кислота, 1-хлор-2-метилпропиловый эфир
К только что смешанным хлориду цинка (70 мг) и триметилацетилхлориду (12,3 мл, 100 ммоль), охлажденным в ванне со льдом, растворенным в дихлорметане (25 мл), добавляли изобутиральдегид (9,08 мл, 100 ммоль), поддерживая температуру реакции 25oC. Раствор оставляли согреться до комнатной температуры и перемешивали в течение часа, промывали раствором уксуснокислого натрия (50 мл, 20%), осушали (сульфат магния) и выпаривали под низким вакуумом до удаления дихлорметана (выход 16,18 г, 84%).
C. 2-Этил-3-[[2'-2-(трифенилметил)-2H-тетразол-5-ил] [1,1'-бифенил]-4-ил] окси] -4-хинолинкарбоновая кислота, 1-(2,2-диметил-1-оксопропокси)-2-метилпропиловый эфир
Смесь соединения A (1,215 г, 1,44 ммоль, предположительно, 90% чистоты), йодида калия (287 мг, 1,73 ммоль), карбоната калия (398 мг, 2,88 ммоль), 18-крон-6 (76 мг, 0,29 ммоль), диметилформамида (2,88 мл) и соединения B (972 мг, 5,04 ммоль) объединяли и перемешивали при 90oC в атмосфере аргона, в течение 4 часов. Смесь охлаждали до комнатной температуры, вливали в этилацетат (200 мл), промывали водой (150 мл), бисульфитом натрия (150 мл, 20% водный раствор) и соляным раствором (150 мл), осушали (сульфат магния) и выпаривали в вакууме (150 мл), осушали (сульфат магния) и выпаривали в вакууме до получения сырого масла. Сырой продукт очищали при помощи тонкослойной хроматографии (65 г, ЕМ диоксида кремния, элюция гексан:этилацетат 6:1), и фракции главного продукта собирались вместе и выпаривались в вакууме до получения названного соединения в виде светло-коричневой полужидкой массы (990 мг, 1,18 ммоль, 74%).
D. 2-Этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4- ил]окси]-4-хинолинкарбоновая кислота, 1-(2,2-диметил-1-оксопропокси)- 2-метилпропиловый эфир, однокалийная соль
Соединение C (870 мг, 1,04 ммоль) растворяли и перемешивали в растворе этанола, тетрагидрофурана и 2н. соляной кислоты (по 20,8 мл каждого) в течение 2 часов. Раствор выпаривали до объема приблизительно 30 мл, образовывалось белое, воскообразное, образующее хлопья вещество, которое отфильтровывали. Оставшийся раствор доводили до pH 7,4 бикарбонатом калия (20% водный раствор) и очищали при помощи препаративной жидкостной хроматографии высокого разрешения (Jordi-gel полистироловая колонка, элюция в течение 30 минут линейным градиентом вода-метанол). При жидкостной хроматографии высокого разрешения (аналитической) и ЯМР обнаружено, что продукт был загрязнен трифенилкарбинолом и была произведена дополнительная очистка при помощи тонкослойной хроматографии (60 г диоксида кремния, элюция гексан:этилацетат: уксусной кислотой 8:4:0,1). После этого продукт растворяли в этаноле/воде и повторно приводили pH к 7,4 бикарбонатом калия (20% водный раствор) и очищали при помощи препаративной жидкостной хроматографии высокого разрешения (Jordi gel полистироловая колонка, элюция в течение 30 минут линейным градиентом от воды к метанолу). Окончательный продукт извлекали лиофилизацией из воды (20 мл) и этанола (2 мл) в виде белого твердого вещества (330 мг, 0,53 ммоль, 51%); т.пл. 184 - 190oC.
Анализ элементов по формуле C34H34N5O5K • 1,0 H2O
Расчетные величины: C 62,85; H 5,58; N 10,78; K 6,02;
Полученные величины: C 62,64; H 5,55; N 10,78; K 5,73.
Пример 17
2-Циклопропил-3-[[2'-[2-[1-(2,2-диметил-1-оксопропоксо)-2- метилпропил] -2H-тетразол-5-ил] [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота
A. 2-Циклопропил-3-[[2'-[2-(трифенилметил)-2H-тетразол- 5-ил] [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота
Соединение D из примера 6 (800 мг, 1,77 ммоль, 1 экв.) растворяли в метиленхлориде (8,9 мл, 0,2 M) и добавляли триэтиленамин (0,62 мл, 4,43 ммоль, 2,5 экв. ), диметиламинопиридин (22 мг, 0,177 ммоль, 0,1 экв.) и хлортрифенилметан (597 мг, 2,14 ммоль, 1,2 экв.). Реакцию проводили при комнатной температуре, перемешивая в течение 4 часов, разводили этилацетатом, промывали хлоридом аммония/водой и насыщали хлоридом натрия. Органическую жидкость осушали (сульфат магния) и выпаривали, получая означенное соединение.
B. 2-Циклопропил-3-[[2-[2-(трифенилметил)-2H-тетразол-5-ил] [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота, 2-пропениловый эфир
Соединение A растворяли в диметилформамиде (5,9 мл, 0,3 M) и добавляли аллилбромид (1,28 г, 10,62 ммоль, 6 экв.) и карбонат калия (612 мг, 4,43 ммоль; 2,5 экв. ). Реакционную смесь перемешивали 15 часов при комнатной температуре и еще 2 часа при 50oC. Смесь разводили этилацетатом, промывали хлоридом аммония/водой и насыщали хлоридом натрия. Органический слой осушали (сульфат магния), фильтровали и выпаривали до получения нужного соединения.
C. 2-Циклопропил-3-[[2-(2H-тетразол-5-ил)-[1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, 2-пропениловый эфир
Соединение B растворяли в этаноле (18 мл) и тетрагидрофуране (18 мл) и добавляли соляную кислоту (2 н., 18 мл). Реакционную смесь перемешивали при комнатной температуре три часа и экстрагировали этилацетатом. Экстракты осушали (сульфат магния) и выпаривали. Осадок хроматографировали на силикагеле, элюируя метиленхлоридом/метанолом (100:0,3), затем метиленхлоридом:метанолом (100:2 6) получая названное соединение (550 мг, 64%).
D. 2-Циклопропил-3-[[2'-[2-1-(2,2-диметил-1-оксопропокси)-2- метилпропил-2H-тетразол-5-ил] [1,1'-бифенил-4-ил]окси]-4- хинолинкарбоновая кислота, 2-пропениловый эфир
Смесь соединения C (550 мг, 1,12 ммоль, 1 экв.), соединения B из примера 16: 2,2-диметилпропановая кислота, 1-хлор-2-метилпропиловый эфир (1,30 г, 6,74 ммоль, 6 экв.), активированного молекулярного сита (4A, 1,1 г, 200 вес. %), оксид серебра (1,04 г, 4,50 ммоль, 4,4 экв.) и тетрагидрофурана (5,6 мл, 0,2 M) нагревали при 65oC в течение 18 часов. Реакционную смесь встряхивали с этилацетатом и хлоридом аммония/водой. Органический слой промывали соляным раствором, осушали (сульфатом магния), фильтровали и выпаривали. Осадок хроматографировали на препаративной силикагельной пластинке, разгоняя смесь гексан: этилацетат (2:1), получали названное соединение (345 мг, 48%).
E. 2-Циклопропил-3-[[2'-[2-[1-(2,2-диметил-1-оксопропокси)-2- метилпропил]-2H-тетразол-5-ил] [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота
Соединение D (320 мг, 0,50 ммоль, 1 экв.) растворяли в тетрагидрофуране (3,8 мл, 0,13 M) с димедоном (209 мг, 1,49 ммоль, 3 экв.) и добавляли Pd (трифенилфосфин)4. Смесь перемешивали при комнатной температуре 30 минут и затем выпаривали. Осадок хроматографировали на силикагеле, элюируя метиленхлоридом, содержащим возрастающие концентрации метанола, и получали объявленное соединение (280 мг, 93%); т.пл. 165 - 168oC.
Анализ элементов по формуле C35H35N5O5 • 1,5 H2O
Расчетные величины: C, 66,44; H 6,05; N 11,07;
Полученные величины: C, 66,24; H 5,64; N 10,65.
Пример 18
2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]- 4-ил]окси]-4-хинолинкарбоновая кислота, (5-метил-2-оксо-1,3-диоксол- 4-ил)метиловый эфир, однокалийная соль
A. 4,5-Диметил-1,3-диоксол-2-он
К 3-гидрокси-2-бутанону (17,62 г, 0,2 моль, 1,0 экв.) и N,N-диметиланилину (25,4 г, 0,21 моль, 1,05 экв.) в метиленхлориде (200 мл) добавляли при 0oC раствор фосгена в толуоле (1,93 M, 109 мл, 0,21 моль, 1,05 экв.). Перемешивали при 0oC 15 минут и затем при комнатной температуре в течение 4 дней растворители отгонялись до тех пор, пока температура бани не достигала 160oC. Смесь охлаждали до комнатной температуры, разводили эфиром, промывали 1 н. соляной кислотой и насыщали хлоридом натрия. Органический слой осушали (сульфат магния) и выпаривали. Осадок перекристаллизовывался (эфир/гексан). Получали соединение в виде белого твердого вещества (12,64 г, 55%).
B. 4-(Бромметил)-5-метил-1,3-диоксол-2-он
К раствору соединения A (12,46 г, 0,111 моль, 1,0 экв.) в четыреххлористом углероде (554 мл, 0,2 M) добавляли бромсукцинимид (19,72 г, 0,111 моль, 1 экв.) и азобисизобутиронитрил (253 мг). Производили нагревание в противотоке с обратным охлаждением в течение 30 минут. Смесь охлаждали до комнатной температуры, выпаривали до половины объема и фильтровали. Удаляли растворитель из фильтрата и осадков, дистиллировали в вакууме. Получалось нужное соединение; т.кип. 124oC (14 г, 65%).
C. 2-Циклопропил-3-[[2'-[2-(трифенилметил)-2H-тетразол-5-ил] [1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, (5-метил-2-оксо-1,3-диоксол-4-ил)метиловый эфир
К соединению A из примера 17 : 2-циклопропил-3-[[2'-[2- (трифенилметил)-2H-тетразол-5-ил] [1,1'-бифенил] -4-ил] -окси] - 4-хинолинкарбоновой кислоте (1,32 г, 1,91 ммоль, 1 экв.) и соединению B (1,84 г, 9,54 ммоль, 5 экв.) в диметилформамиде (3,8 мл, 0,5 M) добавляли карбонат калия (0,66 г, 4,77 ммоль, 2,5 экв.). Смесь перемешивали при комнатной температуре в течение 21 часа, разводили этилацетатом и фильтровали. Фильтрат промывали хлоридом аммония/водой и насыщали хлоридом натрия, осушали (сульфат магния), фильтровали и выпаривали, получая названное соединение.
D. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил)-[1,1'-бифенил]- 4-ил]окси]-4-хинолинкарбоновая кислота, (5-метил-2-оксо-1,3-диоксол- 4-ил)метиловый эфир
Соединение C растворяли в этаноле (20 мл) с тетрагидрофураном (20 мл) и добавляли соляную кислоту (2 н., 20 мл). Смесь перемешивали в течение часа при комнатной температуре и экстрагировали метиленхлоридом. Выпаривали органические экстракты, осадок хроматографировали на силикагеле, элюируя метиленом с возрастающими концентрациями метанола, до получения соединения (631 мг, 59%).
E. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил [1,1'-бифенил]-4- ил]окси]-4-хинолинкарбоновая кислота, (5-метил-2-оксо-1,3-диоксол- 4-ил)метиловый эфир, однокалийная соль
К раствору соединения D (631 мг, 1,12 ммоль, 1 экв.) в метаноле (40 мл) при 0oC добавляли раствор бикарбоната калия (124 мг, 1,24 ммоль, 1,1 экв.) в воде (10 мл). Смесь перемешивали при комнатной температуре 20 минут. Большую часть растворителей удаляли выпариванием в вакууме. Осадок хроматографировали на HP-20 колонке, элюируя водой с возрастающим содержанием ацетона, до получения нужного соединения (230 мг, 47%); т. пл. 124 - 127oC.
Анализ элементов по формуле C31H22N5O6K
Расчетные величины: C 62,09; H 3,70; N 11,68;
Полученные величины: C 63,78; H 4,38; N 11,21.
Пример 19
2-Циклопропил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил]окси] -4-хинолинкарбоновая кислота, (5-метил-2-оксо-1,3-диоксол-4-ил)метиловый эфир
К раствору соединения из примера 18 : 2-циклопропил-3-[[2'- (2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновой кислоты, (5-метил-2-оксо-1,3-диоксол-4-ил)метиловому эфиру, однокалийной соли (631 мг, 1,12 ммоль, 1 экв.)в метаноле (40 мл) при 0oC добавляли раствор бикарбоната калия (124 мг, 1,24 ммоль, 1,1 экв.) в воде (10 мл). Смесь перемешивали 20 минут при комнатной температуре. Большую часть растворителей испаряли в вакууме. Осадок хроматографировали на HP-20 колонке, элюируя водой, водой:ацетоном (100: 3 15), затем водой:ацетоном (100:25 30), получая соединение из примера 18: 2-циклопропил-3-[[2'-(2H-тетразол -5-ил)[1,1'-бифенил] -4-ил]окси]-4-хинолинкарбоновую кислоту, (5-метил-2-оксо-1,3-диоксол-4-ил)метиловый эфир, однокалийную соль (230 мг, 34%). Колонку HP-20 промывали затем метанолом, чтобы получить указанное соединение (исходный материал 170 мг, 27%); т. пл. 103 - 106oC.
Анализ элементов по формуле C31H23N5O6 • 0,4H2O
Расчетные величины: C 65,47; H 4,22; N 12,31;
Полученные величины: C 65,72; H 3,93; N 12,15.
Пример 20
6-Бром-2-пропил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, двухкалийная соль
A. 3-[[2'(аминокарбонил)[1,1'-бифенил] -4-ил]окси]- 6-бром-2-пропил-4-хинолинкарбоновая кислота
Смесь 5-бромизатина (1 г, 4,42 ммоль) и соединения C из примера 1 : 4-(2-оксопентилокси)-[1,1'-бифенил]-2-карбонитрио (1,23 г, 4,51 ммоль) в едком кали (11 мл, 30% водный раствор) нагревали в масляной бане со 105oC в течение 6 часов. Затем реакционную смесь охлаждали до комнатной температуры и подкисляли и экстрагировали этилацетатом. Органический экстракт промывали соляным раствором, осушали (сульфат магния) и испаряли, чтобы получить около 2,5 г сырого продукта. После растирания в этилацетате-гексанах извлекали 1,97 г сырого продукта (88%), который участвовал в следующей реакции.
B. 6-Бром-3-[(2'-циано[1,1'-бифенил] -4-ил)окси] -2- пропил-4-хинолинкарбоновая кислота
Раствор соединения A (1,87 г, 3,70 ммоль) в смеси диоксана (7,5 мл) с пиридином (3,74 мл) охлаждали до 0oC и обрабатывали трифторуксусным ангидридом (2,78 г, 1,87 мл, 13,2 ммоль). Холодную баню снимали и реакцию продолжали, помешивая, при комнатной температуре в течение ночи, затем вливали в соляную кислоту (80 мл, 1 н. водный раствор) и экстрагировали этилацетатом (110 мл). Органический экстракт ополаскивали тремя порциями воды по 40 мл, соляным раствором и осушали (сульфат магния). Выпаривание в вакууме давало сырой продукт (3 г). Растирание с горячими этилацетатом-гексанами давало названное соединение (1,04 г). Материнская жидкость выпаривалась и хроматографировалась в тонком слое на силикагеле (133 г). Элюировали системой гексаны: этилацетат:уксусная кислота 7:4:0,1 и получали еще 222 мг продукта. Общий выход составил 1,26 г (70%).
C. 6-Бром-2-пропил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4- ил]окси] -4-хинолинкарбоновая кислота, двухкалийная соль
Смесь соединения B (222 мг, 0,456 ммоль), (nBu)3 Sn-N3 (605 мг, 1,82 ммоль) и ксилолов (1 мл) нагревали в закупоренных флаконах при 100oC в течение 16 часов. Добавляли дополнительное количество (nBu)3 Sn-N3 (480 мг) и продолжали нагревание при 100oC еще 19 часов. В течение ночи нагревание повторяли два раза, каждый раз добавляя по 300 мг (nBu)3 Sn-N3. При практически полном исчезновении исходного материала охлажденный продукт реакции обрабатывали метанолом (3 мл), размешивали 30 минут, выпаривали в вакууме, повторно разводили метиленхлоридом (0,5 мл) и хроматографировали в тонком слое на силикагеле (25 г), элюируя метиленхлоридом:метанолом:уксусной кислотой 30: 1: 0,5. Совокупные фракции продукта давали целевой кислый тетразол (190 мг). Из этого вещества при обработке едким кали (0,86 мл, 1 н. водный раствор) образовывалась целевая двухкалийная соль, которая очищалась на колонке HP-20 (20 мл) и элюировалась градиентом от 5% до 10% водного ацетата. Фракции, содержащие продукт, собирали вместе и лиофилизировали, чтобы получить заданное соединение (150 мг, 51%) в виде гидрата с 2,39 молекулами воды (не плавится ниже 250oC).
Анализ элементов по формуле C26H18N5O3BrK2 • 2,39 H2O
Расчетные величины: C 48,07; H 3,53; N 10,78; Br 12,30;
Полученные величины: C 48,07; H 3,34; N 10,56; Br 12,54.
Пример 21
2-Пропил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4- ил] окси] -4-хинолинкарбоновая кислота, 1-оксид, дилитиевая соль
Соединение из примера 1: 2-пропил-3-[[2'-(2H-тетразол- 5-ил)[1,1'-бифенил)-4-ил]окси]-4-хинолинкарбоновая кислота, дилитиевая соль, растворяли в приблизительно 5 мл воды и 80% монопероксифталевой кислоты, добавляли соль магния (MMPP) (516 мг, 0,25 ммоль) и проводили реакцию при нагревании до 50oC в течение 2 часов. Еще 345 мг MMPP добавляли в реакцию по ходу трехчасового нагревания до 50oC. Затем продукт охлаждали до комнатной температуры, добавляли 1 н. соляную кислоту до кислой реакции раствора и трижды экстрагировали этилацетатом. Органическую фазу осушали и выпаривали, получая сырой N-оксид (465 мг). К сырому материалу добавляли углекислый литий (3,1 ммоль) в воде (28 мл) и метанол, чтобы получить раствор. Затем материал выпаривался до объема приблизительно 5 мл и помещался в колонку HP-20. Чтобы получить заданный продукт чистотой 93% элюировали порциями по 250 мл воды, 2,5% водного ацетона и 5% водного ацетона. Для дальнейшей очистки соединение растворяли в 3,0 мл 0,05 М углекислого лития и хроматографировали на колонке SP-207, элюируя на градиенте 0 - 20% ацетон:вода, используя 300 мл растворителя в целом. Фракции продукта чистотой свыше 98%, объединялись, выпаривались, пропускались через миллипоровый фильтр и лиофилизировались, давая заданный N-оксид (16 мг, 30%); т. пл. 270oC.
Анализ элементов по формуле C26H19N5O4 • Li • 5,43 H2O
Расчетные величины: C 54,11; H 5,21; N 12,13;
Полученные величины: C 54,50; H 4,71; N 11,74.
Пример 22
6-Бром-2-этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил-4-ил] окси]-4-хинолинкарбоновая кислота, двухкалийная соль
A. 3-[[2'-(Аминокарбонил)[1,1'-бифенил]-4-ил]окси]-6-бром-2-этил -4-хинолинкарбоновая кислота
Смесь 5-бромизатина (0,86 г, 3,81 ммоль) и соединения A из примера 2: 4'-(2-оксобутилокси)[1,1'-бифенил]-2-карбонитрил, (1,01 г, 3,81 ммоль) в 9,5 мл 30% водного раствора едкого кали нагревали на масляной бане при 105oC в течение трех часов. Получали крайне нерастворимый продукт. Этот материал непосредственно растирался с избытком 1 н. водного раствора соляной кислоты и полученное таким образом твердое вещество отфильтровывали, промывали водой, потом - этиловым эфиром и, наконец, высушивали в вакууме. Смесь без дальнейшей очистки переходила на следующую стадию.
B. 6-Бром-3-[(2'-циано[1,1'-бифенил)-4-ил)окси)-2- этил-4-хинолинкарбоновая кислота
Раствор соединения A (1,35 г, 2,75 ммоль смеси изомеров) в смеси диоксана (6,8 мл) с пиридином (3,4 мл) охлаждали до 0oC и обрабатывали трифторуксусным ангидридом (2,53 г, 1,7 мл, 12,0 ммоль). Холодную ванну убирали и перемешивали при комнатной температуре в течение трех часов, затем вливали в 1 н. водный раствор соляной кислоты и экстрагировали этилацетатом. Органический экстракт споласкивали водой, соляным раствором и осушали (сульфат магния). Выпаривание в вакууме давало сырой продукт (1,5 г). Растирание с этилацетатом давало целевое соединение (0,96 г), смешанное с другим изомером в приблизительном соотношении 72:28 по 1H ЯМР. Эта смесь использовалась в дальнейшем без дополнительной очистки.
C. 6-Бром-2-этил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил]окси]-4- хинолинкарбоновая кислота
Смесь изомеров нитрила, содержащую соединение B (907 мг, 1,92 ммоль, около 72% целевого изомера), (nBu)3 Sn-N3 (1,9 г, 5,72 ммоль) и ксилолов (1 мл) нагревали в закупоренных флаконах до 107oC в течение 64 часов. После охлаждения реакционную смесь растворяли в метиленхлориде (2 мл) и хроматографировали в тонком слое на силикагеле (200 г), элюируя 7,5:2:0,5 толуол-ацетон: уксусной кислотой. Собранные фракции продукта дают целевой кислый тетразол (613 мг, 62%) и побочный продукт-изомер (261 мг).
D. 6-Бром-2-этил-3-[[2'(2H-тетразол-5-ил) [1,1'- бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота, двухкалийная соль
Соединение C (200 мг, 0,387 ммоль) обрабатывали едким кали (0,85 мл 1 н. водный раствор) и хроматографировали на 20 мл колонке HP-20, элюируя водой. Фракции, содержащие продукт, собирались вместе и лиофилизировались, чтобы получить указанное соединение (163 мг, 67%) в виде гидрата с 1,85 молекул воды (не плавится ниже 260oC).
Анализ элементов по формуле C25H16N5O3BrK2 • 1,85 H2O
Расчетные величины: C 47,98; H 3,17; N 11,19; Br 12,77;
Полученные величины: C 47,59; H 2,73; N 10,89; Br 13,28.
Пример 23
2-Этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4-ил]-окси]-4-хинолинкарбоновая кислота, 1-оксид, дилитиевая соль
Соединение из примера 2: 2-этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, дилитиевая соль (98 мг, 0,191 ммоль) растворяли в воде (4,5 мл) и добавляли, при комнатной температуре, монопероксифталевую кислоту, соль магния (MMPP) (309 мг, 0,5 ммоль). Затем нагревали до 50oC и почти полностью растворяли компоненты. Дополнительно MMPP (114 мг) вводили через 2, 3 и 4 часа (общее количество 651 мг). Общая продолжительность нагревания составляла 7 часов. Затем раствор подкисляли добавлением 1 н. соляной кислоты и экстрагировали этилацетатом. Органическую фазу осушали и выпаривали. Затем к сырой смеси добавляли карбонат лития (250 мг) в воде (25 мл) и метанол, чтобы создать эффект раствора. Когда все вещества растворялись, раствор выпаривали, доводя его объем до, приблизительно, 10 мл и хроматографировали на колонке SP-207, элюируя водой (200 мл) и, затем, по градиенту от 0 до 15% ацетона:вода, что давало слегка загрязненный продукт (98 мг). Это вещество хроматографировали в тонком слое на силикагеле, элюируя 87:7:5 долями этилацетата; изопропанола:уксусной кислоты, чтобы получить 56 мг продукта. Это вещество растворяли в 1,5 мл 0,1 M карбоната лития и метаноле (0,5 мл) и хроматографировали на колонке HP-20, элюируя водой (80 мл) и затем порциями по 40 мл и 5 и 10% ацетона; вода. Продукт выпаривали, пропускали через миллипоровый фильтр и лиофилизировали, получая белое твердое вещество (41,9 мг, 48%); т. пл. > 270oC.
Анализ элементов по формуле C25H17N5O4 • 2 Li • 2,85 H2O
Расчетные величины: C 58,12; H 4,43; N 13,55;
Полученные величины: C 58,21: H 3,90; N 13,16.
Пример 24
2-Метил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]-окси]-4-хинолинкарбоновая кислота, дилитиевая соль
A. 4-(2-Оксопропокси) [1,1'-бифенил]-2-карбонитрил
Соединение B из примера 1: 4'-гидрокси-[1,1-бифенил]-2-карбонитрил, (3,00 г, 15,14 ммоль) растворяли в ацетоне (8 мл) с хлорацетоном (1,59 мл, 20 ммоль), добавляли свежесмолотый карбонат калия (1,12 г, 15,4 ммоль) и йодид калия (128 мг, 0,77 моль). Смесь нагревали до 60oC в течение 15 часов, затем разделяли между соляной кислотой (1,0 M) и этилацетатом. Водную фазу экстрагировали этилацетатом, и объединенные органические экстракты осушали над сульфатом магния, фильтровали и удаляли растворитель, получая твердое золотистое вещество (4,51 г). Этот твердый остаток перекристаллизовывали из смеси толуола с гексаном, получая твердое золотистое вещество (3,34 г, 87%); т. пл. 102 - 105oC.
B. 3-[(2'-Циано [1,1'-бифенил] -4-ил)окси]-2-метил-4-хинолинкарбоновая кислота
Изатин (468 мг, 3,18 ммоль) и соединение A (800 мг, 3,18 ммоль) растворяли в едком кали (8 мл, 30%) с этанолом (5 мл). Смесь нагревали до 75oC полтора часа, затем нейтрализовали соляной кислотой (1н.) и экстрагировали этилацетатом. Объединенные органические экстракты осушали над сульфатом магния, фильтровали и удаляли растворитель. Осадок очищали тонкослойной хроматографией с силикагелем (150 г), элюировали 1% уксусной кислотой, 19% ацетоном, толуолом. Фракции, содержащие продукт, объединяли и удаляли растворитель, получая желтое твердое вещество (370 мг, 29%); т. пл. 217 - 220oC.
C. 2-Метил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота, дилитиевая соль
Соединение B (400 мг, 1,00 ммоль) и три-н-бутилтиназид (1,1 мл, 4,00 ммоль) суспендировали в ксилоле (1,1 мл) и смесь нагревали до 105oC в течение 4 дней. Затем смесь охлаждали до комнатной температуры и смешивали с метанолом в течение 30 минут. Реакционная смесь абсорбировалась на силикагель и очищалась тонкослойной хроматографией с силикагелем (150 г), элюировалась 5% уксусной кислотой, 30% ацетоном, толуолом. Фракции, содержащие продукт, объединялись и растворитель удалялся. Получали золотистый твердый остаток (290 мг). Этот осадок растворяли в 1 н. гидроксиде лития (4,5 мл) с метанолом (1 мл) и очищали на хроматографической колонке, пользуясь колонками HP-20 с объемом 60 мл, заполненными полистиролом. Смолу смывали водой (200 мл), затем порциями по 100 мл, 5% и 10% водным ацетоном. Фракции, содержащие продукт, объединяли и лиофилизировали, извлекая бледно-желтое твердое вещество (240 мг, 56%); т. пл. > 270oC.
Анализ элементов по формуле C24H15N5O3Li2 • 1,32 H2O
Расчетные величины: C 62,79; H 3,87; N 15,26;
Полученные величины: C 62,79; H 3,82; N 15,09.
Пример 25
7-Хлор-2-этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, этиловый эфир, однокалийная соль
A. 3-[[2'-(Аминокарбонил) [1,1'-бифенил] -4-ил]окси]-7-хлор-2-этил-4-хинолинкарбоновая кислота
Смесь, содержащую соединение A из примера 2: 4'-(2-оксобутилокси) [1,1'-бифенил] -2-карбонитрил (1,01 г, 3,81 ммоль), 6-хлоризатин (692 мг, 3,81 ммоль), едкий кали (10 мл, 30% водный раствор) и этанол (10 мл) нагревали при 82oC в закупоренных флаконах в течение ночи. Охлажденную реакционную смесь затем подкисляли 6 н. соляной кислотой и экстрагировали этилацетатом. Органический экстракт ополаскивали водой и соляным раствором, осушали (сульфат магния) и выпаривали в вакууме, получая сырой продукт (2,11 г). Эту смесь переносили на следующую реакцию.
B. 7-Хлор-3-[2'-циано[1,1'-бифенил] -4-ил)окси] -2-этил-4-хинолинкарбоновая кислота
Сырое соединение A (номинально 3,81 ммоль) растворяли в пиридине (20 мл), охлаждали до 0oC в атмосфере аргона и обрабатывали трифторуксусным ангидридом (2,69 мл, 4 г, 19,05 ммоль). По-видимому, реакция должна произойти через 30 минут. Реакционную смесь подкисляли концентрированной соляной кислотой, разводили водой и экстрагировали этилацетатом. Органический экстракт ополаскивали 1 н. водной соляной кислотой, водой и соляным раствором, затем осушали (сульфат магния) и выпаривали в вакууме, до образования около 2 г неочищенного продукта. Тонкослойная хроматография на силикагеле (200 г), элюция 5:4:0,1 гексаны:этилацетат:уксусной кислотой давали очищенный продукт (0,89 г), который дважды растирался с этиловым эфиром до получения целевого соединения (0,54 г, 33%). Это вещество использовалось непосредственно в следующей реакции.
C. 7-Хлор-3-[(2'-циано[1,1'-бифенил] -4'-ил)окси]-2-этил-4-хинолинкарбоновая кислота, этиловый эфир
Соединение B (540 мг, 1,26 ммоль) растворяли в ацетоне (4 мл) и обрабатывали этилйодидом (0,2 мл, 390 мг, 2,50 ммоль) и карбонатом калия (522 мг, 3,78 ммоль). Реакционную смесь закупоривали и перемешивали при комнатной температуре в течение 16 часов, затем нагревали при 50oC в течение 4 часов, чтобы довести реакцию до завершения. Затем реакционную смесь охлаждали до комнатной температуры, разводили этилацетатом и фильтровали. Органический фильтрат ополаскивали водой, насыщенным водным раствором бисульфита натрия, водой и соляным раствором, затем осушали (сульфат магния) и выпаривали в вакууме до образования красного масла (690 мг). Тонкослойная хроматография на силикагеле (27 г) давала целевое соединение (487 мг, 85%).
D. 7-Хлор-2-этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси-4-хинолинкарбоновая кислота, этиловый эфир, однокалийная соль
Смесь соединения C (467 мг, 1,02 ммоль), (nBu)3Sn-N3 (1,02 г, 3,06 ммоль) и ксилолов (0,5 мл) нагревали при 105oC в закупоренных флаконах в течение 37 часов. После охлаждения до комнатной температуры реакционную смесь обрабатывали метанолом, затем выпаривали в вакууме и хроматографировали в тонком слое на силикагеле (75 г), элюируя 10:4:0,1 гексаны:этилацетат:уксусной кислотой до получения тетразолиевого продукта (460 мг, 90%). Эфир тетразола (212 мг, 0,424 ммоль) обрабатывали бикарбонатом калия (42,4 мг, 0,424 ммоль) и 1н. водным раствором едкого кали, затем хроматографировали на HP-20, элюировали градиентом 0 - 30% водного ацетона. Фракции, содержащие продукт, собирались вместе и лиофилизировались до получения целевого соединения (148 мг, 62%) в виде гидрата с 1,3 молекулами воды (т. пл. >150, 218 - 220oC).
Анализ элементов по формуле C27H21N5 O3ClK•1,3 H2O
Расчетные величины: C 57,76; H 4,24; N 12,47; Cl 6,31;
Полученные величины: C 57,75; H 4,14; N 12,26; Cl 6,04,
Пример 26
7-Хлор-2-этил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, двухкалийная соль
A. 7-Хлор-2-этил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, этиловый эфир
Приготовленное, как описано выше, для соединения D из примера 25: 7-хлор-2-этил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил]-4-ил]окси] -4-хинолинкарбоновая кислота, этиловый эфир, однокалийная соль.
B. 7-Хлор-2-этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил] окси]-4-хинолинкарбоновая кислота, двухкалийная соль
Соединение A (230 мг, 0,46 ммоль) омыляли 1,1 мл 1 н. водного раствора KOH в 2,5 мл этанола при 70oC в течение 22 часов. После охлаждения до комнатной температуры реакционную смесь немедленно наносили на 18 мл колонку HP-20, которую промывали градиентом 0 - 6% водного ацетона, фракции, содержащие продукт, собирали и лиофилизировали до получения 223 мг целевого соединения (85 %) в виде гидрата с 1,11 молекулами воды (не плавится ниже 250oC).
Анализ элементов по формуле C25H16N5 O3ClK2•1,11 H2O
Расчетные величины: C 52,86; H 3,23; N 12,33; Cl 6,24;
Полученные величины: C 52,85; H 3,33; N 12,22; Cl 6,37.
Пример 27
2-Пропил-3-[[2'-(2H-тетразол-5-ил)[1,1'-бифенил] -4-ил] окси] - 4-хинолинкарбоновая кислота, 2-(диэтиламино)-2-оксоэтиловый эфир
A. N,N-Диэтилхлорацетамид
К раствору хлоруксусной кислоты (10 г, 0,11 моль) в метиленхлориде (530 мл) при 0oC добавляли диэтиламинхлористоводородную кислоту (15,3 г, 0,14 моль), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (26,4 г, 0,14 моль) и 4-метилморфолин (29 мл, 0,27 моль). Перемешивали в течение одного часа при 0oC, затем перемешивали при комнатной температуре в течение 4 часов. Затем реакционную смесь промывали водой, 1 н. соляной кислотой (до обесцвечивания водной фазы) и насыщенным хлоридом натрия, осушали над сульфатом магния, фильтровали и выпаривали до получения целевого соединения в виде желтого масла (9,3 г, 58%), которое непосредственно использовалось на следующей стадии.
B. 3-[(2'-Циано[1,1'-бифенил] -4-ил)окси]-2-пропил-4- хинолинкарбоновая кислота, 2-(диэтиламино)-2-оксоэтиловый эфир
К раствору соединения E из примера 1: 3-(2-циано 1,1'-бифенил]-4-ил)окси]-2-пропил-4-хинолинкарбоновой кислоты (630 мг, 1,54 ммоль) в ацетоне (5 мл) добавляли соединение A (461 мг, 3,08 ммоль), карбонат калия (638 мг, 4,62 ммоль) и йодид калия (50 мл). После перемешивания в течение 16 часов при комнатной температуре реакционную смесь экстрагировали этилацетатом и органический экстракт ополаскивали водой и соляным раствором, осушали (сульфат магния) и выпаривали в вакууме. Тонкослойная хроматография на силикагеле (60 г) с элюцией 7:3 гексаны:этилацетатом не смогла очистить продукт. Целевое соединение было получено на второй колонке (110 г силикагеля; градиент от 9:1 до 7:3 гексаны:этилацетат), извлечено 538 мг, 67%.
C. 2-Пропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси]-4 -хинолинкарбоновая кислота, 2-(диэтиламино)-2-оксоэтиловый эфир, однокалийная соль
Смесь соединения B (518 мг, 0,993 ммоль), (nBu)3Sn- N3 (990 мг, 2,98 ммоль) и ксилолов (0,7 мл) нагревали при 110oC в закупоренных флаконах в течение двух дней. Реакционную смесь охлаждали до комнатной температуры и хроматографировали в тонком слое на силикагеле (50 г), элюируя сначала одним объемом колонки смесью гексанов с этилацетатом 6:4, потом 6:4:0,1 гексаны: этилацетат:уксусная кислота. Фракции, содержащие продукт, объединялись, чтобы получить тетразолиевый продукт (400 мг, 71%).
Весь продукт превращали в калийную соль обработкой едким кали (1,69 мл, 1 н. ) с последующей хроматографией 35 мл HP-20 в градиенте элюции 0 - 30% водного ацетона. Фракции, содержащие продукт, собирали вместе и лиофилизировали, получая целевое соединение (234 мг, 54%, извлеченные из колонки, 38% общего выхода от соединения B) в виде гидрида с 0,57 молекул воды; т. пл. 118 - 130oC.
Анализ элементов по формуле C32H31N6 O4K•0,57 H2O
Расчетные величины: C 62,70; H 5,28; N 13,71;
Полученные величины: C 62,70; H 5,11; N 13,57.
Пример 28
2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил] окси]-4-хинолинкарбоновая кислота, 2-метил-1-(1-оксопропокси) пропиловый эфир, однокалийная соль
A. 2-Циклопропил-3-[[2'-[2-(трифенилметил)-2H-тетразол-5- ил][1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота
Смесь, содержащая соединение из примера 6: 2-циклопропил-3-[[2- [[2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота, дилитиевая соль (906 мг, 2,02 ммоль), трифенилметилхлорид (590 мг, 2,11 ммоль) и триэтиламин (0,309 мл, 224 мг, 2,22 ммоль) в ацетоне (10 мл) перемешивалась при комнатной температуре в закупоренном флаконе в течение 4 дней (время реакции за пределами 2 дней не является необходимым). Реакционную смесь фильтровали и повторно растворяли в 40 мл ацетона. Выход предполагался равным 100% и соответствующие части использовались в последующих реакциях.
B. 2-Циклопропил-3-[[2'-[2-(трифенилметил)-2H-тетразол- 5-ил] [1,1'-бифенил] -4-ил] окси] -4-хинолинкарбоновая кислота, 2-метил-1-(1-оксопропокси)пропиловый эфир
Неочищенное соединение A (номинально 1,21 ммоль) и соединение A из примера 5: 1-хлор-2-метилпропиловый эфир пропановой кислоты (697 мг, 4,23 ммоль) растворяли в сухом диметилформамиде (2,4 мл). Добавляли карбонат калия (335 мг, 2,42 ммоль), йодид калия (241 мг, 1,45 ммоль) и 18-крон-6 (64 мг, 0,242 ммоль) и закупоренную реакционную смесь нагревали при 90oC в течение 2,5 часов. После охлаждения до комнатной температуры реакционную смесь разводили этилацетатом (50 мл) и фильтровали. Органический фильтрат ополаскивали двумя порциями по 25 мл 5% водного раствора бисульфита натрия и соляным раствором, осушали (сульфат магния) и выпаривали в вакууме, получая неочищенный продукт (1,4 г). Тонкослойная хроматография на силикагеле (50 г), покрытом гексанами, и элюция 250 мл 24:1 и вслед примерно двумя литрами 12:1 гексанов:этилацетата давала целевое соединение (697 мг, 70% общего выхода от соединения A).
C. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил] окси]-4-хинолинкарбоновая кислота, 2-метил-1- (1-оксопропокси)пропиловый эфир, однокалийная соль
Соединение C (667 мг, 0,813 ммоль) растворяли в тетрагидрофуране (16 мл). Добавляли абсолютный этанол (16 мл), затем - 16 мл 2 н. водного раствора соляной кислоты, и, наконец, дополнительно 7 мл тетрагидрофурана. После 2,5 часов перемешивания при комнатной температуре реакционную смесь доводили до pH 8 осторожным добавлением водного раствора. Попытка удалить преципитат на этом этапе была безуспешной. Всю смесь повторно подкисляли 2 н. водным раствором соляной кислоты и экстрагировали этилацетатом. Органический экстракт ополаскивали соляным раствором, осушали (сульфат магния) и выпаривали в вакууме, получая неочищенный продукт (668 мг). Тонкослойная хроматография на силикагеле (50 г) при элюировании сначала 10:4 гексанов:этилацетата, затем 10:4:0,1 гексанов:этилацетата:уксусной кислоты, давала продукт тетразол (389 мг, 78% выхода).
Тетразоловый продукт (0,673 ммоль) обрабатывали бикарбонатом калия (100 мг, 1,01 ммоль) в водном метаноле и хроматографировали на 35 мл колонке HP-20, элюируя градиентом 0 - 40% водного ацетона. Фракции, содержащие продукт, объединялись и лиофилизировались, для извлечения заданного соединения (243 мг 58%, 48% от соединения C в целом) в виде гидрата с 0,55 молекулами воды; т. пл. S 125, 148 - 150oC, разлагается.
Анализ элементов по формуле C33H30N5 O5K•0,55 H2O
Расчетные величины: C 63,35; H 5,01; N 11,19;
Полученные величины: С 63,35; H 4,90; N 11,21.
Пример 29
2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4-ил] окси]-1,5-нафтиридин-4-карбоновая кислота, дилитиевая соль A. α -Циано-3-нитро-2-пиридинуксусная кислота, этиловый эфир
К сухому трет-бутанолу (80 мл, дистиллированный из гидрида кальция) осторожно, маленькими комочками добавляли калий (2,5 г, 63 ммоль). После завершения добавки реакционную смесь нагревали до 50oC и перемешивали, пока весь калий не был поглощен. Добавляли этилцианоацетат (6,71 мл, 63 ммоль) и получали густой белый осадок. 2-Хлор-3-нитропиридин (5 г, 31,5 ммоль) добавляли в подогретый (60oC) трет-бутанол (80 мл), после чего реакционная смесь становилась темно-оранжевой. Реакционную смесь нагревали с обратным охлаждением в течение двух часов, трет-бутанол удаляли, и осадок распределялся между соляной кислотой (1 н.) и этилацетатом. Водная фаза экстрагировалась этилацетатом, и объединенные органические фазы высушивались над сульфатом магния, фильтровались и растворитель удалялся. Твердый коричневый осадок перекристаллизировался из этилацетата, образуя целевой продукт в виде красных иголок (4,8 г, 65%); т. пл. 133 - 134oC.
Анализ элементов по формуле C10H9N3O4
Расчетные величины: C 51,07; H 3,86; N 17,87;
Полученные величины: C 51,09; H 3,68; N 18,00.
B. 3-Амино- α -циано-2-пиридинуксусная кислота, этиловый эфир
Соединение A (4,8 г, 20,4 ммоль) растворяли в этаноле (750 мл). Добавляли палладий на углероде (10%, 200 мг) и гидрогенизировали реакционную смесь при 50 ps водорода в шейкере Парра в течение 6 часов. Растворитель удаляли, чтобы получить твердый оранжевый осадок, который использовался непосредственно в следующих реакциях.
C. 2,3-Дигидро-2-окси-1H-пирроло[3,2-b] пиридин-3-карбонитрил
Соединение B из предыдущей реакции суспендировали в параксилоле (60 мл) и нагревали до 150oC в герметичном цилиндре. Через 24 часа реакционную смесь охлаждали и удаляли растворитель, получая черный твердый осадок, который был непосредственно использован в следующих реакциях.
D. 1H-Пирроло [3,2,-b] пиридин-2(3H)-он
Соединение C из предыдущей реакции суспендировали в концентрированной соляной кислоте (120 мл) и нагревали с обратным холодильником в течение 24 часов. Реакционную смесь охлаждали и нейтрализовали твердым карбонатом калия. Этот раствор экстрагировали этилацетатом, объединенные экстракты осушали над сульфатом магния и удаляли растворитель, получая 1,82 г (66% в 3 приема) коричневого осадка, который использовался в дальнейших реакциях без очистки.
E. 3,3-Дибром-1H-пирроло [3,2-b] пиридин-2(3H)-он
Соединение D (181 г, 13,5 ммоль) растворяли в трет-бутаноле (130 мл, 95%) и добавляли N-бромсукцинимид (4,8 г, 27 ммоль). Реакционную смесь мешали 4 часа при комнатной температуре, затем абсорбировали на силикагель (20 г) и очищали тонкослойной хроматографией на силикагеле (350 г), элюируя 30% ацетоном, гексаном до получения целевого продукта в виде золотистого осадка (2,85 г, 72%).
F. 1H-Пирроло[3,2-b] пиридин-2,3-(3H)-дион
Соединение E (2,78 г, 9,52 ммоль) растворяли в ацетонитриле (143 мл) с водой (9,5 мл). Добавляли трифторацетат серебра (4,12 г, 19,0 ммоль) и нагревали смесь с обратным холодильником. Через час смесь охлаждали до комнатной температуры, фильтровали через селит для удаления бромида серебра и удаляли растворитель. Осадок абсорбировали на силикагеле и очищали тонкослойной хроматографией на силикагеле, элюируя 50% ацетоном, гексаном до получения изатина в виде оранжевого осадка (1,09 г, 77%).
G. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4- ил]окси]-1,5-нафтиридин-4-карбоновая кислота, двухлитиевая соль
Соединение F (246 мг, 1,66 ммоль) и соединение C из примера 6: 1-циклопропил-2-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил[-4-ил]окси]этанон (800 мг, 2,5 ммоль) растворяли в едком кали (3,2 мл, 30%) с этанолом (1,6 мл). Смесь нагревали до 75oC в течение 1,5 часов, затем нейтрализовали соляной кислотой (1 н.). Смесь экстрагировали этилацетатом, объединяли органические экстракты и осушали над сульфатом магния, фильтровали и удаляли растворитель. Осадок абсорбировали на силикагеле и очищали тонкослойной хроматографией с силикагелем (125 г), элюируя 6% воды, 8% уксусной кислоты, этилацетатом, фракции, содержащие продукт, объединяли и удаляли растворитель, чтобы получить коричневый осадок (576 г). Этот осадок растворяли в гидроксиде лития (1 М) и очищали хроматографией на колонках с НР-20 полистиролом (объем колонки 60 мл), элюируя водой (200 мл), потом порциями по 100 мл 5%, 10% и 15% ацетона в воде. Фракции, содержащие продукт, объединяли и лиофилизировали, чтобы получить белый осадок (156 мг), содержащий незначительные примеси по данным 1H-ЯМР. Этот осадок повторно растворяли в воде и повторно очищали НР-20 смолой (объем колонки 60 мл), элюируя, порциями по 100 мл, водой, 5%, 10% и 15% ацетона в воде. Фракции с продуктом объединяли и лиофилизировали, получая белый осадок (120 мг, 11%); т. пл. > 270oC.
Анализ элементов по формуле C25H16N6O3Li2 • 1,69 H2O
Расчетные величины: C 60,94; H 3,96; N 17,05;
Полученные величины: C 61,12; H 3,75; N 16,87.
Пример 30
2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4- ил]окси]-4-хинолинкарбоновая кислота, этиловый эфир, однокалийная соль
A. 2-Циклопропил-3-[[2'-[2-(трифенилметил)-2H-тетразол-5- ил] [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота, этиловый эфир
Смесь соединения A из примера 28: 2-циклопропил-3-[[2'-[2- (трифенилметил)-2H-тетразол-5-ил] [1,1'-бифенил] -4-ил]окси]-4- хинолинкарбоновая кислота (372 мг, 0,517 ммоль), этилйодид (0,13 мл, 254 мг; 1,62 ммоль) и карбонат калия (335 мг, 2,42 ммоль) в диметилформамиде (2,5 мл) нагревали при 90oC в течение 90 минут. После охлаждения до комнатной температуры реакционную смесь разводили этилацетатом и ополаскивали 5% водным раствором бисульфита натрия и соляным раствором, осушали (сульфат магния) и выпаривали в вакууме, получая неочищенный продукт (580 мг). Тонкослойной хроматографией на силикагеле (40 г), элюируя 10:1 гексанами:этилацетатом, извлекали названное соединение (372 мг, 64%).
B. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4- ил]окси]-4-хинолинкарбоновая кислота, этиловый эфир, однозамещенная калийная соль
Соединение A (372 мг, 0,517 ммоль) растворяли в тетрагидрофуране (9 мл). Добавляли абсолютный этанол (9 мл), затем - 9 мл водной 2н. соляной кислоты. После трехчасового перемешивания при комнатной температуре реакционную смесь разводили этилацетатом (18 мл) и соляным раствором (18 мл). Затем органический слой отделяли и промывали водой:соляным раствором 1:1 и соляным раствором (порциями по 18 мл), затем осушали (сульфат магния) и выпаривали в вакууме, получая неочищенный продукт (377 мг). Тонкослойная хроматография на силикагеле (30 г) с элюцией сначала гексанами:этилацетатом 10:4, потом гексанами:этилацетатом:уксусной кислотой 10:4:0,1, давала порошкообразный продукт тетразола (189 мг, 76%). Тетразол (0,396 ммоль) обрабатывали 0,52 мл 1 н. водного раствора едкого кали и хроматографировали на 15 мл НР-20, элюируя градиентом 0 - 30% водного ацетона. Фракции, содержащие продукт, объединяли и лиофилизировали, получая целевое соединение (149 мг, 71%, 54% общего выхода из соединения A) в виде гидрата с 0,86 молекул воды; т. пл. > 100, 140 - 150oC, разрушается.
Анализ элементов по формуле C28H22N5O3K • 0,86 H2O
Расчетные величины: C 63,32; H 4,50; N 13,19;
Полученные величины: C 63,33; H 4,19; N 12,99.
Пример 31
2-Циклопропил-6-метокси-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4-ил] окси]-4-хинолинкарбоновая кислота, двузамещенная литиевая соль
A. 2-Циклопропил-6-метокси-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота, дилитиевая соль
5-Метоксииндол-2,3-дион (G. B. Bachcran, G.M. Picha, J. Am. Chem. Soc., 80, 126 (1958)) (183 мг, 1,03 ммоль) и соединение C из примера 6: 1-циклопропил-2-[[2'-(2H-тетразол-5-ил) [[1,1'-бифенил] -4- ил]окси]-этанон (300 мг, 0,94 ммоль) растворяли в едком кали (2 мл, 30%) с этанолом (1 мл). Смесь нагревали до 83oC в течение 11 часов и затем оставляли стоять при комнатной температуре на 10 часов. Затем смесь нейтрализовали соляной кислотой (1 н.) и экстрагировали этилацетатом. Объединенные органические экстракты осушали над сульфатом магния, их фильтровали и удаляли растворитель. Осадок очищали тонкослойной хроматографией, используя силикагелем (65 г) и элюируя 5% уксусной кислоты, 15% ацетона и толуолом. Фракции, содержащие продукт, объединяли, растворитель удаляли и получали желтый осадок (370 мг). Этот осадок растворяли в гидроксиде лития (1 М) и очищали колоночной хроматографией с НР-20 полистиролом (объем колонки 60 мл), элюируя водой (200 мл) и следующими порциями по 100 мл 2,5%, 5%, 10%, 15% и 20% ацетона в воде. Фракции, содержащие продукт, объединяли и лиофилизировали, чтобы извлечь светло-желтый осадок (96 мг, 21%); т. пл. > 270oC.
Анализ элементов по формуле C27H19N5O4Li2 • 3,50 H2O
Расчетные величины: C 58,49; H 4,73; N 12,63;
Полученные величины: C 58,29; H 4,16; N 12,32.
Пример 32
2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4- ил]окси]-4-хинолинкарбоновая кислота, 2-метил-1-(2,2-диметил-1- оксопропокси)пропиловый эфир, однозамещенная калийная соль
A. 2-Циклопропил-3-[[2'-[2-трифенилметил)-2H-тетразол-5- мл] [1,1'-бифенил] -4-ил] окси] -4-хинолинкарбоновая кислота, 2-метил-1-(2,2-диметил-1-оксипропокси)пропиловый эфир
Смесь соединения A из примера 28: 2-циклопропил-3- [[2'-[2-(трифенилметил)-2H-тетразол-5-ил] [1,1'-бифенил]-4- ил]окси]-4-хинолинкарбоновая кислота (1,55 ммоль), соединения B из примера 16: 2,2-диметилпропановая кислота, 1-хлор-2-метилпропиловый эфир (1,09 г, 6,65 ммоль), карбонат калия (521 мг, 3,77 ммоль), йодид калия (375 мг, 2,26 ммоль) и 18-крон-6- (100 мг, 0,378 ммоль) в диметилформамиде (3,7 мл) нагревали при 90oC в течение 2,5 часа. После охлаждения до комнатной температуры реакционная смесь разводилась этилацетатом (75 мл) и фильтровалась. Органический фильтрат ополаскивали 5% водным раствором бисульфата натрия и соляным раствором, осушали (сульфат магния) и выпаривали в вакууме, получая неочищенный продукт (2 г). После тонкослойной хроматографии на силикагеле (60 г) извлекали промыванием гексанами объемом в 1 колонку, и гексаны:этилацетатным градиентом от 12:1 (1,8 л) до 8:1 (900 мл) целевое соединение (950 мг, 72%).
B. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4- ил]окси]-4-хинолинкарбоновая кислота, 2-метил-1-(2,2-диметил-1- оксопропокси)пропиловый эфир, однозамещенная калийная соль
Соединение A (930 мг, 1,10 ммоль) растворяли в тетрагидрофуране (22 мл). Добавляли абсолютный этанол (22 мл), затем - 22 мл 2 н. водного раствора соляной кислоты. После двухчасового размешивания при комнатной температуре реакционную смесь разводили этилацетатом (100 мл), переносили в разделительную воронку, ополаскивали тремя порциями по 50 мл соляного раствора, осушали (сульфат магния) и выпаривали в вакууме, получая 2 г неочищенного продукта. Тонкослойная хроматография на силикагеле (70 г) с элюцией 10:4 гексанами-этилацетатом, и затем 10: 4:0,1 гексанами:этилацетатом: уксусной кислотой извлекала продукт порошкообразного тетразола (580 мг, 87%). Тетразол (0,96 ммоль) обрабатывали излишком бикарбоната калия и хроматографировали на 35 мл НР-20, элюируя градиентом 0 - 70% водного ацетона. Фракции, содержащие продукт, объединяли и лиофилизировали для извлечения целевого вещества (340 мг, 54%, 47% выхода от соединения B) в виде водного гидрата с 0,9 молекулами воды; т. пл. s 78, 86 - 123oC.
Анализ элементов по формуле C35H34N5O5K • 0,9 H2O
Расчетные величины: C 63,69; H 5,47; N 10,61;
Полученные величины: C 64,13; H 5,77; N 10,17.
Пример 33
2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4- ил]окси]-4-хинолинкарбоновая кислота, 1-(1-оксипропокси)-этиловый эфир, однозамещенная калийная соль
A. Пропановая кислота, 1-хлорэтиловый эфир
Хлорид цинка (75 мг) расплавляли в сухом флаконе. Добавляли пропаноилхлорид (43,4 мл, 0,500 моль) и сухой метиленхлорид (30 мл) и смесь охлаждали до 0oC в атмосфере аргона. Ацетальдегид (27,95 мл, 0,500 моль) добавляли к реакционной смеси со скоростью, позволяющей сохранить внутреннюю температуру между 10 и 15oC. Ванну убирали и перемешивали реакционную смесь при температуре окружающей среды в течение 2 часов. После тщательного выпаривания реакционной смеси на роторном испарителе осадок перегоняли, чтобы получить целевой продукт (8 г, 12%), который перегоняется при 30oC и давлении ниже 1 мм рт. ст.
B. 2-Циклопропил-3-[[2'-(2'-трифенилметил)-2H-тетразол-5-ил] [1,1-бифенил] -4-ил] окси] -4-хинолинкарбоновая кислота, 1(1-оксопропокси)этиловый эфир
Смесь соединения A из примера 28: 2-циклопропил-3-[[2'- [2-(трифенилметил)-2H-тетразол-5-ил] [1,1'-бифенил]-4-ил]окси]-4- хинолинкарбоновая кислота (1,55 ммоль), соединения A в данном примере (1,1 г, 8,05 ммоль), йодида калия (375 мг, 2,26 ммоль) и 18-крон-6 (100 мг, 0,378 ммоль) в диметилформамиде (3,7 мл) нагревали при 65oC 45 минут. После охлаждения до комнатной температуры реакционную смесь разводили этилацетатом (75 мл) и фильтровали. Органический фильтрат промывали 5% водным раствором бисульфита натрия и соляным раствором, осушали (сульфат магния) и выпаривали в вакууме, получая неочищенный продукт (2 г). Тонкослойная хроматография на силикагеле (50 г) отмытом 1 объемом колонки гексанами с последующим отмыванием 1,8 л смеси гексаны:этилацетат, 6:1 давала целевое соединение (930 мг, 76%).
C. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4- ил]окси]-4-хинолинкарбоновая кислота, 1-(1-оксопропокси)этиловый эфир, однозамещенная калийная соль.
Соединение B (830 мг, 1,04 ммоль) растворяли в тетрагидрофуране (20 мл). Добавляли абсолютный этанол (20 мл) и следом 20 мл 2н. водного раствора соляной кислоты. После двухчасового перемешивания при комнатной температуре реакционную смесь разводили этилацетатом (100 мл), переносили в разделительную воронку, ополаскивали тремя порциями по 50 мл соляного раствора, осушали (сульфат магния) и выпаривали в вакууме, получая около 1 г неочищенного продукта. Неочищенный материал объединяли с материалом, полученным при пробной реакции со 100 мг, проведенной точно таким же способом (общий стартовый материал: 930 мг, 1,17 ммоль). Тонкослойная хроматография на силикагеле (70 г), отмытом сначала гексанами:этилацетатом 10:4, потом гексанами:этилацетатом: уксусной кислотой 15: 5:0,12, давала порошкообразный продукт тетразола (450 мг, 70%). Тетразол (435 мг, 0,792 ммоль) обрабатывали избытком бикарбоната калия и хроматографировали на колонке с НР-20, элюируя градиентом 0 - 40% водного ацетона. Фракции, содержащие продукт, объединяли и лиофилизировали, извлекая целевое соединение (259 мг, 54%, 37% выхода от соединения B) в виде гидрата с 0,9 молекулами воды; т. пл. 100 - 155oC.
Анализ элементов по формуле C31H26N5O5K • 0,9 H2O
Расчетные величины: C 61,66; H 4,64; N 11,60;
Полученные величины: C 61,68; H 4,41; N 11,40.
Пример 34
2-Пропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси]- 4-хинолинкарбоновая кислота, 2-метил-1-(2,2-диметил-1- оксопропокси)пропиловый эфир
A. 2-Пропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4- ил]окси]-4-хинолинкарбоновая кислота
Раствор соединения E из примера 1 : 3-[(2'-циано[1,1'-бифенил]- 4-ил)окси] -2-пропил-4-хинолинкарбоновая кислота, (3,9 г, 9,6 моль) и три-н-бутилтиназида (9,6 г, 28,9 ммоль) в орто-ксилоле (3,9 мл) нагревали до 108oC а течение 48 часов. После охлаждения до комнатной температуры добавляли метанол (15 мл) и раствор темно-коричневого цвета перемешивали 20 минут. Метанол удаляли в вакууме, добавляли еще метанол (15 мл), реакционную смесь быстро размешивали и выпаривали снова. Осадок растворяли в этилацетате (500 мл), промывали трижды 1 М раствора трехзамещенного цитрата натрия, соляным раствором, осушали над сульфатом магния и выпаривали, получая вязкое коричневое масло (10,98 г). Тонкослойной хроматографией на силикагеле (659 г) с элюцией толуолом: ацетоном: уксусной кислотой 70:25:5 извлекали целевое соединение в виде осадка светло-желтого цвета (3,14 г).
B. 2-Пропил-3-[[2'-[2-(трифенилметил)-2H-тетразол-5-ил [1,1'-бифенил]-4-ил]окси]-4-хинолинкарбоновая кислота
Раствор соединения A (1,5 г, 3,3 моль), трифенилметилхлорида (0,97 г, 3,5 ммоль) и триэтиламина (0,51 мл, 3,7 ммоль) в ацетоне (17 мл) перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разводили ацетоном (50 мл); гидрохлорид триэтиламмония собирали фильтрацией и промывали несколькими порциями ацетона. Фильтрат выпаривали, остаток растворяли в этилацетате (60 мл), трижды промывали водой (по 20 мл) и соляным раствором. Объединенные водные слои повторно экстрагировали этилацетатом, объединенные этилацетатные слои осушали над сульфатом натрия и выпаривали в вакууме, чтобы извлечь осадок. Тонкослойная хроматография (диоксид кремния, 90:5:5 этилацетат:метанол:уксусная кислота) указывала на присутствие соединения A в объединенных водных слоях. Неочищенный продукт хроматографировали, элюцией 95: 5 этилацетатом:гексанами извлекали целевое соединение (0,32 г, 14%) в виде белого осадка, т. пл. 167 - 170oC вспенивается.
C. 2-Пропил-3-[[2'-[2-трифенилметил)-2H-тетразол-5-ил] [1,1'- бифенил] -4-ил] окси] -4-хинолинкарбоновая кислота, 2-метил-1-(2,2-диметил-1-оксопропокси)пропиловый эфир
Смесь соединения B (0,42 г, 0,61 ммоль), соединения B из примера 16: 2,2-диметилпропановая кислота, 1-хлор-2-метилпропиловый эфир, (0,39 г, 2,0 ммоль), К1 (0,15 г, 0,73 ммоль), карбоната калия (0,17 г, 1,2 ммоль) и 18-крон-6 (0,03 г, 0,12 ммоль) в диметилформамиде (1,2 мл) перемешивали при 90oC в течение 2,5 часа. После стояния в течение 16 часов при комнатной температуре добавляли этилацетат (40 мл), нерастворимые соли удаляли фильтрацией, фильтрат промывали 50% водным раствором сульфита натрия, водой, соляным раствором, осушали над сульфатом натрия и выпаривали до получения светло-коричневого вязкого масла (0,48 г). Тонкослойной хроматографией на силикагеле (35 г), элюируя 95:5 гексанами:этилацетатом, извлекали целевое соединение (0,23 г, 44%) в виде белого осадка; т. пл. 68 - 140oC, вспенивается.
D. 2-Пропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси]- 4-хинолинкарбоновая кислота, 2-метил-1-(2,2-диметил-1- оксопропокси)пропиловый эфир
Раствор соединения C (0,23 г, 0,27 ммоль) в этаноле (5,4 мл) и тетрагидрофуране (5,4 мл) обрабатывали 5,4 мл 2 М соляной кислоты. Перемешивание продолжалось 3 часа. Реакцию останавливали добавлением этилацетата (60 мл) и 40 мл 1:1 воды:соляного раствора. Слой этилацетата промывали 40 мл 1:1 воды: соляного раствора, осушали над сульфатом натрия и выпаривали, получая 0,21 г неочищенного продукта. Тонкослойная хроматография на силикагеле (10 г) при элюции 0,5 л гексана, 1 л смеси гексана с этилацетатом 95:5, 0,5 л смеси гексана с этилацетатом 85:15, 0,5 л смеси гексана с этилацетатом 75:25 и 1 л смеси гексана с этилацетатом и уксусной кислотой 75:23:2 извлекала целевое соединение в виде белого осадка (0,16 г, 97%); т. пл. 68 - 130oC, вспенивается.
E. 2-Пропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]окси]- 4-хинолинкарбоновая кислота, 2-метил-1-(2,2-диметил-1- оксопропокси)пропиловый эфир
Раствор соединения D (0,15 г, 0,25 ммоль) в тетрагидрофуране (0,87 мл, комнатная температура) обрабатывали бикарбонатом калия (29,6 мг, 0,30 ммоль) и водой (0,65 мл). Через 15 минут тетрагидрофуран удаляли в вакууме. Остаток очищали препаративной высокоразрешающей жидкостной хроматографией на 30 • 500 мм YMCS-10 ODS колонке, извлекая смесью метанола:воды: TFA 90:10:0,1, чтобы получить целевое соединение в виде белого осадка (78,2 мг, 46%); т. пл. 78 - 93oC, вспенивается.
Анализ элементов по формуле C35H37N5O5 • 1,0 C2HF3O2
Расчетные величины: C 61,66; H 5,17; N 9,72;
Полученные величины: C 61,53; H 5,19; N 9,72.
Пример 35
2-Этил-3-[[2'-(2H-тетразол-5-ил) [1,1-бифенил] -4-ил] окси]-4- хинолинкарбоновая кислота, этиловый эфир, однозамещенная калийная соль
A. 3-[(2'-Циано[1,1'-бифенил]-4-ил)окси]-2-этил-4- хинолинкарбоновая кислота, этиловый эфир
Смесь, содержащую соединение C из примера 2: 3-[(2'-циано[1,1'-бифенил] -4-ил)окси] -2-этил-4-хинолинкарбоновая кислота, (707 мг, 1,79 ммоль), этилйодид (559 мг, 3,58 ммоль) и карбонат цезия (1,46 г, 4,48 ммоль) в диметилформамиде (4 мл) перемешивали при комнатной температуре в течение 9 часов, затем разводили смесью ацетона с этилацетатом и фильтровали. Фильтрат выпаривали в вакууме и извлекали продукт этилацетатом. Органический экстракт ополаскивали водой и соляным раствором, осушали (сульфат магния) и выпаривали в вакууме, получая неочищенный продукт (720 мг). Тонкослойная хроматография на силикагеле Мерка (30 г) извлекала смесью гексанов:этилацетата 1:1 целевое соединение (703 мг, 93% выхода).
B. 2-Этил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4- ил]окси]-4-хинолинкарбоновая кислота, этиловый эфир, однозамещенная калийная соль
Смесь соединения A (700 мг, 1,66 моль), трибутилтиназида (2,2 г, 6,64 ммоль) и ксилола (1 мл) нагревали в закупоренных флаконах при 105oC в течение 24 часов, затем обрабатывали добавочным количеством (1 г) трибутилтиназида и повторно нагревали в течение 24 часов. Последняя порция азидового реактива (0,5 г) вносилась, и нагревание продолжали еще 16 часов. Затем реакционную смесь охлаждали и обрабатывали метанолом (2 мл), перемешивали 30 минут и выпаривали в вакууме. Тонкослойная хроматография на силикагеле Мерка (100 г) извлекала смесью гексанов:этилацетата: уксусной кислоты 10:4:0,1 и 8:4:0,1 продукт тетразола (686 мг, 89% выхода). Часть этого продукта растворяли в этаноле и обрабатывали бикарбонатом калия (64,5 мг, 0,644 ммоль), растворенным в воде, и образовавшийся раствор калийной соли очищали на 25 мл колонке с HP-20 полистиролом, элюируя градиентом ацетон-вода. Фракции продукта, извлеченные 20 - 30% ацетоном, сливали вместе и выпаривали в вакууме. После лиофилизации получали 180 мг (58% общего выхода) калийной соли тетразола; т.пл. 227 - 234oC.
Анализ элементов по формуле C27H22N5O3K • 0,8 H2O
Расчетные величины: C 62,60; H 4,59; N 13,52;
Полученные величины: C 62,42; H 4,00; N 13,21.
Пример 36
2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] -4- ил] окси]-1,8-нафтиридин-4-карбоновая кислота, двузамещенная соль лития
A. 3,3-Дибром-1,3-дигидро-2H-пирроло[2,3-b]-пиридин-2-он
7-Азаиндол (4,08 г, 34,5 ммоль) растворяли в трет-бутаноле (250 мл) с водой (3 мл), медленно добавляли частями, на протяжении 45 минут, бромидпербромид пиридиния (34,2 г, 107 ммоль). По окончании добавления начинал образовываться светло-желтый преципитат. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов, добавляли воду (5 мл) к перемешивающейся смеси и выпаривали в вакууме. Неочищенное вещество затем распределяли между водой и этилацетатом и органические экстракты дважды промывались водой и один раз соляным раствором. В это время водная фаза имела pH 5. Затем органическую фазу осушали и выпаривали до получения золотистого осадка (9,67 г, 96%).
B. 1H-Пирроло[2,3-b]пиридин-2,3-дион
Соединение A (3,0 г, 10,3 ммоль) растворяли в ацетонитриле (155 мл) с водой (10,4 мл) и затем прибавляли трифторацетат серебра (4,6 г, 20,6 ммоль), реакционную смесь защищали от света и нагревали до 85oC в течение полутора часов. Затем реакционную смесь охлаждали и фильтровали через слой селита, ополаскивали его ацетонитрилом. Фильтрат выпаривали и остаток распределяли между водой и метиленхлоридом, органические части осушали и выпаривали, чтобы получить неочищенное вещество (0,417 г). Неочищенное вещество хроматографировали в тонком слое (силикагель, 55:45 гексан:этилацетат), чтобы получить 252 мг (60% возврата колонки, 17% общего выхода) чистого азаизатина.
C. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]- 4-ил]окси]-1,8-нафтиридин-4-карбоновая кислота
Соединение B (195 мг, 1,32 ммоль) и соединение C из примера 6: 1-циклопропил-2-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил]-окси] этанон, (1,27 г, 3,95 ммоль) растворяли в едком кали (2,5 мл, 30%) с этанолом (1,25 мл), реакционную смесь герметично закрывали и нагревали до 80oC в предварительно нагретой масляной бане в течение 45 минут. Смесь охлаждали и этанол удаляли в вакууме. Добавляли воду и устанавливали кислый pH добавлением 1 н. соляной кислоты. Реакционную смесь экстрагировали этилацетатом и смесью метанол/метиленхлорид. Органические части соединяли, осушали и выпаривали, чтобы получить неочищенный желтый осадок, который преабсорбировался на силикагеле и подвергался тонкослойной хроматографии на силикагеле. Первая элюция производилась этилацетатом для удаления избытка вещества C из примера 6, принимавшего участие в реакции, затем продукт элюировали смесью этилацетата: уксусной кислоты: воды 86:8:6. Фракции продукта выпаривали и создавали азеотропные смеси с толуолом и гексаном, чтобы получить целевой продукт (480 мг, 81%).
D. 2-Циклопропил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил] окси]-1,8-нафтиридин-4-карбоновая кислота, двузамещенная соль лития
К соединению C (480 мг, 1,07 ммоль) добавляли 1,0 M водный раствор гидроксида лития (2,4 мл) и метанол (5 мл), для того, чтобы создать раствор. Раствор хроматографировали на HP-20 колонке, элюируя водой (500 мл), затем - 5% ацетон: вода. Продукт выпаривали, пропускали через миллипоровый фильтр и лиофилизировали, чтобы получить целевой продукт в виде белого осадка (442 мг, 89%); т.пл. > 255oC.
Анализ элементов по формуле C25H16N6O3Li2 • 0,91 H2O
Расчетные величины: C 62,72; H 3,75; N 17,56;
Полученные величины: C 63,05; H 3,43; N 17,23.
Пример 37
2-Циклопропил-5-метил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил] 4-ил] окси]-4-хинолинкарбоновая кислота, двузамещенная соль лития
A. 2-Метил-6-нитро- α -оксобензолпропановая кислота
Металлический натрий (3,80 г, 165 ммоль) растворяли в абсолютном этаноле (66 мл) при 0oC. Затем добавляли 3-нитроорто-ксилол (10 г, 66,2 ммоль) и диэтилоксалат (18 мл, 132 ммоль) и реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 часов. Смесь кипятили с обратным охлаждением 30 минут, затем охлаждали, добавляли воду (22 мл) и мешали при комнатной температуре 1 час. Реакционную смесь выпаривали для удаления этанола, экстрагировали этилацетатом, промывали соляным раствором, осушали над сульфатом натрия, фильтровали и выпаривали, чтобы получить целевой продукт (5,99 г, 49%).
B. 2-Метил-6-нитробензолуксусная кислота
Соединение A (13,92 г, 62,4 ммоль) растворяли в 1 н. едком натре (187 мл) при 0oC и добавляли по каплям 30% перекись водорода (7,8 мл, 68,6 ммоль) и реакционную смесь перемешивали при 0oC в течение 90 минут. Затем реакционную смесь подкисляли 10% водным раствором соляной кислоты до pH 2 и перемешивали 1 час при комнатной температуре, затем отфильтровывали осадок и промывали водой. Осадок перекристаллизовывался из этилацетата:гексана. Получали целевую кислоту (5,99 г, 49%).
C. 1,3-Дигидро-4-метил-2H-индол-2-он
Соединение B (6,54 г, 33,5 ммоль) растворяли в этаноле (200 мл) с 50% водным раствором серной кислоты (134 мл) и нагревали до 90oC. Металлический цинк (8,77 г, 134 ммоль) добавляли в реакционную смесь при 90oC в течение часа и перемешивали еще час после добавления последней порции. Затем реакционную смесь охлаждали, фильтровали и выпаривали до удаления этанола. Остаток распределяли между водой и смесью хлороформа с этилацетатом 1:1, и органическую фазу промывали насыщенным бикарбонатом натрия и соляным раствором, затем осушали над сульфатом натрия, фильтровали и выпаривали, получая целевой оксиндол (2,91 г, 59%).
D. 4-Метил-1H-индол-2,3-дион
Соединение C нагревали до 50oC в этаноле (275 мл) до полного растворения, затем охлаждали до 40oC и добавляли нитрит натрия (1,22 г, 17,6 ммоль), следом медленно добавляли концентрированную соляную кислоту (4,0 мл). По завершении нагревали реакционную смесь до 40oC в течение 16 часов. Реакционную смесь охлаждали, выпаривали в вакууме, к остатку прибавляли воду и доводили pH до 6 - 7 насыщенным раствором бикарбоната натрия. Смесь экстрагировали этилацетатом, органическую часть промывали водой, осушали и выпаривали, получая неочищенный желто-оранжевый осадок (1,21 г). Вещество очищали тонкослойной хроматографией (силикагель, 80:18:2 гексан :этилацетат:уксусная кислота), чтобы получить целевой продукт в виде оранжевого осадка (0,390 г, 36%).
E. 2-Циклопропил-5-метил-3-[[2'-(2H-тетразол-5-ил) [1,1'-бифенил]-4-ил] окси]-4-хинолинкарбоновая кислота, двузамещенная соль лития
Соединение D (300 мг, 186 ммоль) растворяли в 30% растворе едкого кали (4,0 мл) и добавляли соединение C из примера 6: 1-циклопропил-2-[[2'-(2H-тетразол-5-ил-[1,1'-бифенил] -4-ил] окси] этанон, (596 мг, 1,86 ммоль) и реакционную смесь нагревали до 110oC в течение 19 часов. Затем смесь охлаждали и добавляли воду вместе с концентрированной соляной кислотой до pH 1. Затем смесь экстрагировали этилацетатом, осушали и выпаривали, чтобы получить неочищенный желто-коричневый осадок (0,88 г). Это неочищенное вещество соединялось с 0,169 г другого неочищенного материала от предыдущей реакции, и объединенные вещества преабсорбировали на силикагеле и очищали тонкослойной хроматографией (силикагель, 50:50 этилацетат:гексан), чтобы получить 0,420 г продукта, очищенного на 88% по данным высокоразрешающей жидкостной хроматографии. К смеси добавляли гидроксид лития (4,2 мл, 1,0 M) и раствор хроматографировали на колонке с HP-20, элюируя водой (250 мл), потом градиентом ацетон: вода 0 - 25% общим объемом 1,5 л. Фракции с продуктом выпаривали, потом добавляли воду и активированный уголь и нагревали на паровой бане 10 минут. Раствор фильтровали через миллипоровый фильтр с селитным вкладышем для задержки угля и лиофилизировали, чтобы получить чистый тетразол (180 мг, 21%); т.пл. > 270oC.
Анализ элементов по формуле C27H19N5O3Li2 • 2,74 H2O
Расчетные величины: C 61,80; H 4,70; N 13,35;
Полученные величины: C 61,93; H 4,81; N 13,22.
Пример 38
Испытания in vitro включают излучение сродства к связыванию рецептора, а также функционального антагонизма. Сродство определяют методом конкурентного связывания с использованием ангиотензина II, меченого 125I и связанного с AII-рецепторами на адренокортикальных мембранах крысы. Константы ингибирования (Ki) для популяции рецептора AT1 рассчитывают способом построения интерактивной кривой1.
Функциональный антагонизм (KB) оценивают по способности антагониста в единичной концентрации блокировать индуцированные AII сокращения гладкой мышцы аорты кролика2.
Результаты экспериментов приведены в табл. 1, 1А и 2.
1. Chiu, A.T.; Carini, D.J.; Johnson, A.L.; McCall, D.E.; Price, W.A.; Thoolen, M. C.; Wong, P.C.; Taber, R.I.; Timmermans, P.B.M.W. Eur. J. Pharmacol. 1988, 157, 13-21.
2. Wong P. C. ; Hart, D.S.; Zaspel, A.M.; Chiu, A.T.; Ardecky. R.J.; Smith, R. D.; Timmermans, P.B.M.W.J. Pharmacol. Exp. Ther. 1990, 255, 584-590.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ АКТИВНОСТЬ АНГИОТЕНЗИНА II, И СПОСОБ ЛЕЧЕНИЯ ГИПЕРТОНИИ У МЛЕКОПИТАЮЩИХ | 1991 |
|
RU2111208C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТРИФТОРМЕТИЛМЕРКАПТАНА | 1991 |
|
RU2024504C1 |
| СЕРУЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ МЕВИНОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2041205C1 |
| ФЕНИЛСУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ ИЗОКСАЗОЛА И СПОСОБ ЛЕЧЕНИЯ | 1993 |
|
RU2133742C1 |
| ПРОИЗВОДНЫЕ БЕНЗАЗЕПИНА ИЛИ БЕНЗОТИАЗЕПИНА | 1989 |
|
RU2090562C1 |
| 7-ОКСАБИЦИКЛОГЕПТИЛЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ АМИДЫ ИЛИ ИХ СТЕРЕОИЗОМЕРЫ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ ТРОМБОКСАНА | 1991 |
|
RU2015980C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРАНИЛ-ЦИАНОГУАНИДИНА | 1990 |
|
RU2057129C1 |
| ПУРИНИЛ- ИЛИ ПИРИМИДИНИЛПРОИЗВОДНЫЕ МЕТИЛЕНЦИКЛОПЕНТИЛА | 1991 |
|
RU2037496C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИС(ГИДРОКСИМЕТИЛ)ЦИКЛОБУТИЛ ПУРИНОВ ИЛИ ПИРИМИДИНОВ | 1989 |
|
RU2041213C1 |
| Способ получения азетидинонов | 1983 |
|
SU1391496A3 |
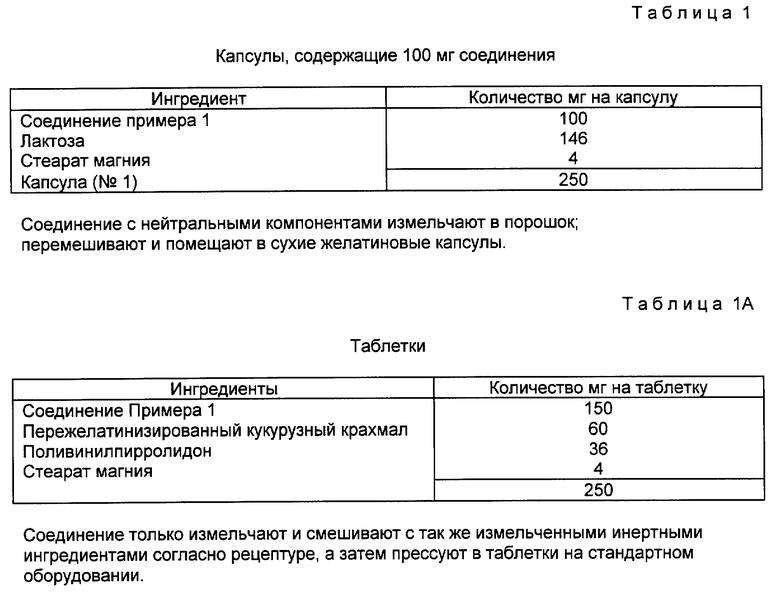
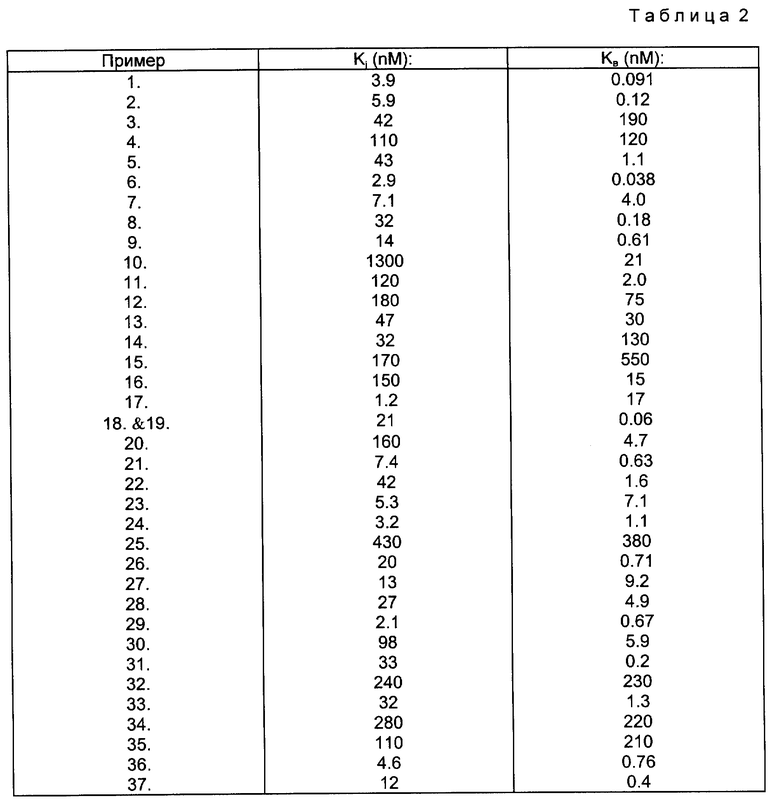
Производные хинолина формулы I,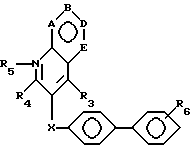
где каждый из атомов A, B, D или E - углерод, или один из A, B, D или E - азот; X - O; R1 и R2 - заместители у атомов A, B, D или E, когда A, B, D или E - углерод, представляют H, алкил, алкокси, галоген или карбокси; R3 - COOH, COOR7; R4 - H, алкил, C3-7 - циклоалкил; R5 - необязательно атом кислорода; R6 - H, 5-тетразолил; R6 и R8 - алкил; R9 - H или низший алкил, или их фармацевтически приемлемые соли подавляют действие ангиотензина П и поэтому полезны, например, как средства, снижающие давление. 3 с. и 38 з.п. ф-лы, 3 табл.
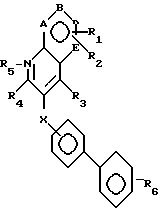
где каждый из атомов, A, B, D или E представлены углеродом, или один из атомов A, B, D или E представлен азотом;
X является -O-;
R1 и R2 являются заместителями у атомов A, B, D или E, когда A, B, D или E представлены углеродом и независимо выбираются из водорода, C1-4-алкила, C1-4-алкокси, галогена или карбокси,
R3 является COOH, COOR7;
R4 является водородом, C1-4-алкилом, C3-7-циклоалкилом;
R5 - необязательно атом кислорода;
R6 - водород, 5-тетразолил;
R7 - C1-4-алкил, -CH2-COOR8,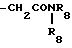
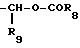
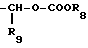
R8 - низший алкил;
R9 - водород или низший алкил;
или их фармацевтически приемлемые соли.
| 1971 |
|
SU410762A1 | |
| 0 |
|
SU400974A1 | |
| US 5049565 A, 1991 | |||
| US 4880804 A, 1989 | |||
| М.Д.Машковский "Лекарственные средства", ч.1, М., Медицина, 1988, с.127-129, 382-383. | |||
Авторы
Даты
1998-11-27—Публикация
1993-02-12—Подача