Изобретение касается способа получения производных сахарозы путем региоизбирательной реакции, и он может быть использован, например, для получения монозамещенных производных сахарозы, в которых заместитель находится в положении 6. Данное изобретение охватывает также некоторые новые дистанно-оксановые соединения.
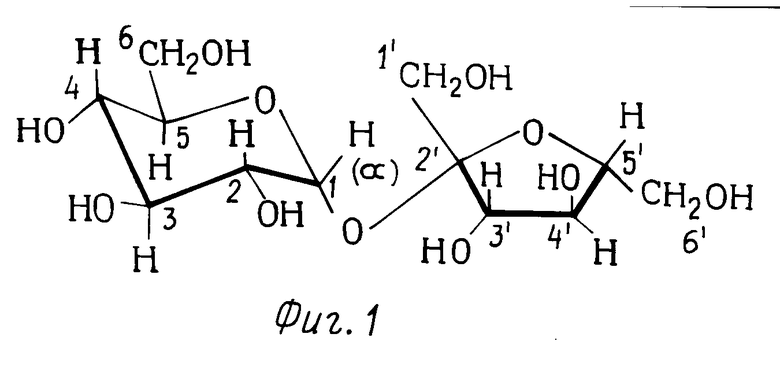
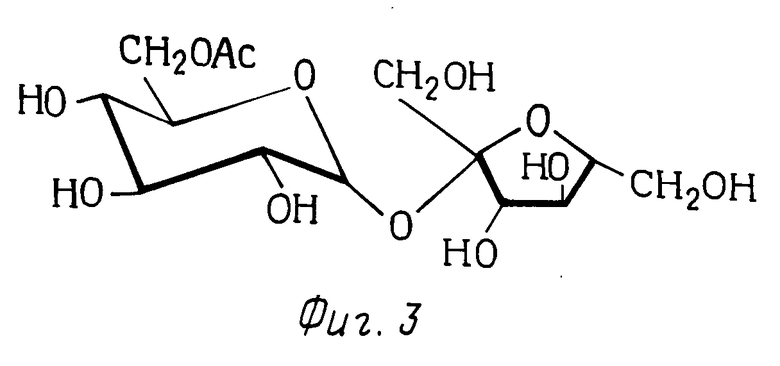
Сахароза представляет собой дисахарид, имеющий молекулярную структуру, показанную на фиг.1. (На фиг.1-3 показывающих молекулярную структуру сахарозы и ее производных, используется конфармационная структурная формула. Для удобства на фиг.1 показаны лишь атомы водорода, связанные с атомами углерода в двух кольцах, и номера положений углеродных атомов). Молекула сахарозы содержит три первичные гидроксильные группы и пять вторичных гидроксильных групп. Следовательно, при желании получения производных сахарозы путем реакции гидроксильных групп, основной процесс синтеза может быть направлен лишь на химическую реакцию до получения желаемых гидроксильных групп. Так, например, искусственное сахаристое вещество 4,1',6'-трихлор-4,1',6'-тридеоксигалактосахароза получается из сахарозы путем вытеснения гидроксилов в 4, 1' и 6' положениях хлором. (В процессе получения сахаристого вещества стереоконфигурация в положении 4 становится обратной следовательно данное соединение представляет собой галактосахарозу). Данное соединение и способы синтеза описываются в патентах США NN 4343934, 4362869, 4380476 и 4435440. Направление атомов хлора лишь и желательные положения является основной проблемой синтеза, особенно ввиду того, что гидроксильные группы, которые вытемняются, имеют различную химическую активность (два являются первичными и один является вторичным; кроме того, синтез усложняется тем, что первичный гидроксил, находящийся в положении 6, является незамещенным в конечном продукте). Такое получение данного сахаристого вещества является лишь одной иллюстрацией синтеза производных сахарозы, где желательно либо образование некоторых специфических гидроксильных групп, и лишь только таких групп, либо образование лишь определенного числа гидроксильных групп, и вероятно в этом последнем случае образующиеся гидроксильные группы не должны быть специфическими гидроксильными группами. Получение поверхностно-активных веществ, являющихся сложными моноэфирами на основе сахарозы, является примером осуществления в промышленных условиях монозамещения в молекуле сахарозы.
Изобретение предусматривает способ синтеза соединений сахарозы в виде 6-замещенных производных сахарозы, в котором процесс является в высокой степени региоизбирательным как в отношении направления хода реакции строго в 6-положение, так и в отношении получения лишь моно-замещенных производных. Под термином "региоизбирательный" имеется в виду реакция, которая очень благоприятствует получению единственного основного продукта. (Смотри публикацию Hassner "Региоспецифичность. Терминология, используемая в реакциях присоединения и реакциях элиминирования", J. Org. Chem. 33, N 7, 2684-2686, 1968).
В обзорной публикации под названием Regioselective manipulation of hydroxyl group via organotin derivatives, Tetrahedron, том 41, N 4, стр. 643-663, 1985 г. David и др. описывается реакция соединений олова с соединениями, содержащими гидроксильную группу, с образованием в результате станнаксиловых соединений, которые затем могут алкилироваться или ацилироваться с образованием простых или сложных эфиров. Описывается реакция оксида бис(трибутилолова) с различными углеводами (включая сахарозу) с последующим ацилированием для получения смеси сложных эфиров с различной степенью замещения. В этой публикации описывается также использование оксида дибутилолова в реакции с углеводородами. В этой публикации сообщается о получении двух углеводных производных диалкилстаннилена, а именно 2,3-0-дибутилстанниленового производного метил-4,6-0-бензилиден-α -D-глюкопиранозида и 4,6-0-бензилиден-2,3-0-дибутилстаннилен-α-D-маннопиранозида. Предложенные молекулярные структуры этих двух стенниленовых производных показаны на рисунках 3 и 4 на стр. 645 данной публикации.
Wagner и др. J. Org. Chem. 39, 24, 1974, описывают получение дибутилстанниленовых производных нуклеозидов путем реакции оксида дибутилолова с нуклеозидами в кипящем метаноле. После отгонки метанола стенниленовое производное ацилируется путем реакции с равномолярными количествами хлорангидрида кислоты и триэтиламина.
Helzapfel и др. "Производные сахарозы и избирательное бензоилирование вторичных гидроксильных групп 6,1',6'-три-0-тритилсахарозы", S. Afr. Tydskr. Chem. 1984, 373, стр. 57-61, описывают реакцию оксида дибутилолова с последующей реакцией с хлористым бензоилом, в результате чего получаются 3-0-бензоил-6,1',6'-три-0-тритилсахароза с выходом 72% и производное 2-0-бензоата с выходом 9% и незначительные количества производного 2,3'-бунзоата.
Как говорится в известных публикациях, химическая активность гидроксильной группы увеличивается за счет образования связи с оловом, но в гидроксилированных соединениях, таких как сахара, нельзя априорно предсказать какая гидроксильная группа будет активироваться (смотри стр. 646-647 приведенной как ссылочный материал публикации статьи David и др. в разделе "Стереоэлектронные последовательности связи Sn-O-нуклеофильное усиление атома кислорода", особенно последний абзац данного раздела).
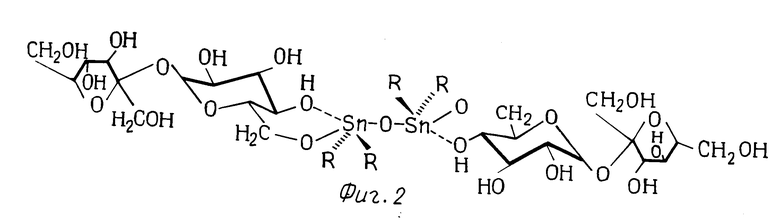
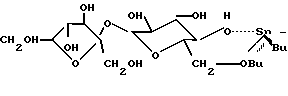
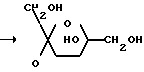
На фиг.1-3 представлены структурные формулы сахарозы, 1,3-ди-(6-0-сахароза)-1,1,3,3-тетрабутил дистанноксана и сахарозо-6-сложного эфира, соответственно.
Способ изобретения включает реакцию оксида дибутилолова в кипящем метаноле с сахарозой при молярном соотношении 1:1 в течение времени, необходимом для получения прозрачного раствора.
Ниже приводится обобщенное описание процедуры.
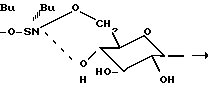
В реакционный сосуд вводятся метанол (100 мл), сахароза (5 г) и оксид дибутилолова (3,64 г 1 молярный эквивалент, в расчете на моли сахарозы используется 1 моль олова на моль сахарозы). Содержимое реакционного сосуда кипятится с обратным холодильником в течение 2-2,5 ч, после чего метанол отгоняется. Продуктом этой реакции является 1,3-ди-(6-0-сахарозо)-1,1,3,3-тетрабутилдистанноксан (или дибутилстанноксисахароза "DBSS" в виде белого твердого вещества.
В описанных специфических реакциях оксид дибутилолова и сахароза смешиваются и нагреваются в кипящем метаноле. Следует иметь в виду, что метанол сначала химически взаимодействует с оксидом дибутилолова с образованием 1,3-диметокси-1,1,3,3-тетра-бутилдистанноксана (или "диметоксидистанноксана"). Диметоксидистанноксан является таким соединением, которое реагирует с сахарозой с образованием DBSS. Анализ DBSS позволяет сделать заключение, что DBSS является соединением указанной ниже структуры:
Suc-O-Sn(Bu)2-O-Sn(Bu)2-O-Suc, в которой Suc представляет собой 6-0-сахарозу (то есть сахарозное звено связано через кислород, который связан с атомом углерода в положении 6), и в которой Bu представляет собой бутил. На фиг. 2 показана молекулярная структура 1,3-ди(6-0-сахарозо)-1,1,3,3-тетра (гидрокарбил)-дистанноксанов, которые получаются при осуществлении способа данного изобретения. На данной фигуре группы "R" представляют собой гидрокарбильные группы, которые могут быть одинаковыми или различными.
Согласно предпочтительному принципу осуществления данного изобретения, когда ди(гидрокарбилокси)-дистаноксан образуется непосредственно в ходе процесса в результате реакции оксида ди(гидрокарбил) олова с низшим алканолом, таким как метанол, оксид ди(гидрокарбил) олова и сахароза используются в данной реакции предпочтительно в таких пропорциях, чтобы на один моль сахарозы приходилось не менее чем один моль оксида ди(гидрокарбил) олова. Несколько более высокие пропорции оксида ди(гидрокарбил) олова не оказывают нежелательного влияния на реакцию этерификации. Однако менее чем равномолярные пропорции соединения олова будут снижать количество сахарозы, превращаемой в DBSS и, следовательно, будут снижать специфичность реакции.
Вместо оксида дибутилолова могут использоваться другие оксиды ди(гидрокарбил) олова, в которых гидрокарбильные группы, связанные с оловом, могут представлять собой индивидуально алкил, циклоалкил, арил или арилалкил, такие как метил, этил, пропил, бутил, октил, бензил, фенетил, фенил, нафтил, циклогексил и замещенный фенил. Предпочтительными гидрокарбильными группами являются группы алкила с содержанием вплоть до 8 атомов углерода. Вместо оксида олова могут быть использованы диалкоксид, дигалогенид, диацилат ди(гидрокарбил) олова и другие оловоорганические соединения, которые образуют ди(гидрокарбилокси)дистанноксан непосредственно в зоне протекания процесса.
Данная реакция осуществляется в органической жидкой реакционной среде, которая представляет собой растворитель сахарозы и ди(гидрокарбилокси)дистанноксана. Когда ди(гидрокарбилокси) дистанноксан образуется непосредственно в зоне процесса, реакционная среда предпочтительно также является растворителем для соединения (или соединений), которые используются для получения ди(гидрокарбилокси)дистанноксана. Наиболее желательно, чтобы данная реакционная среда была также одним из реагентов, которые используются для образования ди(гидрокарбилокси)дистанноксана непосредственно в зоне процесса. В качестве реакционной среды можно использовать большое число различных алифатических и циклоалифатических спиртов. Часто бывает наиболее экономично, чтобы осуществлялась реакция между оксидом ди(гидрокарбил) олова (или эквивалентным реагентом) и спиртом или фенолом при нагревании с обратным холодильником при атмосферном давлении. Для этой цели обычно предпочтительными являются первичные спирты низшего алкила. Так, предпочтительными реакционными средами являются низшие алканолы, такие как метанол, этанол, н-пропанол, н-бутанол, н-пентанол и н-гексанол. Дополнительными спиртами и фенолами, которые могут использоваться в качестве реагента /реакционной среды, являются вторичные спирты, такие как изопропиловый /спирт и другие вторичные алканолы, фенол, замещенные фенолы, такие как низшие алкил-замещенные фенолы, циклогексанол и замещенные циклогексанолы, такие как низший алкил-замещенный циклогексанол. В данной реакции при желании могут использоваться инертные органические жидкости, такие как толуол, ксилол и другие углеводороды.
Ди(гидрокарбилокси)-дистанноксан может быть представлен следующей формулой:
R'-O-Sn(R)2-O-Sn(R)2-O-R', в которой каждая группа R' индивидуально представляет собой алкил, циклоалкил, арил или аралкил, и в которой каждая группа индивидуально представляет собой группу гидрокарбила, например алкила, циклоалкила, арила или аралкила. Реакция между сахарозой и ди(гидрокарбилокси) дистанноксаном осуществляется при такой температуре и в течение такого периода времени, которые достаточны для образования ди(гидрокарбил)-станноксилсахарозы. Так, например, температуры реакции находятся в пределах примерно 50-150оС. Наиболее желательно осуществление реакции при температуре нормального (то есть при атмосферном давлении) флегмообразования реакционной среды. Так, время реакции составляет примерно 1-24 ч.
Ди(гидрокарбил) станнооксилсахароза извлекается способами, аналогичными тем, которые уже известны в данной области. Реакционная среда удаляется путем ее отгонки, которая может осуществляться при желании при пониженном давлении. Данный продукт является твердым веществом и может очищаться при желании путем перекристаллизации.
П р и м е р 1. 1,3-Ди-(6-0-сахарозо)-1,1,3,3-тетрабутилдистанноксан (DBSS).
Сахароза (50 г) и оксид дибутилолова (38,2 г) кипятятся в кипящем метаноле (1 л) при нагревании с обратным холодильником до тех пор, пока не получается прозрачный раствор (2,5 ч). Раствор выпаривается и остаточный продукт выпаривания высушивается в вакууме и в результате получается 87,9 г DBSS.
Вычислено, C 41,26; H 6,75; Sn 20,39.
C40H78O23Sn2.
Найдено, C 41,28; H 6,84; Sn 20,63.
Термогравиметрический анализ (ТГА) показал потерю массы 18% при нагревании материала до 204-218оС.
Дифференциальная сканирующая калориметрия (ДСК) показала две экзотермы. Первая начинается при 172оС, максимум пика приходится на 184оС (Н 48 J/g); вторая начинается при 207оС и максимум пика приходится на 212оС (Н 97,3 J/g). Первый экзотермический эффект связан, возможно, с распадом комплекса, тогда как второй объясняется разложением карбогидрата и коррелирует с наблюдаемой по ТГА потерей массы 18%
Удельное вращение [α]20 + 34o (CH3OH, C 0,31).
Спектральные данные.
а) Ядерный магнитный резонанс (ЯМР)119 Sn комплекса показывает единичный резонанс на -183,034 млн.д. относящийся к тетраметилолову (0 млн.д.) в ДМФ, что согласуется со структурой типа дистанноксана.
б) Данные ЯМР13С подтверждают, что одна сахароза приходится на остаток дибутилолова. Пики резонанса были приписаны следующим образом: Сахароза: Глюкозил Фруктозил С1 92,097 64,053 С2 73,917* 103,103 С3 74,121 79,379 С4 70,079 74,627 С5 73,917* 82,555 С6 61,347 60,080 (может быть обращен)
* сигналы перекрываются
Sn(CH2CH2CH2CH2)2
- H2CH3 34,594 CH
H2CH3 34,594 CH H2CH3 29,466
H2CH3 29,466
-CH2CH3 12,351 CH2CH2CH3 25,724
Использование: в качестве промежуточного продукта для синтеза подслащивающего вещества. Сущность изобретения: 1,3-ди-(6-0-сахароза)-1,1,3,3-тетрабутилстанноксан [α]20+34°(CH3OH) с 0,31). Реагент 1:сахароза. Реагент 2: оксид дибулолова. Условия реакции: в кипящем метаноле до получения прозрачного раствора. 2 с.п. ф-лы, 3 ил.
2. Способ получения 1,3-ди-(6,0-сахарозо)- 1,1,3,3-тетрабутилдистанноксана, отличающийся тем, что осуществляют взаимодействие оксида дибутилолова в кипящем метаноле с сахарозой при молярном соотношении 1:1 в течение времени, необходимого для получения прозрачного раствора.
| Wagner et al., j.Org.Chem., 39, 24 (1974) |
Авторы
Даты
1995-08-09—Публикация
1989-07-17—Подача