Область техники
Настоящее изобретение относится к способу получения эфира угольной кислоты из металлорганического соединения и диоксида углерода. Более конкретно настоящее изобретение относится к способу получения эфира угольной кислоты, включающему стадии: (1) проведения реакции между первой смесью металлорганического соединения и диоксидом углерода, где первая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из реакционноспособного металлорганического соединения, с получением в результате реакционной смеси, содержащей эфир угольной кислоты, полученный в результате реакции, нерегенерируемое инертное соединение и регенерируемое метаморфное металлорганическое соединение, образованное из реакционноспособного металлорганического соединения; (2) разделения реакционной смеси на первую часть, содержащую сложный эфир угольной кислоты и нерегенерируемое инертное соединение, и вторую часть, содержащую регенерируемое металлорганическое соединение; и (3) взаимодействия второй части реакционной смеси со спиртом с образованием второй смеси металлорганического соединения и воды и удаления воды из второй смеси металлорганического соединения, где вторая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из реакционноспособного металлорганического соединения.
С помощью способа настоящего изобретения эфир угольной кислоты может быть получен с высоким выходом из металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и диоксида углерода. Одним из преимуществ указанного способа является то, что диоксид углерода не обладает ни токсичностью, ни коррозионной активностью и является недорогим. Кроме того, способ настоящего изобретения обладает преимуществом не только в том, что металлорганическое соединение после применения в этом способе может быть регенерировано и рециркулировано для повторного применения, но также и в том, что нерегенерируемое инертное металлорганическое соединение, образованное в этом способе, может быть удалено из реакционной системы, посредством чего реализуется эффективное и стабильное производство эфира угольной кислоты. Более того, отсутствует необходимость в использовании большого количества дегидратирующего агента, в результате чего предотвращается образование отходов, образующихся из дегидратирующего агента. Таким образом, способ настоящего изобретения является коммерчески весьма полезным и имеет высокое промышленное значение.
Предшествующий уровень техники
Эфир угольной кислоты является полезным соединением. Например, эфир угольной кислоты используют в качестве добавок в различных целях, таких как присадка к бензину для повышения октанового числа и присадка к дизельному топливу для снижения количества частиц в выхлопном газе, генерируемом при сгорании дизельного топлива. Эфир угольной кислоты также используют в качестве алкилирующего агента, карбонилирующего агента, растворителя и т.д. в области синтеза органических соединений, таких как поликарбонат, уретан, фармацевтические средства и агрохимикаты. Эфир угольной кислоты также может быть использован в качестве электролита для литиевого аккумулятора, исходного вещества для получения смазочного масла и исходного вещества для получения раскислителя, который может быть использован для защиты бойлерных труб от ржавления.
В качестве обычного способа получения эфира угольной кислоты можно упомянуть способ, в котором фосген, используемый в качестве источника карбонила, вводят в реакцию со спиртом, в результате чего образуется эфир угольной кислоты. Так как фосген, используемый в этом способе, является исключительно вредным и высококоррозионным, этот способ невыгоден из-за того, что транспортировка и хранение фосгена требует особой осторожности, и, кроме того, необходимы большие затраты на эксплуатацию технологического оборудования и обеспечение безопасности. Кроме того, этот способ вызывает проблему необходимости утилизации соляной кислоты, образующейся в качестве загрязняющего побочного продукта.
Другой обычный способ получения эфира угольной кислоты представляет собой способ окислительного карбонилирования, при котором монооксид углерода, используемый в качестве источника карбонила, вводят в реакцию со спиртом и кислородом в присутствии катализатора, такого как хлорид меди, в результате чего получают эфир угольной кислоты. В указанном способе монооксид углерода (который является исключительно вредным) используют под высоким давлением; следовательно, указанный способ невыгоден из-за того, что имеют место большие затраты на эксплуатацию технологического оборудования и обеспечение безопасности. Кроме того, проблема названного способа заключается в том, что имеет место побочная реакция, такая как окисление монооксида углерода с образованием диоксида углерода. По этой причине желательно разработать безопасный и более эффективный способ производства эфира угольной кислоты.
В таких обычных способах, в которых фосген или монооксид углерода используются в качестве исходного вещества, галоген, такой как хлор, присутствует в исходном веществе сам по себе или в составе катализатора. Следовательно, в случае указанных способов полученный эфир угольный кислоты содержит следовое количество галогена, который не может быть полностью удален с помощью простой стадии очистки. Когда такой эфир угольной кислоты используют в качестве присадки к бензину, присадки к светлым нефтепродуктам или в качестве материала для производства электронного оборудования, существует опасность, что галоген, содержащийся в эфире угольной кислоты, будет вызывать коррозию оборудования. Для снижения количества галогена в эфире угольной кислоты только до следовых количеств необходимо проводить тщательную очистку эфира угольной кислоты. По этой причине желательно разработать способ производства эфира угольной кислоты, в котором не используют какое-либо галогенсодержащее исходное вещество и галогенсодержащий катализатор.
С другой стороны, на практике реализован способ, в котором диоксид углерода вводят в реакцию с этиленоксидом или подобным соединением с получением циклического угольного эфира и полученный циклический эфир угольной кислоты вводят в реакцию с метанолом, получая в результате диметилкарбонат. Преимущество указанного способа заключается в том, что диоксид углерода как исходное вещество является безвредным, и коррозионные вещества, такие как соляная кислота, по существу не используются и не образуются. Однако этот способ отличается следующими проблемами. В этом способе побочным продуктом является этиленгликоль; следовательно, с точки зрения стоимости производства необходимо искать пути эффективной утилизации побочного этиленгликоля. Кроме того, трудно осуществить безопасную транспортировку этилена (который является исходным веществом для производства этиленоксида) и этиленоксида. Следовательно, для исключения потребности в транспортировке необходимо, чтобы завод по производству эфира угольной кислоты этим способом был построен в месте, которое находится рядом с заводом по производству этилена и этиленоксида.
Также известен способ, по которому диоксид углерода, используемый в качестве источника карбонила, вступает в равновесную реакцию со спиртом в присутствии катализатора, содержащего металлорганическое соединение, имеющее связь металл-кислород-углерод, в результате чего образуется эфир угольной кислоты и вода. Такая равновесная реакция представлена следующим уравнением (3):
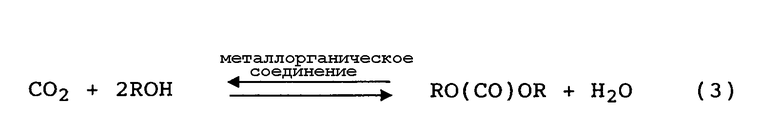
(R представляет собой ненасыщенную или насыщенную углеводородную группу)
Преимущество указанного способа состоит в том, что диоксид углерода и спирт как исходные вещества являются безвредными. Однако этот способ основан на равновесной реакции, в которой эфир угольной кислоты и вода как продукты реакции образуются одновременно. Как и в случае названного выше способа окислительного карбонилирования с использованием монооксида углерода образуется вода. Однако в способе окислительного карбонилирования не используется равновесная реакция. Равновесие равновесной реакции с использованием диоксида углерода в качестве исходного вещества термодинамически смещено в сторону исходной системы. Следовательно, проблема способа на основе равновесной реакции заключается в том, что для получения эфира угольной кислоты с высоким выходом необходимо, чтобы эфир угольной кислоты и вода как продукты реакции удалялись из реакционной системы. Кроме того, также существует проблема в том, что образующаяся вода разлагает катализатор, что не только препятствует реакции, но также приводит к тому, что число рециклов катализатора (то есть число циклов регенерации и повторного использования) составляет только 2 или 3. Для решения этой проблемы предложены различные способы удаления воды (которая является продуктом реакции) с использованием дегидратирующего агента.
Например, предложен способ, в котором спирт и диоксид углерода вводят в реакцию друг с другом, в результате чего образуется эфир угольной кислоты и вода, где большое количество дициклогексилкарбодиимида (DCC) (который является дорогим органическим дегидратирующим агентом) или подобного соединения используется в качестве дегидратирующего агента (см. Collect. Czech. Chem. Commun., Vol. 60, 687-692 (1995)). Проблема указанного способа состоит в том, что дегидратирующий агент после использования не может быть регенерирован, в результате чего существует большое количество отходов, полученных из дегидратирующего агента.
В других способах получения эфира угольной кислоты используют ортоэфир карбоновой кислоты в качестве органического дегидратирующего агента (см. нерассмотренную выложенную патентную заявку Японии N. Hei 11-35521) (В этом патентном документе есть следующие слова: «ортоэфир карбоновой кислоты вводят в реакцию с диоксидом углерода» и «ацеталь реагирует с диоксидом углерода». Однако в результате последних исследований в данной области в общем случае высказано предположение, что настоящий реакционный путь состоит в следующем. «Спирт и диоксид углерода реагируют друг с другом с получением эфира угольной кислоты и воды. Воду вводят в реакцию с ортоэфиром карбоновой кислоты»). Этот способ имеет проблему в том, что ортоэфир карбоновой кислоты (который является дорогим соединением) используется в качестве дегидратирующего агента, а метилацетат является побочным продуктом (см. "Kagaku Sochi (Chemical Equipment)", Vol. 41, № 2, 52-54 (1999)). Следовательно, указанный способ также неудачен, как и упомянутые выше способы.
Кроме того, еще в одном способе используют большое количество ацеталя в качестве органического дегидратирующего агента (см. патент Германии № 4310109). Также существует патентный документ, в котором описывается, что ацеталь и диоксид углерода реагируют друг с другом при использовании в качестве катализатора алкоксида металла или оксида дибутилолова (см. нерассмотренную выложенную патентную заявку Японии № 2001-31629). (Что касается реакции, описанной в последней, то в результате недавних исследований в данной области сделано общее предположение, что действительный ход реакции заключается в следующем. «Спирт и диоксид углерода реагируют друг с другом с получением эфира угольной кислоты и воды. Вода затем вступает в реакцию с ацеталем»). Однако эти патентные документы не указывают на способ или не предлагают способа достаточно эффективного производства ацеталя без образования отходов. Кроме того, способы, описанные в указанных патентных документах, имеют проблему в том, что когда в качестве дегидратирующего агента используют ацеталь, образуются большие количества побочных продуктов, таких как кетон и альдегид, в качестве отходов.
Результаты, достигаемые с помощью способов, в которых используют органический дегидратирующий агент, должны улучшить число рециклов катализатора. Однако органический дегидратирующий агент расходуется в стехиометрическом количестве в соответствии с образованием эфира угольной кислоты (и воды в качестве побочного продукта), так что расходуется большое количество органического дегидратирующего агента, приводя в результате к образованию большого количества продукта разложения органического дегидратирующего агента. Таким образом, необходимо проводить дополнительную стадию регенерации большого количества органического дегидратирующего агента. Кроме того, несмотря на использование органического дегидратирующего агента в большом количестве, все еще остается вероятность дезактивации катализатора. Причина состоит в следующем. В обычном способе получения эфира угольной кислоты при использовании равновесной реакции приведенного выше уравнения (3) диоксид углерода находится в сверхкритическом состоянии. В общем случае в сверхкритическом диоксиде углерода катализатор имеет плохую растворимость, и частицы катализатора, по-видимому, связаны вместе. Следовательно, проблема состоит в том, что когда оловоорганическое соединение (которое чувствительно к полимеризации) используют в качестве катализатора в сверхкритическом диоксиде углерода, оловоорганическое соединение как катализатор, вероятно, дезактивируется вследствие полимеризации.
Также предложен способ, в котором используется твердый дегидратирующий агент (см. Applied Catalysis, Vol. 142, L1-L3 (1996)). Однако проблема указанного способа состоит в том, что твердый дегидратирующий агент не может быть регенерирован, следовательно, образуется большое количество отходов.
Также известен способ, в котором спирт (метанол) и диоксид углерода реагируют друг с другом в присутствии оксида металла (оксида дибутилолова) с получением в результате реакционной смеси, и полученную реакционную смесь охлаждают и вводят в насадочную колонну, содержащую твердый дегидратирующий агент, в результате чего постепенно смещают равновесие в сторону эфира угольной кислоты, воздействуя при этом на дегидратацию, чтобы получить эфир угольной кислоты (см. нерассмотренную выложенную патентную заявку Японии № 2001-247519). Указанный способ основан на методике, в которой обычная методика использования дегидратирующего агента объединена с известным явлением, что способность адсорбировать воду обычного дегидратирующего агента (такого как молекулярные сита) имеет температурную зависимость. Дегидратирующий агент (такой как молекулярные сита) имеет более низкую способность адсорбировать воду при высоких температурах, чем при низких температурах. Следовательно, для удаления следового количества воды (побочного продукта) из реакционной смеси, которая содержит значительный избыток низкомолекулярного спирта, используемого в качестве растворителя, необходимо охлаждать реакционную смесь, в которой равновесие достигается при высокой температуре и в условиях высокого давления, до введения реакционной смеси в насадочную колонну, содержащую твердый дегидратирующий агент. Кроме того, для повышения конверсии спирта как исходного вещества, необходимо, чтобы реакционная смесь, которая охлаждена и дегидратирована в насадочной колонне, была возвращена в условия с высокой температурой и высоким давлением, которые необходимы для реакции. Следовательно, проблема способа состоит в том, что необходимо расходовать исключительно большое количество энергии для охлаждения и нагревания и требуется большое количество твердого дегидратирующего агента. Указанный способ очень широко используется для производства алифатических сложных эфиров, имеющих относительно большую константу равновесия. Однако при производстве эфира угольной кислоты из диоксида углерода и спирта, когда равновесие реакции сильно смещено в сторону исходной системы, это способ неприемлем, так как такой способ имеет проблему, заключающуюся в том, что необходимо повторять упомянутую выше операцию, которая требует очень большого расхода энергии для охлаждения и нагревания. Кроме того, для регенерации использованного дегидратирующего агента, который абсорбирует воду до насыщения, обычно необходимо прокаливать использованный дегидратирующий агент при нескольких сотнях °С, что делает этот способ коммерчески неприемлемым. Кроме того, в этом способе только один (вода) из двух продуктов равновесной реакции удаляется и, следовательно, существует проблема в том, что, когда равновесная реакция развивается с повышением концентрации эфира угольной кислоты в реакционной системе, становится невозможным дальнейшее протекание реакции, то есть способ все еще находится под ограничением равновесной реакции. Кроме того, оксид дибутилолова, который используется в качестве катализатора в этом способе, имеет исключительно низкую растворимость в метаноле и, следовательно, почти весь оксид дибутилолова как катализатор остается в реакционной системе в твердой форме. Таким образом, когда реакционную смесь охлаждают до комнатной температуры на стадии охлаждения, реакционная смесь превращается в белую суспензию, вызывая такую проблему, что на последующей стадии дегидратации, проводимой с использованием насадочной колонны, содержащей дегидратирующий агент, суспензия вызывает забивку насадочной колонны.
В целом в данной области реакций органического синтеза известен способ дегидратации, в котором воду удаляют отгонкой. Однако в области производства эфира угольной кислоты из диоксида углерода и спирта, хотя в публикации «Study Report of Asahi Glass Association for Promotion of Industrial Technology (Asahi Garasu Kogyogijutsu Shoreikai Kenkyu Hokoku)», Vol. 33, 31-45 (1978) утверждается, что «дегидратация отгонкой в настоящее время изучается», отсутствуют сообщения и подобные публикации, в которых утверждается, что способ дегидратации с использование отгонки осуществлен.
Есть статья, в которой упоминается отделение отгонкой эфира угольной кислоты из реакционной смеси, содержащей алкоксид металла, где реакционная смесь получена при взаимодействии диоксида углерода и спирта друг с другом в присутствии катализатора алкоксида металла; однако в данной области известно, что когда используется в качестве катализатора алкоксид металла, разделение отгонкой вызывает обратную реакцию, что делает трудным выделение эфира угольной кислоты отгонкой (см. «Journal of the Chemical Society of Japan (Nippon Kagaku Kaishi)», № 10, 1789-1794 (1975)). В частности, не известен способ, по которому эфир угольной кислоты, имеющий высокую температуру кипения, мог бы быть отделен с высоким выходом от реакционной смеси, содержащей алкоксид металла.
С другой стороны, алкоксид металла является настолько нестабильным, что чувствителен к дезактивации под действием влаги воздуха. Следовательно, в приведенном выше способе работа с алкоксидом металла требует большой осторожности. По этой причине обычная методика использования в качестве катализатора алкоксида металла не применяется при промышленном производстве эфира угольной кислоты. Катализатор на основе алкоксида металла является дорогим соединением, и не известна методика регенерации дезактивированного алкоксида металла как катализатора.
Предложен способ производства эфира угольной кислоты с использованием диалкоксида дибутилолова в качестве катализатора, в котором при проведении реакции катализатор образуется из оксида дибутилолова (который устойчив к воздействию влаги), добавленного в реакционную систему (см. патент Японии № 3128576). Проблема указанного способа состоит в том, что, хотя оксид дибутилолова, который загружен в реакционную систему, является стабильным, оксид дибутилолова превращается в ходе реакции в диалкоксид дибутилолова, который нестабилен. Следовательно, указанный способ не решает названную выше проблему нестабильности катализатора алкоксида металла. То есть недостаток названного способа состоит в том, что при удалении реакционной смеси из реакционной системы для выделения эфира угольной кислоты, полученного в качестве продукта реакции, нестабильный диалкоксид дибутилолова дезактивируется и не может быть регенерирован по обычной методике. Следовательно, в этом способе нет другого выбора, как выбрасывать катализатор диалкоксид дибутилолова (который является дорогим соединением) в виде отхода после реакции.
С другой стороны, известно, что когда алкоксид металла (например, диалкоксид диалкилолова) нагревают приблизительно до 180°С, алкоксид металла подвергается термическому разложению с образованием алкоксида триалкилолова и т.д. (см. «Kougyoukagakuzasshi (Journal of the Society of Chemical Industry)», Vol. 72, № 7, рр. 1543-1549 (1969)). Также известно, что алкоксид триалкилолова, образовавшийся при термическом разрушении, имеет очень низкую способность к образованию эфира угольной кислоты (см. «J. Org. Chem.», Vol. 64, pp. 4506-4508 (1999)). Трудно (или по существу невозможно) регенерировать диалкоксид диалкилолова, имеющий прекрасную активность, из алкоксида триалкилолова. Кроме того, образование такого непригодного соединения (то есть нерегенерируемого инертного соединения) вызывают проблему в том, что когда алкоксид металла используется в качестве катализатора повторно, содержание активного катализатора в алкоксиде металла уменьшается и, следовательно, скорость реакции и выход эфира угольной кислоты понижаются, что делает стабильное производство эфира угольной кислоты трудным. В этом случае для стабилизации скорости реакции и выхода эфира угольной кислоты используют обычный способ, в котором в реакционную систему добавляют небольшое количество свежего алкоксида металла. Однако проблема указанного способа состоит в том, что, когда проводят добавление свежего алкоксида металла, оставляя продукт деградации, образовавшийся в ходе реакции, поскольку он присутствует в реакционной системе, продукт деградации, который имеет низкую каталитическую активность, в большом количестве накапливается в реакционной системе. Как очевидно из вышесказанного, не существует обычного способа, при котором алкоксид металла эффективно используется повторно в качестве катализатора; в любом из обычных способов получения эфира угольной кислоты по окончании реакции нет другого выбора, как выбрасывать алкоксид металла в качестве отхода, что делает производство эфира угольной кислоты неприемлемо дорогим.
Таким образом, в обычных способах производства эфира угольной кислоты с использованием алкоксида металла, диоксида углерода и спирта, когда алкоксид металла (который является дорогим продуктом) теряет свою каталитическую активность из-за гидролиза и т.д., нет путей легкой и эффективной регенерации и повторного использования алкоксида металла. Следовательно, недостаток обычных способов получения эфира угольной кислоты состоит в том, что необходимо использование большого количества органического дегидратирующего агента или твердого дегидратирующего агента в комбинации с небольшим количеством алкоксида металла.
Как описывалось выше, методики получения эфира угольной кислоты предшествующего уровня техники имеют много проблем и, следовательно, не могут быть введены в практику.
Для решения проблем, сопровождающих предшествующий уровень техники, заявители настоящего изобретения в публикации WO 03/055840 предложили новый способ получения эфира угольной кислоты. Существенным признаком нового способа является то, что в указанном способе используют реакционный путь, в котором органическое соединение, имеющее связь металл-кислород-углерод, используется в большом количестве в качестве предшественника эфира угольной кислоты, а не в качестве катализатора, и металлорганическое соединение вступает в реакцию присоединения с диоксидом углерода с образованием аддукта, после чего следует реакция термического разложения аддукта с получением в результате реакционной смеси, содержащей эфир угольной кислоты. Заявители настоящего изобретения установили, что этим способом эфир угольной кислоты может быть получен с высоким выходом. Большинство из приведенных выше проблем предшествующего уровня техники решено с помощью названного способа. Однако даже этот способ имеет проблему в том, что во время реакции образуется и накапливается в реакционной системе нерегенерируемое инертное металлорганическое соединение.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
С учетом сложившейся ситуации авторы настоящего изобретения провели дополнительные широкие и интенсивные исследования для решения названных выше проблем. В этих исследованиях авторы настоящего изобретения использовали методики своего предшествующего открытия, описанного в публикации WO 03/055840. В результате неожиданно было установлено, что проблема может быть решена с помощью способа получения эфира угольной кислоты, включающего стадии: (1) проведения реакции между первой смесью металлорганического соединения и диоксидом углерода, где первая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из реакционноспособного металлорганического соединения, с получением в результате реакционной смеси, содержащей эфир угольной кислоты, полученный в результате реакции, нерегенерируемое инертное соединение и регенерируемое метаморфное металлорганическое соединение, образованное из реакционноспособного металлорганического соединения; (2) разделения реакционной смеси на первую часть, содержащую эфир угольной кислоты и нерегенерируемое инертное соединение, и вторую часть, содержащую регенерируемое метаморфное металлорганическое соединение; и (3) взаимодействия второй части реакционной смеси со спиртом с образованием второй смеси металлорганического соединения и воды и удаления воды из второй смеси металлорганического соединения, где вторая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из реакционноспособного металлорганического соединения. Эфир угольной кислоты может быть легко выделен из первой части реакционной смеси обычным способом, таким как отгонка. Вторая смесь металлорганического соединения, полученная на стадии (3), может быть выделена и рециркулирована на стадию (1), где вторая смесь металлорганического соединения используется в упомянутой выше реакции получения эфира угольной кислоты. Настоящее изобретение осуществлено на основе этого открытия.
Таким образом, главной целью настоящего изобретения является разработка способа, в котором реакционноспособное металлорганическое соединение, используемое в реакции, может быть повторно использовано без необходимости большого количества дегидратирующего агента и с помощью которого промышленное производство эфира угольной кислоты с высоким выходом может быть осуществлено непрерывно и неоднократно любое число раз при удалении нерегенерируемого инертного металлорганического соединения из реакционной системы.
Перечисленные выше и другие объекты, признаки и преимущества настоящего изобретения будут очевидны из следующего подробного описания, рассматриваемого в сопровождении чертежей и прилагаемой формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На чертежах:
Фиг.1 представляет собой спектр 119Sn-ЯМР реакционноспособного металлорганического соединения, содержащего 2-этилгексилоксигруппу, используемого на стадии (1) в примере 1; и
Фиг.2 представляет собой спектр 119Sn-ЯМР нерегенерируемого инертного соединения, которое отгоняется на стадии (2) в примере 1.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает способ производства эфира угольной кислоты, который включает стадии:
(1) проведения реакции между первой смесью металлорганического соединения и диоксидом углерода, где первая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из реакционноспособного металлорганического соединения и которое имеет в своей молекуле, по меньшей мере, три связи металл-углерод, с получением в результате реакционной смеси, содержащей эфир угольной кислоты, образовавшийся в ходе реакции, нерегенерируемое инертное соединение и регенерируемое метаморфное металлорганическое соединение, образованное из реакционноспособного металлорганического соединения;
(2) разделения реакционной смеси на первую часть, содержащую эфир угольной кислоты и нерегенерируемое инертное соединение, и вторую часть, содержащую регенерируемое метаморфное металлорганическое соединение; и
(3) взаимодействия второй части реакционной смеси с первым спиртом с образованием второй смеси металлорганического соединения и воды и удаления воды из второй смеси металлорганического соединения, причем вторая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образуется из реакционноспособного металлорганического соединения и которое имеет в своей молекуле, по меньшей мере, три связи металл-углерод.
Для простоты понимания настоящего изобретения ниже перечислены существенные признаки и различные предпочтительные варианты осуществления настоящего изобретения.
1. Способ производства эфира угольной кислоты, включающий стадии:
(1) проведения реакции между первой смесью металлорганического соединения и диоксидом углерода, причем первая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из реакционноспособного металлорганического соединения и которое имеет в своей молекуле, по меньшей мере, три связи металл-углерод, с получением в результате реакционной смеси, содержащей эфир угольной кислоты, образовавшийся в ходе реакции, нерегенерируемое инертное соединение и регенерируемое метаморфное металлорганическое соединение, образованное из реакционноспособного металлорганического соединения;
(2) разделения реакционной смеси на первую часть, содержащую эфир угольной кислоты и нерегенерируемое инертное соединение, и вторую часть, содержащую регенерируемое метаморфное металлорганическое соединение; и
(3) взаимодействия второй части реакционной смеси с первым спиртом с образованием второй смеси металлорганического соединения и воды и удаления воды из второй смеси металлорганического соединения, причем вторая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образуется из реакционноспособного металлорганического соединения и которое имеет в своей молекуле, по меньшей мере, три связи металл-углерод.
2. Способ по пункту 1, который также включает после стадии (3) стадию (4), на которой вторую смесь металлорганического соединения, полученную на стадии (3), выделяют и рециркулируют на стадию (1).
3. Способ по пункту 1 или 2, где реакционноспособное металлорганическое соединение, используемое на стадии (1), содержит, по меньшей мере, одно соединение, выбранное из группы, включающей:
металлорганическое соединение, представленное формулой (1):
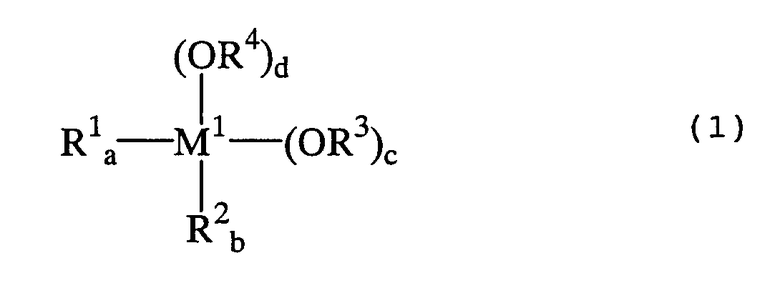
где:
М1 представляет собой атом металла, выбранный из группы, включающей элементы, принадлежащие к группам 4 и 14 Периодической таблицы, за исключением кремния;
каждый из заместителей R1 и R2 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу, С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил, или незамещенную или замещенную С6-С20-арильную группу;
каждый из заместителей R3 и R4 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу или С7-С20-аралкильную группу, состоящую их незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил;
каждый из индексов a и b представляет собой целое число от 0 до 2, а + b = от 0 до 2, каждый из индексов с и d представляет собой целое число от 0 до 4, и а + b + c + d = 4; и
металлорганическое соединение, представленное формулой (2):

где:
каждый из М2 и М3 независимо друг от друга представляет собой атом металла, выбранный из группы, включающей элементы, принадлежащие к группам 4 и 14 Периодической таблицы, за исключением кремния;
каждый из заместителей R5, R6, R7 и R8 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу, С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил, или незамещенную или замещенную С6-С20-арильную группу;
каждый из заместителей R9 и R10 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу или С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил;
каждый из индексов e, f, g и h представляет собой целое число от 0 до 2, e + f = от 0 до 2, g + h = от 0 до 2, каждый из индексов i и j представляет собой целое число от 1 до 3, e + f + i = 3 и g + h + j = 3.
4. Способ по пункту 3, где каждый из заместителей R3 и R4 в формуле (1) и R9 и R10 в формуле (2) независимо друг от друга представляет собой н-бутильную группу, изобутильную группу, линейную или разветвленную С5-С12-алкильную группу или линейную или разветвленную С4-С12-алкенильную группу.
5. Способ по пункту 3, где каждый из М1 в формуле (1) и М2 и М3 в формуле (2) представляет собой атом олова.
6. Способ по пункту 3, где реакционноспособное металлорганическое соединение, используемое на стадии (1), получено из оловоорганического оксида и спирта.
7. Способ по пункту 1 или 2, где на стадии (1) реакционноспособное металлорганическое соединение используют, по меньшей мере, в одной из форм, выбранных из группы, включающей мономерную форму, олигомерную форму, полимерную форму и ассоциированную форму.
8. Способ по пункту 1 или 2, где на стадии (1) реакционноспособное металлорганическое соединение используют в количестве, которое составляет от 1/50 до 1 от стехиометрического количества относительно количества диоксида углерода.
9. Способ по пункту 1 или 2, где реакцию на стадии (1) проводят при 20°С или выше.
10. Способ по пункту 1 или 2, где реакцию на стадии (1) проводят в присутствии второго спирта, который является тем же самым спиртом или отличается от первого спирта, используемого на стадии (3).
11. Способ по пункту 1 или 2, где на стадии (2) разделение реакционной смеси на первую часть и вторую часть проводят, по меньшей мере, с помощью одного из способов разделения, выбранных из группы, включающей перегонку, экстракцию и фильтрацию.
12. Способ по пункту 1 или 2, где на стадии (2) разделение реакционной смеси на первую часть и вторую часть проводят в присутствии спирта, который является тем же самым спиртом или отличается от первого спирта, используемого на стадии (3).
13. Способ по пункту 1 или 2, где первый спирт, используемый на стадии (3), представляет собой, по меньшей мере, один спирт, выбранный из группы, включающей алкиловый спирт, содержащий линейную или разветвленную С1-С12-алкильную группу, циклоалкиловый спирт, содержащий С5-С12-циклоалькильную группу, алкениловый спирт, содержащий линейную или разветвленную С2-С12-алкенильную группу, и аралкиловый спирт, содержащий С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил.
14. Способ по пункту 13, где первый спирт имеет температуру кипения, которая выше чем температура кипения воды, измеренная при атмосферном давлении.
15. Способ по пункту 14, где первый спирт представляет собой, по меньшей мере, один спирт, выбранный из группы, включающей 1-бутанол, 2-метил-1-пропанол, алкиловый спирт, содержащий линейную или разветвленную С5-С12-алкильную группу, алкениловый спирт, содержащий линейную или разветвленную С4-С12-алкенильную группу, циклоалкиловый спирт, содержащий С5-С12-циклоалкильную группу, и аралкиловый спирт, содержащий С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил.
16. Способ по пункту 1 или 2, где удаление воды на стадии (3) проводят путем разделения через мембрану.
17. Способ по пункту 16, где разделение через мембрану представляет собой диффузионное испарение через мембрану.
18. Способ по пункту 1 или 2, где удаление воды на стадии (3) проводят путем отгонки.
Ниже изобретение описано более подробно.
Как описано выше, в обычных способах (за исключением способа, предложенного заявителями настоящего изобретения в упомянутой выше публикации WO 03/055840) получения эфира угольной кислоты используется равновесная реакция, представленная уравнением (3):

(R представляет собой ненасыщенную или насыщенную углеводородную группу)
То есть в качестве обычных способов (за исключением способа, предложенного заявителями настоящего изобретения в упомянутой выше публикации WO 03/055840) можно указать способ, в котором используется дегидратирующий агент в случае реакционной смеси, содержащей систему равновесной реакции (представленную выше уравнением (3)), где равновесная реакционная система содержит систему продукта, включающую эфир угольной кислоты и воду; и способ, в котором реакционную смесь, содержащую упомянутую выше равновесную реакционную систему, охлаждают и подвергают дегидратации, при которой реакционную смесь вводят в насадочную колонну, содержащую твердый дегидратирующий агент, и циркулируют через насадочную колонну с тем, чтобы постепенно дегидратировать равновесную реакционную систему, посредством чего подавить реакцию разложения катализатора и накопить эфир угольной кислоты, образующийся в следовом количестве.
С другой стороны, техническая концепция способа настоящего изобретения полностью отличается от технической концепции обычных способов.
Реакция, проводимая в способе настоящего изобретения, в основном является той же реакцией, что и реакция, проводимая в способе, предложенном заявителями рассматриваемого изобретения в публикации WO 03/055840. До объяснения способа настоящего изобретения кратко объяснена суть способа упомянутой публикации WO 03/055840.
Способ публикации WO 03/055840 отличается, тем, что:
используется реакционный путь, в котором металлорганическое соединение, имеющее связь металл-кислород-углерод, используется в большом количестве в качестве предшественника эфира угольной кислоты, а не в качестве катализатора, и металлорганическое соединение вступает в реакцию присоединения с диоксидом углерода с образованием аддукта, после чего следует реакция термического разложения аддукта, в результате чего получают реакционную смесь, содержащую эфир угольной кислоты (стадия (1)),
за стадией (1) следует операция, на которой эфир угольной кислоты отделяют от реакционной смеси с получением остаточной жидкости (стадия (2)), и
за стадией (2) следует реакция остаточной жидкости со спиртом, в результате чего получают реакционную смесь, содержащую металлорганическое соединение, имеющее связь металл-кислород-углерод и воду, после чего следует удаление воды из реакционной смеси путем отгонки или другим подобным способом, в результате чего получают металлорганическое соединение, после чего выделяют полученное металлорганическое соединение (стадия (3)),
после чего следует рециркулирование металлорганического соединения на стадию (1) для производства эфира угольной кислоты.
Реакции на стадии (1) и стадии (2) способа публикации WO 03/055840 представлены приведенными ниже уравнениями (4) и (5) соответственно.
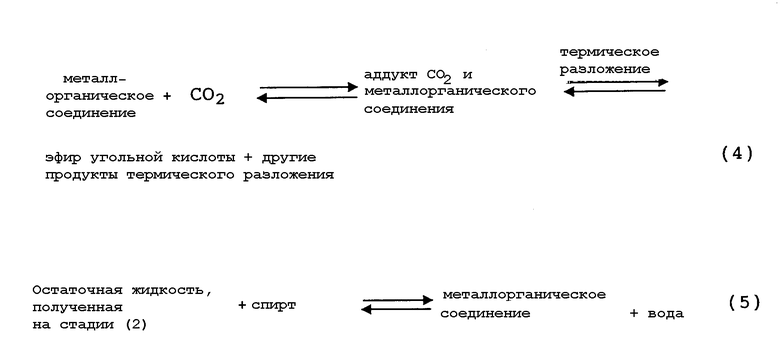
Таким образом, способ публикации WO 03/055840 представляет собой способ, в котором металлорганическое соединение, имеющее связь металл-кислород-углерод, используется, главным образом, в качестве предшественника эфира угольной кислоты и металлорганическое соединение вступает в реакцию присоединения с диоксидом углерода с образованием аддукта, после чего следует реакция термического разложения аддукта, в результате чего получают реакционную смесь, содержащую эфир угольной кислоты, после чего эфир угольной кислоты отделяют от реакционной смеси с получением остаточной жидкости (содержащей продукты термического разложения аддукта, образованного реакцией присоединения металлорганического соединения, имеющего связь металл-кислород-углерод, с диоксидом углерода), после чего следует операция, на которой остаточную жидкость вводят в реакцию со спиртом, чтобы в результате регенерировать металлорганическое соединение, имеющее связь металл-кислород-углерод. Регенерированное металлорганическое соединение выделяют и рециркулируют на стадию производства угольного эфира, и цикл указанных стадий повторяют с тем, чтобы получить эфир угольной кислоты в желаемом количестве.
На стадии (1) публикации WO 03/055840, по меньшей мере, часть металлорганического соединения, имеющего связь металл-кислород-углерод, превращается в продукт его термического разложения и, следовательно, реакционная смесь, полученная на стадии (1) способа публикации WO 03/055840, может содержать или может не содержать остаточную часть металлорганического соединения, имеющего связь металл-кислород-углерод, используемого на стадии (1). Кроме того, после окончания стадии (2) способа публикации WO 03/055840, по меньшей мере, часть металлорганического соединения, имеющего связь металл-кислород-углерод, превращается в продукт его термического разложения или его гидролиза и, следовательно, остаточная жидкость, полученная на стадии (2) способа публикации WO 03/055840, может содержать или может не содержать остаточную часть металлорганического соединения, имеющего связь металл-кислород-углерод, используемого на стадии (1). В любом случае металлорганическое соединение, имеющее связь металл-кислород-углерод, регенерируют (повторно синтезируют) до окончания стадии (3) способа публикации WO 03/055840.
В обычных способах с использованием равновесной реакции уравнения (3), приведенного выше, вся реакция находится в равновесии. Напротив, в способе заявителей настоящего изобретения равновесная реакция уравнения (3) может быть эффективно поделена на две последовательные реакции, которые можно легко контролировать, делая в результате возможным эффективное производство эфира угольной кислоты, выделяя эфир угольной кислоты и воду из реакционной системы. То есть на стадии (1) способа публикации WO 03/055840 реакция может быть проведена в отсутствие воды. На стадии (2) способа публикации WO 03/055840 обратная реакция эфира угольной кислоты и образование других продуктов термического разложения могут быть предупреждены путем выделения эфира угольной кислоты из реакционной смеси. На стадии (3) способа публикации WO 03/055840 после регенерации металлорганического соединения, имеющего связь металл-кислород-углерод, металлорганическое соединение может быть выделено путем удаления воды. Кроме того, на каждой стадии способа публикации WO 03/055840 рабочие условия могут быть легко оптимизированы путем использования подходящих обычных методик химического синтеза, таких как охлаждение, нагревание, перемешивание, повышение давления, уменьшение давления и разделение.
Как упоминалось выше, способ настоящего изобретения разработан в результате широких и интенсивных исследований с целью улучшения приведенного выше способа, предложенного заявителями настоящего изобретения в публикации WO 03/055840. Проблемой способа публикации WO 03/055840 является то, что нерегенерируемое инертное соединение (то есть непригодное соединение), образованное в ходе реакции, постепенно накапливается в реакционной системе. Однако эта проблема может быть легко решена с помощью способа настоящего изобретения. Обычно металлорганическое соединение чувствительно к термическому разложению. Следовательно, когда металлорганическое соединение, которое было использовано, рециркулируют, реакционная система содержит смесь активного металлорганического соединения и металлорганического соединения, имеющего исключительно низкую активность (то есть нерегенерируемое инертное соединение, которое является непригодным соединением), где отношение нерегенерируемого инертного соединения к активному металлорганическому соединению становится большим. Следовательно, для стабильного производства эфира угольной кислоты необходимо во время реакции непрерывно подавать свежее активное металлорганическое соединение или его исходное вещество. В области производства эфира угольной кислоты от диоксида углерода и спирта трудно отделять непригодное соединение (полученное из металлорганического соединения), образованное в ходе реакции. Хотя в некоторых документах предшествующего уровня, касающихся такого способа, описан рецикл металлорганического соединения, не существует обычной методики для удаления непригодного соединения (полученного из металлорганического соединения) из реакционной системы. С другой стороны, в области производства эфира угольной кислоты в присутствии обычного катализатора на практике реализован способ, в котором часть катализатора, использованного для реакции получения эфира угольной кислоты, отбирают из реакционной системы и подают свежий катализатор в количестве, которое соответствует количеству катализатора, потерявшего свою каталитическую активность. Однако проблема способа состоит в том, что в случае отбора дезактивированного катализатора необходимо отбирать часть активного катализатора в количестве, которое в несколько раз или десятков раз больше количества дезактивированного катализатора. Кроме того, когда реакцию проводят с использованием этого способа в присутствии дорогого катализатора, стоимость производства становится очень высокой. Следовательно, фактически невозможно реализовать такой способ в промышленном масштабе. То есть в таком обычном способе, когда катализатор рециркулируют, важно селективно отделять непригодное соединение от реакционной системы. В результате широких и интенсивных исследований заявители настоящего изобретения установили, что непригодное соединение имеет физические свойства (такие как температура кипения и физическое состояние, например, твердая форма или жидкая форма) и химические свойства (такие как способность к гидролизу), которые отличаются от физических свойств полезных металлорганических соединений (то есть реакционноспособного металлорганического соединения и регенерируемого метаморфного металлорганического соединения). На основе такого открытия заявители разработали настоящее изобретение, относящееся к способу, в котором металлорганическое соединение может быть использовано повторно при селективном выведении, по меньшей мере, части непригодного соединения, образованного из реакционноспособного металлорганического соединения.
Способ настоящего изобретения представляет собой способ производства эфира угольной кислоты, включающий стадии:
(1) проведения реакции между первой смесью металлорганического соединения и диоксидом углерода, причем первая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из реакционноспособного металлорганического соединения и которое имеет в своей молекуле, по меньшей мере, три связи металл-углерод,
с получением в результате реакционной смеси, содержащей эфир угольной кислоты, полученный в ходе реакции, нерегенерируемое инертное соединение и регенерируемое метаморфное металлорганическое соединение, образованное из реакционноспособного металлорганического соединения;
(2) разделения реакционной смеси на первую часть, содержащую эфир угольной кислоты и нерегенерируемое инертное соединение, и вторую часть, содержащую регенерируемое метаморфное металлорганическое соединение; и
(3) взаимодействия второй части реакционной смеси с первым спиртом с образованием второй смеси металлорганического соединения и воды и удаления воды из второй смеси металлорганического соединения, причем вторая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, содержащего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образуется из реакционноспособного металлорганического соединения и которое имеет в своей молекуле, по меньшей мере, три связи металл-углерод. Ниже даны объяснения относительно соединений, используемых в способе настоящего изобретения.
На стадии (1) способа настоящего изобретения используют реакционноспособное металлорганическое соединение, имеющее связь металл-кислород-углерод. Реакционноспособное металлорганическое соединение, используемое на стадии (1) способа настоящего изобретения, имеет в своей молекуле, по меньшей мере, две связи металл-кислород-углерод. В качестве примера такого металлорганического соединения можно назвать реакционноспособное металлорганическое соединение, содержащее, по меньшей мере, две алкоксигруппы. Предпочтительно, чтобы реакционноспособное металлорганическое соединение, используемое на стадии (1), содержало, по меньшей мере, одно соединение, выбранное из группы, включающей:
металлорганическое соединение, представленное формулой (1):
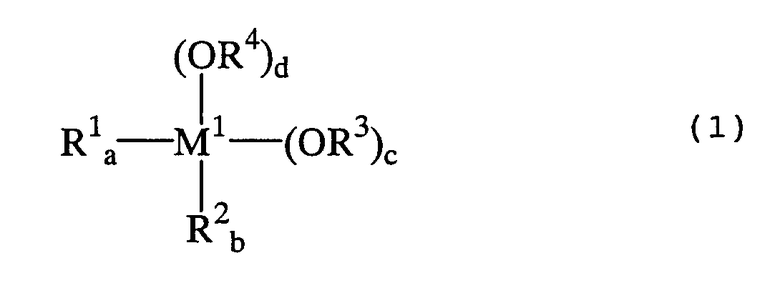
где:
М1 представляет собой атом металла, выбранный из группы, включающей элементы, принадлежащие к группам 4 и 14 Периодической таблицы, за исключением кремния;
каждый из заместителей R1 и R2 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу, С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил, или незамещенную или замещенную С6-С20-арильную группу;
каждый из заместителей R3 и R4 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу или С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил; и
каждый из индексов a и b представляет собой целое число от 0 до 2, а + b = от 0 до 2, каждый из индексов с и d представляет собой целое число от 0 до 4, и а + b + c + d = 4; и
металлорганическое соединение, представленное формулой (2):

где:
каждый из М2 и М3 независимо друг от друга представляет собой атом металла, выбранный из группы, включающей элементы, принадлежащие к группам 4 и 14 Периодической таблицы, за исключением кремния;
каждый из заместителей R5, R6, R7 и R8 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу, С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил, или незамещенную или замещенную С6-С20-арильную группу;
каждый из заместителей R9 и R10 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу или С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил;
каждый из индексов e, f, g и h представляет собой целое число от 0 до 2, e + f = от 0 до 2, g + h = от 0 до 2, каждый из индексов i и j представляет собой целое число от 1 до 3, e + f + i = 3 и g + h + j = 3.
Упоминаемая в данном случае Периодическая таблица соответствует предписаниям IUPAC (International Union of Pure and Applied Chemistry) (1989).
В способе настоящего изобретения упомянутое выше металлорганическое соединение используется, по меньшей мере, в одной из форм, выбранной из группы, включающей мономерную форму, олигомерную форму, полимерную форму и ассоциированную форму.
Каждый из металлов М1 в металлорганическом соединении, представленном выше формулой (1), и М2 и М3 в металлорганическом соединении, представленном выше формулой (2), независимо друг от друга представляет собой атом металла, выбранный из группы, включающей элементы, принадлежащие к группам 4 и 14 Периодической таблицы, за исключением кремния. Предпочтительно, чтобы каждый из металлов М1, М2 и М3 представлял собой атом металла, выбранный из группы, включающей атом титана, атом олова и атом циркония. С точки зрения растворимости в спирте и реакционной способности к спирту более предпочтительно, чтобы каждый из металлов М1, М2 и M3 представлял собой атом олова.
Примерами заместителей R1 и R2 в металлорганическом соединении, представленном выше формулой (1), и заместителей R5, R6, R7 и R8 в металлорганическом соединении, представленном выше формулой (2), являются С1-С12-алкильные группы (которые представляют собой алифатические углеводородные группы) и С5-С12-циклоалкильные группы (которые представляют собой алициклические углеводородные группы), такие как метильная группа, этильная группа, пропильная группа, н-бутильная группа (и ее изомеры), бутильная группа (и ее изомеры), пентильная группа (и ее изомеры), гексильная группа (и ее изомеры), гептильная группа (и ее изомеры), октильная группа (и ее изомеры), нонильная группа (и ее изомеры), децильная группа (и ее изомеры), ундецильная группа (и ее изомеры), додецильная группа (и ее изомеры), 2-бутенильная группа, циклобутенильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклопентадиенильная группа и циклогексенильная группа; С7-С20-аралкильные группы, такие как бензильная группа и фенилэтильная группа; и С2-С20-арильные группы, такие как фенильная группа, толильная группа и нафтильная группа. Каждая из таких углеводородных групп может содержать эфирную связь. Более того, каждая из таких углеводородных групп может быть галогенированной углеводородной группой (то есть углеводородной группой, которая имеет, по меньшей мере, один атом водорода, замещенный атомом галогена), такой как нонафторбутильная группа или гептафторбутильная группа (и их изомеры). Однако заместители R1, R2, R5, R6, R7 и R8 не ограничены приведенными примерами. Из перечисленных выше групп низшие алкильные группы являются предпочтительными, и линейные или разветвленные С1-С4-алкильные группы являются более предпочтительными. Углеводородные группы, содержащие больше атомов углерода, чем упомянуто выше, также могут быть использованы в качестве заместителей R1, R2, R5, R6, R7 и R8, однако, когда используются такие группы, имеющие большее число атомов углерода, существует опасность, что текучесть металлорганического соединения и/или производительность по эфиру угольной кислоты станут низкими. Примерами заместителей R3 и R4 в металлорганическом соединении, представленном выше формулой (1), и заместителей R9 и R10 в металлорганическом соединении, представленном выше формулой (2), являются С1-С12-алкильные группы (которые представляют собой алифатические углеводородные группы) и С5-С12-циклоалкильные группы (которые представляют собой алициклические углеводородные группы), такие как метильная группа, этильная группа, пропильная группа (и ее изомеры), бутильная группа (и ее изомеры), 2-бутенильная группа, пентильная группа (и ее изомеры), гексильная группа (и ее изомеры), октильная группа (и ее изомеры), нонильная группа (и ее изомеры), децильная группа (и ее изомеры), ундецильная группа (и ее изомеры), додецильная группа (и ее изомеры), циклопропильная группа, циклобутильная группа, циклопентильная группа, циклопентадиенильная группа, циклогексильная группа, группа, циклогексенильная группа, метоксиэтильная группа, этоксиметильная группа и этоксиэтильная группа; и С7-С20-аралкильные группы, такие как бензильная группа и фенилэтильная группа. Однако заместители R3, R4, R9 и R10 не ограничены приведенными примерами. Из перечисленных выше групп предпочтительными являются металлорганические соединения, в которых каждый из соответствующих спиртов (то есть R3OH, R4OH, R9OH и R10OH) имеет температуру кипения выше, чем температура кипения воды (где температуру кипения измеряют при атмосферном давлении). Кроме того, с точки зрения рециркулирования металлорганического соединения, регенерированного на стадии (3), наиболее предпочтительно, чтобы в металлорганическом соединении, представленном выше формулой (1) и/или формулой (2), алкильный или алкенильный остаток каждой из алкоксигрупп представлял собой н-бутил, изобутил, линейный или разветвленный С5-С12-алкил или линейный или разветвленный С4-С12-алкенил.
Примерами реакционноспособных металлорганических соединений, представленных выше формулой (1), являются соединения алкоксиолова, соединения алкоксититана и соединения алкилалкоксиолова. Конкретными примерами таких металлорганических соединений являются тетраметоксиолово, тетраэтоксиолово, тетрапропилоксиолово (и его изомеры), тетрабутилоксиолово (и его изомеры), тетрапентилоксиолово (и его изомеры), тетрагексилолово (и его изомеры), тетрагептилоксиолово (и его изомеры), тетраоктилоксиолово (и его изомеры), тетранонилоксиолово (и его изомеры), диметоксидиэтоксиолово, тетраметоксититан, тетраэтоксититан, тетрапропилоксититан, тетраизопропилоксититан, тетракис(2-этил-1-гексилокси)титан, тетрабензилоксиолово, диметоксидиэтоксиолово, диэтоксидипропилоксиолово (и его изомеры), диметоксидигексилоксиолово (и его изомеры), диметилдиметоксиолово, диметилдиэтоксиолово, диметилдипропилоксиолово (и его изомеры), диметилдибутилоксиолово (и его изомеры), диметилдипентилоксиолово (и его изомеры), диметилдигексилоксиолово (и его изомеры), диметилдигептилоксиолово (и его изомеры), диметилдиоктилоксиолово (и его изомеры), диметилдинонилоксиолово (и его изомеры), диметилдидецилоксиолово (и его изомеры), диметоксид дибутилолова, диэтоксид дибутилолова, дипропоксид дибутилолова (и его изомеры), дибутоксид дибутилолова (и его изомеры), дипентилоксид дибутилолова (и его изомеры), дигексилоксид дибутилолова (и его изомеры), дигептилоксид дибутилолова (и его изомеры), диоктилоксид дибутилолова (и его изомеры), динонилоксид дибутилолова (и его изомеры), дидецилоксид дибутилолова (и его изомеры), дибензилоксид дибутилолова, дифенилэтоксид дибутилолова, диметоксид дифенилолова, диэтоксид дифенилолова, дипропоксид дифенилолова (и его изомеры), дибутоксид дифенилолова (и его изомеры), дипентилоксид дифенилолова (и его изомеры), дигексилоксид дифенилолова (и его изомеры), дигептилоксид дифенилолова (и его изомеры), диоктилоксид дифенилолова (и его изомеры), динонилоксид дифенилолова (и его изомеры), дидецилоксид дифенилолова (и его изомеры), дибензилоксид дифенилолова, дифенилэтоксид дифенилолова, диметоксид бис(трифторбутил)олова, диэтоксид бис(трифторбутил)олова, дипропоксид бис(трифторбутил)олова (и его изомеры) и дибутоксид бис(трифторбутил)олова (и его изомеры).
Примерами реакционноспособных металлорганических соединений, представленных выше формулой (2), являются алкоксидистанноксаны и аралкилоксидистанноксаны. Конкретными примерами таких металлорганических соединений являются:
1,1,3,3-тетраметил-1,3-диметоксидистанноксан,
1,1,3,3-тетраметил-1,3-диэтоксидистанноксан,
1,1,3,3-тетраметил-1,3-дипропилоксидистанноксан (и его изомеры),
1,1,3,3-тетраметил-1,3-дибутилоксидистанноксан (и его изомеры),
1,1,3,3-тетраметил-1,3-дипентилоксидистанноксан (и его изомеры),
1,1,3,3-тетраметил-1,3-дигексилоксидистанноксан (и его изомеры),
1,1,3,3-тетраметил-1,3-дигептилоксидистанноксан (и его изомеры),
1,1,3,3-тетраметил-1,3-диоктилоксидистанноксан (и его изомеры),
1,1,3,3-тетраметил-1,3-динонилоксидистанноксан (и его изомеры),
1,1,3,3-тетраметил-1,3-дидецилоксидистанноксан (и его изомеры),
1,1,3,3-тетраметил-1,3-дибензилоксидистанноксан,
1,1,3,3-тетраметил-1,3-дифенилэтоксидистанноксан,
1,1,3,3-тетрабутил-1,3-диметоксидистанноксан,
1,1,3,3-тетрабутил-1,3-диэтоксидистанноксан,
1,1,3,3-тетрабутил-1,3-дипропилоксидистанноксан (и его изомеры),
1,1,3,3-тетрабутил-1,3-дибутилоксидистанноксан (и его изомеры),
1,1,3,3-тетрабутил-1,3-дипентилоксидистанноксан (и его изомеры),
1,1,3,3-тетрабутил-1,3-дигексилоксидистанноксан (и его изомеры),
1,1,3,3-тетрабутил-1,3-дигептилоксидистанноксан (и его изомеры),
1,1,3,3-тетрабутил-1,3-диоктилоксидистанноксан (и его изомеры),
1,1,3,3-тетрабутил-1,3-динонилоксидистанноксан (и его изомеры),
1,1,3,3-тетрабутил-1,3-дидецилоксидистанноксан (и его изомеры),
1,1,3,3-тетрабутил-1,3-дибензилоксидистанноксан,
1,1,3,3-тетрабутил-1,3-дифенилэтоксидистанноксан,
1,1,3,3-тетрафенил-1,3-диметоксидистанноксан,
1,1,3,3-тетрафенил-1,3-диэтоксидистанноксан,
1,1,3,3-тетрафенил-1,3-дипропилоксидистанноксан (и его изомеры),
1,1,3,3-тетрафенил-1,3-дибутилоксидистанноксан (и его изомеры),
1,1,3,3-тетрафенил-1,3-дипентилоксидистанноксан (и его изомеры),
1,1,3,3-тетрафенил-1,3-дигексилоксидистанноксан (и его изомеры),
1,1,3,3-тетрафенил-1,3-дигептилоксидистанноксан (и его изомеры),
1,1,3,3-тетрафенил-1,3-диоктилоксидистанноксан (и его изомеры),
1,1,3,3-тетрафенил-1,3-динонилоксидистанноксан (и его изомеры),
1,1,3,3-тетрафенил-1,3-дидецилоксидистанноксан (и его изомеры),
1,1,3,3-тетрафенил-1,3-дибензилоксидистанноксан,
1,1,3,3-тетрафенил-1,3-дифенилэтоксидистанноксан,
1,1,3,3-тетракис(трифторбутил)-1,3-диметоксидистанноксан,
1,1,3,3-тетракис(трифторбутил)-1,3-диэтоксидистанноксан,
1,1,3,3-тетракис(трифторбутил)-1,3-дипропилоксидистанноксан (и его изомеры),
1,1,3,3-тетракис(трифторбутил)-1,3-дибутилоксидистанноксан (и его изомеры),
1,1,3,3-тетракис(пентафторбутил)-1,3-диметоксидистанноксан,
1,1,3,3-тетракис(пентафторбутил)-1,3-диэтоксидистанноксан,
1,1,3,3-тетракис(пентафторбутил)-1,3-дипропилоксидистанноксан (и его изомеры),
1,1,3,3-тетракис(пентафторбутил)-1,3-дибутилоксидистанноксан (и его изомеры),
1,1,3,3-тетракис(пентафторбутил)-1,3-дипентилоксидистанноксан (и его изомеры),
1,1,3,3-тетракис(пентафторбутил)-1,3-дигексилоксидистанноксан (и его изомеры),
1,1,3,3-тетракис(гептафторбутил)-1,3-диметоксидистанноксан,
1,1,3,3-тетракис(гептафторбутил)-1,3-диэтоксидистанноксан,
1,1,3,3-тетракис(гептафторбутил)-1,3-дипропилоксидистанноксан (и его изомеры),
1,1,3,3-тетракис(гептафторбутил)-1,3-дибутилоксидистанноксан (и его изомеры).
Приведенные выше реакционноспособные металлорганические соединения могут быть использованы отдельно или в комбинации. Кроме того, металлорганические соединения, отличные от упомянутых выше, или неорганические соединения металла могут быть использованы в комбинации с приведенными выше реакционноспособными металлорганическими соединениями. В качестве реакционноспособных металлорганических соединений могут быть использованы такие реакционноспособные металлорганические соединения, которые являются коммерчески доступными. С другой стороны, реакционноспособные металлорганические соединения, представленные выше формулой (1), могут быть получены обычным способом (например, способом, описанным в патенте Голландии № 6612421), в котором оксид дибутилолова, спирт, содержащий 4 или более атомов углерода, и растворитель, образующий азеотропы с водой, смешивают для проведения реакции, и полученный продукт подвергают перегонке, получая в результате фракцию, содержащую реакционноспособное металлорганическое соединение, представленное выше формулой (1). В приведенном выше патенте Голландии № 6612421 описано, что этот способ не может быть использован для получения металлорганического соединения, содержащего С1-С3-алкоксигруппу и что металлорганическое соединение, содержащее С1-С3-алкоксигруппу, может быть получено из дихлорида дибутилолова и алкоголята натрия. С другой стороны, при использовании способа, описанного в патентной заявке Японии № 2001-396537 или в патентной заявке Японии № 2001-396545, можно получить металлорганическое соединение, представленное формулой (1) или (2), из оксида металла и спирта. Этим способом можно получить металлорганическое соединение, имеющее С1-С3-алкоксигруппу, такую как метоксигруппа. Например, металлорганическое соединение, содержащее метоксигруппу, может быть получено из оксида дибутилолова, метанола и гексана. Известно, что в таком случае метанол и гексан образуют азеотроп с минимальной температурой кипения. Однако авторы настоящего изобретения неожиданно установили, что с помощью этого способа удаление воды может быть осуществлено, даже если смесь метанол/гексан имеет точку кипения ниже, чем у воды. На основе этого открытия авторы настоящего изобретения разработали способ получения металлорганического соединения из спирта, имеющего температуру кипения ниже, чем температура кипения воды. Металлорганическое соединение, полученное из оксида дибутилолова и спирта, имеющего температуру кипения ниже, чем температура кипения воды, содержит преимущественно металлорганическое соединение, представленное формулой (2). Однако когда желательно получить большое количество металлорганического соединения, представленного формулой (1), это может быть достигнуто, если подвергнуть названное выше металлорганическое соединение, содержащее преимущественно металлорганическое соединение, представленное формулой (2), перегонке, получая в результате фракцию, содержащую металлорганическое соединение, представленное формулой (1). С другой стороны, металлорганическое соединение, представленное формулой (1), может быть получено путем проведения реакции дихлорида диалкилолова и алкоголята.
В настоящем изобретении в связи с названным выше реакционноспособным металлорганическим соединением используют определение «регенерируемое метаморфное металлорганическое соединение, образованное из реакционноспособного металлорганического соединения» и определение «нерегенерируемое инертное (металлорганическое) соединение, образованное из реакционноспособного металлорганического соединения». Объяснение этих определений приведено ниже. Реакционноспособное металлорганическое соединение, используемое в настоящем изобретении, представляет собой металлорганическое соединение, имеющее в своей молекуле, по меньшей мере, две связи металл-кислород-углерод. В настоящем изобретении определение «регенерируемое метаморфное металлорганическое соединение, образованное из реакционноспособного металлорганического соединения» используется для определения соединений, которые состоят преимущественно из продуктов разложения, образованных при термическом разложении упоминаемого выше аддукта (СО2-аддукт), образованного по реакции реакционноспособного металлорганического соединения с диоксидом углерода, где продукты термического разложения образуются одновременно с образованием эфира угольной кислоты. Трудно определить более детально структуру регенерируемого метаморфного металлорганического соединения. Однако в качестве регенерируемых метаморфных металлорганических соединений также можно назвать продукт гидролиза реакционноспособного металлорганического соединения и продукт гидролиза аддукта диоксида углерода и реакционноспособного металлорганического соединения.
С другой стороны, определение «нерегенерируемое инертное (металлорганическое) соединение, образованное из реакционноспособного металлорганического соединения» (или просто «непригодное соединение») используется для идентификации соединений, которые представляют собой нерегенерируемые металлорганические соединения (образованные при термической деградации реакционноспособного металлорганического соединения и/или его аддукта с СО2), имеющего исключительно низкую активность. Непригодное соединение (то есть нерегенерируемое инертное соединение) образуется преимущественно на стадии (3). Однако непригодное соединение иногда образуется на стадии получения реакционноспособного металлорганического соединения. В качестве типичного примера непригодного соединения можно назвать соединение, имеющее в своей молекуле на один атом металла, по меньшей мере, три связи металл-углерод. В качестве примера такого соединения можно назвать соединение, представленное следующей формулой (6):
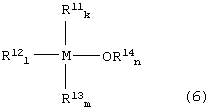
где:
М представляет собой атом металла, выбранный из группы, включающей элементы, принадлежащие к группам 4 и 14 Периодической таблицы, за исключением кремния;
каждый из заместителей R11, R12 и R13 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу, С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил, или незамещенную или замещенную С6-С20-арильную группу;
заместитель R14 представляет собой линейную или разветвленную С1-С12-алкильную группу, С5-С12-циклоалкильную группу, линейную или разветвленную С2-С12-алкенильную группу или С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил; и
каждый из индексов k, l и m представляет собой целое число от 0 до 4, k + l + m = 3 или 4, n представляет собой целое число 0 или 1, и k + l + m + n = 4.
Конкретные примеры непригодных соединений формулы (6) представляют собой тетралкилолово и алкоксид триалкилолова. Другими примерами непригодных соединений (инертных соединений) являются оксиды металлов, такие как SnO2, TiO2 и ZrO2.
Непригодные соединения (такие как упомянутые выше соединения, имеющие в своей молекуле на один атом металла, по меньшей мере, три связи металл-углерод), имеют физические и химические свойства, отличные от свойств полезных металлорганических соединений (то есть реакционноспособного металлорганического соединения или регенерируемого метаморфного металлорганического соединения). То есть непригодное соединение отличается от полезного металлорганического соединения главным образом тем, что непригодное соединение имеет температуру кипения ниже, чем температура кипения полезного металлорганического соединения и менее чувствительно к гидролизу, чем полезное металлорганическое соединение.
Далее приведены объяснения, относящиеся к спиртам, используемым в способе настоящего изобретения.
В способе настоящего изобретения первый спирт используется на стадии (3). Кроме того, второй спирт может быть необязательно использован на стадии (1). Более того, спирт необязательно может быть использован на стадии (2) (здесь и далее этот спирт часто называют «третьим спиртом»).
Первый, второй и третий спирты могут быть одинаковыми или могут отличаться друг от друга. Примерами таких спиртов являются алкиловые спирты, содержащие линейную или разветвленную С1-С12-алкильную группу, циклоалкиловые спирты, содержащие С5-С12-циклоалкильную группу, алкениловые спирты, содержащие линейную или разветвленную С2-С12-алкенильную группу, и аралкиловые спирты, содержащие С7-С20-аралкильные группы, состоящие из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил.
Конкретными примерами таких спиртов являются С1-С12-алифатические спирты и С5-С12-алициклические спирты, такие как метанол, этанол, пропанол, 2-пропанол, 1-бутанол, 2-бутанол (и его изомеры), 2-метил-1-пропанол, 2-метил-2-пропанол, циклобутанол, 1-пентанол, 2-пентанол (и его изомеры), 3-пентанол, 3-метил-1-бутанол, 2-метил-1-бутанол, 2-метил-2-бутанол (и его изомеры), 3-метил-2-бутанол (и его изомеры), циклопентанол, 2-метил-1-циклобутанол (и его изомеры), 3-метил-1-циклобутанол (и его изомеры), 1-метил-1-циклобутанол (и его изомеры), циклобутилметанол (и его изомеры), 1-гексанол, 2-гексанол (и его изомеры), 3-гексанол (и его изомеры), 4-метил-1-пентанол (и его изомеры), 3-метил-1-пентанол (и его изомеры), 2-метил-1-пентанол (и его изомеры), 2-этил-1-бутанол, 3-метил-2-пентанол (и его изомеры), 3-метил-3-пентанол (и его изомеры), циклогексанол, 1-метил-1-циклопентанол (и его изомеры), 2-метил-1-циклопентанол (и его изомеры), 2-циклобутилэтанол (и его изомеры), 1-циклобутилэтанол (и его изомеры), (1-метилциклобутил)метанол (и его изомеры), (2-метилциклобутил)метанол (и его изомеры), гептанол (и его изомеры), циклогексилметанол (и его изомеры), (метилциклогексил)метанол (и его изомеры), циклогексилэтанол (и его изомеры), (этилциклобутил)метанол (и его изомеры), (метилциклопропил)этанол (и его изомеры), (этилциклопропил)метанол (и его изомеры), октанол (и его изомеры), нонанол (и его изомеры), деканол (и его изомеры), ундеканол (и его изомеры), додеканол (и его изомеры), пропениловый спирт, бутениловый спирт (и его изомеры), пентениловый спирт (и его изомеры), циклопентенол (и его изомеры), циклопентадиениловый спирт, гексенол (и его изомеры) и циклогексенол (и его изомеры); и аралкиловые спирты, такие как бензиловый спирт и фенилэтиловый спирт.
Кроме того, в качестве первого, второго и третьего спиртов могут быть использованы многоатомные спирты. Примерами многоатомных спиртов являются многоатомные С1-С12-алифатические спирты и многоатомные С5-С12-алициклические спирты, такие как этиленгликоль, 1,3-пропандиол, 1,2-пропандиол, циклогександиол и циклопентандиол; и аралкиловые спирты, такие как бензолдиметанол.
Среди названных выше спиртов предпочтительными являются С1-С8-первичные или вторичные одноатомные спирты, такие как метанол, этанол, пропанол, 2-пропанол, 1-бутанол, 2-бутанол (и его изомеры), 2-метил-1-пропанол, 2-метил-2-пропанол, циклобутанол, 1-пентанол, 2-пентанол (и его изомеры), 3-пентанол, 3-метил-1-бутанол, 2-метил-1-бутанол, 2-метил-2-бутанол (и его изомеры), 3-метил-2-бутанол (и его изомеры), циклопентанол, 2-метил-1-циклобутанол (и его изомеры), 3-метил-1-циклобутанол (и его изомеры), 1-метил-1-циклобутанол (и его изомеры), циклобутилметанол (и его изомеры), 1-гексанол, 2-гексанол (и его изомеры), 3-гексанол (и его изомеры), 4-метил-1-пентанол (и его изомеры), 3-метил-1-пентанол (и его изомеры), 2-метил-1-пентанол (и его изомеры), 2-этил-1-бутанол, 3-метил-2-пентанол (и его изомеры), 3-метил-3-пентанол (и его изомеры), циклогексанол, 1-метил-1-циклопентанол (и его изомеры), 2-метил-1-циклопентанол (и его изомеры), 2-циклобутилэтанол (и его изомеры), 1-циклобутилэтанол (и его изомеры), (1-метилциклобутил)метанол (и его изомеры), (2-метилциклобутил)метанол (и его изомеры), гептанол (и его изомеры), циклогексилметанол (и его изомеры), (метилциклогексил)метанол (и его изомеры), циклогексилэтанол (и его изомеры), (этилциклобутил)метанол (и его изомеры), (метилциклопропил)этанол (и его изомеры), (этилциклопропил)метанол (и его изомеры), октанол (и его изомеры) и гексенол; и С7-С8-первичные и вторичные аралкиловые спирты, такие как бензиловый спирт.
Среди упомянутых выше спиртов более предпочтительными являются алкиловые спирты, циклоалкиловые спирты, алкениловые спирты и аралкиловые спирты, которые имеют температуру кипения выше, чем температура кипения воды (где температура кипения измерена при атмосферном давлении). Примерами таких спиртов являются 1-бутанол, 2-метил-1-пропанол, алкиловый спирт, содержащий линейную или разветвленную С5-С12-алкильную группу, алкениловый спирт, содержащий линейную или разветвленную С4-С12-алкенильную группу, циклоалкиловый спирт, содержащий С5-С12-циклоалкильную группу, и аралкиловый спирт, содержащий С7-С20-аралкильную группу, состоящую из незамещенного или замещенного С6-С19-арила и алкила, выбранного из группы, включающей линейный или разветвленный С1-С14-алкил и С5-С14-циклоалкил. Среди таких спиртов наиболее предпочтительными являются алкиловые спирты, содержащие линейную или разветвленную С5-С8-алкильную группу.
Далее приведены объяснения по методу анализа реакционноспособного металлорганического соединения и непригодного соединения, образованного из него.
Реакционноспособные металлорганические соединения, которые соответственно представлены формулами (1) и (2), и непригодное соединение (нерегенерируемое инертное соединение) могут быть проанализированы, например, с помощью спектроскопии ядерного магнитного резонанса на ядрах Sn-119 (119Sn-ЯМР) (см., например, патент США № 5545600). Однако в спектре 119Sn-ЯМР значение химического сдвига, приписываемого металлорганическому соединению, представленному формулой (1), зависит, главным образом, например, от содержания металлорганического соединения в образце, используемом для проведения 119Sn-ЯМР, и от присутствия или отсутствия спирта в образце, используемом для 119Sn-ЯМР. Таким образом, предпочтительно, чтобы анализ металлорганического соединения проводили способом, в котором спектроскопия ядерного магнитного резонанса на протонах (1Н-ЯМР) и спектроскопия ядерного магнитного резонанса на ядрах углерода-13 (13С-ЯМР) используются в комбинации со спектроскопией 119Sn-ЯМР. Ниже в таблице 1 представлены примеры данных 119Sn-ЯМР для значений химических сдвигов, приписываемых структуре реакционноспособного металлорганического соединения, представленного формулой (1), которое получено из 2-этил-1-гексанола и оксида дибутилолова. Ниже в таблице 2 представлены примеры данных 119Sn-ЯМР для значений химических сдвигов, приписываемых структуре непригодного соединения (то есть нерегенерируемого инертного металлорганического соединения), представленного формулой (6). В спектре 119Sn-ЯМР непригодного соединения значение химического сдвига, приписываемого структуре непригодного соединения, не очень сильно зависит от содержания непригодного соединения в образце, используемом для 119Sn-ЯМР, а зависит главным образом от типов алкильных и алкоксигрупп, содержащихся в непригодном соединении. Характеристичным признаком спектра 119Sn-ЯМР непригодного соединения является то, что сигналы, приписываемые структуре непригодного соединения, появляются в интервале значений δ от 90 до 110 м.д.
Содержание металлорганического соединения формулы (I), содержащего 2-этилгексилоксигруппу, в растворах образцов, и значения химических сдвигов в спектре 119Sn-ЯМР, полученного для растворов образцов
(δ м.д.)
Значения химических сдвигов в спектрах 119Sn-ЯМР, полученных для растворов образцов, содержащих непригодное соединение, представленное формулой (6), которое представляет собой соединение трибутилметалла
Что касается каждой стадии способа настоящего изобретения, то подробные объяснения приведены ниже.
На стадии (1) способа настоящего изобретения проводят реакцию между первой смесью металлорганического соединения и диоксидом углерода, где первая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из реакционноспособного металлорганического соединения и которое имеет в своей молекуле, по меньшей мере, три связи металл-углерод, в результате чего получают реакционную смесь, содержащую эфир угольной кислоты, образованный в ходе реакции, нерегенерируемое инертное соединение и регенерируемое метаморфное металлорганическое соединение, образованное из реакционноспособного металлорганического соединения. Стадия (1) способа настоящего изобретения подразумевает реакционный путь, в котором образуется аддукт диоксида углерода и реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и образованный аддукт термически разлагают с получением эфира угольной кислоты. То есть в реакционном пути стадии (1) диоксид углерода является связанным за счет присоединения к реакционноспособному металлорганическому соединению с образованием аддукта, и аддукт термически разлагают. В отличие от обычных способов стадия (1) способа настоящего изобретения отличается тем, что металлорганическое соединение, имеющее в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, вводят в реакцию с небольшим стехиометрическим количеством диоксида углерода. В обычных способах диоксид углерода под высоким давлением вводят в реакцию со спиртом в присутствии небольшого количества металлического катализатора. В качестве примера такого обычного способа можно упомянуть способ, в котором диоксид углерода вводят в реакцию с метанолом в присутствии диметилоксида дибутилолова (см. Polyhedron, Vol. 19, рр. 573-576 (2000)). В обычном способе, описанном в этой публикации, диоксид углерода под давлением приблизительно 30 мПа вводят в реакцию с метанолом при 180°С в присутствии нескольких миллимолей диметоксида дибутилолова. Точное количество диоксида углерода, используемого в реакции, не описано в приведенной выше публикации. Однако считают, что даже если вычесть парциальное давление метанола, количество диоксида углерода, используемого в реакции, должно быть, по меньшей мере, в 100 раз больше стехиометрического количества относительно количества металлорганического соединения, имеющего связь металл-кислород-углерод. За счет достижения упомянутых выше условий высокого давления равновесие принудительно сдвигается в направлении эфира угольной кислоты с тем, чтобы эфир угольный кислоты мог быть получен с выходом, который больше, чем ожидается из количества катализатора. Однако при реакции диоксида углерода с метанолом также образуется свободная вода, вызывая в результате серьезную проблему гидролиза катализатора свободной водой. Для решения этой проблемы необходимо разработать способ дегидратации реакционной системы. В приведенной выше публикации описано, что при названных выше условиях реакции оксид дибутилолова образуется в качестве продукта гидролиза диметоксида дибутилолова и остается в реакционной системе. Оксид дибутилолова не может быть растворен в растворителе при комнатной температуре; однако в способе настоящего изобретения, даже когда реакционную смесь после окончания стадии (1) охлаждают до комнатной температуры, реакционная смесь обычно остается в форме жидкости. Следовательно, реакция, используемая в способе настоящего изобретения, отличается от реакции, используемой в упомянутом выше обычном способе, в котором применяется большое количество диоксида углерода.
В случае обычного способа реакционная система имеет высокую концентрацию диоксида углерода, и, следовательно, реакцию необходимо проводить в условиях высокого давления. Таким образом, когда реакционную смесь, содержащую полученный эфир угольной кислоты, отбирают из реактора, необходимо отдувать большое количество диоксида углерода из реактора до извлечения реакционной смеси. Такая необходимость ставит проблемы не только в том, что большое количество диоксида углерода уходит в отходы, то также в том, что если предполагается повторное использование отдутого диоксида углерода, становится необходимым повторное повышение давление диоксида углерода и, следовательно, большое количество энергии расходуется на повышение давления диоксида углерода. Кроме того, в обычном способе также, по-видимому, имеет место следующая проблема. Известно, что когда реакционная система имеет высокую концентрацию диоксида углерода, плотность слоя газообразного диоксида углерода растет так, что диоксид углерода растворяет не только растворитель и катализатор, но также производимый эфир угольной кислоты, давая в результате реакционную смесь, составляющую гомогенную смесь диоксида углерода, растворителя, катализатора и полученного эфира угольной кислоты. Когда реакционную смесь (гомогенную смесь) охлаждают с получением жидкой реакционной смеси, жидкая реакционная смесь содержит диоксид углерода в форме жидкой угольной кислоты. Таким образом, исключительно трудно отделить полученный эфир угольной кислоты от реакционной смеси.
На стадии (1) способа настоящего изобретения предпочтительно, чтобы диоксид углерода использовался в количестве, которое составляет от 1 до 50, более предпочтительно от 1 до 20 стехиометрических количеств относительно количества реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод. Когда количество диоксида углерода является большим, реакция становится реакцией высокого давления, так что не только необходимо использовать реактор, имеющий большую прочность при высоком давлении, но, кроме того, большое количество диоксида углерода теряется при отдувке непрореагировавшего диоксида углерода по окончании стадии (1). Следовательно, еще более предпочтительно, чтобы диоксид углерода использовался в количестве, которое составляет от 1 до 10 стехиометрических количеств относительно количества реакционноспособного металлорганического соединения. Другими словами, на стадии (1) является предпочтительным, чтобы реакционноспособное органическое соединение использовалось в количестве, которое составляет от 1/50 до 1, более предпочтительно от 1/20 до 1 стехиометрического количества относительно количества диоксида углерода. В настоящем изобретении аддукт диоксида углерода и реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, может быть легко получено путем введения в контакт реакционноспособного металлорганического соединения с диоксидом углерода. Когда температура реакции равна комнатной температуре (20°С), аддукт диоксида углерода образуется экзотермически за счет введения в контакт реакционноспособного металлорганического соединения с потоком диоксида углерода, имеющего атмосферное давление. В этом случае аддукт диоксида углерода может быть получен с выходом почти 100%. С повышением температуры реакции количество получаемого аддукта диоксида углерода становится пониженным; однако даже когда температура реакции является высокой, понижение количества аддукта диоксида углерода может быть подавлено путем введения в контакт реакционноспособного металлорганического соединения с диоксидом углерода, имеющим высокое давление. На стадии (1), когда реакционноспособное металлорганическое соединение контактирует с диоксидом углерода, имеющим высокое давление, трудно определить количество полученного аддукта диоксида углерода; однако предпочтительно, чтобы реакция реакционноспособного металлорганического соединения с диоксидом углерода проводилась при желаемом давлении в зависимости от скорости, при которой образуется эфир угольной кислоты, и от количества полученного эфира угольной кислоты. Реакционное давление обычно составляет от атмосферного давления до 200 МПа. Предпочтительно, чтобы количество эфира угольной кислоты, полученное на стадии (1), составляло 100% или менее, более предпочтительно 50% или менее из расчета на стехиометрическое количество относительно количества реакционноспособного металлорганического соединения. Причина этого заключается в следующем. Реакционноспособное металлорганическое соединение, используемое в способе настоящего изобретения, является более чувствительным к гидролизу, чем полученный эфир угольной кислоты. Следовательно, когда эфир угольной кислоты получают в количестве, которое составляет 100% или менее, предпочтительно 50% или менее, из расчета на стехиометрическое количество относительно количества реакционноспособного металлорганического соединения, вода, которая, по-видимому, гидролизует полученный эфир угольной кислоты, преимущественно не присутствует в реакционной смеси. С другой стороны, в случае обычных способов реакцию проводят так, чтобы количество полученного эфира угольной кислоты составляло более чем 100% из расчета на стехиометрическое количество относительно количества реакционноспособного металлорганического соединения. В результате в случае обычных способов образование свободной воды, которая, по-видимому, гидролизует полученный эфир угольной кислоты, создает серьезную проблему. Для предупреждения гидролиза полученного эфира угольной кислоты необходимо добавлять дегидратирующий агент в реакционную систему или проводить реакцию в присутствии дегидратирующего агента, где дегидратирующий агент выбирают из группы, включающей дегидратирующий агент, который более чувствителен к гидролизу, чем реакционноспособное металлорганическое соединение, и твердый дегидратирующий агент, имеющий высокую способность адсорбировать воду. Такое использование дегидратирующего агента является невыгодным не только в том, что необходима усложненная стадия, но также в том, что дегидратирующий агент является дорогим. Следовательно, обычные способы практически не применяются в качестве способа производства эфира угольной кислоты в промышленном масштабе. Напротив, в реакционном пути стадии (1) способа настоящего изобретения основная реакция представляет собой реакцию разложения, при которой аддукт диоксида углерода и реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, термически разлагается с получением эфира угольной кислоты. Реакцию термического разложения проводят при температуре в интервале от 20 до 300°С. На стадии (1) способа настоящего изобретения реакция обмена со спиртом или реакция обмена со сложным эфиром может быть проведена вместе с упомянутой выше реакцией разложения. То есть, например, когда стадию (1) проводят в присутствии второго спирта, реакция обмена со спиртом протекает между связью кислород-углерод второго спирта и связью кислород-углерод реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод так, что может быть получен эфир угольной кислоты, соответствующий второму спирту. С другой стороны, после образования эфира угольной кислоты второй спирт может быть добавлен к реакционной системе, чтобы провести реакцию обмена со сложным эфиром, получая в результате другой эфир угольной кислоты, соответствующий второму спирту.
Что касается стадии (1), то ниже приведены более детальные объяснения.
Исследования заявителей настоящего изобретения показали, что на стадии (1) эфир угольной кислоты получают реакцией между реакционноспособным металлорганическим соединением и диоксидом углерода. Следовательно, использование второго спирта на стадии (1) является необязательным. Однако с точки зрения получения эфира угольной кислоты с высоким выходом предпочтительно использовать второй спирт на стадии (1). Для этого имеется следующая причина. Реакция термического разложения на стадии (1) имеет обратную реакцию. Когда добавляют к реакционной системе второй спирт, возможно, что дополнительно протекает другая равновесная реакция между вторым спиртом и продуктом термического разложения, отличным от эфира угольной кислоты, улучшая в результате выход эфира угольной кислоты. Добавление второго спирта для улучшения выхода эфира угольной кислоты является особенно эффективным, когда реакционноспособное металлорганическое соединение состоит главным образом из металлорганического соединения, представленного формулой (2). С другой стороны, когда реакционноспособное металлорганическое соединение состоит главным образом из металлорганического соединения, представленного формулой (1), равновесие реакции термического разложения на стадии (1) сдвигается в направлении продуктов системы, и, следовательно, выход эфира угольной кислоты значительно выше, так что в некоторых случаях выход эфира угольной кислоты не может быть дополнительно улучшен путем добавления второго спирта. Когда второй спирт содержит большое количество воды, выход эфира угольной кислоты понижается. Следовательно, предпочтительно, чтобы количество воды, содержащейся во втором спирте, составляло не более чем 0,1, более предпочтительно не более чем 0,01 от стехиометрического количества относительно количества реакционноспособного металлорганического соединения. Когда реакцию на стадии (1) проводят с использованием металлорганического соединения, представленного формулой (1), аддукт диоксида углерода и металлорганического соединения, представленного формулой (1), термически разлагается с образованием эфира угольной кислоты. Хорошо известно, что эфир угольной кислоты производят из димера металлорганического соединения, представленного формулой (1) (см. ECO INDUSNRY, Vol. 6, № 6, рр. 11-18 (2001)). В обычном способе, описанном в литературе, эфир угольной кислоты, а также оксид дибутилолова производят из димера металлорганического соединения, представленного формулой (1), где количество полученного эфира угольной кислоты составляет две молекулы на молекулу димера металлорганического соединения. Заявители настоящего изобретения провели широкие и интенсивные исследования образования эфира угольной кислоты из металлорганического соединения. В результате неожиданно было установлено, что, когда аддукт диоксида углерода и димера металлорганического соединения, представленного формулой (1), термически разлагается, эфир угольной кислоты выделяется быстро, где количество выделенного эфира угольной кислоты равно одной молекуле на молекулу аддукта диоксида углерода, так что может быть получено металлорганическое соединение, представленное формулой (2), и/или его аддукт с диоксидом углерода. В этом случае добавление спирта не является необходимым. Стадия (2) может быть проведена сразу же после получения эфира угольной кислоты и, по меньшей мере, одного соединения, выбранного из группы, включающей металлорганическое соединение, представленное формулой (2), и его аддукт с диоксидом углерода. С другой стороны, стадия (2) может быть осуществлена после того, как эфир угольной кислоты дополнительно произведен из полученного металлорганического соединения, представленного формулой (2), и/или полученного аддукта диоксида углерода. Как упоминалось выше, предпочтительно, чтобы реакционноспособное металлорганическое соединение, используемое на стадии (1), содержало, по меньшей мере, одно соединение, выбранное из группы, включающей металлорганические соединения, соответственно представленные формулами (1) и (2). Более предпочтительно, чтобы, по меньшей мере, часть реакционноспособного металлорганического соединения, используемого на стадии (1), представляла собой металлорганическое соединение, представленное формулой (1). Еще более предпочтительно, чтобы реакционноспособное соединение, используемое на стадии (1), содержало 5 мол.% или более металлорганического соединения, представленного формулой (1), где количество металлорганического соединения выражено в значениях количества атомов металла, содержащихся в металлорганическом соединении.
На стадии (1) для реакционноспособного металлорганического растворителя может быть использован растворитель. Реакционноспособное металлорганическое соединение, используемое в настоящем изобретении, обычно находится в форме жидкости. Однако в некоторых случаях реакционноспособное металлорганическое соединение находится в форме твердого вещества. Кроме того, существуют случаи, когда реакционноспособное металлорганическое соединение превращается в твердую форму, когда реакционноспособное металлорганическое соединение дает аддукт с диоксидом углерода на стадии (1). Даже когда реакционноспособное металлорганическое соединение находится в форме твердого вещества, эфир угольной кислоты может быть получен на стадии (1). Однако текучесть реакционноспособного металлорганического соединения иногда имеет большое значение, если эфир угольной кислоты производится непрерывно. Кроме того, для повышения скорости реакции между реакционноспособным металлорганическим соединением и диоксидом углерода иногда предпочтительно, чтобы реакционноспособное металлорганическое соединение находилось в форме жидкости. В таких случаях стадия (1) может быть проведена с использованием растворителя для реакционноспособного металлорганического соединения. В качестве растворителя может быть использован спирт, содержащий ту же органическую группу, что и производимый эфир угольной кислоты. С другой стороны, также может быть использован инертный растворитель. Примерами инертных растворителей являются углеводороды и простые эфиры. Конкретными примерами инертных растворителей являются С5-С20-насыщенные углеводороды, такие как пентан, гексан, циклогексан, гептан, октан и декан; С6-С20-ароматические углеводороды (которые могут содержать С1-С14-насыщенную алкильную группу и/или С5-С14-циклоалкильную группу), такие как бензол, толуол ксилол и этилбензол; С6-С20-насыщенные простые алкиловые эфиры, такие как дипропиловый эфир, дибутиловый эфир и дигексиловый эфир; С4-С20-циклоалкиловые простые эфиры, такие как тетрагидрофуран и диоксан; и С7-С28-фениловые простые эфиры (содержащие фенильную группу, имеющую в качестве заместителя С0-С8-группу и группу, выбранную из группы, включающей С1-С14-алкильную группу и С5-С14-циклоалкильную группу), такие как анизол, этилфениловый эфир, изопропилфениловый эфир, бензилметиловый эфир и 4-метиланизол.
Температура для проведения реакции на стадии (1), обычно находится в интервале от комнатной температуры (20°С) до 300°С. Когда предполагается окончание реакции за короткий промежуток времени, предпочтительно проводить реакцию при температуре от 80 до 200°С в течение от 10 мин до 500 час. Когда реакцию на стадии (1) проводят при высокой температуре (например, при 200°С или более), спектр 119Sn-ЯМР, полученный для реакционной смеси после стадии (1), иногда показывает наличие сигнала около 100 м.д., приписываемого некоторому веществу, если при проведении 119Sn-ЯМР в качестве стандарта используют тетраметилолово. Однако когда способ настоящего изобретения проводят несколько раз, предпочтительно, чтобы реакция на стадии (1) проводилась в условиях, при которых образование названного выше вещества, дающего сигнал около 100 м.д., могло бы быть подавлено, или реакцию на стадии (1) проводят с использованием добавки для подавления образования упомянутого выше вещества, дающего сигнал около 100 м.д.
Что касается количества диоксида углерода, то когда реакцию на стадии (1) проводят при комнатной температуре (20°С), достаточно, если диоксид углерода используют в количестве, которое представляет собой стехиометрическое количество относительно количества реакционноспособного металлорганического соединения, используемого на стадии (1). Однако когда реакцию на стадии (1) проводят при температуре, которая выше, чем комнатная температура (20°С), при условиях, где количество диоксида углерода соответствует стехиометрическому количеству относительно количества реакционноспособного металлорганического соединения, используемого на стадии (1), скорость присоединения диоксида углерода к реакционноспособному металлорганическому соединению иногда становится очень низкой, так что скорость образования эфира угольной кислоты заметно падает. Давление, используемое для реакции, проводимой на стадии (1), обычно находится в интервале от атмосферного давления до 200 МПа, предпочтительно от атмосферного давления до 100 МПа, где, если желательно, реакция может быть осуществлена при введении дополнительного диоксида углерода в реакционную систему или при выведении части диоксида углерода из реакционной системы. Введение дополнительного диоксида углерода в реакционную систему может быть осуществлено или периодически или непрерывно.
В способе настоящего изобретения реакционная система на стадии (1) может содержать вещества, отличные от упомянутых выше. Примерами других веществ, которые могут быть использованы на стадии (1), являются вещества, которые выполняют функцию дегидратирующего агента в реакционной системе. При использовании дегидратирующего агента на стадии (1) реакционную систему можно поддерживать неводной. В качестве дегидратирующего агента можно использовать любой обычный органический дегидратирующий агент. Примерами дегидратирующих агентов являются ацетали и ортоэфиры, такие как ортотриметилацетат. Кроме того, дициклогексилкарбодиимид и подобные вещества также могут быть использованы в качестве органического дегидратирующего агента. С другой стороны, твердые дегидратирующие агенты, такие как молекулярные сита, могут быть использованы в качестве дегидратирующего агента. Когда используется твердый дегидратирующий агент, предпочтительно, чтобы твердый дегидратирующий агент удалялся из реакционной системы до проведения стадии (3).
На стадии (1) способа настоящего изобретения необязательно используют спирт (второй спирт). С точки зрения повышения чистоты эфира угольной кислоты в качестве второго спирта предпочтительно использовать спирт, имеющий органическую группу, которая является той же самой органической группой, что и в оксигруппе (например, алкоксигруппы или аралкилоксигруппы) реакционноспособного металлорганического соединения. Когда такой спирт используют в качестве второго спирта, предпочтительно, чтобы количество второго спирта составляло от 1 до 100000 от стехиометрического количества относительно количества реакционноспособного металлорганического соединения. С другой стороны, когда спирт, имеющий органическую группу, отличную от группы оксигруппы реакционноспособного металлорганического соединения, используют в качестве второго спирта или когда в качестве реакционноспособного металлорганического соединения используют только металлорганическое соединение формулы (2), количество второго спирта предпочтительно составляет от 2 до 1000, более предпочтительно от 10 до 1000 стехиометрических количеств относительно количества реакционноспособного металлорганического соединения. Когда спирт, имеющий органическую группу, отличающуюся от группы оксигруппы реакционноспособного металлорганического соединения, используют в качестве второго спирта, на стадии (1) получают асимметричный эфир угольной кислоты. Как упоминается ниже, когда на стадии (1) используют второй спирт, особенно в том случае, когда используется только металлорганическое соединение, представленное формулой (2), выход эфира угольной кислоты значительно улучшается. Приведенное выше предпочтительное количество второго спирта в случае, когда металлорганическое соединение, представленное формулой (2), используется отдельно, определяется с этой точки зрения.
В случае, когда упомянутая ниже стадия (4) следует за стадией (1), второй спирт может быть добавлен к реакционной системе так, чтобы количество второго спирта попадало в пределы приведенного выше предпочтительного интервала. С другой стороны, в случае, когда стадия (4) следует за стадией (1), спирт может быть удален из реакционной системы.
Как указывалось выше, на стадии (1) способа настоящего изобретения путем проведения реакции между первой смесью металлорганического соединения, содержащей смесь реакционноспособного металлорганического соединения и нерегенерируемого инертного соединения (которое образуется из реакционноспособного металлорганического соединения), и диоксидом углерода, получают реакционную смесь, содержащую эфир угольной кислоты, полученный в ходе реакции, нерегенерируемое инертное соединение (то есть непригодное соединение) и регенерируемое метаморфное металлорганическое соединение, образованное из реакционноспособного металлорганического соединения.
Когда с помощью анализа реакционной смеси получают подтверждение, что желаемый эфир угольной кислоты получен, стадию (1) завершают. Например, когда эфир угольной кислоты получают в количестве, которое составляет 5% или более из расчета на стехиометрическое количество относительно количества реакционноспособного металлорганического соединения, стадия (1) может быть завершена. Реакционную смесь можно выводить из реактора или после уменьшения давления в реакторе до атмосферного или без понижения давления в реакторе. Когда стадию (1), стадию (2) и стадию (3) проводят в отдельных реакторах, реакционная смесь может непрерывно циркулировать, например, способом, в котором реакционную смесь после стадии (3) подают в реактор стадии (1); реакционную смесь, содержащуюся в реакторе стадии (1), подают в реактор стадии (2); и реакционную смесь, содержащуюся в реакторе стадии (2), подают в реактор стадии (3). Циркуляция реакционной смеси является предпочтительной с точки зрения снижения количества диоксида углерода, отдуваемого из реактора (для стадии (1)), который заполнен диоксидом углерода. Реакционная смесь, полученная по окончании каждой стадии, может быть охлаждена или нагрета. Когда реакционную смесь охлаждают, ее можно охлаждать принудительно или ей можно дать возможность охладиться самопроизвольно. Как описано ниже, если желательно, то стадия (1) синтеза эфира угольной кислоты и стадия (2) отделения синтезированного эфира угольной кислоты могут быть проведены одновременно.
Стадия (2) способа настоящего изобретения представляет собой стадию, на которой реакционную смесь, полученную на стадии (1), разделяют на первую часть, содержащую эфир угольной кислоты и непригодное соединение (то есть нерегенерируемое инертное соединение), и вторую часть, содержащую регенерируемое метаморфное металлорганическое соединение. С помощью такого разделения, при котором непригодное соединение, полученное из реакционноспособного металлорганического соединения, вынужденно находится в первой части, содержащей эфир угольной кислоты (где первую часть отбирают из реакционной системы), становится возможным предупредить накопление непригодного соединения в реакционной системе. Следовательно, все проблемы обычных способов решены с помощью способа настоящего изобретения.
Как описывалось выше, при производстве эфира угольной кислоты из диоксида углерода и спирта с помощью обычного способа с использованием реакции уравнения (3) образуется вода, а также эфир угольной кислоты, и воду вводят в контакт с адсорбентом или дегидратирующим агентом, чтобы удалить ее из реакционной системы, сдвигая в результате равновесие реакции в сторону системы продуктов. Теоретически количество полученного эфира угольной кислоты также может быть повышено путем непрерывного удаления производимого эфира угольной кислоты из реакционной системы с тем, чтобы сдвинуть равновесие реакции в сторону продуктов. Однако в обычном способе, когда производимый эфир угольной кислоты удаляют из реакционной системы, полученная в ходе реакции вода накапливается в реакционной системе. Как хорошо известно в данной области, если в реакционной системе накапливается вода, катализатор гидролизуется водой и теряет свою каталитическую активность. Гидролизованный катализатор имеет очень плохую растворимость в растворителе, и, следовательно, встает проблема, состоящая в том, что на последующей стадии дегидратации с использованием адсорбционной колонны гидролизованный катализатор вызывает забивку адсорбционной колонны. Кроме того, отсутствует способ регенерации катализатора, который потерял свою активность вследствие гидролиза. По этой причине в обычных способах невозможно эффективное отделение полученного эфира угольной кислоты от реакционной смеси.
На стадии (2) способа настоящего изобретения обычный способ отделения эфира угольной кислоты от реакционной смеси может быть использован до тех пор, пока не ухудшается результат способа настоящего изобретения. Например, отделение эфира угольной кислоты от реакционной смеси может быть осуществлено фильтрацией, экстракцией растворителем, отгонкой и фильтрацией через мембрану, каждый из которых хорошо известен в данной области техники. В качестве предпочтительного примера экстракции растворителем можно назвать экстракцию растворителем, не проявляющим реакционной способности по отношению к эфиру угольной кислоты. Примерами таких растворителей являются углеводороды, такие как гексан и циклогексан; ароматические углеводороды, такие как бензол, толуол и хлорбензол; и простые эфиры, такие как диэтиловый эфир и анизол. Отгонка может быть осуществлена любым удобным способом. Например, отгонка может быть осуществлена как отгонка при атмосферном давлении, отгонка при пониженном давлении, отгонка при давлении выше атмосферного и отгонка в тонком слое, каждая из которых хорошо известна в данной области техники. Температура отгонки может меняться в зависимости от типа эфира угольной кислоты, который должен быть получен, но предпочтительно, чтобы температура составляла от -20 до 200°С. Отгонка может быть осуществлена или в присутствии растворителя или экстрактивной отгонкой. С другой стороны, как указывалось выше, когда отгонку проводят при нагревании, отделение эфира угольной кислоты отгонкой иногда сопровождается следующими недостатками. Когда отгонку проводят при нагревании, в некоторых случаях протекает обратная реакция эфира угольной кислоты и других продуктов термического разложения в равновесной реакции, что в результате понижает выход эфира угольной кислоты. Однако в том случае, когда первую часть, содержащую эфир угольной кислоты, имеющий высокую температуру кипения, отделяют от реакционной смеси отгонкой, эфир угольной кислоты может быть получен с высоким выходом путем отделения эфира угольной кислоты из реакционной смеси со скоростью, которая выше, чем скорость обратной реакции. Для этой цели предпочтительно проводить отгонку в условиях, когда температура отгонки и степень снижения давления подобраны соответствующим образом.
На стадии (2), если желательно, может быть использован третий спирт. Когда третий спирт добавляют к реакционной системе, реакция обмена со сложным эфиром протекает между эфиром угольной кислоты, полученным на стадии (1), и третьим спиртом, в результате чего получают эфир угольной кислоты, который имеет число атомов углерода, отличное от числа атомов углерода эфира угольной кислоты, полученного на стадии (1). Количество третьего спирта, используемого на стадии (2), составляет от 1 до 1000 стехиометрических количеств относительно количества реакционноспособного металлорганического соединения, используемого на стадии (1). Температура, используемая для реакции обмена сложного эфира, предпочтительно находится в интервале от комнатной температуры (приблизительно 20°С) до 200°С. Принимая во внимание желаемую скорость обменной реакции сложного эфира и протекание реакции разложения эфира угольной кислоты при высокой температуре, температура, используемая для обменной реакции сложного эфира, наиболее предпочтительно находится в интервале от 50 до 150°С. В обменной реакции сложного эфира может быть использован обычный катализатор. Реакция обмена с эфиром и отделение эфира угольной кислоты от реакционной смеси могут быть осуществлены периодически или непрерывно. В качестве способа отделения первой части, содержащей эфир угольной кислоты, от реакционной смеси после реакции обмена сложного эфира может быть использован любой из приведенных выше способов разделения (такой как фильтрация, экстракция растворителем, отгонка и фильтрация через мембрану).
Способом настоящего изобретения может быть получен не только симметричный эфир угольной кислоты, но также асимметричный эфир угольной кислоты. В случае получения асимметричного эфира угольной кислоты с использованием обычного способа вначале получают симметричный эфир угольной кислоты и полученный симметричный эфир угольной кислоты затем подвергают обменной реакции сложного эфира с получением асимметричного эфира угольной кислоты. С другой стороны, в способе настоящего изобретения асимметричный эфир угольной кислоты может быть получен напрямую. Следовательно, способ настоящего изобретения имеет преимущество с точки зрения снижения энергетических затрат и стоимости оборудования. В способе настоящего изобретения асимметричный эфир угольной кислоты может быть получен следующим образом. Объяснения приведены ниже, при этом в качестве примера взят случай, когда реакционноспособное металлорганическое соединение содержит, по меньшей мере, один тип алкоксигруппы. Когда реакционноспособное металлорганическое соединение, используемое на стадии (1), содержит два различных типа алкоксигрупп, асимметричный эфир угольной кислоты может быть получен без использования спиртов (в качестве второго спирта и третьего спирта) на стадиях (1) и (2). С другой стороны, когда металлорганическое соединение, используемое на стадии (1), содержит только один тип алкоксигруппы, асимметричный эфир угольной кислоты может быть получен путем проведения стадии (1) в присутствии спирта (второй спирт), содержащего органическую группу, которая отличается от алкоксигруппы реакционноспособного металлорганического соединения, или путем проведения стадии (2) в присутствии спирта (третий спирт), содержащего органическую группу, которая отличается от алкоксигруппы реакционноспособного металлорганического соединения. Кроме того, в каждом случае, когда реакционноспособное металлорганическое соединение, используемое на стадии (1), имеет только один тип алкоксигруппы, и в случае когда реакционноспособное металлорганическое соединение, используемое на стадии (1), имеет два различных типа алкоксигрупп, асимметричный эфир угольной кислоты также может быть получен путем проведения стадии (1) в присутствии двух различных спиртов (вторые спирты), или путем проведения стадии (2) в присутствии двух различных спиртов (третьи спирты). Когда используют два различных спирта, стехиометрическое отношение двух спиртов меняется в зависимости от типов двух спиртов; однако стехиометрическое отношение обычно находится в интервале от 2:8 до 8:2, где каждое из количеств двух спиртов выражено в значениях стехиометрического количества относительно количества реакционноспособного металлорганического соединения. Когда предполагается получение асимметричного эфира угольной кислоты в количестве, которое больше, чем количество симметричного эфира угольной кислоты, предпочтительно, чтобы стехиометрическое отношение двух спиртов было как можно ближе к отношению 1:1. То есть стехиометрическое отношение двух спиртов предпочтительно находится в интервале от 3:7 до 7:3, более предпочтительно в интервале от 4:6 до 6:4. Когда производство асимметричного эфира угольной кислоты осуществляют с использованием двух различных спиртов, которые используются в избыточных количествах (например, в количествах, каждое из которых, по меньшей мере, соответствует 10 стехиометрическим количествам относительно количества реакционноспособного металлорганического соединения), становится возможным получать асимметричный эфир угольной кислоты, содержащий два различных типа алкоксигрупп, соответствующих двум спиртам, независимо от типа алкоксигруппы реакционноспособного металлорганического соединения, используемого на стадии (1). Отделение первой части, содержащей асимметричный эфир угольной кислоты, от реакционной смеси может быть осуществлено любым способом (таким как фильтрация, экстракция растворителем, отгонка и фильтрация через мембрану), описанным выше для стадии (2). Во многих случаях получают не только асимметричный эфир угольной кислоты, но также симметричный эфир угольной кислоты. В каждом случае могут быть проведены следующие операции. Асимметричный и симметричный эфиры угольной кислоты отделяют от первой части. Асимметричный эфир угольной кислоты отделяют от симметричного эфира угольной кислоты. Симметричный эфир угольной кислоты или добавляют ко второй части, содержащей регенерируемое метаморфное соединение, после чего следует проведение стадии (3), или возвращают на стадию (1) или (2).
Как указывалось выше, на стадии (2) способа настоящего изобретения смесь, содержащую непригодное соединение, образованное из реакционноспособного металлорганического соединения, и эфир угольной кислоты, отделяют от реакционной смеси в качестве первой части. Что касается удаления непригодного соединения, то может быть удалено все непригодное соединение или может быть удалена часть непригодного соединения. Количество удаленного непригодного соединения может меняться в зависимости от размера реактора и/или числа рециркуляции (то есть числа циклов регенерации и повторного использования) реакционноспособного металлорганического соединения. Предпочтительно, чтобы было удалено 10% или более непригодного соединения. Более предпочтительно, чтобы было удалено 50% или более непригодного соединения.
Что касается способа разделения, проводимого на стадии (2) способа настоящего изобретения, то ниже приведены более подробные объяснения. Разделение реакционной смеси, полученной на стадии (1), на первую часть и вторую часть может быть проведено любым из описанных выше обычных способов. В качестве предпочтительных примеров таких способов можно назвать способ, в котором к реакционной смеси добавляют воду, чтобы вызвать фазовое разделение, и способ с использованием отгонки. Ниже описан каждый из этих способов.
1). Способ разделения, в котором к реакционной смеси добавляют воду
Воду или содержащий воду растворитель добавляют к реакционной смеси, полученной на стадии (1), с образованием белой суспензии, и твердые вещества в белой суспензии удаляют фильтрацией. Путем фильтрации может быть получена вторая часть, содержащая регенерируемое метаморфное металлорганическое соединение, в качестве остатка после фильтрации, а первая часть, содержащая эфир угольной кислоты и непригодное соединение, может быть получена в качестве фильтрата. Что касается воды, используемой в этом способе, то особенных ограничений не существует; однако предпочтительно использовать дистиллированную или деионизированную воду.
Количество воды, используемой на стадии (2), обычно составляет от 1 до 100 стехиометрических количеств относительно количества реакционноспособного металлорганического соединения, используемого на стадии (1). Количество воды, необходимой для отделения второй части (содержащей регенерируемое метаморфное металлорганическое соединение) от реакционной смеси разделением фаз самое большее соответствует 1 стехиометрическому количеству относительно количества металлорганического соединения, используемого на стадии (1).
На стадии (2) температура, при которой воду добавляют к реакционной смеси, полученной на стадии (1), находится в интервале от температуры (например, -20°С), при которой вода не замерзает в реакционной смеси, до 100°С, предпочтительно от 0 до 100°С, более предпочтительно от 10 до 80°С. С точки зрения удовлетворительного подавления вероятного гидролиза эфира угольной кислоты, предпочтительно устанавливать температуру воды от 10 до 50°С. Когда воду используют на стадии (2), вода может быть использована отдельно или в комбинации с растворителем, отличным от воды. В качестве растворителя, отличного от воды, предпочтительно использовать растворитель, который не реагирует с эфиром угольной кислоты. В том случае когда воду используют в форме раствора в спирте, который является тем же самым, что и второй спирт, используемый на стадии (1), отделение растворителя путем отгонки становится легким. Когда на стадии (2) используют третий спирт, чтобы провести обменную реакцию сложного эфира, предпочтительно, чтобы вода использовалась в форме раствора в спирте, который является тем же самым, что и спирт, присутствующий в реакционной смеси после обменной реакции сложного эфира.
На стадии (2), когда к реакционной смеси добавляют воду, есть вероятность, что непригодное соединение также постепенно будет подвергаться гидролизу, вызывая в результате затвердевание непригодного соединения. Таким образом, предпочтительно, чтобы после добавления воды к реакционной смеси полученная белая суспензия подвергалась фильтрации как можно быстрее после окончания затвердевания второй части, содержащей регенерируемое метаморфное металлорганическое соединение. Период времени от добавления воды до фильтрации меняется в зависимости от типов реакционноспособного металлорганического соединения и используемого спирта. Когда разделение на стадии (2) проводят при комнатной температуре, период времени находится в интервале от 30 сек до 60 мин, предпочтительно от 1 до 10 мин.
2) Способ разделения с использованием отгонки
Реакционную смесь, полученную на стадии (1), подвергают отгонке, чтобы в результате разделить реакционную смесь на первую часть, содержащую эфир угольной кислоты и непригодное соединение, и вторую часть, содержащую регенерируемое метаморфное металлорганическое соединение. И эфир угольной кислоты, и непригодное соединение имеют температуру кипения ниже, чем температура кипения регенерируемого метаморфного металлорганического соединения. Следовательно, отгонка может быть проведена любым обычным способом. Например, отгонка может быть осуществлена отгонкой при давлении выше атмосферного, отгонкой при пониженном давлении, отгонкой при нагревании, отгонкой в тонком слое и диффузионным испарением с использованием мембраны, причем каждый из этих способов хорошо известен в данной области.
Температура, используемая для отгонки, особенно не ограничена, до тех пор пока непригодное соединение имеет давление паров при этой температуре; однако температура предпочтительно составляет от -20 до 300°С. С точки зрения минимизации потерь эфира угольной кислоты, содержащегося в реакционной массе, обусловленных указанной выше обратной реакцией, более предпочтительно, чтобы температура, используемая для отгонки, составляла от -20 до 200°С. Для регулирования используемой для отгонки температуры отгонка может быть проведена или под давлением выше атмосферного или при пониженном давлении. Кроме того, отгонка может быть проведена или непрерывным способом, или периодически.
Отделение эфира угольной кислоты от первой части (содержащей эфир угольной кислоты и нерегенерируемое инертное соединение), полученной на стадии (2), может быть легко осуществлено любыми обычными способами, такими как адсорбция, перегонка, фильтрация и разделение через мембрану.
Стадия (3) представляет собой стадию синтеза (регенерации) реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод. Соединение во второй части, полученной на стадии (2), обычно находится в форме прозрачной или непрозрачной жидкости. Например, вторая часть не содержит оксид дибутилолова в форме твердого вещества (следует отметить, что оксид дибутилолова не проявляет растворимости почти во всех органических растворителях при комнатной температуре (20°С) и, следовательно, при таких условиях находится в форме твердого вещества). Структура соединения во второй части еще недостаточно идентифицирована. Однако неожиданно было установлено, что при проведении стадии (3) способа настоящего изобретения можно получить реакционноспособное металлорганическое соединение, имеющее в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, такое как металлорганическое соединение, представленное формулой (1), или металлорганическое соединение, представленное формулой (2).
Стадия (3) включает взаимодействие второй части (реакционной смеси), полученной на стадии (2), с первым спиртом с образованием второй смеси металлорганического соединения и воды, и удаление воды из второй смеси металлорганического соединения, где вторая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из реакционноспособного металлорганического соединения. Если желательно, способ настоящего изобретения может дополнительно включать после стадии (3) стадию (4), на которой вторую смесь металлорганического соединения, полученную на стадии (3), выделяют и рециркулируют на стадию (1).
Примерами первых спиртов, используемых на стадии (3), являются спирты, приведенные выше. Если желательно, то до использования любого из упомянутых выше спиртов может быть проведена перегонка спирта для его очистки или регулирования концентрации спирта. С этой точки зрения, предпочтительно использовать спирт, имеющий температуру кипения 300°С или ниже, измеренную при атмосферном давлении. С точки зрения легкости удаления воды на стадии (3), более предпочтительно использовать, по меньшей мере, один спирт, выбранный из группы, включающей 1-бутанол, 2-метил-1-пропанол, алкиловый спирт, содержащий пять или более атомов углерода, и аралкиловый спирт, содержащий пять или более атомов углерода.
Что касается структуры реакционноспособного металлорганического соединения, полученного с использованием многоатомного спирта в качестве первого спирта на стадии (3), то существенного ограничения не существует. Например, металлорганическое соединение может содержать, по меньшей мере, один компонент, выбранный из группы, включающей поперечно сшитый продукт металлорганического соединения, представленного формулой (1), и поперечно сшитый продукт металлорганического соединения, представленного формулой (2).
Количество первого спирта, используемого на стадии (3), предпочтительно составляет от 1 до 10000, более предпочтительно от 2 до 100 стехиометрических количеств относительно стехиометрического количества реакционноспособного металлорганического соединения, используемого на стадии (1). Когда последовательность стадий (1)-(4) повторяют один или несколько раз, иногда возможно, чтобы спирт присутствовал во второй части, полученной на стадии (2). В таких случаях подходящее количество спирта может быть добавлено ко второй части так, чтобы количество спирта во второй части попадало в указанный выше интервал количества первого спирта. С другой стороны, спирт, присутствующий во второй части, может быть удален.
Удаление воды на стадии (3) может быть проведено любым обычным способом. Например, удаление воды на стадии (3) может быть проведено отгонкой, использованием дегидратирующей колонны, наполненной твердым дегидратирующим материалом (таким как молекулярные сита), и способом с использованием мембранного разделения (таким как диффузионное испарение через мембрану). Из них отгонка и способ с использованием мембранного разделения (такого как диффузионное испарение через мембрану) являются предпочтительными. Также хорошо известно, что диффузионное испарение может быть использовано для удаления воды в спирте. В настоящем изобретении диффузионное испарение через мембрану может быть использовано для удаления воды в спирте. В настоящем изобретении предпочтительно может быть использовано диффузионное испарение через мембрану. В случае спирта, имеющего температуру кипения выше, чем температура кипения воды, удаление воды в спирте также может быть легко осуществлено путем отгонки воды при нагревании. С другой стороны, в случае спирта, имеющего температуру кипения ниже, чем температура кипения воды, удаление воды в спирте также может быть осуществлено с помощью методики отгонки, при которой используется растворитель, образующий азеотропную смесь с водой. Как указывалось выше, удаление воды в спирте может быть осуществлено любым способом с использованием твердого дегидратирующего агента, отгонкой и мембранным разделением. Однако когда желательно получить вторую смесь металлорганического соединения в большом количестве за короткий период времени, предпочтительно, чтобы удаление воды в спирте проводилось путем отгонки. Отгонка может быть проведена любым обычным способом. Например, отгонка может быть проведена отгонкой при атмосферном давлении, отгонкой при пониженном давлении, отгонкой при давлении, выше атмосферного, отгонкой в тонком слое и экстрактивной отгонкой, каждая из которых хорошо известна в данной области. Отгонка может быть проведена при температуре от -20°С до температуры кипения первого спирта, используемого на стадии (3). Предпочтительно, чтобы температура отгонки составляла от 50°С до температуры кипения первого спирта, используемого на стадии (3). До или во время отгонки может быть добавлено любое желаемое вещество во вторую часть второй части реакционной смеси. Вторая часть реакционной смеси может содержать, например, растворитель, который образует азеотропную смесь с водой с точки зрения легкости удаления воды на стадии (3); или растворитель, который усиливает гидрофобные свойства второй части реакционной смеси с тем, чтобы парожидкостное равновесие воды, полученной по реакции на стадии (3), становилось выгодным. Кроме того, вторая часть реакционной смеси может содержать растворитель, который регулирует текучесть второй части реакционной смеси.
Температура, используемая в случае реакции, проводимой на стадии (3), меняется в зависимости от типа используемого первого спирта; однако температура обычно находится в интервале от комнатной температуры (приблизительно 20оС) до 300оС. Когда удаление воды на стадии (3) проводят путем отгонки, температура, используемая в случае отгонки, особенно не ограничена до тех пор, пока вода имеет давление паров при этой температуре. Когда предполагается завершить реакцию на стадии (3) за короткий промежуток времени при атмосферном давлении, предпочтительно, чтобы отгонка проводилась в условиях, когда температура паров, полученных при отгонке, представляет собой азеотропную температуру воды и первого спирта. Когда вода и первый спирт не образуют азеотропную смесь, предпочтительно, чтобы отгонка проводилась при температуре кипения воды. Когда предполагается завершить реакцию на стадии (3) за короткий период времени, отгонка может быть проведена с использованием автоклава при температуре выше, чем температура кипения первого спирта или воды, при постепенном удалении воды в паровой фазе. Когда температура, используемая в случае реакции, проводимой на стадии (3), является исключительно высокой, иногда возможно протекание реакции термического разложения металлорганического соединения. В таких случаях жидкость, содержащая воду, может быть удалена с помощью отгонки при пониженном давлении или другим подобным способом.
Даже когда первый спирт не образует азеотропную смесь с водой, вода может быть удалена азеотропной отгонкой, при которой используют растворитель, образующий азеотропную смесь с водой. Этот способ предпочтителен, так как вода может быть удалена при низкой температуре. Примерами растворителей, которые образуют азеотропную смесь с водой, являются ненасыщенные и насыщенные углеводороды, такие как гексан, бензол, толуол, ксилол, нафталин; простые эфиры, такие как анизол и 1,4-диоксан; и галогенированные углеводороды; такие как хлороформ.
С точки зрения облегчения отделения воды от азеотропной смеси после азеотропной отгонки предпочтительно использовать в качестве растворителя ненасыщенный или насыщенный углеводород, в котором вода имеет низкую растворимость. При использовании растворителя его необходимо использовать в таком количестве, чтобы вода могла быть удовлетворительно удалена азеотропной отгонкой. Предпочтительно использовать дистилляционную колонну для азеотропной перегонки, так как растворитель может быть рециркулирован в реакционную систему после отделения растворителя от азеотропной смеси в дистилляционной колонне, и, следовательно, количество растворителя может быть уменьшено до относительно небольшого количества.
При проведении реакции на стадии (3) может быть получена, например, смесь металлорганического соединения, содержащая, по меньшей мере, одно реакционноспособное металлорганическое соединение, выбранное из группы, включающей металлорганическое соединение, представленное формулой (1), и металлорганическое соединение, представленное формулой (2).
Когда реакция на стадии (3) достигает фазы, где вода почти не образуется, стадия (3) может быть завершена. Когда последовательность стадий (1)-(4) повторяют один или несколько раз, количество эфира угольной кислоты, полученное на стадии (1), меняется в зависимости от количества воды, которое удалено на стадии (3). Следовательно, предпочтительно, чтобы количество воды, удаленной на стадии (3), было как можно больше.
Обычно количество воды, удаленной на стадии (3), составляет от 0,01 до 1 от количества воды, полученной по реакции на стадии (3), где количество воды, получаемой теоретически, рассчитывают на основе допущения, что только металлорганическое соединение, представленное формулой (1), образуется по реакции на стадии (3). Во многих случаях количество воды, удаленной на стадии (3), составляет менее чем 1 от упомянутого выше теоретического количества воды, образованного по реакции на стадии (3). В результате проведенных заявителями настоящего изобретения исследований установлено, что, когда металлорганическое соединение образуется из оксида дибутилолова и спирта и последовательность стадий (1)-(4) повторяется один или несколько раз, количество воды, удаленное на стадии (3), меньше количества воды, образующейся во время реакции, при которой реакционноспособное металлорганическое соединение образуется из оксида дибутилолова и спирта. Когда на стадии (2) к реакционной системе добавляют воду для разделения первой части, содержащей эфир угольной кислоты и непригодное соединение, иногда возможно образование белого твердого вещества, содержащего воду, и количество воды, удаленной на стадии (3), составляет больше 1 от приведенного выше теоретического количества воды, полученной реакцией на стадии (3). Когда последовательность стадий (1)-(4) повторяют один или несколько раз, трудно рассчитать теоретическое количество воды, образующейся по реакции на стадии (3), так как структура регенерируемого метаморфного металлорганического соединения, содержащегося в реакционной смеси, полученной на стадии (1), еще недостаточно идентифицирована. В этом случае измеряют изменение (со временем) количества удаляемой воды. Когда с помощью такого измерения подтверждается, что вода больше не удаляется, стадия (3) может быть завершена.
По окончании стадии (3), если желательно, может быть удалено избыточное количество спирта. С точки зрения улучшенной чистоты эфира угольной кислоты, полученного на стадии (1), в случае когда последовательность стадий (1)-(4) повторяется один или несколько раз, предпочтительно удалять избыточное количество спирта. Когда некоторые спирты, используемые на стадии (3), используются на стадии (1), в том случае, когда последовательность стадий (1)-(4) повторяется один или несколько раз, удаление спирта после стадии (3) можно не проводить. Кроме того, соответствующее количество спирта может быть добавлено к реакционной системе после стадии (3).
Удаление избыточного количества спирта может быть осуществлено следующим образом. Когда вторая смесь металлорганического соединения, полученная на стадии (3), находится в форме твердого вещества, спирт может быть удален в виде фильтрата, полученного фильтрацией. С другой стороны, когда вторая смесь металлорганического соединения, полученная на стадии (3), находится в форме жидкости, удаление спирта может быть осуществлено путем отгонки при пониженном давлении, или с помощью способа, в котором инертный газ, такой как азот, вводят в реактор с тем, чтобы спирт удалялся в количестве, которое соответствует давлению паров спирта. В случае использования инертного газа, когда инертный газ высушен не полностью, по-видимому, может проявляться такой недостаток, когда вторая смесь металлорганического соединения гидролизуется и разлагается до оксида металла и спирта так, что количество эфира угольной кислоты, полученного реакцией на стадии (1), в случае когда последовательность стадий (1)-(4) повторяется один или несколько раз, становится исключительно низким. Стадии (1)-(3) могут быть проведены или периодически или ступенчато.
Как описано выше, если желательно, то стадии (1) и (2) могут быть проведены одновременно. Кроме того, если желательно, то стадии (2) и (3) могут быть проведены одновременно. Кроме того, стадии (1)-(3) также могут быть проведены одновременно. Также когда способ настоящего изобретения повторяется один или несколько раз, если желательно, то стадия (3) и стадия (1) последующего цикла могут быть осуществлены одновременно. Что касается случаев одновременного проведения этих стадий, то объяснения приведены ниже.
(Вариант, когда стадии (1) и (2) проводят одновременно)
Что касается реакции, проводимой на стадии (1), то существуют два случая: один (первый случай) представляет собой вариант, где при проведении реакции на стадии (1) присутствуют жидкая фаза и паровая фаза, и другой (второй случай) представляет собой вариант, когда диоксид углерода находится в сверхкритическом состоянии в условиях высокой температуры и высокого давления, и реакционная смесь образует гомогенную смесь. Стадии (1) и (2) могут быть проведены одновременно в первом случае. В первом случае температура реакции и реакционное давление меняются в зависимости от типа алкоксигруппы, содержащейся в реакционноспособном металлорганическом соединении, и типа спирта, когда спирт используется. Однако температура реакции обычно составляет 200°С или ниже, а реакционное давление составляет 8 МПа или менее. Эфир угольной кислоты имеет высокую растворимость в диоксиде углерода и, следовательно, часть эфира угольной кислоты растворяется в паровой фазе. Таким образом, при проведении реакции на стадии (1) с выведением части паровой фазы первая часть (содержащая эфир угольной кислоты и нерегенерируемое инертное соединение) может быть отделена от реакционной смеси.
(Вариант, когда стадии (2) и (3) проводят одновременно)
Стадии (2) и (3) могут быть проведены одновременно, когда реакционноспособное металлорганическое соединение получают из спирта, имеющего температуру кипения выше, чем температура кипения воды, и С1-С3-алкиловый спирт используется на стадии (1) или (2). Отделение эфира угольной кислоты, непригодного соединения и воды от реакционной смеси может быть осуществлено способом, в котором реакционную смесь, полученную на стадии (1), помещают в поток инертного газа, такого как газообразный диоксид углерода, удаляя в результате эфир угольной кислоты, непригодное соединение и воду из реакционной смеси в форме захваченных инертным газом. Отделение эфира угольной кислоты, непригодного соединения и воды из реакционной смеси также может быть осуществлено обычным способом, таким как разделение через мембрану. С помощью такого способа эфир угольной кислоты, непригодное соединение и вода могут непрерывно отделяться от реакционной смеси.
(Вариант, когда стадии (1)-(3) проводят одновременно)
Что касается реакции, проводимой на стадии (1), то существует два случая: один (первый случай) представляет собой вариант, где при проведении реакции на стадии (1) присутствуют жидкая фаза и паровая фаза, и другой (второй случай) представляет собой вариант, когда диоксид углерода находится в сверхкритическом состоянии в условиях высокой температуры и высокого давления и реакционная смесь образует гомогенную смесь. Стадии (1)-(3) могут быть проведены одновременно в случае, когда при проведении реакции на стадии (1) присутствует жидкая фаза и паровая фаза, реакционноспособное металлорганическое соединение получено из спирта, имеющего температуру кипения выше, чем температура кипения воды, и используется С1-С3-алкиловый спирт (предпочтительно метанол или этанол). В этом случае температура реакции и реакционное давление меняются в зависимости от типа алкоксигруппы, содержащейся в реакционноспособном металлорганическом соединении, и типа спирта, когда спирт используется. Однако температура реакции обычно составляет 150°С или менее, и реакционное давление обычно составляет 5 МПа и менее. Вода, эфир угольной кислоты и непригодное соединение имеют высокую растворимость в диоксиде углерода и, следовательно, часть воды, эфира угольной кислоты и непригодного соединения растворена в паровой фазе. Следовательно, при проведении реакции на стадии (1) с удалением части паровой фазы эфир угольной кислоты и непригодное соединение могут быть отделены от реакционной смеси с регенерацией металлорганического соединения. Кроме того, также возможно использование способа, в котором реакцию проводят в реакторе с неподвижным слоем, содержащем смесь металлорганического соединения, где смесь металлорганического соединения нанесена на носители или находится в форме твердого вещества. В таком способе диоксид углерода и С1-С3-спирт вводят в реактор с неподвижным слоем, получая в результате эфир угольной кислоты, непригодное соединение и воду в форме захваченных газообразным диоксидом углерода. В качестве носителя для нанесения смеси металлорганического соединения может быть использован обычный носитель.
(Вариант, где стадию (3) и стадию (1) последующего цикла проводят одновременно, если способ настоящего изобретения повторяют один или несколько раз)
Когда способ настоящего изобретения повторяют один или несколько раз, стадия (3) и стадия (1) последующего цикла могут быть проведены одновременно способом, на котором стадию (3) проводят в атмосфере или в присутствии газообразного диоксида углерода. То есть стадия (3) и стадия (1) последующего цикла могут быть проведены одновременно способом, в котором вторую часть (реакционной смеси), полученную на стадии (2), вводят в реакцию с первым спиртом, чтобы регенерировать (повторно синтезировать) реакционноспособное металлорганическое соединение и получить воду, и регенерированное реакционноспособное металлорганическое соединение вводят в реакцию с диоксидом углерода, получая в результате эфир угольной кислоты, где полученную воду удаляют. Стадия (3) и стадия (1) последующего цикла могут быть проведены одновременно в случае, когда в реакционной системе присутствуют жидкая фаза и паровая фаза. В этом случае температура реакции и реакционное давление могут меняться в зависимости от типа алкоксигруппы, содержащейся в реакционноспособном металлорганическом соединении, и типа используемого спирта. Однако температура реакции обычно составляет 200°С или менее и реакционное давление составляет 1 МПа или менее. Предпочтительно, чтобы стадию (3) и стадию (1) последующего цикла проводили одновременно путем взаимодействия реакционноспособного металлорганического соединения с диоксидом углерода в присутствии спирта, имеющего температуру кипения выше, чем 100°С (при измерении при атмосферном давлении) в условиях, когда температура реакции равна или ниже, чем температура кипения спирта, а давление находится в интервале от атмосферного давления до 0,5 МПа. Более предпочтительно, чтобы стадию (3) и стадию (1) последующего цикла проводили одновременно способом, при котором газообразный диоксид углерода вводят во вторую реакционную смесь с тем, чтобы образовавшуюся воду выводить из реакционной системы в форме захваченной газообразным диоксидом углерода.
Как упоминалось выше, способ настоящего изобретения также может включать после стадии (3) стадию (4), на которой вторую смесь металлорганического соединения, полученную на стадии (3), выделяют и рециркулируют на стадию (1). Последовательность стадий (1)-(4) может быть повторена один или несколько раз. До рецикла металлорганического соединения на стадию (1) металлорганическое соединение может быть охлаждено или нагрето. Стадия (4) может быть проведена или непрерывным или периодическим способом.
На стадии (3), когда реакцию второй части реакционной смеси с первым спиртом проводят при высокой температуре или в течение продолжительного периода времени, появляется проблема в том, что в большом количестве образуется непригодное соединение. Кроме того, предпочтительно, чтобы реакция на стадии (3) проводилась при условиях, при которых образование непригодного соединения подавлялось бы как можно в большей степени. Непригодное соединение (то есть нерегенерируемое инертное соединение) образуется за счет реакции диспропорционирования, которая имеет место, когда металлорганические соединения, представленные формулами (1) и (2), нагревают. В атмосфере диоксида углерода такая реакция диспропорционирования развивается медленно и, следовательно, нерегенерируемое инертное соединение образуется главным образом на указанной стадии (3). Что касается непригодного соединения, образованного и накопленного до реакции стадии (3), и непригодного соединения, образующегося во время реакции стадии (3), то такие непригодные соединения могут быть удалены из реакционной системы на стадии (3). Причина состоит в том, что непригодное соединение, представленное выше формулой (6), имеет температуру кипения ниже, чем температура кипения реакционноспособного металлорганического соединения, полученного реакцией на стадии (3). Удаление непригодного соединения из реакционной системы на стадии (3) может быть осуществлено обычным способом, таким как отгонка или разделение через мембрану. Например, отгонка может быть предпочтительно проведена отгонкой при давлении выше атмосферного, отгонкой при пониженном давлении, отгонкой при нагревании и отгонкой в тонком слое. Разделение через мембрану может быть предпочтительно проведено, например, диффузионным испарением с использованием мембраны. С точки зрения минимизации числа стадий применяемого способа удаления более предпочтительно, чтобы удаление непригодного соединения проводилось способом, в котором после удаления воды на стадии (3) непригодное соединение отгоняют при сильно пониженном давлении. Температура, используемая при отгонке, не имеет особенных ограничений до тех пор, пока непригодное соединение имеет давление паров при этой температуре; однако температура предпочтительно находится в интервале приблизительно от 20 до 300°С. Когда отгонку проводят при нагревании при высокой температуре, существует опасность, что количество образовавшегося непригодного соединения дополнительно увеличивается. Следовательно, более предпочтительно, чтобы температура, используемая при отгонке, находилась в интервале от 20 до 200°С.
В способе настоящего изобретения иногда образуется твердое непригодное соединение (отличное от упомянутого выше нерегенерируемого инертного соединения), которое имеет в своей молекуле, по меньшей мере, три связи металл-углерод. Полагают, что такое твердое непригодное соединение образуется в результате реакции диспропорционирования продукта, который образуется в качестве двойника нерегенерируемого инертного соединения, имеющего в своей молекуле, по меньшей мере, три связи металл-углерод. В качестве примера такого твердого непригодного соединения можно упомянуть оксид металла, такой как оксид титана или оксид олова. Такие твердые непригодные соединения могут быть легко удалены из реакционной системы фильтрацией. На стадии (1), стадии (2) (в случае, когда вода не используется) и стадии (3) реакционная смесь обычно присутствует в форме гомогенной жидкости. Следовательно, когда твердое непригодное соединение выпадает в осадок в реакционной системе в результате повторяющегося использования металлорганического соединения, твердое непригодное соединение может быть уделено фильтрацией. Фильтрацию можно осуществить любыми обычными способами. Например, фильтрацию можно провести как фильтрацию при атмосферном давлении, фильтрацию при пониженном давлении, фильтрацию при давлении выше атмосферного и центрифугирование. Когда воду вводят в реакционную систему во время фильтрации, существует опасность, что полезное металлорганическое соединение будет гидролизоваться и станет твердым. Следовательно, для предупреждения удаления полезного металлорганического соединения вместе с твердым непригодным соединением предпочтительно, чтобы фильтрацию проводили с большой осторожностью с тем, чтобы подавить гидролиз металлорганического соединения.
Ниже приведены объяснения, касающиеся реакционных сосудов, используемых в способе настоящего изобретения.
Что касается типа реакционного сосуда, используемого на каждой стадии (1), (2) и (3), то особенных ограничений не существует и может быть использован любой обычный реакционный сосуд. Примерами обычных реакционных сосудов являются реактор смешения, многоступенчатый реактор смешения и многоступенчатая дистилляционная колонна непрерывного действия. Такие реакционные сосуды могут быть использованы отдельно или в комбинации. Используя, по меньшей мере, один из названных выше реакционных сосудов, стадии (1)-(3) могут быть проведены периодическим или непрерывным методом. То есть что касается стадий (1) и (3), то с точки зрения эффективного смещения равновесия реакции в направлении системы продуктов, предпочтительно использование многоступенчатой дистилляционной колонны. Более предпочтительно, чтобы каждая из стадий (1) и (3) проводилась непрерывно с использованием многоступенчатой дистилляционной колонны.
Что касается многоступенчатой дистилляционной колонны, то не существует особенных ограничений, пока колонна представляет собой дистилляционную колонну, которая имеет две или несколько теоретических стадий и которая способна обеспечить непрерывную отгонку. В качестве такой многоступенчатой дистилляционной колонны может быть использована любая обычная многоступенчатая дистилляционная колонна, которая обычно используется в данной области техники. Примерами таких многоступенчатых дистилляционных колонн являются колонна тарелочного типа, использующая тарелки, такие как колпачковая тарелка, сетчатая тарелка, клапанная тарелка; и насадочные колонны, заполненные любым из различных типов насадок, таких как кольцо Рашига, кольцо Лессинга, кольцо Палля, седло Берля, седло «Инталокс», насадка Диксона, насадка Мак-Магона, насадка Хели, насадка Зульцера и Mellapak. Кроме того, также предпочтительно можно использовать смешанный тип тарелочной колонны и насадочной колонны, которая содержит как тарелочную часть, так и насадочную часть с насадкой.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже настоящее изобретение описано более подробно с помощью следующих примеров, которые не следует рассматривать как ограничивающие объем настоящего изобретения.
Методы анализа
(1) Анализ металлорганического соединения с помощью ядерного магнитного резонанса (ЯМР)
Прибор: система JNM-A400 для ЯМР с преобразованием Фурье (производится и продается JEOL Ltd., Япония)
Приготовление растворов образцов для проведения 1Н-, 13С- и 119Sn-ЯМР:
Взвешивают приблизительно от 0,1 до 1 г реакционной смеси, и затем добавляют 0,05 г тетраметилолова и приблизительно 0,85 г дейтерированного хлороформа, в результате получают раствор образца для проведения анализа с помощью ЯМР.
(2) Анализ эфира угольной кислоты с помощью газовой хроматографии (ГХ)
Прибор: система GC-2010 (производится и продается Shimadzu Corporation, Япония)
(i) Получение раствора образца
Взвешивают 0,06 г реакционной смеси и затем добавляют приблизительно 2,5 мл дегидратированного диметилформамида или дегидратированного ацетонитрила. Затем к полученному раствору добавляют приблизительно 0,06 г дифенилового эфира в качестве внутреннего стандарта, получая в результате образец раствора для ГХ анализа.
(ii) Условия ГХ анализа
Колонка: DB-1 (производится и продается J&W Scientific, США)
Жидкая фаза: 100% диметилполисилоксана
Длина колонки: 30 м
Диаметр колонки: 0,25 мм
Толщина пленки: 1 мкм
Температура колонки: температуру повышают от 50 до 300°С со скоростью 10°С/мин
Температура ввода: 300°С
Температура детектора: 300°С
Детектор: FID (пламенно-ионизационный детектор).
(iii) Количественный анализ
Количественный анализ образца раствора проводят с использованием калибровочной кривой, полученной относительно стандартных образцов.
(3) Расчет выхода эфира угольной кислоты (то есть диалкилкарбоната)
Выход диалкилкарбоната выражают в значениях мольных % диалкилкарбоната из расчета на мольное количество металлорганического соединения, используемого на стадии (1), где количество металлорганического соединения выражено в значениях количества атома металла, содержащегося в нем.
Пример 1
Вначале синтезируют реакционноспособное металлорганическое соединение, содержащее 2-этилгексилоксигруппу, из оксида дибутилолова и 2-этил-1-гексанола следующим образом.
В четырехгорлую колбу объемом 1 л, снабженную холодильником, термометром (для измерения внутренней температуры в колбе), вакуумным насосом и регулятором вакуума (производится и продается Okano Works, Ltd., Japan), загружают 249 г (1,0 моль) оксида дибутилолова (производится и продается Aldrich, США), 650 г (5,0 моль) 2-этил-1-гексанола (производится и продается Aldrich, США, марка - обезвоженный). Затем в колбу помещают мешалку. Колбу погружают в масляную баню. Колбу продувают газообразным азотом. Затем начинают перемешивать содержимое колбы при нагревании. Когда внутренняя температура в колбе достигает 172°С, давление в колбе постепенно понижают с выведением дистиллята (то есть воды и 2-этил-1-гексанола) из колбы с помощью линии продувки и реакцию проводят в течение приблизительно 7 час. За счет понижения давления в колбе давление в колбе в конечном итоге понижается приблизительно до 28 кПа. Когда дистиллят почти до конца выведен из колбы, колбу вынимают из масляной бани и внешнюю сторону колбы охлаждают. Затем в колбу вводят газообразный азот для повышения давления в колбе до атмосферного давления. С помощью описанных выше операций получают 410 г вязкой жидкости.
Дистиллят, отобранный из колбы, анализируют. В результате установлено, что дистиллят содержит приблизительно 13 г воды. Полученную вязкую жидкость анализируют с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. В результате установлено, что вязкая жидкость содержит 1,1,3,3-тетрабутил-1,3-ди(2-этилгексилокси)дистанноксан, ди(2-этилгексилоксид) дибутилолова и 2-этилгексилоксид трибутилолова.
Стадия (1)
В автоклав объемом 500 мл (производится и продается Toyo Koatsu Co., Ltd., Япония), который имеет баллон с газообразным диоксидом углерода, присоединенный к нему с помощью SUS-трубки и вентиля, загружают 404 г полученной выше вязкой жидкости. Автоклав герметично закрывают, атмосферу в автоклаве продувают с помощью газообразного азота. Затем упомянутый выше вентиль открывают, чтобы ввести в автоклав газообразный диоксид углерода, имеющий давление 4 МПа. Введение газообразного диоксида углерода в автоклав проводят в течение 10 мин при перемешивании содержимого автоклава и затем останавливают, закрыв вентиль баллона с диоксидом углерода. Затем внутреннюю температуру в автоклаве повышают до 120°С при перемешивании. Затем проводят реакцию в течение 3 час при поддержании внутреннего давления в автоклаве при 4 МПа с помощью обратного клапана баллона с диоксидом углерода. По окончании реакции внешнюю сторону автоклава охлаждают приблизительно до 30°С и газообразный диоксид углерода мягко выдувают из автоклава через линию продувки с понижением давления в автоклаве до атмосферного давления, получая в результате прозрачную жидкость в качестве реакционной смеси. Установлено, что выход ди(2-этилгексил)карбоната составляет 25%. Реакционную смесь анализируют с помощью спектров 1Н-, 13С- и 119Sn-ЯМР. В результате подтверждено, что реакционная смесь содержит 2-этилгексилоксид трибутилолова и его аддукт с диоксидом углерода в суммарном количестве приблизительно 0,1% моль. Два названных соединения представляют собой нерегенерируемые инертные соединения.
Стадия (2)
После стадии (1) устройство для перегонки в тонком слое (Е-420, производится и продается Shibata Scientific Technology Ltd., Япония), имеющее внутреннюю температуру 130°С и внутреннее давление приблизительно 65 Па, присоединяют к автоклаву с помощью жидкостного насоса (LC-10AT, производится и продается Shimadzu Corporation, Япония), и проводят отгонку следующим образом. Приблизительно 120 г реакционной смеси, полученной на стадии (1), загружают в устройство для перегонки в тонком слое через жидкостной насос при подаче 3 г/мин, чтобы отогнать летучее вещество из реакционной смеси, после чего следует охлаждение, в результате выделяют приблизительно 14 г летучего вещества в жидкой форме. Установлено, что приблизительно 50% ди(2-этилгексил)карбоната, содержащегося в реакционной смеси, загруженной в устройство для перегонки в тонком слое, отогнано в виде летучего вещества. Летучее вещество анализируют в жидкой форме с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. В результате подтверждено, что летучее вещество в жидкой форме содержит приблизительно 0,02 моль. 2-этилгексилоксида трибутилолова.
Стадия (3)
В четырехгорлую колбу объемом 300 мл, снабженную охлаждающей трубкой, термометром (для измерения внутренней температуры в колбе), вакуумным насосом и регулятором вакуума (производится и продается Okano Works, Ltd., Japan), загружают приблизительно 100 г остатка после отгонки, полученного с помощью описанной выше отгонки, 5 г (приблизительно 2 ммоль) оксида дибутилолова (производится и продается Aldrich, США) и 216 г (1,7 моль) 2-этил-1-гексанола (производится и продается Aldrich, США, марка - обезвоженный). Затем в колбу помещают мешалку. Колбу погружают в масляную баню. Колбу продувают газообразным азотом. Затем начинают перемешивание содержимого колбы при нагревании. Когда внутренняя температура в колбе достигает 172°С, давление в колбе постепенно понижают, отбирая дистиллят (то есть воду и 2-этил-1-гексанол) из колбы с помощью линии продувки, и реакцию проводят в течение приблизительно 7 час. За счет понижения давления давление в колбе в конечном итоге понижается приблизительно до 28 кПа. Когда дистиллят почти до конца выведен из колбы, колбу вынимают из масляной бани и внешнюю сторону колбы охлаждают. Затем в колбу вводят газообразный азот для повышения давления в колбе до атмосферного давления. С помощью описанных выше операций получают вязкую жидкость.
Полученную вязкую жидкость анализируют с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. В результате установлено, что вязкая жидкость содержит 1,1,3,3-тетрабутил-1,3-ди(2-этилгексилокси)дистанноксан, ди(2-этилгексилоксид) дибутилолова и 2-этилгексилоксид трибутилолова. Из этих трех соединений первые два соединения представляют собой регенерируемые метаморфные металлорганические соединение и, по меньшей мере, одно соединение представляет собой нерегенерируемое инертное соединение.
Вязкую жидкость, полученную выше на стадии (3), выделяют и рециркулируют на стадию (1), и стадию (1) проводят следующим образом.
В автоклав объемом 100 мл (производится и продается Toyo Koatsu Co., Ltd., Япония), который имеет баллон с газообразным диоксидом углерода, присоединенный к нему с помощью SUS-трубки и вентиля, загружают 79 г полученной выше вязкой жидкости. Автоклав герметично закрывают и автоклав продувают с помощью газообразного азота. Затем упомянутый выше вентиль открывают, чтобы ввести в автоклав газообразный диоксид углерода, имеющий давление 4 МПа. Введение газообразного диоксида углерода в автоклав проводят в течение 10 мин при перемешивании содержимого автоклава, и затем останавливают, закрыв вентиль баллона с диоксидом углерода. Затем внутреннюю температуру в автоклаве повышают до 120°С при перемешивании. Затем проводят реакцию в течение 3 час при поддержании внутреннего давления в автоклаве при 4 МПа с помощью обратного клапана баллона с диоксидом углерода. По окончании реакции внешнюю сторону автоклава охлаждают приблизительно до 30°С и газообразный диоксид углерода мягко выдувают из автоклава через линию продувки до понижения давления в автоклаве до атмосферного давления, получая в результате прозрачную жидкость в качестве реакционной смеси. Установлено, что выход ди(2-этилгексил)карбоната составляет 25%.
После стадии (1) устройство для перегонки в тонком слое (Е-420, производится и продается Shibata Scientific Technology Ltd., Япония), имеющее внутреннюю температуру 130°С и внутреннее давление приблизительно 65 Па, присоединяют к автоклаву с помощью жидкостного насоса (LC-10AT, производится и продается Shimadzu Corporation, Япония), и проводят отгонку следующим образом. Приблизительно 25 г реакционной смеси, полученной на стадии (1), загружают в устройство для перегонки в тонком слое с помощью жидкостного насоса при скорости 3 г/мин, чтобы отогнать летучее вещество из реакционной смеси, после чего следует охлаждение, в результате выделяют приблизительно 14 г летучего вещества в жидкой форме. Установлено, что приблизительно 50% ди(2-этилгексил)карбоната, содержащегося в реакционной смеси, загруженной в устройство для перегонки в тонком слое, отгоняется в виде летучего вещества. Летучее вещество анализируют в жидкой форме с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. В результате подтверждено, что летучее вещество в жидкой форме содержит приблизительно 0,005 моль. 2-этилгексилоксида трибутилолова.
Пример 2
Синтез металлорганического соединения, содержащего гексилоксигруппу, из оксида дибутилолова и гексанола проводят следующим образом.
В автоклав объемом 200 мл (производится и продается Toyo Koatsu Co., Ltd., Япония) загружают 24,9 г (100 ммоль) оксида дибутилолова (производится и продается Aldrich, США) и 51,1 г (500 ммоль) гексанола (производится и продается Aldrich, США, марка - обезвоженный). Автоклав герметично закрывают и атмосферу в автоклаве продувают с помощью газообразного азота. Затем начинают перемешивание содержимого автоклава и внутреннюю температуру в автоклаве повышают до 160°С. Затем перемешивание продолжают в течение приблизительно 30 мин. Вентиль линии продувки автоклава открывают и воду и гексанол отгоняют через линию продувки в течение 4 час, вдувая небольшое количество азота в нижнюю часть автоклава. После этого периода времени дистиллят почти отсутствует. Внешнюю сторону автоклава охлаждают приблизительно до 30°С, получают вязкую реакционную массу. Проводят анализ реакционной смеси с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. Анализ с помощью ЯМР показывает, что вязкая реакционная смесь содержит приблизительно 40 ммоль 1,1,3,3-тетрабутил-1,3-дигексилоксидистанноксана, приблизительно 6 ммоль дигексилоксида дибутилолова и приблизительно 4 ммоль гексилоксида трибутилолова.
Стадия (1)
В описанный выше автоклав объемом 200 мл, содержащий реакционную смесь (содержащую металлорганическое соединение, имеющее гексилоксигруппу), загружают 61,5 г (602 ммоль) гексанола (производится и продается Aldrich, США, марка - обезвоженный) и автоклав герметично закрывают. Затем из баллона с газообразным диоксидом углерода, который соединен с автоклавом посредством SUS-трубки и вентиля, в автоклав подают газообразный диоксид углерода, имеющий давление 5 МПа. Начинают перемешивание содержимого автоклава. Через 10 мин после начала перемешивания вентиль баллона с газообразным диоксидом углерода закрывают. Далее внутреннюю температуру в автоклаве повышают до 180°С, продолжая перемешивание. В этом случае внутреннее давление в автоклаве составляет приблизительно 7,5 мПа. Затем реакцию проводят в течение 6 час, поддерживая внутреннее давление в автоклаве приблизительно при 7,5 МПа. Внешнюю сторону автоклава охлаждают приблизительно до 30°С и внутреннее давление в автоклаве понижают до атмосферного путем мягкой отдувки газообразного диоксида углерода, получают в результате прозрачную жидкость. В реакционной смеси получен дигексилкарбонат с выходом 14%.
Стадия (2)
После стадии (1) к реакционной смеси, полученной на стадии (1), осторожно добавляют 10 г гексанола, содержащего 1% воды, и полученную смесь перемешивают приблизительно 1 мин. Затем автоклав открывают. Установлено, что смесь в автоклаве превращается в белую суспензию. Белую суспензию подвергают фильтрации с использованием мембранного фильтра (Н020А142С, производится и продается Advantec Toyo Kaisha, Ltd., Япония), в результате чего получают белые твердые вещества и фильтрат. Белые твердые вещества промывают 2 раза 20 мл гексанола. Фильтрат переносят в грушевидную колбу объемом 1 л и подвергают перегонке при нагревании на масляной бане при 160°С и при пониженном давлении. Путем отгонки гексилоксид трибутилолова и дигексилкарбонат выделяют в виде дистиллята. Выход дигексилкарбоната составляет 13%. Установлено, что дистиллят содержит приблизительно 2 ммоль гексилоксида трибутилолова. С другой стороны, по окончании отгонки в колбе остается вязкая жидкость.
Стадия (3)
Белые твердые вещества, полученные на стадии (2), и остаточную вязкую жидкость, которая остается в колбе после перегонки, проведенной на стадии (2), загружают в автоклав объемом 200 мл (производится и продается Toyo Koatsu Co., Ltd., Япония). Кроме того, в автоклав загружают 51,1 г (500 ммоль) гексанола (производится и продается Aldrich, США, марка - обезвоженный) и автоклав герметично закрывают. Автоклав продувают газообразным азотом. Затем содержимое автоклава начинают перемешивать, а внутреннюю температуру в автоклаве повышают до 160°С. Затем перемешивание продолжают в течение приблизительно 30 мин. Затем линию продувки автоклава открывают и воду и гексанол отгоняют через линию продувки в течение 4 час, вдувая небольшое количество азота в нижнюю часть автоклава. После этого периода времени дистиллят почти отсутствует. Далее внешнюю сторону автоклава охлаждают приблизительно до 30°С и получают реакционную смесь. Проводят анализ реакционной смеси с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. Анализ с помощью ЯМР показывает, что реакционная смесь содержит приблизительно 40 ммоль 1,1,3,3-тетрабутил-1,3-дигексилоксидистанноксана, приблизительно 7 ммоль дигексилоксида дибутилолова и приблизительно 4 ммоль гексилоксида трибутилолова.
После стадии (3) проводят стадию (1) следующим образом.
В описанный выше автоклав, в котором проводилась стадия (3), загружают 61,5 г (602 ммоль) гексанола (производится и продается Aldrich, США, марка - обезвоженный). Автоклав герметично закрывают. Затем из баллона с газообразным диоксидом углерода, который соединен с автоклавом посредством SUS-трубки и вентиля, в автоклав подают газообразный диоксид углерода, имеющий давление 5 МПа. Начинают перемешивание содержимого автоклава. Через 10 мин после начала перемешивания вентиль баллона с газообразным диоксидом углерода закрывают. Далее внутреннюю температуру в автоклаве повышают до 180°С, продолжая перемешивание. В этом случае внутреннее давление в автоклаве составляет приблизительно 7,5 МПа. Затем реакцию проводят в течение 6 час, поддерживая внутреннее давление в автоклаве приблизительно при 7,5 МПа. Далее внешнюю сторону автоклава охлаждают приблизительно до 30°С и внутреннее давление в автоклаве понижают до атмосферного путем мягкой отдувки газообразного диоксида углерода через линию продувки, получают в результате прозрачную реакционную смесь. В реакционной смеси получен дигексилкарбонат с выходом 14%.
После стадии (1) к реакционной смеси, полученной на стадии (1), осторожно добавляют 10 г гексанола, содержащего 1% воды, и полученную смесь перемешивают приблизительно 1 мин. Затем автоклав открывают. Установлено, что смесь в автоклаве превращается в белую суспензию. Белую суспензию подвергают фильтрации с использованием мембранного фильтра (Н020А142С, производится и продается Advantec Toyo Kaisha, Ltd., Япония), в результате чего получают белые твердые вещества и фильтрат. Белые твердые вещества промывают 2 раза 20 мл гексанола. Фильтрат переносят в грушевидную колбу объемом 1 л и подвергают перегонке при нагревании на масляной бане при 160°С и при пониженном давлении. Путем отгонки гексанол, гексилоксид трибутилолова и дигексилкарбонат выделяют в виде дистиллята. Выход дигексилкарбоната составляет 13%. Установлено, что дистиллят содержит приблизительно 2 ммоль гексилоксида трибутилолова.
Пример 3
Вначале синтезируют реакционноспособное металлорганическое соединение, содержащее 3-метилбутоксигруппу, из оксида дибутилолова и 3-метил-1-бутанола следующим образом.
В четырехгорлую колбу объемом 1 л, снабженную охлаждающей трубкой (которая соединена с регулятором вакуума и вакуумным насосом) и насадкой Дина-Старка, загружают 70,5 г (0,28 моль) оксида дибутилолова (производится и продается Aldrich, США) и 502 г (5,7 моль) 3-метил-1-бутанола (производится и продается Aldrich, США). Затем в колбу помещают мешалку.
Колбу погружают в масляную баню, имеющую температуру 140°С, и давление в колбе постепенно снижают приблизительно до 90 кПа при перемешивании содержимого колбы. Затем давление в колбе дополнительно снижают до 85 кПа при перемешивании содержимого колбы и, отбирая из колбы дистиллят, и реакцию проводят при 85 кПа в течение 12 час, дополнительно отбирая из колбы дистиллят. Затем непрореагировавшие компоненты (такие как непрореагировавший спирт) в колбе отгоняют из колбы в течение 30 мин, при этом постепенно понижая давление в колбе приблизительно до 200 Па. Колбу извлекают из масляной бани и внешнюю сторону колбы охлаждают. Затем в колбу вводят азот, чтобы повысить давление в колбе до атмосферного давления. С помощью описанной выше операции получено 127 г вязкой жидкости.
Дистиллят, отобранный из колбы, анализируют. В результате установлено, что дистиллят содержит приблизительно 260 ммоль воды. Полученную выше вязкую жидкость анализируют с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. В результате установлено, что вязкая жидкость содержит бис(3-метилбутоксид) дибутилолова, 1,1,3,3-тетрабутил-1,3-ди(3-метилбутокси)дистанноксан и 3-метилбутоксид трибутилолова.
Стадия (1)
В автоклав объемом 200 мл (производится и продается Toyo Koatsu Co., Ltd., Япония), который имеет баллон с газообразным диоксидом углерода, присоединенный к нему с помощью SUS-трубки и вентиля, загружают 114 г полученной выше вязкой жидкости. Автоклав герметично закрывают и атмосферу в автоклаве продувают с помощью газообразного азота. Затем упомянутый выше вентиль открывают, чтобы ввести в автоклав газообразный диоксид углерода, имеющий давление 5 МПа. Введение газообразного диоксида углерода в автоклав проводят в течение 10 мин при перемешивании содержимого автоклава, и затем останавливают, закрыв вентиль баллона с диоксидом углерода. Затем внутреннюю температуру в автоклаве повышают до 120°С при перемешивании. Затем проводят реакцию в течение 4 час при поддержании внутреннего давления в автоклаве приблизительно при 4 МПа.
Во время проведения реакции и после реакции из автоклава отбирают образцы реакционной смеси и анализируют. В результате установлено, что реакционная смесь, полученная через 1 час после начала реакции, содержит ди(3-метилбутил)карбонат с выходом 18% и что реакционная смесь, полученная через 4 час после начала реакции, содержит ди(3-метилбутил)карбонат с выходом 20,4%.
По окончании реакции внешнюю сторону автоклава охлаждают и отдувают из него газообразный диоксид углерода.
Стадия (2)
После стадии (1) содержимому автоклава дают охладиться до комнатной температуры (приблизительно 20°С). Затем автоклав открывают, чтобы извлечь из него реакционную смесь. Реакционную смесь загружают в грушевидную колбу объемом 300 мл, снабженную охлаждающей трубкой, вакуумным насосом и регулятором вакуума (производится и продается Okano Works, Ltd., Япония). Затем в колбу помещают мешалку. Далее колбу погружают в масляную баню, имеющую температуру 140°С.
Отгонку проводят при 140°С при перемешивании содержимого колбы и постепенном понижении давления в колбе. Во время перегонки вначале из колбы отгоняется 3-метил-1-бутанол и затем ди(3-метилбутил)карбонат. С помощью отгонки получают приблизительно 9 г ди(3-метилбутил)карбоната и приблизительно 1 ммоль 3-метилбутоксида трибутилолова.
Стадия (3)
В четырехгорлую колбу объемом 1 л, снабженную охлаждающей трубкой (которая соединена с регулятором вакуума и вакуумным насосом) и насадкой Дина-Старка, загружают остаток после перегонки, полученный на стадии (2), и 502 г (5,7 моль) 3-метил-1-бутанола (производится и продается Aldrich, США). Затем в колбу помещают мешалку.
Колбу погружают в масляную баню, имеющую температуру 140°С, и давление в колбе постепенно снижают приблизительно до 90 кПа при перемешивании содержимого колбы. Затем давление в колбе дополнительно снижают до 85 кПа при перемешивании содержимого колбы и, отбирая из колбы дистиллят, и реакцию проводят при 85 кПа в течение 20 час, дополнительно отбирая из колбы дистиллят. Затем непрореагировавшие компоненты (такие как непрореагировавший спирт) в колбе отгоняют из колбы в течение 30 мин, при этом постепенно понижая давление в колбе приблизительно до 200 Па, получают в результате реакционную смесь. Реакционную смесь анализируют с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. В результате установлено, что реакционная смесь содержит бис(3-метилбутоксид) дибутилолова и 1,1,3,3-тетрабутил-1,3-ди(3-метилбутоксид)дистанноксана. Кроме того, реакционная смесь также содержит приблизительно 2 ммоль (3-метилбутоксида) трибутилолова. Затем температуру в масляной бане понижают так, чтобы внутренняя температура в колбе составляла приблизительно 93°С, и из колбы при пониженном давлении 50 Па отбирают дистиллят. Затем колбу извлекают из масляной бани и внешнюю сторону колбы охлаждают. Затем в колбу вводят азот, чтобы повысить давление в колбе до атмосферного давления. С помощью описанной выше операции получено 110 г вязкой жидкости.
Полученную выше вязкую жидкость анализируют с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. В результате установлено, что вязкая жидкость содержит бис(3-метилбутоксид) дибутилолова и 1,1,3,3-тетрабутил-1,3-ди(3-метилбутокси)дистанноксан. Также установлено, что отгоняется приблизительно 1 ммоль 3-метилбутоксида трибутилолова.
Стадия (1)
В автоклав объемом 200 мл (производится и продается Toyo Koatsu Co., Ltd., Япония), который имеет баллон с газообразным диоксидом углерода, присоединенный к нему с помощью SUS-трубки и вентиля, загружают 112 г полученной выше вязкой жидкости. Автоклав герметично закрывают и автоклав продувают газообразным азотом. Затем упомянутый выше вентиль открывают, чтобы ввести в автоклав газообразный диоксид углерода, имеющий давление 5 МПа. Введение газообразного диоксида углерода в автоклав проводят в течение 10 мин при перемешивании содержимого автоклава и затем останавливают, закрыв вентиль баллона с диоксидом углерода. Затем внутреннюю температуру в автоклаве повышают до 120°С при перемешивании. Затем проводят реакцию в течение 4 час при поддержании внутреннего давления в автоклаве приблизительно при 4 МПа.
Во время проведения реакции и после реакции из автоклава отбирают образцы реакционной смеси и анализируют. В результате установлено, что реакционная смесь, полученная через 1 час после начала реакции, содержит ди(3-метилбутил)карбонат с выходом 18% и что реакционная смесь, полученная через 4 час после начала реакции, содержит ди(3-метилбутил)карбонат с выходом 20,4%.
По окончании реакции внешнюю сторону автоклава охлаждают и отдувают из него газообразный диоксид углерода.
Стадия (2)
После стадии (1) содержимому автоклава дают охладиться до комнатной температуры (приблизительно 20°С). Затем автоклав открывают, чтобы извлечь из него реакционную смесь. Реакционную смесь загружают в грушевидную колбу объемом 300 мл, снабженную охлаждающей трубкой, вакуумным насосом и регулятором вакуума (производится и продается Okano Works, Ltd., Япония). Затем в колбу помещают мешалку. Далее колбу погружают в масляную баню, имеющую температуру 140°С.
Перегонку проводят при 140°С при перемешивании содержимого колбы и постепенном понижении давления в колбе. При отгонке из колбы вначале отгоняется 3-метил-1-бутанол и затем ди(3-метилбутил)карбонат. С помощью отгонки получают приблизительно 9 г ди(3-метилбутил)карбоната и приблизительно 1 ммоль 3-метилбутоксида трибутилолова.
Стадия (3)
В четырехгорлую колбу объемом 1 л, снабженную охлаждающей трубкой (которая соединена с регулятором вакуума и вакуумным насосом) и насадкой Дина-Старка, загружают остаток после перегонки, полученный на стадии (2), 502 г (5,7 моль) 3-метил-1-бутанола (производится и продается Aldrich, США) и 1 г (4 ммоль) оксида дибутилолова. Затем в колбу помещают мешалку.
Колбу погружают в масляную баню, имеющую температуру 140°С, и давление в колбе постепенно снижают приблизительно до 90 кПа при перемешивании содержимого колбы. Затем давление в колбе дополнительно снижают до 85 кПа при перемешивании содержимого колбы и отбирая из колбы дистиллят, и реакцию проводят при 85 мПа в течение 20 час, дополнительно отбирая из колбы дистиллят. Затем непрореагировавшие компоненты (такие как непрореагировавший спирт) в колбе отгоняют из колбы в течение 30 мин, при этом постепенно понижая давление в колбе приблизительно до 200 Па, получают в результате вязкую реакционную смесь. Вязкую реакционную смесь анализируют с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. В результате установлено, что реакционная смесь содержит бис(3-метилбутоксид) дибутилолова и 1,1,3,3-тетрабутил-1,3-ди(3-метилбутоксид)дистанноксана. Кроме того, реакционная смесь также содержит приблизительно 2 ммоль 3-метилбутоксида трибутилолова. Затем температуру в масляной бане понижают так, чтобы внутренняя температура в колбе составляла приблизительно 93°С, и из колбы при пониженном давлении 50 Па отбирают дистиллят. Затем колбу извлекают из масляной бани и внешнюю сторону колбы охлаждают. Затем в колбу вводят азот, чтобы повысить давление в колбе до атмосферного давления. Описанной выше операцией получают 110 г вязкой жидкости.
Полученную выше вязкую жидкость анализируют с помощью спектроскопии 1Н-, 13С- и 119Sn-ЯМР. В результате установлено, что вязкая жидкость содержит бис(3-метилбутоксид) дибутилолова и 1,1,3,3-тетрабутил-1,3-ди(3-метилбутокси)дистанноксан. Также установлено, что отгоняется приблизительно 1 ммоль 3-метилбутоксида трибутилолова.
ПРИМЕНЕНИЕ В ПРОМЫШЛЕННОСТИ
С помощью способа настоящего изобретения эфир угольной кислоты может быть получен с высоким выходом из металлорганического соединения, имеющего в своей молекуле, по меньшей мере, две связи металл-кислород-углерод, и диоксида углерода. Преимущество способа состоит в том, что диоксид углерода не токсичен, не обладает коррозионной способностью и является недорогим. Кроме того, способ настоящего изобретения имеет преимущество не только в том, что металлорганическое соединение после использования в этом способе может быть регенерировано и рециркулировано, но также в том, что образующееся нерегенерируемое инертное металлорганическое соединение может быть удалено из реакционной системы, в результате чего реализуется эффективное и стабильное производство эфира угольной кислоты. Кроме того, отсутствует необходимость в использовании большого количества дегидратирующего агента, что предупреждает появление отходов, образующихся из дегидратирующего агента. Таким образом, способ настоящего изобретения является коммерчески очень полезным и имеет высокое промышленное значение.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИАЛКОКСИДОВ ДИАЛКИЛОЛОВА | 2007 |
|
RU2414474C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭФИРА УГОЛЬНОЙ КИСЛОТЫ | 2002 |
|
RU2280023C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКОКСИДОВ АЛКИЛОЛОВА | 2005 |
|
RU2338749C2 |
| СПОСОБ ОТДЕЛЕНИЯ И ИЗВЛЕЧЕНИЯ ДИАЛКОКСИДА ДИАЛКИЛОЛОВА | 2007 |
|
RU2401838C2 |
| СПОСОБ ПОЛУЧЕНИЯ АРОМАТИЧЕСКОГО КАРБОНАТА | 2004 |
|
RU2329250C2 |
| СМЕСЬ ДЛЯ ИЗВЛЕЧЕНИЯ С ЦЕЛЬЮ ИСПОЛЬЗОВАНИЯ ИЛИ ТРАНСПОРТА ДИОКСИДА УГЛЕРОДА | 2007 |
|
RU2396107C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОЦИАНАТОВ | 2007 |
|
RU2419603C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОЦИАНАТОВ | 2008 |
|
RU2434849C2 |
| СПОСОБ НЕПРЕРЫВНОГО ПОЛУЧЕНИЯ ОРГАНИЧЕСКИХ КАРБОНАТОВ ИЛИ ОРГАНИЧЕСКИХ КАРБАМАТОВ И ТВЕРДЫЕ КАТАЛИЗАТОРЫ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2009 |
|
RU2447056C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИЗОЦИАНАТОВ С ИСПОЛЬЗОВАНИЕМ ДИАРИЛКАРБОНАТА | 2008 |
|
RU2523201C2 |
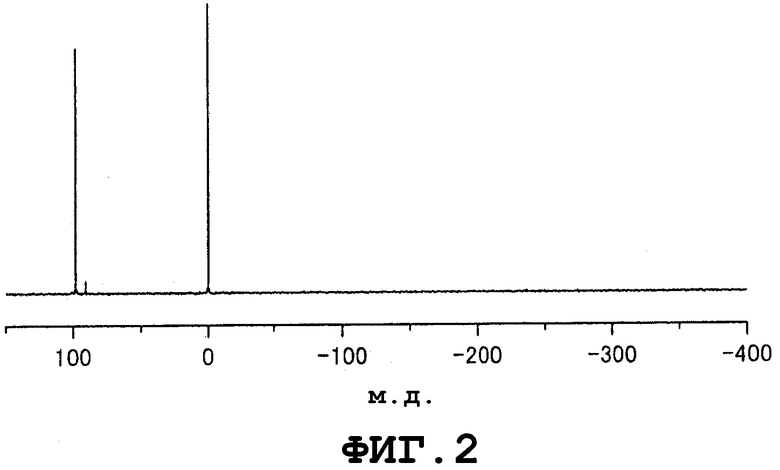
Изобретение относится к усовершенствованному способу производства диалкилкарбоната, включающий стадии: (1) проведения реакции между первой смесью металлорганического соединения и диоксидом углерода, необязательно в присутствии алкилового спирта, содержащего линейную или разветвленную С1-С12-алкильную группу, причем указанная первая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из указанного реакционноспособного металлорганического соединения и которое имеет в своей молекуле три связи металл-углерод, где указанное реакционноспособное металлорганическое соединение выбрано из группы, которую составляют: металлорганическое соединение, представленное формулой (1):
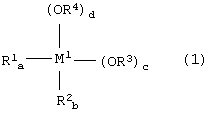
где: М1 представляет собой атом олова или титана; каждый из заместителей R1 и R2 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, каждый из заместителей R3 и R4 независимо друг от друга представляет собой линейную или разветвленную C1-С12-алкильную группу, и каждый из индексов а и b представляет собой целое число от 0 до 2, а+b=2, каждый из индексов c и d представляет собой целое число от 0 до 2, и a+b+c+d=4; и металлорганическое соединение, представленное формулой (2):
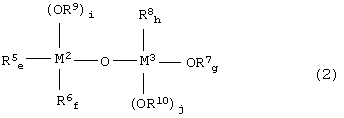
где: каждый из М2 и М3 независимо друг от друга представляет собой атом олова или титана; каждый из заместителей R5, R6, R7 и R8 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу; каждый из заместителей R9 и R10 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу; и каждый из индексов е, f, g и h представляет собой целое число от 0 до 2, e+f=2, g+h=2, каждый из индексов i и j представляет собой 1, е+f+i=3 и g+h+j=3, и где нерегенерируемое инертное соединение включает, по меньшей мере, одно соединение, представленное следующей формулой (6):

где: M представляет собой атом олова или титана; каждый из заместителей R11, R12 и R13 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу; заместитель R14 представляет собой линейную или разветвленную С1-С12-алкильную группу; и каждый из индексов k, l и m представляет собой целое число от 0 до 4, k+l+m=3 или 4, n представляет собой целое число 0 или 1, и k+l+m+n=4, с получением в результате реакционной смеси, содержащей диалкилкарбонат, образованный в ходе реакции, указанное негенерируемое инертное соединение и регенерируемое метаморфное металлорганическое соединение, образованное из указанного реакционноспособного металлорганического соединения; (2) разделения указанной реакционной смеси, необязательно в присутствии алкилового спирта, содержащего линейную или разветвленную С1-С12-алкильную группу, на первую часть, содержащую диалкилкарбонат и указанное нерегенерируемое инертное соединение, и вторую часть, содержащую указанное регенерируемое метаморфное металлорганическое соединение; и (3) взаимодействия указанной второй части указанной реакционной смеси с алкиловым спиртом, содержащим линейную или разветвленную C1-C12-алкильную группу, с образованием второй смеси металлорганического соединения и воды и удаления указанной воды из указанной второй смеси металлорганического соединения, причем указанная вторая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образуется из указанного реакционноспособного металлорганического соединения и которое имеет в своей молекуле три связи металл-углерод, где указанное реакционноспособное металлоорганическое соединение включает, по меньшей мере, одно соединение, выбранное из группы, состоящей из металлорганического соединения, представленного формулой (1) и металлорганического соединения, представленного формулой (2), и указанное нерегенерируемое инертное соединение включает, по меньшей мере, одно соединение, представленное формулой (6). 13 з.п. ф-лы, 2 табл., 2 ил.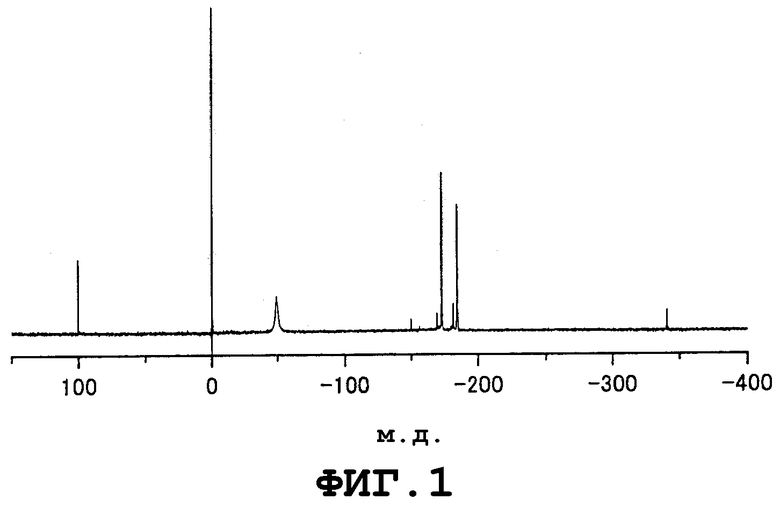
(1) проведения реакции между первой смесью металлорганического соединения и диоксидом углерода, необязательно в присутствии алкилового спирта, содержащего линейную или разветвленную C1-C12-алкильную группу, причем указанная первая смесь металлоорганического соединения содержит смесь реакционноспособного металлоорганического соединения, имеющего в своей молекуле две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образовано из указанного реакционноспособного металлоорганического соединения и которое имеет в своей молекуле три связи металл-углерод, где указанное реакционноспособное металлоорганическое соединение выбрано из группы, которую составляют
металлоорганическое соединение, представленное формулой (I):
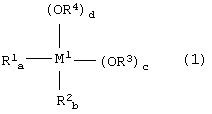
где М1 представляет собой атом олова или титана;
каждый из заместителей R1 и R2 независимо друг от друга представляет собой линейную или разветвленную C1-C12-алкильную группу,
каждый из заместителей R3 и R4 независимо друг от друга представляет собой линейную или разветвленную С1-С12-алкильную группу, и
каждый из индексов а и b представляет собой целое число от 0 до 2, а+b=2, каждый из индексов c и d представляет собой целое число от 0 до 2, и a+b+c+d=4;
и
металлорганическое соединение, представленное формулой (2):

где каждый из М2 и М3 независимо друг от друга представляет собой атом олова или титана;
каждый из заместителей R5, R6, R7 и R8 независимо друг от друга представляет собой линейную или разветвленную C1-C12-алкильную группу;
каждый из заместителей R9 и R10 независимо друг от друга представляет собой линейную или разветвленную C1-C12-алкильную группу; и
каждый из индексов е, f, g и h представляет собой целое число от 0 до 2, e+f=2, g+h=2, каждый из индексов i и j представляет собой 1, е+f+i=3 и g+h+j=3, и где нерегенерируемое инертное соединение включает, по меньшей мере, одно соединение, представленное следующей формулой (6):
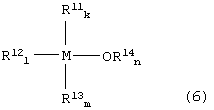
где М представляет собой атом олова или титана;
каждый из заместителей R11, R12 и R13 независимо друг от друга представляет собой линейную или разветвленную C1-C12-алкильную группу;
заместитель R14 представляет собой линейную или разветвленную C1-C12-алкильную группу; и
каждый из индексов k, 1 и m представляет собой целое число от 0 до 4, k+1+m=3 или 4, n представляет собой целое число 0 или 1,и к+1+m+n=4,
с получением в результате реакционной смеси, содержащей диалкилкарбонат, образованный в ходе реакции, указанное негенерируемое инертное соединение и регенерируемое метаморфное металлорганическое соединение, образованное из указанного реакционноспособного металлорганического соединения;
(2) разделения указанной реакционной смеси, необязательно в присутствии алкилового спирта, содержащего линейную или разветвленную C1-C12-алкильную группу, на первую часть, содержащую диалкилкарбонат, и указанное нерегенерируемое инертное соединение, и вторую часть, содержащую указанное регенерируемое метаморфное металлорганическое соединение;
(3) взаимодействия указанной второй части указанной реакционной смеси с алкиловым спиртом, содержащим линейную или разветвленную C1-C12-алкильную группу, с образованием второй смеси металлорганического соединения и воды и удаления указанной воды из указанной второй смеси металлорганического соединения, причем указанная вторая смесь металлорганического соединения содержит смесь реакционноспособного металлорганического соединения, имеющего в своей молекуле две связи металл-кислород-углерод, и нерегенерируемого инертного соединения, которое образуется из указанного реакционноспособного металлорганического соединения и которое имеет в своей молекуле три связи металл-углерод, где указанное реакционноспособное металлоорганическое соединение включает, по меньшей мере, одно соединение, выбранное из группы, состоящей из металлорганического соединения, представленного формулой (1), и металлорганического соединения, представленного формулой (2), и указанное нерегенерируемое инертное соединение включает, по меньшей мере, одно соединение, представленное формулой (6).
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| ЖНЫХ ЭФИРОВ УГОЛЬНОЙiKSi слоты | 0 |
|
SU359808A1 |
Авторы
Даты
2007-03-27—Публикация
2003-08-06—Подача