Изобретение относится к способу получения стабильных, неиммуногенных, физиологически хорошо совместимых, растворенных или сублимационно высушенных галеновых композиций из человеческих протеинов (белков), в особенности эритропоэтина.
Человеческие протеины (белки) представляют собой аутогенные, имеющиеся только в незначительных количествах, протеины, как, например, тканевый плазмогенный активатор (t-РА), стрептокиназа, урокиназа, интерферон, стимулирующие различные колонии факторы (СSF) или эритропоэтин (ЕРО). На примере ЕРО, который предпочтительно используется в составе, изобретение поясняется подробнее.
Эритропоэтин (ЕРО) представляет собой гликопротеин, который стимулирует образование гемоглобина, соответственно, эритроцитов в костном мозгу. Этот липопротеин образуется главным образом в почках, в очень незначительных количествах находится в сыворотке и при физиологических условиях частично выделяется в моче.
Отсутствие ЕРО при почечной недостаточности обусловлено ренальной анемией. Благодаря введению ЕРО в физиологических количествах, т.е. несколько микрограмм, за одну или несколько дозировок, можно снова возбуждать в таких случаях образование эритроцитов. Так как организм чувствительно реагирует на незначительные изменения дозы, то дозировка должна быть точно воспроизводима. Обычно ЕРО инъецируют или внутримышечно или внутривенно в виде водного раствора или вводят в виде распыляемого раствора через слизистую оболочку носа.
Однако известно, что ЕРО, и именно как прежде всего полученный из человеческой мочи продукт М yake и др. ВioI, Chem. т.25, 5558-5564, 1977), как также получаемые между тем путем генной инженерии продукты (ВОИС 85-02610), в водном растворе нестабильны и даже при хранении при -80оС наступают большие потери активности. Эти оба вида продуктов отличаются несколько по образу гликозилирования и по активности, прямое сравнение содержащимся в сыворотке ЕРО до сих пор не известно.
Эти потери активности сводятся, с одной стороны, к разрушению (разложению) ЕРО за счет каталитических эффектов поверхности служащих для хранения ампул благодаря следам тяжелых металлов, кислороду воздуха и т.д. с другой стороны, однако также за счет отложения ЕРО-молекул на стенках сосуда, причем также может происходить частично денатурация. Так как, как сказано выше, в каждой дозировочной единице должны содержаться только несколько микрограммов, потери за счет адсорбции уже спустя короткое время хранения могут быть значительными.
Было описано ингибирование этого отложения на стенках сосуда благодаря добавке полимерных соединений, как альбумин сыворотки человека или крупного рогатого скота, лецитин, декстран, целлюлоза, полиэтиленгликоль и т.д. и таким образом достижение спустя примерно 2 ч хранения при 20оС ЕРО в количестве 75-98% в противоположность чему обнаруживают только 16% без такой добавки. При этом, впрочем, измерялось только обнаружение радиоактивной маркировки (14С), так что эти опыты ничего не говорят о стабилизации ЕРО от разложения.
Согласно найденному, стабилизации в течение длительного времени с помощью таких средств, однако, нельзя достигать, т.е. ЕРО-активность в тесте на мышах сильно падает, к тому же эти средства при инфекции вызывают иммуногенные реакции. Далее описаны "стабилизаторы", в особенности для сублимационно высушенных ЕРО-препаратов. Наряду с полимерными веществами ПЭГ 4000, желатиной и декстраном 40, названы различные сахара и многоатомные спирты, дающие при окислении моносахариды, аминокислоты, неорганические соли и тиольные соединения. Комбинации этих веществ с человеческим сывороточным альбумином, желатиной и декстраном также указаны. Также было определено только обнаружение радиоактивностей спустя 2 месяца хранения сублимационно высушенных продуктов. Оно указывается равным 87-99% в противоположность 60% без добавок. Так как лиофилизированный материал используется непосредственно после получения в качестве стандарта, но не указано, какие еще потери активности при приготовлении препаратов. Также эти препараты обладают высокой потерей активности в тесте на мышах.
Поэтому была поставлена задача создания хорошо совместимого ЕРО-препарате который стабилен при хранении, так как сохраняет ин виво активность, не приводит к адсорбциям на стенках ампул или шприцов и легко может переводиться в инъекцируемую форму.
Эта задача решается благодаря комбинации различных компонентов. Как показали опыты, индивидуальные вещества этими свойствами не обладают, или обладают только в незначительной мере.
Решающей для стабилизации является добавка мочевины и различных аминокислот. Мочевина используется в количестве 5-50 г/л, предпочтительно 10-15 г/л. В качестве аминокислот следует назвать, например, глицин, L-аланин, L-аргинин, L-лейцин, L-изолейцин, L-2-фенилаланин, L-глутаминовая кислота или L-треонин. Смеси различных аминокислот, по-видимому, имеют особенно предпочтительный эффект. Их используют в количествах 0,5-50 г/л, предпочтительно 1-20 г/л, причем общее количество должно составлять предпочтительно 5-25 г/л.
Далее, необходим физиологически совместимый буфер, который в необходимых для инъекционных растворов незначительных концентрациях (примерно 20-100 ммоль/л) устанавливает необходимую для ЕРО рН-область 6,5-7,4, в особенности 7,0-7,2. Кроме фосфатных буферов применимы также глицинат, карбонат, цитрат и другие, причем в качестве противоионов могут служить, кроме ионов натрия и калия, также ионы аммония. Буферирование дополнительно вызывается содержащимися аминокислотами.
Прилипание ЕРО к стенкам ампул и шприцам существенно снижается за счет добавки незначительных количеств детергента. Так как препарат должен предпочтительно вводиться путем инъекции, это вещество должно быть физиологически, в особенности внутривенно, совместимо, оказываются пригодными концентрации 0,05-5 г/л, в особенности 0,1-0,5 г. Неионные смачиватели, как различные виды полимакроголов, в особенности полиэтиленсорбитанлаурат (Твин 20 или 80) или сорбитантриолеат (Sрап 35 или 80) или полигликолевый эфир глицеринолеиловой кислоты (Lab-rafilR) оказываются пригодными для этой цели, однако в равной мере могут использоваться другие совместимые вещества.
Для уменьшения влияния на ЕРО ионов тяжелых металлов, которые почти неизбежно увлекаются при обработке, например из используемых металлических инструментов, далее оказывается пригодным добавление раствора 0,01-5 г/л растворимой кальциевой соли, предпочтительно примерно 0,02-0,2 г/л, хлорида кальция. Также могут использоваться другие физиологически совместимые комплексообразователи, например цитрат, ЕDТА, NТА, пантотенат.
В качестве растворителя используют чистую воду для инъекционных целей, к которой для установления изотонии добавляются еще 0,5-10 г/л хлорида натрия или соответствующих веществ, как маннит, сорбит и т.д.
Для получения предлагаемых препаратов все вспомогательные вещества растворяют в необходимом количестве воды, примешивают ЕРО-препарат, который должен иметь активность примерно 100000-20000 ед./мг протеина, стерильно фильтруют в соответствующие ампулы, замораживают и осторожно лиофилизируют при низких температурах. Полученные препараты устойчивы в атмосфере азота в течение 2-х лет при 0оС и в течение 1 года при комнатной температуре. При реконструировании с помощью воды они растворяются за несколько секунд без помутнения и таким образом могут прямо вводиться путем внутривенной или внутримышечной инъекции или после разбавления изотоническими растворами, например раствором хлорида натрия.
Процессу замораживания придают особое значение. Вспомогательные вещества по ряду и количеству выбираются так, чтобы эвтектическая точка замораживаемого раствора находилась между -50 и -30оС. С помощью управляемой компьютером программы оптимизации определялись следующие оптимальные условия для 3-х фаз лиофилизации:
Время замораживания: 12-14 ч при -40оС
Основная сушка: температура рассола 10оС, давление 10-1 мбар, время 48-60 ч.
Дополнительная сушка: температура рассола 20оС, давление 10-3 мбар, время 4-6 ч.
При этом существенным является распознавание с помощью измерительного устройства Δр, а также измерение электропpоводности, когда закончится основная сушка, чтобы лиофилизируемый продукт слишком быстро не нагревался и чтобы избегать оттаивания замороженного раствора и связанной с этим потери активности.
Используемые вспомогательные вещества выбираются так, чтобы осуществлялось образование равномерно структурированного лиофилизируемого замерзшего тела и во время лиофилизации получался пористый скелет (осадок на фильтре), из которого возможна оптимальная сублимация льда, прежде всего также к концу основной сушки. Дополнительная сушка осуществляется, как указано выше, только при 20оС в течение 4-6 ч. Эта осторожная обработка является важной, так как иначе приводит к потере активности в случае слишком лиофилизированного материла.
Как правило, таким образом лиофизилированные продукты имеют содержание воды по К. Фишеру примерно 2-5% Это остаточное содержание воды зависит от рода и количества вспомогательных веществ, которые используются в соответствующей рецептуре.
Водные растворы стабилизированного ЕРО можно также непосредственно заливать в ампулы и без лиофилизации в виде готовой к употреблению формы использовать. Устойчивость, однако, благодаря этому по сравнению с лиофилизатом сокращается примерно до 1 года при 0оС и нескольких месяцев при комнатной температуре.
П р и м е р 1. Сухое вещество для инъекции с 2000 ед. эритропоэтина (состав для 35000 ампул).
В стерильном, снабженном мешалкой, емкостью 100 л У2А резервуаре с двойной рубашкой растворяют вспомогательные вещества: Мочевина 700,0 г (10,0 г/л) Хлорид натрия 70,0 г (1,0 г/л) Твин 20 7,0 г (0,1 г/л) Дигидрофосфат натрия х 1 Н2О 38,4 г (0,55 г/л)
Динатрийгид- рофосфат х 2Н2О 350,0 г (5,0 г/л)
Хлорид кальция x х 2Н2О 8,4 г (0,12 г/л) Глицин 105,0 г (1,5 г/л) L-Лейцин 140,0 г (2,0 г/л) L-Изолейцин 140,0 г (2,0 г/л) L-Треонин 35,0 г (0,5 г/л)
L-Глутаминовая кислота 35,0 г (0,5 г/л) L-Фенилаланин 70,0 г (1,0 г/л)
Вода для инъек- ционных целей До 70,0 л
К 30 л этого вспомогательного раствора добавляют 214,3 мл сырьевой загрузки эритропоэтина с титром ЕРО 140000 ед/мл и доливают до конечного объема 35 л и перемешивают. С помощью остального раствора вспомогательных веществ споласкивают систему фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор в асептических условиях заливают в склянки для инъекции емкостью 1 мл и сублимационно высушивают в установке для лиофилизации при следующих критериях:
Время замораживания 12-14 ч при -40оС.
Основная сушка: температура рассола 10оС, давление 10-1 мбар, время 48-60 ч.
Дополнительная сушка: температура рассола 20оС, давление 10-3 мбар, время 4-6 ч.
Получают таким образом объемистое, с открытыми порами сухое вещество для инъекций, которое стабильно по крайней мере 2 года в холодильнике и 1 год при комнатной температуре и в течение нескольких часов растворяется в 2 мл воды для инъекционных целей без помутнения и лишенное частиц.
П р и м е р 2. Лиофилизат с 200 ед. эритропоэтина (состав для 35000 ампул) Эритропоэтин 46,7=7 Мiо ед.
100000 ед/л Хлорид натрия 100,0 г (1,43 г/л) Твин 20 10,0 г (0,14 г/л)
Дигидрофосфат натрия х 1 Н2О 155,0 г (2,21 г/л)
Динатрийгид- рофосфат х 2 Н2О 500,0 г (7,14 г/л)
Хлорид кальция х x 2Н2О 10,0 г (0,14 г/л) Мочевина 1000,0 г (14,29 г) L-Лейцин 150,0 г (2,14 г/л) L-Треонин 120,0 г (1,71 г/л) L-Фенилаланин 165,0 г (2,36 г/л) Вода для инъек- ционных целей До 70,0 л
Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРО-биологически активного вещества. Вторые 35 л используют для споласкивания системы фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор при асептических условиях разливают в склянки для инъекции емкостью 1 мл и лиофилизируют при тех же критериях, как указано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться без больших потерь активности 2 года в холодильнике или 1 год при комнатной температуре.
П р и м е р 3. Лиофилизат с 1000 ед. эритропоэтина (состав для 35000 ампул) Эритропоэтин 233,33 мл 35 Мiо ед.
500000 ед/л Хлорид натрия 100,0 г (1,43 г/л) Твин 20 12,0 г (0,17 г/л)
Дигидрофосфат натрия х Н2О 140,0 г (2,0 г/л)
Динатрийгид- рофосфат х 2 Н2О 450,0 г (6,43 г/л) Хлорид кальция х 2 Н2О 10,0 г (0,14 г/л) Мочевина 700,0 г (10,0 г/л) Глицин 1050,0 г (15,0 г/л) L-Лейцин 92,0 г (1,31 г/л)
L-Глутаминовая кислота 103,0 г (1,47 г/л) L-Фенилаланин 115,5 г (1,64 г/л)
Вода для инъек- ционных целей До 70,0 л
Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРО-биологически активного вещества. Вторые 35 л используют для споласкивания системы для фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор при асептических условиях заливают в склянки для инъекции емкостью по 1 мл и лиофилизуют при тех же критериях, как описано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться 2 года в холодильнике или 1 год при комнатной температуре, без больших потерь активности.
П р и м е р 4. Лиофилизат с 500 ед. эритропоэтина (состав для 35000 ампул) Эритропоэтин 116,67 мл= 17,5 Мiо
единиц
250000 ед/л Хлорид натрия 70,0 г (1,0 г/л) Твин 20 7,0 г (0,01 г/л)
Дигидрофосфат натрия х Н2О 38,5 г (0,55 г/л)
Динатрийгид- рофосфат х 2Н2О 490,0 г (7,0 г/л)
Хлорид кальция x х 2Н2О 5,6 г (0,08 г/л) Мочевина 840,0 г (12,0 г/л) L-Лейцин 92,4 г (1,32 г/л) L-Глутаминовая кислота 105,0 г (1,5 г/л) L-Фенилаланин 119,0 г (1,7 г/л) Вода для инъек- ционных целей До 70,0 л
Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРО-биологически активного вещества. Вторые 35 л используют для споласкивания системы для фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор разливают при асептических условиях в склянки для инъекций емкостью по 1 мл и лиофилизируют при тех же критериях, как указано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться без больших потерь активности 2 года в холодильнике или 1 год при комнатной температуре.
П р и м е р 5. Лиофилизат с 750 ед. эритропоэтина (состав для 35000 ампул) Эритропоэтин 175,0 мл= 26,25 Мiо ед
37500 ед/л Хлорид натрия 100,0 г (1,43 г/л) Дигидрофосфат натрия х Н2О 140,0 г (2,0 г/л)
Динатрийгид- рофосфат х 2Н2О 450,0 г (6,43 г/л)
Хлорид кальция х x 2Н2О 10,0 г (0,14 г/л) Мочевина 840,0 г (12,0 г/л) Глицин 1250,0 г
(17,86 г/л) L-Изолейцин 98,0 г (1,4 г/л)
L-Глутаминовая кислота 130,0 г (1,86 г/л) L-Фенилаланин 145,0 г (2,07 г/л)
Вода для инъек- ционных целей До 70,0 л
Вспомогательные вещества растворяют в 70 л воды для инъекционных целей и затем разделяют на 2 порции по 35 л. Первые 35 л смешивают с необходимым количеством ЕРО-биологически активного вещества. Вторые 35 л используют для споласкивания системы для фильтрации. Раствор состава стерильно фильтруют через мембранный фильтр с размером пор 0,2 мкм. Стерильно профильтрованный раствор разливают при асептических условиях в склянки для инъекций емкостью до 1 мл и лиофилизируют при тех же критериях, как указано в примере 1. Получают таким образом белого цвета, пористый, хорошо растворимый в 2 мл воды лиофилизат, который может храниться без больших потерь активности 2 года в холодильнике или 1 год при комнатной температуре.
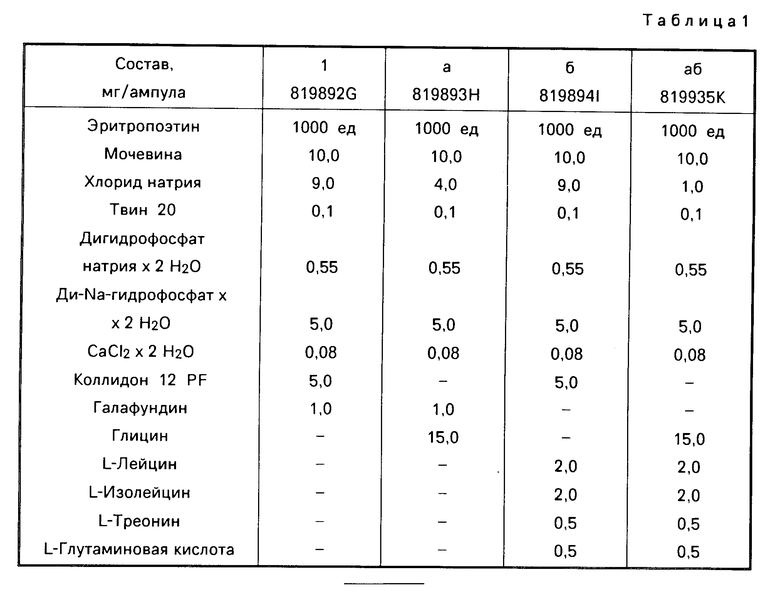
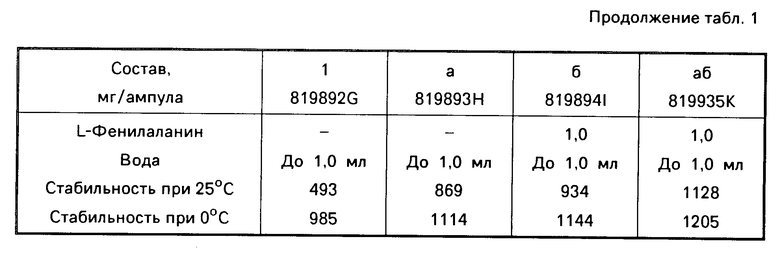
П р и м е р 6. Для того, чтобы испытать эффективность (активность) различных стабилизаторов, стандартную рецептуру с 1000 ед. ЕРО/мл, которая содержит в качестве основного стабилизатора мочевину, смешивают со смесью поливинилпирролидона с белком, соответственно, различными аминокислотами и продукты лиофилизируют. Результаты представлены в табл.1.
Стабильность ЕРО после 6 недель хранения лиофилизата при 35оС, соответственно 0оС, в тесте на селезенке мыши согласно методике G.Кrystal Ехр. Неmatol. 11, 649-660. 1983, определяется следующим образом: самкам В6С3F1-мышей массой примерно по 20 г в два последовательных дня вводили путем инъекции интраперитонеально 60 мг/кг фенилгидразингидрохлорида. Спустя следующие 3 дня извлекали селезенку, клетки селезенки суспендировали в стерильной Коmрlet-среде (модифицированная Еаgle среда Dulbecco + 584,0 мг/л L-глутамина +0,1 ммоль/л 2-меркаптоэтанола + 20% зародышевой телячьей сыворотки) и разбавляли до 4х106 ядросодержащих клеток/мл. Суспензию, к которой прежде добавляют тест-вещество, соответственно ЕРО-стандарт, смотря по обстоятельствам, в пригодных концентрациях, растворенные в ВSA-буфере, распределяют на пластинках для микротитра (0,2 мл/углубление). После инкубации (22 ч, 37оС, воздух +15% СО2) на углубление добавляют 20 мкл 3Н-метил-тимидинового раствора с 1 μCu и снова инкубируют 2 ч при 37о. После этого содержимое переводят с помощью клеточного Наrvesters и промывают дистиллированной водой. Встроение 3Н-тимидина определяют с помощью β-сцинтилляционного счетчика и оценивают по отношению к стандартным препаратам.
В качестве рабочего стандарта используют "Р009-ЕРО-стандарт" Института Генетики (Кембридж. Массачусетс. США), который содержит 112 ед. ЕРО мл (и 503 нг протеина (мл) уравненный по отношению к ЕРО-стандарту WПО "International Reference Рreрarational of Еrytroрoietin. Нuman, Urinary for Bioassay, (2 по I.Р.О. established". 1971) Стандартные концентрации находятся в области 10-100 mV/мл.
Испытывающиеся на ЕРО-активность лиофилизаты сначала растворяли в 2 мл воды для инъекционных целей, осуществляли дальнейшие разбавления так же как в случае рабочего стандарта с помощью ВSА-буфера (8,75 г NаСl, 1,95 г СаСl2х2Н2О, 1,00 г ВSА) бычий сывороточный альбумин фирмы Саlbiochem (вода для инъекционных целей до 1 л). 3Н-Метил-тимидин (удельная активность 2 Cu/моль) получали от Neu England Nuclear.
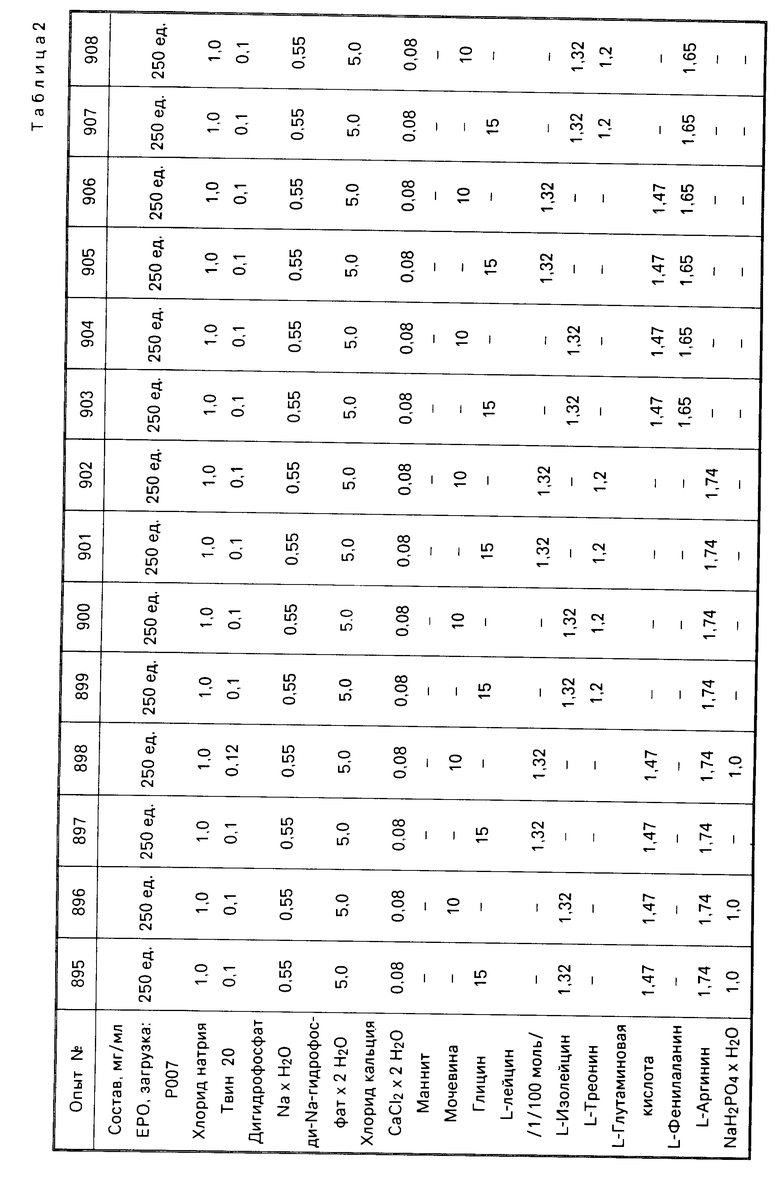
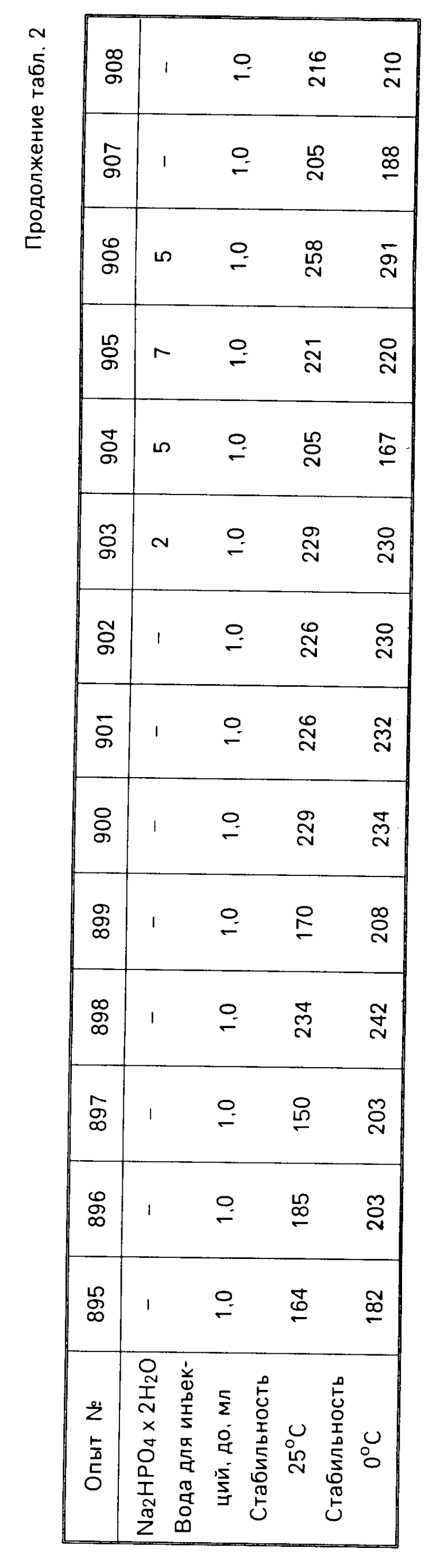
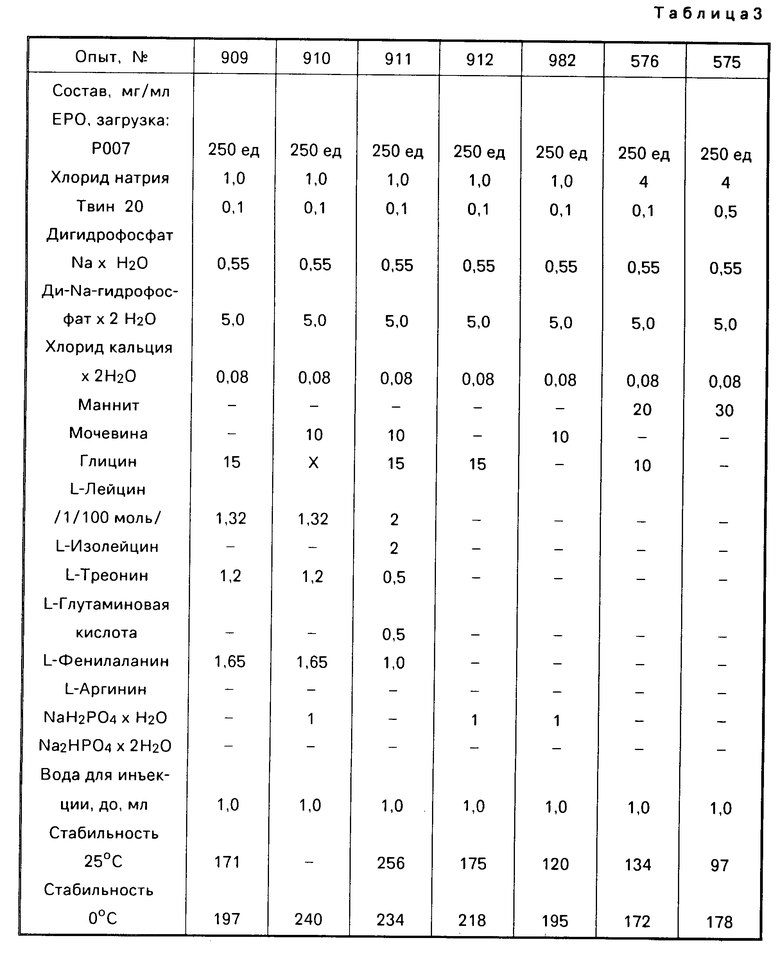
П р и м е р 7. Таким же образом, как и в примере 6, несколько измененную штамм/рецептуру смешивали с мочевиной и различными аминокислотами, соответственно смесями. Для сравнения исследовали две содержащие маннит рецептуры, которые соответствуют европейскому патенту 178665. Результаты представлены в табл.2,3.
Изобретение относится к медицине, а именно к химико-фармацевтической промышленности, и касается способа получения инъекционной формы эритропоэтина. Сущность способа заключается в смешивании эритропоэтина с мочевиной и смесью аминокислот с добавлением полиэтиленсорбитанлаурата, взятых в определенных количествах, при этом доза эритропоэтина составляет 100 5000 ед. далее проводят стерилизующую фильтрацию и лиофилизацию. Технический результат заключается в повышении стабильности лекарственной формы. 1 з. п. ф-лы, 3 табл.
| УСТРОЙСТВО для УЛЬТРАЗВУКОВОЙ ОБРАБОТКИ | 0 |
|
SU178665A1 |
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1995-09-10—Публикация
1988-09-05—Подача