Изобретение касается новых азотнокислых эфиров производных циклогексанола с общей формулой I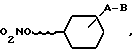
где
A-валентность или C1-C6 - алкиленовая цепь;
B - группа -NR1-CO-Z, -NR1-SO2-Z или -CO-NR2-Z;
R1 - водород или C1-C6- алкильная группа;
R2 - водород, гидрокси -C1-C6-алкил-, C1-C6-алкил, C2-C6-алкенил-;
Z - водород, C1-C6-алкил, C2-C6 - алкенил- или C2-C6 -алкенил-группа которые могут быть одно- или многократно замещены на гидрокси-, C1-C6- алкокси-, галоген-, циано-, карбокси-, C1-C6-алкоксикарбонил-, -CO-NR3R4, или C1-C6 = алкилкарбонилмеркапто-группу, пиридинил, N-оксипиридинил, или пирролидиновое кольцо, или Z вместе с R2 и атомом азота, к которому они присоединены, образуют шестичленное гетероциклическое кольцо, которое дополнительно может иметь в своем составе атом кислорода, R3 и R4- C1-C6 = алкил, водород, а также их оптически активных форм и лекарственных препаратов, содержащих эти соединения.
Аналогичные соединения с нитросизофункцией известны из более ранних Европейских заявок [1, 2].
В [1] описаны в числе прочих нитроксициклогексиламины, содержащие концевую основу аминогруппу. В [2] представлены нитроксисоединения, в которых нитроксигруппа через группу A-B соединена с пирролидиновым или пиперидиновым кольцом. В EP A-0.359.335 описаны также препараты, содержащие производные нитратных эфиров в качестве активного вещества для лечения заболеваний сердца и органов кровообращения. В приведенных там примерах 35-40 представлены циклогексанолдинитраты, замещенные в 2-, 3- и 4-х положениях циклогексанового кольца, как соответственно циклогексанолнитрат, имеющий нитроксигруппу в 2-м положении.
Нитросоединения для лечения болезней сердца описаны в патенте [3].
Представляемые изобретением соединения с формулой (I) обладают ценными фармацевтическими свойствами. Они способствуют снижению потребности в кислороде или сердце, стимулируют кровоток и снижают давление крови. Неожиданно удалось установить, что заявляемые соединения обладают нитратоподобным действием особенно длительной продолжительности. Поэтому они могут быть использованы для профилактики и/или лечения болезней сердца и органов кровообращения, например, Angina pectoris.
Группа A-B может находиться в 2-, 3- и 4-х положениях циклогексильного кольца, причем 3- и 4-е положения можно считать более предпочтительными. Группа A-B может находиться в цис и транс-положениях, причем транс-положение более предпочтительно.
Алкильные, алкенильные и алкинильные радикалы в указанных выше группах, например в алкокси-, алкил-, или алкил- карбонилокси= группах, могут быть прямыми или разветвленными и могут содержать 1-6 или 2-6 C-атомов, предпочтительно 1-4 или 2-4 C-атомов. Линейные алкильные радикалы могут представлять собой метил-, этил-, н-пропил-, н-бутил- и н-пентилрадикал. Разветвленные алкильные радикалы могут быть, например, группами -CH(CH3)-, -C(CH3)2-, -CH(CH3)-CH2- или -CH2-CH(CH3)-CH2.
Алкенильные радикалы - это прежде всего линейные радикалы, как например, винил-, 1-пропенил-, или 2-пропенилогруппа. Алкинил-радикалы могут быть прямыми или разветвленными, например, пропаргил- или 2-метил-3-бутинил.
Представляемые изобретением соединения общей формулы I могут быть получены по известному методу, а именно соединение общей формулы II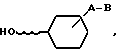
где
A-B имеют указанное выше значение, подвергаются реакции с образованием нитрат=эфиров,
соединение общей формулы III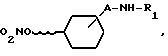
вступают во взаимодействие с соединением общей формулы IV
W-CO-Z (IVa) или W-SO2-Z (IVb)
где
R1 и Z имеют указанное выше значение,
W - представляет собой реакционноспособную группу, или
соединение общей формулы V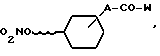
реагирует с соединением общей формулы VI
R2-NH-Z,
где
R2, W, A и Z имеют указанное выше значение, и полученные при этом соединения общей формулы (I) в последующем преобразуются в другие соединения формулы (I). Некоторые соединения общей формулы (I) представляют собой новые вещества. Они могут быть получены при использовании известных методов, причем
соединение общей формулы VII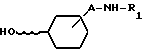
где
R1 и A имеют указанное выше значение, вступает во взаимодействие с соединением общей формулы IV, или
соединение общей формулы VIII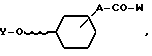
где
A и W имеют указанное выше значение, а Y представляет собой защитную группу, реагирует с соединением общей формулы VI с последующим отщеплением защитной группы Y.
Реакцию образования нитрат=эфиров для получения соединений общей формулы I можно проводить при взаимодействии соединений общей формулы II с образующим эфиры азотной кислоты реактивом, таким как дымящаяся азотная кислота, смесь из дымящейся азотной кислоты и ацетангидрата, смесь дымящейся азотной кислоты и концентрированной серной кислоты или пятиокись азота при низких температурах в присутствии или отсутствии инертного растворителя.
Диапазон реакционных температур лежит в пределах от комнатной температуры до -60oC, предпочтительно от -30 до 0oC. Молярное соотношение реакционных компонентов от 1 до 10.
В качестве реакционноспособной группы можно рассматривать галогениды, такие как бром или хлор, алкилкарбоксилаты или гидроксильную группу. Поэтому соответствующие активированные карбоновые кислоты IV и V существуют в форме эфиров, лактионов, галогенидов или ангидридов карбоновых кислот. Однако активирование карбоновых кислот можно проводить также, используя такие реактивы, как N, N-карбонилдиимидазол, N,N-дициклогексил-карбодиимид или эфиры хлормуравьиной кислоты. Молярные соотношения для реакционных компонентов выбираются в пределах 1:100.
В качестве защитной группы V могут быть использованы обычные гидроксигруппы, например, ацетилогруппа.
Соединения в общей формуле VII, где A-валентность, R1 - водород или ацетил, описаны в Ber, 72, 995, 1939. Подобные соединения можно получать аналогичным способом. При A в формуле, обозначающем валентность и R1 -хлорацетил- или хлорпропионил-группа, эти соединения описаны, как промежуточные продукты в [1]. Аналогично могут быть получены другие соединения с формулой VII.
Соединения с общей формулой VIII, где A- валентность, V - ацетилогруппа и W-гидроксильная группа, можно получить по методу, описанному J.Chem.Soc. 1950, 1979. Другие соединения с формулой VIII можно получить с применением аналогичного метода.
Соединения III и V известны из EP-A-192 829 и описаны там как промежуточные продукты с формулами XI и IX.
Дополнительное преобразование соединений с формулой I в другие соединения формулы I становятся возможным за счет того, что карбоксильная группа вследствие взаимодействия со спиртами превращается в соответствующие производные эфиров или при реакции с аминами в соответствующие амиды. Используемые карбоновые кислоты можно предварительно преобразовать в активные производные карбоновых кислот, такие как ангидриды или галогениды, применяя для этого известные методы. В случае Z-замещенный на алкилкарбонильную группу радикал, то такие соединения вследствие гидролиза эфира преобразуются в соответствующие гидроксизамещенные производные. При Z - N-оксипиридиновое кольцо их предпочтительно получать из соответствующих пиридин-производных с формулой I, путем дополнительного окисления с помощью способных к переносу кислорода реагентов, таких как, например, перекись водорода.
Представляемые соединения с общей формулой I представляют собой циклогексан-производные, заместители в которых - ONO2 и A - B могут находиться в 1,2-, 1,3 или 1,4-х положениях. Структура может иметь цис- и транс-конфигурацию. В случае положений 1,2 и 1,3, представляемых в изобретении, соединения имеют два хиральных C-атома. Поэтому предметом изобретения являются также все рацематы, смеси диастереомеров и оптически активные формы представляемых изобретением соединений с общей формулой I.
Получение совместимых в фармакологическом отношении солей соединений формулы I производится путем взаимодействия с гидроокисями или карбонатами щелочных или щелочно-земельных металлов или с органическими основаниями, например триэтиламином.
Вещества с общей формулой I и их соли могут применяться в жидком или твердом виде энтерально или парэнтарально. В качестве среды для инъекций используется вода, что является более предпочтительным, которая содержит обычные добавки, такие как стабилизирующие свойства, стимуляторы растворения или буферы. Добавление подобных средств, таких как тартратный или цитратный буфер, этанол, комплексообразователь (например, этилен - диаминтетрауксусная кислота или ее не токсичные соли), высокомолекулярные полимеры (такие как жидкий полиэтиленоксид), направлено на регулирование вязкости. Твердые вещества-носители - это, например, крахмах, лактоза, маннит, метилцеллюлоза, тальк, высокодисперсные кизельгелевые кислоты, высокомолекулярные жирные кислоты (например, стеариновые кислоты), желатин, агар-агар, фосфат кальция, стеарат магния, животные и растительные масла, и твердые высокомолекулярные полимеры (например, полиэтиленгликоль). Предназначенные для орального применения составы могут, по желанию, содержать в своем составе вкусовые и подслащивающие вещества.
Лекарственные средства, содержащие соединения с формулой I, предназначены для одноразового ежедневного орального применения. Лекарственные средства могут содержать представляемое в изобретении соединение в количестве 1 - 50 мг, предпочтительно 5 - 30 мг на форму применения.
Наряду с представленными ниже примерами в этом качестве могут быть использованы, например, следующие соединения:
моноамид N-метил-N-(транс-4-нитроксициклогексил)янтарной кислоты;
диамид N-метил-N-(транс-4-нитроксициклогексил)янтарной кислоты;
диамид N-метил-N-(транс-4-нитроксициклогексил) N'N'- диметилянтарной кислоты;
цис-N-формил-3-нитроксициклогексиламин;
моноамид N-(цис-3-нитроксициклогексил)янтарной кислоты;
диамид N-(цис-3-нитроксициклогексил)янтарной кислоты;
диамид N-(цис-3-нитроксициклогексил) N'N'-диметилянтарной кислоты;
транс-N-формл-2-нитроксициклогексиламин;
транс-N-ацетит-2-нитроксициклогексиламин;
моноамид N-(транс-2-нитроксициклогексиламин)янтарной кислоты;
диамид N-(транс-2-нитроксициклогексиламин)янтарной кислоты;
диамид N-(транс-2-нитроксициклогексиламин)N'N'-диметилянтарной кислоты;
амид 2-циан-2-метил-N-(транс-4-нитроксициклогексиламин) пропионовой кислоты;
цис-N-формил-4-нитроксициклогексиламин;
N-(тетразол-5-ил)-амид транс-4-нитроксициклогексилкарбоновой кислоты;
амид 2-метилмеркапто-N-(транс-4-нитроксициклогексил)уксусной кислоты;
амид 2-амино-3-метилмеркапто-N-(транс-4-нитроксициклогексил) пропионовой кислоты;
амид 2-метиламино-3-метилмеркапто-N-(транс-4-нитроксициклогексил) пропионовой кислоты;
амид 2-метиламино-3-ацелтилмеркапто-N-(транс-4- нитроксициклогексил) пропионовой кислоты;
амид 2-ацетиламино-3-меркапто-N-(транс-4-нитроксициклогексил) пропионовой кислоты;
амид 2-ацетиламино-3-ацетилмеркапто-N-(транс-4- нитроксициклогексил) пропионовой кислоты;
амид 2-амино-3-меркапто-N-(транс-4-нитроксициклогексил) масляной кислоты;
амид 2-амино-4-метилмеркапто-N-(транс-4-нитроксициклогексил) масляной кислоты;
амид 2-ацетиламино-4-метилмеркапто-N-(транс-4- нитроксициклогексил) масляной кислоты;
амид N-[2-//3-пропионовокислый этиловый эфир/]-транс-4- нитроксициклогексилкарбоновой кислоты;
этиловый эфир-амид N-[2-(3-ацетилмеркапто)пропионовой кислоты] транс-4-нитроксициклогексилкарбоновой кислоты;
этиловый эфир-амид N-[2-(4-метилмеркапто)масляной кислоты] транс-4-нитроксициклогексанкарбоновой кислоты;
N-(2-меркаптоэтил)-амид транс-4-нитроксициклогексанкарбоновой кислоты;
амид 2-меркапто-N-(транс-4-нитроксициклогекил)уксусной кислоты.
Пример 1. 28,3 мл (0,3 моль) ангидрида уксусной кислоты смешивали с 375 мл ацетонитрила, охлаждали на ледяной бане до 0 - 5oC и добавляли по каплям 12,6 мл (0,3 моль) 100%-ной азотной кислоты. Через 30 мин при перемешивании и охлаждении при 0 - 5oC добавляли твердый транс-N-ацетил-4-гидроксициклогексил-амин в количестве 15,7 г (0,1 моль). Реакционную смесь продолжали перемешивать еще в течение 3 ч при 0 - 5oC, после чего осторожно выливали в раствор 150 г (1,8 моль) кислого карбоната натрия в 500 мл ледяной воды. После экстрагирования с использованием эфира уксусной кислоты, высушивания органической фазы и отгонки под вакуумом оставалось 17,8 г сырого продукта. После перекристаллизации из уксусного эфира получали 10,3 г указанного в заголовке соединения с. т. пл. 146 - 148oC, т.е. 50 % от теории.
По аналогичному методу были получены следующие соединения:
1/1 Транс-N-н-гексаноил-4-циклогексиламин из транс-N-н-гексаноил-4-гидроксициклогексиламина с т. пл. 100 - 101oC (эфир), выход 58%.
1/2 Амид транс-4-нитроксициклогексанкарбоновой кислоты из Амида транс-4-гироксициклогексанкарбоновой кислоты с т. пл. 160 - 159oC (эфир уксусной кислоты), выход 62%.
1/3 Диметиламид транс-4-нитроксициклогексанкарбоновой кислоты из диметиламида транс-4-гидроксициклогексанкарбоновой кислоты с т.пл. 108 - 110oC (эфир уксусной кислоты), выход 40%.
1/4. Морфолид транс-4-нитроксициклогексанкарбоновой кислоты из морфолида транс-4-нитроксициклогексанкарбоновой кислоты с т. пл. 89 - 90oC (эфир), выход 40 %.
1/5. Цис-N-ацетил-4-нитроксициклогексиламин из цис-N-ацетил-4-нитроксициклогексиламина т. пл. 107 - 109oC (эфир). Выход 45 %.
1/6. Амид 2-хлор-N-/транс-4-нитроксициклогексил/уксусной кислоты из амида 2-хлор-N-/транс-4-гидроксициклогексил/уксусной кислоты с т. пл. 102 - 104oC (эфир). Выход 34%.
1/7. Амид 2-бром-2-бром-2-метил-N-(транс-4-нитроксициклогексил /пропионовой кислоты из амида 2-бром-2-бром-2-метил-N-(транс-4- гидроксициклогексил /пропионовой кислоты с т. пл. 92 - 94oC (эфир/изогексан). Выход 60 %.
1/8. Амид N-/транс-4-нитроксициклогексид/акриловой кислоты из амида N-/транс-4-гидроксициклогексил/акриловой кислоты с т. пл. 160 - 162oC (эфир уксусной кислоты). Выход 63 %.
1/9. Амид 2-циан-N-/транс-4-нитроксициклогенксил/уксусной кислоты из амида 2-циан-N-/транс-4-гидроксициклогенксил/уксусной кислоты с т. пл. 149 - 150oC (эфир). Выход 53 % от теории.
Пример 2. Транс-N-ацетил-4-нитроксициклогексиламин. Раствор 2,3 г (0.015 моль) транс-4-нитроксициклогексиламина в 25 мл эфира уксусной кислоты растворяли в 10 мл (0,13 моль) ангидрида уксусной кислоты и в течение ночи перемешивали при комнатной температуре. Затем охлаждали до 5oC, добавляли 100 мл этанола и после выдерживания в течение ночи при комнатной температуре перегоняли под вакуумом. После растирания с эфиром отсасывали кристаллическую массу. Получали 1,5 г указанного в заголовке соединения с т. пл. 146 - 148oC, т.е. 50 % от теории.
Аналогичным способом получали следующие соединения.
2/1 Транс-N-ацетил-4-нитроксициклогексилметиламин из транс-4-нитроксициклогексилметиламина с т. пл. 91 - 963oC (эфир). Выход 30 %.
2/2. Цис-N-ацетил-3-нитроксициклогексиламин из цис-3-нитроксициклогексиламина с т. пл. 112 - 113oC (эфир). Выход 41 %.
2/3. Транс-N-метил-N-ацетил-4-нитроксициклогексиламин из транс-N-метил-4-нитроксициклогексиламина с т. пл. 37 - 39oC (эфир/изогексан). Выход 77 % от теории.
2/4. Транс-N-этил-N-ацетил-4-нитроксициклогексиламин из транс-N-этил-4-нитроксициклогексиламина с т. пл. 68 - 69oC (эфир). Выход 35 % от теории.
Пример 3. Транс-N-формил-4-нитроксициклогексиламин. Смесь из 6,8 мл (0,072 моль) ангидрида уксусной кислоты и 2,8 мл (0,072 моль) муравьиной кислоты нагревали в течение 2 ч при 60oC, после чего при охлаждении при 5oC разбавляли 1,9 г (0,012 моль) транс-4-нитроксициклогексиламина. Затем в течение ночи перемешивали при комнатной температуре, разбавляли 100 мл эфира уксусной кислоты и добавляли 100 мл воды. После нейтрализации насыщенным раствором кислого карбоната натрия органическую фазу высушивали сульфатом натрия и отгоняли под вакуумом. После растирания с эфиром отсасывали кристаллическую массу. Получали 1,5 г указанного в заголовке соединения с т. пл. 148 - 150oC, т.е. 66 % от теории.
Аналогичным способом получали следующие соединения.
3/1. Транс-N-формил-4-нитроксициклогексилметиламин из транс-4-нитроксициклогексилметиламина с т. пл.: масло. Выход 70 %.
3/2. Транс-N-метил-N-формил-4-нитроксициклогексиламин из транс-N-метил-4-нитроксициклогексиламина с т. пл. 52 - 54oC (эфир/изогексан). Выход 60 % от теории.
Пример 4. Моноамид N-(транс-4-нитроксициклогексил)янтарной кислоты. К раствору 4,8 г (0,03 моль) транс-4-нитроксициклогексиламина в 25 мл ацетонитрила добавляли при 10oC 3 г (0,33 моль) ангидрида янтарной кислоты и перемешивали при комнатной температуре в течение 48 ч. После отсасывания оставалось 3,6 г указанного в заголовке соединения с т. пл. 136 - 138oC, т.е. 46 % от теории.
Аналогичным способом получали следующие соединения.
4/1. Моноамид N-(транс-4-нитроксициклогексил)малеиновой кислоты из транс-N-нитроксициклогексиламина из ангидрида малеиновой кислоты с т. пл. 178 - 179oC (ацетонитрил). Выход 47 %.
4/2. Моноамид N-(транс-4-метил)янтарной кислоты из транс-4-нитроксициклогексилметиламина и ангидрида янтарной кислоты с т. пл. 79 - 81oC (эфир). Выход 80 %.
Пример 5. Диамид N-(транс-4-нитроксициклогексил)янтарной кислоты. Суспензию из 3,9 г (0,015 моль) моноамида N-(транс-4-нитроксициклогексил)янтарной кислоты (пример 4) в 100 мл абсолютного метиленхлорида разбавляли 3,1 г (0,015 моль) пятихлористого фосфора при охлаждении до 5 - 10oC. После двухчасового перемешивания при комнатной температуре перегоняли под вакуумом при максимальной температуре 20oC, растирали с абсолютным эфиром и отсасывали. Хлорангидрид тотчас же добавляли в 50 мл 10%-ного аммиака при 5 - 10oC и перемешивали в течение ночи при комнатной температуре. После отсасывания оставалось 1,2 г указанного в заголовке соединения с т. пл. 167 - 169oC, т.е. 30 % от теории.
Аналогичным способом получали следующие соединения.
5/1. Диамид N-/транс-4-нитроксициклогексил/малеиновой кислоты из моноамида Т-(транс-4-нитроксициклогексил)малеиновой кислоты (пример 4/1) и аммиака с т. пл. 151 - 1522 (эфир уксусной кислоты). Выход 31 %.
5/2. Диамид N-/транс-4-нитроксициклогексил/N'N-диметилянтарной кислоты из моноамида N-(транс-4-нитроксициклогексил)янтарной кислоты (пример 4) и диметиламина с т. пл. 120 - 1222 (эфир). Выход 42 %.
5/3. Диамид N-(транс-4-нитроксициклогексилметил)янтарной кислоты из моноамида N-(транс-4-нитроксициклогексиламетил)янтарной кислоты и аммиака с т. пл. 156 - 157oC (эфир уксусной кислоты). Выход 63 %.
5/4. Диамид N-/транс-4-нитроксициклогексилметил/-N'N'- диметилянтарной кислоты из моноамида N-(транс-4-нитроксициклогексилметил)янтарной кислоты и диметиламина с т. пл. 70 - 71oC (эфир). Выход 40 %.
Пример 6. Транс-N-пропионил-4-нитроксициклогексиламин. К раствору 3,2 г (0,02 моль) транс-4-нитроксициклогексиламина в 80 мл абсолютного метиленхлорида добавляли при 5 - 10oC 3 мл (0,02 моль)триэтиламина и затем 2 г (0,02 моль) пропионилхлорида в 20 мл абсолютного метиленхлорида. Перемешивали ночь при комнатной температуре, трехкратно встряхивали с 25 мл воды, высушивали органическую фазу с применением сульфата натрия и перегоняли под вакуумом. Остаток растирали с эфиром и отсасывали. Оставалось 2,8 г указанного в заголовке соединения с т. пл. 138 - 140oC, т.е. 65 %: от теории.
Аналогичным способом получали следующие соединения.
6/1 Амид-2-метокси-N-(транс-4-нитроксициклогексил/уксусной кислоты из транс-4-нитроксициклогексиламина и хлорангидрида метоксиуксусной кислоты с т.пл. 98 - 99oC (эфир). Выход 40%.
6/1 Амид 2-ацетокси-N-/транс-4-нитроксициклогексил/уксусной кислоты из транс-4-нитроксициклогексиламина и хлоргидрида ацетоксиуксусной кислоты с т. пл. 98 - 99oC (эфир). Выход 90%.
6/3 Амид 2-ацетокси-N-/транс-4-нитроксициклогексил/пропионовой кислоты из хлорангидрида транс-4-нитроксициклогексиламина и хлорангидрида 2-ацетокси-пропионовой кислоты с
т.пл. 104 - 105oC (эфир уксусной кислоты/эфир). Выход 80%.
6/4 Амид 3-ацетокси-N-/транс-4-нитроксициклогексил/2,2-диметилпропионовой кислоты из транс-4-нитроксициклогексиламина и хлоргидрида 3-ацетокси-2,2-диметилпропионовой кислоты с т.пл. масло. Выход 80%.
6/5 N-/транс-4-нитроксициклогексил/никотиновой кислоты из транс-4-нитроксициклогексиламина и азида никотиновой кислоты с т.пл. 171 - 173oC (эфир уксусной кислоты). Выход 46%.
6/6 Амид N-/транс-4-нитроксициклогексил/изоникотиновой кислоты из транс-4-нитроксициклогексиламина и азида изоникотиновой кислоты с т.пл. 170 - 172oC (2-пропанол). Выход 40%.
6/7 Амид 2-ацетокси-N-/транс-4-нитроксициклогексилметил/уксусной кислоты из транс-4-нитроксициклогексил-метиламина и хлоргидрида ацетоуксусной кислоты с т.пл. 65 - 66oC (эфир). Выход 60%.
6/8 Амид N-транс-4-нитроксициклогексил-2,2-диметилпропионовой кислоты из транс-4-нитроксициклогексиламина и хлорангидрида 2,2-диметилпропионовой кислоты с т.пл. 148 - 151oC. Выход 25% от теории.
6/9 Амид N-транс-4-нитроксициклогексил-метансульфокислоты из транс-4-нитроксициклогексиламина и хлорангидрида метансульфокислоты с т.пл. 154 - 155oC. Выход 84% от теории.
6/10 Амид 2,2-бис-/ацетоксиметил/-N-транс-4-нитроксициклогексил- пропионовой кислоты из транс-4-нитроксициклогексиламина и хлорангидрида 2,2-бис-(-ацетоксиметил)пропионовой кислоты с т. пл. 95 - 97oC (эфир уксусной кислоты). Выход 40% от теории.
6/11 N-этоксикарбонил-транс-4-нитроксициклогексиламин из 4-нитроксициклогексиламина и этилового эфира хлормуравьиной кислоты с т.пл. 93 - 94oC (эфир/изогексан). Выход 56% от теории.
6/12 Амид 2-ацетилмеркапто-N-(транс-4-нитроксициклогексил)-уксусной кислоты из транс-4-нитроксициклогексиламина и хлорангидрида 2-ацетилмеркаптоуксусной кислоты с т.пл. 127 - 129oC (эфир). Выход 67% от теории.
Пример 7. N-/2-метил-3-бутил-2-ил/амид 4-нитроксициклогексанкарбоновой кислоты. 6,2 г /0,075 моль/ 2-метил-3-бутил-2-иламина растворяли в 100 мл абсолютного эфира уксусной кислоты и при охлаждении до 5 - 10oC добавляли по каплям 5,2 г (0,025 моль) хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты в 25 мл абсолютного эфира уксусной кислоты. После трехчасового перемешивания при комнатной температуре встряхивали с 100 мл воды, фазу этилацетата высушивали с помощью сульфата натрия и перегоняли под вакуумом. Остаток разбавляли эфиром и отсасывали. Получали 2,6 г указанного в заголовке соединения с т.пл. 138 - 139oC, т.е. 40% от теории.
Аналогичным способом получали следующие соединения.
7/1 N-(2-гидроксиэтил)амид транс-4-нитроксициклогексанкарбоновой кислоты из хлорангидрида транс-4(-нитроксициклогексан)карбоновой кислоты 2-гидроксиэтиламина с т.пл. 132 - 133oC (эфир). Выход 25%.
7/2 N-(3-гидрокси-пропил)амид транс-4-нитроксициклогексанкарбоновой кислоты
из хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты и 3-гидроксипропиламида с
т.пл. 78 - 79oC. Выход 45%.
7/3 N-/N,N-диметил-ацетамидо/амид транс-4-нитроксициклогексанкарбоновой кислоты из хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты и N, N-диметил-амида уксусной кислоты с
т.пл. 142 - 144oC (этанол). Выход 20%.
7/4 N-/2,2-диметилацетамидо/амид транс-4-нитроксициклогексанкарбоновой кислоты
из хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты и амида 2-амино-2-метилпропионовой кислоты с
т.пл. 180 - 181oC (вода). Выход 53%.
7/5 N-/метил/гидроксиламид транс-4-нитроксициклогексанкарбоновой кислоты из хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты и N-метил-гидроксидамина с
т.пл. 125 - 126oC (эфир). Выход 53%.
7/6 N-2-/2-метил-3-этил/амид транс-4-нитроксициклогексанкарбоновой кислоты
из хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты и 2-амино-2-метил-пропанола с т.пл. 150 - 151oC (эфир). Выход 65% от теории.
7/7 N-бис-(2-гидрокси-этил)амид транс-4-нитроксициклогексанкарбоновой кислоты
из хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты и бис-(2-гидроксиэтил)амина с
т.пл. 78oC (этилацетат/эфир). Выход 80% от теории.
Пример 8. N-Амид (уксусной кислоты) транс-4-нитроксициклогексанкарбоновой кислоты 1,1 г (0,015 моль) аминоуксусной кислоты растворяли в 25 мл воды и добавляли 0,6 г (0,015 моль) гидроокиси натрия. После охлаждения добавляли по каплям при 5oC раствор 3,1 г (0,015 моль) хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты в 10 мл диоксана. При одновременном добавлении 2N едкого натра (7,5 мл) поддерживали pH раствора на уровне 12. Смесь перемешивали в течение 2 ч при комнатной температуре, доводили pH до 1 и экстрагировали этилацетатом. Органическую фазу высушивали сульфатом натрия и перегоняли под вакуумом. После растворения с эфиром и отсасывания получали 1,4 г указанного в заголовке соединения с т.пл. 143 - 144oC (эфир), т.е. 38% от теории.
Аналогичным способом получали следующие соединения.
8/1 N-пропионовокислый амид транс-4-нитроксициклогексанкарбоновой кислоты из хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты и 2-амино-пропионовой кислоты с
т.пл. 113 - 114oC (эфир). Выход 25%.
8/2 N-/ацетамидо/амид транс-4-нитроксициклогексанкарбоновой кислоты из хлорангидрида транс-4-нитроксициклогексанкарбоновой кислоты и амида аминоуксусной кислоты с
т.пл. 170oC (этилацетат). Выход 35% от теории.
Пример 9. Амид-2-гидрокси-N-/транс-4-нитроксициклогексил/уксусной кислоты 6,1 г (0,023 моль) амида 2-ацетокси-N-(транс-4-нитроксициклогексилуксусной кислоты (пример 6/2) растворяли в 100 мл раствора аммиака в метаноле и перемешивали в течение ночи при комнатной температуре. После отгонки по вакуумом растворяли этилацетате и встряхивали с водой. Фазу этилацетата высушивали сульфатом натрия и перегоняли под вакуумом. После растворяли с эфиром и отсасывания. Получали 1,8 г указанного в заголовке соединения с т.пл. 81 - 83oC, т.е. 36% от теории.
Аналогичным способом получали следующие соединения.
9/1 Амид 2-гидрокси-N-(транс-4-нитроксициклогексил)пропионовой кислоты из амида 2-ацетокси-N-(транс-4-нитроксициклогексил)пропионовой кислоты (пример 6/3) с т.пл. 117 - 118oC (эфир). Выход 23%.
9/2 Амид 2-гидрокси-N-(транс-4-нитроксициклогексил)-2,2- димметилпропионовой кислоты
из амида 2-ацетокси-N-(транс-4-нитроксициклогексил)-2,2- диметил-пропионовой кислоты (пример 6/4) с т.пл. 100 - 101oC (эфир). Выход 28%.
9/3 Амид 2-гидрокси-N-/транс-4-нитроксициклогексилметил/- уксусной кислоты из амида 2-ацетокси-N-(транс-4-нитроксициклогексилметил)уксусной кислоты (пример 6/7) с т.пл. 111 - 112oC (эфир). Выход 24%.
9/4 Амид 2,2-бис-(гидроксиметил)-N-транс-4-нитроксициклогексилпропионовой кислоты из амида 2,2-бис-(ацетоксиметил)-N-транс-4-нитроксициклогексилпропионовой кислоты с
т.пл. 110 - 112oC (этилацетат). Выход 20% от теории.
Пример 10. Амид 4-гидрокси-N-/транс-4-нитроксициклогексил/масляной кислоты 4,8 г (0,03 моль) транс-4-нитроксициклогексиламина смешивали с 5,7 мл 4-бутилролактона и перемешивали в течение 3 дней при комнатной температуре. Для удаления избыточного лактона фильтровали через кизельгелевую кислоту с применением этилацетата. После соединения чистых фракций перегоняли под вакуумом, растирали с эфиром и отсасывали. Оставалось 2,1 г указанного в заголовке соединения с т. пл. 58 - 60% от теории.
Пример 11. Амид N-(транс-4-нитроксициклогексил-)-(S)-пироглютаминовой кислоты.
2,1 г (0,016 моль) (S)-пироглютаминовой кислоты (2-пиролидон-5-карбоновой кислоты) растворяли в 50 мл абсолютного тетрагидрофурана и 2,5 мл (0,018 моль) триэтиламина. После охлаждения до 5oC добавляли по каплям 2 мл (0,016 моль) пивалоилхлорида в 10 мл абсолютного тетрагидрофурана. После 15-минутного перемешивания при 5oC добавляли по каплям раствор 3,9 г транс-4-нитроксициклогексиламина в 40 мл абсолютного тетрагидрофурана и 2,8 мл (0,02 моль) триэтиламина. Затем продолжали перемешивание в течение 2 дней при комнатной температуре, отсасывали и удаляли под вакуумом растворитель. Остаток растворяли в этилацетате и встряхивали с кислым карбонатом натрия. После просушивания фазы этилацетата с применением сульфата натрия, отгоняли под вакуумом, растирали с эфиром и отсасывали. Получали 1,5 г указанного в заголовке соединения с т.пл. 166oC, т.е. 35% от теории.
Пример 12. Амид-N-оксид -N-/транс-4-нитроксициклогексил/никотиновой кислоты. 1,5 г (0,005 моль) амида N-транс-4-нитроксициклогексилникотиновой кислоты (пример 6/5) растворяли в 4 мл уксусной кислоты, добавляли по каплям 4 мл 30%-ной перекиси водорода и перемешивания в течение 2 дней при 40oC. После концентрирования и растирания с эфиром отсасывали кристаллы. Получали 0,9 г указанного в заголовке соединения с т.пл. 170 - 171oC, т.е. 53% от теории.
Аналогичным способом получали следующие соединения.
12/1 Амид-N-оксид N-/транс-4-нитроксициклогексил/изоникотиновой кислоты из амида N-(транс-4-нитроксициклогексил)изоникотиновой кислоты (пример 6/6) с т.пл. 180oC (этилацетат). Выход 82%.
Пример 13. Транс-4-гидроксициклогексилметиламин /VII/
а) Цис-транс-4-гидроксициклогексанкарбоновая кислота
184 г (1,07 моль) этилового эфира цис-транс-4-гидроксициклогексанкарбоновой кислоты /см. SACS, 70, /1948/, 1998/ нагревали в 1,8 л воды с 119,8 г (2,14 молями) гидроокиси калия в течение 3 ч до флегмы. После подкисления концентрированной соляной кислотой и экстрагировали в метиленхлоридом получали 146 г кислоты с т.пл. 111 - 1152, т.е. 94% от теории.
б) Транс-4-0-ацетилциклогексанкарбоновая кислота
145 г (1,01 моль) цис-транс-4-гидроксициклогексанкарбоновой кислоты суспендировали в 1 л уксусной кислоты, добавляли по каплям 123,5 г (1,21 моль) ацетилхлорида и нагревали в течение 5 ч до флегмы. После отгонки уксусной кислоты добавляли 200 мл воды и перегоняли досуха. Остаток растворяли в диизопропиловом эфире и после кристаллизации отсасывали. Получали 112 г сырого продукта. После перекристаллизации в 740 мл воды получали 84 г, т.е. 44% от теории чистого транс-соединения с т.пл. 140 - 141oC.
в) Метиловый эфир транс-4-O-ацетилциклогексанкарбоновой кислоты.
84 г /0,45 моль/ транс-4-O-ацетилциклогексанкарбоновой кислоты растворяли в 1 л метанола, добавляли 8,6 г (0,045 молей) пара-толуолсульфокислоты и нагревали 20 ч до флегмы. После отгонки метанола остаток растворяли в воде и нейтрализовали кислым карбонатом натрия. Водный раствор насыщали поваренной солью и несколько раз экстрагировали этилацетатом. Экстракты эфиров уксусной кислоты высушивали сульфатом натрия, отфильтровали и перегоняли. Получали 72,7 г эфира, т.е. 80% от теории продукта в виде бесцветного масла.
г) Амид транс-4-гидроксициклогексанкарбоновой кислоты
36 г /0,18 моль/ метилового эфира Транс-4-O-ацетилциклогексанкарбоновой кислоты нагревали в 500 мл метанола и 500 мл жидкого аммиака в течение 24 ч при 100oC в 2-литровом автоклаве. После испарения аммиака и отгонки метанола остаток растирали с эфиром и отсасывали. Получали 21,6 г амида с т. пл, 208 - 210oC, т.е. 83% от теории.
л) Транс-4-гидроксициклогексилметиламин.
К суспензии 11,4 г /0,3 моль/ литийалюминийгидрида в 500 мл безводного тетрагидрофурана загружали в твердом виде 21,6 г /0,15 моль/ амида транс-гидроксициклогексанкарбоновой кислоты и в течение 24 ч кипятили до флегмы. После разложения с применением 45 мл насыщенного раствора поваренной соли отсасывали и фильтрат перегоняли. Остаток перетирали с эфиром и отсасывали кристаллы. Получали 11 г амина, т.е. 57% теории с т.пл. 137 - 139oC.
Пример 14. Фармакологические исследования.
Поставленная задача. Целью проводимых исследований было найти нитраты, способные более продолжительное время сохранять свое действие, лечебное действие и преимущества которых состояло бы в том, чтобы они принимались один раз в день и оказывали бы при этом необходимое терапевтическое действие. При этом исходили бы из того, что одноразовый ежедневный прием вместо многократного приводит к повышению "податливости" пациента, и может таким образом находиться под влиянием фармакокинетического профиля активности вещества, т. е. исходили из того, что разница между максимальным и минимальным уровнем вследствие незначительного падения концентраций значительно благоприятной.
Метод. Для идентификации денитрирования, представляющего собой профиль активности всех нитратов, определяли скорость денитрации в соотношении к соответствующему значению для известных ISDN-метаболитов IS-5MN. Для этого крыс умерщвляли в наркозе и печень реперфундировали соответственно концентрированным эквимолярным (5 • 10-5 моль/л) раствором IS-5-MN или исследуемым веществом в течение 4 мин. В перфузате определяли выделяющееся количество NO2. Чтобы обеспечить сравнительные условия для контроля, перфузию с IS-5-MN (стандартное вещество, этанол) трижды проводили таким образом, как если бы треть перфузии представляла собой неизвестное вещество (таким образом удавалось определить измененную в условиях эксперимента функцию печени и соответственно учитывать ее). Значения Yотн. (относительная скорость денитрации) показывают, что скорость денитрации значительно выше в сравнении с IS-5-MN. Высокие значения свидетельствуют о быстрой денитрации, низкие - соответственно о медленной.
Результаты.
Было установлено, что скорость денитрации через перфундированную печень крысы при использовании исследуемого вещества значительно выше, чем при введении изосорбит-5-мононитрата, и составляет Vотн. = 0,95, т.е. были установлены меньшие значения скорости денитрации, чем в случае изосорбит-5-мононитрата.
Результаты метода представлены ниже:
Пример - Yотн.
1 - 0,45
5/3 - 0,49
7/7 - 0,49
10 - 0,28
12/1 - 0,36л
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ КУМАРИНА, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ PLA-ИНГИБИТОРОВ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1994 |
|
RU2133745C1 |
| ФОСФОЛИПИДНЫЕ ПРОИЗВОДНЫЕ НУКЛЕОЗИДОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2104282C1 |
| 4-АМИНОПИРИДИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2126388C1 |
| Способ получения сульфонамидов алкилфенилкарбоновых кислот | 1981 |
|
SU1088664A3 |
| ПРОИЗВОДНЫЕ ФОСФОНЯНТАРНОЙ КИСЛОТЫ И ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2115656C1 |
| Способ получения производных феноксиалкилкарбоновой кислоты,их солей,сложных эфиров и амидов | 1979 |
|
SU1052157A3 |
| Способ получения производных феноксиалкилкарбоновой кислоты, а также их натриевых солей, сложных эфиров и амидов | 1981 |
|
SU1097194A3 |
| Способ получения оксимов пировиноградной кислоты,их солей или амидов | 1982 |
|
SU1217252A3 |
| Способ получения производных аминопропанола или их солей | 1977 |
|
SU1041033A3 |
| СПОСОБ ПОЛУЧЕНИЯ 3-(ГЕКСАДЕКАНСУЛЬФОНИЛ- ИЛИ СУЛЬФИНИЛ-2-МЕТОКСИМЕТИЛПРОПИЛ)- (2-ТРИМЕТИЛАММОНИО-ЭТИЛ)-ФОСФАТА, ИХ СТЕРЕОИЗОМЕРОВ ИЛИ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2035466C1 |
Изобретение касается новых эфиров азотной кислоты производных циклогексанола с общей фомулой I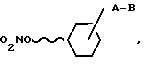 где А - черта, обозначающая валентность,или С1 - С6-алкиленовая цепь; В -группа -NR1 - CO-Z, -NR1-SO2-Z или -CO-NR2-Z, R1 - водород или С1 - С6-алкилогруппа; R2 - водород, гидрокси-, гидрокси-С1 - С6-алкил-, С1 - С6-алкил-, С2 - С6-алкенил-; Z - водород, С1 - С6алкил-, С2 - С6-алкенил или С2 - С6-алкинил-группа, которые могут быть одно- или многократно замещены на гидрокси-, С1 - С6-алкилкарбонилокси-, С1 - С6-алкокси-, галоген-, циано-, карбокси-, С1 - С6-алкоксикарбонил-, -CO-NR3R4 или С1 - С6-алкилкарбонилмеркаптогруппу или Z - означает пиридин-, N-оксипиридин-, или пирролидиновое кольцо, или же Z вместе с R2 и атомом азота, с которым связаны Z и R2, образует гетероциклическое кольцо, которое может дополнительно содержать атом кислорода, R3 и R4 - С1 - С6-алкил, водород, а также их оптически активных форм. Изобретение касается также способа получения соединений формулы I и лекарственного средства на их основе. 3 с и 7 з.п.ф-лы.
где А - черта, обозначающая валентность,или С1 - С6-алкиленовая цепь; В -группа -NR1 - CO-Z, -NR1-SO2-Z или -CO-NR2-Z, R1 - водород или С1 - С6-алкилогруппа; R2 - водород, гидрокси-, гидрокси-С1 - С6-алкил-, С1 - С6-алкил-, С2 - С6-алкенил-; Z - водород, С1 - С6алкил-, С2 - С6-алкенил или С2 - С6-алкинил-группа, которые могут быть одно- или многократно замещены на гидрокси-, С1 - С6-алкилкарбонилокси-, С1 - С6-алкокси-, галоген-, циано-, карбокси-, С1 - С6-алкоксикарбонил-, -CO-NR3R4 или С1 - С6-алкилкарбонилмеркаптогруппу или Z - означает пиридин-, N-оксипиридин-, или пирролидиновое кольцо, или же Z вместе с R2 и атомом азота, с которым связаны Z и R2, образует гетероциклическое кольцо, которое может дополнительно содержать атом кислорода, R3 и R4 - С1 - С6-алкил, водород, а также их оптически активных форм. Изобретение касается также способа получения соединений формулы I и лекарственного средства на их основе. 3 с и 7 з.п.ф-лы.
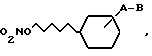
где A - связь или С1 - С6-алкиленовая цепь;
B - группа -NR1 - CO - Z, -CO - NR2 - Z, -NR1 - SO2Z;
R1 - водород или С1 - С6-алкил;
R2 - водород, OH, C1 - C6-алкил, C2 - C6-алкенил, гидрокси-(C1 - C6)-алкил;
Z - водород, C1 - C6-алкил, C2 - C6-алкенил или C2 - C6-алкинил, которые могут содержать один или два заместителя, выбранных из группы OH, C1 - C6-алкилкарбонилокси, C1 - C6-алкокси, галоген, циано, карбокси, C1 - C6-алкоксикарбонил, -CONR3R4, C1 - C6-алкилкарбонилмеркапто, пиридинил, N-оксипиридинил, пирролидинил, или Z и R2 вместе в атомом азота, к которому они присоединены, образуют шестичленное гетероциклическое кольцо, дополнительно содержащее кислород, R3 и R4 -C1 - C6-алкил, водород, а также их оптически активные формы.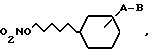
где А - связь или С1 - С6-алкилен;
B - группа -NR1 - CO - Z, -CO - NR2 - Z, -NR1 - SO2Z;
R1 - водород или С1 - С6-алкил;
R2 - водород, OH, C1 - C6-алкил, C2 - C6-алкенил, гидрокси-(С1 - С6)-алкил, Z - водород, С1 - С6-алкил, С2 - С6-алкенил или С2 - С6-алкинил, которые могут содержать один или два заместителя, выбранных из группы OH, C1 - C6-алкилкарбонилокси, С1 - С6-алкокси, галоген, циано, карбокси, С1 - С6-алкоксикарбонил, -CONR3R4, C1 - C6-алкилкарбонилмеркапто, пиридинил, N-оксипиридинил, пирролидинил, или Z и R2 вместе с атомом азота, к которому они присоединены, образуют шестичленное гетероциклическое кольцо, дополнительно содержащее кислоту, R3 и R4 - С1 - С6-алкил, водород, отличающийся тем, что соединение общей формулы II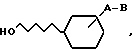
где A и B, как указано выше, подвергают взаимодействию с образующим эфир азотной кислоты реагентом.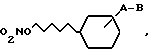
где A - связь или C1 - C6 - алкиленовая цепь;
B - группа NR1 - CO - Z, - CO - NR2 - Z, -NR1 - SO2Z;
R1 - водород или C1 - C6 - алкил;
R2 - водород, гидрокси, C2 - C6-алкенил, C1 - C6-алкил, гидрокси - C1 - C6-алкил;
Z - водород, C1 - C6-алкил, C2 - C6-алкенил или C2 - C6-алкинил, которые могут содержать один или два заместителя, выбранных из группы гидрокси, C1 - C6-алкилкарбонилокси, C1 - C6-алкокси, галоген, циано, карбокси, C1 - C6-алкоксикарбонил, CONR3R4, C1 - C6-алкилкарбонилмеркапто или Z означает пиридиновое кольцо, N-оксипиридиновое и пирролидиновое кольцо или Z и R2 вместе с атомом азота, к которому они присоединены, образуют шестичленное гетероциклическое кольцо, дополнительно содержащее кислород, и R3 и R4 означают водород и C1 - C6-алкил, а также их оптически активные формы, обладающие пролонгированной нитратоподобной активностью.
| EP, заявка, 0367019, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| EP, заявка, 0366004, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| US, патент, 4780560, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-03-10—Публикация
1991-02-14—Подача