Изобретение относится к новым органическим соединениям и к их использованию в качестве фармацевтических препаратов.
В настоящее время имеется большое количество лекарств для лечения расстройств центральной нервной системы. Среди этих лекарств существует категория лекарств, известных под названием антипсихотических средств, предназначенных для лечения серьезных умственных расстройств, таких как шизофрения и болезни шизофренического типа. Применение известных лекарств, предназначенных для лечения этих состояний, часто связано с наличием нежелательных побочных эффектов, поэтому имеется нужда в улучшенных средствах для контроля или устранения соответствующих симптомов более безопасным и эффективным путем. Более того, множество пациентов вовсе не реагирует или реагирует лишь частично на лечение существующими лекарствами; оценки количества таких частично реагирующих или вовсе не реагирующих пациентов варьируются в пределах от 40 до 80% от общего количества подвергшихся лечению.
Как только антипсихотические средства были введены в медицинскую практику, сразу же было замечено, что у ряда пациентов наблюдаются вызванные приемом лекарств экстрапирамидальные симптомы, включая вызванный приемом лекарств паркинсонизм, острые дистонические реакции, акатизию, позднюю дискинезию и позднюю дистонию. Шкала Симпсона-Ангуса (Simpson Angus Scale), оценочная шкала Барнса для акатизии (Barnes Akathisia Rating) и шкала патологических непроизвольных движений (Abnormal involuntary Movement Scale: A IMS) являются хорошо известными шкалами для оценки экстрапирамидальных симптомов. Огромное большинство известных лекарств для лечения шизофрении склонны давать эти экстрапирамидальные побочные эффекты при использовании в дозах, дающих положительный эффект в отношении симптомов заболевания. Тяжесть нежелательных побочных явлений и/или низкая эффективность для значительного количества пациентов часто приводит к неудовлетворительному протеканию лечения или к его прекращению.
Действие многих лекарств связано с седативным эффектом и может оказывать нежелательное влияние на аффективные симптомы заболевания, вызывая депрессию. В некоторых случаях длительное применение лекарств приводит к необратимым состояниям, таким как упомянутые поздняя дискинезия и поздняя дистония. Одним из таких лекарств, о котором сообщалось как о часто вызывающим экстрапирамидальные симптомы и которое может также вызывать позднюю дискинезию, является широко используемое антипсихотическое средство галоперидол. Недавно было заявлено, что клозапин, принадлежащий к большой группе трициклических антипсихотических средств, не вызывает экстрапирамидальных эффектов. Однако было найдено, что это соединение вызывает у некоторых пациентов агранулоцитоз состояние, приводящее к потенциально опасному для жизни уменьшению количества белых кровяных клеток, и в настоящее время оно может применяться только в условиях очень жесткого медицинского наблюдения и контроля.
Следующей группой антипсихотических соединений являются соединения, включающие тиенобензодиазепины, имеющие следующее структурное ядро: Главное соединение этой группы флумезапин (7-фтор-2-метил-10-(4-метил-1-пиперазинил)-4Н-тиено[2,3-b] [1,5] бензодиазепин ) было доведено до стадии клинического введения психически больным пациентам, страдающим шизофренией. До того, как после консультации с Административным Советом США по пищевым продуктам и лекарственным препаратам, были прерваны клинические испытания из-за недопустимо частых случаев повышения уровней содержания ферментов в организмах пациентов. 17 пациентов подвергались лечению флумезапином. Анализы проб крови, взятых у пациентов, показали, что содержание фермента креатининфосфокиназы (КФК) и ферментов печени сывороточной глутаматоксалауксусной трансаминазы (СГОТ) и сывороточной глутаматпировиноградной трансаминазы (СГПТ) значительно превышали нормальные уровни, что свидетельствовало с возможной токсичности. По своей способности повышать уровни содержания ферментов печени флумезапин подобен хлорпромазину антипсихотическому соединению, которое использовалось в течение долгого времени, но безопасность которого была поставлена под сомнение. При клинических испытаниях флумезапина у двух пациентов наблюдалось появление экстрапирамидальных побочных эффектов, что было определено с помощью вышеупомянутой шкалы AIMS.
Главное соединение этой группы флумезапин (7-фтор-2-метил-10-(4-метил-1-пиперазинил)-4Н-тиено[2,3-b] [1,5] бензодиазепин ) было доведено до стадии клинического введения психически больным пациентам, страдающим шизофренией. До того, как после консультации с Административным Советом США по пищевым продуктам и лекарственным препаратам, были прерваны клинические испытания из-за недопустимо частых случаев повышения уровней содержания ферментов в организмах пациентов. 17 пациентов подвергались лечению флумезапином. Анализы проб крови, взятых у пациентов, показали, что содержание фермента креатининфосфокиназы (КФК) и ферментов печени сывороточной глутаматоксалауксусной трансаминазы (СГОТ) и сывороточной глутаматпировиноградной трансаминазы (СГПТ) значительно превышали нормальные уровни, что свидетельствовало с возможной токсичности. По своей способности повышать уровни содержания ферментов печени флумезапин подобен хлорпромазину антипсихотическому соединению, которое использовалось в течение долгого времени, но безопасность которого была поставлена под сомнение. При клинических испытаниях флумезапина у двух пациентов наблюдалось появление экстрапирамидальных побочных эффектов, что было определено с помощью вышеупомянутой шкалы AIMS.
Открыто соединение, которое обладает удивительными и неожиданными свойствами по сравнению с флумезапином и другими родственными соединениями.
Соединение согласно изобретению представляет собой соединение формулы I (I) или соль этого соединения, образованную присоединением к нему кислоты. Свободное основание, имеющее формулу (I), носит название 2-метил-10-(4-метил-1-пиперазинил)-4Н-тиено [2,3-b] [1,5] бензодиазепин.
(I) или соль этого соединения, образованную присоединением к нему кислоты. Свободное основание, имеющее формулу (I), носит название 2-метил-10-(4-метил-1-пиперазинил)-4Н-тиено [2,3-b] [1,5] бензодиазепин.
Соединение согласно изобретению дало удивительные и превосходные результаты в экспериментальных отборочных тестах на активность по отношению к центральной нервной системе и в клинических испытаниях, эти результаты указывают на возможность использования данного соединения для относительно безопасного и эффективного лечения широкого круга расстройств центральной нервной системы.
Результаты фармакологических тестов показывают, что соединение согласно изобретению является антагонистом дипамина на рецепторах D-1 и D-2 и, кроме того, обладает антимускариновыми-антихолинергическими свойствами, и активностью антагониста на рецепторных участках 5НТ-2. Оно также обладает активностью антагониста на норадренергических α-рецепторах. Эти свойства указывают на то, что данное соединение является потенциальным нейролептиком с релаксантными, анксиолитическими или противорвотными свойствами, является полезным при лечении таких психотических состояний, как шизофрения, болезни шизофренического типа и острые маниакальные состояния. В меньших дозах соединение можно использовать для лечения состояний легкой тревоги.
Как упомянуто, соединение изобретения продемонстрировало высокую активность при клинических испытаниях на психически больных пациентах, страдающих шизофренией, причем эта высокая активность проявляется при удивительно малых дозировках. Было найдено, что дозировки оказываются ниже, чем можно было бы ожидать, исходя из наблюдений, сделанных в предварительных тестах на животных. Профиль ответной реакции пациентов на данное соединение соответствует профилю известных антипсихотических агентов для тех случаев, когда их применение было успешным, что указывает на очевидное сходство действия данного соединения и действия известных антипсихотических агентов при их оценке по основным оценочным шкалам, таким как сокращенная психиатрическая оценочная шкала (Brief Psychiatric Rating Scale BPRS) (субшкала шизофрении) и общая клиническая картина (Clinical Glolal Impression: CGI).
В первом завершенном открытом (противоположном слепому) исследовании соединения изобретения на пациентах- шизофрениках, при 4-недельном курсе лечения у шести из восьми пациентов, подвергавшихся лечению в течение как минимум 2 недель, при ежедневных дозах от 5 до 30 мг наблюдалось от 66 до 87% улучшения (согласно оценке по шкале BPRS). Предварительные результаты, полученные в следующих трех, еще продолжающихся в настоящее время испытаниях, подтверждают этот высокий уровень эффективности при дозах, меньших или равных минимальной дозе в первом исследовании, например при дозах 2,5 и 5 мг в день. Более того, редко наблюдается лишь небольшое и временное увеличение содержания ферментов печени у пациентов, подвергшихся лечению терапевтическими дозами, и уровни содержания креатининфосфокиназы (КФК) в плазме являются более низкими, чем для флумезапина, что свидетельствует о менее вредном влиянии на мышечную ткань. Более того, соединение изобретения вызывает меньшее увеличение содержания пролактина, чем другие используемые в настоящее время нейролептические лекарства, и это предполагает более редкие нарушения менструального цикла и меньшую степень опасности возникновения галактореи и гинекомастии. В клинических испытаниях не было обнаружено какого-либо изменения количества белых кровяных клеток.
В исследованиях токсичности, проведенных на собаках, при использовании близкого аналога 2-этил-10-(4-метил-1-пиперазинил)-4Н-тиено [2,3-b] [1,5] бензодиазепина при дозировке 8 мг/кг наблюдалось, что у четырех из восьми собак происходит значительное увеличение уровня содержания холестерина, в то время как в случае соединения изобретения никакого повышения уровня содержания холестерина не происходит.
Таким образом, в клинических условиях соединение изобретения демонстрирует лучшие характеристики побочных эффектов, чем известные антипсихотические агенты, и обладает также значительным преимуществом с точки зрения активности.
Соединение изобретения можно использовать как в виде свободного основания, так и в виде соли, образованной присоединением кислоты. Соли присоединения кислоты предпочтительно представляют собой фармацевтически приемлемые, нетоксичные соли, образованные присоединением подходящих кислот, таких как неорганические кислоты, например соляная, бромистоводородная, азотная, серная или фосфорная кислоты, или органические кислоты, например гликолевая, малеиновая, гидроксималеиновая, фумаровая, яблочная, винная, лимонная или молочная кислоты, или органические сульфокислоты, например метансульфокислота, этансульфокислота, 2-гидроксиэтансульфокислота, п-толуолсульфокислота, нафталин-2-сульфокислота. Кроме фармацевтически приемлемых солей присоединения кислоты, изобретение включает в себя и другие соли присоединения кислоты, например, соли, образуемые присоединением пикриновой или щавелевой кислот, поскольку они могут служить промежуточными соединениями при очистке или при получении других солей, или используются для идентификации, охарактеризования или очистки свободного основания.
Соединение согласно изобретению формулы (I) или его соль, образованная присоединением к нему кислоты, может быть получено по способу, который включает:
(a) реакцию N-метилпиперазина с соединением формулы II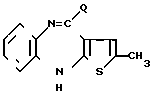 (II) в которой Q представляет собой радикал, способный отщепляться, или
(II) в которой Q представляет собой радикал, способный отщепляться, или
(b) замыкание кольца в соединении формулы III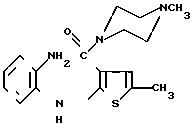 (III)
(III)
Соответствующие условия проведения реакций и подходящие значения Q для этих способов нетрудно выбрать. В реакции (а) радикал Q может представлять собой, например, аминогруппу или моно- или диалкилзамещенную аминогруппу (каждый алкильный заместитель предпочтительно содержит от 1 до 4 атомов углерода), гидроксильную группу, тиольную группу, или алкокси, алкилтио или алкилсульфогруппу, предпочтительно содержащую от 1 до 4 атомов углерода, например, метокси- или метилтиогруппу, или атом галогена, в особенности атом хлора. Предпочтительно Q представляет собой амино-(NH2), гидроксильную или тиольную группу, наиболее предпочтительно аминогруппу. Реакцию предпочтительно проводят при температуре от 50 до 200оС.
Если Q представляет собой аминогруппу, промежуточное соединение формулы (II) может находиться в имино-форме: NH-
NH- а когда Q представляет собой гидроксил или тиол, промежуточное соединение формулы (II) может находиться в формах амида или тиоамида:
а когда Q представляет собой гидроксил или тиол, промежуточное соединение формулы (II) может находиться в формах амида или тиоамида: NH-
NH-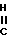 или
или  NH-
NH-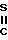
Амидин формулы (II) (Q представляет собой NH2) может находиться в солевой форме, например в виде соли минеральной кислоты, такой как солянокислая соль, и может подвергаться реакции с N-метилпиперазином в органическом растворителе, таком как анизол, толуол, диметилформамид или диметилсульфоксид, предпочтительно в интервале температур от 100 до 150оС.
Амидин получают конденсацией тиофена формулы: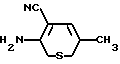 с орто-галоиднитробензолом в присутствии основания, например гидрида натрия, в растворителе, таком как, например, тетрагидрофуран, или Н-бутиллития в тетрагидрофуране, или карбоната калия или гидроокиси лития в диметилсульфоксиде, или с тетраалкиламмониевой солью в двухфазной системе, с образованием нитронитрила формулы:
с орто-галоиднитробензолом в присутствии основания, например гидрида натрия, в растворителе, таком как, например, тетрагидрофуран, или Н-бутиллития в тетрагидрофуране, или карбоната калия или гидроокиси лития в диметилсульфоксиде, или с тетраалкиламмониевой солью в двухфазной системе, с образованием нитронитрила формулы: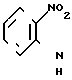
 который может одновременно подвергаться восстановлению и замыканию цикла с образованием амидина формулы (II), с использованием, например, двухлористого олова и хлористого водорода в среде водного этанола или, альтернативно, восстанавливаться водородом с использованием палладия на угле или полисульфида аммония с последующим катализируемым кислотой замыканием кольца. Если Q представляет собой гидроксил, то реакцию (а) предпочтительно проводить в присутствии четыреххлористого титана, который способен реагировать с N-метилпиперазином, давая металламинный комплекс. Можно также использовать хлориды других металлов, таких как цирконий, гафний или ванадий. Реакцию можно проводить в присутствии агента, связывающего кислоту, такого как третичной амин, например, триэтиламин. Альтернативно, реакцию можно проводить, используя избыток метилпиперазина, который в этом случае выполняет роль агента, связывающего кислоту. В качестве реакционной среды можно использовать подходящий органический растворитель, такой как толуол или хлорбензол, хотя особенно желательно использование анизола, по крайней мере, в качестве сорастворителя, из-за его способности образовывать растворимый комплекс с TiCl4. Можно, если это нежелательно, использовать для ускорения реакции повышенные температуры, например, до 200оС; предпочтительным температурным интервалом для проведения реакции является интервал от 80 до 120оС.
который может одновременно подвергаться восстановлению и замыканию цикла с образованием амидина формулы (II), с использованием, например, двухлористого олова и хлористого водорода в среде водного этанола или, альтернативно, восстанавливаться водородом с использованием палладия на угле или полисульфида аммония с последующим катализируемым кислотой замыканием кольца. Если Q представляет собой гидроксил, то реакцию (а) предпочтительно проводить в присутствии четыреххлористого титана, который способен реагировать с N-метилпиперазином, давая металламинный комплекс. Можно также использовать хлориды других металлов, таких как цирконий, гафний или ванадий. Реакцию можно проводить в присутствии агента, связывающего кислоту, такого как третичной амин, например, триэтиламин. Альтернативно, реакцию можно проводить, используя избыток метилпиперазина, который в этом случае выполняет роль агента, связывающего кислоту. В качестве реакционной среды можно использовать подходящий органический растворитель, такой как толуол или хлорбензол, хотя особенно желательно использование анизола, по крайней мере, в качестве сорастворителя, из-за его способности образовывать растворимый комплекс с TiCl4. Можно, если это нежелательно, использовать для ускорения реакции повышенные температуры, например, до 200оС; предпочтительным температурным интервалом для проведения реакции является интервал от 80 до 120оС.
Промежуточный амид формулы (II) (Q представляет собой -ОН), можно получить из соответствующего амидина (Q представляет собой -NH2) щелочным гидролизом, или из соединений формулы IV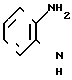
 (IV) где R в сложноэфирной группе предпочтительно представляет собой алкильный радикал с числом атомов углерода от 1 до 4, реакцией замыкания кольца, используя, например, метилсульфонилметанид натрия в подходящем растворителе, таком как диметилсульфоксид. С другой стороны, амид можно получить замыканием кольца аминокислоты, используя, например, дициклогексилкарбодиимид в подходящем растворителе, таком как тетрагидрофуран. Аминокислоту можно получить, например, из указанных сложных эфиров щелочным гидролизом, используя, например, гидроокись натрия в среде этанола.
(IV) где R в сложноэфирной группе предпочтительно представляет собой алкильный радикал с числом атомов углерода от 1 до 4, реакцией замыкания кольца, используя, например, метилсульфонилметанид натрия в подходящем растворителе, таком как диметилсульфоксид. С другой стороны, амид можно получить замыканием кольца аминокислоты, используя, например, дициклогексилкарбодиимид в подходящем растворителе, таком как тетрагидрофуран. Аминокислоту можно получить, например, из указанных сложных эфиров щелочным гидролизом, используя, например, гидроокись натрия в среде этанола.
Тиоамиды формулы (II) (Q представляет собой SH), иминотио- (простые) эфиры, имино (простые) эфиры или иминогалогениды, или другие производные, содержащие активные радикалы Q, соответствующие приведенному описанию, более реакционноспособны по отношению к N-метилпиперазину, и обычно могут реагировать с ним без обязательного присутствия TiCl4, но с использованием тех же температурных условий и растворителей. Тиоамид формулы (II) (Q представляет собой SH), можно получить, обрабатывая раствор соответствующего амида в безводном растворителе основного типа, таком как пиридин, пентасульфидом фосфора. Аналогично, амид можно превратить в иминотио (простой) эфир, имино (простой) эфир или иминогалогенид, или в другие производные, содержащие активные радикалы Q, обрабатывая его соответствующими реагентами, такими как, например, пентахлорид фосфора, в случае иминохлорида.
Промежуточные соединения формулы (II), в которых радикал Q представляет собой радикал, способный отщепляться, особенно те соединения, в которых Q представляет собой -NH2, -OH или -SH, и, когда Q представляет собой -NH2, соли этих соединений, являются новыми соединениями и составляют следующий аспект настоящего изобретения.
Что касается указанной реакции (б), то замыкание кольца в соединении (III) можно осуществить, используя, например, четыреххлористый титан в качестве катализатора и анизол в качестве растворителя; реакцию предпочтительно проводят при температуре от 100 до 250оС, например от 150 до 200оС. Промежуточное соединение формулы (III) предпочтительно получают in situ без выделения с помощью реакции соединения формулы (IV), в которой R в сложноэфирной группе предпочтительно представляет собой алкильный радикал с числом атомов углерода от 1 до 4, с N-метилпиперазином при нагревании до температуры от 30 до 120оС, например при около 100оС, в подходящем растворителе, таком как, например, анизол, с использованием в качестве катализатора TiCl4.
Соединение формулы (IV) можно получить из соответствующего нитросоединения формулы V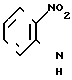
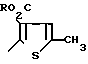 (V)
(V)
Такие соединения формулы (V), в которых R представляет сложно-эфирную группу, такую как, например, С1-С4 алкил, являются новыми и составляют еще один аспект данного изобретения.
Если это удобно, данное нитросоединение можно превратить в амин формулы (IV) без выделения перед реакцией с N-метилпиперазином.
Промежуточные соединения формулы (V) можно получить конденсацией тиофена формулы VI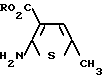 (VI) с ортогалоиднитробензолом, предпочтительно ортофтор- или ортохлорнитробензолом, в присутствии основания, например, (а) гидрида натрия в растворителе, таком как, например, тетрагидрофуран, при температуре от 20 до 30оС, или (b) безводного карбоната калия, или гидроокиси лития в растворителе, таком как диметилсульфоксид, при температуре от 90 до 120оС. Соединение формулы (V) превращают в соединение формулы (IV), например, каталитическим восстановлением, используя водород и катализатор палладий уголь, или химическим путем, используя хлорид двухвалентного олова и хлористый водород в среде водного этанола, или полисульфид аммония, или цинк в среде водного хлористого аммония. Очевидно понятно, что соединение формулы (I) может выделяться per se, или может превращаться в соль присоединения кислоты, с использованием обычных способов. Как упоминалось выше, соединение изобретения обладает полезной активностью в отношении центральной нервной системы. Эта активность была показана на моделях с использованием хорошо отработанных методик. Например, соединение подвергали ряду стандартных испытаний на поведение, являющихся предсказательными в отношении антипсихотической активности. Оно оказалось антагонистом индуцированного апоморфином лазательного поведения и гипотермии у мышей (Н.А.Моор и др. Psychopharmacology
(VI) с ортогалоиднитробензолом, предпочтительно ортофтор- или ортохлорнитробензолом, в присутствии основания, например, (а) гидрида натрия в растворителе, таком как, например, тетрагидрофуран, при температуре от 20 до 30оС, или (b) безводного карбоната калия, или гидроокиси лития в растворителе, таком как диметилсульфоксид, при температуре от 90 до 120оС. Соединение формулы (V) превращают в соединение формулы (IV), например, каталитическим восстановлением, используя водород и катализатор палладий уголь, или химическим путем, используя хлорид двухвалентного олова и хлористый водород в среде водного этанола, или полисульфид аммония, или цинк в среде водного хлористого аммония. Очевидно понятно, что соединение формулы (I) может выделяться per se, или может превращаться в соль присоединения кислоты, с использованием обычных способов. Как упоминалось выше, соединение изобретения обладает полезной активностью в отношении центральной нервной системы. Эта активность была показана на моделях с использованием хорошо отработанных методик. Например, соединение подвергали ряду стандартных испытаний на поведение, являющихся предсказательными в отношении антипсихотической активности. Оно оказалось антагонистом индуцированного апоморфином лазательного поведения и гипотермии у мышей (Н.А.Моор и др. Psychopharmacology  (2), 263-266 (1988) и
(2), 263-266 (1988) и  , 539 (1988)) в дозах, меньших 10 мг/кг. Оно также ингибировало реакцию условно-рефлекторного избегания у крыс (ЕД504,7 мг/кг), но, в отличие от стандартных соединений, вызывает каталепсию только при гораздо больших дозах (ЕД50 39,4 мг/кг). Этот разрыв в дозах, требуемых для блокирования реакции условно-рефлекторного избегания и для вызывания каталепсии, показывает, что индуцирование экстрапирамидальных побочных эффектов в случае клинического использования заявляемого соединения менее вероятно.
, 539 (1988)) в дозах, меньших 10 мг/кг. Оно также ингибировало реакцию условно-рефлекторного избегания у крыс (ЕД504,7 мг/кг), но, в отличие от стандартных соединений, вызывает каталепсию только при гораздо больших дозах (ЕД50 39,4 мг/кг). Этот разрыв в дозах, требуемых для блокирования реакции условно-рефлекторного избегания и для вызывания каталепсии, показывает, что индуцирование экстрапирамидальных побочных эффектов в случае клинического использования заявляемого соединения менее вероятно.
Соединение изобретения также проявляет активность в дозах менее 10 мг/кг в тесте, основанном на упомянутом тесте с индуцированным апоморфином лазанием, в котором измеряется способность соединения предотвращать нарушение лазательной реакции, производимое предварительной обработкой за 24 ч N-этоксикарбонил-2-этокси-1,2-дигидрохинолином (ЭЭДХ) агентом, инактивирующим допаминовый рецептор (Меллер и др. Central D1 dopamine receptors, Plenum Press, 1988). Этот тест показывает, что соединение обладает активностью и на рецепторе D1, и на рецепторе D2. Кроме того, соединение изобретения имеет благоприятный профиль активности в ряде испытаний на связывание in vitro, разработанных для измерения степени связывания с нервными рецепторами. Как показывают значения IC50, составляющие менее 1 мкМ, в тестах на связывание с 3Н-SCH23390 (В. Биллард и др. Life Science  , 1885, 1984) и 3Н-спипероном (П. Сейман и др. Nature
, 1885, 1984) и 3Н-спипероном (П. Сейман и др. Nature  717 (1976)), соединение активно и на допаминовом рецепторе D-1, и на допаминовом рецепторе D-2; что находится в соответствии с наблюдениями, сделанными в тестах на поведение. Соединение имеет значение IC50 менее 1 мкМ в анализе на связывание с 3Н-QNB, описанном Х.И.Ямамурой и С.Х.Снайдером в Proc. Nat. Acad. Sci. США
717 (1976)), соединение активно и на допаминовом рецепторе D-1, и на допаминовом рецепторе D-2; что находится в соответствии с наблюдениями, сделанными в тестах на поведение. Соединение имеет значение IC50 менее 1 мкМ в анализе на связывание с 3Н-QNB, описанном Х.И.Ямамурой и С.Х.Снайдером в Proc. Nat. Acad. Sci. США  , 1725, 1974, это свидетельствует о том, что оно обладает антимускариновой-антихолинергической активностью. Кроме того, соединение обнаруживает свою наивысшую активность на рецепторе 5-НТ-2; это проявляется в том, что оно вытесняет Н-спиперон с участком связывания в любых долях коры головного мозга крыс (Перутка С.Дж. и Снайдер С. Х. Mol. Pharmacol.
, 1725, 1974, это свидетельствует о том, что оно обладает антимускариновой-антихолинергической активностью. Кроме того, соединение обнаруживает свою наивысшую активность на рецепторе 5-НТ-2; это проявляется в том, что оно вытесняет Н-спиперон с участком связывания в любых долях коры головного мозга крыс (Перутка С.Дж. и Снайдер С. Х. Mol. Pharmacol.  , 687, 1979) при низких наномолярных концентрациях. Соединение активно также на рецепторе 5-НТ-IC. Этот профиль активности, полученный в испытаниях рецепторного связывания in vitro, а также профиль, полученный в поведенческих тестах, показывают, что соединение является эффективным для лечения психотических состояний, но с меньшей вероятностью индуцирует экстрапирамидальные побочные эффекты.
, 687, 1979) при низких наномолярных концентрациях. Соединение активно также на рецепторе 5-НТ-IC. Этот профиль активности, полученный в испытаниях рецепторного связывания in vitro, а также профиль, полученный в поведенческих тестах, показывают, что соединение является эффективным для лечения психотических состояний, но с меньшей вероятностью индуцирует экстрапирамидальные побочные эффекты.
Соединение изобретения является эффективным в широком интервале доз, причем конкретная вводимая доза зависит от состояния, подлежащего лечению. Например, при лечении взрослых людей могут быть использованы дозы от 0,05 до 30 мг, предпочтительно от 0,1 до 20 мг в день. Как правило, достаточным является введение ежедневной дозы в один прием, хотя ее можно вводить и по частям. Для лечения психотических расстройств подходящим является интервал доз от 2 до 15 мг, предпочтительно от 2,5 до 10 мг в день, в то время как для состояний легкой тревоги более подходящим может быть интервал меньших доз, таких как от 0,1 до 5 мг, предпочтительно от 0,5 до 1 мг. При выборе оптимальных режимов для пациентов, страдающих психотическими заболеваниями, часто может быть необходимым начинать с доз от 2 до 15 мг/день и после достижения контроля над заболеванием снизить дозу по 0,5-1 мг/день. В исследованиях с использованием соединения изобретения, содержащего радиоактивную метку, его следы были обнаружены в слюне; таким образом, возможно осуществление мониторинга соединения у пациентов с целью определения их склонности к лечению. Соединение изобретения, как правило, следует вводить орально или с помощью инъекции, для этих целей оно обычно используется в форме фармацевтической композиции.
Фармацевтическая композиция содержит в качестве активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль присоединения кислоты в сочетании с фармацевтически приемлемым носителем. Для приготовления композиции могут быть использованы общепринятые методы приготовления фармацевтических композиций. Например, активный ингредиент обычно смешивают с носителем, или разбавителем, или помещают внутрь носителя, который в этом случае может представлять собой капсулу, мешочек, бумагу или другой контейнер. Когда носитель является разбавителем, он может быть твердым, полужидким или жидким материалом, который действует как носитель, наполнитель или среда для активного ингредиента. Активный ингредиент может быть адсорбирован на гранулярном твердом контейнере. Некоторыми примерами подходящих носителей являются: лактоза, декстроза, сахароза, сорбитол, маннитол, крахмалы, камедь акации, фосфат кальция, альгинаты, трагакант, желатин, сироп, метилцеллюлоза, метил- и пропилгидроксибензоат, тальк, стеарат магния и минеральное масло. Если требуется, композиции можно изготовить в таких формах, которые обеспечивали бы быстрое, пролонгированное или задержанное выделение активного ингредиента после введения пациенту. В зависимости от способа введения композиции могут быть изготовлены в форме таблеток, капсул, растворов для инъекций (для парэнтерального использования), суспензий или эликсиров для орального использования или суппозиторий. Предпочтительно композиции изготовляются в форме дозировочных единиц, каждая единица содержит от 0,1 до 20 мг, чаще от 0,5 до 10 мг активного ингредиента. Предпочтительной лекарственной формой является капсула или таблетка, содержащая от 0,1 до 20 мг, или от 0,5 до 10 мг активного ингредиента, и фармацевтически приемлемый носитель для него. Другой предпочтительной лекарственной формой является препарат для инъекций, дозировочная единица которого содержит от 0,1 до 20 мг или от 0,5 до 10 мг активного ингредиента вместе с фармацевтически приемлемым разбавителем для него. Особенно предпочтительным типом препарата для инъекций является препарат с пролонгированным выделением для внутримышечных инъекций.
П р и м е р 1. 1). 2-Амино-5-метилтиофен-3-карбонитрил.
Смесь серы (217,8 г, 6,79 ммоль), пропионового альдегида (472,5 г, 587 мл, 8,13 ммоль) и диметилформамида (1350 мл) помещают в 5-литровую колбу, снабженную мешалкой с воздушным приводом, воздушным холодильником, термометром с длинной ножкой и капельной воронкой. К охлажденной перемешиваемой реакционной смеси по каплям в течение 30 мин добавляют триэтиламин (576 мл, 4,13 ммоль), поддерживая температуру колбы между 5 и 10оС с помощью ледяной бани. После окончания добавления смеси позволяют нагреваться до 18оС в течение 50 мин, продолжая интенсивно перемешивать ее. Затем по каплям в течение 70 мин добавляют раствор малононитрила (450 г, 6,8 ммоль) в диметилформамиде (900 мл), поддерживая при этом температуру в колбе в районе 20оС. После окончания добавления смесь перемешивают при температуре 15-20оС еще 45 мин, после чего анализируют пробу методом ТСХ (тонкослойной хроматографии). Затем смесь при перемешивании выливают на смесь, состоящую из 4 л льда и 8 л воды, при этом происходит осаждение целевого продукта. Через 10 мин мешалку выключают и дают твердому веществу осесть. Водный слой сливают декантацией, твердый продукт отделяют фильтрованием. Выделенный твердый продукт тщательно промывают водой (деионизированной, 4 л), затем сушат в течение ночи под вакуумом при 70-75оС, получая целевое соединение (585 г), т.пл. 100оС.
2). 2-(2-Нитроанилино)-5-метилтиофен-3-карбонитрил.
К перемешиваемой суспензии гидрида натрия (14,4 г, 50%-ная дисперсия в масле, 0,3 ммоль) в сухом тетрагидрофуране (50 мл) в атмосфере азота по каплям добавляют раствор 2-фторнитробензола (28,2 г, 0,2 ммоль) и 2-амино-5-метилтиофен-3-карбонитрила (27,6 г, 0,2 ммоль) в сухом тетрагидрофуране (250 мл). Смесь перемешивают при 25оС в течение 24 ч выливают на размельченный лед и и экстрагируют дихлорметаном (3 раза по 500 мл). Соединенные вместе экстракты промывают 2 н. хлористоводородной кислотой (2 раза по 200 мл), водой (2 раза по 200 мл), сушат над сульфатом магния, удаляют растворитель при пониженном давлении. Остаток кристаллизуют из этанола, получая целевое соединение (35,2 г), т.пл. 99-102оС.
3). 4-Амино-2-метил-10Н-тиено [2,3-b][1,5] бензодиазепина гидрохлорид.
К перемешиваемой суспензии 2-(2-нитроанилино)-5-метилтиофен-3-карбонитрила (3 г, 0,011 ммоль) в этаноле (35 мл) при 50оС в течение 10 мин добавляют раствор безводного хлорида двухвалентного олова (6,95 г, 0,037 ммоль) в хлористоводородной кислоте (26 мл, 5 моль). Смесь кипятят с обратным холодильником при перемешивании в течение 1 ч, концентрируют при пониженном давлении и оставляют на ночь при 5оС для кристаллизации. Соль отфильтровывают, промывают небольшим количеством воды, сушат (4,3 г), т.пл. >250оС, и используют на следующей стадии без дальнейшей очистки.
4). 2-Метил-10-(4-метил-1-пиперазинил)-4Н-тиено [2,3-b] [1,5]-бензодиазепин.
Неочищенный гидрохлорид 4-амино-2-метил-10Н-тиено [2,3-b] [1,5]бензодиазепина (4,3 г) кипятят с обратным холодильником в смеси N-метилпиперазина (15 мл), диметилсульфоксида (20 мл) и толуола (20 мл) в атмосфере азота в течение 20 ч. Смесь охлаждают до около 50оС, добавляют 20 мл воды, и дают продукту кристаллизоваться при 5оС в течение ночи. Продукт отфильтровывают и кристаллизуют из ацетонитрила (30 мл), получая целевое соединение (1,65 г), т.пл. 195оС.
Строение полученного соединения было подтверждено спектроскопическими методами:
1H ЯМР (CDCl3): δ 2,30 (3H, c. 4'-C ), 2,28 (3H, c. 2-C
), 2,28 (3H, c. 2-C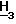 ), 2,45 (4H, м. 3'-C
), 2,45 (4H, м. 3'-C ), 3,49 (4H, м. 2'-C
), 3,49 (4H, м. 2'-C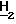 ), 5,00 (H, широкий с. 10-N
), 5,00 (H, широкий с. 10-N ), 6,23 (H, широкий с. 3-С
), 6,23 (H, широкий с. 3-С ), 6-35-7-10 (4Н, м. 6,7,8,9-Н).
), 6-35-7-10 (4Н, м. 6,7,8,9-Н).
3С ЯМР (CDCl3): 128,5 (c, C-2), 127,8 (д, С-3), 119,1 (с. С-3а), 157,4 (с, С-4), 140,8 (с, С-5а), 123,4; 122,6; 124,1 (д, С-6,7,8), 118,8 (д, С-9), 142,5 (с, С-9а), 151,8 (с, С-10а), 46,5 (т, 2'-C), 54,8 (т, 3'-C), 45,9 (c, 4'-C), 15,2 (к, 2-Ме).
Масс-спектр показывает М+ 312 и ионы основного фрагмента с m/z 255, 242, 229 и 213.
П р и м е р 2.
1). Метил-2-амино-5-метилтиофен-3-карбоксилат.
К перемешиваемой смеси метилцианоацетата (3,9 г, 0,4 ммоль), серы (1,26 г, 0,04 ммоль) и триэтиламина (3,2 мл, 0,002 ммоль) в сухом метилформамиде (12 мл) в атмосфере азота при 45оС по каплям добавляют раствор свежеперегнанного пропионового альдегида (2,5 г, 0,043 ммоль) в сухом диметилформамиде (2 мл), поддерживая температуру в интервале 45-47оС. Смесь перемешивают при 45оС в течение 1,5 ч, затем распределяют между водой и этилацетатом. Органический экстракт промывают водой, сушат и упаривают. Целевое соединение очищают хроматографически на нейтральной окиси алюминия, элюируя смесью хлороформ-гексан (4,8 г).
2). Метил-2-(2-нитроанилино)-5-метилтиофен-3-карбоксилат.
К перемешиваемой суспензии гидрида натрия (2 г) в сухом тетрагидрофуране (25 мл) в атмосфере азота добавляют раствор метил-2-амино-5-метилтиофен-3-карбокси- лата (4,8 г, 0,028 ммоль) и 2-фторнитробензола (4,0 г, 0,025 ммоль) в сухом тетрагидрофуране (30 мл). Смесь перемешивают при 25оС в течение 20 ч, выливают на лед и распределяют между 2 н. хлористоводородной кислотой и этилацетатом. Органические экстракты сушат над сульфатом магния, растворитель упаривают при пониженном давлении, и целевое соединение очищают хроматографически на силикагеле, элюируя толуолом, после чего кристаллизуют из этанола (4,1 г).
3). 2-Метил-10-(4-метил-1-пиперазинил)-4Н-тиено [2,3-b] [1,5]-бензодиазепин.
Метил-2-(2-нитроанилино)-5-метилтио- фен-3-карбоксилат (3,7 г, 0,0013 ммоль) гидрируют в аппарате Парра при давлении водорода 60 фунтов/кв. дюйм в смеси этанол-этилацетат (2:1, 150 мл) на катализаторе "палладий на древесном угле" (10% 200 мг). После удаления катализатора и растворителя неочищенный диаминоэфир растворяют в смеси N-метилпиперазина (21 мл) и анизола (55 мл). К этому раствору в атмосфере азота при перемешивании добавляют раствор тетрахлорида титана (3,45 мл) в анизоле (15 мл). Смесь перемешивают при 100оС в течение 1 ч, затем при кипячении с обратным холодильником в течение 48 ч для осуществления замыкания кольца 1-{[2-(2-аминоанилино)-5-метилтиофен-3-ил] карбо- нил}-4-метилпиперазина. После охлаждения до 80оС осторожно добавляют смесь 30%-ного раствора аммиака (10 мл) и изопропанола (10 мл), затем 25 мл этилацетата. Осадок неорганического вещества удаляют фильтрованием, и фильтрат промывают водой (3 раза по 25 мл), сушат над сульфатом магния, растворитель удаляют при пониженном давлении. Продукт очищают хроматографически на сорбенте Florisil элюируя этилацетатом и, наконец, кристаллизуют из ацетонитрила (40 мл), получая целевое соединение (2,32 г), идентичное описанному.
Использование: в качестве фармацевтических препаратов для лечения растройства центральной нервной системы. Сущность изобретения: продукт 2-метил-10- (4-метил-1-пиперазинил) 4Н-тиено [2,3-b] [1,5] бензодиазепин, температура плавления 195°С, 4-амино-2-метил-1ОН- тиено [2,3-b] [1,5] бензодиазепин гидрохлорид, температура плавления выше 250°С. 2 с.п.ф-лы.
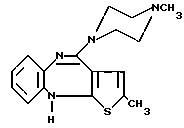
или его кислотно-аддитивная соль.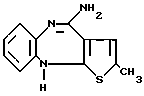
| Psychopharmacological Agents, ed M | |||
| Gordon, Academic Press, New Jork, 1974, voll III, p.175. |
Авторы
Даты
1995-09-20—Публикация
1992-09-25—Подача