шивают в течение ночи в атмосфере а та. Темно-красньш раствор затем гас в смеси лед/вода/НС и фильтруют с получением оранжевого твердого вещества. Твердое вещество хроматогра фируют в колонке с силикатом ма.гния используя дихлорметан; очищенный пр дукт перекристаллизовывают из этилацетата-этанола с получением оранже вого кристаллического твердого вещества, т.пл. 159-160 С. П р и м е р 2. 6,7-Дихлор-2-метил- 10- С4-метш1-1 -пиперазинил -2,4-дигидро-1,2,3-триазол 4,,5 -бензодиазепин. 1О-Амино-6,7-дихлор-2-метил-2,4-дигидро-1,2,3-триазол 4,5-ЬЗ 1 5J-бензодиазепина гидрохлорид (0,84 г) добавляют к смеси сухого д метилсульфоксида (5 мл), толуола (5 мл) и N-метилпиперазина (1 мл), которую продували азотом в течение 20 мин. Затем, перемешиваемый раствор нагревают при 125 С (масляная баня) в атмосфере азота в течение 16 ч, охлаждают до комнатной темпер туры и добавляют дистиллированную воду (10 мл), поддерживая температу ру ниже . После перемешивания при 5С в течение получаса полученную суспензию отфильтровывают и сущат П1зи 70 С при пониженном давле нии, получая желто-коричневое твердое вещество, которое перекристалли зовывают из зтилацетата н-гексана с получением желтого кристаллического твердого вещества: т.пл. 217,5218,. 1О-Амино-6,7-дихлор-2-метил-2,4-дигидро-1,2,3-триазол 4,5-Ь1 1,5 }-бензодиазепина гидрохлорид. К суспензии 2-метил-4- 4,5-дихлор-2-нитроанилино -1,2,3-триазол-3-карбонитрила (1,1 г) в этаноле (10 мл) добавляют безводный хлорид олова (II) (2,0 г) в концентрированной хлористоводородной кислоте (10 мл) и раствор нагревают с обрат ным холодильником в течение часа, охлаждают и результирующее твердое вещество отфильтровывают и сушат при и пониженном давлении с по лучением оранжевого кристаллическог твердого вещества, перекристаллизо- ванного из этанола, т.пл. 255°С. 2-Метил-4- 4,5-диxлcp-2-нитpoaни линoЗ-1 ,2,3-триазол-5-карбонитрил. К раствору 4-амино-2-метш1-1,2,3,-триазол-карбонитрила (1,7 г) в тетрагидрофуране (40 мл) в атмосфере азота добавляют гидрид натрия (1,0 г, 50%-ная дисперсия в масле) при комнатной температуре. Спустя 15 мин к смеси добавляют 2,4,5-трихлорнитробензол (3,13 г), которую перемешивают в течение 6 ч в атмосфере азота. Затем темно-красный раствор гасят в смеси лед/вода/НСК и фильтруют с получением желто-оранжевого твердого вещества. Твердое вещество хроматографируют в колонке с силикатом магния, используя дихлорметан. Очищенный продукт перекристаллизовывгиот из этанол с получением оранжевого твердого вещества, т.пл. 148-150с. Аналогично, по сходной методике получают следующие соединения формулы (I): 7-хлор-2-метил-10- 4-метил-1-пиперазинил -2,4-дигидро-1,2,3-триазол 4, 5-Ь} l ,5 j-бензодиазепин, т.пл. 200-203°С (ацетони рил); 7-бром-2-метш1-10-(4-метил-1-пиперазинил)-2,4-дигидро-1,2,3-триазол 4, 5-Ь j 1,5 -бензодиазепин, т.пл. 183-184С (этилацетат/н-гексан); 7-трифторметш1-2-метш1-10- 4-метил-1-пиперазинил -2,4-дигидро-1,2,3-триазол 4,5-Ь 1,5 -бензодиазепин, т.пл. 109-111°С (этилацетат/н-гексан) -, 2-метил-1О- 4-метил-1-пиперазинил -2,4-дигидро-1,2,3-триазол 4,5-Ь l,5j-бензодиазепин,т.пл. 182 184 С (этилацетат/н-гексан)} 7-фтор-2-зтил-1О- 4-метил-1-пиперазинил J-1 , 4-дигидро- 1 ,2,3-триазол 4,,5J-бензодиазепин, т.пл. 178-180 С (этилацетат/н-гексан); 7-ХЛОР-2-ЗТИЛ-10- 4-метил-1 -пиперазинил -2,4-дигидро-1,2,3-триазол 4,5-Ь 1,5 j-бензодиазепин, т.пл. 180-182 С (этилацетат/н-гексан). По описанной методике получают следующие промежуточные соединения ормулы (II): 10-амино-7-хлор-2-метил-2,4-дигидро- 1 ,2,3-триазол 4,5-Ь l ,5 бензодиазепина гидрохлорид, .пл. , с разложением (этаол) ;
10-амино-7-бром-2-метго1-2,4-дигидро-1,2,3-триазол 4,,5 -бензодиазепина гидрохлорид, т.пл. 287-291 С (этанол);
10-амино-7-трифторметил-2-метил-2,4-дигидро-1,2,3-триазол 4 5--Ь . fl,5 -бензодиазепина гидрохлорид, т.пл. (этанол) i
10-амино-2-метил-2,4-дигидро-1,2,3-триазол 4,5-bj t,5J-бензодиазепина гидрохлорид, т.пл. 270 С (этанол))
10-амино-2-этш1-7-фтор-2.4-дигидро-1,2,3-триазол 4,,5 -бензодиазепина гидрохлорид, т.пл. 270 С (этанол)i
10-амино-7-хлор-2-этил-2,4-дигидро-1,2,3-триазол 4,,5 -бензодиазепина гидрохлорид, т.пл. (зтанол).
Нижеследующие нитроанилин-нитрил ные промежуточные соединения выделяют при получении указанных выше соединений:
2-метш1-4- 4-хлор-2-нитроанИлино -1,2,3-триазол-5-карбонитрил, т.пл. 166-168 € (этанол);
2-метил-4- 4-бром-2-нитроанилино J-1,2,3-триазол-5-карбонитрил, т.пл. 162-164 (этанол)j
2-метил-4- 4-трифторметил-2-нитроанилино -1,2,3-триазол-5-карбонитрил, т.пл. 116-117 с (этанол);
2-метил-4- 2-нитранш1Ино -1 2,3-триазол-5-карбонитрил, т.пл. 144145 С (этанол)v
2-этил-4 4-фтор-2-нитроанилино-1,2,3-триахол-карбонитрил, т.пл. 115-116 С (этанол);
2-ЭТИЛ-4- 4-хлор-2-нитроанилино -1,2,3-триазол-5-карбонитрил, т.пл. 130-132 С (этанол).
Пример 3. Таблетки, содержащие каждая 50 мг активного ингредиента имеют следующий состав.
Активный ингредиент50Крахмал120 1Ъ1крокристаш1Ическая целлюлоза100 Поливинилпирролидин (10%-ный раствор в воде)13 Натрий-карбоксиметилкрахмал14Стеарат магния 3 Всего . 300
Активньм ингредиент, крахмал и целлюлозу тщательно перемешивают. Раствор поливинилпирролидона смешивают с результирую1цими порошками и пропускают через сито. Полученные таким путем гранулы сушат и вновь пропускают через сито. Затем к гранулам добавляют натрий-карбоксиметилкрахмал и стеарат магния, после смешивания гранулы прессуют на таблетирующей магине с получением таблеток весом по 300 мг.
Пример 4. Капсулы, содержащие каждая по 100 мг препарата, имеют следующий состав, мг:
Активный ингредиент
100 98 2 200
Высушенный крахмал
Стеарат магния
Всего
Активный ингредиент, крахмал и стеарат магния пропускают через сито и используют для заполнения твердых желатиновых капсул по 200 мг.
Пример 5. Свечи, содержаasfie каждая 100 мг активного ингредиента, имеют следующий состав, мг:
Активный ингредиент 100
Глицериды насьш енных
жирных кислот, до 2000
Активный ингредиент пропускают через сито и суспендируют в глицеридах нacьш eHныx жирных кислот,предварительно расплавленных с использованием минимального нагрева.Затем смесь выливают в форму для приготовления свечей номинальной емкостью 2 г и охлаждают их.
Как указывалось, соединения согласно изобретению характеризуются активностью в отношении центральной нервной системы. Эта активность продемонстрирована на модельных подопытных животных с использованием отработанных методик. Например, при изучении поведения мышей обнаружено проявление соединениями активности при дозировке 12,5-300 мг/кг, перорально. Кроме того, обнаружено, что соединения проявляют активность в условиях теста на связывание сиропопериодола, описанного Seeman et al. Nature, 261, 717-719 (1976), и характеризуются, например, величиной lOje (концентрация соединения, необходимая для снижения связывания спиропериодола на 50%, равной менее 4 мкмоль). Таким образом, соедо1нения являются мощными агентами цент рального действия с нейролептическими, седативными или релаксантным анксиолоитичесними или антиэметическими свойствами. Эти свойства, сочетании с их высоким терапевтиче ким индексом, делают их полезными для лечения состояний страха слабо тяжести и некоторых видов психических состояний, таких как шизофрения и обострение маниакальных психозов. Соединения согласно изобретению эффективны в широком диапазоне дозировок, причем фактически предпис ваемая дозировка зависит от таких факторов, как используемое конкрет ное соединение, состояние находяще гося на излечении, тип и размеры м копитающего, подверженного воздействию. Однако требуемая дозировка обычно соответствует диапазону 0,5 50 мг/кг в сутки (например, при лечении взрослых людей могут испол зоваться дозировки от 5 до 500 мг в сутки). Известное соединение имеющее структуру ,значительно менее активно, чем предлагаемое соединение при испыта нии по спироперидольному (спипероново14у} тесту. Этот тест дает возможность установить силу взаимодействия химического соединения с передатчиками нейронов и таким образом обеспечивает оценку ЦНС-свой соединений и их потенциальную акти ность в качестве лекарств для лечения центральной нервной системы (см. таблицу). Продолжение.таблицы Способ испытаний следующий. Получают замороженные образцы поперечно-полосатого тела теленка. Ткани гомогенизируют в 40 объемах охлажденного льдом буфера трис -НС (рН 7,7, 50 мМ) и центрифугируют при ускорении 50 000 в течение 10 мин при 4°С. Получающуюся плотную массу в виде таблетки промывают при гомогенизировании 40 объемами указанного буфера и снова центрифугируют в описанных условиях. Полученную таблетку гомогенизируют в 13 объемах 50 мМ буфера три с-НС содержащего 0,1% аскорбиновой кислоты (рН 7,7) и инкубируют полученную суспензию при 37 °С в течение 5 мин. Концентрацию Ъротеинов определяют методом Лаури и хранят полученную ткань при - 50 °С в аликвотах по 2 мл в течение срока до трех месяцев. Для испытания образцы тканей переводят в три с -буфер (50 мМ , содержащего 100 мМ. хлористого натрия и 0,1% аскорбиновой кислоты,рН 7,7), содержащий 0,4 . спиперона, поставляемого Амершэм Интернейшл, +1 мкМ немеченного спиперона, с целью определения специфического места нейролептического связывания при введении испытуемого соединения в различных концентрациях а также гомогената ткани, содержащего 0,4 мг протеина. После инкубирования при в течение 15 мин образцы быстро фильтруют через фильтры из стекловолокна и быстро промывают 2 порциями по 5 мл охлажденного на льду буфера. Кружки фильтрованного материала помещают в кювету для определения радиоактивности и опреде ляют величину радиоактивности. Спе .
9 117097110
цифическое нейролептическое связы-связывания от концентрации исслевание определяется как разностьдуемого лекарственного средства, общего связывания (в отсутствии немеченного спиперона) и неспецифи- Соединения приведенной общей форческого связывания (связывания,мулы имеют ингибирующую концентракоторое достигается в присутствиицию IC-50, равную 11,00 мкМ,тогда немеченного спиперона). Концентра-как из приведенных результатов, ция испытываемого соединения, ко- полученных при испытании предлагаеторая способна ингибировать 50%)0 мых соединений, видно, что указанспецифического связывания, полу-ные соединения являются значительчается из графика зависимости про-но более активными при испытаниях цента ингибирования специфическогосогласно данному тесту.
,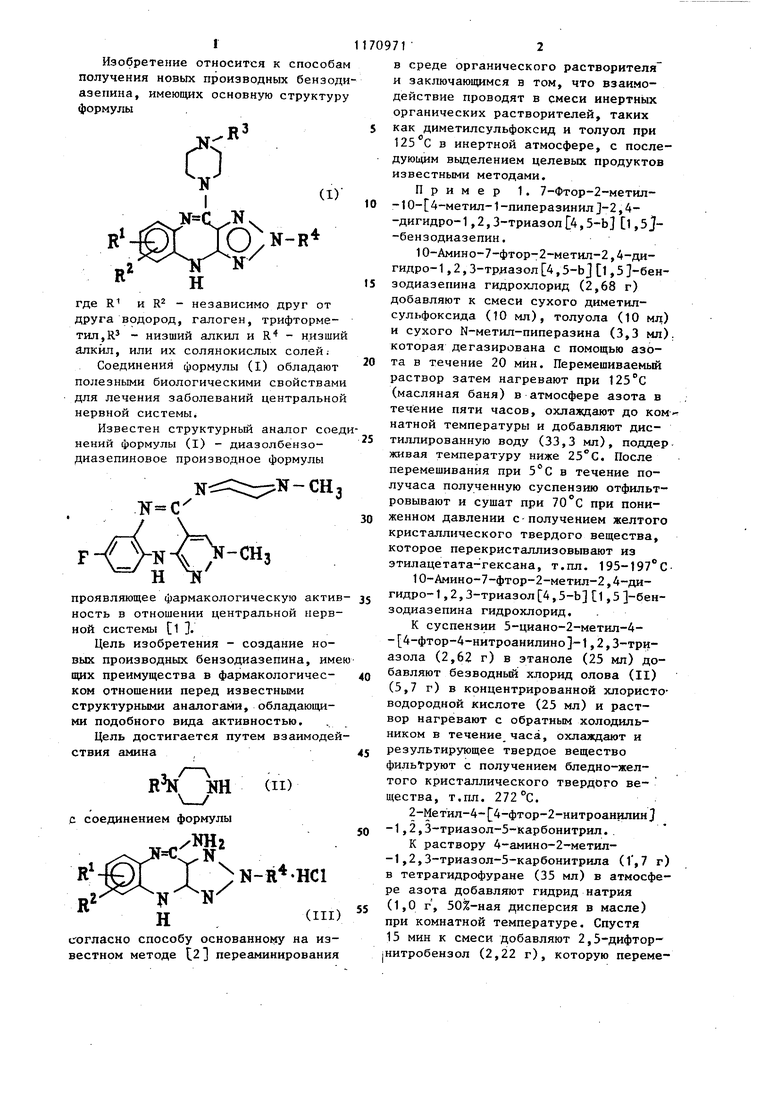




Gnoco6 получения производных бензодиазепина общей формулы (I) R3 О К (b)N-R где R2 независимо друг от друО) га водород, галоген, трифторметил; R3 R низший алкил, низший алкил. или их солянокислых солей, заключающийся в том, что амин формулы (II) RV(ra со где R3 имеет указанное значение, подвергают взаимодействию с соединением формулы III /Ш2 . . N-J-K/ Н где R, R2, R имеют указанные значения, в смеси инертных органических растворителей, таких как диметилсульфоксид и толуол, при 125с в инертной атмосфере.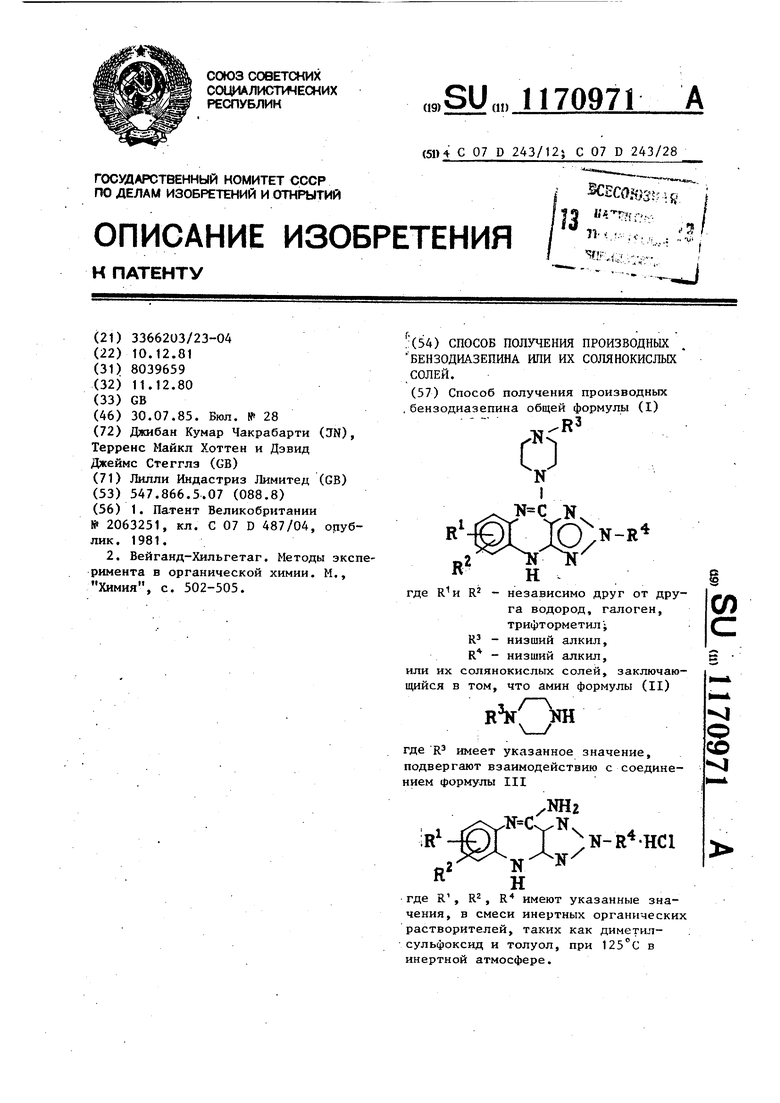
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| УСТРОЙСТВО ДЛЯ ЛЕЧЕНИЯ ОРГАНОВ ТАЗОВОЙ И БРЮШНОЙ ПОЛОСТИ | 1993 |
|
RU2063251C1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление для изготовления в грунте бетонных свай с употреблением обсадных труб | 1915 |
|
SU1981A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Вейганд-Хильгетаг | |||
| Методы эксперимента в органической химии | |||
| М., Химия, с | |||
| Мерная кружка для жидких тел | 1914 |
|
SU502A1 |
Авторы
Даты
1985-07-30—Публикация
1981-12-10—Подача