Изобретение относится к иммунологии, в частности к получению биологического препарата для аллергической диагностики туберкулеза.
Известен применяемый для этой цели в мировой практике очищенный РРД (Purified Protein Derivative) туберкулин, представляющий собой белок, выделенный химическим путем из культурального фильтрата возбудителя туберкулеза, выращенного на синтетической питательной среде [1, 2, 3]
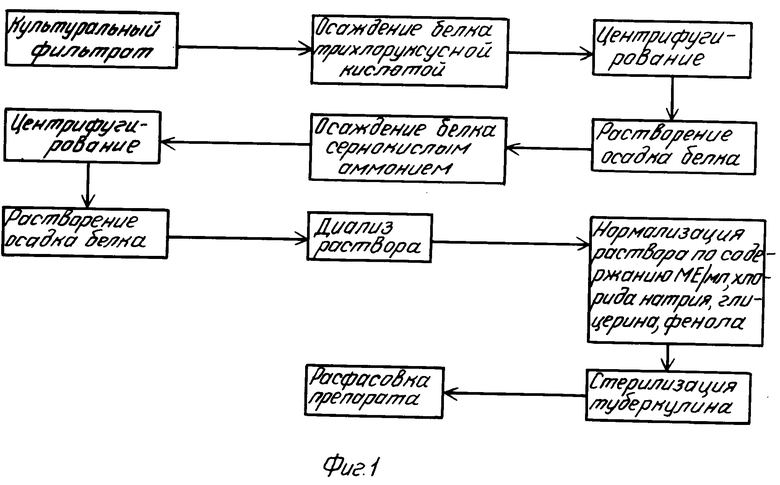
Белок из культурального фильтрата осаждают трихлоруксусной кислотой, сернокислым аммонием с последующей очисткой его путем многократных переосаждений указанными реактивами или спиртом. Такая методика изготовления туберкулина применяется во всех странах, производящих препарат. Так, в отечественной технологии производства туберкулина для ветеринарных целей белок из культурального фильтрата возбудителя туберкулеза осаждают трихлоруксусной кислотой, переосаждают сернокислым аммонием и освобождают от сульфатов путем диализа против водопроводной воды (схема 1, фиг. 1).
В медицинской практике белок осаждают трихлоруксусной кислотой, затем очищают и обезвоживают спиртом и ацетоном.
Такой туберкулин представляет собой смесь фракций разной молекулярной массы от низкомолекулярных пептидов до высокомолекулярных белковых соединений. Содержащиеся в туберкулине высокомолекулярные белковые фракции обладают антигенными свойствами, индуцируют у животных образование антител и повышенную чувствительность немедленного типа [4] снижают видовую специфичность препарата, что усложняет диагностику туберкулеза и требует применения дополнительных методов исследования при установлении состояния животного по этой болезни.
Процесс производства туберкулина открытый и многостадийный, при обработке белка происходит контаминация его микрофлорой, что приводит к образованию в препарате протеолитических ферментов, снижающих активность туберкулина в процессе хранения [5] и других посторонних белков, отрицательно влияющих на специфичность препарата.
На различных технологических этапах происходят большие потери белка. Эти потери составляют (по отношению к исходному содержанию белка в культуральном фильтрате) при осаждении трихлоруксусной кислотой до 42% сульфатом аммония до 30% при диализе до 4% Окончательный выход белка составляет 20% к исходному [6]
Применение при производстве препарата агрессивных химических веществ, сбрасываемых затем в канализацию, загрязняет окружающую среду.
Известно применение при изготовлении очищенного туберкулина метода ультрафильтрации через коллоксилиновые или другие мембраны для концентрирования органических соединений в культуральном фильтрате и удаления неколлоидных составных частей и низкомолекулярных продуктов обмена и аутолиза микобактерий. Туберкулопротеин из такого концентрата осаждают затем дегидратантами (трихлоруксусной кислотой, сернокислым аммонием) [1, 2, 7] что не уменьшает в нем количества высокомолекулярных белков.
Известно также применение в лабораторных исследованиях метода ультрафильтрации с использованием мембран с различной задерживающей способностью для выделения из культурального фильтрата возбудителя туберкулеза белковых фракций различной молекулярной массы с целью изучения их свойств [12, 13] (прототип). Метод заключается в выращивании возбудителя туберкулеза человеческого вида, штамм Н37Rv, на синтетической питательной среде, отделении культурального фильтрата и разделении его на фильтрующих мембранах с задерживающей способностью 10 кДа и 1 кДа. Из части концентрата, содержащего соединения мол.м. 10 кДа и выше, получают туберкулин осаждением белка сернокислым аммонием с последующим обессоливанием раствора, стерилизующей фильтрацией и лиофилизацией.
Однако, несмотря на положительные результаты ряда таких исследований, метод ультрафильтрации для изготовления туберкулина до сих пор не нашел практического применения вследствие малого выхода препарата с узким диапазоном молекулярной массы содержащегося в нем белка и вследствие этого неэкономичностью технологии.
Кроме того, туберкулин, изготавливаемый из M. tuberculosis, содержит больше родовых антигенов микобактерий в сравнении с препаратом, для получения которого используется M. bovis, что обусловливает его невысокую видовую специфичность, а животные, инфицированные M. bovis, реагируют в большей степени на гомологичный аллерген [8, 9, 10]
Поэтому для использования в ветеринарии при диагностике туберкулеза у животных более целесообразно для повышения эффективности исследования применять препарат, изготовленный из M. bovis.
Целью изобретения является получение туберкулина, состоящего из наиболее активной и специфичной части белкового спектра возбудителя туберкулеза, при непрерывном и экономичном технологическом процессе без применения химических реактивов.
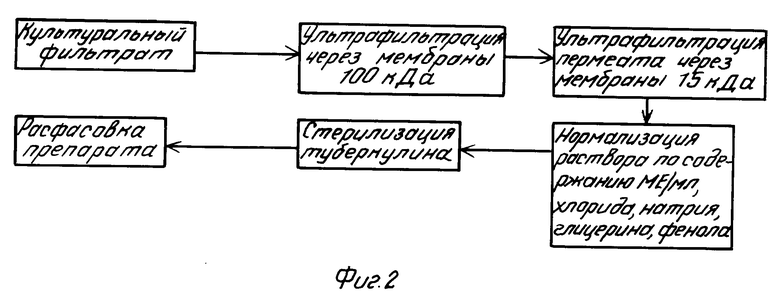
Это достигается выращиванием на синтетической питательной среде M. bovis, штамм N 8 [11] в течение 6-8 недель, инактивацией культуры автоклавированием, отделением культурального фильтрата от бактериальной массы пропусканием через фильтр-полотно и фильтрующие пластины. Затем полученный культуральный фильтрат пропускают последовательно через мембраны (пластинчатые, рулонные или в виде полых волокон) с задерживающей способностью 100 и 15 кДа.
После ультрафильтрации через мембраны 100 кДа концентрат отбрасывают. Фильтрат подвергают ультрафильтрации через мембраны 15 кДа, фильтрат отбрасывают, а концентрат, содержащий соединения мол.м. от 15 до 100 кДа, используют в качестве целевого продукта (схема 2 технологического процесса изготовления "УФ-туберкулина", фиг. 2).
Как показывает сопоставление схем 1 и 2 (фиг. 1 и 2), при изготовлении "УФ-туберкулина" количество этапов производства сокращается в 2 раза.
П р и м е р 1. Для изготовления "УФ-туберкулина" 100 л культурального фильтрата M. bovis, штамм N 8, выращенного в течение 8 недель на синтетической питательной среде и инактивированного нагреванием, пропускали в режиме концентрирования через фильтрующие мембраны с задерживающей способностью 100 кДа. Степень концентрирования равнялась 50. Таким образом было получено 2 л концентрата и 98 л пермеата.
Концентрат, содержащий соединения мол.м. более 10 кДа, отбрасывали, а пермеат с соединениями менее 100 кДа фильтровали через мембраны с задерживающей способностью 15 кДа также в режиме концентрирования. Степень концентрирования части раствора, содержащей соединения мол.м. от 15 до 100 кДа, равнялась 10. Таким способом было получено 9,8 л концентрата и 88,2 л пермеата, содержащего низкомолекулярные вещества.
Пермеат отбрасывали, а концентрат разводили раствором хлористого натрия, содержащим глицерин и фенол, до получения в 1 мл раствора туберкулина 1 мг белка, 0,85% хлорида натрия, 10% глицерина и 0,3% фенола.
Готовый препарат подвергали стерилизующей фильтрации и расфасовывали в условиях асептики во флаконы вместимостью 10 и 20 мл.
Образцы проверены на активность в сравнении с референтной серией ППД-туберкулина для млекопитающих в соответствии с ГОСТ 16739-88 "Туберкулин очищенный (ППД) для млекопитающих" и на видовую специфичность в соответствии с ТУ 10-19-518-87 "Аллерген сухой очищенный комплексный из атипичных микобактерий (КАМ)".
П р и м е р 2. При проверке на морских свинках, сенсибилизированных культурой БЦЖ, установлено, что активность "УФ-туберкулина" была равна 49500 МЕ/мл, что составляет 99% активности референс-препарата туберкулина. По условиям ГОСТ допускается выпуск препарата с содержанием в 1 мл 40-60 тыс. МЕ. Таким образом, изготовленная серия "УФ-туберкулина" по этому показателю соответствует требованиям ГОСТ.
П р и м е р 3. Проведена сравнительная оценка активности "УФ-туберкулинов", содержащих белковые фракции мол.м. более 100 кДа и менее 100 кДа во внутрикожной пробе на морских свинках, сенсибилизированных культурой БЦЖ, в сравнении с референтной серией ППД-туберкулина для млекопитающих. Проверкой установлено, что содержание МЕ в испытываемых препаратах практически одинакового 49500-50000 МЕ в 1 мл.
П р и м е р 4. Проверена видовая специфичность "УФ-туберкулинов", содержащих белковые фракции мол. м. более 100 и менее 100 кДа, на морских свинках, сенсибилизированных смесью культур скотохромогенных (M. scrofulaceum) и нефотохромогенных (M. intracellulare) атипичных микобактерий. При этом установлена более выраженная видовая специфичность "УФ-туберкулина", содержащего белковые фракции мол.м. менее 100 кДа, количество реагирующих на этот препарат животных было меньше в 1,5 раз, и реакция у реагировавших животных в 1,2 раза менее интенсивна.
Результаты опытов 3 и 4 показывают, что активность белков возбудителя туберкулеза не зависит от их молекулярной массы, а видовая специфичность туберкулопротеина повышается с уменьшением молекулярной массы белка. Таким образом, удаление из туберкулина белков мол.м. более 100 кДа повышает его видовую специфичность.
Активные белки содержатся и в части раствора, содержащей соединения мол. м. менее 15 кДа. Однако концентрация таких белков недостаточна для использования в качестве туберкулина с требуемым содержанием международных единиц в миллилитре. Кроме того, в этой части раствора содержится большое количество солей, которые необходимо удалить. В связи с этим методом ультрафильтрации на мембранах 15 кДа проводится концентрирование раствора с соединениями мол. м. от 15 до 100 кДа, и этот концентрат используется в качестве туберкулина.
(56) 1. Seibert F.B. The isolation and properties of the purified psotein derivative of tuberculin Am. Rev. Tuberc. 1934, v. 30, N 6, р. 713-720.
2. Линникова М.А. Очищенный протеино-дериват туберкулина. Проблемы туберкулеза, М. 1939, N 12.
3. Tsumina T. Kuvabara C. Способ получения туберкулина. Патент Японии N 582745, 19.09.73.
4. Петров Р.В. Иммунология. М. Медицина, 1983, с. 368.
5. Безгин В.М. Совершенствование промышленной технологии (ППД) туберкулина и его биохимическая характеристика. Автореф. дисс. канд. биол. наук, М. 1990, с. 27.
6. Шевырев Н.С. Совершенствование промышленной технологии сухого очищенного туберкулина для млекопитающих. Тр. ВГНКИ ветпрепаратов, М. 1972, т. XVIII.
7. Collins F. Lamb J.R. Joung D.B. Infect and Immun. 1988, v. 56, N 5, р. 1260-1266.
8. Lesslie I.W. Hebert C.N. Birn K.T. Comparison of the specificity of human and bovine tuberculin PPD for testing cattle. 1. Republic Ireland Vet. Rec. 1975, v. 96, N 15, р. 332-334.
9. Chaparas S.D. Composition of antigens of various mycobacterial species detected with with a M. tuberculosis reference serum. Amer. Rev. Resp. Dis. 1975, v. 112, N 1, р. 135-137.
10. Baizden L.A. Comparison of the proteins and specificities of human and bovine tuberculosis Amer. J. Vet. Res, 1952, v. 13, N 48, р. 338-344.
11. Инструкция по изготовлению и контролю туберкулина очищенного (ППД) для млекопит. утв. ГУВ 30.12.85.
12. Affronti L.F. Ouchterlony O. Lind A. et. al. Tuberculosis, 1983, N 2, р. 66-68.
13. Affronti L.F. Ouchterlony O. Lind A. Ridell M. Wisingerova E.A WHO cooperative effort to isolate a species specific tuberculin skin testing. Int symposium BCG vaccines and tuberculins, part M. Budapest, 1986, p. 503-509.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛИНА | 1997 |
|
RU2113233C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛИНА | 1993 |
|
RU2035914C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛИНА | 1992 |
|
RU2031656C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЛЕРГЕНА ТУБЕРКУЛЕЗНОГО ДЛЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ И ПИТАТЕЛЬНАЯ СРЕДА, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЭТОГО | 2019 |
|
RU2725630C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛИНА | 1997 |
|
RU2131263C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛИНА ДЛЯ МАССОВОЙ ДИАГНОСТИКИ И ПРОФИЛАКТИКИ ТУБЕРКУЛЕЗА | 2013 |
|
RU2538624C1 |
| КОМПЛЕКСНЫЙ АЛЛЕРГЕН ДЛЯ ДИФФЕРЕНЦИАЦИИ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ У КРУПНОГО РОГАТОГО СКОТА НА ППД-ТУБЕРКУЛИН ДЛЯ МЛЕКОПИТАЮЩИХ | 2002 |
|
RU2217165C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛЕЗНОГО АНАТОКСИНА | 1996 |
|
RU2115432C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЛЕРГЕНА ДЛЯ ДИФФЕРЕНЦИАЦИИ НЕСПЕЦИФИЧЕСКИХ РЕАКЦИЙ НА ППД ТУБЕРКУЛИН ДЛЯ МЛЕКОПИТАЮЩИХ | 2015 |
|
RU2605633C1 |
| Комплексный аллерген для диагностики паратуберкулеза | 2021 |
|
RU2771778C1 |
Использование: ветеринарная иммунология, биологический препарат, аллергическая диагностика туберкулеза. Сущность изобретения: аллерген для диагностики туберкулеза представляет собой эндопротеин, выделенный из культурального фильтра штамма Mycobacterium boris N8, с мол. м. 15 100 кДа, имеющий активность в аллергическом тесте 50000 ± 10000 МЕ/мл. при изготовлении "УФ туберкулина" количество этапов производства сокращается в 2 раза в сравнении с применяющимся методом получения препарата путем осаждения белка дегидратантами а технологический цикл является замкнутым и экологически чистым, без загрязнения окружающей среды агрессивными веществами. Препарат получают методом ультрафильтрации. С этой целью культуральный фильтрат возбудителя туберкулеза, выращенного на синтетической питательной среде и инактивированного нагреванием, пропускают через фильтрующие мембраны с задерживающей способностью 100 кДа, затем полученный пермеат концентрируют на мембранах с задерживающей способностью 15 кДа и нормализует по содержанию МЕ, хлорида натрия и фенола в 1 мл раствора. 2 с. п. ф лы, 2 ил.
Белок 70 80
Липид 5 8
Полисахарид 4 8
нуклеиновые кислоты:
ДНК 0,5 1,5
РНК 0,10 0,15
молекулярная масса 15 100 кДа, обусловленная использованием мембран с задерживающей способностью 15 и 100 кДа;
активность в аллергическом тесте, 50000 ± 10000 МЕ/мл.
| Affronti L.F., Ouchterlony O., Lind A., Ridell M., Wisingerova E | |||
| A WHO cooperative effort to isolate a species specific tuberculin skin testing | |||
| Int.symposium BCG vaceines and tuberculins, part B, Budapest, 1986, p.503-509. |
Авторы
Даты
1995-10-20—Публикация
1992-12-25—Подача