Изобретение относится к ветеринарной иммунологии, в частности к способу получения биологических препаратов, применяемых для аллергической диагностики туберкулеза сельскохозяйственных животных.
Известен способ получения туберкулина, включающий выращивание микобактерий туберкулеза на синтетической питательной среде, термоинактивацию туберкулезных культур, освобождение культуральной жидкости от микобактерий путем фильтрации, выделение белков культуральной жидкости последовательным осаждением трихлоруксусной кислотой и сульфатом аммония, стерильную фильтрацию через асбестсодержащие фильтры. (Инструкция по получению и контролю туберкулина очищенного (ППД) для млекопитающих. Утверждена ГУ ветеринарии МСХ СССР в 1985 г.)
При этом способе получения туберкулина наиболее уязвимым местом технологии является глубинная стерилизующая фильтрация через асбестовые фильтры. Применение асбестсодержащих глубинных фильтров не позволяет получать гарантированно стерильный препарат. Кроме того, использование большого количества глубинных фильтров приводит к значительным потерям белка, что снижает выход препарата.
Известен способ получения аллергена для диагностики туберкулеза, в котором вместо осаждения белков культуральной жидкостью ее подвергают ультрафильтрации на мембранах с номинальной отсекаемой молекулярной массой (НОММ) 100 кДа и последующему концентрированию на мембранах с НОММ 15 кДа [1].
Однако этот метод не позволяет достаточно полно избавиться от полисахаридов культуральной жидкости, снижающих специфичность препарата. Кроме того, ультрафильтрационное фракционирование и концентрирование больших объемов культуральной жидкости технологически трудно осуществимо из-за длительности процессов и значительных потерь выделяемого белка.
Наиболее близким к предлагаемому способу является способ получения туберкулина, включающий выращивание микобактерий туберкулеза на синтетической питательной среде, отделение культуральной жидкости, выделение из нее туберкулина трихлоруксусной кислотой и сульфатом аммония с последующим обессоливанием раствора туберкулина электродиализом и стерильной фильтрацией [2].
Вышеуказанным способом получается туберкулин, содержащий кроме белковой фракции 8 - 15% полисахаридов, которые, являясь балластными веществами, снижают специфичность туберкулина. Наряду с этим в препарате присутствуют крупномолекулярные белоксодержащие микобактериальные антигены, обладающие высокой иммуногенностью. Целью настоящего изобретения является получение более специфичного диагностического препарата и увеличение выхода туберкулина.
Поставленная цель достигается использованием мембранного фракционирования концентрата белков M.bovis с последующей диафильтрацией и, далее, микрофильтрацией раствора туберкулина.
Предлагаемый способ позволяет получать высокоспецифичный, неиммуногенный препарат, более технологичный в изготовлении, а также повысить выход туберкулина. Это стало возможным благодаря использованию ультрафильтрации и диафильтрации раствора белков, выделенных из культуральной жидкости, на мембранах с НОММ 150 - 1000 кДа и последующей микрофильтрации белкового раствора на мембранах с размером пор 0,2 мкм.
Наиболее важными показателями качества туберкулина являются специфичность, активность, иммуногенность. Поэтому в идеале туберкулин для млекопитающих, изготовленный из фракций M. bovis, не должен вызывать реакций у животных, контактировавших с микобактериями других видов, должен давать четкую реакцию у животных, сенсибилизированных M.bovis, и не должен вызывать при многократных введениях здоровым животным сколько-нибудь выраженных иммунных реакций на антигены препарата.
Антигены разных видов микобактерий близки по составу, что определяет наличие перекрестных реакций у животных, инфицированных различными видами микобактерий.
По мнению авторов, полисахариды микобактерий, а также крупномолекулярные комплексы белков с полисахаридами и липидами опосредуют в значительной степени развитие неспецифических иммунных реакций. Кроме того, крупномолекулярные антигены обладают высокой иммунногенностью. Анализ фракций различных туберкулинов по молекулярной массе методом гель-фильтрации показал наличие крупномолекулярного пика, обогащенного полисахаридами.
Значительное отличие по молекулярной массе крупномолекулярного пика от пиков с меньшей молекулярной массой, содержащих в основном белки туберкулина, позволило разработать метод мембранного фракционирования для отделения иммунногенной и неспецифичной фракции туберкулина.
Авторы предлагают применить процесс ультрафильтрации для отделения из концентрата туберкулина крупномолекулярной фракции, обогащенной полисахаридами. Для этого используют ультрафильтрационные мембраны с НОММ 150 - 1000 кДа. Использование мембран с НОММ меньше 150 кДа снижает скорость процесса ультрафильтрации и при определенных режимах приводит к задержке на мембране специфичных белков препарата, что ведет к возрастанию потерь. Применение мембран с НОММ больше 1000 кДа не позволяет эффективно отделить крупномолекулярную фракцию.
Одно лишь ультрафильтрационное концентрирование не позволяет достаточно полно выделить белки туберкулина с необходимой молекулярной массой, что ведет к снижению эффективности процесса.
Авторы предлагают после ультрафильтрационного концентрирования макромолекул туберкулина подвергнуть полученный концентрат процессу диафильтрации с использованием тех же мембран (НОММ - 150 - 1000 кДА). Оба процесса ультрафильтрационного концентрирования и диафильтрации осуществляются при скорости 30 - 50 - дм3/м2 час и трасмембранном давлении 0,1 - 1,0 бар.
Процессы ультрафильтрационного концентрирования и диафильтрации в тангенциальном потоке позволяют удалить нефильтруемые в обычном режиме микрофильтрации полисахариды и ввести в качестве заключительного этапа технологии стандартную стерильную микрофильтрацию в тупиковом режиме. В существующей технологии конечную фильтрацию препарата проводят на глубинных фильтрах СФ, что ведет к значительным потерям белка.
Таким образом, мембранное фракционирование туберкулина позволило не только исключить неспецифическую и иммунногенную фракцию макромолекул из препарата, но и повысить выход конечного продукта.
Предлагаемый способ осуществляется следующим образом.
Готовят матриксную расплодку M.bovis на синтетической питательной среде (среда Курской биофабрики с L-аспарагином). Осуществляют производственный посев и инкубируют культуру в течение 6 - 8 недель при температуре 37oC, инактивируют посевы в течение 30 мин при температуре 120oC. Бакмассу отделяют от культуральной жидкости фильтрованием. Из культурального фильтрата высаждают белок 50% раствором трихлоруксусной кислоты в конечной концентрации 4 - 10%. После центрифугирования осадок растворяют из расчета 1 часть белка и 6 - 10 частей дистиллированной воды, подщелоченной 10%-ным раствором аммиака до pH 7,4 - 7,6. Переосаждают белок равным объемом насыщенного раствора сульфата аммония при нейтральном значении pH. Белок после центрифугирования растворяют в дистиллированной воде (pH 7,6 - 7,8) в соотношении 1 : 5 - 1 : 7 и обессоливают. Обессоленный раствор белка подвергают ультрафильтрационному фракционированию на мембранах с НОММ 150 - 1000 кДа с целью отделения крупномолекулярных белков и полисахаридов. Для более полного извлечения активных специфичных белковых аллергенов M. bovis проводят диафильтрацию концентрата на тех же мембранах. Пермеат, полученный при ультрафильтрации и диафильтрации, стерилизуют методом микрофильтрации на мембранах с размером пор 0,2 мкм.
Стерильный раствор белка используют для приготовления ППД-туберкулина сухого или ППД-туберкулина в стандартном растворе.
Для получения сухого ППД-туберкулина раствор белка фасуют в ампулы или флаконы в зависимости от концентрации и сублимируют.
Для получения ППД-туберкулина в стандартном растворе стерильный раствор белка разбавляют растворителем до необходимой концентрации, нагревают до температуры 90oC и после охлаждения фасуют.
Предлагаемый способ характеризуется следующим примером.
Пример. Готовили матриксную расплодку на синтетической питательной среде (среда Курской биофабрики с L-аспарагином). Производили посев туберкулезной культуры (M. bovis) на синтетическую питательную среду и инкубировали при температуре 37oC 8 недель. Инактивировали посевы в течение 30 мин при температуре 120oC. Бакмассу отделяли от культуральной жидкости фильтрованием. Из культурального фильтрата высаждали белок 50%-ным раствором трихлоруксусной кислоты в конечной концентрации 8%. После центрифугирования осадок растворяли дистиллированной водой, подщелоченной до pH 7,5 из расчета 1 часть белка и 6 частей воды. Переосаждали белок равным объемом насыщенного раствора сульфата аммония при нейтральном значении pH. После центрифугирования белок растворяли в подщелоченной дистиллированной воде в соотношении 1 : 5. Обессоливали раствор белка электродиализом. Обессоленный раствор белка подвергали ультрафильтрационному фракционированию на мембранах с НОММ 300 кДа для отделения крупномолекулярных белков и полисахаридов. Для более полного извлечения активных специфичных белковых аллергенов M.bovis проводили диафильтрацию на тех же мембранах. Пермеат, полученный при фракционировании и диафильтрации, стерилизовали микрофильтрацией на мембранах с размером пор 0,2 мкм.
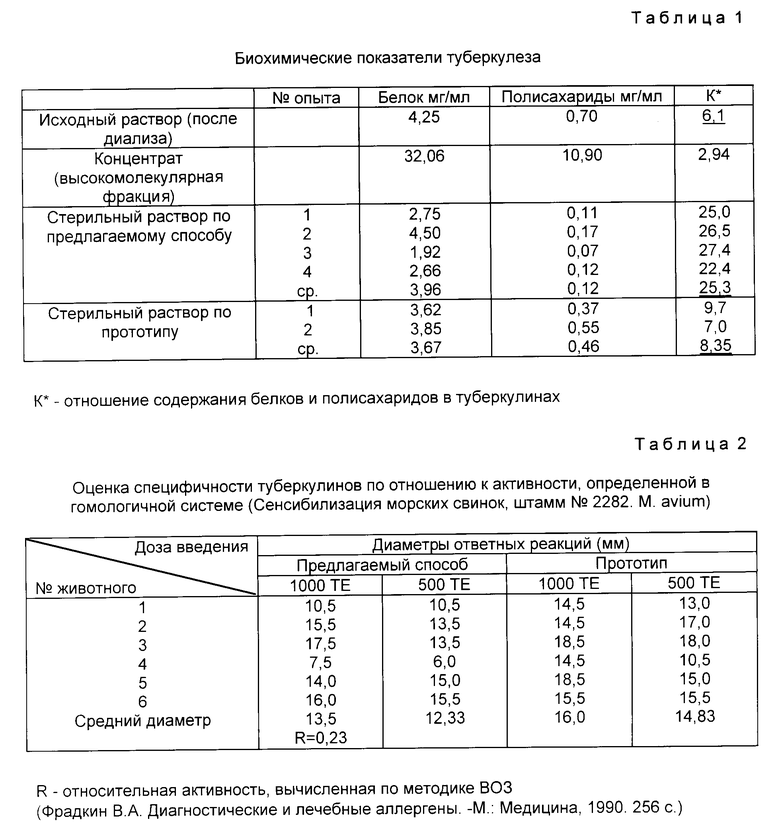
Данные анализов туберкулинов, полученные по предлагаемому способу и по прототипу, приведены в таблицах 1 - 5.
В качестве пояснения к таблицам необходимо отметить следующее.
Как видно из табл. 1, предлагаемый способ позволяет получать туберкулины с более низким содержанием полисахаридов. Так, например, отношение содержания белков к содержанию полисахаридов (К) в опытах составляет в среднем 25,3, тогда как по прототипу эта величина составляет 8,35, т.е. в три раза ниже.
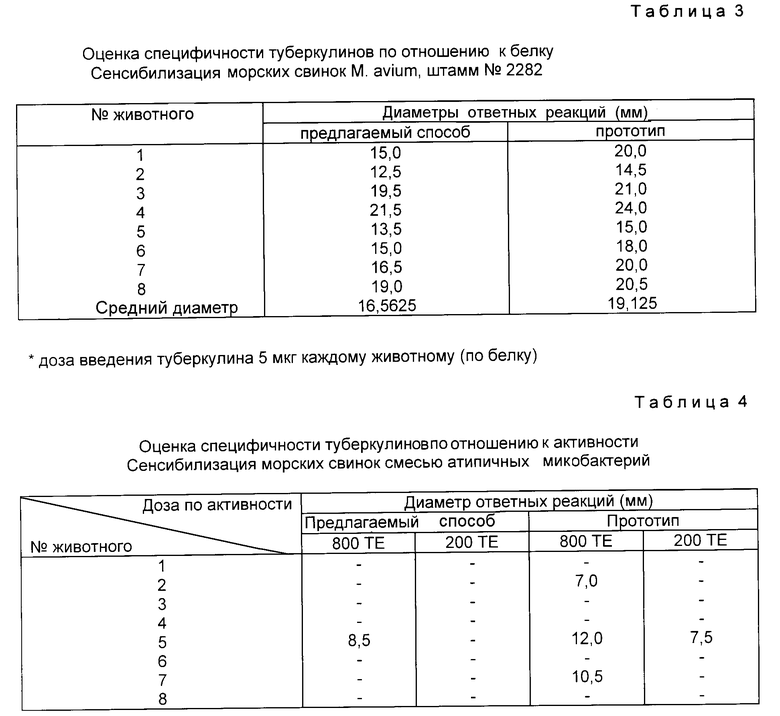
В табл. 2 - 4 приведены результаты сравнения специфичности туберкулинов. Для этого морским свинкам, сенсибилизированным гетерологичными (по отношению к M. bovis) штаммами (M.avium. M. scotochromogenes и M. neochromogenes), вводили равные по содержанию белка или по активности (в системе M. bovis) дозы туберкулинов, полученных по предлагаемому способу и по прототипу.
Средние диаметры ответных реакций на 1000 и 500 ТЕ туберкулина, полученного по предлагаемому способу, меньше средних диаметров ответных реакций таких же доз туберкулина, полученного по прототипу (табл. 2).
При сравнении диаметров ответных реакций равных по белку доз туберкулинов в гетерологичной системе (M. avium) также выявлена достоверно меньшая активность предлагаемого препарата (табл. 3).
Аналогичные данные получены при сравнении туберкулинов по прототипу и по предлагаемому способу на морских свинках, сенсибилизированных атипичными микобактериями (табл. 4).
Таким образом, туберкулин, полученный по предлагаемому способу, проявляет меньшую активность в гетерологичной системе по сравнению с прототипом, т. е. является более специфичным.
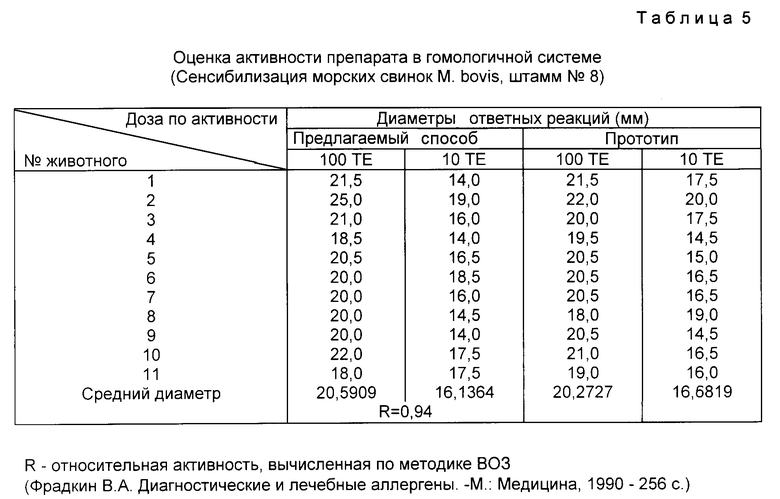
При анализе туберкулина, полученного предлагаемым способом в гомологичной системе (на морских свинках, сенсибилизированных M. bovis), установлена его высокая активность (табл. 5).
Несмотря на то что концентрация белков и органических веществ в опытах в два раза ниже, чем по прототипу (0,35 - 0,8 и 0,4 - 1,0 - соответственно), оба препарата показали одинаковую активность. Таким образом, в предлагаемом препарате при активности, соответствующей ГОСТу 16739-88, количество балластных органических веществ снижено более чем в два раза. Этим можно объяснить более высокую специфичность предлагаемого препарата. Относительная активность опытного туберкулина (R) в гомологичной системе равна 0,94, а в гетерологичной 0,23. Т.е. по отношению к прототипу предлагаемый препарат вызывает неспецифические реакции в четыре раза слабее (0,94 : 0,23 = 4).
| название | год | авторы | номер документа |
|---|---|---|---|
| АЛЛЕРГЕН ДЛЯ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2045959C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛИНА | 1993 |
|
RU2035914C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛИНА | 1997 |
|
RU2131263C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЛЕРГЕНА ТУБЕРКУЛЕЗНОГО ДЛЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ И ПИТАТЕЛЬНАЯ СРЕДА, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЭТОГО | 2019 |
|
RU2725630C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛИНА | 1992 |
|
RU2031656C1 |
| КОМПЛЕКСНЫЙ АЛЛЕРГЕН ДЛЯ ДИФФЕРЕНЦИАЦИИ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ У КРУПНОГО РОГАТОГО СКОТА НА ППД-ТУБЕРКУЛИН ДЛЯ МЛЕКОПИТАЮЩИХ | 2002 |
|
RU2217165C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕНА ДЛЯ ДИАГНОСТИКИ САПА В РЕАКЦИИ АГГЛЮТИНАЦИИ | 1997 |
|
RU2111763C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА "АФФИНОЛЕЙКИН" ДЛЯ ПРОТИВОИНФЕКЦИОННОЙ ИММУНОТЕРАПИИ | 1991 |
|
RU2076715C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТУБЕРКУЛЕЗНОГО АНАТОКСИНА | 1996 |
|
RU2115432C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЛЕРГЕНА ДЛЯ ДИФФЕРЕНЦИАЦИИ НЕСПЕЦИФИЧЕСКИХ РЕАКЦИЙ НА ППД ТУБЕРКУЛИН ДЛЯ МЛЕКОПИТАЮЩИХ | 2015 |
|
RU2605633C1 |
Туберкулин предназначен для аллергической диагностики туберкулеза сельскохозяйственных животных. Туберкулин получают выращиванием микробактерий туберкулеза на синтетической питательной среде и отделением культуральной жидкости. Из культуральной жидкости выделяют туберкулин трихлоруксусной кислотой, переосаждают его сульфатом аммония и обессоливают. Обессоленный концентрат фракционируют на ультрафильтрационных мембранах с НОММ 150 - 1000 кДа. Крупномолекулярную фракцию диафильтруют на тех же мембранах. Далее проводят стерилизующую микрофильтрацию полученных пермеатов. Стерильный раствор белка можно использовать для приготовления ППД-туберкулина сухого или ППД-туберкулина в стандартном растворе. Способ позволяет получать высокоспецифичный, неиммуногенный препарат, более технологичный в изготовлении, а также повысить выход туберкулина. 5 табл.
Способ получения туберкулина путем выращивания микобактерий туберкулеза на синтетической питательной среде, отделения культуральной жидкости с последующим выделением из нее туберкулина трихлоруксусной кислотой, переосаждением его сульфатом аммония и обессоливанием раствора туберкулина, отличающийся тем, что после обессоливания концентрат туберкулина фракционируют на ультрафильтрационных мембранах с НОММ 150 - 1000 кДа, диафильтруют крупномолекулярную фракцию на тех же мембранах и далее проводят стерилизующую микрофильтрацию полученных пермеатов.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| RU, патент, 2045959, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| RU, патент, 2031656, к л | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1998-06-20—Публикация
1997-07-04—Подача