Известны (патент США N 3274209) 6-арил-2,3,5,6-тетрагидроимидазо[2,1-b] тиазол производные, которые применялись как глистогонное средство. Использование 2,3,5,6-тетрагидро-6-фенилимидазо[2,1-b] тиазола для лечения опухолевых заболеваний было описано в патенте США N 4584305. Иммуностимулирующие свойства [S]-[-]-2,3,5,6-тетрагидро-6-фенилимидазо [2,1-b]тиазол, известного под названием левамизол были описаны в Immunofarmacology 1, 1979, 245-254; clin exp.Immunol, 22, 1975, 486-492; и в ссылках к этим статьям. Соединение 5,6-дигидро-3,5,6-трифенилмидазо[2,1-b] тиазол описано в Gazz.Chim.Ital, 114, 1984, 201-204 (СА; 101; 211027) и соединение 5,6-дигидро-6-фенилимидазо[2,1-b] -уксусной кислоты этиловый эфир, дигидрохлорид в I.Heterocycl. Chem, 19, 1982 343-348. Ни одно из соединений не проявило никаких полезных фармакологических или других свойств.
Соединения согласно данному изобретению отличаются от известных тем, что 2,3-связь является ненасыщенной и положение 2 и/или 3 является замещенным. Данные соединения обладают неожиданно значительно большими возможностями как иммуностимулирующее средство по сравнению с известным левамизолом.
Данное изобретение относится к новым производным 6-арил-5,6-дигидроимидазо[2,1-b]тиазола, имеющим общую формулу I
Ar
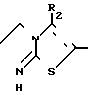 R1 их фармацевтически пригодным солям присоединения кислот и стереохимическим изомерам,
R1 их фармацевтически пригодным солям присоединения кислот и стереохимическим изомерам,
где Аr это фенил, необязательно замещенный галогеном, С1-С6-алкилокси-, С1-С6-алкил-, нитрогруппой или двумя атомами галогена, пиридинил, тиснил, фуранил;
R1 и R2 каждый может быть С1-С20-алкил, циклогексил) метил или фенил, один из R1 и R2 может быть водородом; R1 и R2 совместно могут образовывать С3-С6-алкандиилрадикал.
В приведенных выше определениях С1-С6-алкил является линейным и разветвленным углеводородным радикалом, имеющим от 1 до 6 атомов углерода, например метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, гексил и т.п. С1-С20-алкил означает С1-С6-алкил и их высшие гомологи, имеющие от 7 до 20 атомов углерода, такие, как, например, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил, нонадецил, эйкозил и их разветвленные изомеры; С3-С7-циклоалкил означает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил; С3-С6-алкадиил означает двухвалентные линейные или разветвленные углеводородные радикалы, имеющие от 3 до 6 атомов углерода, такие, как, например, 1,3-пропандиил, 1,6-гексадиил, 1,4-бутандиил, 1,5-пентадиил и т.д. галоген означает фтор, хлор, бром или йод.
Определенная подгруппа из веществ, описываемых формулой I, определенных ранее в тексте, включает соединения, где R2 водород. Другая определенная подгруппа из веществ, описываемых формулой I, включает соединения, где R2 не является водородом. Представляют интерес соединения формулы I из упомянутых ранее подгрупп, в которых Ar фенил, при необходимости замещенный от 1 до 2 независимо выбранных заместителей из группы: галоген, нитро-, гидроксил, С1-С6-алкилокси-, С1-С6-алкил, С1-С6-алкилкарбониламино и арилкарбониламино, тиенил, фуранил или пиридинил.
Особый интерес из упомянутой выше группы интересных соединений представляют соединения, где R1 С4-С10-алкил и Ar фенил, частично замещенный на галоген, нитро-, метоксигруппы или метил.
Наиболее интересными соединениями являются 6-(4-бромфенил)-2-гексил-5,6-дигидроимидазо[2,1-b] тиазол; 6-(4-бромофенил)-2-пентил-5,6-дигидроимидазо-2,1-тиа- зол; 5,6-дигидро-2-пентил-6-фенилимидазо[2,1-b]тиазол; 2-гексил-5,6-дигидро-6-фенилимидазо[2,1-b] тиазол; 2-гептил-5,6- дигидро-6-фенилимидазо[2,1-b] тиазол; и 5,6-дигидро-2-октил-6-фенилимидазо[2,1-b] тиазол, их фармацевтически пригодные кислые соли и их стереоизомеры.
Предпочтительными соединениями являются 2-гексил-5,6-дигидро-6-фенилимидазо[2,1-b] тиазол; [S] -[-] -2-гексил-5,6- дигидро-6-фенилимидазо[2,1-b] тиазол; [R]-[+]-2-гексил-5,6-дигидро-6-фенилимидазо [2, 1-b]тиазол; все смеси последних упомянутых энантиомеров, также, как и их фармакологически пригодные кислые соли.
В зависимости от природы заместителей, соединения формулы I имеют несколько асимметричных атомов углерода. За исключением особо оговоренных случаев химическое название соединения означает смесь всех возможных стереоизомеров, упомянутые смеси содержат диастереоизомеры и энантиомеры основных молекул. Точная конфигурация каждого хирального центра может отличаться стереохимическими указателями R и S.
Данное изобретение охватывает также стереохимические изомеры соединений формулы I.
Соединения формулы I, имеющие основные свойства, могут быть превращены в терапевтически активные нетоксичные соли присоединения кислот путем обработки соответствующими кислотами, такими, как, например, неорганические кислоты, хлористоводородная, бромистоводородная и т.п. серная, азотная, фосфорная и т.п. или органическими кислотами, такими, как, например, уксусная, пропановая, оксиуксусная, 2-оксипропановая, 2-оксопропановая, этандионовая, пропандионовая, бутандионовая, [Z] -2-бутендионовая, [E]-2-бутендионовая, 2-оксибутендионовая, 2,3-диоксибу- тендионовая, 2-окси-1,2,3-пропантрикарбоновая, метансульфиновая, этансульфоновая, бензосульфоновая, 4-метилбензосуль- фоновая, циклогексансульфаминовая, 2-оксибензойная, и т.п. Обратное превращение может быть осуществимо путем обработки соли щелочью.
Термин "фармацевтически пригодные соли" также включает сольваты, которые могут образовывать соединения формулы I и упомянутые сольваты охватываются данным изобретением. Примерами таких сольватов служат, например, гидраты, алкоголяты и т.п.
Соединения формулы I могут быть получены путем циклизации промежуточного вещества формулы II в присутствии соответствующего реагента, при необходимости в подходящем инертном растворителе
Ar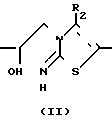 R1
R1
 Ar
Ar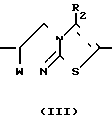 R1
R1
Соответствующие активирующие реагенты включают реагенты, которые могут превращать гидроксильную группу в реакционную остаточную группу W, также, как, например, неорганические и органические кислоты, галогенводородные кислоты, серная, фосфорная, полифосфорная, этиловый эфир полифосфорной кислоты, уксусная и т.п. кислоты, галогенирующие реагенты, например, тионилхлорид, трихлорид фосфора, фосфорилхлорид, хлорид цинка и подобные галогенирующие реагенты; сульфонилирующие реагенты, например, метансульфонил хлорид, метилбензосульфонилхлорид и т.п. ацилирующие реагенты, например, уксусная, пропановая кислоты, бензангидрид, ацетил, пропионил и бензоилхлориды; дегидратирующие реагенты, например, дициклогексикарбодиимид и т.п. Упомянутая остаточная группа W в промежуточном веществе III представляет, например, гидроксоний, галогены, т.е. ионы хлора и брома, ацильная группа, т. е. ацетил, пропионил, бензоил и т.п. или сульфонилоксигруппа, т.е. сульфонилоксиметан, метилсульфонилоксибензол и т.п. Подходящими инертными растворителями являются, например, ароматические углеводороды, т.е. бензол, метилбензол, диметилбензол и т.п. галоидозамещенные углеводороды, например, дихлорметан, трихлорметан, тетрахлорметан и т.п. эфиры, например, тетрагидрофуран, 1,1'-оксибисэтан, 1,4-диоксан и т.п. уксусный ангидрид и т.п. или смесь таких растворителей. В некоторых случаях проводят циклизацию промежуточного вещества III в присутствии оснований, таких, как, например, карбонаты щелочных или щелочноземельных металлов или гидрокарбонатов, например, карбонат натрия, карбонат калия и т.п. или органических оснований, таких, как, например, третичных аминов, т. е. N, N-диэтилэтанамин, N,N-ди(1-метилэтил)этанамин и т.п. Упомянутая реакция циклизации может проводиться при комнатной температуре, хотя в некоторых случаях был бы полезен небольшой подогрев.
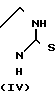
Соединения формулы I также могут быть получены путем взаимодействия имидазолина формулы IV или эквивалентного таутометрического тиола, с реагентом формулы R1-CH[W1]-C[=O]-R2 (V).
Ar
 +
+ 
 (I)
(I)
В формуле V и ниже W1 представляет удаляемую реакционную группу, такую, как, например, галоидные ионы: ионы хлора и брома, сульфонилоксигруппу: сульфонилоксиметан, 4-метилсульфонилоксибензол и т.п. Упомянутая реакция циклизации может выполняться путем перемешивания, если необходимо с нагреванием реагентов в реакционно-инертном растворителе, иногда в присутствии подходящего основания. Подходящими растворителями являются, например, алканолы: метанол, этанол и т.п. кетоны: 2-пропанон, 4-метил-2-пентанон и т.п. карбоновые кислоты, уксусная, пропановая и т.п. кислоты; ароматические углеводороды: бензол, метилбензол и т.п. галоидозамещенные углеводороды: дихлорметан, трихлорметан, тетрахлорметан и т.п. эфиры: 1,1'-оксибисэтан, тетрагидрофуран, 1,4-диоксан и т.п. биполярный апротонный растворитель: N,N-формамид, N, N-диметилацетиламид, пиридин т.п. или смесь этих растворителей. Подходящими основаниями являются, например, неорганические основания: карбонаты щелочных и щелочноземельных металлов, гидрокарбонаты, оксиды или гидроксиды: карбонат натрия, гидрокарбонат натрия, карбонат калия, гидроксид натрия, гидроксид калия и т.п. гидрид натрия; или органические основания, такие, как, например, алкоксиды щелочных металлов: метоксид натрия, этоксид натрия, трет.бутоксид т.п. амины: N-(1-метилэтил)-2-пропанамин, N,N-диэтилэтанамин, 1,8-диазобицикло[5,4,0] ундец-7-ен и т.п. основания. Для увеличения скорости возможен подогрев реакционной смеси, точнее до температуры флегмы.
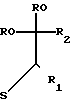
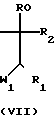
В некоторых случаях можно провести реакцию между имидазолином (IV) с защищаемым производным реагента формулы V, конкретно ацеталем (VII): диметил-, диэтил-, этандиил- или пропандиилацеталем, получая таким образом промежуточное вещество формулы VI.
Ar
 + RO
+ RO  ___→ Ar
___→ Ar
 ___→ (I)
___→ (I)
Упомянутое промежуточное вещество (VI) может быть далее циклизировано в соединение формулы I путем обработки соответствующей кислотой, такой, как, например, хлористоводородная, серная и т.п. карбоновой кислотой: уксусной, пропановой, трихлоруксусной, трифторуксусной и т.п. кислотами, в подходящем реакционно-инертном растворителе, который был определен ранее.
Некоторые из промежуточных и исходных веществ, которые упоминаются далее, известны и могут быть получены по известным методикам получения упомянутых или аналогичных промежуточных или исходных веществ, а определенное количество промежуточных веществ являются новыми. Некоторые способы получения этих новых промежуточных веществ будут подробно описаны в тексте.
Промежуточные вещества формулы II являются новыми и могут в общем случае приготовляться путем окисления промежуточных кетонов формулы VII.
Ar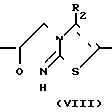 R1 ____→ Ar
R1 ____→ Ar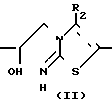 R1
R1
Упомянутое окисление проводят путем обработки промежуточного кетона (VIII) в подходящем реакционно-инертном растворителе с использованием окислителей, таких, как, например, боргидрид щелочного металла: лития, калия или предпочтительно боргидрид натрия, цианоборгидрид натрия, триметоксиборгидрид натрия, бис-(2-метоксиэтокси) гидрид алюминия, литийалюминийгидрид, триалкоксиаланы лития и т.п. окислители. Подходящими растворителями являются, например, вода, алканолы, метанол, этанол, 1-пропанол, 2-пропанол и т. п. например, 1,1'-оксибисэтан, тетрагидрофуран, 1,4-диоксан, 2-метоксиэтанол, 2,2'-оксибиспропан, 1,2-диметоксиэтан, 1,1'-окси- бис(2-метоксиэтан) и т.п. ароматические углеводороды: бензол, метилбензол, диметилбензол и т.п. или смеси этих растворителей.
Другим способом получения промежуточных веществ формулы II является реакция между эпоксидом формулы IX и тиазоламином формулы X
Ar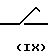 O +
O + 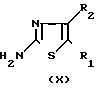 ____→ (II)
____→ (II)
Упомянутая реакция может проводиться путем нагревания, иногда с нагреванием реагентов в реакционно-инертном растворителе, иногда в присутствии соответствующей кислоты. Подходящим растворителем является ароматическое углеводороды: бензол, метилбензол и т.п. галоидозамещенные углеводороды: дихлорметан, трихлорметан, тетрахлорметан и т.п. эфиры: 1,1'-оксибисетан, тетрагидрофуран, 1,4-диоксан и т.п. биполярные апротонные растворители: N, N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, ацетонитрил и т. п. или смеси этих растворителей. Соответствующими кислотами являются органические кислоты 4-метилбензосульфоновая кислота, метансульфоновая кислота и т.п.
Промежуточные вещества формулы VIII могут быть получены путем N-алкилирования тиазоламина формулы X с реагентом формулы XI, где W это остаточная реакционная группа, которая была определена ранее
Ar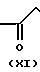 W +
W + 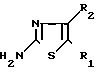 ____→(VIII)
____→(VIII)
Упомянутая реакция N-алкилирования может выполняться путем перемешивания, иногда с нагреванием, агентов в реакционно-инертном растворителе. В качестве реакционно-инертных растворителей можно отметить: метанол, этанол, 2-пропанол, 1-бутанол и т.п. кетоны: 2-пропонанон, 4-метил-2-пентанон и т.п. ароматические углеводороды: бензол, метилбензол и т.п. галоидозамещенные углеводороды: дихлорметан, трихлорметан, тетрахлорметан и т.п. эфиры: 1,1'-оксибисэтан, тетрагидрофуран, 1,4-диоксан и т.п. сложные эфиры: этилацетат и т. п. биполярные растворители: N,N-диметилформамид, диметилсульфоксид, ацетонитрил и т.п. или смеси этих растворителей. В некоторых случаях может использоваться добавка иодида щелочного металла, например иодида натрия.
Промежуточное вещество формулы IV может быть получено путем циклизации диамина формулы XII с реагентом формулы L-C[=S]-L (XIII), где L представляет подходящую остаточную группу
AR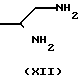 + L-
+ L-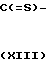 L ____→ Ar
L ____→ Ar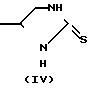
В качестве типичных примеров реагентов XIII можно отметить тиомочевину, дихлорангидрид карбонотионовой кислоты, сероуглерод, 1,1-карбонотиоилбис-[1H-имидазол] и т.п. реагенты.
Упомянутая реакция циклизации может проводиться путем перемешивания, при необходимости с подогревом, реагентов в реакционно инертном растворителе, таком, как, например, ароматические углеводороды: бензол, метилбензол, диметилбензол и т.п. галоидзамещенные углеводороды: трихлорметан, тетрахлорбензол, хлорбензол и т.п. эфиры: 1,1'-оксибисэтан, тетрагидрофуран, 1,4-диоксан и т.п. диполярные апротонные растворители: N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, 1-метил-2-пирролидинон, метилпиридин, диметилпиридин, 1,1-диоксид тетрагидротиофена и т.п. или смеси этих растворителей. В некоторых случаях, однако, предпочтительно проводить реакцию с нагреванием в отсутствии растворителя. Иногда следует добавлять к реакционной смеси основание, такое, как, например, амины: N,N-диэтилэтанамин, N-(1-метилэтил)-2-пропанамин, 4-метилморфолин и т.п. амины. В случае применения в качестве реагента формулы XIII сероуглерода реакцию можно проводить также в воде или алканоле, таком, как, например, метанол, этанол, пропанол и т. п. в присутствии таких оснований, как гидроксид калия, натрия, и т.п. Или другим способом эта реакция может проводиться в основном растворителе, таком, как, например, пиридин и т.п. в присутствии фосфоритов, например, дифенилфосфата.
Промежуточные вещества формулы XIII в общем случае получают и растворяют согласно описанию в статье Ann.Chem. 1932, 494, 143 и в ссылках к этой статье. Другим способом также можно получить диамины формулы XII: реакцией соответствующего альдегида Ar-CHO с цианидом щелочного металла: цианидом натрия или калия и т.п. в присутствии аммиака или его кислой соли типа гидрохлорида аммония и т.п. Полученный таким образом аминонитрил может быть затем окислен до диамина (XII) по известным способам окисления, например, гидрогенизацией с палладиевым, платиновым, никелевым и т.п. катализаторами в подходящем растворителе, например, в алканоле: метанол, этанол, 2-пропанол и т.п. в эфире: 1,1'-оксибисэтан, 2,2'-оксибиспропан, тетрагидрофуран, 1,4-диоксан; в ароматических углеводородах: бензол, метилбензол и т.п. в присутствии подходящей кислоты, такой как, например, хлористоводородная, бромистоводородная, уксусная и т.п.
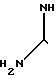
Промежуточные вещества формулы X, в свою очередь, могут быть получены реакцией промежуточного вещества формулы V с тиомочевиной XIV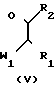 H2N
H2N 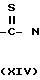 H2 ____→ H2N
H2 ____→ H2N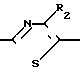 R1
R1
Упомянутая реакция может проводиться согласно способу получения соединений формулы I из промежуточных веществ IV и V, описанному ранее.
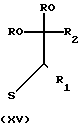
Другим способом получения промежуточных веществ формулы X также служит реакция между промежуточным веществом VII и тиомочевиной XIV и последующая циклизация таким способом полученного промежуточного вещества XV c помощью соответствующей кислоты, как описано в случае получения соединений формулы I из промежуточных веществ IV, VII

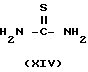
Чистые стереохимические изомеры соединений формулы I могут быть получены применением известных способов. Диастереоизомеры могут разделяться физическими методами, такими, как, например, селективная кристаллизация и хроматография: противоточное разделение, жидкостная хроматография и т.п. энантиомеры могут разделяться путем селективной кристаллизации их диастереомерных солей с помощью оптически активных кислот или предпочтительно путем хроматографии: жидкостной хроматографией с использованием в качестве хиральной стационарной фазы подходящего производного целлюлозы, например, три(диметилкарбомоил) целлюлоза (Chiroal OD ) и т.п. Чистые стереохимические изомеры могут также быть получены из соответствующих чистых стереохимических изомеров подходящих начальных веществ при условии, что реакция является стереоспецифической.
) и т.п. Чистые стереохимические изомеры могут также быть получены из соответствующих чистых стереохимических изомеров подходящих начальных веществ при условии, что реакция является стереоспецифической.
Совершенно неожиданно оказалось, что предлагаемые вещества обладают значительно большими возможностями в качестве иммуностимулирующих препаратов по сравнению с известным ранее [S]-[-]-2,3,5,6-тетрагидро-6-фенилимидазо[2,1-в] тиазол, что в патентах США NN 3274209 и 4584305 и известно под названием левамизол. Улучшенные иммуностимулирующие свойства предлагаемых веществ четко проявляются при измерении степени включения 3Н-тимидина в конкавалине А-стимулированных в тимоцитах мышей [in Conconavalin A-stimulated murine thymocytes] в присутствии микромолярных количеств предлагаемых веществ.
Когда [S] -[-]-2,3,5,6-тетрагидро-6-фенилмидазo[2,1-b]тиазол(левамизол) проявляет свой максимальный стимулирующий эффект только около 100 μМ (Immunopharma- cology, 1979, 1, 246): "внедрение 3Н-тимидина максимально при концентрации 50 мг/мл (-200 μМ))", предлагаемого вещества показывают максимальный стимулирующий эффект при концентрации 0,1-1,0 μМ. Таким образом, предлагаемые вещества наиболее активные при концентрациях в 100-1000 раз ниже, чем концентрации известных ранее веществ.
Весьма неожиданно, что промежуточные вещества формулы II и VIII также проявляют иммуностимулирующие свойства, что может быть показано с помощью описанной методики анализа.
С учетом улучшенных иммуностимулирующих свойств соединения формулы I и промежуточные вещества формул II и VIII являются полезными при лечении человека и теплокровных животных, страдающих заболеваниями, при которых иммунная система ослаблена или подавлена. Типичным примером таких заболеваний служат, например, бактериальные, вирусные инфекции, например, verrucal, herpes simplex, вирусный гепатит, СПИД и т.п. туберкулез, ревматические заболевания и т. п. Особый интерес представляет использование этих соединений в качестве вспомогательных лекарственных препаратов в лечении опухолевых заболеваний.
Такое использование включает лечение пациента соединениями формулы I или промежуточными веществами формулы I или VIII совместно с противоопухолевой терапией также, как и пациентов, у которых есть угроза рецидива после противоопухолевого лечения. Термин "противоопухолевое лечение" определяется как методы, обычно используемые для лечения пациентов, страдающих злокачественными заболеваниями, например, хиpургические, радиотерапевтические и особенно химиотерапия. С точки зрения полезности фармакологических свойств данные соединения и промежуточные вещества могут применяться в различных формах.
Для получения фармацевтического препарата по изобретению необходимое количество определенного соединения или промежуточного вещества в виде кислой соли или основной формы смешивается с фармацевтически пригодным носителем, в результате чего можно получить различные формы употребления в зависимости от способа применения лекарств. Желательно получать эти фармацевтические составы в одноразовых дозах, подходящих предпочтительно для следующих способов применения: через рот, ректально, подкожно или парэнтеральной инъекции. Например, при приготовлении препарата для применения через рот может использоваться любая обычная фармацевтическая среда: вода, гликоли, масла, алкоголи и т.п. для случая жидких составов, таких, как, суспензия, сиропы, эликсиры и растворы; или твердые носители, такие, как крахмал, сахара; каолин, консистентные масла, связующие, разлагающие агенты и т.п. в случае порошков, пилюль, капсул и таблеток. Таблетки и капсулы, в которых используется твердый фармацевтический носитель, наиболее удобны вследствие легкости их применения. Для парэнтеральных составов носитель обычно включает дистиллированную воду, по крайней мере большем количестве, чем другие ингредиенты, например, для улучшения растворимости. Растворы для инъекций, например, могут приготовляться с использованием носителей, включающих солевые растворы, растворы глюкозы или их смеси. Суспензии для инъекций могут также получаться с использованием подходящих жидких носителей, суспендирующих агентов и т.п.
Для составов для подкожного применения носитель включает агент для ускорения введения и/или подходящий смачивающий агент, иногда смешанный с небольшими количествами подходящих добавок, причем эти добавки не должны оказывать вредного воздействия на кожу. Упомянутые добавки способствуют введению препарата и/или могут быть полезны при приготовлении желаемых составов. Эти составы могут применяться различными способами, например, в виде мази с повязкой. Кислые соли формулы I и промежуточные вещества формул II и VIII благодаря своей более высокой растворимости в воде, по сравнению с основными формами, очевидно более удобны для получения водных составов.
Особенно важно изготавливать упомянутые фармацевтические составы в формах разовых доз для облегчения их применения и однородности распределения веществ в дозе. Используются физически раздельные дозы для разового применения, причем каждая доза содержит предварительно рассчитанное количество активного ингредиента для получения необходимого терапевтического эффекта, вместе с требуемым фармацевтическим носителем. Примерами таких доз служат таблетки (обычные или в оболочке), капсулы, пилюли, пакетики с порошком, облатки, инъекционные растворы или суспензии, чайные и столовые ложки и т.п. разделенные между собой. Количество активного ингредиента на одну дозу находится в диапазоне 0,1-500 мг, точнее 0,5-100 мг, предпочтительно 2-40 мг.
С точки зрения полезных свойств данных соединений и промежуточных веществ как иммуностимулянтов, изобретение дает метод лечения людей и теплокровных животных, страдающих от расстройств и/или заболеваний, при которых ослаблена иммунная система, упомянутый метод включает применение эффективного количества иммуностимулирующего соединения формулы I или промежуточных веществ формулы II или VIII, их фармацевтически пригодных кислых солей или стереохимических изомеров, в смеси с фармацевтическим носителем. Специалисты в области лечения расстройств и/или заболеваний, связанных с ослаблением иммунной системы, могут легко определить эффективное количество иммуностимулирующего соединения формулы I и промежуточных веществ II и VIII из экспериментальных результатов, приводимых далее в тексте. В общем случае предполагается, что эффективная дневная доза соединения формулы I или пpомежуточных веществ формул II и VIII составляет 0,01-5,0 мг/кг веса тела, предпочтительно 0,04-2,5 мг/кг веса тела в день. В некоторых случаях необходимую дозу следует принимать в один прием или два, или три, или четыре, или более приемов с соответствующими интервалами в течение дня. Уменьшенные дозы могут приготовляться в виде единичных форм. Очевидно, что эффективная дневная доза зависит от состояния, реакции пациента на лечение, тяжести заболевания, оценки лечащим врачом данных соединений, т.е. эффективное количество может быть соответственно снижено или увеличено. Диапазон эффективного количества является лишь общим направлением и не служит пределом для использования изобретения.
Предлагается метод лечения пациентов, страдающих опухолевыми заболеваниями. Предлагаемый метод включает применение эффективного количества иммуностимулирующего соединения формулы II или VIII совместно с антиопухолевым лечением, таким, как, хирургия, радиотерапия и особенно химиотерапия. В качестве примера противоопухолевых лекарств, которые могут использоваться в химиотерапии, следует отметить анцитабин (циклокситидин), азатиоприн, блеомицин, бисульфан, каластерон, карбоквон, кармустин, хлорамбицил, цисплатин, циклофосфамид, цитарабин, дакарбазин, дактиномицин, доксорубицин (адриамицин), дромостанолон пропинат, эпитиостанол (эпитиоадростанол), эстрамустин фосфат, этопосид, фторурацил, диэтилстилбестрол дифосфат, оксимочевина, ломустин, меленгестрол, мельфалан, 6-меркаптопурин, метотрексат, митобронитол, митомецин С, митоподозид, митотан, микофеноликовая кислота, нимустин, пипоброман, пипосульфан, преднимустин, прокарбазин, разоксан, тегафур, тенипозид, тестолактон, триэтиленфосфоромид, тиогуанин, триазеквон, трофосфамид, урамустин, винбластин, винкристин и т.п. антиопухолевые лекарства.
Эффективное количество противоопухолевого лекарства, особенно одно или несколько из лекарств, дается пациенту одновременно, отдельно или последовательно с эффективным количеством иммуностимулирующего соединения формулы I или промежуточных веществ формул II или VIII. В общем случае считается, что эффективная доза противоопухолевого лекарства равна обычно применяемой дозе в противоопухолевой терапии, и эффективное количество иммуностимулирующего соединения формулы I или промежуточных веществ формул II или VIII будет находиться в следующем диапазоне 0,01-5 мг/кг веса тела, предпочтительно 0,04-2,5 мг/кг веса тела.
Следующие примеры иллюстрируют данное изобретение, но не ограничивают его существа. За исключением особо оговоренных случаев, все количества веществ выражены в вес.ч.
Экспериментальная часть
А. Получение промежуточных веществ.
П р и м е р 1. К перемешиваемому раствору 21 ч. октодеканала в 65 ч. дихлорметана и 50 ч. 1,4-диоксана по капле добавлены 34,1 ч. брома. После перемешивания в течение 4 ч при комнатной температуре реакционную смесь выливали в 250 ч.воды. Продукт экстрагировали дихлорметаном и экстракт высушивали, фильтровали и испаряли с выходом 28 ч (95% ) 2-бромооктодеканала (промежуточное вещество 1).
Смесь 6,7 ч тиомочевины, 28 ч. промежуточного вещества 1 и 80 ч этанола перемешивали в течение 1 ч при температуре флегмы. Реакционная смесь испарялась, и остаток промывали NaOH (водн.). Продукт экстрагировали дихлорметаном, экстракт высушивали, фильтровали и испаряли с выходом 11,8 ч (45%) 5-гексадецил-2-тиазоламина (промежуточное вещество 2).
П р и м е р 2. Смесь 6 ч. 5-гептил-2-тиазоламина (полученный как промежуточное вещество 2), 6 ч. 2-бромо-1-фенилэтанона и 120 ч. ацетонитрила перемешивали в течение ночи при комнатной температуре. Осадок отфильтровывали, промывали 2,2-оксибиспропаном и высушивали с выходом 10 ч. гидробромида 2-(5-гептил-2,3-дигидро-2-имино-3-тиазолил)-1-фенилэтанона (промежуточное вещество 3).
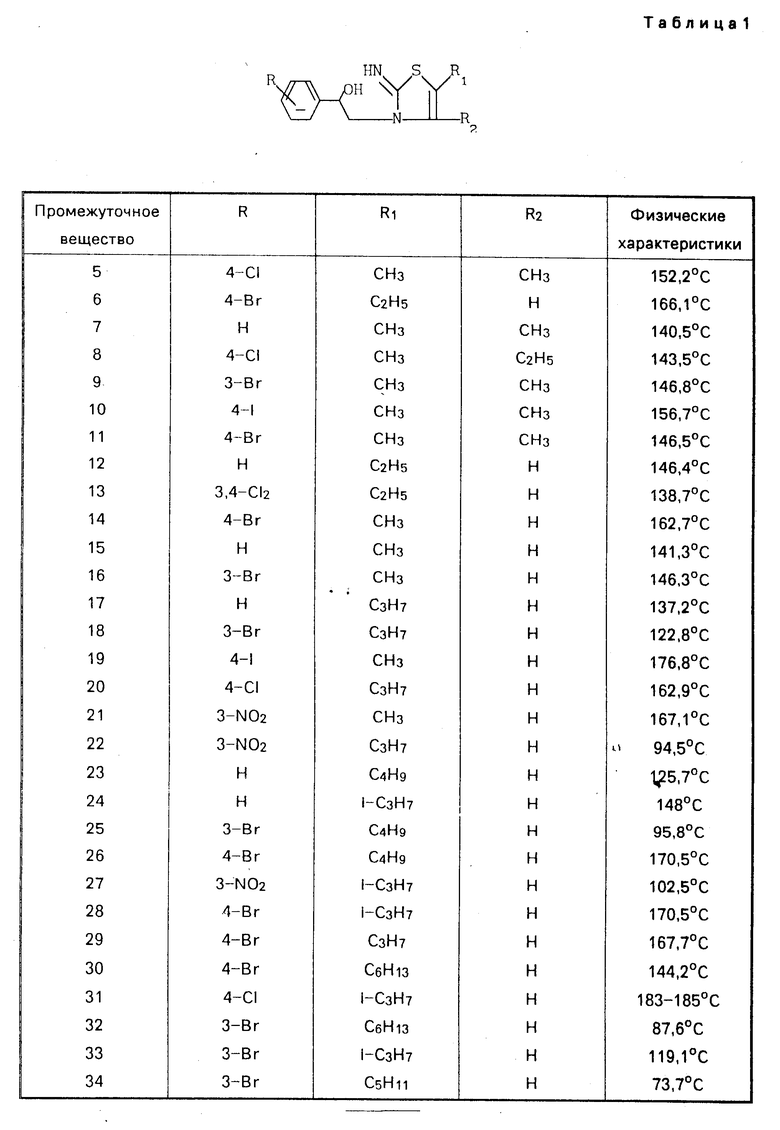
П р и м е р 3. К перемешиваемой и охлажденной (ледяной ванной) смеси 10 ч. промежуточного вещества 3 в 120 ч. метанола небольшими порциями была добавлена 1 ч. тетрагидробората натрия. После перемешивания в течение 2 ч при комнатной температуре реакционную смесь разбавляли 100 ч. воды и затем осуществляли выпаривание. Остаток растирали в порошок в воде, фильтровали и растворяли в трихлорметане. Этот раствор высушивали, фильтровали и испаряли. Остаток кристаллизовали из 2-пропанола с выходом 5,3 ч. 5-гептил-2,3-дигидро-2-имино-α-фенил-3-тиазолэтанола; т.п. 123,5оС (промежуточное вещество 4). Промежуточные вещества, приведенные в табл. 1 и 2, получены аналогичным образом.
П р и м е р 4. Смесь 51 ч 2-бромо-1-(2-тиенил)этанона, 28,5 ч. 5-этил-2-тиазоламина и 240 ч. ацетонитрила перемешивали в течение 1 ч при нагревании на водяной бане. После охлаждения осадок был отфильтрован, промыт этанолом и высушен под вакуумом с выходом 54 ч. гидробромида 2-(2,3-дигидро-2-имино-5-метил-3-тиазолил) -1-(2-тиенил)этанона; т. пл. 207,5-208оС (промежуточное вещество 56).
Смесь 38 ч. промежуточного вещества 56,19 ч. уксусного ангидрида, 19 ч. пиридина и 300 ч. трихлорметана нагревали в течение 6 ч на паровой бане. После охлаждения реакционную смесь промывали гидроксидом аммония. Органический слой отделяли, высушивали, фильтровали и испаряли. Остаток перекристаллизовывали из метилбензола с выходом 20 ч. N-[2,3-дигидро-3-[2-оксо-2-(2-тиенил)этил]-5-метил-2-тиазолиден]-ацета- мида; т.пл. 187-188,5оС (промежуточное вещество 57).
К перемешанной суспензии 7 ч. промежуточного вещества 57 в 100 ч. метанола по капле был добавлен 0,95 ч. тетрагидробората натрия. После перемешивания в течение 1 ч при комнатной температуре растворитель испаряли. Остаток помещался в воду и экстрагировали трихлорметаном. Экстракт высушивали, фильтровали и испаряли. Остаток перекристаллизовывали из горячего метилбензола с выходом 6 ч. N-[2,3-дигидро-3-[2-окси-2-(2-тиенил)этил] -5-метил-2-тиазо- лиден]-ацетамида; т.пл. 114-115оС (промежуточное вещество 55).
Аналогичным образом получен N-[2,3-дигидро-3-[2-окси-2(2-тиенил)этил]-4-метил-2-тиазолиден] ацетамид; т. пл. 105,5-107оС (промежуточное вещество 59).
Б. Получение целевых соединений.
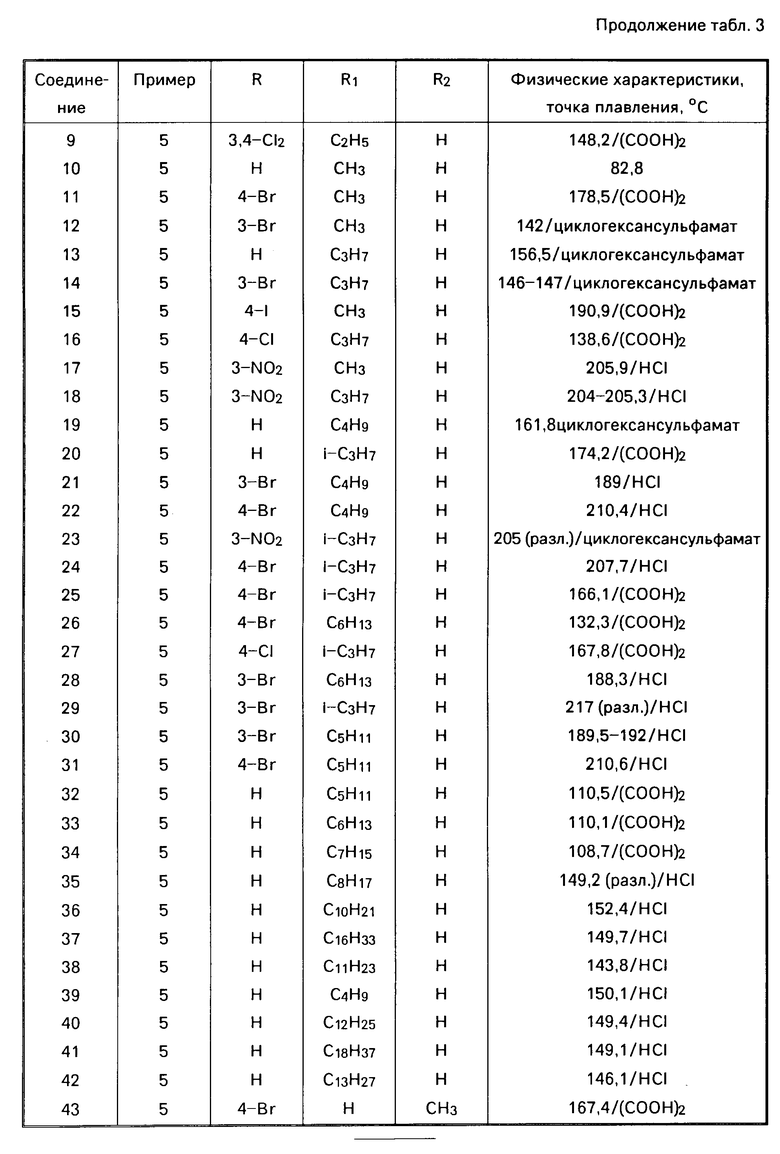
П р и м е р 5. Смесь 4 ч промежуточного вещества 4 и 36 ч. серной кислоты перемешивали в течение 0,5 ч при 0оС и в течение 1,5 ч при комнатной температуре. Реакционную смесь наливали в сосуд с дробленным льдом, куда добавляли NH4OH (водн.). Продукт экстрагировали дихлорметаном и экстракт высушивали, фильтровали и испаряли. Остаток превращали в этандиоат в 2-пропаноле. Продукт отфильтровывали и высушивали с выходом 3 ч. 2-гептил-5,6-дигидро-6-фенилимидазо[2,1-b]тиазол-этан-диоата; т.пл. 108,7оС (соединение 34).
П р и м е р 6. К перемешанному раствору 9,8 ч. промежуточного вещества 6 в 75 ч. трихлорметана по капле добавляли 5 ч. тиенилхлорида. После перемешивания в течение 1 ч при 50оС реакционную смесь испаряли и остаток помещали в водный раствор 100 ч. Na2CO32N. Этот раствор перемешивали в течение 1 ч при 90оС, охлаждали и экстрагировали трихлорметаном. Экстракт высушивали, инфильтровали и испаряли. Остаток кристаллизовали из смеси метилбензола и петролейного эфира с выходом 3,5 ч. 6-(4-бромофенил)-2-этил-5,6-дигидроимидазо-[2,1-b]-тиазола; т.пл. 74,8оС (соединение 2).
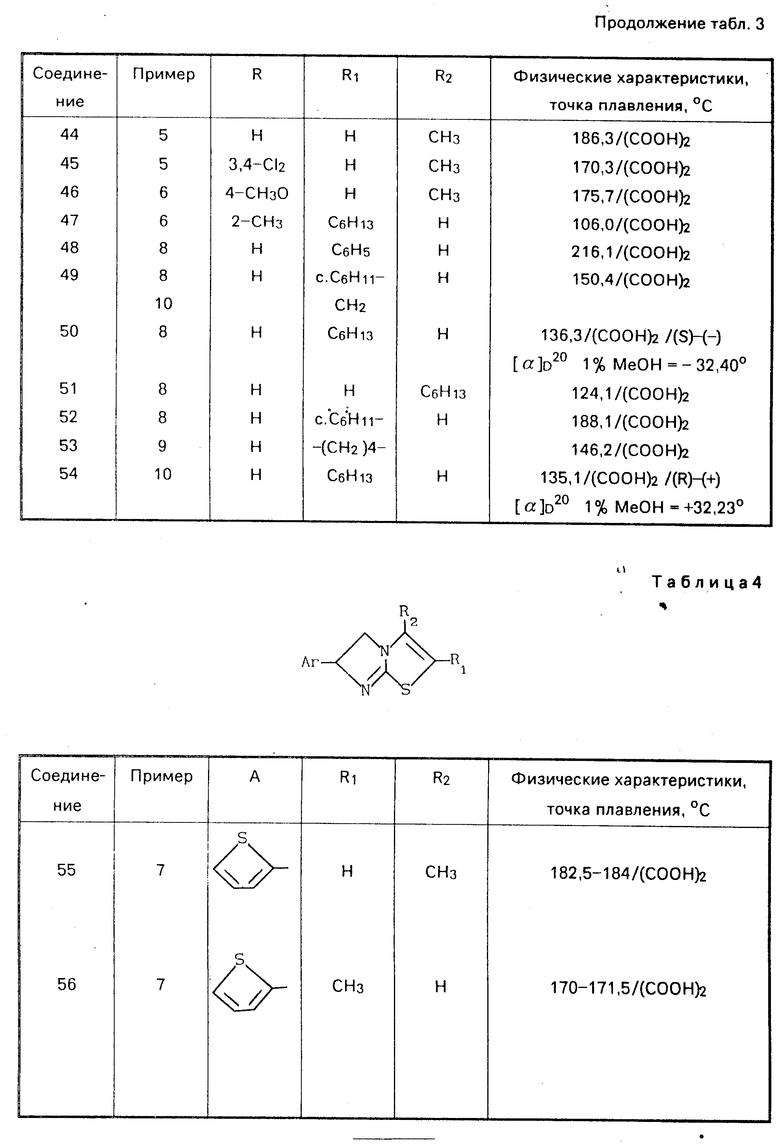
П р и м е р 7. К перемешанным и охлажденным (0оС) 16 ч. тионилхлорида были добавлены небольшими порциями 5,6 ч. промежуточного вещества 58, причем температура поддерживалась ниже 10оС. После перемешивания в течение 2 ч. при комнатной температуре добавляли 50 ч. ацетангидрида при температуре ниже 20оС. Образовавшийся ацетилхлорид отгонялся (136оС) и остаток испаряли. Кубовой остаток растворяли в смеси воды и соляной кислоты. После фильтрования к этому раствору добавляли NH4OH и экстрагировали метилбензолом. Экстракт высушивали, фильтровали и испаряли. Остаток превращали в этандиоад в 2-пропаноле. Соль отфильтровывали, промывали 2-пропаноном и высушивали с выходом 1,5 ч (±)-5,6-дигидро-2-метил-6-(2-тиенил)имидазо-[1,2-b]-тиа- зол-этандиоата; т.пл. 170-171,5оС (соединение 56).
П р и м е р 8. К раствору 5,3 ч (S)-(+)-1-меркапто-4-фенил-2-имидазолина (патент США N 3274209) в 63 ч. уксусной кислоты добавляли 6,2 ч 2-бромооктальдегида. После перемешивания в течение 1,5 ч при температуре флегмы растворителя испаряли. Остаток помещали в воду и добавляли NH4OH. Свободное основание экстрагировали метилбензолом и экстракт высушивали, фильтровали и испаряли. Остаток превращали в этандиоад в 2-пропаноле. Соль отфильтровывали и высушивали с выходом 3,1 ч (27,4%) продукта; т.пл. 132,7оС. Маточный раствор испаряли, и остаток обрабатывали NH4OH. Продукт экстрагировали дихлорметаном, экстракт высушивали, фильтровали и испаряли. Остаток очищали на хроматографической колонке (силикагель; СН2Cl2(CH3OH)NH3 (97,5:2,5). Элюент желаемой фракции испаряли и остаток превращали в этандиоат также, как и раньше, с выходом 1,6 ч. (14,2%) продукта; т.пл. 136,3оС. Общий выход: 4,7 ч. (З41,6% ) (S)-(-)-2-гексил-5,6-дигидро-6-фенилимидазо-[2,1-b] -тиазолэтандиоата (1:1) (соединение 50).
[α]D20 (фракция 2)=-32,40о (конц.1% в СН3ОН).
Соединение 51 получали аналогичным образом, используя метанол вместо уксусной кислоты, и перегоняли в течение 15 ч вместо 1,5 ч.
Соединение 52 приготовляли аналогичным образом, перегоняя в течение 17 ч в метаноле на первом этапе, затем заменив растворитель на уксусную кислоту, перегоняли еще в течение 15 ч.
П р и м е р 9. Смесь 1,78 ч 2-меркапто-4-фенил-2-имидазолина, 44,5 ч, тетрагидрофурана и 0,92 ч. дисперсии гидрида натрия в минеральном масле (50% ) перемешивали в течение 45 мин при комнатной температуре. Затем добавляли 1,5 ч. 2-хлорциклогексанона и продолжали перемешивать в течение 2 ч. Реакционную смесь разбавляли водой, после чего испаряли. Остаток перемешивали в HCl 2 н. в течение 15 мин, после чего добавляли NH4OH. Продукт экстрагировали дихлорметаном, экстракт высушивали, фильтровали и испаряли. Остаток дважды очищали на хроматографической колонке [силикагель; CH2Cl(CH3OH 95:5; CH2Cl2(CH3OH)CH3OH(NH3) 97: 2:1] Элюент желаемой фракции испаряли и остаток превращали в этандиоад в тетрагидрофуране. Соль отфильтровывали и высушивали с выходом 1,6 ч. (46,2%) 2,3,5,6,7,8-гексагидро-2-фенилимидазо [2,1-b]бензотиазолэтанди- оата (1:1); т.пл. 146,2оС (соединение 53).
П р и м е р 10. 3,8 ч. соединения 33 разделяли на R- и S-изомеры путем препаративной хроматографии (Chiracel OD ): гексанол (2-С3Н7OH 90:10). Элюент (R)-(+)-фракции испаряли, и остаток превращали в этандиоат в 2-пропаноле. Продукт отфильтровывали и высушивали с выходом 1,2 ч. (24,0%) (R)-(+)-2-гексил-5,6-дигидро-6-фенилимидазо-[2,1-b] тиазолэтандиоат (1:1); т.пл. 135,1оС; [α] D20= +32,23о (конц. 1% в СН3ОН) (соединение 54). Испарением элюента (S)-(-)-фракции и аналогичной обработкой, как и для (S)-(-)-2-гексил-5,6-дигидро-6-фенилимидазо-[2,1-b] тиазол-этандиоата (1: 1); т. пл. 142,2оС; [α]D20=-32,34о (конц.1% в СН3ОН) (соединение 50).
): гексанол (2-С3Н7OH 90:10). Элюент (R)-(+)-фракции испаряли, и остаток превращали в этандиоат в 2-пропаноле. Продукт отфильтровывали и высушивали с выходом 1,2 ч. (24,0%) (R)-(+)-2-гексил-5,6-дигидро-6-фенилимидазо-[2,1-b] тиазолэтандиоат (1:1); т.пл. 135,1оС; [α] D20= +32,23о (конц. 1% в СН3ОН) (соединение 54). Испарением элюента (S)-(-)-фракции и аналогичной обработкой, как и для (S)-(-)-2-гексил-5,6-дигидро-6-фенилимидазо-[2,1-b] тиазол-этандиоата (1: 1); т. пл. 142,2оС; [α]D20=-32,34о (конц.1% в СН3ОН) (соединение 50).
Аналогичные соединения, указанные в табл.3 и 4, были получены способами, аналогичными способам, указанным в примерах.
В. Фармакологические примеры.
Иммуностимулирующие свойства соединений по изобретению могут быть проиллюстрированы следующими примерами.
П р и м е р 11. Ко-стимулирующий эффект на внедрение 3Н-тимидина в мышиные тимоциты, стимулированные Конканавалином А (описано в Int.I=Immunopharm, 1979, 1, 233-237).
Культуральная среда состоит из EarLe-среды с добавлением 100 ед/мл пенициллина, 100 мг/мл стрептомицина и 2 мМ L-глутамина (GIBCO, Grand Osland, N-Y) вместе с 5% эмбриональной сыворотки (FCS).
Культуральная процедура.
Мышиные тимусы асептически удаляли, с помощью щипцов помещали в культуральную холодную среду и фильтровали через нейлоновую сетку. Обсчет клеток и тест на прорастание проводили с помощью нейбауэровского темоцитомера. Культуры высаживали в тройную емкость размером 16х25 мм из пластиковых трубок. Культуры содержали 106 тимоцитов. КОН А (2 мг) и тестовое соединение в количестве 1,0 мл. Трубки инкубировали в 5% СО2-атмосфере. После инкубации в течение 64 ч при 37оС клетки подвергались импульсам (Were pulsed) путем добавки 1 μCi 3H-тимидина. После этого культуры промывались однократно 2 мл 0,9% -ной NaCl и дважды 1 мл 5%-ной трихлоруксусной кислоты. Полученный осадок растворяли в 0,3 мл 0,5 н. гидроксида Na, переводили в обсчетные емкости и добавляли 10 мл Instagel. Внедрение измеряли с помощью Packard Tri-Carp жидкостного scintillation спектрометра. Ко-стимулирующий эффект испытуемых веществ определяли следующим образом.
Для различных концентраций испытуемого вещества формулы I рассчитывалось отношение между количеством cpm/culture в присутствии конконовалина А (2 мг/мл) и испытуемым соединением, и количество cpm/culture в присутствии конконовалина А (2 мг/мл) отдельно. В табл.5 приведена концентрация (мкм) испытуемого вещества при максимальном ко-стимуляционном эффекте, т.е. максимально рассчитанном отношении, при внедрении 3Н-тимидина.
Г. Типичные формы фармацевтических составов в дозировках, пригодных для систематического применения для теплокровных животных в соответствии с изобретением. Термин "активный ингредиент" (АИ), используемый в данных примерах, относится к соединению формулы I, фармацевтически пригодной его кислой соли или его стереохимических изомеров.
П р и м е р 12. Капли для орального применения.
500 г АИ растворяли в 0,5 л 2-оксипропановой кислоты и 1,5 полиэтиленгликоля при 60-80оС. После охлаждения до 30-40оС добавляли 35 л полиэтиленгликоля, и смесь хорошо перемешивали. Затем добавляли раствор 1750 г сахарина Na в 2,5 л очищенной воды и при перемешивании добавляли 2,5 л кокосовой заправки и полиэтиленгликоль до объема в 50 л, получая раствор капель орального применения, содержащий 10 мг/мл АИ. Полученный раствор переливали в подходящую тару.
П р и м е р 13. Растворы для орального применения.
9 г метил 4-оксибензоата и 1 г пропил-4-оксибензоата растворяли в 4 л кипящей очищенной воды. В 3 л этого раствора растворяли сначала 10 г 2,3-диоксибутандионовой кислоты и потом 20 г АИ. Последний раствор сливали с оставшейся частью предыдущего раствора и 12 л 1,2,3-пропантpиол и добавляли 3 л 70% -ного раствора сорбита. 40 г сахарина Na растворяли в 0,5 л воды и добавляли 2 мл малины и 2 мл эссенции крыжовника. Последний раствор сливали с предыдущим и разбавляли водой до объема в 20 л, получая раствор для орального применения, содержащий 5 мг АИ на 1 чайную ложку (5 мл). Полученный раствор переливали в подходящую тару.
П р и м е р 14. Капсулы.
20 г АИ, 6 г лауринсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидного диоксида кремния и 1,2 г стеарата магния тщательно перемешивали. Полученную смесь пересыпали в 1000 подходящих твердых желатиновых капсул, каждая из которых содержала 20 мг АИ.
П р и м е р 15. Таблетки в оболочке.
Приготовление внутренней части (сердцевины).
Смесь 100 г АИ, 570 г лактозы и 200 г крахмала хорошо перемешивали увлажняли раствором 5г додецилсульфата натрия и 10 г поливинилпирролидона (Kollidon-K90 ) в 200 мл воды. Мокрый порошок просеивали, высушивали и вновь просеивали. Затем добавляли 100 г микрокристаллической целлюлозы (Avicel
) в 200 мл воды. Мокрый порошок просеивали, высушивали и вновь просеивали. Затем добавляли 100 г микрокристаллической целлюлозы (Avicel ) и 15 г гидрогенезированного растительного масла (Sterotex
) и 15 г гидрогенезированного растительного масла (Sterotex ). Все хорошо перемешивали. Отпрессовали в 10 000 таблеток, каждая содержащая 10 мг АИ.
). Все хорошо перемешивали. Отпрессовали в 10 000 таблеток, каждая содержащая 10 мг АИ.
Оболочка.
К раствору 10 г метилцеллюлозы (Methocel 60 HG ) в 75 мл денатурированного этанола добавили 5 г этилцеллюлозы (Ehhocel 22 eps
) в 75 мл денатурированного этанола добавили 5 г этилцеллюлозы (Ehhocel 22 eps ) в 150 мл дихлорметана. Затем добавляли 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. 10 г полиэтиленгликоля расплавляли и растворяли в 75 мл дихлорметана. Последний раствор добавляли к предыдущему, а затем добавляли 2,5 г октадекансата магния, 5 г поливинилпирролидона и 30 мл концентрированной цветной суспензии (Opaspray K-1-2109
) в 150 мл дихлорметана. Затем добавляли 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. 10 г полиэтиленгликоля расплавляли и растворяли в 75 мл дихлорметана. Последний раствор добавляли к предыдущему, а затем добавляли 2,5 г октадекансата магния, 5 г поливинилпирролидона и 30 мл концентрированной цветной суспензии (Opaspray K-1-2109 ) и гомогенизировали. Сердцевина таблетки была покрыта в специальном устройстве полученной смесью.
) и гомогенизировали. Сердцевина таблетки была покрыта в специальном устройстве полученной смесью.
П р и м е р 16. Растворы для инъекций.
1,8 г 4-оксибензоата и 0,2 г пропил-4-оксибензоата растворяли в 0,5 л кипящей воды для инъекций. После охлаждения до ≈50оС при перемешивании добавляли 4 г молочной кислоты, 0,05 г пропиленгликоля и 4 г АИ. Раствор охлаждали до комнатной температуры и разбавляли водой до объема в 1 л, полученный раствор содержал 4 мг ИА/мл. Раствор стерилизовали путем фильтрации (U.S.P. XVII р. 811) и разливали в стерильные ампулы.
П р и м е р 17. Свечи.
3 г АИ растворяли в растворе 3 г 2,3-диоксибутандионовой кислоты в 25 мл полиэтиленгликоля 400. 12 г поверхностно активного вещества (SPAN ) и триглицерид (Witepsol 555
) и триглицерид (Witepsol 555 ) добавляли до 300 г и все расплавляли. Смесь хорошо перемешивали с предыдущим раствором. Полученную таким образом смесь заливали в формы при 37-38оС. Получено 100 свечей, каждая из которых содержала 30 мг АИ.
) добавляли до 300 г и все расплавляли. Смесь хорошо перемешивали с предыдущим раствором. Полученную таким образом смесь заливали в формы при 37-38оС. Получено 100 свечей, каждая из которых содержала 30 мг АИ.

Использование: в медицине, в частности в качестве соединений с иммуностимулирующей активностью для создания лечебных композиций. Сущность изобретения: производные 6-арил-5,6-дигидроимидазо [2.1-b]тиазола ф-лы I, где Ar -фенил, не- или замещенный галогеном, C1-C6 алкокси-, C1-C6 алкил-, нитрогруппой или двумя галогенами, пиридинил, тиенил, фуранил, R1 и R2 независимы C1-C20 алкил, циклогексил)метил; циклогексил или фенил: один из R1 и R2 может быть водородом или вместе образовывать алкилфенильный радикал, или их фармацевтически приемлемые соли или их стереохимические изомерные формы. Производные 2-имино-тиазола ф-лы II в качестве промежуточных продуктов для получения соединений ф-лы I. Получение последних ведут циклизацией соединения ф-лы II в инертном растворителе в присутствии активирующего агента. Иммуностимулирующая композиция содержит в инертном носителе 0,1-500 мг на одну дозу. Структура соединений ф-лы I и II указаны в тексте описания. 4 с. п. ф-лы, 5 табл.
где Ar фенил, необязательно замещенный галогеном, C1 - C6-алкилокси-, C1 C6-алкил-, нитрогруппой или двумя атомами галогена, пиридинил, тиенил или фуранил;
R1 и R2 каждый независимо C1 C20-алкил, (циклогексил)метил, циклогексил или фенил, один из R1 и R2 может быть также водородом или R1 и R2, взятые вместе, образуют C3 C6-алкандиильный радикал,
или их фармацевтически приемлемые соли присоединения кислоты, или их стереохимически изомерные формы, обладающие иммуностимулирующей активностью.
где Ar фенил, необязательно замещенный галогеном, C1 - C6-алкилокси-, C1 C6 алкил-, нитрогруппой или двумя атомами галогена, пиридинил, тиенил или фуранил;
R1 и R2 каждый независимо C1 C20-алкил, (циклогексил)метил, циклогексил или фенил;
R1 и R2 один может быть также водородом или R1 и R2, взятые вместе, образуют C3 C6-алкандиильный радикал,
или их фармацевтически приемлемые соли присоединения кислот, или их стереохимически изомерных форм, отличающийся тем, что производные 2-иминотиазола общей формулы II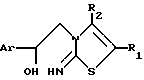
где Ar фенил, необязательно замещенный галогеном, C1 - C6-алкилокси, C1 C6-алкил-, нитрогруппой или двумя атомами галогена, пиридинил, тиенил или фуранил;
R1 и R2 каждый независимо C1 C20-алкил, (циклогексил)метил, циклогексил или фенил;
R1 и R2 один может быть также водородом или R1 и R2, взятые вместе, могут также образовывать C3 -C6-алкандиильный радиал,
или их фармацевтически приемлемые соли присоединения кислоты, или их стереохимически изомерные формы, подвергают циклизации в присутствии активирующего агента, в случае необходимости в реакционно-инертном растворителе и при желании отделяют энантиомерные формы соединения формулы I элюированием раствора рацемической смеси над хиральной неподвижной фазой и при желании превращают соединения формулы I в соль обработкой фармацевтически приемлемой кислотой, или, наоборот, превращают соль в свободное основание обработкой щелочью и/или получают стереохимические изомеры.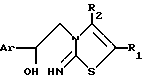
где Ar фенил, необязательно замещенный галогеном, C1 - C6-алкилокси-, C1 C6-алкил-, нитрогруппой или двумя атомами галогена, пиридинил, тиенил или фуранил;
R1 и R2 каждый независимо C1 C20-алкил, (циклогексил)метил, циклогексил или фенил;
R1 и R2 один может быть также водородом или R1 и R2, взятые вместе, могут также образовывать C3 - C6-алкандиильный радикал,
или их фармацевтически приемлемые соли присоединения кислоты, или их стереохимически изомерные формы в качестве промежуточных продуктов для получения производных 6-арил-5,6-дигидроимидазо-[2,1-b]тиазола.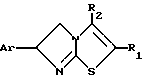
где Ar фенил, необязательно замещенный галогеном, C1 C6 алкилокси-,C1 C6-алкил-, нитрогруппой или двумя атомами галогена, пиридинил, тиенил, или фуранил;
R1 и R2 каждый независимо C1 C20-алкил, (циклогексил)метил, циклогексил или фенил, R1 и R2 один может быть также водородом или R1 и R2, взятые вместе, могут также образовывать C3 C6 алкандиильный радикал,
или их фармацевтически приемлемые соли присоединения кислоты, или их стереохимически изомерные формы в количестве 0,1 500 мг на дозу.
| Машковский М.Д | |||
| Лекарственные средства | |||
| М., 1986, т | |||
| Универсальный двойной гаечный ключ | 1920 |
|
SU169A1 |
Авторы
Даты
1995-12-27—Публикация
1990-11-23—Подача