з) 2-пиримидинил, 1,3-дигидро-2Н- -инден-2-ил; тетрагидро-4Н-пиран-4- -ил; З-оксо-1-циклогексенил; 1,4,5,6- -тетрагидро-2-пиримидинил, или их фармацевтически приемлемых солей или возможной стереохимической изомерной формы, которые обладают анти- аритмическим действием и могут быть использованы в медицине. Цель - создание веществ указанного класса с лучшей активностью. Получение новых соединений I ведут из этилового эфира соответствующей кислоты и амина
1
Изобретение относится к химии гетероциклических coeffKueuHH, в частности к способу получения новых КГ- -арил-рб-аминокарбоксамидов общей формулы I:
У
C-N-Ar
R
де тип -целое число, равное 1,
2 или 3, причем сумма тип равна 4, и один атом водорода в радикале может быть замещен низшей алкил- или низшей ал- коксигруппой;
R, - водород или низший алки.п;
R - водород, низший гшкил, ацетил или бензил;
Кз - водород или низший алкил,
или R и 1 вместе с атомом азота образуют морфолиновое кольцо;
Аг - незамещенный фенил, фенил с одним заместителем, таким как 2-НИ3111ИЙ алкокси или 3-трифторметил; фенил с двумя заместителями, такими как низший алкокси или галоген; фенил с тремя заместителями, такими как низпшй алкил, гидроксил, низший алкокси, галоген, ди(низший алкил)
B,NHAr, где Р, и Аг - указаны вьше, двумя путями: а) в среде 1,1-оксибис- этана или тетрагидрофурана в присутствии литий-бутана в атмосфере азота при охлаждении; б) в среде тетрагидрофурана в присутствии NaOH или LiNH Выделение целевого продукта ведут либо в свободном виде, либо в виде фармацевтически приемпемой соли или стереохимически изомерной форме. , Соединения I.. обеспечивают нормализацию сердечн:ого ритма и снижение количества экстрасистол. 7 табл.
5
0
5
5
аминогруппа, причем один из заместителей обязательно низший алкил;
L - водород, (окси) (фенил) алкил; низший алкил, который может быть замещен фенилом, циклопропилом, циклопентилом, гидроксилом, низшей алкокси- группой, феноксигруппой, фе- нилкарбонилом, пиперидинкар- бонилом, низшим алкоксикар- бонилом, аминокарбонилом, цианогруппой, аминогруппой, ди(низший алкил)аминогруппой, фениламиногруппой, ди- бензиламиногруппой, (2,6-ди- метилфенил)a шнoкapбoнилoм, (2 оксициклогексил)аминокарбонилом, (2-оксициклогексш1) аминогруппой, 1-пиперидини- лом; 2-пропенил, З-фенил-2- -пропенил; циклопентил, который может быть замещен в положении 2-гидроксилом, аминогруппой, ацетиламино- группой, бензиламиногруппой, (гидроксинизший алкил)аминогруппой, (бензил) (гидроксинизший алкил)аминогруппой, (низший алкилоксикарбонил) низшим алкилом; циклогексил, который может быть замещен двумя радикалами, выбранными из групп, включаюших низший ;злкил, (динизший алкил- амино)низший алкил, радикал формулы ОР, где R4 - водо313
род, низший галкил или бензил радикал формулы -OCFj, где
Rj - низший алкил, фенил или (метокси) (фенил) (три- фторметил)метил, радикал формулы NR, где R - низший алкил, радикал формулы Nlffl, где RY - водород, низший алкил, низший алкилсуль- фонил или бензил, радикал формулы - NHCRg, где Rg О
низший алкил, фенил, аминогруппа или низшая алкилокси- группа, ибо L -радикал формулы -CRq .где
О
R 3 - низший алкил, низший апкилокси, бензилокси3,4,5- триметоксифенил или цикло- гексил, ибо L - радикал формулы
OtHu
N 1
Hio
водород, низший алкил или низший алкилоксикарбонил; водород, гидрокси или низшая алкилоксигруппа, радикал формулы
ои
-СН -С-СНг-Вй й
где В - оксиметил, бензилоксиметил, гидрокси, 4-галогенфенокси, аминогруппа, динизший алкил амино, бензиламино или дибензиламиногруппа; Ria - водород или низший алкил; либо L 2-пирИ утдинШ1, 1,3-дигидро- -2Н-инден-2-ил, тетрагидро- -4Н-пиран-4-ил, З-оксо-1- -циклогексенил, 1,4,5,6- -тетрагидро-2-пиримидинил, или их солей с фармацевтически приемлемой кислотой или возможной сте- реохимической изомерной формы, об- ладаюш 1Х антиаритмическим действием, которые могут быть применены в медицине.
33444
Целью изобретения является создание на основе известных методов способа получения новых соединений, обладающих ценными фармакологически- 5 ми свойствами.
Получение промежуточных соединений. 1
Пример 1. Смесь 73,5 ч 2,6-диметил-4-нитробензоламина и 180 ч. муравьиной кислоты перемешивают и нагревают с обратным холодильником в течение 5 ч. После охлаждения смесь перемешивают до достижения комнатной температуры. Смесь выливают в толченый лед. Выпавший в осадок продукт отфильтровывают и кристаллизуют из 2-пропанола. Снова.отфильтровывают и сутчат в вакууме при 80 С. Получают 62,3 ч. (73%) К-(2,6-диметил-4-нит(промежуточное
0
5
0
5
0
рофенил)формамида соединение 1).
Смесь 30 ч. N-(2,6-димeтил-4-нит- рофенил)формамида и 400 ч метанола гидрируют при нормальном давлении и комнатной температуре с применением 2 ч. катализатора - 10%-ного палладия на угле. После поглощения расчетного количества водорода катализатор отфильтровывают и продукт оставляют кристаллизоваться. Выпавший в осадок продукт перемешивают в теплом 2-ме- токси.этаноле. Всю смесь отфильтровывают и фильтрат выпаривают. Остаток кристаллизуют из 400 ч, метанола. Продукт отфильтровывают (фильтрат сохраняют) и сушат. Получают первую фракцию 16,4 г (66%) N-(4-aMHHo-2,6- -диметилфенил)формамида.
Сохраненный фильтрат упаривают. Концентрат оставляют кристаллизовать - ся. Продукт отфильтровывают и сушат. Получают вторую фракцию - 7,2 ч. (29%) К-(4-амино-2,6-диметилфенил) формамида. Т.пл. 233,4 С (промежуточное соединение 2).
Смесь 23 ч. поли(оксиметилен)а, 23 ч. К-(4-амино-2,6-диметилфенил) формамида, 2 ч. 4%-ного раствора тиофена в метаноле и 540 ч. 2-меток0
5
0
5
сиэтанола гидрируют при нормальном давлении и 70 С с применением 3 ч. катализатора - 10%-ного палладия на угле. После поглош;ения расчетного количества водорода добавляют 10 ч. уксусной кислоты и катализатор от- фильтровьгеают. Фильтрат упаривают, остаток растворяют в воде и обрабатывают 50%-ным раствором гидроксида
51
натрия. Выпавший в осадок продукт отфильтровывают и кристаллизуют из метанола. Продукт отфильтровывают и сушат. Получают первую фракцию 16,61, ч. (димeтилaминo)-2,6- -димeтилфeнил формамиДа,
Маточный раствор (метанол-фильтрат) выпаривают и остаток перемешивают в 2,2 -оксибнспропане. Продукт отфильтровьшают и сушат. Получают вторую фракцию - 4,06 ч. (ди- метиламино)-2,6-дикетилфенил форм- амида; т.пл. 216,3 С промежуточное соединение 3).
Смесь 3 ч. (диметиламино)- -2,6-диметилфенил формамида и 50 ч, 1 н.раствора соляной кислоты перемешивают и нагревают с рефлюксом 1 ч. После охлаждения смесь обрабатывают 50%-ным раствором гидроокиси натрия. Продукт дважды экстрагируют дихлор- метаном. Органический слой промывают один раз водой, сушат, фильтруют и упаривают. Остаток растворяют в не- тил бензоле и всю смесь снова упаривают. Получают 2,4 ч. (93%) к , м 3,5-тетраметил-1,4-бензолдиамина в остатке (промежуточное соединение 4)
Пример 2. К перемешиваемой суспензии 100 ч. (4-окси-2,6-диме- тилфенил)-формамида в 1200 ч. 2-про- панона добавляют по частям 124,3 ч, карбоната калия, далее добавляют 75,7 ч. диметилсульфата. После окончания добавления продолжают перемешивание в течение ночи с обратным холодильником. Всю смесь отфильтровывают в горячем состоянии и фильтрат упаривают. Остаток кристаллизуют из ацетонитрила. После охлаждения продукт отфильтровывают и сушат. Получают 62,4 г (58%). 11-(4-метокси-2,6- -диметилфенил)формамида (промежуточное соединение 5).
Смесь 18,5 ч. N-(4-keтoкcи-2,б- -димeтилфeнил )формамида. 55,16 ч. Н,И-диэтш1этанамина и 337 ч дихлор- метана перемешивают и нагревают с обратным холодильником. По каплям в течение двух часов добавляют раствор 21,61 ч. трихлорметилкарбонохло- ридата в 104 ч. дихлорметана. Смесь перемешивают при нагревании с обратным холодильником 30 мин, После охлаждения смесь трижды промьгоают 10%- ным раствором карбоната натрия, сушат, фильтруют и выпаривают Остаток очищают методом колоночной хромато6
графии на силикагеле с применением метилбензола в качестве элюента. Собирают первую фракцию и элюент выпаривают. Остаток кристаллизуют из петролейного эфира. Продукт отфильтро- вьюают и сушат. Получают 8,2 ч. (49%) 2-изоциано-5-метокси-1,3-диметилбен- зола (промежуточное соединение 6). Пример З.К перемешиваемой
и охлаждаемой (О С) смеси 5 ч. 2-ами- ноциклогексанола, 5,3 ч. карбоната натрил, 180 ч, карбоната натрия и 180 ч. карбоната натрия добавляют по каплям 9,7 ч, 2-хлорацетилхлорида
при 0-5 С. Реакционную смесь оставляют медленно охлаждаться до комнатной температуры и добавляют 50 ч. воды. Разделяют слои. Органическую фазу сушат, фильтруют и выпаривают. 0статок очищают фильтрованием и на силикагеле с применением в качестве элюента смеси трихлорметил:метанол (90:10 по объему). Чистые фракции собирают и элюент выпаривают, а остаток кристаллизуют из 2,2 -оксибис- пропана. Продукт отфильтровывают.и сушат. Получают 5ч, (61%) транс-2- -:слор-Н-(2-оксициклогексил )ацетами- да, т.пл. 212,3 С (промежуточное соединение 7). ,
Пример 4. К перемеииваемо- му раствору 9,2 ч, транс-2-(диэтил- aминo)мeтил -циклoгeкcaнoлa в 45 ч.
тетрагидро(1урана добавляют по частям 2,4 ч. 50%-ной дисперсии гидрида натрия. По окончании добавления продол- :;зют перемешивание в течение 1,3 ч с обратным, холодильником. После охлаждения до добавляют по каплям 5.,85 ч. метансульфонилхлорида при температуре.ниже 10 С (экзотермическая реакция). По окончании добавления продолжают перемешивание в течение 2 ч. После охлаждения до 0°С ре- . акцнонную смесь разлагают путем добавления воды по каплям. Продукт экстрагируют 1,1 -оксибисэтаном. Органический слой промывают водой, сушат, фильтруют и выпаривают. Оставшееся масло очищают методом колоночной хроматографии на силикагеле с элюентом - смесью трихлорметана и метанола (90:10 по объему). Чистые фракции собирают, элюент выпаривают. Получают 6,9 ч. (90,4%) транс-2- диэтиламино)метил пиклогексанометан- сульфоната (сложный эфир) в виде
маслянистого остатка (промежуточное соединение 8).
Пример 5, К перемешиваемой смеси 197,3 ч. N-(фенилметил)бензол- метамина и 3 ч. воды добавляют по каплям 92,5 ч. (хлорметил)-оксирана при температуре -5 С (экзотермическая реакция: температура повышается до 3 с). После перемешивания в течение 4 ч при О С смесь оставляют на- греваться до комнатной температуры и перемешивание продолжают в течение 2 сут. при комнатной температуре. Затем добавляют 1440 ч. тетрагидро- фурана, ПО ч. 30%-ного раствора метоксида натрия и все это перемешивают в течение ночи при комнатной температуре. Добавляют 400 ч. .воды и разделяют слои. Органическую фазу промывают водой, сушат, фильтруют и выпаривают. Получают 153,6 ч. (100%) N,К-бис (фенилметил)оксиранметамина в виде маслянистого остатка (промежуточное соединение 9).
Пример 6. К перемешиваемой смеси 25 ч (8-бутенил)оксиметил бензола и 390 ч. дихлорметана добавляют по частям 18,49 ч. бикарбоната натрия. Все это охлаждают до 5 С и добавляют быстро по частям 48,9 ч. 3- хлорбензолкарбоперкислоты. По окончании добавления продолжают перемешивание - сначала в течение 30 мкн на ледяной бане, затем в течение ночи при комнатной температуре. Осадок отфильтровывают и тш:ательно промывают ди- хлорметаном. Фильтрат промывают последовательно пять раз 100 ч. насьщен- ного раствора сульфита натрия, пят.ь раз 100 ч. нacьш eннoгo раствора кар- боната натрия, два раза 200 ч. 2,5%- раствора гидроксида натрия и два раза 200 ч. воды. Органический слой сушат, фильтруют и выпаривают. Остаток очищают методом колоночной хромате- графии на силикагеле с применением элюента - трихлорметана. Чистые фракции собирают, и элюент вьтаривают. Остаток перегоняют с метилбензэлом Получают 24 ч. (80%) 2-(фенилметок- си)этил оксирана в виде остатка (промежуточное соединение 10).
Подобным образом получают метил 2-(фенилметокси)этш1 оксиран в виде остатка (промежуточное соединение И)
Пример 7. Суспендируют 39 ч 39 ч. транс-2-(фенилметил)амино цик- лопентанола в 100 ч. цианометана при
охлаждении на ледяной бане. Затем добавляют последовательно 60,3 ч. трифенилфосфина, 60 ч. цианометана, 31,2 ч. тетрахлорметана и 20,6 ч. N,N-диэтилэтaминa (эндотермическая реакция). Все это перемешивают в течение 8 ч при С. После стояния в течение ночи в со льдом реакционную смесь отфильтровывают и фильтровальную лепешку промывают холодным цианометаном. Фильтрат выпаривают. Добавляют 175 ч, петролейного эфира и все снова выпаривают. Остаток перемешивают в течение 5 мин, фильтруют и фильтрат выпаривают. Остаток дистиллируют. Получают 29,8 ч. (84%) 6-(фенилметил)-6-аза- бииикло 3.1.0 гексана, т.кип. 71- 86 С при давлении 0,5 мм (промежуточное соединение 12).
Пример 8. Смесь 100 ч. 4- -(метиламино)-1-(фенилметил)-4-пи- перидинкарбоксимида и 1000 ч. концентрированного раствора соляной кислоты перемешивают при нагревании с обратным холодильником в течение 24 ч. Реакционную смесь упаривают. Оставшееся масло кристаллизуют из 250 ч. 6 н.раствора соляной кислоты. Твердый продукт перекристалли зуют из 200 ч. 6 н.раствора соляной кислоты. Получают 58 ч. 4-(метиламино)-1-(фе- нилметил)-4-пиперидинкарбоксилата, т.пл. 146-255 С (разл.) (промежуточное соединение 13).
Раствор 101,7 ч. двухлористоводородной 4-(метиламино)-1-(фенилметил -4-пиперидинкарбоновой кислоты в 300 ч. воды подщелачивают гидрокси- дом аммония до тех пор, пока вновь не растворится образовавшийся осадок Раствор нейтрализуют уксусной кислотой. После охлаждения вьтавший в осадок продукт отфильтровьгаают и сушат при . Получают 49,8 ч. 4- -(метиламино)-1-(фенилметил)-4-пиперидинкарбоновой кислоты, т.пл. 272°С (промежуточное соединение 14).
Раствор 4-(метштамино)-1-(фенил- метил)-4-пиперидинкарбоновой кислоты и 22 ч. гидроксида натрия в 700 ч. воды гидрируют при нормальном давлении и 30 С пятью частями катализатора - 10%-ного палладия на угле. После поглощения расчетного количества водорода катализатор отфильтровывают и промывают водой. В фильтрате разделяют слои, водную фазу упа9131
ривают. Получают 89,7 ч. 4- метилами- но -4-пиперидинкарбоксилата натрия в виде остатка (промежуточное соединение 15).
Растворяют 90 ч, 4-(метиламине)- -4-пиперидинкар6оксилата натрия в смеси 1200 ч. воды и 2 ч, гидроксида натрия. Затем добавляют еще 20 ч.
дополнительно подщелачивают гидрокси- дом натрия. Выпавщий в осадок продукт отфильтровывают и кристаллизуют из смеси воды и 50%-ного раствора гидроокиси натрия. Продукт отфильтровывают и повторно кристаллизуют из воды. Получают 101,7 ч.(54,6%)4-(4- морфолинил)-1-(фенилметил)-4-пиперидинкарбоксилата натрия (промежугидроксида натрия. Полученный раствор
разбавляют 108 ч.- тетрагидрофурана и tO точное соединение 18
охлаждают до 5°С..При перемешивании Смесь 4,9 ч. 4-(4-морфолинил)-1добавляют по каплям в течение 1,5 ч раствор 89,7 ч. (фенилметил)карбоно- хлоридата в 162 ч. тетрагидрофурана при температуре ниже 10 С. По окончании добавления продолжают перемешивание в.течение 3,5 ч на ледяной
-(фенилметил)-4-пиперидинкарбоксилата натрия и 100 ч. гексаметилфрсфор- триамида нагревают до 160°С при пе- 5 ремешивании. После охлаждения до комнатной температуры медленно добавляют 1,84 ч. бромэтана. Продолжают перемешивание при комнатной температуре в течение 24 ч. Реакционную 1,Г -оксибисэтаном. Водную фазу ней- 20 смесь выпивают в 400 ч. воды. Выбане при температуре ниже 10 С. Реакционную смесь промывают три раза
трализуют уксусной кислотой . Выпавший в осадок продукт отфильтровывают, промывают водой и сушат. Получают 108 ч. (74%) 4(мeтилa fflнo)-l-(фенилметоксикарбонил )-4 пиперидинкарбоно- вой кислоты. -Т. пл. 250 С (промежуточное соедипение 16).
Газообразную хлорокись углерода пропускают через перемешиваемую суспензию 107 ч, 4-(метиламино)-1-(фе- нилметоксик.арбонил)-4-пиперид,инкар- боновой кислоты в 1500 ч. 1,5-диок сана; сначала в течение 30 мин при комнатной температуре, затем после
нагрева с рефлюксом в течение 1,75 ч 35 -пиперидинона в 1200 ч дихлорметана при температуре обратного холодиль- .добавляют по каплям 360 ч. этилкар- ника. Затем вводят сухой газообразный азот, одновременно давая смеси
бонохлоридата. По окончании добавления все это перемешивают при нагрева нии с рефлюкс(зм в течение 3 ч. Затем
охладиться до комнатной температуры.
бонохлоридата. По окончании добавле ния все это перемешивают при нагрев нии с рефлюкс(зм в течение 3 ч. Зате
Растворитель отгоняют и остаток раст- О добавляют по каплям 353,5 ч. N-диворяют в диметилбензоле. Последачий
снова отгоняют в вакууме на кипящей водяной бане. Получают 116,5 ч, (фенилметил )-1-метил-2,4-диоксо 3-окса -,8-диазаспиро 4,5 дёкан-8 карбок- силата в. виде остатка (промежуточное соединение 17).
Пример 9. Раствор 184 ч. 4-(4-морфолинил)-1-(феннлметил)-4- -пиперидинкарбоксилата в 2880 ч. 12 н.раствора соляной кислоты перемешивают с рефлюксом в течение 5 дней. Реакционную смесь выпаривают. Остаток растворяют в 1000 ч. воды. Раствор сначала подщелачивают гидрокеи- дом натрия до рН 7-8, промывают пос- ледовательно три раза трихпорметаном и один раз 1,1 -оксибисэтаном, затем
О
дополнительно подщелачивают гидрокси- дом натрия. Выпавщий в осадок продукт отфильтровывают и кристаллизуют из смеси воды и 50%-ного раствора гидроокиси натрия. Продукт отфильтровывают и повторно кристаллизуют из воды. Получают 101,7 ч.(54,6%)4-(4- морфолинил)-1-(фенилметил)-4-пиперидинкарбоксилата натрия (промежуСмесь 4,9 ч. 4-(4-морфолинил)-1-(фенилметил)-4-пиперидинкарбоксилата натрия и 100 ч. гексаметилфрсфор- триамида нагревают до 160°С при пе- ремешивании. После охлаждения до компавший в осадок продукт отфильтровывают, тщательно промывают водой и растворяют в трихлорметане. Раствор промывают три.раза водой, сушат, фильтруют и. выпаривают. Остаток затвердевает-при перемешивании в 2,2 - оксибиспропане. Продукт отфильтровывают и сушат. Получают 2,08 ч. . (41 ,7%) этил- 4- (4-морфолинил)-1-(фенилметил )-5-пиперидинкарбоксилата, т.пЛ. 76,4 С промежуточное соединение 19).
Примерю. К перемешиваемой смеси 580 ч. 1-(фенилметил)-3-пиперидинона в 1200 ч дихлорметана добавляют по каплям 360 ч. этилкар-
бонохлоридата. По окончании добавления все это перемешивают при нагревании с рефлюкс(зм в течение 3 ч. Затем
этилэтанамина и продолжают перемещение при температуре флегмы в течение ночи. Реакционную смесь охлаждают и промываю водой. Органический слой отделяют,, сушат, фильтруют и выпаривают. Остаток дистиллируют. Получают фракцию - 27-1 ч. этил-З-оксо-1 пиперидинкарбоксилата, т.кип. i31-140 c при давлении 1 - 1,5 мм (промез;суточное соединение 20).
Пример П. К перемешиваемой смеси 17,1 ч. ЭТИЛ-4-ОКсо-1-пиперидинкарбоксилата и 225 ч. трихлор- метана добавл гют по каплям раствор 16 ч. брома в 75 ч. трихлорметана л. при (-5)-0 С. Трихлорметановую фазу промывают ледяной водой, сушат, филь- труют и выпарьгвают. Получают 25 ч.
этил-3-бром-4-оксо-1-пиперидинкарбок силата в- йиде маслянистого остатка (промежуточное соединение 21).
К перемешиваемой смеси 200 ч. 30% ного раствора метанолата натрия и 640 ч. метанола добавляют 250 ч. этил-З-бром-4-оксо-1-пиперидинкарбок силата при 20 С. Все это перемешивают 3 ч при комнатной температуре. Растворитель отгоняют и маслянистый остаток растворяют в 2,2 -оксибис- пропана. Раствор промывают водой, сушат, фильтруют и вьшаривают. Получают 190 ч. этил-3-окси-4,4-диметок- си-1-пиперидинкарбоксилата в виде маслянистого остатка (промежуточное соединение 22).
К перемешиваемой смеси 35 ч. этил-З-окси-1,4-диметокси-1-пипери- динкарбоксилата и 144 ч. Ш,К-диметил формамида добавляют-по частям 8,2 ч. 50%-ной дисперсии гидрида натрия: экзотермическая реакция (температура повьшхается до 30°С; необходимо охлаждать на водяной бане для поддержания температуры ниже 30 С). Смесь перемешивают 1,50 ч при 30 С и затем охлаждают до комнатной температуры. Добавляют по каплям 24,1 ч. йодметана- (сильно экзотермическая реакция), поддерживая температуру ниже 30°С, По окончании добавления перемеривание продолжают в течение 2 сут. при комнатной температуре. Реакционную смесь выливают в воду, и продукт экстрагируют 4-метил-2- -пентаноном. Экстракт промывают водой, сушат, фильтруют и вьшаривают. Получают 35,9 ч. (95,7%) этил-3,4,4- -триметокси-1 -пиперидинкарбоксилата в виде маслянистого остатка . (промежуточное соединение 23),
Смесь 56,2 ч. этил-3,4,4-триме- токси-1-пиперидинкарбоксилата и 1850 ч. 1%-ного водного раствора серной кислоты перемешивают с обратным холодильником 2,50 ч. Реакционную смесь охлаждают до комнатной температуры и подщелачивают карбона- том натрия. Продукт экстрагируют ди- хлорметаном. Экстракт промывают на- сьш1енньш раствором хлорида натрия, сушат, фильтруют и выпаривают. Получают 41,2 ч. (90,4%) этш1-3-метокси- -4-оксо-1-пиперидинкарбсксилата в виде маслянистого остатка (промежуточ- ное соединение 24).
5
5 0 -5
0 5
5 О
Пример 12. .Смесь 321,5 ч. 4-(этиламино) -1-(фенилметил)4-пипери- динкарбоксимида и 3600 ч. 12 н.раствора соляной кислоты перемешивают с обратным холодильником 48 ч. Реакционную смесь концентрируют до объема -1000 ч. Выпавший в осадок продукт отфильтровывают (фильтрат сохраняют), промывают 100 ч. вода и 240 ч. этанола, сушат и получают первую фракцию - 283 ч. (65,2%) моногидрата двухлорис- товодородной 4-(этиламино)-1-(фенил- метил )-4-пиперидинкарбоновой кислоты, т.пл. 260-262,.
Сохраненньш фильтрат концентрируют до объема 300 ч. Выпавший в осадок продукт отфильтровывают и кристаллизуют из 300 ч. воды. После охлаждения до О С и внесения затравки продукт отфильтровывают, промьгеают этанолом н сушат. Получают вторую фракцию - 51 ч. (11,75%) моногидрата двухлористоводородной 4-(этилами- но)-1-(фенилметил)-4-пиперидинкарбоновой кислоты (промежуточное соединение 25).
Смесь 330 ч. моногидрата двухлористоводородной 4-(этиламино)-1-(фенилметил) -4-пиперидинкарбоновой кислоты и 1800 ч. воды градрируют при. нормальном давлении и комнатной температуре 5 ч. катализатора - 10%-но- го палладия на угле. После поглощения расчетного количества водорода катализатор отфильтровывают и фильтрат выпаривают, Получают 245,8 ч. моногидрата двухлористоводородной 4- -(этиламино)-4-пиперидинкарбонов ой кислоты в виде остатка (промежуточное соединение 26).
К перемешиваемой смеси 245,8 ч. моногидрата двухлористоводородной 4-(этиламино)-4-пиперидинкарбоновой кислоты в 1800 ч. воды добавляют 149,5 ч. гидроокиси натрия с последующим добавлением 1080 ч. тетрагид- рофурана. После охлаждения до 5 С добавляют по каплям в течение 2 ч 187,5 ч. (фенилметил)-карбонохлори- дата. По окончании добавления продолжают перемешивание в течение 4 ч при 5 С. Реакционную смесь промывают два раза 350 ч. 1,1 -оксибиспро- пана. Водную фазу нейтрализуют уксусной кислотой. Выпавший в осадок продукт отфильтровьшают и кипятят в 2000 ч. воды. После охлаждения до температуры С продукт отфильтро13
Бывают, промывают этанолом и сушат. Получают 223 ч. (78%) 4-(этиламино)- -1-(фенилметокси)карбонил 4-пипе- ридинкарбоновой кислоты (промежуточное соединение 27).
Перемешиваемую суспензию 153,2 ч„ 4-( этиламино) (фенилметокси)карбо-- нилП-А-пиперидинкарбоновой кислоты в 1900 ч. 1,4-диоксана нагревают с флегмой, осторожно вводя при этом газообразную хлорокись углерода. В течение 2 ч газообразная хлорокись углерода слабо барботирует через суспензию, нагреваемую с рефлюксом. Реакционную смесь оставляют охлаждаться при перемешивании и пропускании сухого азота в течение 2 ч. Растворитель выпаривают и остаток снова отгоняют с бензолом. Твердый остаток кристаллизуют из 4-метил-2-пентанона Продукт отфильтровывают, сушат и получают 112 ч. (67,5%)(фенкпметил) 1- -этил-2,4-диоксо-3-окса-1,8-диазаспи- ро 4,5 декан-8-карбоксилата, т.ил, 127,5°С (промежуточное соединение 28
Приме.р 13, К перемешив 1е мой при флегме смеси 403 ч. зтил-3- /фенилметил|-амино бутаноата и 160 ч. зтанола добавляют по каплям 100 ч, этил-2-пропеноата. После перемешивания в течение ночи при температуре флегмы добавляют по каплям вторую порцию - 100 ч. этилпропеноа- та. По окончании добавления продолжают перемешивание при температуре флегмы в течение 48 ч. Реакционнзто смесь, выпаривают и получают смесь этил-N- 2-( этоксикарбонил) -1 этил -И-(фенилэтил)-р-аланина и этил- -N- 2- (этоксикарбонил) этил -N,( фе;- нилметил)-В-аланина в виде маслянистого остатка. Последний перемешивают при комнатной температуре с 17ч, карбоната натрия в 900 ч. трихлорме- тана.-Затем добавляют-по каплям 217 -ч. этилкарбонохлоридата. По окончании добавления продолжают перемешивание в течение ночи. Смесь промывают водой, сушат, фильтруют и выпаривают. Остаток экстрагируют разбавленным раствором соляной кислоты,, Кислую водную фазу промывалот 2,2 -ок- сибиспропаном; Свободное основание вьоделяют при помощи гидроксида ния и экстрагируют 2,2 -оксибиспропа- ном. Экстракт промывают водой, сушат фильтруют и вьтаривают, Получают -264,5 ч. этил-N- 2-(этоксикарбонил)
13344 14
-1-метилэтил -N-(фенилметил)- -алани- на в виде остатка (промежуточное соединение 29).
Смесь 192,8 ч. этил-М- 2-(этокси- 5 карбонил )-1-метилэтил -W-(фенилметил -р-аланина и,280 ч. абсолютного зтанола перемешивают в аппарате для гидрирования. Затем добавляют 45 ч,, раст вора соляной кислоты. После охлаждеfO ния добавляют 10 ч. катализатора - 5%-ного палладия на угле и смесь встряхивают при комнатной температуре до поглощения 1 эквивалента водорода. Катализатор отфильтровывают и
t5 фильтрат выпаривают. Получают 150 ч. солянокислого этил-К 2-(этоксикарбонил )-1-метилэтил - 3-аланина в виде маслянистого остатка (промежуточное соединение 30) .
20 К перемешиваемой смеси 105 ч.
этил-К- 2-(этоксикарбонил)-1-метил- зт1-ш)-р-аланина, 63,8 ч. И,И-диэтил- этанамина и 1200 ч. трихлорметана добавляют по каплям при комнатной пературе 61,4 ч. этилкарбонохлоридата. Перемешивание при комнатной температуре продолжают в течение ночи. Реакционную смесь выпаривают. К остатку добавляют воду и продукт экст30 рагируют 2,2 -оксибиспропаном. Экстракт высушивают, фильтруют и выпаривают. Получают 114 ч. этил-3-(этоксикарбонил) .2-( этоксикарбонил) амино бутаноата. в виде остатка (про35 межуточное соединение 31).
К перемешиваемому раствору зток- сида натрия, приготовленному заранее из 9,5 ч. натрия и 80 ч. этанола, до бавляют 225 ч:, диметилбензола. Эта40 НОЛ отгоняют. К остатку добавляют по каплям смесь 97 ч. этил-3-((этоксикарбонил) 2-(этоксикарбонил)этил амино( бутаноата и 45 ч. диметилбензола при нагревании до 110-120 С и
продолжающейся отгонке этанола. По окончании добавления продолжают пере- меишвание при 110-120°С в течение 1 ч. Реакционную смесь охлаждают и добавляют к ней 50 ч. уксусной кис50 лоты и 50 ч., воды. После кратковременного перемешивания слои разделяют. Органическую фазу сушат, фильтруют и выпаривают. Получают 54 ч. диэтил- 2-метил-4-оксо-1 ,3-пиперидинкарбок.55 силата в виде, остатка (промежуточное соединение 32).
Перемешивание 54 ч. диэтш1-2-ме- ТИЛ-4-ОКСО-1,3-пиперидинкарбоксилата
1513
и раствор 42 ч. этандикарбоновой кислоты в 300 ч. воды и нагревают с рефлюксом в течение 40 ч. Реакционную смесь охлаждают. Продукт экстрагируют трихлорметаном. Экстракт сушат, фильтруют и выпаривают. Получают 28 ч. этил-2-метил-4-оксо-1-пипе- ридинкарбоксилата в виде остатка (промежуточное соединение 33).
П р и м е. р 14. Смесь 111,5 ч. этил-4-амино-1-(фенилметил)-4-пипе- ридинкарбоксилата, 50 ч. поли(окси- метилен) а, 3 ч. 4%-ного раствора ти- офена в метаноле и 480 ч. этанола гидрируют при нормальном давлении и температуре 50 С 5 ч. катализатора - 10%-ного палладия на угле. После поглощения расчетного количества водорода катализатор отфильтровывают и фильтрат выпаривают. Остаток растворяют в дихлорметане. Раствор промывают разбавленным раствором гидр- оксида натрия и один раз водой, сушат, фильтруют и выпаривают. Получаю 117, 9 ч. (96%) этил-4-(диметилами- но)-1-(фенилметил)-4-пиперидинкарбок силата в виде остатка (промежуточное соединение 34).
Смесь 40 ч. этил-4-(диметиламино) -1-(фенилметил)-4-пиперидинкарбокси- лата и 400 ч. этанола гидрируют при нормальном давлении и температуре 50 С 4 ч. катализатора - 10%-ного палладия на угле. После.поглощения расчетного количества.водорода катализатор отфильтровывают и фильтрат выпаривают. Остаток растворяют в ме- тилбензоле и продолжают выпаривание Получают 21,2 ч, (76,8%) этил-4-(ди- метиламино)-4-пиперидинкарбоксилата в виде остатка (промежуточное соединение 35).
Пример 15. Смесь 19 ч. 7- -оксабицикло 4,1 .0 гептана, 21,2 ч. этил-4-(диметиламино)-4-пиперидин- карбоксилата, 500 ч. воды и 400 ч. этанола перемешивают при нагревании с рефлюксом в течение 10 ч. Реакционную смесь концентрируют до объема ч. и продукт экстрагируют ди- хлорметанрм. Экстракт промывают водой, сушат, фильтруют и выпаривают Остаток превращают в хлористоводородную соль в 525 ч, 1,l -оксибисэтана и 2-пропанола. Растворитель декантируют и остаток перемешивают в 1,1 - -оксибисэтане. Последний снова декантируют, и остаток кристаллизуют из
34416
240 ч. ацетонитрила. Продукт отфильтровывают, сушат и получают 40,0 ч. двухлористоводородного этил-транс-4- -(диметиламино)-1-(2-оксициклогексил
-4-пиперидинкарбоксилата, т.пл.
173,4°С (промежуточное соединение 36),
К перемешиваемой смеси 25,06 ч. этил-транс-4-(диметиламино)-1 -(2-ок- сициклогексил)-4-пиперидинкарбоксилата и 270 ч. тетрагидрофурана добавляют по частям 4,32 ч. 50%-ной дисперсии гидрида натрия (слабо экзотермическая реакция). Смесь нагревают до 50 С и снова охлаждают до комнатной
температуры. Затем добавляют по каплям .11,92 ч. йодметана. По окончании добавления все это нагревают с рефлюксом и продолжают перемешивание в течение 2 ч при температуре флегмы. Добавляют еще 0,8 ч. 50%-ной дисперсии гидрида натрия по частям и все нагревают до 50 С. После охлаждения до комнатной температуры добавляют
2,28 ч. йодметана и продолжают перемешивание в течение 2 ч при темпера- . туре флегмы. Реакционную смесь охлаждают и добавляют 200 ч. раствора хлорида натрия. Слои разделяют, и водную фазу экстрагир5тот метилбензо- лом. Соединенные органические слои сушат, фильтруют и выпаривают. Остаток очищают методом колончатой хроматографии на силикагеле с применением в качестве элюента смеси трихлормета- на и насыщенного аммиаком метанола (95:5 по объему).
Первую фракцию собирают, и элюент выпаривают. Остаток снова очищают методом колоночной хроматографии на силикагеле с применением в качестве элюента смеси трихлорметана и насыщенного аммиаком метанола (95:5 по объему). Чистые фракции собирают и элюент отгоняют. Получают первую фра;кцию - 6,26 ч. этил-транс-4-(диметиламино )-1-(2-метоксициклогексил)- -4-пиперидинкарбоксилата.
Собирают вторую фракцию и выпаривают элюент. Получают вторую фракцию - 8,7 ч. этил-транс-4-(диметиламино )-1-(2-метоксициклогексил)-4-пиперидинкарбоксилата (промежуточное соединение 37).
Пример 16. 45,5ч. 1,1 -оксибисэтана охлаждают в бане 2-пропа- HoH/COj при температуре - 50 С в атмосфере азота. Затем туда добавляют 25 ч 1-литийбутана при температуре
0
5
0
5
1713
минус (40-50)°С. Добавляют по каплям раствор 6,57 ч, 4-бутокси-2,6-диме- тилбензоламина в 14 ч, 1 ,1 -о.ксибис- этана в течение 30 мин при темпера-туре приблизительно -45 С, По окончании Добавления продолжают переме- пгивание в течение 15 мин при-,40°С, Добавляют по каплям раствор 8,95 ч, этил-4-(диметиламино)-1-(фенилметил) -4-пиперидинкарбоксилата в 14 ч. 1,l -оксибисэтана в течение 45 млн. Смеси дают медленно нагреться до комнатной температуры и перемешивают в течение ночи при этой те мпературе, 1,1-Оксибисэтан отгоняют при одновременном добавлении 90 ч. тетрагидрофу рана. Смесь перемешивают при нагревании с обратным холодильником в течение 20 ч. После охлаждения добавляют 8 ч. 2-пропанола и воду. Слои разделяют. Водную фазу экстрагируют дихлорметаном. Соединенные органические слои сушат, фильтруют и выпаривают. Остаток очищают методом колоночной хроматографии на силикагеле с применением в качестве элюента смеси трихлорметана и насьпденного атФшаком метанола (95:5 по объему). Первую фракцию собирают и э-тшент отгоняют. Остаток кристаллизуют из 2,2 -окси- биспропана. Продукт отфильтровывают и сушат. Получают 4,03 ч, (30%) N- -(4-бутокси-2,6-диметилфенил)-4-(диметил амино )-1-(фенилметил)-4-пипери- динкарбоксамида, т.пл. 195 С (соединение 13). Выход 30%.
Аналогичным способом получают также следуюш 1е соединения:
4-(диметиламино)(диметил- амино)-2,6-диметилфенил -1 -(фенилметил )-4-пиперидинкарбоксам:ид, т. пл, 196,8°С (соединение 15), выход 33%;
транс-4-(диметиламино)-N-(2,6- -диметилфенил)-1-(2-метоксицикло- гексил)-4-пиперидинкарбоксамид5 т.пл 131 , 5°С (соединение 18), выход 26,4%
(фенилметил) -4- ( 2,5-диметш1фе- нил) аминок арбонил -4- (метил амн-но) -пиперидинкарбоксилат, т.пл. 157,5 С (соединение 19), выход 22%;
(фенилметил )-4-|( 5-хлор 2-метилфе НИЛ) амино карбонил -4- (э тиламино) -1 - -пиперидйнкарбокснлат, т.пл, 124,1 С (соединение 21), вых:од 39,2%;
4-(адетилэтиламино)-Н-(2,6-диметилфенил )- 1 - (1 -ме.тилэтил) -4-пипери- динкарбоксамид, т.пхс. 196,4 С (соеди некие 2), выход 18%.
334418
Пример 17.К перемешиваемому раствору 1,4 ч. К-(2,6-диметилфенил )-4-(метиламино)-1-( 1-метилэтил)- 4-пиперидинкарбоксамида в 60 ч. 2- 5 пропанола добавляют несколько капель 2-пропанона, насьш1енного хлористым водородом. Выпавший в осадок продукт отфильтровывают и перемешивают в течение 2, ч в 2-пропаноне и небольшом 10 количестве воды. Затем снова отфильтровывают и суигат на воздухе. Получают 1,40 ч. дигидрата двухлористоводо- родного ( 2,6-диметилфенил)-4-(ме- тиламино)(1-метилэтил)-4-пипери- 5 динкарбоксамида, т.пл. 219, (соединение 232).
Пример 18. Смесь 6 ч. транс- 4-(диметиламино)N-(2,6-диметилфенил)- -( .-оксициклогексил)-4-пипе- 20 ридинкарбоксамида, 1,2 ч. (-) (R, R)j-2,3-диоксибутандикйрбоно- вой кислоты, 120 ч. ацетонитрила и 120 ч. 2-пропанола перемешивают при рефгаоксе мин. Прозрачный раствор оставляют кристаллизоваться. Продукт .отфильтровывают и перекристаллизовы- вают из 200 ч. смеси ацетонитрила и 2 -пропанола (50:50 по объему). Продукт отфильтровывают и снова перекри- 30 сталлизовывают из 144 ч. смеси ацето- нитрила и 2-пропанола. Получают 2,58 ч, (69%) (-)-транс-4-(диметил- aivMHo)-TJ- ( 2,6-диметилфенил) -1 - (2-ок- сициклогексил)-4-пиперидинкарбокс- 35 амида и (-) - S- (R , Р.) -2,3-диокси- . бутандиоатз (2:1 ) , -7,1251 (с 1% в метаноле) (соединение 233),
Раствор 2,58 ч. (.-) транс-4-(диметил амино )-N-( 2,6-диметилфенил)(2- -оксициклогексил)-4-пиперидинкарбокс- амида и (-)(R«, R)-2,3-диокси- бутандиоата (2:1) в 100 ч. воды обрабатывают карбонатом натрия. Продукт экстрагируют двр раза дихлорметаном. Соединенные органические слои промы- вают 50 ч. воды, сушат, фильтруют и выпаривают. Остаток кристаллизуют из 2-пропанола, Получают (диметиламино) -N(2,б-диметилфенил)-1 -(2-оксидикло- 5Р гексил)-4-пиперидинкарбоксамнд, т.пл. 167, Mgg +2,37(с 1% в метанолеО (соединение 234).
Пример 19. Смесь 10 ч. транс-4-(динетиламино)-N-(2,6-диме- т:илфенил)-1 - (2-оксидиклогексил) -4- -пиперидинкарбоксамида, 2,05 ч. ( + )- - R- (R, R) -2,3-диоксибутандикар- боновой кислоты и 240 ч. смеси 2-пропанола и ацетонитрила (50:50 по объему) перемешивают при рефлюксе в течение 15 мин. Прозрачный раствор оставляют кристаллизоваться. Продукт отфильтровывают и перехристаллизовы- вают пять раз соответственно из 360, 360, 304, 288 и 240 ч. смеси ацетонитрила и 2-пропанола (50:50 по объему). Получают 3,49 ч.(+)-транс-4- -(диметйламино)-N-(2,6-диметилфенил)-1-(2-оксициклогексил)-4-пиперидин- карбоксамида.и (+)(Е, R)-2,3- -диоксибутандиоата ( 2:1 ); об g +7,8156 (с 1% в метаноле) (соединение 235).
Раствор 3,49 ч. (+)-транс-4-(диметйламино )-N-( 2,6-диметилфенил)-1-( 2-. -оксициклогексил)-4-пиперидинкарбок- самид и (+)-Гк-(Е, Д)-2,3-диокси- бутандиоата 2:1} в 150 ч. воды обрабатывают карбонатом натрия. Продукт дважды экстрагируют дихлорметаном. Соединенные экстракты промывают 80 ч. воды, сушат, фильтруют и выпаривают. Остаток кристаллизуют из 2- пропанола. Продукт отфильтровывают и сушат. Получают 2-,09 ч. (71%) (-)- -транс-4-(диметйламино)-N-(2,6-диметилфенил )- 1 -(2-оксициклогексил)-4- -пиперидинкарбоксамида, т.пл. 167,2 С (соединение 236).
Пример 20. К перемешиваемой смеси 12,5 ч. (фенилметил) этил -4-этиламино-1,4-пиперидинкарбокси- лата, 6,1 ч. (2,6-диметил)-бензол- амина и 90 ч. тетрагидрофурана частями добавляют 2,4 ч. 50%-ной дисперсии гидрида натрия (вспенивание). После завершения этой операции пере- мешивание продолжают в течение 1 ч при комнатной температуре и еще 4 ч с обратным холодильником. Реакционную смесь охлаждают, по каплям добавляют 16 ч 2-пропанола, после чего добавляют 50 ч. воды. Слои разделяют и водную фазу экстрагируют дихлорметаном. Объединенные органические фазы сушат, фильтруют и выпаривают. Остаток очищают методом хроматогра- фии на колонке с силикагелем с использованием в качестве элюента смеси трихлорметана и метанола (95:3 по объему). Чистые фракции собирают, и элюент выпаривают. Остаток пере- носят в метилбензол и последнее вещество выпаривают снова с образованием 7,4 ч. (фенилметил)-4-(2,6-ди- метилфенил)амино карбонил-4-(этиламино)-пиперидинкарбоксилата, т.пл.
149, (соединение 39). Выход 46%.
В некоторых соединениях стереохи- мическая структура не определяется экспериментально. В этих случдях обычно принято определять стереохимичес- кие изомерные формы таким образом: выделяемая первой - форма А, выделяемая второй - форма В. При этом не дается никаких ссылок на действительную стереохимическую конфигурацию .
Следуя аналогичной методике и используя эквивалентные количества соответствзтощих исходных материалов, получают следующие вещества:
N-(4-бутокси-2,6-диметилфенил)-4- (диметиламино)-4-пиперидинкарбоксамид т.пл. 190 С (соединение 22), выход 3%
-4(диметйламино)(диметйламино) -2, 6-диметилфенил -4-пиперидинкар- боксамид полугидрат, т.пл. 167,9 С (соединение 24), выход 2%;
N-(2,6-диметилфенил)-4- (фенилметил) амино -4-пиперидинкарбоксамид, т.пл. 133°С (соединение 27), выход 5%
N-(2,6-диметилфенил)-4-(этиламино) -4-пиперидинкарбоксамид т.пл. 140 С (соединение 28), выход 7%;
К-(4-метокси-2-метилфенил) -4-(метил амино)-4-пиперидинкарбоксамид. т.пл. .86°С (соединение 32), выход 2%;
(А)-(фенилметил)-4-(2,6-диметилфенил )аминокарбонил -3-метил-4-(ме- тиламино)-1-пиперидинкарбоксилат, т.пл. 149 С (соединение 40), выход 53,7%;
(фенилметил)-4- (2,6-диметш1фенил) аминокарбонил -3-метокси-4-(метилами- но)-1-пиперидинкарбоксилат, т.пл. 149,5°С (соединение 41), выход 72%;
(фенилметил)-4-(2-хлор-6-метил- фенил)аминок арбонил -4-(метиламино)- -1-пиперидинкарбоксилат, т.пл. 141, (соединение 42), выход 62%;
(фенилметил)-4-(4-метокси-2-ме- тилфенил) аминокарбонил -4- (метилами- но)-1-пиперидинкарбоксилат, т.пл. 110°С (соединение 44), выход 66%;
(фенилметил)-4- (2-метоксифенил) аминокарбонил -4-(метиламино)- -пиперидинкарбоксилат, т.пл. 81 С (соединение 45), выход 71%;
(фенилметил)-4-L(5-хлор-2-метш1- фенил)аминокарбонил -4-(метиламино)- -1-пиперид11Нкарбоксилат, т.пл. 98 С (соединение 46);
211
(фенилметил)-4-(4-метоксн-2,6- -диметйлфенил)аминокарбокил -4-(ме- тиламино)- -пиперидинкарбоксилат,, т.пл. 135°С (соединение 48), выход 65%;
4-(диметиламино)-К-(2,6-диметил- фенил)-3-метокси 4-пипвридинкарбокс- амид, т.пл. 166,2°С (соединение 68), выход 2,5%;
4-(диме тиламино)-N-4-пиперидинкар боксамид, т. гш. 121°С (соединение 70), выход 3%;
4-(диметиламино)-N-(2,6-диметил- фенил)-4-пиперидинкарбокеамид, т.пл, 194,5°С (соединение 71), выход 4%;
В-(2,6 диметилфенил)-4-(метилаш5- но)-4-пиперидинкарбоксамид, т,пл, 150 С (соединение 72), выход 3%;
N-(2,6-диметилфенил)-4™(этилметил амино)-4-пиперидинкарбоксамид, т.пл, 176,0°С (соединение 73), выход 5%;
4-(диэтиламино)-N-(2,6-диметилфе- нил)-4-пиперидинкарбоксамид, т.пл. 195,5°С (соединение 74), выход 2%;
(А)-4-(диметиламрп о)-W-( 2,6-диме- тш1фенил)-3-метил-4-пиперидинкарбок- самид (соединение 76), выход 8%;
4-(диметиламино)N-(2,6-диметил- фенил)-2-метил-4-пиперидинкарбокс- амид, т.пл. 121°С (соединение 77), выход 4,5%;
4(диметиламино)-И-(2,4,6-триме- тилфенил)-4 -пиперидинкарбоксамид, т.пл. 154, (соединение 80), выход 4%.
Пример 21. К 108 ч. тетра- гидрофурана добавляют 31,9 ч. 1-ли- тий бутаНа при О С и в атмосфере азота. При 0-5 С в течение 30 мин по каплям добавляют раствор 11,3 ч., N ,N ,3,5-тетраметил-1,4-бензолдиами на в 36 ч. тетрагидрофурана (ТГФ). После завершения добавления перемешивание продолжают в течение 15 мин при комнатной температуре. При ком- натн ой температуре в течение 15 мин по каплям добавляют раствор 18,02 ч. этил 4- (диме тиламино) -1 - (фенилме тил) -4-пиперидинкарбоксилата в 36 ч. Д, После завершения добавления перемешивание продолжают в течение ночи с в системе, снабженной обратным холодильником. Реакционную смесь охлаждают, добавляют воду и разделяют слои. Воднзпо фазу экстрагируют ди- хлорметаном. Объединенные органические слои сушат, фильтруют и выпаривают. Остаток перемешивают в 2.2 422
орссибиспропане, Продукт отфильтровывают и перекристаллизовывают из аце- тонитрила. Продукт реакции отфильтровывают (фильтрат отбрасывают) и су- шат с образованием первой фракции - 7,10 ч, 4-(диметиламино)(диметил амино) -2 5 б-диметилфенил -1-( фенилме тил)-4 -пиперидинкарбоксамида. Фильтрат, который отбросили, выпариваюто Остаток очищают хроматогра- фически на колонке с силикагелем, используя в качестве элюента смесь три- хлорметана и метанола, насыщенную аммиаком (96:4 по объему). Отбирают
первую фракцию и элюент выпаривают. Остаток перекристаллизовывают из аце- тонитрила. Продукт отфильтровывают и сутаат с образованием второй фракции- 1 ч. 4-(диме тил амино)-W-(4-диме тиламино-2,6-диметилфенил)-1-(фенилметил )-4-пиперидинкарбоксамида. Общий выход: 8,10 ч. (33%) 4-(диметиламино W-(4-диметиламино-2,6-диметилфенил) -1-(фенилметил)-4-пиперидинкарбокс- аг Шда, т.пл. 196,8 С (соединение 15), выход 33%.
Следуя аналогичной методике и ис- пользуя эквивалентные количества соответствующих исходных веществ, получают следующие соединения:
(фенилме тил)-4-(2,6-диме тилфенил) аминокарбонил 4-(этилметиламино)-1- -пиперидинкарбоксилат, т.пл. 211,7 С (соединение 51), выход 69%;
4-(диэтиламино.) -N-( 2,6-диметилфенил )(-метилэтил)-47пиперидинкар- боксамид, т„пл,177,5 С(соединение 53) , выход 18,7%;
1-циклопентил-4-(диэтиламино)-N(:;; J 6-диметилфенил) -4-пиперидинкарбок- боксамид, т.пл. 177, (соедине- , ние 53), выход 18,7%;
(фенилметил)-4-(диэтиламино)-4- (2,6-диме тилфенил )аминокарбонил./-1-пиперидинкарбоксилат, т.пл. 219 С (соединение 55), выход 35%;
(фенилметил)-4-(5-хлор-2-метилфенил )аминокарбонил1 -4- (диэтиламино) -1-пиперидинкарбоксилат, т.пл.
137,2°С (соединение 56), выход 8%;
(фенилмет:ил )-4-(диметиламино )-4- - (2,6-диметилфенил)аминокарбонилЗ - -3-метокси-1-пиперидинкарбоксилат, т.пл. 182 С (соединение 57), выход 44%:
(фенилметил)-4-(2-хлор-6-метил- Фенш1)аминокарбонил -4-(диметиламино)
10
15
-1-11Иперидинкзр6оксилат, т.пл. 228,5°С (соединение 58), выход 49%;
(фенилметил)-4-(диметиламино)-4- . -(2,6-диме тилфенил)аминокарбонил -1 - -пиперидинкарбоксилат, т.пл. 232,5 С 5 (соединение 61) выход 37,2%;
(фенилметил)-4-(диметиламино)-4- -(4-метокси-2-метилфенил)аминокарбо- нил - -пиперидинкарбоксилат, т.пл. 141°С (соединение 63), выход 52%;
(фенилметил)-4-(диме тиламино)-4- -(2-метоксифенил)аминокарбонил -1- -пиперидинкарбоксилат, т.пл. 146 С (соединение 64), выход 50,4%;
(фенилметил)-4-(диметиламино)-4- - (4-метокси-2,6-диметилфенил)-амино- карбонил -1-пиперидинкарбоксилат, т.пл. 208 С (соединение 67), выход 48%;
N-(2-хлор-6-метилфенил)-4-(диметиламино )-4-пиперидинкарбоксамид, т.пл. 173, (соединение 83)выход 5,5%;
N-(5-хлор-2-метилфенил)-4-(диэтил- амино)-4-пиперидинкарбоксамид, т.пл. 101 с (соединение 84), выход 4%;
цис-4-(диметиламино)-N-(2,6-диме- тилфенил)-3 -метокси- (1,4 -бипипери- дин)-4-карбоксамид. т.пл. 111,5 С (соединение 85), выход 3%;
4-(диметиламино)-N-(2,6-диметил- фенил)-(1,4 -бипиперидин)-4-карбокс- амид. т.пл, 180,5 С (соединение 86), выход 2,5%;
транс-4-амино-И-(2,6-диметилфенил)35 . , /о /200J, выход 5%;
-1-(2-гидроксициклогексил)-4-пипери-
динкарбоксамид. т.пл. 174,8 С (соединение 187), выход 19%; 1
4-aMHHo-N-(2,6-диметилфенил)-1- -(1-метилэтил)4-пиперидинкарбокс- амид. т.пл. 103°С (соединение 188), выход 32%;
W-(2,6-диметилфенил)-4-(этиламино) -}-(1-метилэтил)-4-пиперидинкарбокс- 45 амид, т.пл. (соединение 189), выход 18%;
4-амино-1-циклопентил-N-(2,6-дит.пл. 130, (соединение 192), выход 15%;
1 - 3-(диэтиламино)-2-гидроксипро- (диметиламино)-N-(2,6-диметил фенил )-4-пиперидинкарбоксамид. т.пл. 113, (соединение 193), выход 12%;
4-(диметиламино)-N-(2,6-диме тилфе нил)-1-(1,4,5,6-тетрагидро-2-пирими- динил)-4-пиперидинкарбоксамид, т.пл. 238, (соединение 194), выход 4,5%
4-(диметиламино)-N-(2,6-диметилфенил )-1 -( 2-гидрокси-1 -метил-2-фенил этил)-4-пиперидинкарбоксампд, т.пл. 185, (соединение 195), выход 18%;
транс-4-(диметиламино)-N-(2,6-диметилфенил )-1-(4-гидрок сициклогек- сил)-4-пиперидинкарбоксамид, т.пл. 84,2°С (соединение 196), выход 17%;
цис-4-(Диметиламино) -N- ( 2,6-диме- 20 тилфенил)-1-(4-гидроксициклогексил)- -4-пиперидинкарбоксамид. т.пл. 215 С (соединение 197), выход 14%;
4-(диметиламино)(2,4-дигидр- 25 оксибутил)-N-(2,6-диметилфенил)-4-пи перидинкарбоксамид. т.пл. 157 С (соединение 198), выход 6%;
1-(2,4-дигидрокси-2-метилбутил)- -4-(диметиламино)-N-(2,6-диметилфе- 30 нил)-4-пиперидинкарбоксамид, т.пл. 163 С (соединение 199), выход 2%;
()-l-(lQ, 2/3, 5)-1-(2,5-дигид- роксициклогексил)-4-(диметиламино)-N -(2,6-диметилфенил) -4-пиперидинкарбоксамид. т.пл. 188,5 С (соединение
40
(i)(lq, 2,5a)J 1-(2,5-ди- гидроксицйклогексил)-4-диметиламинр- -N-(2,6-диметилфенил)-4-пиперидинкарбоксамид, т.пл. 187 С (соединение 201), выход 11%;
(jt)( a, 2р,4а) -1 - ( 2,4-дигид роксициклогексил)-4-димeтилaминo-N- -(2,6-диметилфенил)-4-пиперидинкарбоксамид. т.пл. 21. С (соединение 202), выход 14%;
транс- 2-С4-(диметиламино)-4-, -(2,6-диметилфенил)аминокарбонил -1
метилфенил)-4-пиперидинкарбоксамид, - -
т.пл. 124°С (соединение 190), выход 50 -пиперидинил циклогексил пропаноат 22%;
1-(З-амино-2-гидроксипропил)-4- -(диметиламино)-N-(2,6-диметилфенил- -4-пиперидинкарбоксамид. т.пл. 156,2°С (соединение 19Ц выход 1,5%; 55
4-(диметиламино)-N-(2,6-диметйл- фенил)-1-(2-гидрокси-3-( фенилметил)
т.пл. 174,3°С (соединение 203), выхо 2%;
транс-4-(диметиламино)-N-(2,6-диметилфенил )-1-(2-гидрокс1щиклогексил -4-пиперидинкарбоксамид ацетат эфир) т.пл. 168,5°С (соединение 204), выход 2,5%;
транс- 2- 4-(диметиламино)-4-(2,
т
ч спил/ 1 f. 1 и/л - л -п - 1 LycnnjiMciiuiyграи - i- L амини ; -Ч-L ,
аминоЗПропил -4-пиперидинкарбоксамид, -диметилЛенил)аминокарбонилЗ- -пипе10
15
. - 5
-
-
31334424
т.пл. 130, (соединение 192), выход 15%;
1 - 3-(диэтиламино)-2-гидроксипро- (диметиламино)-N-(2,6-диметилфенил )-4-пиперидинкарбоксамид. т.пл. 113, (соединение 193), выход 12%;
4-(диметиламино)-N-(2,6-диме тилфе- нил)-1-(1,4,5,6-тетрагидро-2-пирими- динил)-4-пиперидинкарбоксамид, т.пл. 238, (соединение 194), выход 4,5%;
4-(диметиламино)-N-(2,6-диметилфенил )-1 -( 2-гидрокси-1 -метил-2-фенил- этил)-4-пиперидинкарбоксампд, т.пл. 185, (соединение 195), выход 18%;
транс-4-(диметиламино)-N-(2,6-диметилфенил )-1-(4-гидрок сициклогек- сил)-4-пиперидинкарбоксамид, т.пл. 84,2°С (соединение 196), выход 17%;
цис-4-(Диметиламино) -N- ( 2,6-диме- 20 тилфенил)-1-(4-гидроксициклогексил)- -4-пиперидинкарбоксамид. т.пл. 215 С (соединение 197), выход 14%;
. 200J, выход 5%;
4-(диметиламино)(2,4-дигидр- оксибутил)-N-(2,6-диметилфенил)-4-пи- перидинкарбоксамид. т.пл. 157 С (соединение 198), выход 6%;
1-(2,4-дигидрокси-2-метилбутил)- -4-(диметиламино)-N-(2,6-диметилфе- нил)-4-пиперидинкарбоксамид, т.пл. 163 С (соединение 199), выход 2%;
()-l-(lQ, 2/3, 5)-1-(2,5-дигид- роксициклогексил)-4-(диметиламино)-N- -(2,6-диметилфенил) -4-пиперидинкарбоксамид. т.пл. 188,5 С (соединение
(i)(lq, 2,5a)J 1-(2,5-ди- гидроксицйклогексил)-4-диметиламинр- -N-(2,6-диметилфенил)-4-пиперидинкарбоксамид, т.пл. 187 С (соединение 201), выход 11%;
(jt)( a, 2р,4а) -1 - ( 2,4-дигид- роксициклогексил)-4-димeтилaминo-N- -(2,6-диметилфенил)-4-пиперидинкарбоксамид. т.пл. 21. С (соединение 202), выход 14%;
транс- 2-С4-(диметиламино)-4-, -(2,6-диметилфенил)аминокарбонил -1- -
-пиперидинил циклогексил пропаноат
-пиперидинил циклогексил пропаноат
т.пл. 174,3°С (соединение 203), выход 2%;
транс-4-(диметиламино)-N-(2,6-диметилфенил )-1-(2-гидрокс1щиклогексил) -4-пиперидинкарбоксамид ацетат эфир) т.пл. 168,5°С (соединение 204), выход 2,5%;
транс- 2- 4-(диметиламино)-4-(2,6 т
i- L амини ; -Ч-L ,
-диметилЛенил)аминокарбонилЗ- -пипе2513
ридинил циклогексил}бечзоат, т.пг (соединение 205), выход 4%;
()- 2- 4- диметиламино)-4- ( 2,6-диметилфенил)аминокарбонил -1-пипе- ридинилЗ циклогексил -о6 метокси- -(трифторметил)бензилацетат, т.пл, 190°С (соединение 206), выход 2%;
(В) диметиламино) -диметилфенил) аминокарбонил -1 -пипе- ридинил циклoгeкcилj-й-мeтoкcи-l i- -Стрифторметил)бензилацетат, т.пл. 176,7°С (соединение 207), выход 2%;
(А + )(диметиламино)-4- Г( 256- -диметилфенил)аминокарбонил -1-пипе- ридинил циклогексил -ц -метокси--,- -(трифторметил)бензилацетат, т,пл 200 С. (соединение 208), выход 2%;
(В-)-2-С4(диметиламино)-4- (2 , -диметилЛенил)аминокарбонил -1 --пипе- ридинил циклогексшД-сг-метокси-Оо- -(трифторметил)бензилацетат, т,пл, 176 С (соединение 209), выход 2%;
транс-4 (диметиламине) -Г1- ( 2, б-ди- метилфенил)-3 -гидрокси-( .,4 -бипи- перидин)-4 карбоксамид. т,пл. 166,6°С (соединение 210), выход 4,5%;
транс-4-( димётиламино)-1 ( 2 б- ди- метилй)енил)-4 -гидрокси-( 1 ,3 -бигш- перидин)-4-карбоксамид, т,пл, 180,6 С (соединение 211), выход 1,5%
Пример 22, К перемепшвае- мому раствору 14,16 ч. 4-хлор-2-ме- тилбензиламина в 135 ч. тетрагидтюфу рана порциями добавляют 3,,65 ч, аык- да лития при нагревании с обратным холодильником. После завервзения добавления- перемешивание продолжаю :: в течение 2 ч при температуре дефлегмации. После охлаждения при комнатной температуре по каплям добавляют раст вор 14,92 ч, этил-транс-4-(диметил- амино)- -(2-гидроксициклогексил) --4- -пиперидин карбоксилата в 45 ч ТГФ, После окончания .добав ления перемеши-- вание продолжают в течение 3 ч при температуре дефлегмации и в течение ночи при комнатной температуре. Осторожно добавляют 50 ч, воды н затем 200 ч, воды. Продукт дваг/кды экстрагируют дихлорметаном. Объединенные экстракты промывают водой,, сушат,, фильтруют и выпаривают Остаток очищают методом колоночной хроматографии на колонке с сшт.икагелем с использованием смеси трихлорметана и метанола (95:5 по объему) в качестве элюента. Вторую фракцию собирают и
426
элюент выпаривают. Остаток перекрис- таллизовывают из 2,2 -оксибиспропана. Продукт отфильтровывают и сушат с образованием 5,8 ч. (29%) транс-К-(4 хлор-2-метилфенил )--4-(диметил- амино) -1 -г ( 2-гидроксициклогексил)-4- -пиперидинкарбоксамида , т.пл. 127,7°С (соединение 257), выход 29%. Следуя аналогичной методике и используя эквивалентные количества соответствующих исходных материалов, получают следующие вещества:
транс -4- (диметиламино) -N-( 2,6-ди- метилфенил)-1-(2-гидроксициклогексш1 -4-пиперидинкарбоксамид, т.пл, 165,5°С (соединение 89), выход 9%;
тр анс-4-(диметиламино)-1-(2-гидроксициклогексил )-N-( 4-метокси-2-ме- типфенил) -Б -метил-4-пиперидинкарбоксамид, т.пл„ 133,5°С (соединение 126), выход 11%;
транс-Г1-( 2 з6-диметилфенил)-1-( 2- -гидроксициклогексил) -4-(4-морфоли- вил)-4 пиперидинкарбоксамид, т.пл.
242 С (соединение 127);
тр ан с-4-(диме тиламино)-Ж-(2,6-ди- метилфенил) (фенилметил)-амино циклогексклЗ-4 -пиперидинкарбоксамид, т„пл„ 157, (соединение 128), выход 23%;
транс-4-(диметиламино)-N-(2,6-ди- метилфенил)( фенилметил)амино пиклодентил -4-пиперидинкарбоксамид, т.пл. 101 С (соединение 129), выход
30%;
1 -циклопентил-4( ,чиме тил амино) -N- ( 2 5 6-диметилфенил)-4-пиперидинкарб- оксамид, т.пл. 175,2 С (соединение 130) , выход 31%;
4( ацетилметиламино) ( 2,6-диметилфенил)-1-( 1-метилэтил)-4-пипери- динкарбоксамид, т.пл,. 187,5°С (соединение 157), выход 39,5%; 4-(диметиламино) -К-( 2, б-диметил- фенил)(3 метилциклогексил)-4-пи- перидинкарбоксамид, т.пл, 173,8°С (соединение 158), выход 44%;
4-(диметиламино)-N-(2,6-диметил- фенил )( З-оксо-1 циклогексенил)-4- -пиперидинкарбоксамид, т.пл. 270°С (соединение 159) выход 12%;
(диметиламино)-Н-( 2,6-диметилфенил)( 3-гндроксициклогексил). -4-пиперидинкарбоксамид, т.пл,
147,9 С (соединение 60), выход 8,5%j транс-4-(диметиламино)-N-(2,6-ди- нетилфени.п) -1 - (3-гидроксициклогексил),
2713
-А-пилеридинкарбоксамид, т.пл, 219,4°С (соединение 161), вькод 9%;
4-(диметиламино)-И-(2,6-диметил- фенил)-1 -(2-пропенил)-А-пиперидин- карбоксамид, т.пл, 144,5 С (соединение 162), выход 43,8%;
1- (2-диэтилaминo)-этил -4-(ди- мeтил амине )-N-(2,6-диметилфенил)-4- -пиперидинкарбоксамид, т.пл. 97, (соединение 163), выход 25%;
N-(2,6-диметилфенил)-1 -(1-метил- этил)-4- (фенилметил)амино -4-нипери динкарбоксамид, т.пл. 152,5 С (соединение 164), выход 60%;
( -циклопентил -N-(2,6-диметилфенил -4-(фенилметил} амино -4-пиперидин- карбоксамид, т.пл. 171,5 С (соединение 165), выход 65%;
N-(5-хлор-2-метилфенил)-1-цикло- пентил-4-(диэтиламино)-4-пиперидин- карбоксамид дигидрохлорид полугидрат т.пл. 201,2 С (соединение 166), выход 30%;
4-(диме тиламино)-N-(2,6-диметил- фенил)-1-( 2-гидроксиэтил)-4- пипери- динкарбоксамид, т.пл. 167 С (соединение. 167), выход 12%;
транс-1-(2-диэтиламино)метил(цик- логексил)-4-(диметиламино)-N-(2,6- -диметилфенил)-4-пиперидинкарбокс- амид, т.нл. 144,5-147,2°С (соединение 168), выход 17%;
4-(диметиламино)-N-(2,6-диме тил- фенил)-1-(2-пиримндинил)-4-пиперидин карбоксамид, т.пл. 160,5 С (соединение 169), выход 61%;
4-(диметиламино)-Н-(2,6-диметил- фенил) 2-(1-пиперидинил) -пиперидинкарбоксамид. т.пл, 144,5 С (соединение 170), выход 38%;
(диэтиламино)-2-метилэтил - -4-(диметиламино)-N-(2,6-диметилфенил )-4-пиперидинкарбоксамид, т.пл. 121,4°С (соединение 171), выход 24%;
4-(диметиламино)-N-(2,6-диметилфенил )-1- 2-оксо-2-( 1-пиперидинил)- -этилЗ-4-пиперидинкарбоксамид, т.пл. 160°С (соединение 172), выход 50%;
N-(2,6-диметилфенил)-4-(этилме- тиламино)( -фенилэтил) -4-пипери- динкарбоксамид, т.пл. 183 С (соединение 173), выход 39,5%;
4-(2,6-диметилфенил)аминокарбо- нил -4- (этиламетил амино) -сС-метил-1 - -пиперидинацетамид, т.пл. 214,5 С (соединение 174), выход 23,4%;
4-(диэтиламино)-N-(2,6-диметил- фенил)(-оксопропил)-4-пиперидин428
карбоксамид. т.пл. 154,1°С (соединение 175), выход 69,5%;
4-(диметиламино)-N-(2,6-диметил- фенил)-1-(1-фенилэтил)-4-пиперидинкарбоксамид. т.пл. 183,3 С (соединение 176), выход 26%;
4-(диэтиламино)-N-(2,6-диметилфе- нил)(3,4,5-триметоксибензоил)-4- -пиперидинкарбоксамид, т.пл. 197,5 С
(соединение 177), выход 51%;
4-(диметиламино)-N-(2,6-диметилфенил )-1 (фениламино)этил -4-пи- перидинкарбоксамид. т.пл. 157 С (соединение 178), выход 25%;
-(1-бензоилэтил)-4-(диметиламино )-N-(2,6-диметилфенил)-4-пипери- динкарбоксамид. т.пл. 163 С (соединение 179), выход 66%;
4-(диметиламино)-N-(2,6-диметилфенил)-4- (2,6-диметилфенил)-амино- карбонил -1-пиперидинаиетамид, т.пл. 202,7 С (соединение 180), выход 26%;
4-(диметиламино)-N-(2,6-диметилфенил )-1-(3-фенил-2-пропенил) -4-пи- . перидинкарбоксамид,- т.пл. 155,5°С (соединение 181), выход 35,7%;
4-(диметиламино)-N- (2,6-диметилфенил )аминокарбонилЗ-1-пиперидинадетамид, т.пл. 241,7 с (соединение 182) выход 39%;
транс-4-(диметиламино)-4- (2,6- -диметилфенил)аминокарбоиил -N-(2- -гидроксициклогексил)-1-пиперидинацетамид моногидрат, т.пл. 171, (соединение 183) выход 11%;
4-(диме тиламино)-N-(2,6-диме тил- фенил)-1-(3-фенилпропил)-4-пипери- динкарбоксамид, т.пл. 107,5°С (соединение 184), выход 15%;
1-(циклогексилкарбонил)-4-(диметиламино )-N-(2,6-диметилфенил)-4- -пиперидинкарбоксамид, т.пл. 175,5°С (соединение 185), выход 61%;
этил-4-(диметиламино)-4- (2,6-диметилфенил )аминокарбонил -1-пипери- динацетат, т.пл. 127,5°С (соединение 186), выход 50,6%;
транс-4-(диметиламино)-N-(2,6-ди- метилфенил)- -этил-4 -гидрокси- -(1,3 -бипиперидин)-4-карбоксамид, Т.Ш1. 173,3°С (соединение 212), вы- ход 14%;
4-(диметиламино )-N-( 2,6-диметилфенил )-1 -зтш1-(1,4 -бипиперидин)-4- -карбоксамид, т.пл. 147,Z C (соединение 213), выход 41%;
29
13
транс-4-(диметиламило)-N-(2,6-ди- метилфенил)- -этил-3 -гидрокси- -(1,4 -бипиперидин)-4-карбоксамид, т.пл. (соединение 214), выход 16%;
цис-4-(диметиламино) -N-( 2,, 6-диме- тилфенил)- -этил-3 -метокси-(1,4 - -биггаперидин)-4-карбоксамид, т.пл, 156,5 С (соединение 215), выход 19,7%;
транс-1-(2-аминоциклогексил)-4- -(диме тил амино)-N-(2,6-диме тилфенил- -4-пиперидинкарбоксамид, т.пл. 168,3°С (соединение 216), выход 2%;
транс-1-(2-аминоциклопентил)-4- -(диметиламино)-N-(2,6-диметилфенил) -4-пиперидинкарбоксамид, т.пл. 131 , С (соединение 2 17), выход 1 %;
транс-1- 2-(ацетиламино)циклогек- (диметиламино)-Ж-(2,6-диметил фенил)-4-пиперидинкарбоксамид, т.пл. 275,3°С (соединение 218), выход 30%;
транс-1- 2-(ацетиламино)циклопент -А-(диметиламино)-N-(2,6-диметилфе- нил)-4-пиперидинкарбоксамид, т.пл. 199, (соединение 219), выход 33%;
транс -4- (диме тил аъшно) -N- ( 2,6-ди- метилфейил)-1- 2-С(метилсульфонил) aMHHoJ циклогексил -4-пиперидинкарбоксамид, т.пл. 234, (соединение 220), выход 41%;
этил-транс- (2- 4- (диметиламино) - -4-(2,6-диметилфенил)аминокарбонилЗ -1-пиперидинилЗциклогексих карбамат, т.пл. 243,7°С (соединение 221), вы-. ход 39%;
транс-4-( диметиламино)( 2,6-диме тилфенйл )(1-океопропил)амино циклогексил -4-пиперидинкарбоксамид; т.пл. 268,7 С (соединение 222), вы- ход 31%;
транс-1-12-(бензоиламино)циклогек (диметиламино)-N-(2,6-диметилфенил )4-пиперидинкар 3 оке амид, т.пл. 250 С (соединение 223), выход 34%;
транс-1- 2-(аминокарбонил)амино циклогексил -4-(диметиламино)-N-(2,6 -диметилфенил)-4-пиперидинкарбоксамид, т.пл. 243 С (соединение 224), выход 18%;
транс-4-(диметиламино)-N-(2,6-диме тилфенйл )-1 -{2- t (2-гидроксиэтил) фенилметил -амино циклопентил)-4-пиперидинкарбоксамид, т.пл. 161,4 С (соединение 225), выход 4,5%;
транс-4-(диметиламино)(диметиламино )-циклогёксил -Н-( 2,6-ди- мeтилфeнил)-4-1Шперидинкарбоксамид,
4
30
т.пл. 170, (соединение 226), выход 40%;
транс-4-(диме тиламино)-N-(2,6-диметилфенил )-1 (метиламино)-цик- логексил -4-пиперидинкарбоксамид, т.пл. 188,4 С (соединение 229), выход 7%;
транс-4-(диметиламино)-N-(2,6-диметилфенил )-1- 2-(этиламино)-цикло- гексилЗ-4-пипе.ридинкарбоксамид, т.пл., 176,1 С (соединение 230), выход 8%;
транс-4- (диметил амино) -N- ( 2,6-диме тилфенйл )( 2-гидроксиэтил) амино циклогексил -4-пиперидинкарбоксамид, т. пл. 168,9 С (соединение 231), вьпсод 16%;
(фенилметил)-3- (2,6-диметилфенил ами11окарбонил |-3-(метил амино)-1-пи- перидинкарбоксилат, т.пл. 107,6 С (соединение 239), выход 82%;
транс-3-(диметиламино)-N-(2,6-ди метилфенйл)-1-(2-гидроксициклогексил -3-пиперидинкарбоксамид, т.пл. 170,,4°С (соединение 242), выход 11%;
-цианометил-4-(диметиламино)-N- -(2,6-диметилфенил)-4-пиперидинкарбоксамид, т.пл. 193,3 С (соединение 250), выход 69,2%;
1-(2-аминоэтил)-4-(диметиламино)- -N-(2,6-диметилфенил)-4-пиперидинкарбоксамид, т.пл. 162,6°С (соединение 251), выход 1%;
транс-4-(диметиламино)-N-(2,6-ди- ме тилфенйл) -1 - 1.2- ц 2-гидроксицикло- гексил) а;мино этил -4-пиперидинкарбоксамид, т.пл. 141,8 С (соединение 252), выход 14%;
транс-4-(диметиламино)-1-(2-гидро сицикло гeкcил)-N-(4-гидpoкcи-2,6-ди- метилфенил) -4-пиперидинкарбоксамид, т.пл. 207, (соединение 254), выхо 9,5%;
N-(4-бром-2,6-диметилфенил)-4- -(диметиламино)-1 -(фенилметил)-4-пиперидинкарбоксамид, т.пл. 189, (соединение 255), выход 48%;
этил 4-(4-бром-2,6-диметилфенил) аминокарбонил -4-(диметиламино)-1- -пиперидинкарбоксилат, т.пл. 135, (соединение 256), выход 41%;
N-(4-6poM-2,6-диметилфенил)-4-(диме тиламино) -4-пиперидинкарбоксамид, т.пл. 144,9°С (соединение 258), выход 2%;
транс-N-(2,4-дихлорфенш1)-4-диме- тиламино)-1-(2-гидроксициклогексил)31131334432
соли и их возможные стереохимическн изомерные формы проявляют отличные антиаритмические свойства и в качестве таковых являются ценными средствами для нормализации нарушенных сердечных ритмов. Антиаритмическое действие предлагаемых соединений изучают в эксперименте, проведенном на собаках. Эксперимент проводят с ней- тролептанальгезией (1 мл на 10 кг живого веса) фентанила (0,4 мг/мл) и дроперидола (20 мг/мл). Через 16 ч после наложения лигатуры на переднение 262), выход 20,4%jнее нисходящее ответвление левой ко4-(диметиламино)-И-(4-фтор-2,6-ди- -5 ронарной артерии у собак обнаруживаметилфенил)-4-пиперидинкарбоксамид, ется многоочаговая желудочная аритт.пл. 187°С (соединение 263), выход мия.
3%;Испытуемые соединения вводят внутранс-4-(диметиламино)-М-(4-фтор- тривенно после контрольного периода
-2,6-диметилфенил)-1-(2-гидроксицик- 30 мин. Минимальная эффективная до-4-пиперидинкарбоксамид, т.пл.
112, (соединение 259), выход 12%;
транс-N-(2,5-дихлорфёнил)-4-(диме- тиламино)-1-(2-гидроксициклогексил)- -4-пиперидинкарбоксамид, т.пл. 129 С 5 (соединение 260), выход 9%;
транс-N-(4-бром-2,6-диметилфенил)- -4-(диметиламино)-1-(2-гидроксициклогексил )-4-пиперидинкарбоксамид, т.пл. 197,5°С (соединение 261), выход 14%; 0
4-(диметиламино)-W-(4-фтор-2,6-диметилфенил )-1-(Ленилметил)-4-пипери- динкарбоксамид, т.пл. 114°С (соеди25
логексил)-4-пиперидинкарбоксамид, т.пл,.150,0 С (соединение 264), выход 11%;
транс-N-(2-хлор-5-метилфенил)-4- -(диметиламино)-1-(2-гидроксициклогексил )-4-пиперидинкарбоксамид, т.пл. 100,2°С (соединение 265), выход 14%;
транс-4-(диметиламино -N-(4-фтор- -2,6-диметилфенил)-1-(2-гидроксициклогексил )-4-пиперидинкарбоксамид, т.пл. 156,8°С (соединение 266), выход 19%;
транс-4-(диметиламино)-N-(4-фтор- -2-метш1фенил)-1-(2-гидроксициклогексил) -4-пиперидинкарбоксамид., т.пл. 35 123,6°С (соединение 267), выход 10%;
TpaHC-N-.( 5-хлор-4-фтор-2-метилфе- нил)-4-(диметиламино)-1-(2-гидрокси- циклогексил)-4-пиперидинкарбоксамид,
30
за, способная вызвать нормализацию сердечного ритма, значительное снижение количества экстрасистол и по- вьшение количества нормальньпс биений, а также продолжительность действия соединения при указанной минимальной эффективной дозе (ЮД в мг/кг живого веса) приведены в табл. 4-6.
В связи с их активной способностью нормализовать нарушения сердечных ритмов предлагаемые соединения целесообразно применять в качестве антиаритмических средств.
Предлагаемые соединения могут быть приготовлены в различных фармацевтических формах, для чего эффективное количество конкретного соединения в виде основания или кислотоад- дитивной соли в качестве активных
т.пл, 167,9°С (соединение 268), выход О да редиентов тщательно смешивают с ° 5фармацевтически приемлемым носителем,
транс-N-(2-хлор-4-фтор-5-метилфе- который может быть в самых различных нил)-.4-(диметш1амино)-1-(2-гидрокси- формах в зависимости от требуемой
формы препарата, предназначенного для введения, причем указанное количество является количеством, эффективным для нормализации нарушения сердечных ритмов.
Такие фармацевтические композиции желательно готовить в форме одноразовой дозировки предпочтительно для орального, ректального или парэнте- рального введения. При приготовлении композиций в форме оральной дозировлы, получают вещества, указанные в применять любую из обычных табл, 1-3,фармацевтических сред, например воду,
Соединения формулы I их фармацев- тликоли, масла, спирты и т.п. для тически приемлемые кислотоаддитивные приготовления жидких препаратов, предциклогексил)-4-пиперидинкарбоксамид, т.пл. 120,(соединение 269), вы- ход 20%;
транс-4-(диметиламино)-1-(2-гидр- оксициклогексил)-N-(3-гидрокси-2,6- -диметилфенил)-4-пиперидинкарбоксамид
моногидрат, т.пл. 174,2°С (соедине- ни,), выход 18%.
Пример 23. Следуя методике, описанной в примере 22, и используя соответствующие исходные материя
за, способная вызвать нормализацию сердечного ритма, значительное снижение количества экстрасистол и по- вьшение количества нормальньпс биений, а также продолжительность действия соединения при указанной минимальной эффективной дозе (ЮД в мг/кг живого веса) приведены в табл. 4-6.
В связи с их активной способностью нормализовать нарушения сердечных ритмов предлагаемые соединения целесообразно применять в качестве антиаритмических средств.
Предлагаемые соединения могут быть приготовлены в различных фармацевтических формах, для чего эффективное количество конкретного соединения в виде основания или кислотоад- дитивной соли в качестве активных
да редиентов тщательно смешивают с фармацевтически приемлемым носителем,
назначенных для. орального приема, например, суспензий, сиропов, эликсиров и растворов; или твердые носители, например, крахмалы, сахара, смазочные средства, связующие,, диспергирующие агенты и т.п.. для приготовления порошков, пилюль, капсул и таблеток,
В связи с легкостью введения таблетки и капсулы являются наиболее предпочтительными формами оральной одноразовой дозировки. В этих случаях применяют, конечно, твердые фармацевтические носители. Дпя парэнтераль- ных композиций носитель обычно содер- жит стерилизованную воду, хотя быть приготовлены и другие ингредиенты, например, в которых носитель включает в себя солевой раствор, раствор глюкозы или раствор смеси соли и глюкозы. Могут быть приготовле- ны также и растворы для инъекций, Б этом случае могут быть щэименены подходящие жидкие носители, суспендирующие агенты и т.п. В ислотоаддитиБНые соли формулы I более пригодны для п-риготовления водных композиций вследствие их большей водорастворимо- сти по сравнению с соответствую1 щми основаниями.
Особенно предпочтительно готовить указанные фармацевтические, композиции в форме одноразовой дозировки с целью облегчения введения и достижения единообразия дозировки. Форма одноразовой дозировки относится к физически дискретным единицам,, годным ,цля применения в качестве единичной дозы, причем каждая единица содержит заранее установленное количество активного ингредиента, рассчи- танное на требуемое терапевтическое
действие в сочетании с требуемым фармацевтическим носителем.
Примерами таких форм одноразовой дозировки являются таблетки (включая таблетки с надрезами и покрытиями), капсулы, пилюли, порошки, вафли,, растворы или суспензии.для инъекций и т,п., а также отдельные их количества о
Количество активного ингредиента на одноразовую дозу составляет 0,25- 100 мг, предпочтительно 0,5-20 мг
Могут быть приготовлены следующие типичные композиции для нормализации нарушений сердечньга: ритмов в форме одноразовой дозировки, пригодной гщя
систематического введения животным и человеку.
Капли для орального приема. Состав рассчитан на 50 л раствора для орального приема по каплям, содержащего 10 мг активного ингредиента - 4-(диметиламино)( 2,6-диметил фенил)-1-(2-оксициклогексил)-4-пипе- ридинкарбоксамида на I мл:
Активный ингредиент, г 500 2-Оксипропановая кислота, л0,5 Сахарин натрия, г 1750 Вкусовое вещество какао, л2,5 Очищенная вода, л 2,5 Полиэтиленгликоль, л До 50 Активньш ингредиент растворяют в 2-оксипропановой кислоте и 1,5 л по- лиэтиленгликоля при 60-80 С. После охлаждения до 30-40 с к раствору добавляют 35 л полиэтиленгликоля и смесь тщательно перемешивают. Затем добавляют раствор сахарина натрия в 2,5 л очищенной воды и при перемешивании добавляют вкусовое вещество какао и полиэтилен до требуемого объема. Полученный раствор разливают в контейнеры.
Раствор для инъекций. Состав рассчитан на 20 л парэнте- рального раствора, содержащего 2 мг активного ингредиента - 4-(диметил- амино)-N-(2,6-диметилфенил)-1-(2-оксициклогексил )-4-циперидинкарбокс- амида на 1 мл:
Активный ингредиент, г 40 2,3-Диоксибутандикар- боновая кислота, г 20 Метил-4-оксибензоат, г 36 Пропил-4-оксибензоат, г 4 Вода для инъекций, л До 20 4-Оксибензоаты метила и пропила растворяют приблизительно в 10л кипящей воды Щ1я. инъекций. После охлаждения до 50 С добавляют при перемешивании 2,3-диоксибутандикарбо- новую кислоту и затем активный ингредиент. Раствор охлаждают до комнатной темпефатуры и добавляют воду для инъекций до требуемого объема. Раствор стерилизуют методом фильтрации (Фармакопея США) XVII, с. 811) и разливают в стерильные контейнеры. Раствор для .орального приема. Состав рассчитан на 20 л раствора для орального приема, содержащего 5 мг активного ингредиента - 4-(диме35131
иламино) -N-(2 ,.6-диметилфенил )-l-(2- oкcициклoгeкcил)-4-пипepидинкapбoкc- мидa на 1 столовую ложку (5 мл): Активный ингредиент, г 20 2,3-Диоксибутандикар6о- новая кислота, г10
Сахарин натрия, г40
1,2,3-Пропантриол, л 12 70%-ный раствор сорбита, л3 Метил-4 оксибензоат, г 9 Пропш1-4-оксибензоат, г 1 Малиновая эссенция, мл 2 Эссенция крыжовника, мл 2 Очищенная вода, л До 20 4-Оксибвнзоаты метила и проннла растворяют в 4 л кипящей очищенной воды. В 3 л этого раствора растворя- ют сначала 2,3 диоксибутандикарбоно- вую кислоту, затем активньй ингредиент . Полученный раствор соединяют с оставшейся частью первого раствора и добавляют в него раствор 1,2,3-про- пантриола и сорбит. Растворяют сахарин натрия в 0,5 л воды и добавляют малиновую эссенцию и эссенцию крыжовника. Последний раствор соединяют с первьм, добавляют воду до требуемого объема и полученный раствор разливают в контейнеры.
Таблетки с пленочным покрытием. 10 000 прессованных таблеток, содержащих в качестве активного ингредиента по 10 мг 4-(диметиламино)-К- -(2,6-диметилфенил)-1-(2-оксицикло- гексил)-4-пиперидинкарбоксамида каждая, готовят из следующего состава:
Содержимое таблетки Активный ингредиент, г 100 Лактоза, г570
Крахмал, г200
Поливинилпирролидон
(Kollidon К 90), гЮ
Микрокристаллическая целлюлоза (Avicell), г 100 Додецилсульфат натрия, г 5 Гидрированное растительное масло (Sterotex),.г 15
Покрытие Метилцеллюлоза
(Methocell 60 HG), г 10 Этилцеллюлоза
(Ethocfel 22 сПз), г 5 1,2,3-Пропантриол, мл 2,5 Полиэтиленгликоль 6000, г 10 Концентрированная красящая суспензия (Opaspray К-1-2109) МП30
5
5
34436
Поливинилпирролидон (повидон), г5
Октадеканоат магния, г 2,3 Приготовление содержимого таблет- ки.
Смесь активного ингредиента, лактозы и крахмала тщательно перемешивают и затем увлажняют раствором доде- цилсульфата натрия и поливинилпирро- 0 лидона приблизительно в 200 мп воды. Влажный порошок просевают,,сушат и снова просевают. Затем добавляют микрокристаллическую целлюлозу и прессуют таблетки.
Приготовление покрытия. К раствору метилцеллюлозы в 75 мл денатурированного этанола добавляют раствор этилцеллюлозы в 150 мл ди- хлорметана. Затем добавляют 75 мл 0 дихлорметана и 1,2,3-пропантриол. Полиэтиленгликоль расплавляют и растворяют в 75 мл дихлорметана. Последний раствор добавляют к первому, добавляют туда же октадеканоат магния , Поливинилпирролидон и концентрированную красящую суспензию и смесь гомогенизируют.
Содержимое таблеток покрывают полученной смесью в устройстве для покрытия .
Приготовление свечей. Сто свечей, содержаш;их каждая по 3 мг активного ингредиента - 4-(ди- метиламино)-N-(2,6-диметилфенил)-1- 5 -(оксициклогексил)-4 пиперидинкар- бокс амида, готовят из следующего состава:
Активный ингредиент, г 0,3 2,3-Диоксибутандикарбо- новая кислота, г 3 Полиэтиленгликоль 400, мл25
Поверхностно-активное вещество (Spau) г 12 Триглицериды (Witersol 555), гДо 300
Активный ингредиент растворяют в растворе 2,3-диоксибутандикарбоновой кислоты в полиэтиленгликоле 400. Расплавляют одновременно поверхностно-активное вещество и ч риглицериды, Эту смесь тщательно перемешивают с первым раствором. Полученную таким образом смесь выливают в формы при 37-38°С для формования свечей.
Нормализация сердечных ритмов у больных, страдаюпрпс нарушениями ука0
0
5
3713
заиньгх режимов, способствует систематическое введение эффективного количества по меньшей мере одного соединения формулы I, его кислото- адцитивной соли или его стереохими- чески изомерной форм1.1 в смеси с фармацевтическим носителем.
Хотя количество подлежащего приему активного ингредиента может изменяться в широком интервале в зависимости от конкретных обстоятельств, суточные дозы от 0,005 до приблизительно 1 мг/кг живого веса при одноразовом или повторном приеме бывают обычно достаточны.
Данные табл. 7 отражают особенности структурного строения, известных и предлагаемых соединений. Методики получения этих соединений аналогичны описанным.
Данные по токсичности. Транс-4-(Диметиламино)-N-(2,6-ди- метилфенил)-1 -(2-оксициклогексил)-4- -пиперидинкарбоксамид в различных дозах вводят орально или внутривенно собакам или крысам. Значение ЛДзо определяют как дозу, при которой погибает 50% животных, мг/кг,. веса тела Крысы (внутривенно) 0,61 Крысы (орально)5,35
Собаки (внутривенно) 0,58 Собаки (орально) 4,15 Таким образом, предложен способ получения соединений формулы I, обладающих ценными фармакологическими свойствами.
Формула изобретения
Способ получения N-арил-об-амино- карбоксамидов общей формулы
О R ./Cn,H,
L---N
Y CnHan- N-R2
--nii n
R:
50
де тип - целое число, равное 1 2 или 3, причем тип равна 4 и один атом водорода в радикале C Hj может быть заме-,, щен низшей алкил- или низпей алкоксигруппой; R - водород или низший ал;- кил;
O
(5
344
5
0
5
30
35
40
45
50
,,
38
R - водород, низший алкил, ацетил или бензил;
К„ - водород или низший алкил, или Р. 2 и RJ вместе с атомом азота образуют морфолиновое кольцо;
Аг - незамещенный фенил, фенил с одним заместителем, таким как 2-низший
алкокси или 3-трифтор- метил, фенил с двумя заместителями, такими как низший алкил, низший алкокси или галоген; фенил с тремя заместителями, такими как низпшй алкил, гидроксил, низший алкокси, галоген, ди-(низший ;злкил)аминогруппа, причем один из заместителей обязательно низший алкил;
L - водород, (окси) (фенил) низший алкил, низший алкил, который может быть замещен фенилом, цикло- пропилом, диклопентилом, гидроксилом, низшей алкоксигруппой, фенокси- группой, фенилкарбони- лом, пиперидинилкарбо- нилом. низпшм алкокси- карбонилом, аминокарбо- нилом, цианогруппой, . аминогруппой, диСнизший алкил)-аминогруппой, фе- ниламиногруппой, дибен- зоиламиногруппой, (2,6- -диметилфенил)аминокар-- бонилом, (2-окСицикло- гексил)аминокарбонилом, (2-оксициклогексш1)ами - ногруппой, 1-пиперидини- лом, 2-пропенил, 3-фе- нил-2-пропенил, цикло- пентил, который может быть замещен в положении 2 гидроксилом, аминогруппой, ацетиламино- группой, бензиламино- группой, (гидроксиниз- ший алкил) аминогруппой (бензил) (гидроксиниз- ший алкил)аминогруппой, (низший алкилоксикарбо- нил) низший алкил ом, . циклогексил, который может быть замешен двумя
радикалами, выбранными из групп, включающих низший алкил, (динизший ацкиламино низший алкил, радикал формулы - OR, где R - водород, низший алкил или бензил,
радикал формулы - OCR..
II О
где Ry низший алкил, фенил, или (метокси) (фенил) (трифторметил) метил, радикал формулы -NCRJ, где Pg - низший алкил, радикал формулы -ИНБ где 1 - водород, низший алкил, низший алкилсульфонил или бензил, радикал формулы -NHCRg, где Rg - низший
О;
алкил, фенил, амино- . группа, или низший алкилоксигруппа,
ли L - радикал формулы CRo ,
11 О
где RO - низший алкил, низший алкилокси, бензилокси, 3,4,5-триметоксифенил или циклогексил, ли L - радикал формулы
6
R.
L
водород, низший алкил или. низший алкилоксикарбонил; 40 водород, гидрокси или низшая алкилоксигруппа, , радикал формулы
он
GH2 C--CH2Ri2
Ri3
R
г
R L
1Ь
оксиметил, бензилоксиме- тил, гидрокси, 4-галоген- фенокси, аминогруппа, динизший алкиламино, бензил- амино или дибензиламино- группа; водород или низший алкил, 2-пиримидинил, 1,3-дигид- ро-2Н-инден-2-ил, тетра
гидро-4Н-пиран, 4-ил, 3- -оксо-1-циклогексенил, 1,4,5,6-тетрагидро-2-пи- римидинил,
или их солей с фармацевтически приемлемой кислотой или возможной сте- реохимической изомерной формы, отлич аюшийс-я тем, что зфир соответствующей кислоты общей формулы
О 1 / 2т /С--ОС2К5
СпНгп/ -H-i Нз
где R, R,Lmиn имеют указанные значения
подвергают взаимодействию с амином общей формулы
HN-Ar
4
0
5
0 ,
5
0
5
где R, и Аг имеют указанные значения, в среде 1,1-оксибисзтана или тетра- гидрофурана в присутствии 1-литийбу- тана в атмосфере азота при охлажде-, иии или в среде тетрагидрофурана в присутствии гидрида натрия или амида лития с выделением целевого продукта в свободном виде, в виде соли с фармацевтически приемлемой кислотой или в стереохимически изомерной форме.
Приоритет по признакам: 11.04.83 - m и п - целое число, равное 1 , 2 или 3, причем тгумма m и п равна 4, и один атом водорода в радикале С Н может быть замещен низшей алкил или низшей алкоксигруппой, п - водород или низший алкил; В - водород, низший алкил, ацетил или
бензил, R, - водород или низший ал- - - .
кил; или R Д вместе с атомом азота образуют морфолиновое кольцо; Аг - незамещенный фенил, фенил с двумя или тремя заместителями, такими как низший алкил или галоген, причем один из заместителей низший алкил; L.- водород, низший алкил, который может быть замешен фенилом, цикло- пропилом, гидроксилом, низшим алкок- силом, фенилом, фенилкарбонилом, . пиперидинкарбонилом, низшим алкокси- карбонилом, аминокарбонилом, циано- группой, амином, ди-(низший алкил)
Al13
дибенэоиламином (2,6-диметилфенил) аминокарбонилом, (2-оксициклогексил) аминогруппой, 2-пропенил; 3-йенил-2- -пропенил; циклопентил, который может быть замещен в положении 2 - гид роксилом, амино, ацетиламино, цик- логексил, который может быть заме;щен двумя радикалами, выбранными из . групп, включающих низший алкил (ди- низший алкиламинов низший алкил, радикал формулы Oli ,,е Р.д является водородом, низшим алкилом или бензилом, радикал формулы OCRj, где Rj О
низший алкил, NHK, где R водород низший алкил, или ра,цикал формулы - , где Rg низший алкил, низший
О
алюшокси, бензилокси, 3,4,5-триметоксифенил или циклогексил, или L - радикал формулы г тч
Т.
N Hio
где В iQ - водород, низший .апкил или низший алкилоксикарбонил, R - водород, гидроксил или апкил ок сил;
21„02,84 - при тип- целое число, равное 1, 2 или 3, причем сумма тип равна 4 и один атом водорода в радикале может быть замеш;ен низшей алкил- или низшей алкоксигруп- пой; RI - водород или низший алкил; R,j - водород, низший ллкил, ацетил
4 42
или бензил; R, -- водород или низший алкил, или R и РЭ вместе с атомом азота образуют морфолиновое кольцо; Аг - фенил, замешенный одной или несколькими группами, выбранными из следуюш11х групп: низшая алкоксигрупп, трифторметил, гидроксил, ди (низший алкил)аминогруппа, L - низший алкил, замещенный 1-пиперидинилом, циклопентил, в положении 2 замещенный бен- зиламиногруппой, оксинизщий алкил- аминогруппой, бензил (оксинизший алкил) аминогруппой, t низший алкокси- карбонил)низшим алкилом, циклогексил,
замешенный двумя радикалами - OCR,ПО
где Ну - фенил или (метокси)(фенил) (трифторметил)метилом, радикалом NHR 5 где R- - низший алкилсульфонил или бензил, радикалом - NHCRg, где
О
Rg - низший алкил, фенил, аминогруппа или низшая алкоксигруппа, L - радикал Аормулы
ОН -СН2-С-СН2В12
Ни
где R,j - 4-галоидфенил, гидроксил, дибензиламиногруппа, аминогруппа, бензиламиногруппа (динизший алкил) аминогруппа, оксиметил, бензилокси- метил, R,g. - водород или низпшй алкил.
п)
Я X
t; ю rt Н
со
ю
CS1ЮчО
00
00
00
1Л
1Л
гшюг 3М#t «I
о ONO Cvl- Т
ЧО - Г ONО О
- --Cvl Сч1
00
CNI
оо
CS1 СГ1
«S ГО
««
сч
I . t
ж о
t
п: о
и
(П
ж и
а: о
«
ж и
Wi
S
(П
и
ж. и
с
ж о
tr,
ж о
J l
а:
I J | |
X S
ж ж
i
Сч|
Оч
ГП
CTi
CI
О
а
г о
00
(Ti
а о
о о
1313344
и
-и.
50
Таблица 2
-и.
м
О II
C-NH
IJ-CH
I ОШз СНй
0-C-C-f 7
II I / о сг
о
Таблипа. 4
продолжение табл.4
1Л
чО О
- гО
LO 1Л CN1 CN
-d
- in
- T5
I ГЧ
U
к
S
Xrt
+Р.
ttc
x I
4D
Ж
и
ж и
a: и
ж
и
ь с;
з:
Ж
о ;
0)
(W о
: яо щ
C-J
О X
и
(ч
о t ь:
о
ж
см
о о
CN
CTi о - CSJ
- in I I
+ и13 «.
- I CN
f Ж
и
ж и
ж и
и
ж о
и
п
и
ж
CJ
о
и
ж
U
л
ж о
U
рп
1-1-(
U
ж
ж
ж
ж
о ь:
0)
I-, о
i
До
ж
CN
CN) СМ
f
CN
о,
ГЛ
го
с
-- г I I
TlLll со.
- I rg
О) к ж
U
tJ
U
з: и
I
vO
I с
CN
Зи
и
X
и
п: с
X
с;
о «
О)
и о R «
S
:j I
о
CVI
оо
m ил ш -. ш -
--Г - О го
оо О
со о
о
fl а
Ео ж m ft ь
и Ж
nj ft ь
о я rt ft t
О) к х
гО
: и
I
чС
о;
хс
CJ
I
чС
и
5 о
X
С
DC
и
U
з; о
а:
U
CJ
о
э о, с
т
-dо: и
X
и
зп е;
ос о
X
и
Зй U
з:
д: п:
X
-d- г og oj
CN-
00
ОЛ r-sl
to
CNi
Г--C -
--ГО
OJCNICsJ
65
1313344
О
L 1()- 1-С СН2--Аг Ar
известное соединение
(сн,) сн
с,н.
сн,
2,6-Диметилфенил A-Cl-CgH- 5 (СН,)СН СН, 2.6-Ди- 0,16
метил- фенил То же CgHj 5 СН, СН, То же 0,63
CgHj.
Циклогек- сил
Фенил
3-Cl-CgH
Составитель Н. Нарышкова Редактор Н. Егорова Техред И.Попович Корректоре. Шекмар
1983/58
Тираж 372 Подписное ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-.35, Раушская наб. д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
66
Таблица 7
У
-Rl
Ro
соединение формулы
H-CjH CHj СН,
0,16
Цикло- СН, СН, - гексил
0,16


















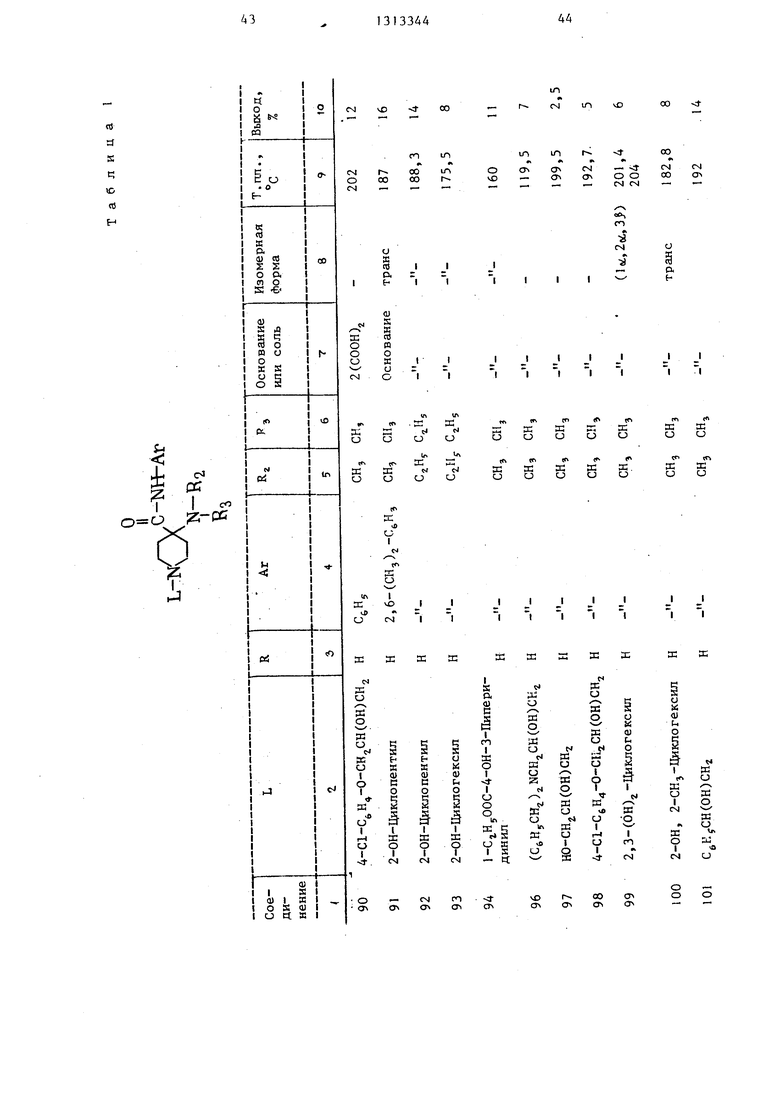
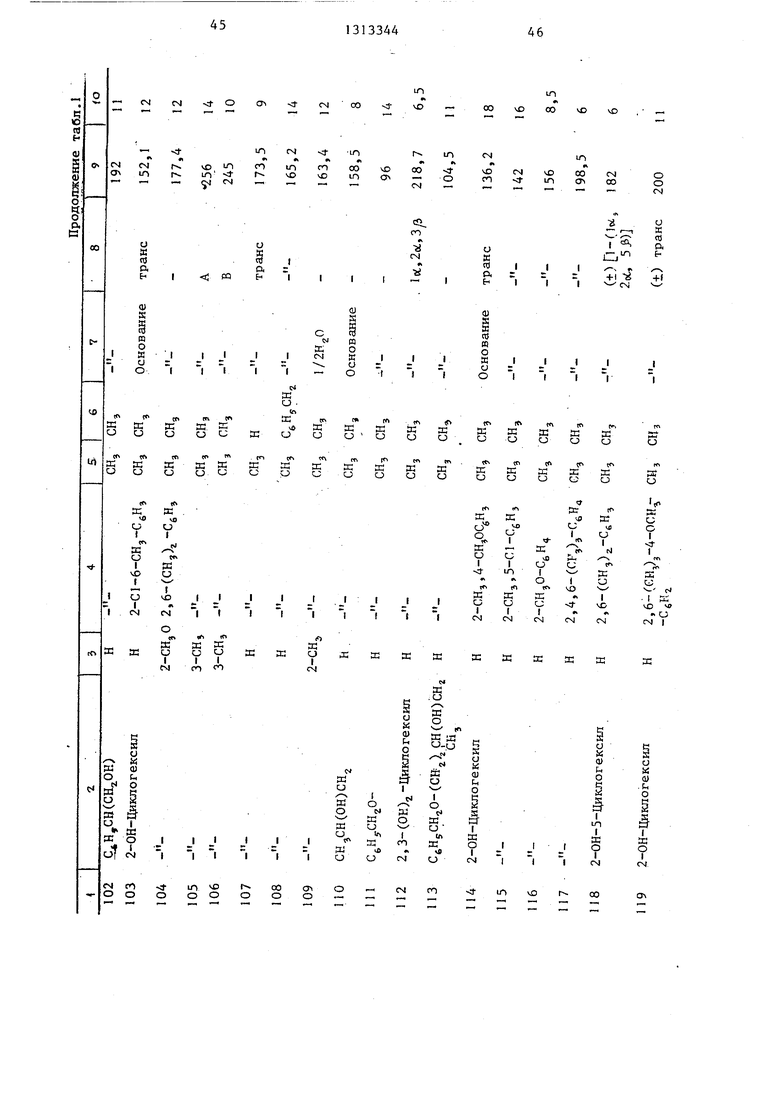
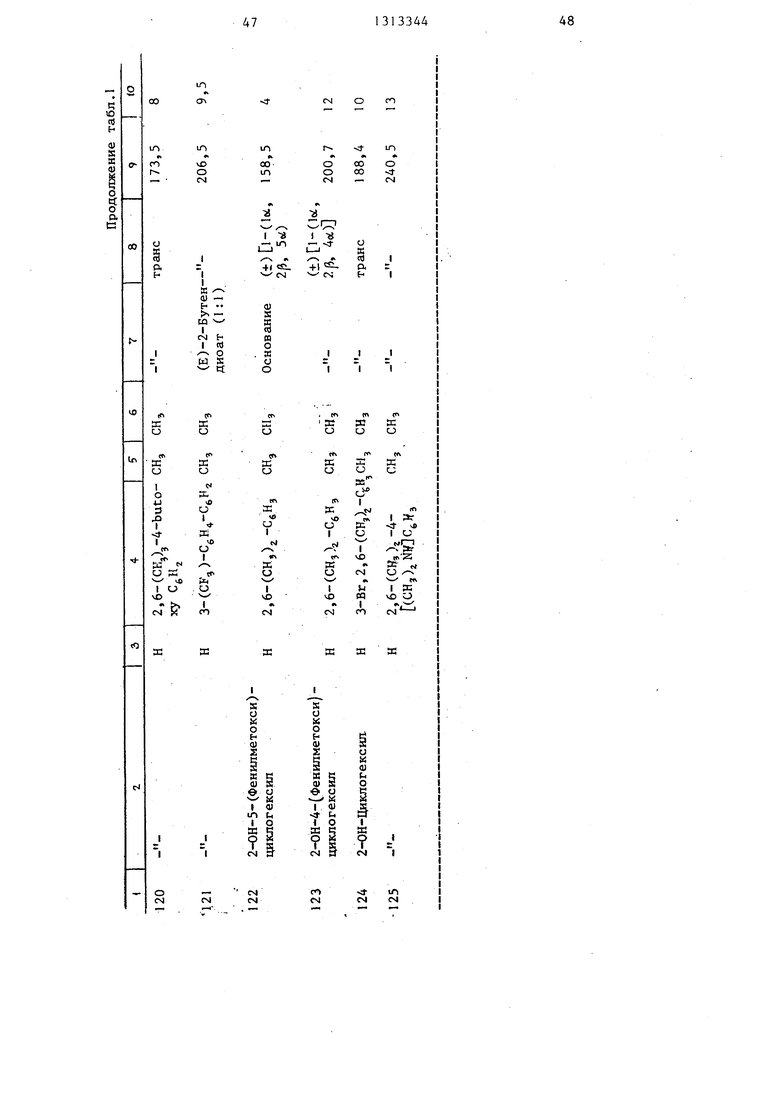
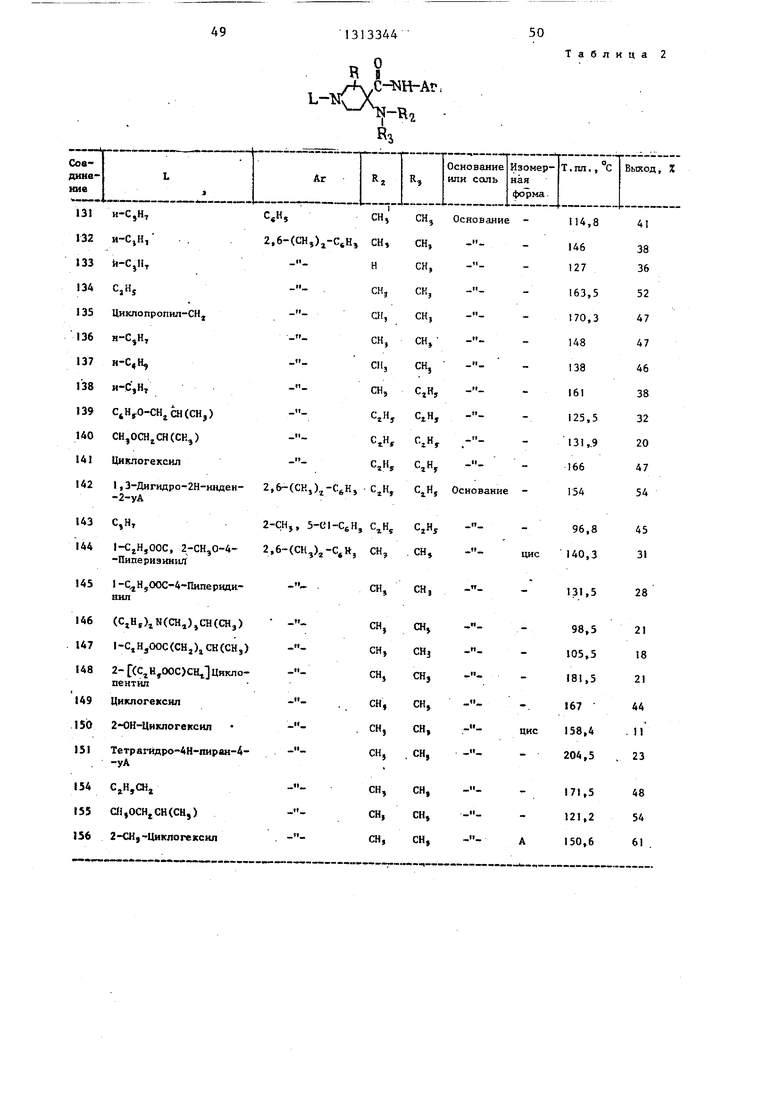
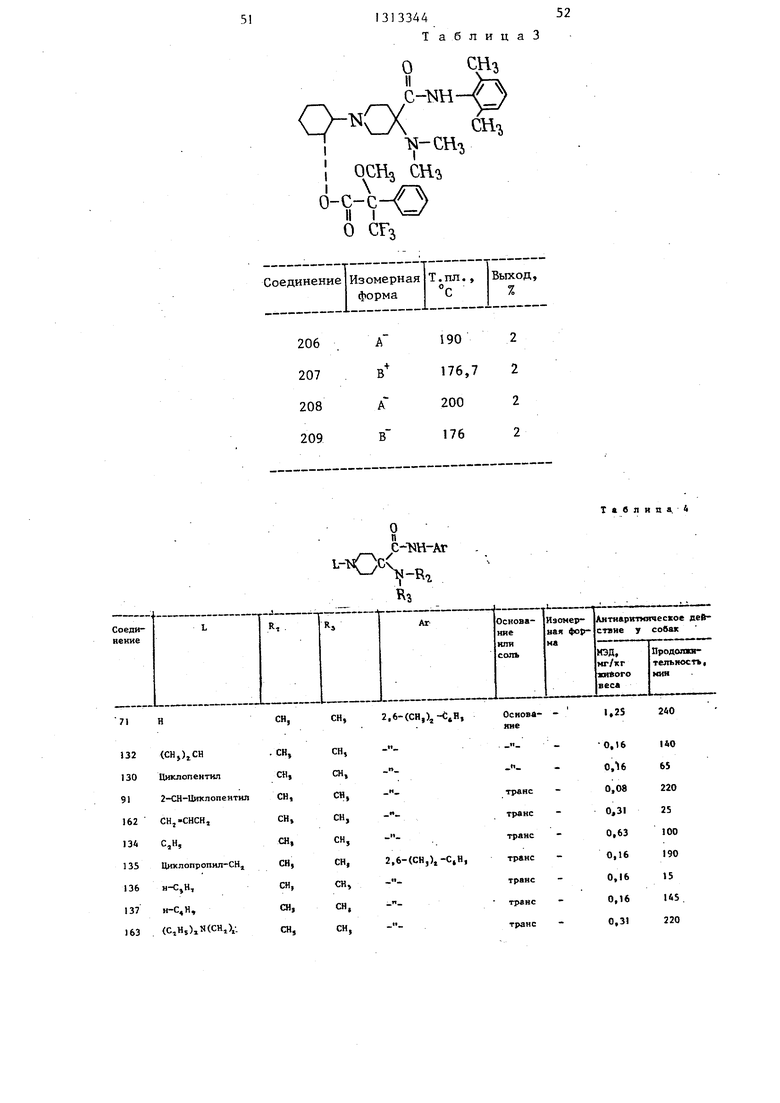

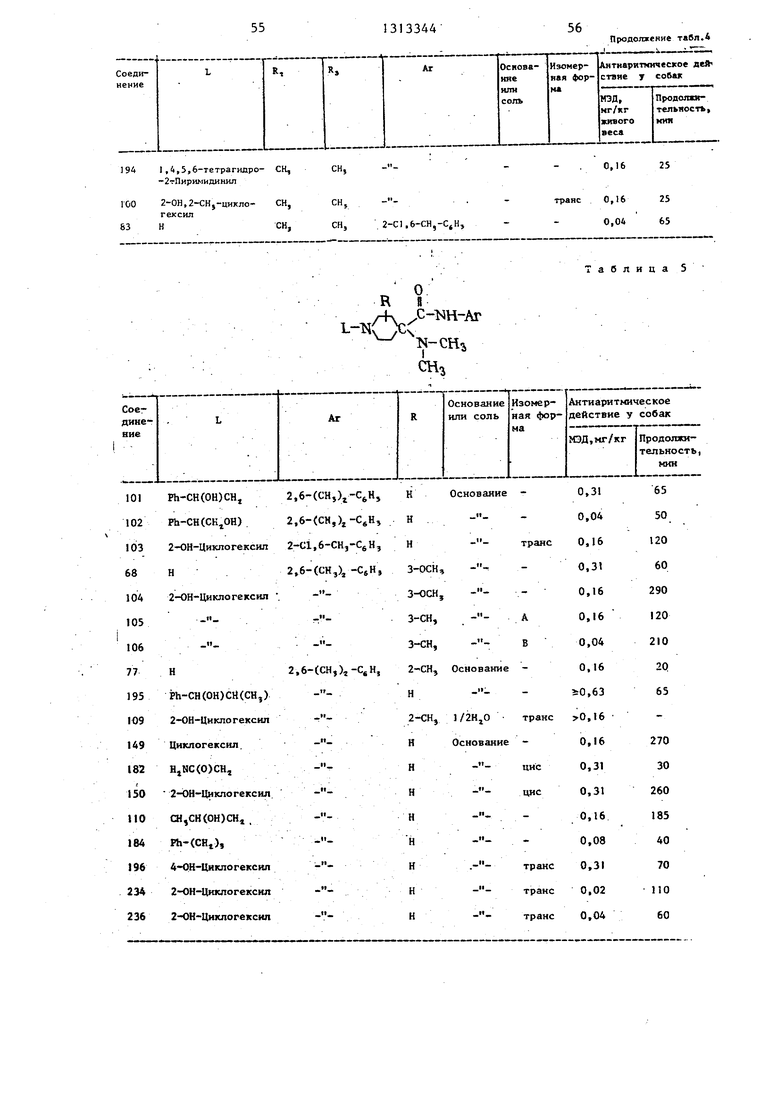

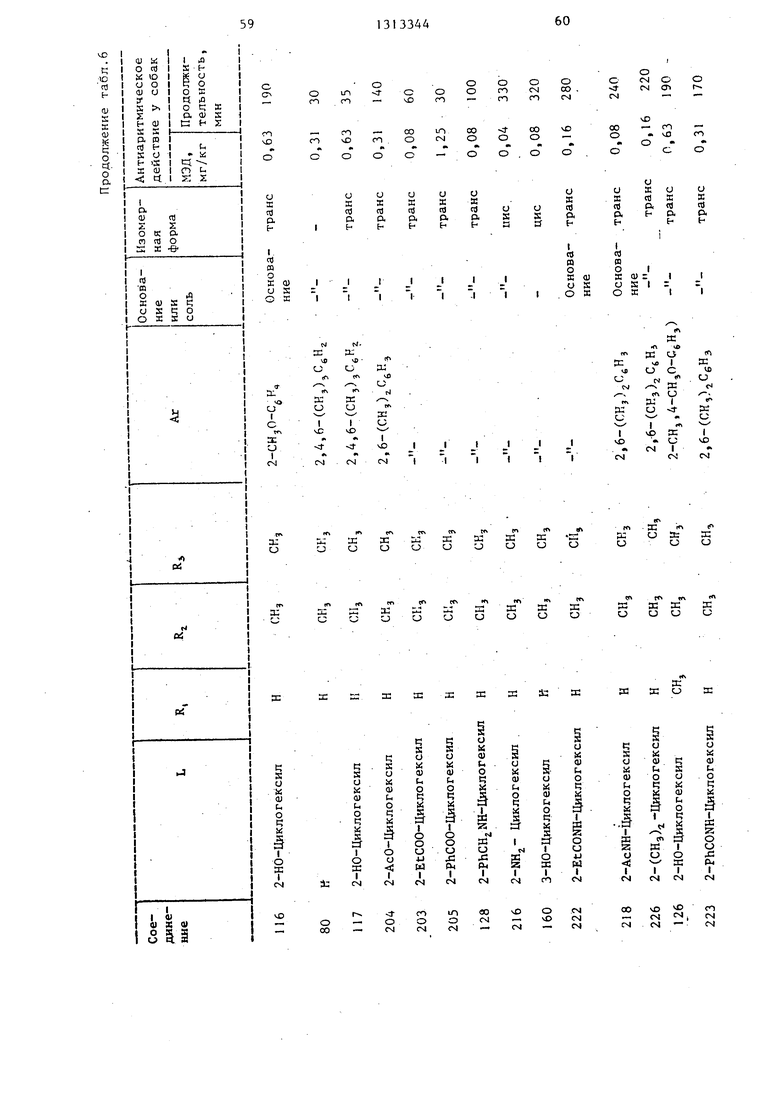

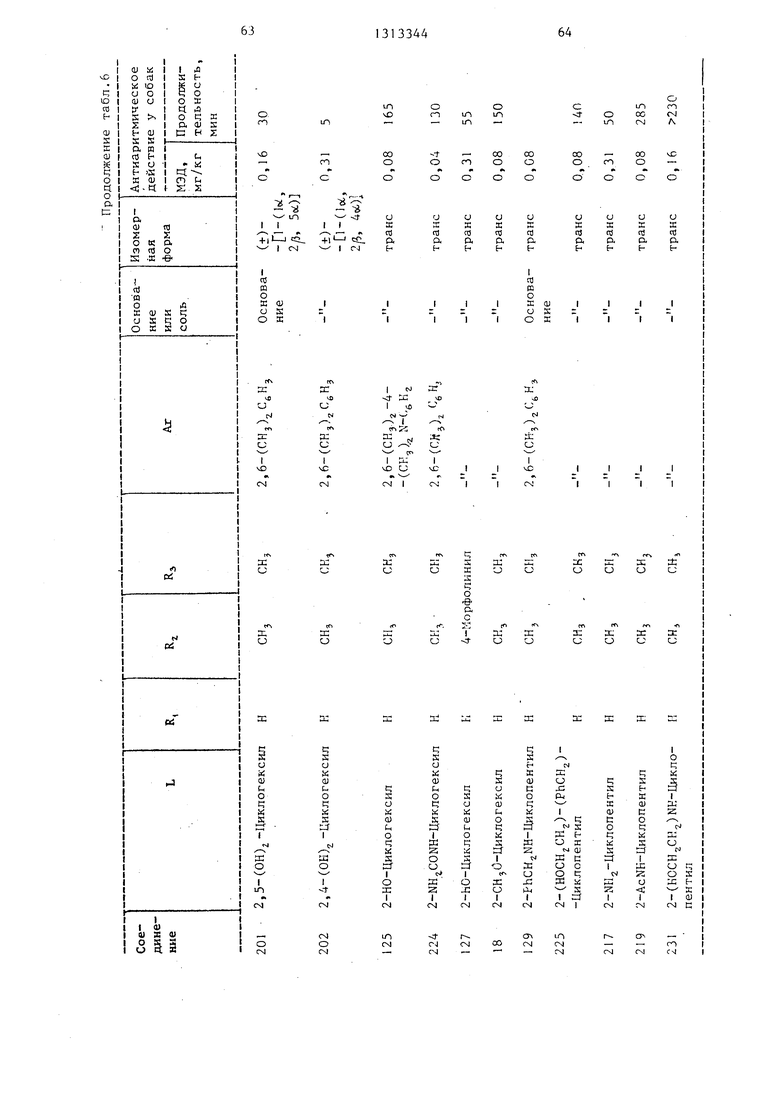
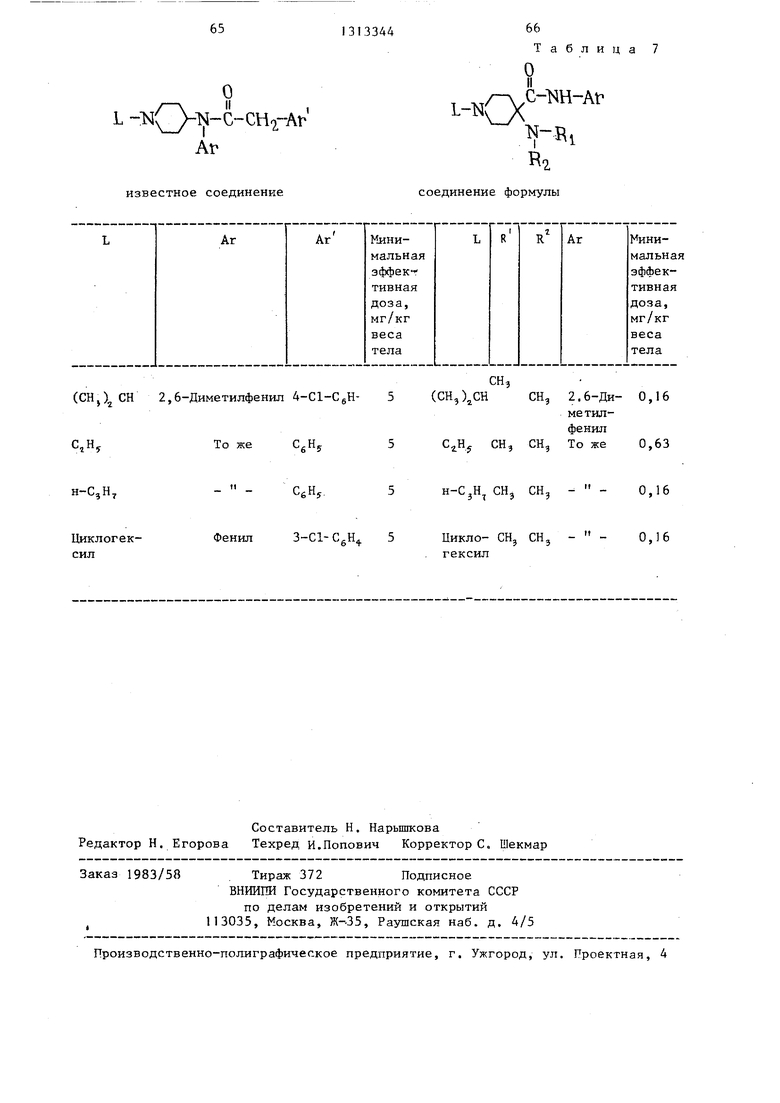
Изобретение касается гетероциклических соединений, в частности N- -арил-о -аминокарбоксамидов общей формулы L - .,-CXY - (О, где X ,; Y -C(0)NR,Ar: m n 1, 2 или 3, причем когда m + + п 4, то один из Н в может быть замещен низшим алкилом или низшим алкоксилом; R, - Н; низший алкил; R2 - Н, низший алкил, С(0)СН, или CHjCgHg; Кз - Н, низший алкил или R и R- вместе с азотом морфолинил; Аг - фенил, не- или замещенный моно-2-низ- шим алкоксилом или 3-трифторметилом, ди-низшим алкилом, низшим алкоксилом или галогеном или тринизшим алкилом, гидроксилом, низшим алкоксилом, галогеном или ди(низший алкил) аминогруппой, причем в случае тризамеще- ния один из радикалов должен быть низшим алкилом; L - а) Н; б)(ОН)() низший алкил; не- или в)замешенный фенилом, циклопропилом, циклопентилом, гидроксилом, низшим алкоксилом, феноксилом, фенилкарбо- нилом, пиперидинилкарбонилом, низшим алкоксикарбонилом, аминокарбонилом, CN, KHj, ди(низшим алкил)амином, фе- ниламином, дибензиламином, (2,6-ди- метил)аминокарбонилом, (2-оксицикло- гексил)аминокарбонилом, (2-оксицик- логексил)аминокарбонилом, (2-окси- циклогексил)амином, 1-пиперидинилом; г) СН5.3-СбИ,-СИ-СИ . . циклопентил, не- или замещенный во 2-м положении ОИ, NH, C(0)NH, бен- зиламином, (гидрокси-низший-алкил) амином, (бензил)(гидрокси-низшим-алкил) амином, (низшим-алкилоксикарбонил низшим алкилом; циклогексил, не- или дизамещенный низшим алкилом, (ди- -низшим алкиламино)низшим алкилом, группа -ОКд , при R4 Н низший алкил, бензил; группа -0-C(0)Rj, при Rj - низший алкил, СбН5СИ(СГз)ОСН,; группа -N(Rg), при Вь - низший алкил; группа -ШШу, при R - Н, низший алкил, НИ31ЧИЙ алкилсульфонил, бензил; группа -NHC(o)Bg, при R - низший алкил, 1Ш, низший алкоксшт; д) группа -C(O)R , при R - низший аи- кил, низший алкоксил, бензилоксил, 3,4,5-(СНjO)-СбНг или циклогексил; е) группа. )-СН -СИ2- (R,J )-(iHj,, при R,Q - и, низший алкил, низший алкилоксикарбонил; В„ - И, ОН или низший алкоксил; ж) радикал -CHjC(OH)(R,j )CH.R, , при R,2 - СИ,,0, CjFyCH OCH,; ОН, 4-галоген-СбН40, NHj, ди-низший-алкиламин, CglJyCH tiJlf) (C,HyCH)iNi,R,, - Н, низший алкил; i СУ) оо САЭ СО 4 СМ




| Вейганд-Хильгетаг Методы эксперимента в органической химии | |||
| М.: Химия, 1968, с | |||
| Автоматический прибор для регистрирования числа замыканий | 1922 |
|
SU454A1 |
Авторы
Даты
1987-05-23—Публикация
1984-04-10—Подача