Изобретение относится к ветеринарной микробиологии и может быть использовано для специфической профилактики хламидиозной инфекции крупного рогатого скота.
Хламидиоз крупного рогатого скота инфекционная болезнь, которая проявляется преимущественно абортами у коров и нетелей преждевременным рождением слабых и нежизнеспособных телят, воспалительными явлениями органов генитальной системы у коров и быков-производителей и заболеваемостью молодняка крупного рогатого скота гастроэнтеритом, пневмонией, полиартритом, менингоэнцефалитом и другими синдромами. Хламидиоз крупного рогатого скота в последние годы получил широкое распространение в животноводческих комплексах и племпредприятиях страны.
Для хламидиозной инфекции в целом характерна слабая иммунологическая реакция, тенденция к хроническому и латентному течению с сохранением возбудителя в организме даже после острого переболевания и клинического выздоровления [1]
Меры борьбы с хламидиозом крупного рогатого скота как у нас в стране, так и за рубежом до недавнего времени были основаны на применении медикоментозных средств, ветеринарно-санитарных и ограничительных мероприятий.
Недостатком указанной вакцины является низкая эффективность ее для иммунизации крупного рогатого скота против хладиоза из-за существующих между штаммами хламидий антигенных различий. Известно, что существующие между штаммами хламидий антигенные различия значительно влияют на эффективность иммунизации против заболеваний, вызываемых хламидиями (Ata F.A. Storz J. 1973).
Наиболее близким по сущности к предлагаемому изобретению (прототип) является "Вакцина против хламидиоза сельскохозяйственных животных", содержащая в качестве антигена возбудитель хламидиозного аборта, выращенный в желточной оболочке куриных эмбрионов, инактивированный мертиолятом, а в качестве адъюванта служат раствор тригидрооксиметиламинометана и тетраметилдиамина, раствор акриламинда и метилбисакриламида, раствор персульфата аммония и раствор глутарового альдегида [2]
Состав вакцины, взятой в качестве прототипа, следующий, мл:
Антигенная жидкость из 20-40%-ной суспензии желточных мешков, зараженных хламидиями (ЭЛД50 10-6,5-7,0) 8-10
Смесь растворов тригидрооксиметиламинометана (36,3%-ного) с тетраметилдиамином (0,23%-ным) 1-2
Смесь растворов акриламида (30%-ного) и метилбисакриламидом (0,8%-ным) - 3-4
1,4%-ный раствор персульфата аммония 1-2
25% -ный раствор глутарового альдегида до конечной концентрации 0,05% - 0,038
Недостатком известной вакцины является неочищенность от компонентов желточной оболочки куриных эмбрионов исходной биомассы хламидий в качестве которой используют 20-40%-ную суспензию возбудителя хламидиозного аборта коров (штамм "250") и низкая концентрация хламидийного антигена в инактивированной вакцине и как следствие этого слабая иммуногенная активность вакцины необеспечивающая формирование длительного и напряженного иммунитета против хламидиоза крупного рогатого скота.
Целью изобретения является разработка противохламидиозной вакцины, обеспечивающей повышение напряженности и длительности иммунитета за счет щадящей инактивации возбудителя, очистки, концентрации, адсорбции на алюмокалиевых квасцах и эмульгирования биомассы хламидий в масляно-ланолиновой смеси.
Поставленная цель достигается тем, что возбудитель хламидиозного аборта коров (штамм "250") выращивают одновременно в желточной и хорионаллантоисной оболочках куриных эмбрионов (согласно авт.св. N 1641883 от 15 декабря 1990 г. ), биомассу хламидий инактивируют 0,2%-ным формальдегидом в присутствии 0,1% глутарового альдегида в течение 24 ч, антиген подвергают очистке и концентрированию до 30-40 мкг/мл хламидий дифференциальным центрифугированием, адсорбируют на алюмокалиевых квасцах и эмульгируют в масляно-ланолиновой смеси при следующих соотношениях компонентов мас.
Антиген из штамма Chlamydia psittaci "250" 45-50
Масло-ланолиновый адъювант 45-50
Формальдегид 0,04-0,06
Сопоставительный анализ с прототипом позволяет сделать вывод, что предлагаемая вакцина против хламидиоза крупного рогатого скота отличается от известной новым способом выращивания специфического хламидийного антигена одновременно в желточной и аллантоисной оболочках куриного эмбриона, новым ускоренным способом инактивации хламидий путем комбинированного воздействия на возбудителя формальдегидом (0,2% ) в присутствии глутарового альдегида (0,1%), очисткой биомассы от компонентов куриных эмбрионов, концентрацией до 30-40 мк/мл специфического хламидийного антигена и введением в состав вакцин новых компонентов, а именно: алюмокалиевых квасцов, минерального масла (ПЭС-3) и в качестве консерванта формальдегида. Таким образом предлагаемое техническое решение соответствует критерию "новизна". Анализ составов известных вакцин против хламидиоза сельскохозяйственных животных (авт.св. N N 826744, 690128) показал, что некоторые введенные в предлагаемом решении вещества известны, например, возбудитель хламидиозного аборта коров (штамм "250"), масляный адъювант. Однако их применение в этих препаратах в сочетании с другими компонентами не обеспечивает вакцинам такие свойства, которые они проявляют в предложенном решении, а именно: значительное усилие иммуногенных свойств и, как следствие повышение напряженности и длительности противохламидийного иммунитета у вакцинированного крупного рогатого скота. Таким образом, данный состав компонентов придает вакцине новые свойства, что позволяет сделать вывод о соответствии предлагаемого решения критерию "существенные отличия".
В качестве антигена в вакцине используют штамм (Chlamydia psittaci "250" возбудитель хламидиозного аборта коров. Штамм выделен от абортированного плода коровы и депонирован в коллекции микроорганизмов Всесоюзного государственного научно-контрольного института ветеринарных препаратов под номером 5 от 3 октября 1990 г.
Штамм Chlamydia psittaci "250" обладает следующими свойствами:
Морфологические признаки. Культура штамма представляет собой мелкие элементарные тельца хламидий, имеющие сферическую форму размером 200-400 нм. которые хорошо воспринимают карбол-фуксин Циля в разведении 1:5 и окрашиваются по модифицированному методу Стемп в ярко-красный цвет.
Культуральные свойства. Штамм хламидий "250" хорошо культивируется в желточной оболочке 6-7 суточных и аллантоисной оболочке 8-9-суточный развивающихся куриных эмбрионов. Специфическая гибель куриных эмбрионов, инфицированных в желточную полость, отмечается на 5-9 сутки после заражения; возбудитель накапливается при этом в титре 106,5-10-7,5ЭЛД50 в 0,3 мл.
Патогенные свойства. Штамм хламидий "250" обладает токсичностью и высокой вирулентностью для лабораторных и восприимчивых животных. При внутрибрюшинном и интраназальном заражении белых мышей и морских свинок в дозе соответственно 0,5 и 1 мл 10%-й свежеполученной суспензией инфицированных желточных оболочек, вызывает заболевание и гибель животных на 4-16 сутки после введения материала. У нетелей после внутреннего заражения в дозе 8 мл 10-7,5ЭЛД50 в 0,3 мл штамм обусловливает аборты и рождения слаборазвитого приплода на 20-60 сутки после инфицирования.
Иммуногенные свойства. Использование в качестве антигена биомассы, приготовленной из штамма Chlamydia psittaci "250" в инактивированной адсорбированно-эмульгированной вакцине обеспечивает формирование у 100% привитых животных напряженного и длительного иммунитета.
В экспериментальных опытах при двукратной иммунизации нетелей вакцина предохраняла 100% животных от развития хламидиозной инфекции и абортов после искусственного заражения их вирулентным штаммом возбудителя хламидиозного аборта коров.
Использование вакцины в полевых опытах в неблагополучных по хламидиозу хозяйствах существенно уменьшает количество абортов и мертворождений у коров и нетелей, снижает заболеваемость и гибель телят от хламидиозной инфекции и тем самым в 4-5 раз сокращает потери молодняка крупного рогатого скота и уменьшает напряженность эпизоотической ситуации по хламидийным инфекциям.
Для экспериментальной проверки предлагаемой вакцины, ее готовят следующим образом. Куриные эмбрионы 7-дневного возраста заражают в желточную полость суспензией свежепассированного штамма хламидий "250" возбудителя хламидиозного аборта коров, разведенной до 10-4 в дозе 0,3 мл. Инфицированные эмбрионы инкубируют при 37-38oC в течение двух дней, затем проводят овоскопию, отбирают и уничтожают павших (неспецифическая гибель), а живые эмбрионы заражают повторно в аллантоисную полость суспензий штамма "250", разведенной до 10-3 в дозе 0,3 мл. Далее зараженные эмбрионы инкубируют при 37-38oC в течение 7-8 дней. Специфическая гибель 90-95% инфицированных эмбрионов происходит на 6-9 дни после первичного заражения. Павшие эмбрионы охлаждают и вскрывают. От каждого эмбриона отсасывают 4-4,5 мл хламидосодержащей аллантоисной жидкости и отбирают 1-2 г хорионаллантоисной и желточной оболочек вместе с сопутствующим желтком.
Хламидосодержащий материал до использования хранят в замороженном при минус 20-30oC состоянии. Аллантоисную жидкость перед заморозкой осветляют центрифугированием при 3 тыс. об/мин в течение 30 мин.
Для получения полуфабриката вакцины из хламидиосодержащего материала готовят 10%-ю исходную суспензию на фосфатно-буферном физиологическом растворе (ФБР) pH 7,2-7,4 следующим образом: хламидиосодержащие оболочки взвешивают подвергают термолизису путем трехкратного замораживания и оттаивания, и суспензируют до 20% -й концентрации на коллоидной мельнице добавив расчетное количество ФБР. Суспензию центрифугируют при 3000 об/мин в течение 30 мин и отсасывают средний слой центрифугата взвесь хламидий. Осадок тканей и верхний желточный слой повторно гомогенизируют в таком же количестве ФБР, центрифугируют в тех же условиях и снова отсасывают суспензию хламидий.
Замороженную хламидиосодержащую аллантоисную жидкость размораживают по возможности быстро в водяной бане при температуре 37oC интенсивно встряхивая флакон с целью предотвращения образования крупных хлопьев. Размороженную слегка опалесцирующую аллантоисную жидкость разводят в соотношении 1:1 с ФБР.
Хламидиосодержащие суспензии инфицированных оболочек и аллантоисной жидкости объединяют в соотношении 1:1 и добавляют сначала глутаровый альдегид в конечной концентрации 0,1% затем через 30 минут, формальдегид в конечной концентрации 0,2% Суспензию после добавления реагентов перемешивают и выдерживают в течение 24 ч при температуре плюс 20-24o (комнатная температура) для инактивации хламидий.
Хламидии из инактивированной суспензии осаждают путем центрифугирования ее при 18-20 тыс. об/мин в течение 60 мин. Надосадочную жидкость вместе с верхним желточным слоем удаляют, осадок элементарных телец хламидий взвешивают и ресуспендируют в соотношении 1:10 с ФБР, содержащим 0,1% формальдегида.
Стандартизацию суспензии по содержанию элементарных телец хламидий осуществляют путем определения ее оптической плотности. Для этого из приготовленной взвеси хламидий готовят разведение 1:10 (к 0,5 мл взвеси добавляют 4,5 мл ФБР) и измеряют коэффициент поглощения на ФЭК 56М при длине волны 540 нм в кюветах с рабочей длиной 10 мм. Оптимальным для получения иммуногенной вакцины является коэффициент поглощения, равный 2,4-2,6 единиц, что соответствует содержанию 30-40 мкг антигена в одном мл суспензии.
Стандартизованную взвесь хламидий пропускают через коллоидную мельницу, добавляют алюмо-калиевые квасцы в конечной концентрации 0,5% и снова гомогенизируют в течение 5 мин, затем взвесь сливают в стеклянные баллоны и помещают в рефрижератор при 4-6oC на 1-2 суток. В этих условиях хламидии адсорбируются на алюмокалиевых квасцах и осаждаются в виде хлопьев. Надосадочную жидкость осторожно отсасывают и удаляют, а осадок ресуспендируют до исходного объема фосфатно-буферным раствором, содержащим 0,1% формальдегида. Процедуру отмывки хламидий от избытка алюмо-калиевых квасцов повторяют 2-3 раза. Полученный полуфабрикат вакцины с консервантом хранят до использования в рефрижераторе при 4-6oC.
Пример 1. Для изготовления 1 л вакцины берут 500 мл инактивированного антигена Chlamydia psittaci "250", содержащего 30 мкг/мл хламидий адсорбированных на алюмо-калиевых квасцах с 0,08% формальдегида. Добавляют 500 мл стерильной масло-ланолиновой смеси в соотношении 84:16. Пропускают через коллоидную мельницу и расфасовывают в стерильные флаконы по 100 мл. Средний арифметический титр комплементсвязывающих антител в сыворотке крови вакцинированных морских свинок составляет не ниже 1:20.
Пример 2. Для изготовления 1 л вакцины берут 450 мл инактивированного антигена Chlamydia psittaci "250", содержащего 40 мкг/мл хламидий адсорбированных на алюмо-калиевых квасцах с 0,12% формальдегида. Добавляют 550 мл стерильной масло-ланолиновой смеси в соотношении 85:15. Пропускают через коллоидную мельницу и расфасовывают в стерильные флаконы по 100 мл. Средний арифметический титр комплементсвязывающих антител в сыворотке крови вакцинированных морских свинок составляет не ниже 1:20.
При изменении минимума и максимума в соотношениях компонентов при изготовлении вакцины происходит расслоение эмульсии на водную и масляную фракции, что снижает иммуногенность эмульсионной вакцины.
Контроль вакцины на стерильность, стойкость эмульсии и безвредность проводится по общепринятым методам. Контроль иммуногенности проводят на морских свинках. Животных вакцинируют в дозе 0,5 мл подкожно в области лопатки справа и слева (по 0,25 мл). Вакцинация способствует выработке специфических хламидийных комплементсвязывающих антител на 30-35 день в титрах 1:5 1:80 (средний арифметический титр не ниже 1:20).
Вакцину применяют с профилактической целью в хозяйствах и племпредприятиях неблагополучных или угрожаемых по хламидиозу крупного рогатого скота. Вакцинируют все серонегативное поголовье крупного рогатого скота однократно один раз в год с трехмесячного возраста. Телок случного возраста и коров вакцинируют за 20-25 дней до осеменения или случки. Больных хламидиозом животных перед вакцинацией подвергают лечению с использованием антибиотиков тетрациклинового ряда и вакцинируют после выздоровления.
Вакцину вводят крупному рогатому скоту в асептических условиях подкожно в область подгрудка или верхней трети шеи из расчета не более 1,5 мл в одно место в следующих дозах: 1 мл телятам в возрасте от 3 до 6 месяцев; 2 мл телятам в возрасте от 6 до 12 месяцев; 3 мл телятам старше года, коровам и быкам-производителям.
У вакцинированных животных на месте введения вакцины образуется уплотнение размером до 3х4 см, которое постепенно рассасывается в течение 4-8 месяцев. Иммунитет у привитых животных создается через 30 сут. после вакцинации и сохраняется в течение 12 месяцев. Срок годности вакцины 1,5 года.
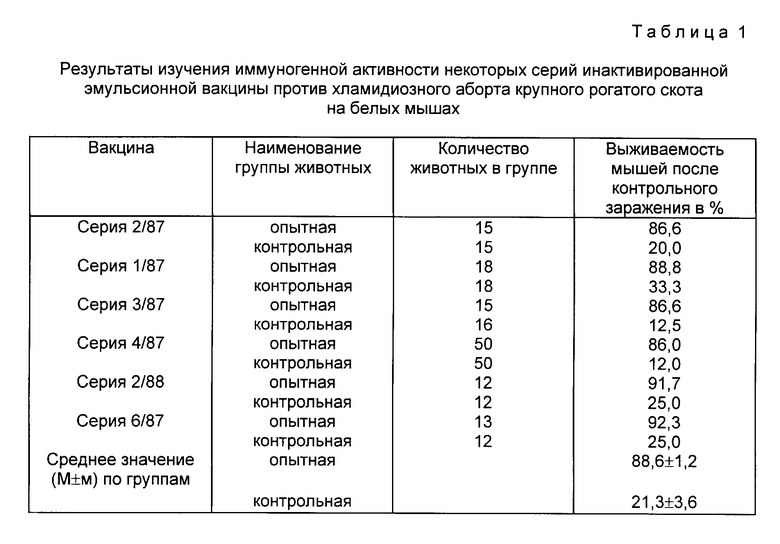
Проведены испытания 6 экспериментальных и 3 опытно-промышленных серий инактивированной эмульсионной вакцины против хламидиоза крупного рогатого скота на антигенную и иммуногенную активность.
Экспериментальные серии вакцины были испытаны в опытах на лабораторных животных и нетелях. Белых мышей массой 16-18 г вакцинировали двукратно подкожно с интервалом 7 дней в дозе 0,1-0,15 мл. Через 21-28 дней после вакцинации мышей заражали возбудителем хламидиозного аборта коров (штамм "250") внутрибрюшинно в дозе 0,3-0,5 мл 10%-й взвесью возбудителя. Одновременно с иммунизированными мышами инфицировали интактных (контрольных) мышей аналогичного возраста. Результаты проведенных шести серий опытов (табл. 1) показали, что выживаемость предварительно вакцинированных мышей после контрольного заражения вирулентной культурой хламидий колебалась в пределах 86-92,3% (88,6±1,2% ). При этом в контрольной группе отмечалась гибель от 66,7 до 88% мышей (78,7% ). Следовательно, вакцина обладает высокой иммуногенностью и обеспечивает устойчивость вакцинированных мышей к искусственному заражению вирулентной культурой хламидий.
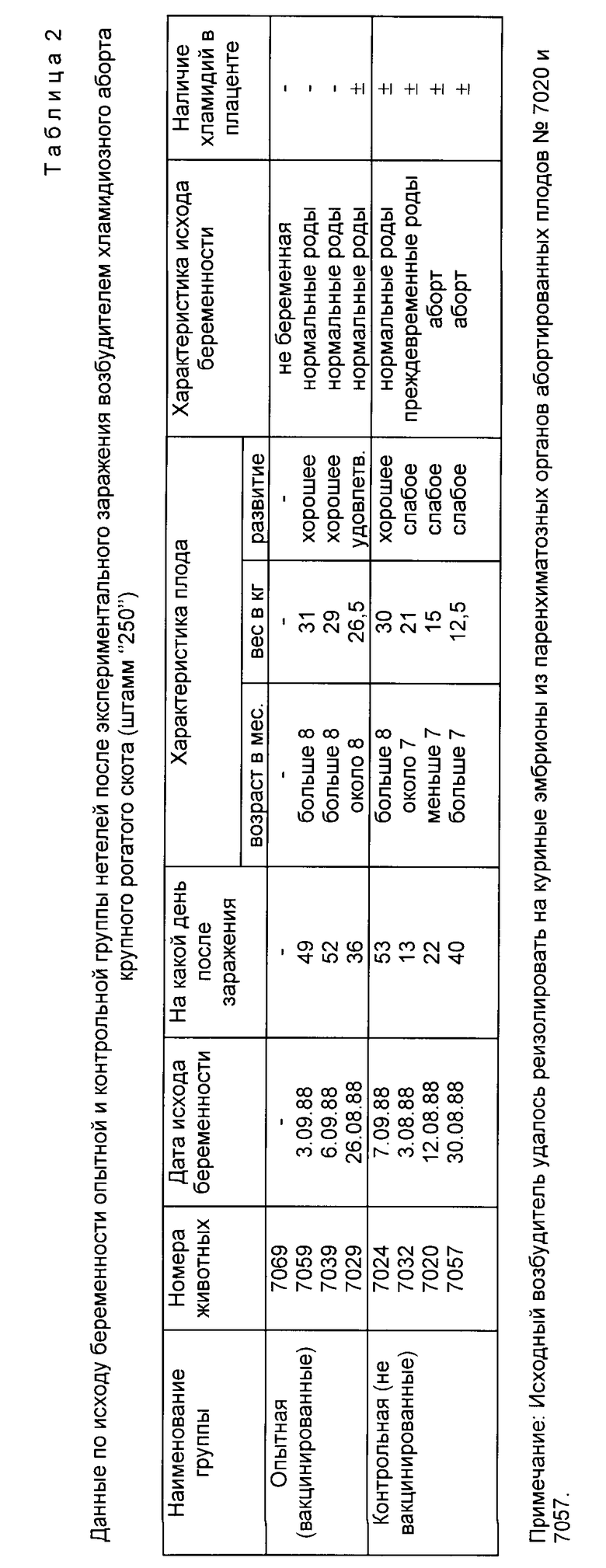
В опытах на нетелях в экспериментальных условиях было установлено, что двукратное подкожное введение вакцины в дозе по 1,5 мл нетелям предохраняет их от развития хламидиозного аборта крупного рогатого скота после контрольного заражения вирулентным штаммом хламидий "250" (табл. 2).
В условиях Херсонской биофабрики согласно разработанной нами технологии было изготовлено 3 опытно-промышленные серии вакцины против хламидиоза крупного рогатого скота. Производственный контроль стерильности, безвредности и иммуногенной активности, их приемку, а также заключение о промышленном производстве было сделано согласно приказу ГУВ СССР N 57 от 5.06.90 г. При этом было установлено, что все три изготовленные опытно-промышленные серии вакцины являются стерильными, безвредными и иммуногенными препаратами (Акт Херсонской биофабрики от 24 мая 1990 г.).
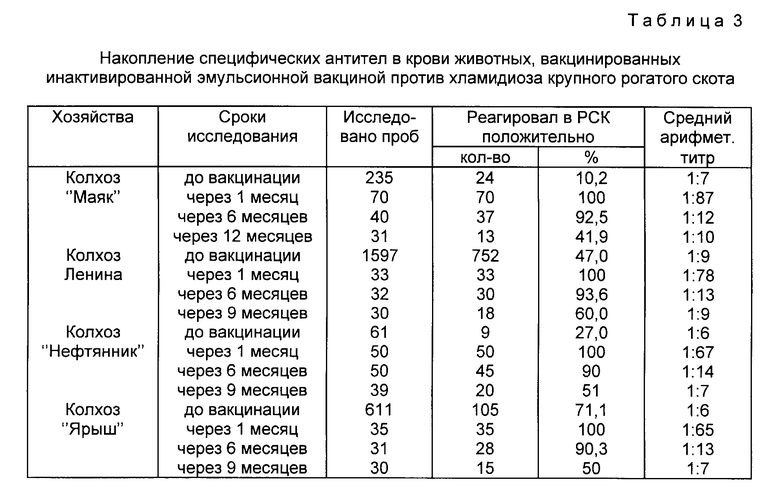
Производственные испытания вакцины, изготовленной на Херсонской биофабрике, проводили в девяти неблагополучных по хламидиозу хозяйствах ТССР и Владимирской области. При этом было вакцинировано 6862 гол. крупного рогатого скота, в том числе 3715 коров, 79 быков-производителей и 3068 телят и телок случного возраста. Результаты испытания вакцины в полевых условиях обобщены в табл. 3 и 4. Из приведенных в табл. 3 данных видно, что через месяц после вакцинации у 100% вакцинированных животных выявлена серопозитивность в РСК к хламидийному антигену. Средний арифметический титр специфических хламидийных антител при этом колебался в пределах 1:65 1:87. Через 6 месяцев положительно на хламидиоз по РСК реагировали от 90 до 93,6% вакцинированных животных со средним арифметическим титром 1:12 1:14. Через 12 месяцев серопозитивность к хламидиозному антигену сохранилась у 50-60% крупного рогатого скота со средним комплементсвязывающих антител 1:7 1:10.
Таким образом вакцинация животных обусловливает их серопозитивность к хламидиозному антигену. Максимальный уровень антител (титры 1:10 1:160) формируется через 30-35 дней после вакцинации и сохраняется на высоком уровне у 90-93,6% животных в течение 6 месяцев; затем происходит постепенное снижение уровня серопозитивности к 12 месяцам после иммунизации.
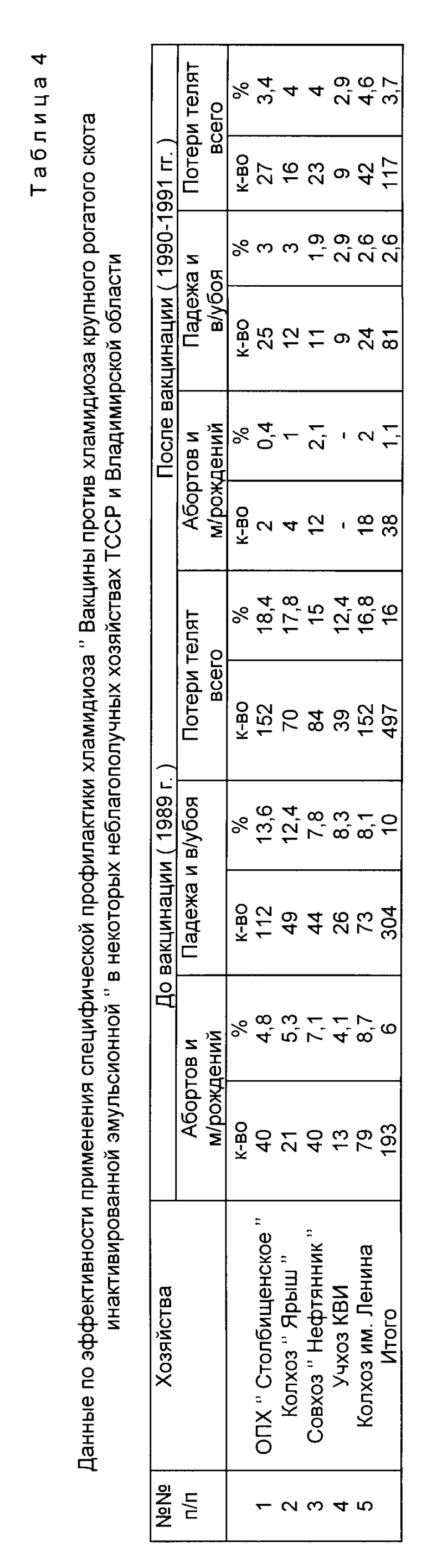
Оценку эффективности вакцинации крупного рогатого скота в полевых условиях проводили сравнивая количество абортов и мертворождений среди коров и нетелей, а также количества падежа и вынужденного убоя телят в неблагополучных хозяйствах до вакцинации (1989 г.) и после вакцинации (1990, 1991 гг. ). Из приведенных в табл. 4 данных видно, что количество абортов и мертворождений в пяти хозяйствах до вакцинации составили в среднем 6% падеж и вынужденный убой 10% Общие потери молодняка составили в среднем 16% После применения вакцины количество абортов и мертворождений в этих же хозяйствах уменьшилось в 5,4 раза и составило лишь 1,1% Одновременно в 3,7 раза сократилась заболеваемость и вынужденный убой телят от хламидиозной инфекции. Общие потери молодняка после вакцинации составили 3,7% что в 4,2 раза меньше, чем до применения вакцины в этих хозяйствах. Следовательно, вакцина в условиях неблагополучного по хламидиозу крупного рогатого скота хозяйства до минимума сокращает количество абортов и мертворождаемости, значительно уменьшает заболеваемость и гибель телят от хламидиозной инфекции, улучшает эпизоотическую обстановку по хламидиозу и таким образом обеспечивает повышение продуктивности животных.
Ввиду того, что предлагаемое изобретение обладает признаками патентоспособности вакцина для специфической профилактики хламидиоза крупного рогатого скота может быть представлена для загранпатентования.
Внедрение вакцины в ветеринарную практику позволит животноводческим хозяйствам предотвратить экономические потери, обусловленные недополучением до 20% телят за счет абортов, мертворождений у коров и нетелей, падежа и вынужденного убоя телят, а также стабилизации привесов на откорме животных и сохранение уровня удоя молока лактирующими коровами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ДЛЯ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ХЛАМИДИОЗА СВИНЕЙ | 2002 |
|
RU2247577C2 |
| ВАКЦИНА ДЛЯ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ХЛАМИДИОЗА КРУПНОГО И МЕЛКОГО РОГАТОГО СКОТА | 2005 |
|
RU2301682C1 |
| ВАКЦИНА КУЛЬТУРАЛЬНАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ ХЛАМИДИОЗА КРУПНОГО И МЕЛКОГО РОГАТОГО СКОТА | 2002 |
|
RU2233174C2 |
| Способ получения биомассы хламидий | 1988 |
|
SU1641883A1 |
| АССОЦИИРОВАННАЯ ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ХЛАМИДИОЗА, КАМПИЛОБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА И ЛЕПТОСПИРОЗА МЕЛКОГО РОГАТОГО СКОТА | 1994 |
|
RU2086259C1 |
| Вакцинная композиция для профилактики энзоотического аборта у овец | 2023 |
|
RU2802251C1 |
| Штамм Chlamydia abortus "Chlamydia VNITIBP-21" для производства иммунобиологических лекарственных препаратов | 2022 |
|
RU2798283C1 |
| ВАКЦИНА КУЛЬТУРАЛЬНАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ ХЛАМИДИОЗА СВИНЕЙ | 2002 |
|
RU2233670C2 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS. MUSCULUS L., ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К CHLAMYDIA | 1998 |
|
RU2158760C2 |
| ШТАММ CHLAMYDIA PSITTACI, ИСПОЛЬЗУЕМЫЙ ДЛЯ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ ХЛАМИДИОЗА КОШЕК И ПУШНЫХ ЗВЕРЕЙ | 1997 |
|
RU2122579C1 |
Использование: ветеринарная микробиология, специфическая профилактика хламидиозной инфекции крупного рогатого скота, вакцина. Сущность изобретения: вакцина содержит инактивированный формальдегидом в присутствии глутарового альдегида, очищенный антиген из штамма Chlamydia psittaci "250" - возбудителя аборта коров, выращенный одновременно в желточный и аллантоисной оболочках куриных эмбрионов, с концентрацией 15-20 мкг/мл, адсорбированный на алюмокалиевых квасцах и эмульгированный в маслоланолиновой смеси. Использование вакцины уменьшает количество абортов и мертворождений у коров и нетелей, снижает заболеваемость и гибель телят от хламидиозной инфекции. 4 табл.
Вакцина для специфической профилактики хламидиоза крупного рогатого скота, содержащая инактивированный антиген Chlamydia psittaci, адъювант и консервант, отличающаяся тем, что содержит инактивированный и очищенный хламидийный антиген из штамма Chlamydia psittaci "250" возбудителя аборта коров в концентрации 15 20 мг/мл, адсорбированный на алюмокалиевых квасцах и эмульгированный в масляно-ланолиновом адъюванте, а в качестве консерванта - формальдегид при следующих соотношениях компонентов, мас.
Инактивированный и очищенный хламидийный антиген из штамма Chlamydia psittaci "250" возбудителя аборта коров 45 50
Алюмокалиевые квасцы 0,2 0,3
Масляно-ланолиновый адъювант 45 55
Формальдегид 0,04 0,06о
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Хламидиозы сельскохозяйственных животных / Под ред | |||
| Н.З.Хазипова и А.З.Равилова | |||
| - М.: Колос, 1984 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1997-10-10—Публикация
1991-10-29—Подача