Изобретение относится к области ветеринарной микробиологии и биотехнологии, в частности к производству вакцины для специфической профилактики хламидиоза свиней, этиологическим агентом которого являются хламидии вида Chlamydia psittaci.
Хламидиоз свиней - инфекционная болезнь, протекающая в виде абортов, бронхопневмоний, уретритов, полиартритов, энцефаломиелитов и других синдромов. Хламидиоз свиней в последние годы получил широкое распространение в свиноводческих хозяйствах страны (Г.П.Щербань и др., Г.Д.Фирсова, Т.Г.Воскресенская. Хламидиоз свиней. //Ж. Ветеринария. - 1978. - №8. - С.55-58; В.А.Бортничук. Хламидиоз свиней// Киев: Урожай, 1991; С.И.Прудников, П.И.Митрофанов, Т.М.Прудникова. Хламидиоз свиней // Хрон. инф. животных. - М.: Колос, 1984. - С.71-76). Для хламидиозной инфекции в целом характерна слабая иммунологическая реакция, тенденция к хроническому и латентному течению с сохранением возбудителя в организме даже после острого переболевания и клинического выздоровления (Хламидиозы сельскохозяйственных животных. М.: Колос, 1984. - С.71-76).
Меры борьбы с хламидиозами свиней как у нас в стране, так и за рубежом до недавнего времени были основаны на применении медикаментозных средств, ветеринарно-санитарных и ограничительных мероприятий. Если при хламидиозе овец и крупного рогатого скота разработаны и внедрены эффективные меры борьбы и специфической профилактики, то при хламидиозе свиней эти вопросы находятся в стадии разработки и апробации. В США в 1979 году A.S.Seawell предложил комплексную вакцину для профилактики хламидиоза овец, крупного рогатого скота и свиней. Препарат представляет собой живую эмбрион-вакцину - приготовленную из штамма хламидий пневмонии кошек, безопасного для с.-х. животных (Seawell A.S. Methods of wsing chlamydia vaccine for preventing and treating bovine and diseases, США). При учете эффективности применения живых вакцин исследователи пришли к выводу, что они более перспективны по сравнению с инактивированными препаратами, но в силу обстоятельств эти препараты не нашли широкого применения в ветеринарии, прежде всего это связано с тем, что живые вакцины имели ограниченный срок хранения (Н.З.Хазипов др. Иммунитет и специфическая профилактика // Хламидиозы с.-х. животных. - М.: Колос, - 1984. - С.193-200).
В нашей стране сотрудниками Северо-Кавказского зонального научно-исследовательского ветеринарного института (Г.П.Щербань, Г.Д.Фирсова, Т.Г.Воскресенская) была предложена поливалентная инактивированная вакцина против хламидиозов свиней, в качестве субстрата хламидий авторы использовали культуру куриных фибробластов (Хламидиоз свиней. Ж. Ветеринария. - 1978. - №8. - С.55-58). Согласно сообщению данная вакцина показала высокую эффективность при профилактике хламидиоза у свиней, лошадей и других видов животных.
Известна выпускаемая биологической промышленностью "Инактивированная эмульсин-вакцина против хламидиозного аборта овец" авторы Ю.Д.Караваев, И.И.Налетов (Авторское свидетельство СССР №692128) рекомендовали данную вакцину для специфической профилактики хламидиоза свиней, однако ее применение не привело к ощутимым результатам (Тр. института ВИЭВ. - 1981. - №53. - С.95-102). Для иммунопрофилактики на крупных свиноводческих комплексах позитивно зарекомендовала себя поливалентная вакцина "Плах" (против парвовирусной инфекции, лептоспироза, болезни Ауески и хламидиоза). В настоящее время вакцина еще проходит испытание в свиноводческих хозяйствах страны (В.А.Бортничук. Хламидиозы свиней //Киев: Урожай, 1991. - С.150).
Наиболее близким аналогом по сущности к предлагаемому изобретению (прототип) является “Вакцина против хламидиоза сельскохозяйственных животных”, содержащая в качестве антигена возбудитель хламидиозного аборта крупного рогатого скота, выращенный в желточной оболочке куриных эмбрионов, инактивированный мертиолятом, а в качестве адъюванта служат раствор тригидрооксиметиламинометана и тетраметилдиамина, раствор акриламинда и метилбисакриламида, раствор персульфата аммония и раствор глутарового альдегида (см. Авт. свид. №826744 “Вакцина против хламидиоза сельскохозяйственных животных”, кл. С 12 N 5/00 за 1984 г.).
Состав вакцины, взятый в качестве прототипа, следующий, мл:
Антигенная жидкость 20-40%-ной суспензии желточных мешков, зараженных хламидиями (ЭЛД 50 10-6,5-7,0) 8-10
Смесь растворов тригидрооксиметиламинометана (0,23%-ным) 1-2
Смесь растворов акриламида (30%-ного) и метилбисакриламида (0,8%-ного) 3-4
1,4%-ный раствор персульфата аммония 1-2
25%-ный раствор глутарового альдегида до конечной концентрации 0,05 0,038
Недостатком известной вакцины является невысокая эффективность ее против хламидиоза свиней из-за существующих антигенных различий между штаммами хламидий крупного рогатого скота и свиней, а также неочищенность от компонентов желточной оболочки куриных эмбрионов исходной биомассы хламидий, в качестве которой используют 20-40%-ную суспензию возбудителя хламидиозного аборта коров (штамм “250”) и, как следствие этого, слабая иммуногенная активность вакцины, не обеспечивающая формирования длительного и напряженного иммунитета против хламидиоза свиней. Внутри вида Chl. psittaci, изолированного от свиней, штаммы отличаются между собой по биохимическим свойствам, антигенной структуре, а также вирулентностью по отношению к экспериментальным и естественным организмам. Это дает основание утверждать о существовании внутри вида Chl. psittaci серотипов и даже вариантов. Установлено, что штаммы, выделенные от свиней при аборте и бронхопневмонии, имеют существенные антигенные различия, которые необходимо учитывать при конструировании противохламидиозных вакцин. Но некоторые исследователи, исходя из наличия в составе всех хламидий общегруппового термостабильного комплементсвязывающего антигена, высказываются о возможности создания единой вакцины, обеспечивающей защиту от хламидиозов животных всех видов (В.А.Бортничук. Хламидиозы свиней // Киев: Урожай, 1991. - С.152).
Поэтому проблема создания эффективной вакцины против хламидиоза свиней продолжает оставаться актуальной.
Задачей изобретения является получение вакцины, обладающей высокой иммуногенной активностью и широким спектром антигенности при различных клинических формах заболевания свиней.
Сущность изобретения заключается в получении инактивированной вакцины против хламидиоза свиней, содержащей два очищенных антигена из штаммов хламидий вида Chlamydia psittaci: "PC-85" - возбудителя хламидиозного аборта свиней и "ЛС-87" - возбудителя хламидиозной пневмонии свиней, выращенные одновременно в желточной и аллантоисной оболочках куриных эмбрионов, с концентрацией 10-15 мг/мл, адсорбированных на алюмокалиевых квасцах и эмульгированных в масляно-ланолиновом адъюванте, с содержанием 0,1% глутарового альдегида, при следующем соотношении компонентов, об.%:
1. Инактивированные хламидийные антигены из штаммов вида Chl. psittaci, выделенные от свиней.
"PC-85" с титром ЭЛД5010-5,5-10-7,7 в 0,3 мм 24-25
"ЛС-87" с титром ЭЛД50 10-6,5-10-7,7 в 0,3 мм 24-25
2. Масляно-ланолиновый адъювант 48-49
3. Алюмокалиевые квасцы 0,4-0,5
10% раствор глутарового альдегида 0,1-0,15
Входящие в вакцину штаммы хламидий "ЛС-87" и "PC-85" изысканы и являются производственными.
Штамм "ЛС-87" возбудитель хламидиозной пневмонии свиней выделен в 1987 году из легких свиней, отнесен к порядку Chlamydiales, сем. Chlamydiасеае, роду Chlamydia, вида Chlamydia psittaci. Штамму возбудителя хламидиозной пневмонии свиней присвоен регистрационный номер ЛС-87 ДЕП во Всероссийской государственной коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве (123022, г. Москва, Звенигородское шоссе, 5, ВГНКИ). Штамм депонирован 26 апреля 2000 г.
Штамм "PC-85" возбудитель хламидиозного аборта свиней выделен в 1986 г. от абортированного плода свиньи, отнесен к порядку Chlamydiales, сем. Chlamydiaceae, роду Chlamydia, вида Chlamydia psittaci. Штамму возбудителя хламидиозного аборта свиней присвоен регистрационный номер PC-87 ДЕП во Всероссийской государственной коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве (123022, г.Москва, Звенигородское шоссе, 5, ВГНКИ). Штамм депонирован 26 апреля 2000 г.
Штамм "ЛС-87" обладает следующими свойствами:
Морфологические признаки. Культура штамма представляет собой мелкие элементарные тельца хламидий, имеющие сферическую форму размером 200-400 нм, которые хорошо воспринимают карбол-фуксин Циля в разведении 1:5 и окрашиваются по модифицированному методу Стемпа в ярко-красный цвет.
Культуральные свойства. Штамм хламидий "ЛС-87" хорошо культивируются в желточной оболочке 6-7-суточных и аллантоисной оболочке 8-9-суточных развивающихся куриных эмбрионов.
Специфическая гибель куриных эмбрионов, инфицированных в желточную полость, отмечается на 5-9-сутки после заражения; при этом возбудитель накапливается в титре 10-5,25-10-6,5 ЭЛД50 в 0,3 мл.
Патогенные свойства. Штамм хламидий "ЛС-87" обладает высокой вирулентностью для лабораторных и восприимчивых животных. При заражении белых мышей и морских свинок интраназально, подкожно и внутрибрюшинно 10%-ной свежеполученной хламидиосодержащей взвесью отмечается 100% заболевание и гибель 31-73% мышей. Морские свинки переболевают, при и/н заражении гибнет около 25% животных. У свиней штамм хламидий "ЛС-87" вызывает пневмонию, рождение мертвых поросят после внутривенного заражения в дозе 5 мл 10-6,5 ЭЛД50 в 0,3 мл.
Антигенные свойства. Оценка антигенных свойств штамма проводилась в РСК, ИФА путем перекрестных исследований антигена, изготовленных из хламидий штамма "ЛС-87" согласно "Инструкции по изготовлению и контролю набора антигенов и сывороток для серологической диагностики хламидиозов с.-х. животных", утв. ГУВ Госагропрома СССР в 1988 году с иммунной сывороткой овцы, полученной гипериммунизацией данным штаммом, а также стандартных диагностикумов, изготовленных в условиях лаборатории вирусологии ВНИВИ из штаммов "Ростиново-70" возбудителя хламидиоза овец, штамма орнитоза "Лори", штамма "PC-85" - возбудителя хламидиозного аборта свиней и штамма "ЛС-87" - возбудителя хламидиозной пневмонии свиней (см. таблицу 1).
Изучение антигенных свойств штамма хламидий "ЛС-87"
Приведенные в таблице 1 данные свидетельствуют о принадлежности штамма "ЛС-87" к хламидиям, антигенно отличающимся от штамма "PC-85", гипериммунные сыворотки и антигены из штамма "PC-85" реагируют с антигеном и сыворотками штамма "ЛС-87" в титрах 1:40, т.е. на два порядка ниже, чем с гомологичным 1:160.
Таким образом, штаммы "ЛС-87" и "PC-85" обладают отличительными антигенными свойствами.
Иммуногенные свойства. Изготовленный из штамма "ЛС-87" антиген в инактивированной адсорбированной эмульгированной вакцине обеспечивает формирование у привитых животных напряженного и длительного иммунитета.
В экспериментальных опытах на белых мышах установлено, что двукратная иммунизация вакциной на основе штамма "ЛС-87" предохраняет белых мышей от развития хламидиозной инфекции после искусственного заражения на 87% штаммом "ЛС-87" и на 30% от штамма "PC-85" (таблица 2).
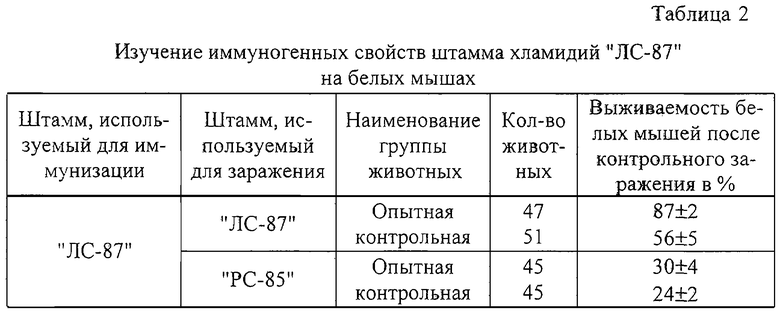
Таким образом, в опытах на белых мышах установлена высокая иммуногенная активность штамма "ЛС-87", изготовленная на его основе вакцина обеспечивает формирование у привитых животных напряженного иммунитета от гомологичного штамма "ЛС-87", а при заражении штаммом "PC-85" иммунитет слабый.
Штамм "Chlamydia psittaci" "PC-85" обладает следующими свойствами:
Морфологические признаки. Культура штамма представляет собой мелкие элементарные тельца хламидий, имеющие сферическую форму размером 200-400 нм, которые хорошо воспринимают карбол-фуксин Циля в разведении 1:5 и окрашиваются по модифицированному методу Стемпа в ярко-красный цвет.
Культуральные свойства. Штамм хламидий "PC-85" хорошо культивируется в желточной оболочке 6-7-суточных и аллантоисной оболочке 8-9-суточных развивающихся куриных эмбрионов.
Специфическая гибель куриных эмбрионов, инфицированных в желточную полость, отмечается на 5-9 сутки после заражения; при этом возбудитель накапливается в титре 10-6,25- 10-6,5 ЭЛД50 в 0,3 мл.
Патогенные свойства. Штамм хламидий "PC-85" обладает высокой вирулентностью для лабораторных и восприимчивых животных. При заражении белых мышей и морских свинок интраназально, внутрибрюшинно и подкожно 10%-ной свежеполученной хламидиосодержащей взвесью отмечается 100% заболевание и гибель 54-73% зараженных белых мышей. Морские свинки переболевают. У свиней штамм хламидий "PC-85" вызывает аборты, рождение нежизнеспособных поросят после внутривенного заражения в дозе 5,0 мл 10-6,5 ЭЛД50 в 0,3 мл.
Антигенные свойства. Оценку антигенных свойств штамма "PC-85" проводили в (РСК, ИФА) путем перекрестных исследований антигена, изготовленного из штамма хламидий "PC-85" согласно "Инструкции по изготовлению и контролю набора антигенов и сывороток для серологической диагностики хламидиозов с.-х. животных", утвержденной ГУВ Госагропрома СССР в 1988 году с иммунной сывороткой овцы, полученной гипериммунизацией данным штаммом, а также стандартных диагностикумов, изготовленных в условиях лаборатории вирусологии ВНИВИ из штаммов "Ростиново-70" - возбудителя хламидиоза овец, штамма орнитоза - "Лори", штамма "ЛС-87" - возбудителя хламидиозной пневмонии свиней и штамма "PC-85" - возбудителя хламидиоза аборта свиней.
Приведенные в таблице 3 данные свидетельствуют о принадлежности штамма "PC-85" к хламидиям, антигенно отличающимся от штамма "ЛС-87". Так гипериммунные сыворотки и антигены из штамма "ЛС-87" реагировали с антигеном и сыворотками из штамма "PC-85" в титрах 1:40, а с гомологичными 1:160.
Изучение антигенных свойств штамма хламидий "PC-85"
Таким образом, антигенные свойства штамма "PC-85" - возбудителя хламидиозного аборта свиней отличаются от антигенных свойств штамма "ЛС-87" - возбудителя хламидиозной пневмонии свиней.
Иммуногенные свойства. Использование в качестве антигена биомассы, приготовленной из штамма "PC-85" в инактивированной адсорбированно-эмульгированной вакцине, обеспечивает формирование у 80% привитых животных напряженного и длительного иммунитета.
В экспериментальных опытах (таблица 4) при двукратной иммунизации белых мышей вакциной на основе штамма "PC-85" установлено, что она предохраняла белых мышей от развития хламидиозной инфекции после искусственного заражения их вирулентными штаммами возбудителя хламидиоза аборта свиней "PC-85" на 80% и на 36% от возбудителя хламидиозной пневмонии свиней (штамм "ЛС-87").

Таким образом в опытах на белых мышах установлена высокая иммуногенная активность штамма "PC-85". Изготовленная на его основе вакцина обеспечивает формирование у привитых животных напряженного иммунитета.
При сравнительной оценке двух штаммов "PC-85" и "ЛС-87", относящихся к одному виду Chl. psittaci, были выявлены существенные различия в вирулентности, иммуногенности и антигенности (таблица 5). Так при внутрибрюшинном способе заражения белых мышей штаммом "PC-85" наблюдалась гибель белых мышей более 73%, а при подкожном и интраназальном способах 54-57%. У штамма "ЛС-87" наибольшая гибель белых мышей наблюдалась при интраназальном способе заражения - 73%, а при подкожном и внутрибрюшинном - 31-34% соответственно. При заражении морских свинок штаммом "PC-85" все животные переболевали, тогда как при заражении штаммом "ЛС-87" более 25% морских свинок из числа заболевших погибали от пневмонии.
Существенные различия в клинических признаках наблюдали при заражении свиней штаммами "PC-85" и "ЛС-87". Так, у животных, зараженных штаммом "PC-85", в основном отмечали аборты и рождение нежизнеспособного приплода, а при заражении штаммом "ЛС-87" в клинике заболевания преобладала пневмония. Таким образом на основании изучения биологических свойств штаммов "PC-85" и "ЛС-87" установили межштаммовые различия в вирулентности по отношению к экспериментальным и естественным животным.
При изучении антигенных свойств штаммов "PC-85" и "ЛС-87" выявили, что антигены и сыворотки, полученные к штаммам "PC-85" и "ЛС-87", реагируют с сыворотками и антигенами из штаммов "ЛС-87" и "PC-85" на два порядка ниже, чем с гомологичными. Таким образом установили, что штаммы "PC-85" и "ЛС-87" значительно отличаются в антигенном отношении.
Сравнительное изучение иммуногенных свойств штаммов "PC-85" и "ЛС-87" показало, что иммунизация белых мышей штаммов "PC-85" предохраняет белых мышей от развития хламидиозной инфекции после заражения штаммом "PC-85" на 80% и на 36% от штамма "ЛС-87". Иммунизация белых мышей штаммом "ЛС-87" предохраняла их от развития хламидиозной инфекции после заражения штаммом "ЛС-87" на 87% и на 30% от возбудителя хламидиозного аборта свиней (штамм "PC-85").
Сравнительная характеристика свиных штаммов хламидий: "PC-85" - возбудителя хламидиозного аборта и "ЛС-87" возбудителя хламидиозной пневмонии
Таким образом, в опытах по изучению иммуногенных свойств штаммов "PC-85" и "ЛС-87" установили, что изготовленные на их основе препараты обеспечивают формирование у привитых животных напряженного иммунитета от заражения гомологичными штаммами, и слабый - от гетерологичного штамма.
Полученные данные при изучении иммуногенных свойств "свиных" штаммов: "PC-85" и "ЛС-87" свидетельствуют о разной их иммуногенной активности и, как следствие, слабом перекрестном иммунитете.
Таким образом, работа, проведенная нами по сравнительному изучению свойств свиных штаммов хламидий "PC-85" и "ЛС-87", показала, что выделенные штаммы значительно отличаются между собой, хотя и относятся к одному и тому же виду хламидий - Chl. psittaci. Полученные данные служили научной предпосылкой при конструировании противохламидиозной свиной вакцины. Поэтому для повышения эффективности созданной противохламидиозной свиной вакцины были взяты два штамма: возбудителя хламидиозного аборта свиней "PC-85" и возбудителя хламидиозной пневмонии свиней "ЛС-87", тем самым мы добились значительного повышения иммуногенности созданной вакцины за счет расширения спектра антигенности и иммуногенности препарата, что является отличительным признаком созданной противохламидиозной вакцины от существующего прототипа.
Пример 1. Приготовление нативных суспензий хламидий свиней.
Используют куриные эмбрионы 6-7-дневного возраста, половину которых заражают в желточную полость суспензий свежепассированных штаммов хламидий "PC-86" возбудителя хламидиозного аборта свиней и вторую половину "ЛС-88" возбудителем хламидиозной пневмонии свиней, разведенной до 10-4 в дозе 0,3 мл. Инфицированные эмбрионы инкубируют при 37-38°С в течение двух дней, затем проводят овоскопию, отбирают и уничтожают павших (неспецифическая гибель), а живые эмбрионы заражают повторно в аллантоисную полость суспензией, разведенной до 10-3 в дозе 0,3 мл соответственно штаммами "PC-86" и "ЛС-87". Далее зараженные эмбрионы инкубируют при 37-38°С в течение 7-8 дней. Специфическая гибель 90-95% инфицированных эмбрионов происходит на 6-9 дни после первичного заражения. Павшие эмбрионы охлаждают и вскрывают. От каждого эмбриона отсасывают 4-5 мл хламидиосодержащей аллантоисной жидкости и отбирают 1-2 г хорин-аллантоисной и - желточной оболочек вместе с сопутствующим желтком.
Хламидиосодержащий материал до использования хранят в замороженном при минус 20-30°С состоянии. Аллантоисную жидкость перед заморозкой осветляют центрифугированием при 3 тыс. об/мин в течение 30 минут.
Для получения полуфабриката вакцины из хламидиосодержащего материала двух штаммов готовят 10%-ную исходную суспензию на фосфатно-буферном физиологическом растворе (ФСБ) рН 7,2-7,4 следующим образом: хламидиосодержащие оболочки взвешивают, подвергают термолизису путем трехкратного замораживания и оттаивания и суспендируют до 20%-ной концентрации на коллоидной мельнице, добавив расчетное количество ФБР. Суспензию центрифугируют при 3000 об/мин в течение 30 минут и отсасывают средний слой центрифугата - взвесь хламидий. Осадок тканей и верхний желточный слой повторно гомогенизируют в таком же количестве ФБР, центрифугируют в тех же условиях и снова отсасывают суспензию хламидий.
Замороженную хламидиосодержащую аллантоисную жидкость размораживают по возможности быстро в водяной бане при температуре 37°С, интенсивно встряхивая флакон с целью предотвращения образования крупных хлопьев. Размороженную слегка опалесцирующую аллантоисную жидкость разводят в соотношении 1:1 с ФБР.
Пример 2. Объединение штаммов хламидий и инактивация.
Хламидиосодержащие суспензии инфицированных оболочек и аллантоисной жидкости штаммов "PC" и "ЛС" объединяют и добавляют формальдегид в конечной концентрации 0,2%. Суспензию после добавления реагентов перемешивают и выдерживают в течение 48 часов при температуре 37-38°С для инактивации хламидий. Хламидий из инактивированной суспензии осаждают путем центрифугирования ее при 18-20 тыс. об/мин в течение 60 минут. Надосадочную жидкость вместе с верхним желточным слоем удаляют, осадок элементарных телец хламидий взвешивают и ресуспендируют в соотношении 1:25 с ФБР, содержащим 0,1% глутарового альдегида.
Стандартизацию суспензии по содержанию элементарных телец хламидий осуществляют путем определения ее оптической плотности. Для этого из приготовленной взвеси хламидий готовят разведение 1:10 (к 0,5 мл взвеси добавляют 4,5 мл ФБР) и измеряют коэффициент поглощения на ФЭК 56 М при длине волны 540 нм в кюветах с рабочей длиной 10 нм. Оптимальным для получения иммуногенной вакцины является коэффициент поглощения, равный 1,4-1,6 единиц, что соответствует содержанию 10-15 мг антигена в одном мл суспензии.
Стандартизированную взвесь хламидий пропускают через коллоидную мельницу, добавляют алюмокалиевые квасцы в конечной концентрации 0,5% и снова гомогенезируют в течение 5 минут, затем взвесь сливают в стеклянные баллоны и помещают в рефрижератор при 4-6°С на 1-2 сутки. В этих условиях хламидий адсорбируются на алюмокалиевых квасцах и осаждаются в виде хлопьев. Надосадочную жидкость осторожно отсасывают и удаляют, а осадок ресуспендируют до исходного объема фосфатно-буферным раствором, содержащим 0,1% глутарового альдегида. Полученные полуфабрикаты вакцины с консервантом хранят в рефрижераторе при 4-6°С.
Пример 3. Приготовление вакцины.
Для изготовления 1 литра вакцины берут 450 мл инактивированного антигена Chlamydia psittaci штаммов "ЛС-87" и "PC-86", содержащего 10-15 мг/мл хламидий, адсорбированных на алюмокалиевых квасцах с 0,1% глутарового альдегида. Добавляют 550 мл стерильной масляно-ланолиновой смеси в соотношении 84-16. Пропускают через коллоидную мельницу и расфасовывают в стерильные флаконы по 100 мл.
При изменении минимума или максимума в соотношениях компонентов при изготовлении вакцины происходит расслоение эмульсии на водную и масляную фракции, что снижает иммуногенность эмульсионной вакцины.
Пример 4. Контроль вакцины на стерильность, безвредность и на антигенную и иммуногенную активность.
Контроль вакцины на стерильность, стойкость эмульсии и безвредность проводится по общепринятым методам.
Испытывалось 10 серий вакцины на лабораторных животных и беременных подсвинках. Белых мышей массой 16-18 г вакцинировали внутрибрюшинно в дозе 0,1 мл, морских свинок подкожно по 1,0 мл с последующим наблюдением за состоянием подопытных животных в течение 14 и 23 дней соответственно.
Падежа лабораторных животных после вакцинации в течение срока наблюдения не установлено. Общее состояние вакцинированных животных во всех сериях опытов было удовлетворительным. Испытуемые серии вакцины против хламидиоза свиней были стерильны, безвредны (таблицы 6, 7).
Результаты изучения стерильности экспериментальных серий вакцины против хламидиоза свиней
Результаты изучения безвредности экспериментальных серий вакцины против хламидиоза свиней на белых мышах и морских свинках
м/с - морские свинки.
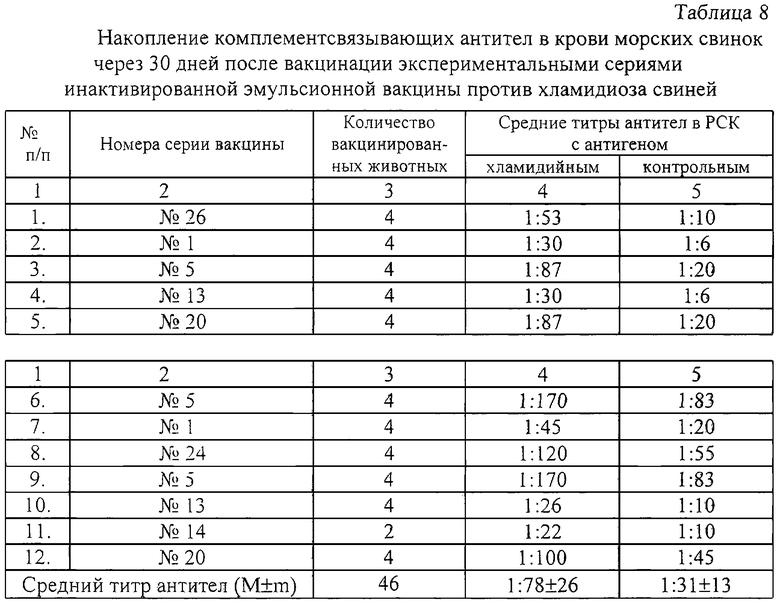
Контроль иммуногенности проводят на морских свинках. Животных вакцинируют в дозе 0,5 мл подкожно в области лопатки справа и слева (по 0,25 мл). Вакцинация способствует выработке специфических хламидийных комплементсвязывающих антител на 30-35 день в титрах 1:5-1:80 (средний арифметический титр не ниже чем 1:20) (таблица 8).
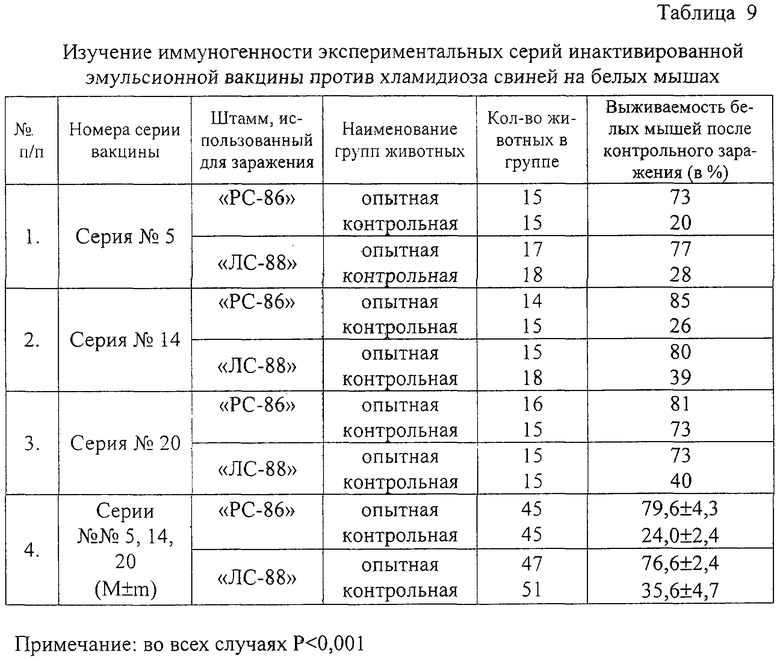
Контроль иммуногенной активности вакцины против хламидиоза свиней проводят на белых мышах. Мышей вакцинируют подкожно в дозе 0,1-0,15 мл. Контрольное заражение опытных и интактных животных проводят штаммами хламидий “PC-86” и “ЛС-88” внутрибрюшинно в дозе 0,5 мл через 30 дней после иммунизации. Выживаемость белых мышей после контрольного заражения вирулентными культурами хламидий штаммом “PC-86 и “ЛС-88” колебалась в пределах 73-85% (79,6±4,3%) и 73-80% (76,6±2,4%) соответственно. Средний процент выживаемости вакцинированных мышей после контрольного заражения составил 78,2±2,1% (таблица 9). В группах контрольных мышей после заражения отмечается 100% клиническое заболевание и гибель от 60 до 80% животных. Выживаемость интактных мышей после заражения штаммами хламидий “PC-86” и “ЛС-88” колеблется в пределах 20-26% (24±2,4%) и 28-40% (35,6±4,7%) соответственно.
В опытах на свиноматках в экспериментальных условиях было установлено, что однократное внутримышечное введение вакцины в дозе по 2,0 мл свиноматкам предохраняет их от развития хламидиозного аборта и пневмонии свиней после контрольного заражения вирулентными штаммами хламидий "PC-86" и "ЛС-88" (таблица 10).
Вакцину применяют с профилактической целью в хозяйствах и племпредприятиях, неблагополучных по хламидиозу свиней. Вакцинируют клинически здоровых животных однократно. Больных хламидиозом животных перед вакцинацией подвергают лечению антибиотиками тетрациклинового ряда. Свиноматок и ремонтных свинок вакцинируют за 15-20 дней до осеменения или случки. Вакцину применяют свиньям внутримышечно в области шеи в дозе: взрослым животным - 2 мл; 3-6-месячным свиньям - 1 мл. У вакцинированных животных на месте введения вакцины наблюдают местную реакцию в виде небольшой припухлости, которая исчезает в течение 2-4 недель. Иммунитет у привитых животных наступает через месяц после прививки и сохраняется в течение шести месяцев. Срок годности вакцины 1 год.
Производственное испытание вакцины, изготовленной в лаборатории вирусологии во ВНИВИ (г.Казань), проводили в условиях свинокомплекса "Сосновоборский" Республики Татарстан, совхозе им.Г.Д. Гая Сенгелеевского района Ульяновской области, в совхозе "Звениговский" Марий-Эл и хозяйствах Чувашии Урмарского района: СХП "МИР", КЛП им. "Мичурина", ПСХ "Чакинское". Данные по вакцинации против хламидиоза свиней в неблагополучных хозяйствах Татарстана, Марий-Эл, Чувашии и Ульяновской области представлены в таблице 11, из которой следует, что в результате применения вакцины количество абортов и мертворождений в 6-ти неблагополучных хозяйствах до вакцинации колебались в пределах 10,6-66% (в среднем 48%); падеж и вынужденный убой поросят составил от 8-43% (в среднем 26%).
В результате применения вакцины количество абортов и мертворождений в этих хозяйствах составило от 1,0-16,0 (в среднем 8%), т.е. уменьшилось в 6 раз. Также значительно (в 2,3 раза) сократилась заболеваемость, падеж и вынужденный убой поросят от хламидиозной инфекции.
За период 1995-2000 г. изготовлено более 200000 доз вакцины против хламидиоза свиней, которая используется в 22 неблагополучных по хламидиозу свиней хозяйствах Российской Федерации (таблица 12), в том числе в двух крупных свиноводческих комплексах: "Сосновоборский" Республики Татарстан и "Звениговский" Республики Марий-Эл.
Опыты по широкому производственному испытанию разработанной нами инактивированной эмульсионной вакцины против хламидиоза свиней в различных регионах показали, что вакцина обладает высокой эффективностью и при систематическом использовании обеспечивает стабилизацию эпизоотической ситуации по хламидиозу и оздоровление свинопоголовья от хламидиозной инфекции.
Данные до вакцинации свиней против хламидиоза в неблагополучных хозяйствах РФ
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ДЛЯ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ХЛАМИДИОЗА КРУПНОГО И МЕЛКОГО РОГАТОГО СКОТА | 2005 |
|
RU2301682C1 |
| ВАКЦИНА ДЛЯ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ХЛАМИДИОЗА КРУПНОГО РОГАТОГО СКОТА | 1991 |
|
RU2092188C1 |
| ВАКЦИНА КУЛЬТУРАЛЬНАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ ХЛАМИДИОЗА СВИНЕЙ | 2002 |
|
RU2233670C2 |
| ВАКЦИНА КУЛЬТУРАЛЬНАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ ХЛАМИДИОЗА (ОРНИТОЗА) ПТИЦ | 2005 |
|
RU2279892C1 |
| Вакцинная композиция для профилактики энзоотического аборта у овец | 2023 |
|
RU2802251C1 |
| ВАКЦИНА КУЛЬТУРАЛЬНАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ ХЛАМИДИОЗА (ОРНИТОЗА) ПТИЦ | 1995 |
|
RU2125465C1 |
| Штамм Chlamydia abortus "Chlamydia VNITIBP-21" для производства иммунобиологических лекарственных препаратов | 2022 |
|
RU2798283C1 |
| ВАКЦИНА КУЛЬТУРАЛЬНАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ ХЛАМИДИОЗА КРУПНОГО И МЕЛКОГО РОГАТОГО СКОТА | 2002 |
|
RU2233174C2 |
| Способ определения иммуногенности вакцин против хламидиозов сельскохозяйственных животных | 1990 |
|
SU1706632A1 |
| ШТАММ CHLAMYDIA PSITTACI, ИСПОЛЬЗУЕМЫЙ ДЛЯ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ ХЛАМИДИОЗА КОШЕК И ПУШНЫХ ЗВЕРЕЙ | 1997 |
|
RU2122579C1 |
Изобретение относится к области ветеринарной микробиологии и биотехнологии. Вакцина содержит в качестве источника специфических антигенов равную смесь инактивированных очищенных хламидийных антигенов штаммов: "PC-85" - возбудитель хламидиозного аборта свиней и "ЛС-87" - возбудитель хламидиозной пневмонии свиней, выращенных одновременно в желточной и аллантоисной оболочках куриных эмбрионов, с концентрацией хламидий 10-15 мг/мл, адсорбированных на алюмокалиевых квасцах и эмульгированных в масляно-ланолиновом адъюванте, с содержанием 0,1% глутарового альдегида. Применение вакцины в неблагополучных по хламидиозу свиней свиноводческих хозяйствах уменьшает количество абортов и мертворождений у свиноматок, снижает заболеваемость и гибель поросят от хламидиозной инфекции. 10 табл.
Вакцина для специфической профилактики хламидиоза свиней, содержащая инактивированный антиген Chlamydia psittaci, адъювант и консервант, отличающаяся тем, что содержит инактивированный и очищенный хламидийные антигены из штаммов PC-85 - возбудителя хламидиозного аборта свиней и ЛС-87 - возбудителя хламидиозной пневмонии свиней, выращенных одновременно в желточной и аллантоисной оболочках куриных эмбрионов, взятых в равном количестве с концентрацией хламидий 10-15 мг/мл, адсорбированных на алюмокалиевых квасцах и эмульгированных в масляно-ланолиновом адъюванте, с содержанием 0,1% глутарового альдегида в качестве консерванта.
| ВАКЦИНА ДЛЯ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ХЛАМИДИОЗА КРУПНОГО РОГАТОГО СКОТА | 1991 |
|
RU2092188C1 |
| 1977 |
|
SU826744A1 | |
| Хламидиозы сельскохозяственных животных | |||
| Под ред | |||
| ХАЗИПОВА Н.З | |||
| и РАВИЛОВА А.З | |||
| - М.: Колос, 1984. | |||
Авторы
Даты
2005-03-10—Публикация
2002-12-20—Подача