Изобретение относится к агенту против вируса иммунодефицита человека (ВИЧ).
Известно, что вирус иммунодефицита человека является причиной приобретенного синдрома иммунодефицита, так называемого AIDS, у людей, заряженных им. В результате исследований, проводимых в поиске агентов против ВИЧ, уже было разработано несколько эффективных агентов. Однако ни один из них не является полностью удовлетворительным. Так, даже азидотимидин (AZT), о котором говорят, что он является активным хемотерапевтическим агентом, не может быть свободен от проблем; назначение AZT в течение длительного срока вызывает отрицательные реакции, являющиеся следствием подавления костного мозга, такие как анемия и нейтропеня, и дает толчок выработке устойчивости к AZТ у ВИЧ. В настоящее время было обнаружено, что различные фторсодержащие пиридонкарбоновокислотные производные могут ингибировать продуцирование прогении ВИЧ в клетках, зараженных им, с одной стороны, и, с другой стороны, не ингибируют пролиферацию хозяйских клеток; а кроме того, при использовании в сочетании с азидотимидином, дидезоксинозином или дидезоксицитидином, они могут также давать хороший эффект. Настоящее изобретение основывается на этих находках.
Предлагаемое изобретение относится к агенту, подавляющему вирус иммунодефицита человека (антивирусному агенту ВИЧ), который включает в качестве активного ингредиента производное фторсодержащей пиридонкарбоновой кислоты, и кроме того к лекарственной композиции, которая включает в качестве активного ингредиента фторсодержащее производное пиридонкарбоновой кислоты в сочетании с азидотимидином, дидезоксицитидином (2',3'-дидезоксицитидином) (Daheberg Y. E. и др.) Proc.Natl. Acad. Sci. США, 84: 2469-2473, 1987) или дидезоксиинозином (2', 3'-дидезоксиинозином) (Jarchoan R. и др. Science 245: 412-145, 1989) для увеличения анти-ВИЧ эффекта или действия.
Фторсодержащие производные пиридонкарбоновой кислоты могут быть представлены формулой где 0 представляет собойN- или С(R8)-, в котором R8 H, F, Cl, низший алкил или низший алкоксил, или, когда он взят вместе с R1, представляет -OCH2CH(R81)-, -CH2CH(R81)- или -OCH2N(R81)-, завершая дополнительное кольцо, причем R81 H или низший алкил; R1 низший алкил, циклопропил, галоидциклопропил (в частности, цис-фторциклопропил), галоидэтил, винил, фенил или галоидфенил (в особенности, 2-фторфенил, 4-фторфенил или 2,4-дифторфенил); R7 азотсодержащая гетероциклическая группа (например, пиперазинил, пиролидинил или пиперидинил), которая может быть необязательно замещена одним или более заместителями, в типичном случае группу формулы
где 0 представляет собойN- или С(R8)-, в котором R8 H, F, Cl, низший алкил или низший алкоксил, или, когда он взят вместе с R1, представляет -OCH2CH(R81)-, -CH2CH(R81)- или -OCH2N(R81)-, завершая дополнительное кольцо, причем R81 H или низший алкил; R1 низший алкил, циклопропил, галоидциклопропил (в частности, цис-фторциклопропил), галоидэтил, винил, фенил или галоидфенил (в особенности, 2-фторфенил, 4-фторфенил или 2,4-дифторфенил); R7 азотсодержащая гетероциклическая группа (например, пиперазинил, пиролидинил или пиперидинил), которая может быть необязательно замещена одним или более заместителями, в типичном случае группу формулы
R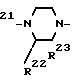 R
R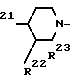 или R
или R где R21, R22 и R23 каждый независимо представляет собой атом водорода, атом галогена, амино, низший алкил, низший алкоксил или аминонизший алкил, и два из них могут быть объединены друг с другом, образуя спиро кольцо. В качестве конкретных примеров азотсодержащей гетероциклической группы могут быть упомянуты, наряду с другими, 3-аминопирролидинил, 3-метиламинопирролидинил, 3-диметиламино- пирролидинил, 3-этиламинопирролидинил, 3-пропиламинопирролидинил, 3-изопропиламинопирролидинил, 3-амино-4-метилпирролидинил, 3-амино-5-метилпирролидинил, 3-амино-4,5-диметилпирролидинил, 3-метиламино-4-метилпирролидинил, 3-метиламино-5-метилпирролидинил, 3-метиламино- 4,5-диметилпирролидинил, 3-диметиламино-4-метилпирролидинил, 3-диметиламино-5-метилпирролидинил, 3-диметиламино- 4,5-диметилпирролидинил, 3-метилпиперазинил, 4-метилпиперазинил, 3,4-диметилпиперазинил, 3,5-диметилпиперазинил, 3,4,5-триметилпиперазинил, 4-этил-3,5-диметилпиперазинил, 4-изопропил-3,5-диметилпиперазинил, 3-аминометилпирро- лидинил, 3-метиламинометилпирролидинил, 3-(1-амино)-этилпирролидинил, 3-(1-метиламино)этилпирролидинил, 3-(1-этил- амино)этилпирролидинил, 3-(1-амино/пропилпирролидинил/, 3-(1-метиламино)пропилпирролидинил, 3-аминопирролидинил, 3-амино-4,4-диметилпирролидинил, 7-амино-5-азаспиро(2.4)гептан-5-ил, 8-амино-6-азаспиро(3.4)октан-6-ил, 1,4-диазаби- цикло(3.2.1)октан-4-ил, 3,8-диазабицикло(3.2.1)октан-3-ил, 8-метил-3,8-диазабицикло(3.2.1)октан-3-ил, 8-этил-3,8- диазабицикло(3.2.1)октан-3-ил и аналогичные. Эти соединения хинолинкарбоновой кислоты, соединения нафтаилидинкарбоновой кислоты и пиридобензоксазинкарбоновокислотные соединения описываются, например, в JP-A-53-141286, JP-A-58-74667, JP-A-59-67279, JP-A-60-64979, JP-A-60-174786, JP-A-60-28479 (Термин JP-A", используемый здесь, означает "не прошедшую экспертизу японскую патентную заявку") и в японских патентных заявках N 1-106762, 1-123366, 1-156316 и 1-223910 и могут получаться по способам, описанным в соответствующих патентных заявках. Среди таких соединений те фторсодержащие производные пиридонкарбоновой кислоты, которые были разработаны до настоящего времени и выпущены в продажу, известны под названием новых хинолонов, как известно, обладают превосходной антимикробной активностью (см. работу Nika Internal Medicine, 62, (1), 28-33, 198 и Farumashia, 25 (5), 434-440). Антимикробные соединения того же самого типа, которые предстоит разработать в будущем, а именно дополнительные соединения приведенной выше формулы, которые имеют скелет 6-фторхинолин-3-карбоновой кислоты, 6-фтор-1,8-нафтиридин-3-карбоновой кислоты или 9-фтор-2,3-дигидро-7-оксо-7Н-пиридо[1,2,3-de] [1,4] бензоксазин-6-карбоновой кислоты с одним или более соответствующими заместителями, а также показывают превосходную анти-ВИЧ активность, когда они используются или одни, или в сочетании с азидотимидином, дезоксиинозином или дезоксицитидином. В частности, офлоксацин и S/-/-9-фтор-2,3-дигидро-3-метил-10-(4-метил-1-пиперазинил) -7-оксо-7Н-пиридо/1,23-de/ /1,4 бензоксазин-6-карбоновая кислота-полугидрат /левофлоксацин; DR-3355/ проявляют заметный анти-ВИЧ-эффект. Кроме того, офлоксацин (или левофлоксацин), когда он используется в сочетании с азидотимидином (или дидезоксицитидином или дидезоксиинозигом) также дает заметный анти-ВИЧ-эффект. Те, которые находятся в продаже, и могут использоваться на практике изобретения, включают офлоксацин (OFLX; / /-9-фтор-3-метил-10-/4-метил-1-пиперазинил/-7/оксо-2,3-дигидро-7Н-пи- ридо/1,2,3-de/+/1,4бензоксазин-6-карбо- новую кислоту/, норфлоксацин (NFLX; 1-этил-6-фтор-1,4-дигидро-4-оксо-7-/1-пипе- разинил/-3-хинолинкарбоновую кислоту/, ципрофлоксацин-хлоргидрат (CPFX; 1-циклопропил-6-фтор-1,4-дигидро-4-оксо-7-/1-пиперазинил/-3-хинолинкарбонову ю кислоту/, эноксацин (ЕИХ; 1-этил-6-фтор-1,4-дигидро-4-оксо-7-/1-пиперазинил/-1,3-нафтиридин -3-карбоновую кислоту/, тозуфлоксацин (TFLX, моногидрат п-толуолсульфоната /±/-7-/3-амино-1-пирролидинил/-6-фтор-1-/2,4-дифторфенил/-1,4-дигидро-4-оксо 1,8-нафтиридин-3-карбоновой кислоты/ и ломефлоксацин /LF LX, хлоргидрат /±/-1-этил-6,8-дифтор-1,4-дигидро-7-/3-метил-1-пиперазинил/-4-оксо-3- хинолизинкарбоновой кислоты, наряду с другими. Такие соединения могут также использоваться в форме солей, гидратов и аналогичных. АнтиВИЧ-композиции согласно предлагаемому изобретению могут назначаться с помощью таких обычных методов, как оральное назначение и внутривенное вливание капельницей. Для орального назначения указанная композиция имеет форму таблеток, капсул, гранул, порошков, сиропов, и т.д. Для внутривенных капель указанная композиция может иметь форму растворов, приготовленных путем добавления солюбилизирующего агента, такого как кислота или щелочь, в зависимости от необходимости. Для орального назначения подходящая суточная доза фторсодержащей пиридонкарбоновой кислоты для взрослых людей лежит в интервале 100-1000 мг, в частности 200-600 мг. В случае левофлоксацина обычно подходящей является доза 150-300 мг (для орального назначения). Доза азидотимидина для орального назначения подходящим образом составляет 600-1800 мг, в особенности 1200 мг. Дозы могут устанавливаться в зависимости от возраста и симптомов пациента. В частности, когда офлоксацин или аналогичное производное фторсодержащей пиридонкарбоновой кислоты используется в сочетании с азидотимидином, дидезоксацитидином или дидезоксиинозином, оба активных агента могут назначаться для приема или одновременно, или раздельно с некоторыми интервалами времени. Количества или число назначений двух агентов может быть не всегда одним и тем же. Подходящим является прием азидотимидина в виде 4-6 раздельных доз в день, а фторсодержащего производного пиридонкарбоновой кислоты в виде 2-4 раздельных доз в день. Следующие примеры являются дальнейшей иллюстрацией данного изобретения. В качестве хозяйских клеток для ВИЧ использовались Т-клетки человеческого происхождения Т4 антиген-положительные СЕМ-клетки (из Института Пастера, Франция). Культивирование клеток осуществлялось в атмосфере, содержащей двуокись углерода, в инкубаторе, поддерживаемом при 37оС, в соответствии с обычной методикой (см. National Institute of Health (Япония), Alumni Association "Virus Jukkengaku Soron" (Эксперименты в Вирологии); с. 131-151). RPMl 1640 cреда (Gibco), содержащая 10% -ную сыворотку эмбриона теленка (FCS), использовалась в качестве культуральной среды для клеток. В качестве источника ВИЧ использовался плавающий сверху культуральный слой (5˙106 ТСID50/мл), полученный подтвержением СЕМ-клеток заражению ВИЧ-I (L AY I штамм) и хранящийся при -70оС. Сокращение "ТСID50" обозначает 50%-ную инфекционную дозу тканевой культуры" (см. Hisao Uetake: "Virus gaku" (Вирусология) Rikogakusha c.472), a "MOI" означает множественность заражений" (см. там же, с. 36).
где R21, R22 и R23 каждый независимо представляет собой атом водорода, атом галогена, амино, низший алкил, низший алкоксил или аминонизший алкил, и два из них могут быть объединены друг с другом, образуя спиро кольцо. В качестве конкретных примеров азотсодержащей гетероциклической группы могут быть упомянуты, наряду с другими, 3-аминопирролидинил, 3-метиламинопирролидинил, 3-диметиламино- пирролидинил, 3-этиламинопирролидинил, 3-пропиламинопирролидинил, 3-изопропиламинопирролидинил, 3-амино-4-метилпирролидинил, 3-амино-5-метилпирролидинил, 3-амино-4,5-диметилпирролидинил, 3-метиламино-4-метилпирролидинил, 3-метиламино-5-метилпирролидинил, 3-метиламино- 4,5-диметилпирролидинил, 3-диметиламино-4-метилпирролидинил, 3-диметиламино-5-метилпирролидинил, 3-диметиламино- 4,5-диметилпирролидинил, 3-метилпиперазинил, 4-метилпиперазинил, 3,4-диметилпиперазинил, 3,5-диметилпиперазинил, 3,4,5-триметилпиперазинил, 4-этил-3,5-диметилпиперазинил, 4-изопропил-3,5-диметилпиперазинил, 3-аминометилпирро- лидинил, 3-метиламинометилпирролидинил, 3-(1-амино)-этилпирролидинил, 3-(1-метиламино)этилпирролидинил, 3-(1-этил- амино)этилпирролидинил, 3-(1-амино/пропилпирролидинил/, 3-(1-метиламино)пропилпирролидинил, 3-аминопирролидинил, 3-амино-4,4-диметилпирролидинил, 7-амино-5-азаспиро(2.4)гептан-5-ил, 8-амино-6-азаспиро(3.4)октан-6-ил, 1,4-диазаби- цикло(3.2.1)октан-4-ил, 3,8-диазабицикло(3.2.1)октан-3-ил, 8-метил-3,8-диазабицикло(3.2.1)октан-3-ил, 8-этил-3,8- диазабицикло(3.2.1)октан-3-ил и аналогичные. Эти соединения хинолинкарбоновой кислоты, соединения нафтаилидинкарбоновой кислоты и пиридобензоксазинкарбоновокислотные соединения описываются, например, в JP-A-53-141286, JP-A-58-74667, JP-A-59-67279, JP-A-60-64979, JP-A-60-174786, JP-A-60-28479 (Термин JP-A", используемый здесь, означает "не прошедшую экспертизу японскую патентную заявку") и в японских патентных заявках N 1-106762, 1-123366, 1-156316 и 1-223910 и могут получаться по способам, описанным в соответствующих патентных заявках. Среди таких соединений те фторсодержащие производные пиридонкарбоновой кислоты, которые были разработаны до настоящего времени и выпущены в продажу, известны под названием новых хинолонов, как известно, обладают превосходной антимикробной активностью (см. работу Nika Internal Medicine, 62, (1), 28-33, 198 и Farumashia, 25 (5), 434-440). Антимикробные соединения того же самого типа, которые предстоит разработать в будущем, а именно дополнительные соединения приведенной выше формулы, которые имеют скелет 6-фторхинолин-3-карбоновой кислоты, 6-фтор-1,8-нафтиридин-3-карбоновой кислоты или 9-фтор-2,3-дигидро-7-оксо-7Н-пиридо[1,2,3-de] [1,4] бензоксазин-6-карбоновой кислоты с одним или более соответствующими заместителями, а также показывают превосходную анти-ВИЧ активность, когда они используются или одни, или в сочетании с азидотимидином, дезоксиинозином или дезоксицитидином. В частности, офлоксацин и S/-/-9-фтор-2,3-дигидро-3-метил-10-(4-метил-1-пиперазинил) -7-оксо-7Н-пиридо/1,23-de/ /1,4 бензоксазин-6-карбоновая кислота-полугидрат /левофлоксацин; DR-3355/ проявляют заметный анти-ВИЧ-эффект. Кроме того, офлоксацин (или левофлоксацин), когда он используется в сочетании с азидотимидином (или дидезоксицитидином или дидезоксиинозигом) также дает заметный анти-ВИЧ-эффект. Те, которые находятся в продаже, и могут использоваться на практике изобретения, включают офлоксацин (OFLX; / /-9-фтор-3-метил-10-/4-метил-1-пиперазинил/-7/оксо-2,3-дигидро-7Н-пи- ридо/1,2,3-de/+/1,4бензоксазин-6-карбо- новую кислоту/, норфлоксацин (NFLX; 1-этил-6-фтор-1,4-дигидро-4-оксо-7-/1-пипе- разинил/-3-хинолинкарбоновую кислоту/, ципрофлоксацин-хлоргидрат (CPFX; 1-циклопропил-6-фтор-1,4-дигидро-4-оксо-7-/1-пиперазинил/-3-хинолинкарбонову ю кислоту/, эноксацин (ЕИХ; 1-этил-6-фтор-1,4-дигидро-4-оксо-7-/1-пиперазинил/-1,3-нафтиридин -3-карбоновую кислоту/, тозуфлоксацин (TFLX, моногидрат п-толуолсульфоната /±/-7-/3-амино-1-пирролидинил/-6-фтор-1-/2,4-дифторфенил/-1,4-дигидро-4-оксо 1,8-нафтиридин-3-карбоновой кислоты/ и ломефлоксацин /LF LX, хлоргидрат /±/-1-этил-6,8-дифтор-1,4-дигидро-7-/3-метил-1-пиперазинил/-4-оксо-3- хинолизинкарбоновой кислоты, наряду с другими. Такие соединения могут также использоваться в форме солей, гидратов и аналогичных. АнтиВИЧ-композиции согласно предлагаемому изобретению могут назначаться с помощью таких обычных методов, как оральное назначение и внутривенное вливание капельницей. Для орального назначения указанная композиция имеет форму таблеток, капсул, гранул, порошков, сиропов, и т.д. Для внутривенных капель указанная композиция может иметь форму растворов, приготовленных путем добавления солюбилизирующего агента, такого как кислота или щелочь, в зависимости от необходимости. Для орального назначения подходящая суточная доза фторсодержащей пиридонкарбоновой кислоты для взрослых людей лежит в интервале 100-1000 мг, в частности 200-600 мг. В случае левофлоксацина обычно подходящей является доза 150-300 мг (для орального назначения). Доза азидотимидина для орального назначения подходящим образом составляет 600-1800 мг, в особенности 1200 мг. Дозы могут устанавливаться в зависимости от возраста и симптомов пациента. В частности, когда офлоксацин или аналогичное производное фторсодержащей пиридонкарбоновой кислоты используется в сочетании с азидотимидином, дидезоксацитидином или дидезоксиинозином, оба активных агента могут назначаться для приема или одновременно, или раздельно с некоторыми интервалами времени. Количества или число назначений двух агентов может быть не всегда одним и тем же. Подходящим является прием азидотимидина в виде 4-6 раздельных доз в день, а фторсодержащего производного пиридонкарбоновой кислоты в виде 2-4 раздельных доз в день. Следующие примеры являются дальнейшей иллюстрацией данного изобретения. В качестве хозяйских клеток для ВИЧ использовались Т-клетки человеческого происхождения Т4 антиген-положительные СЕМ-клетки (из Института Пастера, Франция). Культивирование клеток осуществлялось в атмосфере, содержащей двуокись углерода, в инкубаторе, поддерживаемом при 37оС, в соответствии с обычной методикой (см. National Institute of Health (Япония), Alumni Association "Virus Jukkengaku Soron" (Эксперименты в Вирологии); с. 131-151). RPMl 1640 cреда (Gibco), содержащая 10% -ную сыворотку эмбриона теленка (FCS), использовалась в качестве культуральной среды для клеток. В качестве источника ВИЧ использовался плавающий сверху культуральный слой (5˙106 ТСID50/мл), полученный подтвержением СЕМ-клеток заражению ВИЧ-I (L AY I штамм) и хранящийся при -70оС. Сокращение "ТСID50" обозначает 50%-ную инфекционную дозу тканевой культуры" (см. Hisao Uetake: "Virus gaku" (Вирусология) Rikogakusha c.472), a "MOI" означает множественность заражений" (см. там же, с. 36).
П р и м е р 1. Цитотоксичность.
Клеточная культуральная среда (10 мл), помещенная в пластиковый сосуд для культуры (25 см2), инокулировалась СЕМ-клетками до плотности клеток 2,5˙105 кл. /мл. В течение 3 дн проводилась инкубация. Затем культура переносилась в 15-миллилитровую пластиковую центрифугу и центрифугировалась при 1000 об/мин в течение 5 мин для удаления среды. К отдельным клеткам добавлялась свежая порция среды, причем плотность клеток доводилась до 5,0˙105 кл. /мл. Общий объем 1,0 мл композиции, состоящей из 0,5 мл клеточной суспензии (5,0˙105 кл. /мл), полученной описанным выше образом, 0,4 мл среды (RPMl 1640, 10% FCS) и 0,1 мл физиологического солевого раствора испытываемого вещества с концентрацией 10-кратной конечной концентрации, инкубировался на 24-ячеистой пластиковой пластине для культуры в течение 4 дн. Клетки в каждой лунке или ячейке пластинки для культуры затем равномерно суспендировались в среде с использованием пипетки, и отделялась 0,5 мл порция суспензии. К оставшейся суспензии клеток добавлялась свежая 2 мл порция среды, свободной от испытываемого вещества (0,5 мл), и после дополнительного 3-дневного инкубирования получалась таким же образом суспензия клеток. Порция ее собиралась и подвергалась исследованию для подсчета жизнеспособных клеток и определения процента жизнеспособных клеток при окрашивании трипаном голубым (синим). В результате офлоксации ципрофлоксацин, эноксацин, норфлоксацин, левофлоксацин и азидотимидин не показали никакой цитотоксичности при концентрациях, не превышающих 10 мкг/мл. Два повторения того же самого опыта дали одни и те же результаты.
П р и м е р 2. Анти-ВИЧ активность.
Среда для культуры клеток (10 мл), помещенная в пластиковый сосуд для культуры (25 см2), инокулировалась СЕМ-клетками при плотности клеток 2,5˙105 кл. /мл. После инкубирования в течение 3 дн культура переносилась в 15-миллилитровые пластиковые центрифужные пробирки и подвергалась центрифугированию при 1000 об./мин в течение 5 мин для осаждения клеток и удаления культуральной среды.
Исходная вирусная суспензия добавлялась к полученным таким образом хозяйским клеткам до МОI=0,05, и смесь выдерживалась при 37оС в течение 90 мин при периодическом перемешивании с 30-минутными интервалами для адсорбции вирусов. К этим ВИЧ-инфицированным клеткам добавлялась среда для доведения плотности клеток до 5,0˙105 кл./мл. Полученная в результате ВИЧ-инфицированная клеточная суспензия использовалась в качестве суспензии клеток инокулюма.
Смесь (1,0 мл) 0,5 мл ВИЧ-инфицированной суспензии клеток, 0,5 мл среды (10% FCS в RPMl 1640) и 0,1 мл физиологического солевого раствора испытываемого соединения при концентрации 10-кратной конечной концентрации помещалась в каждую лунку 24-ячеистой пластиковой пластины для культуры. Конечная концентрация испытываемого вещества доводилась до 10, 5, 2,5 или 1 мкг/мл. Лунки без добавления (0 мкг/мл) служили в качестве контроля.
После 4-дневного инкубирования после заражения вирусами клетки в каждой лунке на 24-ячеистой пластине для культуры суспендировались равномерно с использованием пипетки и отделялась 0,5 мл порция суспензии, 2,0 мл порция свежей среды, свободной от испытываемого вещества, добавлялась к оставшейся 0,5 мл порции суспензии клеток с последующей инкубацией. (Для офлоксацина и левофлоксацина также проводились эксперименты с непрерывным (повторным) добавлением).
Спустя 7 дней после заражения вирусами производился отбор пипеткой для получения равномерной суспензии клеток в каждой лунке и 0,5 мл порция суспензии отделялась.
Инкубирование продолжалось и через 10 дн. после заражения вирусом таким же образом в каждой лунке получалась равномерная суспензия клеток и 1,5 мл (2,0 мл) порция ее отделялась. 2,0 мл порция свежей среды, свободной от (или содержащей) испытываемого вещества, добавлялась к оставшейся 0,5 мл порции суспензии клеток с последующей непрерывной инкубацией.
Спустя 15 дн после заражения вирусом клетки в каждой лунке суспендировались равномерно в среде таким же образом и отделялась 2,0 мл порция суспензии. К 0,5 мл остальной клеточной суспензии добавлялась 2,0 мл порция свежей среды, свободной от испытываемого вещества (или содержащей его), и инкубирование продолжалось. Через 25 дн после вирусного заражения также производилась замена среды.
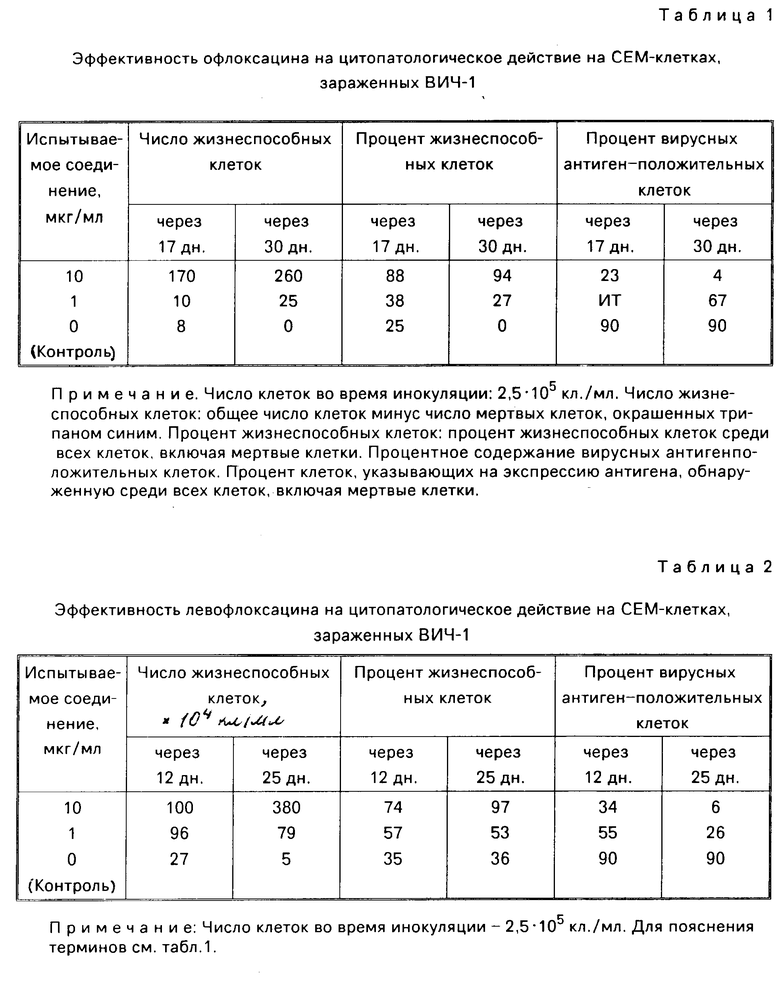
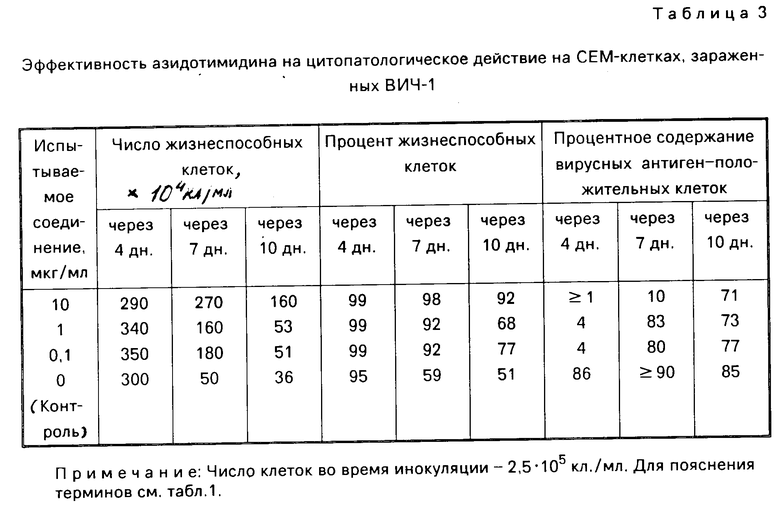
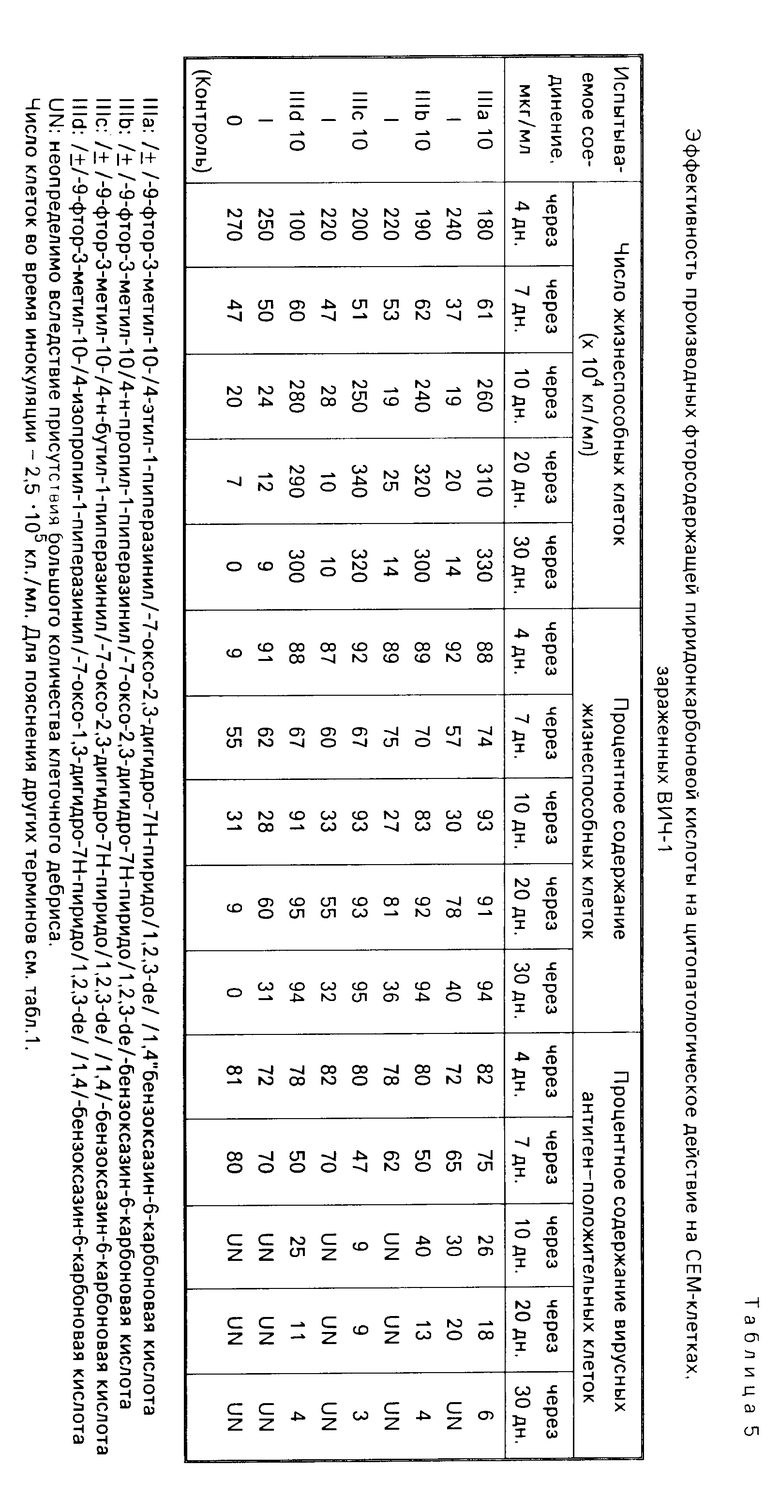
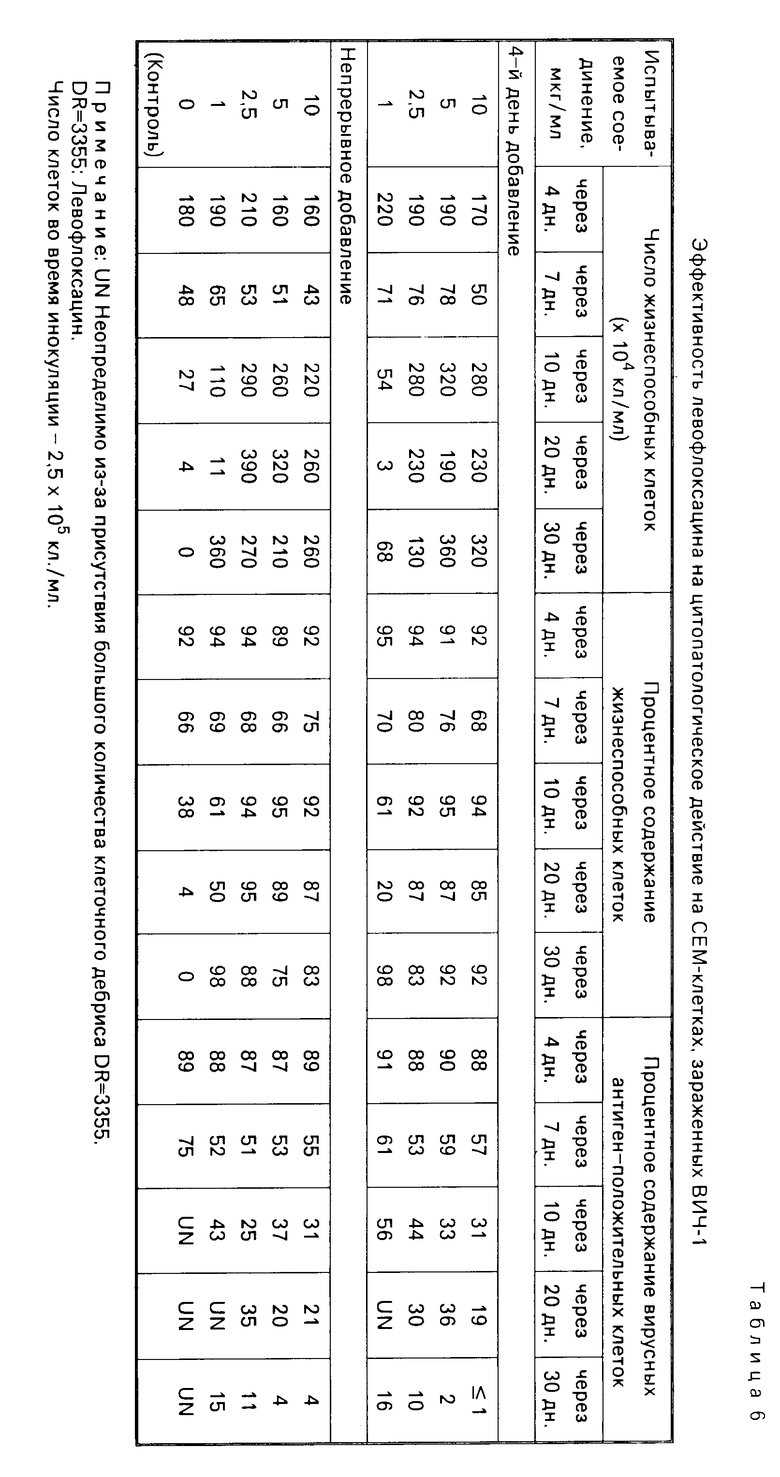
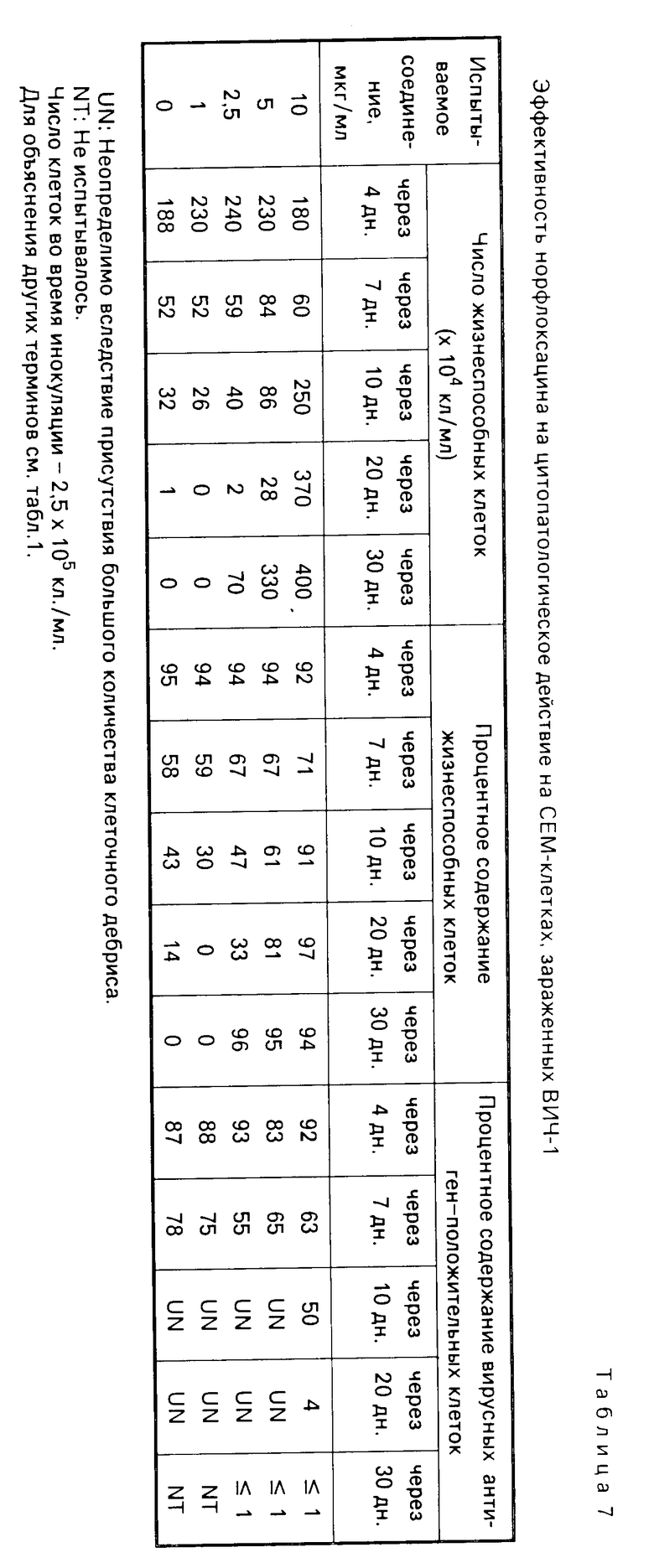
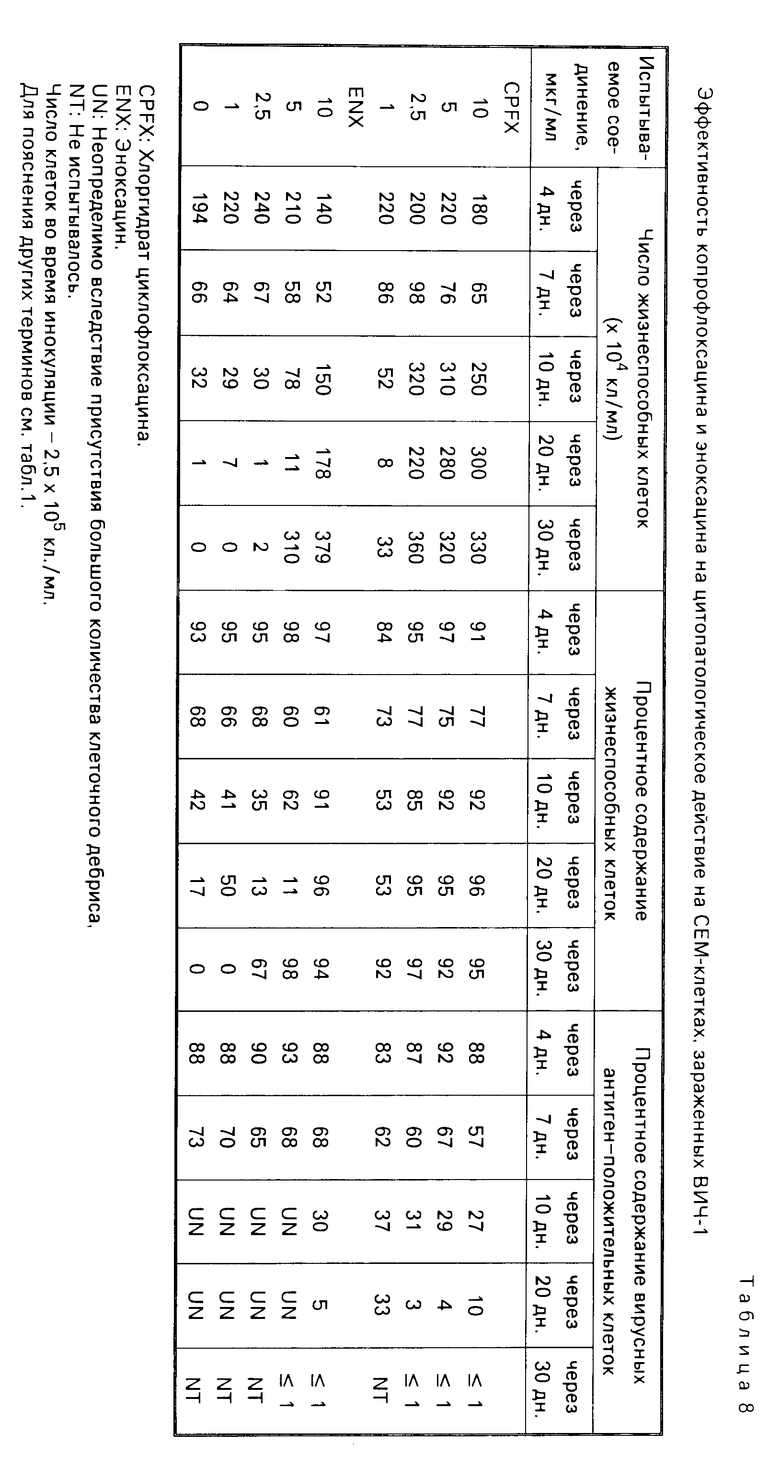
Суспензии клеток, собранные в день, показанный в каждой из табл.1-8, испытывались на подсчет жизнеспособных клеток, и кроме того определялся процент жизнеспособных клеток при окрашивании трипаном синим. В одно и то же время определялся процент вирусных антиген-положительных клеток с помощью метода флюоресценции с использованием антиВИЧ-антисыворотки, изолированной из здорового носителя ВИЧ. Полученные таким образом результаты показаны в табл. 1-8. Каждая из данных числовых величин представляет среднее для соответствующих двух ячеек на пластине для культуры. Число жизнеспособных клеток представляет число всех клеток минус число мертвых клеток, окрашенных трипаном синим. Процент жизнеспособных клеток представляет процент жизнеспособных клеток из всех клеток, включая мертвые клетки. Процент вирусных антиген-положительных клеток представляет процент клеток, указывающих на экспрессию антигена, обнаруженную среди всех клеток, включая мертвые клетки.
В контрольных экспериментах без обработки каким-либо соединением число клеток снижалось через 17 дн, а спустя 30 дн все клетки были мертвыми, как показано в табл.1; испытания на вирусный антиген всегда давали положительный результат. Обработка офлоксацином или левофлоксацином способствовала поддержанию клеточной пролиферации и подавляла процент антиген-положительных вирусных клеток. Обработка азидотимидином, как показано в табл.3, приводила в результате к временному поддержанию клеточной пролиферации при высоких концентрациях, которая однако сопровождалась уменьшением числа клеток и пролиферацией вируса, о чем свидетельствовало увеличение процента антиген-положительных вирусных клеток. Ввиду полученных таким образом благоприятных результатов число испытываемых соединений было увеличено, и проводилась проверка по времени более подробно (табл.4-8). Фторсодержащие производные пиридонкарбоновой кислоты (данные в табл.4-8) были эффективными против цитопатологического действия вируса и показали активность ингибирования клеточной пролиферации при той же тенденции, проявленной левофлоксацином и офлоксацином (табл.1 и 2), хотя степень антивирусной активности изменялась в зависимости от конкретного соединения.
П р и м е р 3. (i) Метод испытания сочетания фторсодержащего производного пиридонкарбоновой кислоты (левофлоксацина) и изидотимидина на анти-ВИЧ активность.
Суспензия клеток инокулюма, полученная в примере 1, доводилась до плотности клеток 2,5˙105 кл/мл с помощью добавления свежей среды для культуры клеток. Суспензия клеток инокулировалась порциями в 1 мл в лунки 24-ячеистой пластины для культуры. Добавлялся физиологический солевой раствор испытываемых соединений азидотимидина и/или левофлоксацина при концентрации 100-кратной конечной концентрации порциями 10 мкл в лунки 24-ячеистой пластины для культуры. Зараженные вирусом клетки затем культивировались при 37оС в течение 4 дн в СО2-инкубаторе.
Клетки в каждой ячейке 24-ячеистой пластины для культуры равномерно суспензировались с использованием пипетки, 0,5 мл порции однородной клеточной суспензии отбирались в разовые пробирки для подсчета жизнеспособных клеток и обнаружения ВИЧ-антигена.
К оставшейся суспензии клеток (0,5 мл) добавлялась 2 мл порции свежей среды, свободной от испытываемых соединений (или содержащей их) и инкубирование продолжалось.
Через 7 дн после заражения вирусом клетки в каждой лунке пластины для культуры суспендировались равномерно с использованием пипетки и отбиралась 0,5 мл порция суспензии клеток.
Спустя 10 дн после заражения вирусом клетки в каждой лунке пластины для культуры равномерно суспендировались с использованием пипетки и отделялась 1,5 мл порция суспензии клеток, 2 мл порция среды, свободной от испытываемого соединения (или содержащей его), добавлялась к оставшейся клеточной суспензии (0,5 мл), и инкубация продолжалась.
Через 15 дн после заражения вирусом клетки в каждой лунке культуральной пластины суспендировались равномерно с использованием пипетки и отбиралась 2 мл порция суспензии клеток. К оставшейся клеточной суспензии (0,5 мл) добавлялась 2 мл порция среды, свободной от испытываемого соединения (или содержащей его), и инкубирование продолжалось.
Далее таким же образом проводилась смена среды через 20 и 25 дн после вирусного заражения.
Порции суспензии клеток, отделенные через 4, 7, 10, 15, 20 и 30 дн после вирусного заражения подвергались подсчету жизнеспособных клеток и определялся процент жизнеспособных клеток с использованием технологии окрашивания трипаном синим.
В то же самое время проводилось определение процента вирусных антиген-положительных клеток с помощью метода иммунофлюоресценции с использованием антиВИЧ-сыворотки, выделенной из здорового носителя ВИЧ. Полученные результаты показаны в табл.9.
Каждая числовая величина представляет среднее из двух лунок.
(ii) Действие объединенного использования левофлоксацина и азидотимидина.
Когда СЕМ-клетки заражались с использованием ВИЧ-разбавления (ТСID50: 5˙106/мл, МОI:0,05), 50-91% клеток, ставших за 4 дн антиген-положительными, наблюдалось быстрое уменьшение числа клеток на 7 день. После этого все клетки на 20 день были мертвыми (табл.9).
Клетки СЕМ, зараженные ВИЧ, обрабатывались раствором азидотимидина при конечной концентрации 0,1-1,0 мкг/мл в течение 4 дн и инкубировались в течение 30 дн со средой, сменяемой с регулярными интервалами, как упомянуто выше. Быстрое уменьшение числа клеток вследствие заражения ВИЧ наблюдалось на 15 день инкубирования, с задержкой примерно на 8 дней по сравнению с необработанным контролем (7 день). Однако даже клетки, обработанные азидотимидином, оказались все мертвыми на 20 день. Непрерывная обработка тем же самым агентом показала ту же тенденцию.
Еще одна культуральная пластина инокулировалась СЕМ-клетками, зараженными ВИЧ, и после добавления раствора левофлоксацина до окончательной концентрации 1 или 10 мкг/мл, проводилась обработка левофлоксацином в течение 4 дн или непрерывно в течение 30 дн. В данной системе культуры временное уменьшение числа клеток с 7 до 15 дня сопровождалось повторной полиферацией, при этом клетки переживали клеточное повреждение ВИЧ и число клеток поддерживалось на высоком уровне плотности (табл.9).
Отдельно дополнительная культуральная пластина инокулировалась СЕМ-клетками, зараженными ВИЧ, которые затем обрабатывались раствором, содержащим два испытываемых вещества: левофлоксацин (конечная концентрация 1,0 или 10 мкг/мл) и азидотимидин (конечная концентрация 0,1 или 1,0 мкг/мл). В данной системе культуры с объединенной обработкой степень снижения числа клеток была заметно низкой на 4-10 день по сравнению с контролем без обработки и почти все клетки выжили. В данном случае такое быстрое снижение числа клеток после задержанного заражения, как это было видно в случае с единственной обработкой азидотимидином, не наблюдалось. Объединенное использование снижало степень такого временного уменьшения числа клеток на 7-15 день инкубирования, замеченного при единичной обработке левофлоксацином. В этом отношении объединенное использование обоих соединений давало благоприятные эффекты.
Кроме того, испытание на обнаружение вирусного антигена показало, что клетки, обработанные одним азидотимидином, все в конечном итоге становились положительными и умирали, но клетки, подвергнутые объединенной обработке, как и клетки, обработанные одним левофлоксацином, давали пониженную степень положительных (1% или ниже) в более поздней части периода инкубирования, и не обнаруживалось антигена, а большинство из них выжило как клетки свободные от вируса. В случае с непрерывной обработкой также получались по существу те же результаты.
П р и м е р 4. Дозированная форма (капсулы), мг:
Фторсодержащая пиридонкарбоновая кислота (например, офлоксацин или левофлоксацин) 100,0
Кукурузный крахмал 23,0
Кальциевая СМС 22,5
Гидроксипропилметилцеллюлоза 3,0
Стеарат магния 1,5
Всего: 150,0
П р и м е р 5. Дозированная форма (инъецируемый раствор): Левофлоксацин, г 20 Хлористый натрий, г 6
Дистиллированная вода для инъекций, мл до 1000
Промышленная применимость.
(i) Производные фторсодержащей пиридонкарбоновой кислоты согласно предлагаемому изобретению проявляют антивирусную активность, хотя и медленно, снижая со временем процент вирусных антиген-положительных клеток и ингибируя репродуцирование вирусов. Такие вещества как азидотимидин, дидезоксиинозин и дидезоксицитидин первоначально ингибируют размножение ВИЧ, но позднее дают возможность репродуцирования вирусов, что со временем ведет к повреждению клеток. Производные фторсодержащей пиридонкарбоновой кислоты обнаруживают антиВИЧ-активность с помощью иных механизмов действия, чем механизмы действия азидотимидина, дидезоксиинозина или дидезоксицитидина, и обладают свойствами, позволяющими их использование в качестве антиВИЧ-агентов.
(ii) Когда любое из производных фторсодержащей пиридонкарбоновой кислоты и азидотимидин, дидезоксицитидин или дидезоксиинозин используются в сочетании, дополнительно достигается эффект пролонгирования жизни клеток, обеспечиваемый производным фторсодержащей пиридонкарбоновой кислоты, а также эффект азидотимидина (или дидезоксиинозина, или дидезоксицитидина), проявляющийся в задержке заражения. При объединенном использовании обоих соединений процент вирусных антиген-положительных клеток со временем уменьшается и даже после этого не наблюдается какого-либо увеличения вирусных антигенов. Обработка одним азидотимидином (или дидезоксиинозином, или дидезоксицитидином) первоначально ингибирует размножение ВИЧ, но позднее позволяет ВИЧ размножаться, а клеткам становиться антиген-положительными к вирусу. Следовательно, объединенное использование фторсодержащей пиридонкарбоновой кислоты и азидотимидина ( или дидезоксицитидина, или дидезоксиинозина) будет давать лучший эффект по сравнению с единичной обработкой любым из соединений. Производные фторсодержащей пиридонкарбоновой кислоты предположительно проявляют свою антиВИЧ-активность благодаря другим механизмам действия, чем действия азидотимидина (или дидезоксицитидина, или дидезоксиинозина), и можно сказать, что объединенное использование обоих агентов будет служить благоприятным методом лечения ВИЧ-инфекции.
Что касается токсичности соединений, используемых в соответствии с изобретением, могут быть упомянуты следующие величины ЛД50, определенные на мышах, например, 244 мг/кг (внутривенно) для левофлоксацина, 5450 мг/кг (орально) для офлоксацина и не менее чем 4000 мг/кг (орально) для ципрофлоксацина, эноксацина и норфлоксацина.
Производные пиридонкарбоновой кислоты, содержащие азаспирогруппу в заместителе были испытаны на активность против ВИЧ. Соединение А показало эффективное действие против ВИЧ, почти равное уровню 0,2 μг/мл (пример 6), и соединение В при 0,2 μг/мл (пример 7).
Тесты на действие против ВИЧ, (см. табл.1-11 и 13) были проведены с использованием СЕМ-клеток (СО4 позитивные вспомогательные Т-лимфоциты). Аналогичный тест на действие против ВИЧ был проведен с DR=3355 при использовании МТ4-клеток, которые также являются СО4 позитивными вспомогательными Т-лимфоцитами, но составляют различные линии как несущие клетки. Как результат, даже при использовании вирус-инфицированных МТ4-клеток, была получена такая же эффективность (пример 8). Таким образом, помощь несущими клетками от цитопатического (летального) действия ВИЧ-1 вируса (которая приводит к выживанию и росту указанных клеток) как результат обработки несущих клеток лекарством (DR= 3355) была аналогична действию в случае использования СЕМ-клеток. Опыт с МТ4-клетками отличался от опыта с СЕМ-клетками тем, что вирус определялся непрерывно в выживающих МТ4-клетках.
В дальнейшем эксперименте, результаты которого показаны в примере 9, было найдено, что вирус размножался в СЕМ-клетках в присутствии DR=3355 в течение 6 дн после инфицирования, теряя свое цитопатическое (летальное) действие. Эта характеристика сохранялась даже в отсутствии лекарства (DR= 3355), когда при инфицировании были использованы простые культуры клеток.
Использованные в соответствии с изобретением соединения имеют низкую токсичность. Например, следующие величины LD50, определенные на мыши, могут быть приведены: 5,450 мг/кг (орально) для офлоксацина, не менее 4 г/кг (орально) для ципрофлоксацина, еноксацина и норфлоксацина и не менее 200 мг/кг (внутривенно) для DR=3355.
П р и м е р 6. Действие соединения А против ВИЧ в СЕМ-клетках.
Использовалась линия LAU 1 ВИЧ. СЕМ-клетки были инфицированы ВИЧ-1. Полученный культуральный супернатант (5 ˙ 105 ТСID 50/мл) был разделен, хранился при -70оС и размораживался перед каждым экспериментом. СЕМ-клетки были суспендированы в среде культуры клеток (RPMl 1640 среда, содержащая 10% сыворотки плода коровы) до достижения клеточной плотности значения 2,5˙105 кл. /мл. Суспензия была инокулирована в пластиковые колбы для культур (25 см2) и инкубирована в течение 3 дн. Культивированная клеточная суспензия была перенесена в центрифужную пробирку и среда была удалена из нее при помощи центрифугирования в течение 5 мин со скоростью 1000 об./мин.
Для адсорбции вируса на несущие клетки (СЕМ-клетки) замороженная суспензия вируса была оттаяна и добавлена в клеточный пеллет в центрифужную пробирку до достижения МОI (мультиплетность инфекции) 0,05. Инфицированные клетки были инкубированы при 37оС в течение 90 мин с периодическим встряхиванием через каждые 30 мин. Плотность клеток была доведена до 5,0˙104 кл./мл добавлением вышеуказанной среды культуры клеток к вирусинфицированным клеткам, порции клеточной суспензии по 2 мл были распределены в ячейки 24-ячеечной пластиковой платы для культур. Клетки были инкубированы в инкубаторе с СО2 при 37оС. Во время непрерывной инкубации инфицированных клеток они были обработаны соединением А/7-/7-(S)-7-амино-5-азаспиро/2.4/гептан- 5-ил/-8-хлор-6-фтор-1-/2-(S)-фтор-1-(R)-циклопропил/-4-оксо-1,4-дигидрохинол ин-3карбоновая кислота) в течение 12 дн после инфицирования вирусом. Конечные концентрации соединения А, использованные в эксперименте, составляли 0,5, 0,2, 0,1, 0,05, 0,02 и 0,01 г/мл. В необработанных контрольных образцах использовался физиологический раствор. Количество жизнеспособных клеточных единиц, процент жизнеспособных клеток и процент вирусных (ВИЧ-1) антигенных позитивных клеток был определен через 4,8 и 12 дн после вирусного инфицирования в порциях величиной по 0,3 мл каждой клеточной суспензии (табл.10).
Количество жизнеспособных клеток значительно уменьшалось после 8-го дня с момента вирусного инфицирования в контрольной группе (без добавления соединения А) и при добавлении соединения А в концентрации не более 0,1 г/мл. Однако, когда соединение А было добавлено в концентрациях не менее чем 0,2 μг/мл, количество жизнеспособных клеток значительно повышалось. Когда соединение А было добавлено в концентрации 0,5 μг/мл, процент вирусных интигенных позитивных клеток значительно понижался на 12-й день после вирусного инфицирования.
П р и м е р 7. Действие соединения B против ВИЧ в СЕМ-клетках.
Использовалась линия LAU 1 ВИЧ-1. СЕМ-клетки были инфицированы ВИЧ-1. Полученный культурный супернатант (5˙106 ТСID 50/мл) был разделен, хранился при -70оС и размораживался перед каждым экспериментом. СЕМ-клетки были суспендированы в среде культуры клеток (PPMI 1640 среда, содержащая 10% сыворотки плода коровы) до достижения клеточной плотности значения 2,5˙105 кл. /мл). Суспензия была инокулирована в пластиковые колбы для культур (25 см2) и инкубировалась в течение 3 дн. Культивированная клеточная суспензия была перенесена в центрифужную пробирку, и среда была удалена из нее при помощи центрифугирования в течение 5 мин со скоростью 1000 об/мин.
Для адсорбции вируса на несущие клетки (СЕМ-клетки) замороженная суспензия вируса была оттаяна и добавлена в клеточный пеллет в центрифужную пробирку до достижения МОI (мультиплетность инфекции) 0,02. Инфицированные клетки были инкубированы при 37оС в течение 90 мин с периодическим встряхиванием через каждые 30 мин. Плотность клеток была доведена до величины 5,0˙104 кл./мл добавлением вышеуказанной среды культуры клеток к вирусинфицированным клеткам, и порции клеточной суспензии по 2 мл были распределены в ячейки 24-ячеечной пластиковой платы для культур. Клетки были инкубированы в инкубаторе с СО2 при 37оС. Во время непрерывающейся инкубации инфицированных клеток они были обработаны соединением В (7-/7-(S)-7-амино-5-азаспиро/2.4/гептан-5-ил/-8-хлор-1-циклопропи- л-6-фтор-4-оксо-1,4-дигидрохинолинкарбо- новая кислота) в течение 12 дн после инфицирования вирусом. Конечные концентрации соединения А, использованные в эксперименте, составляли 0,5, 0,2, 0,1, 0,05, 0,02 и 0,01 г/мл. В необработанных контрольных образцах использовался физиологический раствор. Количество жизнеспособных клеток, процент жизнеспособных клеток и процент вирусных (ВИЧ-1) антигенных позитивных клеток был определен через 4, 8 и 12 дн после вирусного инфицирования в порциях клеточной суспензии величиной по 0,3 мл (табл.11).
В контрольной группе (без добавления соединения В) количество жизнеспособных клеток значительно уменьшилось после 8-го дня с момента вирусного инфицирования и при добавлении соединения А в концентрации не более 0,2 μг/мл, в то время как при добавлении соединения В в количестве не менее 0,02 μг/мл число жизнеспособных клеток значительно увеличивалось и процент вирусных антигенных позитивных клеток значительно уменьшался на 12-й день с момента вирусного инфицирования.
П р и м е р 8. Действие DR=3355 против ВИЧ в МТ4-клетках.
Использовалась линия LAU I ВИЧ. МТ4-клетки были инфицированы ВИЧ-1. Полученный культурный супернатант (5˙106 ТСID 50/мл) был разделен, хранился при -70оС и размораживался перед каждым экспериментом. МТ4-клетки были суспендированы в среде культуры клеток (RPMl 1640 среда, содержащая 10% сыворотки плода коровы) до достижения клеточной плотности значения 2,5˙106 кл. /мл. Суспензия была инокулирована в пластиковую колбу для культур (25 см2) и инкубировалась в течение 3 дн. Культивированная клеточная суспензия была перенесена в центрифужную пробирку, и среда была удалена из нее при помощи центрифугирования в течение 5 мин со скоростью 1000 об./мин.
Для адсорбции вируса на несущие клетки (МТ4-клетки) замороженная суспензия вируса была оттаяна и добавлена в клеточный пеллет в центрифужной пробирке до достижения МОI (мультиплетность инфекции) 0,05. Инфицированные клетки были инкубированы при 37оС в течение 90 мин с периодическим встряхиванием через каждые 30 мин. Клеточная плотность была доведена до значения 5,0˙105 кл. /мл добавлением вышеуказанной среды культуры клеток к вирусинфицированным МТ4-клеткам, и порции клеточной суспензии по 2 мл были распределены в ячейки 24-ячеечной пластиковой платы для культур. Инкубация была проведена в инкубаторе с СО2 при 37оС. Обработка лекарством (DR=3355) была проведена в течение 4 дн после вирусного инфицирования или, в некоторых экспериментах, непрерывно. Конечные концентрации DR=3355, использованные в эксперименте, были 50 и 10 μг/мл. В контрольных образцах (без обработки лекарством) использовался физиологический раствор.
Для замены среды в каждой ячейке 24-ячеечной платы для культур клетки были суспендированы пипетированием для достижения однородной клеточной плотности, после чего порция в 1 мл клеточной суспензии отбиралась. Половина порции (0,5 мл) суспензии была перенесена на 24-ячеечную плату для культур в ячейку, содержащую 2 мл свежеприготовленной среды DR=3355 (или в некоторых эксперимаентах, содержащую DR=3355 для непрерывной обработки), и инкубация были продолжена. Оставшиеся 0,5 мл клеточной суспензии были использованы для подсчета количества жизнеспособных клеток, процента жизнеспособных клеток и процента вирусных антигенных позитивных клеток. Замена среды была осуществлена вышеуказанным способом на 4, 10, 15, 20 и 25 дни после вирусного инфицирования. Количество жизнеспособных клеток, процент жизнеспособных клеток и процент вирусных (ВИЧ-1) антигенных позитивных клеток были определены на 4, 10, 15, 20 и 30 дни после вирусного инфицирования. В случае непрерывной обработки DR=3355 он добавлялся к вышеуказанным конечным концентрациям (соответственно показанным в табл.12) в каждом случае замены среды.
В контрольной группе (без добавления DR=3355) все клетки погибли через 20 дн после вирусного инфицирования, тогда как при добавлении DR=3355 на 4 день инфицированные клетки продемонстрировали значительный рост и почти все инфицированные клетки были избавлены от гибели вследствие цитопатического воздействия вируса ВИЧ-1. Процент вирусных антигенных позитивных клеток для МТ4-клеток увеличился до 100% в отличие от опыта с СЕМ-клетками. Эксперименты, где DR= 3355 добавлялся непрерывно, дали по существу такие же результаты.
П р и м е р 9. Влияние обработки лекарством DR=3355 на действие вируса, вызывающее заболевание и гибель клеток.
1) Предварительная обработка вируса лекарством DR=3355.
Использовалась линия LAU 1 ВИЧ. СЕМ-клетки были инфицированы вирусным штаммом. Полученный культурный супернатант (5˙106 ТСID 50 кл./мл) был разделен, хранился при -70оС и размораживался перед каждым экспериментом. СЕМ-клетки были суспендированы в среде культуры клеток (RPMl 1640 среда, содержащая 10% сыворотки плода коровы) до достижения клеточной плотности значения 2,5˙105 кл. /мл. Суспензия была инокулирована в пластиковую колбу для культур (25 см2) и инкубировалась в течение 3 дн. Культивированная клеточная суспензия была перенесена в центрифужную пробирку, и среда была удалена из нее при помощи центрифугирования в течение 5 мин со скоростью 1000 об/мин.
Для адсорбции вируса на несущие клетки (СЕМ-клетки) замороженная суспензия вируса была оттаяна и добавлена в клеточный пеллет в центрифужную пробирку до достижения МОI (мультиплетность инфекции) 0,05. Инфицированные клетки были инкубированы при 37оС в течение 90 мин с периодическим встряхиванием трубки через каждые 30 мин. Свежеприготовленная вышеописанная среда культур клеток была добавлена к вирусинфицированным клеткам до достижения клеточной плотности среды значения 5,0˙104 кл./мл, полученная клеточная суспензия порциями по 10 мл была инокулирована в пластические колбы для культур (25 см2) и раствор DR=3355 был добавлен до достижения конечной концентрации 5,0 г/мл. Клетки были инкубированы в инкубаторе с СО2 при 37оС в течение 6 дн. На 6 день после вирусной инфекции содержание вирусных антигенных позитивных клеток составляло 80%
Для получения суспензии вируса, обработанного лекарством, супернатант, полученный из среды культуры на 6 день после вирусного инфицирования, был отфильтрован через миллипорный фильтр (0,22 μм), и фильтрат был распределен во флаконы для хранения при -70оС.
2) Метод вирусной инфекции.
СЕМ-клетки были суспендированы в среде культуры клеток (среда RTMl 1640, содержащая 10% сыворотки плода коровы) до получения плотности 2,5˙105 кл. /мл, суспензии были инокулированы в пластические колбы для культур (25 см2) и инкубировались в течение 3 дн. Культивированные клеточные суспензии были перенесены в центрифужную пробирку, и среда была удалена центрифугированием в течение 5 мин при скорости 1000 об./мин. Замороженная суспензия вируса, обработанного лекарством DR=3355, приготовленная как указано выше в пункте 1), была разморожена и МОI (мультиплетность инфицирования) доведена до 0,05.
Для абсорбции вируса на несущие клетки (СЕМ-клетки) вирусная суспензия была добавлена в клеточный пеллет в центрифужную пробирку, и инкубация была проведена при 37оС в течение 90 мин с периодическим встряхиванием через каждые 30 мин. Затем для удаления лекарства (DR=3355), содержащегося в суспензии вирусинфицированных клеток, свежеприготовленная порция 5 мл среды культуры клеток была добавлена в пробирку, супернатант был удален и свежеприготовленная порция среды культуры клеток была добавлена к клеточному пеллету для доведения таким образом клеточной плотности до величины 5˙104 кл./мл. Полученная клеточная суспензия была инокулирована порциями по 2 мл в ячейки 24-ячеечной платы для культур, и клетки были инкубированы в инкубаторе с СО2 при 37оС. Инфицированные клетки выращивались при обработке лекарством (DR= 3355) в течение последующих 12 дн после вирусной инфекции. Конечная концентрация DR= 3355, использованная в этом эксперименте, составляла 5,0 г/мл. В необработанном лекарством контрольном образце использовался физиологический раствор. Количество жизнеспособных клеток, процент жизнеспособных клеток и процент вирусных антигенных позитивных клеток определялся на 4, 8 и 12 день после вирусного инфицирования путем отбора 0,3 мл клеточной суспензии из каждой ячейки. Для сравнения одновременно была изучена проба, в которой вирус не подвергался предварительной обработке лекарством (DR=3355).
В экспериментах, где была проведена ложная предварительная обработка физиологическим раствором вируса ВИЧ-1 в течение 6 дн (табл.13), количество жизнеспособных клеток увеличивалось только тогда, когда была проведена последующая обработка лекарством DR=3355. Результаты были аналогичны тем, которые получены при использовании вируса без предварительной обработки (табл. 1-9). С другой стороны, когда клетки, инфицированные вирусом 1, предварительно обрабатывались лекарством (DR= 3355) в течение 6 дней, значительное увеличение количества жизнеспособных клеток наблюдалось независимо от того, была ли сделана последующая обработка лекарством (DR=3355) или нет (табл. 13).
Такое действие предварительной обработки лекарством означает:
что предварительная обработка вызывает исчезновение цитопатического (летального) действия, первоначально вызываемого вирусом ВИЧ-1;
что вирус, который потерял свое цитопатическое действие, сохраняет это свойство (потерю цитопатического действия) даже в отсутствии лекарства.






Использование: медицина. Сущность изобретения: производные фторсодержащей пиридонкарбоновой кислоты, такие как офлоксации, левофлоксации, норфлоксации, эноксации, ципфофлоксации, ломефлоксации, флероксации, дифлоксации и тозуфлоксации, обнаруживают антиВИЧ-активность и являются полезными терапевтическими агентами для лечения болезней, вызываемых данным вирусом (ВИЧ). Кроме того, когда они используются в сочетании с азидотимидином, дидезоксинозином или дидезоксицитидином, эти производные фторсодержащей пиридонкарбоновой кислоты проявляют усиленную антиСВЧ активность, и в связи с этим ожидается также, что они могут служить в качестве полезных лекарственных препаратов.
Приоритет по пунктам:
23.02.90 по пп.1,2,6-8,12,13;
24.07.89 по пп.4,10,11;
28.04.89 по п.5.
| Proc | |||
| Nafl | |||
| Acad | |||
| Sci., 1987, 84, 2469-1473. |
Авторы
Даты
1995-09-27—Публикация
1991-10-25—Подача