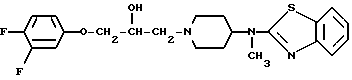
Изобретение относится к рацемической смеси и (S)-форме 4-[(2-бензотиазолил)метиламано]-α -[(3,4-дифторофенокси)метил]-1-пиперидинэтанола, которая может быть представлена формулой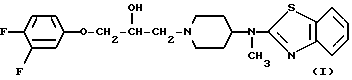
и к его фармацевтически приемлемым кислотно-аддитивным солям (солям кислотного присоединения).
В Патенте США 4861785 описаны бензоксазол- и бензотиазоламинпроизводные, имеющие активность против аноксии. Соединения бензотиазола, отвечающие изобретению, показывают неожиданную активность против удара (паралича) по сравнению со структурно родственным соединением сабелюзолом.
Соли кислотного присоединения, как указано выше, означают, что они содержат терапевтически активные нетоксичные формы солей кислотного присоединения, которые способны образовать соединение формулы (1). Последнее легко может быть получено взаимодействием основной формы с соответствующими кислотами, такими как, например, неорганические кислоты, такие, как галоидоводородная кислота, например хлористоводородная, бромистоводородная и т.п. серная кислота, азотная кислота, фосфорная кислота и т.п. или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, этандионовая, пропандионовая, бутандионовая, (Z)-2-бутандионовая, (Е)-2-бутандионовая, 2-гидроксибутандионовая, 2,3-дигидроксибутандионовая, 2-гидрокси-1,2,3-пропантрикарбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, 4-метилбензолсульфоновая, циклогексансульфаминовая, 2-гидроксибензойная, 4-амино-2-гидроксибензойная, 7,7-диметил-2-оксобицикло-[2,2,1] гептан-1-метансульфоновая, 2-[(4-метилфенил)сульфониламино] пентадионовая и т.п. кислоты. Наоборот, солевая форма может быть переведена в форму свободного основания обработки щелочью.
Термин соль кислотного присоединения или кислотно-аддитивная соль, который используется здесь, также включает сольваты, которые способны образовывать соединения формулы (1), и это означает, что указанные сольваты входят в объем изобретения. Примерами таких сольватов являются гидраты, алкоголяты и т.п.
Соединения, отвечающие изобретению, имеют ассиметричный углеродный атом, и абсолютная конфигурация этого ассиметричного центра может быть указана стереохимическими дескрипторами R и S. Если не указано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм. Здесь далее термин "энантиомерно чистый" означает соединения, имеющие энантиомерный избыток не менее 94% (т.е. минимум 97% одного энантиомера и максимум 3% другого энантиомера) до энантиомерного избытка 100% (т.е. 100% одного энантиомера и нуль другого), в частности, соединения имеющие энантиомерный избыток от 96% до 100% и особенно, имеющие энантиомерный избыток от 98% до 100%
Предпочтительными соединениями согласно изобретению являются: (S)-4-[(2-бензотиазолид)метиламино] -α -[(3,4-дифторофенокси)метил-1-пиперидинэтанол и его дигидрохлоридная соль.
Соединения формулы (1) могут быть обычно получены N-алкилированием пиперидина формулы (II) алкилирующим реагентом формулы (III) с помощью известных в технике приемов N-алкилирования.
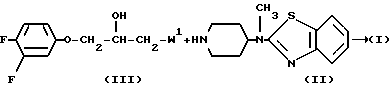
В формуле (III) W1 представляет соответствующую реакционноспособную уходящую или удаляемую группу, такую как, например, гелоид-, например хлор-, бром- или иод-; сульфонилокси-, например метансульфонилокси-, трифторометансульфонилокси-, бензолсульфонилокси-, 4-метилбензолсульфонилокси и т.п. удаляемые группы. Указанная реакция N-алкилирования может удобно осуществляться смешением реагентов обычно в реакционно инертном растворителе, таком как, например, ароматический растворитель, например бензол, метилбензол, диметилбензол и т.п. С1-6-алканол, например метанол, этанол, 1-бутанол и т. п. кетон, например 2-пропано, 4-метил-2-пентанон и т.п; сложный эфир, например этилацетат, γ -бутилактон и т.п. простой эфир, например 1,1'-оксибисэтан, тетрагидрофуран, 1,4-диоксан и т.п. диполярный апротонный растворитель, например,  ,
,  -диметилформамид,
-диметилформамид,  ,
,  -диметилацетамид, диметилсульфоксид, пиридин, 1-метил-2-пирролидинон, нитробензол, ацетонитрил и т.п. или смеси таких растворителей. Добавление соответствующего основания, такого как, например, карбонат, бикарбонат, гидроокись, окись, карбоксилат, алкоголят, гидрид или амид, щелочного или щелочноземельного металла, например, карбоната натрия, бикарбоната натрия, карбоната калия, гидроокиси натрия, окиси кальция, ацетата натрия, метилата натрия, гидрида натрия, амида натрия и т. п. или органического основания, такого как, например третичный амин, например
-диметилацетамид, диметилсульфоксид, пиридин, 1-метил-2-пирролидинон, нитробензол, ацетонитрил и т.п. или смеси таких растворителей. Добавление соответствующего основания, такого как, например, карбонат, бикарбонат, гидроокись, окись, карбоксилат, алкоголят, гидрид или амид, щелочного или щелочноземельного металла, например, карбоната натрия, бикарбоната натрия, карбоната калия, гидроокиси натрия, окиси кальция, ацетата натрия, метилата натрия, гидрида натрия, амида натрия и т. п. или органического основания, такого как, например третичный амин, например  -диэтилэтанамин,
-диэтилэтанамин,  -(1-метил-этил)-2-пропанамин, 4-этилморфолин, 1,4-диазобицикло [2,2,2] октан, пиридин и т.п. может необязательно использоваться для улавливания кислоты, которая образуется в ходе реакции. В некоторых случаях может быть подходящим добавление иодидной соли предпочтительно, иодида щелочного металла, или кроунэфира, например 1, 4, 7, 10, 13, 16-гексаоксациклооктадекана и т.п. Перемешивание и несколько повышенные температуры могут увеличить скорость реакции; в частности, реакция может быть проведена при температуре дефлегмации реакционной смеси. Альтернативно, указанное
-(1-метил-этил)-2-пропанамин, 4-этилморфолин, 1,4-диазобицикло [2,2,2] октан, пиридин и т.п. может необязательно использоваться для улавливания кислоты, которая образуется в ходе реакции. В некоторых случаях может быть подходящим добавление иодидной соли предпочтительно, иодида щелочного металла, или кроунэфира, например 1, 4, 7, 10, 13, 16-гексаоксациклооктадекана и т.п. Перемешивание и несколько повышенные температуры могут увеличить скорость реакции; в частности, реакция может быть проведена при температуре дефлегмации реакционной смеси. Альтернативно, указанное  -алкилирование может быть выполнено с применением известных условий каталитических реакций фазового переноса. Несколько повышенные температуры могут применяться для увеличения скорости реакции.
-алкилирование может быть выполнено с применением известных условий каталитических реакций фазового переноса. Несколько повышенные температуры могут применяться для увеличения скорости реакции.
В данном и последующих способах получения продукты реакции могут быть выделены из среды и, если необходимо, затем очищены известными методами, например, экстракцией, кристаллизацией, растиранием и хроматографией.
Соединение формулы (1) может быть также получено реакцией пиперидина формулы (II) с эпоксидом формулы (IV).
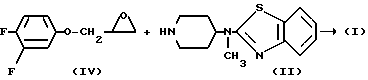
Эта реакция может быть проведена при перемешивании и, если желательно, при нагревании реагентов в реакционно-инертном растворителе, таком как, например, вода, ароматический углеводород, например бензол, метилбензол и т. п. спирт,
например метанол, этанол, изопропанол, 1-бутанол и т.п. кетон, например 2-пропанон, 4-метил-2-пентанон и т.п. диполярный апротонный растворитель, например, 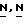 -диметилформамид,
-диметилформамид, 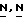 -диметилацетамид и т.п. или смесь таких растворителей.
-диметилацетамид и т.п. или смесь таких растворителей.
Соединения формулы (I) могут быть также получены циклизацией производного тиомочевины формулы (VII), которое может быть образовано реакцией амина формулы (V) с изоцианатом формулы (VI) в соответствующем реакционно-инертном растворителе, таком как, например, алканол, простой эфир, кетон и т.п.
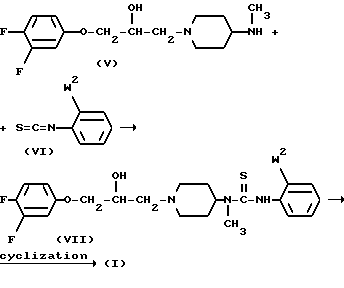
В формуле (VI) и (VII) W2 представляет, например, водород, галоид-, например хлор- и бром-; С1-6-алкокси- или С1-6-алкилтио-. Указанная реакция циклизации может быть обычно выполнена в присутствии подходящего окислителя, такого как, например, дигалогенид, например хлор или бром. Указанная реакция циклизации может быть выполнена в реакционно-инертном растворителе, таком как, например, галоидированный углеводород, например тетрахлорметан, трихлорметан, дихлорметан и т. п. углеводород, например бензол, метилбензол, гексан и т.п. простой эфир, например тетрагидрофуран и т.п. кетон, например 2-пропанон, 2-бутанон и т.п; спирт, например метанол, этанол, 2-пропанол и т. п. диполярный апротонный растворитель, например 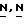 -диметилфлоамид,
-диметилфлоамид, 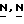 -диметилацетамид и т. п. Повышенные температуры и перемешивание могут увеличить скорость реакции.
-диметилацетамид и т. п. Повышенные температуры и перемешивание могут увеличить скорость реакции.
Соединение формулы (I) может альтернативно быть получено реакцией соответствующего реагента формулы (VIII) с бензотиазолом формулы (IX).
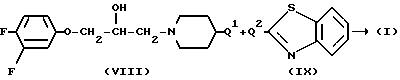
В (VIII) и (IX) Q1 и Q2 выбираются так, чтобы в ходе реакции алкилирования образовался радикал формулы N(CH3)-. Например, когда Q1 является соответствующей уходящей группой, Q22 - является радикалом формулы NH(CH5), или когда Q1 является радикалом NH(CH3), Q2 является соответствующей уходящей группой. Соответствующей уходящей группой являются, например, галоид-, например хлор-, бром и т.п. сульфонилокси-группа, например метансульфонилокси, 4-метил-бензолсульфонилокси- и т.п. Реакция может быть выполнена в реакционно инертном растворителе, таком как, например, ароматический углеводород, например бензол, метилбензол и т. п; простой эфир, например 1,4-диоксан, тетрагидрофуран и т.п. галоидированный углеводород, например трихлорметан, тетрахлорметан и т. п; алканол, например метанол, этанол, 1-бутанол и т.п. кетон, например 2-пропанон, 4-метил-2-пентанон и т.п. диполярный апротонный растворитель, например 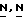 -диметилформамид,
-диметилформамид, 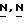 -диметилацетамид и т.п. Добавление соответствующего основания, такого как, например, карбонат или бикарбонат щелочного металла, например карбоната натрия, бикарбоната натрия и т. п. гидрид натрия; или
-диметилацетамид и т.п. Добавление соответствующего основания, такого как, например, карбонат или бикарбонат щелочного металла, например карбоната натрия, бикарбоната натрия и т. п. гидрид натрия; или
органическое основание, такое как, например, 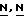 -диэтил-этанамин и т.п. может быть использовано для улавливания кислоты, которая образуется в ходе реакции.
-диэтил-этанамин и т.п. может быть использовано для улавливания кислоты, которая образуется в ходе реакции.
Соединения формулы (I) могут быть также получены реакцией  -замещенного 4-пиперидинона формулы (X) с бензотиазоламином формулы (XI) с помощью известного способа восстановительного
-замещенного 4-пиперидинона формулы (X) с бензотиазоламином формулы (XI) с помощью известного способа восстановительного  -алкилирования.
-алкилирования.
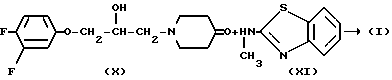
Реакция (X) с (XI) обычно может быть выполнена смещением реагентов в соответствующем реакционно-инертном растворителе с соответствующим восстановителем. Предпочтительно, кетон формулы (X) сначала вводится в реакцию с промежуточным соединением формулы (XI) с образованием енамина, который может быть обычно выделен и затем очищен, с последующим восстановлением указанного енамина. Соответствующими растворителями являются, например, вода; С1-6-алканолы, например метанол, этанол, 2-пропанол и т.п. эфиры. например, 1,4-диоксан и т.п. галоидированные углеводороды, например трихлорметан и т. п. диполярные апротонные растворители, например 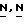 -диметилформамид,
-диметилформамид,  -диметилацетамид, диметилсульфоксид и т.п. или смесь таких растворителей. Соответствующими восстановителями являются, например, гидриды металла или комплексные гидриды металлов, например борогидрид натрия, цианоборогидрид натрия, литий-алюминий гидрид и т.п. Альтернативно может быть использован в качестве восстановителя водород в присутствии соответствующего катализатора, такого как, например, палладий-на-угле, платина-на-угле и т.п. Для того, чтобы предотвратить нежелательное дальнейшее гидрирование некоторых функциональных групп в реагентах и продуктах реакции, необходимо добавить к реакционной смеси эффективный соответствующий каталитический яд, такой как, например, тиофен и т.п.
-диметилацетамид, диметилсульфоксид и т.п. или смесь таких растворителей. Соответствующими восстановителями являются, например, гидриды металла или комплексные гидриды металлов, например борогидрид натрия, цианоборогидрид натрия, литий-алюминий гидрид и т.п. Альтернативно может быть использован в качестве восстановителя водород в присутствии соответствующего катализатора, такого как, например, палладий-на-угле, платина-на-угле и т.п. Для того, чтобы предотвратить нежелательное дальнейшее гидрирование некоторых функциональных групп в реагентах и продуктах реакции, необходимо добавить к реакционной смеси эффективный соответствующий каталитический яд, такой как, например, тиофен и т.п.
Энантиомерно чистые формы соединений формулы (I) могут быть получены превращением рацемической смеси соединений формулы (I) с использованием соответствующего разделяющего или расцепляющего агента, такого как, например, хиральная кислота, например винная, яблочная, миндальная кислоты, камфорсульфоновая кислота, 4,5-дигидро-I  -2-бензопиран-2-карбоновая кислота и т. п. в смесь диастереомерных солей; физическим разделением указанных смесей, например, селективной кристаллизацией или хроматографией, например, жидкостной хроматографией и т.п. методами; и, наконец, переводом указанных разделенных диастереомерных солей в соответствующие энантиомерные формы соединения формулы (I) гидролизом в кислой или щелочной водной среде, необязательно при повышенной температуре.
-2-бензопиран-2-карбоновая кислота и т. п. в смесь диастереомерных солей; физическим разделением указанных смесей, например, селективной кристаллизацией или хроматографией, например, жидкостной хроматографией и т.п. методами; и, наконец, переводом указанных разделенных диастереомерных солей в соответствующие энантиомерные формы соединения формулы (I) гидролизом в кислой или щелочной водной среде, необязательно при повышенной температуре.
Альтернативно, энантиомерно чистые формы могут легко быть получены из энантиомерно чистых изомерных форм исходных материалов, при условии, что последующие реакции проходят стереоспецифически. Например, энантиомерно чистые формы соединения (I) могут быть получены реакцией энантиомерно чистого эпоксида формулы (IV) с промежуточным соединением формулы (II), как описано выше. Энантиомерно чистый эпоксид формулы (IV) может быть получен реакций 3,4-дифторфенола с энантиомерно чистым эпоксидом формулы (XVII), как описано ниже.
В качестве дополнительной альтернативы, энантиомеры могут быть отделены с помощью жидкостной хроматографии с использованием хиральной стационарной фазы.
Ряд промежуточных материалов в вышеуказанных способах получения являются известными соединениями, которые могут быть получены известными методами получения указанных или подобных соединений. Способы получения некоторых других промежуточных соединений описаны ниже более подробно.
Промежуточное соединение формулы (II) может быть получено окислительной циклизацией производного тиомочевины формулы (XII), где Р является соответствующей удаляемой группой, такой как, например, С1-6-алкилоксикарбонил, фенилметоксикарбонил, фенилметил и т.п. а W2 имеет значения, описанные выше, с помощью тех же приемов, описанных ранее для получения (I) из (VII), и последующего удаления защитной группы Р в полученном таким образом промежуточном соединении (XIII).
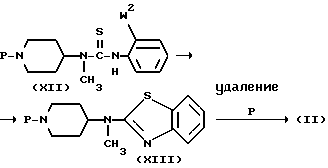
Удаление защитной группы Р в (XIII) может быть выполнено, следуя известным способам, как например, гидролиз в кислой или щелочной водной среде или каталитическое гидрирование, в зависимости от природы P.
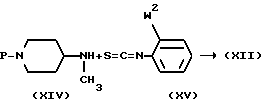
Указанные промежуточные соединения формулы (XII) могут, в свою очередь, быть получены реакцией амина формулы (XIV) с изоцианатом формулы (XV), как описано ранее для получения (VII) из (V) и (VI).
Промежуточное соединение формулы (IV) может быть получено реакцией 3,4-дифторфенола (XVI) с эпоксидом формулы (XVII). В формуле (XVII) W1 имеет ранее описанное значение.
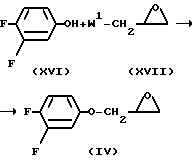
Указанная реакция алкилирования может быть выполнена, как описано ранее для получения (I) из (II) и (III).
Соединение формулы (I) (рацемическая смесь и (S)-форма) и фармацевтически приемлемые его соли кислотного присоединения обладают антиударными свойствами ин виво, которые могут быть подтверждены испытанием, названным "Пост-лечение фотохимической модели удара на крысах", которое описывается в экспериментальной части ниже.
Настоящие соединения, подобные известным соединениям из Патента США 4861785 (такие как сабелюзол), являются потенциальными антигипоксическими агентами. Неожиданное свойство настоящих соединений по сравнению с указанными известными соединениями состоит в том, что настоящие соединения являются сильными для применения в качестве антиударных агентов ин виво, в то время как подобная активность не наблюдается в случае известных соединений. Антиударная активность, проявляемая заявляемыми соединениями, является неожиданной с точки зрения того факта, что заявляемые соединения являются слегка менее сильными антигипоксическими агентами по сравнению с сабелюзолом. Очевидно, нет простой зависимости между антигипоксической и антиударной активностью ин виво. Поэтому, заявляемые соединения могут быть использованы при остром лечении ударов, тогда как известные соединения используются только при хроническом лечении ударов, например при поддерживающем лечении. Дополнительные преимущества заявляемых соединений над известными соединениями заключаются в более длительном сохранении антигипоксической активности, отсутствии явлении успокоения и нарушения координации движения у мышей и отсутствии птоза век у крыс.
С точки зрения их полезных фармакологических свойств, заявляемые соединения могут формироваться в виде рецептур в различных фармацевтических формах для целей назначения. Для получения фармацевтических композиций, соответствующих изобретению, эффективное количество конкретного соединения, в форме соли кислотного присоединения или основания, в качестве активного ингредиента объединяются в тесную связь с фармацевтически приемлемым носителем, который может иметь широкий диапазон форм в зависимости от формы препарата, желаемой для назначения. Эти фармацевтические композиции являются желательными в форме единичной дозировки, пригодной для употребления, предпочтительно, для приема внутрь, ректально, кожной или парэнтеральной инъекции. Например, для получения композиций в виде дозированной формы для приема внутрь может быть применена любая фармацевтическая среда, такая как, например, вода, гликоли, масла, спирты и т.п. в случае жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазки, связующие, дезинтеграционные агенты и т.п. в случае порошков, пилюль, капсул и таблеток. Благодаря их легкости назначения таблетки и капсулы представляют наиболее распространенную форму единичной дозировки для приема внутрь, причем в обоих случаях используются обычно применяемые твердые фармацевтические носители. В случае парэнтеральных композиций носитель обычно содержит стерильную воду, по крайней мере в большей части, хотя, например, для целей растворимости, могут быть включены другие ингредиенты, например, могут приготавливаться инъецируемые растворы, в которых носитель включает солевой раствор, глюкозный раствор или смесь солевого и глюкозного раствора. Инъецируемые растворы, содержащие соединения формулы (I), могут также формироваться в масле для длительного действия. Маслами, пригодными для этой цели, являются, например, арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические глицериновые эфиры жирных кислот с длинной цепью и смеси этих и других масел. Могут также приготавливаться инъекционные суспензии, в которых могут применены соответствующие жидкие носители, суспендирующие агенты и т.п. В композициях, предназначенных для кожного назначения, носитель обычно содержит агент, усиливающий пенетрацию, и/или соответствующий смачивающий агент, необязательно в комбинации с подходящими добавками любой природы в минимальных пропорциях, чтобы добавки не оказывали вредного воздействия на кожу. Указанные добавки могут облегчить нанесение на кожу и/или могут быть полезными для получения желаемых композиций. Эти композиции могут быть применены различными способами, например, трансдермально, или в виде мази. Соли кислотного присоединения (I), благодаря их повышенной водорастворимости по сравнению с соответствующей основной формой, являются более подходящими для получения водных композиций.
Интересными композициями среди групп композиций являются композиции, содержащие циклодекстрин (ЦД) или его эфирное производное в качестве комплекса образующего агента и/или солюбилизатора. В качестве примеров таких циклодекстринов могут быть указаны α-ЦД, b-ЦД, g-ЦД и его эфирные или смешанные эфирные производные.
Конкретные производные таких декстринов описываются в Патенте США 3459731, Европейском патенте А-0149197 и Европейском патенте А-0197571.
Обычно такие производные эфира или смешанных эфиров включают a -, b- и g-ЦД, где одна или более гидроксильных групп замещены С1-6-алкилом, в частности метилом, этилом или изопропилом, гидрокси-C1-6-алкилом, особенно, гидроксиэтилом, гидроксипропилом или гидроксибутилом; карбокси-C1-6-алкилом, особенно, карбоксиметилом или карбоксиэтилом; C1-6-алкилоксикарбонил-C1-6-алкилом или карбокси-C1-6-алкилокси-C1-6алкилом, особенно, карбоксиметоксипропилом или карбоксиэтоксипропилом. Особенно примечательно, когда комплексантами и/или солюбилизаторами являются b-ЦД, 2,6-диметил-b-ЦД и, в частности, 2-гидроксипропил-b-ЦД, 2-гидроксиэтил-b-ЦД, 2-гидроксиэтил-g-ЦД, 2-гидроксипропил-g-ЦД и (2-карбоксиметокси)пропил-b-ЦД. В вышеуказанных производных циклодекстрина С3 (степень замещения, т.е. среднее число замещенных гидроксифункций на глюкозное звено), предпочтительно, находится в пределах от 0,125 до 3, в частности от 0,2 до 2 или от 0,2 до 1,5. Более предпочтительно С3 изменяется в пределах от 0,2 до 0,7, в частности от 0,35 до 0,5 и наиболее часто около 0,4. МЗ (мольная степень замещения, т.е. среднее число молей замещающего агента на глюкозное звено) находится в пределах от 0,125 до 10, в частности от 0,3 до 3 или от 0,3 до 1,5. Более предпочтительно, МЗ изменяется в пределах от 0,3 до 0,8, в частности от 0,35 до 0,5 и наиболее часто около 0,4. Указанные композиции могут легко быть получены растворением циклодекстрина или его эфирного производного в воде и добавлением к соединению формулы (I) раствора, а также других адъювантов и компонентов, таких как, например, хлорид натрия, нитрат калия, глюкоза, маннит, сорбит, ксилит и буферные соединения, такие как, например, фосфаты, ацетаты или цитраты; и обычно концентрированием или сушкой раствора испарением при пониженном давлении или лиофилизацией; и дальнейшим смешением лиофилизованного остатка с водой. Количество циклодекстрина или его эфирного производного в конечной композиции обычно находится в пределах от 1 до 40% в частности от 2,5 до 25% и более часто от 5 до 20%
Особым преимуществом является преобразование или формирование вышеуказанных фармацевтических композиций в виде единичной дозы для облегчения назначения и равномерности дозировки. Дозированная единичная форма, как использовано в описании и формуле изобретения, относится к физически раздельным единицам, пригодным для единичного дозирования, причем каждая единица содержит определенное количество активного ингредиента, рассчитанное с учетом желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких дозированных единичных форм являются таблетки (включая непокрытые или покрытые таблетки), капсулы, пилюли, пакетики порошков, облатки, инъекционные растворы и суспензии, чаи, отвары и т.п. и раздельные множества их.
С точки зрения антиударных свойств, соединение формулы (I) (рацемическая смесь и (S)-форма) и его соли кислотного присоединения могут быть использованы для острого лечения субъектов, страдающих от таких состояний, как, например, ишемический приступ, удар с кровоизлиянием, субарахноидальное кровотечение, или они могут быть использованы в остром лечении пост-асфиксиального повреждения головного мозга у новорожденных. В дополнительном аспекте, изобретение предусматривает способ лечения субъектов, страдающих от указанных состояний, причем указанный способ содержит системное назначение эффективного ударозащитного количества соединения формулы (I) или фармацевтически приемлемой его соли присоединения. Специалисты в области лечения болезней могут легко определить эффективное количество по результатам испытания, представленным ниже. В основном считается, что эффективное защитное против удара количество составляет от примерно 0,1 мг до примерно 100 мг в день, более предпочтительно, от примерно 1 мг до примерно 50 мг в день. Может быть подходящим назначение требуемой дозы в виде двух, трех или более суб-доз с интервалами приема через день. Указанные суб-дозы могут быть изготовлены в виде единичной дозировки, например, содержащей от 0.1 до 100 мг, и в частности, от 1 до 50 мг активного ингредиента на форму единичной дозировки.
Соединение формулы (I), предпочтительно, применяется внутривенно. Композиции для внутривенного применения могут содержать, кроме эффективного противоударного количества соединения формулы (I), буферную систему, изотонизирующий агент, воду, циклодекстрин или его эфирное производное и необязательно дополнительный фармацевтически приемлемый ингредиент.
Следующие примеры приводятся для иллюстрации, но не для ограничения объема изобретения.
Экспериментальная часть
А. Получение промежуточных соединений
Пример 1
К перемешиваемой и охлажденной (на ледяной бане) смеси 13,0 г 3,4-дифторфенола и 200 мл  -диметилформамида, добавлялись 4,8 г дисперсии гидрида натрия в минеральном масле (50%) и, после перемешивания в течение 1 ч раствор 22,8 г (S)-(оксиранилметил)-4-метилбензолсульфоната (эфира) в том же
-диметилформамида, добавлялись 4,8 г дисперсии гидрида натрия в минеральном масле (50%) и, после перемешивания в течение 1 ч раствор 22,8 г (S)-(оксиранилметил)-4-метилбензолсульфоната (эфира) в том же  -диметилформамиде. Перемешивание при комнатной температуре продолжалось с вечера до утра. Реакционная смесь выливалась в ледяную воду, и продукт экстрагировался метилбензилом. Экстракт промывался NaCl (разб.) и водой и затем сушился, фильтровался и выпаривался. Остаток перегонялся (13,3 Па:55oС), давая 9,5 г (51,0%) (S)-[(3,4-дифторфенокси)метил]-оксирана (промежуточное соединение 1).
-диметилформамиде. Перемешивание при комнатной температуре продолжалось с вечера до утра. Реакционная смесь выливалась в ледяную воду, и продукт экстрагировался метилбензилом. Экстракт промывался NaCl (разб.) и водой и затем сушился, фильтровался и выпаривался. Остаток перегонялся (13,3 Па:55oС), давая 9,5 г (51,0%) (S)-[(3,4-дифторфенокси)метил]-оксирана (промежуточное соединение 1).
Пример 2
Смесь 117,1 г 3,4-дифторфенола, 185,5 г хлорметилоксирана, 125 г карбоната калия и 500 мл 2-пропанона перемешивалась в течение 48 ч при температуре дефлегмации. Реакционная смесь выпаривалась, и остаток брался в дихлорметан. Затем все последовательно промывалось водой, NаОН (водн.) (дважды) и водой, и затем сушилось, фильтровалось и выпаривалось. Остаток перегонялся (13,3 Па, 58oС), давая 90,4 г (54,0%) [(3,4-дифторфенокси)метил]оксирана (промежуточное соединение 2).
В. Получение конечных соединений.
Пример 3
Смесь 3,4 г промежуточного соединения 2, 6,1 г  -метил-
-метил- -(4-пиперидинил)-2-бензотиазоламиндигидробромида, 100 мл 2-пропанола и 5,3 г карбоната натрия перемешивалась на протяжении ночи при температуре дефлегмации. Реакционная смесь выпаривалась, а остаток распределялся между водой и дихлорметаном. Органический слой отделялся, сушился, фильтровался и выпаривался. Остаток очищался на хроматографической колонне (силикагель; CHCI3:CH3ОН 98: 2). Элюент желаемой фракции выпаривался, остаток превращался в дигидрохлоридную соль в 2-пропаноле. Продукт отфильтровывался, промывался, 2-пропанолом и 2,2-оксибиспропаном и сушился при 60oС и при 80oС, давая 6,1 г (80,3%) 4-(2-бензотиазолилметиламино)-α -[(3,4-дифторфенокси)метил] -1-пиперидинэтанолдигидрохлорида; т. пл. 211,8o (соединение 1). Подобным образом был также получен: (-)-(S)-4-[(2-бензотиазолил)метиламино]-a-[(3,4-дифторфенокси) окси)метил]-1-пиперидинэтанол (Е)-2-бутендиоат (1:1); т. пл. 167,8oС;
-(4-пиперидинил)-2-бензотиазоламиндигидробромида, 100 мл 2-пропанола и 5,3 г карбоната натрия перемешивалась на протяжении ночи при температуре дефлегмации. Реакционная смесь выпаривалась, а остаток распределялся между водой и дихлорметаном. Органический слой отделялся, сушился, фильтровался и выпаривался. Остаток очищался на хроматографической колонне (силикагель; CHCI3:CH3ОН 98: 2). Элюент желаемой фракции выпаривался, остаток превращался в дигидрохлоридную соль в 2-пропаноле. Продукт отфильтровывался, промывался, 2-пропанолом и 2,2-оксибиспропаном и сушился при 60oС и при 80oС, давая 6,1 г (80,3%) 4-(2-бензотиазолилметиламино)-α -[(3,4-дифторфенокси)метил] -1-пиперидинэтанолдигидрохлорида; т. пл. 211,8o (соединение 1). Подобным образом был также получен: (-)-(S)-4-[(2-бензотиазолил)метиламино]-a-[(3,4-дифторфенокси) окси)метил]-1-пиперидинэтанол (Е)-2-бутендиоат (1:1); т. пл. 167,8oС;
[α]
Пример 4
К перемешанной смеси 10 г промежуточного соединения 1, 14,3 частей  -метил-
-метил- -(4-пиперидинил)-2-бензотиазоламина (полученного, как описано в Патенте США 4861785); 14,2 г карбоната натрия и 112 мл 1-бутанола добавлялось по каплям 11,2 мл воды. После перемешивания в течение 16 ч при температуре дефлегмации реакционная смесь разбавлялась к 100 мл воды. Органический слой отделялся, сушился, фильтровался и выпаривался. Остаток растворялся в 200 мл дихлорметана, и раствор перемешивался в течение 2 ч с 50 г силикагеля. Силикагель отфильтровывался и промывался смесью дихлорметана и метанола (95: 5). Фильтрат выпаривался, и остаточное масло кристаллизовалось из 2,2'-оксибиспропана. Продукт отфильтровывался и сушился при 50oС, давая 7,5 г (38,7% ) (+)-(S)-4-[(2-бензотиазолил)метиламино] -α -[(3,4-дифторфенокси)метил] -1-пиперидинаэтанола; т. пл. 65,8oС; [α]
-(4-пиперидинил)-2-бензотиазоламина (полученного, как описано в Патенте США 4861785); 14,2 г карбоната натрия и 112 мл 1-бутанола добавлялось по каплям 11,2 мл воды. После перемешивания в течение 16 ч при температуре дефлегмации реакционная смесь разбавлялась к 100 мл воды. Органический слой отделялся, сушился, фильтровался и выпаривался. Остаток растворялся в 200 мл дихлорметана, и раствор перемешивался в течение 2 ч с 50 г силикагеля. Силикагель отфильтровывался и промывался смесью дихлорметана и метанола (95: 5). Фильтрат выпаривался, и остаточное масло кристаллизовалось из 2,2'-оксибиспропана. Продукт отфильтровывался и сушился при 50oС, давая 7,5 г (38,7% ) (+)-(S)-4-[(2-бензотиазолил)метиламино] -α -[(3,4-дифторфенокси)метил] -1-пиперидинаэтанола; т. пл. 65,8oС; [α]
Аналогичным образом получался также (±)(RS)-4-[(2-бензотиазолил)метил-амино] -α -[(3,4-дифторфенокси)метил] -1-пиперидинэтанол; т. пл. 86,4oС (соединение 4).
Пример 5
4,0 г соединения 2 обрабатывались аммиаком с получением свободного основания. Раствор выпаривался, и остаток превращался в дигидрохлоридную соль в 2-пропаноле. Соль отфильтровывалась, промывалась 2-пропанолом и 2,2'-оксибиспропаном и сушилась в вакууме при 30oС, давая 3,0 г (81,4%) (-)-(S)-4-[(2-бензотиазолил)-метиламино] -a -[(3,4-дифторфеокси)метил] -1-пиперидинэтанолдигидрохлорида; т. пл. 148,7oС; [α]
Пример 6
К перемешанному раствору 6,9 г соединения 3 в 100 мл 2-пропанона добавлялось по каплям 10 мл 2-пропанола, насыщенного бромистым водородом, при комнатной температуре. Осадок отфильтровывался, и фильтрат выпаривался. Остаток превращался в гидробромидную соль в 2-пропаноне. Продукт отфильтровывался, промывался 2,2'-оксибиспропаном и сушился при 60oС, давая 5,5 г (58,1% ) (-)-(S)-4-[(2-бензотиазолил)метиламино] -α -[(3,4-дифторфенокси)метил]-1-пиперидинэтанолдигидробромида; т. пл. 213,7oС (соединение 6).
Пример 7
К перемешанному раствору 4,38 г соединения 3 в 150 мл этилацетата добавлялось 9,40 г 7,7-диметил-2-оксабицикло[2,2,1] гептан-1-метансульфоновой кислоты. Реакционная смесь нагревалась до тех пор, пока не становилась гомогенной. После охлаждения до 20oС все перемешивалось в течение 24 ч. Выкристаллизовавшийся продукт отфильтровывался, промывался дважды 25 мл этилацетата и сушился при 50oС, давая 7 г (77,9%) (+)-(S)-4-[(2-бензотиазолил)метиламино] -a -[(3,4-дифторфенокси)метил] -1-пиперидинэтанол (S)-7,7-диметил-2-оксобицикло [2,2,1]гептан-1-метансульфоната (1:2); т. пл. 119,5oC (соединение 7).
Пример 8
К перемешанному раствору 4,38 г соединения 3 в 100 мл 2-пропанола добавлялось 3,11 г (+)-(L)-2-[(4-метилфенил)сульфониламино]пентандионовой кислоты. Реакционная смесь нагревалась до тех пор, пока не становилась гомогенной. После медленного охлаждения до 20oC реакционная смесь перемешивалась в течение 68 ч при 20oС. Выпавший в осадок продукт отфильтровывался, промывался 25 мл 2-пропанола и сушился в вакууме при 50oС, давая 6,87 г (93,5%) (+)-(S)-4-[(2-бензотиазолил)метиламино] -a-[(3; 4-дифторфенокси)метил]-1-пиперидинэтанол (+)-(L)-2-[(4-метилфенил)сульфонил]амино]пентандиоата (1:1) (соединение 8).
С. Фармакологические примеры
Полезные противоударные свойства соединений формулы (1) демонстрируются с помощью следующей процедуры испытаний.
Пример 9 Пост-лечение фотохимической модели удара (приступа) на крысах
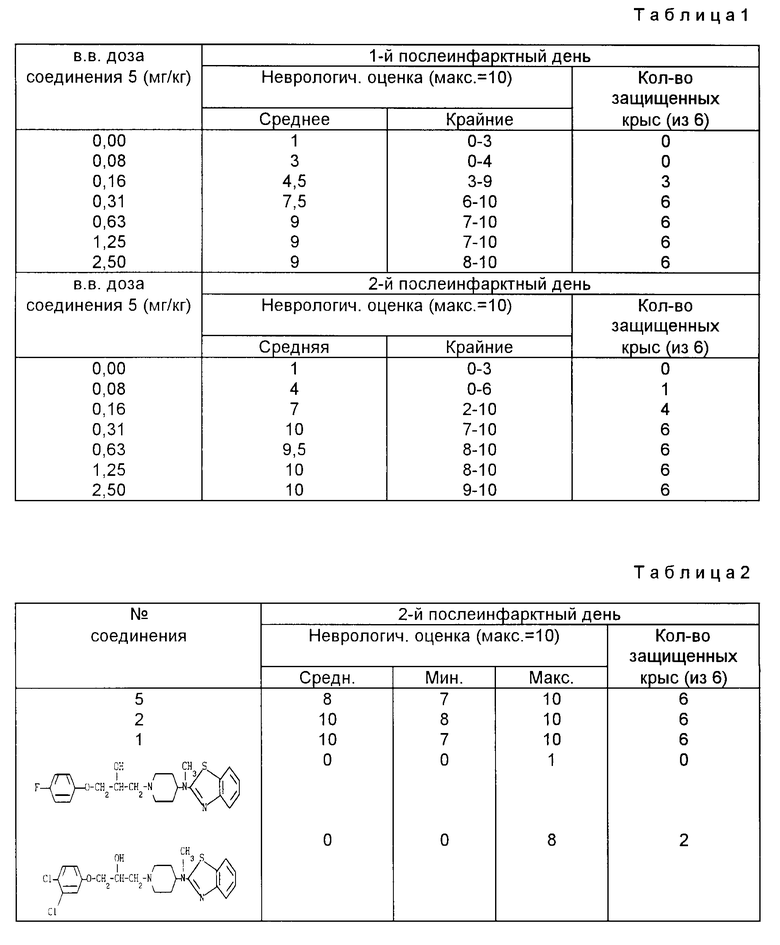
Самцы крыс Wistar, весом 260-280 г анестезировались галотаном в N2O/O2-смеси. Животных помещали в стереотактический аппарат, скальп разрезался для открытия черепной поверхности, и катетер вводился в боковую хвостовую вену. Rose Bengal (30 мг/кг; 15 мг/мл в 0,9% NаCI) вливался внутривенно животным в течение 2 мин с обычными гемодинамическими и кровяным газами. После этого череп фокально освещался холодным белым светом в течение 5 мин с помощью волоконно-оптического пучка с 1-мм диаметром объектива. Свет был нацелен на область задней конечности правого теменного сенсоромоторного неокортекса. Через 5 мин после инфарктной индукции (т.е. через 5 мин после отвода света) крысам инъецировали внутривенно (в.в.) шариком соединения 5 или его носителем, 10% гидроксипропил-b-циклодекстрином. Неврологические испытания, включающие реакции помещения конечностей, проводились в первые два дня после развития инфаркта с 24-часовым интервалом после его индуцирования, тактильное помещение вперед и вбок испытывалось по легкому контакту края стола со спинной и боковой сторонами лапы (2 испытания).
Проприоцептивное помещение вперед и вбок включало подталкивание лапы против края стола для того, чтобы стимулировать мышцы и сочленения конечности (2 испытания). Крыс помещали вдоль края поднятой платформы для того, чтобы оценить проприоцептивное приведение конечности к средней линии: лапа слегка оттягивалась вниз и в сторону от края платформы, и, после внезапного высвобождения, проверялась на возврат и размещение (1 ис.). Для каждого из 5 испытаний оценки размещения были: 0, отсутствие размещения; 1, неполное и/или задержанное размещение; или 2, немедленное, полное размещение. Для каждой конечности суммарная оценка тактильного/проприоцептивного размещения, включая испытание с платформой, была максимально 10. В испытаниях на каждую дозу использовали 6 крыс. Ниже даны результаты испытаний для соединения 5. Табл. 1 дает средние и экстремальные оценки размещения конечностей наряду с числом защищенных крыс (оценка 5) в 1 и 2 послеинфарктные дни. В 50% для соединения 5, которая является дозой, которая дает защиту неврологической функции у 50% крыс, при 95% пределе доверительности, составляла 0,16 (0,13-0,20) и 0,13 (0,08-0,20) мг/кг (внутривенно) в 1 и 2 послеинфарктные дни, соответственно.
Пример 10. Пост-лечение фотохимической модели удара у крыс. Условия испытаний являются такими же, как описаны в примере 9, за исключением того, что через 60 мин после инъекции внутривенных шариков испытываемым животным давалась инвериантная оральная доза 10 мг/кг испытываемого соединения.
Результаты испытаний для ряда соединений согласно изобретению сравниваются с результатами двух соединений-аналогов, описанных в Патенте США 4861785.
Табл. 2 представляет среднее и крайние оценки размещения конечностей наряду с числом защищенных крыс (оценка ≥5) во 2-й послеинфарктный день после применения дозы 1,25 мг/кг вв. + 10 мг/кг (через рот) испытываемого соединения.
С. Примеры композиций
Следующие рецептуры являются примерами типичных фармацевтических композиций в форме единичной дозы, пригодной для системного или местного назначения для теплокровных животных в соответствии с изобретением.
"Активный ингредиент" (а.и.), используемый во всех этих примерах, относится к соединению формулы (I), его фармацевтически приемлемой соли кислотного присоединения или стереохимически изомерной форме.
Пример 11. Инъецируемые растворы.
а) 1,8 г метил-4-гидроксибензоата и 0,2 г пропил-4-гидрокси-бензоата растворяются примерно в 0,5 л кипящей воды для инъекций. После охлаждения примерно до 50oС туда добавляется при перемешивании 4 г молочной кислоты, 0,05 г пропиленгликоля и 1 г а.и. Раствор охлаждается до комнатной температуры, и к нему добавляется вода для инъекции, дополняется до 1 л объема с получением раствора 1 мг а.и. на мл. Раствор стерилизуется фильтрацией (U.S. P. XVII стр. 811) и наливается в стерильный контейнер.
в) активный ингредиент 4 мг
Хлорид натрия 3,59 мг
Цитрат натрия 2 воды 5,8 мг
Лимонная кислота 1 водн. 62 мкг
Гидроксипропил-b-циклодекстрин (МЗ=0,4) 100 мг
Хлористоводородная кислота (1 норм.) или сколько необходимо до рН 6,9
Гидроокись натрия (1 норм)
Вода до 1 мл
Способ получения
18 л холодной свободной от пирогенов воды стерилизуется фильтрацией. Туда же добавляется при перемешивании 2 кг гидроксипропил-b-циклодекстрина (МЗ=0,4), 116 г цитрата натрия (дигидрата), 1,24 г лимонной кислоты (IH2O) и 71,8 г хлорида натрия. Раствор охлаждается до 25oС и рН доводится до рН 6,9 добавлением NаОН (1 норм) и NCl (1 норм.). Раствор перемешивается до гомогенного состояния и охлаждается до 2-8oC. 80 г соединения формулы (I) добавляется к буферному раствору лимонной кислоты и перемешивается в течение 5 мин при температуре ниже 8oC. Этот раствор разбавляется холодной свободной от пирогенов водой до окончательного объема 20 л и стерилизуется фильтрацией в атмосфере стерильного азота. Конечный раствор наливается в стерильные 1 мл-контейнеры.
Следующая рецептура приготовляется аналогичным образом с применением соответствующих количеств ингредиентов для получения конечного раствора требуемого состава.
с)
Активный ингредиент 1 мг
Хлористоводородная кислота (1 норм.) 6,35 мг
Гидроксипропил- b-циклодекстрин 10 мг
Глюкоза, безводн. 46 мг
Гидроокись натрия (1 норм.) до рН 4
Вода до 1 мл
Пример 12. Оральные капли
50 г а. и. растворяется в 0,5 л 2-гидроксипропановой кислоты и 11,5 л полиэтиленгликоля при 60-80oС. После охлаждения до 30-40oС добавляется 35 л полиэтиленгликоля, и смесь хорошо перемешивается. Затем туда добавляется раствор 1750 г натрий-сахарина в 2,5 л очищенной воды, и при перемешивании туда добавляется 2,5 л какао ароматизатора и полиэтиленгликоль в количество до получения общего объема 50 л, получая раствор внутренних (оральных) капель, содержащий 1 мг/мл а.и. Конечным раствором заполняются соответствующие контейнеры.
Пример 13. Раствор для приема внутрь
9 г метил-4-гидроксибензоата и 1 г пропил-4-гидроксибензоата растворяются в 4 л кипящей очищенной воды. В 3 л этого раствора растворяется сначала 10 г 2,3-дигидроксибутандионовой кислоты и затем 8 г а.и. Последний раствор комбинируется с остальной частью первого раствора, и к нему добавляется 12 л 1,2,3-пропантриола и 3 л 70% раствора сорбита. 40 г натрий-сахарина растворяется в 0,5 л воды и добавляется 2 мл малиновой и 2 мл крыжовниковой эссенции. Последний раствор комбинируется с первым, добавляется вода до объема 20 л с получением раствора для приема внутрь, содержащего 2 мг а.и. на чайную ложку (5 мл). Конечный раствор разливается в подходящие контейнеры.
Пример 14. Капсулы
2 г а.и. 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидной двуокиси кремния и 1,2 г стеарата магния энергично смешиваются вместе. Полученной смесью впоследствии заполняют 1000 подходящих твердых желатиновых капсул, каждая из которых содержит 2 мг а.и.
Пример 15. Таблетки с пленочным покрытием.
Получение ядра таблетки
Смесь 10 г а. и. 500 г лактозы и 200 г крахмала хорошо смешивается и затем увлажняется раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона (Коллидон-К 90® ) в примерной 200 мл воды. Влажная порошковая смесь просеивается, сушится и снова просеивается. Затем добавляется 100 г микрокристаллической целлюлозы (Авицел®) и 15 г гидрированного растительного масла (Стеротекс®). Все хорошо смешивается и прессуется в таблетки с получением 10000 таблеток, каждая из которых содержит 1 мг а.и.
Покрытие
К раствору 10 г метилцеллюлозы (Метоцел 60 HG HG® ) в 75 мл денатурированного этанола добавляется раствор 5 г этилцеллюлозы (Этоцел 22 спз®) в 150 мл дихлорметана. Затем туда добавляется 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. 10 г полиэтиленгликоля расплавляется и растворяется в 75 мл дихлорметана. Последний раствор добавляется к первому, и затем туда добавляется 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл суспензии концентрированного красителя (Opaspray К-1-2109®), и все гомогенизируется. Ядро таблеток покрывается полученной таким образом смесью в оборудовании для нанесения покрытия.
Использование: в химии гетероциклических соединений, обладающих противоинфарктным действием на мозговую ткань. Сущность изобретения: 4-/(2-бензотиазолил)метиламино/-α -/(3,4-дифторфенокси)метил/-1-пиперидинэтанол в виде рацемической смеси или (S)-формы или его фармацевтически приемлемая соль присоединения кислоты. Описываются фармацевтические композиции на основе этого соединения, проявляющие противоинфарктные свойства на мозговую ткань, способ получения указанного соединения. 3 с. и 4 з.п. ф-лы, 2 табл.
в виде рацемической смеси или (S)-формы или его фармацевтически приемлемая соль присоединения кислоты.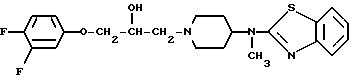
в виде рацемической смеси или (S)-формы или его фармацевтически приемлемой соли присоединения кислоты, отличающийся тем, сто пиперидин формулы II
подвергают взаимодействию с эпоксидом формулы IV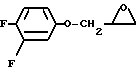
при необходимости при получении соединения формулы I в виде рацемической смеси превращают ее в смесь диастереомерных солей с помощью подходящего расщепляющего агента, такого, как, например, хиральная кислота, и затем осуществляют физическое разделие указанной смеси с помощью, например, селективной кристаллизации или хроматографических приемов и, наконец, превращение указанных разделенных диастереомерных солей в соответствующие энантиомерные формы соединения формулы I с помощью гидролиза в кислой или основной среде, необязательно при повышенной температуре или, если необходимо, превращают соединение формулы I в солевую форму с помощью обработки фармацевтически приемлемой кислотой, или наоборот, превращают солевую форму в свободное основание с помощью обработки щелочью.
| US, патент, 4861785, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1997-10-27—Публикация
1992-02-14—Подача