Изобретение относится к новым производным N-ацил-α-аминокислоты и фармацевтическим композициям на их основе.
Из литературы известны различные производные аминокислот. Известны [1] соединения формулы II: H2N(NH)CNHC6H4ZCOOH, не содержащие амидных групп. Эти кислоты не считаются физиологически активными. Полагают, что соответствующие кислотам II амиды I, которые вместо группы -Z-COOH содержат группу -Z-COOCH2CON(R1,R2), действуют как ингибиторы трипсина и плазмина и таким образом могут находить применение при лечении острого геморрагического панкреатита.
В отличие от этих соединений заявленные соединения тормозят связывание других протеинов, таких как фибриноген, фибронектин, витронектин, коллаген, ламинин и фактор Виллибранда, с соответствующими рецепторами и поэтому могут быть использованы при лечении такого, например, заболевания, как тромбоз. Эта, на удивление эффективная, тормозящая активность подтверждается ниже (см. таблицу).
Наиболее близкими являются N-ацил-альфа-аминокислоты [2] которые отличаются от предлагаемых производных радикалами Q и R', R" (см. ниже структурную формулу I), и их активность, например, как ингибитора связывания кровяных пластинок, как видно из нижеуказанных сравнительных данных, уступает активности предлагаемых соединений.
Согласно изобретению предлагаются производные N-ацил-альфа-аминокислоты формулы I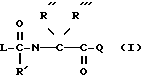
где L группа формулы: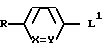
или
H2N(CH2)t, L2
где X обозначает CH;
Y обозначает CH или N;
t обозначает целое число от 2 до 6;
R амидиногруппа;
R' обозначает H, Alk, AlkOAlk;
R'' обозначает h, Alk, AlkNH2, AlkOH, AlkCOOH, Alkиндолил, AlkOCOAlk, Ph, AlkPh, где Ph необязательно имеет один или несколько заместителей, выбранных из группы OH, галоген, OAlk, причем OH- или COOH-группы в R'' могут быть переведены в простой или сложный эфир или амид или
R' обозначает вместе с R'' при определенных условиях пропилен- или бутилен-группу, замещенную OH или AlkPh;
R''' обозначает Alk или H;
Q обозначает группу формулы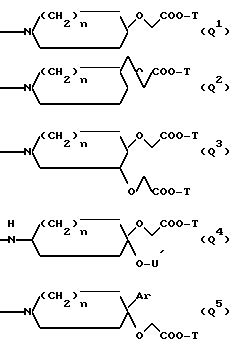
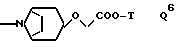
или -NH(CH2)vOCH2COO-T Q7,
где U, U' H, низший алканоил; Ar F3AlkPh или, если R' и R'' вместе с N и C атомами, с которыми они связаны, образуют пирролидиниленовое или пиперидиниленовое кольцо, может быть также группой формулы: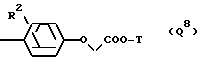
где R2 Alk, H, OCH2COOAlk;
везде Alk обозначает низший алкил;
v целое число от 2 до 5;
n целое число от 0 до 1;
T обозначает H или низший алкил;
T' обозначает H;
или их физиологически приемлемые соли или их простые или сложные эфиры, или амиды, или их гидраты.
Предпочтительными являются соединения I, где L представляет группу L1, R', R'' и R''' обозначают водород или другие указанные выше значения, причем находящиеся в R'' гидроксильные или карбоксильные группы могут быть этерифицированы с образованием простого или сложного эфира или амидированы, и T обозначает в группе Q водород или отщепляемый при физиологических условиях низший алкил; а также соединение I, где L обозначает группу L1, R обозначает амидино, X обозначает CH, Y обозначает CH или N, Q обозначает группу Q1, Q2, Q4, Q5 или Q8.
Предпочтительными являются также соединения I, где Q обозначает группу Q1, особенно где n= 1 и T обозначает водород или метил, и -N(R')C(R'', R''')CO- один из остатков Gly, Ala, D-Ala, Val, Leu, Sar, Orn, Lys, Phy, 2-метил-Pro, Phe, Tyr, 3-иод-Tyr, 3,5-дииод-Tyr, Ser(Ac), Ser, Asp, Glu, Pro, 4-бензилокси-Pro, 4-гидрокси-Pro, 2-пиперидиленкарбонил, NHCH(CH2CH2NH2)CO, Trp, Tyr(Me), Tyr(гексил) и O,N(Me)2-Tyr;
в частности, соединения I, где Q обозначает группу Q2, особенно если n 1, T обозначает водород и -N(R')C(R'', R''')CO является остатком Ala,
или соединения I, где Q обозначает группу Q4, особенно такие соединения, где n 1, T обозначает водород, U и U' обозначают водород или Ac, и -N(R')C(R'', R''')CO является остатком Ala;
либо соединения I, где Q обозначает группу Q5, особенно если n 1, T обозначает водород, Ar обозначает α,α,α-трифтор-м-толил и (N(R')C(R'', R''')CO- является остатком Ala;
а также соединения I, где Q обозначает группу Q8, особенно где R2 обозначает группу -OCH2COO(H или метил), T обозначает водород или метил и -N(R')C(R'', R''')CO является остатком Pro.
Наиболее предпочтительны соединения I, выбранные из группы:
[[1-[N(n-амидинобензоил)-L-аланил]-4-пиперидинил]окси]уксусная кислота,
[[1-[N-[(5-амидино-2-пиридил)карбонил] -L-аланил] -4-пиперидинил] окси] уксусная кислота,
[[1-[N-(n-амидинобензоил)-3-(4-гидрокси-3-иодфенил)-L-аланил] -4-пиперидинил]окси]уксусная кислота,
[[1-[3-ацетокси-N-(n-амидинобензоил)-L-аланил]-4-пиперидинил]окси]уксусная кислота,
[n-[[1-(n-амидинобензоил)-2-пирролидинил] карбонил] фенокси] уксусная кислота,
[[1-[N-[(5-амидино-2-пиридил)карбонил] -L-тирозил] -4-пиперидинил] окси] уксусная кислота, и особенно
[[1-[N-(n-амидинобензоил)-L-тирозил] -4-пиперидинил]окси]уксусная кислота.
Среди предпочтительных соединений можно назвать соединения I, где Q обозначает группу Q3, особенно где n 1 и T обозначает водород или группу Q6, особенно где T обозначает водород,
либо соединения I, где Q обозначает группу Q7, особенно где v 2, T обозначает водород или бутил,
а также соединения I, где -N(R')C(R'', R''')CO-является остатком N(метоксиэтил)Gly.
В частности, предпочтительны соединения I, выбранные из группы:
(S)-1-[2-(5-амидинопиридин-2-илкарбониламино)-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксусная кислота,
сложный этиловый эфир (S)-1-[2-(4-амидинобензамидо)-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксусной кислоты,
(S)-1-[2-(4-амидинобензамидо)-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксусная кислота,
[1-[N-(4-амидинобензоил)-4'-гексилокси-L-фенилаланил]пиперидин-4-илокси] уксусная кислота.
В настоящем описании данного изобретения Me обозначает метил, Ac обозначает ацетил, t-Bu обозначает трет.-бутил, Boc обозначает t-бутоксикарбонил, Z обозначает бензилоксикарбонил, Fmoc обозначает 9-флуоренилметоксикарбонил, Val обозначает L-валил, Phe обозначает L-фенилаланил, Ser обозначает L-серил, Gly обозначает глицил, Ala обозначает L-аланил, Asp обозначает L-аспартил, Leu обозначает L-лейцил, Tyr обозначает L-тирозил, Sar обозначает саркозил, Orn обозначает L-орнитил, Lys обозначает L-лизил, Phg обозначает L-a-фенилглицил, Pro обозначает L-пролил, Glu обозначает L-глутамил, Trp обозначает L-триптофан.
Выражение "низший" обозначает группы с 1-6, предпочтительно с 1-4, C-атомами. Примерами низших алкильных групп являются метил, этил, пропил, изопропил, н. -, втор. или трет.-бутил и гексил. Примерами отщепляемых при физиологических условиях низших алкильных групп являются первичные и вторичные низшие алкильные группы.
Символы R', R'' и R''' в остатке a-аминокарбоновой кислоты -N(R')C(R'', R''')CO- представляют водород или в a-аминокарбоновых кислотах с открытой цепью или циклических, природных или синтетических обычные N-заместители или боковые цепи. Примерами таких N-заместителей R' и боковых цепей R'' и R''' являются возможно замещенные OH, COOH, NH2 или арил, особенно фенил, гидроксифенил, гидроксииодфенил или гидроксидииодфенил, низший алкил. Две замещенные таким образом при необходимости низшие алкильные группы R' и R'' вместе с N- или C-атомом, с которым они связаны, могут образовывать 4- до 6-членное, особенно 5-членное кольцо. Встречающиеся в N-заместителях R' и боковых цепях R'' и R''' гидрокси- или карбоксигруппы могут быть этерифицированы с образованием простого или сложного эфира или амидированы, а встречающиеся аминогруппы могут быть проацилированы C1-6-алканоилом или ароилом. Примерами таких групп простого эфира, сложного эфира или амида являются -O-T0, -COO-T0 или -CON(V, V'), где V и V' имеют указанное значение и T0 обозначает низший алкил, особенно метил, гексил и трет.-бутил, или аралкил, особенно бензил.
Примерами a-аминокарбоновых кислот с открытыми цепями являются H-Gly-OH, H-Ala-OH, H-Orn-OH и H-Tyr-OH; примерами циклических альфа-аминокарбоновых кислот, то есть таких, где R' и R'' вместе с N- или C- атомом, с которым они связаны, образуют кольцо, являются H-Pro-OH, H-Pro(4-OH)-OH и 2-пиперидинкарбоновой кислотой.
Примерами C1-6-алканоильных групп U и U' являются формил, ацетил и пропионил. Арил обозначает фенил, при необходимости имеющий до 3-х заместителей, как алкил, OH, низший алкокси, галоген или гало-низший алкил, особенно CF3. Ароил обозначает соответствующие группы бензоила.
Соединения формулы I можно подвергать сольватации, особенно гидратации. Гидратацию можно осуществлять в процессе способа получения или она может происходить постепенно в результате гигроскопических свойств ранее безводного соединения формулы I.
Примерами физиологически приемлемых солей соединений формулы I являются соли с физиологически переносимыми минеральными кислотами, как соляная кислота или фосфорная кислота; или с органическими кислотами, как метансульфокислота, уксусная кислота, трифторуксусная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота или салициловая кислота. Соединения формулы I со свободной карбоксигруппой могут образовывать также соли с физиологически переносимыми основаниями. Примерами таких солей являются соли щелочных металлов, щелочно-земельных металлов, аммония и алкиламмония, как соль Na, K, Ca или тетраметиламмония. Соединения формулы I могут существовать также в форме амфотерных ионов.
Соединения формулы I, которые содержат один или несколько асимметрических атомов C, могут существовать в виде энантиомеров, диастереомеров или их смесей, в частности, в виде рацематов.
Вышеуказанные N-ацил-альфа-аминокислоты можно получать по изобретению в результате того, что
а) в соединении формулы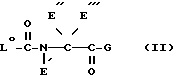
где L0 представляет группу формулы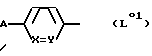
или
R01-(CH2)t,
в которой A представляет защищенную в случае необходимости амидиногруппу,
R01 представляет защищенную в случае необходимости аминогруппу, E', E'', E''' и G имеют такое же значение, как R', R'', R''' и Q в формуле I, причем если R01 представляет амино или если A представляет амидино, по меньшей мере один из E', E'', E''' и G содержит по меньшей мере одну группу сложного эфира карбоновой кислоты и/или группу простого эфира и/или защищенную аминогруппу,
отщепляют группу простого эфира или защищенную амино- или амидиногруппу или сложного эфира карбоновой кислоты; или
б) в нитриле формулы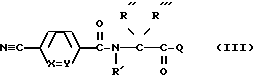 ,
,
переводят цианогруппу в амидиногруппу, или
в) амин формулы
R'-NHC(R'',R''')CO-Q (IV)
обрабатывают кислотой формулы L1-COOH или его реакционноспособным производным, и
г) в случае необходимости функционально изменяют содержащуюся в соединении формулы I реакционноспособную группу, и
д) в случае необходимости соединение формулы I переводят в физиологически переносимую соль или соль соединения формулы I переводят в свободную кислоту или основание.
Примерами отщепляемых групп сложного эфира карбоновой кислоты являются бензил-OCO- и низший алкил-OCO, как t-Bu-OCO-. Примерами отщепляемых защищенных амино- и амидиногрупп являются -NH-Z, -NH-Boc и -N3; -C(NH)NH-Z, -C(NH)-NH-Boc, C(N-Boc)N(Boc)2 и -C(N-Boc)NH-Boc; -NHC(NH)NHNO2 и -NHC(N-Boc)NH-Boc. Примерами отщепляемой группы простого эфира является t-Bu-O-.
Группы сложного эфира можно гидролизовать известным образом, например, при помощи основания, как гидроокись щелочного металла, например, гидроокись натрия, в растворителе, как метанол или вода; или при помощи кислоты, как соляная кислота. Сложный бензиловый эфир можно расщеплять гидрированием в присутствии катализатора на основе благородного металла, как палладий на активном угле (Pd/C) в растворителе, как метанол, этанол, муравьиная кислота или уксусная кислота, при температуре приблизительно до 40oC, предпочтительно при комнатной температуре. При этом одновременно отщепляется содержащаяся в группе A защитная группа амидино, как Z.
Группы сложного эфира, как t-Bu-OCO, а также защитные амино или амидиногруппы, как Boc, и группы простого эфира, как t-Bu-O-, можно отщеплять при помощи кислоты, такой как муравьиная кислота или трифторуксусная кислота, при желании в растворителе, как дихлорметан, или при помощи насыщенной HCl ледяной уксусной кислоты, при температуре до 40oC, предпочтительно при комнатной температуре.
Вариант б) можно осуществлять при реакции нитрили III' с сероводородом и триэтиламином в пиридине с получением тиоамида; последний метилированием метилиодидом в ацетоне и последующим аммонолизом с ацетатом аммония в метаноле переводят в соединение I.
Взаимодействие в) амина IV с кислотой L1-COOH или с ее реакционноспособным производным, таким как хлорангидрид кислоты, осуществляют в присутствии основания, как пиколин, в растворителе, как дихлорметан, при температуре до 40oC, предпочтительно при комнатной температуре.
Для функциональных превращений реакционноспособных групп по варианту способа г) используют отщепление содержащихся в группе Q групп низшего алкоксикарбонила -COO-T или -COO-T', или С1-6-алканоилокси или ароилоксигрупп O-U или O-U', или этерификацию карбоксигруппы в кислоте I, и галогенирование, особенно иодирование содержащейся в боковой цепи R'' или R''' арильной группы.
Так, содержащиеся в группе Q бутоксикарбонил- или метоксикарбонилгруппы можно омылять при помощи кислоты, такого как водный раствор соляной кислоты или уксусной кислоты, или в основных условиях, например, при помощи водного раствора натрового щелока в метаноле, ацетоксигруппы при помощи карбоната калия в метаноле. Этерификацию карбоксигруппы осуществляют, например, реакцией кислоты с подходящим спиртом в присутствии каталитических количеств H2SO4.
Иодирование арильной группы, особенно гидроксифенилгруппы в боковой цепи R'' или R''', можно осуществлять реакцией соединения I с хлорамином T в присутствии иодида натрия в воде/диметилформамиде.
Амин I, где L представляет группу H2N(CH2)t можно превратить в соответствующий гуанидин I, где L обозначает HN=C(NH2)NH(CH2)t, причем амин обрабатывают этансульфонатом 2-S-изотиомочевины в присутствии основания, такого как Na2CO3 или NaOH при температурах до 40oC.
Соединения формул II' и III' являются новыми и как таковые также представляют предмет настоящего изобретения.
Таким образом, предметом данного изобретения являются соединения формулы II: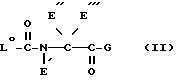
где L0 обозначает группу формулы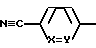
и E', E'', E''' и G имеют значения R', R'', R''', как указано выше,
или где L0 обозначает группу формулы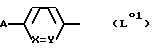
или
R01-(CH2)t L02
в которой A обозначает защищенную в случае необходимости амидиногруппу, R01 обозначает в случае необходимости защищенную аминогруппу, и E', E'', E''' и G имеют такое же значение, как R', R'', R''' или Q в формуле I, причем если R01 обозначает амино, или если A обозначает амидино, по меньшей мере один из E', E'', E''' и G содержит по меньшей мере одну группу сложного эфира карбоновой кислоты и/или группу простого эфира и/или защищенную аминогруппу.
Соединение II со значением L0 L01 получают обработкой амина формулы
E'-NHC(E'', E''')CO-G' (V)
где G' обозначает одну из групп Q1 Q8, в которой группа -COO-T и имеющаяся в случае необходимости группа -COO-T' являются группами сложного эфира карбоновой кислоты, кислотой формулы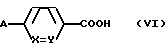
или ее реакционноспособным производным, например хлорангидридом кислоты.
Это превращение можно осуществлять в случае необходимости в присутствии тетра-н-бутиламмонийгидрогенсульфата в растворителе, как дихлорметан, и основания, как водный раствор бикарбоната натрия.
Амин H-Q0, где Q0 представляет одну из аминогрупп Q1 Q7, в которой группа -COO-T и имеющаяся в случае необходимости группа -COO-T' являются группой сложного эфира карбоновой кислоты, можно обрабатывать кислотой формулы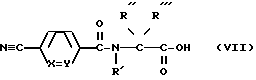
до нитрила III.
Эту реакцию можно осуществлять в присутствии 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний-гексафторфосфата (HBTU) и органического основания, как N-метилморфолин, в растворителе, как диметилформамид.
Соединение II', где A представляет амидино, можно получать превращением цианогруппы в амидиногруппу в соответствующем соединению II нитриле. Последний можно получать реакцией амина вышеуказанной формулы V с кислотой формулы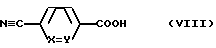 ,
,
или с ее функциональным производным, например, хлорангидридом кислоты.
Эту реакцию можно осуществлять в присутствии 2-хлор-4,6-диметокси-1,3,5-триазина (CDMT) и основания, как N-метилморфолин, в растворителе, как дихлорметан.
Соединение II, где L0 обозначает группу L02 с защищенной амино-группой R01, получают реакцией амина V с кислотой формулы R01-(CH2)t-COOH, например, в присутствии HBTU и N-метилморфолина.
Нитрил III', где Q представляет группу Q, можно получать, например, следующим образом:
Амин формулы: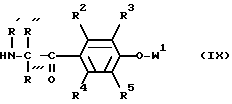 ,
,
где R' и R'' вместе с N- и C-атомом образуют цикл, и W1 представляет защитную группу,
обрабатывают кислотой VIII или ее функциональным производным, отщепляют защитную группу и превращают полученный фенол с производным бромуксусной кислоты BrCH2COO-T.
Реакцию амина IX с соответствующим кислоте VIII хлорангидридом кислоты можно осуществлять в присутствии основания, как триэтиламин, в диметилформамиде. Отщепление защитной группы W1, например, бензила, можно осуществлять гидрогенолизом на Pd/C в этаноле, а реакцию вышеуказанного фенола с производным бромуксусной кислоты в диметилформамиде в присутствии карбоната калия.
Амины IV и V можно получать, например, реакцией N-защищенной аминокислоты формулы
W2-N(E')C(E'',E''')COOH (X)
с амином H-Q0 и удалением защитной группы W2, например, Z или Boc, в продукте реакции.
Кислоту VII можно получать взаимодействием функционального производного кислоты VIII, например, хлорангидрида кислоты, с амином
R'-NHC(R'',R''')COO-низший алкил (X')
и отщеплением группы сложного эфира в продукте реакции. Эту реакцию можно осуществлять, например, в дихлорметане в присутствии триэтиламина. Группу низшего алкила, например, метил, можно удалять водным раствором LiOH в метаноле.
Можно превращать также аминокислоту формулы
R'-NHC(R'',R''')COOH (X")
например, глицин, реакцией непосредственно с соответствующим кислоте VIII хлорангидридом в присутствии водного раствора бикарбоната натрия, в случае необходимости в присутствии тетраметиламмоний-сульфата в дихлорметане, до кислоты VII.
Амин IX можно получать в результате того, что реагент Гриньяра бромида формулы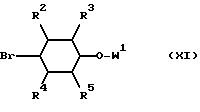
обрабатывают соединением формулы
и удаляют защитную аминогруппу W2 из продукта реакции.
Используемые выше амины HQ0, где Q0 обозначает одну из аминогрупп Q1 Q7, в которой группа -COO-T и имеющаяся в случае необходимости группа -COO-T' являются группами сложного эфира карбоновой кислоты, можно получать, как описано в нижеследующих примерах 1 a) b) c), 2 a), 46 a) b), 47 a) и 48 a) b).
Соединения формулы I, их сольваты и их соли тормозят как связывание фибриногена, фибронектина и фактора Виллибрандта с фибриногенным рецептором кровяных пластинок (глюкопротеин IIb/IIIa), так и связывание тех же и других адгезивных протеинов, как витронектин, коллаген и ламинин, с соответствующими рецепторами на поверхности различных типов клеток. Таким образом, указанные соединения оказывают влияние на взаимодействие клеток-клеток и клеток-матрицы. Они особенно препятствуют образованию тромбоцитов и могут применяться при борьбе или предупреждении таких заболеваний, как тромбы, кровоизлияние в мозг, инфаркт миокарда, воспаление и артериосклероз. Далее, эти соединения оказывают воздействие на клетки опухоли, причем они тормозят их метастазирование. Таким образом, их можно применять также в качестве противоопухолевых средств. Далее, они могут ускорять заживление раны. Так как они также препятствуют рассасыванию костной ткани, их можно применять при лечении остеопороза.
Торможение связывания фибриногена с фибриногенным рецептором, глюкопротеином IIb/IIIa можно обнаружить следующим образом:
Глюкопротеин IIb/IIIa получают из Тритон-X-100-экстрактов кровяных пластинок человека и очищают методом лектин-афинной хроматографии (Analytical Biochemistry 151, 1985, 169-177) и методом афинной хроматографии на Arg-Gly-Asp-Ser-колонке (Science 231, 1986, 1559-62). Полученный таким путем протеин-рецептор связывают на пластинках с микротитром.
Специфическое связывание фибриногена с иммобилизированным рецептором определяют при помощи ELISA-системы ("enzyme-linked immunosorbent assay"). Нижеприведенные IC50-величины соответствуют такой концентрации испытываемого вещества, которая необходима, чтобы тормозить на 50% связывание фибриногена с иммобилизированным рецептором.
Ниже приведены данные IC50 для соединений, полученных по примерам табл. 1.
Эти соединения имеют низкую токсичность, однако LD50 продуктов примеров 3 и 14 составляет 250 и примера 5 500 мг/кг при внутривенном назначении у мыши.
Для подтверждения явного превосходства заявленных соединений по сравнению с соединениями, описанными в европейской заявке, ниже приводятся сравнительные данные для IC50, полученные для обоих соединений формулы I.
Ингибирование агрегации бляшек в человеческой плазме
Человеческую плазму, обогащенную тромбоцитами, (h-PRP) получают из антикоагулированной крови с помощью 1/10 объема 90 мМ тринатрий цитрата, и агрегацию тромбоцитов измеряют путем регистрации скорости изменения световой трансмиссии с помощью агрегометра. Затем проводилось серийное разбавление с помощью ингибиторов и агрегация осуществлялась с помощью таких агонистов, как коллаген (COL), аденозинтриофосфит (ADP) или тромбин (THR) при конечной концентрации в человеческой плазме 2,5 мкг/мл, 10 мкМ и 0,2 U/мл соответственно. Значения IC50 для этих трех агонистов приведены в следующих табл.2 и 3.
Концентрации COL, ADP и THR указаны в различных единицах, наиболее подходящих для трех агонистов. Коллаген (COL) является высокомолекулярным белком, ADP молекулой аденозин-5'-дифосфата, и THR ферментом. Сокращение U для THR представляет собой единицу измерения активности фермента.
Известный "неодикумарин" или "пелентан" является антикоагулянтом и антагонистом витамина K. В противоположность этому, как следует из описания и приложенной таблицы, заявленные соединения обладают действием, тормозящим как связывание адгезивных протеинов с тромбоцитами, так и агрегацию тромбоцитов, а также на взаимодействие клетка-клетка. (J. Cardiovasc. Surg. 106, 1993, 834-41 и Thrombosis and Haemostasis. 70, 1993, 817-21, а также копия реферата N 65 из Thrombosis and Haemostasis 69, 1993, 560). Из вышеуказанных источников следует, что вещество Ro 44-9883, которое соответствует продукту из примера 14, в организмах собаки и морской свинки проявляет тормозящее действие на агрегацию кровяных пластинок и потому может применяться для лечения и профилактики лечения тромбозов.
Предметом данного изобретения является также композиция, ингибирующая связывание адгезивных протеинов с тромбоцитами и агрегацию тромбоцитов, содержащая активное начало и фармацевтически инертные вспомогательные вещества, которая в качестве активного вещества содержит соединение формулы I в эффективном количестве.
Соединения формулы I, их сольваты или соли могут быть переработаны как таковые или, при желании, с другими терапевтически активными веществами в галеновую форму.
Лекарственные средства, содержащие вышеуказанные соединения, можно применять орально, через кишечник, например, в форме таблеток через рот, таблеток с лаковым покрытием, драже, капсул в твердой и мягкой желатине, растворов, эмульсий или суспензий, или ректально, в форме, например, свечей; или в виде аэрозоля. Но можно применять также парентерально, например, в форме растворов для инъекций или настоек для вливания.
Для получения таблеток, таблеток с лаковым покрытием, драже и капсул в твердой желатине можно смешивать активное вещество с фармацевтически инертными, неорганическими или органическими наполнителями. В качестве таких наполнителей для таблеток, драже и капсул в твердой желатине можно применять, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли. Для капсул в мягкой желатине в качестве наполнителей применяются, например, растительные масла, воски, жиры, полутвердые и жидкие многоатомные спирты; однако, в зависимости от свойства активного вещества для капсул с мягкой желатиной возможно отсутствие любых наполнителей. Для получения растворов и сиропов в качестве наполнителей применяются, например, вода, многоатомные спирты, сахароза, инвертный сахар и глюкоза; для растворов для инъекций применяются, например, вода, спирты, многоатомные спирты, глицерин и растительные масла, а для свечей применяются, например, натуральные или отвержденные масла, воски, жиры и полужидкие или жидкие многоатомные спирты. Фармацевтические препараты наряду с этим могут содержать еще консерванты, агенты растворения, стабилизаторы, смачиватели, эмульгаторы, подслащивающие вещества, красители, ароматические вещества, соли для изменения осмотического давления, буферные растворы, средства для покрытия или антиокислители.
Для борьбы или предупреждения вышеназванных заболеваний дозировка активного вещества может изменяться в широких пределах и, конечно, в каждом отдельном случае должна быть приспособлена к индивидуальным условиям. В общем, при оральном назначении следовало бы устанавливать дозу около от 0,1 до 20 мг/кг, предпочтительно около от 0,5 до 4 мг/кг в день для взрослого, причем указанный верхний предел может быть и выше, если это окажется необходимым.
Пример 1. Раствор 2,43 г сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)глицил] -4-пиперидинил] оксиуксусной кислоты в 15 мл дихлорметана/трифторуксусной кислоты 1 1 оставляют на 5 ч при комнатной температуре. После выпаривания растворителей и хроматографии [силилированный кизельгель (LiChroprep RP-18), метанол/вода-элюент] получают 0,46 г трифторацетата [[1-[N-(n-амидинобензоил)глицил]-4-пиперидинил]окси]уксусной кислоты, точка плавления 233-236oC. MS (FAB): 363 (M + H)+.
Исходное вещество можно получать следующим образом:
а) К раствору 50 г 4-гидроксипиперидина в 500 мл дихлорметана добавляют по очереди при 0oC 69,1 мл триэтиламина и 70,2 мл сложного бензилового эфира хлормуравьиной кислоты. Полученную суспензию перемешивают в течение ночи при комнатной температуре и затем фильтруют. Получающийся после сгущения фильтрата остаток поглощают в уксусном эфире, промывают водой и 1 н. соляной кислотой, сушат и сгущают. Получают 73,6 г N-бензилоксикарбонил-4-гидроксипиперидина, коэффициент Rf 0,56 (уксусный эфир/метанол 9 1), MS (EI): 235 (M+).
b) К раствору 30,1 г N-бензилоксикарбонил-4-гидроксипиперидина в 300 мл толуола добавляют 28 мл сложного трет.-бутилового эфира бромуксусной кислоты и 1,4 г тетра-н-бутиламмонийбисульфата в 10 мл воды. После этого прикапывают раствор 125 г гидроокиси натрия в 125 мл воды. После перемешивания в течение ночи органические экстракты отделяют, сушат и сгущают. После сушки получают 34,1 г N-бензилоксикарбонил-4-[(трет. -бутоксикарбонил)метокси]пиперидина, коэффициент Rf 0,76 (уксусный эфир). MS (EI): 293 (M-C4H8)+.
с) К раствору 30 г продукта b) в 50 мл этанола добавляют 1,5 г Pd/C (10% ). Реакционную смесь гидрируют при комнатной температуре. После этого отфильтровывают катализатор, промывают этанолом и сгущают фильтрат. Получают 17,4 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты, коэффициент Rf 0,14 (уксусный эфир/метанол 1 1). MS (EI): 215 (M+).
d) Реакцией 5,8 г (активированного 5,4 г CDMT) Z-глицина с 6,0 г сложного трет. -бутилового эфира 4-пиперидинилоксиуксусной кислоты и 6,3 мл N-метилморфолина в дихлорметане получают 10 г бензил-[[[4-[(N-бутоксикарбонил)метокси]пиперидинил]карбонил]метил]карбамата. MS (EI): 406 (M+).
е) Гидрогенолизом раствора 10 г продукта d) в 200 мл этанола в присутствии 0,7 г Pd/C (10%) и 1,4 мл уксусной кислоты выделяют после хроматографии на силикагеле с уксусным эфиром/метанолом 1 1 4,1 г сложного трет. бутилового эфира 1-[(1-глицил-4-пиперидинил)окси]уксусной кислоты, MS (EI): 273 (M + H)+. ИК: 1746 см-1.
f) К смеси 4,1 г продукта е) и 0,03 г тетра-н-бутиламмонийгидросульфата в 210 мл дихлорметана/насыщенного раствора бикарбоната натрия 4 3 добавляют при комнатной температуре 2,95 г п-амидинобензоилхлорид-гидрохлорида (полученного из п-амидинобензойной кислоты превращением с хлористым тионилом в тетрагидрофуране в присутствии диметилформамида). После перемешивания в течение ночи разбавляют дихлорметаном и водой, устанавливают pH 9-10 добавлением 1 н. натрового щелока, отделяют органические экстракты, сушат и сгущают. После сушки получают 2,43 г желаемого исходного вещества, MS (FAB): 419 (M + H)+.
Пример 2. A) Раствор 1,5 г сложного метилового эфира [[1-[N-(n-цианбензоил)глицил]-4-пиперидинил]окси]уксусной кислоты в 215 мл пиридина/триэтиламина 40 3 насыщают сероводородом и оставляют на 24 ч при комнатной температуре. После удаления растворителей поглощают остаток в уксусном эфире и промывают насыщенным раствором хлористого натрия. Органические экстракты сушат и сгущают. После хроматографии остатка на силикагеле с уксусным эфиром в сопровождении уксусного эфира/метанола выделяют 1,34 г сложного метилового эфира [[1-[N-[n-(тиокарбамоил)бензоил]глицил]-4-пиперидинил]окси] уксусной кислоты, MS (FAB): 394 (M + H)+.
B) Взаимодействие 1,25 г продукта с предыдущей стадии с 7,5 мл иодистого метила в 150 мл ацетона при температуре кипения дает после фильтрования и удаления растворителя 1,65 г гидроиодида сложного метилового эфира [[1-[N-[п- [1-(метилтио)формимидоил] бензоил] глицил] -4-пиперидинил]окси]уксусной кислоты, MS (FAB): 408 (M + H)+.
C) Аммонолизом 1,5 г продукта B) в присутствии 0,32 г ацетата аммония в 100 мл метанола при температуре кипения получают 0,76 г гидроиодида сложного метилового эфира [[1-[N-(n-амидинобензоил)глицил] -4-пиперидинил]окси] уксусной кислоты. Точка плавления 103-105oC. MS (FAB): 377 (M + H)+.
Исходный нитрил можно получать следующим образом:
a) Этерификацией трифторацетата 4-пиперидинилоксиуксусной кислоты (полученного обработкой продукта примера 1c) трифторуксусной кислотой в дихлорметане) в метаноле в присутствии хлористого тионила получают гидрохлорид сложного метилового эфира 4-пиперидинилоксиуксусной кислоты, MS (EI): 173 (M)+.
b) Реакция 1,35 г продукта a) с 1,18 г N-(n-цианбензоил)глицина (полученного превращением глицина с n-цианбензоилхлоридом в насыщенном растворе бикарбоната натрия) в присутствии HBTU и N-метилморфолина в диметилформамиде дает после хроматографии на силикагеле (уксусный эфир/метанол 9 1 до 1 1) 1,66 г желаемого исходного нитрила, MS (EI): 359 (M)+.
Пример 3. Из 13 г сложного трет.-бутилового эфира [[1-N-(n-амидинобензоил)-L-аланил]-4-пиперидинил]окси]уксусной кислоты обработкой трифторуксусной кислотой в дихлорметане (как описано в примере 1) получают после перекристаллизации из метанола/простого диэтилового эфира 8,9 г трифторацетата [[1-[N-(n-амидинобензоил)-L-аланил] -4-пиперидинил]окси] уксусной кислоты. Точка плавления 120oC (разложение). MS (FAB): 377 (M + H)+. [α]
Исходное вещество можно получать следующим образом:
a) Реакция 18 г Z-L-аланила с 17,4 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты и последующий гидрогенолиз полученного продукта, как в примере 1d) и е), дает 15,8 г ацетата сложного трет.-бутилового эфира 1-[(1-L-аланил-4-пиперидинил)окси]уксусной кислоты. Точка плавления 93-96oC. [α]
b) Реакция 4,7 г продукта a) с 3,4 г n-амидинобензоилхлорид-гидрохлорида, как в примере 1f), дает 4,2 г желаемого исходного вещества. MS (EI): 433 (M + H)+.
Пример 4. Из 0,3 г сложного трет.-бутилового эфира [[1-[N-[n-[N-(тpeт. -бутоксикарбонил)амидинобензоил] -D-аланил]-4-пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 0,1 г трифторацетата [[1-[N-(n-амидинобензоил)-D-аланил]-4-пиперидинил]окси] уксусной кислоты. Точка плавления 115oC (разложение). [α]
Исходное вещество можно получать следующим образом:
a) Взаимодействием 3 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 2,43 г Z-D-аланина, как описано в примере 1d), получают после хроматографии на силикагеле при элюировании уксусным эфиром/гексаном 1 1 3,1 г бензил-[(R)-1-[[4-[(трет.-бутоксикарбонил) метокси] пиперидинил]карбонил]этил]карбамата. MS (EI): 420 (M)+.
b) Гидрогенолизом 3,1 г продукта a), как описано в примере 1e), получают 2,5 г ацетата сложного трет.-бутилового эфира 1-[(1-D-аланил-4-пиперидинил)окси]уксусной кислоты. MS (EI): 215 (M-C3H5NO).
с) Взаимодействием 1 г продукта предыдущей стадии с 0,66 г п-амидинобензоилхлорид-гидрохлорида в диметилформамиде в присутствии триэтиламина и последующей обработкой ди-трет.-бутилдикарбонатом получают после хроматографии на силикагеле с дихлорметаном/метанолом 20 1 0,3 г желаемого исходного вещества. MS (FAB): 533 (M + H)+.
Пример 5. Гидролизом 1,6 г сложного трет.-бутилового эфира [[1-[N-[(5-амидино-2-пиридил)карбонил]-L-аланил]-4-пиперидинил]окси] уксусной кислоты в насыщенной хлористым водородом ледяной уксусной кислоте получают после хроматографии на силилированном силикагеле RP-18 и перекристаллизации из тетрагидрофурана/уксусного эфира 0,15 г [[1-[N-[(5-амидино-2-пиридил) карбонил] -L-аланил] -4-пиперидинил] окси]уксусной кислоты. Точка плавления: выше 200oC (разложение). MS (FAB): 378 (M + H)+.
Исходное вещество можно получать следующим образом:
a) Взаимодействием 2,4 г ацетата сложного трет.-бутилового эфира 1-[(1-L-аланил-4-пиперидинил)окси] уксусной кислоты (пример 3a) с 1,0 г 5-циано-2-пиколиновой кислоты по примеру 1d) получают 2,43 г сложного трет.-бутилового эфира [[1-[N-[(5-циан-2-пиридил)-карбонил]-L-аланил]-4-пиперидинил] окси]уксусной кислоты, MS (FAB): 417 (M + H)+.
b) Последующая обработка 2,4 г продукта вышеуказанной стадии, как описано в примере 2A) B) C), дает 2 г желаемого исходного вещества. Точка плавления 142-145oC. MS (FAB): 434 (M + H)+.
Пример 6. Из 1 г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-L-валил] -4-пиперидинил] окси] уксусной кислоты получают по аналогии с примером 1 после кристаллизации из уксусного эфира 0,8 г [[1-[N-(n-амидинобензоил)-L-валил] -4-пиперидинил] окси] уксусной кислоты в виде трифторацетата. Точка плавления 210-211oC. MS (FAB): 405 (M + H)+.
[α]
Исходное вещество можно получать следующим образом:
a) Реакцией 2,5 г Z-L-валина с 2 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты, как описано в примере 2б), получают 4 г сложного трет. -бутилового эфира [[1-[N-[(бензилокси)карбонил]-L-валил]-4-пиперидинил]оксиуксусной кислоты. MS (EI): 449 (M + H)+.
b) По аналогии с примером 1e), однако без добавления уксусной кислоты, получают из 1,9 г продукта примера 6a) 1,4 г сложного трет.-бутилового эфира 1-[(1-L-валил-4-пиперидинил)окси]уксусной кислоты. MS (EI): 315 (M + H)+.
c) По аналогии с примером 1f) получают из 3,3 г продукта примера 6b) и 2,5 г n-амидинобензоилхлорид-гидрохлорида после хроматографии (силикагель; дихлорметан/метанол/уксусная кислота 95 4 1) и кристаллизации из простого диэтилового эфира 1,1 г желаемого исходного ацетата. Точка плавления 179-182oC. MS (FAB): 461 (M + H)+.
Пример 7. Из 1,5 г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-L-лейцил] -4-пиперидинил] окси] уксусной кислоты получают по аналогии с примером 1 после кристаллизации из уксусного эфира/простого диэтилового эфира 1,1 г [[1-[N-(n-амидинобензоил)-L-лейцил]-4-пиперидинил] окси] уксусной кислоты в виде трифторацетата. Точка плавления 216-218oC. MS (FANB): 419 (M + H)+.
[α]
Исходный ацетат можно получать следующим образом:
a) Реакцией 2,6 г Z-L-лейцина с 2 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты, как описано в примере 1d), получают 4,1 г сложного трет.-бутилового эфира [[1-[N-[(бензилокси)карбонил]-L-лейцин]-4-пиперидинил]окси]уксусной кислоты. MS (FAB): 463 (M + H)+.
b) По аналогии с примером 6b) и 1f) получают из 4,1 г продукта примера 7a) после хроматографии (силикагель; дихлорметан/метанол/уксусная кислота 95 4 1) и кристаллизации из простого диэтилового эфира 1,5 г желаемого ацетата. Точка плавления 120-129oC (разложение). MS (FAB): 475 (M + H)+.
Пример 8. Из 1,4 г ацетата сложного трет.-бутилового эфира [[1-[(n-амидино-N-метилбензамидо)ацетил] -4-пиперидинил] окси]уксусной кислоты получают по аналогии с примером 1 после кристаллизации из простого диэтилового эфира 0,9 г [[1-[(n-амидино-N-метилбензамидо)ацетил]-4-пиперидинил]окси]уксусной кислоты в виде трифторацетата. Точка плавления 134-135oC. MS (FAB): 377 (M + H)+.
Исходное вещество можно получать следующим образом:
a) Взаимодействием 2,0 г Z-саркозин-N-гидpoкcиcукцинимиднoгo эфира с 1,3 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты в присутствии триэтиламина в тетрагидрофуране получают 2,1 г бензил-[4-[[[(трет. -бутоксикарбонил)метокси] пиперидино] карбамоил] метил] метилкарбамата. MS (FAB): 421 (M + H)+.
b) По аналогии с примером 6b) и 1f) получают из 4 г продукта примера 8a) после хроматографии (силикагель; дихлорметан/метанол/уксусная кислота 93 5 2) и кристаллизации из простого диэтилового эфира 1,5 г желаемого ацетата. Точка плавления 188-189oC. MS (FAB): 432 (M + H)+.
Пример 9. Из 5,4 г сложного трет.-бутилового эфира [[1-N2-(n-амидинобензоил)-N5-(трет. -бутоксикарбонил)-L-орнитил] -4-пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 4,9 г [[1-N2-(n-амидинобензоил-L-орнитил] -4-пиперидинил] окси] уксусной кислоты в виде трифторацетата. MS (FAB): 420 (M + H)+.
[α]
Исходное вещество можно получать следующим образом:
a) Превращением 6 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 10,2 г N2-Z-N5-Boc-L-орнитина, как описано в примере 1d), получают после хроматографии на силикагеле с уксусным эфиром/гексаном 1 1 11 г сложного трет.-бутилового эфира [[1-[N2-(бензилоксикарбонил)-N5-(трет.-бутоксикарбонил)-L-орнитил] -4-пиперидинил] окси]уксусной кислоты. MS (FAB): 564 (M + H)+.
b) Гидрогенолизом 11 г продукта a), как описано в примере 1e), получают 9 г ацетата сложного трет.-бутилового эфира [[1-[N5-(трет.-бутоксикарбонил)-L-орнитил] -4-пиперидинил] окси] уксусной кислоты. MS (FAB): 430 (M + H)+.
c) Реакцией 9 г продукта b) с 4,4 г n-амидинобензоилхлорида-гидрохлорида, как описано в примере 1f), получают 5,7 г желаемого исходного вещества. MS (FAB): 576 (M + H)+.
Пример 10. Из 0,54 г сложного трет.-бутилового эфира [[1-[N2-[n-N-(трет. -бутоксикарбонил)амидинобензоил] -N6-(трет. -бутоксикарбонил)] -L-лизил]-4-пиперидинил] окси] уксусной кислоты получают по аналогии с примером 1 0,35 г [[1-[N2-(n-амидинобензоил)] -L-лизил] -4-пиперидинилокси] уксусной кислоты в виде трифторацетата. MS (FAB): 434 (M + H)+.
[α]
Исходное вещество можно получать следующим образом:
а) Реакцией 2 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 2,8 г N2-Z-N6-Boc-L-лизина, как описано в примере 1d), получают после хроматографии на силикагеле с уксусным эфиром/гексаном 1 1 2,6 г сложного трет.-бутилового эфира [[1-[N2-(бензилоксикарбонил)-N6-(трет.-бутоксикарбонил)-L-лизил]-4-пиперидинил]окси]уксусной кислоты. MS (FAB): 578 (M + H)+.
b) Гидрогенолизом 2,6 г полученного продукта, как описано в примере 1e), получают 2 г ацетата сложного трет.-бутилового эфира [[1-[N6-(тpeт.- бутоксикарбонил)-L-лизил] -4-пиперидинил]окси]уксусной кислоты. MS (FAB): 444 (M + H)+.
c) Реакцией 2 г продукта предварительной стадии с 1 г n-амидинобензоилхлорид-гидрохлорида, как описано в примере 4c), получают после хроматографии (силикагель; дихлорметан/метанол 20 1) 1,95 г желаемого исходного вещества. MS (FAB): 690 (M + H)+.
Пример 11. Из 0,4 г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-L-фенилглицил] -4-пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 0,25 г [[1-[N-(n-амидинобензоил)-L-фенилглицил]-4-пиперидинил] окси] уксусной кислоты в виде трифторацетата. Точка плавления выше 250oC (уксусный эфир/простой диэтиловый эфир 1 1). MS (FAB): 439 (M + H)+.
[α]
Исходное вещество можно получить следующим образом:
a) Взаимодействием 1,85 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 3,5 г Z-L-фенилглицин-N-гидроксисукцинимидного эфира, как описано в примере 8a), получают после хроматографии на силикагеле с петролейным эфиром/простым диэтиловым эфиром 1 1 3,8 г сложного трет.-бутилового эфира [[1-(N-бензилоксикарбонил-L-фенилглицин)-4-пиперидинил]окси] уксусной кислоты. MS (FAB): 483 (M + H)+.
b) Гидрогенолизом 4,7 г полученного продукта, как описано в примере 6b), получают 3,2 г сложного трет.-бутилового эфира [[1-(L-фенилглицил)-4-пиперидинил]окси]уксусной кислоты. MS (FAB): 349 (M + H)+.
c) Реакцией 3,2 г продукта стадии b) с 2,2 г n-амидинобензоилхлорид-гидрохлорида, как описано в примере 1f), получают после хроматографии (силикагель; дихлорметан/метанол/уксусная кислота 95 5 2) 0,4 г желаемого ацетата. Точка плавления 207-220oC (уксусный эфир, разложение). MS (FAB): 495 (M + H)+.
Пример 12. Из 0,5 г ацетата сложного трет.-бутилового эфира [[1-[1-(n-амидинобензоил)-2-метил-L-пролил] -4-пиперидинил] окси] уксусной кислоты получают по аналогии с примером 1 0,14 г [[1-[1-(n-амидинобензоил)-2-метил-L-пролил] -4-пиперидинил] окси]уксусной кислоты в виде трифторацетата. Точка плавления 219-220oC (ацетонитрил). MS (FAB): 417 (M + H)+.
[α]
Исходное вещество можно получать следующим образом:
a) Реакцией 2-метил-L-пролил-гидробромида с n-цианбензоилхлоридом аналогично примеру 2b) получают 1-(n-цианбензоил)-2-метил-L-пролин. MS (EI): 213 (M-COOH)+.
b) Реакцией 1,67 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 0,8 г хлорангидрида кислоты 1-(n-цианбензоил)-2-метил-L-пролина (полученного обработкой продукта предварительной стадии хлористым тионилом) получают 0,89 г сложного трет.-бутилового эфира [[1-[1-(n-цианбензоил)-2-метил-L-пролил]-4-пиперидинил]окси]уксусной кислоты. Точка плавления 180-182oC (уксусный эфир).
c) Последующей обработкой 0,89 г продукта b), как описано в примере 2A) B) C), получают после хроматографии (силилированный силикагель RP-18; вода/метанол 9 1) 0,59 г желаемого ацетата. Точка плавления 191-192oC (уксусный эфир, разложение). MS (FAB): 473 (M + H)+.
Пример 13. Из 2,5 г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-3-фенил-L-аланил] -4-пиперидинил] окси] уксусной кислоты получают по аналогии с примером 1 1,9 г [[1-[N-(n-амидинобензоил)-3-фенил-L-аланил] -4-пиперидинил] окси] уксусной кислоты в виде трифторацетата. Точка плавления 234-235oC (уксусный эфир).
[α]
Исходное вещество можно получать следующим образом:
a) Реакцией 2,15 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 3,0 г Z-L-фенилаланина, как описано в примере 2b), получают 4,8 г сложного трет.-бутилового эфира [[1-(N-бензилоксикарбонил-3-фенил-L-аланил)-4-пиперидинил]окси]уксусной кислоты. MS (FAB): 497 (M + H)+.
b) Гидрогенолизом 4,8 г полученного продукта, как описано в примере 6b), и последующим превращением с 2,0 г n-амидинобензоилхлорид-гидрохлорида, как описано в примере 1f), получают после хроматографии (силикагель; дихлорметан/метанол/уксусная кислота 22 21) 2,5 г желаемого ацетата. Точка плавления 176-178oC (диэтиловый простой эфир). MS (FAB): 509 (M + H)+.
Пример 14. Из 2,5 г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-3-(n-трет. -бутоксифенил)-L-аланил] -4-пиперидинил] окси]уксусной кислоты получают по аналогии с примером 1 после хроматографии (силилированный силикагель RP-18, вода/метанол-градиент) 1,0 г [[1-[N-(n-амидинобензоил)-L-тирозил]-4-пиперидинил]окси]уксусной кислоты как трифторацетат. Точка плавления 125-130oC (уксусный эфир, разложение). MS (FAB): 469 (M + H)+.
Исходное вещество можно получать следующим образом:
a) Превращением 2,15 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 3,71 г N-Z-(OtBu)-L-тирозина, как описано в примере 2b), получают после хроматографии (силикагель; простой диэтиловый эфир/петролейный эфир 1 1) 4,8 г сложного трет.-бутилового эфира [[1-[N-(бензилоксикарбонил)-3-[n-(трет. -бутоксифенил)] -L-аланил] -4-пиперидинил] окси] уксусной кислоты. Точка плавления 96oC (простой диэтиловый эфир), MS (EI): 417 (M-C7H7-C4H8)+,
[α]
b) Гидрогенолизом 4,8 г продукта предварительной стадии, как в примере 6b), и последующим взаимодействием с 1,5 г n-амидинобензоилхлорид-гидрохлорида, как в примере 1f), получают после хроматографии (силикагель; дихлорметан/метанол/уксусная кислота 22 2 1) 2,6 г желаемого ацетата. Точка плавления 170-172oC (простой диэтиловый эфир). MS (FAB): 581 (M + H)+.
Пример 15. Хроматографией выделяют 0,09 г трифторацетата сложного метилового эфира [[1-[N-(n-амидинобензоил)-L-тирозил]-4-пиперидинил]окси] уксусной кислоты в виде простого продукта, полученного по примеру 14. Точка плавления 189-190oC (уксусный эфир). MS (FAB): 483 (M + H)+.
Пример 16. Обработкой 0,58 г трифторацетата [[1-[N-(n-амидинобензоил)-L-тирозил] -4-пиперидинил] окси] уксусной кислоты (пример 14) хлорамином T в присутствии иодистого натрия в воде/диметилформамиде 8 1 получают после хроматографии (силилированный кизельгель RP-18, вода/ацетонитрил-элюент) 0,04 г [[1-[N-(n-амидинобензоил)-3-(4-гидрокси-3-иодфенил)-L-аланил]-4-пиперидинил] окси] уксусной кислоты. Точка плавления 230oC (вода, разложение). MS (FAB): 595 (M + H)+.
Пример 17. Из описанной в примере 16 реакционной массы выделяют дополнительно 0,09 г [[1-[N-(n-амидинобензоил)-3-(4-гидрокси-3,5-дииодфенил)-L-аланил] -4-пиперидинил] окси] уксусной кислоты. Точка плавления 220-221oC (вода, разложение). MS (FAB): 720 (M + H)+.
Пример 18. Из 1,3 г сложного трет.-бутилового эфира [[1-[3-трет.-бутокси-N-[n-[N(трет. -бутоксикарбонил)амидино] бензоил]-L-аланил]-4-пиперидинил] окси]уксусной кислоты получают обработкой хлористым водородом в ледяной уксусной кислоте после хроматографии (силилированный кизельгель RP-18, метанол/вода-элюент) 0,45 г гидрохлорида [[1-[3-ацетокси-N-(n-амидинобензоил)-L-аланил]-4-пиперидинил]окси]уксусной кислоты,
[α]
Исходное вещество получают следующим образом:
a) Реакцией 7,5 г Z-L-Ser(tBu)-OH с 7,0 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты и последующим гидрогенолизом полученного продукта, как описано в примере 1d), e), получают 10,6 г ацетата сложного трет. -бутилового эфира [[1-(3-трет.-бутокси-L-аланил)-4-пиперидинил]окси]уксусной кислоты. Точка плавления 76-78oC, MS (FAB): 359 (M + H)+.
b) Реакцией 9,9 г продукта предварительной стадии a) с 5,2 г n-амидинобензоилхлорид-гидрохлоридом в диметилформамиде в присутствии триэтиламина и последующей обработкой ди-трет.-бутилдикарбонатом получают после хроматографии на силикагеле дихлорметаном/метанолом 20 1, а затем уксусным эфиром/гексаном 3 1, 4,3 г сложного трет.-бутилового эфира [[1-[3-трет.-бутокси-N-[n-[N-(трет. -бутоксикарбонил)амидино] бензоил]-L-аланил]-4-пиперидинил] окси]уксусной кислоты. Точка плавления 162-165oC. MS (FAB): 605 (M + H)+.
Пример 19. Из 1,0 г сложного трет.-бутилового эфира [[1-[3-трет.-бутокси-N-[n-[N-(трет. -бутоксикарбонил)амидино] бензоил]-L-аланил]-4-пиперидинил] окси] уксусной кислоты (пример 18) получают по аналогии с примером 1 после хроматографии (силилированный кизельгель RP-18, вода) 0,58 г трифторацетата [[1-[N-(n-амидинобензоил)-L-серил]-4-пиперидинил]окси] уксусной кислоты.
[α]
Пример 20. Из 5 г сложного трет.-бутилового эфира L-N-(n-амидинобензоил)-3-[[4-[(трет. -бутоксикарбонил)метокси] пиперидинил] карбонил] -β-аланина получают по аналогии с примером 1 после кристаллизации с уксусным эфиром/тетрагидрофураном 2,0 г трифторацетата L-N-(n-амидинобензоил)-3-[[4- (карбоксиметокси)пиперидино] карбонил]-b-аланина, точка плавления 145-150oC. MS (FAB): 421 (M + H)+.
Исходное вещество можно получать следующим образом:
a) Реакцией 11 г моногидрата Z-L-Asp(O-tBu)-OH с 7,0 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты, как описано в примере 2b), получают 16 г сложного трет.-бутилового эфира L-N-(бензилоксикарбонил)-3-[[4-[(трет.-бутоксикарбонил)метокси]пиперидино]карбонил]-b-аланина. MS (FAB): 521 (M + H)+.
b) После гидрогенолиза 17 г продукта стадии a), как изложено в примере 6b), выделяют 11 г сложного трет.-бутилового эфира L-3-[[4-[(трет.- бутоксикарбонил)метокси]пиперидино]карбонил]-b-аланина. MS (FAB): 387 (M + H)+.
c) Реакцией 11 г продукта предыдущей стадии с 6,9 г n-амидинобензоил-гидрохлорида, как изложено в примере 1f), выделяют после хроматографии (силикагель; дихлорметан/метанол 9 1) 10,2 г желаемого исходного вещества. MS (FAB): 533 (M + H)+.
Пример 21. Из 0,5 г сложного трет.-бутилового эфира [[1-[N-n-амидинобензоил)-4-трет. -бутокси-L-глутамоил] -4-пиперидинил] окси] уксусной кислоты получают по аналогии с примером 1 после кристаллизации с уксусным эфиром 0,25 г трифторацетата [[1-[N-(n-амидинобензоил)-L-a-глутамоил]-4-пиперидинил]окси]уксусной кислоты. Точка плавления 105-108oC.
[α]
Исходное вещество можно получать следующим образом:
a) Реакцией 11 г Z-L-Glu(Ot-Bu)-OH с 7,0 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты, как описано в примере 1d), получают 15,4 г сложного трет.-бутилового эфира [[1-N-(бензилоксикарбонил)-4-трет.-бутокси-L-глутамоил] -4-пиперидинил] окси] уксусной кислоты. MS (FAB): 535 (М+Н)+.
b) После гидрогенолиза 15,4 г предварительной стадии, как изложено в примере 6b), получают 7,5 г ацетата сложного трет.-бутилового эфира [[1-(4- трет. -бутокси-L-глутамоил] -4-пиперидинил] окси]уксусной кислоты. MS (FAB): 401 (M + H)+.
с) Реакцией 7,5 г продукта предыдущей стадии с 3,9 г n-амидинобензоилхлорид-гидрохлорида, как изложено в примере 1f), получают 6,9 г сложного трет. -бутилового эфира [[1-N-(n-амидинобензоил)-4-трет.-бутокси-L-глутамоил]-4-пиперидинил]окси]уксусной кислоты. MS (FAB): 547 (M + H)+.
Пример 22. Из 2 г сложного трет.-бутилового эфира [[(R/S)-1-N-(n-амидинобензоил)-L-аланил] -3-пиперидинил] метокси] уксусной кислоты получают по аналогии с примером 1 0,6 г трифторацетата [[(R/S)-1-N-(n-амидинобензоил)-L-аланил] -3-пиперидинил] метокси] уксусной кислоты. Точка плавления 87-90oC (уксусный эфир). MS (FAB): 391 (M + H)+.
Исходное вещество можно получать следующим образом:
a) Из рац-3-(гидроксиметил)пиперидина получают по аналогии с примером 1а) рац-N-бензилоксикарбонил-3-(гидроксиметил)пиперидин. MS (EI): 249 (M)+.
b) Из продукта a) получают по аналогии с примером 1b) бензил-рац-3-[[(трет. -бутоксикарбонил)метокси] метил] -1-пиперидинилкарбоксилат. MS (EI) 307 (M-C4H8)+.
с) Продукт b) по аналогии с примером 1c) гидрируют до сложного трет.-бутилового эфира рац-(3-пиперидинилметокси)уксусной кислоты. MS (EI): 172 (M-C4H8)+.
d) Реакцией продукта c) с Z-L-аланином, как в примере 1d), получают бензил-[(S)-1-[[(R/S)-3-[(трет. -бутоксикарбонил)метокси] пиперидино] карбонил] этил]карбамат. MS (EI): 434 (M)+.
e) Гидрированием продукта d), как в примере 1e), получают ацетат сложного трет. -бутилового эфира [(R/S)-1-L-аланил-3-пиперидинил] метокси]уксусной кислоты. MS (EI): 285 (M-CH3)+.
f) Реакцией продукта e) с n-амидинобензоилхлорид-гидрохлоридом, как в примере 1f), получают после хроматографии (силилированный кизельгель RP-18) желаемое исходное вещество. MS (FAB): 447 (M + H)+.
Пример 23. Из 2,7 г сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-L-аланил] -4-(α,α,α-трифтор-м-толил) -4-пиперидинил] окси]уксусной кислоты получают по аналогии с примером 1 0,7 г [[1-[N-(n-амидинобензоил)-L-аланил-4-(a,α,α-трифтор-м-толил) -4-пиперидинил] окси] уксусной кислоты. Точка плавления выше 280oC (вода/метанол). MS (FAB): 521 (M + H)+.
Исходное вещество можно получать следующим образом:
a) Из 4-(3-(трифторметил)фенил)пиперидин-4-ола получают по аналогии с примером 1a) бензил-4-гидрокси-4-(a,α,α-трифтор-м-толил)-1-пиперидинкарбоксилат. MS (EI): 379 (M)+.
b) Из продукта a) получают по аналогии с примером 1b) бензил-4-[(трет. -бутоксикарбонил)метокси] -4-(a,α,α-трифтор-м-толил)-1-пиперидинкарбоксилат. MS (FAB): 494 (M + H)+.
c) Гидрированием продукта b), как в примере 1e), получают ацетат сложного трет.-бутилового эфира [[4-(a,α,α-трифтор-м-толил)-4-пиперидинилоксиуксусной кислоты. MS (EI): 227 (M-C6H12O3)+.
d) Взаимодействием продукта c) с Z-L-аланином, как в примере 1d), получают бензил-[(S)-1-[[4-[(трет.-бутоксикарбонил)метокси]-4-(a,α,α-трифтор-м-толил)-1-пиперидинил]карбонил]этил]карбамат. MS (FAB): 565 (M + H)+.
e) Гидрированием продукта d), как в примере 1e), получают ацетат сложного трет.-бутилового эфира 1-[[L-аланил-4-(a,α,α-трифтор-м-толил)-4-пиперидинил]окси]уксусной кислоты. MS (EI): 415 (M-CH3)+.
f) Взаимодействием продукта e) с n-амидинобензоилхлорид-гидрохлоридом, как в примере 1f), получают желаемое исходное вещество. MS (EI): 577 (M + H)+.
Пример 24. Раствор 150 мг трет.-бутил-[[1-[1-(n-амидинобензоил)-L-пролил] -4-пиперидинил] окси] ацетата в 10 мл дихлорметана и 10 мл трифторуксусной кислоты перемешивают 2 ч при комнатной температуре и выпаривают. Остаток суспендируют в простом эфире и фильтруют на нутче. Получают 141 мг трифторацетата [[1-[1-(n-амидинобензоил)-L-пролил]-4-пиперидинил]окси] уксусной кислоты. Точка плавления 234-236oC.
Исходное вещество можно получать следующим образом:
a) 4,97 г хлорангидрида цианбензойной кислоты, 3,45 г L-пролина и 0,73 г тетраметиламмонийсульфата перемешивают в 300 мл дихлорметана и 150 мл 5%-ного раствора бикарбоната натрия 48 ч. Водную фазу подкисляют при помощи 3 н. серной кислоты и экстрагируют уксусным эфиром. Фазу уксусного эфира промывают насыщенным раствором хлористого натрия, сушат и выпаривают. Хроматография остатка на силикагеле (RP-18) с водой дает 3,70 г 1-(n-цианобензоил)-L-пролина. Точка плавления 80-85oC.
b) Реакция 250 мг 1-(n-цианобензоил)-L-пролина с 215 мг сложного трет. -бутилового эфира 4-пиперидинилоксиуксусной кислоты дает после хроматографии на силикагеле с уксусным эфиром/метанолом (98 2) 300 мг трет.-бутил-[[1-[1-(n-цианобензоил)-L-пролил]-4-пиперидинил]окси] ацетата. MS: 442 (M + H)+.
c) Обработка 1 г продукта предварительной стадии, как в примере 2A) B) C), ведет через трет.-бутил-[[1-[1-[n-(тиокарбамоил)бензоил]-L-пролил]-4-пиперидинилоксиацетат, точка плавления 108-110oC, и трет.-бутил-[[1-[1-[n-[(1-метилтио)формимидоил]бензоил]-L-пролил]-4-пиперидинил]окси]ацетат, точка плавления 132-133oC, к 72 мг желаемого ацетата, точка плавления 100oC (разложение).
Пример 25. Аналогично примеру 24 получают из 150 мг трет.-бутил-[[1-[(4R)-1-(n-амидинобензоил)-4-бензилокси-L-пролил] -4-пиперидинил] окси] ацетат-гидрохлорида после хроматографии на силикагеле (RP-18, вода/тетрагидрофуран 95 5) 72 мг [[1-[ (4R)-1-(n-амидинобензоил)-4-бензилокси-L-пролил]-4-пиперидинил]окси]уксусной кислоты. Точка плавления 226-227oC.
Исходное вещество можно получать следующим образом:
a) В раствор 905 мг сложного метилового эфира (4R)-гидрокси-L-пролина и 828 мг хлористого 4-цианобензоила в 50 мл дихлорметана добавляют 1,46 мл триэтиламина. После перемешивания раствор промывают насыщенным раствором хлористого натрия, сушат и выпаривают. Хроматография остатка на силикагеле (уксусный эфир/гексан 5 1) дает 810 мг сложного метилового эфира (4R)-1-(n-цианобензоил)-4-гидрокси-L-пролина. Точка плавления 101-102oC.
b) В раствор 730 мг продукта стадии a) и 600 мкл бензилтрихлорацетимидата в 5 мл циклогексана и 5 мл дихлорметана прикапывают 40 мкл трифторметансульфокислоты. Полученный осадок фильтруют на нутче и промывают фильтрат 5% -ным раствором бикарбоната натрия, сушат и выпаривают. Хроматография остатка на силикагеле (уксусный эфир) дает 940 мг сложного метилового эфира (4R)-4-бензилокси-1-(n-цианобензоил)-L-пролина. MS: 305 (M-59).
c) 880 мг предварительной стадии и 1,2 мл 2 н. раствора гидроокиси лития перемешивают в 10 мл метанола. После удаления метанола водный остаток подкисляют при помощи 2,4 мл 1 н. соляной кислоты и экстрагируют уксусным эфиром. Сушка органической фазы и выпаривание дает 470 мг (4R)-4-бензилокси-1-(n-цианобензоил)-L-пролина. Точка плавления 58-60oC.
d) 450 мг продукта c) обрабатывают в присутствии HBTU 280 мг сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты. Остаток растворяют в уксусном эфире и промывают фазу уксусного эфира 5%-ным раствором бикарбоната натрия, 1 н. раствором бисульфата калия и насыщенным раствором хлористого натрия, сушат и выпаривают. После хроматографии остатка на силикагеле (дихлорметан/метанол 98 2) получают 500 мг трет.-бутил-[[1-[(4R)-4-бензилокси-1-(n-цианобензоил)-L-пролил] -4-пиперидинил]окси]ацетата. MS: 548 (M + H)+.
e) Обработка 400 мг продукта стадии d), как в примере 2A) B) C), дает 177 мг желаемого ацетата. Точка плавления гидроиодида 148-150oC.
Пример 26. Раствор 1,60 г трет.-бутил-[[1-[ (4R)-1-(n-амидинобензоил)-4-гидрокси-L-пролил]-4-пиперидинил]окси]ацетата в 20 мл дихлорметана и 20 мл трифторуксусной кислоты перемешивают 2 ч при комнатной температуре и выпаривают. Остаток растворяют в этаноле и смешивают с простым эфиром. Фильтрование на нутче и сушка осадка дает 1,25 г трифторацетата [[1-[(4R)-1-(n-амидинобензоил)-4-гидрокси-L-пролил] -4-пиперидинил] окси] уксусной кислоты. Точка плавления 220oC (разложение).
Исходное вещество можно получать следующим образом:
a) Реакция 14,78 г (4R)-1-(бензилоксикарбонил)-4-гидрокси-L-пролина с 12,0 г сложного трет.-бутилового эфира с 4-пиперидинилоксиуксусной кислоты дает после хроматографии на силикагеле (уксусный эфир/метанол 95 5) 17,83 г трет. -бутил-[[1-[(4R)-1-(бензилоксикарбонил)-4-гидрокси-L-пролил] -4-пиперидинил]окси]ацетата. MS: 463 (M + H)+.
b) Гидрирование 17,0 г продукта предыдущей стадии в этаноле в присутствии 2,0 г Pd/C (10%) дает после отфильтровывания катализатора и сгущения 11,06 г трет.-бутил-[[1-[(4R)-4-гидрокси-L-пролил]-4-пиперидинил]окси] ацетата. MS: 329 (M + H)+.
c) Реакция 2,0 г продукта стадии b) с 1,34 г n-амидинобензоилхлорида по примеру 1f) дает 1,95 г желаемого ацетата.
Пример 27.
Раствор 700 мг трет.-бутил-[[1-[[1-(n-амидинобензоил)-2-пиперидинил]карбонил] -4-пиперидинил] окси] ацетата в 20 мл дихлорметана и 20 мл трифторуксусной кислоты перемешивают 3 ч при комнатной температуре и выпаривают. Остаток растворяют в этаноле и смешивают с простым эфиром. Фильтрование на нутче и сушка осадка и хроматография на силикагеле (RP-18, вода/тетрагидрофуран 9: 1) дают 111 мг [[1-[[1-(n-амидинобензоил)-2-пиперидинил] карбонил] -4-пиперидинил] окси] уксусной кислоты. Точка плавления 233-234oC.
Исходное вещество получают следующим образом:
a) Взаимодействием 5,26 г 1-(бензилоксикарбонил)-2-пиперидинкарбоновой кислоты с 4,30 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты и хроматографией на силикагеле (уксусный эфир/гексан 2 1) получают 7,33 г сложного бензилового эфира 2-[[4-[(трет.-бутоксикарбонил)метокси] пиперидино]карбонил]-1-пиперидинкарбоновой кислоты. MS: 461 (M + H)+.
b) Гидрированием 4,6 г продукта стадии a) в этаноле в присутствии 0,4 г Pd/C (10% ) получают после отфильтровывания катализатора и сгущения растворителя 3,2 г трет. -бутил-[[1-(2-пиперидинилкарбонил)-4-пиперидинил]окси] ацетата. MS: 327 (M + H)+.
c) Реакция 3,26 г продукта предыдущей стадии с 2,49 г n-амидинобензоилхлорида по примеру 1f) дает 1,56 г желаемого ацетата, точка плавления 93-95oC.
Пример 28. Раствор 130 мг трет.-бутил-[[ (1RS,2RS,3RS,4SR)-4-[[N-(n-амидинобензоил)-L-аланил] амино] -2,3-диацетоксициклогексил] окси]ацетат-гидрохлорида в 5 мл дихлорметана и 5 мл трифторуксусной кислоты перемешивают 2 ч при комнатной температуре и сгущают. Суспендирование остатка в простом эфире и фильтрование на нутче дает 126 мг трифторацетата [[(1RS,2RS,3RS, 4SR)-4-[[N-(амидинобензоил)-L-аланил] амино]-2,3-диацетоксициклогексил]окси] уксусной кислоты. MS: 507 (M + H)+.
Исходное вещество получают следующим образом:
a) Раствор 4,64 г цис-4-амино-2-циклогексен-1-ола, 10,2 г N-(бензилоксикарбонилокси)сукцинимида и 5,7 мл триэтиламина в диметилформамиде после перемешивания разбавляют простым эфиром, промывают насыщенным раствором хлористого натрия, сушат и сгущают. Хроматография остатка на силикагеле (уксусный эфир/гексан 2 1) дает 5,62 г бензил (1RS,4SR)-4-гидрокси-2-циклогексен-1-карбамата. MS: 156 (M-91)+.
b) В условиях фазового перехода (30 мл толуола, 30 мл 50%-ного раствора гидроокиси натрия, 100 мг тетрабутиламмонийгидросульфата), 2,1 г продукта предыдущей стадии превращают с 1,76 мл сложного трет.-бутилового эфира бромуксусной кислоты. После перемешивания органическую фазу отделяют, промывают насыщенным раствором хлористого натрия, сушат и сгущают. Хроматография остатка на силикагеле (гексан/уксусный эфир 3 1) дает 1,91 г бензил-(1RS, 4SR)-4-[(трет.-бутоксикарбонил)метокси]-2-циклогексен-1-карбамата. MS: 333 (M-28)+.
c) Раствор 722 мг продукта предыдущей стадии b), 280 мг N-метилморфолин-N-окиси и 26 мг тетраокиси осмия в 20 мл ацетона и 10 мл воды перемешивают и затем удаляют ацетон при пониженном давлении и экстрагируют водную фазу простым эфиром. Промывка органической фазы насыщенным раствором хлористого натрия, сушка и сгущение дают после хроматографии на силикагеле (уксусный эфир/гексан 2 1) 476 мг бензил-(1RS,2SR,3SR, 4SR)-4-[(трет.-бутоксикарбонил)метокси]-2,3-дигидроксициклогексанкарбамата. MS: 396 (M + H)+.
d) Раствор 728 мг продукта предыдущей стадии в 10 мл этанола гидрируют в присутствии 100 мг 20%-ного Pd/C. Затем отфильтровывают катализатор, выпаривают фильтрат и обрабатывают остаток в 30 мл тетрагидрофурана в присутствии 697 мг HBTU и 200 мкл триэтиламина, 410 мг N-бензилоксикарбонил-L-аланина. Реакционный раствор разбавляют простым эфиром, промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия и сгущают. Хроматография на силикагеле (уксусный эфир/метанол 95 5) дает 521 г бензил-[(S)-l-[[(1RS, 2SR, 3SR,<4SR)-4-[(трет.-бутоксикарбонил)метокси]-2,3-дигидроксициклогексил]карбамоил]этил]карбамата. MS: 467 (M + H)+.
e) Ацетилирование 800 мг продукта стадии d) в 10 мл уксусного ангидрида и 10 мл пиридина и сгущение реакционного раствора дает после хроматографии на силикагеле (уксусный эфир/гексан 2 1) 670 мг бензил-[(S)-1-[[(1RS,2SR, 3SR,4SR)-4-[(трет.-бутоксикарбонил)метокси]-2,3-ацетоксициклогексил]карбамоил]этил] карбамата. MS: 551 (M + H)+.
f) Гидрирование 670 мг продукта предыдущей стадии в 10 мл этанола в присутствии 100 мг 10%-ного Pd/C, отфильтровывание катализатора и выпаривание раствора дает после обработки (аналогично примеру 1f) 329 мг n-амидинобензоилхлорида и хроматографии на силикагеле (RP-18, вода/метанол 9 1) 230 мг желаемого исходного вещества. MS: 563 (M + H)+.
Пример 29. 220 г продукта примера 28 и 300 мг карбоната калия перемешивают в 10 мл метанола при комнатной температуре и затем выпаривают метанол. Хроматография на силикагеле (RP-18, вода/ацетонитрил 95 5) дает 110 мг [[(1RS, 2RS, 3RS, 4SR)-4-[[N-(n-амидинобензоил)-L-аланил] амино]-2,3-дигидроксициклогексил]окси]уксусной кислоты.
Пример 30. Обработка 1,3 г сложного метилового эфира рац-[п-[[1-(п-цианбензоил)-2-пирролидинил] карбонил] фенокси] уксусной кислоты, как описано в примере 2A) B) C), дает после хроматографии (силилированный кизельгель RP-18, вода/метанол-элюент) и перекристаллизации из этанола 0,45 г ацетата сложного метилового эфира рац-[n-[[1-(n-амидинобензоил)-2-пирролидинил] карбонил] фенокси]уксусной кислоты. Точка плавления 210-211oC. MS (FAB): 410 (M + H)+.
Исходное вещество можно получать следующим образом:
a) Реакцией реактива Гриньяра из 8,3 г n-бензилоксибромбензола и 0,8 г магниевых стружек с 9,34 г Z-L-пролин-N-метоксиметиламида в тетрагидрофуране выделяют после хроматографии (силикагель; простой диэтиловый эфир/петролейный эфир 1 1) 4,3 г рац-1-(бензилоксикарбонил)-2-(n-бензилоксибензоил)-пирролидина. MS (EI): 211 (C14H11O2)+, 204 (C12H14NO2)+.
b) Гидрированием 3,3 г продукта стадии a), как в примере 6b), и последующей реакцией с 1,32 г n-цианбензоилхлорида в диметилформамиде в присутствии триэтиламина получают 2,8 г рац-1-(n-цианбензоил)-2-(n-гидроксибензоил)пирролидина. Точка плавления 194-196oC (уксусный эфир). MS (EI): 320 (M)+.
c) Реакция 2,8 г продукта предыдущей стадии с 1,53 г сложного метилового эфира бромуксусной кислоты в диметилформамиде в присутствии карбоната калия дает после хроматографии (силикагель; дихлорметан/метанол 99 1) 1,3 г желаемого исходного соединения. MS (EI): 392 (M)+.
Пример 31. Нагреванием 0,30 г продукта примера 30 в водном растворе уксусной кислоты получают после хроматографии (силилированный кизельгель RP-18, вода/ацетонитрил-элюент) 0,11 г рац-[n-[[1-(n-амидинобензоил)-2- пирролидинил] карбонил]фенокси]уксусной кислоты. Точка плавления выше 250oC. MS (FAB: 396 (M + H)+.
Пример 32. Обработкой 0,85 г сложного диметилового эфира [[4-[1-(n-цианбензоил)-DL-пролил] -м-фенилен] диокси] диуксусной кислоты, как описано в примере 2A) B) C), получают после хроматографии (силилированный силикагель RP-18, вода/метанол-градиент) и кристаллизации из простого диэтилового эфира 0,09 г ацетата сложного диметилового эфира [[4-[1-(n-амидинобензоил)-DL-пролил] -м-фенилен] диокси] диуксусной кислоты. Точка плавления 93-95oC. MS (FAB): 498 (M + H)+.
Исходное вещество получают следующим образом:
a) Превращением магниевой соли 4 г сложного метилового эфира 3-гидрокси-феноксиуксусной кислоты с 5,8 г Z-L-пролиналя и этерификацией продукта с 3,8 г сложного метилового эфира бромуксусной кислоты, как описано в примере 30c), получают после хроматографии (силикагель; простой диэтиловый эфир/петролейный эфир 4 1) 7,6 г сложного диметилового эфира [[4-[(RS)-1-бензилоксикарбонил)-DL-пирролил] гидроксиметил] -м-фенилен]диокси]диуксусной кислоты. MS (FAB): 488 (M + H)+.
b) Из 5,3 г продукта стадии а) получают окислением при помощи 7,5 мл реактива Джонса в простом диэтиловом эфире после хроматографии (силикагель; дихлорметан/метанол 99: 1) 2,2 г сложного диметилового эфира [[4-[1-(бензилоксикарбонил)-DL-пролил] -м-фенилен] диокси] диуксусной кислоты. MS (EI): 485 (M)+.
c) Гидрированием 2,2 г продукта стадии b), как в примере 6b), и последующим взаимодействием с 1,0 г n-цианбензоилхлорида в хлороформе в присутствии триэтиламина получают после хроматографии (силикагель, дихлорметан/метанол 99 1) 0,85 г желаемого исходного вещества. MS (EI): 480 (M)+.
Пример 33. Из 0,09 г продукта примера 32 получают гидролизом водным раствором натрового щелока в метаноле при 50oC после нейтрализации уксусной кислотой, хроматографии (силилированный кизельгель RP-18, вода/ацетонитрил-элюент) и кристаллизации из этанола 0,09 г мононатриевой соли [[4-[1-(n-амидинобензоил)-DL-пролил] -м-фенилен] диокси] диуксусной кислоты. Точка плавления 241-242oC. MS (FAB): 492 (M + Na)+, 470 (M + H)+.
Пример 34. Из 0,47 г [[1-[N-(n-амидинобензоил)-L-тирозил]-4-пиперидинил] окси]уксусной кислоты (пример 14) получают этерификацией в этаноле в присутствии каталитических количеств концентрированной серной кислоты после хроматографии (LiChroprep RP-18, вода/этанол-элюент) 0,3 г полусульфата сложного этилового эфира [[1-N-(n-амидинобензоил)-L-тирозил]-4-пиперидинил]окси] уксусной кислоты, точка плавления 182-184oC (этанол). MS (ISO ионное плавление): 497 (M + H)+.
Пример 35. Из 0,48 г сложного трет.-бутилового эфира [[1-[N-[5-(1-трет. -бутоксиформамидо)пентаноил] -3-(n-трет. -бутоксифенил)-L-аланил] -4-пиперидинил] окси] уксусной кислоты получают по аналогии с примером 1 после кристаллизации из простого диэтилового эфира 0,2 г соли трифторацетата [[1-[N-(5-аминопентаноил)-L-тирозил] -4-пиперидинил] окси] уксусной кислоты, точка плавления 78-88oC (разложение).
[α]
Исходное вещество можно получать следующим образом:
Реакция 0,7 г сложного трет.-бутилового эфира [[1-[3-(n-бутоксифенил)-L-аланил] -4-пиперидинил] окси] уксусной кислоты (полученного гидрогенолизом продукта примера 14a) с 0,35 г N-Boc-аминопентановой кислоты в присутствии HBTU и N-метилморфолина (как в примере 2b) дает 0,55 г исходного эфира.
[α]
Пример 36. Из 0,6 г [(S)-3-(n-амидинобензамидо)-3-[[4-[(трет.-бутоксикарбонил)метокси] пиперидино]карбонил]пропил]-трет.-бутилкарбамата получают по аналогии с примером 1 после хроматографии (LiChroprep RP-18, вода/метанол-элюент) и перемешивания в тетрагидрофуране 0,26 г соли трифторацетата [[1-[(S)-2-(n-амидинобензамидо)-4-аминобутаноил)] -4-пиперидинил] окси] уксусной кислоты. Точка плавления выше 170oC (разложение).
[α]
Исходное вещество можно получать следующим образом:
a) Реакция 1,0 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 2,0 г N2-Fmoc-N4-Boc-(S)-2,4-диаминомасляной кислоты в присутствии HBTU и основания Хюнига дает, как описано в примере 2b), после хроматографии (силикагель, EtOAc/гексан 1 1,5) 2,2 г 3-трет.-бутил-1-(флуорен-9-илметил)-(S)-1-[[4-[(трет. -бутоксикарбонил)метокси] пиперидино] карбонил] триметилен-дикарбамата. MS (FAB): 638 (M + H)+.
b) Взаимодействие 2,3 г продукта a) с пиперидином (20% в диметилформамиде) дает после хроматографии (силикагель, уксусный эфир/метанол 4 1) 0,65 г трет. -бутил-[(S)-3-амино-3-[[4-[(трет. -бутоксикарбонил)метокси] пиперидино]карбонил]пропил]карбамата, MS (FAB): 416 (M + H)+.
c) Взаимодействие 0,65 г продукта b) с 0,38 г n-амидинобензоилхлорид-гидрохлоридом (как в примере 1f) получают 0,6 г исходного карбамата, MS (FAB): 562 (M + H)+.
Пример 37. Из 0,25 г соли ацетата сложного трет.-бутилового эфира [[1-[N-[(5-амидино-2-пиридил)карбонил] -3-(n-трет.-бутоксифенил)-L-аланил]-4-пиперидинил]окси]уксусной кислоты получают (как в примере 1) после хроматографии (LiChroprep RP-18, вода/метанол-градиент) и перемешивания в уксусном эфире 0,12 г [[1-[N-[(5-амидино-2-пиридил)карбонил]-L-тирозил]-4-пиперидинил]окси]уксусной кислоты, точка плавления 198-200oC (разложение). MS (FAB): 470 (M + H)+.
Исходное вещество можно получать следующим образом:
a) Реакция 2,5 г сложного трет.-бутилового эфира [[1-[3-(n-трет.-бутоксифенил)-L-аланил] -4-пиперидинил]окси]уксусной кислоты с 0,85 г 5-циан-2-пиколиновой кислоты (как в примере 1d) дает 1,55 г сложного трет.-бутилового эфира [[1-[3-(n-трет. -бутоксифенил)-N-[[5-циано-2-пиридил]карбонил]-L-аланил)-4-пиперидинил]окси]уксусной кислоты. Точка плавления 122-123oC (простой диэтиловый эфир/петролейный эфир 4 1). MS (FAB): 565 (M + H)+.
b) Последующая обработка 1,43 г продукта стадии a), как описано в примере 2A) B) C), дает 0,98 г желаемого исходного вещества. Точка плавления 183-186oC. MS (EI): 582 (M + H)+.
Пример 38. Реакция 0,7 г сложного этилового эфира (S)-1-[2-(5-цианопиридин-2-илкарбониламино)-3-(4-метоксифенил)пропионил] пиперидин-4-илоксиуксусной кислоты, как описано в примере 2A) B) C), дает после кристаллизации из воды 0,1 г соли ацетата сложного этилового эфира (S)-1-[2-(5-амидинопиридин-2-илкарбониламино)-3-(4-метоксифенил)пропионил] пиперидин-4-илоксиуксусной кислоты. Точка плавления 180-181oC (разложение). MS (ISP): 512 (M + H)+.
Исходный нитрил можно получать следующим образом:
a) Взаимодействие 7 г N-Z-L-тирозин-дигидрата с 4,5 г сложного этилового эфира 4-пиперидинилоксиуксусной кислоты (полученного обработкой соответствующего сложного трет.-бутилового эфира, пример 1c), с трифторуксусной кислотой, с последующей обработкой раствором соляной кислоты в этаноле, как в примере 1d), дает 6,5 г сложного этилового эфира [[1-[N-(бензилоксикарбонил)-L-тирозил-4-пиперидинил] окси] уксусной кислоты. Этот продукт обрабатывают в диметилформамиде в присутствии карбоната калия иодистым метилом, причем после хроматографии (силикагель, хлористый метилен/метанол 99 1) получают 4,2 г сложного этилового эфира (S)-1-[2-бензилоксикарбониламино-3-(4-метоксифенил)пропионил] пиперидин-4-илоксиуксусной кислоты,
[α]
Ь) Из 4 г продукта a) получают по аналогии с примером 1a) 3,5 г сложного этилового эфира (S)-1-[2-амино-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксусной кислоты, MS (EI): 365 (M + H)+.
c) Взаимодействие 1,46 г продукта b) с 0,74 г 5-циан-2-пиколиновой кислоты по примеру 1d) дает после хроматографии на силикагеле (хлористый метилен/метанол 40 1) 0,72 г исходного нитрила, MS (ISP): 495,5 (M + H)+.
Пример 39. Омылением сложного этилового эфира (S)-1-[2-(5-амидинопиридин-2-илкарбониламино)-3-(4-метоксифенил)пропионил] пиперидин-4-илоксиуксусной кислоты (пример 38) при pH 12 получают после хроматографии (LiChroprep RP-18, вода/метанол-элюент) и перемешивания в этаноле (S)-1-[2-(5-амидинопиридин-2-илкарбониламино)-3-(4-метоксифенил)пропионил] пиперидин-4-илоксиуксусную кислоту. Точка плавления выше 250oC. MS (ISP): 484,4 (M + H)+.
Пример 40. Взаимодействием 1,2 г сложного этилового эфира (S)-1-[2-амино-3-(4-метоксифенил)пропионил] пиперидин-4-илоксиуксусной кислоты (пример 38b) с 0,77 г гидрохлорида хлорангидрида 4-амидинобензойной кислоты в 3-пиколине (аналогично примеру 1f) получают после хроматографии (LiChroprep RP-18, вода/этанол-элюент) и перемешивания с уксусным эфиром 0,25 г гидрохлорида сложного этилового эфира (S)-1-[2-(4-амидинобензамидо)-3-(4- метоксифенил)пропионил] пиперидин-4-илоксиуксусной кислоты, точка плавления 105-107oC. MS (ISP): 511,3 (M + H)+.
Пример 41. Омылением 0,35 г гидрохлорида сложного этилового эфира (S)-1-[2-(4-амидинобензамидо)-3-(4-метоксифенил)пропионил] пиперидин-4-илоксиуксусной кислоты (пример 40) при pH 12 получают после хроматографии (LiChroprep RP-18, вода/метанол-элюент) и кристаллизации из этанола/воды 0,05 г (S)-1-[2-(4-амидинобензамидо)-3-(4-метоксифенил) пропионил]пиперидин-4-илоксиуксусной кислоты, точка плавления 191-192oC. MS (ISP): 483,3 (M + H)+.
Пример 42. Из 1,6 г сложного трет.-бутилового эфира [1-[N-(4-амидинобензоил)-L-триптофил] пиперидин-4-илокси] уксусной кислоты получают по аналогии с примером 1 после хроматографии (LiChroprep RP-18, вода/метанол-элюент) и смешивания с тетрагидрофураном и ацетонитрилом 0,7 г [1-[N-(4-амидинобензоил)-L-триптофил]пиперидин-4-илоксиуксусной кислоты, точка плавления 210oC (разложение). MS (ISP): 492,2 (M + H)+.
Исходное вещество получают следующим образом:
a) Взаимодействие 5,1 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты (пример 1c) с 8,0 г Z-Trp-OH в присутствии HBTU и N-метилморфолина дает, как описано в примере 2b), после хроматографии (силикагель, хлористый метилен/метанол 20 1) 11,5 г сложного трет.-бутилового эфира [1-(N-бензилоксикарбонил-L-триптофил)пиперидин-4-илокси] уксусной кислоты. MS (ISP): 536,0 (M + H)+.
b) Раствор 6,6 г продукта a) в метаноле нагревают в присутствии 10%-ного Pd/C и формиата аммония до температуры кипения. После фильтрования и хроматографии (силикагель, хлористый метилен/метанол 9 1) получают 4,3 г сложного трет. -бутилового эфира (1-L-триптофил-пиперидин-4-илокси)уксусной кислоты. MS (EI): 384 (M-NH3)+.
c) Превращением 1,9 г продукта b) с 1,15 г гидрохлорида хлорангидрида бензойной кислоты в пиридине, как описано в примере 1f), получают после хроматографии (силикагель, хлористый метилен/метанол 7 1) 1,6 г исходного эфира. MS (ISP): 548,3 (M + H)+.
Пример 43. Раствор 3,2 г сложного трет.-бутилового эфира [1-[N-(4-амидинобензоил)-4'-гексилокси-L-фенилаланил] пиперидин-4-илокси] уксусной кислоты в муравьиной кислоте оставляют на ночь при комнатной температуре. После сгущения, хроматографии (LiChroprep RP-18, вода/метанол-элюент) и перемешивания с простым диэтиловым эфиром выделяют 0,45 г [1-[N-(4-амидинобензоил)-4'-гексилокси-L-фенилаланил] пиперидин-4-илокси] уксусной кислоты, точка плавления 160oC (разложение),
[α]
Исходный эфир получают следующим образом:
a) По аналогии с примером 38a) взаимодействие 5,6 г сложного трет.-бутилового эфира [[1-[N-(бензилоксикарбонил)-L-тирозил] -4-пиперидинил]окси] уксусной кислоты с 1-иодгексаном при 80oC дает после хроматографии (силикагель, гексан/уксусный эфир 2,5 1) 3,9 г сложного трет.-бутилового эфира [1-(N-бензилоксикарбонил-4'-гексилокси-L-фенилаланил)пиперидин-4- илокси]уксусной кислоты. MS (EI): 445 (M-Z-NH2)+.
b) Гидрированием 3,9 г продукта a) в метаноле (аналогично примеру 1c) получают 2,85 г сложного трет.-бутилового эфира [1-(4'-гексилокси-L-фенилаланил)пиперидин-4-илокси] уксусной кислоты. MS (EI): 462 (M)+, 445 (M-NH3)+.
c) Взаимодействием 0,5 г продукта b) с 0,3 г гидрохлорида хлорангидрида 4-амидинобензойной кислоты в пиридине (аналогично примеру 1f) получают после хроматографии (силикагель, хлористый метилен/метанол 5 1) 0,7 г исходного эфира. MS (ISP): 609,4 (M + H)+.
Пример 44. Раствор 0,65 г сложного трет.-бутилового эфира (R,S)-[1-[2-(4-аминоиминометил-N-метилбензоиламино)-3-(4-метоксифенил) пропионил] пиперидин-4-илокси] уксусной кислоты в муравьиной кислоте оставляют на ночь при комнатной температуре. После сгущения и хроматографии (LiChroprep RP-18, вода/ацетонитрил-элюент) выделяют 0,13 г (R,S)-[1-[2-(4-аминоиминометил-N-метилбензоиламино)-3-(4-метоксифенил) пропионил]пиперидин-4-илокси]уксусной кислоты, точка плавления 181-182oC. MS (ISP): 497,1 (M + H)+.
Исходный эфир получают следующим образом:
a) Взаимодействием 1,37 г Z-N-Me-Tyr(Me)-OH (J. A. C. S. 112, 1990, 7663) с 0,86 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты (пример 1с), как описано в примере 2b), получают после хроматографии (силикагель, простой диэтиловый эфир/гексан 5 1) 1,6 г сложного трет.-бутилового эфира (R, S)-1-[2-(N-бензилоксикарбонил-N-метиламино)-3-(4-метоксифенил) пропионил]пиперидин-4-илокси]уксусной кислоты. MS (EI): 541,0 (M + H)+.
b) Гидрированием 1,5 г продукта a) в метаноле, как описано в примере 1c), получают 1,05 г масла, которое превращают непосредственно с 0,58 г гидрохлорида хлорангидрида 4-амидинобензойной кислоты в пиридине, как описано в примере 1f). После хроматографии (силикагель, хлористый метилен/метанол 9 1) получают 0,7 г исходного эфира, точка плавления 109-111oC. MS (ISP): 553,2 (M + H)+.
Пример 45. Этерификацией 0,07 г (R,S)-1-[2-(4-аминоиминометил-N-метилбензоиламино)-3-(4-метоксифенил)пропионил]пиперидин-4-илокси] уксусной кислоты в этаноле, как описано в примере 34, получают после хроматографии (LiChroprep RP-18, вода/этанол-элюент) и перемешивания с простым диэтиловым эфиром 0,056 г сложного этилового эфира (R,S)-1-[2-(4-аминоиминометил-N-метилбензоиламино)-3-(4-метоксифенил)пропионил] пиперидин-4-илоксиуксусной кислоты, точка плавления 126-128oC. MS (ISP): 525,5 (M + H)+.
Пример 46. K 100 мг сложного трет.-бутилового эфира (S)-цис-1-[2-(4-амидинобензоиламино)пропионил]-4-трет.-бутоксикарбонилметокси-пирролидин-3-илоксиуксусной кислоты в 5 мл хлористого метилена добавляют 5 мл трифторуксусной кислоты. После перемешивания при комнатной температуре растворители выпаривают и остаток хроматографируют на силикагеле RP-18 с водой/тетрагидрофураном (0-50%). Получают 73 мг (S)-цис-1-[2-(4-амидинобензоиламино)пропионил]-4-карбоксиметокси-пирролидин-3-илоксиуксусной кислоты. MS: 437 (M + H)+.
Исходный эфир получают следующим образом:
a) Перемешивают в условиях фазового перехода 237 мг цис-N-бензилоксикарбонилпирролидин-3,4-диола, 1 мл сложного трет.-бутилового эфира бромуксусной кислоты и 100 мл тетрабутиламмонийгидросульфата в 10 мл 50%-ного натрового щелока. Органическую фазу промывают водой и выпаривают. Хроматография остатка от выпаривания на силикагеле с уксусным эфиром/гексаном (1 3) дает 354 мг сложного бензилового эфира цис-3,4-бис-трет.-бутоксикарбонилметокси-пирролидин-1-карбоновой кислоты. MS: 354 (M-111).
b) Продукт стадии a) гидрируют 320 мг в 10 мл EtOH в присутствии 100 мг 10% -ного Pd/C, через 2 ч отфильтровывают катализатор и остаток в 10 мл тетрагидрофурана перемешивают с 224 мг N-бензилоксикарбонил-L-аланин-N-гидроксисукцинимидного эфира в присутствии 100 мкл триэтиламина. Реакционный раствор разбавляют с простым эфиром, органическую фазу промывают 1-молярным раствором KHSO4, сушат и выпаривают. Хроматография остатка с гексаном/уксусным эфиром (1 1) на силикагеле дает 260 мг сложного трет.-бутилового эфира (S)-цис-l-(2-бензилоксикарбониламинопропионил)-4-трет.-бутоксикарбонилметокси-пирролидин-3-ил-оксиуксусной кислоты. MS: 537 (M + H)+.
c) Продукт стадии b) гидрируют 250 мг в 10 мл этанола в присутствии 100 мг 10%-ного Pd/C, через 4 ч отфильтровывают катализатор и перемешивают остаток в 10 мл пиридина с 102 мг n-амидинобензоилхлорид-гидрохлорида. Выпаривание раствора и хроматография остатка на силикагеле RP-18 с водой/тетрагидрофураном (5-30% ) дает 143 мг исходного эфира, точка плавления 127oC (d).
Пример 47. Раствор 150 мг гидрохлорида сложного этилового эфира (S)-8-[2-(4-амидинобензоиламино)-3-(4-трет. -бутоксифенил)пропионил] -8-азабицикло[3.2.1] октан-эндо-3-илоксиуксусной кислоты перемешивают в 5 мл CH2Cl2 и 2,5 мл трифторуксусной кислоты при комнатной температуре и выпаривают. Остаток с простым эфиром дает кристаллы, которые отсасывают на нутче и растворяют в 5 мл EtOH. К раствору добавляют 40 мг NaOH, растворенной в 1 мл воды, и перемешивают при комнатной температуре. Реакционный раствор нейтрализуют при помощи 1 н. соляной кислоты и выпаривают. Хроматография остатка с водой/тетрагидрофураном на силикагеле RP-18 дает 75 мг (S)-8-[2-(4-aмидинoбeнзoилaминo)-3-(4-гидpoкcифeнил)-пропионил] -8-азабицикло[3.2.1] октан-эндо-3-илоксиуксусной кислоты. MS: 495 (M + H)+.
Исходное вещество получают следующим образом:
a) К раствору 1 г N-бензилоксикарбонил-нортропина и 20 мг ацетата родия (II) в 3 мл толуола добавляют при 80oC 2 мл сложного этилового эфира диазоуксусной кислоты в 2 мл толуола. Через 3,5 ч раствор выпаривают и остаток хроматографируют с гексаном/уксусным эфиром (20-50%) на силикагеле. Получают 555 мг сложного бензилового эфира эндо-3-этокси-карбонилметокси-8-азабицикло[3.2.1]октан-8-карбоновой кислоты. MS: 348 (M + H)+.
Ь) Раствор 500 мг продукта стадии a) в 20 мл этанола гидрируют в присутствии 100 мг 10%-ного Pd/C, через 3 ч отфильтровывают катализатор и выпаривают фильтрат. Остаток растворяют в 10 мл тетрагидрофурана и добавляют к раствору 828 мг N-Z-L-Tyr(tBu)-OH, 140 мкл N-метилморфолина и 569 мг HBTU в 10 мл тетрагидрофурана, который перемешивали 1 ч при 0oC. После перемешивания реакционный раствор выпаривают и остаток хроматографируют с гексаном/уксусным эфиром (1 1) на силикагеле. Получают 650 мг сложного этилового эфира (S)-8-[2-бензилоксикарбониламино-3-(4-трет.-бутоксифенил)пропионил]-8-азабицикло [3.2.1]октан-эндо-3-илоксиуксусной кислоты. MS: 567 (M + H)+.
c) 600 мг продукта предыдущей стадии гидрируют в 20 мл этанола в присутствии 100 мг 10%-ного Pd/C, через 16 ч отфильтровывают катализатор и остаток в 10 мл пиридина перемешивают с 262 мг n-амидинобензоилхлорид-гидрохлорида при комнатной температуре. Выпаривание раствора и хроматография остатка на силикагеле RP-18 с водой/тетрагидрофураном (0-50%) дает 198 мг исходного эфира. MS: 579 (M + H)+.
Пример 48. 706 мг сложного бутилового эфира (E)- или (Z)-(S)-[3-[2-[4-(трет.-бутоксикарбониламино-ди-трет.-бутоксикарбониламинометил)бензоиламино] пропиониламино] пропокси] уксусной кислоты перемешивают в 1,5 мл хлористого метилена и 1,5 мл трифторуксусной кислоты при 20oC. После выпаривания растворителя в вакууме, отпарки с толуолом и кристаллизации из ацетонитрила получают 407 мг трифторацетата сложного бутилового эфира (S)-[3-[2-[4-(амидино)бензоиламино]пропиониламино] пропокси]уксусной кислоты (1 1), точка плавления 163-165oC.
[α]
Исходное вещество получают следующим образом:
a) Акрилонитрил, сложный бутиловый эфир гликолевой кислоты и карбонат калия нагревают до 60oC. После обработки уксусным эфиром и водой отгоняют сложный бутиловый эфир 2-цианэтоксиуксусной кислоты. Точка плавления 100-120oC, 0,3 мм рт.ст. (трубка с шаровым расширением).
b) Последний гидрируют в уксусной кислоте на Pd/C, и полученный при этом амин обрабатывают N-бензилоксикарбонил-L-аланином для получения сложного бутилового эфира (S)-[3-(2-бензилоксикарбониламино-пропиониламино)пропокси] уксусной кислоты, точка плавления 54-55oC.
[α]
c) Гидрированием на Pd/C в уксусной кислоте получают из него сложный бутиловый эфир [3-(2-аминопропиониламино)пропокси]уксусной кислоты, который обрабатывают n-[E/Z]-три(трет.-бутоксикарбонил)амидинобензойной кислотой для получения исходного вещества. MS: 707 (27 M + H).
[α]
Пример 49. 416 мг сложного бутилового эфира (S)-[3-[2-[4-(амидино)бензоиламино]пропиониламино]пропокси] уксусной кислоты перемешивают в 8,3 мл 25% -ной соляной кислоты при 20oC. Раствор выпаривают, и остаток отпаривают с водой. Из тетрагидрофурана получают 211 мг гидрохлорида (S)-[3-[2-[4-(амидино)бензоиламино] пропиониламино] пропокси] уксусной кислоты в виде гидрата (1 1), точка плавления 89-90oC.
[α]
Пример 50. 1 г сложного трет.-бутилового эфира 1-[N-[4-(трет.-бутоксикарбонилимино-ди-трет. -бутоксикарбониламинометил)бензоил] -N-(2-метоксиэтил)глицил] пиперидин-4-илоксиуксусной кислоты перемешивают в 3,8 мл хлористого метилена и 3,8 мл трифторуксусной кислоты при 20oC. Смесь растворителей выпаривают, остаток отпаривают с водой, растворяют в этиловом спирте и при помощи раствора аммиака в метаноле устанавливают pH 8, после чего выкристаллизовывают 1-[N-[4-(аминоиминометил)бензоил] -N-(2-метоксиэтил)глицил] пиперидин-4-илоксиуксусную кислоту в виде гидрата (2 1). Точка плавления >250oC. MS: 421 (100, M + H).
Исходное вещество можно получать следующим образом:
a) Сложный трет.-бутиловый эфир N-(2-метоксиэтил)глицина взаимодействуют в простом эфире и насыщенном водном растворе бикарбоната натрия со сложным бензиловым эфиром хлормуравьиной кислоты с получением сложного трет.-бутилового эфира N-бензилоксикарбонил-N-(2-метоксиэтил) глицина. MS: 324 (82, M + H).
b) Последний расщепляют в хлористом метилене/трифторуксусной кислоте до N-бензилоксикарбонил-N-(2-метоксиэтил)глицина. MS: 267 (1, M).
c) Реакция последнего со сложным трет.-бутиловым эфиром пиперидин-4-илоксиуксусной кислоты приводит к сложному трет.-бутиловому эфиру 1-[N-бензилоксикарбонил-N-(2-метоксиэтил)глицил] пиперидин-4-илоксиуксусной кислоты. MS: 465 (100, M + H).
d) Каталитическим гидрированием на Pd/C в этаноле получают из него сложный трет.-бутиловый эфир 1-[N-(2-метоксиэтил)глицил]пиперидин-4-илоксиуксусной кислоты. MS: 331 (100, M + H).
e) Последний обрабатывают 4-(трет.-бутоксикарбонилимино-ди-трет.-бутоксикарбониламинометил)бензойной кислотой до исходного эфира. MS: 777 (70, M + H).
Ниже приводятся примеры фармкомпозиций для получения лекарственных форм. В указанных композициях активно действующим веществом может служить любое соединение формулы I.
Пример A. Соединение формулы (I) можно использовать известным образом в виде активного вещества для получения таблеток состава, приведенного в табл. 4.
Пример B. Соединение формулы (I) можно использовать известным образом в виде активного вещества для получения капсул состава, приведенного в табл.5.
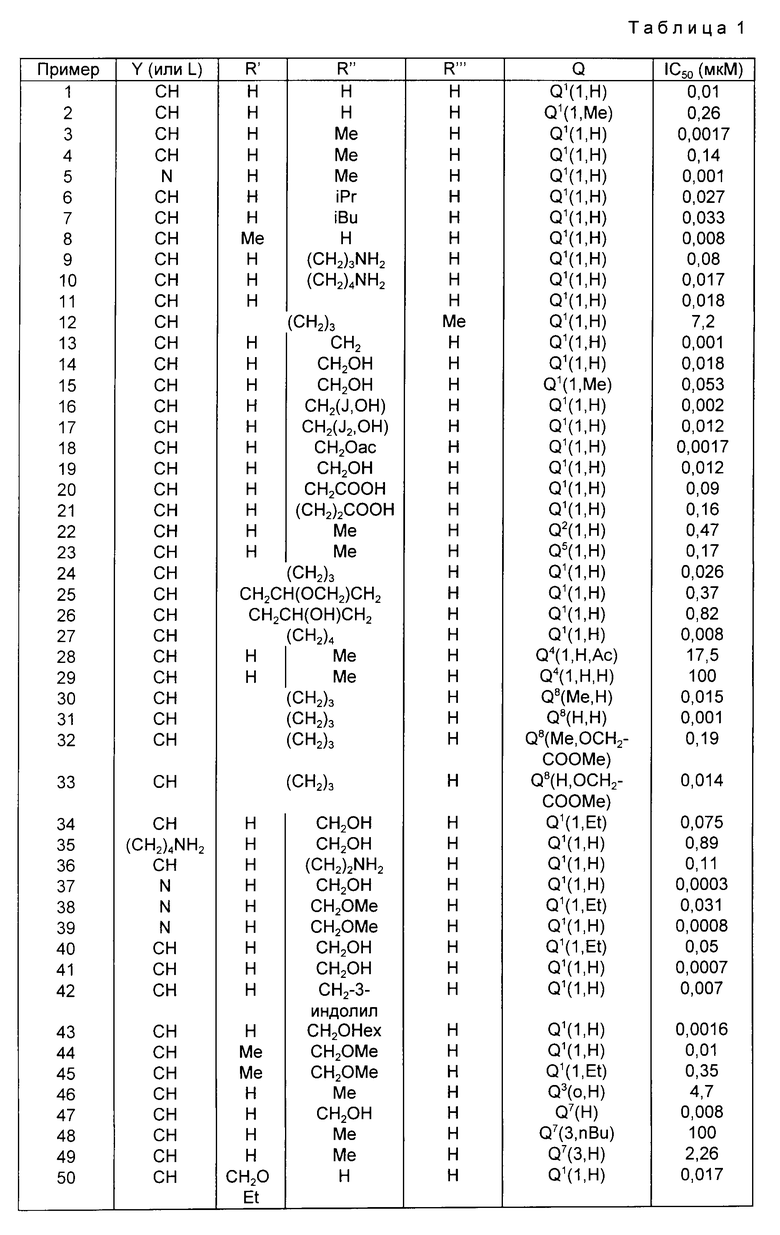
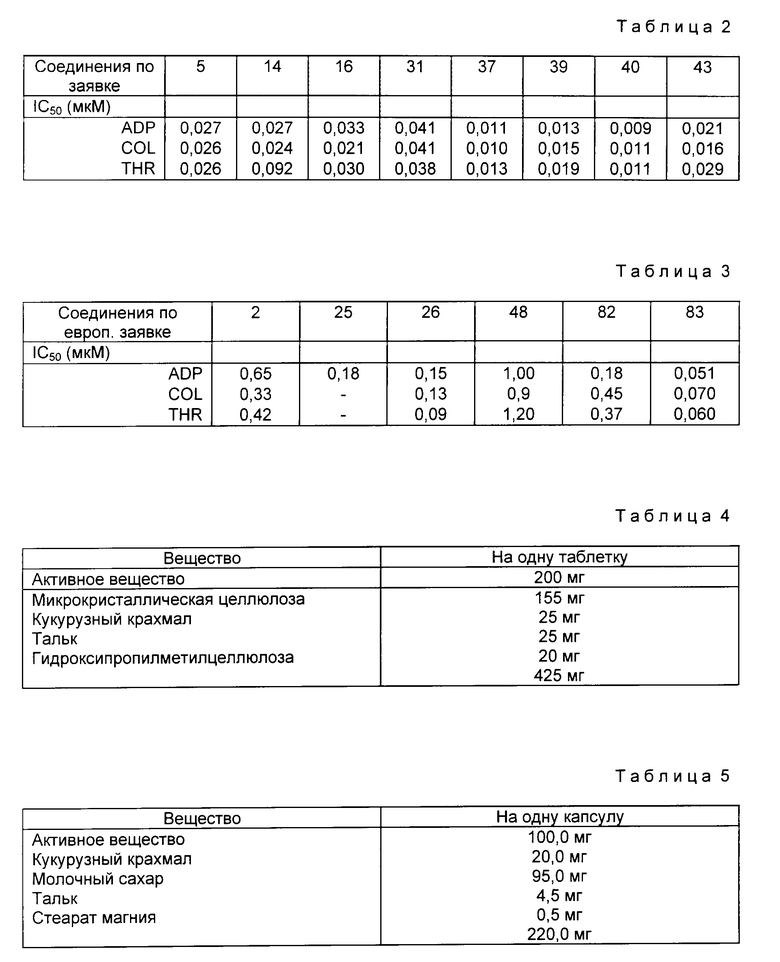
Предложены производные N-ацил-альфа-аминокислоты или их физиологически приемлемые соли, простые или сложные эфиры, амиды или гидраты формулы (I)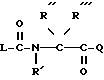 ,
,
где L - группа формулы 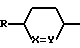 или H2N(CH2)t; R - амидиногруппа, X - CH, Y - CH или N, R' - H, alk, alkOalk, R'' - H, alk и т.д., которые можно использовать для лечения или профилактики болезней, которые вызваны связыванием адгезивных протеинов с тромбоцитами, а также агрегацией тромбоцитов и кислотно-клеточным сцеплением. Соединения I получают отщеплением защитных групп в соответствующих соединениях или переводом цианогруппы в амидиногруппу в соответствующих нитрилах. 3 с. и 12 з.п. ф-лы, 5 табл.
или H2N(CH2)t; R - амидиногруппа, X - CH, Y - CH или N, R' - H, alk, alkOalk, R'' - H, alk и т.д., которые можно использовать для лечения или профилактики болезней, которые вызваны связыванием адгезивных протеинов с тромбоцитами, а также агрегацией тромбоцитов и кислотно-клеточным сцеплением. Соединения I получают отщеплением защитных групп в соответствующих соединениях или переводом цианогруппы в амидиногруппу в соответствующих нитрилах. 3 с. и 12 з.п. ф-лы, 5 табл.
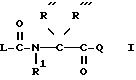
где L группа формулы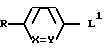
или H2N(CH2)t,
где R амидиногруппа;
Х СН;
Y СН или N;
t целое число от 2 до 6;
R' H, Alk, AlkOAlk;
R" H, Alk, AlkNH2, AlkOH, Alk-индолил, AlkCOOH, AlkOCOAlk, Ph, AlkPh, где Ph необязательно имеет один или несколько заместителей, выбранных из группы ОН, галоген, OAlk, причем ОН- или COOH-группы в R'' могут быть переведены в простой или сложный эфир или амид, или R' вместе с R" при определенных условиях пропилен- или бутиленгруппа, замещенная ОН или AlkPh;
R''' Alk или Н;
Q группа формул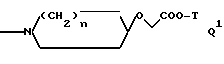
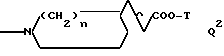
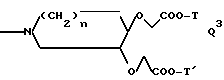
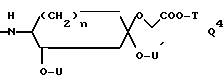
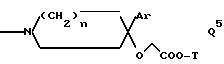
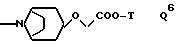
или -NH(CH2)vOCH2COO-T Q7,
где U, U' H, низший алканоил;
Ar F3AlkPh или, если R' и R" вместе с N и С атомами, с которыми они связаны, образуют пирролидиниленовое или пиперидиниленовое кольцо, может быть также группой формулы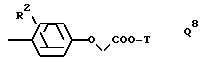
где R2 Alk, H, OCH2COOAlk;
Alk везде низший алкил;
v целое число от 2 до 5;
n целое число от 0 до 1;
T Н или низший алкил;
T' Н,
или их физиологически приемлемые соли, простые или сложные эфиры, амиды или их гидраты.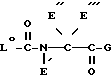
где L0 группа формулы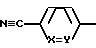
Е', Е", Е''' и G имеют значение R', R", R''' и Q, указанные в п. 1,
или L0 группа формулы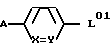
или
R01-(CH2)t L02
где А защищенная в случае необходимости амидиногруппа;
R0 1 в случае необходимости защищенная аминогруппа;
Е', Е", Е''' и G имеют значения R', R", R''' или Q в формуле I,
причем если R0 1 амино или если А амидино, по меньшей мере один из Е', Е", Е''' и G содержит по меньшей мере одну группу сложного эфира карбоновой кислоты, и/или группу простого эфира, и/или защищенную аминогруппу.
Приоритет по пунктам:
26.03.91 по пп. 2, 3, 5 9;
22.01.92 остальные пункты формулы.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J | |||
| Chem | |||
| Abstr, 1991, ref 1750402i | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ЕР, патент, 0381033, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1997-11-27—Публикация
1992-01-31—Подача