Изобретение относится к химико-фармацевтической промышленности, в частности к способам получения лекарственных препаратов растительного происхождения, обладающих противовирусной активностью.
Известен также способ получения суммы фенольных соединений, обладающих противовирусным действием, экстракцией их из листьев облепихи крушиновидной 50% водным ацетоном, упариванием до водного кубового остатка, обработкой последнего смесью хлороформа с изопропиловым спиртом с целью отделения балластных веществ и выведения их из технологического процесса, последующим концентрированием водного кубового остатка и высушиванием его на распылительной сушилке (патент СССР N 1805967, приоритет 3.11.87, 1993).
Этим методом за счет более полного извлечения экстрактивных веществ из сырья (в 1,4-1,5 раза) на первой стадии технологического процесса достигается более высокий выход целевого продукта, обладающего более высокой активностью. Использование классического для получения таннинов экстрагента-воды на этой стадии неэффективно даже при повышенной температуре и дает целевой продукт с выходом лишь 12,5%
Недостатком этого способа является использование токсических хлорсодержащих растворителей (хлороформа), загрязняющих окружающую среду, а также использование метода распылительной сушки, приводящей к частичной деструкции действующих веществ, к ухудшению качества препарата, потере части целевого продукта на заключительной стадии процесса. Кроме того, на этой стадии трудно контролировать чистоту получаемой субстанции на механические примеси и микробную обсемененность.
Этот способ является наиболее близким к заявляемому способу по технической сущности и достигаемому результату и принят за прототип.
Существует также способ получения таннинов облепихи крушиновидной, который заключается в экстракции листьев облепихи водным ацетоном, удалении ацетона в вакууме, обработке водного остатка последовательно эфиром, этилацетатом, бутанолом с последующим выделением соединений из этилацетатной, бутанольной и водной фаз с применением хроматографии из различных сорбентах (гельхроматография, распределительная хроматография, ионообменная хроматография и др.). Однако этот метод имеет лишь чисто аналитическое значение, он применен для выделения и идентификации соединений и не пригоден для наработки веществ в препаративных количествах (T.Yoshida, K.Tanaca, X-H.Cham, T.Okuda. Phytochemistry, 1991, V.30, N 2, P. 663-666).
Целью изобретения является улучшение технологии получения препарата гипорамина (очищенной суммы полифенольных соединений облепихи крушиновидной), не уступающего по противовирусной активности препарату, полученному по способам, заявляемым в авторских свидетельствах N 1188947 и N 1805967, в отношении вирусов гриппа А, герпеса и СПИД. Изобретение позволяет исключить из схемы производства препарата гипорамина токсичные хлорсодержащие растворители, такие, как хлороформ, провести производственные операции в более мягких режимах, исключающих термолиз биологически активных компонентов препарата, а также получить продукт, обладающий лучшей растворимостью в воде.
Указанная цель обеспечивается тем, что на стадии жидкофазной экстракции была использована смесь углеводородсодержащего растворителя гексанового типа, например керосина, петролейного эфира, экстракционного бензина, нефраса, керосина, и алифатического спирта, например н-бутилового спирта, а также высушивание водного концентрата на лиофильной сушилке. В этом методе на стадии лиофилизации выход достигает 99,6-99,8% что по сравнению с методом распылительной сушки, описанным в прототипе (81,8-90,2% по содержанию таннинов в продукте), на 9,6-18% выше.
Целевая сумма полифенольных соединений (гипорамин) содержит 59-65% галлоэллаготаннинов. Поскольку препарат представляет собой природную смесь полифенольных соединений с различной молекулярной массой, значения содержания действующих веществ являются условной величиной. В данном случае пересчет произведен на доминирующий компонент фракции таннинов казуаринин. Биологически активными компонентами гипорамина являются гидролизуемые таннины, в том числе гипорамин (C27H22O18), казуаринин (C41H28O26•7H2O), гипофенин В (C48H32O31), казуариктин (C41H28O26•6H2O), стриктинин (C27H22O18•2,5H2O), изостриктинин (C27H22O18•H2O) и другие, которые были идентифицированы с таннинами, полученными ранее, а также с веществами, выделенными из этого же растения, произрастающего в районе Ченчжоу (Китай) (О.П.Шейченко, В.И.Шейченко и др. Химия природных соединений, 1987, N 6, с.902-907; T.Yoshida, K. Tanaka, X-M.Chen, T.Okuda, Phytochemistry, 1991, Vol. 30, N 2, p. 663-666).
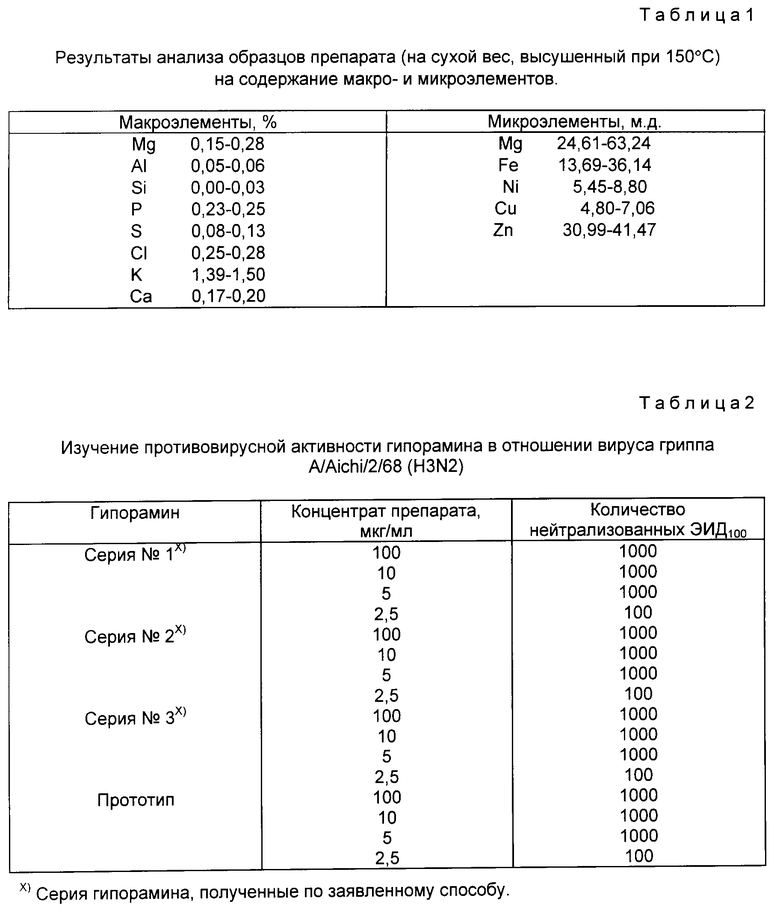
Общими для них структурными элементами являются глюкоза, галлоильный и гексагидроксидифеноильный остатки. Кроме того, в состав препарата входят флавоноиды (17-20%) и квебрахит (5-13%). Таннины сухого очищенного экстракта (гипорамина) частично (до 13% ) находятся в виде металлокомплексов с K+, Mn++, Ca++, Mg++, Fe+++ и другими ионами металлов (см. табл.1), которые проявляются на хроматограмме препарата в виде стартовых пятен. Токсичных металлов в препарате нет. Разрушением металлокомплексов с помощью катионообменных смол (H+-форма) получают деминерализованный продукт, водные растворы которого в отличие от не обработанного ионообменной смолой препарата, показывают кислую реакцию. На хроматограммах такого препарата отсутствуют стартовые пятна металлокомплексов.
При жидкость-жидкостной экстракции в органическую фазу переходят вещества липофильного характера (хлорофилл, тритерпеноид гликозиды флавоноидов кверцетина и изорамнетина), не обладающие противовирусной активностью, а также плохо растворимые в воде, в связи с чем эта фракция выводится из технологического процесса.
Новизна способа получения заключается в использовании новой системы растворителей, наиболее полно извлекающей из водной фазы сопутствующие неактивные экстрактивные вещества (экспериментально показано, что для этой цели подходят двухкомпонентные системы растворителей алифатического углеводорода или смеси алифатических углеводородов с алифатическим спиртом, например с бутанолом), а также высушивании водного концентрата на лиофильной сушилке, при котором не происходит изменения действующих веществ.
Данные анализа полученных образцов препарата показали, что предполагаемая схема получения очищенного сухого экстракта полифенольных соединений (гипорамина) обеспечивает мягкие режимы технологии, при которой не происходит гидролиза биологически активных компонентов, что подтверждается отсутствием в препарате свободной галловой кислоты.
Изобретательский уровень заключается в новой совокупности признаков (системы растворителей) и методов высушивания на заключительной стадии, которые в известных решениях (способах получения таннинов) не найдены. Аналогичный препарат из листьев облепихи с указанным спектром противовирусной активности в отечественной или зарубежной литературе не описан.
В качестве сырья для производства препарата гипорамина использовались листья облепихи крушиновидной с содержанием таннинов не менее 15% и влажностью около 10% Другие органы растения содержат незначительные количества биологически активных таннинов и поэтому не используются в производстве препарата.
Технология получения препарата апробирована на опытно-промышленной установке и на ее основе разработан опытно-промышленный регламент на производство гипорамина. Документация по доклиническому изучению препарата передана в Фармакологический комитет МЗ РФ и получено разрешение на клинические испытания.
Пример 1. 50 г измельченных листьев облепихи крушиновидной с содержанием таннинов 21,5% и влажностью 7,1% заливают 0,5 л 50% водного ацетона, через 1 ч экстракт сливают, к сырью добавляют растворитель, равный объему слива. Таким образом проводят еще три экстракции. Водно-ацетоновые экстракты объединяют и упаривают до объема 0,3 л. Водный кубовый остаток пятикратно обрабатывают смесью нефраса с бутиловым спиртом (2:1) в соотношении 1:1, водную фазу упаривают до 0,1 л и сушат на лиофильной сушилке. Режим сушки: замораживание при -25oC -45oC, выдерживание при -25 45oC 17 ч, поднятие температуры от -35oC до +20oC в течение 2 ч и сушат при этой же температуре 17 ч, температура конденсатора -80oC. Выход 16,30 г (32,57%) с содержанием таннинов 64,05% (расчет сделан с учетом влаги в образце).
Пример 2. Процесс осуществляют, как в примере 1, с тем отличием, что для жидкостной экстракции после удаления ацетона используют смесь гексана с н-бутиловым спиртом в том же соотношении. Выход целевого продукта с учетом влаги 14,83 г (29,60%) с содержанием таннинов 64,91%
Пример 3. Процесс осуществляют, как в примере 1, с тем отличием, что для жидкостной экстракции водную фазу после удаления ацетона используют смесь петролейного эфира с н-бутиловым спиртом в том же состоянии. Выход целевого продукта с учетом влаги 12,89 г (25,78%) с содержанием таннинов 64,01%
Пример 4. Процесс осуществляют, как в примере 1, с тем отличием, что для жидкостной экстракции водную фазу после удаления ацетона используют экстракционный бензин в смеси с н-бутиловым спиртом в том же состоянии. Выход целевого продукта с учетом влаги 15,50 г (31,10%) с содержанием таннинов 66,88%
Пример 5. Процесс осуществляют, как в примере 1, с тем отличием, что для жидкостной экстракции водную фазу после удаления ацетона используют смесь керосина с н-бутиловым спиртом в том же состоянии. Выход целевого продукта с учетом влаги 13,11 г (26,20%) с содержанием таннинов 68,21%
Пример 6. Процесс осуществляют, как в примере 1, с тем отличием, что на стадии твердофазной экстракции листьев облепихи используют 20%-ный ацетон. Выход целевого продукта с учетом влаги 15,18 г (30-36%) с содержанием таннинов 61,20%
Результаты сравнительного изучения активности гипорамина, полученного по заявляемому способу и прототипу в отношении вируса гриппа А
Препарат
1.1. Исследовали гипорамин, получаемый по заявляемому способу. В качестве прототипа использовали гипорамин, получаемый по патенту 1805967 "Способ получения средства, обладающего противовирусной активностью" с приоритетом от 3.11.87.
1.2. Изучение вируснейтрализующей активности в системе куриного эмбриона проводили с использованием вируса гриппа человека A/AICH/2/68 (H3N2).
Методика исследования. Изучали вируснейтрализующее действие гипорамина в контактных опытах in vitro с индикацией на куриных эмбрионах.
Препарат растворяли в буферном растворе с pH 7,2-7,4 и смешивали с 1, 10, 100 и 1000 ЭИД100 вируса гриппа, получая конечные концентрации препарата 100, 10, 5 и 2,5 мкг/мл.
Смеси препарата с вирусом выдерживали в течение 1 ч при температуре 4oC, после чего вводили в объеме 0,2 мл в аллантоисную полость 9-10-дневных интактных эмбрионов. Через 48 ч куриные эмбрионы вскрывали и в аллантоисной жидкости определяли наличие вируса методом реакции гемагглютинации (РГА).
Активность выражали количеством нейтрализованных эмбриональных инфекционных доз (ЭИД) вируса гриппа.
Опыты проводили в нескольких повторностях.
Результаты исследования представлены в табл.2.
Исследование в отношении вируса гриппа штамм A/Aichi/2/68 (H3N2) показало, что гипорамин, получаемый по заявляемому способу, обладает высоким вируснейтрализующим действием в отношении вируса гриппа и не уступает противовирусной активности гипорамина, получаемого по патенту N 1805967 и взятого в качестве прототипа.
Клинические исследования гипорамина в целом были проведены на 374 больных, из них в I фазе испытания на 48 пациентах, во II фазе на 326 пациентах.
Первая фаза клинических исследований была осуществлена в НИИ вирусологии им. Д. И.Ивановского РАМН (дир. акад. РАМН, профессор Д.К.Львов) и в отделе по изучению репаративных процессов в коже ММА им. И.М.Сеченова (зав. профессор И.Я.Шахмейстер). Первая фаза клинических исследований гипорамина, проведенная в этих двух учреждениях на 48 больных, показала хорошую переносимость и достаточную эффективность препарата во всех пяти лекарственных формах, что было подтверждено объективными клинико-лабораторными показателями.
Вторая фаза расширенных клинических испытаний гипорамина на 326 пациентах подтвердила данные I фазы о хорошей переносимости гипорамина во всех изученных лекарственных формах и показала широкий диапазон его противовирусной активности.
Так, в Институте вирусологии была установлена высокая эффективность гипорамина при наблюдении 149 больных, среди которых 84 больных было с неосложненным гриппом и 65 пациентов с другими ОРВЗ, осложненными бактериальной инфекцией -ангиной. Гипорамин при раннем его применении при гриппе и других ОРВЗ (1-2-й день болезни) достоверно сокращал продолжительность лихорадки и симптомов токсикоза. Особенностью гипорамина является его эффективность при ангинах, в т.ч. протекающих на фоне ОРВЗ: препарат способствует более ранней нормализации температуры, исчезновению симптомов интоксикации и воспалительных изменений в миндалинах. Кроме того, по данным Института вирусологии, гипорамин способствует коррекции клеточного иммунитета и повышает содержание сывороточного интерферона.
В НИИТ и ИО клинические испытания проведены на 112 больных кардиохирургического и нефрологического профиля. Из них 75 пациентам гипорамин применяли с целью с целью профилактики послеоперационных осложнений. В этой группе было 24 больных, относящихся к группам риска. С лечебной целью гипорамин назначали 25 пациентам, среди которых было 20 больных с простым герпесом и 5 больных с опоясывающим лишаем. Было установлено, что гипорамин не только дает стойкий лечебный противовирусный эффект при осложнениях герпесвирусной этиологии и ОРВЗ, но и оказывает профилактическое действие для предупреждения послеоперационных вирусных осложнений у больных, особенно в условиях постоянно осуществляемой иммунодепрессивной терапии: ни у одного больного из 75 не было осложнений вирусной этилогии (в контроле 25% случаев).
В трех лечебных учреждениях: в НИИ иммунологии (20 больных), в отделе репаративных процессов в коже ММА им. И.М.Сеченова (20 больных) и на кафедре кожных и венерических болезней ММА им. И.М.Сеченова (25 больных) клинические исследования были проведены на 65 больных с вирусными поражениями кожи и слизистых оболочек, в т.ч. герпес простой и рецидивирующий экстрагенитальной и генитальной локализации, опоясывающий лишай, цитомегаловирусная инфекция. Применение гипорамина способствовало более быстрому засыханию везикул и образованию корочек, уменьшению воспалительной реакции, снижению субъективных ощущений, болезненности, зуда. При вирусных поражениях кожи и слизистых оболочек гипорамин близок по действию к хелепину и алпизарину, несколько уступает ацикловиру и заметно превосходит бонафтон.
Все 5 клинических учреждений в своих отчетах отмечают хорошую переносимость гипорамина и отсутствие каких-либо побочных явлений при применении всех пяти изученных лекарственных форм.
Все клинические учреждения, проводившие клиническое изучение, рекомендуют гипорамин для применения в медицинской практике в качестве противовирусного средства.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ | 1994 |
|
RU2118163C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОВИРУСНОГО ПРЕПАРАТА ГИПОРАМИНА (ВАРИАНТЫ) | 2001 |
|
RU2197978C1 |
| Биологически активное вещество против вируса СПИД | 1987 |
|
SU1805967A3 |
| Способ выделения 6-0-галлоил-1,3-0-гексагидроксидифеноил- @ -Д-глюкозы | 1987 |
|
SU1439107A1 |
| СПОСОБ ПОЛУЧЕНИЯ САНГВИРИТРИНА | 1995 |
|
RU2089212C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАНГИФЕРИНА | 1991 |
|
RU2032413C1 |
| СПОСОБ ПОЛУЧЕНИЯ САНГВИРИТРИНА | 1997 |
|
RU2141837C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОТИВОВИРУСНОГО ДЕЙСТВИЯ | 2013 |
|
RU2538082C2 |
| СПОСОБ ПОЛУЧЕНИЯ НЕЙРОГОРМОНАЛЬНОГО СРЕДСТВА | 1995 |
|
RU2106148C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОТИВОВИРУСНОГО И ПРОТИВОВОСПАЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2015 |
|
RU2596499C1 |
Изобретение относится к химико-фармацевтической промышленности и может найти применение в производстве лекарственных препаратов фенольной природы (например, таннинов) из растительного сырья. Способ заключается в экстракции листьев облепихи крушиновидной (Hippophae rhamnoides L.) водным органическим растворителем, отгонке органического растворителя, обработке водного раствора двухкомпонентной системой органических растворителей, не смешивающихся с водой, содержащих алифатический спирт, и удалении воды из водной фазы, отличается тем, что в качестве экстрагента на стадии жидкостной экстракции используют систему, состоящую из алифатических углеводородов, например гексана, петролейного эфира, экстракционного бензина, нефраса, керосина и н-бутилового спирта, а водную фазу подвергают лиофильной сушке. 2 табл.
Способ получения противовирусного препарата путем извлечения экстрактивных веществ из листьев облепихи крушиновидной (Hippophae rhamnoides L.) водным органическим растворителем, отгонки органического растворителя, обработки водного раствора двухкомпонентной системой органических растворителей, не смешивающихся с водой, содержащих алифaтический спирт, и удаления воды из водной фазы, отличающийся тем, что в качестве экстрагента на стадии жидкофазной экстракции используют систему, содержащую в качестве алифатическогo спирта п-бутанол и алифатический углеводород или смесь алифатических углеводородов, выбранных из группы, включающей гексан, петролейный эфир, экстракционный бензин, нефрас, керосин, а водную фазу подвергают лиофильной сушке.
| SU, патент, 1805967, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1997-12-10—Публикация
1994-03-30—Подача