Изобретение относится к новым производным 1Н-азол-( ω-4-1-(2-пиримидинил)-пиперазинил)-алкила, а также к их физиологически приемлемым солям, предназначенным для лечения расстройств, связанных с абстинентным синдромом, наведенным удалением бензодиазепинов, в частности диазепама, кокаина, спирта и/или никотина.
В то время, как известные анксиолитики [1] всегда оказываются не способными к торможению абстинентного синдрома, оказалось совершенно неожиданным, что некоторые производные 1Н-азол-( ω-(4-(2-пиримидинил(1-пиперазинил)-алкила являются очень активными для лечения расстройств, связанных с таким синдромом.
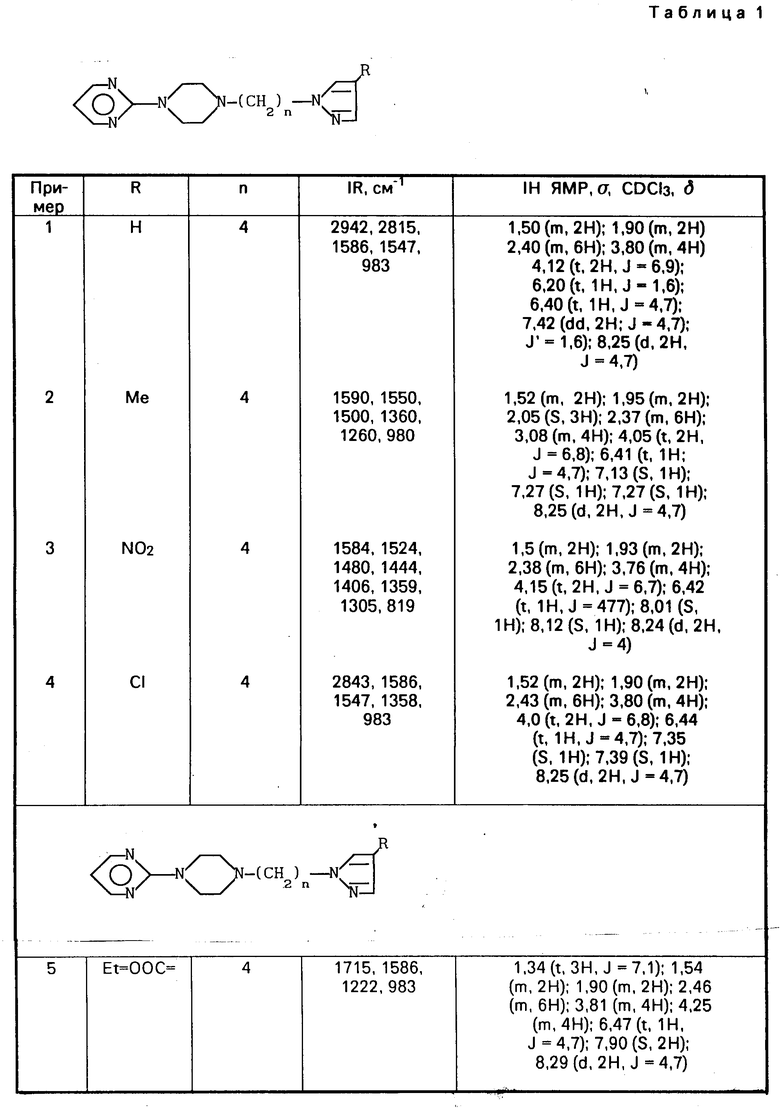
Соединения согласно предлагаемому изобретению отвечают общей формуле I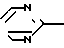 N
N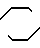 N
N (CH2)n-N
(CH2)n-N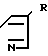 (l) где n может иметь значения от 1 до 6 и R представляет атом водорода, галоген, низший алкил с С1-С4, радикал гетероарил, сульфоновый радикал, замещенный N-сульфамидрадикал или двузамещенный N-сульфамидрадикал, радикал нитро, радикал гидрокси, радикал оксо, низший радикал алкокси с С1-С4, радикал циано, низший радикал алкилкарбоксилат с С1-С4, радикал арил или замещенный радикал арил, радикал амино или замещенный радикал амино формулы
(l) где n может иметь значения от 1 до 6 и R представляет атом водорода, галоген, низший алкил с С1-С4, радикал гетероарил, сульфоновый радикал, замещенный N-сульфамидрадикал или двузамещенный N-сульфамидрадикал, радикал нитро, радикал гидрокси, радикал оксо, низший радикал алкокси с С1-С4, радикал циано, низший радикал алкилкарбоксилат с С1-С4, радикал арил или замещенный радикал арил, радикал амино или замещенный радикал амино формулы
-N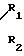 где R1 и R2, одинаковые или разные, представляют атом водорода, радикал алкил, радикал арил, радикал алкилкарбокси, радикал арилкарбокси, радикал алкилсульфонил или радикал арилсульфонил, фрагменты алкил этих радикалов, содержащие 1-4 атома углерода.
где R1 и R2, одинаковые или разные, представляют атом водорода, радикал алкил, радикал арил, радикал алкилкарбокси, радикал арилкарбокси, радикал алкилсульфонил или радикал арилсульфонил, фрагменты алкил этих радикалов, содержащие 1-4 атома углерода.
Эти производные общей формулы I могут быть получены по одному из следующих методов.
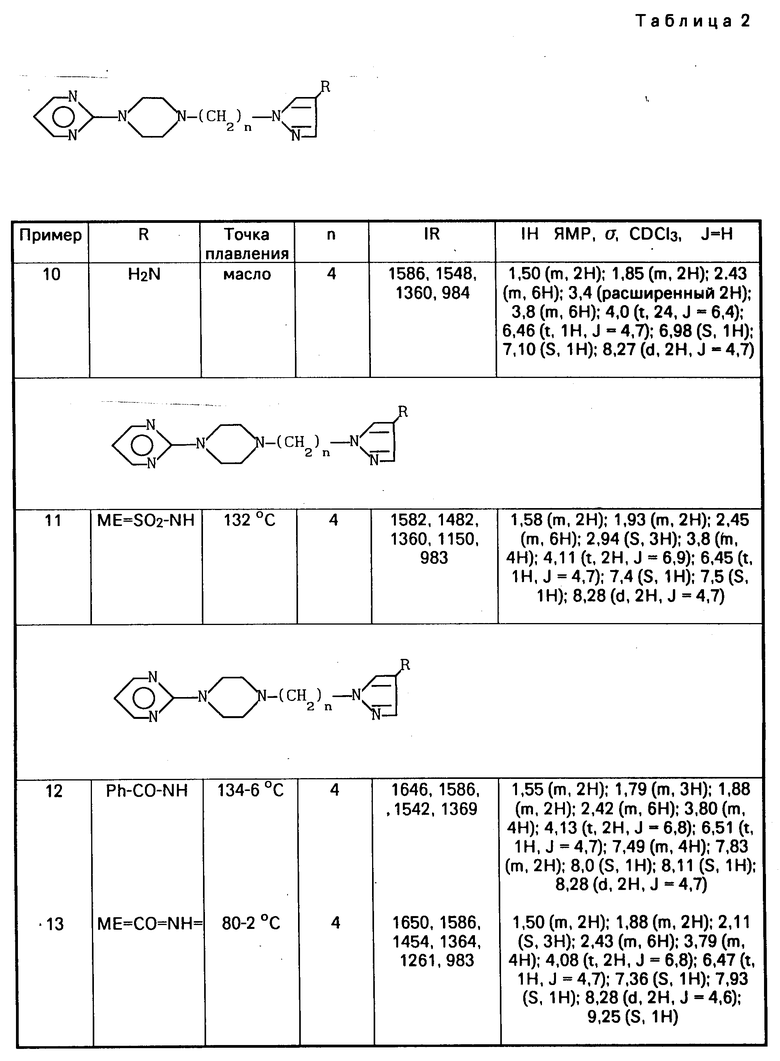
Метод А
Посредством реакции одного соединения общей формулы II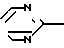 N
N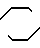 N
N (CH2)n-X (ll) где Х представляет галогенатом или группу, выбранную среди тозилокси или мезилокси, с одним соединением общей формулы III
(CH2)n-X (ll) где Х представляет галогенатом или группу, выбранную среди тозилокси или мезилокси, с одним соединением общей формулы III
HN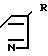 (lll) где R имеет вышеупомянутые значения.
(lll) где R имеет вышеупомянутые значения.
Реакция осуществляется в присутствии адекватного растворителя, например диметилсульфоксида, диметилформамида, спирта, ароматического или неароматического углеводорода, такого эфира, как диоксан или дифениловый эфир, или в присутствии смеси этих растворителей. Преимущественно, эта реакция проводится в присутствии одного основания, такого как гидроокиси, карбонаты или бикарбонаты щелочных металлов, или же в присутствии смеси этих оснований. Наиболее адекватные температуры находятся в диапазоне от температуры окружающей среды до температуры рефлюкса растворителя, а время реакции составляет от 1 до 24 ч.
Метод В.
Путем восстановления одного соединения общей формулы I, в которой R представляет одну группу нитро.
Среди многочисленных восстановителей, которые могут использоваться для восстановления одной группы нитро до одной группы амино, можно назвать следующие восстановители: каталитическая гидрогенизация с использованием в качестве катализаторов никеля, палладия или платины, амальгамы цинка с хлористоводородной кислотой, боргидридов щелочных металлов и т.д.
Реакция осуществляется в таком одном спирту, как метанол, этанол или в одном каком-либо из пpопанолов или бутанолов, или же в смеси одного спирта с водой. Наиболее адекватные температуры находятся в диапазоне от -10оС до температуры рефлюкса растворителя, а время реакции составляет от 1 до 24 ч.
Метод С
Путем ацилирования одного соединения общей формулы I, в которой R представляет одну группу амино с одним кислотным галогенидом или с одним ангидридом.
Реакция осуществляется без растворителя или в присутствии одного адекватного растворителя, такого как углеводород, кетон или эфир, и в присутствии одного основания, такого как пиридин или триалкиламины. Наиболее соответствующие температуры находятся в диапазоне от -10оС до температуры кипения растворителя, а время реакции составляет от 1 до 24 ч.
Метод D
Путем алкилированного восстановления одного соединения общей формулы I, в которой R представляет одну группу нитро, причем это алкилированное восстановление выполняется с боргидридом щелочного металла в присутствии хлорида никеля II и одного соединения, имеющего группу кетон или альдегид. Эта реакция осуществляется в спирту или в смеси спирта и воды. Наиболее подходящими температурами являются температуры от -15оС до температуры рефлюкса растворителя, а время реакции составляет от нескольких минут до 24 ч.
Метод Е
Посредством реакции одного соединения общей формулы IУ
X-(CH2)n-N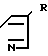 (lV) где Х и n имеют вышеупомянутые значения, с одним соединением общей формулы V
(lV) где Х и n имеют вышеупомянутые значения, с одним соединением общей формулы V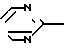 N
N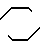 NH (V)
NH (V)
В нижеприведенных примерах показано получение некоторых производных в рамках предлагаемого изобретения. Описываются также некоторые формы применения.
Метод А
П р и м е р 1. Получение 1Н-пиразол-1-(4-(-4(2-пиримидинил)-1-пиперазилинил)-бу- тила).
Нагревают в рефлюксе в течение 14 ч смесь 4 г (13,3 ммоль) 2-пиримидин-1-(4-бромбутил)-4-пиперазина, 1,02 г (15 ммоль) пиразола и 2,76 г (20 ммоль) карбоната калия в 50 мл диметилформамида. Выпаривают в вакууме, добавляют хлороформ, промывают водой, высушивают на сульфате натрия, выпаривают в вакууме и получают 3,5 г масла, которым является 1Н-пиразол-1-(4-(4-(2-пиримидинил)-1-пиперазинил)-бутил).
Соединения, идентифицированные примерами 2-9, получают таким же способом, а данные по их идентификации приводят в табл.1.
Метод В
П р и м е р 10. Получение 1Н-пиразол-4-амино-1-(4-(4-(2-пиримидинил)-1-пиперази- нил)-бутила).
Добавляют 10,2 г (43,2 ммоль) гексагидратхлорида никеля II в раствор 7,2 г (21 ммоль) 1Н-пиразол-4-нитро-1-(4-(4-(2-пиримидинил)-1-пиперазинил)-бутила) (пример 7) в 60 мл этанола при сильном перемешивании. Охлаждают ледяной ванной и медленно добавляют 10,2 г (81 ммоль) боргидрида натрия. Оставляют при перемешивании в течение 1 ч и после 1 ч при температуре окружающей среды добавляют воду, выпаривают в вакууме, подкисляют концентрированной хлористоводородной кислотой, фильтруют, подщелачивают гидратом окиси аммония и экстрагируют этиловым эфиром. Таким образом, получают 4,4 г 1Н-пиразол-4-амино-1-(4-(4-(2-пиримидинил)- 1-пиперазинил)-бутила) в жидком виде.
Спектроскопические данные для его идентификации приводят в табл.2.
Метод С
П р и м е р 11. Получение 1Н-пиразол-4-метилсульфонамидо-1-(4-(4-(2-пиримидинил)-1-пиперазинил)-бутила ).
Медленно добавляют 1,8 г (16 ммоль) метансульфонилхлорида в охлажденный раствор 4,4 г (14,6 ммоль) 1Н-пиразол-4-амино-1-(4-(4-(2-пиримидинил)-1-пиперазинил)-бутила) (пример 16) в 30 мл пиридина. Оставляют в течение 1 ч при 0оС, оставляют при температуре окружающей среды в течение 4 ч, выливают в ледяную воду, экстрагируют хлороформом и получают 3,7 г 1Н-пиразол-4-метил-сульфонамидо-1-(4-(4-(2-пиримидинил)-1-пиперазинил)-бутил а), который можно рекристаллизировать в этиловом эфире с точкой плавления 132оС.
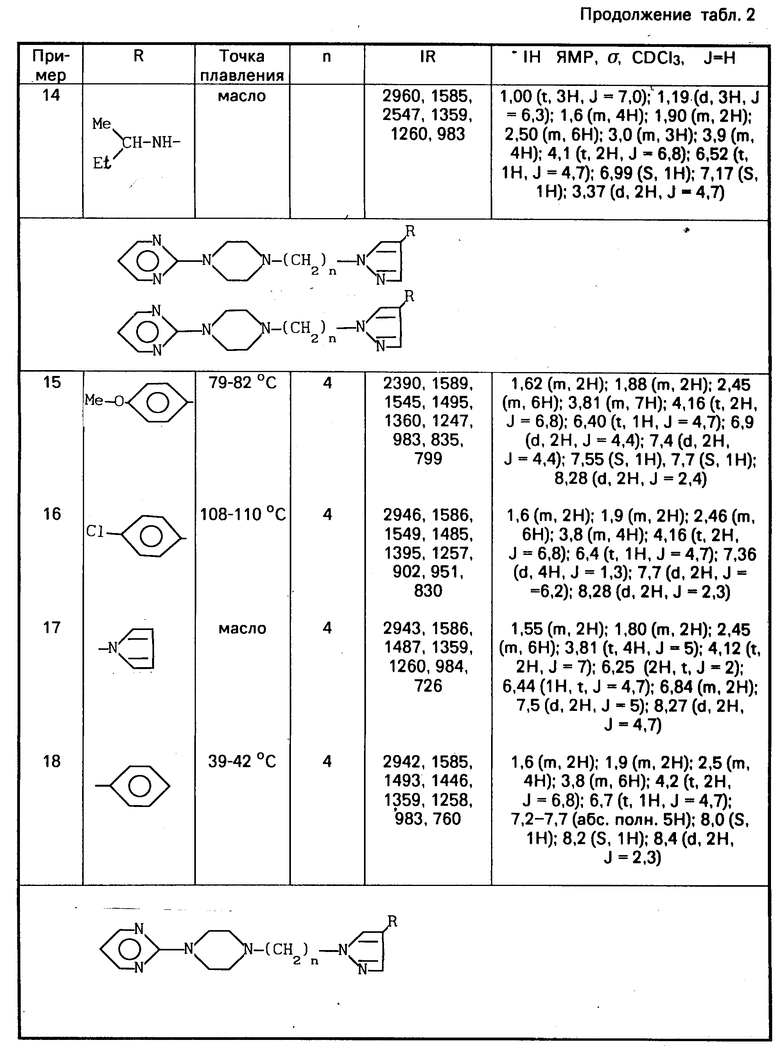
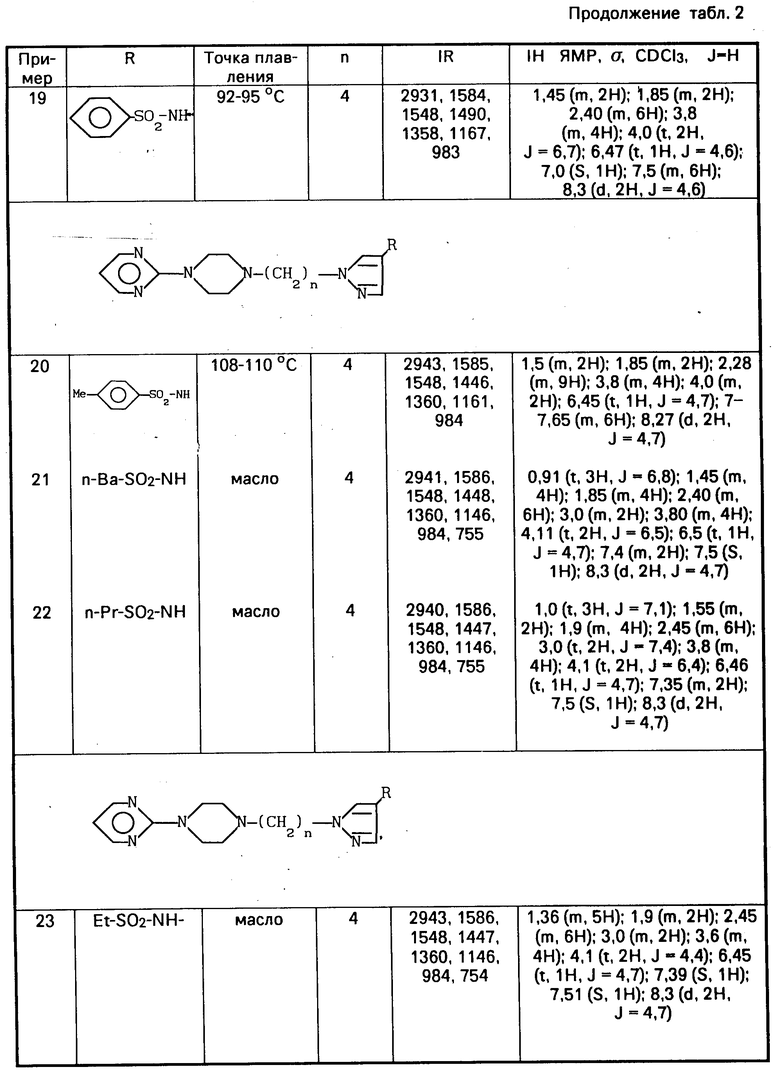
Соединения, идентифицированные примерами 12 и 13, получают по тому же самому способу, а данные для их идентификации приводят в табл.2.
Метод D
П р и м е р 14. Получение 1Н-пиразол-4-(2-бутил)амино-1-(4-(-4(2-пиримидинил)-1- пиперазинил)-бутила).
Добавляют 0,9 г (24 ммоль) боргидрида натрия в суспензию 2,8 г (12 ммоль) гексагидратдихлорида никеля в растворе 2 г (6 ммоль) 1Н-пиразол-4-нитро-1-(4-(4-(2-пиримидинил)-1-пиперазинил)бутила) (пример 7) и 10 мл метилэтилкетона в 50 мл этанола, охлажденного до 0оС. Выдерживают эту температуру в течение 30 мин, оставляют смесь до повышения комнатной температуры, продолжают перемешивание в течение 2 ч, выпаривают в вакууме, поглощают этилацетатом и получают 1,22 г 1Н-пиразол-4-(2-бутил)амино-1-(4-(4-(2-пиримидинил)-1-пипера- зинил)-бутила) в жидком виде.
Спектроскопические данные этого продукта указывают в табл.2.
Изучение анксиолитической или вызывающей беспокойство активности на мышах
Используют тест светлой и темной коробки (J.Phar. Pharmacol, 1988, 40, p. 494-500). Мышь помещают в светлую зону одной коробки, разделенной на два отсека: один сильно освещенный, светлая коробка, и другой слабо освещенный, темная коробка.
Подсчитывают, сколько раз мышь поднимается на задние лапы в каждом отсеке в течение 5 мин. (см. колонка 2, табл. 3-6).
Активность в каждом отсеке приводится путем подсчета числа перекрещиваний клетками, которые составляют отделения каждого отсека (см, колонка 3, табл.3-6).
Измеряют время, проведенное в темной коробке в течение 5 мин. отсчета (см. колонка 4, табл.3-6).
Определяют исходную латентность, т.е. время, прошедшее от помещения животного в светлую коробку, в начале испытания, до его прохождения в темную коробку (см. колонка 5, табл.3-6).
Определяют анксиолитическое или возбужденное поведение мышей в ходе различных периодов лечения, всегда сравнивая его с поведением группы контрольных животных, не подвергавшейся никакой обработке.
Лечение и экспериментальная схема
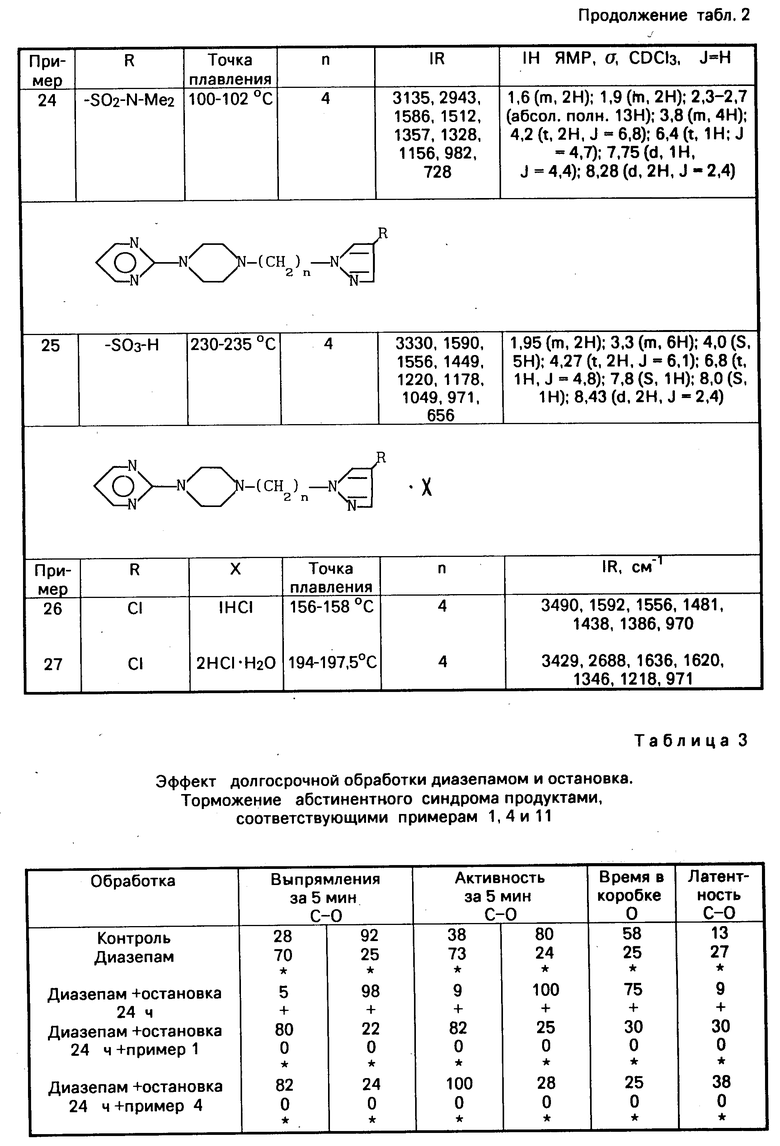
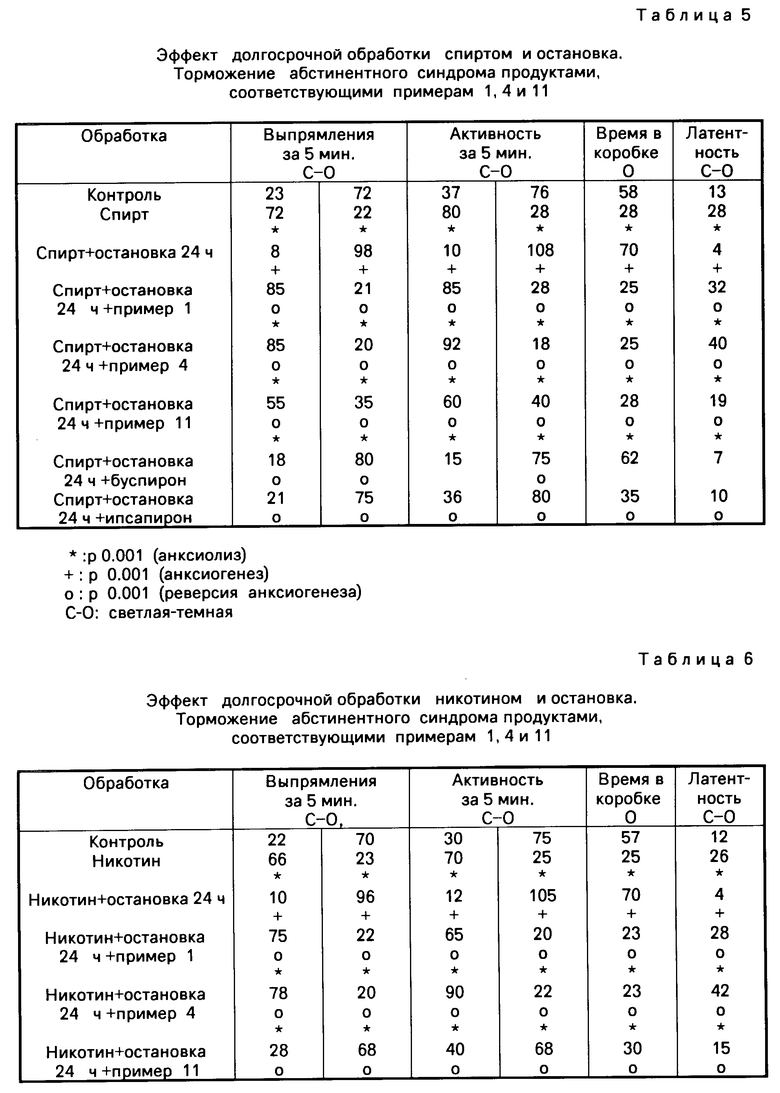
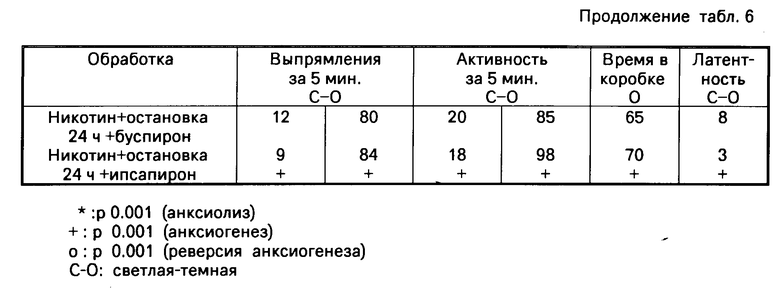
Зависимость определенного лечения (диазепам, кокаин, спирт или никотин) посредством ежедневного введения в течение периода 7 или 14 дней. Эта обработка вызывает ответную анксиолитическую реакцию (увеличиваются активность и время присутствия в светлой коробке).
Дозировки:
диазепам: 10 мг/кг i.p. 2 раза в день в течение 7 дней;
кокаин: 1 кг/кг i.p. в течение 14 дней;
спирт: вводится из расчета 8% вес/объем в питьевую воду в течение 14 дней;
никотин: 0,1 мг/кг i.p. 2 раза в день в течение 14 дней.
Остановка лечения за 24 ч вызывает абстинентный синдром, который проявляется как анксионенная ответная реакция (увеличивает активность и присутствие в темной коробке).
3) Другие различные группы получают помимо диазепама, кокаина, спирта или никотина сопутствующую обработку продуктами, являющимися предметами настоящего изобретения и в качестве сравнения буспироном или ипсапироном. Эти группы освобождаются также от обработки диазепамом, кокаином, спиртом или никотином и наблюдается также ответная реакция по истечении 24 ч.
Приводятся следующие описанные продукты и тестированные дозы:
1Н-пиразол-4-хлор-1-(4-(4-(2-пиримиди-нил)-1-пиперазинил)-бутил) (пример 4): 0,5 мг/кг i.p. 2 раза в день;
1Н-пиразол-1-(4-(4-(2-пиримидинил)1-пиперазинил)-бутил) (пример 1): 0,5 мг/кг i. p. 2 раза в день; 1Н-пиразол-4-метилсульфонамидо-1-(4-(4-(2-пиримидинил)-1-пиперазинил)-бутил (пример 11): 1 мг/кг i.p. 2 раза в день (по отношению в диазепаму, спирту и никотину) и 0,5 мг/кг i.p. 2 раза в день (по отношению к кокаину).
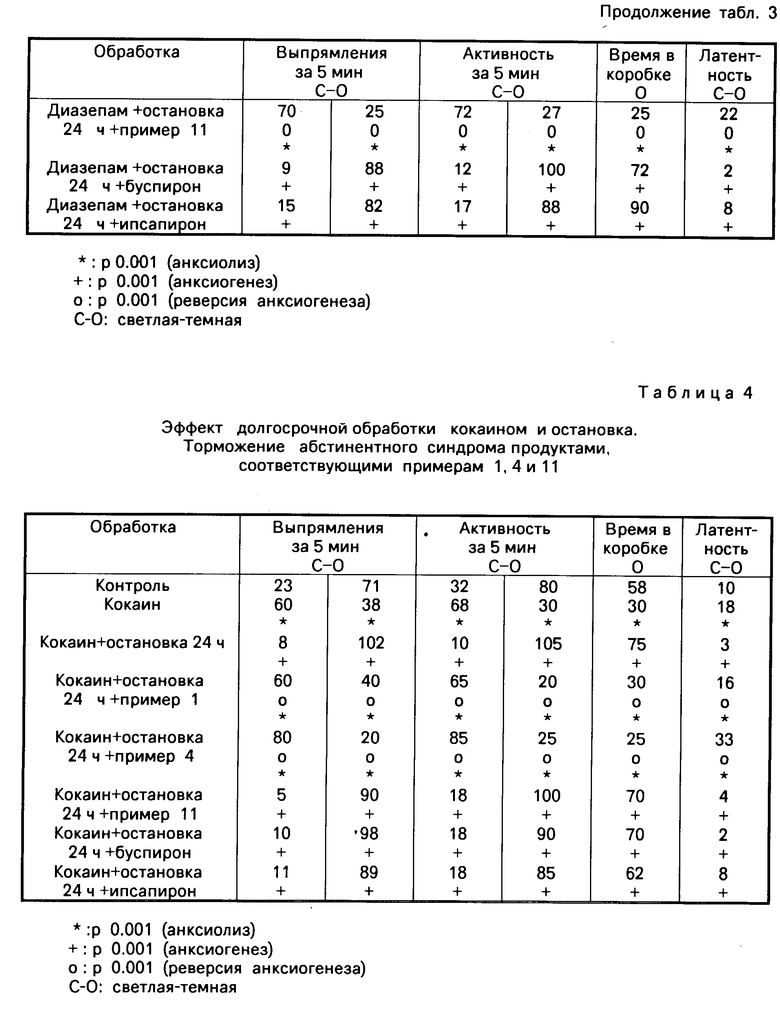
Отмеченные результаты указаны в табл.3-6.
Получены следующие ответные реакции с продуктами, являющимися предметами изобретения:
Производимые по примерам 1 и 4 тормозят абстинентный синдром, который проявляется как анксиогенная ответная реакция, индуктированная диазепамом, кокаином, спиртом и никотином, и кроме того они удерживают значительную анксиолитическую ответную реакцию, когда останавливают введение диазепама, кокаина, спирта или никотина.
Производные по примеру 11 тормозят абстинентный синдром, который проявляется как анксиогенная ответная реакция, индуктированная диазепамом, спиртом и никотином, и, кроме того, они удерживают значительную анксиолитическую ответную реакцию, когда останавливают введение диазепама и спирта.
Буспирон сохраняет абстинентный синдром, который проявляется как анксиогенная ответная реакция, индуктированная диазепамом и кокаином. Однако при остановке обработки спиртом и никотином не происходит больше абстинентного синдрома, а также анксиогенеза. Буспирон заметно тормозит только некоторые параметры анксиогенной ответной реакции после остановки обработки спиртом.
Ипсапирон сохраняет абстинентный синдром, который проявляется как анксиогенная ответная реакция, индуктированная диазепамом, кокаином и никотином. Ипсапирон тормозит абстинентный синдром, который проявляется в виде анксиогенной реакции, индуктированной спиртом.
Следовательно, производные общей формулы I согласно изобретению являются полезными в качестве активных веществ в лекарствах, предназначенных для лечения расстройств, связанных с абстинентным синдромом, который проявляется, в частности, в виде анксиогенной ответной реакции, индуктированной резким устранением продолжительного лечения такими бензодиазепинами, как диазепам, кокаин или продолжительной абсорбции спирта и/или никотина.
В человеческой терапии доза введения конечно зависит от серьезного синдрома.
Она обычно составляет примерно 5-100 мг/день.
Производные изобретения вводятся, например, в виде таблеток, растворов или суспензий, или же в виде желатинозных капсул.
В качестве примеров ниже приводятся два отдельных галеновых вида.
Пример формулы для таблетки, мг
Соединение I 5
Лактоза 60
Микрокристаллическая
целлюлоза 25
Повидон 5
Предварительно желати-
низированный крахмал 3
Коллоидная двуокись кремния 1
______________________________________________________
Вес таблетки 100
Получение таблеток:
Смешивают в смесителе соединение I, лактозу и предварительно желатинизированный крахмал до гомогенного состояния. Полученную смесь смешивают с этанольным раствором повидона. Сушат в печи при 50оС в течение 10 ч. Гранулируют через сито с отверстием 1 мм. Определяют вес гранул и смешивают с микрокристаллической целлюлозой и коллоидальной двуокисью кремния до гомогенного состояния. Добавляют стеарат магния и перемешивают в течение не более 5 мин. Отбирают пробу и анализируют. После анализа спрессовывают гранулы в прессовальной машине и получают таблетки с теоретическим весом 100 мг (граничные параметры согласно Ph.Eur.). Отбирают образец для окончательного контроля.
Пример формулы для желати-
нозной капсулы, мг
Соединение IV 10
Полиоксиэтиленированный
глицерин 135
Бегенат глицерина 5
________________________
150
Эксцепиент: мягкая желатина в достаточном количестве.
Пример получения желатинозной капсулы.
Расплавляют в реакторе полиоксиэтиленированный глицерин и бегенат глицерина, расплав перемешивают. В полученную смесь, нагретую до 45-55оС, вводят при перемешивании соединение IV, и продолжают перемешивание до гомогенного состояния. Смеси дают охладиться при перемешивании и затем при достижении заданной консистенции меняют якорную мешалку. Продолжают охлаждение до 25оС и затем перемешивание прекращают. Отбирают пробу для анализа. После установления анализа осуществляют введение наполнителей. Для этого перемешивают при плавлении следующие размягчающие компоненты: желатин, глицерин, пигмент и очищенную воду. Перекачивают смесь в воронку машины наполнителя, снабженной системой мягкого перемешивания. Дозируют совместно смесь и мягкий желатин для оболочки таким образом, чтобы вес капсулы находился в следующих пределах:
Теоретический вес: 150 мг (стандарт по Ph. Eur.)
Общий вес: 200 мг ( ±5%).
Промывают полученные капсулы и сушат. Отбирают образцы для конечного контроля.
Использование: в медицине в качестве средства для лечения абстинентного синдрома. Сущность изобретения: продукты: производные пиперазинилалкила формулы 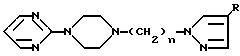 где n целое число от 1 до 6; R водород, галоген C1-C4- алкил, гетероарил, сульфонил, моно- или дизамещенная сульфамидная группа, нитро, гидрокси, оксо, C1-C4- алкокси, циано, C1-C4 алкилкарбоксильная группа, незамещенный или замещенный арил, амино- или замещенная аминогруппа. Реагент I
где n целое число от 1 до 6; R водород, галоген C1-C4- алкил, гетероарил, сульфонил, моно- или дизамещенная сульфамидная группа, нитро, гидрокси, оксо, C1-C4- алкокси, циано, C1-C4 алкилкарбоксильная группа, незамещенный или замещенный арил, амино- или замещенная аминогруппа. Реагент I 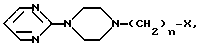 где X галоген. Реагент 2:
где X галоген. Реагент 2: 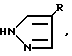 где R имеет вышеуказанные значения Условия реакции: в среде органического растворителя в присутствии основания. 6 табл.
где R имеет вышеуказанные значения Условия реакции: в среде органического растворителя в присутствии основания. 6 табл.
Производные пиперазинилалкила общей формулы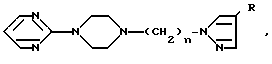
где n целое число от 1 до 6;
R водород, галоген, С1-С4-алкил, 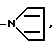 сульфонил, моно- или дизамещенная сульфамидная группа, нитро, гидрокси, оксо, С1-С4-алкокси, циано, С1-С4 алкилкарбоксильная группа, незамещенный или замещенный фенил, амино- или замещенная аминогруппа формулы
сульфонил, моно- или дизамещенная сульфамидная группа, нитро, гидрокси, оксо, С1-С4-алкокси, циано, С1-С4 алкилкарбоксильная группа, незамещенный или замещенный фенил, амино- или замещенная аминогруппа формулы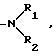
где R1 и R2 одинаковые или различные; водород, алкил, алкилкарбокси, алкилсульфонил, содержащие от 1 до 4 атомов углерода в алкиле, фенил, фенилкарбокси или фенилсульфонил,
или их соли, обладающие свойством торможения абстинентного синдрома.
| Патент США N 4524206, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление для установки двигателя в топках с получающими возвратно-поступательное перемещение колосниками | 1917 |
|
SU1985A1 |
Авторы
Даты
1995-08-27—Публикация
1991-10-15—Подача