Изобретение касается лечения для ингибирования роста или репликации вирусов вирусной группы человеческого иммунодефицита соединениями, пригодными для таковой, и фармацевтическими рецептурами, содержащими такие соединения.
Вирусы представляют собой мельчайшие известные инфекционные образования. Они состоят из нуклеиновой кислоты (либо дезоксирибонуклеиновой кислоты (ДНК), либо рибонуклеиновой кислоты (РНК) и вирусных белков, которые заключены в белковую оболочку.
Вирусные инфекции, если их рассматривать как группу, являются наиболее трудными инфекциями для лечения из-за способа репликации и взаимодействия вирусов с клетками, которые они заражают. Так, существующие способы лечения, направленные на торможение роста или репликации вирусов, часто ведут в некоторому разбалансу клеточного метаболизма у хозяина с результирующим токсическим воздействием на клетки хозяина.
Обычно вирусы сначала связываются с внешней мембраной некоторой данной клетки хозяина. После сцепления в клетку хозяина начинают поступать вирусные нуклеиновые кислоты (ДНК или РНК) наряду с некоторыми вирусными белками.
Вирусные нуклеиновые кислоты изменяют затем ход метаболического процесса у клетки хозяина и вынуждают клетку хозяина вырабатывать вирусные нуклеиновые кислоты и белки, которые затем компануются и в конечном итоге выбрасываются из клетки. Поскольку высвобождение вируса сопровождается разрывом клеточной мембраны протекание полного вирусного репликационного цикла ведет к гибели клетки хозяина.
Вирусы обычно делят на ДНК-вирусы и РНК-вирусы (что зависит от типа нуклеиновой кислоты, которую они содержат) и затем подразделяют на различные семейства.
Ретровирусы представляют собой РНК-вирусы, которые содержат высокомолекулярную РНК, следовые количества ДНК и различные ферменты, включая обратную транскриптазу и нуклеазы, заключенные в белковую оболочку. Вирус этого типа сначала связывается с внешней мембраной надлежащей клетки, после чего вирусная РНК и обратная транскриптиза поступают в клетку хозяина.
Обратная транскриптиза использует вирусную РНК в качестве матрицы для получения комплементарной ДНК-цепи. Эта ДНК оказывается встроенной в ДНК хозяина и вынуждает клетку хозяина вырабатывать вирусную РНК и вирусные белки.
Подгруппа вирусов у семейства ретровирусов включает в себя вирусы человеческого иммунодефицита (ЧИВ), которые, как известно, преимущественно нападают на клетки иммунной и нервной систем человека. Обозначение HIV-1 относится к вирусу, который является одним из этиологических агентов, вызывающих появление синдрома приобретенного иммунодефицита ("AIDS"(СПИД) у людей. Известно, что вирус человеческого иммунодефицита передается посредством обмена жидкими средами между организмами, такими как половые выделения и кровь, например, в результате полового контакта, переливания крови или совместного использования игл, к примеру, пациентами, вводящими внутривенно лекарственные препараты.
Группа вирусов человеческого иммунодефицита заражает и разрушает CD-4-T-лимфоциты (вспомогательные Т-лимфоциты) и клетки центральной нервной системы.
Вспомогательные Т-лимфоциты являются жизненно важными для иммунной системы и необходимыми для иммунной системы, чтобы она могла противостоять условно-патогенным микроорганизмам, таким как Pneumocystis carinii (которые вызывают превмонию), Toxoplasma gondii (токсоплазмоз), вирусным инфекциям, вызванным вирусами Герпеса и вирусами ветряной оспы, а также препятствовать образованию некоторых раковых новообразований, среди которых наиболее известной является саркома Капоши.
Потеря этих клеток под воздействием вирусной инфекции человеческого иммунодефицита - либо в количественном, либо в функциональном отношении - ведет в конечном итоге к утере способности у иммунной системы человека противостоять этим болезням. Вспомогательные Т-лимфоциты являются также необходимыми для противодействия инфекции человеческого иммунодефицита. Именно потеря вспомогательных Т-клеток ведет к возникновению острого иммунодефицита, что является одной из характерных особенностей СПИДа. Заражение центральной нервной системы вирусами человеческого иммунодефицита ведет к прогрессивной потере церебральной функции, завершающейся при СПИДе появлением комплекса деминации.
К моменту составления этой заявки распространение СПИДа, вызванного вирусом человеческого иммунодефицита, достигло в различных частях мира, включая США, эпидемических размеров.
С целью предотвращения заражения вирусами человеческого иммунодефицита или терапии при таком заражении испытанию были подвергнуты различные известные антивирусные лекарственные препараты, включая альфа-интерферон, гамма-интерферон, азимексон, изопиносин и азидотимидин (или АЗТ). Пока единственным веществом, при использовании которого был достигнут некоторый клинический успех, является азидотимидин. Это вещество представляет собой синтетический тимидиновый аналог, который входит в ДНК, и обусловливает преждевременное завершение синтеза ДНК. Сказанное сопровождается ингибированием вирусной репликации, поскольку не образуется ДНК, необходимая для получения вирусной РНК.
Однако синтез ДНК является также необходимым для осуществления нормального функционирования клетки хозяина. Следовательно, введение азидотимидина ведет к ингибированию синтеза ДНК у хозяина с проявлением сопутствующих сильных побочных эффектов в виде, например, анемии, гранулоцитопении и тромбоцитопении.
Таким образом, ощущается настоятельная необходимость создания более совершенных способов подавления вирусов человеческого иммунодефицита и более совершенных лекарственных препаратов, направленных против вирусов человеческого иммунодефицита.
Патент Великобритании N 1451299 касается алкоксикарбонил-фенbлмочевин, которые, как утверждают, обладают гербицидными свойствами. Европейская патентная заявка N 0104070 касается различных N-фенилкарбаматов, которые, как утверждают, являются фунгицидами. Европейская патентная заявка N 0099822 касается 1-(2-карбалкокси-4-(тиенилалкиламидо)фенокси)-3-амино-2-пропанолов, обладающих терапевтическим действием. Европейская патентная заявка N 0217206 касается пара-замещенных фенильных соединений, которые, как утверждают, обладают терапевтическими свойствами.
Теперь будут рассмотрены способы лечения и лекарственные препараты, которые отвечают такой потребности.
В соответствии с одним из аспектов настоящего изобретения предлагается способ ингибирования роста или репликации, который включает в себя введение эффективно действующего количества соединения формулы (I)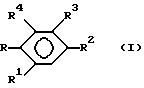
в которой
R1 представляет водород, галоген, C1 - C4-алкил или C1 - C4-алкокси;
R2 представляет водород, галоген, C1-C4-алкил, C1 - C4-алкокси или OH;
R3 представляет
(i) CO2R5, где R5 представляет C1 - C6-алкил, C3 - C6-алкенил, C2 - C6-алкоксиалкил, С1 - С6-галоидалкил, карбокси(C1 - C6-алкил), (C1 - C6-алкил)карбокси(C1 - C6-алкил), фенил, (C1- C6-алкил)фенил, три (C1 - C6-алкил)силилалкил, C3 - C8-циклоалкил, фуранил или тетрагидрофуранил;
(ii) 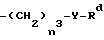 , где n3 представляет 0 или 1, Y представляет 0 или S и Rd представляет C1 - C6-алкил, C3 - C6-циклоалкил, C2 - C6-алкенил, C2 - C6-алкинил, -CH2CO2R5 или -CO2R5;
, где n3 представляет 0 или 1, Y представляет 0 или S и Rd представляет C1 - C6-алкил, C3 - C6-циклоалкил, C2 - C6-алкенил, C2 - C6-алкинил, -CH2CO2R5 или -CO2R5;
(iii) -G-CO2R5, где G представляет -CH2-;
(iv) -CH=NORa, где Ra представляет C1 - C6-алкил;
R4 представляет водород или галоген;
R представляет группу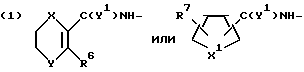 ,
,
где
R6 представляет низший алкил;
R7 представляет водород или один или более низших алкилов;
Y1 представляет кислород или серу;
X1 представляет кислород или серу;
X и Y представляют кислород или серу; или X представляет кислород, а Y представляет CH2-;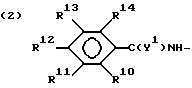 ,
,
где
R10, R11, R12 и R13 представляют водород или галоген;
R14 представляет водород, C1 - C4-алкил, C1 - C4-алкокси, галоген, CO2H, NHCO2 (C1 - C4-алкил) или NH2;
(3) R15-C(O)-NH- или R10-W-C(S)-NH-,
где
R15 представляет C1 - C4-алкокси, C2 - C4-алкинил или C2 - C4-алкенил;
W представляет O или NH(C1 - C4-алкил);
R10 представляет C1 - C6-алкил, С2 - С4-алкенил, C4 - C6-циклоалкил, адамантил, бензил, C1 - C4-алкокси, трифторзамещенный C1 - C4-алкил или фуранил;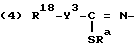 ,
,
где
R18 представляет прямой или разветвленный C1 - C6-алкил;
Y3 представляет 0;
Ra представляет C1 - C4-алкил.
Соединения, пригодные для проведения обработки в соответствии с настоящим изобретением, представляют собой соединения с формулой I, где R означает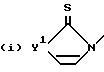 ,
,
в которой
R1 - водород, галоген, C1 - C4-алкильная группа или C1 - C4- алкоксигруппа;
R2 - водород, галоген, C1 - C4-алкильная группа, C1 - C4-алкоксигруппа, гидроксигруппа, моно-, ди- или тригалогенметильная группа, трифторметоксигруппа, метилтиогруппа, нитрогруппа, цианогруппа, ацетоксигруппа или диметиламиногруппа;
R3 представляет собой
I/ - SO2NRaRb, где Ra и Rb независимо представляют собой водород или C1 - C6-алкильную группу или совместно образуют гетероциклическое соединение, у которого гетероциклическая часть представляет собой морфолинильную, пиперидинильную, пирролидинильную или пиперазинильную группу;
II/ -CO2R5, где R5-алкильная группа, C3 - C6-алкенильная или алкинильная группа, галогеналкильная группа с числом атомов галогена от одного до шести, алкоксиалкильная группа, алкилтиоалкильная группа, карбоксиалкильная группа, алкилкарбоксиалкильная группа, C6 - C12-арилкарбоксиалкильная группа, алкиламиноалкильная группа, или диалкиламиноалкильная группа, триалкилсилилалкильная группа, у каждой из которых упомянутые выше алкильные части содержат от одного до восьми атомов углерода, фенильная группа, нафтильная группа, C1 - C6-алкилфенильная группа, C7 - C12-арилалкильная или алкарилалкильная группа, C3 - C8-карбоциклическая группа, C1 - C4-алкил(C3 - C8)карбоциклическая группа или гетероциклилалкильная группа, у которой гетероциклическая часть представляет собой морфолинильную, пиперидинильную, пирролидинильную, пиперазинильную, оксиранильную, фуранильную или тетрагидрофуранильную группу;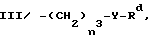 где n3 - число, равное 0 или 1; Y -кислород, сера, SO, SO2 или NH и Rd -C1 - C6-алкильная группа, C3 -C6-циклоалкильная группа, C2 - C6-алкенильная группа, C2 - C6-алкинильная группа, -CH2CO2R5, -CO2R5 с условием, что Y не может представлять собой SO2 или -CORa, где R5 и Ra уже были определены выше;
где n3 - число, равное 0 или 1; Y -кислород, сера, SO, SO2 или NH и Rd -C1 - C6-алкильная группа, C3 -C6-циклоалкильная группа, C2 - C6-алкенильная группа, C2 - C6-алкинильная группа, -CH2CO2R5, -CO2R5 с условием, что Y не может представлять собой SO2 или -CORa, где R5 и Ra уже были определены выше;
IV/ -G-CO2R5, где G - -CH2-, -CH2CH2- или -CH=CH- и R5 - группа, как она была определена выше;
V/ -CH=NORa, где Ra - группа, как она была определена выше;
VI/ -CS2R5, где R5 - группа, как она была определена выше;
VII/ -COSR5, где R5 - группа, как она была определена выше;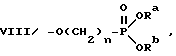 где n - число, равное 1 или 2; Ra и Rb независимо представляют собой водород или C1 - C6 алкильную группу;
где n - число, равное 1 или 2; Ra и Rb независимо представляют собой водород или C1 - C6 алкильную группу;
IX/ -CORa, где Ra - группа, как она была определена выше; или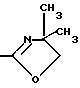
R4 - водород, галогенсодержащая группа, метильная или моно-, ди- или тригалогенметильная группа;
R представляет собой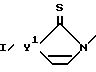 , где Y1 - кислород, сера, NH или NRa, где Ra - группа, как она была определена выше;
, где Y1 - кислород, сера, NH или NRa, где Ra - группа, как она была определена выше;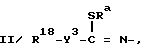 , где R18 - линейная или разветвленная C1 - C6-алкильная или алкоксиалкильная группа, в которой алкильными группами являются C1 - C6, C3 -C8-циклоалкильная группа или моно-, ди- или тригалоген C1 - C6-алкильная группа; Y3 - кислород или сера; Ra - группа, как она была определена выше.
, где R18 - линейная или разветвленная C1 - C6-алкильная или алкоксиалкильная группа, в которой алкильными группами являются C1 - C6, C3 -C8-циклоалкильная группа или моно-, ди- или тригалоген C1 - C6-алкильная группа; Y3 - кислород или сера; Ra - группа, как она была определена выше.
III/ Rz - NH-, где Rz представляет собой где Ra и Rb независимо представляют собой водород или C1 - C6-алкильную группу;
где Ra и Rb независимо представляют собой водород или C1 - C6-алкильную группу;
Z1 - кислород или сера;
б/ цианогруппу;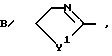 , где Y1 - группа, как она определена выше;
, где Y1 - группа, как она определена выше;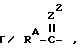 где Z2 - кислород, сера, NH, NRa или NC ≡ N; где Ra - группа, как она была определена выше; и RA представляет собой
где Z2 - кислород, сера, NH, NRa или NC ≡ N; где Ra - группа, как она была определена выше; и RA представляет собой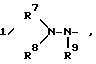 где R7, R8 и R9 независимо представляют собой водород или C1 - C6-алкильную группу или R7 и R8 совместно с атомом азота N образуют C2 - C6-гетероциклическое кольцо;
где R7, R8 и R9 независимо представляют собой водород или C1 - C6-алкильную группу или R7 и R8 совместно с атомом азота N образуют C2 - C6-гетероциклическое кольцо;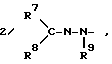 где R7, R8 и R9 независимо представляют собой водород или C1 - C6-алкильную группу или R7 и R8 совместно с атомом углерода образуют C3 - C7-карбоциклическое кольцо;
где R7, R8 и R9 независимо представляют собой водород или C1 - C6-алкильную группу или R7 и R8 совместно с атомом углерода образуют C3 - C7-карбоциклическое кольцо;
3/ а) полностью ненасыщенную, частично или полностью восстановленную или замещенную оксатиинильную, фуранильную, дитиинильную, диоксинильную, тиенильную, тиазолильную, оксазолильную, изоксазолильную, тиадиазолильную, пиразолильную, пирролильную, пиранильную, оксатиазинильную, оксадиазолильную или индолильную группу;
б/ замещенную или незамещенную линейную или разветвленную C1 - C8-алкильную группу, C2 - C8-алкенильную группу, C2 - C8-алкинильную группу, C1 - C8-моно- или диалкиламиногруппу, C3 - C7-циклоалкильную группу, C3 - C7-циклоалкил(C1 - C6)алкильную группу, C3 - C7-циклоалкенильную группу, незамещенную или замещенную C1 - C6- алкилом, или C7 - C8-фенилалкильную группу;
в/ арильную группу, C7 - C10-аралкильную, или арилоксиалкильную или C3 - C8-циклоалкиларилоксисодержащую группу, в которой арильная часть этой группы представляет собой нафтильную, фенильную или фенильную группу, замещенную одной или несколькими галогенсодержащими группами, С1 - С8-алкильными группами, карбоксильными группами, C1 - C8-галоалкильными группами, C1 - C8-алкилтиогруппами, фенильными группами, нитрогруппами, аминогруппами, ацетильными группами, C1 - C8-алкилкарбониламиногруппами, гидроксильными группами, ацетильными группами, ацетоксигруппами, феноксигруппами, C1 - C8-алкоксикарбонильными группами или C1 - C8-алкилкарбонильными группами;
4/ R10-W-, где W-O, NH или NRf, где Rf - C1 - C4-алкильная группа и R10 -
1/ линейная или разветвленная, незамещенная или галогензамещенная С1 - С8-алкильная группа, С2 - С8-алкенильная группа, С2 - С8-алкинильная группа, С3 - С7-циклоалкильная группа, С3 - С7-циклоалкил(С1 - С6)алкильная группа, С3 - С7-циклоалкенильная группа, незамещенная или замещенная на С1 - С6-алкильную группу, незамещенная фенильная группа или фенильная группа, замещенная на галоген-C1 - С6-алкильную группу, С1 - С6-алкоксигруппу, карбоксильную группу, С1 - С8-галогеналкильную группу, C3 - C7-циклоалкильную группу, С1 - С8-алкилтиогруппу, фенильную группу, нитрогруппу, аминогруппу, гидроксильную группу, ацетильную группу, ацетоксигруппу, феноксигруппу, C1 - C8-алкоксикарбонильную группу, C1 - C8-алкилкарбонильную группу, фуранилалкильная группа, тетрагидрофуранилалкильная группа, оксэтанилалкильная группа или оксиранилалкильная группа;
II/ R11-W1Re, где Re - линейная или разветвленная C1 - C6-алкилиденовая группа; W1 - кислород или сера; R11 - линейная или разветвленная C1 - C4-алкильная группа;
III/ R13R12-N-Re, где Re - группа, как она была определена выше; R12 и R13 независимо представляют собой линейную или разветвленную C1 - C4-алкильную группу;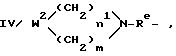 где Re - группа, как она была определена выше; W2 - O, S, NH, NR14 или CR15R16, где R14 - линейная или разветвленная C1 - C4-алкильная группа; R15 и R16 независимо представляют собой водород, линейную или разветвленную C1 - C4-алкильную группу; n1 и m - число, независимо равное 1, 2 или 3;
где Re - группа, как она была определена выше; W2 - O, S, NH, NR14 или CR15R16, где R14 - линейная или разветвленная C1 - C4-алкильная группа; R15 и R16 независимо представляют собой водород, линейную или разветвленную C1 - C4-алкильную группу; n1 и m - число, независимо равное 1, 2 или 3;
V/ R17O2C-Re, где Re - группа, как она была определена выше; R17 - линейная или разветвленная C1 - C6-алкильная группа, C2 - C6-алкенильная группа, C2 - C6-алкинильная группа или C3 - C7-циклоалкильная группа, C3 - C7-циклоалкил(C1 - C6)алкильная группа, C3 - C7-циклоалкенильная группа, незамещенная или замещенная C1 - C6-алкильной группой;
VI/ U-Re-, где Re - группа, как она была определена выше; U - гидроксильная группа, ацилоксигруппа, ароилоксигруппа, арилсульфонилоксигруппа, NO2, CN или Si(CH3)3;
VII/ 1-адамантильное, 2-адамантильное или боронильное образования;
VIII/ Ar1-Re-, где Re - группа, как она была определена выше; Ar1 - фенильная группа или фенильная группа, независимо замещенная одним-тремя атомами галогена, моно-, ди- или тригалогенметильной группой, нитрогруппой, C1 - C4-алкильной группой, С2 - С4-алкенильной группой, C1 - C4-алкоксигруппой, C2 - C4-алкенилоксигруппой или C2 - C4-алкинилоксигруппой.
К предпочтительным соединениям из соединений, пригодных для обработки согласно этому изобретению, относятся соединения с формулой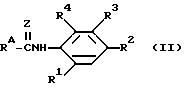 ,
,
в которой
Z - кислород или сера;
RA -
а) полностью ненасыщенная, частично или полностью восстановленная или замещенная оксатиинильная, фуранильная, дитиинильная, диоксинильная, тиенильная, тиазолильная, оксазолильная, изоксазолильная, тиадиазолильная, пиразолильная, пирролильная, пиранильная, оксатиазинильная или оксадиазолильная группа;
б/ линейная или разветвленная C1 - C8-алкильная группа, C2 - C8-алкенильная группа, C2 - C8-алкинильная группа, C1 - C8-алкоксигруппа, C2 - C8-алкенилоксигруппа, C2 - C8-алкинилоксигруппа, C3 - C8-циклоалкилоксигруппа, C3 - C8-циклоалкилалкоксигруппа, C1 - C8-алкиламиногруппа, C3 - C6-циклоалкильная группа, C3 - C6-циклоалкенильная группа, C7 - C8-фенилалкильная группа, C7-C8-феноксиалкильная группа или феноксигруппа;
в) фенильная группа или фенильная группа, замещенная одним или несколькими атомами галогена, C1 - C8-алкильной группой, C1 - C8-алкоксигруппой, карбоксильной группой, C1 - C8-галогеналкильной группой, C1 - C8-алкилтиогруппой, фенильной группой, аминогруппой, ацетамидогруппой, гидроксильной группой, ацетильной группой, ацетоксигруппой, феноксигруппой, C1 - C8-алкоксикарбонильной группой или C1 - С8-алкилкарбонильной группой;
R1, R2, R3 и R4 - группы, как они были определены в формуле I.
К более предпочтительным соединениям из соединений, пригодных для обработки согласно этому изобретению, относятся соединения формулы II, в которой
Z - кислород или сера;
RA -
а) дигидро-3-оксатиинильная группа, фуранильная группа, дигидрофуранильная группа, тиенильная группа, дигидро-2-диитинильная группа или дигидро-2-диоксинильная группа, которая может быть замещенной одной-тремя алкильными или алкоксиалкильными группами, в которых алкильная группа содержит от одного до четырех атомов углерода;
б) фенильная группа или фенильная группа, замещенная группой, выбранной из группы, в которую входят C1 - C8-алкильная группа, галоген, C1 - C8-галогеналкильная группа, C1 - C8-алкилтиогруппа, карбоксильная группа, аминогруппа, ацетамидогруппа, C1 - C8-алкоксигруппа, C1 - C8-алкоксикарбонильная группа, гидроксильная группа, C1 - C8-алкилкарбонильная группа, фенильная группа или феноксигруппа;
в) линейная или разветвленная C1 - C8-алкильная группа, C2 - C8-алкенильная группа, C2 - C8-алкинильная группа, C1 - C8-алкоксигруппа, C2 - C8-алкенилоксигруппа, C2 - C8-алкинилоксигруппа, C3 - C8-циклоалкилоксигруппа, C3 - C8-циклоалкилалкоксигруппа, C1 - C8-алкиламиногруппа, C3 - C7-циклоалкильная группа, C3 - C7-циклоалкил(C1 - C6)алкильная группа, C3 - C7-циклоалкенильная группа, незамещенная или замещенная C1 - C6-алкильная группа или феноксигруппа и в которой R1, R2, R3 и R4 имеют те же значения, что и в приведенной формуле (I).
В частности, к предпочтительной группе оксатииновых производных относятся соединения формулы (III)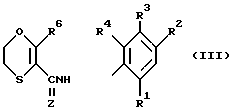
в которой
Z - кислород или сера;
R6 - алкильная или алкоксиалкильная группа, в которых алкильные группы независимо представляют собой C1 - C4-алкильные группы;
R1, R2, R3 и R4 имеют тот же смысл, что и в приведенной формуле (I)
Особенно предпочтительная группа соединений имеет формулу (IV)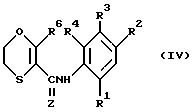 ,
,
в которой
Z - кислород или сера;
R1 - водород, фторсодержащая группа или метильная группа;
R2 - водород, хлорсодержащая, фторсодержащая или метильная группа;
R3 - COOR5, где R5 - алкильная группа с числом атомов углерода от одного до шести;
R4 - водород;
R6 - метильная, этильная или пропильная группа.
Фурановые производные, найденные пригодными для использования по способу, отвечающему настоящему изобретению, включают в себя соединения с формулой (Va) и (Vb)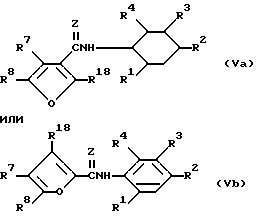 ,
,
в которой
Z - кислород или сера;
R7 и R8 независимо представляют собой водород или метильную группу;
R18 - водород, метильная или этильная группа;
R1, R2, R3 и R4 имеют те же значения что и в приведенной формуле (I).
К предпочтительным соединениям этой группы относятся соединения с приведенными выше формулами (Va) и (Vb), в которых R1 и R4 - водород, R2 - галоген и R3 - COOR5, где R5 - алкильная группа с числом атомов углерода от одного до шести.
Еще одна группа эффективных соединений имеет формулу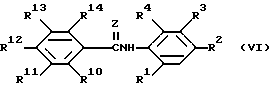
в которой Z, R1, R2, R3 и R4 имеют тот же смысл, что и в приведенной формуле (I);
R10, R11, R12 и R13 независимо представляют собой водород или галоген;
R14 - водород, галоген, C1 - C4-алкильная группа, C1 - C4-алкоксигруппа, C1 - C4-галогеналкильная группа, C1 - C4-алкилтиогруппа, аминогруппа, C1 - C8-алкилкарбониламиногруппа, гидроксильная группа, ацетильная группа, ацетилоксигруппа или ацетиламиногруппа.
Более предпочтительными соединениями с формулой (VI) являются соединения, у которых R1 - водород или фторсодержащая группа; R10, R11, R12 и R13 - водород; R14 - водород, метильная группа, этильная группа, хлорсодержащая группа, йодсодержащая группа, аминогруппа, бромсодержащая группа, фторсодержащая группа, метилтиогруппа, метоксигруппа или гидроксильная группа.
Диоксиновые производные, которые могут быть использованы в способе ингибирования роста или репликации вирусов человеческого иммунодефицита, включают в себя соединения с формулой (VII)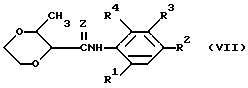
в которой
Z, R1, R2, R3 и R4 имеют те же значения, что и в приведенной формуле (I).
К более предпочтительным диоксиновым соединениям относятся те соединения, у которых R1 и R4 - водород и R3 - COOR5 - группа, у которой R5 имеет тот же смысл, что и в приведенной формуле (I).
К предпочтительным производным ациклических карбоксамидов или карбаматов, пригодных для использования в настоящем способе, относятся соединения формулы (VIII)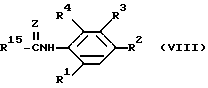 ,
,
в которой
R15 - линейная или разветвленная С3 - С6-алкильная группа, C2 -C6-алкенильная или алкинильная группа, C7 - C8-аралкильная или арилоксиалкильная группа, C1 - C8-алкоксигруппа, C2 - C8-алкенилокси- или алкинилоксигруппа, C1 - C8-арилоксигруппа, C3 - C7-циклоалкильная группа, C3 - C7-циклоалкил(C1 - C6)алкильная группа, C3 - C7-циклоалкенильная группа, незамещенная или замещенная C1 - C6-алкилом, C3 - C8-циклоалкилоксигруппа, циклоалкилалкилоксигруппа, циклоалкиларилоксигруппа или алкиламиногруппа;
Z, R1, R2, R3 и R4 имеют те же значения, что и в приведенной формуле (I).
Более предпочтительными соединениями являются такие соединения, у которых R1 - водород или фторсодержащая группа, R2 имеет тот же смысл, что и в приведенной формуле (I), R3 -COCR5, где R5 имеет тот же смысл, что и в приведенной формуле (I), R4 - водород и R15 может представлять собой C3 - C6-алкильную группу, C2 -C6- алкенильную группу или алкинильную группу, C7 - C8- фенилалкильную или феноксиалкильную группу, C1 - C8-алкоксигруппу, C2 - C8-алкенилокси- или алкинилоксигруппу, феноксигруппу, C3 - C7-циклоалкильную группу, C3 - C7-циклоалкил(C1 - C6)алкильную группу, C3 - C7-циклоалкенильную группу, незамещенную или замещенную C1 - C6-алкилом, C3 - C8-циклоалкокси- или циклоалкилалкилоксигруппу, циклоалкил- феноксигруппу или алкиламиногруппу.
Эффективными соединениями являются соединения формулы (VIII), в которой R15 - C3 - C6-циклоалкильная или циклоалкенильная группа и R1-R4 имеют те же значения, что и в приведенной формуле (I).
К подгруппе соединений с формулой (VIII) относятся соединения, у которых R1 и R4 - водород и R3 - COOR5 - группа, где R5 имеет те же значения, что и указанные выше.
Дитииновые производные, найденные наиболее пригодными для использования в описываемом способе, включают в себя соединения с формулой (IX).
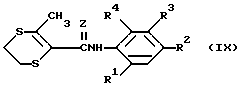 ,
,
в которой
Z и R1-R4 имеют тот же смысл, что и в приведенной формуле (I).
Предпочтительными соединениями с формулой (IX) являются соединения, у которых R1 и R4 - водород; R2 - водород или хлорсодержащая группа и R3 - алкоксикарбонильная группа.
Известны различные карбониламинопроизводные оксатиинов. Так, в патентах США N 3249499, 3402241, 3454391, 3657449, 3806332, 4182716, 4247707 и 4359579 раскрыты получение и применение различных 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоксамидов (которые могут быть также названы 23-дигидро-5-карбоксамидо-6-метил-1,4-оксатиинами) в качестве бактерицидов, фунгицидов и растительных вирицидов особенно применительно к сельскохозяйственным задачам.
Одно такое соединение - карбоксин, а именно 5,6-дигидро-2-метил-N-фенил-1,4-оксатиин-3-карбоксамид (ранее называвшееся 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоксанилидом), производится промышленностью и используется в качестве систематически применяемого растительного фунгидица, обеспечивающего возможность борьбы с различными грибками путем обработки семян, чем предотвращаются заболевания семян и проростков у разных культур.
Некоторые отдельные оксатииновые производные, пригодные для использования в настоящем способе, раскрыты у Уайта и др. (White et al., Pesticide Biochemistry and Physiology, 9, 165 (1978)). В частности, Уайт и др. раскрывают, что метил-3-[[(5,6-дигидро-2-метил-1,4-оксатиин-3-ил)карбонил]амино] бензоат и этил-3-[[(5,6-дигидро-2-метил-1,4-оксатиин-3-ил)карбонил] амино] бензоат (пример 8, приведенный ниже) являются ингибиторами сукцинат-дегидрогеназного комплекса в митохондриях в отношении Ustilagomaydis - грибка злаковых, вызывающих головню.
В этой публикации ничего не раскрывается и ничего не предлагается в отношении любого из указанных соединений в том плане, что они являются полезными в смысле ингибирования роста и репликации вирусов, относящихся к классу вирусов человеческого иммунодефицита.
В соответствии с другим аспектом настоящего изобретения предлагается класс ранее неизвестных соединений, пригодных для ингибирования роста или репликации вирусов человеческого иммунодефицита, который ранее не был описан в литературе.
Поднабор ранее неизвестных соединений, которые могут быть использованы в рассматриваемом способе, включает в себя фуранил-, фенил-, дитиинил-, диоксинил-, алкокси- и алкил-карбониланопроизводные с формулой (I), приведенной выше, и оксатиинилпроизводное с формулой (II), отличные от производных, у которых карбалкоксисоставляющая часть арильного ядра представляет собой карбометоксигруппу или карбэтоксигруппу и все радикалы R1, R2 и R4 представляют собой водород.
Соединения, пригодные для использования в соответствии с настоящим изобретением, могут быть получены способами, описанными у фон Шмелинга (Von Schmeling) и др. (патент США N 3249499, от колонки 2, строка 34, до колонки 3, строка 73) или у Знотинза (Znotins) и др. (патент США N 4182716, колонка 2, строка 3, и до колонки 2, строка 68).
Если RA представляет собой производное сахара с числом атомов углерода от трех до шести, то тогда оно будет представлять собой одно из следующих производных.
A. Сахаропроизводное с тремя атомами углерода, имеющее общую структурную формулу вида CH2OPICHOPII-CH2-, где PI и PII представляют собой водород или комбинацию из атома водорода и подходящей защитной группы (т.е. монозащищенный сахар) или комбинацию из двух таких защитных групп. Подходящими защитными группами являются простой алкильный или арильный эфир, сложный алкильный или арильный эфир, простой алкильный или арилсилильный эфир или циклическая защитная группа (т.е. группы PI и PII являются соединенными друг с другом), такая как сложный ацетальный, кетальный эфир, сложный ортоэфир или сложный циклический эфир. Сахар может находиться либо в D-конфигурации, либо в L-конфигурации, либо представлять собой рацемическую смесь обеих конфигураций.
Б. Сахаропроизводное с четырьмя атомами углерода, имеющее общую структурную формулу вида CH2OPI-CHOPII-CHOPIII-CH2, где группы PI, PII и PIII являются такими, какими они были определены выше. В круг рассматриваемых соединений входят также пятичленные (фураноза) циклические формы исходных альдоз, как это показано на рисунке, приведенном ниже. Эти сахара находятся в стереохимических конфигурациях, отвечающих структурам с названиями эритрит (эритроза) или треит (треоза), пребывая либо в D-, либо в L-, либо в рацемической формах. В случае циклических форм рассмотрению подвергаются как α -, так и β-аномеры.
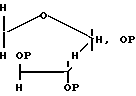 .
.
В. Альдозное или кетозное производное сахара с пятью атомами углерода, находящееся в одной из следующих форм:
I) надлежащим образом защищенная линейная форма соответствующих сахарных спиртов, аналогичная описанной в пункте Б;
II) их пятичленные (фураноза) или шестичленные (пираноза; см. приведенный ниже пример) циклические формы, которые присоединяются к группе V либо через первичный, либо через вторичный атом углерода, и где защитными группами являются группы, описанные выше. Эти сахара находятся в D-, L- или рацемической формах (включая α - и β-аномеры, если они возможны) структур, отвечающих конфигурациям, описываемым под общими названиями рибоза, арабиноза, ксилоза и ликсоза (альдозы) или ксилулоза и рибулоза (кетозы). Кроме того, в круг рассматриваемых соединений входят отдельные дезоксиформы этих сахаров, у которых отсутствует одна из O-защитных групп и она заменена на водород или CH3-группу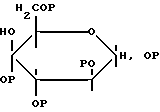
Г. Альдоза или кетозное производное сахара с шестью атомами углерода, находящееся в любой из следующих форм:
I) надлежащим образом защищенная линейная форма соответствующих сахарных спиртов, аналогичная описанной в пункте В;
II) пятичленная (фураноза) или шестичленная (пираноза) циклические формы. Сахарная группа присоединяется к Y либо через первичный, либо через вторичный углерод, и защитными группами являются группы, описанные выше. Сахара находятся в D-, L- или рацемической формах (включая α- и β-аномеры, если они возможны) структур, отвечающих стереохимическим конфигурациям, описываемым под общими названиями аллоза, альтроза, глюкоза, гулоза, манноза, идоза, галактоза, талоза (альдогексозы) и фруктоза, сорбоза, псикоза и тагатоза (2-кетогексозы). Кроме того, рассмотрению подвергаются известные дезоксиформы упомянутых выше сахаров, как они были описаны в пункте В, которые отличаются от ранее упомянутых соединений.
Соединения с формулой (II), в которой Z - кислород и RA - оксатиинильная, фуранильная, дитиинильная, диоксинильная, другая гетероциклическая группа, замещенная фенильной или алкильной группой, могут быть получены из надлежащих карбоновых кислот вида RACOOH и анилинового производного, т.е. из соединения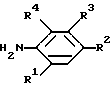
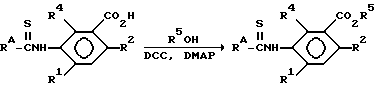
посредством использования одного из обычных способов образования амидной связи. Например, карбоновая кислота может быть превращена в галогенангидрид кислоты, такой как хлорид кислоты RACOCl, который может быть затем приведен во взаимодействие с аналиновым производным, чтобы образовался амид (I). Реакцию образования амида проводят в надлежащем растворителе, таком как хлористый метилен, толуол, метилэтилкетон, тетрагидрофуран, диметилформамид или ацетонитрил, при температуре примерно от 0 до 100oC. Обычно реакцию предпочитают вести в присутствии основания, такого как триэтиламин или пиридин. Могут быть использованы и другие реакционноспособные производные карбоновой кислоты, например ангидрид карбоновой кислоты или смешанный ангидрид, такой как алкоксикарбонилоксипроизводное, может быть приведен во взаимодействие с аналиновым производным. Или же карбоновая кислота и аналиновое производное могут быть приведены во взаимодействие в присутствии конденсирующего вещества, такого как дициклогексилкарбодиимид, чтобы образовался амид.
Производные анилина могут быть получены восстановлением соответствующих нитросоединений при использовании хорошо известных способов, например воздействием водорода в присутствии катализатора, такого как никель Ренея или платина, или металлокислотным воздействием, таким как воздействие при использовании железа или олова и хлористоводородной или уксусной кислоты. В том случае, когда группа R3 представляет собой COOR5-группу, группа R5 может быть введена этерификацией надлежащей аминобензойной кислоты или нитробензойной кислоты, проводимой обычными способами.
Другие соединения с формулой (II), в которой RA представляет собой алкоксигруппу, могут быть получены взаимодействием подходящего анилинового производного с хлористым алкоксикарбонилом в условиях, в основном схожих с условиями, используемыми при проведении взаимодействия хлорангидрида кислоты с анилиновым производным. Они могут быть также получены взаимодействием подходящего изоцианатного производного со спиртом. Изоцианат может быть получен взаимодействием анилинового производного или надлежащей соли, такой как хлористоводородная соль, с фосгеном или фосгензамещенным соединением, таким как трихлорметилхлорформиат.
Соединения с формулой (II), в которой R3 - COOR5 или COSR5, могут быть также получены из подходящей карбониламинобензойной кислоты, т.е. из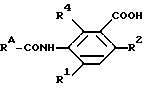
или из соответствующего производного таковой, такого как хлорангидрид кислоты, что достигается использованием обычного способа проведения этерификации. Например, кислота может взаимодействовать со спиртом R5OH или тиолом R5SH в присутствии одного из обычных катализаторов этерификации, такого как хлористый водород, серная кислота, метансульфоновая кислота, n-толуолсульфоновая кислота, хлористый тионил или пентахлорид фосфора. Спирт может сам по себе выступать в роли растворителя, или этерификация может проводиться в совместимом растворителе, таком как толуол, хлористый метилен или тетрагидрофуран. Этерификация может также сопровождаться взаимодействием хлорангидрида кислоты с указанным выше спиртом или тиолом, чему может способствовать присутствие основания, такого как триэтиламин или пиридин. Сложные эфиры могут быть также получены взаимодействием соли щелочного металла и кислоты с галогенидом вида R5Hal.
Производные карбониламинобензойной кислоты могут быть получены взаимодействием соответствующей аминобензойной кислоты с хлорангидридом кислоты RACOCl или проведением гидролиза соединения с формулой (II), в которой R3 - COOR5и R5 - желательно низшая алкильная группа (метильная или этильная), например, взаимодействием гидроксида натрия или калия с последующим подкислением.
Оксатииновые производные с формулой (II) могут быть получены взаимодействием 5,6-дигидро-1,4-оксатиин-3-карбонилхлористого производного с анилиновым соединением в подходящем растворителе, таком как хлористый метилен или толуол в присутствии основания, такого как триэтиламин или пиридин:
Хлорангидрид кислоты может быть получен обычными способами из 5,6-дигидро-1,4-оксатиин-3-карбоновой кислоты, которая, в свою очередь, может быть получена из надлежащего меркаптоэтанольного производного и метильного или этильного 2-хлор-3-оксоалканоата по способу, описанному в патенте США N 3249499 (колонка 3, строки 46-66) при получении 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (названной в ссылке 2,3-дигидро-6-метил-1,4-оксатиин-5-карбоновой кислотой или 2,3-дигидро-5-карбокси-6-метил-1,4-оксатиином), как это проиллюстрировано ниже:
Некоторые соединения с формулой (II) могут быть также получены взаимодействием анилинового производного и дикетеном, ведущим к образованию 1,3-диоксобутиламинопроизводного. Это соединение может быть превращено в оксатиин хлорированием и взаимодействием по способу, описанному в патенте США N 3249499 (колонка 1, строка 54 и до колонки 2, строка 67), как это проиллюстрировано ниже: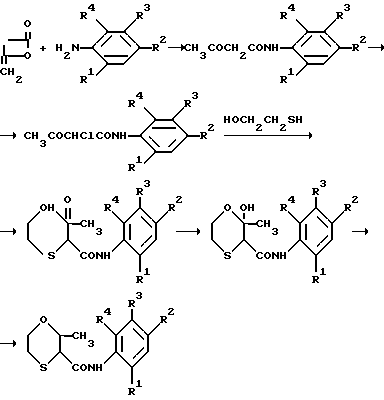
Или же 1,3-диоксобутиламинопроизводное может быть превращено в оксатиин по способу, описанному в патенте США N 4182716 (от колонки 2, строка 3, до колонки 2, строка 68), как это проиллюстрировано ниже: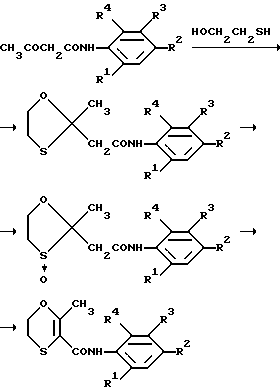
Оксатиины с формулой II, где R3 - COOR5 или COSR5, могут быть также получены из надлежащего соединения оксатиинкарбониламинобензойной кислоты, т.е. из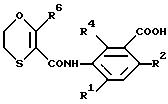
или из реакционноспособного производного таковой, такого как хлорангидрид кислоты, при использовании обычного способа проведения этерификации. Например, кислота может быть приведена во взаимодействие со спиртом R5OH или тиолом R5SH в присутствии одного из обычных катализаторов этерификации или взаимодействием хлорангидрида кислоты со спиртом или тиолом в присутствии, если необходимо, основания, такого как триэтиламин или пиридин. Этерификация может также сопровождаться взаимодействиями соли щелочного металла и кислоты с галогенидом вида R5Hal.
Производные оксатиинкарбониламинобензойной кислоты могут быть получены взаимодействием надлежащего хлористого 5,6-дигидро-1,4-оксатиин-3-карбонила c производными аминобензойной кислоты или гидролизом оксатиина с формулой (II), в которой группы R3 представляет собой OR5 - группу, где желательно, чтобы группа R5 представляла собой низшую алкильную группу (такую как метильная или этильная группа), происходящим, например, при взаимодействии с гидроксидом натрия или калия с последующим подкислением.
Тиокарбаматы, тиомочевины и тиокарбоксанилиды являются важными и активными соединениями, отвечающими настоящему изобретению. Тиокарбаматы и тиомочевины получают, беря спирты и амины и приводя их во взаимодействие с надлежащим изотиоцианатом. Так, при приготовлении соединений с формулой (II) поступают следующим образом: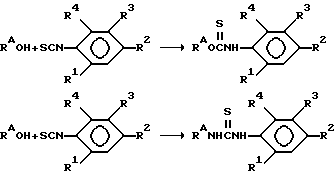
Изотиацианат готовят, используя надлежащее производное анилина или подходящую соль такового, такую как хлорангидрид, и приводя во взаимодействие с тиофосгеном.
Или же сложные эфиры этих тиокарбаматов могут быть получены использованием карбоновой кислоты и надлежащего спирта в присутствии дициклогексилкарбодиимида и основного катализатора, такого как 4-диметиламинопиридин. Предпочтительной карбоновой кислотой является 2-хлор-5-[(1-метилэтокси)тиоксометил]амино]бензойная кислота.
Тиокарбоксанилиды могут быть получены взаимодействием соответствующего амида с сульфурирующим веществом, таким как реактив Лоэссона (Lawesson) или пентасульфид фосфора.
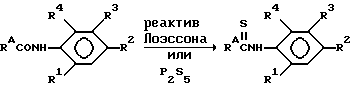
Соединения, отвечающие настоящему изобретению, является, как отмечали выше, пригодными для ингибирования роста или репликации вирусов группы вирусов человеческого иммунодефицита, к которой, как сейчас считают, относятся разновидности HIV-I и HIV-II. Настоящие соединения могут также оказаться полезными для тех, кто оказался подвергнутым воздействию вирусов человеческого иммунодефицита, но не заразился при этом; в этом случае они играют роль профилактической меры, направленной против заражения вирусами человеческого иммунодефицита. Они могут использоваться сами по себе или в сочетании с другими химиотерапевтическими веществами либо с профилактической целью, либо для борьбы с активной инфекцией.
Дозировки, при которых соединения, отвечающие настоящему изобретению, применяются в людской терапии, могут, разумеется, регулироваться в расчете на получение оптимального терапевтического эффекта. Например, несколько раздельных доз может вводиться ежедневно или же доза может быть пропорционально пониженной, что диктуется характером терапевтической ситуации.
Для простоты введения и однородности дозировки может оказаться предпочтительным образовывать составы в формах единичной дозировки. "Форма единичной дозировки", как этот термин используется в настоящем описании, относится к физической дискретной фасовке, пригодной для использования в качестве однократной дозы при лечении млекопитающих. Каждая фасовка содержит предварительно установленное количество активного вещества, рассчитанное из соображения получения желательного терапевтического эффекта, в сочетании с требуемым фармацевтически приемлемым количеством носителя. Специфические характеристики форм единичной дозировки диктуются и непосредственно зависят от а) собственных характеристик активного вещества и некоторого определенного терапевтического эффекта, который должен быть достигнут, и б) ограничений, свойственных этой области медицины при компоновке такого активного вещества, предназначенного для обработки вирусных инфекций человеческого иммунодефицита у живых организмов без проявления чрезмерных цитотоксических побочных эффектов.
Активные соединения могут быть надлежащим образом введены парентерально, интераперитонеально, внутриоболочечно, внутривенно, орально или в виде аэрозоля. Растворы или дисперсии активных соединений могут быть приготовлены, например, в глицерине, жидких полиэтиленгликолях и смесях таковых или в маслах. В случае хранения и использования при обычных условиях эти препараты обычно содержат консервант, препятствующий росту микроорганизмов.
К фармацевтическим формам, пригодным для использования в инъекциях, относятся стерильные водные растворы или дисперсии и стерильные порошки, пригодные для непосредственного приготовления стерильных инъецируемых растворов или дисперсий. При таких применениях лекарственная форма должна быть стерильной и должна содержать такое количество жидкости, которое является достаточным для обеспечения легкого введения посредством шприца. Лекарственная форма должна сохранять стабильность в условиях производства и хранения и должна быть защищена в отношении загрязняющего действия микроорганизмов, таких как бактерии и грибки.
Носителем может быть растворитель или диспергирующая среда, содержащая, например, воду, этанол, полиол (глицерин, пропиленгликоль, жидкий полиэтиленгликоль и им подобные вещества) или подходящие смеси таковых, и растительные масла. Надлежащая текучесть среды может обеспечиваться, например, использованием покрытия из материала, такого как лецитин, поддерживанием требуемого размера частиц в случае дисперсии и использованием поверхностно-активных веществ. Противодействие микроорганизмам может быть обеспечено использованием различных антибактериальных и противогрибковых веществ, например парабена, хлорбутанола, фенола, сорбиновой кислоты и тимеросала.
Могут использоваться и другие вещества. Во многих случаях желательно включить изотонические вещества, например сахара или хлорид натрия, вводя их в дозированном количестве. Затянутая абсорбция у инъектируемых рецептур может быть достигнута введением в них веществ, задерживающих абсорбцию, например моностеарата алюминия или желатина.
Стерильные инъецируемые растворы готовят введением активных соединений в надлежащий растворитель в смеси с различными другими ингредиентами, перечисленными выше, когда это необходимо, с последующей стерилизацией с фильтрованием. Обычно дисперсии готовят введением стерилизованного активного ингредиента в стерильный носитель, который содержит диспергирующую среду и другие необходимые ингредиенты.
С другой стороны, при использовании стерильных порошков для приготовления стерильных инъецируемых растворов стерильный отфильтрованный раствор из требуемых ингредиентов желательно подвергать вакуумной сушке или сушке вымораживанием, получая при этом порошок активного ингредиента в сочетании с дополнительными необходимыми ингредиентами.
Применительно к использованию в настоящем описании под понятием "фармацевтически приемлемый" носитель или разбавитель подпадают разбавители, диспергирующие среды, антибактериальные и противогрибковые вещества, изотонические и задерживающие абсорбцию вещества и им подобные. Использование таких сред и веществ в качестве носителей или разбавителей фармацевтически активных веществ хорошо известно в этой области техники. Исключая всякую обычную среду или вещество, несовместимое с активными ингредиентами, отвечающими настоящему изобретению, или являющееся токсичным, в терапевтических рецептурах, отвечающих настоящему изобретению, допускается использование любых веществ. В настоящую рецептуру могут быть также введены дополнительные активные ингредиенты.
Далее изобретение будет описываться со ссылкой на последующие примеры, что, однако, не означает, что изобретение ограничивается спецификой этих примеров.
В примерах процентное содержание (%) указывается по массе. Данные ядерного магнитного резонанса указываются под сокращением ЯМР.
В табл. 1 и в табл. 1A - 1E суммированы структуры соединений из примеров со ссылкой на предшествующие общие формулы.
В табл. 1A-1E проводится перечень других соединений, которые были приготовлены и которые подпадают под настоящее изобретение. В специфических примерах, следующих за таблицами, подробно приводятся точные методики приготовления некоторых соединений, указанных в таблицах; остальные соединения готовили аналогичными способами.
Пример 1
А. Получение 1-метилэтил-5-амино-2-хлорбензоата
Метансульфоновую кислоту (99%, 318 г, 3,3 моль) медленно добавляли к перемешиваемой смеси 5-амино-2-бензойной кислоты (85%, 215 г, 1,1 моль) в 2-пропаноле (примерно 1100 мл). Смесь грели в сосуде с обратным холодильником при перемешивании в течение 6 ч, затем избыточный 2-пропанол выпаривали при пониженном давлении. К остатку добавляли воду (примерно 1000 мл), и смесь нейтрализовали бикарбонатом натрия в виде твердого вещества и экстрагировали хлористым метиленом (примерно 1200 мл). Экстракт дважды промывали водой, сушили над сульфатом магния и упаривали до получения пурпурной маслянистой жидкости, которую кристаллизовали введением затравки. Продукт вторично осаждали из разбавленного раствора хлористоводородной кислоты, медленно добавляя концентрированный раствор гидроксида аммония и затравку. Образовавшиеся кристаллы после сушки плавились при 50,5-52oC (170 г, выход 75%).
B. Получение 1-метилэтил-2-хлор-5-[[(5,6-дигидро-2-метил-1,4-оксатиин-3-ил)карбонил] амино]бензоата (соединение 1)
Этил 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоксилат готовили по способу, описанному в патенте США N 3249499 (колонка 5, строки 36-55) со следующими изменениями: в качестве растворителя вместо бензола использовали толуол; в качестве основания вместо гидроксида калия использовали бикарбонат натрия; и азеотропное удаление воды проводили при пониженном давлении примерно при 65oC. 5,6-Дигидро-2-метил-1,4-оксатиин-3-карбоновую кислоту получали гидролизом сложного эфира, как это описано в том же патенте (колонка 5, строки 56-68, где эта кислота фигурирует под названием 2,3-дигидро-5-карбокси-6-метил -1,4-оксатиин).
Хлористый тионил (6,5 г, 0,055 моль) добавляли к перемешиваемому шламу, образованному из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (8,0 г, 0,050 моль) в хлористом метилене (50 мл). Смесь перемешивали при 35-40oC в течение 4 ч, причем за это время твердое вещество полностью переходило в раствор. Раствор затем упаривали при пониженном давлении примерно при 35oC, в результате чего удаляли хлористый водород, диоксид серы и непрореагировавший хлористый тионил.
Остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, который отверждался, растворяли в хлористом метилене (50 мл). Раствор охлаждали на льду, и его по каплям обрабатывали раствором 1-метилэтил-5-амино-2-хлорбензоата (10,7 г, 0,050 моль) и триэтиламина (5,5 г, 0,055 моль) в хлористом метилене (50 мл). Добавление производили на протяжении примерно 2 ч, после чего реакционную смесь при перемешивании оставляли на ночь при комнатной температуре.
Реакционную смесь промывали раствором хлористого метилена с водой (50 мл), разбавленной хлористоводородной кислотой (3,5%, 50 мл), водой (50 мл), разбавленным гидроксидом натрия (2%, 25 мл) и водой (50 мл). Раствор хлористого метилена затем фильтровали через безводный сульфат натрия (примерно 5 г) и упаривали. Остаток отверждали. Сырой продукт (17,0 г, температура плавления 123-128oC) перекристаллизовывали из 95%-ного этанола (175 мл), получая светлые рыжевато-коричневые кристаллы с температурой плавления 130-132oC (12,9 г, выход 72,5%).
Найдено, %: C 54,01; H 5,10; N 3,94.
Вычислено, %: C 53,96; H 4,98; N 3,94%.
ЯМР (CDCl3: 1,4 (6H, дублет), 2,3 (3H, синглет), 2,95 (2H, мультиплет), 4,35 (2H, мультиплет), 5,2 (1H, мультиплет), 7,2-8,0 (3H, мультиплет), 8,2 (1H, граничный синглет).
C. Альтернативный способ получения
Раствор дикетена (4,0 г, 0,048 моль) в толуоле (20 мл) по каплям добавляли на протяжении 1,5 ч к охлажденному (8-12oC) раствору 1-метилэтил-5-амино-2-хлорбензоата (9,9 г, 0,046 моль) в толуоле (20 мл). Реакционную смесь медленно нагревали до 40oC, затем нагревали до 60-65oC на протяжении 4 ч. Реакционную смесь затем промывали разбавленной хлористоводородной кислотой и дважды водой, фильтровали и упаривали. Остаток, представляющий собой пурпурную маслянистую жидкость, медленно переходил в твердое состояние. Продукт, представляющий собой сырой 1-метилэтил-2-хлор-5-[(1,3-диоксобутил)амино]бензоат (11,7), плавился при 72-75oC. Перекристаллизацией образца (1,0 г) из толуола (5 мл) получали небелое твердое вещество (0,5 г) с температурой плавления 89-91oC.
Сырой 1-метилэтил-2-хлор-5-[(1,3- диоксобутил)амино] бензоат (10,0 г, 0,034 моль) перемешивали в толуоле (50 мл) и по каплям обрабатывали при комнатной температуре раствором хлористого сульфурила (4,6 г, 0,034 моль) в толуоле (20 мл). Перемешивание вели на протяжении ночи; затем смесь упаривали при пониженном давлении. Остаток не удалось подвергнуть кристаллизации, но спектр ЯМР этого вещества находился в согласии со спектром 1-метилэтил-2-хлор-5-[(2-хлор-1,3-диоксобутил)амино] бензоата, примерно наполовину находящегося в енольной форме.
К раствору сырого 1-метилэтил-2-хлор-5-[(2-хлор-1,3-диоксобутил)амино] бензоата (11 г) в толуоле (75 мл) добавляли 2-меркаптоэтанол (2,6 г, 0,033 моль). На протяжении 30 мин при интенсивном перемешивании добавляли бикарбонат натрия (5,0 г, 0,06 моль), неполностью растворенный в воде. Перемешивание продолжали вести в течение еще 1 ч, затем толуольный слой отделяли, промывали водой и фильтровали. К толуольному раствору добавляли n-толуолсульфоновую кислоту и грели в сосуде с обратным холодильником при 60-70oC в условиях пониженного давления, используя ловушку Дина-Старка (Dean-Stark) для удаления воды. После прекращения образования воды толуольный раствор охлаждали и промывали сначала водой, а затем 2%-ным водным раствором бикарбоната натрия и снова водой. После испарения толуола получали вязкую маслянистую жидкость. Криссталлизацией из 90%-ного этанола (30 мл) получали небелое твердое вещество с температурой плавления 127-130oC (1,2 г, выход 10%), которое идентифицировали (по температуре плавления и по спектрам ЯМР) как 1-метилэтил-2-хлор-5-[[(5,6-дигидро-2-метил-1,4-оксатиин-3-ил)карбонил] амино] бензоат.
Пример 2
1-метилэтил-2-хлор-5-[[(5,6-дигидро-2-метил-1,4-оксатиин- 3-ил)карбонил] амино]-4-фторбензоат (соединение 2)
Хлористый тионил (4,2 г, 0,035 моль) добавляли к перемешиваемому шламу, состоящему из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (4,8 г, 0,030 моль) в хлористом метилене (40 мл). Смесь нагревали до 35oC и грели при этой температуре в течение 3 ч, затем с перемешиванием оставляли при комнатной температуре на ночь. Раствор затем упаривали при пониженном давлении примерно при 35oC. Твердый остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (50 мл), раствор охлаждали на льду и обрабатывали по каплям раствором 1-метилэтил-5-амино-2-хлор-4-фторбензоата (7,0 г, 0,030 моль) и триэтиламина (3,5 г, 0,035 моль) в хлористом метилене (50 мл). Добавление проводили на протяжении 2 ч, после чего реакционную смесь перемешивали при 20-35oC в течение 3 ч.
Реакционную смесь промывали сначала раствором хлористого метилена с водой (50 мл), а затем разбавленной хлористоводородной кислотой (3,5%, 50 мл), снова водой (50 мл), затем разбавленным гидроксидом натрия (2%, 25 мл) и водой (50 мл). Раствор хлористого метилена затем выпаривали, получая маслянистую жидкость, которая отверждалась. Сырой продукт перекристаллизовывали из этанола (100 мл), в результате чего получали кристаллы с температурой плавления 123 - 125oC (8,2 г, выход 37%).
Вычислено, %: C 51,41; H 4,58; N 3,75.
Найдено, %: C 50,91; H 4,45; N 3,43.
ЯМР (CDCl3): 1,35 (6H, дублет), 2,3 (3H, синглет), 3,0 (2H, мультиплет), 4,4 (2H, мультиплет), 5,2 (1H, мультиплет), 7,2 (1H, дублет), 8,2 (1H, граничный синглет), 8,8 (1H, дублет).
Пример 3
Метил-2-хлор-5-[[(5,6-дигидро-2-метил-1,4-оксатиин-3-ил)карбонил] амино] бензоат (соединение 3)
Хлористый тионил (4,1 г, 0,034 моль) добавляли к перемешиваемой смеси, состоящей из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (4,3 г, 0,027 моль) и хлористого метилена (35 мл). Смесь грели в мягких условиях в сосуде с обратным холодильником в течение примерно 3,5 ч, оставляли при перемешивании на ночь при комнатной температуре и затем упаривали при пониженном давлении. Твердый остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (50 мл), и раствор обрабатывали по каплям при 5 - 10oC на протяжении 2 ч раствором метил-5-амино-2-хлорбензоата (5,1 г, 0,027 моль) и триэтиламина (3,1 г, 0,031 моль) в хлористом метилене (35 мл). Реакционную смесь перемешивали при комнатной температуре еще в течение 3 ч и последовательно промывали водой (50 мл), разбавленной хлористоводородной кислотой (3,5 %, 50 мл), водой (50 мл), разбавленным гидроксидом натрия (2%, 25 мл) и водой (50 мл). Хлористый метилен затем выпаривали, получая маслянистую жидкость (8,2 г), которая медленно отверждалась. Перекристаллизацией из метанола (75 мл) получали бежевое твердое вещество с температурой плавления 115 - 117oC (5,5 г, выход 62,5%).
Вычислено, %: C 51,30; H 4,31; N 4,27.
Найдено, %: C 50,96; H 4,25; N 4,23.
ЯМР (CDCl3): 2,3 (3H, синглет), 3,0 (2H, мультиплет), 3,9 (3H, синглет), 4,4 (2H, мультиплет), 7,2 - 8,2 (4H, мультиплет).
Пример 4
Этил-2-хлор-5-[[(5,6-дигидро-2-метил-1,4-оксатиин-3-ил)карбонил] амино] бензоат (соединение 4)
Хлористый тионил (7,3 г, 0,055 моль) добавляли к перемешиваемой смеси, состоящей из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (8,0 г, 0,050 моль) и хлористого метилена (50 мл). Смесь нагревали до 35oC и грели при этой температуре в течение 4,5 ч, затем упаривали при пониженном давлении. Твердый остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (50 мл) и раствор обрабатывали по каплям при 5 - 10oC на протяжении 5 ч раствором этил-5-амино-2-хлорбензоата (10,0 г, 0,050 моль) и триэтиламина (5,5 г, 0,054 моль) в хлористом метилене (50 мл). Реакционную смесь оставляли при перемешивании на ночь при комнатной температуре.
Реакционную смесь подвергали обработке, промывая хлористометиленовый раствор последовательно водой (50 мл), разбавленной хлористоводородной кислотой (3,5%, 50 мл), водой (50 мл), разбавленным раствором гидроксида натрия (2%, 25 мл) и водой (50 мл). Хлористометиленовый раствор фильтровали через безводный сульфат натрия и упаривали. Оставшуюся коричневую маслянистую жидкость, которая медленно кристаллизовалась, перекристаллизовывали из 95%-ного этанола (80 мл), в результате чего получали рыжевато-коричневый продукт с температурой плавления 86 - 88oC (10,6 г, выход 62%).
Вычислено, %: C 52,71; H 4,72; N 4,10.
Найдено, %: C 53,10; H 4,97; N 4,05.
ЯМР (CDCl3): 1,4 (3H, триплет), 2,3 (3H, синглет), 3,0 (2H, мультиплет), 4,2 - 4,6 (4H, мультиплет), 7,2 - 7,95 (3H, мультиплет), 8,05 (1H, граничный синглет).
Пример 5
Пропил-2-хлор-5-[[(5,6-дигидро-2-метил-1,4-оксатиин-3-ил)карбонил]амино] бензоат (соединение 5)
Хлористый тионил (4,4 г, 0,037 моль) добавляли к перемешиваемой смеси, состоящей из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (5,25 г, 0,033 моль) и хлористого метилена (50 мл). Смесь грели в мягких условиях в сосуде с обратным холодильником в течение 3 ч, перемешивали на протяжении ночи при комнатной температуре и упаривали при пониженном давлении. Твердый остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (50 мл), охлаждали и обрабатывали по каплям на протяжении примерно 2 ч раствором пропил-5-амино-2-хлорбензоата (7,0 г, 0,033 моль) и триэтиламина (3,5 г, 0,035 моль) в хлористом метилене (50 мл).
Реакционную смесь перемешивали в течение ночи при комнатной температуре и последовательно промывали водой (50 мл), разбавленной хлористоводородной кислотой (3,5%, 50 мл), водой (50 мл), разбавленным раствором гидроксида натрия (2%, 25 мл) и водой (50 мл). Хлористый метилен затем выпаривали, получая коричневую маслянистую жидкость (8,2 г), которая медленно кристаллизовалась. Перекристаллизацией из 100%-ного этанола (60 мл) получали рыжевато-коричневые кристаллы с температурой плавления 76 - 78oC (6,2 г, выход 53%).
Вычислено, %: C 54,01; H 5,10; N 3,94.
Найдено, %: C 53,99; H 5,06; N 3,59.
ЯМР (CDCl3): 1,0 (3H, триплет), 1,8 (2H, мультиплет), 2,3 (3H, синглет), 3,0 (2H, мультиплет), 4,15 - 4,55 (4H, мультиплет), 7,2 - 8,0 (3H, мультиплет), 8,1 (1H, граничный синглет).
Пример 6
Бутил-2-хлор-5-[[(5,6-дигидро-2-метил-1,4-оксатиин-3-ил)карбонил] амино] бензоат (соединение 6)
Хлористый тионил (4,4 г, 0,037 моль) добавляли к перемешиваемой смеси, состоящей из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (5,0 г, 0,031 моль) и хлористого метилена (50 мл). Смесь нагревали до 35 - 40oC, грели при этой температуре в течение примерно 3 ч, оставляли при перемешивании на ночь в условиях комнатной температуры и упаривали при пониженном давлении. Твердый остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (50 мл), и раствор по каплям обрабатывали при 5 - 10oC на протяжении 2 ч раствором бутил-5-амино-2-хлорбензоата (6,1 г, 0,031 моль) и триэтиламина (3,6 г, 0,036 моль) в хлористом метилене (50 мл). Реакционную смесь перемешивали при комнатной температуре еще в течение 3 ч и затем последовательно промывали водой (50 мл), разбавленной хлористоводородной кислотой (3,5%, 50 мл), водой (50 мл), разбавленным раствором гидроксида натрия (2%, 25 мл) и водой (50 мл). После испарения растворителя получали маслянистую жидкость, которая медленно отверждалась. Перекристаллизацией из метанола (50 мл) получали бежевые кристаллы с температурой плавления 71-73oC (4,7 г, выход 41%).
Вычислено, %: C 55,21; H 5,45; N 3,79.
Найдено, %: C 55,10; H 5,42; N 3,51.
ЯМР (CDCl3): 1,0 (3H, мультиплет), 1,2-2,0 (4H, мультиплет), 3,0 (2H, мультиплет), 4,15-4,55 (4H, мультиплет), 7,2-7,95 (3H, мультиплет), 8,1 (1H, граничный синглет).
Пример 7
1-Метилэтил-2-хлор-5-[[(2-этил-5,6-дигидро-1,4-оксатиин-3-ил)карбонил] амино]бензоат (соединение 7)
Хлористый тионил (3,7 г, 0,031 моль) добавляли к перемешиваемой смеси, состоящей из 2-этил-5,6-дигидро-1,4-оксатиин-3-карбоновой кислоты (5,0 г, 0,029 моль) и хлористого метилена (35 мл). Смесь нагревали примерно до 35oC, грели при этой температуре в течение 4 ч, затем упаривали при пониженном давлении. Темный остаток, представляющий собой сырой хлористый 2-этил-5,6-дигидро-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (50 мл) и по каплям обрабатывали примерно при 10oC на протяжении 2,5 ч раствором 1-метилэтил-5-амино-2-хлорбензоата (6,1 г, 0,029 моль) и триэтиламина (3,3 г, 0,033 моль) в хлористом метилене (50 мл). Реакционную смесь перемешивали на протяжении ночи при комнатной температуре и последовательно промывали водой (50 мл), разбавленной хлористоводородной кислотой (3,5%, 50 мл), водой (50 мл), разбавленным раствором гидроксида натрия (2%, 25 мл) и водой (50 мл). Хлористый метилен затем выпаривали, в результате чего получали твердый остаток (10,5 г). Перекристаллизацией из 100%-ного этанола (40 мл) получали серо-коричневое твердое вещество с температурой плавления 90-92oC (5,0 г, выход 47%).
ЯМР (CDCl3): 1,15 (3H, триплет), 1,37 (6H, дублет), 2,6 (2H, квартет), 3,0 (2H, мультиплет), 4,4 (2H, мультиплет), 5,25 (1H, мультиплет), 7,25-7,95 (3H, мультиплет), 8,1 (IH, граничный синглет).
Пример 8
Этил-3-[[(5,6-дигидро-2-метил-1,4-оксатиин-3- ил)карбонил]амино]бензоат (соединение 8)
Хлористый тионил (6,5 г, 0,055 моль) добавляли к перемешиваемой смеси, состоящей из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (8,0 г, 0,050 моль) и хлористого метилена (50 мл). Смесь нагревали до 35-40oC, грели при этой температуре в течение 4 ч, и результирующий темный раствор упаривали при пониженном давлении. Твердый остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (50 мл). На следующий день раствор по каплям обрабатывали при 15-20oC на протяжении 2 ч раствором, состоящим из этил-3-амино-бензоата (8,2 г, 0,050 моль) и триэтиламина (5,5 г, 0,054 моль) в хлористом метилене (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение еще 5 ч и последовательно промывали водой (50 мл), разбавленной хлористоводородной кислотой (3,5%, 50 мл), водой (50 мл), разбавленным раствором гидроксида натрия (2%, 25 мл) и водой (50 мл). После испарения растворителя получали маслянистую жидкость, которая медленно отверждалась. Перекристаллизацией из этанола (75 мл) получали желтовато-рыжевато-коричневые кристаллы с температурой плавления 100-102oC (11,2 г, выход 73%).
Вычислено, %: C 58,62; H 5,57; N 4,56.
Найдено,%: C 58,46; H 5,74; N 4,72.
ЯМР (CDCl3): 1,4 (3H, триплет), 2,3 (3H, синглет), 3,0 (2H, мультиплет), 4,15-4,6 (4H, мультиплет), 7,2-8,3 (5H, мультиплет).
Пример 9
N-(3-Цианофенил)-5,6-дигидро-2-метил-1,4-оксатиин-3-карбоксамид (соединение 9)
Находящиеся в хлористом метилене 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновую кислоту (5,0 г, 0,031 моль) и хлористый тионил (4,1 г, 0,034 моль) грели в сосуде с обратным холодильником в течение примерно 2 ч, затем упаривали при пониженном давлении. Твердый остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене, и охлажденный раствор по каплям обрабатывали раствором 3-аминобензонитрила (3,7 г, 0,031 моль) и триэтиламина (3,2 г, 0,032 моль) в хлористом метилене. Реакционную смесь перемешивали при комнатной температуре еще в течение 3 ч и затем промывали разбавленной хлористоводородной кислотой и разбавленным раствором гидроксида натрия. Испаряя растворитель, получали твердый остаток, который перекристаллизовывали из метанола, получая белое твердое вещество с температурой плавления 119-121oC (5,5 г, выход 67%).
ЯМР (CDCl3): 2,3 (3H, синглет), 3,0 (2H, мультиплет), 4,4 (2H, мультиплет), 7,2-8,2 (5H, мультиплет).
Пример 10.
1-Метилэтил-5-[[(5,6-дигидро-2-метил-1,4-оксатиин-3-ил)карбонил] амино] бензоат (соединение 10)
Хлористый тионил (3,5 г, 0,029 моль) добавляли к перемешиваемой смеси, состоящей из 5,6 -дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (4,7 г, 0,029 моль) и хлористого метилена (100 мл). Смесь нагревали до 30-35oC и грели при этой температуре в течение 4 ч, затем упаривали при пониженном давлении. Остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (100 мл), и охлажденный на льду раствор по каплям обрабатывали раствором 1-метилэтил-3-аминобензоата (5,2 г, 0,029 моль) и триэтиламина (2,9 г, 0,029 моль) в хлористом метилене (50 мл). Реакционную смесь перемешивали на протяжении ночи при комнатной температуре и затем последовательно промывали водой, разбавленной хлористоводородной кислотой, 2%-ным раствором гидроксида натрия и водой. Испаряя растворитель, получали маслянистую жидкость, которая отверждалась. После перекристаллизации из этанола (30 мл) получали продукт (4,0 г, выход 42%) с температурой плавления 92-94oC.
Вычислено, %: C 59,79; H 5,96; N 4,36.
Найдено, %: C 59,46; H 6,21; N 4,51.
ЯМР (CDCl3): 1,35 (6H, дублет), 2,3 (3H, синглет), 3,0 (2H, мультиплет), 4,4 (2H, мультиплет), 4,4 (2H, мультиплет), 5,25 (1H, мультиплет), 7,2-8,2 (5H, мультиплет).
Пример 11
Этил-2-хлор-5-[[(2-этил-5,6-дигидро-1,4-оксатиин-3-ил)карбонил]амино]бензоат (соединение 11)
Хлористый тионил (4,0 г, 0,034 моль) добавляли к перемешиваемой смеси, состоящей из 2-этил-5,6-дигидро-1,4-оксатиин-3-карбоновой кислоты (5,9 г, 0,034 моль) и хлористого метилена (100 мл). Смесь нагревали примерно до 35oC и грели при этой температуре в течение 3 ч, затем упаривали при пониженном давлении. Остаток, представляющий собой сырой хлористый 2-этил-5,6-дигидро-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (100 мл), и охлажденный на льду раствор по каплям обрабатывали раствором этил-5-амино-2-хлорбензоата (6,8 г, 0,034 моль) и триэтиламина (3,7 г, 0,037 моль) в хлористом метилене (100 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре и затем последовательно промывали водой, разбавленной хлористоводородной кислотой, водой, 2%-ным раствором гидроксида натрия и водой. Испарением растворителя получали маслянистую жидкость, которая отверждалась. После перекристаллизации из этанола (30 мл) получали продукт (7,0 г, выход 58%) с температурой плавления 86-88oC.
Вычислено, %: C 54,01; H 5,10; N 3,94.
Найдено, %: C 53,60; H 5,03; N 4,04.
ЯМР (CDCl3): 1,0-1,6 (6H, мультиплет), 2,6 (2H, квартет), 3,0 (2H, мультиплет), 4,15-4,6 (4H, мультиплет), 7,2-7,9 (3H, мультиплет), 8,05 (1H, граничный синглет).
Пример 12
1-Метилэтил-5-[[(5,6-дигидро-2-метил-1,4-оксатиин-3- ил)карбонил]амино] -4-фтор-2-метилбензоат (соединение 12)
Хлористый тионил (4,7 г, 0,040 моль) добавляли к перемешиваемой смеси, состоящей из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (6,0 г, 0,037 моль) и хлористого метилена (50 мл). Смесь перемешивали на протяжении ночи при комнатной температуре, затем упаривали при пониженном давлении. Твердый остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (50 мл) и охлажденный раствор по каплям на протяжении примерно 1 ч обрабатывали раствором 1-метилэтил-5-амино-4-фтор-2-метилбензоата (7,9 г, 0,037 моль) и триэтиламина (3,9 г, 0,039 моль) в хлористом метилене (50 мл). Реакционную смесь подвергали перемешиванию при комнатной температуре на протяжении ночи и последовательно промывали водой (50 мл), разбавленной хлористоводородной кислотой (3,5%, 50 мл), водой (50 мл), разбавленным раствором гидроксида натрия (2%, 25 мл) и водой (50 мл). Испарением растворителя получали твердый остаток. Перекристаллизацией из 100%-ного этанола (60 мл) получали желтовато-рыжевато-коричневые кристаллы с температурой плавления 119-122oC (7,6 г, выход 57%).
Вычислено, %: C 57,78; H 5,70; N 3,96.
Найдено, %: C 57,75; H 5,79; N 3,99.
ЯМР (CDCl3): 1,35 (6H, дублет), 2,3 (3H, синглет), 2,55 (3H, синглет), 3,0 (2H, мультиплет), 4,4 (2H, мультиплет), 5,2 (1H, синглет), 6,95 (1H, дублет), 8,1 (1H, граничный синглет), 8,75 (1H, дублет).
Пример 13
1-Метилэтил-3-[[(5,6-дигидро-2-метил-1,4-оксатиин- 3-ил)карбонил]амино] -4-фторбензоат (соединение 13)
Хлористый тионил (4,6 г, 0,039 моль) добавляли к перемешиваемой смеси, состоящей из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (6,0 г, 0,037 моль) и хлористого метилена (50 мл). Смесь нагревали до 35-40oC и выдерживали при этой температуре в течение 3 ч, затем упаривали при пониженном давлении. Остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, разбавляли хлористым метиленом (50 мл), и охлажденный на льду раствор по каплям обрабатывали раствором 1-метилэтил-3-амино-4-фторбензоата (7,4 г, 0,037 моль) и триэтиламина (3,9 г, 0,039 моль) в хлористом метилене (50 мл). Реакционную смесь перемешивали на протяжении ночи при комнатной температуре и затем последовательно промывали водой (50 мл), разбавленной хлористоводородной кислотой (3,5%, 50 мл), водой (50 мл), разбавленным раствором гидроксида натрия (2%, 25 мл) и водой (50 мл); сушили над безводным сульфатом натрия и упаривали. Перекристаллизацией твердого остатка из 100%-ного этанола (100 мл) получали светло-коричневые кристаллы с температурой плавления 132-135oC (7,8 г, выход 61%).
Вычислено, %: C 56,63; H 5,35; N 4,13.
Найдено, %: C 56,40; H 5,26; N 4,25.
ЯМР (CDCl3): 1,35 (6H, дублет), 2,3 (3H, синглет), 3,0 (2H, мультиплет), 4,4 (2H, мультиплет), 5,25 (1H, мультиплет), 7,1 (1H, мультиплет), 7,8 (1H, мультиплет), 8,2 (1H, граничный синглет), 8,9 (1H, мультиплет).
Пример 14
Этил-3-[[(5,6-дигидро-2-метил-1,4-оксатиин-3- ил)карбонил] амино]-4-метилбензоат (соединение 14)
Хлористый тионил (4,5 г, 0,038 моль) добавляли к перемешиваемой смеси, состоящей из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (6,0 г, 0,037 моль) и хлористого метилена (100 мл). Смесь нагревали до 30-35oC и выдерживали при этой температуре в течение 3 ч, затем упаривали при пониженном давлении. Остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (100 мл), и охлажденный на льду раствор по каплям обрабатывали раствором этил-3-амино-4-метилбензоата (6,7 г, 0,037 моль) и триэтиламина (4,0 г, 0,040 моль) в хлористом метилене (100 мл). Реакционную смесь перемешивали на протяжении ночи при комнатной температуре и затем последовательно промывали водой, разбавленной хлористоводородной кислотой, водой, 2%-ным раствором гидроксида натрия и водой. Испарением растворителя получали маслянистую жидкость, которая отверждалась. После перекристаллизации из этанола (30 мл) получали продукт (7,1 г, выход 59%) с температурой плавления 105-107oC.
Вычислено, %: C 59,79; H 5,96; N 4,36.
Найдено, %: C 59,87; H 5,73; N 4,52.
ЯМР (CDCl3): 1,35 (3H, триплет), 2,25 (3H, синглет), 2,3 (3H, синглет), 2,3 (3H, синглет), 3,0 (2H, мультиплет), 4,15-4,55 (4H, мультиплет), 7,1-7,3 (1H, мультиплет), 7,55-7,95 (2H, мультиплет), 8,45 (1H, дублет).
Пример 15
Пентил-2-хлор-5-[[(5,6-дигидро-2-метил-1,4-оксатиин- 3-ил)карбонил] амино]бензоат (соединение 15)
Хлористый тионил (3,9 г, 0,033 моль) добавляли к перемешиваемой смеси, состоящей из 5,6-дигидро-2-метил-1,4-оксатиин-3-карбоновой кислоты (5,2 г, 0,035 моль) и хлористого метилена (100 мл). Смесь перемешивали на протяжении ночи при комнатной температуре, затем упаривали при пониженном давлении. Остаток, представляющий собой сырой хлористый 5,6-дигидро-2-метил-1,4-оксатиин-3-карбонил, растворяли в хлористом метилене (100 мл), и охлажденный на льду раствор по каплям обрабатывали раствором пентил-5-амино-2-хлорбензоата (7,9 г, 0,063 моль) и триэтиламина (3,3 г, 0,033 моль) в хлористом метилене (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, затем последовательно промывали водой, разбавленной хлористоводородной кислотой, водой, 2%-ным раствором гидроксида натрия и водой. Испарением растворителя получали маслянистую жидкость, которая отверждалась очень медленно. После перекристаллизации из этанола (30 мл) получали продукт (5,9 г, выход 47%) с температурой плавления 65 - 68oC. Проведением второй перекристаллизации температуру плавления повышали до 70 - 71oC.
Вычислено,%: C 56,32; H 5,78; N 3,65.
Найдено,%: C 56,29; H 5,66; N 3,67.
ЯМР (CDCl3): 0,7 - 1,9 (9H, мультиплет), 2,3 (3H, синглет), 3,0 (2H, мультиплет), 4,15 - 4,55 (4H, мультиплет), 7,15 - 8,1 (4H, мультиплет).
Пример 16
1-Метилэтил-2-хлор-5-[[(2,4,5-триметил-3-фуранил)карбонил] амино]бензоат (соединение 16)
2,4,5-Триметил-3-фуранкарбоновую кислоту готовили по способу, предложенному Хансоном и др. (Hanson et al., J. Chem. Soc. (1965), 5984).
Хлористый 2,4,5-триметил-3-фуранкарбонил готовили нагреванием в сосуде с обратным холодильником 2,4,5-триметил-3-фуранкарбоновой кислоты (20,0 г) с хлористым тионилом (20 мл) в толуоле (75 мл) в течение 3 ч. Толуол и избыточный хлористый тионил удаляли на вращающемся испарителе, и остаток отгоняли (температура кипения составляла 95 - 97oC при давлении порядка 12 мм рт. ст. ).
Раствор 2,4,5-триметил-3-фуранкарбонилхлорида (7,8 г, 0,045 моль) в толуоле (25 мл) добавляли к 1-метилэтил-5-амино-2- хлорбензоату (10,6 г, 0,050 моль) и триэтиламину (6 г) в толуоле (25 мл). Смесь нагревали до 60oC и грели при этой температуре в течение примерно 1 ч, затем последовательно промывали разбавленной хлористоводородной кислотой, водой, водным 5%-ным раствором бикарбоната натрия и водой. Раствор сушили над сульфатом магния, фильтровали и упаривали. Остаток кристаллизовали из смеси толуола с петролейным эфиром, в результате чего получали 6,7 г бледно-желтого твердого вещества с температурой плавления 83 - 85oC.
Вычислено,%: C 61,89; H 5,73; N 4,01.
Найдено,%: C 61,78; H 5,83; N 4,10.
ЯМР (DMSO (диметилсульфоксид) - d6) 1,35 (6H, дублет), 1,98 (3H, синглет), 2,20 (3H, синглет), 2,42 (3H, синглет), 5,2 (1H, мультиплет), 7,4 - 8,2 (3H, мультиплет), 10,1 (1H, синглет).
Пример 17
1-Метилэтил-2-хлор-5-[[(3-метил-2-фуранил)карбонил] амино] бензоат (соединение 17)
3-Метил-2-фуранкарбоновую кислоту (41 г, температура плавления 136 - 138oC) готовили нагреванием в сосуде с обратным холодильником метил-3-метил-2-фуранкарбоксилата, взятого в количестве 54 г (Organic Synthesis, Coll, Vol, IV, p. 649), гидроксида натрия (20 г), воды (100 мл) и этанола (100 мл); затем проводили охлаждение и подкисление концентрированной хлористоводородной кислотой.
Хлористый 3-метил-2-фуранкарбонил готовили нагреванием в сосуде с обратным холодильником 3-метил-2-фуранкарбоновой кислоты (20,0 г) с хлористым тионилом (25 мл) в толуоле (75 мл) в течение 3 ч. После удаления растворителя хлорангидрид кислоты перегоняли (температура кипения составляла 74 - 76oC при давлении порядка 12 мм рт. ст.).
Раствор 3-метил-2-фуранкарбонилхлорида (9,5 г, 0,066 моль) в толуоле (20 мл) добавляли к 1-метилэтил-5-амино-2-хлорбензоату (14 г, 0,066 моль) и триэтиламину (10 г) в толуоле (20 мл). После пребывания смеси при температуре окружающего воздуха в течение примерно 3 ч смесь промывали разбавленной хлористоводородной кислотой, водой, водным 5%-ным раствором бикарбоната натрия и водой. При охлаждении продукт кристаллизовался из толуола (температура плавления 99 - 100oC, 10 г, выход 47%).
Вычислено,%: C 59,81; H 4,98; N 4,36.
Найдено,%: C 59,11; H 5,00; N 4,02.
ЯМР (DMSO - d6 (диметилсульфоксид): 1,35 (6H, дублет), 2,37 (3H, синглет), 5,2 (1H, мультиплет), 6,6 (1H, дублет), 7,44 - 8,29 (4H, мультиплет), 10,35 (1H, синглет).
Пример 18
1-Метилэтил-5-(бензиламино)-2-хлор-4-фторбензоат (соединение 18)
Раствор хлористого бензоила (2,94 г, 0,021 моль) и 1-метилэтил- 5-амино-2-хлор-4-фторбензоата (4,62 г, 0,020 моль) в метилэтилкетоне (50 мл) перемешивали при комнатной температуре в течение 3 дней. Испарением растворителя и кристаллизацией твердого остатка из этилового эфира получали бесцветные игольчатые кристаллы с температурой плавления 117 - 119oC (6 г, выход 90%).
Вычислено,%: C 60,81; H 4,50; N 4,17.
Найдено,%: C 60,89; H 4,72; N 4,08.
ЯМР (CDCl3): 1,37 (6H, дублет), 5,25 (1H, мультиплет), 7,20 (1H, дублет), 7,4 - 7,6 (3H, мультиплет), 7,75 - 8,0 (2H, мультиплет), 8,15 (1H, граничный синглет), 8,83 (1H, дублет).
Пример 19
1-Метилэтил-2-хлор-5-[(2-метоксибензоил)амино]бензоат (соединение 19)
Хлористый 2-метоксибензоил (8,8 г, 0,05 моль) добавляли при комнатной температуре, делая это в среде сухого азота, к перемешиваемой смеси, состоящей из 1-метилэтил-5-амино-2- хлорбензоата (10,7 г, 0,05 моль), триэтиламина (5,6 г, 0,055 моль) и 4-(N,N-диметиламино)пиридина (катализатор 0,2 г), растворенного в n-диоксане (100 мл). Образовывался твердый осадок. После протекания начальной экзотермической реакции (температура возросла примерно до 45oC) реакционную смесь перемешивали в среде азота при комнатной температуре в течение 20 ч. Затем реакционную смесь добавляли к воде (500 мл), получая при этом осадок из твердого продукта, который собирали вакуумным фильтрованием, промывали водой (500 мл) и сушили, в результате чего получали 16,2 г названного соединения с температурой плавления 94 - 96oC.
ЯМР (CDCl3): 1,40 (6H, дублет), 4,05 (3H, синглет), 5,28 (1H, мультиплет), 7,02 (1H, дублет), 7,11 (1H, мультиплет), 7,38 (1H, дублет), 7,49 (1H, мультиплет), 7,87 (1H, мультиплет), 7,95 (1H, дублет), 8,25 (1H, мультиплет), 9,86 (1H, синглет).
Пример 20
2,3,4,5-Тетрабром-6-[[[4-хлор-2-фтор-5-(1- метилэтоксикарбонил)фенил] амино]карбонил]бензойная кислота (соединение 20)
Тетрабромфталевый ангидрид (6,67 г, 0,014 моль) и 1-метилэтил-5-амино-2-хлор-4-фторбензоат (3,33 г, 0,014 моль) грели в сосуде с обратным холодильником при перемешивании с добавлением примерно 150 мл толуола, затем перемешивание вели на протяжении ночи при комнатной температуре. Фильтрованием реакционной смеси получали названное соединение с температурой плавления 160 - 165oC (идет разложение).
Вычислено,%: C 31,09; H 1,60; N 2,01.
Найдено,%: C 31,27; H 1,57; N 2,12.
ЯМР (DMSO - d6 (диметилсульфоксид)): 1,35 (6H, дублет), 5,2 (1H, мультиплет), 7,7 (1H, дублет), 8,45 (1H, дублет), 9,9 (1H, граничный синглет), 10,9 (1H, синглет).
Пример 21
2,3,4,5-Тетрабром-6-[[[4-хлор-3-(1- метилэтоксикарбонил)пентил] амино] карбонил]бензойная кислота (соединение 21)
Тетрабромфталевый ангидрид (7,03 г, 0,015 моль), 1-метилэтил-5-амино-2-хлорбензоат (3,24 г, 0,015 моль) и толуол (примерно 150 мл) грели почти до концентрации в обратном холодильнике в течение 30 мин. Реакционную смесь охлаждали и фильтровали, в результате чего получали названное соединение с температурой плавления 169 - 171oC (идет разложение) (8,92 г, выход 87%).
Вычислено,%: C 31,92; H 1,79; N 2,07.
Найдено,%: C 33,00; H 2,00; N 2,12.
ЯМР (DMSO - d6 (диметилсульфоксид)) : 1,35 (6H, дублет), 5,2 (1H, мультиплет), 7,4 - 8,2 (3H, мультиплет), 11,0 (1H, синглет), 12,0 (1H, граничный синглет).
Пример 22
2,3,4,5-Тетрахлор-6-[[[4-хлор-3-(1- метилэтоксикарбонил)фенил] амино] карбонил]бензойная кислота (соединение 22)
Смесь, состоящую из тетрахлорфталевого ангидрида (2,97 г, 0,010 моль), 1-метилэтил-5-амино-2-хлорбензоата (2,22 г, 0,010 моль) и толуола (100 мл), медленно с перемешиванием нагревали до начала конденсации в обратном холодильнике, затем оставляли на ночь при комнатной температуре. Фильтрованием реакционной смеси получали названное соединение с температурой плавления 178 - 179oC (3,45 г, выход 70%).
Вычислено,%: C 43,28; H 2,42; N 2,80.
Найдено,%: C 42,99; H 2,31; N 2,91.
ЯМР (DMSO - d6 (диметилсульфоксид)) : 1,35 (6H, дублет), 5,2 (1H, мультиплет), 7,4 - 8,2 (3H, мультиплет), 11,2 (1H, синглет), 11,5 (1H, граничный синглет).
Пример 23
1-Метилэтил-2-хлор-5-[(2-метилбензоил)амино]бензоат (соединение 23)
Раствор 1-метилэтил-5-амино-2-хлорбензоата (5,3 г, 0,025 моль) и триэтиламина (3 г, 0,030 моль) в хлористом метилене (50 мл) по каплям добавляли на протяжении 1 ч к охлажденному на льду раствору хлористого о-толуола (4 г, 0,026 моль) в хлористом метилене (50 мл). Смесь затем перемешивали при комнатной температуре в течение 2 ч и последовательно промывали водой, разбавленной хлористоводородной кислотой, водой, 2%-ным водным раствором гидроксида натрия и водой. Остаток, образовавшийся после выпаривания хлористого метилена, перекристаллизовывали из изопропилового спирта (50 мл), в результате чего получали названное соединение с температурой плавления 137 - 138oC (4 г, выход 49%).
Вычислено,%: C 65,16; H 5,47; N 4,22.
Найдено,%: C 64,75; H 5,01; N 3,95.
ЯМР (CDCl3): 1,4 (6H, дублет), 2,5 (3H, синглет), 5,25 (1H, мультиплет), 7,2 - 7,55 (5H, мультиплет), 7,7 - 8,0 (3H, мультиплет).
Пример 24
Пропил-2-хлор-5-[(2-метилбензоил)амино]бензоат (соединение 24)
Раствор пропил-5-амино-2-хлорбензоата (10,7 г, 0,050 моль) и триэтиламина (6 г, 0,059 моль) в хлористом метилена (50 мл) по каплям добавляли на протяжении 1 ч к охлажденному льдом раствору хлористого о-толуола (7,8 г, 0,50 моль) в хлористом метилене (50 мл). Смесь затем перемешивали при комнатной температуре на протяжении 3 ч и последовательно промывали водой, разбавленной хлористоводородной кислотой, водой, 2%-ным водным раствором гидроксида натрия и водой. Остаток, полученный от упаривания хлористого метилена, перекристаллизовывали из этанола (100 мл), в результате чего получали названное соединение с температурой плавления 103 - 105oC (7,5 г, выход 45%).
Вычислено,%: C 65,16; H 5,47; N 4,22.
Найдено,%: C 64,79; H 4,91; N 4,11.
ЯМР (CDCl3): 1,0 (2H, триплет), 1,7 (2H, мультиплет), 2,5 (3H, синглет), 4,25 (2H, триплет), 7,2-7,55 (5H, мультиплет), 7,65-8,0 (3H, мультиплет).
Пример 25
N-(4-Хлорфенил)-5,6-дигидро-3-метил-1,4-дитиин-2-карбоксамид (соединение 26)
2-Хлор-N-(4-хлорфенил)-3-оксобутанамид (24,7 г, 0,1 моль), 1,2-этандитиол (9,4 г, 0,1 моль) и небольшое количество n-толуолсульфоновой кислоты, находящиеся в бензоле (150 мл), грели в сосуде с обратным холодильником, используя ловушку Дина-Старка для удаления воды (собирали 1,9 мл воды). Реакционную смесь фильтровали, обрабатывали триэтиламином (8 мл) и грели в сосуде с обратным холодильником в течение еще 30 мин. Смесь затем промывали водой, разбавленной хлористоводородной кислотой, и водой. Выпаривая бензол, получали белое твердое вещество, которое перекристаллизовывали из абсолютного этанола. Продукт плавился при 115-117oC (24 г, выход 84%).
Вычислено, %: C 50,43; H 4,20.
Найдено, %: C 50,18; H 4,15.
Пример 26
1-Метилэтил-2-хлор-5-[[(5,6-дигидро-3-метил-1,4-дитиин-2-ил)карбониил] амино]бензоат (соединение 27)
5,6-Дигидро-3-метил-1,4-дитиин-2-карбоновую кислоту готовили по способу, описанному в патенте США N 4004018 (колонка 11, строки 24-38).
Хлористый тионил (6,5 г, 0,055 моль) медленно добавляли к перемешиваемому раствору 5,6-дигидро-3-метил-1,4-дитиин-2-карбоновой кислоты (3 г, 0,017 моль) в толуоле (15 мл), что делали при комнатной температуре. Смесь грели в сосуде с обратным холодильником в течение 4 ч. Избыточный толуол и хлористый тионил удаляли в роторном испарителе, получая сырой хлорангидрид кислоты. I-Метилэтил-5-амино-2-хлорбензоат (3 г, 0,014 моль), находящийся в пиридине (20 мл), медленно добавляли к перемешиваемому раствору сырого хлорангидрида (3 г) в хлористом метилене (20 мл) при 20oC. Смесь перемешивали в течение 24 ч, выливали на лед и концентрированную хлористоводородную кислоту, дважды промывали водой, сушили над сульфатом магния и выпаривали хлористый метилен. Перекристаллизацией из 95%-ного этанола получали названное соединение с температурой плавления 122-124oC (3 г, выход 57%).
Вычислено, %: C 51,67; H 4,88; N 3,77.
Найдено, %: C 51,43; H 4,70; N 3,72.
ЯМР (DMSO-d6 (диметилсульфоксид)) : 1,4 (6H, дублет), 2,1 (3H, синглет), 3,3 (4H, граничный синглет), 5,2 (1H, мультиплет), 7,4-8,25 (3H, мультиплет).
Пример 27
1-Метилэтил-2-хлор-5-[[(5,6-дигидро-3-метил-1,4-диоксин-2-ил)карбонил] амино]бензоат (соединение 28)
Трифторуксусный ангидрид (100 г, 0,5 моль) по каплям добавляли к охлажденному на льду раствору 2,3-дигидро-5-метил-1,4-диоксина (30 г, 0,30 моль) в хлористом метилене (50 мл) и пиридине (40 г, 0,50 моль). Смесь перемешивали на протяжении ночи и затем упаривали при пониженном давлении. К остатку добавляли простой эфир (150 мл) и 10%-ный раствор карбоната натрия. Эфирную фазу отделяли, промывали разбавленной хлористоводородной кислотой и водой, сушили над безводным сульфатом натрия, фильтровали и упаривали до получения маслянистой жидкости, представляющей собой 1-(5,6-дигидро-3-метил-1,4-диоксин-2-ил)-2,2,2-трифторэтанон (12 г, выход 20%).
Смесь, состоящую из 1-(5,6-дигидро-3-метил-1,4-диоксин-2-ил)-2,2,2-трифторэтанона (12 г, 0,06 моль) и порошкообразного гидроксида калия (6 г, 0,1 моль), грели с толуолом (200 мл) в сосуде с обратным холодильником в течение 7 ч. Смесь охлаждали, подкисляли 6 н. хлористоводородной кислотой, и собирали твердый осадок, представляющий собой 5,6-дигидро-3-метил-1,4-диоксин-2-карбоновую кислоту (6 г, выход 60%).
Смесь, состоящую из хлористого тионила (1,3 г, 0,011 моль) и 5,6-дигидро-3-метил-1,4-диоксин-2-карбоновой кислоты (0,57 г, 0,004 моль), грели в сосуде с обратным холодильником на паровой бане в течение 3 ч, и избыточный хлористый тионил выпаривали при атмосферном давлении. Образовавшуюся жидкость добавляли по каплям к перемешиваемому раствору 1-метилэтил-5-амино-2-хлорбензоата (1,6 г, 0,008 моль) в простом диэтиловом эфире (30 мл), охлажденному на водяной бане со льдом. Смесь разбавляли простым диэтиловым эфиром (120 мл), промывали разбавленной хлористоводородной кислотой (50 мл) и затем водой (50 мл). Диэтиловый эфирный раствор сушили над безводным сульфатом натрия, фильтровали и упаривали при пониженном давлении, в результате чего получали твердый остаток. Сырой продукт промывали изопропиловым спиртом (30 мл), в результате чего получали коричневое твердое вещество с температурой плавления 103-105oC (1,2 г, выход 95,8%).
ЯМР (CDCl3) : 1,4 (6H, дублет), 2,3 (3H, синглет), 4,2 (4H, синглет), 5,3 (1H, мультиплет), 7,3-8,0 (3H, мультиплет), 8,3 (1H, граничный синглет).
Пример 28
1-Метилэтил-2-хлор-5-[[1-метилэтоксикарбонил] амино] бензоат (соединение 29)
Хлористый водород пробулькивали через раствор 1-метилэтил-5-амино-2-хлорбензоата (35 г, 0,16 моль) в сухом диэтиловом эфире (500 мл). Образовавшийся осадок отфильтровывали, промывали простым эфиром и сушили на протяжении ночи в вакуумном эксикаторе. Вещество затем суспендировали в этилацетате и через смесь при перемешивании с нагреванием в сосуде с обратным холодильником на протяжении 45 мин пробулькивали, с избытком, фосген. Часть этилацетата отгоняли с целью удаления избыточного фосгена, затем остальной растворитель удаляли при пониженном давлении, и остаточный 1-метилэтил-2-хлор-5-изоцианатобензоат перегоняли при температуре 114oC и давлении 0,1 мм рт.ст. (28 г, выход 71%).
ЯМР (CDCl3) : 1,39 (6H, дублет), 5,26 (1H, мультиплет), 6,98-7,52 (3H, мультиплет).
Раствор 1-метилэтил-2-хлор-5-изоцианатобензоата (3 г, 0,013 моль) в тетрагидрофуране (5 мл) добавляли к изопропиловому спирту (5 мл), смешанному с тетрагидрофураном (5 мл). Добавляли несколько капель триэтиламина, и реакционную смесь оставляли при температуре окружающей среды на ночь. Удалением растворителя и кристаллизацией из изопропилового спирта получали названное соединение с температурой плавления 108-109oC (2,7 г).
Вычислено, %: C 56,18; H 6,02; N 4,68.
Найдено, %: C 55,66; H 5,93; N 4,51.
ЯМР (DMSO-d6 (диметилсульфоксид)) : 1,27 (6H, дублет), 1,35 (6H, дублет), 4,7-5,38 (2H, мультиплет), 7,38-8,0 (3H, мультиплет), 9,9 (1H, синглет).
Пример 29
1-Метилэтил-2-хлор-5-[(2,2-диметил-1-оксопропил)амино] - 4-фторбензоат (соединение 30)
Раствор хлористого триметилацетила (2,53 г, 0,021 моль) и 1-метилэтил-5-амино-2-хлор-4-фторбензоата (4,62 г, 0,020 моль) в метилэтилкетоне перемешивали при комнатной температуре в течение 16 ч и грели в сосуде с обратным холодильником в течение 2 ч. Растворитель удаляли, и остаток растирали с простым диэтиловым эфиром, в результате чего получали рыжевато-коричневое твердое вещество с температурой плавления 81 - 83oC (5,0 г, выход 79%).
Вычислено, %: C 57,06; H 6,06; N 4,44.
Найдено, %: C 56,83; H 6,08; N 4,38.
ЯМР (CDCl3): 1,33 (9H, синглет), 1,38 (6H, дублет), 5,25 (1H, мультиплет), 5,25 (1H, мультиплет), 7,18 (1H, дублет), 7,60 (1H, граничный синглет), 8,77 (1H, дублет).
Пример 30
Приготовление 1-метилэтил-2-хлор-5-[(2-метил-3-фуранил) тиоксометил] аминобензоата (соединение 59)
Смесь, содержащую 3,5 г 1-метилэтил-2-хлор-5-[[(2-метил-3-фуранил)карбонил]амино]бензоата, 4 г реактива Лоэссона (Lawesson), грели с толуолом в сосуде с обратным холодильником в течение 7 ч. Растворитель удаляли, и остаток элюировали из колонки с силикагелем, используя смесь этилацетата с гексаном, взятыми в соотношении 40 : 60. Из первой фракции получали маслянистую жидкость, которую кристаллизацией из смеси толуола с петролейным эфиром превращали в желтое твердое вещество (0,9 г) с температурой плавления 83 - 85oC.
Вычислено, %: C 56,97; H 4,75; N 4,15.
Найдено, %: C 56,86; H 4,69; N 3,83.
Для спектра ЯМР (CDCl3), выраженного в миллионных долях, получали следующие значения: 1,30 (3H, синглет), 1,40 (3H, синглет), 2,65 (3H, синглет), 5,0 - 5,5 (1H, квартет), 6,55 - 6,62 (1H, дублет), 7,15 - 8,0 (4H, мультиплет), 8,7 - 9,05 (1H, синглет).
Пример 31
1-Метилэтил-2-хлор-5-[[(2,5-диэтил-3-фуранил)тиоксометил] амино] бензоат (соединение 60)
Готовили по способу, аналогичному описанному в примере 30.
Для спектра ЯМР (CDCl3), выраженного в миллионных долях, получали следующие значения: 1,40 (3H, синглет), 1,50 (3H, синглет), 5,0 - 5,6 (1H, квартет), 6,25 (1H, синглет), 7,38 - 8,1 (2H, мультиплет), 8,78 - 9,05 (1H, синглет).
Пример 32
1-Метилэтил-2-хлор-5-[[(2,4,5-триметил-2-фуранил)тиоксометил]амино]бензоат (соединение 58)
Получали по способу, аналогичному описанному в примере 30.
Вычислено, %: C 59,18; H 5,48; N 3,84.
Найдено, %: C 58,94; H 5,49; N 4,40.
Пример 33
2-Хлор-5-[(фенилтиоксометил)амино]этиловый сложный эфир бензойной кислоты (соединение 62)
Раствор 5-(бензоиламино)-2-хлорэтилового сложного эфира бензойной кислоты (3,0 г, 10 ммоль) и 4,12 г (10 ммоль) реактива Лоэссона в 100 мл сухого толуола перемешивали и грели в сосуде с обратным холодильником в течение 9 ч. Раствор концентрировали и затем очищали, пропуская через короткую колонку с набивкой из силикагеля (70 - 230 меш) с использованием в качестве элюента смеси простого этилового эфира с гексаном (взятыми в соотношении 1 : 1). Получали яркое золотистое твердое вещество с температурой плавления 125 - 127oC (2 г, выход 80%).
Вычислено, %: C 60,9; H 4,41; N 4,38.
Найдено, %: C 59,88; H 4,43; N 4,28.
ЯМР (CDCl3): δ - 1,36 (3H, триплет), 4,34 (2H, мультиплет), 7,3 - 8,1 (8H, мультиплет), 9,23 (1H, граничный синглет).
Пример 34
2-Хлор-5-(фенилтиоксометил)амино-1-метилэтил сложный эфир бензойной кислоты (соединение 61)
Раствор 5-(бензоиламино)-2-хлор-1-метилэтилового сложного эфира бензойной кислоты (3,2 г, 10 ммоль) и 4,04 г реактива Лоэссона в 150 мл сухого толуола перемешивали и грели в сосуде с обратным холодильником в течение 40 ч. Раствор концентрировали и затем очищали, пропуская через короткую колонку с набивкой из оксида алюминия при использовании в качестве элюента смеси этилового эфира с гексаном (взятыми в соотношении 1 : 3). Золотистый раствор концентрировали, в результате чего получали яркое золотистое твердое вещество с температурой плавления 93 - 94oC (1,5 г, выход 44,6%).
ЯМР (CDCl3): δ - 1,30 - 1,40 (дублет, 6H), 5,23 (мультиплет, 1H), 7,2 - 8,1 (мультиплет, 8H), 9,30 (граничный синглет, 1H).
Вычислено, %: C 61,16; H 4,83; N 4,20.
Найдено, %: C 61,24; H 4,84; N 4,52.
Пример 35
2-Хлор-5-(3-метил-1-тиоксо-2-бутенил)амино-1-метилэтиловый сложный эфир бензойной кислоты (соединение 67)
Раствор 2-хлор-(3-метил-1-оксо-2-бутенил)амино-1-метилэтилового сложного эфира бензойной кислоты (3,7 г, 12,5 ммоль) и реактива Лоэссона (5,1 г, 12,5 ммоль) в 100 мл сухого толуола перемешивали и грели в сосуде с обратным холодильником в течение 40 ч. Конечный раствор концентрировали и затем очищали, пропуская через короткую колонку с набивкой из силикагеля (70 - 230 меш) при использовании в качестве элюента простого этилового эфира. Получали оранжевую маслянистую жидкость (5 г). Этот сырой продукт далее очищали на колонке с набивкой из оксида алюминия при использовании в качестве элюента смеси простого этилового эфира с гексаном (взятыми в соотношении 1 : 3). Получали светлый золотистый раствор, который концентрировали до получения светлого золотистого твердого вещества с температурой плавления 85 - 86oC (2,8 г, выход 72%).
Вычислено, %: C 57,7; H 5,82; N 4,49.
Найдено, %: C 57,05; H 5,54; N 5,70.
ЯМР (CDCl3): δ - 1,33, 1,40 (дублет, 6H), 1,83 - 2,03 (дублет из дублета, 6H), 5,26 (мультиплет, 1H), 6,13 (неразрешенный мультиплет, 1H), 7,23 - 7,8 (мультиплет, 3H), 7,9 (граничный синглет, 1H).
Пример 36
1-Метилэтил-2-хлор-5-[[(1-метилэтокси)-тиоксометил] амино] бензоат (соединение 32)
Этот синтез соединения 32 проводили, используя 1,3-дициклогексилкарбодиимид. Смесь, состоящую из 2-хлор-5-[[(1-метилэтокси)тиоксометил]амино] бензойной кислоты (2 г, 0,007 моль), изопропилового спирта (1,3 г, 0,02 моль), 4-диметиламинопиридина (0,85 г, 0,007 моль) в 25 мл хлористого метилена, перемешивали на ледяной бане, и добавляли 1,3-дициклогексилкарбодиимид (1,7 г, 0,008 моль). Смеси давали нагреться до температуры окружающей среды и перемешивали на протяжении ночи. Осевшее твердое вещество отфильтровывали, промывали разбавленной хлористоводородной кислотой и водным 5%-ным раствором бикарбоната натрия. После сушки над сульфатом магния, фильтрования и удаления хлористого метилена продукт кристаллизовали из смеси толуола с петролейным эфиром. Получали 1,2 г продукта с температурой плавления 89oC. Температура плавления смеси с действительным соединением 32 также составляла 89 - 90oC. Спектр ЯМР был идентичен таковому у действительного соединения 32.
Вычислено, %: C 53,33; H 5,71; N 4,44.
Найдено, %: C 53,44; H 5,62; N 4,42.
ЯМР (CDCl3): δ - 1,35 (6H, дублет), 1,45 (6H, дублет), 5,0 - 5,8 (2H, мультиплет), 7,28 - 7,80 (3H, мультиплет), 8,43 (1H, синглет).
Результаты исследования in vitro
Соединения, указанные в примерах, были подвергнуты тестированию на анти-СПИД-активность, которое делали по стандартным методикам in vitro Национального института рака. При проведении каждого теста выполняли два холостых опыта. В первом холостом опыте вирусы человеческого иммунодефицита и культуру стандартной человеческой линии клеток инкубировали совместно, что было необходимо для определения инфекционной способности вируса. Жизнеспособность клеток определяли по истечению 6 или 7 дней. В "эффективном" тесте большая часть клеток оказывалась зараженной еще до истечения срока выдержки.
Во втором холостом опыте культуру линии клеток и соединение, подвергаемое тестированию (но без вируса), инкубировали совместно, что было необходимо для определения токсичности лекарственного препарата в отношении линии клеток. Жизнеспособность клеток определяли в функции от концентрации соединения по истечении времени выдержки в 7 дней. В типичном случае клетки сохраняются при низких концентрациях соединения, но при некоторой повышенной концентрации начинает проявляться токсичность соединения и клетки погибают. Концентрация тестируемого соединения, при которой происходит 50%-ное ингибирование роста клеток, определяется как концентрация IC50.
И, наконец, измеряли защитную способность тестируемых соединений. В каждом случае культуру клеток и тестируемое соединение инкубировали с вирусом и измеряли жизнеспособность клеток в функции от концентрации соединения по истечении 6 или 7 дней. Если соединение оказывалось активным в отношении защиты клеток против вируса, то тогда в типичных случаях наблюдалась низкая жизнеспособность клеток до тех пор, пока не достигалась эффективно действующая концентрация тестируемого соединения. С этого момента жизнеспособность клеток начинала непрерывно возрастать, стремясь к величине в 100%, если только у соединения не оказывался существенный эффект токсичности (измеренный во втором холостом опыте).
Концентрация тестируемого соединения, при которой достигалась величина управления в 50%, обозначена как EC 50, т.е. происходило на 50% понижение цитопатического эффекта. Терапевтический индекс TI50 рассчитывается как IC50/EC50.
Могут быть также определены значения концентраций тестируемого соединения, необходимые для понижения вирусного цитопатического эффекта на величину, находящуюся в области от 20 до 50%. Такие соединения классифицируются как умеренно активные. Соединения с величиной управления менее 20% считаются неактивными.
Соединения подвергали тестированию с целью определения их способности понижать цитопатический эффект в отношении вируса человеческого иммунодефицита у человеческих линий клеток CEM и MT2. Тесты проводили, инокулируя эти линии клеток либо свободным вирусом человеческого иммунодефицита (V), либо вирусом, ранее культивированным на клетках хозяина (C). Так, в табл.3 обозначения CEMV означает, что линия клеток CEM была инокулирована свободным вирусом, а обозначение MT2C означает, что линия клеток MT2 была инокулирована культивированными клетками MT2, зараженными вирусом. В некоторых случаях соединение также тестировали на линии клеток совместно с использованием субэффективного количества известного вирицида АЗТ (азидотипидина), применяемого против вируса человеческого иммунодефицита. Это делали для установления существования возможных синергических эффектов. Такие тесты, проведенные на линии клеток СЕМ, обозначаются как CEMZ.
Методика тестирования
1. Лимфоциты T4 (линия клеток CEM) подвергали воздействию вируса человеческого иммунодефицита при отношении вирусов и клеток примерно 0,05 и высевали совместно с незараженными контрольными клетками на панели микротитратора, содержащей 96 ячеек.
2. Каждое испытуемое вещество растворяли в диметилсульфоксиде (если растворитель не оговорен особо), затем разбавляли средой клеточной культуры в соотношении 1:200. Дополнительные разбавления (пятикратные) проводили перед добавлением к равному объему среды, содержащей либо зараженные, либо незараженные клетки.
3. Культуры инкубировали при 37oC в атмосфере с содержанием диоксида углерода 5% в течение 7 дней (если длительность инкубирования составляла 6 дней, то тогда тест с обозначением CEMV идентифицировали как CEM-6).
Указанные выше идентифицирующие обозначения использовали тогда, когда готовили партию проб и образцы вставляли в ячейки. Методикам, предусматривающим добавление лекарственного препарата (или без него) и введение в каждую ячейку незараженных клеток линии CEM с последующим добавлением вируса человеческого иммунодефицита, давали обозначение CEM-IW.
4. Во все ячейки добавляли тетразолиевую соль XTT, и культуры инкубировали с обеспечением возможности проявления жизнеспособными клетками формазанового окрашивания.
5. Отдельные ячейки подвергали спектрофотометрическому анализу для определения количества формазанового продуцирования и, кроме того, просматривали микроскопически с целью обнаружения жизнеспособных клеток и подтверждения наличия защитной активности.
6. Зараженные вирусом клетки, обработанные лекарственным препаратом, сопоставляли с незараженными клетками, обработанными лекарственным препаратом, и с другими надлежащими контрольными образцами (не обработанными, но зараженными и не обработанными и не зараженными, с ячейками без клеток, но содержащими лекарственные препараты, и т.д.), которые находились на той же самой панели.
7. Проводили определение активности.
Данные по опробованию тестированных соединений
Проявление ингибирования вируса человеческого иммунодефицита
Изложенным выше правилам следовали при тестировании соединений, указанных в примерах, что делали во всех случаях, когда хотя бы в одном из тестов обнаруживали некоторую заметную активность. Все результаты тестирования (на молярной основе), полученные для всех соединений, обнаруживающих в каком-либо тесте ингибирующую способность в отношении вируса выше 50%, указывали в табл. 2 как EC50. Кроме того, приведены результаты для соединений, обнаруживающих умеренную активность, т.е. со степенью ингибирования в области примерно от 20 до 50%. Тесты, в которых соединение оказалось неактивным (с активностью менее 20%), обозначаются как I.
В случае соединений с воздействием выше 50% (т.е. истинно обладающих величиной EC50) величина EC50 дается для каждого теста. Соединения со степенью воздействия в области от 20 до 50% причисляются в каждом тесте к умеренно активным (MA).
Испытание соединения из примера 3 на линии клеток CEM
Соединение из примера 3, а именно метил-2-хлор-5-[[(5,6-дигидро-2-метил-1,4-оксатиин-3- ил)карбонил]амино]бензоат, было тестировано в отношении противодействия вирусу H9/HTLV-IIIB (HIV-I) при использовании линии клеток CEM у клеток хозяина, при использовании свободного вируса (HIV-I) с применением линии клеток CEM у клеток хозяина и при использовании инокулирования свободным вирусом (обозначено как CEM-V). Концентрации тестируемого соединения, при которых достигалось 50%-ное ингибирование роста клеток (IC50), концентрация соединения, которая оказывалась эффективной в отношении достижения 50%-ного понижения вирусного цитопатического эффекта (EC50), и терапевтический показатель (I50) приведены ниже в табл.3. Все концентрации выражены в моль на литр.
Соединение из примера 3 начинает обнаруживать ингибирование вирусного цитопатического эффекта при концентрации порядка 5,5•10-7 M и обнаруживает максимальный эффект при концентрации порядка 1,7•10-5M. Таким образом, следует ожидать, что соединение будет эффективным и безопасным при использовании в области между этими двумя значениями концентрации. Соединение из примера 3 было также тестировано с проведением p24- теста и SFU-теста, направленных на подтверждение существования активности в отношении подавления вирусов человеческого иммунодефицита.
Тест p24 представляет собой специфический антитело/антиген-тест, при проведении которого измеряется количество вирусного белка в клетке посредством связывания с вирусным оболочечным белком. В отличие от предыдущих тестов, описанных выше, в которых определяется выживаемость клеток хозяина, в этом тесте определяется выживаемость вируса.
Тест SFU (синцитии-образующие единицы (СОЕ)) характеризует глубину вирусного заражения клетки-хозяина. Обычно белок у вируса человеческого иммунодефицита объединяется с белком клетки хозяина. Этот белок затем экспрессируется на поверхности клетки хозяина, чем обусловливается слияние такой клетки с еще одной клеткой. Образуются гигантские конгломераты клеток, и они могут быть легко подсчитаны.
Начальные исследования по определению токсичности соединения из примера 1 были проведены на мышах. Результаты, полученные при проведении этих тестов, суммированы в табл.4.
Кроме того, было установлено, что соединение из примера 3 обнаруживает полную антивирусную активность в отношении вируса человеческого иммунодефицита на протяжении времени, доходящего до 8 ч после заражения вирусом, и до 12 ч все еще сохраняет некоторую защитную способность. Это контрастирует с препаратом АЗТ (азидотимидином), который оказывается эффективным не более примерно 4 ч после заражения.
Сказанное выше следует только из примера и рамки изобретения должны быть ограничены только рамками приложенных пунктов формулы изобретения.
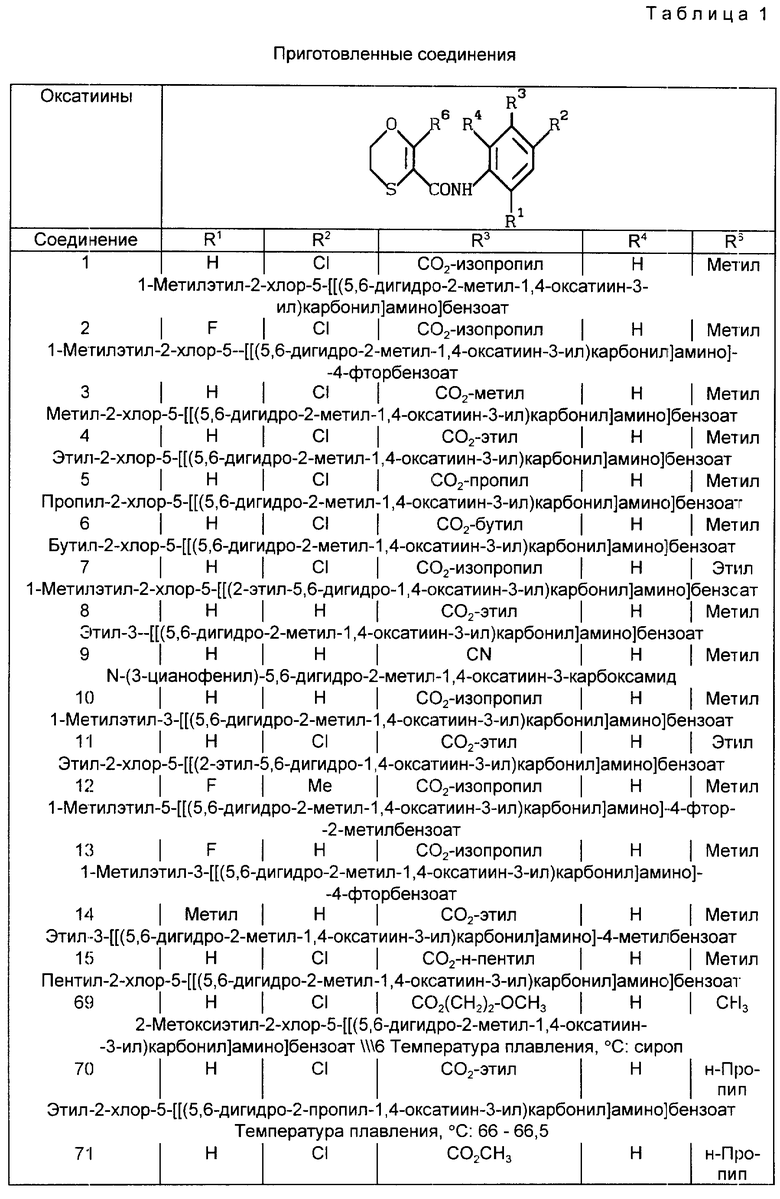

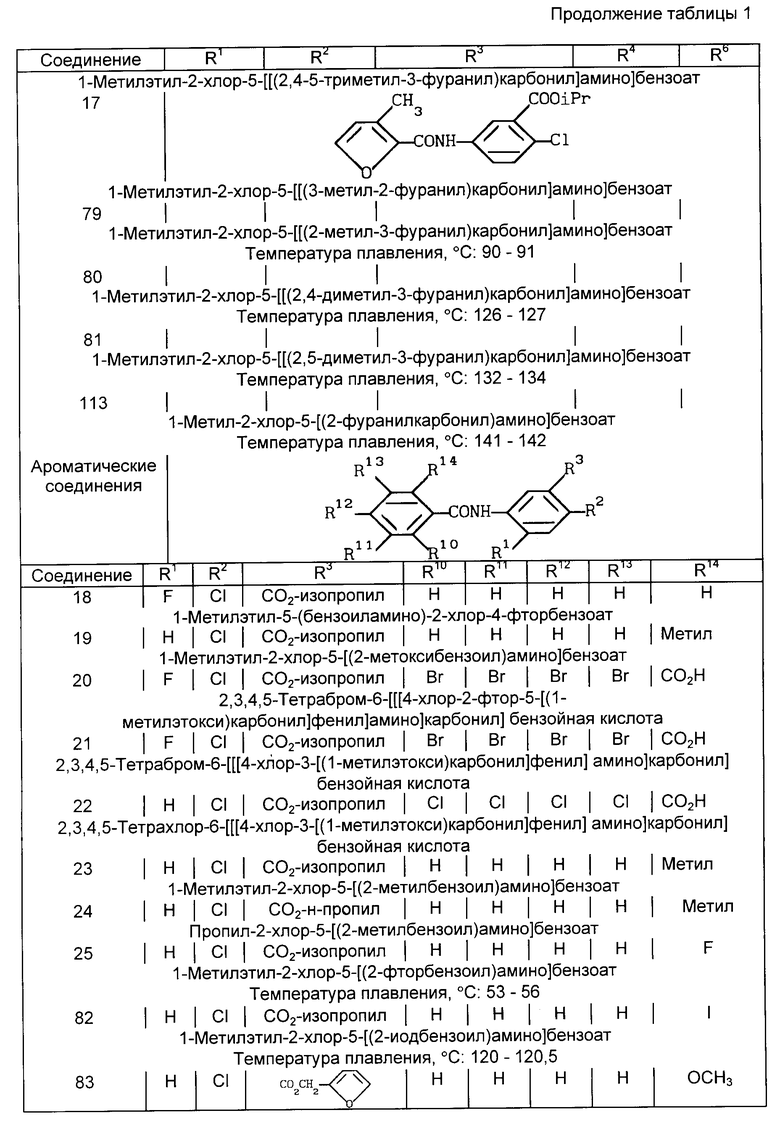

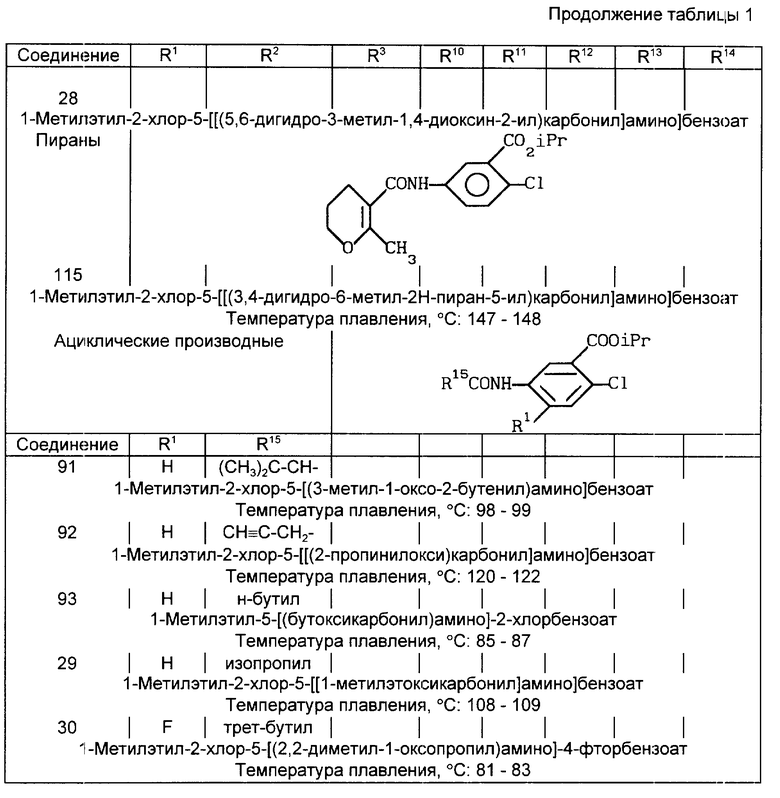
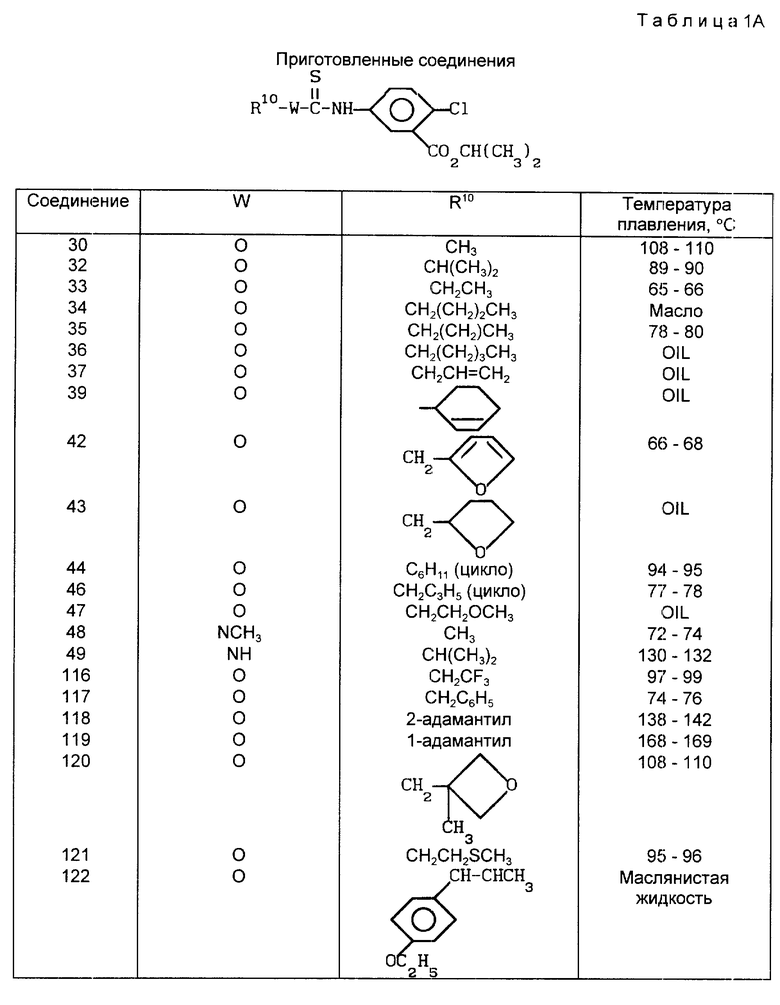
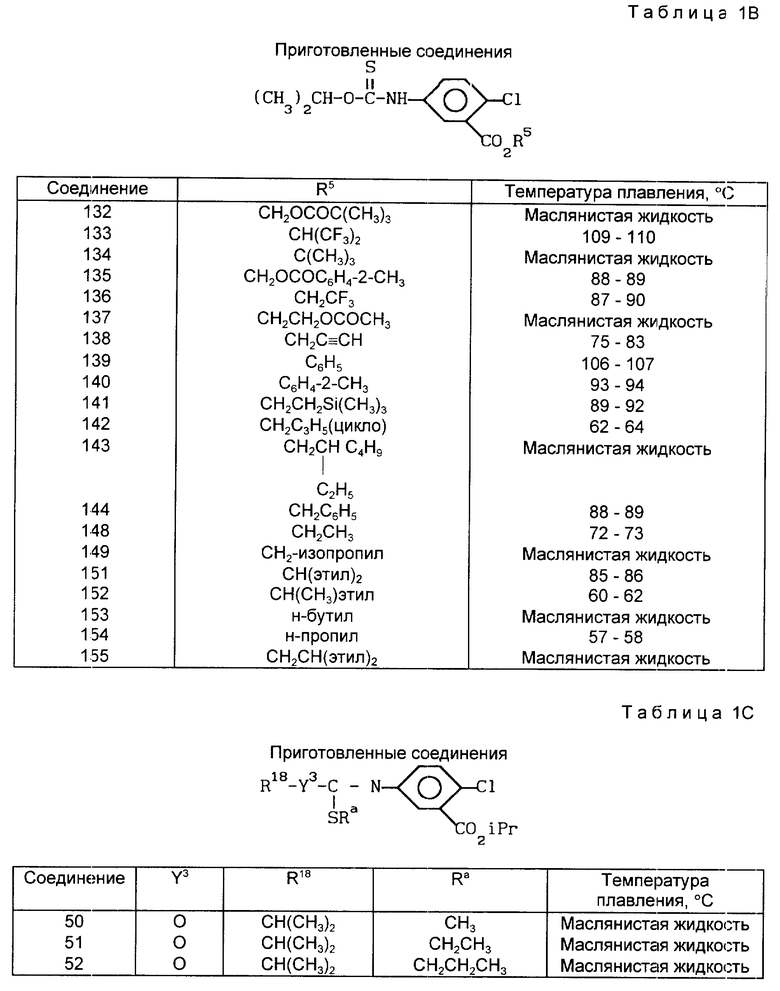
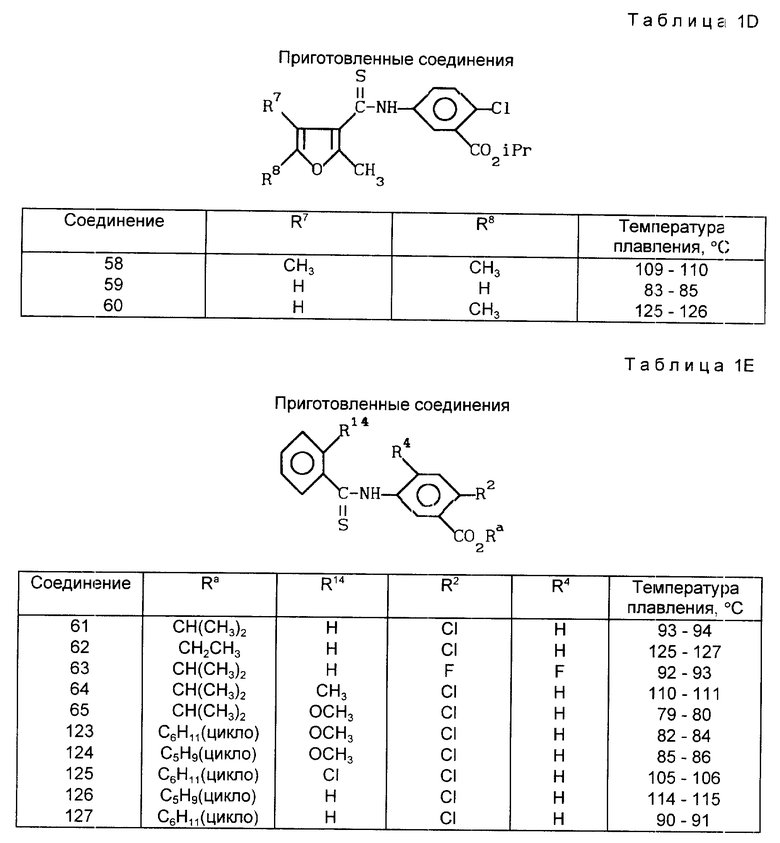
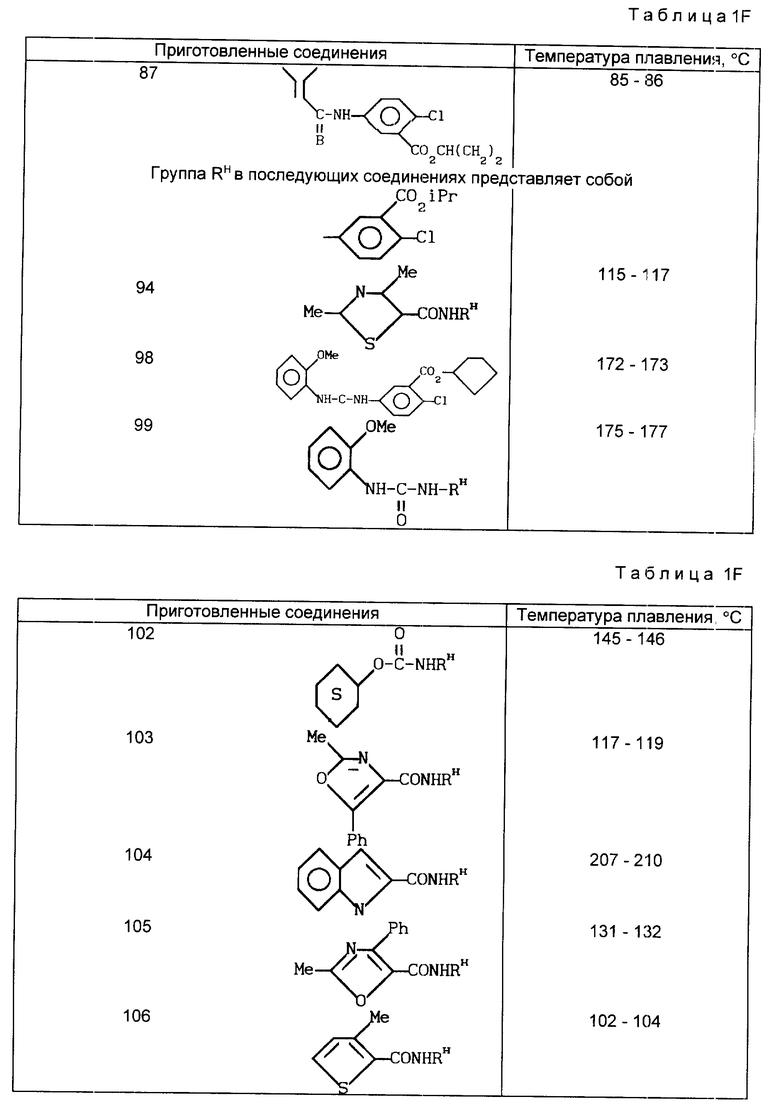
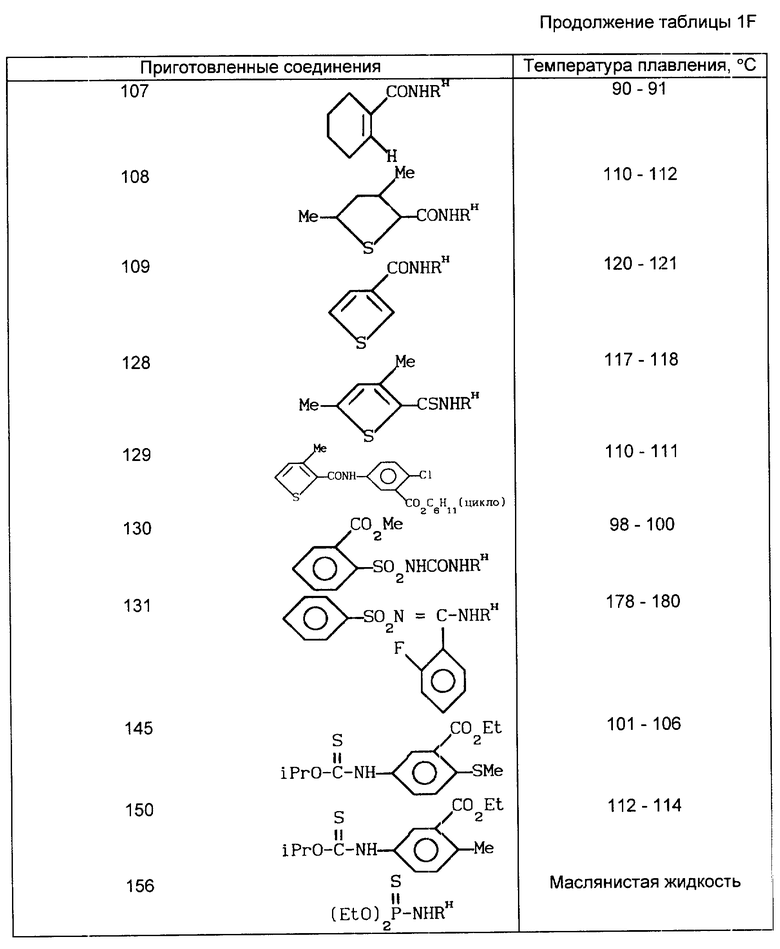

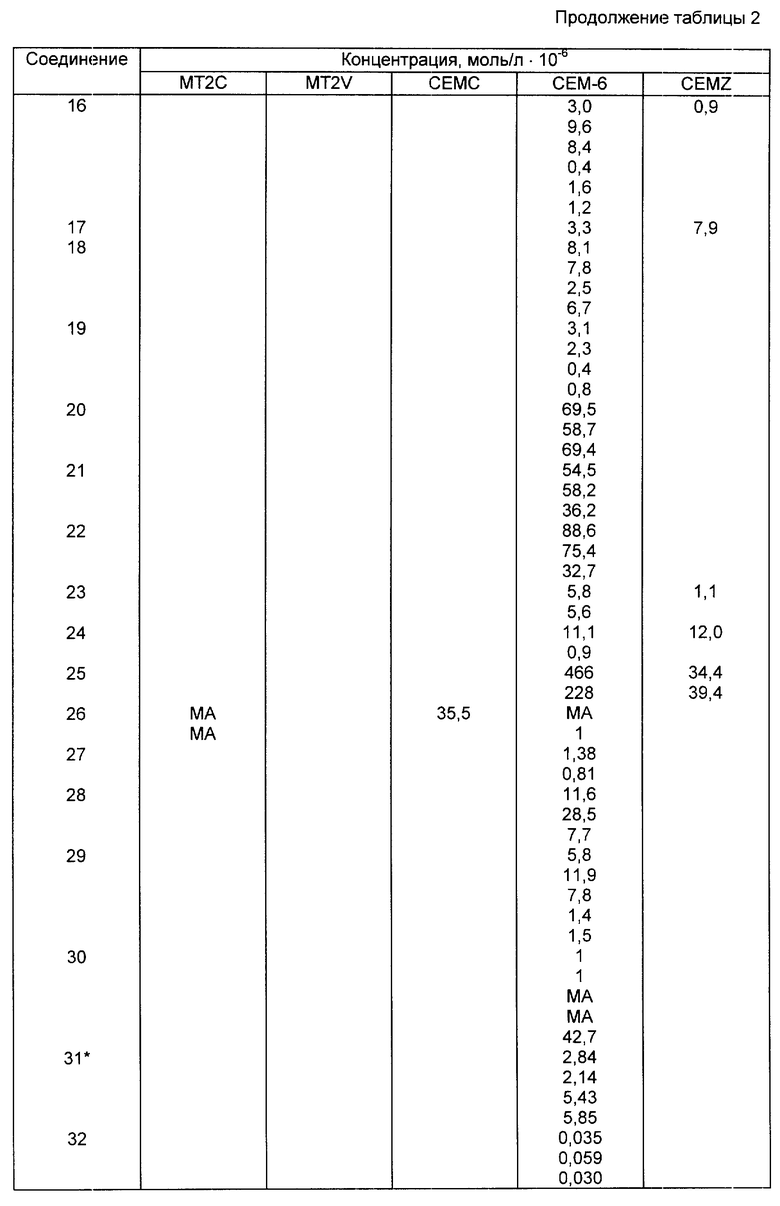
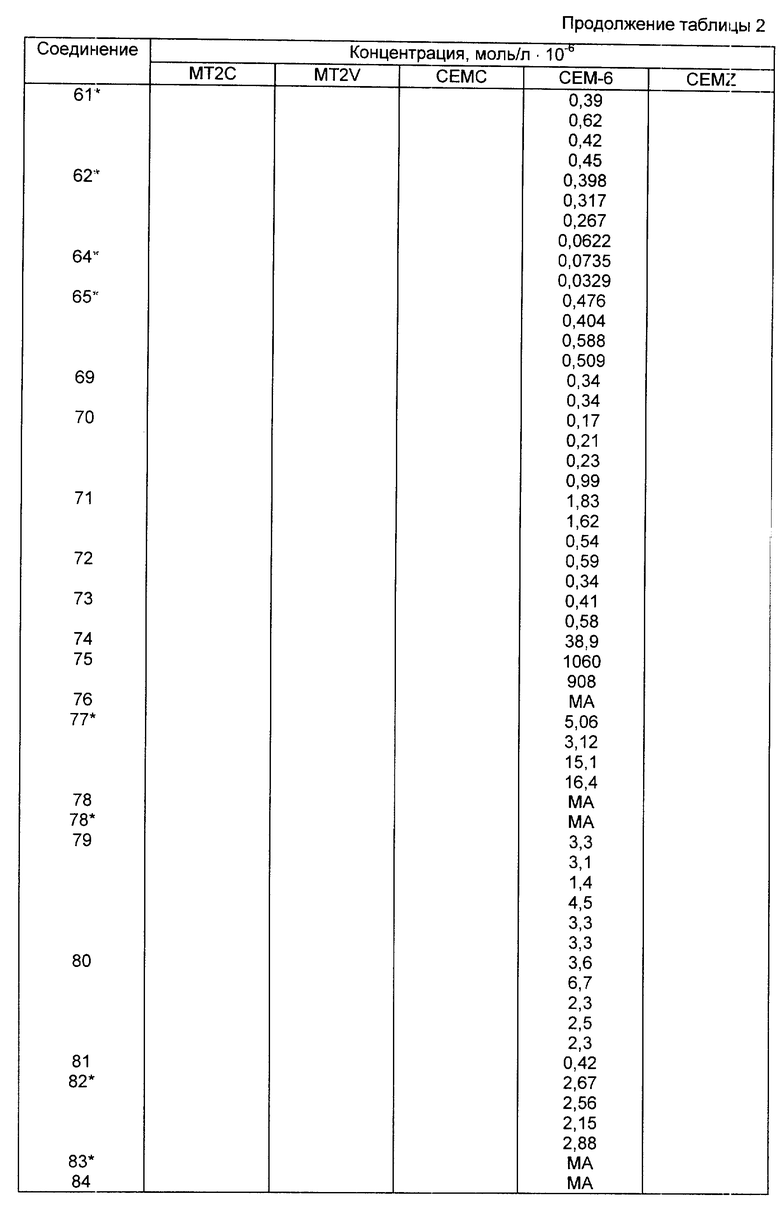
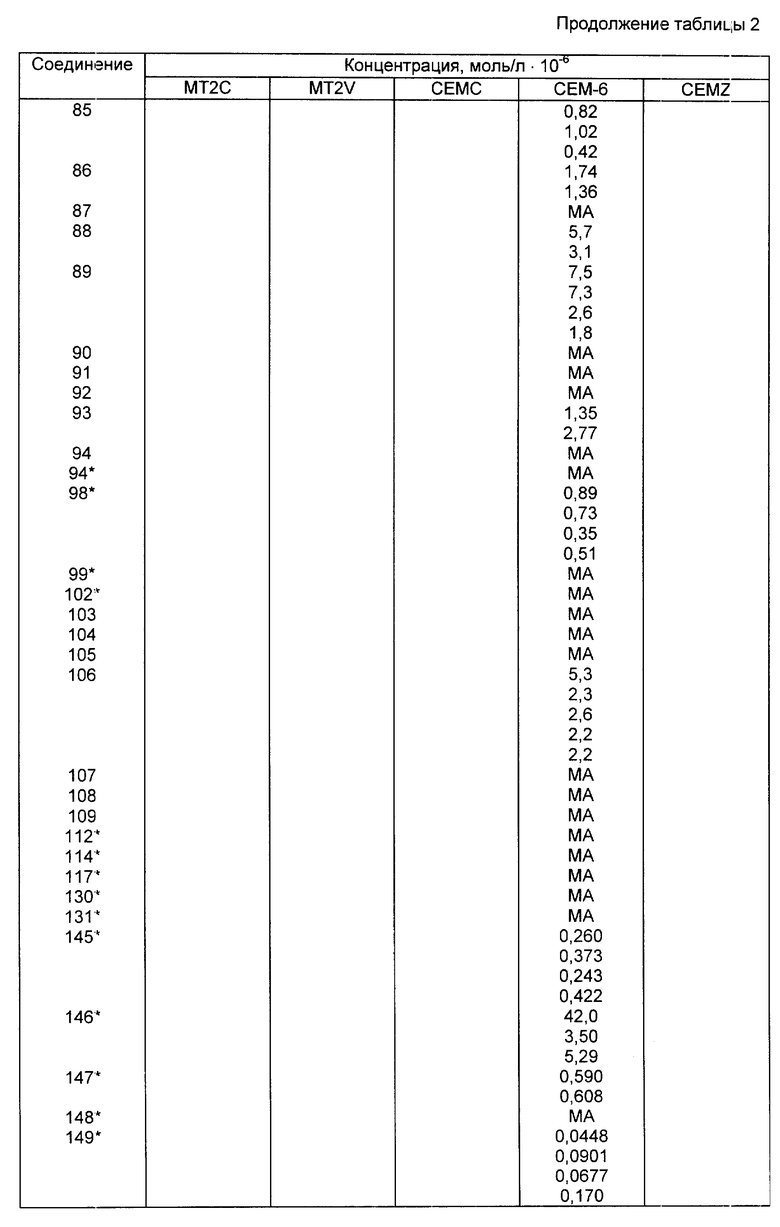
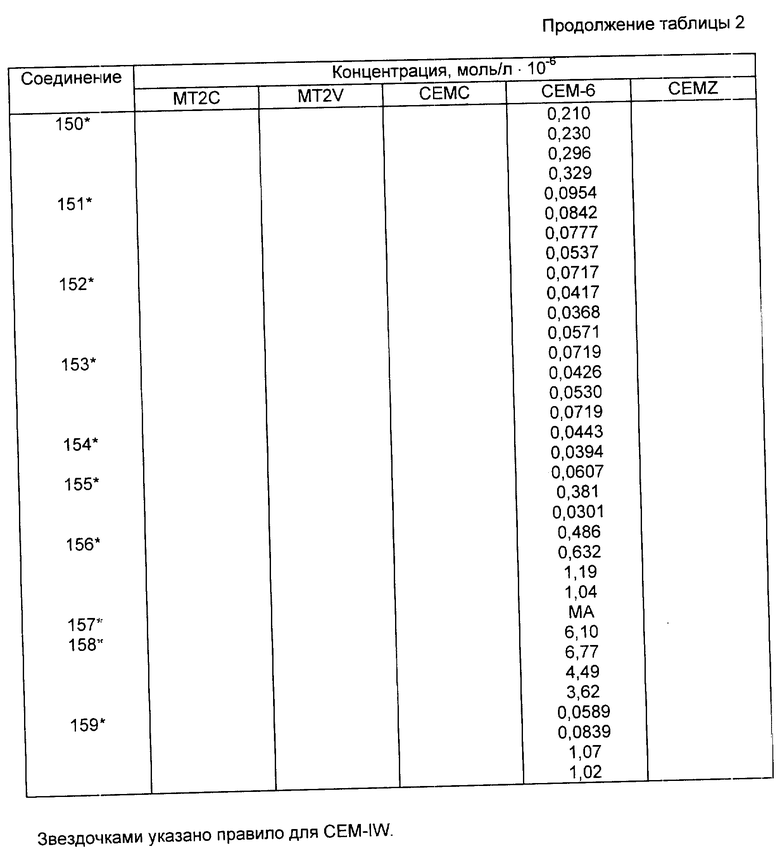

Использование: изобретение относится к медицине. Сущность изобретения: описаны соединения с общей формулой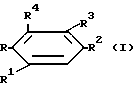
Описаны также фармацевтические композиции, ингибирующие рост или репликации вируса иммунодефицита человека на их основе. 3 с. и 14 з.п.ф-лы, 7 табл.
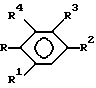
в которой R1 представляет водород, галоген, С1 - С4-алкил или С1 - С4-алкокси;
R2 представляет водород, галоген, С1 - С4-алкил, С1 - С4-алкокси или ОН;
R3 представляет
(i) CO2R5, где R5 представляет С1 - С6-алкил, С3 - С6-алкенил, С2 - С6-алкоксиалкил, С1 - С6-галоидалкил, карбокси (С1 - С6-алкил), (С1 - С6-алкил) карбокси(С1 - С6-алкил), фенил, (С1 - С6-алкил)фенил, три(С1 - С6-алкил) силилалкил, С3 - С8-циклоалкил, фуранил или тетрагидрофуранил;
(ii) 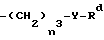 , где n3 представляет 0 или 1, Y представляет О или S и Rd представляет С1 - С6-алкил, С3 - С6-циклоалкил, С2 - С6-алкенил, С2 - С6-алкинил, -CH2CO2R5 или CO2R5;
, где n3 представляет 0 или 1, Y представляет О или S и Rd представляет С1 - С6-алкил, С3 - С6-циклоалкил, С2 - С6-алкенил, С2 - С6-алкинил, -CH2CO2R5 или CO2R5;
(iii) -G-CO2R5, где G представляет - CH2-;
(iv)-CH=NORa, где Ra представляет С1 - С6-алкил;
R4 представляет водород или галоген;
R представляет группу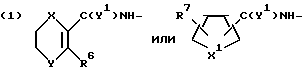
где R6 представляет низший алкил;
R7 представляет водород или один или более низших алкилов;
Y1 представляет кислород или серу;
X1 представляет кислород или серу;
X и Y представляют кислород или серу; или X представляет кислород, а Y представляет -СН2-,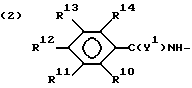
где R10, R1 1, R1 2 и R1 3 представляют водород или галоген;
R1 4 представляет водород, С1 - С4-алкил, С1 - С4-алкокси, галоген, CO2H, NHCO2(С1 - С4-алкил) или NH2;
R1 5 - C(O) - NH или R10-W-C(S)-NH-
где R1 5 представляет С1 - С4-алкокси, С2 - С4-алкинил или С2 - С4-алкенил;
W представляет О или NH(С1 - С4-алкил);
R1 0 представляет С1 - С6-алкил, С2 - С4-алкенил, С4 - С6-циклоалкил, адамантил, бензил, С1 - С4-алкокси, трифтор-замещенный С1 - С4-алкил, или фуранил;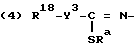
где R1 8 представляет прямой или разветвленный С1 - С6-алкил;
Y3 представляет О;
Ra представляет С1 - С4-алкил.
в которой Z представляет О или S;
R1 представляет водород, галоген, С1 - С4-алкил или С1 - С4-алкокси;
R2 представляет водород, галоген, С1 - С4-алкил, С1 - С4-алкокси или ОН;
R3 представляет
(i) CO2R5, где R5 представляет С1 - С6-алкил, С3 - С6-алкенил, С2 - С6-алкоксиалкил, С1 - С6-галоидалкил, карбокси (С1 - С6-алкил), (С1 - С6-алкил)карбокси(С1 - С6-алкил), фенил, (С1 - С6-алкил)фенил, три(С1 - С6-алкил)силилалкил, С3 - С8-циклоалкил, фуранил или тетрагидрофуранил;
(ii) 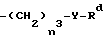
где n3 представляет 0 или 1;
Y представляет О или S;
Rd представляет С1 - С6-алкил, С3 - С6-циклоалкил, С2 - С6-алкенил, С2 - С6-алкинил, CH2CO2R5, или CO2R5;
(iii)-G-CO2R5, где G представляет -СН2-;
(iv)-CH=NORa, где Ra представляет С1 - С6-алкил;
R4 представляет водород или галоген
RA представляет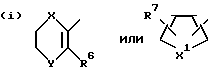
где R6 представляет низший алкил;
R7 представляет водород или один или более низших алкилов;
X1 представляет кислород или серу;
X и Y представляют кислород или серу, или X представляет кислород, а Y представляет -СН2-,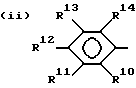
где R1 0, R1 1, R1 2 и R1 3 представляют водород или галоген, и R1 4 представляет водород, С1 - С4-алкил, С1 - С4-алкокси, галоген, CO2H, NHCO2(С1 - С4-алкил) или NH2;
(iii) С1 - С4-алкокси, С2 - С4-алкинил, или С2 - С4-алкенил, когда Z представляет О, или
(iv) R1 0-W-, когда Z представляет S, где W представляет О или NH(С1 - С4-алкил) и R1 0 представляет С1 - С6-алкил, С2 - С4-алкенил, С4 - С6-циклоалкил, адамантил, бензил, С1 - С4-алкокси, трифторзамещенный С1 - С4-алкил или фуранил.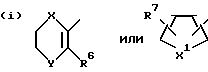
где R6 представляет низший алкил и R7 представляет водород или один или более низших алкилов; или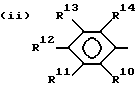
где R10, R1 1, R1 2 и R1 3 представляет водород или галоген и R1 4 представляет водород, С1 - С4-алкил, С1 - С4-алкокси, галоген, CO2H, NH(O2(С1 - С4-алкил) или NH2.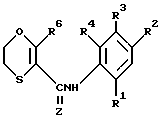
в которой R6 представляет С1 - С4-алкил при условии, что, когда R6 представляет метил или этил, R1 и R2 оба не могут быть водородом.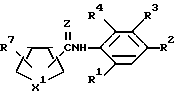
7. Соединение по п. 6, в котором R1 и R4 представляют водород; R2 представляет галоид; R3 представляет группу COOR5, в которой R5 представляет С1 - С6-алкил.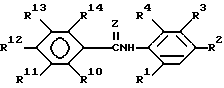
9. Соединение по п.8, в котором R1 представляет водород или фтор, R1 0, R1 1, R1 2 и R1 3 представляют водород; R1 4 представляет водород, метил, этил, хлор, иод, амино, бром, фтор или метокси.
11. Соединение по п. 10, в котором R1 и R4 представляют водород; R3 представляет группу COOR5.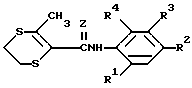
15. Соединение по п. 14, в котором R1 и R4 представляют водород, R1 представляет водород или хлор и R3 представляет С2 - С6-алкоксикарбонил.
| EP, патент, 407782, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1998-04-20—Публикация
1990-10-09—Подача