Изобретение относится к области природных физиологически активных пептидов, конкретно к усовершенствованному способу получения пептида δ -сна формулы I:
TrpAlaGlyGlyAspAlaSerGlyGlu
Пептид δ-сна обладает антистрессорной [1], противоалкогольной [2], антиметастатической [3] и другими видами биологической активности.
В основе известных способов получения пептида δ-сна лежит конденсация Nα-защищенного тетрапептида TrpAlaGlyGly с пентапептидом последовательности AspAlaSerGlyGlu. Известен способ [4], согласно которому пептид δ-сна получают конденсацией NαZ-защищенного тетрапептида, активированного по C-концу методом смешанных ангидридов с изобутилхлорформиатом, с защищенным (бензильными группировками) пентапептидом структуры Asp(OBzl)AlaSer(Bzl)ClyGlu(OBzl)2 с последующим гидрированием полученного защищенного нонапептида над Pd-чернью для снятия защитных групп и очисткой целевого продукта на DEAE-сефадексе. Использование процесса гидрирования для снятия защитных групп приводит к частичному гидрированию индольного кольца триптофана и получению ряда других трудноотделимых примесей [5, 6]. Кроме того, процесс гидрирования в данном случае плохо воспроизводим и трудно доходит до конца из-за осаждения на катализаторе из раствора продуктов неполного гидрирования. Выход пептида δ-сна не превышает 56%.
Наиболее близким к заявляемому по технической сущности является способ получения пептида δ-сна, включающий конденсацию п-нитрофенилового эфира NαZ-защищенного тетрапептида с незащищенным пентапептидом в водно-диоксановой среде, снятие защитной Z-группы гидрированием над Pd-чернью и очистку целевого пептида ионообменной хроматографией [7]. Использование процесса гидрирования для снятия защитных групп, как и в предыдущем способе, приводит к частичному гидрированию индольного кольца триптофана и получению ряда других трудноотделимых примесей [5, 6]. Способ позволяет получать пептид δ-сна с выходом 52%.
Предлагаемый усовершенствованный способ получения пептида δ-сна основан на конденсации пентафторфенилового эфира Boc-защищенного тетрапептида формулы II
BocTrpAlaGlyGlyOPfp
с пентапептидом формулы III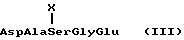
где X - ацетил или формил,
в диметилформамиде в присутствии N-метилморфолина с последующим удалением Boc-группы с помощью муравьиной кислоты при температуре от -2 до +8oC, затем ацетильной или формильной группы - в щелочных условиях, и хроматографической очисткой целевого продукта.
Отличия заявляемого способа от известного [7] заключаются в том, что исходный тетрапептид используется в виде пентафторфенилового эфира и имеет Boc-защиту по N-концу, а исходный пентапептид имеет ацильную защиту по гидроксильной группе серина и конденсацию осуществляют в присутствии N-метилморфолина в диметилформамиде (ДМФА). Кроме того, для снятия защитных групп не используется процесс гидрирования. Boc-группу отщепляют с помощью муравьиной кислоты при температуре от -2 до +8oC, а ацильную группу - в щелочных условиях.
Использование вышеизложенных отличий в заявляемом способе позволяет предотвратить ряд побочных процессов, что дает возможность получать пептид δ-сна с выходом не менее 70%.
Преимуществом заявляемого способа является отсутствие процесса гидрирования для снятия защитных групп на заключительной стадии, т.к. использование последнего может приводить к частичному гидрированию индольного кольца триптофана и получению ряда других трудноотделимых примесей [5, 6]. В отличие от известных в заявляемом способе удаление защитных групп осуществляется в более мягких, легко контролируемых и воспроизводимых условиях.
Преимущества заявляемому способу придает также и то обстоятельство, что исходный пентапептид вводится в синтез в виде N-метилморфолиновой соли (которая образуется после того, как в раствор пентапептида в диметилформамиде добавляется N-метилморфолин). Существенное значение для синтеза имеет высокая растворимость N-метилморфолиновой соли в ДМФА, обеспечивающая высокий выход при образовании пептидной связи.
Известно, что при использовании в синтезе пептидов со свободными карбоксильными группами (в нашем случае - пентапептид) могут протекать процессы переэтерификации [8] или образования смешанных ангидридов, приводящие к получению пептидов незаданной структуры. Однако в описываемом способе вышеуказанные реакции не протекают.
Обычным способом защиты гидроксильной группы серина является введение бензильной или трет-бутильной группы [5]. В заявляемом способе используется ацильная защитная группа, но это не приводит к протеканию побочных процессов, что, по-видимому, обусловлено структурой пентапептида.
Известно, что при наличии в структуре пептида последовательности AspAla могут протекать реакции транспептидации и образования имида [9]. Кроме того, наличие свободной карбоксильной группы может приводить в присутствии активированного эфира N-концевого компонента к переэтерификации по β-карбоксильной группе аспарагиновой кислоты [10]. Однако в заявляемых условиях синтеза вышеупомянутые побочные процессы идут крайне незначительно, что подтверждается данными ТСХ и высоким выходом конечного продукта.
Также неочевидным является использование Boc-группы для защиты остатка триптофана. Известно, что при деблокировании Boc-защищенных пептидов могут получаться трудноотделимые продукты трет-бутилирования триптофана [6, 8]. В заявляемом способе благодаря структуре промежуточного пептида и подобранным условиям деблокирования удается избежать побочного процесса трет-бутилирования.
Необходимо также отметить, что при синтезе триптофансодержащих пептидов остаток триптофана часто защищают по индольному азоту для предотвращения протекания побочных реакций с участием гетероцикла [9]. В заявляемом способе используется пентафторфениловый эфир триптофансодержащего тетрапептида, при этом при его получении и использовании не требуется защита индольного атома азота.
Заявляемый способ осуществляют следующим образом (см. чертеж). Сначала получают тетрапептид и пентапептид методом ступенчатого наращивания пептидной цепи, с использованием активированных эфиров аналогично [4]. Пентафторфениловый эфир Boc-защищенного тетрапептида (II) получают реакцией с дипентафторфенилкарбонатом в ДМФА в присутствии N-метилморфолина. Пентапептид, ацетилированный по серину (III), получают гидрированием над Pd-чернью защищенного пентапептида BocAsp(OBzl)AlaSer(Bzl)GlyGlu(OBzl)2 в присутствии уксусной и/или муравьиной кислоты. Структура пентапетида подтверждена данными масс- и ЯМР-спектроскопии.
Пентапептид III растворяют в ДМФА, добавляют N-метилморфолин и образовавшуюся N-метилморофолиновую соль пентапептида конденсируют с пентафторфениловым эфиром Boc-защищенного тетрапетида в течение 16-47 ч, после чего растворитель упаривают. Полученный защищенный нонапептид деблокируют в муравьиной кислоте, а затем снимают ацетильную или формильную группу в щелочных условиях с использованием 0,1 - 2 М раствора NH4OH, NaOH или любого другого подходящего щелочного агента. Очистку пептида δ-сна проводят хроматографией на ДЕАЕ-сефадексе.
Чистота полученного по заявляемой схеме пептида δ-сна подтверждена данными ЯМР-1H-спектроскопии и ВЖХ на обращенной фазе.
Для ТСХ используют пластинки с силикагелем фирмы Merck N 5724 и хроматографические системы, указанные в табл. 1.
Обнаружение веществ проводят путем последовательной обработки пластинок хлором, а затем 2% водным раствором крахмала, содержащим 1% NaI и 0,1% NaN3. Упаривание растворов проводят на роторном испарителе при 30-40oC.
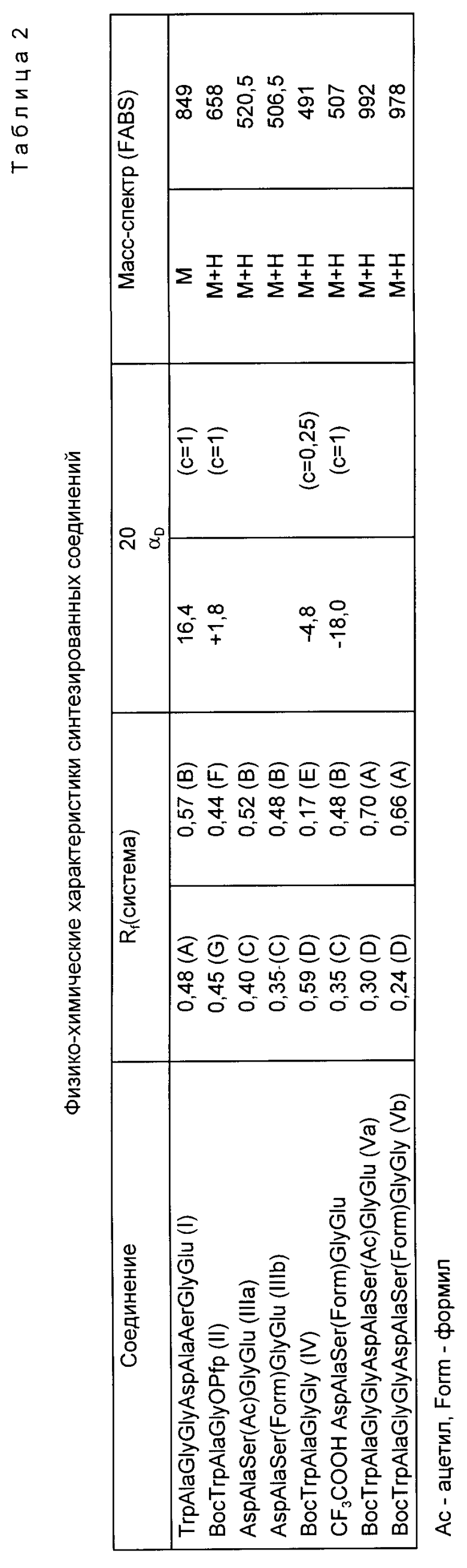
В табл. 2 приведены физико-химические характеристики целевого продукта и промежуточных пептидов, т.к. все промежуточные соединения являются новыми.
Изобретение иллюстрируется нижеследующими примерами.
Пример 1. BocTrpAlaGlyGly (IV).
14,2 г (0,05 моль) HBr•AlaGlyGly растворяют в 140 мл воды, добавляют 4,2 г (0,05 моль) NaHCO3, а затем - 28,2 г (0,06 моль) BocTrpOPfp в 200 мл ДМФА. Смесь перемешивают в течение 12 ч. Растворители упаривают досуха, полученное масло растворяют в 100 мл этилацетата, промывают 2 • 100 мл 10% раствора лимонной кислоты, затем - 2 • 100 мл 10% раствора NaCl, этилацетатный слой высушивают над Na2SO4 и упаривают. Получают 22,8 г (93%) пептида IV.
Пример 2. BocTrpAlaGlyGlyOPfp (II).
К 20 г (0,041 моль) пептида IV в 100 мл ДМФА добавляют 17,7 г (0,045 моль) дипентафторфенилкарбоната и 4,5 мл (0,041 моль) N-метилморфолина. Смесь перемешивают 12 ч, упаривают досуха и перекристаллизовывают из этилацетата. Получают 26,4 г (98%) пептида II.
Пример 3. AspAlaSer(Ac)GlyGlu (IIIa).
46,9 г (0,05 моль) пентапептида BocAsp(OBzl)AlaSer(Bzl)GlyGlu(OBzl)2 растворяют в смеси 500 мл уксусной и 50 мл муравьиной кислот. Добавляют 5 г 10% Pd-черни и гидрируют 80 ч. Смесь упаривают досуха, полученное масло обрабатывают этилацетатом. Получают 30,7 г (97%) пептида IIIa с небольшой примесью пептида IIIb.
Пример 4. AspAlaSer(Form)GlyGlu (IIIb).
К 46,9 г (0,05 моль) пентапептида BocAsp(OBzl)AlaSer(Bzl)GlyGlu(OBzl)2 добавляют 500 мл муравьиной кислоты и гидрируют в течение 60 ч над 5 г Pd-черни. По завершении гидрирования катализатор отфильтровывают, фильтрат упаривают досуха, полученное масло обрабатывают этилацетатом и получают 26,5 г (98%) пептида IIIb.
Пример 5. CF3COOH • AspAlaSer(Form) GlyGlu.
К 46,9 г (0,05 моль) пентапептида BocAsp(OBzl)AlaSer(Bzl)GlyGlu(OBzl)2 добавляют 500 мл муравьиной кислоты и гидрируют в течение 80 ч над 5 г Pd-черни. По завершении гидрирования катализатор отфильтровывают, к фильтрату добавляют 50 мл трифторуксусной кислоты и упаривают досуха. Полученное масло обрабатывают этилацетатом и получают 26,5 г (98%) трифторацетата пентапептида IIIb.
Пример 6. BocTrpAlaGlyGlyAspAlaSer(Form) GlyGlu (Vb).
2,37 г (3,6 ммоль) пептида II растворяют в 40 мл абс. ДМФА, добавляют 1,66 г (3 ммоль) пептапептида IIIb и 1,32 мл (12 ммоль) N-метилморфолина. Реакционную смесь перемешивают 18 ч, упаривают досуха и полученное масло обрабатывают 100 мл смеси этилацетат : уксусная кислота 10 : 1. Образовавшийся осадок отфильтровывают, промывают на фильтре 100 мл этилацетата, затем - 50 мл диэтилового эфира и высушивают в вакууме. Получают 3,69 (95%) нонапептида Vb, гомогенного по ТСХ. Аналогично получают соединение Va с выходом 92%.
Пример 7. TrpAlaGlyGlyAspAlaSerGlyGlu (I).
К 2,59 г (2 ммоль) пептида Vb добавляют 40 мл муравьиной кислоты и оставляют на 24 ч при 0 - 4oC. Реакционную смесь упаривают досуха, к образовавшемуся пептиду добавляют 20 мл 5% аммиака и оставляют при 4oC на 10 ч. Затем пептид лиофилизуют и хроматографируют на ДЕАЕ-сефадексе А-25 в ацетатной форме в 0,3 М ацетате аммония. Фракции, содержащие пептид δ-сна, лиофилизиуют и получают 1,60 г (1,84 ммоль, 90%) пептида I.
Аналогично получают пептид I, исходя из нонапептида Va, с выходом 90%.
Таким образом, заявляемый способ позволяет получать с большим выходом пептид δ-сна высокой степени чистоты.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА δ- СНА | 1995 |
|
RU2111215C1 |
| ПЕПТИДЫ, ОБЛАДАЮЩИЕ РЕГЕНЕРАТИВНО-РЕПАРАТИВНЫМ ДЕЙСТВИЕМ | 1994 |
|
RU2065445C1 |
| ПЕПТИДЫ, ОБЛАДАЮЩИЕ АНТИСТРЕССОРНЫМ, ПРОТИВОСУДОРОЖНЫМ И НЕЙРОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ | 1997 |
|
RU2115660C1 |
| ПЕПТИД, ОБЛАДАЮЩИЙ ЗАЩИТНЫМ ДЕЙСТВИЕМ ПРОТИВ ЯЩУРА ШТАММА A | 1992 |
|
RU2043363C1 |
| Способ получения пептида Ac-His-Ala-Glu-Glu-NH | 2021 |
|
RU2767030C1 |
| ФУЛЛЕРЕНОВОЕ ПРОИЗВОДНОЕ ГЛИКОПЕПТИДА, ОБЛАДАЮЩЕЕ АДЪЮВАНТНОЙ АКТИВНОСТЬЮ | 1997 |
|
RU2124022C1 |
| ГЕПТАПЕПТИД, ОБЛАДАЮЩИЙ СВОЙСТВАМИ ПСИХОСТИМУЛЯТОРА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ С ИММУНОТРОПНОЙ АКТИВНОСТЬ | 1983 |
|
RU1124544C |
| СПОСОБ ПОЛУЧЕНИЯ АНАЛОГОВ АДЕНОКОРТИКОТРОПНОГО ГОРМОНА (АКТГ), ПОСЛЕДОВАТЕЛЬНОСТИ (4-10), ОБЛАДАЮЩИХ НЕЙРОТРОПНОЙ АКТИВНОСТЬЮ, И ТЕТРАПЕПТИД ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2315057C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВТОРИЧНЫХ АМИНОВ | 1998 |
|
RU2148055C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИПСИХОТИЧЕСКОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2411248C2 |

Использование: в медицинской химии при получении пептипов, обладающих широким спектром физиологической активности. Сущность изобретения: усовершенствованный способ получения пептида δ-сна: Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu (I), включающий конденсацию пентафторфенилового эфира Boc-защищенного тетрапептида BocTrpAlaGlyGlyOPfp (II) с пентапептидом AspAlaSer(X)GlyGlu (III), где X - ацетил или формил, в диметилформамиде в присутствии N-метилморфолина, удаление Boc-группы муравьиной кислотой при температуре от -2 до +8oC, снятие ацетильной или формильной группы в щелочных условиях и хроматографическую очистку целевого продукта; гомогенный по данным ТСХ пептид δ-сна получают с выходом 65 - 80%. 2 табл., 1 ил.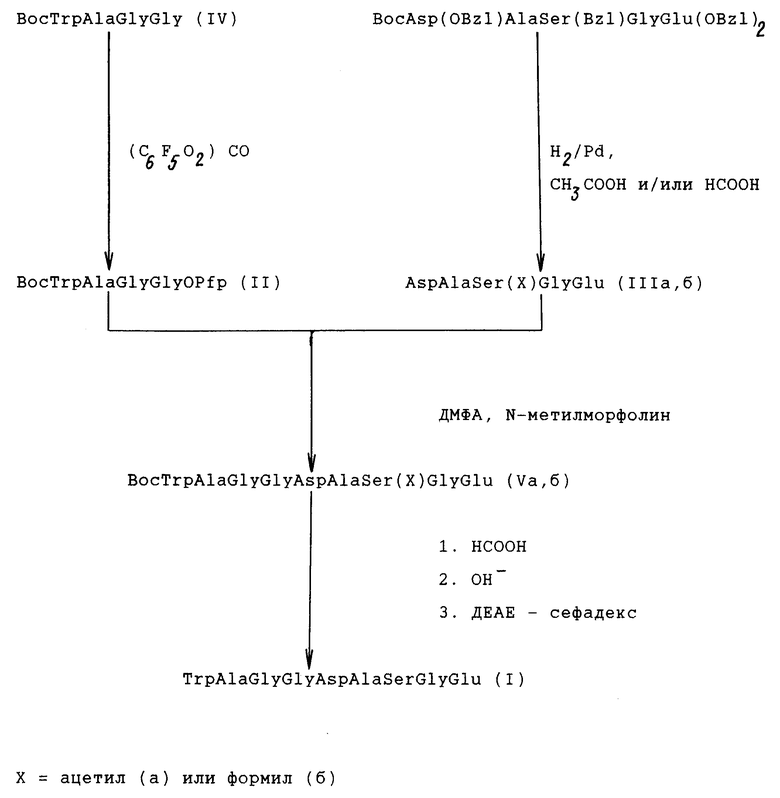
Способ получения пептида δ-сна формулы
Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu,
включающий конденсацию Nα-защищенного C-активированного тетрапептида Trp-Ala-Gly-Gly с пентапептидом Asp-Ala-Ser-Gly-Glu с последующим снятием защитных групп и хроматографической очисткой целевого продукта, отличающийся тем, что пентафторфениловый эфир Вос-защищенного тетрапептида формулы
Boc-Trp-Ala-Gly-Gly OPfp
конденсируют с пентапептидом формулы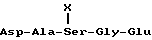
где X - ацетил или формил,
в диметилформамиде в присутствии N-метилморфолина, удаление Вос-группы осуществляют с помощью муравьиной кислоты при температуре -2 ... +8oC, а снятие ацетильной или формильной группы - в щелочных условиях.
Авторы
Даты
1998-05-27—Публикация
1995-04-07—Подача