Изобретение относится к области фармакологии и медицины и направлено на создание новых лекарственных препаратов, обладающих антипсихотической активностью. В качестве предложенного лекарственного препарата используют средство, обладающее антипсихотической активностью и представляющее пептид общей формулы 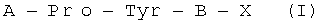 , где Pro может представлять собой DPro,
, где Pro может представлять собой DPro,
А выбирают из Ala, Gly, Ile, Leu, Met, Phe, Ser, Thr, Trp, Tyr, Val;
В выбирают из Ala, Arg, Gly, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val;
X - ОН; -ОСН3; -NH2; -Gly-Pro.
Изобретение расширяет арсенал антипсихотиков нового поколения, эффективных в терапии негативных и позитивных расстройств психики. Может быть использовано для коррекции негативных, позитивных и когнитивных расстройств, наблюдаемых у больных шизофренией и другими психозами, а именно для восстановления и повышения уровня работоспособности, обучаемости, социальной адаптации значительного контингента больных с психическими расстройствами.
Известна группа антипсихотиков непептидной природы (Клозапин, Кветиапин, Оланзапин, Рисперидон, Запрасидон, Регистр лекарственных средств России «Энциклопедия лекарств», 2006 г.). Эти препараты обладают рядом побочных эффектов, а именно вызывают развитие метаболического синдрома, повышая уровень сахара, холестерина, липидов в крови, ожирение, пролактинемию и связанных с ней аменорею, бесплодие, гиперплазию молочных желез у женщин, снижение либидо, эректильную дисфункцию у мужчин. Перечисленные побочные эффекты часто являются препятствием к использованию этих препаратов в клинике.
Процесс производства существующих атипичных антипсихотиков непептидной природы требует значительных затрат и налажен лишь в нескольких крупных зарубежных фирмах. Отечественных аналогов не существует.
В настоящее время доказано, что пептидэргические системы в тесном взаимодействии с системами биогенных аминов вовлечены в патогенез шизофрении. Перспективным направлением является создание нейролептиков с пептидэргическим механизмом действия. Ранее было показано, что эндогенный пептид нейротензин Pyr-Leu-Tyr-Glu-Asn-Lys-Pro-Arg-Arg-Pro-Tyr-Ile-Leu-OH, содержащий фрагмент -Pro-Tyr- (Tadashi Yoshimoto et al., J. Biol. Chem. 253(10), 3708-3716 (1978)), обладает некоторыми свойствами, характерными для нейролептиков. Он обнаруживает широкий спектр фармакологической активности, включая гипертензию, гипергликемию, увеличение проницаемости сосудов, секрецию гормона роста и гипотермические эффекты, имеет отношение к центральной регуляции поведенческих и соматических реакций организма (Carraway R. & Leeman S., 1973, Beadet A. et al., 1994).
Показано, что этот пептид, как и известные антипсихотики, является фармакологическим антагонистом дофаминомиметиков, что уровень этого пептида снижен в спинномозговой жидкости нелеченых больных шизофренией и повышается в результате терапии антипсихотиками.
Исследования, доказывающие вовлечение других нейромедиаторных систем в патогенез психических заболеваний, позволили расширить направление поиска новых антипсихотических препаратов. Вместе с тем до настоящего времени не существует пептидных препаратов с фармакологическим профилем антипсихотиков. Описанные в патенте С.Б.Середенина и соавторов (С.Б.Середенин, Т.А.Воронина, Т.А.Гудашева, Р.У.Островская и др., патент РФ 2091390, 1998 г.) Рrо-Tyr-содержащие соединения обладают сходными биологическими свойствами, но помимо вышеуказанной аминокислотной последовательности имеют в своей структуре химические заместители неприродного происхождения.
Техническим результатом, достигаемым при реализации данного изобретения, является разработка пептидных антипсихотиков, более эффективных и дешевых, чем существующие антипсихотики, а также свободных от их побочных эффектов, где в качестве лекарственного препарата используют средство, обладающеее антипсихотической активностью и представляющее пептид общей формулы  .
.
Указанный технический результат важен тем, что позволяет направленно синтезировать различные пептидные последовательности, отвечающие общей формуле  , где Pro может представлять собой DPro, а также проводить направленный скрининг антипсихотической активности синтезированных пептидов по стандартной программе.
, где Pro может представлять собой DPro, а также проводить направленный скрининг антипсихотической активности синтезированных пептидов по стандартной программе.
Указанный технический результат достигается тем, что используют средство, обладающее антипсихотической активностью и представляющее пептид общей формулы  , где Pro может представлять собой DPro,
, где Pro может представлять собой DPro,
А выбирают из Ala, Gly, Ile, Leu, Met, Phe, Ser, Thr, Trp, Tyr, Val;
В выбирают из Ala, Arg, Gly, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val;
X - ОН; -ОСН3; -NH2; -Gly-Pro.
С целью реализации данного изобретения синтезированы тетрапептиды формулы Val-Pro-Tyr-Phe, Met-Pro-Tyr-Ala, Met-Pro-Tyr-Arg, Met-Pro-Tyr-Phe, Met-DPro-Tyr-Phe, Trp-Pro-Tyr-Phe, Tyr-Pro-Tyr-Phe, Met-Pro-Tyr-Phe-OMe, Met-Pro-Tyr-Trp-OMe и гексапептид Met-Pro-Tyr-Pro-Gly-Pro, отвечающие общей формуле  , обладающие антипсихотической активностью, свойственной атипичным антипсихотикам. Приведенные аминокислотные последовательности, обладающие свойствами атипичных антипсихотиков, имеют общую закономерность, а именно наличие в структуре молекулы дипептида Pro-Туr в положениях 2, 3 вышеприведенных пептидов, где Pro может представлять собой DPro.
, обладающие антипсихотической активностью, свойственной атипичным антипсихотикам. Приведенные аминокислотные последовательности, обладающие свойствами атипичных антипсихотиков, имеют общую закономерность, а именно наличие в структуре молекулы дипептида Pro-Туr в положениях 2, 3 вышеприведенных пептидов, где Pro может представлять собой DPro.
Впервые обнаружена закономерность, что средство, обладающее антипсихотической активностью и представляющее пептид общей формулы  , где Pro может представлять собой DPro,
, где Pro может представлять собой DPro,
А выбирают из Ala, Gly, Ile, Leu, Met, Phe, Ser, Thr, Trp, Tyr, Val;
В выбирают из Ala, Arg, Gly, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val;
X - ОН; -ОСН3; -NH2; -Gly-Pro,
проявляет свойства атипичных антипсихотиков. Эта закономерность подтверждена синтезом ряда пептидов, данными радиорецепторного анализа способности этих пептидов взаимодействовать с рецепторами - мишенями атипичных антипсихотиков - и поведенческими тестами.
Исходя из результатов проведенных исследований можно заключить, что пептиды, отвечающие общей формуле  , где Pro может представлять собой DPro, могут быть использованы для создания новых лекарственных препаратов с антипсихотической активностью.
, где Pro может представлять собой DPro, могут быть использованы для создания новых лекарственных препаратов с антипсихотической активностью.
Некоторые пептиды общей формулы  представлены в таблице 1.
представлены в таблице 1.
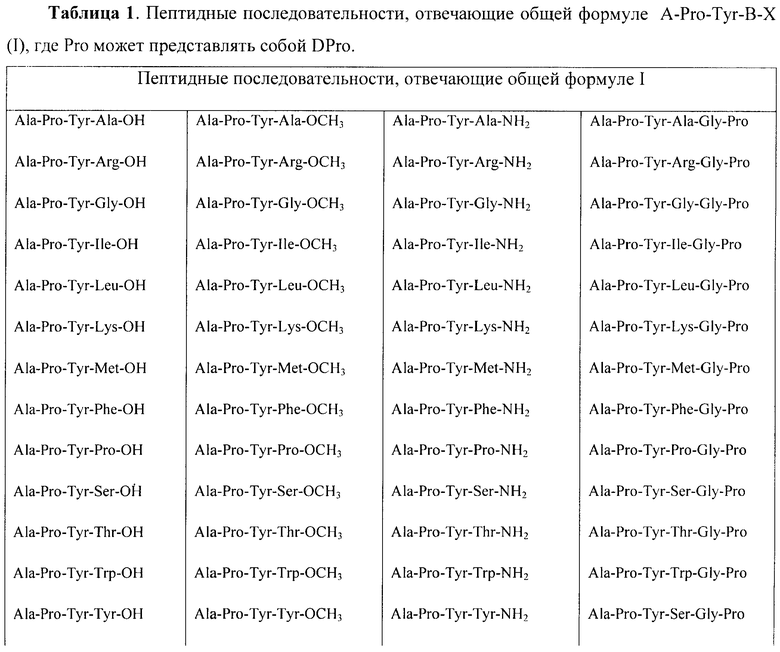

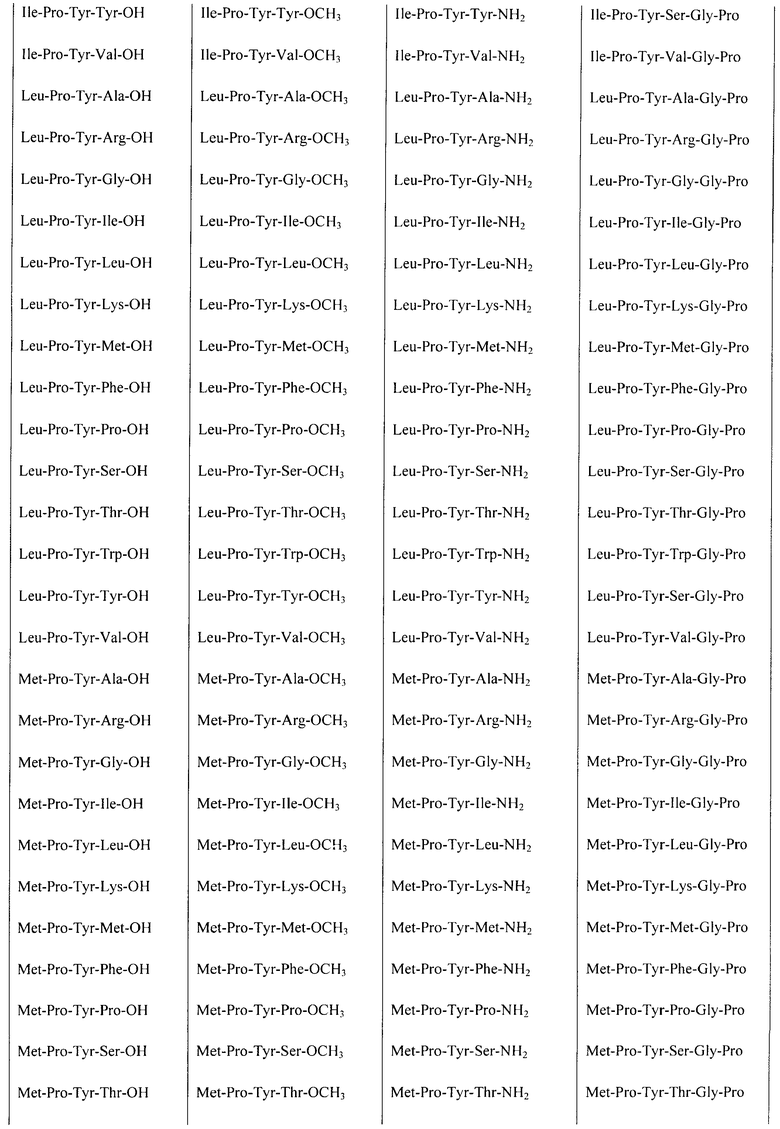





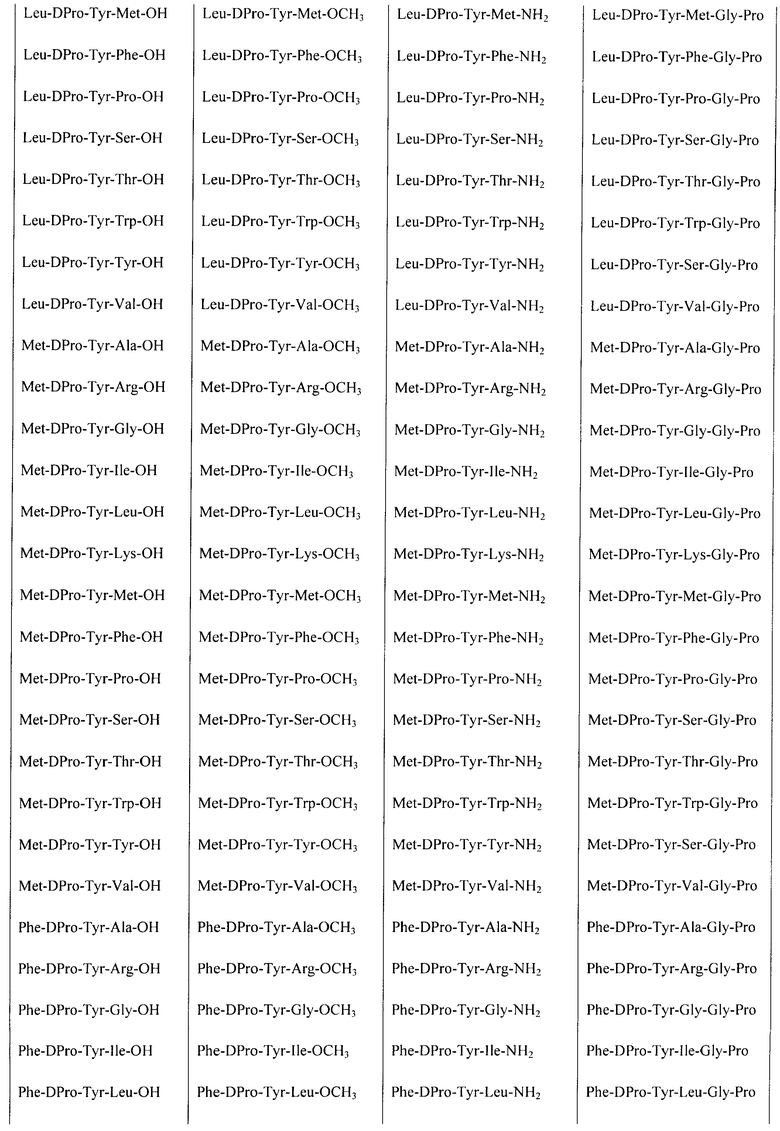



Все представленные в таблице 1 пептиды обладают в разной степени выраженными свойствами атипичных антипсихотиков и могут быть использованы в качестве средства, обладающего антипсихотической активностью.
Ниже приведены примеры подтверждающие это.
Синтез пептидов общей формулы  , где Pro может представлять собой DPro, осуществляли методами пептидной химии как в растворе, так и твердофазным методом синтеза с использованием L и D аминокислот, предварительно защищенных соответствующим образом, и свободных аминокислот. Синтез пептидов в растворе проводился как ступенчатым наращиванием пептидной цепи, так и фрагментной конденсацией с применением метода смешанных ангидридов, карбодиимидного метода с добавлением 1-оксибензотриазола в качестве нуклеофильной добавки, методом активированных эфиров. Все промежуточные и конечные продукты были выделены и охарактеризованы. Упаривание растворов проводили на вакуумном испарителе при 40°С. Температуры плавления, определенные на столике для плавления Boetiys, даны без исправления. Индивидуальность полученных соединений проверяли с помощью ТСХ на пластинках с силикагелем фирмы Silufol (Чехия). Вещества обнаруживали, опрыскивая пластинки раствором нингидрина. Удельное вращение определяли на поляриметре марки «А1-ЕПО», элементный анализ - на анализаторе "Carlo-Erba" модель 1106.
, где Pro может представлять собой DPro, осуществляли методами пептидной химии как в растворе, так и твердофазным методом синтеза с использованием L и D аминокислот, предварительно защищенных соответствующим образом, и свободных аминокислот. Синтез пептидов в растворе проводился как ступенчатым наращиванием пептидной цепи, так и фрагментной конденсацией с применением метода смешанных ангидридов, карбодиимидного метода с добавлением 1-оксибензотриазола в качестве нуклеофильной добавки, методом активированных эфиров. Все промежуточные и конечные продукты были выделены и охарактеризованы. Упаривание растворов проводили на вакуумном испарителе при 40°С. Температуры плавления, определенные на столике для плавления Boetiys, даны без исправления. Индивидуальность полученных соединений проверяли с помощью ТСХ на пластинках с силикагелем фирмы Silufol (Чехия). Вещества обнаруживали, опрыскивая пластинки раствором нингидрина. Удельное вращение определяли на поляриметре марки «А1-ЕПО», элементный анализ - на анализаторе "Carlo-Erba" модель 1106.
Пептиды, синтезированные автоматическим твердофазным методом, синтезированы по Fmoc-схеме на полимере Ринка с использованием DEPCDI/HOBt метода активации аминокислот. Проверку гомогенности полученных пептидов проводили с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) на жидкостном микроколоночном хроматографе «Миллихром А-02». Синтезированные пептиды были охарактеризованы при помощи масс-спектрометрии на масс-спектрометре фирмы Bruker (®Bruker Daltonik GmbH). Растворители, используемые при синтезе пептидов, абсолютировали соответствующим образом.
Приведены хроматографические подвижности (Rf) в системах растворителей, использованные при синтезе пептидов в растворе:
(ацетон:бензол:уксусная кислота) (50:100:1); (бензол: этанол) (8:2); (хлороформ:метанол) (9:1); (хлороформ, насыщ. аммиаком: метанол) (9:1); (хлороформ:метанол:аммиак) (8:1,75:0,25); (бутанол:уксусная кислота:вода) (4:1:1); (хлороформ:метанол:аммиак) (6:4:1); (бутанол: уксусная кислота: пиридин: вода) (30:6:20:24); (гексан: ацетон) (3:2); (изо-пропанол:муравьиная кислота:вода) (20:5:1).
Принятые сокращения:
Ala - аланин; Arg - аргинин; Gly - глицин; Ile - изолейцин; Leu - лейцин; Lys - лиизин; Met - метионин; Phe - фенилаланин; Pro - пролин; Ser- серин; Туr - тирозин; Thr - треонин; Trp - триптофан; Val - валин.
AcN - ацетонитрил
Bzl - бензил
Воc - трет-бутилоксикарбонил
ДЦГК - N,N'-дициклогексилкарбодиимид
ДМФА - диметилформамид
NH2 - амид
ОБТ - 1-оксибензотриазол
OBzl - бензиловый эфир
ОМе или (ОСНз) - метиловый эфир
OPfp - пентафторфениловый эфир
PivCl - пивалоилхлорид
ТСХ - тонкослойная хроматография
ТФУ - трифторуксусная кислота
ТФА - трифторацетат
ТЭА - триэтиламин
На примере синтеза тетрапептидов Met-Pro-Tyr-Phe; Met-Pro-Tyr-Phe-OMe; Tyr-Pro-Tyr-Phe и гексапептида Met-Pro-Tyr-Pro-Gly-Pro показан общий подход при синтезе пептидов формулы (I) в растворе.
Пример 1.
Синтез тетрапептида Met-Pro-Tyr-Phe.
I. Получение Boc-Tyr(Bzl)-Phe-OBzl.
5,5 г (15 ммоль, избыток 1,1) Boc-Tyr(Bzl)-OH помещали в плоскодонную колбу, растворяли в 75 мл ацетонитрила, к раствору добавляли 2,16 г (18 ммоль; избыток 1,2) ОБТ (1-оксибензотриазола), охлаждали до 0°С и добавляли 4,06 г (18 ммоль) ДЦГК (N,N'-дициклогексилкарбодиимида). Перемешивали 1 час на магнитной мешалке при температуре 0°С. Затем к реакционной смеси добавляли ранее приготовленный и охлажденный раствор 13,6 ммоль (4,0 г) HCl·H-Phe-OBzl с ТЭА (2,1 мл, 15 ммоль) в 30 мл ацетонитрила (рН раствора должен быть 8-9). Реакционную смесь перемешивали 1 час при 0°С и трое суток при комнатной температуре. Реакционную смесь отфильтровывали, упаривали, к упаренному остатку добавляли 200 мл этилацетата. Этилацетатный раствор промывали 3 раза по 20 мл Н2O, 3 раза по 20 мл 10% раствором KHSO4, 3 раза по 20 мл Н2О, 3 раза по 20 мл 5% раствором NaHCO3, 3 раза по 20 мл Н2О, 1 раз 20 мл насыщенным раствором NaCl. Раствор этилацетата сушили в течение 30 минут над прокаленным MgSO4. Высушенный раствор этилацетата отфильтровывали, упаривали. Остаток высаждали из эфира гексаном. Полученный продукт сушили в вакууме над P2O5, КОН и парафином.
Выход 7,76 г (12,75 ммоль) (85%)
Т.пл. 74-76°С
[α]D 22=-11,374 (с=1, метанол)
Rf: 0,706 (ацетон:бензол:уксусная кислота) (50:100:1)
0,843 (бензол: этанол) (8:2)
Мол. масса 608,71
Брутто-формула С35Н42N2О8
II. Получение ТФА·Н-Тyr(Вzl)-Рhе-ОВzl.
К 7,0 г (11,5 ммоль) Boc-Tyr(Bzl)-Phe-OBzl прибавляли 28,8 мл хлористого метилена и 28,8 мл ТФУ, выдерживали 45 минут при комнатной температуре, после снятия защитной группы раствор два раза упаривали с абс. метанолом, два раза с бензолом, два раза с эфиром, упаренный остаток растворяли в минимальном объеме бензола и заливали гексаном. Гексан сливали, а полученный остаток сушили в вакууме над Р2O5, КОН и парафином, несколько раз меняя осушители.
Выход 7,0 г (11,25 ммоль) (97,8%)
Rf: 0,341 (бензол:этанол) (8:2)
0,138 (хлороформ:метанол) (9:1)
0,544 (хлороформ, насыщ. аммиаком:метанол) (9:1)
Мол. масса 622,6
Брутто-формула C2HF3O2·C32H32N2O4
III. Получение Boc-Pro-Tyr(Bzl)-Phe-OBzl.
2,51 г (10 ммоль, избыток 1,1) Boc-Pro-OH помещали в плоскодонную колбу, растворяли в 50 мл ацетонитрила, к раствору добавляли 1,6 г (12 ммоль; избыток 1,2) ОБТ (1-оксибензотриазола), охлаждали до 0°С и добавляли 2,7 г (12 ммоль) ДЦГК (N,N'-дициклогексилкарбодиимида). Перемешивали 1 час на магнитной мешалке при температуре 0°С. Затем к реакционной смеси добавляли ранее приготовленный и охлажденный раствор 9,1 ммоль (5,66 г) TФA·H·Tyr(Bzl)-Phe-OBzl с ТЭА (1,4 мл, 10 ммоль, избыток 1,1) в 20 мл ацетонитрила (рН раствора должен быть 8-9). Реакционную смесь перемешивали 1 час при 0°С и трое суток при комнатной температуре. Реакционную смесь отфильтровывали, упаривали, к упаренному остатку добавляли 100 мл этилацетата. Этилацетатный раствор промывали 3 раза по 10 мл Н2О, 3 раза по 10 мл 10% раствором KHSO4, 3 раза по 10 мл H2О, 3 раза по 10 мл 5% раствором NaHCO3, 3 раза по 10 мл H2O, 1 раз 10 мл насыщенным раствором NaCl. Раствор этилацетата сушили в течение 30 минут над прокаленным MgSO4. Высушенный раствор этилацетата отфильтровывали, упаривали. Остаток высаждали из этилацетата гексаном. Полученный продукт сушили в вакууме над Р2O5, КОН и парафином.
Выход 5,43 г (7,5 ммоль) (75%)
Т.пл. 98-100°С
[α]D 22= -65,84 (с=1, метанол)
Rf: 0,614 (бензол:этанол) (8:2)
0,714 (хлороформ:метанол) (9:1)
0,650 (ацетон:бензол:уксусная кислота) (50:100:1)
Мол. масса 723,83
Брутто-формула C42H49N3O8
IV. Получение Boc-Pro-Tyr-Phe-OH.
5 г (7 ммоль) Boc-Pro-Tyr(Bzl)-Phe-OBzl растворяли в 50 мл метанола, прибавляли 0,1 мл СН3СООН и палладиевую чернь, перемешивая на магнитной мешалке, пропускали водород в течение 2 часов. Раствор отфильтровывали, упаривали, 2 раза упаривали с бензолом, 1 раз с эфиром, добавляли 10 мл эфира и заливали гексаном, при добавлении гексана выпадал осадок, гексан сливали, а осадок в колбе сушили в эксикаторе над P2O5/KOH и парафином.
Выход 3,57 г (6,17 ммоль) (88,2%)
Т.пл. 90-92°С
[α]D 22=- 76,94 (с=1, метанол)
Rf: 0,320 (хлороформ:метанол:аммиак) (8:1,75:0,25)
Мол. масса 525,58
Брутто-формула С28Н35N3O7
V. Получение ТФА·H-Pro-Tyr-Phe-OH.
К 2,6 г (5 ммоль) Boc-Pro-Tyr-Phe-OH прибавляли 12,5 мл хлористого метилена и 12,5 мл ТФУ, 1% анизола, выдерживали 45 минут при комнатной температуре, после снятия защитной группы раствор два раза упаривали с абс. метанолом, два раза с бензолом, два раза с эфиром, упаренный остаток растворяли в минимальном объеме бензола и заливали гексаном. Гексан сливали, а полученное масло сушили в вакууме над Р2O5, КОН и парафином, несколько раз меняя осушители.
Выход 2,56 г (4,89 ммоль) (97,8%)
Rf: 0,287 (хлороформ:метанол:аммиак) (7:2,5:0,5)
0,145 (хлороформ:метанол:аммиак) (6:4:1)
Мол. масса 523,47
Брутто-формула С2НF3O2·С23Н27N3O4
VI. Получение Boc-Met-Pro-Tyr-Phe-OH.
2,56 г (4 ммоль) ТФА·H-Pro-Tyr-Phe-OH растворяли в 30 мл диметилформамида, прибавляли 1,36 мл (8 ммоль) N,N'-диизопропилэтиламина и затем по каплям раствор Boc-Met-OPfp 1,83 г (4,4 ммоль, изб. 1,1) в 10 мл ДМФА (диметилформамида). Выдерживали при перемешивании на магнитной мешалке 3 часа. Реакционную смесь упаривали. Остаток высаждали из этилацетата гексаном. Выпавший осадок отфильтровывали, промывая на фильтре гексаном. Полученный продукт отфильтровывали и сушили в эксикаторе под вакуумом над P2O5, КОН и парафином, несколько раз меняя осушители.
Выход 2,37 г (3,62 ммоль); (90.5%)
Т.пл. 101-103°С
[α]D 22=- 65,49 (с=1, метанол)
Rf: 0,687 (этилацетат:ацетон:уксусная кислота 50%) (2:1:1);
0,428 (хлороформ:метанол:аммиак) (8:1,75:0,25);
0,217 (бутанол: уксусная кислота:вода) (4:1:1).
Мол. масса 656,81
Брутто-формула C33H44N4O8S
VII. Получение HCl·H-Met-Pro-Tyr-Phe-OH.
К 1,97 г (3 ммоль) Boc-Met-Pro-Tyr-Phe-OH прибавляли 4,5 мл 1 н. HCl/СН3СООН) и 1% анизола, выдерживали 45 минут при комнатной температуре, после снятия Вос-группы реакционную смесь заливали гексаном. Гексан сливали, а полученный осадок сушили в эксикаторе под вакуумом над Р2O5/КОН и парафином. К высушенному осадку добавляли абс. этилацетат, упаривали на роторном испарителе, добавляли 5 мл абс. этилацетата и высаждали сухим эфиром не содержащего перекиси. При добавлении эфира выпадает осадок, который отфильтровывали. Осадок сушили в эксикаторе под вакуумом над Р2O5/КОН и парафином (белый в виде белого порошка).
Выход 2,37 г (2,67 ммоль); (89%)
Т.пл. 110-112°С
[α]D 22=- 32,59 (с=1, метанол)
Rf: 0,465 (хлороформ:метанол:аммиак) (6:4:1)
Мол. масса 593,22
Брутто-формула НСl·С28Н36N4O6S
Элементный анализ: С 56,50 (56,68); N 9,40 (9,44); Н 6,05 (6,11)
Результаты ВЭЖХ: колонка Prontosil 120-5-C18 AQ, размер 2,0×0,75 мм; объем 2,0 µ1, скорость подачи 100 мкл/мин; температура 35°С, давление 1,6 МПа; элюент А: 0,2 М LiClO4+5 mM HClO4; элюент В: AcN; линейный градиент, время выхода 26 мин.
Пример 2.
Синтез тетрапептида Met-Pro-Tyr-Phe-OMe.
I. Получение Boc-Tyr-Phe-OMe.
4,2 г (15 ммоль, избыток 1,1) Вос-Tyr-ОН помещали в плоскодонную колбу, растворяли в 75 мл ацетонитрила, к раствору добавляли 2,16 г (18 ммоль; избыток 1,2) ОБТ (1-оксибензотриазола), охлаждали до 0°С и добавляли 4,06 г (18 ммоль) ДЦГК (N,N'-дициклогексилкарбодиимида). Перемешивали 1 час на магнитной мешалке при температуре 0°С. Затем к реакционной смеси добавляли ранее приготовленный и охлажденный раствор 13,6 ммоль (2,9 г) HCl·H-Phe-OMe с ТЭА (2,1 мл, 15 ммоль) в 30 мл ацетонитрила (рН раствора должен быть 8-9). Реакционную смесь перемешивали 1 час при 0°С и трое суток при комнатной температуре. Реакционную смесь отфильтровывали, упаривали, к упаренному остатку добавляли 200 мл этилацетата. Этилацетатный раствор промывали 3 раза по 20 мл Н2О, 3 раза по 20 мл 10% раствором KHSO4, 3 раза по 20 мл Н2О, 3 раза по 20 мл 5% раствором NaHCO3, 3 раза по 20 мл Н2О, 1 раз 20 мл насыщенным раствором NaCl. Раствор этилацетата сушили в течение 30 минут над прокаленным MgSO4. Высушенный раствор этилацетата отфильтровывали, упаривали. Остаток высаждали из эфира гексаном. Полученный продукт сушили в вакууме над P2O5, КОН и парафином.
Выход 5,64 г (12,75 ммоль) (87%)
Т.пл. 85-87°С
[α]D 22=- 61,88 (с=1, метанол)
Rf: 0,756 (ацетон:бензол:уксусная кислота) (50:100:1)
0,910 (бензол:этанол) (8:2)
Мол. масса 442,49
Брутто формула C24H30N2O6
II. Получение ТФА-Tyr-Phe-OMe.
К 4,42 г (10 ммоль) Boc-Tyr-Phe-OMe прибавляли 25 мл хлористого метилена и 25 мл ТФУ, 1% анизола, выдерживали 45 минут при комнатной температуре, после снятия защитной группы раствор два раза упаривали с абс. метанолом, два раза с бензолом, два раза с эфиром, упаренный остаток растворяли в минимальном объеме бензола и заливали гексаном. Гексан сливали, а полученное масло сушили в вакууме над Р2O5, КОН и парафином, несколько раз меняя осушители.
Выход 4,47 г (9,8 ммоль) (98%)
Rf: 0,450 (бензол:этанол) (8:2)
0,283 (хлороформ:метанол) (9:1)
0,538 (хлороформ, насыщ. аммиаком:метанол) (9:1)
Мол. масса 456,42
Брутто-формула С2НF3O2·С19Н22N2O4
III. Получение Boc-Pro-Tyr-Phe-OMe.
2,07 г (9,36 ммоль, избыток 1,1) Boc-Pro-OH помещали в плоскодонную колбу, растворяли в 75 мл ацетонитрила, к раствору добавляли 1,39 г (10,3 ммоль; избыток 1,2) ОБТ (1-оксибензотриазола), охлаждали до 0°С и добавляли 2,33 г (10,3 ммоль) ДЦГК (N,N'-дициклогексилкарбодиимида). Перемешивали 1 час на магнитной мешалке при температуре 0°С. Затем к реакционной смеси добавляли ранее приготовленный и охлажденный раствор 8,76 ммоль (4,0 г) ТФА·H-Tyr-Phe-OBzl с ТЭА (1,35 мл, 9,6 ммоль) в 30 мл ацетонитрила (рН раствора должен быть 8-9). Реакционную смесь перемешивали 1 час при 0°С и трое суток при комнатной температуре. Реакционную смесь отфильтровывали, упаривали, к упаренному остатку добавляли 200 мл этилацетата. Этилацетатный раствор промывали 3 раза по 20 мл Н2О, 3 раза по 20 мл 10% раствором KHSO4, 3 раза по 20 мл H2O, 3 раза по 20 мл 5% раствором NаНСО3, 3 раза по 20 мл H2О, 1 раз (20 мл) насыщенным раствором NaCl. Раствор этилацетата сушили в течение 30 минут над прокаленным MgSO4. Высушенный раствор этилацетата отфильтровывали, упаривали. Остаток высаждали из этилацетата гексаном. Полученный продукт сушили в вакууме над P2O5, КОН и парафином.
Выход 3,88 г (7,62 ммоль) (87%)
Т.пл. 108-110°С
[α]D 22=-56,87 (с=1, метанол)
Rf: 0,320 (ацетон:бензол:уксусная кислота) (50:100:1)
0,520 (бензол:этанол) (8:2) 0,680 (хлороформ:метанол) (9:1)
Мол. масса 509,58
Брутто-формула С28Н35Н3О6
IV. Получение ТФА-Pro-Tyr-Phe-OMe.
К 3,56 г (7,0 ммоль) Boc-Pro-Tyr-Phe-OMe прибавляли 17,5 мл хлористого метилена и 17,5 мл ТФУ, 1% анизола, выдерживали 45 минут при комнатной температуре, после снятия защитной группы раствор два раза упаривали с абс. метанолом, два раза с бензолом, два раза с эфиром, упаренный остаток растворяли в минимальном объеме бензола и заливали гексаном. Гексан сливали, а полученное масло сушили в вакууме над Р2O5, КОН и парафином, несколько раз меняя осушители.
Выход 4,47 г (7,72 ммоль) (96%)
Rf: 0,190 (бензол:этанол) (8:2)
0,250 (хлороформ:метанол) (9:1)
0,345 (хлороформ, насыщ. аммиаком:метанол) (9:1)
Мол. масса 523,5
Брутто-формула С2НF3O2·С23Н27N3O4
V. Получение Boc-Met-Pro-Tyr-Phe-OMe.
2,6 г (5,0 ммоль) ТФА·H-Pro-Tyr-Phe-OMe растворяли в 30 мл диметилформамида, прибавляли 1,74 мл (10,0 ммоль, 2-кратный избыток) N,N'-диизопропилэтиламина и затем по каплям раствор Boc-Met-OPfp 2,5 г (6 ммоль, избыток 1,2) в 25 мл диметилформамида. Выдерживали при перемешивании на магнитной мешалке 3 часа при комнатной температуре. Реакционную смесь упаривали, добавляли 150 мл этилацетата. Этилацетатный раствор промывали Н2О (3 раза по 15 мл), 10% раствором KHSO4 (3 раза по 15 мл), Н2О (3 раза по 15 мл), 5% раствором NаНСО3 (3 раза по 15 мл), Н2О (3 раза по 15 мл), насыщенным раствором NaCl (1 раз 15 мл). Раствор этилацетата сушили над MgSO4, отфильтровывали, упаривали. Продукт высаждали из этилацетата гексаном. Полученный осадок отфильтровывали и сушили в вакууме над P2O5, КОН и парафином, несколько раз меняя осушители.
Выход 2,58 г (3,92 ммоль); (78,5%)
Т.пл.110-112°С
[α]D 22=- 52,15 (с=1, метанол)
Rf: 0,710 (хлороформ:метанол) (9:1)
0,244 (ацетон:бензол: уксусная кислота) (50:100:1),
0,763 (хлороформ, насыщ. аммиаком:метанол) (9:1)
Мол. масса 657,77
Брутто-формула C33H44N40O8S
VI. Получение HCl·H-Met-Pro-Tyr-Phe-OMe.
К 2,0 г (3,0 ммоль) Boc-Met-Pro-Tyr-Phe-OMe прибавляли 4,5 мл 1н HCl/СН3СООН, 1% анизола, выдерживали 45 минут при комнатной температуре. После снятия защитной группы реакционную смесь заливали гексаном, гексан сливали, а полученное вещество сушили в вакууме. Высушенное вещество растворяли в 5 мл абс. метанола и переосаждали сухим эфиром. Выпавший осадок отфильтровывали, сушили в эксикаторе под вакуумом, несколько раз меняя осушители (P2O5, КОН и парафин).
Выход 3,8 г (2,7 ммоль) (90%)
Т.пл.115-117°С
[α]D 22=-16,12 (с=1; метанол)
Rf: 0,632 (хлороформ:метанол:аммиак) (6:4:1)
0,883 (бутанол:уксусная кислота:пиридин:вода) (30:6:20:24)
Мол. масса 611,16
Брутто-формула HCl·C28H36N4O9S
Элементный анализ: С 55,06 (55,02); N 9,08 (9,16); Н 5,87 (5,93)
Результаты ВЭЖХ: колонка Prontosil 120-5-C18 AQ, размер 2,0×0,75 мм; объем 2,0 µl, скорость подачи 100 мкл/мин; температура 35°С, давление 1,6 МПа; элюент А: 0,2 М LiClO4+5 mM HClO4; элюент В: AcN; линейный градиент, время выхода 21,5 мин.
Пример 3.
Синтез тетрапептида H-Tyr-Pro-Tyr-Phe-OH.
I. Получение DiBoc-Tyr-Pro-OBzl.
4,7 г (12,32 ммоль) DiBoc-Tyr помещали в плоскодонную колбу, растворяли в 100 мл ацетонитрила, к раствору добавляли 2,0 г (14,78 ммоль; избыток 1,2) ОБТ (1-оксибензотриазол), охлаждали до 0°С и добавляли 3,34 г (14,78 ммоль) (N,N'-дициклогексилкарбодиимида) ДЦГК. Перемешивали 1 час на магнитной мешалке при температуре 0°С. Затем к реакционной смеси добавляли ранее приготовленный и охлажденный раствор HCl·H-Pro-OBzl 13,6 г (14,78 ммоль; избыток 1,2) с ТЭА (2,1 мл, 14,78 ммоль) в 50 мл ацетонитрила (рН раствора должен быть 8-9). Реакционную смесь перемешивали 1 час при 0°С и трое суток при комнатной температуре. Реакционную смесь отфильтровывали, упаривали, к упаренному остатку добавляли 300 мл этилацетата. Этилацетатный раствор промывали 3 раза по 20 мл Н2О, 3 раза по 20 мл 10% раствором KHSO4, 3 раза по 20 мл Н2О, 3 раза по 20 мл 5% раствором NaHCO3, 3 раза по 20 мл Н2О, 1 раз (20 мл) насыщенным раствором NaCl. Раствор этилацетата сушили в течение 30 минут над прокаленным MgSO4. Высушенный раствор этилацетата отфильтровывали, упаривали. Остаток высаждали из эфира гексаном. Полученный продукт сушили в вакууме над Р2О5, КОН и парафином.
Выход 4,80 г (8,44 ммоль) (68,5%)
Т.пл. 98-100°С
[α]D 22=- 61,88 (с=1, метанол)
Rf: 0,923 (хлороформ:метанол) (9:1)
0,800 (ацетон:бензол:уксусная кислота) (50:100:1)
0,750 (бензол: этанол) (8:2)
Мол. масса 568,65
Брутто-формула C31H40N2O8
II. Получение DiBoc-Tyr-Pro-OH.
4,8 г (8,44 ммоль) DiBoc-Tyr-Pro-OBzl растворяли в 100 мл метанола, прибавляли 0,2 мл СНзСООН и палладиевую чернь, перемешивая на магнитной мешалке, пропускали водород в течение 2 часов. Раствор отфильтровывали, упаривали, 2 раза упаривали с бензолом, 1 раз с эфиром, добавляли 10 мл эфира и заливали гексаном, при добавлении гексана выпадал осадок, гексан сливали, а осадок в колбе сушили в эксикаторе над P2O5, KOH и парафином.
Выход 3,57 г (7,46 ммоль) (88,4%)
Т.пл. 101-103°С
[α]D 22=-11,37 (с=1, метанол)
Rf: 0,577 (хлороформ:метанол) (9:1)
0,540 (бензол:этанол) (8:2)
0,545 (ацетон:бензол:уксусная кислота) (50:100:1)
Мол. масса 478,6
Брутто-формула C24H34N2O8
III. Получение Boc-Tyr(Bzl)-Phe-OBzl
5,5 г (15 ммоль, избыток 1,1) Boc-Tyr(Bzl)-OH помещали в плоскодонную колбу, растворяли в 75 мл ацетонитрила, к раствору добавляли 2,16 г (18 ммоль; избыток 1,2) ОБТ (1-оксибензотриазола), охлаждали до 0°С и добавляли 4,06 г (18 ммоль) ДЦГК (N,N'-дициклогексилкарбодиимида). Перемешивали 1 час на магнитной мешалке при температуре 0°С. Затем к реакционной смеси добавляли ранее приготовленный и охлажденный раствор 13,6 ммоль (4,0 г) HCl·H-Phe-OBzl с ТЭА (2,1 мл, 15 ммоль) в 30 мл ацетонитрила (рН раствора должен быть 8-9). Реакционную смесь перемешивали 1 час при 0°С и трое суток при комнатной температуре. Реакционную смесь отфильтровывали, упаривали, к упаренному остатку добавляли 200 мл этилацетата. Этилацетатный раствор промывали 3 раза по 20 мл Н2О, 3 раза по 20 мл 10% раствором KHSO4, 3 раза по 20 мл Н2О, 3 раза по 20 мл 5% раствором NaHCO3, 3 раза по 20 мл H2O, 1 раз (20 мл) насыщенным раствором NaCl. Раствор этилацетата сушили в течение 30 минут над прокаленным MgSO4. Высушенный раствор этилацетата отфильтровывали, упаривали. Остаток высаждали из эфира гексаном. Полученный продукт сушили в вакууме над P2O5, КОН и парафином.
Выход 7,76 г (12,75 ммоль) (85%)
Т.пл. 74-76°С
[α]D 22=-12,37 (с=1, метанол)
Rf: 0,706 (ацетон:бензол:уксусная кислота) (50:100:1)
0,843 (бензол: этанол) (8:2)
Мол. масса 608,71
Брутто-формула C35H42N2O8
IV. Получение TФA·H-Tyr(Bzl)-Phe-OBzl.
К 7,0 г (11,5 ммоль) Boc-Tyr(Bzl)-Phe-OBzl прибавляли 28,8 мл хлористого метилена и 28,8 мл ТФУ, выдерживали 45 минут при комнатной температуре, после снятия защитной группы раствор два раза упаривали с абс. метанолом, два раза с бензолом, два раза с эфиром, упаренный остаток растворяли в минимальном объеме бензола и заливали гексаном. Гексан сливали, а полученное масло сушили в вакууме над Р2O5, КОН и парафином, несколько раз меняя осушители.
Выход 7,0 г (11,25 ммоль) (97,8%)
Rf: 0,341 (бензол:этанол) (8:2)
0,138 (хлороформ:метанол) (9:1)
0,544 (хлороформ, насыщ. аммиаком:метанол) (9:1)
Мол. масса 622,6
Брутто-формула C2HF3O2·C32H32N2O4
V. Получение DiBoc-Tyr-Pro-Tyr(Bzl)-Phe-OBzl.
3,0 г (6,26 ммоль, избыток 1,1) DiBoc-Tyr-Pro-OH помещали в плоскодонную колбу, растворяли в 50 мл ацетонитрила, к раствору добавляли 1,0 г (7,5 ммоль; избыток 1,2) ОБТ (1-оксибензотриазола), охлаждали до 0°С и добавляли 1,7 г (7,5 ммоль) ДЦГК (N,N'-дициклогексилкарбодиимида). Перемешивали 1 час на магнитной мешалке при температуре 0°С. Затем к реакционной смеси добавляли ранее приготовленный и охлажденный раствор 5,7 ммоль (3,55 г) TФA·H-Tyr(Bzl)-Phe-OBzl с ТЭА (0,88 мл, 6,27 ммоль) в 20 мл ацетонитрила (рН раствора должен быть 8-9). Реакционную смесь перемешивали 1 час при 0°С и трое суток при комнатной температуре. Реакционную смесь отфильтровывали, упаривали, к упаренному остатку добавляли 150 мл этилацетата. Этилацетатный раствор промывали 3 раза по 15 мл Н2О, 3 раза по 15 мл 10% раствором KHSO4, 3 раза по 15 мл Н2О, 3 раза по 15 мл 5% раствором NaHCO3, 3 раза по 15 мл Н2О, 1 раз 15 мл насыщенным раствором NaCl. Раствор этилацетата сушили в течение 30 минут над прокаленным MgSO4. Высушенный раствор этилацетата отфильтровывали, упаривали. Остаток высаждали из этилацетата гексаном. Полученный продукт сушили в вакууме над Р2O5, КОН и парафином.
Выход 4,65 г (4,8 ммоль) (85%)
Т.пл. 98-102°С
[α]D 22=- 40,6 (с=1, метанол)
Rf: 0,360 (ацетон:бензол:уксусная кислота) (50:100:1)
0,620 (бензол:этанол) (8:2)
0,780 (хлороформ:метанол) (9:1)
Мол. масса 969,1
Брутто-формула C56H64N4O11
VI. Получение DiBoc-Tyr-Pro-Tyr-Phe-OH.
4,5 г (4,64 ммоль) DiBoc-Tyr-Pro-Tyr(Bzl)-Phe-OBzl растворяли в 100 мл метанола, прибавляли 0,1 мл СН3СООН и палладиевую чернь, перемешивая на магнитной мешалке, пропускали водород в течение 2 часов. Раствор отфильтровывали, упаривали, 2 раза упаривали с бензолом, 1 раз с этилацетатом, добавляли 5 мл этилацетата и заливали гексаном, выпавший осадок отфильтровывали, сушили в эксикаторе над Р2O5, КОН и парафином.
Выход 3,54 г (4,3 ммоль) (93%)
Т.пл.115-116°С
[α]D 22=-79,37 (с=1, метанол)
Rf: 0,351 (хлороформ:метанол) (9:1)
Мол. масса 820,87
Брутто-формула C42H52N4O13
VII. Получение HCl·H-Tyr-Pro-Tyr-Phe-OH.
К 3,0 г (3,65 ммоль) DiBoc-Tyr-Pro-Tyr-Phe-OH прибавляли 1н HCl/СН3СООН (11 мл, в пересчете на две Вос-группы в молекуле тетрапептида), выдерживали 45 минут при комнатной температуре. После снятия защитных групп реакционную смесь заливали гексаном, гексан сливали, а полученное вещество сушили в вакууме. Высушенное вещество растворяли в 5 мл абс. метанола и переосаждали сухим эфиром. Выпавший осадок отфильтровывали, сушили в эксикаторе под вакуумом, несколько раз меняя осушители P2O5, КОН и парафин).
Выход 3,8 г (3,28 ммоль) (90%)
Т.пл. 103-105°С
[α]D 22=-22,97 (с=1, метанол)
Rf: 0,214 (хлороформ:метанол:аммиак) (6,5:3,0:0,5)
0,932 (хлороформ:метанол:аммиак) (6:4:1)
0,180 (бутанол:уксусная кислота:вода) (5:2:1)
0,658 (бутанол:уксусная кислота:пиридин:вода) (30:6:20:24)
Мол. масса 657,14
Брутто-формула НСl·С32H36N4О9
Элементный анализ: С 58,57 (58,48); N 8,48 (8,53); Н 5,48 (5,52)
Результаты ВЭЖХ: колонка Prontosil 120-5-С18 AQ, размер 2,0×0,75 мм; объем 2,0 µl, скорость подачи 100 мкл/мин; температура 35°С, давление 1,6 МПа; элюент А: 0,2 М LiClO4+5 mM HClO4; элюент В: AcN; линейный градиент, время выхода 16 мин.
Пример 4.
Синтез гептапептида Met-Pro-Tyr-Pro-Gly-Pro.
I. Получение Boc-Pro-Gly-OH.
1. 10,75 г (50 ммоль) Boc-Pro-OH растворяли в 150 мл ацетонитрила, охлаждали до -5°С к раствору прибавляли 7,7 мл (50 ммоль) триэтиламина (ТЭА), охлаждали до -20°С, перемешивая на магнитной мешалке. К охлажденному раствору прибавляли 6,8 мл (55 ммоль) пивалоилхлорида (PivCl), перемешивали на магнитной мешалке 20 минут при -10°С, охлаждали до -30°С и прибавляли предварительно охлажденный раствор H-Gly-OH.
Одновременно во второй колбе приготавливали раствор H-Gly-OH.
2. H-Gly-OH 4,5 г (60 ммоль, избыток 1,2) растворяли в 35 мл воды и 60 мл ацетонитрила, прибавляли 8,4 мл (60 ммоль) ТЭА, охлаждали до -10°С и через 20 минут прибавляли к раствору в первой колбе. Реакционную смесь выдерживали 1 час при -10°С и 2 часа при 18-20°С, перемешивая на магнитной мешалке. Реакционную смесь упаривали на роторном испарителе. К остатку добавляли ~50 мл воды. Водный раствор подкисляли 3-кратным избытком NaHSO4 (25 г) до рН=3, экстрагировали 5 раз по 100 мл этилацетатом. Объединенный раствор этилацетата промывали Н2О (50 мл), 10% раствором KHSO4 (50 мл), Н2О (50 мл), насыщенным раствором NaCl (50 мл). Этилацетатный раствор сушили над MgSO4. Высушенный этилацетат отфильтровывали и упаривали. К остатку добавляли сухой эфир. При добавлении эфира в колбе выпадает продукт, который отфильтровывали, промывая его на фильтре сухим эфиром. Полученное вещество высушивали под вакуумом в эксикаторе над КОН, P2O5 и парафином, несколько раз меняя осушители.
Выход: 5,97 г (32,75 ммоль); (65,5%)
Т.пл. 70°С
[α]D 22=-87,8 (с=1, метанол)
Rf: 0,863 (ацетон:бензол:уксусная кислота) (50:100:1)
0,746 (бензол:этанол) (8:2)
0,903 (хлороформ:метанол) (9:1)
0,847 (этилацетат:ацетон:50% уксусная кислота:вода) (2:1:1)
Мол. масса 271,32
Брутто-формула C12H20N2O5
II. Получение Boc-Pro-Gly-Pro-OBzl.
1. 5,9 г (21,74 ммоль) Boc-Pro-Gly-OH растворяли в 100 мл ацетонитрила, охлаждали до -5°С, к раствору прибавляли избыток 1,1 (3,35 мл; 23,9 ммоль) триэтиламина (ТЭА), охлаждали до -20°С, перемешивая на магнитной мешалке. К охлажденному раствору прибавляли избыток 1,1 (2,34 мл; 23,9 ммоль) пивалоилхлорида (PivCl), перемешивали на магнитной мешалке 20 минут при -10°С, охлаждали до -30°С и прибавляли предварительно охлажденный раствор НСl·H-Pro-OBzl.
Одновременно приготавливали раствор НСl·H-Pro-OBzl.
2. HCl·H-Pro-OBzl 6,3 г (26,1 ммоль, избыток 1,2) растворяли в 50 мл ацетонитрила, прибавляли 4,0 мл (28,71 ммоль; избыток 1,1) ТЭА, охлаждали до -10°С и через 20 минут прибавляли к раствору в первой колбе. Реакционную смесь выдерживали 1 час при -10°С и 2 часа при 18-20°С, перемешивая на магнитной мешалке. Реакционную смесь упаривали. К упаренному остатку прибавляли 300 мл этилацетата. Этилацетатный раствор промывали H2O (3 раза по 25 мл), 10% раствором KHSO4 (3 раза по 25 мл), Н2О (3 раза по 25 мл), 5% раствором NaHCO3 (3 раза по 25 мл), Н2О (3 раза по 25 мл), насыщенным раствором NaCl (1 раз 25 мл). Этилацетатный раствор сушили над MgSO4. Высушенный этилацетат отфильтровывали и упаривали. К остатку добавляли ~100 мл сухого эфира. При добавлении эфира в колбе выпадает продукт, который отфильтровывали, промывая его на фильтре сухим эфиром. Полученное вещество высушивали под вакуумом в эксикаторе над КОН, Р2O5 и парафином, несколько раз меняя осушители.
Выход: 8,12 г (17,66 ммоль); (81,23%)
Т.пл. 125-126°С
[α]D 22= -101,18 (с=1, метанол)
Rf: 0,326 (ацетон:бензол:уксусная кислота) (50:100:1)
0,390 (гексан: ацетон) (3:2)
0,947 (хлороформ: метанол) (9:1)
0,620 (бензол:этанол) (8:2)
Мол. масса 459,54
Брутто-формула C24H33N3O6
Элементный анализ: С 62,89 (62,73); N 9,21 (9,14); Н 7,52 (7,24).
III. Получение ТФА·H-Pro-Gly-Pro-OBzl.
К 7,8 г (17,0 ммоль) Boc-Pro-Gly-Pro-OBzl прибавляли 42,5 мл хлористого метилена и 42,5 мл ТФУ, выдерживали 45 минут при комнатной температуре, после снятия защитной группы раствор два раза упаривали с абс. метанолом, два раза с бензолом, два раза с эфиром, растворяли в бензоле и заливали гексаном. Гексан сливали, а полученное масло сушили в эксикаторе над Р2O5, КОН и парафином.
Выход 7,95 г (17,7 ммоль); 98%.
Rf: 0,043 (ацетон:бензол:уксусная кислота) (50:100:1),
0,247 (хлороформ:метанол) (9:1)
0,018 (гексан: ацетон) (3:2)
Мол. масса 473,44
Брутто-формула С2НF3O2·С19Н25N3O4
IV. Получение Boc-Tyr(Bzl)-Pro-Gly-Pro-OBzl.
1. 5,61 г (14,72 ммоль) Boc-Tyr(Bzl)-OH растворяли в 100 мл ацетонитрила, охлаждали до -5°С, к раствору прибавляли избыток 1,1 (2,27 мл; 16,2 ммоль) триэтиламина (ТЭА), охлаждали до -20°С, перемешивая на магнитной мешалке. К охлажденному раствору прибавляли избыток 1,1 (1,99 мл; 16,2 ммоль) пивалоилхлорида (PivCl), перемешивали на магнитной мешалке 20 минут при -10°С, охлаждали до -30°С и прибавляли предварительно охлажденный раствор ТФА·H-Pro-Gly-Pro-OBzl.
Одновременно приготавливали раствор TФA·H-Pro-Gly-Pro-OBzl.
2. TФA·H-Pro-Gly-Pro-OBzl 8,0 г (17,0 ммоль, избыток 1,2) растворяли в 50 мл ацетонитрила, прибавляли 4,76 мл (34,0 ммоль; 2-кратный избыток до рН 8-9) триэтиламина, охлаждали до -10°С и через 20 минут прибавляли к раствору в первой колбе. Реакционную смесь выдерживали 1 час при -10°С и 2 часа при 18-20°С, перемешивая на магнитной мешалке. Реакционную смесь упаривали. К упаренному остатку прибавляли 300 мл этилацетата. Этилацетатный раствор промывали Н2О (3 раза по 25 мл), 10% раствором KHSO4 (3 раза по 25 мл), Н2О (3 раза по 25 мл), 5% раствором NaHCO3 (3 раза по 25 мл), Н2О (3 раза по 25 мл), насыщенным раствором NaCl (1 раз 25 мл). Этилацетатный раствор сушили над MgSO4. Высушенный этилацетат отфильтровывали и упаривали. Остаток растворяли ~30 мл этилацетата и высаждали гексаном. Полученное вещество высушивали под вакуумом в эксикаторе над КОН, P2O5 и парафином, несколько раз меняя осушители.
Высушенный осадок переосаждали из эфира гексаном. Вещество высушивали под вакуумом в эксикаторе над КОН, P2O5 и парафином, несколько раз меняя осушители.
Выход 8,6 г (12,07 ммоль); (82,0%)
Т.пл. 99-102°С
[α]D 22= -52,6 (с=1, метанол)
Rf: 0,530 (ацетон:бензол:уксусная кислота) (50:100:1)
0,538 (бензол:этанол) (8:2)
0,707 (хлороформ:метанол) (9:1)
Мол. масса 712,81
Брутто-формула C40H48N4O8
V. Получение ТФА·H-Tyr(Bzl)-Pro-Gly-Pro-OBzl.
К 8,0 г (11,2 ммоль) Boc-Tyr(Bzl)-Pro-Gly-Pro-OBzl прибавляли 28 мл хлористого метилена и 28 мл ТФУ, выдерживали 45 минут при комнатной температуре, после снятия защитной группы раствор два раза упаривали с абс. метанолом, два раза с бензолом, два раза с эфиром, растворяли в бензоле и заливали гексаном. Гексан сливали, а полученный остаток сушили в эксикаторе над Р2O5/КОН и парафином.
Выход: 7,39 г (10,9 ммоль); (97,15%)
Rf: 0,095 (ацетон:бензол:уксусная кислота) (50:100:1),
0,550 (хлороформ:метанол) (9:1)
0,510 (гексан: ацетон) (3:2)
0,333 (бензол:этанол) (8:2)
Мол. масса 678,7
Брутто-формула С2НF3O2·С35H40N4O3
VI. Получение Boc-Pro-Tyr(Bzl)-Pro-Gly-Pro-OBzl.
2,44 г (11,33 ммоль, избыток 1,1) Вос-Pro-ОН растворяли в 50 мл ацетонитрила, добавляли 1,84 г (13,6 ммоль; избыток 1,2) ОБТ (1-оксибензотриазола), охлаждали до 0°С и добавляли 3,07 г (13,6 ммоль; избыток 1,2) ДЦГК (N,N'-дициклогексилкарбодиимида). Перемешивали на магнитной мешалке 1 час при температуре 0°С, добавляли ранее приготовленный и охлажденный раствор ТФА·H-Tyr(Bzl)-Pro-Gly-Pro-OBzl 7,0 г (10,3 ммоль) с ТЭА 1,6 мл (11,33 ммоль; избыток 1,1) в 25 мл ацетонитрила, перемешивали 1 час при охлаждении и трое суток при комнатной температуре. Реакционную смесь отфильтровывали, упаривали, добавляли 200 мл этилацетата. Этилацетатный раствор промывали Н2О (3 раза по 20 мл), 10% раствором KHSO4 (3 раза по 20 мл), Н2О (3 раза по 20 мл), 5% раствором NаНСО3 (3 раза по 20 мл), H2О (3 раза по 20 мл), насыщенным раствором NaCl (1 раз 20 мл). Раствор этилацетата сушили над MgSO4, отфильтровывали, упаривали. Продукт высаждали из этилацетата эфиром. Полученный осадок отфильтровывали и сушили в вакууме.
Выход 4,73 г (6,45 ммоль) (62,7%)
Т.пл. 98-100°С
[α]D 22= -86,2° (с=0,5 СН3СООН)
Rf: 0,375 (ацетон:бензол:уксусная кислота) (50:100:1),
0,670 (хлороформ:метанол) (9:1)
0,573 (бензол:этанол) (8:2)
Мол. масса 733,82
Брутто-формула C38H49N6O9
VII. Получение ТФА·Н-Pro-Тyr(Вzl)-Pro-Gly-Pro-ОВzl.
К 3,0 г (4,0 ммоль) Boc-Pro-Tyr(Bzl)-Pro-Gly-Pro-OBzl прибавляли 10 мл хлористого метилена и 10 мл ТФУ, выдерживали 45 минут при комнатной температуре, после снятия защитной группы раствор два раза упаривали с абс. метанолом, два раза с бензолом, два раза с эфиром, растворяли в этилацетате и заливали гексаном. Гексан сливали, а полученный остаток сушили в эксикаторе над Р2O5, КОН и парафином.
Выход: 2,72 г (3,9 ммоль); (97,15%)
Rf: 0,23 (хлороформ:метанол) (9:1)
0,142 (бензол:этанол) (8:2)
Мол. масса 757,82
Брутто-формула C2HF3O2·C40H47N50O10
VIII. Получение Boc-Met-Pro-Tyr(Bzl)-Pro-Gly-Pro-OBzl.
2,20 г (3,0 ммоль) TФA·H-Pro-Tyr(Bzl)-Pro-Gly-Pro-OBzl растворяли в 60 мл диметилформамида, прибавляли 1,05 мл (6,0 ммоль, 2-кратный избыток) N,N'-диизопропилэтиламина и затем по каплям раствор Boc-Met-OPfp 4,1 г (3,6 ммоль, избыток 1,2) в 15 мл диметилформамида. Выдерживали при перемешивании на магнитной мешалке 3 часа при комнатной температуре. Реакционную смесь упаривали, добавляли 100 мл этилацетата. Этилацетатный раствор промывали Н2О (3 раза по 10 мл), 10% раствором KHSO4 (3 раза по 10 мл), Н2О (3 раза по 10 мл), 5% раствором NaHCO3 (3 раза по 10 мл), H2O (3 раза по 10 мл), насыщенным раствором NaCl (1 раз 10 мл). Раствор этилацетата сушили над MgSO4, отфильтровывали, упаривали. Продукт высаждали из этилацетата эфиром. Полученный осадок отфильтровывали и сушили в вакууме над Р2O5, КОН и парафином, несколько раз меняя осушители.
Выход 2,13 г (2,26 ммоль); (75,5%)
Т.пл. 85-87°С
[α]D 22=- 51,6 (с=1, метанол)
Rf: 0,690 (хлороформ:метанол) (9:1)
0,266 (ацетон: бензол: уксусная кислота) (50:100:1),
0,855 (хлороформ, насыщ. аммиаком:метанол) (9:1)
Мол. масса 941,2
Брутто-формула С50Н64N9O10S
IX. Получение Boc-Met-Pro-Tyr-Pro-Gly-Pro-OH.
1,88 г (2 ммоль) Boc-Met-Pro-Tyr(Bzl)-Pro-Gly-Pro-OBzl растворяли в 20 мл метанола, прибавляли 0,1 мл СН3СООН и палладиевую чернь, перемешивая на магнитной мешалке, пропускали водород в течение 2 часов. Раствор отфильтровывали, упаривали, два раза упаривали с бензолом, один раз с этилацетатом, добавляли 5 мл этилацетата и заливали гексаном. Выпавший осадок отфильтровывали, промывая на фильтре гексаном. Полученный осадок сушили в эксикаторе под вакуумом над Р2O5, КОН и парафином.
Выход 1,65 г (1,96 ммоль); (98,3%)
Т.пл. 134-136°С
[α]D 22=- 61,2 (с=1, метанол)
Rf: 0,560 (хлороформ:метанол:аммиак) (6:4:1)
Мол. масса 842,94
Брутто-формула C43H58N6O10S
X. Получение HCl·H-Met-Pro-Tyr-Pro-Gly-Pro-OH.
К 1,52 г (1,8 ммоль) Boc-Met-Pro-Tyr-Pro-Gly-Pro-OH прибавляли 2,7 мл 1н HCl/СН3СООН) и 1% анизола, выдерживали 45 минут при комнатной температуре, после снятия Вос-группы реакционную смесь заливали гексаном. Гексан сливали, а полученный осадок сушили в эксикаторе под вакуумом над Р2O5, КОН и парафином. К высушенному осадку добавляли абс. этилацетат, упаривали на роторном испарителе, добавляли 10 мл абс. этилацетата и высаждали сухим эфиром. При добавлении эфира выпадает осадок, который отфильтровывали. Осадок сушили в эксикаторе под вакуумом над Р2O5, КОН и парафином. Белый кристаллический порошок.
Выход: 1,26 г (1,7 ммоль); (96,5%)
Т.пл. 139-140°С
Rf: 0,855 (хлороформ, насыщ. аммиаком:метанол) (9:1)
0,614 (изо-пропанол: муравьиная кислота:вода) (20:5:1)
[α]D 22=- 87,8 (с=1; метанол)
Мол. масса 745,35
Брутто-формула НСl·С31Н44N6О11S
Элементный анализ: С 50,01 (49,95); N 11,14 (11,27); Н 6,94 (7,3)
Результаты ВЭЖХ: колонка Prontosil 120-5-C18 AQ, размер 2,0х0,75 мм; объем 2,0 ц1, скорость подачи 100 мкл/мин; температура 35°С, давление 1,6 МПа; элюент А: 0,2 М LiClO4+5 mM HClO4; элюент В: AcN; линейный градиент, время выхода 28 мин.
В таблице 2 приведены пептиды, относящиеся к общей формуле А-Pro-Tyr-В-Х (I), синтезированные методами пептидной химии в растворе.
 , синтезированные методами пептидной химии в растворе
, синтезированные методами пептидной химии в растворе
Пример 5.
Пептиды, относящиеся к общей формуле  , синтезированные автоматическим твердофазным методом.
, синтезированные автоматическим твердофазным методом.
В таблице 3 приведены примеры синтеза пептидов, относящихся к общей формуле  , синтезированных автоматическим твердофазным методом.
, синтезированных автоматическим твердофазным методом.
 , синтезированные автоматическим твердофазным методом
, синтезированные автоматическим твердофазным методом
Пептиды, приведенные в таблице 3, синтезированы автоматическим твердофазным методом по Fmoc-схеме на полимере Ринка (4-(2,4-диметоксифенилфлуоренилметоксиаминометил)фенокси-полистирол, 0,5 ммоль аминогрупп на 1 г полимера) с использованием DEPCDI/HOBt метода активации аминокислот. Пептиды отщепляли от полимера и деблокировали смесью TFA:m-crezole (95:5). Очистку пептидов проводили с помощью обращенно-фазовой ВЭЖХ (колонка Jupiter Cis (10×250 мм) в следующем градиенте ацетонитрила: 5 мин при 2%, затем линейный градиент от 2 до 60% за 50 мин в 0,1% трифторацетатном буфере при скорости потока 4 мл/мин.
Ниже приведены примеры, иллюстрирующие биологическую активность пептидов.
Пример 6.
Радиорецепторное исследование взаимодействия пептидов, относящихся к общей формуле  , с местами специфического связывания 3Н-спиперона во фронтальной коре (5-НТ2 рецепторы) и стриатуме (D2-рецепторы) головного мозга крыс в опытах in vitro.
, с местами специфического связывания 3Н-спиперона во фронтальной коре (5-НТ2 рецепторы) и стриатуме (D2-рецепторы) головного мозга крыс в опытах in vitro.
Спиперон является неселективным лигандом серотониновых и дофаминовых рецепторов с профилем рецепторного связывания, характерным для ряда атипичных антипсихотиков. В данном исследовании была изучена способность Pro-Tyr - содержащих пептидов (в концентрации 50 мкМ) вытеснять 3H-спиперон из мест его специфического связывания с мембранной фракцией стриатума, где плотность D2-рецепторов превосходит плотность других рецепторов, с которыми взаимодействует этот лиганд, и фронтальной коры - отдела мозга, наиболее обогащенного 5-НТ2 рецепторами.
В экспериментах использовали 20 беспородных белых крыс самцов весом 200±20 г, полученных из питомника РАМН «Крюково Центральное». Животных содержали в стандартных условиях по 5 штук в клетках MAC 4 при температуре 22°С, световом режиме 12:12 часов (свет с 8.00 ч до 20.00 ч), питьевом и пищевом режиме ad libitum. Крыс забивали декапитацией. Затем браншу ножниц вводили в большое затылочное отверстие и вскрывали черепную коробку в продольном направлении. Извлекали головной мозг, немедленно помещали его в чашку Петри на льду и выделяли фронтальную кору и стриатум.
Мембранную фракцию отделов головного мозга крыс для постановки радиорецепторного анализа получали модифицированным методом Nelson et al. (1981). После диссекции фронтальную кору гомогенизировали в ледяном 50 mM TRIS-HC1 буфере, рН 7,4 (соотношение вес/объем 1/20) в механическом гомогенизаторе типа Potter (стекло/тефлон). Гомогенат центрифугировали (30000 g, 30 min, 4°C). Супернатант удаляли, осадок ресуспендировали в том же объеме ледяного TRIS-HC1 буфера, рН 7,4. Описанную процедуру повторяли три раза. Полученный осадок замораживали и хранили при -70°С.
Радиорецепторный анализ проводили по методу Bymaster et al. (1996). Реакционная смесь для изучения связывания спиперона с рецепторами фронтальной коры головного мозга крыс (конечный объем 300 мкл) содержала 50 мМ Трис-НСl буфер, рН 7.4; мембранную фракцию фронтальной коры (0,15 мг белка/мл); 50 мкг/мл бацитрацина; аскорбиновую кислоту 0,1 мг/мл; 10 мкМ паргилина; 5 нМ 3H-спиперона (120 Ки/мМоль, Amersham), исследуемые пептиды в концентрации 100 мкМ.
Реакционная смесь для изучения связывания спиперона с рецепторами стриатума (конечный объем 300 мкл) содержала 50 мМ Трис-НСl буфер, рН 7.4; 120 мМ NaCl, 5 мМ КСl, 2 мМ CaCl2, 1 мМ MgCl2, мембранную фракцию стриатума (0,15 мг белка/мл); 50 мкг/мл бацитрацина; аскорбиновую кислоту 0,1 мг/мл; 10 мкМ паргилина; 0,7 нМ 3H-спиперона, исследуемые пептиды в концентрации 100 мкМ. Инкубацию проводили при 25°С в течение 40 мин. Отделение связавшейся и несвязавшейся метки проводили на харвестере Skatron (Швеция) на стекловолокнистых фильтрах GF-B (Whatman), предварительно замоченных в 0,1% растворе полиэтиленимина. Кетансерин, сульпирид и немеченый спиперон в концентрациях от 0,1 нМ до 1 мкМ использовали для построения контрольной калибровочной кривой вытеснения. Каждая точка определялась в трех параллелях в трех независимых экспериментах. Белок в пробах определяли по методу Лоури.
Полученные результаты представлены в таблице 4. Из таблицы видно, что четыре исследованных пептида, относящиеся к общей формуле  , влияют на специфическое связывание 3H-спиперона с мембранами стриатума, т.е., возможно, обладают способностью взаимодействовать с D2 рецепторами. Эта способность наиболее выражена у Met-Pro-Tyr-Phe-OMe и у Met-Pro-Tyr-Pro-Gly-Pro. Следует отметить, что селективный лиганд D2 рецепторов сульпирид в насыщающих концентрациях (10 мкМ) вытесняет 3H-спиперон из его мест связывания в стриатуме лишь на 50%, что свидетельствует о наличии отличных от D2 типов рецепторов к спиперону в этом отделе мозга.
, влияют на специфическое связывание 3H-спиперона с мембранами стриатума, т.е., возможно, обладают способностью взаимодействовать с D2 рецепторами. Эта способность наиболее выражена у Met-Pro-Tyr-Phe-OMe и у Met-Pro-Tyr-Pro-Gly-Pro. Следует отметить, что селективный лиганд D2 рецепторов сульпирид в насыщающих концентрациях (10 мкМ) вытесняет 3H-спиперон из его мест связывания в стриатуме лишь на 50%, что свидетельствует о наличии отличных от D2 типов рецепторов к спиперону в этом отделе мозга.
Met-Pro-Tyr-Phe-OMe, Met-Pro-Tyr-Trp-OMe, Met-Pro-Tyr-Phe и Met-Pro-Tyr-Pro-Gly-Pro в концентрации 50 мкМ практически полностью ингибируют связывание 3H-спиперона с мембранами фронтальной коры крыс (таблица 4). Наиболее эффективным оказался Met-Pro-Tyr-Phe-OMe; судя по значению ЕС50, его сродство к 5-НТ2 рецепторам сравнимо со сродством спиперона.
 , на специфическое связывание 3H-спиперона с мембранами стриатума и фронтальной коры крыс (% специфического связывания 3H-спиперона в присутствии соответствующих пептидов в концентрации 50 мкМ)
, на специфическое связывание 3H-спиперона с мембранами стриатума и фронтальной коры крыс (% специфического связывания 3H-спиперона в присутствии соответствующих пептидов в концентрации 50 мкМ)
Пример 7.
Радиорецепторное исследование взаимодействия пептидов общей формулы  c 5-HT2 рецепторами головного мозга в опытах in vitro.
c 5-HT2 рецепторами головного мозга в опытах in vitro.
Радиорецепторное исследование взаимодействия пептидов с 5-HT2 рецепторами головного мозга в опытах in vitro проводили также с использованием селективного меченого лиганда 5-НТ2-рецепторов - 3H-кетансерина. Для постановки радиорецепторного анализа (РРА) использовали плоскодонные платы «Linbro» (Великобритания), которые, как показано в контрольных экспериментах, не сорбируют применяемый в РРА 3H-кетансерин. Растворы готовили на 50 mM TRIS-HCl буфере, рН 7,5 (20°С).
Инкубационная смесь объемом 300 мкл при проведении анализа вытеснения содержала 3H-кетансерин в концентрации 2 нМ, мембранную фракцию головного мозга крыс 0,3 мг-эквивалент белка/мл, 0,1 мг/мл аскорбиновой кислоты. Величину специфического связывания определяли по разности связывания 3H-кетансерина в отсутствие (общее связывание) и в присутствии (неспецифическое связывание) избытка (100 мкМ) кетансерина. Она составила в среднем 65-75% от общей величины связывания.
При проведении анализа взаимодействия синтетических пептидов, относящихся к общей формуле 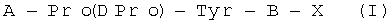 , с местами специфического связывания 3H-кетансерина реакционная смесь содержала 3H-кетансерин в концентрации 2 нМ, изучаемые пептиды в концентрации 0,001-100,0 мкМ, 10 мкМ паргилина, мембранную фракцию головного мозга крыс 0,25 мг-эквивалент белка/мл, 0,1 мг/мл аскорбиновой кислоты, бацитрацин в концентрации 50 мкг/мл.
, с местами специфического связывания 3H-кетансерина реакционная смесь содержала 3H-кетансерин в концентрации 2 нМ, изучаемые пептиды в концентрации 0,001-100,0 мкМ, 10 мкМ паргилина, мембранную фракцию головного мозга крыс 0,25 мг-эквивалент белка/мл, 0,1 мг/мл аскорбиновой кислоты, бацитрацин в концентрации 50 мкг/мл.
Пробы инкубировали 40 минут при температуре 20°С с постоянным перемешиванием. Связавшуюся метку отделяли от несвязавшейся путем фильтрации под вакуумом на стекловолокнистых фильтрах GF/B «Whatman» (Великобритания), используя клеточный харвестр «Skatron» (Норвегия). При этом лунки промывали 4,5 мл охлажденного 50 mM TRIS-HC1 буфера, рН 7,5 (4°С). После высушивания на воздухе в течение ночи фильтры помещали в 6 мл сцинтиллятора ЖС-8, выдерживали в течение суток и определяли уровень радиоактивности на жидкостном сцинтилляционном счетчике «MiniBeta» (LKB-Wallak, Финляндия). Эффективность счета составляла 25%.
Определение содержания белка в пробах проводили по методу Bradford M.M. (1996) с использованием набора фирмы «Sigma» (США) на спектрофотометре фирмы «Perkin-Elmer» 555 UV-VIS Spektrophotometr. Калибровочную кривую строили по бычьему сывороточному альбумину.
В результате радиорецепторного исследования доказана способность ряда исследованных пептидов, относящихся к общей формуле  и, в частности, Met-Pro-Tyr-Trp-ОМе и Met-Pro-Tyr-Phe-OMe вытеснять 3H-кетансерин из 5-НТ2а рецепторов фронтальной коры. ЕС50 для двух указанных пептидов составляет 90±7 нМ и 1,1±0,3 мкМ соответственно.
и, в частности, Met-Pro-Tyr-Trp-ОМе и Met-Pro-Tyr-Phe-OMe вытеснять 3H-кетансерин из 5-НТ2а рецепторов фронтальной коры. ЕС50 для двух указанных пептидов составляет 90±7 нМ и 1,1±0,3 мкМ соответственно.
Пример 8.
Исследования Оланзапина (Зипрекса) (фирмы «Эли Лили») и тетрапептида Trp-Pro-Tyr-Phe, относящегося к общей формуле  , по способности снижать гиперактивацию дофаминовой системы.
, по способности снижать гиперактивацию дофаминовой системы.
Исследование фармакологической активности соединений проводилось в опытах на животных с использованием стандартных методов, применяемых для скрининга нейротропных препаратов с нейролептической активностью, согласно методическим рекомендациям, утвержденным Фармакологическим комитетом МЗ РФ (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, М., 2005).
Проводили сравнение известного препарата Оланзапина (Зипрекса) (фирмы «Эли Лили») и тетрапептида Trp-Pro-Tyr-Phe по способности снижать гиперактивацию дофаминовой системы.
Тестирование проводили на белых беспородных мышах-самцах весом 22-25 г, помещенных в специальные цилиндрические камеры с проволочной стенкой. Исследуемые препарат Оланзапин и тетрапептид Trp-Pro-Tyr-Phe вводили внутрибрюшинно за 30 мин до начала тестирования в 0,2 мл физиологического раствора. Феномен вертикализации вызывали подкожной инъекцией апоморфина гидрохлорида (фирма «Sigma») в дозе 5 мг/кг за 10 минут до начала тестирования. Поведение животных исследовали на протяжении часа. Уровень вертикальной активности оценивали по 4-бальной шкале: число баллов соответствовало числу лапок мыши на проволочной стене камеры. По окончании эксперимента подсчитывали суммарный балл для каждого животного за все время наблюдения.
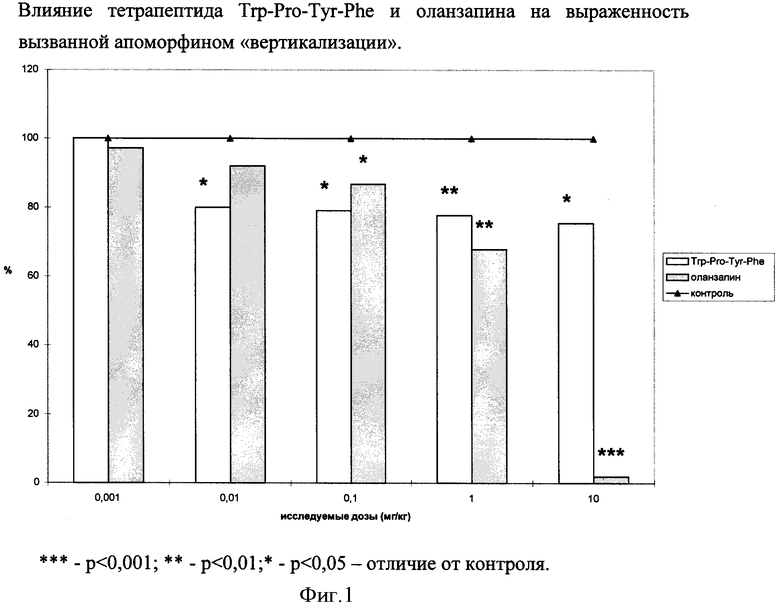
Результаты, выраженные в % от контроля, представлены на фиг.1.
В результате эксперимента показано, что как тетрапептид Trp-Pro-Tyr-Phe, так и оланзапин в широком диапазоне доз (0,01-10,0 мг/кг) достоверно снижает уровень вызванной апоморфином вертикализации. Подавляющий вертикализацию эффект препарата сравнения оланзапина в дозах 0,001-0,1 мг/кг проявляется в меньшей степени, чем эффект тетрапептида Trp-Pro-Tyr-Phe, но с повышением доз становится гораздо более выраженным. Вместе с тем при использовании антипсихотика оланзапина в дозах 1 и 10 мг/кг наблюдается гибель отдельных животных. Так при введении 10 мг/кг оланзапина гибнет около 30% мышей, что свидетельствует о недопустимости использования оланзапина в данной дозе. Таким образом, эффект тетрапептида Trp-Pro-Tyr-Phe достоверен в широком диапазоне доз. Выраженность его практически не изменяется в диапазоне 0,01-10,00 мг/кг и сопоставима с эффектом терапевтических доз оланзапина. Побочных эффектов, вызывающих гибель животных, у исследуемого тетрапептида Trp-Pro-Tyr-Phe не обнаружено.
В аналогичных условиях способность снижать гиперактивацию дофаминовой системы проявили еще пять пептидов, относящихся к общей формуле  и представленных в таблице 5.
и представленных в таблице 5.
 , и оланзапина на выраженность вызванной апоморфином "вертикализации" (в процентах к контролю - апоморфина гидрохлорид)
, и оланзапина на выраженность вызванной апоморфином "вертикализации" (в процентах к контролю - апоморфина гидрохлорид)
Пример 9.
Оценка влияния на дофаминергическую передачу в нигростриатной системе головного мозга тетрапептида Tyr-Pro-Tyr-Phe, относящегося к общей формуле  , на поведенческие проявления гиперфункции дофаминовой системы в тесте «стереотипии».
, на поведенческие проявления гиперфункции дофаминовой системы в тесте «стереотипии».
Для оценки влияния на дофаминергическую передачу в нигростриатной системе головного мозга изучен эффект тетрапептида Tyr-Pro-Tyr-Phe, относящийся к общей формуле  , на поведенческие проявления гиперфункции дофаминовой системы в тесте «стереотипии». Тестирование проводили на белых беспородных крысах-самцах весом 200-250 г. Характеристики экспериментальных животных и условия их содержания описаны в примере 6. Исследуемый тетрапептид Trp-Pro-Tyr-Phe вводили внутрибрюшинно за 30 мин до начала тестирования в 0,2 мл физиологического раствора. Феномен стереотипии вызывали подкожной инъекцией апоморфина гидрохлорида (фирма «Sigma») в дозе 0,75 мг/кг за 10 минут до начала тестирования. Поведение животных исследовали на протяжении часа. Оценивали выраженность стереотипных реакций - грызения, лизания, принюхивания по трехбалльной шкале оценки: 1 балл - отдельные стереотипные движения (например, непостоянные принюхивания); 2 - интенсивная непродолжительная стереотипия (в том числе лизание, грызение); 3 - постоянная интенсивная стереотипия. Учитывали также общую продолжительность стереотипного поведения.
, на поведенческие проявления гиперфункции дофаминовой системы в тесте «стереотипии». Тестирование проводили на белых беспородных крысах-самцах весом 200-250 г. Характеристики экспериментальных животных и условия их содержания описаны в примере 6. Исследуемый тетрапептид Trp-Pro-Tyr-Phe вводили внутрибрюшинно за 30 мин до начала тестирования в 0,2 мл физиологического раствора. Феномен стереотипии вызывали подкожной инъекцией апоморфина гидрохлорида (фирма «Sigma») в дозе 0,75 мг/кг за 10 минут до начала тестирования. Поведение животных исследовали на протяжении часа. Оценивали выраженность стереотипных реакций - грызения, лизания, принюхивания по трехбалльной шкале оценки: 1 балл - отдельные стереотипные движения (например, непостоянные принюхивания); 2 - интенсивная непродолжительная стереотипия (в том числе лизание, грызение); 3 - постоянная интенсивная стереотипия. Учитывали также общую продолжительность стереотипного поведения.
Вышеуказанный тетрапептид Tyr-Pro-Tyr-Phe достоверно уменьшал число стереотипных движений, вызванных апоморфином, при использовании относительно малой дозы 0,01 мг/кг (62,8%, р<0,01).
Пример 10.
Влияние пептидов, относящихся к общей формуле  , на поведенческие проявления гиперфункции серотониновой системы в тесте «встряхивания головой».
, на поведенческие проявления гиперфункции серотониновой системы в тесте «встряхивания головой».
Изучено влияние пептидов общей формулы  на поведенческие проявления гиперфункции серотониновой системы в тесте «встряхивания головой». Тестирование проводили на полученных из питомника РАМН «Крюково-Центральное» белых беспородных мышах-самцах весом 22-25 г. Исследуемые пептиды вводили внутрибрюшинно за 30 мин до начала тестирования в 0,2 мл физиологического раствора. Феномен встряхивания головой вызывали внутрибрюшинной инъекцией 5-гидрокситриптофана (фирма «Sigma») в дозе 300 мг/кг непосредственно перед началом тестирования. Поведение животных исследовали на протяжении часа. Уровень гиперактивности серотониновой системы оценивали по количеству встряхиваний головой.
на поведенческие проявления гиперфункции серотониновой системы в тесте «встряхивания головой». Тестирование проводили на полученных из питомника РАМН «Крюково-Центральное» белых беспородных мышах-самцах весом 22-25 г. Исследуемые пептиды вводили внутрибрюшинно за 30 мин до начала тестирования в 0,2 мл физиологического раствора. Феномен встряхивания головой вызывали внутрибрюшинной инъекцией 5-гидрокситриптофана (фирма «Sigma») в дозе 300 мг/кг непосредственно перед началом тестирования. Поведение животных исследовали на протяжении часа. Уровень гиперактивности серотониновой системы оценивали по количеству встряхиваний головой.
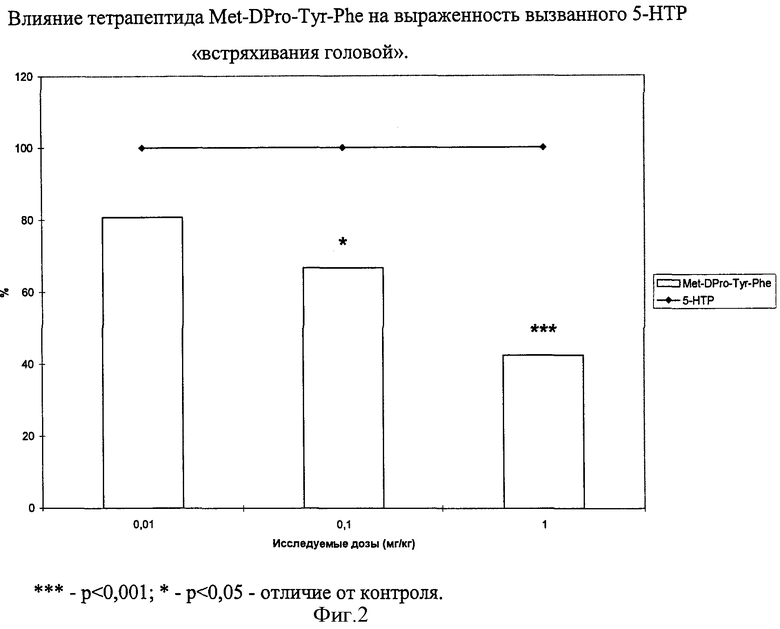
В результате исследований показано, что тетрапептид Met-DPro-Tyr-Phe в дозах 0,01-1,0 мг/кг на 20-60% значимо снижает количество встряхиваний животного головой, вызванных инъекцией 5-гидрокситриптофана (5-НТР). Полученные результаты представлены на фигуре 2. Аналогичное серотонинблокирующее действие в тех же условиях оказывают ряд других пептидов, приведенных в таблице 6.
 , и оланзапина на выраженность вызванного 5-гидрокситриптофаном "встряхивания головой" (в процентах от контроля - 5-гидрокситриптофан)
, и оланзапина на выраженность вызванного 5-гидрокситриптофаном "встряхивания головой" (в процентах от контроля - 5-гидрокситриптофан)
Пример 11.
Исследование синтезированных пептидов, относящихся к общей формуле  , в тесте «Ареколиновый тремор».
, в тесте «Ареколиновый тремор».
Для выявления центрального М-холинергического действия синтезированных пептидов, относящихся к общей формуле  , исследовали их эффекты в тесте «Ареколиновый тремор».
, исследовали их эффекты в тесте «Ареколиновый тремор».
Тестирование проводили на полученных из питомника РАМН «Крюково-Центральное» белых беспородных мышах-самцах весом 22-25 г. Исследуемые пептиды вводили внутрибрюшинно за 30 мин до начала тестирования в 0,2 мл физиологического раствора. Феномен тремора вызывали подкожным введением ареколина (фирма «Sigma») в дозе 25 мг/кг непосредственно перед началом тестирования. Поведение животных наблюдали на протяжении часа. Регистрировали латентный период, продолжительность и выраженность тремора (по локализации и амплитуде) в баллах: 0 - отсутствие, 1 - локальный мелкоамплитудный тремор головы, передних лап или хвоста, 2 - локальный среднеамплитудный тремор, 3 - генерализованный мелко- или среднеамплитудный тремор всего тела.
В результате показано, что тетрапептиды Trp-Pro-Tyr-Phe, Met-Pro-Tyr-Ala и Met-Pro-Tyr-Phe в дозе 1 мг/кг достоверно уменьшают выраженность и продолжительность вызванного ареколином тремора (р<0,05). Полученные результаты представлены в таблице 7. Таким образом, указанные пептиды, относящиеся к общей формуле  , способны снижать поведенческие проявления гиперфункции холинергической системы.
, способны снижать поведенческие проявления гиперфункции холинергической системы.
 , на выраженность и продолжительность тремора, вызванного ареколином (в процентах от контроля - ареколин 25 мг/кг, п/к)
, на выраженность и продолжительность тремора, вызванного ареколином (в процентах от контроля - ареколин 25 мг/кг, п/к)
Пример 12.
Для существующих в настоящее время антипсихотических препаратов характерно наличие отрицательных побочных эффектов: токсичность при высоких дозах, экстрапирамидные расстройства, нарушение обмена веществ и некоторых гормональных функций, ожирение, седация и некоторые другие. Поэтому в работе была исследована возможность развития подобных эффектов в результате введения изучаемых пептидов, относящихся к общей формуле  .
.
Защищаемые данным патентом соединения являются фрагментами природных белков, поэтому не должны обладать острой и хронической токсичностью. Действительно, при использовании всех исследованных пептидов в дозах до 100 мг/кг гибели животных не наблюдалось.
Изучение побочных эффектов веществ в тесте удерживания на параллельных стенках в опытах на мышах.
Для оценки побочных экстрапирамидных нарушений, каталепсии, использовался тест удерживания на параллельных стенках (Т.А.Воронина и др. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2005. С.295-308; К.С.Раевский и др. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2005. С.230-244; С.Morpurgo, Minerva Anestesiol., 1964, v.30, p.417-458) в опытах на мышах. Критерием появления у животного каталепсии считалось удерживание на параллельных стенках в течение 2 минут.
Как видно из таблицы 8, галоперидол в малой терапевтической дозе 0,5 мг/кг вызывал у мышей выраженный каталептогенный эффект, который характеризовался удерживанием на параллельных стенках до 80% мышей. Пептиды общей формулы  при внутрибрюшинном введении (внб) в дозе 10 мг/кг, в 10 раз превышающей терапевтическую, не вызывали у мышей каталепсию. Полученные результаты представлены в таблице 8.
при внутрибрюшинном введении (внб) в дозе 10 мг/кг, в 10 раз превышающей терапевтическую, не вызывали у мышей каталепсию. Полученные результаты представлены в таблице 8.
 и галоперидола на показатель удерживания на параллельных стенках в течение 2 минут
и галоперидола на показатель удерживания на параллельных стенках в течение 2 минут
Пример 13.
Радиорецепторное исследование взаимодействия пептидов, относящихся к общей формуле  с 5-НТ2с рецепторами головного мозга в опытах in vitro.
с 5-НТ2с рецепторами головного мозга в опытах in vitro.
Известно, что 5-НТ2с рецепторы являются одной из мишеней для действия атипичных антипсихотиков. При этом именно эти рецепторы опосредуют один из основных побочных эффектов антипсихотиков - патологическое ожирение.
Исследование проведено методом, незначительно модифицированным по сравнению с описанным в примерах 6 и 7. Радиорецепторный анализ (РРА) проводили с использованием селективного меченого лиганда 5-НТ2с-рецепторов 3H-мезулергина (удельная активность 77 Ки/ммоль, фирма «Amersham»). Для постановки РРА использовали плоскодонные платы «Linbro» (Великобритания), которые, как показано в контрольных экспериментах, не сорбируют применяемый в РРА 3H-мезулергин. Растворы готовили на 50 mM TRIS-HCl буфере, рН 7,4 (20°С).
Инкубационная смесь объемом 300 мкл содержала 3H-мезулергин в концентрации 3 нМ, мембранную фракцию головного мозга крыс 0,25 мг-эквивалент белка/мл, 0,1 мг/мл аскорбиновой кислоты. Величину специфического связывания определяли по разности связывания 3H-мезулергина в отсутствие (общее связывание) и в присутствии (неспецифическое связывание) избытка (100 мкМ) оланзапина. Она составила в среднем 50-60 % от общей величины связывания.
При проведении анализа взаимодействия синтетических пептидов с местами специфического связывания 3H-мезулергина реакционная смесь содержала 3H-мезулергин в концентрации 3 нМ, исследуемые пептиды в концентрации 0,001-100,0 мкМ, паргилин (53 МЕ/мг) фирмы «Sigma» (США) в концентрации 10 мкМ, мембранную фракцию головного мозга крыс 0,25 мг-эквивалент белка/мл, 0,1 мг/мл аскорбиновой кислоты, бацитрацин (53 МЕ/мг) фирмы «Sigma» (США) в концентрации 50 мкг/мл.
В результате проведенного исследования доказано, что в отличие от препарата сравнения оланзапина, исследуемые пептиды в концентрациях до 10 мкМ не влияют на уровень специфического связывания 3H-мезулергина. Результаты представлены в таблице 9. То есть исследуемые пептиды не могут вызвать побочные эффекты, связанные с патологическим ожирением и обусловленные взаимодействием с 5-НТ2с рецепторами.
 , на специфическое связывание 3H-мезулергина с мембранами фронтальной коры крыс (приведен % специфического связывания 3H-мезулергина в присутствии соответствующих пептидов в указанных концентрациях)
, на специфическое связывание 3H-мезулергина с мембранами фронтальной коры крыс (приведен % специфического связывания 3H-мезулергина в присутствии соответствующих пептидов в указанных концентрациях)
Пример 14.
Сравнительное исследование хронического введения атипичного антипсихотика оланзапина и тетрапептида Met-Pro-Tyr-Trp-OMe, относящегося к общей формуле  , на вес беспородных белых мышей самцов.
, на вес беспородных белых мышей самцов.
Проведено сравнительное исследование хронического введения атипичного антипсихотика оланзапина и тетрапептида Met-Pro-Tyr-Trp-OMe на вес беспородных белых мышей самцов. Количество животных в каждой из экспериментальных и контрольных групп 12 штук. В результате введения оланзапина (1 мг/кг внутрибрюшинно, один раз в день на протяжении 30 дней) наблюдалось достоверное (на 6%, р<0,05) повышение массы крыс по сравнению с массой как интактных, так и контрольных животных (введение физраствора). Вместе с тем введение тетрапептида Met-Pro-Tyr-Trp-OMe в той же дозе и в том же режиме не приводило к изменению веса животных по сравнению с весом крыс контрольной и интактной групп. Таким образом, хроническое введение тетрапептида Met-Pro-Tyr-Trp-OMe в эксперименте не приводит к ожирению.
Никаких других отрицательных побочных эффектов типа смертности, заболеваемости, необычных форм поведения ни в одной из исследованных групп животных обнаружено не было.
Пример 15.
Сравнительный анализ влияния острого и хронического введения Met-Pro-Tyr-Trp-OMe, относящегося к общей формуле  , и оланзапина на поведение мышей в «открытом поле».
, и оланзапина на поведение мышей в «открытом поле».
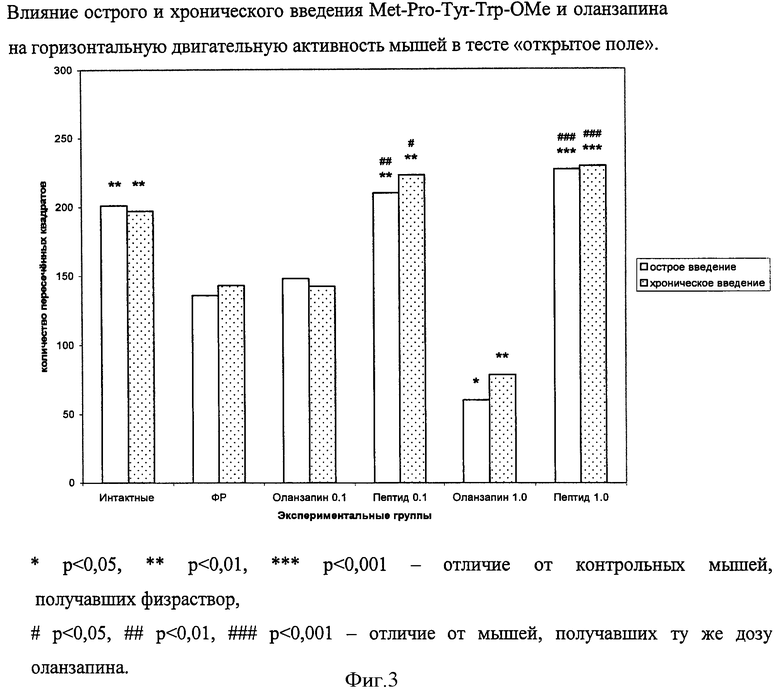
В вышеупомянутом эксперименте по влиянию хронического введения Met-Pro-Tyr-Trp-OMe и оланзапина на массу белых беспородных мышей-самцов было изучено их поведение в «открытом поле» после первой инъекции препаратов и по завершении курса инъекций.
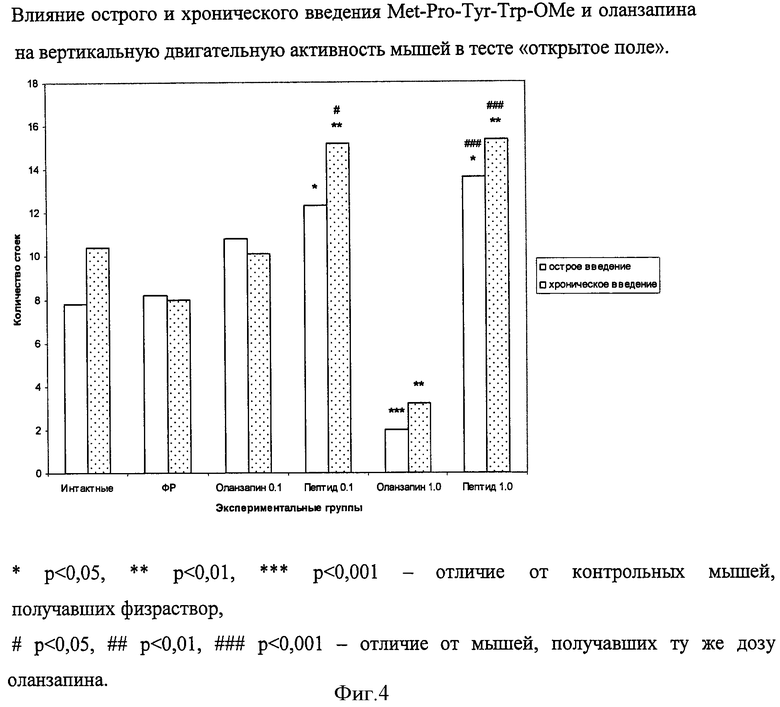
В результате исследования было обнаружено, что стресс от инъекций физраствора (как острых, так и хронических) вызывает у мышей этой популяции реакцию замирания, выражающуюся в снижении горизонтальной двигательной активности (фиг.3). На этом фоне оланзапин в малых дозах (до 0,1 мг/кг) не влияет, а в дозе 1 мг/кг усиливает эту реакцию и/или вызывает дополнительную седацию. Пептид в обеих дозах как при остром, так и при хроническом введении нормализует горизонтальную двигательную активность до уровня таковой у интактных животных. Горизонтальная двигательная активность мышей, получавших пептид, во всех случаях была выше, чем у мышей, получавших ту же дозу оланзапина.
Вертикальная двигательная активность животных не изменялась под влиянием инъекций физраствора (фиг.4). На этом фоне оланзапин в дозе 1 мг/кг практически полностью подавлял этот вид активности у мышей как при остром, так и при хроническом введении. Напротив, количество стоек, осуществляемых животными в «открытом поле», после введения им Met-Pro-Tyr-Trp-OMe, возрастало в 1,5 раза. Если рассматривать вертикальную двигательную активность животных в «открытом поле», как отображение их исследовательской активности, можно утверждать, что Рrо-Tyr-содержащие пептиды, в отличие от известных антипсихотиков, могут оказывать положительное влияние на когнитивные функции больного, обладать ноотропным действием.
Приведенные данные радиорецепторного анализа и поведенческих исследований дают основание рассматривать некоторые из синтезированных пептидов, относящихся к общей формуле  , в качестве средства, обладающего антипсихотической активностью, и перспективных для создания на их основе новых лекарственных препаратов с антипсихотической активностью, способных редуцировать позитивную и негативную симптоматику шизофрении и других психозов.
, в качестве средства, обладающего антипсихотической активностью, и перспективных для создания на их основе новых лекарственных препаратов с антипсихотической активностью, способных редуцировать позитивную и негативную симптоматику шизофрении и других психозов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЕМЕЙСТВО ПЕПТИДОВ, ОБЛАДАЮЩЕЕ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2286169C1 |
| ПЕПТИДЫ, ОБЛАДАЮЩИЕ АНТИКОАГУЛЯНТНО-ФИБРИНОЛИТИЧЕСКОЙ, АНТИТРОМБОЦИТАРНОЙ И АНТИТРОМБОТИЧЕСКОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2286166C1 |
| ГЕКСАПЕПТИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ СТИМУЛЯТОРА ПАМЯТИ | 1998 |
|
RU2131743C1 |
| ПЕПТИД, ОБЛАДАЮЩИЙ АНТИКОАГУЛЯНТНОЙ, ФИБРИНДЕПОЛИМЕРИЗАЦИОННОЙ, АНТИТРОМБОТИЧЕСКОЙ И ФИБРИНОЛИТИЧЕСКОЙ АКТИВНОСТЯМИ | 2005 |
|
RU2288736C1 |
| ПЕПТИД, ОБЛАДАЮЩИЙ АНТИКОАГУЛЯНТНОЙ, ФИБРИНДЕПОЛИМЕРИЗАЦИОННОЙ, АНТИТРОМБОТИЧЕСКОЙ И ФИБРИНОЛИТИЧЕСКОЙ АКТИВНОСТЯМИ | 2005 |
|
RU2289423C1 |
| ГЕПТАПЕПТИД, ОБЛАДАЮЩИЙ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ, СОЧЕТАЮЩЕЙСЯ С ТЕРМОРЕГУЛЯТОРНОЙ И/ИЛИ С СОСУДОДВИГАТЕЛЬНОЙ АКТИВНОСТЬЮ И/ИЛИ С ВЛИЯНИЕМ НА ПОВЕДЕНЧЕСКУЮ РЕАКЦИЮ ИСПЫТУЕМОГО, И СПОСОБ ИЗМЕНЕНИЯ ФИЗИОЛОГИЧЕСКОЙ АКТИВНОСТИ ДЕРМОРФИНА | 1997 |
|
RU2134121C1 |
| ПЕПТИД И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1994 |
|
RU2067000C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ПЕПТИДА И ПОЛУЧЕННЫЙ ПЕПТИД | 2012 |
|
RU2507212C2 |
| Способ получения полипептидов | 1977 |
|
SU904518A3 |
| Способ получения пептидов | 1980 |
|
SU1316565A3 |
Изобретение относится к области фармакологии и медицины. Предложено средство, обладающее антипсихотической активностью, которое представляет собой пептид общей формулы А-Pro-Tyr-В-Х (I), где Pro может представлять собой DPro, А выбирают из Ala, Gly, Ile, Leu, Met, Phe, Ser, Thr, Trp, Tyr, Val; В выбирают из Ala, Arg, Gly, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val; X - OH; -ОСН3; -NH2; -Gly-Pro, и является перспективным для создания новых лекарственных препаратов, способных редуцировать позитивную и негативную симптоматику шизофрении и других психозов. 4 ил., 9 табл.
Средство, обладающее антипсихотической активностью и представляющее пептид общей формулы
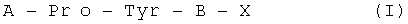 ,
,
где Pro может представлять собой DPro,
А выбирают из Ala, Gly, Ile, Leu, Met, Phe, Ser, Thr, Trp, Tyr, Val;
В выбирают из Ala, Arg, Gly, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val;
X - OH; -ОСН3; -NH2; -Gly-Pro.
| ЗАМЕЩЕННЫЕ ПРОЛИЛТИРОЗИНЫ, ОБЛАДАЮЩИЕ ПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2091390C1 |
| US 2007149763 A1, 28.06.2007 | |||
| WO 2004035606 A2, 29.04.2004 | |||
| WO 2006042661 A2, 27.04.2006 | |||
| WO 2004098644 A1, 18.11.2004 | |||
| ПРЕСС-ФОРМА ПРОХОДНОГО ТИПА | 0 |
|
SU333071A1 |
| CA on STN рег | |||
| УСТРОЙСТВО для ИЗМЕРЕНИЯ КОРОБЛЕНИЯ ПЛОСКИХДЕТАЛЕЙ | 0 |
|
SU321671A1 |
Авторы
Даты
2011-02-10—Публикация
2008-11-13—Подача