Низший алкан подвергают взаимодействию с хлоридом металла для получения соответствующего алкилхлорида. Взаимодействие полученного алкилхлорида с оксидом магния и паром приводит к получению соответствующего алканола. Аналогичным образом низшие алкены или низшие алканолы преобразуют в соответствующие гликоли.
Ранее метан хлорировали газообразным хлором или подвергали оксихлорированию под действием кислорода и хлористоводородной кислоты с получением метилхлорида наряду с другими хлоридами, такими как дихлорметан, трихлорметан и четыреххлористый углерод. При этом способе галоидирования метана образуется хлористоводородная кислота. Такая хлористоводородная кислота должна быть удалена, дегидратирована путем азеотропной перегонки и возвращена в цикл.
Затем отогнанные хлорметаны гидролизуют в паровой фазе до метанола, формальдегида, муравьиной кислоты, двуокиси углерода и хлористоводородной кислоты. Полученные составы зависят от селективности хлорирования до метилхлорида и других хлоридов. При этом существенными являются коррозия и сложности, связанные с обращением с хлором и хлористоводородной кислотой.
Цель изобретения - преодоление или исключение существовавших ранее проблем и создание упрощенного способа конверсии алкана в соответствующий алканол. Этот способ основан на получении алкилхлоридов и их гидратации до соответствующего спирта.
В соответствии с этим способом метан (предпочтительный алкан) подвергают взаимодействию с хлоридом металла (хлоридом двухвалентного металла), где металл находится в более высоком из двух возможных валентных состояний с получением метилхлорида, соответствующего хлорида металла (хлорида одновалентного металла), в котором металл находится в более низком из двух возможных валентных состояний, и хлористоводородной кислоты. Полученные метилхлорид и хлористоводородную кислоту подвергают взаимодействию с оксидом магния для получения метилового спирта и гидрата хлорида магния. Полученный хлорид одновалентного металла подвергают взаимодействию с хлористоводородной кислотой и кислородом для получения хлорида двухвалентного металла, а гидрат хлорида магния преобразуют в оксид магния и хлористоводородную кислоту. Аналогичным образом низшие алкены преобразуют в соответствующие гликоли.
На фиг. 1 представлена технологическая схема одного осуществления заявленного способа; на фиг. 2 - технологическая схема другого и упрощенного осуществления заявленного способа.
Метан подвергают взаимодействию с хлоридом металла, который способен его хлорировать. В качестве металла используют такой, который одновременно снижает свою валентность до более низкой. Такой, например, хлорид двухвалентной меди взаимодействует с метаном с образованием метилхлорида, хлорида одновалентной меди и хлористоводородной кислоты в соответствии с реакцией (I)
2CuCl2 + CH4 → 2CuCl + CH3Cl + HCl. (I)
Затем полученные метилхлорид и хлористоводородную кислоту подвергают взаимодействию с паром и катализатором, содержащим оксид магния, в соответствии со схемой реакции (II) \\2 H2O + CH3Cl + HCl + MgO → CH3OH + MgCl2 + H2O. (II)
Воздух и кислород пропускают в противотоке через хлорид магния для того, чтобы выделить хлористоводородную кислоту в соответствии со схемой реакции (III)
MgCl2 • xH2O → MgO + 2HCl, (III)
а затем через хлорид одновалентной меди с получением вновь хлорида двухвалентной меди в соответствии со схемой реакции (IV)
2 HCl + 1/2 O2 + 2CuCl → 2CuCl2 + H2. (IV)
Реакцию (I) удобно проводить при температуре от 300 до 360oC, при которых не происходит образования хлора путем разложения хлорида двухвалентной меди. Такое разложение имеет место при 993oC с образованием хлора. Благодаря поддержанию низкой температуры возможность дальнейшего хлорирования метилхлорида до высших хлоридов сведена к минимуму.
Реакцию (II) удобно проводить при 200oC или менее для того, чтобы избежать адсорбирования хлоридов и для выделения их в соответствии с законом действия масс.
Реакцию (III) удобно проводить при температуре около 200oC, а реакцию (IV) удобно проводить приблизительно в области температур от 300 до 380oC.
Предпочтительный способ представляет собой непрерывный процесс, в котором используют реакторы с псевдоожиженным слоем. Однако использование ректоров с псевдоожиженным слоем является необязательным и можно использовать реакторы с порционной загрузкой. Вместо хлорида металла, например, хлорида меди, в реакции (I) можно использовать смесь. Предпочтительной смесью является смесь хлорида двухвалентной меди, хлорида одновалентной меди и оксида магния. Эту конкретную смесь предпочтительно используют для хлорирования метана, поскольку при разбавлении хлорида меди оксидом магния образуются менее хлорированные метилхлориды. Кроме того, при повторном окислении в присутствии хлористоводородной кислоты образующийся хлорид магния взаимодействует с любым образующимся оксидом меди с получением хлорида меди. Оксид магния служит также для увеличения пористости
MgCl2 + CuO → MgO + CuCl2. (V)
Избыток хлорида одновалентной меди адсорбирует любой образующийся хлор
CuCl + 1/2 Cl2 → CuCl2. (VI)
Вместо того чтобы подвергать метилхлорид взаимодействию с оксидом магния по реакции (II), можно использовать магниевый цеолит для гидролиза метилхлорида до метанола и хлористоводородной кислоты; при 200oC хлористоводородная кислота адсорбируется далее оксидом магния. При температуре свыше 115oC образуется MgCl2 • 4H2O, полностью адсорбируя всю хлористоводородную кислоту, которая может быть вновь выделена путем нагревания его до 200oC при пропускании через него воздуха.
Механизм и кинетика термического разложения гидратов хлорида магния описаны (Kirk-Othmer Encyclopedia of Chemical Technology, vol. 14-623, 3d Edition). Реакции, которые являются обратимыми, протекают по следующим стадиям:
95-115oC MgCl2 • 6H2O ⇆ MgCl2 • 4H2O + 2H2O;
135-180oC MgCl2 • 4H2O ⇆ Mg(OH)Cl + HCl + 3H2O;
186-230oC MgCl2 • H2O ⇆ Mg(OH)Cl +HCl;
230oC Mg(OH)Cl ⇆ +HCl.
Преимущества являются следствием этих свойств гидратов хлорида магния адсорбировать и вновь выделять хлористоводородную кислоту.
Чрезвычайно высокую конверсию метилхлорида в метиловый спирт (практически 100%) за счет магниевой формы цеолита (MgZ2) можно объяснить следующими реакциями:
MgZ2 + 2CH3Cl → MgCl2 + 2CH3Z,
CH3Z + H2O → HZ + CH3OH
и
MgCl2 +H2O → Mg(OH)2 + 2HCl,
Mg(OH)2 +2HZ → MgZ2 +2H2O.
В этом случае цеолит магния действует как катализатор.
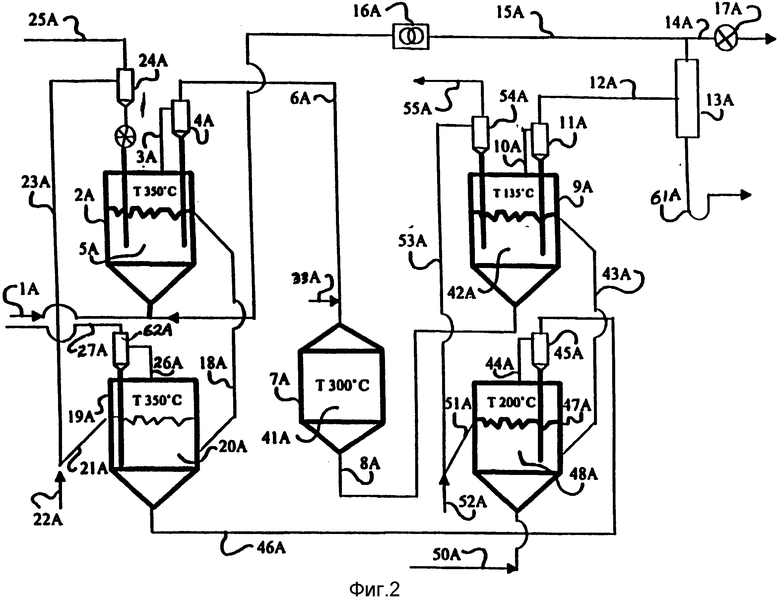
Как показано на фиг. 1, где изображен типичный непрерывный процесс с использованием реакторов с псевдоожиженным слоем, метан подают во флюидизатор 2 по трубопроводу 1, где он взаимодействует с хлоридом двухвалентной меди, содержащемся в псевдоожиженном реагенте 5, состоящем из смеси оксида магния, хлорида двухвалентной меди и хлорида одновалентной меди. (В другом варианте можно использовать бромид двухвалентной меди и бромид одновалентной меди). Прореагировавший газ, состоящий главным образом из хлористоводородной кислоты, метилхлорида и избытка метана, поступает по трубопроводу 3 в циклон 4, из которого пылевидные частицы возвращаются в реактор 2. Газ, покидая циклон 4 по трубопроводу 6, поступает в реактор 7, который содержит катализатор (магниевый цеолит) 41, вместе с паром, который поступает по трубопроводу 33. Прореагировавшие газы, содержащие метиловый спирт, хлористоводородную кислоту и избыток метана, покидают реактор 7 по трубопроводу 8, который направляет их во флюидизатор 9, содержащий оксид магния 42, адсорбирующий всю хлористоводородную кислоту.
Газы, выходящие из флюидизатора 9 по трубопроводу 10 в циклон 11, из которого пылевидные частицы возвращаются во флюидизатор 9, содержат метиловый спирт и избыточный метан. Эти газы подают по трубопроводу 12 в конденсатор 13, где метиловый спирт конденсируется и покидает конденсатор 13 по трубопроводу 61.
Несконденсированный метан покидает конденсатор 13 по трубопроводу 14 к выпускному клапану 17 и по трубопроводу 15 в компрессор 16, который возвращает избыточный метан по трубопроводу 1.
Отработанный реагент 5 из флюидизатора 2 поступает по трубопроводу 18 во флюидизатор 19, где встречает поток газа, содержащего воздух и хлористоводородную кислоту; хлорид одновалентной меди в нем регенерируется снова в форму хлорида двухвалентной меди.
Регенерированный реагент 20 поступает по трубопроводу 21, где он встречает транспортирующий газ воздух 22, который поднимает его по трубопроводу 23 в циклон 24, откуда транспортирующий газ (воздух) выпускается по трубопроводу 25 в атмосферу, а реагент 5 подается через циклон 24 во флюидизатор 2.
Газы из флюидизатора 19, содержащие возможные следы хлористоводородной кислоты, подаются по трубопроводу 26 в циклон 62, из которого пылевидные частицы возвращаются во флюидизатор 19, а освобожденные газы по трубопроводу 27 - во флюидизатор 28, который содержит оксид магния 32, он и адсорбирует все следы хлористоводородной кислоты. Очищенный газ выпускается в атмосферу по трубопроводу 29 и циклон 30, который возвращает пылевидные частицы во флюидизатор 28, а выпускаемый чистый газ без примесей - по трубопроводу 31.
Отработанный оксид магния 32 покидает флюидизатор 28 по трубопроводу 38, который направляет его во флюидизатор 34, где его встречает поток воздуха, который регенерирует отработанный оксид магния 37. Регенерированный оксид магния направляют по трубопроводу 56, здесь транспортирующий газ 40 поднимает его по трубопроводу 39 в циклон 57. Транспортный газ выпускают по трубопроводу 58 в атмосферу, а регенерированный оксид магния поступает во флюидизатор 28. Газы, покидающие реактор с псевдоожиженным слоем 34, содержащие воздух и хлористоводородную кислоту, направляются по трубопроводу 35 в циклон 36, откуда пылевидные частицы возвращаются во флюидизатор 34, а газы подают по трубопроводу 60 в трубопровод 59.
Отработанный оксид магния 42 покидает реактор с псевдоожиженным слоем 9 по трубопроводу 43, который направляет его во флюидизатор 47, где его встречает поток воздуха, введенный по трубопроводу 50, который регенерирует отработанный оксид магния 48. Регенерированный оксид магния поступает по трубопроводу 51, здесь его встречает транспортный газ (воздух) 52, который поднимает его в циклон 54 по трубопроводу 53. Транспортный газ выпускается по трубопроводу 55, и циклон 54 направляет регенерированный оксид магния во флюидизатор 9.
Газы, покидающие флюидизатор 47, содержащие хлористоводородную кислоту и воздух, направляются по трубопроводу 44 в циклон 45, откуда пылевидные частицы возвращают во флюидизатор 47, а газы поступают по линии 46 в линию 59, они направляются по трубопроводу 46 в трубопровод 59 и вместе с газами из трубопровода 60 поступают во флюидизатор 19.
Воздух поступает во флюидизатор 34 по трубопроводу 49; воздух поступает во флюидизатор 47 по трубопроводу 50.
Температуры, указанные на фиг. 1, являются показательными. Реагент 5 получают, например, смешивая хлорид двухвалентной меди, хлорид одновалентной меди и оксид магния, в следующих предлагаемых молярных соотношениях:
Хлорид двухвалентной меди - 1,0
Хлорид одновалентной меди - 0,1
Оксид магния - 2,0
Реагент удобно приготавливать следующим образом: 1,1 моль хлорида двухвалентной меди растворяют в воде до насыщения. Добавляют 2 моль оксида магния. Смесь упаривают досуха и гранулируют. Затем гранулированный продукт восстанавливают метаном или водородом до тех пор, пока 0,1 моль хлорида меди не восстановится до хлорида одновалентной меди. Когда регенерируют реагент, всегда должен присутствовать хлорид одновалентной меди.
Оксид магния служит для снижения активности хлорида двухвалентной меди. В сочетании с оксидом магния можно использовать другие материалы - разбавители (оксид алюминия, двуокись кремния, фуллеровскую землю и т.д.).
Когда конверсия за цикл ограничена менее чем 20%, дальнейшее хлорирование метана ограничено до менее чем 1%. Повышение содержания оксида магния в реагенте оказывает то же самое действие.
Магниевый цеолитный катализатор предпочтительно получают следующим образом: цеолит типа A или типа X (Kirk - Othmer Encyclopedia of chemical Technology, 3d Edition, vol. 15, p. 665) помещают в колонну, а раствор растворимой соли магния (сульфат, нитрат и т.д.) пропускают через цеолит, за счет этого натрий заменяется на магний. Цеолит в магниевой форме затем промывают и сушат, готовя к употреблению. Этот способ хорошо известен (Kirk - Othmer Encyclopedia of chemical Technology, 3d Edition, vol. 13, p. 678 и т. д.).
Хотя предыдущая иллюстрация относилась к хлоридам меди, такие хлориды необязательно заменяют бромидами. Метан также может быть необязательно заменен на этан, пропан или н-бутан для получения соответствующих спиртов.
В альтернативном осуществлении изобретения (фиг. 2) опущены флюидизатор 28 и флюидизатор 34, изображенные на фиг. 1. На фиг. 2 соответствующее оборудование обозначено такими же цифрами, причем индекс A добавлен для удобства сравнения. Все количество хлористоводородной кислоты, поступающее из флюидизатора 47A, полностью абсорбируется в реакторе 19A без образования хлора.
Тщательный термодинамический анализ реакций включает следующее:
Константы реакции (T=300K):
2HCl+1/2 O2 → Cl2 + H2O ΔF = -9080 кал K=9,35•106;
2CuCl = 1/2 O2 → CuCl2+CuO ΔF = - 15700 кал K=3,01 • 1011;
CuO + HCl → CuCl2 + H2O ΔF = - 42857 кал K = 2,16 • 1031.
Легкость протекания реакции зависит от константы реакции K. Так, задолго до того, как хлор образуется при окислении хлористоводородной кислоты, он взаимодействует с присутствующим оксидом меди.
Для того чтобы это обеспечить, избыток оксида меди вводят в исходную реакционную смесь. Предпочтительный состав реагента 5 включает по крайней мере 0,1 моль оксида меди в добавлении к оксиду магния и хлориду одновалентной меди, например, моль:
Хлорид двухвалентной меди - 1
Оксид двухвалентной меди - 0,1
Хлорид одновалентной меди - 0,1
Оксид магния - 2
На фиг. 2 представлена упрощенная конфигурация фиг. 1, где низший алкан преобразуют в соответствующий низший алканол способом, соответствующим способу, описанному для фиг. 1, но с добавлением оксида двухвалентного металла, например, оксида двухвалентной меди, в реагент 5.
После того как низший алкен, например, этилен, обработан на аналогичном оборудовании в соответствующих условиях, его сначала хлорируют до 1,2-дихлорэтана, а затем гидролизуют до этиленгликоля. Единственная разница состоит в том, что требуются большие порции пара, чтобы предотвратить его конденсацию в реакторе 7A наряду с более высокой температурой во флюидизаторе 9A (135oC). Далее приводятся данные по зависимости давления пара от температуры для этиленгликоля.
Давление пара, мм рт.ст. - Температура,oC
10 - 92,1
20 - 105,8
40 - 120,0
60 - 129,5
100 - 141,8
200 - 158,5
400 - 178,5
760 - 197,3
Таким образом, если парциальное давление этиленгликоля составляет 80 мм рт.ст., учитывая избыток пара и избыток этилена, температура во флюидизаторе 9A может поддерживаться при 135oC.
После того как этиленовый спирт превращен в пары и аналогичным образом обработан на том же оборудовании, его сначала хлорируют до этиленхлоргидрина, который в свою очередь гидролизуют до этиленгликоля. Соблюдаются те же самые температурные предосторожности.
Как показано на фиг. 2, который изображает типичный непрерывный процесс с использованием реакторов с псевдоожиженным слоем, этилен подают во флюидизатор 2A по трубопроводу 1A, где он взаимодействует с хлоридом двухвалентной меди, содержащимся в псевдоожиженном реагенте 5A, состоящем из смеси хлорида двухвалентной меди, оксида двухвалентной меди, оксида магния и хлорида одновалентной меди. Альтернативно вместо хлоридов используются бромиды.
Прореагировавший газ, состоящий главным образом из хлористоводородной кислоты, 1,2-дихлорэтана и избытка этилена, поступает по трубопроводу 3A в циклон 4A, из которого пылевидные частицы возвращаются в реактор 2A. Газ, покидающий циклон 4A по трубопроводу 6A, поступает в реактор 7A, в котором содержится катализатор 41A (магниевый цеолит), вместе с паром, поданным по трубопроводу 33A. Прореагировавшие газы, содержащие этиленгликоль, хлористоводородную кислоту и избыток метана, покидают реактор 7A по трубопроводу 8A, он подает их во флюидизатор 9A, содержащий оксид магния 42A, который абсорбирует всю хлористоводородную кислоту. Газы, покидающие флюидизатор 9A по трубопроводу 10A в циклон 11A, из которого пылевидные частицы возвращаются во флюидизатор 9A, содержит этиленгликоль, избыток этилена и водяной пар. Эти газы подают по трубопроводу 12A в конденсатор 13A, где гликоль и водяной пар конденсируются и выходят из конденсатора 13A по трубопроводу 61A.
Несконденсированный этилен выходит из конденсатора 13A по трубопроводу 14A через выпускной клапан 17A и по трубопроводу 15A в компрессор 16A, который возвращает избыточный этилен в трубопровод 1A.
Отработанный реагент 5A из флюидизатора 2A поступает по трубопроводу 18A во флюидизатор 19A, где его встречает поток газа, состоящий из воздуха и хлористоводородной кислоты; хлорид одновалентной меди регенерируется обратно в форму двухвалентной меди. Регенерированный реагент 20A поступает по трубопроводу 21A, где встречает транспортный газ (воздух) 22A, который поднимает его по трубопроводу 23A, здесь транспортный газ (воздух) выпускают по трубопроводу 25A в атмосферу, а реагент 5A поступает через циклон 24A во флюидизатор 2A.
Отработанный оксид магния 42A выходит из флюидизатора 9A по трубопроводу 43A, он направляет его во флюидизатор 47A, где он встречает поток воздуха, вводимый по трубопроводу 50A, который регенерирует отработанный оксид магния 48A. Генерированный оксид магния поступает по трубопроводу 51A, где встречает транспортный газ (воздух) 52A, который поднимает его в циклон 54a по трубопроводу 53A. Транспортный газ выпускают по трубопроводу 55A, а регенерированный оксид магния направляется циклоном 54A во флюидизатор 9A.
Газы, выходящие из флюидизатора 47A, содержащие хлористоводородную кислоту и воздух, поступают по трубопроводу 44A в циклон 45A, откуда пылевидные частицы возвращаются во флюидизатор 47A, а газ направляется по трубопроводу 46A во флюидизатор 19A.
Воздух поступает в псевдоожиженный слой 47A по трубопроводу 50A. Температуры, указанные на фиг. 2, являются указательными. Реагент 5A содержит избыток оксида меди.
Аналогичным образом получают пропиленгликоль из пропилена. Когда исходным веществом для получения этиленгликоля является этиловый спирт вместо этилена, то сконденсированные спирт, водяной пар и гликоль, полученные в конденсаторе 13A, подают в разделитель (не показан), где избыточный этанол отделяют от гликоля и возвращают в парообразном состоянии в трубопровод 1A.
Описанные способ и оборудование, таким образом, являются удобными для преобразования низших алканов в соответствующие низшие алканолы, и для преобразования низших алкенов или низших алканолов в соответствующие гликоли. Низшие одноосновные или двухосновные спирты получают путем следующих стадий:
а) взаимодействием исходного продукта с галогенидом двухвалентного металла (где металл находится в более высоком из двух возможных валентных состояний) для получения продукта реакции, соответствующего галогениду одновалентного металла (где металл находится в более низком из двух возможных валентных состояний) и галогенводородной кислотой;
б) взаимодействием продукта реакции со стадии (а) и галогенводородной кислоты с оксидом магния для получения соответствующего низшего одноосновного или двухосновного алканола;
причем исходным продуктом для получения низшего одноосновного спирта является низший алкан, из которого получают соответствующий низший алканол, а исходным продуктом для получения низшего двухосновного спирта является либо низший алканол, либо низший алкен, из которых получают соответствующий низший гликоль. Для проведения необходимых реакций предусмотрены две системы с псевдоожиженным слоем.
Изобретение и его преимущества легко понятны из предшествовавшего описания. Очевидно, что в процесс, в системы и составы могут быть внесены различные изменения, не выходя за рамки объема и духа изобретения или не теряя его материальных преимуществ. Способ, системы и продукты, описанные здесь, являются просто иллюстративными для предпочтительных осуществлений изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОКИСЛИТЕЛЬНОГО ГАЛОГЕНИРОВАНИЯ C УГЛЕВОДОРОДОВ ДО ГАЛОГЕНИРОВАННЫХ C УГЛЕВОДОРОДОВ И СВЯЗАННЫЕ С НИМ ИНТЕГРИРОВАННЫЕ СПОСОБЫ | 2002 |
|
RU2286329C2 |
| СПОСОБ ОКИСЛИТЕЛЬНОГО ГАЛОГЕНИРОВАНИЯ И СПОСОБ ПОЛУЧЕНИЯ ГАЛОГЕНИРОВАННОГО C ПРОДУКТА | 2006 |
|
RU2409547C2 |
| СИНТЕЗ УГЛЕВОДОРОДОВ | 2004 |
|
RU2366642C2 |
| СПОСОБ ОБЛАГОРАЖИВАНИЯ КРЕМНИЙСОДЕРЖАЩИХ ОСТАТКОВ, ПОЛУЧЕННЫХ ПОСЛЕ ВЫЩЕЛАЧИВАНИЯ МЕДЬСОДЕРЖАЩИХ ОСТАТКОВ СИНТЕЗА ХЛОРСИЛАНОВ | 1995 |
|
RU2106302C1 |
| ОКИСЛИТЕЛЬНОЕ МОНОГАЛОГЕНИРОВАНИЕ МЕТАНА | 2009 |
|
RU2490246C2 |
| Способ получения сложных эфиров этиленгликоля | 1969 |
|
SU441702A1 |
| Способ получения алкилгалоидсиланов | 1984 |
|
SU1838316A3 |
| Способ получения 2-/2',2',2'-тригалогенэтил/-4-галогенциклобутан-1-онов | 1978 |
|
SU917695A3 |
| СПОСОБ АЛКИЛИРОВАНИЯ АЛКАНОВ С-С АЛКИЛГАЛОГЕНИДАМИ С ИСПОЛЬЗОВАНИЕМ ТВЕРДОГО КИСЛОТНОГО КАТАЛИЗАТОРА | 1998 |
|
RU2190589C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-БРОМ-4,5-ДИАЛКОКСИБЕНЗОЙНОЙ КИСЛОТЫ | 2011 |
|
RU2576520C2 |
Низшие одноосновные и двухосновные спирты получают, осуществляя следующие стадии: а) взаимодействие исходного материала с галогенидом двухвалентного металла (где металл находится в более высоком из двух возможных валентных состояний) для получения продукта реакции, соответствующего галогенидам одновалентного металла (где металл находится в более низком из двух возможных валентных состояний) и галогенводородной кислоты; б) взаимодействие продукта реакции со стадии (а) и галогенводородной кислоты с оксидом магния для получения соответствующего низшего одноосновного или двухосновного алканола, где исходным продуктом для получения низшего одноосновного спирта является низший алкан, из которого получают соответствующий низший алканол, а исходным продуктом для получения низшего двухосновного спирта является либо низший алкол, либо низший алкен, из которых получают соответствующий низший гликоль. Для проведения необходимых реакций предложены две непрерывные системы с псевдоожиженными слоями. Предложенный способ позволяет упростить процесс синтеза и может быть использован в области органической химии. 3 с. и 12 з.п. ф-лы, 2 ил.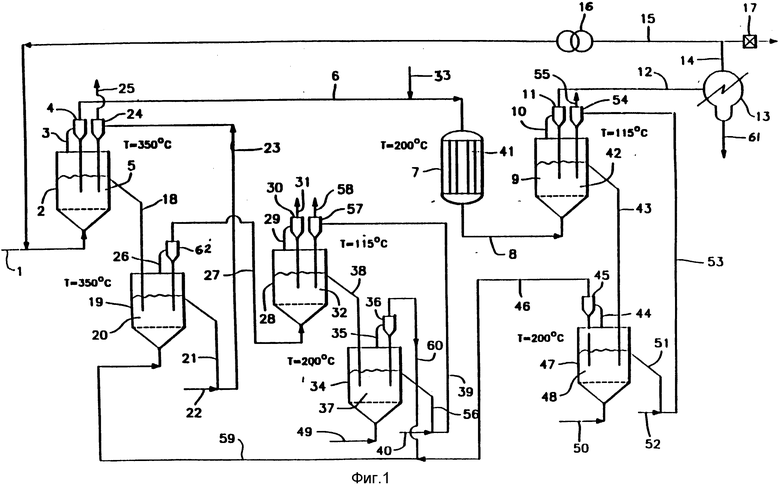
Приоритет по пунктам:
04.11.92 по пп.2 - 8;
04.08.93 по пп.1, 9 и 11.
| US, 5243098, C 07 C 31/04, 07.09.93 | |||
| US, 5185479, C 07 C 29/124, 09.02.93 . |
Авторы
Даты
1998-06-20—Публикация
1993-10-28—Подача