Изобретение относится к получению трансгенных растений, в частности трансгенных растений кукурузы, и может быть использовано в сельском хозяйстве.
Генетическая инженерия растений, которая предполагает изоляцию и обработку генетического материала (обычно в форме ДНК или РНК) с последующим введением этого генетического материала в растение или растительные клетки, открывает значительные перспективы для современного сельского хозяйства и селекции растений. Методами генетической инженерии можно увеличивать пищевую ценность сельскохозяйственных культур, повышать урожай, снижать затраты на производство продукции, обеспечивать устойчивость к вредителям, стрессу и засухе, осуществлять производство фармацевтического сырья, химических соединений и биологических молекул, а также получать другие полезные результаты. После идентификации, клонирования и переконструирования гена его необходимо также внедрить в нужное растение таким образом, чтобы полученное растение было одновременно фертильно и способно передавать данный ген своему потомству.
В настоящее время разработано и доступно множество методов трансформации различных растений и растительных клеток при помощи ДНК. В основном это относится к двудольным растениям, но имеются также сообщения и об определенных достижениях в трансформации некоторых однодольных злаков. Однако некоторые виды злаков до сих пор было невозможно трансформировать каким-либо методом. Так, до настоящего изобретения не были известны технологии, которые позволяли бы получать устойчиво трансформированные растения Zea mays, в которых внесенная рекомбинантная ДНК передавалась бы в течение по крайней мере одного полового цикла. Отсутствие достижений в данной области подтверждается литературой и обсуждалось в ряде последних обзоров [40, 50, 5].
Некоторые испытанные или предложенные способы введения ДНК в клетки кукурузы предполагают использование электропорации, микроинъекции, обстрела микроскопическими частицами, слияния с липосомами, переноса, опосредованного Agrobacterium, макроинъекции или обработки раствором очищенной ДНК.
Так например, в [14 и 37] сообщается о введении ДНК в кукурузу путем смешивания пыльцевых зерен с растворами ДНК и последующего нанесения этой пыльцы на пестики кукурузы. В упомянутых работах отсутствуют молекулярные данные, подтверждающие введение экзогенной ДНК в клетки кукурузы. В [54] описывается инкубация ДНК с пыльцой кукурузы с последующим опылением початков кукурузы и образованием семян. Сообщается, что растения, выращенные из этих семян, содержат внесенную ДНК, но отсутствует указание на то, что внесенная ДНК передается в течение полного полового цикла.
В [19] сообщается о трансформации проростков Zea mays, опосредованной Agrobacterium. Доказательства были основаны на экспериментах, которые иногда могут быть ненадежными. К настоящему времени не сообщалось о дальнейших успехах в области трансформации с использованием пыльцы или переноса, опосредованного Agrobacterium.
Сообщалось также, что в результате обстрела микрочастицами получались трансформированные клетки кукурузы. Данный метод описан в [45], а также в [55] . В [29] описывается получение трансформированных клеток кукурузы с помощью бомбардировки микрочастицами. Использованные клетки, однако, не были способны образовывать растения путем регенерации. Таким образом, не существует опубликованных протоколов, описывающих введение ДНК путем бомбардировки в способные к регенерации культуры кукурузных клеток любого типа. Не сообщалось также о стабильном введении гена в результате бомбардировки кукурузного каллуса с последующей регенерацией фертильных растений и передачей введенного гена в течение хотя бы одного полового цикла. В [53] описывается бомбардировка ДНК кукурузной пыльцы, нанесение ее на рыльца и образование семян, которые, по сообщению авторов, содержат экзогенную ДНК. Однако при этом отсутствуют доказательства того, что эта ДНК передавалась в течение полного полового цикла, и данная группа исследователей не сообщала о получении ими дальнейших результатов.
Согласно [16] электропорация кукурузных протопластов приводила к образованию трансформированных клеток, хотя эти клетки не образовывали регенерированных растений.
Следующая серьезная проблема, мешающая успешному получению фертильных растений кукурузы, заключается в отборе этих немногих трансформантов таким образом, чтобы ни регенерационная способность (в случае использования протопластов или клеточных культур), ни фертильность трансформантов не были нарушены. В связи с общей низкой частотой трансформантов, полученных при трансформации, та или иная процедура отбора часто оказывается необходимой. Такой отбор, однако, обычно предполагает использование какого-либо токсичного агента, например гербицида или антибиотика, который может отрицательно влиять на регенерационную способность или фертильность получаемых растений.
С другой стороны, известно, что нетрансформированные протопласты, культивируемые клетки и каллусы кукурузы по меньшей мере могут регенерировать с образованием зрелых растений и что получаемые растения часто фертильны. Так, например, в [46] и [41] обсуждаются методы получения протопластов из клеточных культур и восстановления фертильных растений из этих протопластов. В [42] описываются попытки регенерации растений кукурузы из протопластов, изолированных из культур эмбриогенных клеток кукурузы.
Однако до сих пор исследователям не удавалось определить, какие ткани или культуры кукурузы являются подходящими реципиентами экзогенной ДНК, в частности содержат полезное число клеток, которые рецептивны к экзогенной ДНК и будут стабильно ее интегрировать, и, в то же время, являются частью зародышевой линии, т.е. частью клеточной линии, ведущей к следующему поколению растений.
Таким образом, исследования сталкиваются с дилеммой. В то время как некоторые способы трансформации приводили, по данным исследований, к получению трансформированных клеток кукурузы и определенные клетки и ткани были предложены в качестве потенциальных реципиентов в связи с их способностью образовывать растения путем регенерации, исследователям не удалось найти комбинацию приемов, которые обеспечили бы успешное получение трансформированных растений кукурузы, способных передавать введенную ДНК в течение одного полного полового цикла.
Известен [43] способ получения трансгенного растения кукурузы (Zea mays), включающий в себя получение из растения реципиентных клеток, их трансформацию, отбор трансформированных клеток и регенерацию из них растения, причем реципиентные клетки представляют собой протопласты, а трансформацию осуществляют путем электропорации.
Однако полученные растения являются стерильными, кроме того, использованные методы получения клеточной линии были невоспроизводимы.
Таким образом, задачей данного изобретения является создание способа получения трансгенных растений Zea mays, который бы позволил получить фертильные растения, которые бы передавали введенный ген потомству, а метод получения клеточной линии был бы воспроизводимым.
Данная задача решается тем, что предложен способ получения трансгенного растения Zea mays, содержащего стабильно интегрированную в хромосому рекомбинантную ДНК, включающий получение реципиентных клеток, их трансформацию путем введения в них экзогенной ДНК, отбор трансформированных клеток и последующую регенерацию из них растений, в котором, согласно изобретению, реципиентные клетки получают из способной к регенерации рыхлой эмбриогенной каллусной культуры, а трансформацию осуществляют путем обстрела реципиентных клеток микрочастицами, покрытыми рекомбинантной ДНК.
Целесообразно получать каллусную культуру из незрелых зародышей.
Целесообразно для обстрела микрочастицами использовать каллусную культуру, имеющую вид комочков, масса каждого из которых составляет 30 - 80 мг.
Целесообразно каллусную культуру культивировать на твердой питательной среде.
На фиг. 1,а показана карта плазмидного вектора pHYGI1, использованного в примере 1. На фиг. 1,б показана соответствующая часть линеаризированного плазмидного вектора pHYGI1, включающая кодирующую последовательность НРТ и ассоциированные регуляторные элементы. Номера пар оснований начинаются с 5'-нуклеотида в последовательности, распознающейся указанными рестрикционными ферментами, начиная с сайта EcоRI на 5'-конце промотора 35S ВТМ.
На фиг. 2,а показана карта плазмидного вектора pBII221, использованного в примере 1.
На фиг. 2,б показан линеаризованный вектор pBII221, в частности участок от сайта расщепления Hind III до сайта EcoRI.
На фиг. 3 показаны Саузерн-блот ДНК изолированной из каллусной линии РН1 и из контрольной нетрансформированной каллусной линии, а также схематическое изображение зондов pHYGIl, использованных в эксперименте.
На фиг. 4 показаны Саузерн-блот ДНК листьев, изолированной из растений R0, регенерированных из линии РН1 и из нетрансформированного каллуса, а также схематическое изображение зондов PHYGI1, использованных в эксперименте.
На фиг. 5 показаны Саузерн-блот ДНК листьев, изолированной из потомства R1 растений R0 PH1 и нетрансформированных растений R0, а также схематическое изображение зондов pHYGI1, использованных в эксперименте.
На фиг. 6 показаны Саузерн-блот ДНК, изолированной из каллусной линии PH2 и из нетрансформированной контрольной каллусной линии, а также схематическое изображение зондов pHYGI1, использованных в эксперименте.
На фиг. 7,а показана карта плазмидного вектора pZ27Z10, использованного в примере 2.
На фиг. 7,б показана линеаризованная плазмида pZ27Z10, включающая кодирующую последовательность Z10 и ассоциированные регуляторные элементы.
На фиг. 8 схематически показано положение ПЦР-праймеров в пределах химерного гена Z27 - Z10.
Изобретение направлено на получение фертильных трансгенных растений и семян вида Zea mays, преимущественно имеющих повышенную пищевую ценность, растений, растительных тканей и семян, получаемых из этих трансгенных растений, а также их потомства и получаемых из них продуктов. Описанным способом могут быть получены любые растения данного вида, включая полевую, сладкую, кормовую кукурузу, а также другие разновидности кукурузы.
"Трансгенными" в данном случае считаются любые клетки, клеточные линии, каллусы, ткани, части растений или растения, генотипы которых были изменены присутствием рекомбинантной ДНК (называемой в генной инженерии также гетерологичной, экзогенной или чужеродной ДНК), которая была введена в генотип растения в процессе генной инженерии или же была первоначально введена в генотип родительского растения в ходе такого процесса и затем передана последующим поколениям путем полового процесса или бесполого размножения. Генотипом в данном случае считается совокупность всего генетического материала клетки как хромосомного, так и внехромосомного. Таким образом, используемый в данном случае термин "трансгенный" не включает растения, генотипы которых изменены обычными методами скрещивания растений или в результате имеющих место в природе процессов случайного оплодотворения, вирусной инфекции или спонтанного мутирования.
"Наследуемой" считается ДНК, способная передаваться в течение по меньшей мере одного полового цикла растения, то есть от растения через его гаметы к растению-потомку.
В соответствии с данным изобретением трансгенные растения могут быть получены путем (1) основания способной к регенерации клеточной культуры, предпочтительно рыхлого эмбриогенного каллуса, (2) трансформации упомянутой клеточной культуры методом обстрела микрочастицами, (3) идентификации или отбора трансформированных клеток и (4) регенерации фертильных трансгенных растений из трансформированных клеток. Некоторые из растений, описываемых в данном изобретении, могут быть получены из трансгенных семян, полученных от фертильных трансгенных растений с использованием обычных методов скрещивания с целью получения трансгенных элитных линий и сортов или коммерческих гибридных семян, содержащих рекомбинантную ДНК.
Линии растений и культуры тканей
Особенно полезными для получения фертильных трансгенных растений кукурузы оказались клетки каллусов, способные к регенерации как до, так и после селекционных процедур, детально описанных ниже. Такие клетки получают в основном из меристемной ткани, содержащей клетки, не прошедшие терминальную дифференцировку. Эта ткань у злаков вообще и у кукурузы в частности включает ткани, находящиеся в основаниях молодых листьев, молодых кистей, незрелых зародышах и узлах стеблей. Использовались преимущественно незрелые зародыши. Методы получения и поддержания каллуса из таких растений и таких тканей хорошо известны и подробно описаны в литературе, например в [39].
Конкретный используемый каллус должен быть способен образовывать путем регенерации фертильное растение. Специфическая регенерационная способность определенного каллуса важна для успеха используемого в данном случае процесса обстрела/отбора, поскольку в ходе селекции регенерационная способность существенно снижается. Поэтому важно работать с самого начала с культурами, имеющими максимально возможную регенерационную способность. Было установлено, что каллус в возрасте от 3 до 36 месяцев имеет достаточно высокую способность к регенерации и поэтому предпочтителен. Регенерационная способность конкретной культуры легко может быть определена путем перенесения проб этой культуры на регенерационную питательную среду и отслеживания роста побегов, корней и проростков. Относительное число проростков на чашку Петри или на грамм живого веса ткани может быть использовано для грубой количественной оценки регенерационной способности. В целом предпочтительна культура, производящая по меньшей мере одно растение на грамм ткани каллуса.
Хотя каллусные культуры кукурузы могут быть основаны от различных тканей растения, использованные в данном случае культуры получаются предпочтительно из незрелых зародышей кукурузы, которые извлекаются из зерновок, находящихся в початке кукурузы, при достижении зародышами длины 1 - 3 мм. Такого размера они достигают обычно через 9 - 14 дн после опыления. Зародыши в стерильных условиях помещаются на обычную твердую среду таким образом, чтобы эмбриональная ось была направлена вниз (скутеллюмом вверх). Каллусная ткань появляется на скутеллюме через несколько дней или недель. После значительного подрастания каллуса пролиферация клеток скутеллюма может быть оценена на рыхлость и на присутствие сформированных зародышей. Под "рыхлостью" понимается способность ткани легко диспергироваться без повреждения клеток. Ткань такой морфологии переносится затем на свежую среду и пассируется обычными методами через каждые 2 недели. Просеивание с целью уменьшения образования комков и или для увеличения поверхности клеток также может использоваться при пассировании.
Для инициации каллуса используются предпочтительно твердые среды. В предпочтительном варианте среда для основания и поддержания каллуса принципиально основана на солевой среде N 6 по [9], как описано в [3], или на солевой среде MS [34]. К минимальной среде добавляется сахароза и 2,4-дихлорфеноксиуксусная кислота (2,4-Д). Было установлено, что добавки типа L-пролина и гидролизата казеина увеличивают частоту образования каллусных культур, а также улучшают их рост и морфологию. Обычно культуры поддерживаются в темноте, хотя возможно также использование низкой освещенности. Содержание синтетического гормона 2,4-Д, необходимого для поддержания и наращивания каллуса, обычно должно составлять от 0,3 до 3,0 мг л.
Хотя в данном случае успешная трансформация и регенерация была достигнута с использованием рыхлого эмбриогенного каллуса, это не обязательно означает, что для получения фертильных трансгенных растений, предлагаемых в данном изобретении, не могут быть использованы другие способные к трансформации и регенерации клетки, ткани и органы. Единственное обязательное требование к трансформируемым клеткам заключается в том, что после трансформации они должны быть способны образовывать путем регенерации растения, несущие рекомбинантные ДНК, после использования каких-либо процедур отбора или скрининга. Например, могут быть использованы клетки, выращенные в жидкой суспензионной культуре. Для основания таких культур каллус второго типа в возрасте 4 - 6 месяцев переносится в жидкую ростовую среду. Методы получения способных к регенерации суспензионных клеточных культур и соответствующие ссылки приводятся в [21, 39 и 48]. Обычно жидкие ростовые среды для суспензионных культур сходны по составу с твердыми средами для индукции каллусов. Для повышения регенерационной способности и жизнеспособности культуры в жидкие ростовые среды может добавляться абсцизиновая кислота (АВА) в концентрации 10-7 М. Предпочтительно не просеивать каллус перед внесением в жидкую среду.
Жидкие культуры пассируются так, как это необходимо для поддержания их активного роста и регенерационных свойств. В предпочтительном варианте применения культуры пассируются один раз в неделю путем разбавления свежей ростовой средой в отношении 1:8 - 1:9.
ДНК, использованная для трансформации
Используемый термин "рекомбинантная ДНК" означает в данном случае ДНК, произведенную или выделенную (изолированную) из любого источника, которая затем может быть химически изменена и введена в Zea mays. Примером рекомбинантной ДНК, "произведенной" из некоторого источника, может быть последовательность ДНК, идентифицированная как полезный фрагмент в геноме какого-либо организма и затем химически синтезированная в практически чистом виде. Примером рекомбинантной ДНК, "выделенной" из некоторого источника, может быть полезная последовательность ДНК, вырезанная или извлеченная из этого источника химическими методами, например с использованием рестрикционных эндонуклеаз, таким образом, что в дальнейшем она может быть подвергнута обработке, например амплификации, с целью ее введения в организм методами генетической инженерии.
Таким образом, понятие "рекомбинантная ДНК" включает в себя полностью синтетическую ДНК, полусинтетическую ДНК, ДНК, выделенную из биологических источников, и ДНК, происходящую от введенной РНК. Обычно рекомбинантная ДНК не происходит из генотипа Zea mays, являющегося реципиентом этой ДНК, но данное изобретение предусматривает возможность выделения гена из некоторого генотипа Zea mays с последующим введением множественных копий этого гена в тот же самый генотип, например с целью увеличения выхода продукта данного гена, например запасного белка.
Рекомбинантные ДНК включают в себя ДНК генов растений или нерастительные гены, такие как гены бактерий, дрожжей, животных или вирусов, модифицированные гены, участки генов, химерные гены, включающие гены из того же самого или другого генотипа Zea mays; этот перечень, однако, не является исчерпывающим.
Используемые для трансформации рекомбинантные ДНК могут быть кольцевыми или линейными, одно- или двунитевыми. Обычно ДНК присутствует в форме химерной, например плазмидной ДНК, которая может также включать кодирующие участки, фланкированные регуляторными последовательностями, обеспечивающими экспрессию рекомбинантной ДНК в полученных растениях кукурузы. Например, рекомбинантная ДНК может сама включать или нести промотор, активный в Zea mays, или может использовать промотор, уже существующий в генотипе Zea mays и являющийся мишенью трансформации.
Состав и методы конструирования рекомбинантной ДНК, способной трансформировать определенные растения, хорошо известны опытным специалистам, и эти методы и составы могут быть использованы для получения ДНК, применяемой в данном случае. Конкретный состав ДНК не является принципиальным для данного изобретения, и при осуществлении изобретения могут использоваться различные рекомбинантные ДНК. В [50] описаны подходящие компоненты ДНК, пригодные для отбора маркерные гены, энхансеры, интроны и т.д., а также приведены соответствующие ссылки на получаемые составы. В [44] предложены подходящие методы конструирования. Обычно рекомбинантная ДНК относительно невелика, т.е. не превышает по длине 30 kb (30 000 пар оснований), что необходимо для снижения чувствительности к физической, химической или ферментативной деградации, которая, как известно, возрастает с увеличением размера ДНК.
В качестве рекомбинантных ДНК в данном случае приемлемы любые ДНК, обеспечивающие или усиливающие какое-либо полезное свойство получаемого в результате трансгенного растения кукурузы. Эти ДНК могут кодировать белки или антисмысловые РНК-транскрипты, способствующие повышению пищевой ценности, устойчивости к вредителям, болезням и гербицидам и т.п. Например, ДНК может кодировать DHDP-синтетазу, как это делает ген dap A, что повышает количество получаемого лизина, бактерии Bacillus thuringiensis (Bt), δ-эндотоксин или ингибитор протеазы, что повышает устойчивость к насекомым, бактериальную EPSP-синтетазу, увеличивающую устойчивость к гербицидам, хитиназу или глюкан-эндо-1,3-β- гликозидазу, сообщающие растениям фунгицидные свойства.
Важное значение для повышения пищевой ценности имеют гены, кодирующие белки, содержащие большие количества незаменимых аминокислот. Например, для обеспечения адекватного питания и поддержания оптимального роста цыплят в корм, приготовляемый из кукурузы и сои, обычно добавляют синтетический метионин или аналог метионина. Создание сортов кукурузы с более высоким содержанием метионина может уменьшить потребность в добавках этого вещества. Создание линий кукурузы с высоким содержанием метионина может быть достигнуто путем внедрения в геном кукурузы активно экспрессирующихся гена или генов, кодирующих белок с высоким содержанием метионина.
Примерами генов, кодирующих белки с высоким содержанием метионина, являются: (1) ген, кодирующий кукурузный белок zein размером 15 кДа (11% метионина) [38] , (2) ген, кодирующий запасной белок бразильского ореха (18% метионина) [2], и (3) ген, кодирующий белок zein размером 10 кДа (22,5% метионина) [27] . Предпочтительно использование гена белка zein размером 10 кДа, поскольку это собственный ген кукурузы, продукт которого в норме накапливается в зерновках и по содержанию метионина вдвое превышает белок размером 15 кДа. Для достижения высокого уровня экспрессии в семенах кодирующая последовательность этого гена может быть слита с регуляторной последовательностью активно экспрессирующегося специфичного для семян гена. С другой стороны, возможно также введение дополнительных копий интактного гена белка эндосперма размером 10 кДа в геном кукурузы, что также увеличит содержание метионина в семенах кукурузы.
Лизин, аминокислота, незаменимая в диетах человека и животных с простым желудком, является одной из трех аминокислот, недостаточное количество которых ограничивает пищевую ценность основных сельскохозяйственных культур, в частности злаковых. Следовательно, основанные на зерне диеты должны дополняться синтетическим лизином или белковой пищей, содержащей лизин. Далее, поскольку большинство масляно-зерновых диет сами по себе не являются адекватными источниками лизина, уравновешивание пищевых смесей по лизину часто приводит к их перегрузке другими, менее необходимыми питательными веществами. Таким образом, повышение содержания лизина в злаках, или масляно-зерновых культурах, или в том и в другом привел бы к значительному увеличению пищевой ценности, а также к существенному снижению затрат для конечных потребителей, таких как производители свинины и домашней птицы.
Один из возможных подходов к увеличению содержания лизина в злаковых культурах заключается в нарушении биосинтетических путей, позволяющем накапливаться свободному лизину. Ген dap A Escherichia coli кодирует синтетазу дигидродипиколиновой кислоты (DHDPS), ключевой регуляторный фермент, активность которого у растений сильно ингибируется лизином по принципу обратной связи. Бактериальный фермент приблизительно в 200 раз менее чувствителен к ингибированию лизином. Введение гена dap A и его экспрессия в растительных клетках позволили бы продолжать синтез свободного лизина после того, как нативная синтетаза DHDPS растения будет полностью ингибирована.
Особое значение для поддержания урожайности кукурузы и значительного снижения затрат на ее выращивание имеет защита кукурузы от вреда, наносимого насекомыми. В США в число основных вредителей кукурузы входят различные вредители из отряда Lepidoptera, например европейский кукурузный сверлильщик, озимый червь и др., а также различные виды Goleoptera, например Diabrotica spp. Защита кукурузы от вреда, наносимого насекомыми, требует больших затрат со стороны производителей и использования периодически вносимых токсичных химических инсектицидов. Поскольку традиционные способы разведения и селекции не позволили создать новые линии кукурузы, имеющие хорошую устойчивость к основным насекомым-вредителям, внесение и наследование в растениях кукурузы генов или последовательностей, обеспечивающих устойчивость к насекомым, в соответствии с настоящим изобретением, позволило бы снизить затраты производителя, уменьшить использование токсичных химических инсектицидов, а также обеспечило бы более эффективное снижение численности насекомых-вредителей.
Существенной особенностью изобретения является введение гена устойчивости к насекомым в клетку кукурузы, митотическая репликация его таким образом, что он оказывается встроенных в растение кукурузы и в конечном итоге наследуется потомством этого растения в процессе митотических и мейотических делений. Бактерии Bacillus thuringlensis (Bt), включающие около 20 известных подвидов бактерий, продуцируют эндотоксические полипептидазы, токсичные для многих насекомых при поглощении с пищей. Биология и молекулярная биология эндотоксических белков (Bt-белков) и соответствующих генов (Bt-генов) была рассмотрена в [51] и (25]. Гены, кодирующие различные Bt-белки, были клонированы и секвинированы. Исследования показали, что сегмент Bt-полипептида, существенный для токсичности по отношению к различным вредителям из отряда Lepidoptera, содержится приблизительно в первой половине этого полипептида. Следовательно, укороченный полипептид, кодируемый укороченным Bt-геном, во многих случаях сохранит свою токсичность для многих вредоносных Lepidoptera. Было показано, что Bt-полипептиды HD73 и HD1 токсичны для личинок важных американских вредителей кукурузы из отряда Lepidoptera, таких как европейский кукурузный сверлильщик, озимый червь и др. Гены, кодирующие Bt-полипептиды HD73 и HD1, были клонированы и секвинированы соответственно Гайзером [17] и Адангом [1]; они могут быть клонированы из штаммов HD1 и HD73, полученных из коллекции культур (например. Bacillus Genetic Stock Center, Columbus, Ohio, или USDA Bt stock collection, Peoria, Illinois) c использованием стандартных процедур.
ДНК, кодирующие новые, ранее не охарактеризованные Bt-токсины, могут быть клонированы из хозяйского организма Bacillus с использованием протоколов, ранее применявшихся для клонирования Bt-генов. Эти протоколы предполагают создание банка ДНК, изолированной из организма Bacillus, в подходящем плазмидном или фаговом векторе, реплицируемом в подходящем хозяине, и использование антител против Bt-белка или ДНК, изолированной из гомологичной последовательности Bt-гена, для идентификации трансформантов, несущих клонированную последовательность Bt. Приблизительное местоположение кодирующей последовательности Bt может быть первоначально определено делекционным картированием клонированной ДНК. Точное положение кодирующей последовательности Bt может быть определено с использованием различных стандартных методов, включая определение последовательности клонированного сегмента ДНК, определение наличия в этой последовательности протяженной открытой рамки считывания, которая могла бы кодировать Bt-белок, и подтверждение того, что эта последовательность ДНК действительно кодирует Bt-белок, путем сравнения аминокислотной последовательности, выведенной на основании последовательности ДНК, с последовательностью, полученной при частичном аминокислотном секвинировании Bt-белка.
Химерный Bt-ген, используемый в данном изобретении, включает 5'-последовательность ДНК, включающую, в свою очередь, последовательность ДНК, делающую возможной инициацию транскрипции (промотор) и трансляцию расположенной ниже последовательности Bt в растении кукурузы. Химерный Bt-ген включает также 3'-последовательность ДНК, включающую последовательность, происходящую из 3'-некодирующего района гена, который может экспрессироваться в кукурузе. Наиболее важно то, что химерный Bt-ген будет включать последовательность ДНК, кодирующую токсичный Вt-полипептид, продуцируемый бактериями Bacillus thuringiensis, или его сегменты, обуславливающие токсичность или имеющие с ним значительную гомологию по аминокислотной последовательности. Кодирующая последовательность Bt включает : (1) последовательности ДНК, кодирующие белки с инсектицидной активностью, имеющие значительную гомологию с Bt-эндотоксинами, активными по отношению к насекомым-вредителям кукурузы, например Bt-последовательности HD73 или HD1; (2) последовательности, кодирующие сегменты эндотоксического Bt-полипептида, имеющие инсектицидную активность, например имеющие инсектицидную активность полипептиды HD73 или HD1, укороченные с карбоксильного или аминоконца; (3) укороченную Bt-последовательность, соединенную в рамке считывания с последовательностью или последовательностями, кодирующими полипептид, обеспечивающий некоторые дополнительные преимущества, например; (а) с генами, доступными для отбора, например генами, сообщающими устойчивость к антибиотикам или гербицидам, (b) с репортерными генами, продукты которых легко выявляются или анализируются, например генами люциферазы или β-глюкуронидазы (с) с последовательностями ДНК, кодирующими последовательности полипептидов, дополнительно стабилизирующие Bt-белок против деградации или увеличивающие эффективность Bt-белка по отношению к насекомым, например ингибиторами протеазы; (D) с последовательностями, способствующими транспорту Bt-белка в специфические компартменты внутри или вне клеток кукурузы, например сигнальными последовательностями.
Для достижения оптимального синтеза Bt-белка в кукурузе может также оказаться целесообразной корректировка последовательности Bt-гена с тем, чтобы она более приближалась к последовательности генов, эффективно экспрессирующихся в кукурузе. Поскольку частота использования кодонов во многих Bt-генах, включая гены HD73 и HD1, более сходна с этой частотой у видов Bacillus и не сходна с этой частотой в генах, экспрессирующихся в кукурузе, экспрессия Bt-гена в клетках кукурузы может быть повышена путем замены редко используемых кодонов Bacillus на кодоны, наиболее часто употребляющиеся у кукурузы [35] . Такая замена кодонов потребует замены оснований без изменения аминокислотной последовательности результирующего Bt-полипептида. Bt-полипептид будет идентичен по своей последовательности продукту бактериального гена или его сегментов. Полная кодирующая Bt-последовательность или ее участки, содержащие более значительную долю кодонов часто встречающихся у кукурузы чем первоначальный бактериальный ген, могут быть синтезированы по стандартным протоколам химического синтеза и введены в Bt-ген или соединены с ним также по стандартным методикам, например с использованием сайт-специфического мутагенеза или полимеризации и лигирования ДНК и т.п.
Помимо рекомбинантных последовательностей ДНК, служащих единицами транскрипции или их участками, полезны могут быть также рекомбинантные ДНК, несущие регуляторную или структурную функцию. Кроме того, ДНК может быть использована также в качестве генетического инструмента для генерирования мутантов или идентификации, выделения или генетического маркирования участков ДНК кукурузы. Дополнительные примеры могут быть найдены в [50].
Рекомбинантные ДНК, предназначенные для внедрения в растительные клетки, обычно должны включать также селективный маркер, или репортерный ген, или то и другое, что облегчает идентификацию и отбор трансформированных клеток. В другом варианте селективный маркер может находиться на отдельном сегменте ДНК и использоваться в котрансформации. Как селективные маркеры, так и репортерные гены могут быть фланкированы подходящими регуляторными последовательностями, делающими возможной их экспрессию у растений. Полезные селективные маркеры хорошо известны в литературе и включают, например, гены устойчивости к антибиотикам и гербицидам.
Конкретные примеры селективных маркерных генов даны в [50]. Предпочтительным селективным маркерным геном является последовательность, кодирующая гигромицин-фосфотрансферазу (НРТ), которая может быть получена из E.coll и которая сообщает устойчивость к антибиотику гигромицину В. Другие селективные маркеры включают ген аминогликозид-фосфотрансферазы транспозона Tn5 (AphII), сообщающий устойчивость к антибиотикам канамицину, неомицину и G418, а также гены, обеспечивающие устойчивость или толерантность к глифосфату, 2,2- дихлоропропионовой кислоте, метатрексату, имидазолиновым гербицидам, гербицидам на основе сульфонилмочевины, бромоксинилу, фосфинотрицину и другим веществам с гербицидными свойствами. Селективные маркерные гены, обуславливающие устойчивость или толерантность к этим фитотоксическим соединениям, также придают коммерческую ценность получаемым трансформированным растениям. Селективные маркерные гены, кодирующие ферменты, сообщающие устойчивость к фитотоксическим соединениям, приведены в табл. 1.
Репортерные гены используются для идентификации потенциально трансформированных клеток и для функциональных свойств регуляторных последовательностей. Репортерные гены, кодирующие легко анализируемые маркерные белки, хорошо известны в литературе. Обычно в качестве репортерного выбирается ген, отсутствующий или не экспрессирующийся в реципиентном организме и кодирующий белок, экспрессия которого влияет на легко анализируемое свойство, например на фенотип или на ферментативную активность. Примеры таких генов представлены в [50]. Используемые гены предпочтительно включают ген хлорамфеникол-ацетилтрансферазы (cat), транспозона Tn9 E.coli, ген β-глюкуронидазы (gus) локуса uidA E. coli и ген люцеферазы огневки Photinus pyralis. Экспрессия репортерного гена анализируется через нужное время после введения ДНК в реципиентные клетки. Предпочтительный вариант такого анализа предполагает использование гена β-глюкуронидазы (GUS) [26]. Трансформированные клетки кукурузы, экспрессирующие данный ген, будут окрашиваться в синий цвет при соприкосновении с субстратом 5-бромо-4-хлоро-3-индолил-β-D-глюкоронидом (X-GLUC), добавляемым во внеклеточную среду.
Используемые в данном случае регуляторные последовательности включают специфичные для органов, тканей или стадий развития индуцибельные или конститутивные промоторы, способные экспрессироваться в клетках конкретного растения. Пригодные для данного случая промоторы описаны в [50]. Ниже приводится частичный выборочный список промоторов, пригодных для наших целей: регуляторные последовательности Т-ДНК Agrobacterium tumifaciens, включающей манопинсинтетазу, нопалинсинтетазу и октопинсинтетазу; промотор алкогольдегидрогеназы кукурузы; индуцируемые светом промоторы, например промоторы генов малой субъединицы рибулозодифосфат- карбоксилазы/оксигеназы различных видов; промоторы генов основного хлорофил а/b-связывающего белка; 35S- и 19S-промоторы вируса табачной мозаики (ВТМ); регулируемые в развитии промоторы кукурузы, например промоторы генов waxy, zein, bronze; другие природные или синтетические конститутивные или индуцибельные промоторы, в том числе проявляющие у растений орган- или стадиеспецифичную экспрессию.
В состав рекомбинантной ДНК могут входить также другие элементы: интроны, энхансеры, сигналы полиаденилирования и т.д. Эти элементы могут быть обязательны или необязательны для функционирования ДНК, но могут также повышать уровень ее экспрессии, влияя на транскрипцию, стабильность мРНК и т.д. Упомянутые элементы могут включаться в состав ДНК таким образом, чтобы обеспечить максимальную эффективность трансформирующей ДНК. Например, первый интрон гена AdhIS кукурузы в некоторой конструкции рекомбинантной ДНК может быть помещен между промотором и кодирующей последовательностью. Известно, что при включении в конструкцию ДНК этот интрон усиливает синтез белка в растительных клетках [8]. Однако достаточный уровень экспрессии селективного маркера может быть достигнут и в отсутствии интрона [29]. Другим примером подходящего интрона может служить первый интрон гена shrunken-1 Zea mays. Упомянутые дополнительные элементы должны быть совместимы с остальной конструкцией ДНК.
3. Процесс введения ДНК.
Рекомбинантная ДНК может быть введена в культуры клеток кукурузы, способных к регенерации, предпочтительно в каллусные культуры, методом обстрела частицами. Общее описание подходящего устройства для обстрела частицами приводится в [45]. Хотя протоколы для применения этого устройства для обстрела суспензионной культуры неспособных к регенерации клеток кукурузы описаны в [29, 30 и 31], опубликованных протоколов для обстрела каллусных культур или способных к регенерации клеток кукурузы не существует.
При обстреле микрочастицами, называемом также биолистическим процессом, транспорт рекомбинантной ДНК в каллус опосредуется очень маленькими частицами биологически инертного материала. Одна или несколько таких инертных частиц, покрытых ДНК и ускоренных до необходимой скорости, способны проникать в одну или более клеток, где ДНК освобождается из частиц и экспрессируется в клетке. Некоторые из реципиентных клеток стабильно сохраняют и экспрессируют введенную ДНК.
Эти микрочастицы обычно состоят из материала с высокой плотностью, например вольфрама или золота. Они покрываются нужной ДНК. Затем микрочастицы помещаются на поверхность макрочастицы, которая служит для передачи движущей силы от подходящего источника энергии на микрочастицы. После разгона макро- и микрочастиц до необходимой скорости они попадают на блокирующее устройство, препятствующее дальнейшему движению макрочастиц, но пропускающее покрытые ДНК микрочастицы и позволяющее им попадать в реципиентные каллусные клетки. Пригодные в данном случае устройства могут использовать различные движущие силы, например порох или ударные волны разряда электрической дуги [11] . В настоящее время чаще применяется устройство, использующее порох в качестве движущей силы; такое устройство описано в [45]. Протокол для использования порохового устройства предоставлен в [30 и 31] и включает два основных типа. Во-первых, вольфрамовые микрочастицы смешиваются в водном растворе с ДНК, хлоридом кальция и спермидином в указанном порядке. Предлагаются различные концентрации различных компонентов. Выбранная методика в точности повторяет методику, описанную в [31], за исключением того что концентрация ДНК, указанная в этой методике как оптимальная, удваивается. Во-вторых, покрытые ДНК микрочастицы, макрочастицы и реципиентные клетки размещаются в устройстве нужным образом, и к макрочастицам прикладывается движущая сила. Измеряемые параметры этого этапа включают расстояние от реципиентных клеток до границы рабочего объема, а также уровень вакуума в камере для образцов. Реципиентные клетки помещаются на 2 - 15 см, а предпочтительно на 5 см ниже останавливающей пластины.
Используемые здесь для получения трансгенных растений каллусные культуры обычно должны пройти примерно половину периода пересева после последнего пересева и, следовательно, должны пройти лаг-фазу, следующую за пересевом на новую среду, но не должны достигнуть стационарной фазы, наступающей со временем в случае отсутствия пересева на свежую среду. Ткань может использоваться в виде кусочков массой 30 - 80, а лучше 40 - 60 мг. Комочки могут быть помещены на чашку Петри или другую поверхность и расположены практически произвольно, но так, чтобы (1) область в центре чашки получила наибольшую концентрацию покрытых ДНК металлических частиц и расположенная в этой области ткань с наибольшей вероятностью была повреждена при обстреле и (2) число частиц, попадающих на ткань, уменьшалось при удалении от центрального участка ткани так, чтобы ткань, удаленная от центра чашки, подвергалась обстрелу с наименьшей вероятностью. Перфорированный экран, предпочтительно металлический, может быть помещен на чашку для предотвращения выбрасывания или разбрызгивания ткани. Согласно другому способу экспонирования ткани для обстрела она может быть распределена тонким слоем на фильтровальной бумаге. Ткань может обстреливаться покрытыми ДНК металлическими частицами один или более раз.
4. Процедура отбора.
После того как каллусы были обстреляны рекомбинантной ДНК и эта ДНК проникла в некоторые клетки, необходимо идентифицировать и отобрать клетки, которые несут рекомбинантную ДНК и в то же время сохранили достаточную регенерационную способность. Для достижения этого были выбраны два основных подхода. В первом случае трансформированные каллусы или регенерированные из них растения могут быть скринированы на предмет присутствия рекомбинантной ДНК различными стандартными методами, которые могут включать тесты на экспрессию репортерных генов или оценку фенотипических эффектов рекомбинантной ДНК, если таковые имеются. Во втором, предпочтительном варианте, когда селективный маркерный ген передается как часть рекомбинантной ДНК или вместе с ней, трансформированные клетки каллуса могут быть идентифицированы путем использования селективного агента для выявления экспрессии селективного маркерного гена.
Отбор предполагаемых трансформантов является критическим этапом для успешного процесса трансформации, поскольку условия отбора должны быть выбраны таким образом, чтобы сделать возможным рост и увеличение численности трансформированных клеток, одновременно подавляя рост нетрансформированных клеток. Ситуация осложняется тем, что жизнеспособность отдельных клеток в клеточной популяции часто сильно зависит от жизнеспособности соседних клеток. Кроме того, условия отбора не должны быть слишком жесткими, чтобы не подавлять регенерационную способность каллусных клеток и фертильность получаемого растения. Таким образом, необходимо оценивать влияние селективного агента на жизнеспособность и морфологию клеток. Для этого предварительно может быть построена экспериментальная кривая ингибирования роста при воздействии данного селективного агента на трансформируемую ткань. Это позволит выявить область концентраций, подавляющих рост.
При использовании селективного маркерного гена комочки каллуса могут быть после обстрела подрощены для их восстановления на неселективной среде или, в предпочтительном варианте, немедленно перенесены на среду, содержавшую селективный агент.
Процедуры отбора предполагают воздействие токсичного агента и могут включать последовательные изменения концентрации агента и многократные циклы отбора. Очевидно, что конкретные концентрации и продолжительность циклов должны варьироваться для каждого конкретного агента. Предпочитаемая в настоящее время процедура отбора включает начальный цикл селекции с относительно низкой концентрацией токсичного агента и затем последующие цикл или циклы с более высокими концентрациями. Это позволяет селективному агенту проявлять свои токсичные свойства медленно, в течение продолжительного времени. Предпочтительно начальная концентрация агента составляет примерно 5 - 40% от концентрации, при которой происходит подавление роста, определенной на основании кривой подавления роста. Это может позволить трансформированным клеткам избирательно расти и делиться, тогда как нетрансформированные клетки будут подавлены, но не до такой степени, что рост нетрансформированных клеток будет полностью остановлен. После того как немногие трансформированные клетки поделятся достаточное число раз, ткань может быть перенесена на среду, содержащую более высокую концентрацию токсичного агента, с тем чтобы убить практически все нетрансформированные клетки. Дискретное увеличение концентрации также уменьшает вероятность того, что нетрансформированные клетки адаптируются к агенту. Высшая концентрация предпочтительно должна находиться в области концентраций, подавляющих рост на 30 - 100%. Первый цикл отбора может продолжаться 1 - 4, а предпочтительно 2 нед. Продолжительность второго цикла может составлять 1 - 12, а предпочтительно 2 - 10 нед. Предположительные трансформанты кукурузы обычно могут быть определены как пролиферирующие участки ткани на фоне непролиферирующих клеток. В ходе общей процедуры отбора каллус может также некоторое время культивироваться на неселективной среде.
После того, как участок каллуса определен как предположительный трансформант, факт трансформации может быть подтвержден фенотипическим и или генотипическим анализом. При использовании селективного агента примером фенотипического анализа может быть измерение увеличения живого веса предположительного трансформанта по сравнению с контрольным при различных концентрациях селективного агента. Другие возможные варианты анализа могут быть основаны на функции рекомбинантной ДНК. Например, если ДНК кодирует фермент или белок, возможен ферментный или иммунологический анализ данного конкретного фермента или белка. Другие продукты генов могут быть проанализированы подходящими биологическими или химическими методами. Такие альтернативные методики хорошо известны в литературе и здесь не описываются. Присутствие гена может быть также подтверждено обычными методами, например Саузерн-блотом или полимеразной цепной реакцией (ПЦР) и т.п.
5. Регенерация растений и получение семян.
Клеточные линии, которые были трансформированы, как описано выше, затем должны быть регенерированы в растения, после чего должна быть определена фертильность полученных растений. Трансформированные линии, давшие положительный ответ при генотипическом и или фенотипическом анализе, помещаются затем на среду, стимулирующую дифференциацию тканей и регенерацию растений. Регенерация может быть осуществлена в соответствии с хорошо известными по литературе стандартными методами. Обычно эти методы предполагают снижение концентрации ауксина, что приостанавливает пролиферацию каллуса и стимулирует развитие соматических зародышей или другую дифференциацию тканей. Один из примеров подобного метода регенерации описан в [21]. Растения выращиваются до созревания в ростовой комнате или теплице, после чего производятся необходимые половые скрещивания, как описано в [36].
Регенерация, важная для данного изобретения, может быть осуществлена любым обычным методом. Если клетки были трансформированы с участием селективного маркера, в регенерационную среду может быть включен селективный агент для дальнейшего контроля того, что регенерирующие проростки действительно трансформированы. Поскольку методы регенерации хорошо известны и не являются определяющими для данного изобретения, любой метод, позволяющий достигнуть регенерации и получить фертильное растение, является подходящим.
6. Анализ поколения R1.
Растения, регенерированные из трансформированного каллуса, обозначаются как поколение R0 или растения R0. Растения, полученные в различных половых скрещиваниях с участием поколения R0, обозначаются как потомство R1 или поколение R1. Получаемые при проращивании семян растения также обозначаются как поколение R1.
Для подтверждения успешной передачи и наследования рекомбинантной ДНК в течение одного полового цикла поколение R1 должно быть проанализировано для выяснения присутствия трансформирующей ДНК. Этот анализ может быть произведен любым методом, описанным выше для анализа обстрелянного каллуса с целью подтверждения трансформации, с учетом того факта, что вместо каллуса используются растения или части растений.
Рекомбинантная ДНК может проявлять различные картины наследования в различных трансформированных линиях. Например, рекомбинантная ДНК может наследоваться потомством в соответствии с правилами менделевской наследственности. Такой тип наследования означает передачу ДНК через мужские и женские гаметы и связан со стабильной интеграцией или встраиванием в ядерную ДНК кукурузы. Другим типом наследования является материнское наследование, при котором рекомбинантная ДНК передается преимущественно или исключительно через женские гаметы. Картина наследования у конкретного трансформанта может быть уточнена анализом потомства от различных половых скрещиваний.
7. Введение рекомбинантной ДНК в другие разновидности кукурузы.
Фертильные трансгенные растения затем могут быть использованы в обычных программах разведения кукурузы с целью введения внедренной рекомбинантной ДНК в нужные линии или сорта. Методы конвергентного улучшения кукурузы и соответствующие ссылки приводятся в [24]. В число подходов, используемых обычными программами разведения, входит процесс конверсии (возвратного скрещивания). Вкратце, конверсия осуществляется путем скрещивания начального трансгенного фертильного растения с элитными инбредными линиями. В потомстве от этого скрещивания будет происходить расщепление, так что некоторые растения будут нести рекомбинантную ДНК, тогда как другие не будут. Растения, несущие эту ДНК, снова скрещиваются затем с элитными инбредными линиями, и в потомстве вновь происходит расщепление. Этот процесс возвратного скрещивания происходит до тех пор, пока первоначальная инбредная элитная линия не превратится в линию, несущую рекомбинантную ДНК, но в то же время сохраняющую все существенные признаки, изначально присущие родителю. Обычно это требует примерно 6 - 8 поколений. Для каждой элитной линии, которую необходимо превратить в генетически перестроенную элитную линию, обычно используется отдельная программа возвратного скрещивания. Как правило, коммерческая ценность созданной таким образом трансформированной кукурузы будет максимальна, если рекомбинантная ДНК будет встроена в большое число различных гибридных комбинаций. Чаще всего фермер выращивает несколько гибридов, основываясь на различиях в сроках созревания, устойчивости или других агрономических свойствах. Кроме того, при выборе гибрида фермер должен исходить из географического положения своей фермы, поскольку гибрид, адаптированный для одного региона, обычно инадаптивен для другого из-за различий по таким свойствам, как сроки созревания, устойчивость к насекомым и болезням. Поэтому необходимо встраивать рекомбинантную ДНК в большое число родительских линий, чтобы можно было получить большое число гибридных комбинаций, содержащих требуемую гетерологическую ДНК.
Методы разведения кукурузы и методы, необходимые для переноса генов из одной линии или сорта в другую линию или сорт, хорошо известны специалистам. Таким образом, эти методы могут быть использованы для введения рекомбинантной ДНК в любую другую линию или сорт.
8. Применение трансгенных растений.
Ожидается, что полученные описанным способом трансгенные растения окажутся полезными для различных коммерческих и исследовательских целей. Могут быть созданы трансгенные растения для традиционного сельского хозяйства, обладающие свойствами, полезными для производителя зерна (например, такими агрономическими свойствами, как устойчивость к гербицидам, вредителям или повышенная урожайность), а также свойствами, полезными для потребителя зерна, полученного из этих растений (например, повышенное содержание питательных веществ в человеческой пище или корме для животных), или для пищевой промышленности (например, свойствами, облегчающими обработку). В таких случаях растения обычно выращиваются с целью использования их зерна в пище для человека или животных. Однако другие части растений, включая стебли, шелуху, вегетативные части и т.д., могут найти применение, например, как часть силоса для животных или как материал для облицовки. Часто химические составляющие кукурузы и других сельскохозяйственных культур (например, масла или крахмалы) извлекаются из растений для пищевых или промышленных целей; поэтому могут быть созданы трансгенные растения с увеличенным или измененным содержанием таких компонентов.
Трансгенные растения могут также найти применение в коммерческом производстве белков или других молекул, где нужная молекула извлекается или очищается из частей растений, семян и т.п. Возможно также культивирование, выращивание in vitro или ферментация полученных из растений клеток или тканей с целью получения таких молекул.
Трансгенные растения также могут быть использованы в коммерческих селекционных программах или скрещены с растениями родственных сельскохозяйственных культур. Полезные свойства, кодируемые рекомбинантной ДНК, могут передаваться, например, от клеток кукурузы клеткам других видов, например путем слияния протопластов.
Трансгенные растения могут иметь многочисленные применения в исследованиях и селекции, включая создание новых мутантных растений путем инсерционного мутагенеза с целью определения благоприятных мутантов, которые впоследствии могут создаваться путем традиционного мутагенеза и отбора. Примером может служить введение рекомбинантной последовательности ДНК, кодирующей мобильный элемент, который может быть использован для генерации генетической изменчивости. Методы данного изобретения могут также использоваться для создания растений, имеющих уникальные опознавательные последовательности, которые могут использоваться для идентификации принадлежности линий или сортов.
Изобретение иллюстрируется (но не ограничивается) нижеследующими примерами. Эти примеры даны в целях лучшего пояснения общих методик, использованных для получения фертильных растений Zea mays, предложенных согласно данному изобретению, которые стабильно экспрессируют рекомбинантную ДНК и передают ее потомству. Все части и процентные отношения считаются по массе, если не оговорено иначе. Необходимо учитывать, что вероятность происходящего конкретного события трансформации зависит от количества материала, подвергнутого процессу трансформации. Поэтому при возникновении ситуаций, в которых описанные здесь процедуры не дают трансформантов, потребуется повторение этих процедур.
Пример 1. Фертильные трансгенные растения Zea mays из каллусной линии AB11
1. Основание и поддержание культур клеток кукурузы, сохраняющих способность к регенерации растений. Были основаны рыхлые эмбриогенные каллусные культуры кукурузы из незрелых зародышей, полученных при опылении растений инбредной линии Al 88 (University of Minnesota, Crop Improvement Association) пыльцой растений инбредной линии В73 (Iowa State University). Початки были собраны по достижении зародышами длины 1,5 - 2 мм. Поверхность каждого початка была стерилизована разбавленным наполовину (по объему) промышленным отбеливателем (2,63%-ным (по массе к объему) гипохлоритом натрия), в течение 20 мин при комнатной температуре. Затем початки были промыты стерильной дистиллированной деионизированной водой. Незрелые зародыши были изолированы в стерильных условиях и помещены в питательную среду для основания и поддержания культур так, чтобы стеблекорневая ось оказалась в среде. Среда для основания и поддержания культур (в дальнейшем обозначаемая как среда F) состояла из минимальной среды N6 [9] с добавлением 2% (масса к объему) сахарозы, 1,5 мг/л 2,4- дихлорфеноксиуксуоной кислоты (2,4-Д), 6 мМ пролина и 0,25% гельрита (Kelco, Inc., San Diego). Перед автоклавированием величина pH была доведена до 5,8. Все манипуляции с культурами ткани производились в стерильных условиях, если не оговорено иначе.
Незрелые зародыши инкубировались при 26oC в темноте. Пролиферация клеток скутеллюма незрелых зародышей оценивалась на рыхлость и на наличие сформированных соматических зародышей. Ткань с такой морфологией переносилась на свежую среду через 10 - 14 дн после первоначального высевания незрелых зародышей. Затем ткань пассировалась стандартными методами каждые 14 - 21 дн. Из кусочков ткани, достигших приблизительно 1 г, отбиралось и переносилось на свежую среду 60 - 70 мг ткани. При пассировании всегда производилось тщательное визуальное наблюдение за тем, чтобы поддерживалась только ткань с правильной морфологией. Наличие соматических зародышей гарантировало, что в подходящих условиях культуры произведут растения. Примером такой культуры была использованная в Данном примере культура клеток, названная AB11, основанная за один год до обстрела.
2. Плазмиды. Плазмида pHYGI1 была создана на основе вектора pBS+ (Stratagene, Inc., San Diego, CA), представляющего собой кольцевую плазмиду размером 3,2 kb), с использованием стандартных методов работы с рекомбинантной ДНК. Фермент Bc1-BamHI размером 553 пары оснований (п.н.), содержащий первый интрон гена Adh-1 кукурузы [8], был вставлен между 35S-промотором ВТМ и гигромицин-кодирующей последовательностью pCHN1-I, представляющей собой плазмиду, сконструированную в соответствии с примером 5. Карта pHYGI1 приведена на фиг. 1. В соответствии с Будапештским договором образец pHYGI1 был депонирован 16.03.90 под номером 40744 в American Type Culture Collection, Rockville, MD, USA. Плазмида рВII221 содержит последовательность, кодирующую β-глюкуронидазу E. coli, фланкированную с 5'-конца 35S-промотором ВТМ и с 3'-конца - сигналом полиаденилирования гена nos. Плазмида была сконструирована путем встраивания первого интрона гена Adh-1 кукурузы между 35S-промотором и кодирующей последовательностью рВII221 [Л26]. Карта рВII221 приведена на фиг. 2.
Плазмида была введена в эмбриогенную каллусную культуру AB11 методом обстрела микрочастицами.
3. Процесс введения ДНК. Линия эмбриогенного каллуса кукурузы AB11 была субкультивирована в течение 7 - 12 дн перед обстрелом микрочастицами. Пять комочков каллуса приблизительно по 50 мг живого веса каждый были крестообразно расположены в центре стерильной чашки Петри размером 60/15 мм (Falkon 1007). Чашки хранились в закрытой емкости с мокрыми бумажными полотенцами в течение всего процесса обстрела. Всего было приготовлено 12 чашек.
Вольфрамовые частицы N-10 (Biolistics) были покрыты плазмидой в точном соответствии с [31], за исключением того что (1) было использовано количество ДНК, вдвое большее рекомендованного, (2) осаждение ДНК на частицы производилось при 0oC и (3) пробирки с покрытыми ДНК вольфрамовыми частицами держались на льду в течение всего процесса обстрела.
Все пробирки содержали по 25 мкл взвеси, 50 мг/л вольфрама M-10 в воде, 25 мкл 2,5 M CaCl, 10 мкл 100 mM спермидина, а также 5 мкл раствора 1 мг/мл плазмидной ДНК. Одна пробирка содержала только плазмиду рВ11221, и одна пробирка содержала буфер ТЕ (табл. 2).
Все пробирки инкубировались на льду в течение 10 мин, частицы осаждались центрифугированием в центрифуге Eppendorf в течение 5 с при комнатной температуре, и удалялось 25 мкл супернатанта. В течение всего процесса обстрела пробирки держались на льду. Каждая порция использовалась не более чем для пяти обстрелов.
Использовались макрочастицы и останавливающие пластины фирмы Biolistics, lnc. (Ithaca, NY). Они были стерилизованы в соответствии с указаниями фирмы. В качестве устройства для обстрела микрочастицами использовалось также устройство фирмы Biolistics.
Поддон с образцами помещался на 5 см ниже дна останавливающей пластины устройства обстрела микрочастицами так, чтобы останавливающая пластина находилась в ближнем к полости прибора пазу. Приготовленные описанным выше способом чашки с тканью каллуса помещались в центре поддона для образцов, после чего крышки чашек удалялись. Поверх открытой чашки для удержания ткани во время обстрела помещалась квадратная жесткая проволочная сетка размером 7х7 см с ячейкой 3х3 мм, изготовленная из стали с гальваническим покрытием. ДНК/вольфрамовые образцы обрабатывались в соответствии с указаниями фирмы Biolistics, Inc. , и 2,5 мкл суспензии наносились пипеткой на верхушку макрочастицы для каждого обстрела. Устройство эксплуатировалось в соответствии с указаниями изготовителя. Информация о произведенных обстрелах дана в табл. 2.
Каждая из двух чашек каллуса, обстрелянного рВII221, была перенесена на чашку среды F (без гигромицина), и каллус культивировался при 26oC в темноте. Через два дня каллус из каждой чашки полностью переносился на чашку Петри размером 35х10мм (Falcon 1008), содержащую 2 мл буфера для анализа GUS (1 мг/мл 5-бромо-4-хлоро-3-индолил-β-D-глюкуронида) (Researsch Organis), 100мМ фосфата натрия (pH 7,0), по 5 мМ феррицианида калия и ферроцианида калия, 10 мМ ЭДТА и 0,6% тритона Х-100. Чашки инкубировались при 37oC в течение трех дней, после чего было подсчитано число синих клеток, оказавшееся равным в общей сложности 313 клеткам, экспрессирующим GUS, на обеих чашках, при 355 клетках с промежуточной окраской; это показывало, что процесс введения ДНК успешно произошел также на других обстрелянных чашках. Чашки, использованные при анализе на GUS, были после подсчета выброшены, поскольку анализ на GUS убивает клетки.
4. Процесс отбора. До заполнения чашек Петри в среду добавлялся гигромицин В (Calbiochem) путем вливания необходимого объема стерилизованного фильтрованием водного раствора гигромицина В (100 мг/мл) после охлаждения среды до 45oC. Сразу после обстрела всех образцов каллус из каждой чашки, обработанной pHYGI1/pBII221, и из каждой из двух чашек, обработанных буфером ТЕ, переносился на отдельную чашку со средой F, содержащей 15 мг/л гигромицина В (10 кусочков каллуса на чашку). В дальнейшем эти чашки называются чашками первого цикла селекции. Каллус из чашек, обработанных ТЕ, переносился на среду F без гигромицина. Эта ткань затем пассировалась каждые 2 - 3 нед на неселективной среде и в дальнейшем называется неселектируемым контрольным каллусом.
После 14 дн отбора ткань выглядела приблизительно одинаково на селективной и неселективной среде. Каллус из семи чашек, обработанных pHYGI1/pBII221, и одной чашки, обработанной ТЕ, переносился с чашек первого цикла селекции на чашки второго цикла селекции, содержавшие 60 мг/л гигромицина. На каждую чашку второго цикла селекции помещалось 10 кусочков каллуса по 30 мг каждый, что приводило к увеличению общего числа чашек.
После 21 дн второго цикла селекции весь материал был перенесен на чашки третьего цикла, среда в которых содержала 60 мг/л гигромицина. Через 79 дн после обстрела было проверено наличие живых участков каллуса на чашках третьего цикла селекции. Один из таких секторов, пролиферирующий на фоне некротической ткани, был обнаружен на чашке с каллусом, обработанным pHYGI1/pBII221. Этот сектор был обозначен как РНЗ и перенесен на среду F без гигромицина.
Через 19 дн роста на среде F без гигромицина каллус РНЗ был перенесен на среду F, содержащую 60 мг/л гигромицина. Каллус РНЗ оказался способным поддерживать свой рост при многократном пассировании в присутствии 60 мг/л гигромицина.
5. Подтверждение трансформации каллуса. Для подтверждения того, что каллус РНЗ действительно приобрел ген устойчивости к гигромицину, была выделена и проанализирована при помощи Саузерн-блоттинга геномная ДНК каллуса РНЗ и неселектируемого контрольного каллуса в соответствии с примером 5. Выделенная ДНК (10 мкг) расщеплялась рестриктазой BamHI(NEB) и разделялась при помощи электрофореза в агарозном геле (0,8%) в течение 16 ч при напряжении 15 В в буфере ТАЕ (40 мМ Трис-ацетата (pH 7,6), 1 мМ ЭДТА). ДНК переносилась на фильтр Nytran (Schleicher and Schuell). Условия переноса, гибридизации и отмывки выбирались в соответствии с рекомендациями изготовителя.
Меченные изотопом 32P зонды были получены путем мечения со случайными праймерами с использованием стандартного набора реактивов для олигонуклеотидного мечения фирмы Pharmacia в соответствии с рекомендациями поставщика. Для мечения был использован нуклеотид α-32P-dCTP (ICN Radiochemicals). В качестве ДНК-матрицы использовался BamHI-фрагмент плазмиды pHYGI1 размером 1055 bp, содержавший полную кодирующую последовательность НРТ.
Фильтры фотографировались на пленку Kodak Х-ОМАТ AR в кассете X-OMATIC с использованием усиливающих экранов. В ДНК каллуса РНЗ в ожидаемой области 1,05 была отмечена полоса, показывающая наличие кодирующей последовательности НРТ. В ДНК контрольного каллуса полос отмечено не было.
Для демонстрации того, что гигромициновый ген встроен в ДНК с большой молекулярной массой, нерасщепленная ДНК из каллуса РНЗ и контрольного каллуса была разделена электрофорезом, перенесена на блот и проанализирована гибридизацией, как описано выше. Нерасщепленная ДНК РНЗ гибридизировалась с зондом только в зоне, соответствующей по своей подвижности нерезаной ДНК. ДНК контрольного каллуса не гибридизовалась c зондом. Эти результаты показывают, что кодирующая последовательность НРТ не присутствует в каллусе РНЗ в качестве интактной плазмиды pHYGI1 или небольшой внехромосомной плазмиды. Эти результаты подтверждают также встраивание гигромицинового гена в ДНК с большой молекулярной массой.
Регенерация растений и получение семян. Порции каллуса РНЗ переносились непосредственно с чашек, содержащих 60 мг/л гигромицина на среду RM5, состоящую из минимальной солевой среды MS [34] с добавлением 0,5 мг/л тиамин•HCl, 0,75 мг/л 2,4-Д, 50 г/л сахарозы, 150 мг/л аспарагина и 2,5 г/л гельрита (Kelco Inc., San Diego).
Через 14 дн культивирования на среде RM5 большинство каллусов РНЗ и неселектируемых контрольных каллусов переносилась на среду R5 (среда RM5 без 2,4-Д). Чашки поддерживались в темноте в течение 7 дн при 26oC и затем выдерживались в режиме с 14 ч светлого времени и 10 ч темного в течение 14 дн при 26oC. После этого сформировавшиеся проростки переносились в банки объемом в одну кварту (Ball), содержащие по 100 мл среды R5. Растения затем переносились из баночек на вермикулит на 7 - 8 дн перед последующим пересаживанием в почву и выращиванием до созревания. В общей сложности было получено 45 растений из каллуса РНЗ и 10 растений из контрольного каллуса.
Контролируемое опыление зрелых растений РНЗ производилось по стандартным методикам с участием инбредных линий Zea mays MBS501 (Mike Brayton Seeds), FR4326 (Illinois Foudation Research) и являющейся нашей собственностью инбредной линии LM1112. Семена собирались через 45 дн после опыления и затем подсушивались в течение 1 - 2 нед.
7. Анализ потомства R1. Растения RI анализировались на присутствие последовательностей генов НРТ и GUS методом ПЦР. Экспрессия гена НТР определялась при помощи ферментного анализа активности НТР. Данные сведены в табл. 3. Эти данные подтверждают передачу и экспрессию рекомбинантной ДНК через мужских и женских родителей в соответствии с менделевскими принципами наследственности. Данные Саузерн-блота, свидетельствующие об интеграции последовательности, кодирующей НРТ, в ДНК с большой молекулярной массой в исходном каллусе, в сочетании с картиной наследования, показывает, что изучаемые последовательности ДНК интегрированы в хромосомы. Присутствие последовательностей гена GUS в потомстве R1 свидетельствует о котрасформации и о наследовании неселектируемого гена.
Ферментный анализ НРТ был основан на методах, описанных в [12, 47 и 7].
Образцы корешков (по 0,2 г) срезались с 7 - 10-дневных проростков и быстро замораживались в жидком азоте. Образцы покрывались алюминием и 400 мкл ЕВ (50 мМ Трис-HCI, 10% (по объему) глицерина, 0,1 мМ ФМСФ, (pH 7,0) в течение 30 - 60 с с использованием пестика и пробирки (Kontes), затем центрифугировались в микроцентрифуге Eppendorf в течение 40 мин. Супернатант переносился в фильтровальную ячейку Centricon 30 и обессоливался центрифугованием в роторе с фиксированным углом в центрифуге Beckman GPR при 5000 об/мин в течение 30 мин при 4oC. Каждая фильтровальная ячейка промывалась 1 мл ЕВ и затем центрифугировалась 60 мин при 5000 об/мин. Центрифугат затем извлекался и хранился при -70oC. Образцы трансгенного и неселектируемого контрольного каллуса обрабатывались описанным выше образом, и супернатанты использовались в качестве позитивного и негативного контролей.
Содержание белка было определено по методу, описанному в [6], с использованием стандартного набора фирмы BioRad. Концентрации белка в экстрактах корней изменились от 0,2 до 2,0 мкг/мкл.
К реакционной смеси, содержащей 20 мМ Трио-малеата, 13 мМ MgCl, 120 мM NH4Cl, 0,5 мМ ДТТ, 50 мкМ АТФ, 0,61 мкг/мкл гигромицина В, 25 мкг/мкл бычьего сывороточного альбумина и 12 μ Ci γ 32Р-АТФ, добавлялся экстракт корней (с общим содержанием белка 4 мкг). Реакционный объем составлял 33 мкл. Реакционная смесь инкубировалась в течение 30 мин при 37oC.
1 мкл реакционной смеси наносился на полиэтилениминцеллюлозный носитель для тонкослойной хроматографии (Sigma Chem. Co.). Пластины носителя элюировались муравьиной кислотой (50 мМ, pH 5,4), высушивались на воздухе и фотографировались на пленку XAR-5. Продукт реакции, фосфат гигромицина, в описанных условиях мигрировал близко к фронту растворителя.
Для проведения ПЦР из растительных тканей были выделены и заморожены в жидком азоте образцы ткани по 0,1 г. Затем эти образцы смешивались с шариками карборунда в растворе, содержавшем 200 мкл 0,1 M Трис-HCl, 0,1 M NaCl, 20 мМ ЭДТА, и 1% саркозила (pH 8,5), при 4oC. После экстракции фенолом и хлороформом и осаждения ДНК этанолом и изопропанолом образцы ДНК ресуспендировались в буфере ТЕ и анализировались при помощи полимеразной цепной реакции [56].
ПЦР проводилась в 100 мкл раствора, содержащего 50 мМ KCl, 10 мМ Трис-HCl (pH 8,4), 3 мМ MgCl, 100 мкг мл желатина, 0,25 мкМ каждого из соответствующих праймеров 0,2 мМ каждого дезоксинуклеозидтрифосфата (dATP, dCTP, dGTP и dTTP), 2,5 единицы Taq-полимеразы (Cetus) и 10 мкл раствора ДНК. На реакционную смесь наслаивалось парафиновое масло, затем смесь прогревалась 3 мин при 94oC, после чего проводилось 35 циклов амплификации, включая 1 мин при 55oC, 1 мин при 72oC и 1 мин при 94oC. Затем смесь инкубировалась 2 мин при 50oC и 5 мин при 72oC. 10 мкл раствора, содержавшего продукты ПЦР, были подвергнуты электрофорезу в агарозном геле и ДНК визуализировалась добавлением бромистого этидия.
Для анализа присутствия гена НРТ использовались два праймера: один комплементарный 35S-промотору и один комплементарный кодирующей последовательности НРТ. Для получения продуктов ПЦР подходящих размеров ДНК-матрица НРТ должна была содержать непрерывный район 35S- промотора, интрон Adh1 и белок-кодирующую последовательность с 5'- конца.
Для анализа присутствия гена GUS использовались ПЦР-праймеры, комплементарные последовательностям в пределах белок-кодирующего участка гена GUS. Если матрица ДНК содержит ненарушенный кодирующий участок между двумя праймерами, то предположительно должен получаться продукт ПЦР размером 797 пар оснований.
Пример 2. Фертильные трансгенные растения из линии каллуса 63S, содержащие рекомбинантную ДНК, кодирующую запасной блок семян
Запасной белок zein размером 10 кДа продуцируется в эндосперме зерновок кукурузы и является представителем класса белков, обозначаемых как "запасные белки семян". Этот белок содержит исключительно большое количество метионина (22,5%) и кодируется геном Zps10/(22) [4]; этот ген ниже обозначается как z10. Таким образом, повышенная экспрессия гена z10 может быть использована для увеличения содержания метионина в кукурузе. Получение фертильной трансгенной кукурузы, не сущей химерный ген z10, было достигнуто методами, описанными в примере 1, с некоторыми незначительными модификациями. В примере 2 также демонстрируется введение рекомбинантной ДНК с использованием линии каллуса, отличной от линии, использованной в примере 1.
1. Линии и культуры ткани. Линия эмбриогенного каллуса кукурузы, названная AB63S, использованная в данном примере, была получена из незрелых зародышей, полученных от скрещивания элитных инбредных линий A188 и В73 с использованием методов основания и поддержания, описанных в примере 1. Линия каллуса была основана примерно за 7 мес до обстрела. За 11 нед до обстрела ткань была просеяна под давлением через сеть с ячейками 1,3 мм и высеяна на среду для поддержания N6. Из полученной ткани через 1 - 2 нед роста был отобран рыхлый эмбрионный каллус, который затем был перенесен на свежую среду и подрощен в течение 1,5 - 3 нед перед повторным просеиванием. Этот цикл просеивания и восстановления рыхлого каллуса был повторен 3 раза перед обстрелом ткани.
2. Плазмиды. В данном примере были использованы описанные в примере 1 плазмиды pHYGI1 и рВII221. Кроме того, в ДНК/вольфрамовые образцы добавлялась плазмида pZ27Z10. Плазмида pZ27Z10 была сконструирована на основе вектора pUC118 [49], представляющего собой кольцевую плазмиду длиной 3,2 kb с использованием стандартных методов работы с рекомбинантными ДНК. Плазмида pZ27Z10 содержит 5'-область регуляции транскрипции гена 27кДа-zein кукурузы [18], обозначаемого здесь как Z27, помещенную непосредственно рядом с кодирующей последовательностью и 3'-некодирующей последовательностью гена 10кДа-zein кукурузы [37], обозначаемого здесь как Z10. Комбинация регуляторной последовательности Z27 с кодирующей и 3'- последовательностями Z10 обозначается здесь как химерный ген Z27-Z10. С 3'-конца последовательностей гена Z10 в плазмиде pZ27Z10 располагается сигнал полиаденилирования из района генома ВТМ, прилежащего к 35S-промотору. Карта этой плазмиды представлена на фиг. 7.
Образец плазмиды pZ27Z10 депонирован в American Type Culture Collection, Rockville, MD, в соответствии c Будапештским договором под номером АТСС 40938.
3. Процесс введения ДНК. Ткань линии эмбриогенного каллуса кукурузы AB63S субкультивировалась в течение трех недель обстрелом микрочастицами. Ткань была подготовлена для обстрела путем просеивания через сито с размером ячейки 1,9 мм. Просеянная ткань высаживалась на стерильные круглые фильтры Whatman No. l диаметром 5,5 см в виде тонкого газона (примерно 500 мг ткани на фильтр). Всего было приготовлено 6 фильтров с тканью. Перед обстрелом микрочастицами фильтры с тканью переносились в пустые чашки Петри. Ткань слегка высушивалась в открытых чашках в ламинарном потоке в течение 20 мин. Для предотвращения дальнейшего высыхания ткани чашки хранились в резервуаре с высокой влажностью до самого обстрела.
Использованная для обстрела ДНК состояла из плазмид pHYGI1 pZ27Z10 и pBII221 в соотношении 1:1:1 (по массе). Осаждение ДНК на вольфрамовых частицах производилось, как описано в примере 1.
Обстрел производился, как описано выше в примере 1, за исключением того что использовался прибор Biolistic PDS 1000 (DuPont) и над тканью не помещалось никакой сетки. Шесть фильтров с каллусной тканью были обработаны следующим образом: два фильтра были обстреляны ДНК/вольфрамовыми образцами по два раза каждый (потенциальная позитивная обработка 2Х); три фильтра были обстреляны по одному разу (потенциальная позитивная обработка IX) теми же ДНК/вольфрамовыми образцами; и один фильтр был обстрелян водно-вольфрамовой суспензией с тем же количеством вольфрама (по массе), что и в ДНК/вольфрамовых обработках (негативный контроль).
4. Отбор трансформированного каллуса. После обстрела фильтры с каллусной тканью из обработки 2X были перенесены на чашки первого цикла отбора, а именно на среду F, содержащую 15мг/мл гигромицина. Два фильтра из обработки 1X и фильтр из негативного контроля также были перенесены на среду первого цикла отбора. Третий фильтр обработки 1X был перенесен на среду F без гигромицина для использования в качестве неселектируемого контроля. Поскольку этот неселектируемый контрольный каллус был потенциально позитивным, он единственный поддерживался в течение первых двух циклов отбора в целях сравнения; впоследствии в качестве неселектируемого контрольного каллуса использовался необстрелянный каллус AB63S, поддерживаемый на среде F без гигромицина.
Через 5 дн каллус был перенесен в виде маленьких комочков (приблизительно по 25 мг) с фильтров на свежую среду первого цикла отбора. Плотность посева составляла 10 комочков на чашку. К этому времени масса каллуса увеличилась приблизительно в два раза. Неселектируемый контрольный каллус был перенесен сходным образом на среду F без гигромицина. На девятнадцатый день после обстрела все образцы ткани были перенесены со среды первого цикла отбора на среду второго цикла отбора (на среду F, содержащую 60 мг/л гигромицина). Плотность посева составляла при этом переносе 14 комочков каллуса на чашку. За 14 дн после предыдущего пересева объем каллуса увеличился примерно втрое. Через 23 дн все каллусы были перенесены со среды второго цикла отбора на среду третьего цикла отбора, содержащую 60 мг/л гигромицина.
Через 59 дн после обстрела среди отмирающих комочков каллуса было обнаружено пять живых пролиферирующих участков. Предполагается, что эти пять участков происходили из единственного комочка каллуса, прошедшего второй цикл отбора, поскольку они находились близко один к другому на последовательных чашках с предыдущего посева. Эти участки происходили из обработки 2Х и были обозначены как линия каллуса Met1.
Линия каллуса Met1 была перенесена на среду F, содержащую 60 мг/л гигромицина, и на среду F без гигромицина. После 22 дн инкубации отсутствовали видимые различия в росте и внешнем виде ткани на этих двух типах среды. Линия каллуса Met1 росла быстро и, очевидно, не ингибировалась присутствием гигромицина в среде. Каллус Met1 оказался очень рыхлым и эмбриогенным на обеих средах и был визуально неотличим от контрольного каллуса AB63S, выращиваемого на среде F без гигромицина.
5. Подтверждение трансформации каллуса. Было изучено ингибирование каллуса Met1 и контрольного каллуса AB63S. До начала изучения ингибирования каллус Met1 подращивался на среде F без гигромицина в течение 21 дн. Каллус Met1 и контрольный каллус AB63S переносились на чашки со средой F, содержавшей 0, 15, 60, 100 и 200 мг/л гигромицина. Для каждой концентрации гигромицина было приготовлено по 3 чашки с каждой линией каллуса; на каждую чашку помещалось по 5 - 6 кусочков каллуса приблизительно по 50 мг (в общей сложности на каждую чашку приходилось по 300 мг каллуса).
Через 28 дн инкубации была измерена масса каллуса на каждой чашке. Степень ингибирования роста (в %) определялась путем деления средней массы каллуса, полученного при каждой концентрации гигромицина. Результаты показали, что рост каллуса Met1 абсолютно не ингибировался при концентрации гигромицина 15, 60 и 100 мг л. На среде, содержащей 200 мг/л гигромицина, рост каллуса Met1 был подавлен примерно на 20%. В отличие от этого, рост каллуса AB63S был подавлен при любой концентрации гигромицина; при концентрации гигромицина 200 мг/л рост каллуса AB63S подавлялся на 90%. Эти результаты подтверждали, что линия каллуса Met1 проявляла устойчивость к гигромицину в ростовой среде.
Для доказательства присутствия в ДНК каллуса Met1 гена устойчивости к гигромицину и для установления того, приобрел ли этот каллус также химерный ген Z27-Z10, был проведен Саузерен-блоттинг. Для обнаружения последовательности, кодирующей НРТ, образцы ДНК, выделенные из каллуса Met1 и из контрольного каллуса, расщеплялись рестриктазами BamHI, HindIII и BstEII. Образцы расщепленной ДНК разделялись элекрофорезом в 0,8%-ном агарозном геле и переносились на фильтр Nytran, как описано в примере 1. Проведенный перед блоттингом визуальный анализ геля, окрашенного бромистым этидием, показал, что рестриктаза BamHI полностью расщепляла ДНК, тогда как ни HindIII, ни BstEII не расщепляли ДНК в значительной степени. Блоты гибридизировались с BamHI-фрагментами кодирующей последовательности НРТ размером 1,05 Kb, меченными биотином. Условия гибридизации, отмывки и проявления соответствовали указанным в наборе реактивов BRL Photone, использованном в этом эксперименте.
После гибридизации на дорожках, содержащих ДНК Met1, расцепленную BamHI, были обнаружены меченые полосы в ожидаемой области 1,05 kb, а также в областях приблизительно 2,7, 4,5 и 6,5 kb. Эти результаты показали, что в ДНК из линии каллуса Met1 присутствовала последовательность, кодирующая НРТ. Дополнительные полосы в областях 2,7, 4,5 и 6,5 kb показывали, что или ферментативное расщепление было неполным, или в ДНК присутствовали множественные перестроенные копии последовательности НРТ. При неполном расщеплении рестриктазами HindIII и BstEII на обеих дорожках были видны сигналы гибридизации в области, соответствующей нерасщепленной ДНК. Этот результат показывал, что последовательность, кодирующая НРТ, в геноме Met1 была интегрирована в ДНК с большой молекулярной массой. На дорожках, содержащих расщепленную ДНК из контрольного каллуса, сигналы гибридизации отсутствовали.
Образцы ДНК, выделенные из каллуса Met1 и из контрольного каллуса, были проанализированы Саузерн-блоттингом для обнаружения химерного гена Z27-Z10. Образцы ДНК расщеплялись рестриктазами BamHI и EcoRI. При расщеплении BamHI высвобождался фрагмент размером 2,76 кb, содержащий кодирующую последовательность Z10 и 3'-некодирующую последовательность конструкции pZ27Z10, использованной в данной трансформации. Плазмида pZ27Z10 размером 7,26 Kb содержит уникальный сайт EcoRI. Приготовленный блот гибридизовался с меченным биотином зондом, содержащим полную кодирующую последовательность Z10, в условиях, описанных в наборе реактивов Photogene.
При расщеплении ДНК BamHI эндогенные последовательности Z10 давали сигналы гибридизации в областях 9 kb и около 15 kb как на дорожках, содержащих ДНК Met1, так и на дорожках с ДНК контрольного каллуса. В образце ДНК Met1, но не в ДНК контрольных образцов была отмечена также дополнительная полоса в области приблизительно 3,5 kb. В ожидаемой области 2,76 kb ДНК Met1 отсутствовали сильные сигналы гибридизации. Отсутствие маркированной полосы 2,7 kb при расщеплении ДНК Met1 BamHI свидетельствовало или о неполном расщеплении ДНК, или о перестройке введенной ДНК.
При расщеплении ДНК Met1 и ДНК контрольного каллуса рестриктазой EcoRI эндогенные последовательности Z10 в обоих случаях давали гибридизационные сигналы в областях приблизительно 12 и 16 kb. В образце ДНК Met1, но не в контрольном образце, была отмечена дополнительная полоса в области приблизительно 14 kb. Эти результаты показывали, что в ДНК каллуса Met1 присутствовали новые последовательности Z10, отсутствовавшие в образцах ДНК контрольного каллуса.
Эти результаты были подтверждены другим Саузерн-блоттингом, для которого ДНК Met1 и контрольного каллуса была расщеплена рестриктазами BamHI, NcoI и Nsil. Были проанализированы также образцы нерасщепленной ДНК Met1 и контрольного каллуса. Фильтр гибридизовался с зондом, содержавшим кодирующую последовательность Z10 и меченным 32Р. При всех вариантах расщепления в ДНК каллуса Met1 были отмечены новые сигналы гибридизации Z10, отсутствовавшие в образцах ДНК из каллуса негативного контроля. Эти результаты подтверждали присутствие новых кодирующих последовательностей Z10 в каллусе Met1. На дорожках с нерасщепленной ДНК, как каллуса Met1, так и контрольного каллуса, были отмечены сигналы гибридизации в области нерасщепленной ДНК. Эти результаты показали, что введенные последовательности Z10 были интегрированы в хромосомную ДНК каллуса Met1.
6. Регенерация растений и получение трансгенных семян. Каллус линии Met1 и контрольной линии AB63S был помещен на среду RM5, как описано в примере 1. Через 14 дн инкубации при 26oC в темноте каллус был перенесен на среду R5, описанную в примере 1. Каллус инкубировался в течение 7 дн при 26oC в темноте и затем был перенесен в световой режим, описанный в примере 1. Через 14 дн на свету проростки были пронесены в коробки Magenta (Sigma Chemical Co.), содержащие по 10 мл среды R5. Через 7 - 14 дн нахождения в этой среде проростки были перенесены на вермикулит на 7 дн и затем в почву, где выращивались до созревания. Всего из каллуса Met1 было регенерировано 49 растений (обозначенных как Met1.1 - Met1.49), а из контрольного каллуса AB63S было регенерировано в общей сложности 25 растений.
Для подтверждения того, что растения, регенерированные из каллуса Met1, сохранили введенную ДНК, был проведен ПЦР-анализ образцов ДНК, выделенных из листовой ткани. Для этой цели было использовано шесть олигодезоксирибонуклеотидных праймеров. Последовательности этих олигонуклеотидов, их ориентация и относительное положение в химерной конструкции гена Z27-Z10 приведены на фиг. 8 и в табл. 4.
Набор олигонуклеотидов (праймеров) был выбран таким образом, чтобы пара олигонуклеотидов, состоящая из одного олигонуклеотида Z27 (Z275' или Z27mid) и одного олигонуклеотида Z10 (Z10mid. или Z103') делала бы возможной амплификацию фрагментов только химерного гена Z27-Z10, но не собственных генов кукурузы Z27 или Z10. Появление амплифицированных фрагментов ожидаемой длины в полимеразных цепных реакциях, использующих эти специфичные для Z27-Z10 пары олигонуклеотидов, свидетельствовало о наличии в образце ДНК конкретного каллуса или растения химерного гена Z27-Z10.
Использование пары олигонуклеотидов Z27 (Z275' или Z27mid в сочетании с Z273') или пары олигонуклеотидов Z10 (Z10mid или Z103' в сочетании с Z105') приводило к амплификации соответственно кодирующих последовательностей Z10 или регуляторных последовательностей Z27 в полимеразных цепных реакциях с участием ДНК контрольного каллуса AB63S, ДНК каллуса Met1 или плазмиды pZ27Z10. Эти реакции служили в качестве позитивных контролей при амплификации последовательностей собственных генов кукурузы в образцах ДНК конкретного каллуса или растения.
Из листьев двух растений R0 Met1 (обозначенных как Met1 и Met1-2) и одного контрольного растения R0 AB63S была выделена ДНК, как описано выше. В полимеразных цепных реакциях с участием этих образцов ДНК использовались пары олигонуклеотидов, специфичных для кодирующей последовательности НРТ, химерного гена Z27-Z10, регуляторной последовательности Z27 и кодирующей последовательности Z10. Разделение продуктов ПЦР в геле показало, что во всех реакциях с участием ДНК Met1-1 и Met1-2 были получены продукты амплификации ожидаемого размера. В контрольной ДНК AB63S отсутствовали кодирующая последовательность НРТ и химерный ген Z27-Z10, но присутствовали собственная регуляторная последовательность Z27 и кодирующая последовательность Z10. Эти результаты показали, что изученные растения R0 Met1 сохранили введенную ДНК НРТ и химерную ДНК Z27-Z10.
Для дополнительного подтверждения того, что продукты диагностической полимеразной цепной реакции Z27-Z10 действительно содержали регуляторные последовательности Z27 и кодирующие последовательности Z10, был проведен Саузерн-блоттинг продуктов ПЦР. Были получены Саузерн-блоты двух агарозных гелей, на которые были нанесены одинаковые образцы. Образцы содержали продукты ПЦР, полученные при амплификации регуляторных последовательностей Z27, кодирующих последовательностей Z10 и последовательностей химерного гена Z27-Z10 описанным выше способом. Один из блотов гибридизовался с зондом, представляющим собой кодирующую последовательность Z10, а другой - с регуляторной последовательностью Z27. Результаты показали, что кодирующая последовательность Z10 гибридизовалась с амплифицированными фрагментами, полученными в полимеразных цепных реакциях с участием кодирующей последовательности Z10 и химерного гена Z27-Z10, но не с амплифицированными фрагментами, полученными в полимеразных цепных реакциях с участием регуляторной последовательности Z27. Сходным образом, зонд Z27 гибридизовался с амплифицированными фрагментами, полученными в полимеразных цепных реакциях с участием регуляторной последовательности Z27 и химерного гена Z27-Z10, но не с амплифицированными фрагментами, полученными в полимеразных цепных реакциях с участием кодирующей последовательности Z10. Эти результаты показали также, что амплифицированные в полимеразных цепных реакциях фрагменты содержали ожидаемые последовательности генов и что продукт диагностической ПЦР-амплификации химерного гена Z27-Z10 содержал как регуляторные последовательности Z27, так и кодирующие последовательности Z10.
Было проведено контролируемое опыление зрелых растений R0 Met1 с участием инбредных линий кукурузы A188, В73, А654 и Н99. Кроме того, было проведено несколько актов самоопыления и опыления сибсов. Всего было проведено 130 опылений, причем растения R0 Met1 использовались и как мужские (доноры пыльцы), и как женские (реципиенты). Зрелые семена были собраны через 45 дн после опыления и затем подсушены в течение 1-2 нед.
7. Анализ потомства R1. Наличие последовательности НРТ и химерного гена Z27-Z10 в ДНК тканей растений R1 оценивалось в трех выборках потомства R1 при помощи ПЦР.
Первая пранализированная выборка потомства R1 содержала четыре незрелых соплодия R0 Met 1-7. Эти соплодия были получены путем открытого опыления пестиков соцветий Met 1-7. Приблизительно через 18 дн после опыления соплодия были отделены от растения, и их поверхность была стерилизована. Эндосперм каждого семени вырезался, замораживался сухим льдом и хранился при -70oC вплоть до его использования для выделения ДНК.
Зародыш из каждого семени переносился на среду R5 и проращивался. Через 10 дн проростки переносились на вермикулит на 7 дн и затем в почву, где выращивались до созревания. ДНК каждого эндосперма выделялась и анализировалась при помощи ПЦР с использованием набора олигонуклеотидов, специфичных для кодирующей последовательности НРТ, химерного гена Z27-Z10 и гена Adh-1 кукурузы. В трех из четырех образцов ДНК эндосперма были обнаружены все упомянутые последовательности. В четвертом образце ДНК эндосперма отсутствовали кодирующая последовательность НРТ и последовательность химерного гена Z27-Z10, но присутствовала собственная последовательность Adh-1. Эти результаты показали, что последовательности НРТ и химерного гена Z27- Z10 были переданы потомству R1 растений Met1-7.
Аналогичным образом было проанализировано 24 семени из скрещивания А654 Х Met1-1. Через 24 дн после опыления семена извлекались из початков и их поверхность стерилизовалась. Зародыши и эндоспермы изолировались и обрабатывались описанным выше образом. ПЦР-анализ образцов ДНК эндосперма показал, что 9 из 24 потомков унаследовали как последовательности НРТ, так и химерный ген Z27-Z10. Остальные 15 потомков не несли ни одной из введенных последовательностей. Третья проанализированная выборка растений поколения R1 состояла из 28 растений R1, полученных при самоопылении растения Met1-6 поколения R0. Образцы ДНК выделялись из ткани листьев 28 двухнедельных проростков.
ПЦР-анализ образцов ДНК листьев показал, что 24 потомка поколения R1 несли как последовательности НРТ, так и химерный ген Z27-Z10. Оставшиеся четыре потомка R1 не несли ни одной из введенных последовательностей. Результаты описанного выше анализа приведены в табл. 5 и показывают, что значительная часть поколения R1 потомства Met1 унаследовала введенную ДНК.
Отношение числа растений Z27Z10+/HPT+ к числу растений Z27Z10-/HPT-, полученных в перекрестно скрещивающейся популяции, соответствует отношению 1: 1, характерному для расщепления по одному локусу. Кроме того, отношение числа растений Z27Z10+/HPT+ к числу растений Z27Z10-/HPT-, полученных в самоопыляющейся популяции, соответствует однолокусному расщеплению 3:1. Данные свидетельствуют также о сцеплении введенных последовательностей НРТ и Z27-Z10.
Пример 3. Фертильные трансгенные растения из линии каллуса AB12, содержащие рекомбинантную ДНК, кодирующую инсектицидный белок
Было показано, что белки, кодирующиеся различными генами Bacillus thuringiensis, в ряде случаев могут быть использованы в качестве пестицидов. Получение трансгенных растений кукурузы со специфическими гетерологическими генами Bt может усилить устойчивость растений к специфическим вредителям. Фертильные трансгенные растения, содержащие рекомбинантный ген Bt, были получены по методам, описанным в примере 1, с несколькими незначительными модификациями, описанными ниже.
Одновременно с линией каллуса AB11, использованной в примере 1, была основана другая линия. Линия AB12 была получена от отдельного скрещивания растений с теми же самыми родительскими генотипами (A188 Х В73). Этот пример демонстрирует регенерацию фертильных трансгенных растений из третьей линии каллуса в дополнение к линиям AB11 и AB63S и показывает, что получение фертильных трансгенных растений не было связано со свойствами, уникальными для одной линии каллуса.
Была использована плазмида pHYGI1, описанная в примере 1, а также плазмида pMS533, содержащая ген инсектицидного эндотоксина Bacillus thuringlensis (ВТ), слитый в одной рамке считывания с геном неомицинфосфотрансферазы (NPTII). С 5'-конца от слитного гена расположены участки ДНК промоторов ВТМ и нопалинсинтетазы. С 3'-конца от слитного гена расположены последовательности ДНК, входящие в ген ингибитора протеазы I томатов и район полиаденилирования гена нопалинсинтетазы.
Каллус был обстрелян так, как описано в примере 1, за исключением того что ДНК, использованная в ДНК/вольфрамовых образцах, содержала плазмиды pHYGI1 и рМS533. Одна пробирка содержала только 5 мкл ТЕ (10 мМ Трис-HCl (pH 8,0), 1 мМ ЭДТА).
Были проведены следующие варианты обстрела: 11 X pHYGI1/pMS533 (потенциальная позитивная обработка) и 3 х ТЕ (контрольная обработка).
После обстрела каллус, обработанный pHYGI1/pMS533, помещался на чашки первого цикла отбора со средой F, содержащей 15 мг/л гигромицина, по 10 кусочков каллуса на чашку. То же самое было проделано с двумя чашками, обстрелянными ТЕ (селектируемый контрольный каллус). Каллус с одной из чашек, обстрелянных ТЕ, был перенесен на среду F, без гигромицина; этот каллус поддерживался в течение всего эксперимента в качестве источника контрольной ткани (неселектируемый контрольный каллус).
Через 18 дн каллус был перенесен с чашек первого цикла селекции на чашки второго цикла селекции со средой, содержавшей 60 мг/л гигромицина; на каждую чашку было помещено 10 кусочков каллуса по 30 мг. Через 21 дн отбора на чашках второго цикла каллус оказался полностью подавлен. Все каллусы были перенесены на чашки третьего цикла отбора со средой, содержавшей 60 мг/л гигромицина.
Через 42 дн отбора на чашках третьего цикла на фоне некротической ткани было обнаружено 6 участков пролиферирующего каллуса; все они происходили от материала, обработанного pHYGI1/pMS533. Эти линии каллуса были перенесены на среду F.
Через 24 дн одна из каллусных линий, обозначенная как СВ2, значительно выросла. После этого части каждой каллусной линии были перенесены на среду F, содержащую 15 мг/л гигромицина, и на среду F, содержащую 60 мг/л гигромицина. Контрольный каллус был помещен на среду F, содержащую 15 мг/л гигромицина.
Только одна из шести каллусных линий, СВ2, была способна поддерживать устойчивый рост при многократном пассировании в присутствии 60 мг/л гигромицина. Из выборок этого каллуса была выделена ДНК, и присутствие гена Bt было подтверждено Саузерн- блоттингом.
ДНК была расщеплена одновременно рестриктазами BamHI и Xhol. BamHI режет 5'- конец кодирующей последовательности Bt, a XhoI режет 3'-конец кодирующего района. Из рестрикционного BamHI/XhoI-фрагмента плазмиды pMS533 размером 1,8 kb был приготовлен меченный 32P зонд. После гибридизации и авторадиографии была отмечена предсказанная полоса в области 1,8 kb. В ДНК из нетрансформированного каллуса полос отмечено не было.
Из каллуса СВ2 были регенерированы растения, и были проведены контролируемые опыления описанным выше способом, что позволило получить поколение R1. Растения R1 были проанализированы на присутствие последовательностей генов НРТ и Bt при помощи ПНР и на экспрессию гена НРТ при помощи ферментного анализа, как описано в примере 1.
Для проведения ПЦР использовалась ДНК, выделенная из корневой ткани проростков, при этом использовались методы, описанные в примере 1. Для проверки пригодности каждого образца ДНК для проведения ПЦР была проведена ПЦР с использованием праймеров, специфичных для нативного гена 10 кДа-zein кукурузы. Один из праймеров, использованных для ПЦР-анализа гена Bt, был комплементарен 35S-промотору, а другой - кодирующей последовательности Bt. Для ПЦР-анализа гена НРТ были использованы те же праймеры, что и в примере 1. Результаты этого анализа приведены в табл. 6. Эти результаты показывают, что введенные гены НРТ и Bt передаются и через мужских, и через женских родителей и что наблюдаемые частоты соответствуют менделевскому наследованию. Эти результаты подтверждают гипотезу о встраивании генов НРТ и Bt в хромосомную ДНК. Было также показано, что гены НРТ и Bt наследуются сцепленно; это показывает, что эти два гена встроены в одну и ту же хромосому недалеко друг от друга.
Пример 4. Фертильные трансгенные растения из каллусной линии AB12, передающие рекомбинантную ДНК в течение двух полных половых циклов
1. Линии растений и культура тканей. Была использована каллусная линия AB12, описанная в примере 3.
2. Плазмиды. Были использованы плазмиды рВII221 и pHYGI1, описанные в примере 1.
3. Процесс введения ДНК. Каллус был обстрелян, как в примере 1, за исключением того, что в ДНК/вольфрамовых образцах была использована другая ДНК. Каждая пробирка содержала по 25 мкл взвеси вольфрама N-10 в воде (50 мг/мл), 25 мкл 2,5 M CaCl2 и 10 мкл 100 мМ спермидина, а также 5 мкл раствора плазмидной ДНК с общей концентрацией ДНК 1 мг/мл. Одна пробирка содержала только плазмиду рВII221, две пробирки содержали только плазмиду pHYGI1 и одна пробирка вообще не содержала плазмид, но содержала 5 мкл буфера ТЕ.
Были проведены следующие варианты обстрела: 2 Х рВII221 (для промежуточной экспрессии), 7 X pHYGI1 (потенциальная позитивная обработка) и 3 x ТЕ (негативная контрольная обработка).
После проведения всех обстрелов каллус, обработанный рВII221, был перенесен на среду F. С каждой чашки каллуса на отдельную чашку со средой F переносилось 5 кусочков по 50 мг. Через два дня каллус был помещен в буфер для анализа GUS, описанный в примере 1. Было подсчитано число клеток с промежуточной экспрессией GUS, оказавшееся равным 686 и 845 GUS-положительным клеткам; это показывало, что процесс введения частиц произошел и на других обстрелянных чашках.
4. Отбор трансформированного каллуса После обстрела каллус, обработанный pHYGI1, был помещен на чашки первого цикла отбора со средой F, содержащей 15 мг/л гигромицина; на каждую чашку было помещено 10 кусочков каллуса по 25 мг. То же самое было проделано с каллусом из двух чашек, обстрелянных ТЕ (селектируемый контрольный каллус). Каллус c одной из чашек, обстрелянных ТЕ, был помещен на среду F без гигромицина; этот каллус поддерживался на протяжении всего эксперимента в качестве источника контрольной ткани (неселектируемый контрольный каллус).
Через 13 дн каллус на чашках первого цикла отбора был неотличим от неселектируемого контрольного каллуса. Все каллусы были перенесены с чашек первого цикла отбора на чашки второго цикла отбора со средой, содержащей 60 мг/л гигромицина. Количество чашек увеличилось приблизительно в 5 раз.
Через 23 дн масса каллуса на чашках второго цикла отбора существенно увеличилась, но к этому моменту каллус оказался близок к некротическому состоянию. Все каллусы были перенесены с чашек второго цикла отбора на чашки третьего цикла отбора со средой, содержащей 60 мг/л гигромицина.
Через 58 дн после обстрела на фоне мертвой ткани было обнаружено 3 живых полиферирующих участка. Эти три линии происходили из обработок pHYGI1 и были обозначены как 24C, 56A и 55A.
Через 15 дн на поддерживающей среде был отмечен рост линий. Линия 24С росла хорошо, тогда как линии 55A и 56A росли медленнее. Все три линии были перенесены на среду F, содержащую 60 мг/л гигромицина. Неселектируемый контрольный каллус также был перенесен с поддерживающей среды на среду F с 60 мг/л гигромицина.
Через 19 дн на среде с 60 мг/л гигромицина рост линии 24C оказался абсолютно не подавленным, тогда как увеличение массы контрольного каллуса составило 80% от массы линии 24C. Линия 56A полностью некротировала, а линия 55A была очень близка к некротическому состоянию. Линии 24C и 55A были вновь перенесены на среду F, содержащую HPT. B ДНК контрольной ткани полос отмечено не было. Линия каллуса 24С была переименована в PHS.
Для доказательства того, что ген устойчивости к гигромицину встроен в ДНК с большой молекулярной массой, выделенная из каллуса РНЗ и из контрольного каллуса ДНК была обработана (1) без рестриктаз, (2) рестриктазой BamHI, как описано выше, и (3) рестриктазой PstI, имеющей уникальный сайт в пределах кодирующей последовательности HPT плазмиды pHYGI1. ДНК переносилась на фильтр и гибридизовалась с использованной в качестве зонда кодирующей последовательностью HPT описанным выше образом.
Нерасщепленная ДНК PH2 гибридизовалась с зондом только в области, соответствовавшей нерезаной ДНК; это показывало, что ген устойчивости к гигромицину встроен в ДНК с большой молекулярной массой. Как было показано ранее, при рестрикции ДНК PH2 рестриктазой BamHI наблюдается ожидаемая полоса в области 1,05 kb. Если бы ген устойчивости к гигромицину находился в составе интактной плазмиды pHYGI1, то при рестрикции ДНК PH2 рестриктазой PstI следовало бы ожидать появления полосы в области 5,9 kb. В случае интеграции гена в геномную ДНК следует ожидать появления двух и более полос изменчивого размера (размер зависит от положения сайтов PstI в последовательностях, фланкирующих ген в хозяйской ДНК). Реально были обнаружены две полосы с молекулярной массой приблизительно 6,0 и 3,0 kb. Эти данные подтверждают встраивание гена устойчивости к гигромицину в ДНК с большой молекулярной массой. ДНК контрольного каллуса не гибридизовалась с зондом ни при какой из описанных обработок.
Эти результаты показывают, что кодирующая последовательность HPT присутствует в каллусе PH2 не в составе интактной плазмиды pHYGI1 и не в составе небольшой внехромосомной плазмиды. Напротив, они подтверждают встраивание гена устойчивости к гигромицину в ДНК с большой молекулярной массой. Проведенный впоследствии Саузерн- блоттинг показал, что кодирующая последовательность НРТ и 35S-промотор входят в состав одной непрерывной последовательности.
6. Регенерация растений и получение семян. Линия PH2 и неселектируемый контрольный каллус были помещены на среду RM5 для регенерации растений, как в примере 1. Через 16 дн каллус был перенесен на среду R5, также описанную в примере 1. Через 25 дн на среде R5 проростки были перенесены на свежую среду R5 и выращивались на ней в течение 20 дн. После этого проростки были перенесены на вермикулит на одну неделю и затем высажены в почву, где выращивались до полового созревания. Затем были проведены контролируемые опыления с участием линии В73.
7. Анализ потомства R1. A. РН2 в качестве донора пыльцы. Десять растений R1 от скрещивания В73 Х РН2.6 были проанализированы на экспрессию НРТ с использованием корневой и листовой ткани. Одно из растений дало положительный ответ. Наличие гена НРТ в этом растении было подтверждено Саузерн-блоттингом с использованием зонда НРТ, как описано в примере 1.
Для анализа удлинения корня семена были стерилизованы разбавленным в два раза промышленным отбеливателем (водный раствор) с добавлением 0,1% алканокса в течение 20 мин в баночках Erlenmeyer объемом 125 мл и 3 раза отмыты стерильной водой. Семена насыщались водой с добавлением 50 мг мл каптана в течение ночи при встряхивании с частотой 150 об/мин.
После набухания семян раствор сливался и семена переносились в проточные коробки (Flow Laboratories) с тремя слоями пропитанной водой бумаги для проращивания семян. Четвертый слой пропитанной водой бумаги для проращивания семян был помещен поверх семян. Затем семена проращивались в течение четырех дней.
После прорастания семян с каждого проростка срезался приблизительно 1 см верхушки первичного корешка, который затем помещался на среду, содержавшую соли MS, 20 г/л сахарозы, 50 мг/л гигромицина и 0,25% гельрита, и инкубировался в темноте четыре дня при 26oC.
Корни анализировались на присутствие либо отсутствие обильных корневых волосков и боковых корней. Корни классифицировались на трансгенные (устойчивые к гигромицину), если они имели корневые волоски и боковые корни, и нетрансформированные (чувствительные к гигромицину), если они имели ограниченное число ответвлений.
После отрезания верхушек корешков проростки с одного початка РН2 и одного контрольного початка переносились на влажный вермикулит и подращивались в темноте в течение пяти дней. После этого для проведения анализа этиолированных листьев с верхушки первичного побега делались срезы по 1 мм, поверхность которых затем стерилизовалась в течение 10 с, после чего они помещались на среду, содержавшую соли MS, 20 г/л гельрита и (кроме контроля) 100 мг/л гигромицина, и инкубировались 18 ч в темноте при 26oC. На каждую чашку помещалось по 2 среза каждого побега. Затем чашки инкубировались при световом режиме, включающем 14 ч света и 10 ч темноты, при 26oC в течение 48 ч, после чего их цвет оценивался по шкале от 0 (полностью коричневые) до 6 (полностью зеленые) для определения процента зеленой окраски в ткани листьев. Побеги классифицировались на нетрансформированные (чувствительные к гигромицину), если им был присвоен нулевой балл, и трансформированные (устойчивые к гигромицину), если им был присвоен балл 3 или более.
В. PH2 в качестве реципиентов пыльцы. 80 растений поколения R1 потомства РН2 от скрещивания РН2.23 Х В73 были проанализированы на экспрессию НРТ с помощью анализа удлинения корня, 26 из них дали положительный ответ. Для всех 26 растений экспрессия гена НРТ была затем подтверждена непосредственным высаживанием проростков на гигромицинсодержащую среду в проточных коробках. Два устойчивых растения были проанализированы при помощи ПЦР, и в них было подтверждено присутствие последовательности НРТ.
8. Анализ поколения потомства R2. Трансгенное растение R1, имевшее PH2 в качестве мужского родителя, было выращено до созревания и использовано для опыления растения FR 4326.
Семена R2 от этого скрещивания были пророщены и проанализированы на присутствие последовательностей НРТ при помощи ПЦР. Экспрессия гена НРТ была определена при помощи ферментного анализа НРТ, описанного в примере 1.
Три из 19 проанализированных потомков содержали последовательности гена НРТ и экспрессировали фермент НРТ. Остальные не содержали последовательностей НРТ и не проявляли активности фермента. Этот результат подтверждает передачу через пыльцу и экспрессию ДНК, введенной при помощи генной инженерии, через два последовательных поколения, показывая тем самым, что ген стабилен.
Пример 5. Использовалась рыхлая эмбриогенная каллусная культура кукурузы AB12, описанная в примере 3.
Плазмиды pGHN1-1 и pLUC-1 были сконструированы на основе вектора pBS+ (Stratagene, Inc., San Diego, CA), являющегося кольцевой плазмидой размером 3,2 kb, c использованием стандартных методов работы с рекомбинантными ДНК. Плазмида pCHN1-1 содержит кодирующую последовательность гигромицин В-фосфотрансферазы (НРТ) E.coli [22], фланкированную с 3'-конца сигналом полиаденилирования гена нопалинсинтетазы (nos) Agrobacterium tumifaclens (Chilton and Barnes, 1983). Экспрессия регулируется 35S-промотором вируса табачной мозаики (ВТМ) [23], расположенным выше кодирующей последовательности НРТ. В данном примере были также использованы плазмиды pBII221 и pHYGI1.
Плазмида pLUC-1 содержит кодирующую последовательность люциферазы огневки (DeWet et al.,1987), фланкированную с 5'-конца 35S-промотором ВТМ, а с 3'-конца - сигналом полиаденилирования nos. Данная плазмида использовалась исключительно в качестве негативной контрольной ДНК. Плазмиды вводились в культуру AB12 методом обстрела микрочастицами. Было приготовлено 26 чашек описанными в примере 1 методами. Одна пробирка содержала только плазмиду pBII221, две пробирки содержали и pHYGI1, и pBII221, две пробирки содержали и pGHNI-1, и pBII221, и одна пробирка содержала только pLUC-1. Информация о проведенных обстрелах приведена в табл. 7.
Две чашки с каллусом, обстрелянным pBII221, были проанализированы на промежуточную экспрессию GUS. Было подсчитано число синих клеток, оказавшееся равным 291 и 477 клеткам с промежуточной экспрессией GUS; это показывало, что процесс введения ДНК произошел и на других обстрелянных чашках.
Сразу после обстрела всех образцов каллус во всех чашках, обработанных pHYGI1/pBII221, pCHNI-1/pBII221, и с трех чашек, обработанных pLUC-1, был перенесен на чашки первого цикла отбора со средой F, содержащей 15 мг/л гигромицина В (с каждой чашки 5 кусочков каллуса переносилось на отдельную чашку). Каллус с четвертой чашки, обработанной pLUC-1, был перенесен на среду F без гигромицина. Эта ткань поддерживалась на неселективной среде, пересевалась каждые 2 - 3 недели и в дальнейшем обозначается как неселектируемый контрольный каллус.
Через 2 нед отбора ткань выглядела практически одинаково на селективной и неселективной среде. Все каллусы, обработанные pHYGI1/pBII221 и pCHN1-1/pBII221 (по 8 чашек), и два контрольных каллуса (с селективной среды) были перенесены с чашек первого цикла отбора на чашки второго цикла отбора со средой, содержавшей 60 мг/л гигромицина. На каждую чашку второго цикла отбора было помещено 10 кусочков каллуса по 30 мг, в результате чего общее число чашек увеличилось.
Оставшаяся ткань, поддерживаемая на селективной среде (по две чашки с обработок pHYGI1/pBII221 и pGHN1-1/pBII221 и одна чашка с контрольным каллусом) была перенесена в буфер для анализа GUS при 37oC для определения того, видны ли синие кластеры клеток через две недели после обстрела. Через 6 дн пребывания ткани в буфере для анализа она была проанализирована на предмет экспрессии GUS. Результаты анализа приведены в табл. 8.
Через 21 дн на чашках второго цикла отбора все живые участки материала были перенесены на чашки третьего цикла отбора со средой, содержавшей 60 мг/л гигромицина. Чашки второго цикла, содержавшие только мертвую на вид ткань, были сохранены. Чашки второго и третьего циклов отбора периодически просматривались для обнаружения живых пролиферирующих участков.
Через 35 дн на чашках третьего цикла отбора все чашки обоих циклов были проверены на наличие живых участков каллуса. Два таких участка, пролиферирующих на фоне мертвой ткани, были обнаружены на чашках, обработанных pHYGI1/pBII221. Первый участок, названный 3AA, был обнаружен на чашке третьего цикла, а второй, названный РН1, на чашке второго цикла. Обе линии были перенесены на среду F без гигромицина.
Через 19 дн на среде F без гигромицина линия 3AA подросла очень мало, тогда как линия РН1 росла быстро. Обе линии были вновь перенесены на среду F без гигромицина на 9 дн. Затем линии 3AA и РН1 были перенесены на среду F, содержавшую 15 мг/л гигромицина, на 14 дн. При этом оказалось, что линия 3AA росла медленно и имела очень низкое качество. Однако линия РН1 быстро росла на среде F с 15 мг/л гигромицина; эта линия пассировалась затем на среде F без гигромицина.
Через 10 дн на среде F было начато изучение ингибирования линии РН1. Каллус РН1 был перенесен на среду F, содержавшую 1, 10, 30, 100 и 250 мг/л гигромицина В. Для каждой концентрации было приготовлено 5 чашек, и каждая чашка содержала по 10 кусочков каллуса приблизительно по 50 мг. Для каждой концентрации гигромицина была приготовлена одна чашка неселектируемой контрольной ткани.
Выяснилось, что линия РН1 способна к устойчивому росту при концентрации гигромицина 0, 10, 30, 100 и 250 мг/л после 9 пассажей.
С чашек второго и третьего циклов отбора в разное время были также восстановлены дополнительные участки ткани. Ни один из них не был способен расти в присутствии гигромицина при многократном (двух- и трехкратном) пассировании.
Для доказательства того, что каллус РН1 приобрел ген устойчивости к гигромицину, этот каллус был проанализирован методом Саузерн-блоттинга, для чего была выделена ДНК из РН1 и неселектируемого контрольного каллуса. Для выделения ДНК 2 г каллуса замораживались в жидком азоте и растирались в тонкий порошок, который затем переносился в пробирку объемом 30 мл (Oak Ridge), содержащую 6 мл буфера для экстракции (7 M мочевина, 250 мМ NaCl, 50мМ Трис-HCl (pH 8,0), 20 мМ ЭДТА (pH 8,0) и 1% саркозина). К этому добавлялись 7 мл смеси фенол/хлороформ (1:1), пробирки встряхивались и инкубировались при 37oC в течение 15 мин. Образцы центрифуговались при 8 К в течение 10 мин при 4oC. Супернатант переносился пипеткой через фильтр Calbiochem 475855 в пробирку объемом 15 мл (American Scientific Products, C3920-15A), содержащую 1 мл 4,4 M ацетата аммония (pH 5,2). Затем добавлялось 6 мл изопропанола, пробирка встряхивалась и выдерживалась в течение 15 мин при -20oC. ДНК осаждалась в центрифуге Beckman TJ-6 при максимальной скорости в течение 5 мин при 4oC. Супернатант сливался, и осадок растворялся в 500 мкл ТЕ (10 мМ Трис-HCl (pH 8,0) и 10 мМ ЭДТА) в течение 15 мин при комнатной температуре. Образцы переносились в пробирку Eppendorf объемом 1,5 мл, и к ним добавлялись 100 мкл 4,4 M ацетата аммония (pH 5,2) и 700 мкл изопропанола. Смесь инкубировалась в течение 15 мин при -20oC, после чего ДНК осаждалась в течение 5 мин при 1200 об/мин в центрифуге Eppendorf. Осадок промывался 70%-ным этанолом, высушивался и ресуспендировался в ТЕ-1 (10 мМ Трис-HCl (pH 8,0), 1 мМ ЭДТА).
10 мкг изолированной ДНК расщеплялось рестриктазой BamHI (NEB) и анализировалось описанным в примере 1 способом с использованием зонда НРТ. Как видно на фиг. 3, в ДНК каллуса РН1 была отмечена полоса в ожидаемой области 1,05 kb, что показывало наличие кодирующей последовательности НРТ. В ДНК контрольного каллуса полос отмечено не было.
Для доказательства того, что ген устойчивости к гигромицину встроен в ДНК с большой молекулярной массой, ДНК, изолированная из каллуса РН1 и из контрольного каллуса, была обработана (1) без рестриктаз, (2) рестриктазой BamHI описанным выше способом и (3) рестриктазой Pst1, которая расщепляет плазмиду pHYGI1 только по одному сайту в пределах кодирующей последовательности НРТ. Образцы были перенесены на блот и проанализированы при помощи зонда, представляющего собой кодирующую последовательность НРТ, описанным выше способом.
Нерасщепленная ДНК каллуса РН1 гибридизовалась с зондом только в области, соответствующей нерасщепленной ДНК; это показывало, что ген устойчивости к гигромицину встроен в ДНК с большой молекулярной массой. При расщеплении ДНК РН1 рестриктазой BamHI была отмечена полоса в ожидаемой области 1,05 kb, как было показано выше. При расщеплении ДНК РН1 рестриктазой Pst1 в случае, если ген устойчивости к гигромицину присутствовал бы в составе интактной плазмиды pHYGI1, ожидалась бы полоса в области 5,9 kb. Если ген встроен в ДНК с большой молекулярной массой, то следует ожидать появления двух или более полос различного размера (размер зависит от положения сайтов расщепления Pst1 в последовательностях, фланкирующих ген в ДНК хозяина). Было отмечено три полосы с приблизительными размерами 12, 5,1 и 4,9 kb. Этот результат свидетельствует о встраивании гена устойчивости к гигромицину в ДНК с большой молекулярной массой. Интенсивность полосы в области 4,9 kb примерно вдвое больше интенсивности других полос; это наводит на мысль, что или расщепление ДНК было неполным, или ген НРТ тандемно повторен. Ни в одной из описанных выше обработок не было отмечено гибридизации с зондом ДНК контрольного каллуса.
Эти результаты показывают, что кодирующая последовательность НРТ присутствует в каллусе РН1 не в виде интактной плазмиды pHYGI1 и не в виде небольшой внехромосомной плазмиды. Они подтверждают встраивание гена устойчивости к гигромицину в ДНК с большой молекулярной массой. Кроме того, Саузерн-блоттинг показал, что кодирующая последовательность НРТ входит в состав одного непрерывного района с 35S-промотором.
Из всех чашек с разными концентрациями гигромицина, использованных при изучении ингибирования каллуса, каллус РН1 был перенесен на среду RM5, и растения были регенерированы так, как описано в примере 1. Всего было получено 65 растений из каллуса РН1 и 30 растений из контрольного каллуса.
Для доказательства того, что введенная ДНК сохранилась в тканях растений R0, был проведен Саузерн-блоттинг расщепленной рестриктазой BamHI ДНК листьев трех случайно выбранных растений поколения R0, полученных из каллуса РН1. Методы проведения Саузерн-блоттинга описаны выше. Блот гибридизовался с зондом НРТ, как описано в примере 1. Как видно на фиг. 4, в ДНК всех трех растений была отмечена полоса в области 1,05 kb, что свидетельствовало о присутствии кодирующей последовательности НРТ. В ДНК контрольных растений полос отмечено не было.
Были проведены контролируемые опыления растений РН1 при помощи стандартных методов с участием инбредных линий Zea mays A188, В73 и Oh43. Семена были собраны через 45 дн после опыления и подсушены в течение 2-3 нед.
Наличие устойчивости к гигромицину у потомства поколения R1 оценивалось при помощи анализа удлинения корня, анализа этиолированных листьев и Саузерн-блоттинга. С каждого растения, регенерированного из каллуса РН1 или контрольного каллуса, было отобрано для анализа по два початка. Для всех початков донором пыльцы была инбредная линия A188. Результаты приведены в табл. 9 и на фиг. 5.
Присутствие гена НРТ было подтверждено в двух растениях поколения R2, происходящих от материнского растения РН1.
Растение РН1.3.1 (табл. 9) было опылено пыльцой Oh43. Девять семян, полученных от этого скрещивания, были пророщены, и из листьев четырех дочерних растений была выделена ДНК, которая затем была проанализирована методом Саузерн-блоттинга с использованием зонда, представляющего собой кодирующую последовательность НРТ. Два из четырех проанализированных растений содержали большое число копий последовательности НРТ. Хотя в двух растениях присутствовал ген НРТ, экспрессия этого гена не была отмечена при анализе этиолированных листьев.
Растение РН1.10.8 (табл. 9) было использовано для опыления растений линии В73 и, кроме того, самоопылено. Пятьдесят дочерних растений, полученных в скрещивании, было проверено на экспрессию НРТ при помощи анализа как корней, так и листьев. Экспрессия не была отмечена. Кроме того, Саузерн-блоттинг ДНК восьми дочерних растений не показал присутствия гена НРТ. В потомстве от самооплодотворения при анализе листьев девяти растений не было получено данных, которые свидетельствовали бы о присутствии гена НРТ; Саузерн-блоттинг ДНК четырех из этих растений также не дал таких данных.
Наследование рекомбинантной ДНК потомством было отмечено только тогда, когда трансгенное растение (R0 или R1) использовалось в качестве женского родителя. Это свидетельствует о материнском наследовании рекомбинантной ДНК у РН1.
Все цитированные выше публикации и патентные документы включены в данное описание в качестве ссылок. Изобретение было описано в связи с различными конкретными и предпочтительными вариантами его осуществления; однако необходимо иметь в виду, что возможны и другие его модификации и варианты, соответствующие его сущности и находящиеся в пределах его объема. -
Литература.
1. Adang M.J. et al. Gene, 36, 1985, 289
2. Altenbach et al. Plant Mol. Biol., 8, 1987, 239
3. Armstrong C.L, et al. Planta, 164, 1985, 207 - 214
4. Benner M.S. et al. Theor. Appl. Genet., 78, 1989, 761
5. Bevan M. et al. Nuc. Acids. Res., 11, 1983, 36a
6. Bradford. Anal. Biochem., 72, 1976, 248
7. Cabanes-Bastos E. Gene, 77, 1989, 169
8. Callis J. et al. Genes & Develop., 1, 1987, 1183 - 1200
9. Chu, C.C. et al. Sci.Sin. (Peking), 18, 1975, 659 - 668
10. Cocking А. et al. Science, 236, 1987, 1259 - 1262
11. Cristou P. et al. Plant Physiol., 87, 1988, 671
12. Datta S.K. et al. Bio/Technology, 8, 1990, 736
13. DeWet et al.Proc. Natl. Sci. USA, 82, 1985, 7870 - 7873
14. DeWet J. et al. Experimental Manipulation of Ovule Tissue, G. Chapman et al., eds., Longman, Inc., New York, 1985, 197 - 269
15. Freeling J.C. et al. Maydica XXI, 1976, 97 - 112
16. Fromm M.E. et al. Nature, 319, 1986, 791
17. Geiser M. et al. Gene, 48, 1986, 109
18. Geraghty D.E. Ph.D. Thesis, University of Minnesota, 1987
19. Graves A. et al. Plant Mol. Biol., 3, 1986, 43 - 50
20. Green C. et al. Crop Sci. 15, 1975, 417 - 421
21. Green C. et al. Maize for Biological Research, Plant Molec. Biol. Assoc., 1982, 367 - 372
22. Gritz L. et al. Gene, 25, 1983, 179 - 188
23. Guilley H. et al. Gell, 30, 1982, 763 - 773
24. Hallauer A.R. et al. Corn and Corn Improvement, 3rd. ed., Agronomy Society of America, 1988, 469 - 564
25. Hofte H. et al. Microbiol. Rev., 53, 1989, 242
26. Jefferson R. et al. EMBO J., 6, 1987, 3901 - 3907
27. Kirihara et al. Gene, 7, 1988, 359
28. Kamo K. et al. Bot. Gaz., 146, 1985, 327 - 334
29. Klein T. et al. Plant Physiol., 91, 1989, 440 - 444
30. Klein T. et al. Proc. Natl. Acad. Sci. USA, 85, 1988, 4305 - 4309
31. Klein T. et al. Bio/Technology, 6, 1988, 559 - 563
32. Lu C. et al. Theor. Appl, Genet., 62, 1982, 109 -112
33. McCabe D, et al. Bio/Technology, 6, 1988, 923 - 926
34. Murashige T. et al. Physiol. Plant, 15, 1962, 473 - 497
35. Murray et al. Nucl. Acids Res., 17, 1987, 477
36. Neuffer M. Maize for Biological Research, Plant. Mol. Biol. Assoc., 1982, 19-30
37. Ohta Y. PNAS USA, 83, 1986, 715
38. Pedersen et al. J. Biol. Chem., 261, 1986, 6279
39. Phillips R. et al. Corn and. Corn Improvement, 3rd ed., Agronomy Society of America, 1988, 345 - 387
40. Potrykus l. Trends in Biotechnology, 7, 1989, 269 - 273
41. Prioli L.M. et al. Bio/Technology, 7, 1989, 589
42. Rhodes C.A. et al. Bio/Technology, 6, 1988, 56
43. Rhodes C.A. et al. Science, 240, 1988, 204 - 207
44. Sambrook J. et al. Molecular Cloning. A Laboranory Manual, 2nd ed., Cold Spring Harbor Laboratory Press, 1989
45. Sanford J. et al. Part. Sci. & Techn., 5, 1987, 27 - 37
46. Shillito R.D. et al. Bio/Technology, 7, 1989, 581
47. Staebell M. et al. Anal. Biochem., 185, 1990, 319
48. Vasil l.. Cell Culture and Somatic Cell Genetics of Plants, Vol.I, Laboratory Procedures and Their Applications, Academic Press, 1984, 152 - 158
49. Vietra J. et al. Methods Enzymol., 153, 1987, 3
50. Weising K. et al., Ann.Rev. of Genetics, 22, 1988, 421 - 478
51. Whitely H.R. et al. Ann. Rev. Microbiol., 40, 1986, 549
52. Yanisch-Perron L. et al. Gene, 33, 1985, 109 - 119
53. Опубликованная заявка на европейский патент N 270356 (McCabe et al.)
54. Опубликованная заявка на европейский патент N 275069 (Arntzen et al. )
55. Опубликованная заявка на европейский патент N 331855 (Sanford J. C. et al.), основанная на заявке N 07/161807 от 29.03.88 на патент США.
56. Патент США N 4683202 (K.B. Mullis).













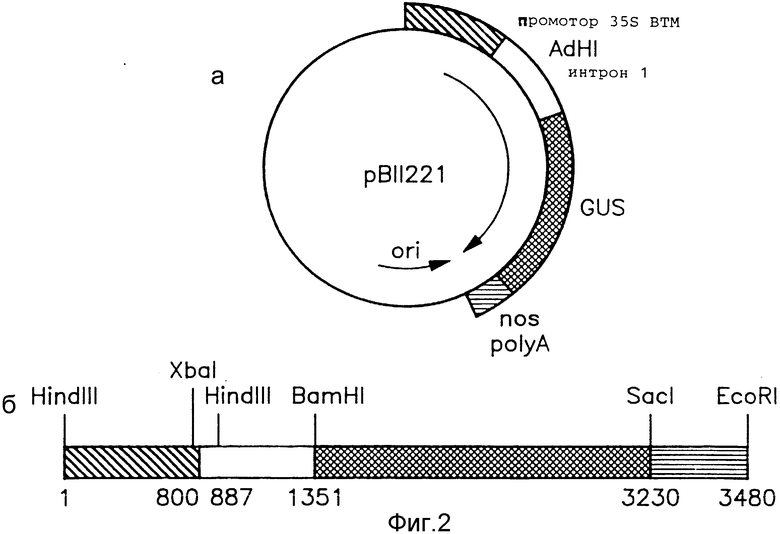
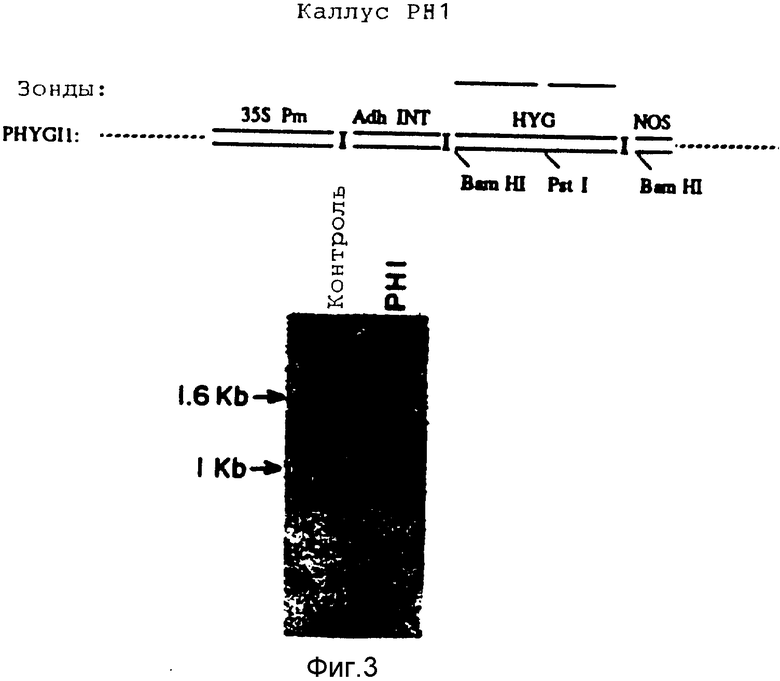
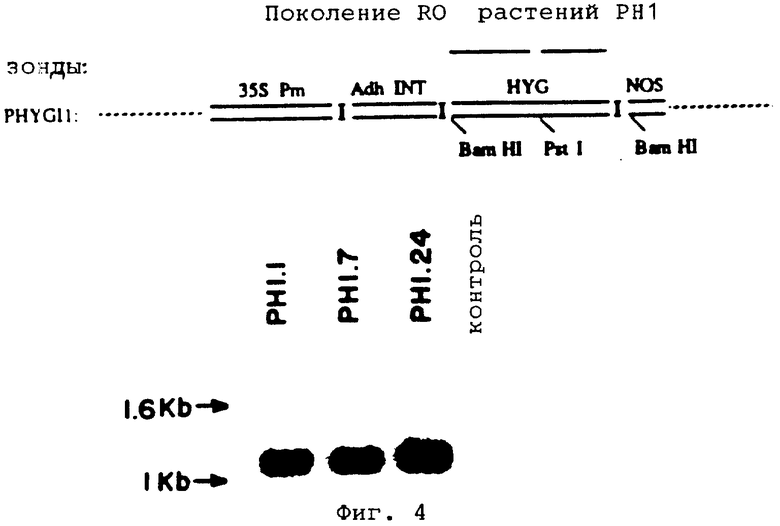
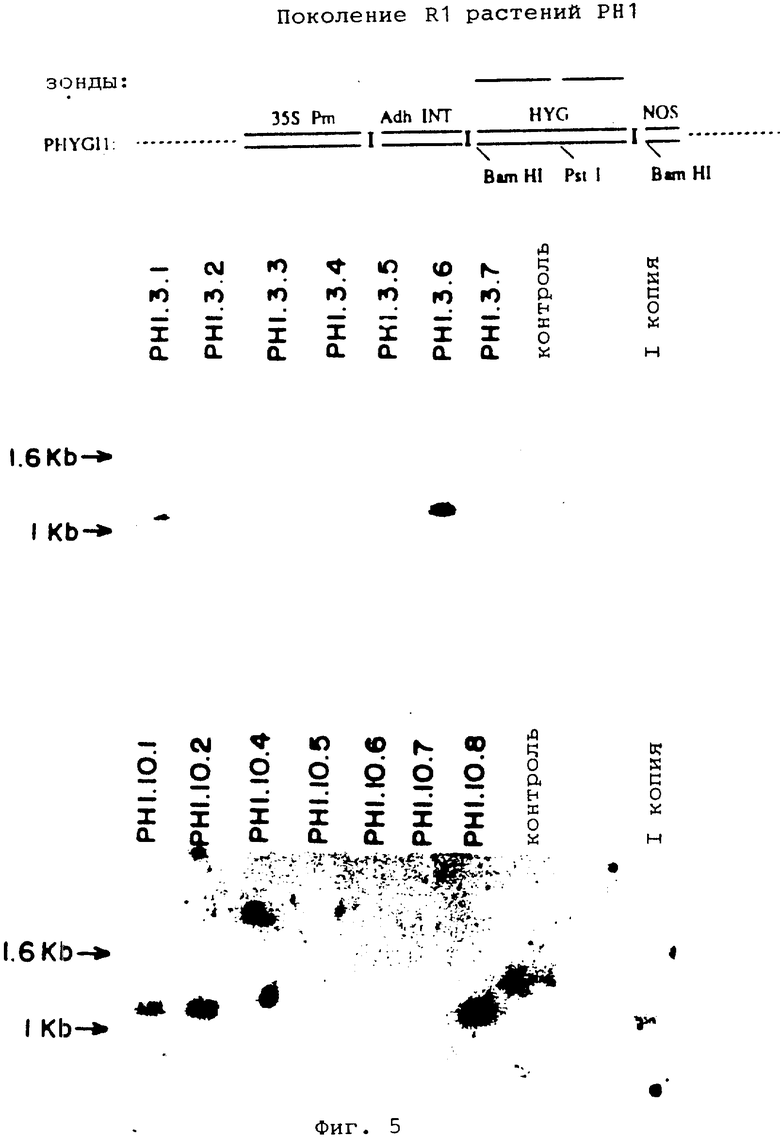
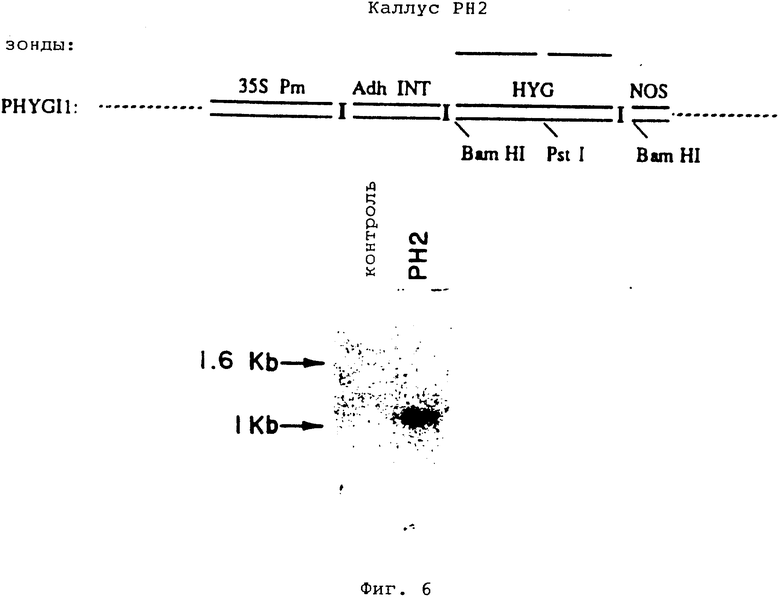
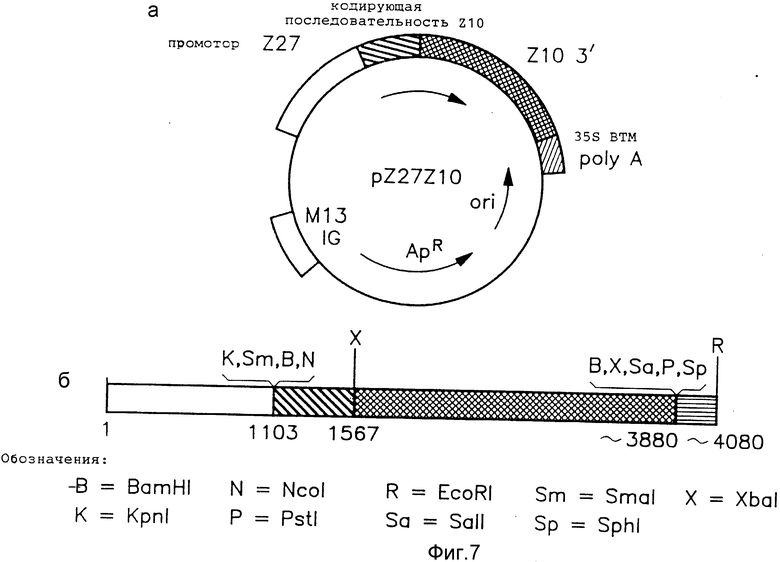
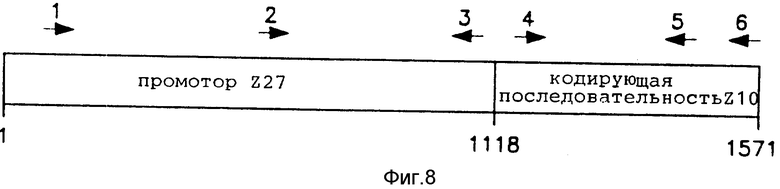
Способ предназначен для получения фертильных трансгенных растений кукурузы и может быть использован для введения в хромосому рекомбинантной ДНК. Реципиентные клетки, полученные из способной к регенерации рыхлой эмбриогенной каллусной культуры, обстреливают микрочастицами, покрытыми ДНК. Используется каллусная культура незрелых зародышей в виде комочков 30 - 80 мг, которая культивируется на твердой питательной среде. Вводимая ДНК может содержать ген, кодирующий белок семян, в результате чего содержание аминокислот увеличивается. 3 з.п.ф-лы. 8 ил., 9 табл.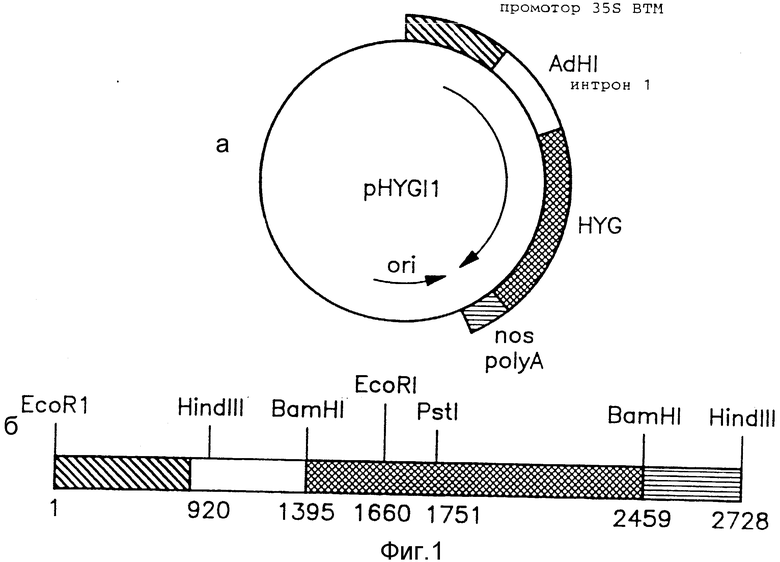
| Rhode C.A | |||
| etal., Science, 240, 1988, 204-207. |
Авторы
Даты
1998-07-10—Публикация
1991-01-14—Подача