Изобретение относится к генной инженерии растений и может быть использовано в селекции мягкой и твердой пшеницы и ячменя.
Клоп-вредная черепашка Eurygaster integryceps Puton является наиболее серьезным вредителем пшеницы, ржи и ячменя, распространенным в степной и лесостепной зонах России, и может вызывать чрезвычайные ситуации в зерновом комплексе страны. Например, в 1996 году поврежденность зерна, потеря его качества и перевод из категории продовольственной в фуражное составили: в Ставропольском крае 30%, в Краснодарском крае 50%, в Ростовской области 80-100%. Из продовольственных ресурсов было выведено 5 млн т продовольственного зерна, а общий ущерб составил 2 миллиарда рублей. Особенно большой ущерб наносится пшенице. В 1999 году около 70% зерна пшеницы урожая 1999 года в Самарской области использовались не для производства хлебопекарной муки, а как фураж (1). В таблице 1 приведены данные о заселенности полей РФ клопом-вредной черепашкой, представленные академиком-секретарем отделения защиты растений РАСХН В.А.Захаренко.
Большой ущерб урожаю наносит клоп и в западных районах Азии.
Вредная черепашка развивается в одном поколении (2). Можно отметить три фазы поражения растений клопом. Первая фаза начинается с прилета клопов на поля с перезимовки в лесополосах или лесах, когда температура воздуха установится не ниже 10-12°С. Перелетев на поле, они начинают интенсивно атаковать растения, находящиеся в фазах кущения и выхода в трубку. Клопы прокалывают хоботком стебли ниже зачаточного колоса и высасывают из них сок. Через 8-12 дней после прилета самки клопа начинают откладывать яйца на листьях, отмерших растениях и комочках почвы. Откладка яиц может продолжаться в течение месяца и более, при этом одна самка откладывает 20-250 яиц. Вторая фаза атаки начинается через 10-20 дней после откладки яиц, когда из них появляются личинки, а третья - через 35-50 дней с появлением из личинок клопов.
Личинки и образовавшиеся из них клопы наносят посевам наибольший вред. Образовавшиеся клопы заканчивают цикл развития на поле, питаясь зерном. Вредитель вводит через стилет в зерновку гидролитические ферменты протеазы, разрушающие высокомолекулярную фракцию запасных белков семени - глютенинов, определяющих хлебопекарные качества зерна. При поражении черепашкой лишь 2%-3% зерен потеря хлебопекарных свойств достигает 100% - хлеб «не всходит». Поэтому понятно, что защита от поражения клопом-вредной черепашкой представляет собой одну из важнейших задач при выращивании пшеницы.
Основным способом борьбы с поражением растений пшеницы вредной черепашкой до сих пор остается применение химических средств. Широкий круг инсектицидов представлен производными пиримидина, амидотиофосфата, N-фенилпиразола, пирролов, гидразина, бензилсульфида, эфира, соединения дигалогенпропена, фтороалкоксиаминотриазины и другими препаратами. Соответствующие средства и способы их применения описаны, в частности, в патентах Российской Федерации RU 2187555, RU 2124018, RU 2026291, RU 2063688, RU 2051902, RU 2170728, RU 2139279, RU 2130008, RU 2047607 и во многих других технических решениях. Инсектицидными композициями протравливают предназначенные для посева семена пшеницы либо их распыляют над посевами с помощью авиации. Обработка посевов и семян пшеницы химическими препаратами является достаточно эффективным средством борьбы с насекомыми, особенно когда она сочетается с другими агротехническими мероприятиями.
Однако применение химических средств в борьбе с вредителями сельскохозяйственных культур не лишено существенных недостатков. Эффективность использования препаратов может быть значительно снижена из-за неблагоприятных погодных условий. Кроме того, подобные препараты необходимо применять систематически. Одним из самых серьезных недостатков применения химических средств в борьбе с вредителями сельскохозяйственных культур является то, что оно может нанести значительный ущерб окружающей природной среде. Поэтому желательна разработка альтернативных средств и методов борьбы с насекомыми, поражающими посевы зерновых культур.
Одной из альтернатив химическим способам борьбы с поражением пшеницы вредной черепашкой являются биологические способы защиты. Например, в патенте RU 2229230 раскрыт способ, предусматривающий использование в агроценозах энтомофагов, выращиваемых в лабораторных условиях и выпускаемых в агроценозы в период массового выхода фитофагов. Способ иллюстрируется использованием теленомин против яиц вредной черепашки на посадке озимой пшеницы. Однако и подобные способы защиты пшеницы зависят от погодных условий, требуют времени и систематического применения.
Более перспективными для борьбы с насекомыми, поражающими растения, являются методы генной инженерии, позволяющие создавать растения, устойчивые к различным патогенным факторам, в том числе к насекомым. Как известно, такие методы имеют ряд преимуществ перед остальными - они не загрязняют окружающую среду, не зависят от погодных условий, не требуют дополнительных агротехнических мероприятий и ежегодного применения.
Известны способы получения генетически модифицированных растений сельскохозяйственных культур, устойчивых, например, к жесткокрылым насекомым за счет введения в геном этих растений генов, кодирующих белки, токсичные для таких насекомых, так называемые дельта-эндотоксины. Современный уровень техники в данной области представлен, частности, в техническом решении по патенту RU 2234531 (Монсанто Ко., опубл. 20.08.2004). В указанном документе раскрывается способ получения трансгенного растения, предусматривающий введение в его геном нуклеотидной последовательности, промоторную последовательность, функционально связанную с последовательностью, кодирующей пластидный транзитный пептид, которая, в свою очередь, сцеплена с последовательностью, кодирующей белок Сrу2Аb дельта-эндотоксина бактерии Bacillus thuringiensis (Bt). Для усиления экспрессии белка-токсина в растении вводимая в него нуклеотидная последовательность дополнительно содержит интронную последовательность, выбираемую из группы, состоящей из интрона 1 Adh, интрона сахарозосинтазы, элемента омега TMV, интрона белка 70 теплового шока кукурузы и интрона ActI риса. Кроме того, для отдаления возникновения устойчивости к насекомым у генетически модифицированного растения в него предлагается вводить дополнительную последовательность нуклеиновой кислоты, содержащую функциональную последовательность, кодирующую белок Сr1 дельта-эндотоксина В.Thuringiensis. Разработчик полагает, что этот способ пригоден для трансформации как многих двудольных, так и однодольных растений, в том числе для пшеницы.
Способы трансформации растений с использованием генов белков дельта-эндотоксинов Bt, требуют, однако, проведения дополнительных мероприятий для обеспечения высокоуровневой экспрессии указанных белков. Такие мероприятия включают так называемую оптимизацию генов из Bacillus thuringiensis, заключающуюся в том, что нуклеотидный состав триплетов, кодирующих конкретные аминокислоты белка из Bt, по возможности заменяют триплетами нуклеотидов, характерных для аминокислотного состава белков растения. Методика подобной трансформации раскрыта, например, в техническом решении по патенту RU 2224795 (Дау Агросайенс ЛЛС, опубл. 27.02.04) на примере получения трансгенных растений кукурузы, устойчивых к поражению насекомыми.
Весьма близкий к заявленному изобретению способ придания именно однодольным растениям, в частности пшенице, устойчивости к поражению насекомыми представлен в техническом решении, раскрытом в патентной заявке RU 99115161 (Новартис АГ и др., опубл. 10.06.2001). Согласно известному способу борьбы с насекомыми растительные клетки трансформируют таким образом, что они содержат рекомбинантную ДНК, включающую последовательность, кодирующую пероксидазу, предпочтительно анионную пероксидазу. Трансформированные растительные клетки приобретают инсектицидные свойства к ряду жесткокрылых, двукрылых и других насекомых и при питании ими или контакте с ними насекомые погибают.
Известные способы получения трансгенных растений с использованием только генов эндоксинов Bt или пероксидазы неэффективны в придании им устойчивости к поражению таким насекомым, как клоп-вредная черепашка, так как использованные гены эндоксинов Bt невидоспецифичны по действию на клопа-черепашку, а действие пероксидазы, очевидно, непатогенно по отношению к ферментам пищеварения клопа-черепашки.
На сегодняшний день неизвестны технические решения, которые обеспечивали бы создание генетически модифицированного растения пшеницы, устойчивого к клопу-вредной черепашке, которое, кроме инсектицидного действия, обладало бы свойствами отдаления времени возникновения устойчивости клопа-черепашки к инсектицидным растениям трансгенной пшеницы, что позволило бы стабильно сохранять урожаи и получать высококачественное зерно для пищевой промышленности.
В заявленном изобретении поставленная задача решается впервые. Способ создания растений пшеницы, устойчивых к клопу-вредной черепашке (Eurygaster integryceps Puton), включает стадию генетической трансформации клеток растений твердой или мягкой пшеницы, по крайней мере, двумя или тремя, различными по механизму действия, генами, кодирующими продукты, блокирующие питание клопа-вредной черепашки за счет ресурсов растения, причем, по крайней мере, один из указанных генов функционально связан с промотором, обеспечивающим конститутивную экспрессию продукта гена в растении, и, по крайней мере, второй из указанных генов функционально связан с промотором, обеспечивающим тканеспецифичную экспрессию продукта в растении, и стадию регенерации растений пшеницы из указанных трансформированных клеток. Предпочтительно, способ предусматривает трансформацию растительных клеток осуществляют с использованием выделенных из различных видов растений генов ингибиторов протеаз и α-амилаз клопа-вредной черепашки, выделенных из растений генов генов растительных лектинов, такого как ASAL из листьев чеснока Allium sativum (3) или GNA из подснежника Galanthus nivalis agglutinin (4), а также оптимизированного для пшеницы гена из Bt, кодирующего дельта-эндотоксин и видоспецифичного к клопу-черепашке, при этом в качестве конститутивного промотора используют усиленные интронами убиквитиновый промотор кукурузы (Ubil) или актиновый промотор риса (Actl), а в качестве тканеспецифичного - специфичный для флоэмы риса промотор рисовой синтетазы сахарозы (RSsl) и/или специфичный для наливающегося зерна промотор злаков, например, семяспецифичный промотор генов запасных белков пшеницы. Трансформация клеток пшеницы осуществляется биобаллистическим методом (5).
Само по себе введение в геном растения двух генов с антипатогенной активностью, как отмечено выше, известно из технического решения по патенту RU 2234531. Однако в известном способе, во-первых, предусматривается введение в растение двух генов дельта-эндотоксинов Bt, влияние которых на блокирование питания клопа-вредной черепашки не установлено, а во-вторых, введение различных генов там не увязывается со специфичностью промоторов, обеспечивающих экспрессию соответствующих генов в растении.
Также известно введение в геном растения двух генов с антипатогенной активностью для повышения его устойчивости к нематодам - см. патент RU 2230787 (Зингента Партисипейшнс АГ, опубл. 20.06.2004). В этом способе предложено вводить в растение конструкцию ДНК, кодирующую слитый протеин, включающий, по крайней мере, два протеина, каждый из которых обладает антипатогенной активностью, соединенные пептидным линкером, при этом, по крайней мере, один из протеинов или доменов протеинов с антипатогенной активностью обладает способностью ингибировать протеиназы, в частности, представляет собой Oc-IΔD86 или CpTI. Предпочтительно, кодирующие гены в конструкции ДНК функционально связаны с промотором, обеспечивающим предпочтительную экспрессию продуктов в корнях растений. Данный способ повышения устойчивости растений, однако, не будет эффективным в защите растений пшеницы от поражения клопом-вредной черепашкой, поскольку клоп-черепашка питается в начале своего развития на проводящей ткани листьев и проростков, далее переходя на соцветия и развивающиеся зерновки.
Далее заявленный способ создания растений пшеницы, устойчивых к к клопу-вредной черепашке (Eurygaster integryceps Puton), раскрывается более подробно со ссылками на чертеж. Показан ПЦР-анализ трансформантов мягкой пшеницы (Т. aestivum L.) с праймерами, специфичными к последовательности гена BAR.
Номера дорожек соответствуют:
1 - 20 MWM Leder
2 - Негативный контроль ДНК пшеницы
3-17 - ДНК отселектированных предположительных трансформантов
18 - Позитивной контроль - ДНК трансгенного картофеля
19 - Плазмида pGFPBAR
В таблице 2 приведены культуральные среды использованные для ведения культуры клеток пшеницы.
Индукция каллуса
Осмотическая среда
Регенерационная среда
Среда для укоренения
Пример 1. Индукция каллусообразования
Пример 1.1. Стерилизация материала.
Очищенные зерновки стерилизовали 70% этиловым спиртом в течение 6 минут. Затем промывали стерильной дистиллированной водой 3 раза по 5 минут.
Пример 1.2. Индукция каллусообразования.
Для индукции культуры in vitro соматических клеток пшеницы в качестве экспланта, были использованы незрелые зародыши. Зародыши выделялись на 12-16 день после опыления, размер зародышей варьировал от 0.5 до1.5 мм. Незрелые, неповрежденные зародыши помещали на среду индукции каллусообразования А, щитком вверх. Инкубация на среде индукции каллусообразования проводили в течение 14 дней до образования морфогенетического каллуса. Каллусы культивировали в темноте при 24+/-2°С, и через 2 недели пересаживали на свежую среду А, при этом проводили визуальный отбор морфогенного каллуса.
Пример 2. Биобаллистическая трансформация пшеницы.
Пример 2.1. Предобработка морфогенетического каллуса пшеницы перед обстрелом микроносителями ДНК
Образовавшийся на среде индукции каллусообразования морфогенетический каллус разделяли на сегменты и переносили на осмотическую среду В, содержащую в качестве осмотического агента сахарозу в концентрации 0,4 М. На одну чашку помешаются 50 каллусов размером 2-3 мм, экспланты выкладывали по кругу диаметром 3 см.
Пример 2.2. Стерилизация микроносителей ДНК.
Для бомбардировки используют вольфрамовые микрочастицы M10 (Sylvania Chemical/Metals), размер частиц в смеси варьирует 0,1-7 мкм, наибольшее количество частиц 80% имеет размер 0,4-2 мкм. Стерилизация микрочастиц проводится при помощи этилового спирта. Навеску микрочастиц "M10" весом 50 мг поместить в эппендорф объемом 1,5 мл. Частицы залить 500 мкл 96% спирта, выдерживать в течение 15-30 минут. Эппендорф с частицами поместить в центрифугу "эппендорф 5415" и произвести осаждение частиц при 14000 обор/мин в течение 6-8 минут. Спирт удалить пипеткой, и залить 500 мкл стерильной дистиллированной водой, тщательно ресуспендировать осадок микрочастиц. Открутить на центрифуге "эппендорф 5415" при 14000 обор/мин в течение 6-8 минут. Промывание частиц стерильной дистиллированной водой повторить три раза.
Пример 2.3. Преципитации ДНК на микроносители ДНК.
В эппендорф объемом 750 млк поместить 25 млк смеси частиц с водой, добавить 5 мкл плазмидной ДНК в концентрации 1 мкг/мкл, ресуспендировать. Добавить 25 мкл 2,5 М CaCL2, ресуспендировать. Добавить 10 мкл 0,1М спермидина, ресуспендировать до выпадения смеси частиц в осадок. Эппендорф поместить на лед на 5 минут.Отобрать пипеткой 50 мкл смеси, из надосадка не затронув частицы. Оставшейся преципитационной смеси 15 мкл достаточно на 4-5 выстрелов по 2,5 мкл на выстрел.
Пример 2.4. Параметры биобаллистической трансформации
Использовали «генную пушку» Джона Файнера " PIG (6).
Давление гелия при выстреле равно 6 атмосфер. Объем гелия при выстреле 6 см3. Давление вакуума в камере 30 мм Hg столба. Расстояние от источника частиц (фильтродержатель) до ткани мишени (морфогенетический каллус сахарной свеклы) 12 см. Разбивающая сетка находится на расстоянии 9 см от ткани мишени, сечение ячейки сетки 500 мкм. Каждая чашка Петри с каллусами обстреливается дважды. Расстояние от фильтродержателя до ткани мишени - 12 см. Объем использованного газа при выстреле - 6 см3. Давление Не при выстреле - 6 атм. Положения разбивающей сетки от ткани мишени - 9 см 30 мм Hg столба давление вакуума при выстреле. Баллистическая трансформация каждого экспланта проводится дважды.
Пример 3. Векторы, используемые для трансформации. Наиболее подходящей плазмидой для трансформации пшеницы является плазмида pGFPBAR (7) и ее производные. Плазмида pGFPBAR содержит ген BAR, обусловливающий устойчивость к гербициду фосфинотрицину (РРТ) и маркерный ген GFP, наличие которого позволяет визуально, прижизненно определять транзиентную, а в последующем и конститутивную экспрессию данного гена, что способствует эффективному отбору трансгенных тканей.
Для введения в геном пшеницы инсектицидных генов ген GFP заменяется на нужный ген, например ген лектина ASAL. В векторе pGFPBAR, сконструированном для трансформации злаков, использованы злакоспецифичные промоторы: рисовый Act1 и кукурузный Ubi1, которые обеспечивают высокий уровень конститутивной экспрессии генов BAR и GFP.
Пример 4. Одновременное ведение нескольких генов в пшеницу. Известно, что при биобаллистической трансформации злаков частота котрансформации (одновременного встраивания в геном растения нескольких генов) при использовании смеси различных векторных конструкций, несущих гены, обуславливающие различные признаки, зависит от количества используемых векторных конструкций, и в случае двух различных векторов, используемых в соотношении 1:1, составляет до 100%. При использовании большего числа векторов частота котрансформации уменьшается, но описаны случаи встраивания до 12 генов одновременно (8).
Пример 5. Селекция трансформантов
В опыте в качестве экспланта использовались незрелые зародыши пшеницы трех сортов Лада, Эстер, Мис на 12 день после опыления. Размер зародышей варьировал в пределах 1-1,5 мм. Зародыши изолировались в стерильных условиях и помещались на среду индукции каллусообразования LS с 2 мг/л ауксина 2,4-D, на 14 дней. После баллистической трансформации каллусы оставались на осмотической среде в течение 16 часов. Селекция проводилась по методике М. Uze с соавторами (9).
Эффективность трансформации в зависимости от сорта варьирует от 1,8% у сорта Лада до 2,9% у сорта Мис. Для сорта Эстер показана эффективность трансформации 2,6%. Для подтверждения успешной доставки генетической конструкции в ткань мишень и надежного отбора трансгенных тканей от нетрансгенных определяли транзиетную экспрессию на 2 и 7 день после баллистической трансформации, а затем и трансгенную экспрессию маркерного гена GFP на 21 и 40 день после баллистической трансформации.
Пример 6. Регенерация растений
Для регенерации морфогенетический каллус помещали на регенерационную среду С. Культивирование каллусов на регенерационной среде происходило в течении 2-3 недель, при освещении 5000 lux, с температурным режимом 24+/-2°С. Экспланты, давшие побеги, помещали в пробирки со средой D для укоренения развившихся побегов. Культивирование побегов на среде укоренения D проводилось в течение 4-6 недель до образования мощной корневой системы. Укоренившиеся регенератные проростки пересаживали в перлит во влажную камеру. По мере развития окрепшие растения переносили в почву до полного созревания в теплице. В таблице 2 приведены данные о количестве полученных трансгенных растений по различным вариантам баллистической трансформации.
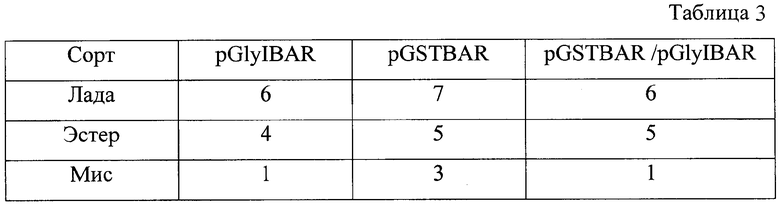
В одном из опытов получено 38 растений, прошедших селекцию на устойчивость к селективному агенту РРТ (фосфинотрицин). Для сорта Мис получено 8 растений. Из них 1 растение, трансформированное плазмидой pGlyIBAR, 3 растения трансформированных плазмидой pGSTBAR, 1 растение трансформировано смесью плазмид. Для сорта Лада получено 19 растений. Из них 6 растений трансформированные плазмидой pGlyIBAR, 7 растений трансформированны плазмидой pGSTBAR, 6 растений трансформированы смесью плазмид. Для сорта Эстер получено 14 растений. Из них 4 растения, трансформированные плазмидой pGlyIBAR, 5 растений, трансформированных плазмидой pGSTBAR, 5 растений, трансформированных смесью плазмид.
Пример 7. Анализ полученных трансгенных растений
Трансгенный статус полученных растений пшеницы был подтвержден с помощью методики ПЦР (полимеразная цепная реакция) анализа (чертеж). После проведения ПЦР анализа был определен, трансгенный статус полученных растений прошедших селективную обработку. Около 60% растений имели сигнал в электрофореграмме, соответствующий анализируемым праймерам. Частота образования эскейпов (растений прошедших селекцию, но не подтвердивших трансгенный статус) составила 40%.
Список использованной литературы
1. Независимая газета, №110, 21.06. 2001 г.
2. Губанов Я.В., Иванов Н.Н. Озимая пшеница. - М.: Колос, 1983, 359 с.
3. S.Bandyopadhyay, A.Roy, S.Das, (2001), Plant Science, 161, (5), 1025-1033, Binding of garlic (Allium sati_um) leaf lectin to the gut receptors of homopteran pests is correlated to its insecticidal activity.
4. Hilder, V.A., Powell, K.S., Gatehouse, A.M.R., Gatehouse, J.A., Gatehouse, L. N., Shi, Y., Hamilton, W. D. O., Merryweather, A., Newell, C.A., Timans, J.C., Peumans, W.J., Van Damme, E. Boulter, D. (1995) Expression of snowdrop lectin in transgenic surfaces of cells lining the gut wall tobacco plants results in added protection against aphids, results).Transgenic Res. 4, 18225.
5. Chen W.P., X.Gu, G.H.Liang, S. Mutthukrishnan, P.D.Chen, D.J.Liu, B.S.Gill. 1998. Introduction and constitutive expression of a rice chitinase gene in bread wheat using biolistic bombardment and the bar gene as a selectable marker. Theor Appi Genet., 97: 1296-1306.
6. Particle inflow gun) (Finer J.J., P.Vain, M.W.Jones, M.D.McMullen. 1992. Development of the particle inflow gun for DNA delivery to the plant cells. Plant Cell Reports, 11:323-328).
7. Richards H.A., V.A.Rudas, H.Sun, J.K.McDaniel, Z.Tomaszewski, B.V.Conger. 2001. Construction of a GFP-Bar plasmid and its use for switchgrass trasformation. Plant Cell Reports, 20:48-54.
8. Chen LL, Marmey P, Taylor NJ, Brizard JP, Espinosa C, Dcruz P, Huet H, Zhang SP, Dekochko A, Beachy RN, Fauquet CM, 1998, Expression and inheritance of multiple transgene in rice plants. Nat. Biotechnol.l6:1060-1064.)
9. M.Uze, I. Potrykus, C. Sautter Theor Appi Genet 1999 №99 pp.487-495. Uze, M., Potrykus, I. and Sautter, C. (1999) Single-stranded DNA in the genetic transformation of wheat (Triticum aestivum L.): transformation frequency and integration pattern. Theor. Appl. Genet. 99, 487-495.
| название | год | авторы | номер документа |
|---|---|---|---|
| БАЛЛИСТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ПОДСОЛНЕЧНИКА (HELIANTHUS ANNUUS L.) | 2001 |
|
RU2193066C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ПШЕНИЦЫ С ИСПОЛЬЗОВАНИЕМ БИОБАЛЛИСТИКИ | 2016 |
|
RU2646108C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ РАСТЕНИЙ САХАРНОЙ СВЕКЛЫ С ИСПОЛЬЗОВАНИЕМ AGROBACTERIUM TUMEFACIENS | 2004 |
|
RU2278162C2 |
| ПОСЛЕДОВАТЕЛЬНОСТИ СИНТЕТИЧЕСКИХ НУКЛЕОТИДОВ, КОДИРУЮЩИХ ИНСЕКТИЦИДНЫЙ КРИСТАЛЛИЧЕСКИЙ БЕЛОК, И ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2820699C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННОГО РАСТЕНИЯ КУКУРУЗЫ | 1991 |
|
RU2114911C1 |
| КОДОН-ОПТИМИЗИРОВАННЫЕ СИНТЕТИЧЕСКИЕ НУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ, КОДИРУЮЩИЕ БЕЛОК Cry2Ai, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2799821C2 |
| СПОСОБЫ ТРАНСФОРМАЦИИ РАСТЕНИЙ ДЛЯ ЭКСПРЕССИИ ДЕЛЬТА-ЭНДОТОКСИНОВ BACILLUS THURINGIENSIS | 1999 |
|
RU2234531C2 |
| ПРОМОТОР ДЛЯ СПЕЦИФИЧЕСКОЙ ЭКСПРЕССИИ ТРАНСГЕНОВ В ЭПИДЕРМИСЕ РАСТЕНИЙ | 2004 |
|
RU2382079C2 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ НА ОСНОВЕ СИСТЕМЫ РЕДАКТИРОВАНИЯ ГЕНОМА CRISPR/CAS9, КОДИРУЮЩАЯ НУКЛЕАЗУ CAS9, ДЛЯ ГЕНОМНОГО РЕДАКТИРОВАНИЯ ОДНОДОЛЬНЫХ ЗЕРНОВЫХ КУЛЬТУР НА ОСНОВЕ ДВОЙНОГО ОТБОРА РАСТЕНИЙ | 2020 |
|
RU2762830C1 |
| ТОЛЕРАНТНОЕ К СТРЕССУ ТРАНСГЕННОЕ РАСТЕНИЕ ПШЕНИЦЫ | 2005 |
|
RU2376377C2 |
Изобретение относится к биотехнологии, в частности к способу получения растения пшеницы, устойчивого к клопу-вредной черепашке (Eurygaster integryceps Puton). Проводят трансформацию клеток растений твердой или мягкой пшеницы, по крайней мере, двумя генами, кодирующими продукты, блокирующие питание клопа-вредной черепашки, где, по крайней мере, один из указанных генов функционально связан с промотором, обеспечивающим конститутивную экспрессию продукта гена в растении, и по крайней мере второй из указанных генов функционально связан с промотором, обеспечивающим тканеспецифичную экспрессию продукта гена в растении. Регенерируют растение пшеницы из указанных трансформированных клеток. Изобретение позволяет повысить устойчивость растений пшеницы к клопу-вредной черепашке, и, тем самым, получить высококачественное зерно и сохранить урожаи. 4 з.п.ф-лы, 1 ил., 3 табл.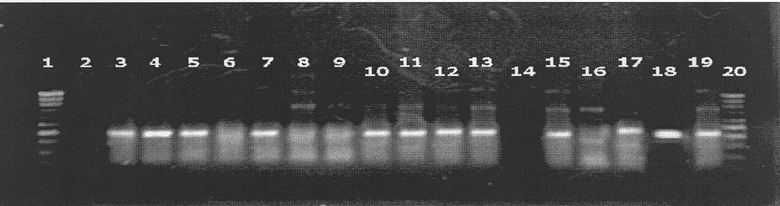
(а) генетической трансформации клеток растений твердой или мягкой пшеницы, по крайней мере, двумя генами, кодирующими продукты, блокирующие питание клопа-вредной черепашки за счет ресурсов растения, причем, по крайней мере, один из указанных генов функционально связан с промотором, обеспечивающим конститутивную экспрессию продукта гена в растении, и, по крайней мере, второй из указанных генов функционально связан с промотором, обеспечивающим тканеспецифичную экспрессию продукта гена в растении, и
(б) регенерации растений пшеницы из указанных трансформированных клеток.
| НОВЫЕ ПЕСТИЦИДНЫЕ ПРОТЕИНЫ И ШТАММЫ | 1995 |
|
RU2196824C2 |
Авторы
Даты
2006-06-10—Публикация
2004-12-30—Подача