Изобретение относится к области биотехнологии и касается способа получения вирусных антигенов гепатита В в дрожжах Saccharomyces cerevisiae. Поверхностные антигены вируса гепатита В человека могут быть использованы для создания высокоэффективных рекомбинантных вакцин и диагностикумов.
Многие из известных способов получения поверхностных антигенов вируса гепатита В человека основаны на использовании рекомбинантных штаммов дрожжей. Использование дрожжей обусловлено тем, что в них происходит сборка 22-мкм частиц, состоящих из иммунологически активного белка. Эти частицы аналогичны 22-мкм частицам, обнаруживаемым в плазме людей - носителей вируса гепатита В (HBV).
Повышение синтеза поверхностных антигенов вируса гепатита В человека в дрожжах обеспечивается за счет использования рекомбинантных плазмид с более эффективными элементами регуляции (регулирующих промоторов, терминаторов транскрипции), а также зависит от выбора штамма-реципиента плазмид.
Известно использование ряда рекомбинантных плазмид дрожжей, определяющих синтез поверхностных антигенов HBsAg6 HBpreSlAg и HBpreS2Ag5.
Pyk1-6, GAP1-6 и др., ЕР 0164556, кл. C 12 N 15/00, 1985;
pHBSGAP 347/33T и pHBpreSGAP 347/33Т, ЕР 0174444, 1986;
pYGAP/pSSA, pYGAP/PSSC, pYGAL/PSSA6 pYGAL/PSSC, pYADH2/PSSA и pYADH/PSSC, EP 0244924, 1987;
pGG6, pGG61/Tn-1 и pGG63, EP 0248410, 1987;
pHBpreSGAP 347/19T и pYGpreS2S1, EP 0312159, 1989;
pTB05A и pHB6, EP 0339567, 1989 и ЕР 341746, 1989;
pPHO P31-R, pPHO P31-W, pGLD P31-R и pPKT P31-R, ЕР 0401941, 1990;
а также
pYeHBS, GB 2104902, 1983; pRIT10673 и pRIT10674, AU-B-16750/83,1983;
рАН201, рАН203 и pAH205, SU 1387878, 1988.
Недостатком использования этих плазмид является невысокий уровень биосинтеза поверхностных антигенов HBV.
Ближайший аналог изобретения охарактеризован в заявке на Европейский патент 0164556, кл. С 12 N 15/00, 1985, и относится к плазмиде PYK 5, содержащей ауксотрофный дрожжевой маркер leu2 ori 2- мкм плазмиды дрожжей Saccharomyces cerevisiae, ген устойчивости к ампициллину, ген S поверхностного белка вируса гепатита В человека, экспрессия которого регулируется гибридным GAL 1-10-PYK-промотором и терминатором транскрипции ADH1.
Основным недостатком данной системы экспрессии поверхностного белка вируса гепатита В в дрожжах сахаромицетах (в частности, S.calstergensis 2150-2-3) является необходимость использования штаммов, мутантных по гену leu2 и, следовательно, минимальных синтетических сред для поддержания рекомбинантной плазмиды PYK 5 в соответствующем штамме. Штаммы - продуценты поверхностных антигенов вируса гепатита В в таких средах растут медленнее, и выход клеточной биомассы и целевого белка бывает невысоким. Максимальный выход иммунологически активного белка HBsAg при использовании плазмиды PYK 5 составляет 1,4 мг/г растворимого клеточного белка, а максимальный выход в этой системе с применением других промоторов достигает 2,1 мг/г.
Технический результат изобретения заключается в увеличении выхода поверхностного антигена (HBsAg) вируса гепатита В человека в дрожжах S.cerevisiae.
Реализация технического результата достигается при использовании новой рекомбинантной плазмиды pFS19, определяющей синтез поверхностного антигена HBV и нового штамма Saccharomyces cerevisiae FH4C/pFS19, обеспечивающего уровень экспрессии 40 - 80 мг белка поверхностного антигена на 1 л культуры (0,4 - 0,8% иммунологически активного белка по отношению ко всему растворимому клеточному белку).
Рекомбинантная плазмида pFS19, определяющая синтез поверхностного антигена вируса гепатита В, характеризуется следующими признаками:
имеет размер 10,4 т.п.о.,
состоит из:
Kpn 1-Хbа I, -фрагмента плазмиды pTZ19R, величиной 2,9 т.п.о., содержащего ген устойчивости к ампициллину и ori E.coli;
Xba I-BamH 1 фрагмента ДНК С.maltosa величиной 3,6 т.п.о., содержащего ген устойчивости к формальдегиду FOR-R (доминантный селективный маркер);
Есо147 I-Hind III фрагмента величиной 2,16 т.п.о., содержащего активатор транскрипции GAL 1-10, промотор гена пируваткиназы PYK I, ген S поверхностного антигена HBV человека, терминатор транскрипции гена фосфоглицераткиназы PGK 1;
Hind III-Есо91 1 фрагмента ДНК 2 мкм плазмиды дрожжей величиной 1,74 т. п.о., содержащего ori;
имеет уникальные сайты узнавания рестриктазами DamH I, Bgl II, Sal I.
На фиг.1 приведена схема клонирования гена устойчивости к формальдегиду FOR-R.
На фиг.2, 3 - нуклеотидная последовательность гена FOR-R.
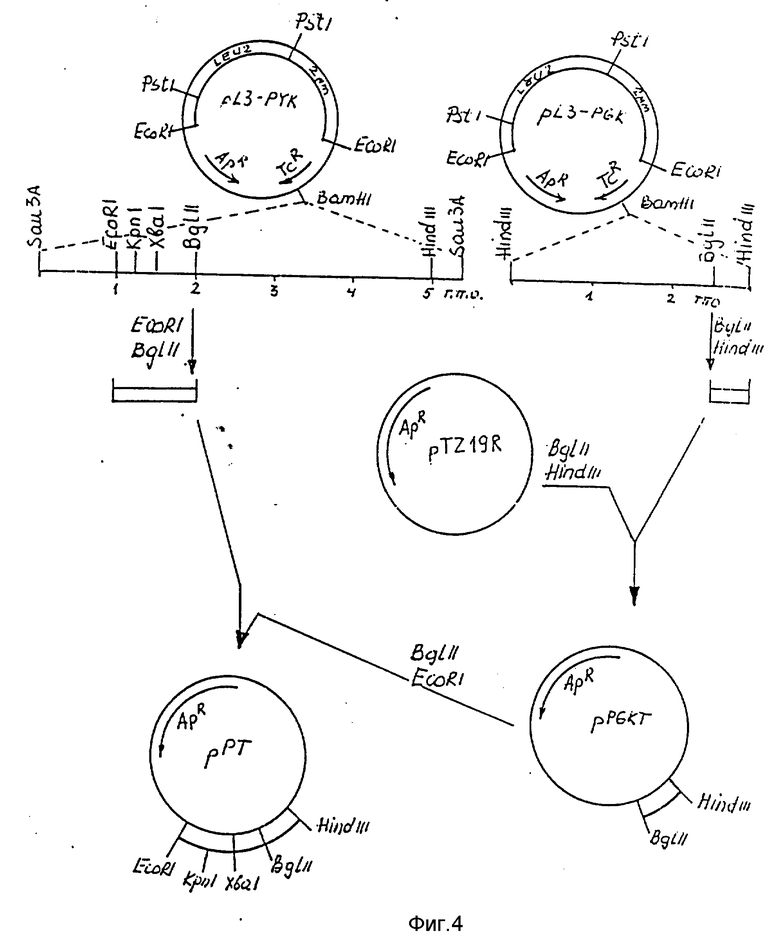
На фиг. 4 - схема получения плазмиды рРТ, содержащей промотор PYK I и терминатор транскрипции гена PGK 1.
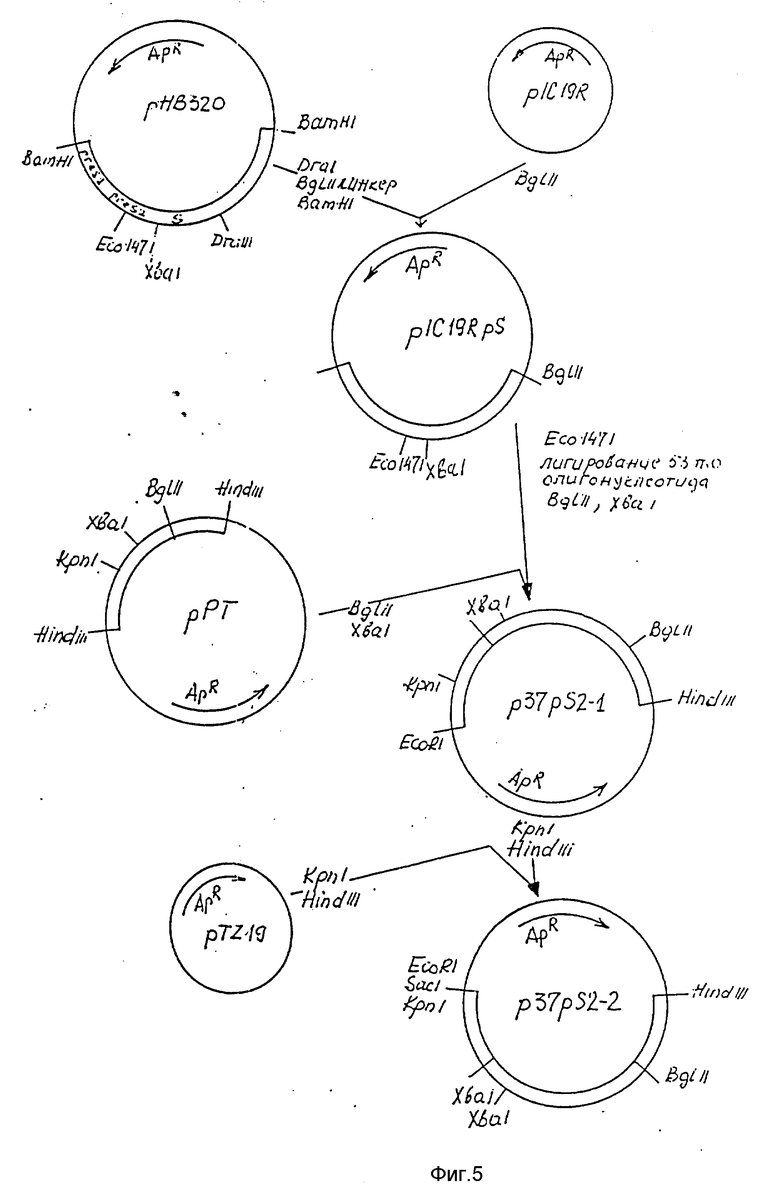
На фиг.5 - схема получения плазмиды p37pS2-2.
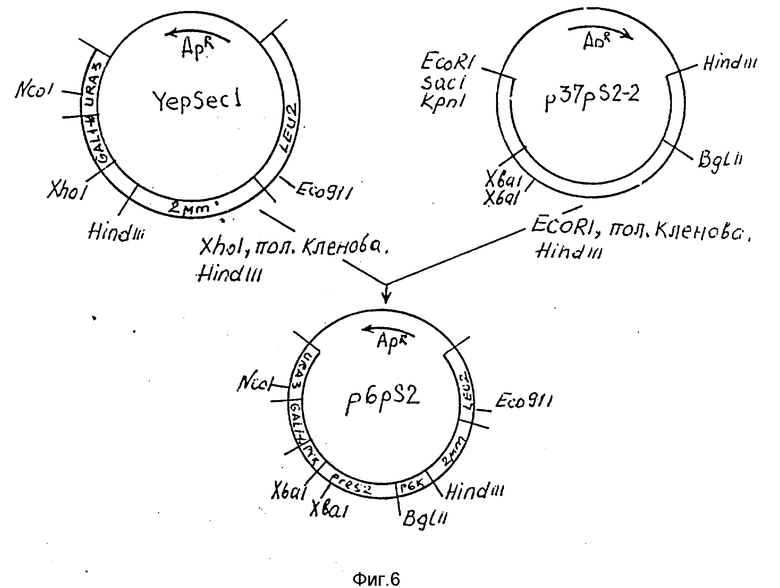
На фиг.6 схема получения плазмиды p6pS2.
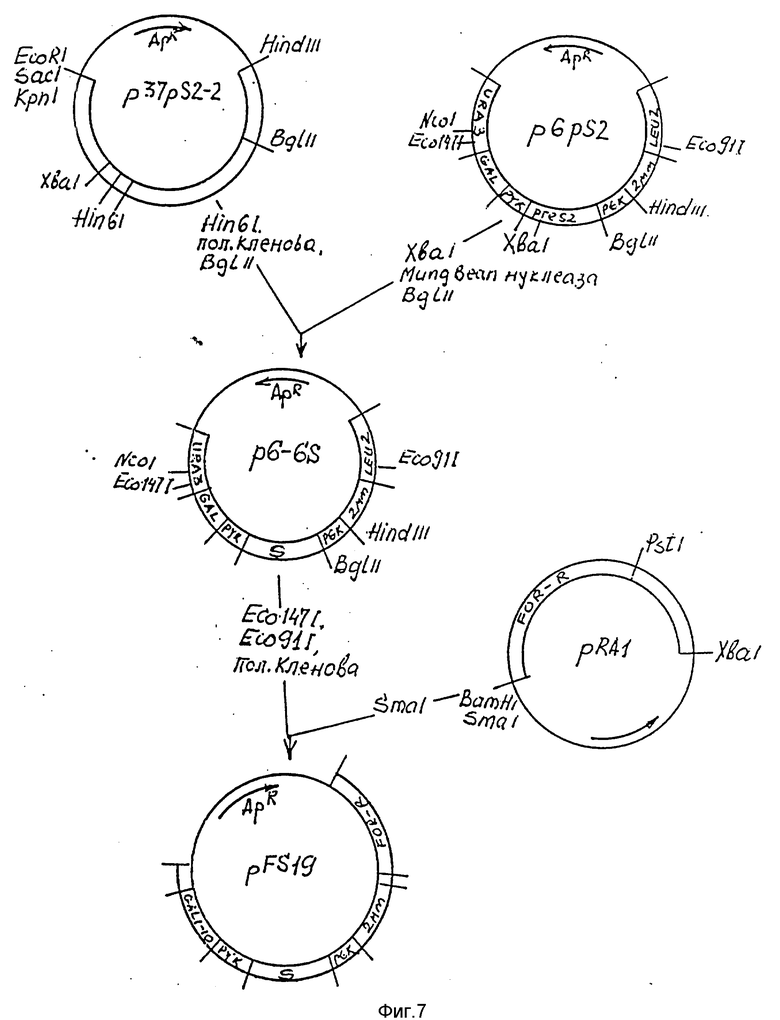
На фиг.7 - схема получения плазмиды pFS19.
Основной принцип конструирования плазмиды pFS19 состоит в объединении в одной плазмиде гена устойчивости к формальдегиду FOR-R в качестве доминантного селективного маркера, гена S, экспрессия которого регулируется гибридным индуцируемым галактозой промотором GAL1-10 - PYK I и терминатором транскрипции PGK 1, фрагмента ДНК 2 мкм плазмиды дрожжей, содержащего ori, гена устойчивости к ампициллину и ori E.coli. При этом клонирование доминантного селективного маркера FOR-R включает получение библиотеки генов Candida maltosa в бифункциональном дрожжевом векторе, последующую трансформацию Saccharomyces cerevisiae и отбор по ауксотрофному маркеру leu 2; отбор трансформантов, способных расти на среде с формальдегидом; выделение плазмид из трансформантов, устойчивых к формальдегиду и содержащих ген FOR-R; субклонирование и секвенирование гена FOR-R.
Основными этапами конструирования продуцента поверхностного антигена являются следующие.
1. Клонирование доминантного селективного маркера FOR-R гена устойчивости к формальдегиду.
2. Клонирование генов PGK 1 (фосфоглицераткиназы) и PYK I (пируваткиназы).
3. Конструирование кассеты экспрессии, состоящей из промотора PYK I и терминатора транскрипции PGK 1.
4. Конструирование плазмиды, экспрессирующей поверхностный антиген вируса гепатита В человека.
5. Поиск штаммов Saccharomyces cerevisiae c пониженной протеолитической активностью и сверхпродукцией поверхностного антигена вируса гепатита В человека.
Получение нового штамма - продуцента поверхностного антигена S вируса В человека основано на трансформации плазмидой pFS19 полиплоидного штамма дрожжей S. cerevisiae дикого типа с пониженной протеолитической активностью по маркеру FOR-R и последующем отборе наилучшего продуцента поверхностного антигена S HBV человека.
Штамм Saccharomyces cerevisiae FH4C/pGS19 ВКПМ У 1831, продуцирующий поверхностный антиген S HBV, характеризуется следующими признаками.
Морфологические признаки. Клетки овальной формы.
Культуральные признаки. Клетки хорошо растут на YEPD (2% пептона, 2% глюкозы, 1% дрожжевого экстракта, 2% агара). При росте на твердых средах - гладкие, белые колонии, которые при хранении становятся шероховатыми. Хорошо растут в жидких средах YEPD (2% пептона, 2% глюкозы, 1% дрожжевого экстракта).
Физиолого-биологические признаки. Клетки растут при температуре от 10 до 37oC при оптимуме pH от 5,0 до 6,0.
В качестве источника углерода штамм усваивает глюкозу, галактозу.
В качестве источника азота - соли аммония, пептон, триптон.
Не усваивает лактозу, целлобиозу, лимонную кислоту, о-ксилозу, L-арабинозу, D-рибозу, L-рамнозу.
Обладает устойчивостью к формальдегиду до 10 мМ.
Протеолитическая активность пониженная.
Пример 1.
Клонирование доминантного селективного маркера FOR-R
Дрожжи Candida maltosa выращивают до поздней логарифмической фазы в среде YEPD (1% дрожжевого экстракта, 2% глюкозы) и из клеток выделяют хромосомную ДНК. Хромосомную ДНК частично расщепляют рестриктазой Sau3A и полученные фрагменты лигируют с плазмидой pL3, расщепленной рестриктазой BamHI и обработанной щелочной фосфатазой. Лигированную ДНК используют для трансформации компетентных клеток штамма HB101 E.coli. Суммарную рекомбинантную ДНК выделяют из клеток E.coli и полученной библиотекой генов С.maltosa трансформируют S.cerevisiae DBY736 (his3 leu2 trp1 ura3). После трансформации клетки высевают на минимальную среду, содержащую по 50 мкг/мл гистидина, урацила и триптофана. Трансформанты, отобранные по фенотипу Leu+ методом реплик переносят на полную среду YEPD с 3-10 мМ формальдегида. Отбирают трансформанты, растущие на среде с 3-10 мМ формальдегида. При анализе плазмид, выделенных из дрожжевых трансформантов и ретрансформированных в E.coli, обнаруживают, что все плазмиды содержат общий участок ДНК Candida maltosa. Путем дальнейшего субклонирования выделяют Xbal-BamHI фрагмент ДНК С.maltosa величиной 3,6 т. п. о. , кодирующей ген устойчивости к формальдегиду FOR-R (плазмида pRA1, фиг.1). Xbal-BamHI фрагмент секвенируют и выявляют одну протяженную открытую рамку считывания, содержащую интрон и кодирующую белок из 380 аминокислот (фиг. 2, 3). Ген FOR-R, клонированный на многокопийных плазмидах, содержащих ori 2 мкм ДНК, определяет устойчивость к формальдегиду в концентрациях 3-10 мМ и позволяет трансформировать штаммы S.cerevisiae дикого типа.
Пример 2.
Клонирование генов PGK 1 и PYK I
С целью клонирования генов PYK I (пируваткиназы) и PGK 1 (фосфоглицераткиназы) библиотекой генов S.cerevisiae, созданной на основе плазмиды pL3, трансформируют штаммы S.cerevisiae DFY331 (leu2 pgkI) и Pyk 1-5 (adeI leui metI4 ura 3 pykI-5) и высевают на синтетическую среду без лейцина, содержащую глюкозу в качестве источника углерода. Штаммы, мутантные по генам PYK I и PGK 1, не способны расти на среде с глюкозой. Из выросших трансформантов выделяют плазмидные ДНК и при дальнейшем субклонировании изолируют гены PYK I и PGK 1 (фиг.3 плазмиды pL3-PYK и pL3-PGK).
Пример 3.
Конструирование кассеты экспрессии, состоящей из промотора PYK I и терминатора транскрипции PGK 1
Клонированные гены PGK 1 и PYK I используют в качестве источника регуляторных элементов для конструирования вектора экспрессии. Плазмиду pL3-PGK расщепляют рестриктазами BglII и HindIII. Выделенный BglII-HindIII фрагмент величиной 0,38 т.п.о., содержащий терминатор транскрипции гена PGK 1, лигируют с плазмидой pIC19R (March et al., Gene, 1984, т.32, с. 481 - 485), расщепленной рестриктазами BglII и HindIII. Полученную плазмиду обозначают pPGKT. Плазмиду pL3-PYK расщепляют рестриктазами EcoRI и BglII, выделяют фрагмент величиной 1,0 т.п.о., содержащий промотор гена PYK I и часть кодирующей последовательности, и лигируют с плазмидой pPGKT, расщепленной рестриктазами EcoRI и BglII. Полученную плазмиду обозначают рРТ (фиг.4). Плазмида рРТ содержит кассету экспрессии, состоящую из промотора гена PYK I (EcoRI-XbaI) и терминатора транскрипции гена PGK 1 (BglII-HindIII).
Пример 4.
Конструирование плазмиды pFS19
50 мкг плазмиды pHВ320 (Пунпен и др. DAH СССР, 1983, т. 271, с. 230 - 235) расщепляют рестриктазой DraI (100 ед. ) в 200 мкл буфера В (10 мМ трис-HCl, 10 мМ MgCl2, 1 мM DTT; pH 7,5) в течение 2 ч при 37oC, после чего рестриктазу инактивируют нагреванием при 70oC в течение 20 мин ДНК осаждают добавлением 20 объемов этанола, центрифугируют 3 мин при 1500 об/мин, затем ДНК растворяют в 200 мкл буфера для лигирования (50 мМ трис-HCl, 10 мМ MgCI, I мМ DTT; pH 7,5), добавляют аденозинтрифосфат (ATP), 0,01 оптических единиц (OE)BglII-линкepов и 50 ед. ДНК лигазы Т4; лигируют 16 ч при 12oC.
Полученную смесь осаждают этанолом, растворяют в 200 мкл буфера О (50 мМ трис-HCI, 10 мМ MgCI, 100 мМ NaCl, I мМ DTT; pH 7,5) и обрабатывают рестриктазами BamH I (50 ед.) и Bgl II (100 ед.) в течение 2 ч при 37oC.
После электрофореза в 1% агарозном геле выделяют BamH I-Bgl II фрагмент величиной 1,68 т. п. о. и лигируют с 3 мкг плазмиды pIC19R, расщепленной рестриктазой Bgl II в буфере для лигирования.
Смесью ДНК после лигирования трансформируют компетентные клетки штамма HB101 E. coli, смесь инкубируют 1 ч при 0oC и 5 мин при 42oC. После 10-кратного разбавления бульоном LB (1% пептона, 0,5% дрожжевого экстракта, 1% NaCl) трансформированные клетки подращивают 1 ч при 37oC и высевают на агаризованную среду LB с ампициллином (100 мкг/л). Среди трансформантов с помощью рестрикционного картирования отбирают клоны, содержащие плазмиду pIC19RS. 50 мкг плазмиды pIC19RS расщепляют рестриктазой Есо147 I (100 ед.) в 200 мкл буфера В в течение 2 ч при 37oC. Полученную смесь обрабатывают смесью фенол-хлороформ (1: 1), центрифугируют, ДНК переосаждают этанолом, растворяют в 200 мкл буфера для лигирования с АТР, добавляют 0,1 опт.ед. синтетического олигонуклеотида размером 53 п. о., содержащего 5'-последовательность гена preS2: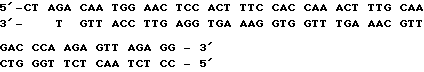 ,
,
и лигируют 16 ч при 12oC. Смесь после лигирования прогревают 20 мин при 70oC, ДНК переосаждают этанолом, растворяют в 200 мкл буфера О, добавляют 100 ед. рестриктазы Bgl II и 200 ед. рестриктазы Xba I и инкубируют 2 ч при 37oC.
После фракционирования данной смеси в 1% агарозном геле выделяют Xba I-BglII-фрагмент величиной 0,85 т.п.о., который лигируют с 3 мкг плазмиды рР-Т, расщепленной рестриктазами Xba I и Bgl II.
Полученной после лигирования смесью трансформируют компетентные клетки штамма HB101 E. coli и высевают на среду LB с ампициллином. Среди клонов отбирают содержащие плазмиду p37-pS2-1.
50 мкг плазмиды p37-pS2-1 растворяют в 200 мкл буфера G (10 мМ трис-НCl, 10 мМ MgCl, 50 мМ NaCl, 1 мМ DTT; pH 7,5), добавляют 100 ед. рестриктазы Kpn 1 и 100 ед. рестриктазы Hind III и инкубируют 2 ч при 37oC. Полученную смесь фракционируют в 1% агарозном геле и выделяют Kpn I-Hind III фрагмент величиной 1,5 т.п.о., который лигируют с 3 мкг плазмиды pTZ19R (Pharmacia, Швеция), расщепленной рестриктазами Kpn 1 и Hind III.
Полученной смесью трансформируют компетентные клетки штамма DH 5а E.coli и высевают на среду LB с ампициллином. Среди трансформантов отбирают клоны, несущие плазмиду p37-pS2-2 (фиг.5).
50 мкг плазмиды p37-pS2-2 растворяют в 200 мкл буфера R (10 мМ трис-HCl, 10 мМ MgCl2 100 мМ NaCl, 1 мМ DTT; pH 8,5), добавляют 100 ед. рестриктазы EcoRI и инкубируют 2 ч при 37oC. ДНК переосаждают этанолом и растворяют в 200 мкл буфера для фрагмента Кленова (50 мМ трис-НCl, 6 мМ MgCl2, 1 мМ меркаптоэтанола; pH 7,6), добавляют дезоксинуклеозидтрифосфаты до концентрации 0,1 мМ, 3 ед. ДНК полимеразы I фрагмента Кленова и инкубируют 30 мин при 20oC. Смесь затем прогревают 20 мин при 70oC, ДНК переосаждают этанолом, растворяют в 200 мкл буфера R, добавляют 100 ед. рестриктазы Hind III и инкубируют 2 ч при 37oC.
Полученную смесь фракционируют в агарозном геле и выделяют EcoRI-HindIII фрагмент величиной 1,51 т.п.о., который лигируют с 3 мкг плазмиды YepSecl (Baldari et al., EMBO J., 1987, т. 6, с. 229 - 234), расщепленной рестриктазами HindIII и XhoI и обработанной фрагментом Кленова.
Полученной смесью трансформируют штамм HB101 E.coli. Среди трансформантов отбирают клоны, содержащие плазмиду, которую обозначают p6pS2.
50 мкг плазмиды p37pS2-2 растворяют в 200 мкл буфера R, добавляют 100 ед. рестриктазы Hind I, инкубируют 2 ч при 7oC.
ДНК переосаждают этанолом, растворяют в 200 мкл буфера для фрагмента Кленова, добавляют дезоксинуклеозидтрифосфаты, 3 ед. ДНК полимеразы фрагмента Кленова и инкубируют фрагмент прогреванием при 70oC в течение 20 мин.
ДНК переосаждают этанолом, растворяют в 200 мкл буфера О, добавляют 100 ед. рестриктазы BglII и инкубируют 2 ч. при 37oC.
После электрофореза в 1% агарозном геле выделяют фрагмент величиной 0,68 т. п. о. , который лигируют с 3 мкг плазмиды p6pS2, последовательно обработанной рестриктазой Xba I, нуклеазой Mung Bean и рестриктазой Bgl II; полученную плазмиду обозначают p6-6S.
50 мкг плазмиды p6-6S растворяют в 200 мкл буфера Y (33 мМ трис- ацетата, 10 мМ ацетата магния, 66 мМ ацетата калия, 0,5 мМ DTT; pH 7,9), добавляют по 100 ед. рестриктаз Есо147 I и Есо91 I и инкубируют 2 ч при 37oC.
ДНК переосаждают этанолом, растворяют в 200 мкл буфера для фрагмента Кленова, добавляют нуклеозидтрифосфаты (NTR), 3 ед. фрагмента Кленова и инкубируют 30 мин при 20oC.
После электрофореза выделяют Есо147 I-Есо91 I фрагмент величиной 3,9 т. п. о. и лигируют его с 3 мкг плазмиды pRA1, расщепленной рестриктазой SmaI. Полученной смесью трансформируют компетентные клетки штамма НВ101 E.coli и высевают на среду LB с ампициллином. Среди трансформантов отбирают клоны, содержащие плазмиду pFS19 (фиг.6).
При расщеплении плазмиды pFS19 рестриктазой EcoRI получают фрагменты величиной 4,9 т.п.о. и 5,5 т.п.о. При расщеплении рестриктазами BglII и BamHI - фрагменты величиной 1,8 т.п.о. и 8,6 т.п.о., а при расщеплении рестриктазой Psti - 0,5 т.п.о., 2,2 т.п.о. и 7,7 т.п.о.
Анализ плазмиды проводят следующим образом.
1. Наличие маркера устойчивости к ампициллину подтверждается устойчивостью штаммов E.coli, трансформированных данной плазмидой, к ампициллину в агаризованной среде в концентрации 50 - 100 мкг/мл.
2. Наличие маркера устойчивости к формальдегиду, FOR-R, подтверждается устойчивостью штаммов S.cerevisiae, трансформированных данной плазмидой, к формальдегиду в концентрации 3 - 10 мМ.
3. Способность плазмиды pFS19 определять синтез поверхностного антигена S вируса гепатита В человека подтверждается проверкой клонов штамма FH4C S. cerevisiae, трансформированных данной плазмидой и устойчивых к формальдегиду, радиоиммунологическим методом на продукцию поверхностного антигена S HBV.
Результаты исследований приведены при описании соответствующего штамма.
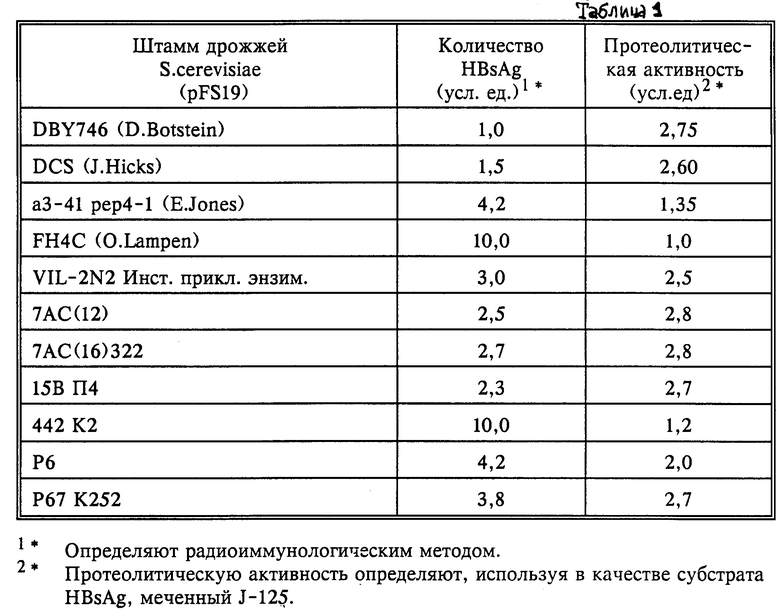
Для разработки систем с увеличенной продукцией поверхностного антигена HBV (HBsAg) проверяют большое количество штаммов-реципиентов дикого типа дрожжей S.cerevisiae. Оказывается, что лучшей продуктивностью обладают быстро растущие, полиплоидные штаммы с пониженной протеолитической активностью (табл.1). Для дальнейшей работы выбирают штамм FH4C.
Пример 5.
Получение штамма S. cerevisiae FH4C/pFS19 ВКПМ Y1831 и определение его продуктивности
Плазмидой pFS19 трансформируют клетки штамма S.cerevisiae FH4C, как описано в работе (Ito et al., J.Bacteriol., 1983, т. 153, с. 163 - 168).
Клетки S.cerevisiae FH4C/pFS19 выращивают при 30oC в 100 мл YEPD в течение 24 ч на качалке при 200 об/мин, добавляют галактозу до концентрации 4% и продолжают процесс 8 - 12 ч. После 8 - 12 ч отбирают пробу.
1 мл культуры клеток центрифугируют 10 мин при 3000 об/мин, суспендируют в 1 мл буфера (0,05 M Na-фосфатный буфер, содержащий 0,05% Тритон X-100, pH 7,2), добавляют 1 г стеклянных шариков диаметром 0,5 мм, затем охлаждают на льду и центрифугируют 10 мин при 3000 об/мин.
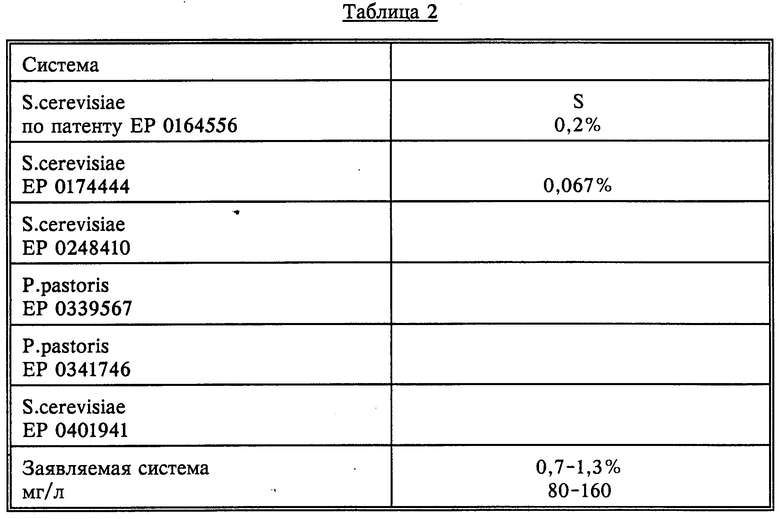
Содержание поверхностного антигена S вируса гепатита В определяют радиоиммунологическим методом, используя наборы для определения HBsAg, а в качестве стандартов для калибровочной кривой - препараты, полученные из Института медицинского контроля (г. Москва). Данные приведены в табл.2.
Из табл. 2 видно, что заявляемая система по выходу поверхностного антигена вируса гепатита В человека в процентах по отношению к общему клеточному белку превосходит известные аналоги примерно в 20 раз, а по выходу в расчете на 1 л культуры - примерно в 100 раз. По продуктивности синтеза заявляемая система находится на том же уровне (лишь несколько повышенном), что и наиболее эффективная из известных в настоящее время систем P.pastoris. Однако система на основе S.cerevisiae является более разработанной и привычной для крупномасштабного производственного культивирования. Дрожжи S.cerevisiae относятся к организмам, прошедшим все медицинские тесты на токсичность, и являются апробированным продуцентом гетерологичных белков для медицинских целей.
Повышение выхода антигена в заявляемой системе достигается за счет использования индуцируемого гибридного промотора GAL 1-10-PYK l, терминатора транскрипции PGK 1 и доминантного селективного маркера FOR-R, позволяющего вести отбор штаммов S.cerevisiae дикого типа с повышенной продуктивностью антигена. Применение доминантного селективного маркера FOR-R позволяет использовать богатые полные дешевые среды для культивирования продуцентов антигенных белков гепатита В человека, что является важным преимуществом при крупномасштабном культивировании.
При использовании полных сред повышается выход биомассы в расчете на тот же объем культуральной жидкости, а также сокращается время ферментации вследствие уменьшения времени генерации дрожжевых клеток.
Поскольку штамм FH4C обладает пониженной протеолитической активностью, то уменьшается деградация гетерологичных белков, что облегчает очистку нативных поверхностных антигенов вируса гепатита В человека. Использование доминантного селективного маркера позволяет легко осуществлять скрининг большого количества штаммов дикого типа с целью отбора штаммов, обладающих повышенной продуктивностью гетерологичных белков.


Изобретение обеспечивает получение поверхностного антигена вируса гепатита В в дрожжах Saccharomycеs cerevisial. Для этого конструируют рекомбинантную плазмиду pFS19, объединения в ней ген устойчивости к формальдегиду FOR-R в качестве доминантного селективного маркера и ген S поверхностного антигена вируса гипатита В, экспрессия которых регулируется гибридным промотором GAL 1-10-PYKI и терминатором транскрипции PGKI, с фрагментом ДНК 2-мкм плазмиды дрожжей, содержащей ori, и геном устойчивости к ампициллину с ori E. coli. При трансформации полученной плазмидой дрожжей S.cerevisial уровень экспрессии поверхностного антигена составляет 50 - 160 мг на 1 л культуральной среды. 2 табл., 7 ил.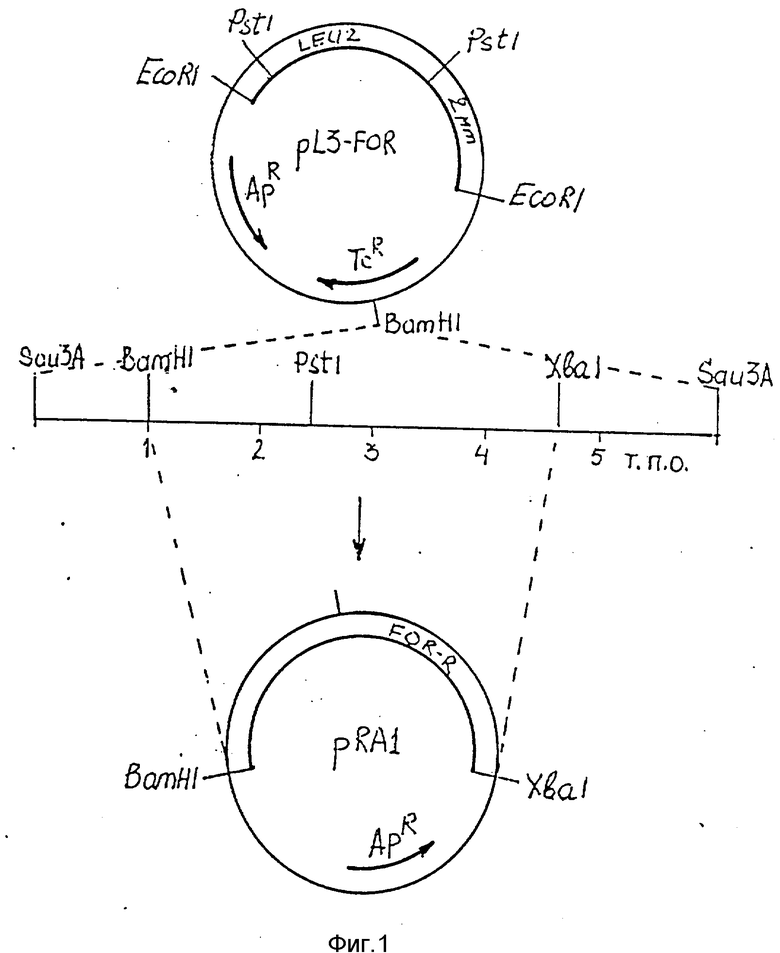
Рекомбинантная плазмида pFS 19, определяющая синтез поверхностного антигена S вируса гепатита В человека, размером 10,4 т.п.о., состоящая из следующих фрагментов: Kpnl-Xbal фрагмента плазмиды pT Z19R величиной 2,9 т. п. о. , содержащего ген устойчивости к ампициллину и ori Escherichia coli; Xbal-BamHl фрагмента ДНК Candida maltosa величиной 3,6 т.п.о., содержащего ген устойчивости к формальдегиду FOR-R (доминантный селективный маркер); Eco147I-HindIII фрагмента величиной 2,16 т.п.о., содержащего активатор транскрипции GAL 1-10, промотор гена пируваткиназы PYKI, ген S поверхностного антигена вируса гепатита В человека, терминатор транскрипции гена фосфоглицераткиназы PGK1; HindIII-Eco 911 фрагмента ДНК 2-мкм плазмиды дрожжей величиной 1,74 т.п.о., содержащего последовательность ori.
| EP, заявка, 0164556, C 12 N 15/00, 1985. |
Авторы
Даты
1998-07-20—Публикация
1992-03-03—Подача