Изобретение относится к оценке целевых компонентов в образцах проб, в частности, к обнаружению и/или количественной оценке целевых клеток, частиц или организмов (именуемых далее "мишенями") в биологических пробах путем одновременного модифицированного удельного веса и окрашивания или мечения мишеней.
В патенте США N 4181609, 1980, раскрывается техника анализа крови, где плотность определенных клеток крови ретикулоцитов повышали так, чтобы в центрифугированной пробе крови между клетками образовалась четкая поверхность раздела. Таким образом, изменение приводного удельного веса ретикулоцитов позволило усовершенствовать анализ крови. В патенте США N 4332785, 1982, раскрывается конкретный способ мечения ретикулоцитов с помощью флуоресцентных антител, который использовали в количественном анализе ретикулоцитов в пробе крови; в патенте США N 3591570 1986, раскрывается использование различных антител, наносимых пятнами на носитель для захвата множества различных антигенов в процедуре иммуноанализа.
Публикация "Physical structure to therapeutic application, North Holland Biomedical Press, 1981, 66 - 82, в которой раскрывается способ анализа биологической жидкости, включающий получение липосомных везикул, имеющих по меньшей мере один тип антител, связанных с внешней поверхностью везикул, специфичных к поверхностному антигену компонента мишени, а также маркерный материал, включенный в везикулу, является ближайшим аналогом заявленного способа.
Однако в предшествующих работах не раскрывается общая процедура, которая включала бы изменение удельного веса различных компонентов испытуемых образцов в целях объединения модифицированных компонентов в центрифугированном исследуемом образце и в целях мечения компонентов так, чтобы их можно было легко идентифицировать.
Изобретение относится к усовершенствованному анализу целевых компонентов испытуемых образцов, который включает в себя избирательное связывание заметно различающихся липосом с соответствующими целевыми компонентами пробы. Указанные липосомы связываются с компонентами образца с помощью антител, прикрепленных к поверхности липосом. Такие антитела могут представлять собой по крайней мере одно антитело, специфичное к поверхности антигена, о котором известно, что он присутствует на целевом компоненте пробы. Различные антитела могут конкурентно связываться с поверхностью одной липосомы, поэтому указанный анализ может быть специфичным для каждой из множества различных мишеней. Дифференцировка липосом обеспечивается легко обнаружимым визуально или с помощью приборов маркером, инкапсулированным во внутрь липосом, либо введенным в фосфолипидный бислой. Таким обнаружимым маркером может быть визуально различаемый краситель; краситель, легко различимый прибором; радиоактивный источник излучения и т.п.
Липосомы представляют собой микроскопические, сферические искусственные структуры, состоящие преимущественно из фосфолипидов. Липосома может состоять из одной или нескольких пластинчатых фосфолипидных везикул, образующих закрытую сферическую оболочку, которая может быть загружена или заполнена таким материалом, как жидкость и т.п. Поскольку липосомы имеют размер 150 - 250 нм, а средняя толщина липидной мембраны составляет 2,5 нм, то очевидно, что плотность липосомы определяется главным образом плотностью инкапсулированного вещества, то есть красителя или индикатора, и буфера или среды-носителя. Способы получения и использования липосом раскрываются в работе Джеймса О' Коннела (James O' Connell Liposomes: Diagnostic and Terapeutic Application, dec. 1988, Medical Device and Diagnostic inductry, pp. 31 - 36).
Изобретение относится к использованию специально изготовленных липосом в целях выделения и цветового выявления различных компонентов пробного образца. Эти липосомы могут быть наполнены или нагружены маркирующим или осветляющим материалом, таким как жидкость, содержащая краситель, который может быть обнаружен визуально или прибором; либо каким-либо другим обнаружимым компонентом. Указанный наполнитель имеет заранее определенный удельный вес, который будет определять удельный вес липосом. Внешняя поверхность липосом будет, кроме того, связывать одно или несколько различных антител, специфичных к различным поверхностным антигенам, присутствующим на различных мишенях в различных испытуемых образцах. Так, например, липосомы могут быть наполнены флуоресцентной жидкостью, имеющей удельный вес 1,5, и, кроме того, могут быть связаны с антителами A, B, C и D, которые являются специфичными к поверхностным антигенам a, b, c и d. При этом известно, что указанные поверхностные антигены присутствуют на одной или нескольких мишенях в различных пробных образцах, подвергаемых либо количественному, либо качественному анализу. Таким образом, для анализа нескольких различных образцов может быть использован простой анализ среды, проводимый способом, описанным ниже в качестве примера. Для одновременного анализа вышеуказанных поверхностных антигенов a - d могут быть также использованы различные липосомы A - D, каждая из которых имеет свою собственную плотность. На основании вышеуказанного следует подчеркнуть, что изобретение может быть широко использовано в медицине, в процедурах диагностики и/или количественного анализа. Для проведения указанных процедур необходимо только знать удельный вес исследуемого компонента и какие поверхностные антигены присутствуют. В том случае если указанные факторы известны, могут быть получены липосомы для мечения компонентов и их объединения в пробе, в которой они присутствуют. Антителами могут быть поликлональные или моноклональные антитела.
Таким образом, целью изобретения является получение улучшенной процедуры анализа пробного образца на присутствие в нем конкретного целевого компонента.
Другой целью изобретения является получение метода описанного выше типа, который позволяет изменять удельный вес целевого компонента, а также маркировать целевые компоненты для того, чтобы они были обнаружимыми в образце.
Следующей целью изобретения является получение материала, который является маркером для целевого компонента и который одновременно может быть специфичным ко многим различным целевым компонентам.
Еще одной целью изобретения является получение метода вышеописанного типа, который позволяет количественно и/или качественно анализировать целевые компоненты в пробе.
Указанные и другие цели, а также преимущества изобретения будут более подробно проиллюстрированы в описании предпочтительных вариантов осуществления изобретения.
На чертеже схематически изображена липосома, модифицированная для использования в изобретении.
На чертеже показана липосома, состоящая из однослойной везикулы 2. Мембрана 4 везикулы 2 является очень тонкой, толщиной примерно 40 A, но при этом охватывает достаточно большой объем. Внутри везикулы содержится маркерная жидкость 6, например краситель или т.п., которая может диспергировать жидкость-носитель или может быть диспергирована в жидкости-носителе. Антитела 8 присоединяются к внешней поверхности мембраны 4. В качестве примера на чертеже показаны четыре различных антитела A, B C и D, расположенные на внешней стороне мембраны 4. Как было указано ранее, с каждой везикулой могут связываться сотни (или тысячи) различных антител, если это необходимо. Очевидно, что антитела являются подвижными по отношению к внешней поверхности везикулы 2, поэтому для осуществления нужного мечения целевых компонентов какой-либо конкретной ориентации везикулы не требуется. При этом следует отметить, что благодаря достаточно большому количественному содержанию маркера 6, инкапсулированного в везикуле, удельный вес маркера 6 и/или его носителя определяется удельный вес везикулы.
Везикула 2 может быть изготовлена любым стандартным способом, причем маркер 6 вводят в везикулу во время ее приготовления так, как описано в работе О'Коннела. В статье Szoka and Papahadiopoulos. Liposomes: Preparation and characterizatio pp. 69 - 82, Fvom Physical Structure to therapeutic application, Elsevier (North Holland and Biomedical press, 1981) описывается несколько способов связывания антител с липосомами. Например, указанные липосомы могут быть получены путем инкапсулирования 5 мМ маркера в виде флуоресцеинсульфоновой кислоты, растворенной в 5 мМ ЭДТК-буферного носителя, имеющего pH 4,5. Антитела могут быть связаны с целыми липосомами посредством основания Шиффа, которое при нейтральном или щелочном pH восстанавливается до стабильного амида с помощью метода, использующего цианоборогидрид натрия (Peddler and Grag, Analitical Biochemistry, т. 86, с. 716 - 724). В этой процедуре используется окисление периодатом липосом, содержащих 10 М % лактозилцереброзида или смешанных гангликозидов мозга. Указанную стадию окисления осуществляют либо в присутствии кислоты (pH 5,5), либо щелочи (pH 8,4). Время окисления периодатом при pH 5,5 должно внимательно контролироваться во избежание попадания периодата в липосомы. Последующую стадию восстановления с использованием цианоборогидрида натрия проводят при нейтральном pH. Во время реакции необходимо следить за сохранением целостности везикулы, на что будет указывать тот факт, что включенное внутрь содержимое не вытекает из липосомы, а также расщепляемые периодатом окисленные компоненты не захватываются липосомой. Вышеуказанный способ позволяет осуществлять эффективное связывание белка. Кроме того, в указанном способе перекрестное сшивание белка с белком или агрегация липосом не представляют серьезных проблем.
Изобретение может быть использовано в количественной оценке ретикулоцитов в пробе цельной крови. Ретикулоциты представляют собой эритроциты на ранней стадии развития, и количественное измерение ретикулоцитов в пробе крови может быть использовано для определения скорости продуцирования организмом эритроцитов. Оценка количества ретикулоцитов является важной для определения причин анемий и может быть также использована для установления наличия компенсированной кровопотери, то есть нормального количества эритроцитов, присутствие которого обусловлено лишь аномально высокой скоростью продуцирования эритроцитов. Указанная компенсированная кровопотеря может быть ранним признаком наличия желудочно-кишечного кровотечения по причине злокачественной опухоли или по каким-либо другим причинам. Ретикулоциты имеют поверхностный антиген - трансферрин, с которым может связываться антитело против трансферрина. Таким образом, популяцию ретикулоцитов в образце цельной крови можно количественно оценить путем связывания антител против трансферрина с мембраной липосом, содержащих жидкий окрашивающий агент, такой как краситель или флуоресцентный агент, который имеет удельный вес, отличающийся от удельного веса ретикулоцитов и зрелых эритроцитов. Меченные липосомы затем смешивают с пробой крови в той мере, в какой это необходимо для связывания всех ретикулоцитов в пробе крови. Затем смесь помещают в пробирку для анализа крови, описанную в патенте США N 4027660 S.C.Wardlaw и др., и проводят количественную оценку в соответствии с процедурами, приведенными в описании изобретения.
Изобретение может быть также использовано для обнаружения и количественной оценки Т-лимфоцитов и их субпопуляции в крови пациента. Т-лимфоциты представляют собой подгруппу лимфоцитов, которые являются медиаторами клеточного иммунитета, тогда как B-лимфоциты медиаторами гуморального иммунитета (антителопродуцентами).
Реактивность лимфоцитов по отношению к конкретным антителам рассматривается в заявке на патент США N 07/340248, 1989, Robert A.Levine и Stephen C. Wardlaw. Активированные лимфоциты (лимфобласты) обладают поверхностными активационными антителами, такими как трансферриновый рецептор: HLA-De, Leu-23 и т.д. Для обнаружения лимфобластов антитела, специфичные к одному из указанных лимфоцитных антигенов, связывают с липосомами, включающими в себя соответствующий маркер. Затем меченные липосомы смешивают с пробой крови в течение периода времени, достаточного для связывания с любыми лимфобластами, которые могут присутствовать в пробе крови. Затем эту смесь помещают в пробирку для анализа крови, которая была описана в патенте США N 4027660, и анализируют в соответствии с процедурами, приведенными в описании изобретения.
Поскольку анализируемые клетки являются лейкоцитами, то предпочтительно выбирать маркерный краситель, имеющий удельный вес, который отличается от удельного веса лейкоцитов, так, чтобы вызвать отделение меченых лимфобластов от оставшихся лейкоцитов или выделение в отдельную полосу среди лейкоцитов. Липосомы, используемые для отбора Т-лимфоцитов из субпопуляции лимфоцитов, имеют плотность менее 1,017 г/мл. Лимфоциты имеют среднюю плотность 1,06 мг/мл и пределы плотности 1,055-1,070 г/мл. Поэтому используемые липосомы способны уменьшать плотность целевых Т-лимфоцитов, заставляя из подниматься на верхнюю поверхность слоя.
Пример 1. Обнаружение Т-лимфоцитов в пробе крови. Маркерную композицию, содержащую 25 мкл неразведенного антитела 55-2/LEU-1, связанного с липосомами, загруженными флуоресцеином (флуоресцентным красителем), который имеет удельный вес менее 1,017 г/мл, добавляли к 1 мл ОДТК-венозной крови, и к этой смеси добавляли 25 мкл неразбавленного 0,42 г/10 мл маточного раствора фторида натрия. Фторид натрия продуцирует более четкое разделение нефлуоресцентных и флуоресцентных компонентов в полосах лимфоцитных клеток. К полученной выше смеси добавляли 50 мкл неразбавленного 1,1 г/10 мл маточного раствора оксалата калия в целях получения более четкого разделения эритроцитов/гранулоцитов, описанного в указанных прототипах. Полученную смесь инкубировали 5 мин, после чего смесь центрифугировали для разделения клеток различных типов в капиллярной трубке или другой, прозрачной пробирке, содержащей пластиковый поплавок, который распределяет различные клетки в образце. С помощью вышеуказанного способа в слое лейкоцитов была получена заметная полоса флуоресцентных лимфоцитов. Эта полоса была количественно проанализирована путем измерения аксиальной величины в пробирке. Полученная величина указала на наличие циркулирующих Т-лимфоцитов в крови. Если используются красители, имеющие разный удельный вес, то можно сделать так, чтобы меченые клетки осаждались где-нибудь в другом месте центрифугированной пробы крови.
Изобретение может быть использовано также для анализа других клеток, частиц или организмов в пробах биологических жидкостей. Известно, что присутствие аномальных количеств Бета-амилоидного белка (ВАР) в мозге, коже и слизистой оболочке толстой кишки характерно для пациентов, страдающих болезнью Альцгеймера, дегенеративными нейрологическими расстройствами, и для пожилых пациентов, страдающих болезнью Дауна и расстройством познавательной способности, известны также как триомия 21. До настоящего времени ВАР не был обнаружен в сыворотке. Присутствие ВАР в лейкоцитах типа лимфоцитов или других типов может быть обнаружено с помощью связанных с липосомами антител, направленных против поверхностных ВАР-антигенов, расположенных на поверхности ВАР-продуцирующих циркулирующих клеток.
Что касается обнаружения организмов в пробах биологических жидкостей, то в этой связи можно указать на возбудителей малярии, которые обычно представляют собой внутриклеточные организмы, и которые внедряются в эритроциты иммунологическим способом, поскольку антитела не способны проникать в эритроциты через мембрану неповрежденной клетки. Возбудитель малярии типа falcipatum вызывает характерные изменения в инфицированных эритроцитах. При этом очень важно различать малярию, вызванную falcipatum, от других видов малярии, поскольку малярия, возбудителем которой является falcipatum, нередко имеет летальный исход и практически не поддается обычно используемым противомалярийным лекарственным препаратам. Для неспециалиста, мофрологически очень трудно дифференцировать малярию, вызванную falcipatum, от малярии других типов. Используя меченые липосомы, которые могут связываться с falcipatum-инфицированными эритроцитами, технически было бы возможно идентифицировать вид заражения. Антитела на липосомах являются специфичными к поверхностному антигену мембраны эритроцитов, который является уникальным для falcipatum-инфицированных эритроцитов.
Пример 2. Обнаружение в пробе крови активированных клеток лимфоцитов, которые экспрессируют CD-69 эпитоп на своей поверхности. Эти активированные лимфоциты предварительно смешивают с неактивированными лимфоцитами, которые отрицательны на CD-69, и оба типа лимфоцитов перемешивают так, чтобы было невозможно провести количественный анализ активированных клеток лимфоцитов способами известного уровня.
К указанной пробе крови добавляется маркерная композиция, включающая обычное анти-CD-69 антитело, связанное с липосомами, нагруженными флюоресцеином в TPYS-буфере в качестве носителя, придающим липосомам удельный вес 1,004 г/мл.
Полученную смесь инкубируют 5 мин, так что меченые липосомы селективно связываются с активированными лимфоцитами. Сформированные таким образом пары имеют удельный вес 1,058 г/мл, который меньше величины удельного веса свободных неактивированных лимфоцитов. После этого смесь центрифугируют для отделения различных типов клеток в прозрачной трубке, содержащей пластиковый поплавок, который расширяет различные полосы клеток в пробе.
Таким образом сформировалась отчетливая полоса флюоресцентных активированных лимфоцитов над уровнем остальных лимфоцитов в пробе. Наличие активированных лимфоцитов в пробе становится видимым в центрифугированной пробе крови.
Пример 3. Обнаружение наличия ретикулоцитов в пробе крови. Ретикулоциты, которые являются незрелыми эритроцитами, имеют CD-64 поверхностный эпитоп антитрансферина, который не существует на зрелых эритроцитах. Они также имеют несколько меньший удельный вес, чем неретикулоцитные красные клетки, но они достаточно сильно смешиваются с более старыми красными клетками, так что трудно провести количественный анализ на основе разности удельного веса.
К указанной пробе крови добавляют маркерную композицию, включающую обычное анти-CD-64 антитело, связанное с внешней поверхностью липосом, нагруженных флюоресцеином, в буфере в качестве носителя, придающим липосомам удельный вес 1004 г/мл.
Полученную смесь инкубируют 5 мин, так что меченые липосомы селективно связываются с ретикулоцитами. Сформированные таким образом пары имеют удельный вес, который меньше величины удельного веса свободных неактивированных лимфоцитов.
После образования указанных пар ретикулоцитов с мечеными липосомами смесь центрифугируют в прозрачной трубке, содержащей пластиковый поплавок, который расширяет различные полосы клеток в пробе.
Пары липосома-ретикулоцит образуют отчетливую флюоресцентную полосу над центрифугированным скоплением клеток эритроцитов, позволяя идентифицировать наличие ретикулоцитов в пробе крови.
Изобретение может быть осуществлено и в других вариантах и модификациях, не выходящих за рамки объема формулы изобретения.
Изобретение относится к медицине и касается модифицирующей удельный вес маркерной частицы и способа анализа биологической жидкости. Изобретение решает задачу создания липосомальной системы, которая связывается с компонентами образца биологической жидкости с помощью антител, прикрепленных к поверхности липосом, и также способа анализа биологической жидкости, которая содержит антигены, специфичные для антител липосомальной системы. Сущность способа заключается в добавлении системы к образцу анализируемой жидкости и центрифугировании смеси для гравиметрического отделения связанных липосом в отчетливую полосу и количественное определение комплекса. Технический результат предложения заключается в создании системы для усовершенствованного анализа целевых компонентов биологической жидкости. 2 с. и 4 з.п. ф-лы, 1 ил.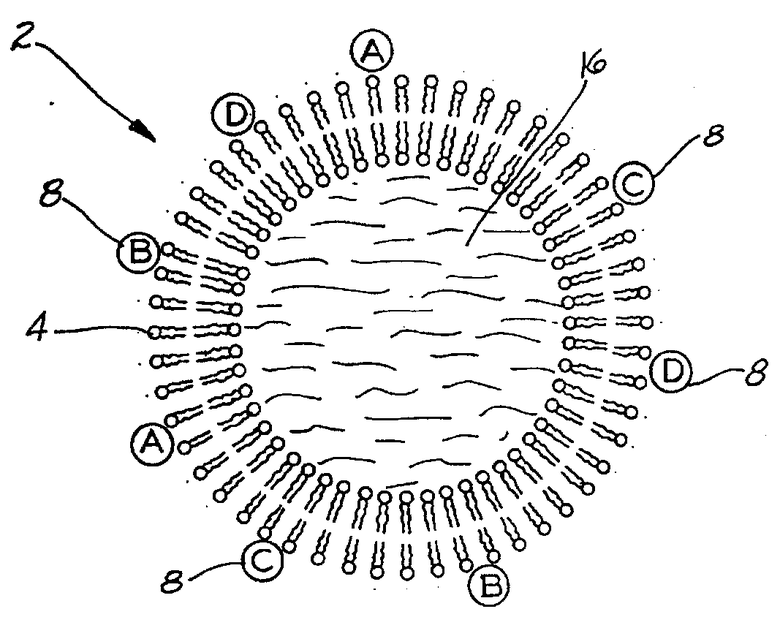
| Способ получения липосом | 1978 |
|
SU1158031A3 |
| US 4181609 A, 01.01.80 | |||
| US 4591570 A, 27.05.86 | |||
| S zoka F., Papahadjopoulos D., Liposomes: Puparation and characterization, F rom Physicol structure to the therapeutic applycation, Elsevilr (North Hol land Bionudicol Press, 1981, p.69-82 | |||
| Chard T., Au Introduction to radioim munoassay and related techniques, North - Holland Publishing Company, Amst erdame-New Iork-Oxford, 1978, с.81 (русского текста). | |||
Авторы
Даты
1998-07-27—Публикация
1993-02-24—Подача