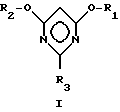
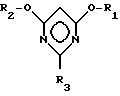
Изобретение относится к новому способу получения 2-замещенных 4,6-диалкоксипиримидинов общей формулы I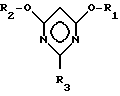
в которой
R1 и R2 могут быть одинаковыми или различными и означают (C1-C4)-алкил, а R3 означает R4-O-, R4-S- или группу R4R5N-, где при R4, равном C1-C4-алкил, R5 означает атом водорода, C1-C4-алкил или фенил; 2-N-алкиламино-4,6-диметоксипиримидинам и способу получения галогензамещенных пиримидина.
Эти 2-замещенные 2,6-диалкоксипиримидины, в частности 4,6-диметокси-2-(метилтио)пиримидин, являются важными полупродуктами для получения гербицидов (европейский патент A 249 708).
Известен способ получения галогенпроизводных пиримидина, в частности 2-хлор-4,6-диалкоксипиримидина, путем диазотирования 2-амино-4,6-диалкоксипиримидина нитритов натрия, с последующим гидролизом образующегося соединения концентрированной соляной кислотой (J.A.Bee и F.L.Rose, J. Chem. Soc., C, 1966, с. 2031).
Большим недостатком этого способа является очень низкий выход целевого 2-хлор-4,6-диметоксипиримидина.
Известен также способ получения 4,6-диалкокси-2-алкилтиопиримидинов с использованием в качестве исходного соединения 4,6-диоксипиримидинов и органических сульфоновых кислот, описанный в японском патенте A-01040470.
Этот способ позволяет получить 4,6-диалкокси-2-алкилтиопиримидины с очень низким выходом.
Известно также, что 4,6-диметокси-2-(метилтио)пиримидин может быть получен путем замещения в 4,6-дихлор-2-метилтиопиримидине атомов хлора с помощью метилата щелочного металла. Согласно этому способу вначале получают исходное соединение 4,6-дихлор-2-метилтиопиримидин хлорированием 2-метилтиобарбитуровой кислоты фосфороксидтрихлоридом (J.Org. Chem., 1961, 26, с. 792-803), которое затем известным специалистам способами, с помощью метилата щелочного металла, переводят в 4,6-диметокси-2-(метилтио)пиримидин.
Этот способ имеет тот недостаток, что при осуществлении его в качестве отхода образуются большие количества фосфата, который необходимо утилизировать.
Задачей изобретения является устранение указанных недостатков путем создания простого и экологически безопасного способа получения 2-замещенных 4,6-диалкоксипиримидинов с высоким выходов.
Таким образом, изобретение относится к новому способу получения 2-замещенных 4,6-диалкоксипиримидинов общей формулы I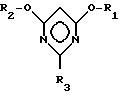
в которой
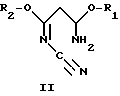
R1 и R2 могут быть одинаковыми или различными и означают (C1-C4)-алкил, а R3 означает R4-O-, R4-S- или группу R4R5N-, где R4 означает (C1-C4)-алкил, а R5 означает атом водорода или (C1-C4)-алкил или фенил. Способ заключается в том, что на первой стадии способа осуществляют циклизацию цианимидата общей формулы II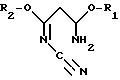
в которой
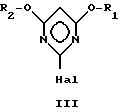
R1 и R2 имеют указанные значения, с галогенводородом с образованием в результате галогенпроизводного пиримидина общей формулы III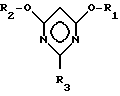
в которой
R1 и R2 имеют указанные значения, а X означает атом галогена, которое на второй стадии способа путем взаимодействия с соединением общей формулы IV
M - R3
в которой
R3 означает вышеопределенную группу R4-O или R4-S-, а M означает атом щелочного металла, или с алкиламином общей формулы V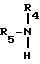
в которой
R4 и R5 имеют вышеприведенные значения, переводят в целевое соединение формулы I.
Преимущественно в качестве цианимидата используют 3-амино-3-метокси-N-циано-2-пропенимидат формулы II, где R1 и R2 означают метил.
В качестве галогеноводорода желательно использовать хлористый водород.
Обычно реакцию на первой стадии проводят при (-30) - (30)oC.
В качестве соединения общей формулы IV на второй стадии используют тиолят или метанолят щелочного металла.
На второй стадии способа желательно использовать алкиламин общей формулы V, в которой R4 означает бутил, а R5 - атом водорода.
Как правило, реакцию на второй стадии способа проводят при -10 - 100oC.
При этом обычно реакцию проводят, не выделяя галогенпроизводное пиримидина формулы III из реакционной смеси.
При осуществлении первой стадии целесообразно использовать в качестве исходного материала имидаты общей формулы II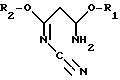
у которых
R1 и R2 означают метил или этил. Предпочтительно использовать в качестве имидата формулы II 3-амино-3-метокси-N-циано-2-пропенимидат, у которого R1 и R2 означают метил.
Указанный 3-амино-3-метокси-N-циано-2-пропенимидат может быть, например, легко получен по способу в соответствии с европейским патентом 024200.
В качестве галогенводорода на первой стадии можно использовать хлористый водород, бромистый водород или иодистый водород. Предпочтительным является использование хлористого водорода.
Галогенводород при взаимодействии его с цианимидатом формулы II можно брать в количестве 2 - 4 моль на моль последнего. Предпочтительно газообразный галогенводород пропускают через реакционную смесь до насыщения.
Реакцию на первой стадии целесообразно проводит при температуре -30 и 30oC, предпочтительно -20 и 10oC.
В качестве растворителя на первой стадии можно использовать органические растворители, такие как, например, тетрагидрофуран, толуол, ацетонитрил, метиленхлорид или низкокипящие спирты. Предпочтительным растворителем является толуол.
После проведения реакции в течение, как правило, 1-5 ч полученное галогенпроизводное пиримидина формулы III может быть подвергнуто обработке обычными способами или непосредственно без выделения из реакционной массы может быть использовано на второй стадии.
При проведении реакции на второй стадии целесообразно использовать в качестве исходного соединение общей формулы IV
M - R3
у которых
R3 означает метокси или этоксигруппу (предпочтительно метокси) или метил - или этилтиогруппу, а M - атом щелочного металла.
Предпочтительным соединением формулы IV является метанолят натрия и калия и тиолят натрия и калия.
При проведении реакции на второй стадии целесообразно также использовать в качестве алкиламина общей формулы V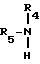
соединения, у которых R4 означает C1-C4-алкил, а R5 - C1-C4-алкил или атом водорода. Предпочтительно в качестве алкиламина использовать бутиламин (в этом случае R4 означает бутил, а R5 - атом водорода).
Соединения общей формулы IV или V можно использовать в количестве 1-3, предпочтительно 1 - 2 моль на моль галогенпроизводного пиримидина формулы III.
Реакцию на второй стадии целесообразно проводить при -10 - 100oC, предпочтительно 40 - 80oC.
В качестве растворителя на второй стадии можно использовать те же растворители, что и на первой.
После проведения реакции в течение, как правило, 1-50 ч образующийся целевой продукт формулы I может быть подвергнут дальнейшей обработке обычными способами.
Предпочтительно проводить весь процесс без выделения галогенпроизводного пиримидина общей формулы III.
Другим объектом изобретения являются 2-N-алкиламино-4,6-диалкоксипиримидины общей формулы I, особенно предпочтителен 2-N-бутиламино-4,6-диметоксипиримидин.
Объектом изобретения является также способ получения галогенпроизводных пиримидина общей формулы III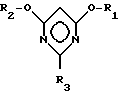
в которой
R1 и R2 могут быть одинаковыми или различными и означают (C1-C4)-алкил, X - атом галогена, заключающийся в том, что цианимидат общей формулы II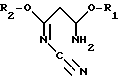
в которой
R1 и R2 имеют указанные значения, подвергают взаимодействию с галогеноводородом.
Пример 1. Получение 2-хлор-4,6-диметоксипиримидина
а) Использование в качестве растворителя тетрагидрофурана.
4,7 г 3-амино-3-метокси-N-циано-2-пропенимидата суспендировали в 60 мл тетрагидрофурана и охлаждали полученную суспензию до -20oC. После этого через нее пропускали газообразный хлористый водород до насыщения, поддерживая при этом температуру в пределах (-10) - (20)oC. В течение 3 ч через каждые 30 мин через раствор пропускали такое количество газообразного хлористого водорода, чтобы он снова был насыщенным. Затем тетрагидрофуран полностью отгоняли, остаток после добавления 50 мл воды трижды подвергали экстракции метиленхлоридом и органическую фазу после высушивания над сульфатом натрия упаривали досуха. В результате получали 4,0 белого кристаллического продукта с выходом 71,1% в расчете на исходный пропенимидат. Температура плавления 99 - 100oC. Содержание целевого соединения в полученном продукте 94% (по данной газовой хроматографии).
Полученный продукт может быть перекристаллизован следующим образом.
Полученный вышеописанным образом сырой пиримидин нагревали в 25 мл изопропанола до 70oC. После добавления к полученному раствору воды до начала помутнения его охлаждали до 10oC и выпадающий осадок отфильтровывали. После высушивания получали 3,5 г чистого продукта, что составляло 66,2% в расчете на исходный пропенимидат. Температура плавления 102oC. Содержание целевого соединения в продукте 99% (по данным газовой хроматографии).
Результаты элементного анализа из расчета на формулу C6H7ClN2O2
Найдено.% C 40,8; H 4,0; N 16,0
Рассчитано,% C 41,3; H 4,0; N 16,1
1H-ЯМР (CDCl3, 300 МГц δ в м.д.: 5,97 (с, 1H), 3,95 (с, 6H).
б) Использование в качестве растворителя толуола.
Суспензию 2,4 г 3-амино-3-метокси-N-циано-2-пропенимидата в 20 мл толуола насыщали при 0oC газообразным хлористым водородом. Суспензию перемещали в течение 2 ч, продолжая пропускать через нее поток HCl с такой скоростью, чтобы реакционная смесь все время оставалась насыщенной. Затем к реакционной смеси добавляли 20 мл воды, фазы разделяли и водную фазу еще дважды подвергали экстракции толуолом, порциями по 10 мл. Объединенные органические фазы упаривали досуха и остаток высушивали в глубоком вакууме. В результате получали 2,1 г белого кристаллического продукта с содержанием целевого соединения (по данным газовой хроматографии) 95%, что соответствовало выходу 73,9 в расчете на исходный пропенимидат. Температура плавления 100oC.
Пример 2. Получение 4,6-диметокси-2-метилтиопиримидина
2-Хлор-4,6-диметоксипиримидин получали так, как это описано в примере 1. Полученные после экстракции органические фазы добавляли при комнатной температуре по каплям к раствору 1,5 моль-эквивалентного тиолята натрия в 5 мл метанола. Для завершения реакции реакционную смесь нагревали через 2 ч до 50oC и выдерживали ее в течение двух часов при этой температуре.
После экстракции 20 мл воды, упаривания и высушивания остатка в глубоком вакууме получали 1,8 г белого кристаллического продукта, что соответствовало выходу 60% в расчете на исходный пропенимидат. Температура плавления 49 - 50oC. Путем перекристаллизации из смеси изопропанола и воды получали продукт с температурой плавления 54 - 56oC.
1H-ЯМР (CDCl3, 300 МГц) δ в м.д.: 5,72 (с, 1H), 3,95 (с, 6H), 2,55 (с, 3H).
Пример 3. Получение 2-N-бутиламино-4,6-диметоксипиримидина
Раствор 1,9 г 2-хлор-4,6-диметоксипиримидина в 30 мл толуола в соответствии с примером 1б смешивали с 2,7 г бутиламина и 3,3 г триэтиламина и нагревали смесь в течение 50 ч при 80oC. После охлаждения ее дважды подвергали экстракции водой, порциями по 30 мл, и органические фазы упаривали досуха. Остаток в виде желтоватой маслянистой жидкости перегоняли при 140oC и давлении с мбар. В результате получали 2,1 г бесцветной маслянистой жидкости, что соответствовало выходу 66% в расчете на исходный проренимидат. Содержание целевого соединения в полученном продукте 98% (по данным газовой хроматографии).
1H-ЯМР (CDCl3, 300 МГц) δ в м.д.: 5,4 (с. 1H), 4,95 (б, 1H), 3,85 (с, 6H), 3,4 (кв., 2H), 1,4 (м, 2H), 0,95 (т, 3H).
Результаты элементного анализа из расчета на формулу C10H17N3O2
Найдено,% C 56,9; H 8,5; N 19,6
Рассчитано,% C 56,9; H 8,1; N 19,9
Пример 4. Получение 2,4,6-триметоксипиримидина
1,3 г 2-Хлор-4,6-диметоксипиримидина, полученного в примере 1a (содержание 94%) растворяли в 9 мл метанола. После добавления 2,5 г 30%-ного метанольного раствора метанолята натрия смесь перемешивали в течение 2 ч при 55oC. После охлаждения выпадающий осадок хлорида натрия отфильтровывали и фильтрат разбавляли 15 мл воды. При стоянии на ледяной бане происходила кристаллизация продукта в виде мелких белых игл, которые отфильтровывали и высушивали в вакууме при комнатной температуре. В результате получали 1,02 г чистого продукта, что соответствовало выходу 86%. Температура плавления 55oC.
1H-ЯМР (CDCl3, 300 МГц) δ в м.д.: 5,7 (с, 1H), 4,0 (с. 3 H), 3,95 (с. 6H).
Аналогично примеру 1 реакцией 2-хлор-4,6-диэтоксипиримидина, полученного в примере 3, с соответствующим аминосоединением были получены продукты, приведенные в таблице.

Использование в качестве полупродуктов для получения гербицидов. Предложен способ получения 2-замещенных 4,6-диалкоксипиримидинов формулы I, где R1 и R2 - одинаковые или различные (C1-C4)-алкил, R3-R4-O-, R4-S- или R4R5N-, где R4 - (C1-C4)-алкил, R5 - водород, (C1-C4)-алкил или фенил, путем циклизации цианимидата формулы II с галогенводородом с образованием галогенпроизводного пиримидина формулы III, которое путем взаимодействия с соединением формулы IV M-R3, где R3 = R4-O- или R4-S-, M - атом щелочного металла, или с алкиламином формулы  , переводят в целевое соединение формулы I. Описан 2-N-бутиламино-4,6-диметоксипиримидин.
, переводят в целевое соединение формулы I. Описан 2-N-бутиламино-4,6-диметоксипиримидин.
3 с. и 7 з. п. ф-лы, 1 табл.
в которой R1 и R2 могут быть одинаковыми или различными и означают C1 - C4-алкил, а R3 означает R4-O, R4-S- или группу R4R5N-, где R4 означает C1 - C4-алкил, а R5 означает атом водорода, C1 - C4-алкил или фенильную группу,
отличающийся тем, что на первой стадии способа осуществляют циклизацию цианимидата общей формулы II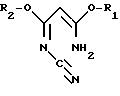
в которой R1 и R2 имеют указанные значения,
с галогенводородом с образованием в результате галогенпроизводного пиримидина общей формулы III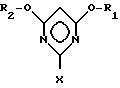
в которой R1 и R2 имеют указанные значения, а X означает атом галогена, который на второй стадии способа путем взаимодействия с соединением общей формулы IV
M - R3,
в которой R3 означает вышеопределенную группу R4-O- или R4-S-, а M означает атом щелочного металла,
или с алкиламином общей формулы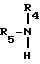
в которой R4 и R5 имеют указанные значения,
переводят в целевое соединение формулы I.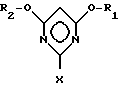
в которой R1 и R2 могут быть одинаковыми или различными и означают C1 - C4-алкил, а X обозначает атом галогена,
отличающийся тем, что цианимидат общей формулы II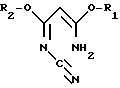
в которой R1 и R2 имеют указанные значения, подвергают взаимодействию с галогенводородом.
| Jowrnal Org | |||
| Chem | |||
| Судно | 1925 |
|
SU1961A1 |
| Вагонный распределитель для воздушных тормозов | 1921 |
|
SU192A1 |
| Jowrnal Chem.Soc., f.C, 1966, p.2031. | |||
Авторы
Даты
1998-08-10—Публикация
1992-11-25—Подача