Настоящее изобретение касается новых соединений 1-(арил-алкиламиноалкил)имидазола, обладающих лечебным действием и используемых для лечения состояний, связанных с воспалением или аллергическим эффектом, лечебных составов, содержащих эти новые соединения, и способов получения этих новых соединений.
Считается, что в ответ на вызывающие воспаления раздражители происходит активация фосфолипазных ферментов, связанная с выделением арахидоновой кислоты из фосфолипидов. Существующие нестероидные противовоспалительные средства (НСПС) вызывают сначала, как полагают, блокировку преобразования этой выделяющейся арахидоновой кислоты в простогландины через циклооксигеназный путь последовательного включения арахидоновой кислоты. Большинство существующих средств такого типа (НСПС) неприемлемы для лечения астматиков. Авторы нашли целую серию соединений, блокирующих выделение арахидоновой кислоты из фосфолипидов. Эти соединения могут быть использованы как противовоспалительные средства с потенциально более широким спектром активности, чем существующие НСПС и потенциально значительно меньшим побочным действием для желудочно-кишечного тракта. Кроме того эти соединения могут быть использованы для лечения астмы.
Соединение A описано в Il Farmaco, 44(5), 495-502, 1989, как вещество, обладающее ингибирующим действием на агрегацию тромбоцитов in vitro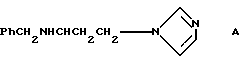
Соединение B представлено как промежуточный химический продукт в Европейской патентной заявке 0230035. О фармакологической активности этого соединения не сообщается.
В патенте Великобритании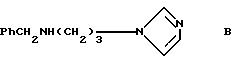
В патенте Великобритании 2088888 описаны составы для проявителей с пониженной чувствительностью, содержащие имидазолы формулы C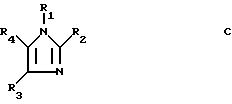
в которой
R1 представляет собой атом водорода, C1-20-алкило- или C6-20-арилогруппу, R2 представляет собой атом водорода, C1-20-алкилогруппу, C6-20-арилогруппу, аминогруппу или C1-20-алкилтиогруппу, R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, C1-4-алкилогруппу или C6-20-арилогруппу и R1, R2, R3 и R4 могут быть замещенными. В патенте описан 1-(6-бензаминогексил)-2-метилимидазол. О фармакологической активности этого соединения не сообщается.
Более отдаленно родственные соединения формулы D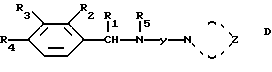
в которой кольцо, содержащее N и Z, представляет собой диалкиламин, морфолин или пиперидин, описаны в Indian Journal of Pharmacology, 1973, 5, 428 и Pfl. Krankh, 1975, 3, 139. Указанные соединения раскрываются как потенциальные депрессанты для центральной нервной системы. N-(2-(4-морфолино)пропил/ -α-этил-3,4-дихлорбензиламин, как утверждают, обладает противовоспалительной активностью, однако отличается целым спектром нежелательных побочных эффектов.
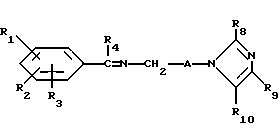
Настоящее изобретение касается новых соединений формулы I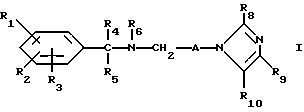
и их фармацевтически приемлемых солей, отличающихся тем, что R1, R2 и R3 независимо друг от друга представляют собой водород, галоген, C1-6-алкилогруппу, C1-6-алкоксигруппу, фенокси (необязательно замещенный на C1-4-алкилогруппу, C1-4-алкоксигруппу или галоген), фенил (необязательно замещенный на C1-4-алкилогруппу, C1-4-алкоксигруппу или галоген), C2-6-алкоксикарбонильную группу, аминогруппу формулы -NR13R14 (в которой R13 и R14 представляют собой независимые друг от друга водород или C1-4-алкилогруппу или R13 и R14 вместе с соединенным с ними атомом азота представляют собой пирролидиновое кольцо, морфолиновое кольцо или пиперидиновое кольцо), галоидированную C1-4-алкоксигруппу, галоидированную C1-4-группу, галоидированную C1-4-алкилгруппу, бензилокси (необязательно замещенный на C1-4-алкилгруппу, C1-4-алкоксигруппу или галоген), гидрокси, C1-4-гидроксиалкилгруппу, (C2-6-алкоксикарбонил)винилогруппу, группу формулы S(O)nR7 (в которой R7 представляет собой C1-4-алкилгруппу и n есть целое число 0, 1 или 2), C2-4-карбамоилалкилгруппу, C2-6-алкоксикарбонил C1-2-алкилгруппу, группу карбамоила формулы -CONR11R12 (в которой R11 и R12 представляют собой независимо водород или C1-6-алкил) или R1 и R2 вместе с фенильным кольцом, к которому они присоединены, представляют собой нафтил, R4 и R5 независимо представляют собой водород, C1-4-алкилгруппу, фенил (необязательно замещенный на C1-4-алкилогруппу, галоген или C1-4-алкоксигруппу) или R4 и R5 вместе с соединенными с ними атомом углерода представляют собой C3-6-циклоалкильную группу.
R6 представляет собой водород, C1-4-алкилгруппу или ω -гидрокси-C1-4-алкилогруппу,
A представляет собой C2-9-алкилен, который может быть с прямой цепью или разветвленной,
R8 представляет собой водород, C1-6-алкил, галоген, C1-4-алкокси-C1-4-гидроксиалкил, фенил (необязательно замещенный C1-4-алкилом, галогеном или C1-4-алкоксигруппой) или бензил (необязательно замещенный C1-4-алкилом, галогеном или C1-4-алкоксигруппой).
R9 и R10 независимо представляют собой водород, C1-6-алкилогруппу, галоген, C1-4-алкоксигруппу, фенил (необязательно замещенный C1-4-алкилом, галогеном или C1-4-алкоксигруппой), или R4 и R5 вместе с соединенным с ними атомом углерода представляют собой C3-6-циклоалкил,
R6 представляет собой водород, C1-4-алкил или ω - гидрокси-C1-4-алкил,
A представляет собой C2-9-алкилен, с прямой или разветвленной цепью,
R8 представляет собой водород, C1-6-алкил, галоген, C1-4-алкоксигруппу, C1-4-гидроксиалкил, фенил (необязательно замещенный C1-4-алкилом, галогеном или C1-4-алкоксигруппой) или бензил (необязательно замещенный C1-4-алкилом, галогеном или C1-4-алкоксигруппой),
R9 и R10 представляют собой независимо водород, C1-6-алкил, галоген, C1-4-алкоксигруппу, фенил (необязательно замещенный C1-4-алкилом, галогеном или C1-4-алкоксигруппой), C1-4-гидроксиалкильную группу, C2-6-алкоксикарбонильную группу, нитро, аминогруппу формулы NR30R31 (в которой R30 и R31 независимо друг от друга представляют собой водород или C1-4-алкилогруппу), C1-6-алканоилокси C1-4-алкил или аминометильную группу, при условии, что если A представляет собой (CH2)2 и R2, R3, R4, R5, R6, R8, R9 и R10 представляют собой водород, то R1 не является водородом или 4-хлором и что если A представляет собой (CH2)5 и R1, R2, R3, R4, R5, R6, R9 и R10 представляют собой водород, то R8 не является метилом.
Совершенно очевидно, что группа, содержащая цепь из 3 или более атомов углерода, может быть прямой или разветвленной, например пропил, может включать в себя н-пропил и изопропил и бутил соответственно представляет н-бутил, втор.-бутил, изобутил или трет.-бутил.
В предпочтительной группе соединений формулы I R1, R2 и R3 независимо друг от друга представляют собой водород, галоген, например, бром, хлор или бром, C1-4-алкилогруппу (например, метил, этил, пропил или бутил), C1-4-алкоксигруппу (например, метокси, этокси, пропокси или бутиокси), фенокси, фенил, C2-6-алкоксикарбонильную группу (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил или пентоксикарбонил), аминогруппу формулы -NR13R14, в которой R13 и R14 независимо друг от друга представляют собой водород или C1-2-алкоксигруппу (например, амино, метиламино, диметиламино, этиламино или диэтиламино), полигалоид-C1-2-алкоксигруппу (например, трифторметокси или пентафторэтокси), полигалоид C1-2-алкильную группу (например, трифторметил или пентафторэтил), бензилокси, гидрокси, (C2-6-алкоксикарбонил)-винилогруппу, C2-6-алкоксикарбонил-C1-2-алкильную группу или R1 и R2 вместе с соединенным с ними фенильным кольцом представляют собой нафтилогруппу,
R4 и R5 независимо друг от друга представляют собой водород, C1-4-алкильную группу (например, метил, этил, пропил или бутил), фенил или R4 и R5 вместе с соединенным с ними атомом углерода представляет собой C3-6-циклоалкильную группу (например, циклопропил, циклобутил, циклопентил или циклогексил),
R6 представляет собой водород или C1-4-алкильную группу (например, метил, этил, пропил или бутил),
A представляет собой C2-7-алкиленогруппу, которая может быть прямой или разветвленной (например, этилен, триметилен, тетраметилен, 1,1-диметилэтилен, 2,2-диметилэтилен или гептаметилен),
R8 представляет собой водород, C1-4-алкилогруппу (например, метил, этил, пропил или бутил), фенил (необязательно замещенный на C1-4-алкилогруппу, галоген или C1-4-алкоксигруппу) или бензил (необязательно замещенный на C1-4-алкильную группу, галоген или C1-4-алкоксигруппу),
R9 и R10 независимо друг от друга представляют собой водород, C1-4-алкилогруппу (например, метил, этил, пропил или бутил), галоген (например, бром, хлор или фтор), C1-4-гидроксиалкильную группу, например, гидроксиметил, 2-гидроксиэтил, или 3-гидроксипропил), C2-6-алкоксикарбонильную группу (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил или бутоксикарбонил), нитро или C1-6-алканоилокси C1-2-алкильную группу (например, формилоксиметил, ацетоксиметил, пропаноилоксиметил или бутаноилоксиметил).
Группа более предпочтительных соединений формулы I, соответствующих формуле II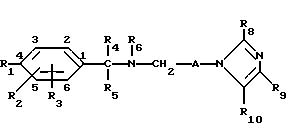
и их фармацевтически приемлемых солей, отличается тем, что R1 представляет собой галоген, C1-4-алкилогруппу, C2-4-алкоксигруппу, фенокси, фенил, C2-4-алкоксикарбонильную группу, пергалоид-C1-2-алкоксигруппу, пергалоидированную C1-2-алкилогруппу, бензилокси, аминогруппу формулы NR13R14 (в которой R13 и R14 независимо друг от друга представляют собой водород или C1-4-алкильную группу), (C2-4-алкоксикарбонил)винильную группу, C2-6-алкоксикарбонил-C1-2-алкильную группу или R1 и R2 вместе с соединенным с ними фенильным кольцом представляют собой нафтилогруппу, R3 и R4 независимо друг от друга представляют собой водород, галоген, C1-4-алкильную группу, C1-4-алкоксигруппу, пергалоидированную C1-2-алкильную группу или гидрокси, R4 и R5 представляют собой независимо друг от друга водород, C1-4-алкильную группу, фенил или R4 и R5 вместе с соединенным с ними атомом углерода представляют собой C3-6-циклоалкильную группу,
R6 представляет собой водород или C1-3-алкильную группу, A представляет собой этилен, триметилен, тетраметилен, 1,1-диметилэтилен или гептаметилен,
R8 представляет собой водород, C1-4-алкильную группу, фенил или бензил,
R9 и R10 независимо друг от друга представляют собой водород, C1-4-алкильную группу, галоген, C1-4-гидроксиалкильную группу, C2-6-алкоксикарбонильную группу, нитро или C1-6-алканоилокси C1-2-алкильную группу.
В предпочтительной группе соединений формулы II R1 представляет собой бром, хлор, метил, этил, трет.-бутил, бутокси, фенокси, фенил, метоксикарбонил, этоксикарбонил, пропоксикарбонил, диметиламино, трифторметокси, трифторметил, бензилокси, 2-этоксикарбонилвинил или R1 и R2 вместе с соединенным с ними фенильным кольцом представляют собой нафтилогруппу. Более предпочтительно, если R1 представляет собой бром, хлор, трет.-бутил, бутокси, фенокси, фенил, метоксикарбонил, пропоксикарбонил, трифторметокси, трифторметил, бензилокси, 2-этоксикарбонилвинил или R1 и R2 вместе с фенильным кольцом, к которому они присоединены, представляют собой нафтилогруппу. Если более предпочтительным считается вариант, когда R1 представляет собой бром или хлор.
В предпочтительной группе соединений формулы II R2 представляет собой водород, 3-хлор, 2-хлор, 3-фтор, 2-метил, 3-метил, 2-метокси, 2-этокси, 2-гидрокси или 3-трифторметил и R3 представляет собой 2-хлор или 3-хлор. Более предпочтительно, если R2 представляет собой водород, 3-хлор, 2-хлор-3-фтор, 2-метил, 3-метил, 2-этокси, 2-гидрокси или 3-трифторметил и R3 представляет собой водород. Еще более предпочтительно, когда R2 представляет собой водород или 2-хлор и R3 представляет собой водород.
В предпочтительной группе соединений формулы II R4 и R5 представляют собой независимо друг от друга водород, метил, этил или R4 и R5 вместе с атомом углерода, с которым они соединены, представляют собой циклопропилогруппу. Более предпочтительно, когда R4 и R5 оба представляют собой водород или метил. Еще более предпочтительно, когда оба радикала R4 и R5 являются метилом.
В предпочтительной группе соединений формулы II R6 представляет собой водород или метил. Более предпочтительно, если R6 является водородом.
В предпочтительной группе соединений формулы II A представляет собой этилен, триметилен или тетраметилен. Более предпочтительно, когда A представляет собой этилен или триметилен.
В предпочтительной группе соединений формулы II R8 представляет собой водород, метил, этил, изопропил, фенил или бензил. Более предпочтительным считается вариант, когда R8 представляет собой водород или метил.
В предпочтительной группе соединений формулы II R9 и R10 независимо друг от друга представляют собой водород, метил, хлор, гидроксиметил, этоксикарбонил, нитро или ацетоксиметил. Более предпочтительно, когда R9 и R10 независимо друг от друга представляют собой водород, метил, хлор, ацетоксиметил или этоксикарбонил. Еще более предпочтительно, когда R9 и R10 независимо друг от друга представляют собой водород или метил.
Вторая группа более предпочтительных соединений формулы I, выраженная формулой II, отличается тем, что R1, R2 и R3 независимо друг от друга представляют собой водород, R4 и R5 являются этилом, R6 представляет собой водород, A - этилен, R8 представляет собой водород или C1-4-алкил и R9 и R10 - независимые друг от друга водород, метил, гидроксиметил или ацетоксиметил.
Третья группа более предпочтительных соединений формулы I, выраженная формулой II, отличается тем, что R1 представляет собой хлор, R2 - водород или 3-хлор, R3 представляет собой водород, R4, R5 и R6 представляет водород, A - этилен, R8 представляет собой водород или метил и R9 и R10 независимо друг от друга представляют собой водород или метил.
Конкретные соединения формулы I представляют собой: -/1-(4-[хлорфенил)этил/-3-(имидазол-1-ил)пропиламин,
-/1-(4-[хлорфенил)этил/-3-(имидазол-1-ил)пропиламин, -/1-(2,4-дихлорфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(2,4-дихлорфенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(3,4-дихлорфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(3,4-дихлорфенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-фторфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-фторфенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-бензилоксифенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-бензилоксифенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-диметиламинофенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-диметиламинофенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(3-хлорфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(3-хлорфенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(2-хлорфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(2-хлорфенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-хлор-3-трифторметилфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-хлор-3-трифторметилфенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-хлор-3-фторфенил)этил/-3-(имидазол-1-ил)-пропил,
-/1-(4-хлор-3-фторфенил)этил/-3-(имидазол-1-ил)-пропил,
3-(имидазол-1-ил)-  -/1-(4-трифторметилфенил)эти л/пропиламин, N-/1-(4-хлор-3-метилфенил)этил/-3-(имидазол-1ил)пропиламин,
-/1-(4-трифторметилфенил)эти л/пропиламин, N-/1-(4-хлор-3-метилфенил)этил/-3-(имидазол-1ил)пропиламин, -/1-(2,3,4-трихлорфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(2,3,4-трихлорфенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-бромфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-бромфенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(2,5-дихлорфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(2,5-дихлорфенил)этил/-3-(имидазол-1-ил)-пропиламин,
3-(имидазол-1-ил)-  -/1-(4-феноксифенил)этил/пропиламин,
-/1-(4-феноксифенил)этил/пропиламин, -/1-(4-хлор-2-метоксифенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-хлор-2-метоксифенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-хлор-2-этоксифенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-хлор-2-этоксифенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-трет.-бутилфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-трет.-бутилфенил)этил/-3-(имидазол-1-ил)-пропиламин,
этил 4-/1-/3-(имидазол-1-ил)пропиламино/этил/бензоат, -/1-(4-этилфенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-этилфенил)этил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-бутоксифенил)этил/-3-(имидазол-1-ил)-пропиламин,
-/1-(4-бутоксифенил)этил/-3-(имидазол-1-ил)-пропиламин,
3-(имидазол-1-ил)-  -/1-(4-трифторметоксифенил)этил-/пропиламин,
-/1-(4-трифторметоксифенил)этил-/пропиламин, -/-(4-хлорфенил)этил/-3-(4,5-диметилимидазол-1-ил)-пропиламин,
-/-(4-хлорфенил)этил/-3-(4,5-диметилимидазол-1-ил)-пропиламин, -/1-(4-хлорфенил)этил/-3-(2-фенилимидазол-1-ил)-пропиламин,
-/1-(4-хлорфенил)этил/-3-(2-фенилимидазол-1-ил)-пропиламин, -/1-(4-хлорфенил)этил/-4-(имидазол-1-ил)бутиламин,
-/1-(4-хлорфенил)этил/-4-(имидазол-1-ил)бутиламин, -/1-(4-хлорфенил)этил/-3-(2-метилимидазол-1-ил)-пропиламин,
-/1-(4-хлорфенил)этил/-3-(2-метилимидазол-1-ил)-пропиламин, -/
-/  -(4-хлорфенил)бензил/-3-(имидазол-1-ил)пропиламин,
-(4-хлорфенил)бензил/-3-(имидазол-1-ил)пропиламин,
5-хлор-2-/1-/3-(имидазол-1-ил)пропиламино/этил/фенол, -/1-(4-хлорфенил)пропил/-3-(имидазол-1-ил/-пропиламин,
-/1-(4-хлорфенил)пропил/-3-(имидазол-1-ил/-пропиламин,
α -/1-(4-хлорфенил)этил/-3-(2,4-диметилимидазол-1-ил)пропиламин,
3-(2-бензил-4-метилимидазол-1-ил)-  -/1-(4-хлорфенил)этил/- пропиламин,
-/1-(4-хлорфенил)этил/- пропиламин,
3-/2-бензил-5-метилимидазол-1-ил)- -/1-(4-хлорфенил)этил/- пропиламин,
-/1-(4-хлорфенил)этил/- пропиламин, -/1-(4-хлорфенил)этил/-3-(4-метил-2-фенилимидазол-1-ил)- пропиламин,
-/1-(4-хлорфенил)этил/-3-(4-метил-2-фенилимидазол-1-ил)- пропиламин, -/1-(4-хлорфенил)этил/-3-(5-метил-2-фенил-имидазол-1-ил/- пропиламин,
-/1-(4-хлорфенил)этил/-3-(5-метил-2-фенил-имидазол-1-ил/- пропиламин, -бензгидрил-3-(имидазол-1-ил)пропиламин,
-бензгидрил-3-(имидазол-1-ил)пропиламин, -(3,4-дихлорбензил)-3-(имидазол-1-ил)пропиламин,
-(3,4-дихлорбензил)-3-(имидазол-1-ил)пропиламин, -(4-бромбензил)-3-(имидазол-1-ил)пропиламин,
-(4-бромбензил)-3-(имидазол-1-ил)пропиламин,
3-(имидазол-1-ил)-  -(4-трифторметилбензил)пропиламин,
-(4-трифторметилбензил)пропиламин,
3-(имидазол-1-ил)-  -(4-феноксибензил)пропиламин,
-(4-феноксибензил)пропиламин, -(4-хлор-2-метилбензил)-3-(имидазол-1-ил)пропиламин,
-(4-хлор-2-метилбензил)-3-(имидазол-1-ил)пропиламин, -(2,4-дихлорбензил)-3-(имидазол-1-ил)пропиламин,
-(2,4-дихлорбензил)-3-(имидазол-1-ил)пропиламин, -(4-хлорбензил)-3-(2-метилимидазол-1-ил)пропиламин,
-(4-хлорбензил)-3-(2-метилимидазол-1-ил)пропиламин, -(4-хлорбензил)-3-(4-метилимидазол-1-ил)пропиламин,
-(4-хлорбензил)-3-(4-метилимидазол-1-ил)пропиламин, -(4-хлорбензил)-3-(5-метилимидазол-1-ил)пропиламин,
-(4-хлорбензил)-3-(5-метилимидазол-1-ил)пропиламин, -(4-хлорбензил)-3-(4,5-диметилимидазол-1-ил)пропиламин,
-(4-хлорбензил)-3-(4,5-диметилимидазол-1-ил)пропиламин, -(4-хлорбензил)-4-(имидазол-1-ил)бутиламин,
-(4-хлорбензил)-4-(имидазол-1-ил)бутиламин, -(4-хлорбензил)-3-(5-метил-2-фенилимидазол-1-ил)пропиламин,
-(4-хлорбензил)-3-(5-метил-2-фенилимидазол-1-ил)пропиламин, -(4-хлорбензил)-3-(4-метил-2-фенилимидазол-1-ил)пропиламин,
-(4-хлорбензил)-3-(4-метил-2-фенилимидазол-1-ил)пропиламин,
Метил-4-/3-(2-метилимидазол-1-ил)пропиламинометил/бензоат,
3-(имидазол-1-ил)-  -(4-метокси-2,6-диметилбензил)пропиламин,
-(4-метокси-2,6-диметилбензил)пропиламин,
Этил 4-/3-(2-метилимидазол-1-ил)пропиламинометил/циннамат,
(-)  -/1-(4-хлорфенил)этил/-3-(имидазол-1-ил)пропиламин,
-/1-(4-хлорфенил)этил/-3-(имидазол-1-ил)пропиламин, -/1-(4-хлорфенил)этил/3-(2-этилимидазол-1-ил)пропиламин,
-/1-(4-хлорфенил)этил/3-(2-этилимидазол-1-ил)пропиламин, -/1-(4-хлорфенил)этил/-3-(4-метилимидазол-1-ил)пропиламин,
-/1-(4-хлорфенил)этил/-3-(4-метилимидазол-1-ил)пропиламин, -/1-(4-хлорфенил)этил/-3-(5-метиламидазол-1-ил)пропиламин,
-/1-(4-хлорфенил)этил/-3-(5-метиламидазол-1-ил)пропиламин, -/1-(4-хлорфенил)этил/-5-(имидазол-1-ил)пентиламин,
-/1-(4-хлорфенил)этил/-5-(имидазол-1-ил)пентиламин,
(+)-  -/1-(4-хлорфенил)этил/-3-(имидазол-1-ил)пропиламин,
-/1-(4-хлорфенил)этил/-3-(имидазол-1-ил)пропиламин, -/1-(4-хлорфенил)этил/-3-(имидазол-1-ил)-2,2-диметилпропиламин,
-/1-(4-хлорфенил)этил/-3-(имидазол-1-ил)-2,2-диметилпропиламин, -/1-(4-хлорфенил)-1-метилэтил/-3-(имидазол-1-ил)пропиламин,
-/1-(4-хлорфенил)-1-метилэтил/-3-(имидазол-1-ил)пропиламин, -/1-(4-хлорфенил)-1-метилэтил)-3-(2-метилимидазол-1-ил/пропиламин,
-/1-(4-хлорфенил)-1-метилэтил)-3-(2-метилимидазол-1-ил/пропиламин, -(4-хлорбензил)-3-(имидазол-1-ил)-2,2-диметилпропиламин,
-(4-хлорбензил)-3-(имидазол-1-ил)-2,2-диметилпропиламин, -(1-хлорфенил)-1-метилэтил/-8-(имидазол-1-ил)октиламин,
-(1-хлорфенил)-1-метилэтил/-8-(имидазол-1-ил)октиламин, -(4-хлорбензил)-3-(4,5-дихлоримидазол-1-ил/-пропиламин,
-(4-хлорбензил)-3-(4,5-дихлоримидазол-1-ил/-пропиламин, -/1-(4-хлорфенил)этил/-3-(2-изопропилимидазол-1-ил)-пропиламин,
-/1-(4-хлорфенил)этил/-3-(2-изопропилимидазол-1-ил)-пропиламин, -/1-(4-хлорфенил)этил/-3-(2,4,5-триметилимидазол-1-ил)-пропиламин,
-/1-(4-хлорфенил)этил/-3-(2,4,5-триметилимидазол-1-ил)-пропиламин, -/1-(4-хлорфенил)этил/-3-(4,5-дихлоримидазол-1-ил)пропиламин,
-/1-(4-хлорфенил)этил/-3-(4,5-дихлоримидазол-1-ил)пропиламин, -/1-(4-хлорфенил)-1-метилэтил/3-(4-метил-имидазол-1-ил/-пропиламин,
-/1-(4-хлорфенил)-1-метилэтил/3-(4-метил-имидазол-1-ил/-пропиламин, -/1-(4-хлорфенил)-1-метилэтил/-3-(5-метилимидазол-1-ил)-пропиламин,
-/1-(4-хлорфенил)-1-метилэтил/-3-(5-метилимидазол-1-ил)-пропиламин, -/1-(4-хлорфенил)-1-метилэтил/-3-(4,5-диметилимидазол-1-ил)пропиламин
-/1-(4-хлорфенил)-1-метилэтил/-3-(4,5-диметилимидазол-1-ил)пропиламин -/4-хлорбензил)-3-(2-изопропилимидазол-1-ил)пропиламин,
-/4-хлорбензил)-3-(2-изопропилимидазол-1-ил)пропиламин, -(4-хлорбензил)-3-(2-этиламидазол-1-ил)пропиламин,
-(4-хлорбензил)-3-(2-этиламидазол-1-ил)пропиламин,
3-(2-метилимидазол-1-ил)-  -(1-метил-1-(п-толил)этилпропиламин,
-(1-метил-1-(п-толил)этилпропиламин, -/1-(4-хлорфенил)-1-метилэтил/-3-(4-нитромидазол-1-ил/-пропиламин,
-/1-(4-хлорфенил)-1-метилэтил/-3-(4-нитромидазол-1-ил/-пропиламин,
3-(имидазол-1-ил)- -/1-метил-1-(п-толил)этил/пропиламин,
-/1-метил-1-(п-толил)этил/пропиламин,
1-(4-хлорфенил)-1-этил-3'-(имидазол-1-ил/-дипропиламин,
1-/3-/1-(4-хлорфенил)-1-метилэтиламино/пропил/имидазол-4-илметанол, -(1-этил-1-фенилпропил)-3-(имидазол-1-ил)пропиламин,
-(1-этил-1-фенилпропил)-3-(имидазол-1-ил)пропиламин,
Этил-4-/1-/3-(имидазол-1-ил)пропиламино/-1-метилэтил)бензоат, -/1-(4-бифенилил)-1-метилэтил/-3-(имидазол-1-ил)пропиламин,
-/1-(4-бифенилил)-1-метилэтил/-3-(имидазол-1-ил)пропиламин, -/1-(4-хлорфенил)циклопро-1-ил/-3-(имидазол-1-ил/пропиламин,
-/1-(4-хлорфенил)циклопро-1-ил/-3-(имидазол-1-ил/пропиламин,
Этил 1-/3-/1-(4-хлорфенил)-1-метилэтиламино/пропил/-4-метилимидазол- 5-карбоксилат, -/1-(2-(нафтил)-1-метилэтил)-3-(имидазол-1-ил)пропиламин,
-/1-(2-(нафтил)-1-метилэтил)-3-(имидазол-1-ил)пропиламин,
1-/3-/1-(3,4-дихлорфенил)-1-метилэтиламино/пропил/имидазол-5-илметанол,
1-/3-/1-(4-хлорфенил)-1-метилэтиламино/пропил/имидазол-5-ил-метанол,
1-/3-/1-(4-бифенилил)-1-метилэтиламино/пропил/-имидазол-4-илметанол,
1-/3-(1-этил-1-фенилпропиламино)пропил/имидазол-4-илметанол,
-/1-(4-бензилоксифенил)-1-метилэтил/-3-(имидазол-1-ил)-пропиламин, -/1-(4-хлорфенил)-1-метилэтил/-4-(имидазол-1-ил)бутиламин,
-/1-(4-хлорфенил)-1-метилэтил/-4-(имидазол-1-ил)бутиламин, -/1-(4-хлорфенилэтил)-3-(имидазол-1-ил)-
-/1-(4-хлорфенилэтил)-3-(имидазол-1-ил)-  -метил-пропиламин,
-метил-пропиламин, -/1-(4-хлорфенил)пропил/-3-(имидазол-1-ил)-
-/1-(4-хлорфенил)пропил/-3-(имидазол-1-ил)-  -метилпропиламин,
-метилпропиламин, -/4-хлорбензил/-3-(2,4-диметилимидазол-1-ил)пропиламин,
-/4-хлорбензил/-3-(2,4-диметилимидазол-1-ил)пропиламин,
3-(2-бензил-4-метилимидазол-1-ил)-  -(4-хлорбензил)пропиламин,
-(4-хлорбензил)пропиламин,
3-(2-бензил-5-метилимидазол-1-ил)-  -(4-хлорбензил)пропиламин,
-(4-хлорбензил)пропиламин, -/1-(4-хлорфенил)-1-метилэтил-5-(имидазол-1-ил)-пентиламин,
-/1-(4-хлорфенил)-1-метилэтил-5-(имидазол-1-ил)-пентиламин,
Пропил-4-/3-(2-метилимидазол-1-ил)пропиламинометил/-бензоат, -/4-хлорбензил/-5-(2-метилимидазол-1-ил)пентиламин,
-/4-хлорбензил/-5-(2-метилимидазол-1-ил)пентиламин, -/1-(4-хлорфенил)-1-метилэтил/-3-(имидазол-1-ил)-
-/1-(4-хлорфенил)-1-метилэтил/-3-(имидазол-1-ил)-  - метилпропиламин,
- метилпропиламин, -/4-Хлорбензил)-N-метил-3-(2-метилимидазол-1-ил)пропиламин,
-/4-Хлорбензил)-N-метил-3-(2-метилимидазол-1-ил)пропиламин, -1-/4-хлорфенил)-1-метилэтил/-3-(2-изопропилимидазол-1-ил/- пропиламин,
-1-/4-хлорфенил)-1-метилэтил/-3-(2-изопропилимидазол-1-ил/- пропиламин,
Пропил 4-//1-(3-имидазол-1-ил)пропиламино/-1-метил-этил) фенилацетат,
1-/3-/1-(4-хлорфенил)-1-метилэтиламино/пропил-5-метилимидазол-4- илметилацетат и
2-/4-(1-3-имидазол-1-ил)пропиламино)-1-метилэтил/фенилэтанол
и их фармацевтически приемлемые соли в виде отдельных энантиомеров, рацематов или других смесей энантиомеров.
Соединения формулы I могут образовывать органические и неорганические соли; например, соединения формулы I могут образовывать соли - продукты кислотного присоединения с неорганическими или органическими кислотами, такими как хлористоводородная, бромистоводородная, фумаровая, винная, лимонная, серная, йодистоводородная, фосфорная, уксусная, малеиновая, бензойная, янтарная, памовая, пальмитиновая, додекановая и кислые аминокислоты, например, глютаминовая кислота. Некоторые соединения формулы I могут образовывать соли со щелочными металлами, например, гидроокись натрия, или с аминокислотами, например, лизин или аргинин. Считается, что соли, если только они являются фармацевтически приемлемыми, могут применяться для целей лечения вместо соответствующих соединений формулы I. Такие соли получают при взаимодействии соединений формулы I с подходящими для этой цели кислотами или основаниями по традиционным методикам. Подобные соли могут также существовать в форме растворов (например, гидратов).
Специалистам в этой области известно, что некоторые соединения формулы I содержат один или более хиральных центров. Таким образом соединения формулы I, в которых R4 и R5 не одинаковы, содержат хиральный центр. Некоторые из заместителей R1, R2, R3, R4, R5, R6, R8, R9 и R10 также могут содержать, по меньшей мере, один хиральный центр, например, если R1, R2, R3, R4, R5, R6, R8, R9 или R10 представляют собой втор.-бутил.
Если соединение формулы I содержит один хиральный центр, то оно может существовать в двух энантиомерных формах. Настоящее изобретение касается как отдельных энантиометров, так и смесей этих энантиомеров. Эти энантиомерные формы можно получать по известным специальным методам. Такие методы обычно включают в себя разделение через образование диастереомерных солей или комплексов, которые можно разделить, например, путем кристаллизации; разделение через образование диастереомерных производных или комплексов, которые можно отделить, например, путем кристаллизации, газо-жидкостной или жидкостной хроматографии; селективное взаимодействие одного энантиомера со специфическим для энантиомера реагентом, например, ферментативная этерификация, окисление или восстановление с последующим разделением модифицированных или немодифицированных энантиомеров, или газо-жидкостная или жидкостная хроматография в хиральном окружении, например, на хиральном носителе, таком как двуокись кремния, связанная с хиральным лигандом, или в присутствии хирального растворителя. Установлено, что когда желаемый энантиомер преобразуют в другую химическую структурную единицу с применением одного из указанных выше методов разделения, на следующей стадии последовательно необходимо произвести отщепление желаемой энантиомерной формы. В другом случае специфические энантиомеры можно синтезировать методом асимметричного синтеза при использовании оптически активных реагентов, субстратов, катализаторов или растворителей или же путем преобразования одного энантиомера в другой методом асимметричной трансформации.
Когда соединение формулы I содержит более одного хирального центра, то оно может существовать в диастереомерных формах. Диастереомерные пары можно разделять с помощью хорошо известных каждому специалисту методов, например, методом хроматографии или кристаллизации и отдельные энантиомеры из каждой пары можно разделять в соответствии с методиками, описанными выше. Настоящее изобретение включает каждый диастереомер соединений формулы I или II или их смеси.
Определенные соединения формулы I могут существовать в более чем одной кристаллической форме, таким образом настоящее изобретение включает каждую кристаллическую форму и их смеси. Определенные соединения формулы I могут существовать, например, в форме растворов, например, в форме гидратов, и рассматриваемое изобретение касается также каждого раствора или их смесей.
Настоящее изобретение включает также фармацевтические составы, содержащие эффективное для лечения количество соединения формулы I вместе с фармацевтически приемлемым разбавителем или наполнителем. Такие фармацевтические составы могут быть использованы для лечения воспалительных явлений и/или аллергических заболеваний.
Используемый ниже термин "активное соединение" представляет собой 1-(арилалкиламиноалкил)имидазол-производный формулы I. Для лечебных целей активное соединение можно вводить орально, ректально, парэнтерально, локально, в виде глазных средств, ушных средств, в виде средств, применяемых через нос, через влагалище или трансбуккально, обеспечивая при этом местный или системный эффект. Активное соединение можно вводить также в профилактических целях. Таким образом представляемые изобретением лечебные составы могут быть приготовлены в виде известных фармацевтических форм для указанных целей применения. Составы могут быть приготовлены по известным специалистам методикам, таким образом, чтобы иметь возможность осуществлять контролирование выделения вещества из лекарственной формы, например, быстрое или контролируемое выделение представляемых изобретением соединений. Фармацевтически приемлемые наполнители и носители, применяемые для подобных целей, достаточно хорошо известны в фармацевтике. Представляемые изобретением составы содержат от 0,1 до 90% активного вещества по весу. Рассматриваемые в изобретении составы обычно готовят в однодозовой форме.
Составы для орального (через рот) применения представляют собой предпочтительные составы, соответствующие предмету изобретения, и имеют традиционную фармацевтическую форму, т.е. могут быть приготовлены в форме таблеток, капсул, гранул, сиропов, водных или масляных суспензий. Наполнители, используемые для получения таких составов, также хорошо известны специалистам в этой области.
Таблетки могут быть приготовлены из смеси активного вещества с наполнителями, например, лактозой или фосфатом кальция, разлагающимися средствами, например, кукурузным крахмалом, смазывающими средствами, например, стеаратом магния, связывающими веществами, такими как микрокристаллическая целлюлоза или поливинилпирролидон, и другими ингредиентами, позволяющими осуществлять таблетирование смесей по известным методикам. По желанию таблетки могут быть заключены в оболочку при использовании известных технологий, и для этой цели, включающей покрытие, разлагающееся в кишечнике, может быть использован, например, гидроксипропилметилцеллюлозофталат.
Таблетки могут быть получены по традиционным технологиям, обеспечивающим контролируемое и подтверждаемое выделение представляемых изобретением соединений. По желанию такие таблетки могут быть обеспечены "кишечным покрытием" по известным методикам, например, за счет использования ацетатфталата целлюлозы.
Аналогичным образом капсулы, например твердые или мягкие желатиновые капсулы, содержащие активное вещество, с добавлением наполнителя или без него, можно получать, пользуясь традиционными методами, по желанию с покрытием, разлагающимся в кишечнике по известным методам. Содержимое капсулы может быть приготовлено по известным методикам, обеспечивающим контролируемое выделение активного вещества. Представляемые изобретением составы с таким покрытием могут быть полезны в зависимости от природы активного соединения. Таблетки и капсулы обычно содержат от 1 до 1000 мг активного вещества каждая (например, 10 мг, 50 мг, 100 мг, 200 мг, 400 мг или 800 мг) активного вещества. Другие составы для орального применения включают, например, водные суспензии соединения формулы I в водной среде в присутствии нетоксичного суспендирующего агента, такого как натрий-карбоксиметилцеллюлозы, и масляные суспензии, содержащие соединение, представляемое изобретением, в подходящем для этой цели растительном масле, например, подсолнечном.
Активное вещество может быть приготовлено в гранулах с добавлением наполнителя или без него. Пациент может непосредственно проглатывать сами гранулы, либо последние можно добавлять в подходящий для этой цели жидкий носитель (например, воду) перед проглатыванием. Гранулы могут содержать разлагающие добавки (например, фармацевтически приемлемые шипучие пары, в состав которых входит кислота и карбонатная или бикарбонатная соль), обеспечивающие получение дисперсии в жидкой среде.
Представляемые изобретением составы для ректального применения представляют собой хорошо известные фармацевтические формы, имеющие указанное назначение, например, свечи с твердым жировым содержанием, а также на основе полусинтетических глицеридов или полиэтиленгликолей.
Соответствующие предмету изобретения составы для парэнтерального применения также хорошо известны в фармацевтике и представляют собой известные формы для такого назначения, например, стериальные суспензии в водной или масляной среде или стерильные растворы в подходящих для этой цели растворителях.
Составы для локального применения могут содержать матрицу, в которой диспергировано активное вещество, позволяющее поддерживать прямой контакт с кожей для непосредственного введения активного вещества трансдермальным способом. Или же активное вещество может быть диспергировано в кремовую, гелевую или мазевую основу или же применяться в виде аэрозоля. Представляемые изобретением составы, имеющие ингаляционное применение, т.е. вводимые через рот или рот и нос одновременно, также представляют собой хорошо известные фармацевтические формы и могут быть приготовлены, например, в виде аэрозолей, распыляемых растворов или порошков.
Можно использовать также строго отмеренные дозированные системы, хорошо известные каждому специалисту.
Составы, приемлемые для защечного применения, включают растворимые таблетки, пастилки, жевательную резинку, гели, порошки, средства для полоскания рта или промывки полости рта.
Представляемые изобретением соединения можно вводить также путем постоянных инфузий, либо в форме внешних введений из внешнего источника, например, внутривенных вливаний, либо из источника, размещенного в теле пациента. Внутренние источники вещества включают в себя имплантированные резервуары, содержащие подлежащее инфузии соединение, которое непрерывно выделяется внутри организма, например, в результате осмолиза, либо имплантаты, которые могут представлять собой а) жидкости, например, такие как масляные растворы или суспензии соединения, подлежащего инфузии, например, в виде очень экономичных водорастворимых производных, таких как додеканоатная соль или б) твердые вещества в виде имплантированных средств закрепления, например, синтетическую смолу или пластичный материал для выделяющегося соединения. В качестве носителя может быть использован один предмет, содержащий все соединения целиком, либо несколько таких предметов, содержащих часть соединения, выделяющегося в результате диффузии.
В некоторых составах может быть полезно использование представляемых изобретением соединений в виде частиц самого различного размера, например, получаемых в результате жидкого помола.
В представленных изобретением составах активное вещество может быть, по желанию, соединено с другими фармацевтически приемлемыми и физиологически совместимыми ингредиентами, такими как, например, а) болеутоляющее средство (например, для лечения ревматоидного артрита); б) β 2 агонист (например, при лечении астмы) и в) неседативный антигистамин (например, при лечении других аллергических заболеваний).
Фармацевтические составы, содержащие эффективное для лечения количество соединения формулы I, могут быть использованы для лечения воспалений и/или аллергических соединений, будучи введенными в организм человека. При таком лечении количество соединения формулы I, вводимого в день, колеблется в пределах от 0,1 до 3000 мг. Специфические соединения, которые можно вводить одновременно с представляемыми изобретением составами, представляют собой новые соединения, упомянутые выше.
Терапевтическая эффективность соединений формулы I была продемонстрирована в ходе опытных испытаний на обычных лабораторных животных. Такие исследования включают в себя, например, оральное введение соединений крысам, у которых вызывали воспалительные явления. Поэтому соединения формулы I могут быть использованы для лечения воспалительных заболеваний у млекопитающих. В то время как уточненное количество активного соединения, подлежащего введению в организм, зависит от множества факторов, например, возраста пациента, серьезности заболевания и истории болезни и всегда должно быть определено здравым смыслом лечащего врача, подходящая доза для энтерального введения млекопитающим, включая человека, обычно составляет от 0,01 до 80 мг/кг/день, чаще 0,2 - 40 мг/кг/день, которую вводят в виде одноразовой или разделенной на более мелкие дозы. Для парэнтерального применения приемлемая доза обычно составляет от 0,01 до 80 мг/кг/день, чаще и обычно 0,2 - 40 мг/кг/день, принимаемая в виде однократной или разделенной на более мелкие дозы форм или же путем постоянных инфузий. Оральное применение считается более предпочтительным.
Соединения формулы I и их фармацевтически приемлемые соли показаны при лечении воспалительных процессов и/или аллергических расстройств скелетных мышц, таких как, например, ревматоидный артрит, остеоартрит, красная волчанка, мышечные травмы, подагра, анкилозирующий спондилоартрит, тетадинит и бурсит, респираторные заболевания, такие как астма и ринит, заболевания желудочно-кишечного тракта, например, гастрит, гранулематозная болезнь (болезнь Крона), ульцерозный колит и другие воспалительные расстройства в области кишечника, заболевания, связанные с изменениями состояния полости рта, например парадонтоз и гингивит, заболевания кожного покрова, например, псориаз, крапивница, аллергические кожные заболевания, ожоги, воспалительные явления глаз, иирит. Соединения формулы I и их соли могут быть использованы так же как анальгетики и/или жаропонижающие средства.
С другой стороны представляемое изобретение включает также способ лечения воспалительных заболеваний и/или аллергических осложнений, включающий введение эффективного для лечения количества соединения формулы I.
Так как точный механизм действия соединений формулы I в настоящее время неизвестен, можно считать, что фармакологический эффект возникает в результате способности этих соединений ингибировать выделение арахидоновой кислоты из фосфолипидов. Далее в качестве предпочтительного аспекта представляемого изобретения представляется способ лечения воспалительных явлений и/или аллергических реакций, состоящий во введении эффективного количества ингибитора формулы I, влияющего на выделение арахидоновой кислоты.
Далее в качестве другого аспекта настоящего изобретения представляют использование соединения формулы I в производстве лекарственного средства для лечения воспалительных заболеваний и/или аллергических реакций.
Описаны способы получения соединений формулы I. Эти способы также входят в предмет изобретения.
Соединения формулы I, в которой R5 и R6 представляют собой водород, могут быть получены путем восстановления имина формулы III.
в которой
R1, R2, R3, R4, R8, R9, R10 и A имеют указанное выше значение, при использовании боргидрида натрия в присутствии инертной органической жидкости, которая предпочтительно является растворителем для соединения формулы III, например, спирта, при температуре от 0 до 150oC при атмосферном давлении.
Соединения формулы III можно получать путем конденсации соединения формулы IV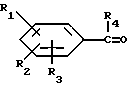
с соединением формулы V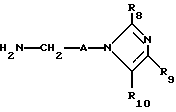
путем нагревания двух соединений при температуре от 0 до 200oC, предпочтительно от 15 до 150oC необязательно в присутствии инертной органической жидкости, которая в предпочтительном варианте является растворителем для реагентов.
Соединения формулы I можно получить по двустадийному методу в одной емкости путем реакции соединения формулы IV с соединением формулы V при нагревании при температуре от 0 до 200oC с последующим восстановлением образующегося промежуточного продукта, например, при использовании боргидрида натрия, в присутствии инертной органической жидкости, которая в предпочтительном варианте является растворителем для реагентов, например, спирта, при температуре от 0 до 150oC при атмосферном давлении.
Соединения формулы I можно получать также по одностадийному методу путем реакции соединения формулы IV с соединением формулы V в присутствии восстановителя, например, цианоборгидрида натрия в присутствии инертной органической жидкости, предпочтительно растворителя для реагентов, например, спирта, при температуре от 0 до 150oC при атмосферном давлении.
Соединения формулы I, в которой R6 представляет собой водород, можно получать путем восстановления имина формулы VI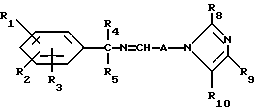
путем взаимодействия с восстановителем, например, боргидридом натрия, в присутствии инертной органической жидкости, предпочтительно растворителя для соединений формулы VI при температуре от 0 до 200oC при атмосферном давлении.
Соединения формулы VI можно получать путем конденсации соединения формулы VII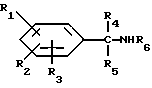
в которой
R6 представляет собой водород, с соединением формулы VIII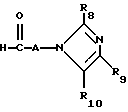
например, при нагревании двух соединений при температуре от 0 до 200oC, предпочтительно от 15 до 150oC необязательно в присутствии инертной органической жидкости, являющейся предпочтительно растворителем для реагентов, например, спирта при атмосферном давлении.
Соединения формулы I можно получать по двустадийному методу в одной емкости путем взаимодействия соединения формулы VII, в которой R6 представляет собой водород, с соединением формулы VIII, например при нагревании двух соединений при температуре от 0 до 200oC, предпочтительно от 15 до 150oC, необязательно в присутствии инертной органической жидкости, являющейся предпочтительно растворителем для реагентов, например, спирта, с непосредственным последующим восстановлением полученного промежуточного продукта путем реакции с восстановителем, например, боргидридом натрия, в присутствии инертной органической жидкости, предпочтительно растворителя для реагентов, например, спирта, при атмосферном давлении при температуре от 0 до 150oC.
Соединения формулы I можно получать по одностадийному методу в результате взаимодействия соединения формулы VII, в которой R6 представляет собой водород, с соединением формулы VIII в присутствии восстановителя, например, цианборгидрида натрия, в присутствии инертной органической жидкости, которая является, в предпочтительном варианте, растворителем для реагентов, например, спирте, при температуре от 0 до 150oC при атмосферном давлении.
Соединения формулы I можно получать путем взаимодействия соединения формулы IX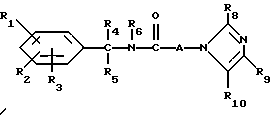
с восстанавливающим агентом, например, бор или литийалюминийгидридом, необязательно в присутствии инертного органического растворителя, который в предпочтительном варианте является растворителем для соединения формулы IX, например, эфира, при температуре от 0 до 200oC более предпочтительно от 15 до 150oC при атмосферном давлении.
Соединения формулы I, в которых R4 и R5 представляют собой водород, можно получать путем реакции соединения формулы X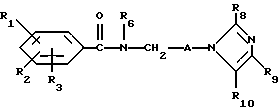
с восстановителем, например, бор- или литийалюминийгидридом, необязательно в присутствии инертной органической жидкости, являющейся предпочтительно растворителем для соединения формулы X, например, эфира, при атмосферном давлении и температуре от 0 до 200oC, преимущественно от 15 до 150oC.
Соединения формулы I можно получать путем реакции соединения формулы XI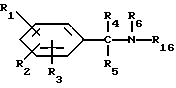
в которой
R16 представляет собой водород, с соединением формулы XII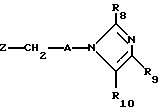
в которой
Z представляет собой отщепляемую группу, например, хлор или бром, необязательно в присутствии основания, например, триэтиламина, в присутствии инертной органической жидкости, являющейся преимущественно растворителем для реагентов, при температуре от 0 до 200oC.
Соединения формулы I, в которой R6 представляет собой водород, можно получить путем реакции соединения формулы XI, в которой R16 представляет собой гидролизуемую ацильную группу (например, формил или ацил) с соединением формулы XII, необязательно в присутствии сильного основания, такого как гидрид натрия, с последующим гидролизом.
Соединения формулы I, в которой R6 представляют собой водород, можно получить путем снятия защиты с соединений формулы XIII,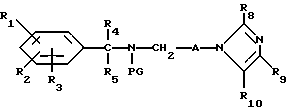
в которой
PG представляет собой защищающую аминогруппу.
Примеры приемлемых для защиты групп для аминов и методы их введения и удаления можно найти в учебнике "Защищающие группы в органическом синтезе" T.W. Green, Джон Уайли и сыновья, 1981, например, формил или ацил.
Соединения формулы I, в которой R5 не является водородом, можно получить путем реакции соединения формулы R5MgX или R5Li, в которой R5 представляет собой C1-4-алкильную группу или фенильную группу (необязательно замещенную на C1-4-алкильную группу, галоген или C1-4-алкоксигруппу) и X представляет собой галоген.
Соединения формулы I, в которой R6 представляют собой C1-4-алкильную группу, можно получить путем алкилирования соответствующего соединения формулы I, в которой R6 представляет собой водород, например, при использовании восстановительного алкилирования с применением альдегида или кетона в присутствии восстановителя, например, боргидрида натрия.
Соединения формулы I, в которой R6 представляют собой водород, можно получить путем взаимодействия соединения формулы XXIX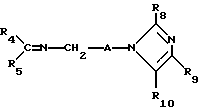
с соединением формулы XXX
в которой
R30 представляет собой группу магний или литийгалогенида формулы MgX, в присутствии органической жидкости, предпочтительно растворителя для реагентов, например, эфира, при температуре от 50 до 150oC.
Соединения формулы I можно получить путем реакции соединения формулы XXXI
в которой
L представляет собой отщепляемую группу, например, галоген, с соединением формулы V, например при нагревании в присутствии органической жидкости, предпочтительно являющейся растворителем для реагентов, при температуре от 0 до 150oC. Необязательно соединения формулы V могут быть модифицированы перед взаимодействием с соединением XXXI, для стимулирования моноалкилирования, например, путем защиты с последующим снятием защиты после реакции в соответствии с методами, хорошо известными каждому специалисту.
Соединения формулы I, в которых R1, R2, R3, R6, R8, R9 и R10 представляют собой гидроксиалкильную группу, можно получить путем восстановления соединения формулы I, в которой R1, R2, R3, R6, R8, R9 или R10 соответственно представляют собой алкоксикарбонильную или алкоксикарбонилалкильную группу, по методам, известным каждому специалисту, например, при использовании борана.
Соединения формулы IV могут быть закуплены или получены по известным специалистам методам, например в соответствии с данными, описанными в Comprehensive Organic Chemistry т. 1 (под редакцией Д.Ф. Стоддарта) и опубликованного издательством Пергаммон Пресс, 1979.
Соединения формулы V можно получить путем гидролиза соединения формулы XIV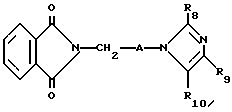
например, в присутствии водного раствора хлористоводородной кислоты или же путем реакции соединения формулы XIV с гидразином.
Соединения формулы VII могут быть закуплены или же получены по известным специалистам методам, описанным, в частности, в Comprehensive Organic Chemistry, т. 2 (под редакцией И.О. Сатерленда), опубликованного издательством Пергаммон Пресс, 1979. Предпочтительные соединения формулы VII, в которой R6 представляет собой водород, можно получить путемперегруппировки амида формулы XXV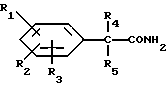
по механизму Гофманна.
Или же соединения формулы VII, в которой R6 представляет собой водород, можно получить путем реакции соединений формулы XXVI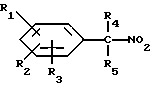
с восстановителем, например, водородом в присутствии катализатора или железа в присутствии кислоты.
Соединения формулы VIII, в которой A представляет собой -(CH2)2, можно получить путем взаимодействия акролеина с соединением формулы YH, в которой Y представляет собой группу формулы XXVII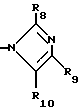
необязательно в присутствии катализатора, например, уксусной кислоты.
Соединения формулы IX можно получить путем реакции соединения формулы XV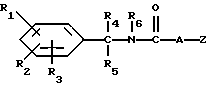
в которой
Z представляет собой отщепляющуюся группу, например, галоген, предпочтительно бром или хлор, с соединением формулы YH или М+Y-, где M+ представляет собой катион щелочного металла и Y- представляет собой анион, полученный из соединения формулы YH, в которой YH представляет собой группу формулы XXVII, имеющей указанное выше значение, например при нагревании.
Соединения формулы IX, в которой A представляет собой -(CH2)2-, можно получить путем реакции соединения формулы XVI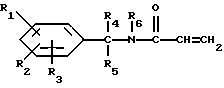
с соединением формулы YH, в которой Y представляет собой группу формулы XXVII, имеющей указанное выше значение, в присутствии катализатора (например,  -бензилтриметиламмонийгидроксида) и необязательно в присутствии органической жидкости, предпочтительно являющейся растворителем для исходных материалов, например, пиридина или 1,4-диоксана при температуре от 50 до 200oC, предпочтительно от 80 до 150oC.
-бензилтриметиламмонийгидроксида) и необязательно в присутствии органической жидкости, предпочтительно являющейся растворителем для исходных материалов, например, пиридина или 1,4-диоксана при температуре от 50 до 200oC, предпочтительно от 80 до 150oC.
Соединения формулы IX можно получить путем реакции соединения формулы XVII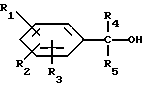
с соединением формулы NC-A-Y, в которой Y представляет собой группу формулы XXVII, например, в присутствии сильной кислоты, такой как серная кислота. Соединения формулы NC-A-Y можно получить по известным специалистам методам.
Соединения формулы IX можно получить путем реакции соединения формулы VII с соединением формулы X.CO.A.Y, в которой X представляет собой отщепляющуюся группу, например, хлор и Y представляет собой группу формулы XXVII, необязательно в присутствии основания, например, триэтиламина. Соединения формулы X. CO. A. Y. можно получить в соответствии с методами, известными каждому специалисту в этой области.
Соединения формулы X моно получить путем реакции соединений формулы XVIII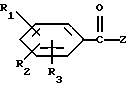
в которой Z представляет собой отщепляющуюся группу, например, галоген, предпочтительно хлор, с соединением формулы R6-NH-CH2-A-Y-, которую получают из соединений формулы V по известным специалистам методам.
Соединения формул XI и XII можно получить также известными специалистам методами.
Соединения формулы XIII можно получить путем взаимодействия соединения формулы XIX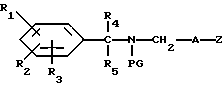
в которой
Z представляет собой отщепляющуюся группу (например, галоген) с соединением формулы YH или формулы M+Y-, имеющей указанные выше значения, например, при нагревании.
Соединения формулы XIII можно получить путем реакции соединения формулы XX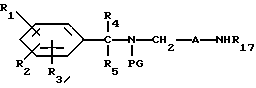
в которой
R17 представляет собой водород или формил, с имидазолобразующим синтоном, как это описано, например, в Advances in Heterocyclic Chemistry, т. 12, 103 (1970), опубликованном Экедемик Пресс.
Соединения формулы XIII, в которой R4 или R5 представляют собой группу, отличную от водорода, можно получить путем реакции соединения формулы XIII, в которой PG представляет собой активирующую защищающую группу (например, блокированную ацильную группу или формамидин) и R4 или R5 представляют собой водород соответственно, с реагентом формулы R4-Z или R5-Z соответственно, в которой Z представляет собой отщепляющуюся группу (например, галоген) в присутствии основания, например, н-бутиллития или бутилнатрийгидрата.
Соединения формулы XIII, в которой R4 и R5 представляют собой группу, отличную от водорода, и имеют различные значения, можно получить путем последовательной реакции соединения формулы XIII, в которой PG представляет собой активирующую защищающую группу (например, блокированную ацильную группу или формамид) и оба радикала R4 и R5 представляют собой водород, с реагентом формулы R4-Z и далее с реагентом формулы R5-Z или наоборот в присутствии основания, например н-бутиллития.
Соединения формулы XIII, в которой R4 и R5 имеют одинаковое значение и не являются водородом, можно получить путем реакции соединения формулы XIII, в которой PG представляет собой защищающую активирующую группу (например, блокированную ацильную группу) и R4 и R5 представляют собой оба водорода, с соединением формулы R4-Z в присутствии основания, например, н-бутиллития или гидрида натрия. Предпочтительно использование, по меньшей мере, двух моделей R4-Z и основания.
Соединения формулы XIII можно получить путем реакции соединения формулы XXIII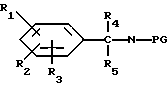
с соединением формулы X-CH2-A-Y, в которой X представляет собой отщепляющуюся группу, например, галоген, и Y представляет собой группу формулы XXVII. Соединения формулы XIII можно получить путем взаимодействия соединения формулы XXIII с соединением формулы X-CO-A-Y с последующим восстановлением. Соединения формулы X-CH2-A-Y и X-CO-A-Y можно получить по известным специалистам методам.
Соединения формулы XIV можно получить путем реакции соединения формулы XXI
в которой
Z представляет собой отщепляющуюся группу, например, галоген, предпочтительно хлор или бром, с соединением формулы YH или формулы M+Y-.
Соединения формулы XV можно получить путем реакции соединения формулы VII с ацилгалоидидом формулы X.CO.A.Z, в которой Z представляет собой отщепляющуюся группу, например, галоген, предпочтительно хлор, и X представляет собой отщепляющуюся группу, например, галоген, в присутствии основания, например, триэтиламина.
Соединения формулы XVI можно получить путем реакции соединения формулы VII с соединением формулы XXII
в которой
Z представляет собой отщепляющуюся группу, например, галоген, предпочтительно хлор.
Соединения формулы XIX можно получить путем реакции соединения формулы XXIII с соединением формулы X-CH2-A-Z, в которой X представляет собой отщепляющуюся группу и Z представляет собой отщепляющуюся группу при условии, что X более неустойчив, чем Z. Соединения формулы X-CH2-A-Z можно получить по методам, хорошо известным специалистам в этой области.
Соединения формулы XIX можно получить путем реакции соединения формулы XXIII с соединением формулы X-CO-A-Z с последующим восстановлением. Соединения формулы X-CO-A-Z, в которой X и Z представляют собой, например, галоген в качестве отщепляемой группы, можно получить по методам, известным специалистам.
Соединения формулы XX, в которой R17 представляет собой формулу, можно получить из соединений формулы XX, в которой R17 представляет собой водород, по известным специалистам методам.
Соединения формулы XX, в которой R17 представляет собой водород, можно получить путем гидролиза соединений формулы XXIV,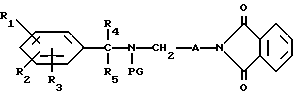
в соответствии с известными специалистам методами.
Соединения формулы XXIII можно получить из соединений формулы VII, в которой R6 представляет собой водород, также по известным специалистам методам.
Соединения формулы XXIV можно получить из соединения формулы XXIII путем алкилирующих методов, хорошо известных каждому специалисту.
Соединения формулы XXV можно получить путем гидролиза соединений формулы XXVIII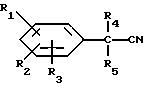
например, a) при использовании кислоты, или b) при использовании основания необязательно в присутствии окислителя, например, перекиси водорода.
Соединения формулы XXVI, в которой R4 или R5 представляют собой группу, отличную от водорода, можно получить путем реакции соединения формулы XXVI, в которой R4 или R5 представляют собой водород, соответственно с реагентом формулы R4-Z или R5-Z, в которой Z представляет собой отщепляющуюся группу (например, галоген), в присутствии основания, например, н-бутиллития или гидрида натрия.
Соединения формулы XXVI, в которой R4 и R5 представляют собой группу, отличную от водорода, и имеют различные значения, можно получить путем последовательной реакции соединения формулы XXVI, в которой R4 и R5 представляют собой водород, с реагентом формулы R4-Z и далее с реагентом формулы R5-Z или наоборот, в присутствии основания, например, н-бутиллития или гидрида натрия.
Соединения формулы XXVI, в которой R4 и R5 имеют одинаковое значение и не являются водородом, можно получить путем реакции соединения формулы XXVI, в которой R4 и R5 оба представляют собой водород, с соединением формулы R4-Z в присутствии основания, например, н-бутиллития или гидрида натрия. Предпочтительно использование, по меньшей мере, двух молей R4-Z и основания.
Соединения формулы YH, в которой Y представляет собой группу формулы XXVII, можно закупить или получить по методам, известным специалистам.
Соединения формулы XXVIII, в которой либо R4, либо R5 представляют собой группу, не являющуюся водородом, можно получить путем реакции соединения формулы XXVIII, в которой R4 или R5 представляют собой водород, соответственно с реагентом формулы R4-Z или R5-Z соответственно, в которой Z представляет собой отщепляющуюся группу (например, галоген), в присутствии основания, например, н-бутиллития или натрийгидрида.
Соединения формулы XXVIII, в которой R4 и R5 представляют собой группу, отличную от водорода, можно получить путем последовательного взаимодействия соединения формулы XXVIII, в которой R4 и R5 представляют собой водород, с реагентом формулы R4-Z и далее с реагентом формулы R5-Z или наоборот, в присутствии основания, например, н-бутиллития или натрийгидрида.
Соединения формулы XXVIII, в которой R4 и R5 имеют одинаковое значение и не являются водородом, можно получить путем реакции соединения формулы XXVIII, в которой R4 и R5 оба представляют собой водород, с соединением формулы R4-Z в присутствии основания, например, н-бутиллития или гидрида натрия. Предпочтительно использовать, по меньшей мере, два моля R4-Z и основание.
Соединения формулы XXIX можно получить путем реакции соединения формулы V с соединением формулы XXXII.
по известным специалистам методам, например, путем нагревания необязательно в присутствии органической жидкости, предпочтительно являющейся растворителем для реагентов при температуре от 0 до 150oC, предпочтительно в присутствии средств для удаления воды, например осушителя или жидкости, образующей азеотропное соединение с водой.
Соединения формул XV, XVII, XVIII, XXI, XXII и XXXI можно получить по известным специалистам методам.
Некоторые соединения формул IV, V, VI, VII и VIII считаются известными, но каждому специалисту ясно, что новые соединения можно получить по аналогичным методикам получения известных соединений указанных формул.
Некоторые промежуточные продукты, т.е. соединения формул III, IV, V, VI, VIII, IX, X, XI, XII и XIII считают новыми соединениями. Все описанные здесь новые соединения также входят в предмет изобретения.
Соединения формулы I являются противовоспалительными средствами и проявляют терапевтическую активность при дозе 200 мг/кг или ниже на стандартных лабораторных животных. Лечебная активность соединений формулы I была продемонстрирована в ходе одного или двух тестов A и/или B.
Опытные испытания серии A проводят следующим образом.
Ингибирование выделения арахидоновой кислоты из макрофагов, стимулированных зимозаном
Самок мышей MPI (весом от 20 до 25 г) забивают при использовании повышенной концентрации CO2. Мышей укладывают на спину и брюшко животных протирают 70% спиртом. Оттягивают кожу, выявляя перитональную стенку. Среду A (5 мл) (см. ниже) вводят в брюшную полость каждой мыши, после чего с помощью шприца (20 мл) и иглы 21G х 40 мм вводят примерно 1 мл воздуха для образования суспензии макрофагных клеток. Полученную суспензию отбирают в стерильный стакан и хранят на льду. Объединяют экстракт от всех животных и эту объединенную клеточную суспензию обсчитывают при использовании счетчика Култера, после чего доводят до конечного значения 1-1,3•106 клеток/мл перед мечением их (3H) арахидоновой кислотой. Обычно пяти мышей бывает достаточно для получения необходимого количества клеток для каждой многоячеистой пластины.
Достаточное количество (3H)-арахидоновой кислоты в этаноле, необходимое для получения конечной концентрации 1,6 мк Ci /мл/эквивалент 40 мк Ci /пластину/ обдувают досуха азотом. Затем повторно суспензируют арахидоновую кислоту в 1 или 2 мл клеточной суспензии, которую затем смешивают с оставшейся клеточной суспензией в склянке центрифуги. Меченую суспензию клеток выливают в стерильные пластиковые 96-плоскодонные ячеистые пластины (250 мкл на ячейку) и хранят в течение ночи при 37oC во влажной атмосфере 5% CO2, 95% воздуха.
На следующий день несклеенные ячейки удаляют путем трехразового промывания стерильным солевым раствором с добавлением фосфатного буфера (СФБ). Слипшиеся брюшинные макрофаги хранят в течение последующих 24 часов в присутствии или в отсутствие лекарственного средства, в среде (B) (см. ниже) при 37oC в атмосфере 5% CO2 для измерения действия лекарства на самопроизвольное выделение арахидоновой кислоты в отсутствие раздражителя. После такого выдерживания надосадочный слой удаляют с получением среды 1 и хранят в герметизированных многоячеистых пластинах при 4oC до проведения сцинтиляционного подсчета. Препарат, усиливающий самопроизвольное выделение арахидоновой кислоты, как полают, является токсичным в концентрации, при которой это явление происходит. Надосадочный слой заменяют свежей средой C, состоящей из свежего препарата и раздражителя. Проводят испытания трех лекарственных препаратов при шести концентрациях (100, 50, 20, 10, 5 и 1 мкМ/по 4 в каждой пластине). Другие ячейки содержат контрольное вещество, состоящее из положительного контрольного средства (например, дексаметазон), только среду (B) и только среду C.
Затем выдерживают еще 5 часов, надосадочный слой собирают с получением среды и слипшиеся клетки промывают солевым фосфатным буфером. Затем клетки подвергают лизису при использовании 100 мкл 0,1% Тритона ® Х100 в 0,1% растворе альбумина сыворотки крупного рогатого скота в 0,9% солевом растворе и механически разъединяют, получая лизаты клеток. Эти надосадочные слои (среда 2) и лизаты клеток (клетки) хранят в герметизированных многоячеистых пластинах при 4oC до проведения сцинтилляционного подсчета. 200 мкл порции среды или 100 мкл порции клеток используют для подсчета с применением 2 мл OPTIPHAZE "Hihg Safe" (торговая марка LKB) в качестве сцинтилланта.
Расчет результатов
Процент выделяющейся арахидоновой кислоты рассчитывают исходя из среднего значения для каждой группы (4 ячейки) по следующему уравнению: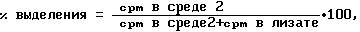
cpm - количество подсчетов в минуту.
Значения, отражающие выделение арахидоновой кислоты в отсутствие раздражителя (самопроизвольно, cpm среды 2) из клеток, которые не подвергаются раздражению или действию препарата, вычитают из всех эквивалентных значений (cpm среды 2, стимулированной действием лекарства или без него) для получения "чистого" значения стимулированного выделения. Процент ингибирования выделения арахидоновой кислоты, вызванный действием лекарства, рассчитывают исходя из следующего уравнения: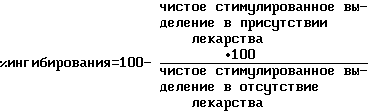
Соединения формулы I испытывают на шести концентрациях (100, 50, 20, 5 и 1 мкМ) и рассчитывают IC50-значение. Соединения с IC50 менее 100 мкМ считают активными. Перспективные соединения имеют IC50 менее 50 мкМ.
Среда A (для промывания брюшной полости)
В стерильный 100 мл мерный цилиндр вводят: 40 мл ТС199 с солями Эрла (десятикратный концентрат) (TMC), 4 мл инактивированной при нагревании сыворотки свиньи (IMC), 10 мл бикарбоната натрия (7,5% в стерильной воде), 0,4 мл раствора антибиотиков (60 мг/мл бензил-пенициллина + 100 мг/мл стрептомицина) и 0,72 мл гепарина (5000 ед/мл). Образовавшуюся смесь переносят в стерильную емкость и доводят до 400 мл стерильной водой.
Среда B (для культуры клеток)
В стерильный 250 мл мерный цилиндр вводят: 65 мл TC 199 (десятикратный концентрат) с солями Эрла (IMC), 6,5 мл инактивированной при нагревании сыворотки свиньи, 16,25 мл бикарбоната натрия (7,5% в стерильной воде), 0,65 мл раствора антибиотиков (7 указанного выше состава) и 65 мл глютамина. Смесь переносят в стерильную емкость/стакан/ и доводят до 650 мл стерильной водой.
Среда C = среда B + стимулирующее средство (зимозан)
Стимулирующее средство зимозан готовят следующим образом: зимозан (200 мг) (производства фирмы Сигма) добавляют в солевой фосфатный буфер (20 мл). Смесь кипятят в течение 30 минут, после чего восстанавливают объем до 20 мл водой. Зимозан собирают путем центрифугирования при 500 Xg в течение 5 минут, дважды промывают путем повторного суспендирования в СФБ и хранят в 1 мл порциях при -20oC. 650 мл среды B, содержащей 15 мл зимозана = 12,5 частицам (клетку получают и хранят в 3 мл порциях в холодильнике).
Тест B проводят следующим образом.
Тест на отек лапы, вызванный каррагенаном
Самок крыс весом от 125 до 159 г запирают на ночь. Одну из задних лап каждого животного маркируют у линии соединения кубовидной кости плюсны ноги (ладьевидной кости, а также пяточной кости) таранной кости ноги. Группе из шести крыс орально вводят дозу в 10 мл/кг в произвольном порядке (указанная доза исследуемого соединения вводится в виде раствора или суспензии в 10% (вес./об.) водном растворе камеди.
Через час после введения 0,1 мл 1% (вес/об) стерильного каррагенана λ в обычном солевом растворе вводят глубоко в подошвенную поверхность в маркировочную линию задней ноги каждого животного. Объем ноги (до маркировочной линии) измеряют непосредственно после произведенной инъекции при использовании показаний вытесненной воды. Через три часа после инъекции объем ноги измеряют снова и определяют процент увеличения объема относительно начального значения, рассчитанного выше.
Увеличение объема ноги (т.е. степень отека) у животных, получавших лекарства, в сравнении с контрольной группой, не проходившей такой обработки, рассматривают как степень ингибирования отека под действием лекарства.
В этом тесте соединения считаются активными, если они дают 20% и более ингибирование отека плюсны ноги в, по меньшей мере, двух или трех тестах после орального введения 100 мг/кг. Статистическую значимость оценивают при использовании теста Стъюдента для однократных дозовых исследований и теста Даннета для многократных дозовых исследований. Более перспективные соединения обнаруживают активность в обоих тестах A и B. (см. табл. 1).
Большинство перспективных соединений формулы I показывают активность в тестах A и B и последующих тестах. Вызванный каррагенаном плеврит у крыс исследуют в тесте на представляемый изобретением препарат, как описано Аккерманом и сотр. в J. Pharmacol. Exp. Therap. 1980, 215, 588-595. "Мигрирующие" лейкоциты собирают путем промывания грудной полости через 72 часа после инъекции 0,3 мл 1% λ каррагенана в стерильном изотоническом солевом растворе. Исследуемые соединения вводят перорально во время введения вещества и через 24 и 48 часов после введения.
Особенно перспективными соединениями формулы I считаются соединения, проявляющие активность в трех указанных тестах, а также в "фазе плато" следующего теста. Раннюю и позднюю стадии бронхостеноза у морских свинок после введения антигена определяют по методу, описанному Хатсоном и сотр. Am. Rev. Resper. Des. 1988, 137, 548-557. Морских свинок сенсибилизируют путем однократной внутрибрюшинной инъекции 10 мкг овальбумина и через 15 - 17 дней вводят антиген в аэрозоле (4%) в течение 5 минут после предварительной обработки мепирамином с целью предупреждения анафилаксии. Исследуемые соединения вводят перорально за 24 часа и 2 часа до введения.
Изобретение иллюстрируется следующими неограниченными примерами, в которых приводятся составы смешанных растворителей в виде объемных соотношений. Новые соединения характеризуются при использовании одного или нескольких методов анализа, а именно: элементарного анализа, метода ядерно-магнитного резонанса, инфракрасной и масс-спектроскопии. Температурные данные даются в градусах Цельсия. Аббревиатура HPIC обозначает высокоэффективную жидкостную хроматографию, ТГФ - тетрагидрофуран, ДМФ - диметилформамид, Amt - количество, Vol - объем, Temp - температура, Ex - пример, IM (технический метилированный спирт c - концентрация в граммах пробы на 100 мл раствора, с - синглет, д - дуплет, т - триплет, шир. - широкий, м - мультиплет.
Пример 1.
а) Смесь 4-хлорацетофенона (15,5 г) и 1-(3-аминопропил/имидазола (12,5 г) нагревают при температуре 110oC в течение 16 часов в атмосфере азота, после чего охлаждают до комнатной температуры.
б) Реакционную смесь растворяют в абсолютном спирте (250 мл), добавляют боргидрид натрия (7,6 г) и смесь кипятят с обратным холодильником в течение 7 часов.
в) Растворитель выпаривают и образующийся остаток растворяют в воде (220 мл). Водную смесь экстрагируют эфиром и объединенный экстракт экстрагируют 5М хлористоводородной кислотой. Объединенный экстракт хлористоводородной кислоты подщелачивают водным раствором гидроокиси натрия и затем экстрагируют эфиром. Объединенный эфирный экстракт промывают водой, сушат и фильтруют с получением после выпаривания фильтрата маслянистого продукта. Масло растворяют в эфире и обрабатывают эфирным хлористым водородом. Гигроскопическое твердое вещество собирают в процессе фильтрования. Полученное твердое вещество суспендируют в эфире и выдерживают до полного испарения растворителя. Образующееся твердое вещество сушат в вакууме при 40oC, получая при этом  -/1-/4-хлорфенил/этил/-3-/имидазол-1-ил/ пропиламиндигидрохлорид с т.пл. 182 - 183oC.
-/1-/4-хлорфенил/этил/-3-/имидазол-1-ил/ пропиламиндигидрохлорид с т.пл. 182 - 183oC.
Примеры с 2 по 23
По методике, описанной в примере 1, соединение формулы I получают а) путем реакции ацетофенона формулы IV, в которой R4 представляют собой CH3, с 1-(3-аминопропил)имидазолом (амин в таблице A) и b) путем нагревания продукта в этаноле с обратным холодильником вместе с боргидридом натрия (см. приведенную ниже таблицу A) (пример 1 включен в таблицу для сравнения). Заместители в соединении формулы IV R1, R2, R3 если нет специальных оговорок, представляют собой водород.
Соединения формулы I, получаемые в примерах 2 - 6, представляют собой:
Пример 2.  -/1-/2,4-дихлорфенил/этил/-3-/имидазол- 1-ил/пропиламин, т. кип. 155 - 165oC (0,01 мм ртутного столба).
-/1-/2,4-дихлорфенил/этил/-3-/имидазол- 1-ил/пропиламин, т. кип. 155 - 165oC (0,01 мм ртутного столба).
Пример 3.  -/1-/3,4-дихлорфенил/этил/-3-/имидазол- 1-ил/пропиламин, т. кип. 180oC (0,05 мм ртутного столба).
-/1-/3,4-дихлорфенил/этил/-3-/имидазол- 1-ил/пропиламин, т. кип. 180oC (0,05 мм ртутного столба).
Пример 4.  -/1-/4-фторфенил/этил/-3-/имидазол-1-ил/пропиламин, т. кип. 160oC (0,05 мм ртутного столба).
-/1-/4-фторфенил/этил/-3-/имидазол-1-ил/пропиламин, т. кип. 160oC (0,05 мм ртутного столба).
Пример 5.  -/1-/4-бензилоксифенил/этил/-3-/имидазол-1- ил/пропиламин, т. кип. 200oC (0,04 мм ртутного столба). Масло растирают с эфиром с получением твердого вещества с т.пл. 45 - 51oC.
-/1-/4-бензилоксифенил/этил/-3-/имидазол-1- ил/пропиламин, т. кип. 200oC (0,04 мм ртутного столба). Масло растирают с эфиром с получением твердого вещества с т.пл. 45 - 51oC.
Пример 6.  -/1-/4-диметиламинофенил/этил/-3-/имидазол-1- ил/пропиламин, т. кип. 155 - 160oC (0,05 мм ртутного столба).
-/1-/4-диметиламинофенил/этил/-3-/имидазол-1- ил/пропиламин, т. кип. 155 - 160oC (0,05 мм ртутного столба).
Далее см. таблицу A.
Примечания к таблице А:
(1) Реакционную смесь экстрагируют дихлорметаном. Полученный остаток растворяют в эфире, обрабатывают углем, фильтруют и после выпаривания фильтрата получают маслянистый продукт.
(2) По методике, описанной в примере 1, гидрохлорид, представляющий собой гигроскопический продукт, преобразуют в свободное основание при использовании для этой цели гидроокиси натрия. Полученный маслянистый продукт далее очищают путем перегонки.
(3) В качестве растворителя для экстрагирования используют дихлорметан. Остаток, полученный после удаления дихлорметана, перегоняют в вакууме.
(4) Реакцию (в) проводят при комнатной температуре при перемешивании, после чего смесь выдерживают при этой температуре в течение 64 часов.
(5) Остаток, полученный после выпаривания растворителя от экстрагирования (этилацетат), растворяют в диэтиловом эфире и обрабатывают эфирным раствором щавелевой кислоты, пока смесь не приобретет кислый характер. Осаждающийся твердый продукт собирают в результате фильтрования и сушат.
(7) После удаления этанола добавляют воду (75 мл) и концентрированный раствор гидроокиси натрия (10 мл, 20 молей). Продукт экстрагируют этилацетатом. После выпаривания объединенного экстракта получают маслянистый продукт (3,9 г), который растворяют в эфире (20 мл) и добавляют лимонную кислоту (1,9 г) в абсолютном спирте (50 мл). Смесь нагревают при 95oC в течение 5 минут, затем охлаждают и соскабливают. Жидкость над осевшим слоем сливают с полутвердого вещества. Полутвердое вещество растирают с эфиром и фильтруют. Остаток сразу же подают в сушилку при 60oC на 24 часа, после чего сушат при температуре 80oC в течение 12 часов с получением твердого гигроскопического продукта.
Соединения формулы I, полученные в примерах 7-23, представляют собой следующие вещества:
Пример 7:  -/1-/3-хлорфенил/этил/-3-/имидазол-1-ид/пропиламин, т.кип. 180-185oC (0,45 мм ртутного столба).
-/1-/3-хлорфенил/этил/-3-/имидазол-1-ид/пропиламин, т.кип. 180-185oC (0,45 мм ртутного столба).
Пример 8:  -/1-/2-хлорфенил/этил/-3-/имидазол-1-ил/пропиламин, т.кип. 130-140oC (0,02 мм ртутного столба).
-/1-/2-хлорфенил/этил/-3-/имидазол-1-ил/пропиламин, т.кип. 130-140oC (0,02 мм ртутного столба).
Пример 9:  -/1-/4-хлор-3-трифторметилфенил/этил/-3-/имидазол-1-ил/пропиламин, т.кип. 142-146oC (0,02 мм ртутного столба).
-/1-/4-хлор-3-трифторметилфенил/этил/-3-/имидазол-1-ил/пропиламин, т.кип. 142-146oC (0,02 мм ртутного столба).
Пример 10:  -/1-/4-хлор-3-фторфенил/этил/-3-имидазол-1-ил/пропиламиндигидрохлорид, т. пл. 199-201oC, после перекристаллизации из этанола
-/1-/4-хлор-3-фторфенил/этил/-3-имидазол-1-ил/пропиламиндигидрохлорид, т. пл. 199-201oC, после перекристаллизации из этанола
Пример 11: 3-/имидазол-1-ил/-  - /4-трифторметилфенил/-этил/пропиламин, маслянистый продукт, который не перегоняют.
- /4-трифторметилфенил/-этил/пропиламин, маслянистый продукт, который не перегоняют.
Пример 12:  -/1-/4-хлор-3-метилфенил/этил/-3-имидазол-1-ил/ пропиламин, маслянистый продукт, который не перегоняют.
-/1-/4-хлор-3-метилфенил/этил/-3-имидазол-1-ил/ пропиламин, маслянистый продукт, который не перегоняют.
Пример 13:  -/1-2,3,4-трихлорфенил/этил/-3-имидазол-1-ил/ пропиламиндигидрохлорид, т.пл. 211-214oC после растирания с горячим пропан-2-олом.
-/1-2,3,4-трихлорфенил/этил/-3-имидазол-1-ил/ пропиламиндигидрохлорид, т.пл. 211-214oC после растирания с горячим пропан-2-олом.
Пример 14:  -/1-/4-бромфенил/этил/-3-(имидазол-1-ил)-пропиламин, т.кип. 153-158oC (0,01 мм ртутного столба).
-/1-/4-бромфенил/этил/-3-(имидазол-1-ил)-пропиламин, т.кип. 153-158oC (0,01 мм ртутного столба).
Пример 15:  -/1-/2,5-дихлорфенил/этил/-3-/имидазол-1-ил)- пропиламин, т.кип. 170-175oC (0,5 мм ртутного столба).
-/1-/2,5-дихлорфенил/этил/-3-/имидазол-1-ил)- пропиламин, т.кип. 170-175oC (0,5 мм ртутного столба).
Пример 16: 3-/имидазол-1-ил/-  -/1-/4-феноксифенил/этил/- пропиламин, т.кип. 220oC (0,5 мм ртутного столба)
-/1-/4-феноксифенил/этил/- пропиламин, т.кип. 220oC (0,5 мм ртутного столба)
Пример 17:  -/1-/4-хлор-2-метоксифенил/этил/-3-имидазол-1-ил/-пропиламин, т.кип. 180oC (0,4 мм ртутного столба).
-/1-/4-хлор-2-метоксифенил/этил/-3-имидазол-1-ил/-пропиламин, т.кип. 180oC (0,4 мм ртутного столба).
Пример 18:  -/1-/4-хлор-2-этоксифенил/этил/-3-имидазол-1-ил/ пропиламин, т.кип. 185oC (0,5 мм ртутного столба).
-/1-/4-хлор-2-этоксифенил/этил/-3-имидазол-1-ил/ пропиламин, т.кип. 185oC (0,5 мм ртутного столба).
Пример 19:  -/1-/4-трет.-бутилфенил/этил/-3-/имидазол-1-ил/ пропиламин, т.кип. 130-140oC (0,01 мм ртутного столба).
-/1-/4-трет.-бутилфенил/этил/-3-/имидазол-1-ил/ пропиламин, т.кип. 130-140oC (0,01 мм ртутного столба).
Пример 20: этил 4-/1-/3-/имидазол-1-ил/пропиламино/этил/-бензоат, т.кип. 180oC (0,1 мм ртутного столба).
Пример 21:  -/1-/4-этилфенил/этил/-3-/имидазол-1-ил/-пропиламингемиоксалат, т.пл. 201-202oC.
-/1-/4-этилфенил/этил/-3-/имидазол-1-ил/-пропиламингемиоксалат, т.пл. 201-202oC.
Пример 22:  -/1-/4-бутоксифенил/этил/-3-/имидазол-1-ил/- пропиламиндиоксалат, т.пл. 114-116oC.
-/1-/4-бутоксифенил/этил/-3-/имидазол-1-ил/- пропиламиндиоксалат, т.пл. 114-116oC.
Пример 23: 3-/имидазол-1-ил/-  -/1-/4-трифторметоксифенил/-этил/пропиламинсескицитрат, т.пл. 143-149oC.
-/1-/4-трифторметоксифенил/-этил/пропиламинсескицитрат, т.пл. 143-149oC.
По методике, аналогичной описанной в примере 1, амины формулы Y, в которой А представляет собой группу формулы (CH2)n, вступают во взаимодействие с 4'-хлорацетофеноном (кетоном), как показано в таблице В. Заместители в соединении формулы Y, R8 R9 R10, представляют собой водород, поскольку других указаний в таблице В нет. Значения "n" приведены в таблице В.
Соединения формулы I, полученные в примерах 24-27, представляют собой следующие вещества.
Пример 24:  -/1-/4-хлорфенил/этил/-3-/4,5-диметил-имидазол-1-ил/- пропиламиндигидрохлорид, т.пл. 205-207oC, после растирания с пропан-2-олом и эфиром.
-/1-/4-хлорфенил/этил/-3-/4,5-диметил-имидазол-1-ил/- пропиламиндигидрохлорид, т.пл. 205-207oC, после растирания с пропан-2-олом и эфиром.
Пример 25:  -/1-/4-хлорфенил/этил/-3-/2-фенилимидазол-1-ил/ пропиламиндигидрохлоридгидрат, т.пл. <100oC (гигроскопический).
-/1-/4-хлорфенил/этил/-3-/2-фенилимидазол-1-ил/ пропиламиндигидрохлоридгидрат, т.пл. <100oC (гигроскопический).
Пример 26:  -/1-/4-хлорфенил/этил/-4-имидазол-1-ил/бутиламин, т.кип. 180-185oC (0,4 мм ртутного столба).
-/1-/4-хлорфенил/этил/-4-имидазол-1-ил/бутиламин, т.кип. 180-185oC (0,4 мм ртутного столба).
Пример 27:  -/1-/4-хлорфенил/этил/-3-2-метилимидазол-1-ил/- пропиламиндигидрохлорид, т.пл. 239-241oC.
-/1-/4-хлорфенил/этил/-3-2-метилимидазол-1-ил/- пропиламиндигидрохлорид, т.пл. 239-241oC.
Пример 28
По методике, аналогичной описанной в примере 1, смесь 4-хлорбензофенона (8,0 г) и 1-(3-аминопропил/имидазола (4,6 г) нагревают при 130oC в течение 12 часов. Затем смесь охлаждают, растворяют в абсолютном спирте (100 мл), обрабатывают боргидридом натрия (2,8 г) и кипятят с обратным холодильником в течение 8 часов. Полученное после обработки масло при использовании дихлорметана в качестве растворителя при экстрагировании перегоняют с получением  -( α - (4-хлорфенил)бензил)-3-(имидазол-1-ил)пропиламина с т.кип. 240oC (0,3 мм ртутного столба).
-( α - (4-хлорфенил)бензил)-3-(имидазол-1-ил)пропиламина с т.кип. 240oC (0,3 мм ртутного столба).
Пример 29
a) Концентрированную серную кислоту (5 капель) осторожно добавляют при перемешивании в смесь 3-хлорфенола (74 г) и ангидрида уксусной кислоты (64,6 г) при комнатной температуре. Затем смесь выдерживают в течение 18 часов и добавляют в воду (300 мл). Смесь экстрагируют дихлорметаном и объединенный экстракт промывают раствором бикарбоната натрия, сушат и выпаривают при пониженном давлении. Полученное масло перегоняют при вакууме, получая 3-хлорфенилацетат с т.кип. 116-118oC (2 мм ртутного столба).
b) Ацетат из п. a) (74 г) смешивают с безводным хлоридом алюминия (85 г) и нагревают при 150oC в течение 2 часов. Смесь охлаждают, затем охлаждают смесью льда и 5M хлористоводородной кислоты и пары перегоняют. Дистиллат экстрагируют диэтиловым эфиром с получением 4'-хлор-2-гидроксиацетофенона в виде маслянистого продукта, который сразу же используют в части c).
c) Ацетофенон (3,3 г) из п. b) и 1-/3-аминопропил/имидазол (7,1 г) растворяют в метаноле (30 мл). Насыщенный метанолом хлористый водород (3 мл) добавляют в полученный раствор с последующим добавлением цианборгидрида (0,84 г). Полученную смесь перемешивают при комнатной температуре в течение 48 часов, а затем выдерживают 64 часа. Концентрированную хлористоводородную кислоту (6 мл) и воду (30 мл) добавляют в смесь, после чего перемешивают в течение 10 минут. Смесь разбавляют водой, промывают дихлорметаном, подщелачивают 5M раствора гидроокиси натрия, а затем экстрагируют дихлорметаном. Объединенный экстракт сушат и выпаривают с получением маслянистого продукта, который растворяют в диэтиловом эфире и подкисляют эфирным хлористым водородом. Полученный твердый продукт отделяют путем фильтрования и сушат в вакууме с получением 5-хлор-2-(1-(3-(имидазол-1-ил)пропиламино)этил) фенолдигидрохлорида с т.пл. >300oC.
Пример 30
По методике, аналогичной описанной в примере 1, смесь 4'-хлорропиофенона (8.4 г) и 1-(3-аминопропил)-имидазола (6,3 г) нагревают при 120oC в течение 9 часов. Охлажденную смесь растворяют в абсолютном этаноле (100 мл), обрабатывают боргидридом натрия (3,9 г) и кипятят с обратным холодильником в течение 16 часов. Полученное после обработки масло растворяют в эфире и обрабатывают эфирным раствором щавелевой кислоты, пока смесь не приобретет кислый характер. Твердый продукт отфильтровывают и перекристаллизовывают из этанола с получением  -/1-/4-хлорфенил/пропил/-3-/имидазол-1-ил/- пропиламиноксалата с т.пл. 189-190oC.
-/1-/4-хлорфенил/пропил/-3-/имидазол-1-ил/- пропиламиноксалата с т.пл. 189-190oC.
Пример 31
По методике, аналогичной описанной в примере 1, смесь 4'-хлорацетофенона (4,0 г) и 1-(3-аминопропил)-2,4-диметилимидазола (4,0 г) нагревают при температуре 115-120oC в течение 7 часов, а затем восстанавливают боргидридом натрия (2,0 г) в этаноле (70 мл) более 18 часов. Полученный твердый продукт растирают с пропан-2-олом и фильтруют с получением  -/1-/4-хлорфенил/этил/-3-2,4-диметилимидазол-1-ил/- пропиламиндигидрохлорида, т. пл. 218-220oC.
-/1-/4-хлорфенил/этил/-3-2,4-диметилимидазол-1-ил/- пропиламиндигидрохлорида, т. пл. 218-220oC.
Пример 32
По методике, аналогично описанной в примере 3, смесь 4'-хлорацетофенона (7.9 г) и 3-/2-бензил-4-метилимидазол-1- ил/ пропиламина (11,7 г) нагревают при 120 - 130oC в течение 6 часов, а затем восстанавливают боргидридом натрия (2,0 г) в IMC (200 мл) в течение 16 часов. Полученный продукт представляет собой 3-/2-бензил-4-метилимидазол-1-ил/-  -/1-/4-хлорфенил/этил/пропиламин, т. кип. 185 - 195oC (0,04 мм ртутного столба). Продукт содержит 12,7% 3-/2-бензил-5-метилимидазол-1-ил/-
-/1-/4-хлорфенил/этил/пропиламин, т. кип. 185 - 195oC (0,04 мм ртутного столба). Продукт содержит 12,7% 3-/2-бензил-5-метилимидазол-1-ил/-  -/1/-4-хлорфенил/этил/ пропиламин/ по данным газожидкостной хроматографии (ГЖХ).
-/1/-4-хлорфенил/этил/ пропиламин/ по данным газожидкостной хроматографии (ГЖХ).
Пример 33
Смесь 3-/4-метил-2-фенилимидазол-1-ил/пропиламина (5,3 г) и 4'-хлорацетофенона (3,8 г) нагревают при 120 - 125oC в течение 7 часов. При охлаждении масло растворяют в абсолютном спирте (70 мл) и после добавления боргидрида натрия (7,0 г) смесь кипятят с обратным холодильником в течение 16 часов. После обработки в соответствии с примером 3 получают маслянистый продукт, который перегоняют при 185 - 205oC (0,06 мм ртутного столба). Основную фракцию повторно перегоняют с получением  -/1-/4-хлорфенил/этил/-3-/4-метил-2- фенилимидазол-1-ил/-пропиламина, т. кип. 205oC (0,04 мм ртутного столба). ГЖХ указывает на присутствие 14%
-/1-/4-хлорфенил/этил/-3-/4-метил-2- фенилимидазол-1-ил/-пропиламина, т. кип. 205oC (0,04 мм ртутного столба). ГЖХ указывает на присутствие 14%  -/1-/4-хлорфенил/-этил/-3-/5-метил-2-фенилимидазол-1-ил/пропиламина.
-/1-/4-хлорфенил/-этил/-3-/5-метил-2-фенилимидазол-1-ил/пропиламина.
Пример 34
По методике, аналогичной описанной в примере 1, при взаимодействии бензофенона (10,0 г) и 1-(3-аминопропил/--имидазола (6,9 г) получают  -бензгидрил-3-/имидазол-1-ил/пропиламиндигидрохлорид. Т. пл. 243 - 244oC.
-бензгидрил-3-/имидазол-1-ил/пропиламиндигидрохлорид. Т. пл. 243 - 244oC.
Пример 35
a) 1-/3-аминопропил/имидазол (6,3 г) добавляют при перемешивании к раствору 3,4-дихлорбензальдегида (8,75 г) в абсолютном спирте (100 мл) при комнатной температуре в атмосфере азота и перемешивают смесь еще в течение 6 часов.
b) Добавляют боргидрид натрия (1,9 г) и смесь кипятят с обратным холодильником в течение 16 часов. Смесь выпаривают досуха при пониженном давлении и образовавшийся остаток растворяют в воде (примерно 100 мл). Раствор экстрагируют этилацетатом (3х100 мл) и объединенный экстракт промывают 5М хлористоводородной кислотой (2х100 мл). Объединенную промывную кислоту подщелачивают 10 М гидроокисью натрия при ледяном охлаждении и продукт экстрагируют этилацетатом (3х100 мл). Объединенный экстракт промывают водой (100 мл), сушат над сульфатом магния и выпаривают с получением  -(3,4-дихлорбензил)-3-(имидазол-1-ил/пропиламина в виде маслянистого продукта, который не перегоняют.
-(3,4-дихлорбензил)-3-(имидазол-1-ил/пропиламина в виде маслянистого продукта, который не перегоняют.
Примеры 36 - 41
Продукты из примеров 36 - 41 получают по методике, описанной в примере 35, путем реакции соединений формулы IV, в которой R4 представляет собой водород, с 3-(имидазол-1-ил)пропиламином (амин), приведенным в таблице C. R1R2R3 представляет собой водород, так как нет специальных оговорок на этот счет (см. таблицу C).
Пример 36 -/4-бромбензил/-3-/имидазол-1-ил/пропиламин, т. кип. 185 - 200oC (0,075 мм ртутного столба).
-/4-бромбензил/-3-/имидазол-1-ил/пропиламин, т. кип. 185 - 200oC (0,075 мм ртутного столба).
Пример 37
3-(имидазол-1-ил)-  -/4-трифторметилбензид)пропиламиндигидрохлорид, т. пл. 185 -186oC.
-/4-трифторметилбензид)пропиламиндигидрохлорид, т. пл. 185 -186oC.
Пример 38
3-(имидазол-1-ил)-  -/4-трифторметоксибензил/пропиламиндигидрохлорид, т. пл. 160 - 163oC.
-/4-трифторметоксибензил/пропиламиндигидрохлорид, т. пл. 160 - 163oC.
Пример 39
3-/имидазол-1-ил/-  -/4-феноксибензил/пропиламин, т. кип. 190oC (0,02 мм ртутного столба).
-/4-феноксибензил/пропиламин, т. кип. 190oC (0,02 мм ртутного столба).
Пример 40 -/4-хлор-2-метилбензил)-3-(имидазол-1-ил)пропиламиндигидрохлорид, т. пл. 212 - 214oC
-/4-хлор-2-метилбензил)-3-(имидазол-1-ил)пропиламиндигидрохлорид, т. пл. 212 - 214oC
Пример 41 -/2,4-дихлорбензил/-3-(имидазол-1-ил/пропиламин, т. кип. 140 - 150oC (0,02 мм ртутного столба).
-/2,4-дихлорбензил/-3-(имидазол-1-ил/пропиламин, т. кип. 140 - 150oC (0,02 мм ртутного столба).
Пример 42
По методике, аналогичной описанной в примере 35, смесь 4-хлорбензальдегида (3,8 г) и 1-(3-аминопропил)-2,4-диметилимидазола (4, 1 г) в этаноле (70 мл) перемешивают, а затем восстанавливают боргидридом натрия (2,0 г).
Гидрохлоридную соль растирают с пропан -2-олом, фильтруют, а остаток промывают эфиром, затем сушат при вакууме при 45oC с получением  -/4-хлорбензил)-3-(2,4-диметилимидазол-1-ил/пропиламиндигидрохлорида, т. пл. 208 - 210oC.
-/4-хлорбензил)-3-(2,4-диметилимидазол-1-ил/пропиламиндигидрохлорида, т. пл. 208 - 210oC.
Примеры 43 - 46
По методике, аналогичной описанной в примере 35, амин формулы Y, в которой A представляет собой (CH2)n, вступает во взаимодействие с 4-хлорбензальдегидом (альдегид) с получением соединений формулы I, как показано в таблице D. R8R9R10 представляет собой водород, если нет специальных оговорок на этот счет в таблице D.
Соединения формулы I, полученные в примерах 43 - 46, представляют собой следующие соединения:
Пример 43 -/4-хлорбензил/-3-/2-метилимидазол-1-ил/-пропиламин, т. кип. 150 - 155oC (0,02 мм ртутного столба).
-/4-хлорбензил/-3-/2-метилимидазол-1-ил/-пропиламин, т. кип. 150 - 155oC (0,02 мм ртутного столба).
Пример 44 -/4-хлорбензил/-3-/4-метилимидазол-1-ил/пропиламиндигидрохлорид, т. пл. 186 - 188oC (из этанола).
-/4-хлорбензил/-3-/4-метилимидазол-1-ил/пропиламиндигидрохлорид, т. пл. 186 - 188oC (из этанола).
Пример 45 -/4-хлорбензил)-3-/4,5-диметилимидазол-1-ил/пропиламиндигидрохлорид, т. пл. 212 - 214oC.
-/4-хлорбензил)-3-/4,5-диметилимидазол-1-ил/пропиламиндигидрохлорид, т. пл. 212 - 214oC.
Пример 46 -/4-хлорбензил)-4-(имидазол-1-ил)бутиламиндигидрохлорид, т. пл. 162 - 165oC (из пропан-2-ола).
-/4-хлорбензил)-4-(имидазол-1-ил)бутиламиндигидрохлорид, т. пл. 162 - 165oC (из пропан-2-ола).
Пример 47
По методике, аналогично описанной в примере 35, смесь 4-хлорбензальдегида (5,6 г) и 1-(3-аминопропил)-2-бензил-4-метилимидазола (9,2 г) в этаноле (100 мл) перемешивают, а затем восстанавливают боргидридом натрия (1,6 г) с получением 3-(2-бензил-4-метилимидазол-1-ил/-  -/4-хлорбензил/пропиламина, т. кип. 190 - 200oC (0,04 мм ртутного столба), ГЖХ и 1H-ЯМР указывают, что продукт содержит 21% 3-/2-бензил-5-метилимидазол-1-ил/-
-/4-хлорбензил/пропиламина, т. кип. 190 - 200oC (0,04 мм ртутного столба), ГЖХ и 1H-ЯМР указывают, что продукт содержит 21% 3-/2-бензил-5-метилимидазол-1-ил/-  -/4-хлорбензил/пропиламина.
-/4-хлорбензил/пропиламина.
Пример 48
3-/4-метил-2-фенилимидазол-1-ил/пропиламин (5,5 г) и 4-хлорбензальдегид (3,6 г) перемешивают в абсолютном спирте (70 мл) в течение 16 часов. Добавляют боргидрид натрия (2,0 г) и смесь кипятят с обратным холодильником в течение 7 часов. Смесь обрабатывают по методике, описанной в примере 42, с получением  -/4-хлорбензил/-3-/4-метил-2-фенилимидазол-1-ил/пропиламина. Методом газожидкостной хроматографии определяют, что продукт содержит около 13%
-/4-хлорбензил/-3-/4-метил-2-фенилимидазол-1-ил/пропиламина. Методом газожидкостной хроматографии определяют, что продукт содержит около 13%  -/4-хлорбензил/-3-/5-метил-2-фенилимидазол-1-ил/пропиламина.
-/4-хлорбензил/-3-/5-метил-2-фенилимидазол-1-ил/пропиламина.
Пример 49.
По методике, аналогичной описанной в примере 35 при взаимодействии метил-4-формилбензоата (8,2 г) и 1-(3-аминопропил/-2-метилимидазола (5,9 г) получают 4-/3-/2-метилимидазол-1-ил/пропиламинометил/бензоат в виде масла, которое не перегоняют.
Пример 50
По методике, аналогичной описанной в примере 37, при взаимодействии молярных эквивалентов 4-метокси-2,6-диметилбензальдегида 1-(3-аминопропил)-имидазола получают 3-(имидазол-1-ил)-  -(4-метокси-2,6-диметилбензил/пропиламиндигидрохлорид, т. пл. 212-213oC (из водного пропан 2-ола).
-(4-метокси-2,6-диметилбензил/пропиламиндигидрохлорид, т. пл. 212-213oC (из водного пропан 2-ола).
Пример 51
4-формилкоричную кислоту (1,76 г) и (1-(3-аминопропил)-2-метилимидазол (2,78 г) перемешивают в метаноле (100 мл) в течение 5 часов при комнатной температуре. Добавляют боргидрид натрия (1,14 г) и продолжают перемешивать смесь в течение 2 дней при комнатной температуре. Реакционную смесь выпаривают досуха. Остаток растворяют в воде (60 мл) и промывают дихлорметаном. Водный раствор нейтрализуют 5М хлористоводородной кислотой, после чего промывают дихлорметаном. Водный слой выпаривают досуха с получением сырого 4-(3-(2-метилимидазол-1-ил)-пропиламинометил/коричной кислоты, которую кипятят с обратным холодильником в абсолютном спирте (50 мл) и концентрированной серной кислотой (1,5 мл) при перемешивании в течение 20 часов. Смесь фильтруют в горячем виде и полученный остаток растворяют в воде, подщелачивают 2М гидроокиси натрия и экстрагируют этилацетатом с получением маслянистого продукта, который растворяют в эфире и обрабатывают эфирным раствором хлористого водорода. Твердый продукт отфильтровывают и перекристаллизовывают из пропан-2-ола с получением этил 4-/3-/2-метилимидазол-1-ил/пропиламинометил/циннаматдигидрохлорида, т. пл. 109-110,5oC.
Пример 52.
a) Смесь 4'-хлорацетофенона (103,3 г), формамида (98%, 123 г) и муравьиной кислоты (97%, 8,3 мл) перемешивают при нагревании при 180oC. Образующуюся при реакции воду удаляют путем перегонки вместе с небольшим количеством исходного ацетофенона, который затем отделяют и возвращают в реакционную емкость. Муравьиную кислоту (70 мл) всего добавляют в виде небольших порций в течение 8 часов. Реакционную смесь охлаждают и полностью экстрагируют толуолом. Объединенный экстракт толуола промывают водой, сушат, фильтруют и выпаривают фильтрат. Добавляют концентрированную хлористоводородную кислоту (70 мл) к образующему остатку и полученную смесь кипятят с обратным холодильником в течение 1 часа. Затем смесь охлаждают, экстрагируют толуолом и образующийся водный слой подщелачивают с водным раствором гидроокиси натрия (5М) . Раствор перегоняют с водным паром до тех пор, пока не соберется 1,4 л дистиллата, после чего дистиллат экстрагируют этилацетатом. Объединенный этилацетатный экстракт сушат, фильтруют, после чего производят выпаривание фильтрата. Получают маслянистый продукт, который перегоняют с получением (+)-1-/4-хлорфенил/-этиламина, т. кип. 120-122oC (19 мм ртутного столба). Небольшое количество дистиллата растворяют в сухом эфире и добавляют эквивалентное количество (объем) насыщенного эфирного раствора хлористого водорода. Образовавшееся твердое вещество отфильтровывают и сушат с получением (+)-1-(4-хлорфенил)этиламингидрохлорида, т.пл. 186-189oC.
b) Раствор 3-хлорпропионилхлорида (32,7 г) в метиленхлориде (20 мл) добавляют по каплям при перемешивании в раствор (+)-1-/4-хлорфенил/этиламина (40 г) в дихлорметане (260 мл) с триэтиламином (28,4 г) в течение 45 минут при 0-5oC. Температуру повышают до 25oC и смесь перемешивают еще в течение 2 часов. Охлажденную реакционную смесь промывают насыщенным водным раствором бикарбоната натрия (260 мл). Органический слой отделяют, сушат и фильтруют, фильтрат выпаривают. Остаток растирают с бензином, отфильтровывают и перекристаллизовывают из этилацетата с получением 3-хлор-  -(1-(4-хлорфенил)-этил)пропионамида, т.пл. 86-91oC. Полученный продукт представляет собой смесь с
-(1-(4-хлорфенил)-этил)пропионамида, т.пл. 86-91oC. Полученный продукт представляет собой смесь с  -/1-/4-хлорфенил/-этил/акриламидом, но является достаточно чистым для использования для целей синтеза. Акриламид не вступает в реакцию и его удаляют при дальнейшей обработке на следующей стадии.
-/1-/4-хлорфенил/-этил/акриламидом, но является достаточно чистым для использования для целей синтеза. Акриламид не вступает в реакцию и его удаляют при дальнейшей обработке на следующей стадии.
c) Раствор 2-метилимидазола (2,64 г) в сухом тетрагидрофуране (ТГФ) (40 мл) добавляют в течение 1 минуты при перемешивании в суспензию гидрида натрия (1,54 г, 60% дисперсия в масле) в тетрагидрофуране (65 мл) в атмосфере сухого азота. Смесь перемешивают при комнатной температуре в течение 1 часа, затем кипятят с обратным холодильником и оставляют для охлаждения. Добавляют раствор 3-хлор-  -/1-/4-хлорфенил/этил/-пропионамида (5,7 г) в тетрагидрофуране (25 мл) и смесь перемешивают при кипячении с обратным холодильником в течение 16 часов. После этого смесь охлаждают и порциями добавляют воду (100 мл) при перемешивании, а затем этилацетат (200 мл). Кислотный слой отделяют и экстрагируют этилацетатом. Объединенный этилацетатный экстракт экстрагируют хлористоводородной кислотой (5М). Объединенный кислотный экстракт подщелачивают концентрированным раствором гидроокиси натрия и экстрагируют этилацетатом с получением масла. Маслянистый продукт растирают с эфиром и фильтруют с получением
-/1-/4-хлорфенил/этил/-пропионамида (5,7 г) в тетрагидрофуране (25 мл) и смесь перемешивают при кипячении с обратным холодильником в течение 16 часов. После этого смесь охлаждают и порциями добавляют воду (100 мл) при перемешивании, а затем этилацетат (200 мл). Кислотный слой отделяют и экстрагируют этилацетатом. Объединенный этилацетатный экстракт экстрагируют хлористоводородной кислотой (5М). Объединенный кислотный экстракт подщелачивают концентрированным раствором гидроокиси натрия и экстрагируют этилацетатом с получением масла. Маслянистый продукт растирают с эфиром и фильтруют с получением  -/1-/4-хлорфенил)этил)-3-(2-метилимидазол-1-ил)пропионамида, т.пл. 135-137oC.
-/1-/4-хлорфенил)этил)-3-(2-метилимидазол-1-ил)пропионамида, т.пл. 135-137oC.
d) Смесь борана и тетрагидрофурана (1М, 55 мл) добавляют в течение 5 минут при перемешивании в суспензию амида, полученную в п.с//3,21 г в сухом тетрагидрофуране (80 мл) в атмосфере азота. Смесь перемешивают в течение 5 часов, после чего выдерживают в течение 18 часов при комнатной температуре. Растворитель удаляют путем выпаривания и образующийся остаток кипятят в атмосфере азота при 100oC в течение 1 часа. Добавляют хлористоводородную кислоту и смесь продолжают нагревать еще в течение 1,5 часов. Реакционную смесь подщелачивают водным раствором гидроокиси натрия (5М) и экстрагируют этилацетатом с получением N-/1-/4-хлорфенил/этил/3-/2-метилимидазол-1-ил/пропиламина в виде маслянистого продукта.
Примеры 53-57
a) По методике, аналогичной описанной в примере 52b, образующиеся на промежуточной стадии амиды формулы XV, в которой R1 = 4-хлор, R2, R3, R5 и R6 представляют собой водород, R4 = CH3, A = (CH2)n и Z представляют собой хлор, используемые в примерах 55-57, получают путем реакции соединения формулы VII, в которой R1 = 4-хлор, R2, R3, R5 и R6 = H и R4 = CH3, с соответствующим ацилхлоридом, представленным в таблице E. (Пример 52b заключен в таблицу E для сравнения).
b) По методике, аналогичной описанной в примере 52c, соединения формулы IX, в которой R1 = 4-хлор, R2, R3, R5 и R6 = H и R4 = CH3, A = (CH2)n и n представляет собой значения, указанные в таблице F, получают путем взаимодействия соответствующего хлорамида формулы XV, в которой Z = хлор и R1, R2, R3, R4, R5, R6 и A имеют указанное выше значение, с натриевой солью формулы Na+Y-, образующейся при реакции YH, в которой Y представляет собой группу формулы XXVII, с гидридом натрия, приведенным в таблице F (пример 52c приведен для сравнения).
Примечания (к таблице F)
(1) Твердый продукт, полученный после выпаривания этилацетатного фильтрата, используют без дальнейшей очистки.
(2) Эфирную промывную жидкость после растирания выпаривают с получением бледно-желтого маслянистого продукта, который используют без дальнейшей очистки.
(3) После кипячения с обратным холодильником реакционную смесь в горячем виде фильтруют через двуокись кремния в качестве фильтрующего средства. Остаток промывают горячим тетрагидрофураном, а затем эфиром. Объединенный фильтрат промывают водой и воду повторно экстрагируют эфиром с получением маслянистого остатка.
Маслянистый остаток элюируют смесью метанола и дихлорметана (1:9) в качестве мобильной фазы при обработке на колонке с набивкой из двуокиси кремния. Двуокись кремния промывают метанолом с получением маслянистого вещества, которое используют без дальнейшей очистки.
(4) После кипячения с обратным холодильником реакционную смесь отфильтровывают и образовавшееся твердое вещество промывают горячим тетрагидрофураном. Объединенный фильтрат и промывные воды выпаривают с получением маслянистого остатка. Остаток элюируют через колонку с двуокисью кремния, используя смесь метанола: дихлорметана (1: 9) в качестве мобильной фазы. Полученное твердое вещество используют без дальнейшей очистки.
(5) По аналогии с п. (4), но без использования колонки с двуокисью кремния, фракцию Rf 0,30 выпаривают с получением твердого вещества, т. пл. 126 - 128oC.
(c) По методике, аналогичной описанной в примере 52 d, соединения формулы I получают путем восстановления амидов формулы IX, полученных в п. b), в которой A представляет собой (CH2)n, а другие заместители имеют указанное выше значение, см. п. b), с бораном, приведенным в таблице G (пример 52 d) приведен для сравнения).
Примечания.
(1) Остаток перегоняют при 160oC (0,1 мм ртутного столба), растворяют в эфире и обрабатывают эфирным раствором хлористого водорода. Полученное твердое вещество растирают с эфиром и растворяют в минимальном количестве горячего этанола. Раствор охлаждают, осаждают эфиром и затем охлаждают до 0oC с получением маслянистой смолы. Последнюю сушат и растирают некоторое время с эфиром с получением твердого вещества.
(2) Желтый маслянистый продукт перегоняют при 190oC (0,1 мм ртутного столба) с получением бесцветного масла.
(3) Прозрачный маслянистый продукт растворяют в эфире и подкисляют эфирным раствором хлористого водорода. Эфир отстаивают и твердое смолистое вещество повторно растворяют в эфире. Эфир затем выпаривают с получением маслянистого вещества, которое выделяют в виде свободного основания путем обработки с 5М гидроокисью натрия и экстрагируют эфиром с получением маслянистого вещества. Масло растворяют в эфире и подкисляют эфирным раствором щавелевой кислоты. Образующееся твердое вещество собирают путем фильтрования и перекристаллизуют из TMC с получением твердой соли.
(4) Маслянистый продукт перегоняют при 135oC (0,1 мм ртутного столба), растворяют в эфире и подкисляют эфирным раствором хлористого водорода. Образующийся твердый продукт отфильтровывают и суспендируют в эфире. Эфир выпаривают с получением твердого вещества, которое перекристаллизовывают из пропан-1-ола.
(5) Маслянистый продукт растворяют в эфире и подкисляют эфирным раствором хлористого водорода. Образующееся твердое вещество отфильтровывают и суспендируют в эфире. Затем производят выпаривание эфира с получением твердого вещества, которое перекристаллизовывают из пропан-2-ола.
Соединения формулы I, полученные в примерах 53 - 57, представляют собой следующие вещества:
Пример 53 -/1-/4-хлорфенил/этил/-3-/2-этилимидазол-1-ил/пропиламиндигидрохлорид, т. пл. 112 - 113oC.
-/1-/4-хлорфенил/этил/-3-/2-этилимидазол-1-ил/пропиламиндигидрохлорид, т. пл. 112 - 113oC.
Пример 54 -/1-/4-хлорфенил/этил/-3-/4-/5-метилимидазол-1-ил/пропиламин, т. кип. 190oC (0,1 мм ртутного столба).
-/1-/4-хлорфенил/этил/-3-/4-/5-метилимидазол-1-ил/пропиламин, т. кип. 190oC (0,1 мм ртутного столба).
Пример 55 -/1-/4-хлорфенил/этил/-5-имидазол-1-ил/пентиламиндиоксалат, т. пл. 93 - 94oC.
-/1-/4-хлорфенил/этил/-5-имидазол-1-ил/пентиламиндиоксалат, т. пл. 93 - 94oC.
Пример 56
(+)-  -/1-/4-хлорфенил/этил/-3-/имидазол-1-ил/пропиламин, дигидрохлорид, т. пл. 122 - 123oC, хиральная высокоэффективная жидкостная хроматография показывает энантиомерную чистоту продукта 98,2%.
-/1-/4-хлорфенил/этил/-3-/имидазол-1-ил/пропиламин, дигидрохлорид, т. пл. 122 - 123oC, хиральная высокоэффективная жидкостная хроматография показывает энантиомерную чистоту продукта 98,2%.
(L)22 = + 21,9o (c = 0,9 EtOH).
Пример 57
(-)  -(1-(4-хлорфенил)этил/-3-(имидазол-1-ил)пропиламиндигидрохлорид, т. пл. 180oC (неотчетливая с появлением пузырьков при 124 - 127oC). Хиральная высокоэффективная жидкостная хроматография показывает знантиомерную чистоту продукта 86,8%.
-(1-(4-хлорфенил)этил/-3-(имидазол-1-ил)пропиламиндигидрохлорид, т. пл. 180oC (неотчетливая с появлением пузырьков при 124 - 127oC). Хиральная высокоэффективная жидкостная хроматография показывает знантиомерную чистоту продукта 86,8%.
(L)22 = -21,5o (c = 0,9 EtOH).
Пример 58
(a) Раствор 3-хлор-2,2-диметилпропионилхлорида (7,0 г) в дихлорметане (50 мл) добавляют по каплям при перемешивании в раствор 1-(4-хлорфенил)этиламина (7,0 г) и триэтиламина (6,3 мл) в дихлорметане (100 мл) при 0 - 5oC в атмосфере азота. После добавления смесь перемешивают при 0oC в течение 0,5 часов, а затем при комнатной температуре 2 часа. Смесь промывают 5М хлористоводородной кислотой, а затем водой. Затем смесь сушат и выпаривают. Остаток перекристаллизовывают из петролейного эфира (т. кип. 60 - 80oC) с получением 3-хлор-N-/1-(4-хлорфенил)этил)/-2,2-диметилпропионамида, т. пл. 95 - 96oC.
(b) Смесь 3-хлор-  -/1-/4-хлорфенил/этил/-2,2-диметилпропионамида (5,0 г) и имидазола (6, 2 г), нагревают при перемешивании при температуре 125oC в течение 6 часов. Избыток имидазола удаляют путем азеотропной перегонки с толуолом при пониженном давлении. Остаток растворяют в 5М хлористоводородной кислоте и промывают дихлорметаном. Кислотный слой подщелачивают 5М раствором гидроокиси натрия и экстрагируют дихлорметаном. Объединенный экстракт промывают водой, сушат и выпаривают с получением
-/1-/4-хлорфенил/этил/-2,2-диметилпропионамида (5,0 г) и имидазола (6, 2 г), нагревают при перемешивании при температуре 125oC в течение 6 часов. Избыток имидазола удаляют путем азеотропной перегонки с толуолом при пониженном давлении. Остаток растворяют в 5М хлористоводородной кислоте и промывают дихлорметаном. Кислотный слой подщелачивают 5М раствором гидроокиси натрия и экстрагируют дихлорметаном. Объединенный экстракт промывают водой, сушат и выпаривают с получением  -/1-/4-хлорфенил/этил/-3-имидазол-1-ил/-2,2-диметилпропионамида, который используют непосредственно в п. с).
-/1-/4-хлорфенил/этил/-3-имидазол-1-ил/-2,2-диметилпропионамида, который используют непосредственно в п. с).
(c) По методике, аналогичной описанной в примере 52 d),  -/1-/4-хлорфенил/этил/-3-имидазол-1-ил/-2,2-диметилпропионамид (4,0 г) в тетрагидрофуране (100 мл) обрабатывают BH3/ТГФ (52,1 мл, 1М) с получением маслянистого продукта, который перегоняют при температуре 165oC (0,05 мм ртутного столба) и низкокипящую фракцию повторно кристаллизуют с получением
-/1-/4-хлорфенил/этил/-3-имидазол-1-ил/-2,2-диметилпропионамид (4,0 г) в тетрагидрофуране (100 мл) обрабатывают BH3/ТГФ (52,1 мл, 1М) с получением маслянистого продукта, который перегоняют при температуре 165oC (0,05 мм ртутного столба) и низкокипящую фракцию повторно кристаллизуют с получением  -/1-/4-хлорфенил/этил/-3-/имидазол-1-ил/-2,2-диметилпропиламина, т. кип. 160oC (0,03 мм ртутного столба).
-/1-/4-хлорфенил/этил/-3-/имидазол-1-ил/-2,2-диметилпропиламина, т. кип. 160oC (0,03 мм ртутного столба).
Пример 59
a) По методике, аналогичной описанной в примере 52, 1-/4-хлорфенил/-1-метилэтиламингидрохлорид (20,0 г) вступает во взаимодействие с 3-хлорпропионилхлоридом (12,3 г) в дихлорметане (250 мл), содержащем триэтиламин (27,0 мл). После подщелачивания насыщенным раствором бикарбоната натрия продукт экстрагируют дихлорметаном с получением смеси 3-хлор-N-/1-/4-хлорфенил/1-метилэтил/пропионамида (26%) и  -/1-/4-хлорфенил/1-метилэтил/акриламида (74%), который используют далее в п. b).
-/1-/4-хлорфенил/1-метилэтил/акриламида (74%), который используют далее в п. b).
b) По методике, аналогичной описанной в примере 52 c, смесь имидазола (1,05 г) и гидрида натрия (0,63 г, 60% дисперсия) в тетрагидрофуране (35 мл) обрабатывают 3-хлор-N-/1-/4-хлорфенил/1-метилэтил/пропионамидом (4,0 г) в тетрагидрофуране (15 мл) с получением N-/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/пропионамида, который используют непосредственно в части c).
c) Пропионамид, полученный в п. b (см. выше) (3,2 г) в тетрагидрофуране (100 мл) обрабатывают BH3/ТГФ /43,8 мл, 1М/ по методике, описанной в примере 52d), с получением  -/1-/4-хлорфенил/-1-метилэтил-3-/имидазол-1-ил/пропиламина, т. кип. 180oC (0,05 мм ртутного столба).
-/1-/4-хлорфенил/-1-метилэтил-3-/имидазол-1-ил/пропиламина, т. кип. 180oC (0,05 мм ртутного столба).
Пример 60
a) По методике, аналогичной описанной в примере 52c, смесь 2-метилимидазола (1,3 г) и гидрида натрия (0,63 г, 60% дисперсия) в тетрагидрофуране (35 мл) обрабатывают смесью 3-хлор-  -(1-/4-хлорфенил/-1-метилэтил)пропионамида (4,0 г) в тетрагидрофуране (15 мл) с получением
-(1-/4-хлорфенил/-1-метилэтил)пропионамида (4,0 г) в тетрагидрофуране (15 мл) с получением  -/1-/4-/хлорфенил/-1-метилэтил/-3-/2-метилимидазол-1-ил/пропионамида в виде маслянистого продукта, который используют непосредственно в п. b).
-/1-/4-/хлорфенил/-1-метилэтил/-3-/2-метилимидазол-1-ил/пропионамида в виде маслянистого продукта, который используют непосредственно в п. b).
b) Пропионамид из п. a) (1,9 г) в тетрагидрофуране (10 мл) добавляют по каплям при перемешивании в суспензию гидрида алюминия (8,27 ммолей) в тетрагидрофуране (18 мл) при 0-5oC в атмосфере азота. Смесь перемешивают при 0oC в течение 1 часа, а затем при комнатной температуре в течение 2 часов. Смесь тщательно охлаждают смесью тетрагидрофурана и воды (1:1) (25 мл). После подщелачивания 5М гидроокисью натрия и экстрагирования дихлорметаном полученный продукт еще содержит небольшое количество исходного материала. Смесь растворяют в тетрагидрофуране (5 мл) и добавляют в суспензию литийалюминийгидрида (0,25 г) в тетрагидрофуране (5 мл) при перемешивании в атмосфере азота. Смесь кипятят с обратным холодильником в течение 4 часов, затем охлаждают и тушат этилацетатом, а затем водой. Смесь фильтруют и фильтрат экстрагируют этилацетатом. Объединенный экстракт сушат и выпаривают. Остаток перегоняют с получением N-/1-/4-хлорфенил/-1-метилэтил/-3-/2-метилимидазол-1-ил/пропиламина, т. кип. 160oC (0,05 мм рт. столба)
Пример 61
a) По методике, аналогичной описанной в примере 52b, 3-хлор-2,2-диметилпропионилхлорид (27,4 г) в дихлорметане (100 мл) добавляют в 4-хлорбензиламин (25,0 г) и триэтиламин (24,6 мл) в дихлорметане (400 мл) с получением 3-хлор-  -/4-хлорбензил/-2,2-диметилпропионамида, т. пл. 97-98oC.
-/4-хлорбензил/-2,2-диметилпропионамида, т. пл. 97-98oC.
b) 3-хлорпропионамид (8,0 г) из п. a) реагирует с имидазолом (10,5 г) по методике, описанной в примере 52c с получением  -/4-/хлорбензил)-3-(имидазол-1-ил)-2,2-диметилпропионамида, который используют непосредственно в п. c).
-/4-/хлорбензил)-3-(имидазол-1-ил)-2,2-диметилпропионамида, который используют непосредственно в п. c).
c) Пропионамид (2,0 г) из п. b) обрабатывают смесью BH3/тетрагидрофурана (27,4 мл, 1 М) по методике, описанной в примере 52d, с получением  -(4-хлорбензил)-3-(имидазол-1-ил)-2,2-диметилпропиламина, т. кип. 180oC (0,4 мм ртутного столба).
-(4-хлорбензил)-3-(имидазол-1-ил)-2,2-диметилпропиламина, т. кип. 180oC (0,4 мм ртутного столба).
Пример 62
a) 1-(4-хлорфенил)-1-метилэтиламингидрохлорид (4,0 г) взаимодействует с 5-хлорпентаноилхлоридом (3,0 г) в дихлорметане (15 мл), содержащем триэтиламин (8,1 мл) по методике, описанной в примере 52b, с получением 5-хлор-  -/1-/4-хлорфенил/-1-метилэтил/пентанамида.
-/1-/4-хлорфенил/-1-метилэтил/пентанамида.
b) Хлорамид из п. a) (6,0 г) и имидазол (7,1 г) нагревают при 125oC при перемешивании в течение 6 часов. Смесь разбавляют дихлорметаном и экстрагируют 5 М хлористоводородной кислотой. Кислотный экстракт объединяют, подщелачивают 5 М раствором гидроокиси натрия и экстрагируют продукт дихлорметаном. Объединенный органический экстракт промывают водой, сушат и выпаривают с получением  -/1-4-хлорфенил/-1-метилэтил/-5-/имидазол-1-ил/пентамида, который используют непосредственно на стадии c).
-/1-4-хлорфенил/-1-метилэтил/-5-/имидазол-1-ил/пентамида, который используют непосредственно на стадии c).
c) По методике, аналогичной описанной в примере 52d, раствор N-/1-4-хлорфенил/-1-метилэтил/-5-/имидазол-1-ил/пентанамид (5,1 г) в тетрагидрофуране (125 мл) восстанавливают смесью BH3/ТГФ (63,7 мл 1 М растворами) с получением  -/1-/4-хлорфенил/-1-метилэтил/-5-/имидазол-1-ил/пентиламина в виде маслянистого продукта с т. кип. 195oC (0,05 мм ртутного столба).
-/1-/4-хлорфенил/-1-метилэтил/-5-/имидазол-1-ил/пентиламина в виде маслянистого продукта с т. кип. 195oC (0,05 мм ртутного столба).
Пример 63
a) Смесь 8-бромоктеновой кислоты (26,4 г), тионилхлорида (40 мл) и ацетонитрила (40 мл) нагревают при 95oC в течение 3 часов. Растворитель удаляют путем перегонки при вакууме и образующийся остаток очищают методом азеотропной перегонки при использовании ацетонитрила с получением 8-бромоктаноилхлорида.
b) 1-/4-Хлорфенил)-1-метилэтиламиндигидрохлорида (4,0 г) реагирует с 8-бромоктаноилхлоридом (4,0 г) в дихлорметане (50 мл), содержащем триэтиламин (8,1 мл) по методике, описанной в примере 52b с получением 8-бром-  -/1-/4-хлорфенил/-1-метилэтил/октанамида, который используют непосредственно в п. c).
-/1-/4-хлорфенил/-1-метилэтил/октанамида, который используют непосредственно в п. c).
c) По методике, аналогичной описанной в примере 62b, смесь бромамида из п. b/ (8,1 г) и имидазол (7,9 г) реагирует с получением  -/1-4-хлорфенил/-1-метилэтил/-8-/имидазол-1-ил/октанамида, который используют непосредственно в п. d).
-/1-4-хлорфенил/-1-метилэтил/-8-/имидазол-1-ил/октанамида, который используют непосредственно в п. d).
d) По методике, аналогичной описанной в примере 52d, раствор  -/1-4-хлорфенил/-1-метилэтил/-8-/имидазол-1-ил/октанамида (5,9 г) в тетрагидрофуране (130 мл) восстанавливают смесью BH3/ТГФ (64,5 мл 1 М раствора) с получением N-/1-/4-хлорфенил/-1-метилэтил/-8-/имидазол-1-ил/октиламина, т. кип. 210oC (0,05 мм ртутного столба).
-/1-4-хлорфенил/-1-метилэтил/-8-/имидазол-1-ил/октанамида (5,9 г) в тетрагидрофуране (130 мл) восстанавливают смесью BH3/ТГФ (64,5 мл 1 М раствора) с получением N-/1-/4-хлорфенил/-1-метилэтил/-8-/имидазол-1-ил/октиламина, т. кип. 210oC (0,05 мм ртутного столба).
Пример 64
a) Смесь  -/4-хлорбензил/акриламида (пример V) (3,9 г), 4,5-дихлоримидазола (2,7 г), бензилтриметиламмонийгидроксида (тритон B) (0,20 мл 40% раствора в метаноле) и пиридина (13 мл) кипятят с обратным холодильником в течение 8 часов. Смесь выпаривают при пониженном давлении и остаток растворяют в дихлорметане (100 мл). Раствор промывают водой (3х100 мл), а затем экстрагируют 5 М хлористоводородной кислотой (3х50 мл). Объединенный кислотный экстракт подщелачивают 5 М гидроокиси натрия, после чего продукт экстрагируют дихлорметаном с получением желтого маслянистого вещества, которое растирают с горячим петролейным эфиром (т. кип. 60-80oC) с получением
-/4-хлорбензил/акриламида (пример V) (3,9 г), 4,5-дихлоримидазола (2,7 г), бензилтриметиламмонийгидроксида (тритон B) (0,20 мл 40% раствора в метаноле) и пиридина (13 мл) кипятят с обратным холодильником в течение 8 часов. Смесь выпаривают при пониженном давлении и остаток растворяют в дихлорметане (100 мл). Раствор промывают водой (3х100 мл), а затем экстрагируют 5 М хлористоводородной кислотой (3х50 мл). Объединенный кислотный экстракт подщелачивают 5 М гидроокиси натрия, после чего продукт экстрагируют дихлорметаном с получением желтого маслянистого вещества, которое растирают с горячим петролейным эфиром (т. кип. 60-80oC) с получением  -(4-хлорбензил-3-/4,5)-дихлоримидазол-1-ил/пропиламида, который, по данным 1H-ЯМР -спектроскопического анализа, является достаточно чистым для использования в части п. b).
-(4-хлорбензил-3-/4,5)-дихлоримидазол-1-ил/пропиламида, который, по данным 1H-ЯМР -спектроскопического анализа, является достаточно чистым для использования в части п. b).
b) Материал из п. a) (4,2 г) растворяют в сухом тетрагидрофуране (70 мл) в атмосфере азота и добавляют комплексное соединение борана с тетрагидрофураном (51 мл, 1 М раствор) за один раз при комнатной температуре. Смесь кипятят с обратным холодильником в течение 2,5 часов, а затем выпаривают досуха при пониженном давлении. Остаток нагревают при 95oC в атмосфере азота в течение 45 минут, охлаждают, после чего добавляют 1 М хлористоводородную кислоту (60 мл). Смесь нагревают при 95oC в течение 1,5 часов. При охлаждении смесь подщелачивают концентрированным раствором гидроокиси натрия (12 М) и экстрагируют этилацетатом. Объединенный органический экстракт экстрагируют 5 М хлористоводородной кислотой и объединенный кислотный экстракт подщелачивают 5 М гидроокиси натрия. Продукт экстрагируют этилацетатом с получением масла, которое содержит небольшое количество твердого вещества. Маслянистый продукт растворяют в эфире и фильтруют с целью удаления этого твердого вещества. Фильтрат выпаривают с получением масла, которое обрабатывают эфирным раствором хлористого водорода, получая при этом  -/4-хлорбензил/-3-/4,5-дихлоримидазол-1-ил/пропиламиндигидрохлорид, т. пл. 185-187oC.
-/4-хлорбензил/-3-/4,5-дихлоримидазол-1-ил/пропиламиндигидрохлорид, т. пл. 185-187oC.
Пример 68a
(Альтернативная методика)
Смесь  -/1-/4-хлорфенил/-1-метилэтил/акриламида (200 г), имидазола (60,9 г), тритона B (20 мл) и 1,4-диоксана (1600 мл) перемешивают и кипятят с обратным холодильником в течение 20 часов. Растворитель удаляют при пониженном давлении и остаток растворяют в дихлорметане (2000 мл). Смесь экстрагируют 2 М хлористоводородной кислотой. Объединенный водный экстракт подщелачивают 2 М раствором гидроокиси натрия и экстрагируют дихлорметаном с получением N-/1-4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/пропионамида, т. пл. 154-155oC.
-/1-/4-хлорфенил/-1-метилэтил/акриламида (200 г), имидазола (60,9 г), тритона B (20 мл) и 1,4-диоксана (1600 мл) перемешивают и кипятят с обратным холодильником в течение 20 часов. Растворитель удаляют при пониженном давлении и остаток растворяют в дихлорметане (2000 мл). Смесь экстрагируют 2 М хлористоводородной кислотой. Объединенный водный экстракт подщелачивают 2 М раствором гидроокиси натрия и экстрагируют дихлорметаном с получением N-/1-4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/пропионамида, т. пл. 154-155oC.
Примеры 65-88
Соединения формулы XVI, в которой R1, R2, R3, R4 и R5 имеют значения, указанные в таблицах H1 и H2, и представляют собой водород, вступают во взаимодействие с соединениями формулы YH, в которой Y представляет собой имидазологруппу формулы XXVII, в которой R8, R9 и R10 имеют значения таблицы H1 и H2, по методике, описанной в примерах 64a и 68a (альтернативная методика) (см. таблицы H1 и H2) с получением соединений формулы IX, в которой A представляет собой (CH2)2 и R1 - R6 имеют указанные выше значения. В случаях, когда образуется смесь двух пространственных изомеров, компоненты смеси разделяют и их структуру определяют по данным 1H-ЯМР и/или 13C-ЯМР спектров путем сравнения химических сдвигов и констант сопряжения с известными замещенными имидазолами. Продукты восстанавливают по методике, описанной в примере 64b (см. таблицу 1), с получением соединений формулы I. В примерах 79, 84, 85, 86 и 88 проводят восстановление и других функциональных групп.
Далее см. таблицы H1 и H2.
Примечания к таблицам H1 и H2
(1) 2,4,5-триметилимидизол получают в соответствии с данными, приведенными в Chem., Ber., 86, 96 (1953)
(2) Остаток перекристаллизовывают из этилацетата
(3) Ксилен (20 мл) добавляют к реагентам и смесь кипятят с обратным холодильником в течение 7 часов. После обработки смеси, проведенной в соответствии с примером 62a, смесь разделяют методом флеш-хроматографии с силикагелем, элюируя смесью этилацетата и триэтиламина (9:1) в качестве мобильной фазы. Первая фракция содержит этил 1-/  -/4-хлорфенил/-1-метилэтил/-2-карбамоилэтил/-4-метилимидазол-5- карбоксилат в виде маслянистого вещества, которое не перегоняют (пример 78(a).
-/4-хлорфенил/-1-метилэтил/-2-карбамоилэтил/-4-метилимидазол-5- карбоксилат в виде маслянистого вещества, которое не перегоняют (пример 78(a).
Колонку промывают метанолом с получением этил 1-/  -/1-/4-хлорфенил/-1-метилэтил/-2-карбамоилэтил/-5-метилимидазол-4- карбоксилата, в виде масла, которое не перегоняют. Полученный продукт используют в качестве исходного материала в примере 98.
-/1-/4-хлорфенил/-1-метилэтил/-2-карбамоилэтил/-5-метилимидазол-4- карбоксилата, в виде масла, которое не перегоняют. Полученный продукт используют в качестве исходного материала в примере 98.
(4) Реакционную смесь выдерживают при комнатной температуре в течение 18 часов, после твердое вещество отделяют путем фильтрования и дважды перекристаллизовывают из этилацетата с получением  -/1-/4-хлорфенил/-1-метилэтил/-3-/формилимидазол-1-ил/пропионамида, т. пл. 151-153oC (79a), которое используют в примере 79b.
-/1-/4-хлорфенил/-1-метилэтил/-3-/формилимидазол-1-ил/пропионамида, т. пл. 151-153oC (79a), которое используют в примере 79b.
Маточный раствор от перекристаллизации объединяют и выпаривают досуха. К образовавшемуся остатку добавляют воду и полученную смесь экстрагируют дихлорметаном. Экстракт дихлорметана экстрагируют 5М хлористоводородной кислотой. Кислотный экстракт объединяют, подщелачивают и экстрагируют дихлорметаном с получением остатка, который растирают с этилацетатом и фильтруют с целью удаления изомера. Фильтрат выпаривают и остаток обрабатывают на хроматографической колонке с двуокисью кремния, элюируя смесью этилацетата (триэтиламина (9: 1) в качестве мобильной фазы с получением N-(1-(4-хлорфенил)-1-метил-3-/5-формилимидазол-1-ил/пропионамида, т.пл. 127-129oC (пример 88a), который используют в дальнейшем в примере 88b.
(5) Смесь охлаждают на льду, выдерживают до комнатной температуры, твердый продукт отфильтровывают и перекристаллизовывают из этилацетата с получением  -/1-/3,4-дихлорфенил/-1-метилэтил/-3-/4-формилимидазол-1-ил/ пропионамида, т.пл. 161-163oC. Фильтрат диоксана выпаривают досуха и остаток разделяют между водой и дихлорметаном. Объединенный дихлорметановый экстракт экстрагируют 5М хлористоводородной кислотой. Объединенный кислотный экстракт подщелачивают концентрированным раствором гидроокиси натрия и экстрагируют дихлорметаном с получением остатка, который растирают с этилацетатом и фильтруют. Полученный твердый продукт растворяют в этилацетате и обрабатывают на хроматографической колонке с двуокисью кремния, элюируя этилацетатом в качестве мобильной фазы. Получают N-/1-/3,4-дихлорфенил/-1-1-метилэтил/-3-/5-формилимидазол-1-ил/ пропионамид, т. пл. 180oC, который используют для получения в примере 84b.
-/1-/3,4-дихлорфенил/-1-метилэтил/-3-/4-формилимидазол-1-ил/ пропионамида, т.пл. 161-163oC. Фильтрат диоксана выпаривают досуха и остаток разделяют между водой и дихлорметаном. Объединенный дихлорметановый экстракт экстрагируют 5М хлористоводородной кислотой. Объединенный кислотный экстракт подщелачивают концентрированным раствором гидроокиси натрия и экстрагируют дихлорметаном с получением остатка, который растирают с этилацетатом и фильтруют. Полученный твердый продукт растворяют в этилацетате и обрабатывают на хроматографической колонке с двуокисью кремния, элюируя этилацетатом в качестве мобильной фазы. Получают N-/1-/3,4-дихлорфенил/-1-1-метилэтил/-3-/5-формилимидазол-1-ил/ пропионамид, т. пл. 180oC, который используют для получения в примере 84b.
Далее таблица I.
Примечания к таблице I.
(1) Продукт (свободное основание) экстрагируют дихлорметаном. Полученную дигидрохлоридную соль, которая представляет собой чрезвычайно гигроскопический продукт, преобразуют обратно в свободное основание путем обработки 12М гидроокиси натрия. Выделенное основание экстрагируют дихлорметаном, экстракт объединяют и выпаривают с получением продукта.
(2) Продукт экстрагируют дихлорометаном после подщелачивания, затем перегоняют.
(3) Полученное масло после обработки очищают методом флеш-хроматографии с двуокисью кремния, элюируя смесью этилацетата и триэтиламина (99:1) в качестве мобильной фазы.
Полученные соединения (см. таблицу H) представляют собой следующие вещества:
Пример 65a -/1-/4-хлорфенил/этил/-3-/2-изопропилимидазол-1-ил/- пропионамид, в виде масла, которое не перегоняют.
-/1-/4-хлорфенил/этил/-3-/2-изопропилимидазол-1-ил/- пропионамид, в виде масла, которое не перегоняют.
Пример 66a -/4-хлорфенил/этил/-3-/2,4,5-триметил-имидазол-1-ил/- пропионамид, т. пл. 141-143oC.
-/4-хлорфенил/этил/-3-/2,4,5-триметил-имидазол-1-ил/- пропионамид, т. пл. 141-143oC.
Пример 67a
N -/1-/4-хлорфенил/этил/-3-/4,5-дихлоримидазол-1-ил/- пропионамид в виде масла, которое не перегоняют.
Пример 68a -/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/ пропионамид, т.пл. 154-155oC (после перекристаллизации из этилацетата).
-/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/ пропионамид, т.пл. 154-155oC (после перекристаллизации из этилацетата).
Пример 69a
Смесь N-/1-/4-хлорфенил/-1-метилэтил/-3-/4-метилимидазол-1-ил/ пропионамида и  -/1-/4-хлорфенил/-1-метилэтил/-3-/5-метилимидазол-1-ил/ пропионамида
-/1-/4-хлорфенил/-1-метилэтил/-3-/5-метилимидазол-1-ил/ пропионамида
Пример 70a -/1-/4-хлорфенил/-1-метилэтил/-3-/4,5-диметилимидазол-1-ил/ пропионамид
-/1-/4-хлорфенил/-1-метилэтил/-3-/4,5-диметилимидазол-1-ил/ пропионамид
Пример 71a -/4-хлорбензил/-3-/2-изопропилимидазол-1-ил/пропионамид (масло).
-/4-хлорбензил/-3-/2-изопропилимидазол-1-ил/пропионамид (масло).
Пример 72a -/4-хлорбензил/-3-/2-этилимидазол-1-ил/пропионамид (масло).
-/4-хлорбензил/-3-/2-этилимидазол-1-ил/пропионамид (масло).
Пример 73a
3-/2-метилимидазол-1-ил/-  -/1-метил-1-/п-толил/этил/- пропионамид, т. пл. 133-135oC.
-/1-метил-1-/п-толил/этил/- пропионамид, т. пл. 133-135oC.
Пример 74a
N -/1-/4-хлорфенил/-1-метилэтил/-3-/4-нитроимидазол-1-ил/ пропионамид, т. пл. 165-166oC.
Пример 75a
3-/имидазол-1-ил/-  -/1-метил-1-/п-толил/этил/-пропионамид, т. пл. 120-121oC.
-/1-метил-1-/п-толил/этил/-пропионамид, т. пл. 120-121oC.
Пример 76a -/1-/4-хлорфенил/-1-этилпропил/-3-/имидазол-1-ил/- пропионамид в виде масла.
-/1-/4-хлорфенил/-1-этилпропил/-3-/имидазол-1-ил/- пропионамид в виде масла.
Пример 77a
Этил /1-/3-имидазол-1-ил/пропионамидо/-1-метилэтил/бензоат, т. пл. 118 - 119oC.
Пример 78a
Этил 1-/  -/1-/4-хлорфенил/-1-метилэтил/-2-карбамоилэтил/- 4-метилимидазол-5-кароксилат в виде масла, которое не перегоняют.
-/1-/4-хлорфенил/-1-метилэтил/-2-карбамоилэтил/- 4-метилимидазол-5-кароксилат в виде масла, которое не перегоняют.
Пример 79a -/1-/4-хлорфенил/-1-метилэтил/-3-/4-формилимидазол-1-ил/- пропионамид, т. пл. 151 - 153oC.
-/1-/4-хлорфенил/-1-метилэтил/-3-/4-формилимидазол-1-ил/- пропионамид, т. пл. 151 - 153oC.
Пример 80a -/1-этил-1-фенилпропил-3-/имидазол-1-ил/пропионамид в виде масла.
-/1-этил-1-фенилпропил-3-/имидазол-1-ил/пропионамид в виде масла.
Пример 81a -/1-4-бифенилил/-1-метилэтил/-3-/имидазол-1-ил/пропионамид в виде масла.
-/1-4-бифенилил/-1-метилэтил/-3-/имидазол-1-ил/пропионамид в виде масла.
Пример 82a
N-/1-/4-хлорфенил/циклопроп-1-ил/-3-/имидазол-1-ил/пропионамид, т. пл. 135,5 - 136,5oC.
Пример 83a
3-/имидазол-1-ил/-  -/1-метил-1-/2-нафтил/этил/пропионамид
-/1-метил-1-/2-нафтил/этил/пропионамид
Пример 84a
N-1-/3,4-дихлорфенил/-1-метилэтил/-3-/5-формилимидазол-1-ил/пропионамид, т. пл. 180 - 181,5oC (см. таблицу H2, примечание 5).
Пример 85a
N-/1-/4-бифенил/-1-метилэтил/-3-/4-формилмидазол-1-ил/- пропионамид, т. пл. 171 - 172oC.
Пример 86a
N-/1-этил-1-фенилпропил/-3-/4-формилимидазол-1-ил/-пропионамид, т. пл. 142 - 143,5oC.
Пример 87a
N-/1-/4-бензилоксифенил/-1-метилэтил/-3-/имидазол-1-ил/- пропионамид, т. пл. 187 - 189oC.
Соединения, представленные в таблице I, являются следующими веществами:
Пример 65b
N-/1-/4-хлорфенил/этил/-3-/2-изопропил-имидазол-1-ил/- пропиламин, в виде масла, которое не перегоняют.
Пример 66b
N-/1-/4-хлорфенил/этил/-3-/2,4,5-триметилимидазол-1-ил/- пропиламин в виде масла, которое не перегоняют.
Пример 67b
N-/1-/4-хлорфенил-этил/-3-/4,5-дихлоримидазол-1-ил/- пропиламинсесквигидрохлорид, т. пл. 248 - 250oC (при разложении).
Пример 68b
N-/1-/4-хлорфенил/-1-/метилэтил/-3-/имидазол-1-ил/-пропиламин в виде масла, т. кип. 180oC (0,05 мм ртутного столба). Пробу полученного масла растворяют в эфире и добавляют эфирный раствор хлористого водорода. Полученное твердое вещество собирают путем выпаривания, сушат и перекристаллизуют из пропан-2-ола с получением N-/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1- ил/пропиламиндигидрохлорида, т. пл. 216 - 218oC (пример 68(2)).
Пример 69b
Смесь  -/1-/4-хлорфенил/-1-метилэтил/-3-/4-метилимидазол-1- ил/пропиламина и
-/1-/4-хлорфенил/-1-метилэтил/-3-/4-метилимидазол-1- ил/пропиламина и  -/1-/4-хлорфенил/-1-метилэтил/-3-/5- метилимидазол-1-ил/пропиламина, представляющего собой масло, т. кип. 160 - 170oC (0,1 мм ртутного столба).
-/1-/4-хлорфенил/-1-метилэтил/-3-/5- метилимидазол-1-ил/пропиламина, представляющего собой масло, т. кип. 160 - 170oC (0,1 мм ртутного столба).
13 C-ЯМР-спектроскопический анализ показывает, что соотношение 4-метил-изомера: 5 метил-изомера составляет 2:1
Пример 70b -/1-/4-хлорфенил/-1-метилэтил/-3-/4,5-диметилимидазол-1- ил/пропиламин, т. кип. 165oC (0,05 мм ртутного столба).
-/1-/4-хлорфенил/-1-метилэтил/-3-/4,5-диметилимидазол-1- ил/пропиламин, т. кип. 165oC (0,05 мм ртутного столба).
Пример 71b -/4-хлорбензил/-3-/2-изопропилимидазол-1- ил/пропиламиндигидрохлорид, т. пл. 189 - 192oC.
-/4-хлорбензил/-3-/2-изопропилимидазол-1- ил/пропиламиндигидрохлорид, т. пл. 189 - 192oC.
Пример 72b -/4-хлорбензил)-3-(2-этилимидазол-1-ил)-пропиламин, т. пл. 155 - 165oC (0,1 мм ртутного столба
-/4-хлорбензил)-3-(2-этилимидазол-1-ил)-пропиламин, т. пл. 155 - 165oC (0,1 мм ртутного столба
Пример 73b
3-/2-метилимидазол-1-ил/-  -/1-метил-1-/п-толил/этил/- пропиламиндигидрохлорид, т. пл. 255oC (при разложении).
-/1-метил-1-/п-толил/этил/- пропиламиндигидрохлорид, т. пл. 255oC (при разложении).
Пример 74b -/1-/4-хлорфенил/-1-метилэтил/-3-/4-нитроимидазол-1-ил/- пропиламин в виде масла, которое не перегоняют. Продукт очищают методом флеш-хроматографии с двуокисью кремния, элюируя смесью этилацетата/метанола в качестве мобильной фазы.
-/1-/4-хлорфенил/-1-метилэтил/-3-/4-нитроимидазол-1-ил/- пропиламин в виде масла, которое не перегоняют. Продукт очищают методом флеш-хроматографии с двуокисью кремния, элюируя смесью этилацетата/метанола в качестве мобильной фазы.
Пример 75b
3-/имидазол-1-ил/-  -/1-метил-1-/п- толил/этил/пропиламиндигидрохлорид, т. пл. 206oC (при разложении)
-/1-метил-1-/п- толил/этил/пропиламиндигидрохлорид, т. пл. 206oC (при разложении)
Пример 76b
1/4-Хлорфенил/-1-этил-3'-(имидазол-1- ил)дипропиламиндигидрохлорид, т. пл. 208 - 211oC.
Пример 77b
Этил 4-/1-/3-имидазол-1-ил/пропиламино-1-метилэтил/-бензоат в виде масла, которое не перегоняют
Пример 78b
Этил 1-/3-/1-/4-хлорфенил/-1-метилэтиламино/пропил/-4- метилимидазол-5-карбоксилат в виде масла, которое не перегоняют.
Пример 79b
1-/3-/1-/4-хлорфенил/-1-метилэтиламино/-пропил/имидазол-4- ил-метанол, т. пл. 103 - 104oC.
Пример 80b -/1-этил-1-фенилпропил/-3-/имидазол-1-ил/пропиламин, т. кип. 140 - 150oC (0,02 мм ртутного столба)
-/1-этил-1-фенилпропил/-3-/имидазол-1-ил/пропиламин, т. кип. 140 - 150oC (0,02 мм ртутного столба)
Пример 81b
-1/1-/4-бифенил/-1-метилэтил/-3-/имидазол-1- ил/пропиламиндигидрохлорид, т. пл. 222 - 226oC.
Пример 82b -/1-/4-хлорфенил/циклопро-1-ил/-3-/имидазол-1- ил/пропиламиндигидрохлорид, т. пл. 188 - 189oC.
-/1-/4-хлорфенил/циклопро-1-ил/-3-/имидазол-1- ил/пропиламиндигидрохлорид, т. пл. 188 - 189oC.
Пример 83b -/1-/2-нафтил/-1-метилэтил/-3-/имидазол-1- ил/пропиламиндигидрохлоридполугидрат, т. пл. 219 - 222oC
-/1-/2-нафтил/-1-метилэтил/-3-/имидазол-1- ил/пропиламиндигидрохлоридполугидрат, т. пл. 219 - 222oC
Пример 84b
1-/3-/4-/3,4-дихлорфенил/-1-метилэтиламино/пропил/имидазол- 5-илметанол, т. пл. 117 - 118oC
Пример 85b
Полученный остаток после обработки перекристаллизовывают из смеси циклогексана и этилацетата (5:7) с получением 1-/3-/1- /4-бифенилил/-1-метилэтиламино/пропил/имидазол-4-илметанола, т. пл. 128 - 129oC
Пример 86b
Полученный после обработки остаток перекристаллизируют из циклогексана с получением 1-/3-/1-этил-1- фенилпропиламино/пропилимидазол-4-илметанола, т. пл. 82 - 84oC.
Пример 87b -/1-/4-бензилоксифенил/-1-метилэтил/-3-/имидазол-1- ил/пропиламиндигидрохлорид, т. пл. 186 - 187oC
-/1-/4-бензилоксифенил/-1-метилэтил/-3-/имидазол-1- ил/пропиламиндигидрохлорид, т. пл. 186 - 187oC
Пример 88b
1-/3-/1-/4-хлорфенил/-1-метилэтиламино/пропил/имидазол-5- илметанолдигидрохлорид, т. пл. 165 - 169oC.
Пример 89
a) По методике, аналогичной описанной в примере 52b, 1-/4-хлорфенил/-1-метилэтиламингидрохлорид (2,5 г) обрабатывают 4-хлорбутирилхлоридом (1,7 г) в дихлорметане (30 мл), содержащем триэтиламин (3,4 мл) с получением 4-хлор-  -/1-/4-хлорфенил/-1- метилэтил/бутиламида, который используют непосредственно на стадии b).
-/1-/4-хлорфенил/-1- метилэтил/бутиламида, который используют непосредственно на стадии b).
b) Хлорбутиламид (3,1 г) со стадии a) и имидазол (3,8 г) нагревают при 125oC в течение 6 часов. Смесь охлаждают, растворяют в 5М хлористоводородной кислоты, после чего промывают дихлорметаном. Водную фазу подщелачивают 5М гидроокисью натрия, а затем экстрагируют дихлорметаном. Объединенный экстракт сушат и выпаривают с получением  -/1-/4-хлорфенил/-1-метилэтил/-4- имидазол-1-ил/бутирамида, который используют непосредственно на стадии c).
-/1-/4-хлорфенил/-1-метилэтил/-4- имидазол-1-ил/бутирамида, который используют непосредственно на стадии c).
c) Бутирамид (2,9 г) из п. b) восстанавливают смесью борана с тетрагидрофураном (37,1 мл, 1М) по методике, описанной в примере 52d, с получением  -/1-/4-хлорфенил-1-метилэтил/-4-(имидазол-1- ил/бутиламина, т. кип. 160oC (0,01 мм ртутного столба).
-/1-/4-хлорфенил-1-метилэтил/-4-(имидазол-1- ил/бутиламина, т. кип. 160oC (0,01 мм ртутного столба).
Пример 90 -/1-/4-хлорфенил/этил/-3-имидазол-1-ил/пропиламиндигидрохлорид (1,7 г, полученного в примере 1) добавляют порциями в муравьиную кислоту (1,2 г, 97%) при 0oC. Формальдегид (0,96 г, 37%) добавляют в образовавшуюся смесь, после чего последнюю нагревают при 95oC в течение 6 часов. После охлаждения добавляют концентрированную хлористоводородную кислоту (0,6 мл) и выпаривают раствор досуха при пониженном давлении. Остаток растворяют в воде, подщелачивают 5М раствора гидроокиси натрия и экстрагируют продукт эфиром. Объединенный экстракт сушат и выпаривают. Полученное масло растворяют в эфире и обрабатывают эфирным раствором хлористого водорода. Образовавшуюся гидрохлоридную соль, представляющую собой гигроскопический продукт, подщелачивают 5М гидроокисью натрия с получением
-/1-/4-хлорфенил/этил/-3-имидазол-1-ил/пропиламиндигидрохлорид (1,7 г, полученного в примере 1) добавляют порциями в муравьиную кислоту (1,2 г, 97%) при 0oC. Формальдегид (0,96 г, 37%) добавляют в образовавшуюся смесь, после чего последнюю нагревают при 95oC в течение 6 часов. После охлаждения добавляют концентрированную хлористоводородную кислоту (0,6 мл) и выпаривают раствор досуха при пониженном давлении. Остаток растворяют в воде, подщелачивают 5М раствора гидроокиси натрия и экстрагируют продукт эфиром. Объединенный экстракт сушат и выпаривают. Полученное масло растворяют в эфире и обрабатывают эфирным раствором хлористого водорода. Образовавшуюся гидрохлоридную соль, представляющую собой гигроскопический продукт, подщелачивают 5М гидроокисью натрия с получением  -/-1-/4-хлорфенил/этил/-3-/имидазол-1-ил/-
-/-1-/4-хлорфенил/этил/-3-/имидазол-1-ил/-  - метилпропиламина в виде масла, которое не перегоняют.
- метилпропиламина в виде масла, которое не перегоняют.
Пример 91 -/1-/4-хлорфенил/пропил/-3-/имидазол-1-ил/пропиламин (13,9 г, свободное основание из примера 30) добавляют порциями в муравьиную кислоту (11,75 г, 98 - 100%) при 0oC. Добавляют формальдегид (9,6 г, 37%) и смесь нагревают при 95oC в течение 6 часов. После обработки в соответствии с данными примера 90 получают
-/1-/4-хлорфенил/пропил/-3-/имидазол-1-ил/пропиламин (13,9 г, свободное основание из примера 30) добавляют порциями в муравьиную кислоту (11,75 г, 98 - 100%) при 0oC. Добавляют формальдегид (9,6 г, 37%) и смесь нагревают при 95oC в течение 6 часов. После обработки в соответствии с данными примера 90 получают  -/1-/4-хлорфенил/пропил/-3-/имидазол-1-ил/-
-/1-/4-хлорфенил/пропил/-3-/имидазол-1-ил/-  -метилпропиламина в виде масла, которое не перегоняют.
-метилпропиламина в виде масла, которое не перегоняют.
Пример 92
a) Раствор (±)-  /(1-(4-хлорфенил)этил)-3-(имидазол-1- ил)пропиламин (5,3 г), полученного в примере 1, в этаноле (10 мл), смешивают с раствором D /-/-винной кислоты (3,0 г) в этаноле (50 мл) и кипятят с обратным холодильником при перемешивании, пока не выпадет в осадок бесцветное вещество. Смесь охлаждают, твердый продукт отфильтровывают, промывают им с получением /-/-N-/1-/4-хлорфенил/-этил-3-/имидазол-1- ил/пропиламина/-/-дитартрата, т. пл. 180 - 183oC (при разложении). По данным хиральной высокоэффективной жидкостной хроматографии чистота энантиомера составляет 98,1%.
/(1-(4-хлорфенил)этил)-3-(имидазол-1- ил)пропиламин (5,3 г), полученного в примере 1, в этаноле (10 мл), смешивают с раствором D /-/-винной кислоты (3,0 г) в этаноле (50 мл) и кипятят с обратным холодильником при перемешивании, пока не выпадет в осадок бесцветное вещество. Смесь охлаждают, твердый продукт отфильтровывают, промывают им с получением /-/-N-/1-/4-хлорфенил/-этил-3-/имидазол-1- ил/пропиламина/-/-дитартрата, т. пл. 180 - 183oC (при разложении). По данным хиральной высокоэффективной жидкостной хроматографии чистота энантиомера составляет 98,1%.
Пример 93
a) Смесь (±)-N-/1-/4-хлорфенил/этил/-3-имидазол-1-ил/- пропиламина (15,8 г), полученного аналогично примеру 1, в ТМС (50 мл) смешивают с раствором 1(+)-винной кислоты (9,0 г) в ТМС (100 мл). Смесь доводят до объема 300 мл с помощью ТМС и кипятят с обратным холодильником при аккуратном перемешивании до тех пор, пока не выпадет в осадок твердое вещество. Смесь охлаждают, твердый продукт отфильтровывают, промывают ТМС и перекристаллизовывают дважды из ТМС с получением (+)-N-/1-/4-хлорфенил/этил/-3-/имидазол-1-ил/пропиламин- /+/дитартрата, т. пл. 181 - 183oC (при разложении). По данным хиральной высокоэффективной жидкостной хроматографии, энантиомерная чистота составляет 94,1%.
Пример 94
Продукт из примера 49 (4,0 г), пропан-1-ол (50 мл) и концентрированную серную кислоту (2,0 мл) кипятят с обратным холодильником в течение 22 часов. Растворитель удаляют при пониженном давлении и остаток растворяют в воде (50 мл) и подщелачивают 5М раствором гидроокиси натрия. Продукт экстрагируют этилацетатом. После перегонки получают пропил 4-/3-/2-метилимидазол-1-ил/пропиламинометил/бензоат, т. пл. 185 - 195oC (0,05 мм ртутного столба).
Пример 95
По методике, аналогичной описанной в примере 70, 5-хлор-N-/4-хлорбензил/валерамид (10,3 г, полученного из 4-хлорбензиламина и 5-хлорвалерилхлорида) и 2-метилимидазола (6,5 г) реагирует с получением  -/4-хлорбензил/-5-/2-метилимидазол-1- ил/валерамида (6,5 г), т. пл. 72 - 75oC, который восстанавливают смесью борана с тетрагидрофураном (86 мл, 1М) с получением
-/4-хлорбензил/-5-/2-метилимидазол-1- ил/валерамида (6,5 г), т. пл. 72 - 75oC, который восстанавливают смесью борана с тетрагидрофураном (86 мл, 1М) с получением  -/4- хлорбензил)-5-(2-метилимидазол-1-ил)пентиламина, т. кип. 170 - 185oC (0,1 мм ртутного столба).
-/4- хлорбензил)-5-(2-метилимидазол-1-ил)пентиламина, т. кип. 170 - 185oC (0,1 мм ртутного столба).
Пример 96
По аналогии с примером 90,  -/1-/4-хлорфенил/-1-метилэтил/-3- /имидазол-1-ил/пропиламин реагирует с формальдегидом и муравьиной кислотой с получением
-/1-/4-хлорфенил/-1-метилэтил/-3- /имидазол-1-ил/пропиламин реагирует с формальдегидом и муравьиной кислотой с получением  -/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/-
-/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/-  -метилпропиламина, т. пл. 170oC (0,03 мм ртутного столба)
-метилпропиламина, т. пл. 170oC (0,03 мм ртутного столба)
Пример 97
По аналогии с примером 90,  -/4-хлорбензил/-3-/2-метилимидазол- 1-ил/пропиламин обрабатывают формальдегидом и муравьиной кислотой с получением
-/4-хлорбензил/-3-/2-метилимидазол- 1-ил/пропиламин обрабатывают формальдегидом и муравьиной кислотой с получением  -/4-хлорбензил/-
-/4-хлорбензил/-  -метил-3-/2-метилимидазол-1-ил/ пропиламина, т. кип. 160 - 166oC (0,2 мм ртутного столба).
-метил-3-/2-метилимидазол-1-ил/ пропиламина, т. кип. 160 - 166oC (0,2 мм ртутного столба).
Пример 98
а) По методике, аналогичной примеру 64b, смесь этил-1-/-  -/1-(4-хлорфенил/-1-метилэтил/-2-карбамоилэтил/-5- метилимидазол-4-карбоксилат (28,8 г, из примера 78) вступает во взаимодействие со смесью борана с тетрагидрофураном (303,4 мл, 400 мл ТГФ), 1,0 М раствор дают 1-/3-/1-/4-хлорфенил/-1- метилэтиламино/пропил/-5-метилимидазол-4-илметанол, т. пл. 97 - 99oC.
-/1-(4-хлорфенил/-1-метилэтил/-2-карбамоилэтил/-5- метилимидазол-4-карбоксилат (28,8 г, из примера 78) вступает во взаимодействие со смесью борана с тетрагидрофураном (303,4 мл, 400 мл ТГФ), 1,0 М раствор дают 1-/3-/1-/4-хлорфенил/-1- метилэтиламино/пропил/-5-метилимидазол-4-илметанол, т. пл. 97 - 99oC.
б) Раствор ацетилхлорида (8,7 г) в дихлорметане (35,5 мл) добавляют по каплям при перемешивании в раствор 1-/3-/1-/4- хлорфенил/-1-метилэтиламино/пропил/-5-метилимидазол-4-илметанола (3,55 г) в дихлорметане (88,8 мл), содержащем триэтиламин (11,1 г) при 0oC. Смесь перемешивают при 0oC в течение 30 мин и далее при комнатной температуре еще 2 часа. Смесь разбавляют дихлорметаном, промывают 5М раствором гидроокиси натрия, сушат и выпаривают. Полученный остаток растворяют в эфире и подкисляют эфирным раствором хлористого водорода. Твердый продукт отфильтровывают и перекристаллизуют из водного раствора пропан-1-ола с получением 1-/3-/1-/4-хлорфенил/-1-метилэтиламино/пропил/-5-метилимидазол-4- илметилацетатдигидрохлорид, т. пл. 188 - 189oC.
Пример 99 -/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/пропиламин (1,25 г) и лимонную кислоту (0,95 г) растворяют в теплом ТМС (10 мл) и оставляют до охлаждения. После выдерживания, сопровождающегося эпизодическим соскребанием, выкристаллизовывается соль. Образующуюся соль отфильтровывают, растирают со смесью этилацетат/метанол (1:1), снова фильтруют и сушат с получением
-/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/пропиламин (1,25 г) и лимонную кислоту (0,95 г) растворяют в теплом ТМС (10 мл) и оставляют до охлаждения. После выдерживания, сопровождающегося эпизодическим соскребанием, выкристаллизовывается соль. Образующуюся соль отфильтровывают, растирают со смесью этилацетат/метанол (1:1), снова фильтруют и сушат с получением  -/1-/4-хлорфенил/-1-метилэтил/- 3-/имидазол-1-ил/пропиламинцитрат, т. пл. 143 - 145oC.
-/1-/4-хлорфенил/-1-метилэтил/- 3-/имидазол-1-ил/пропиламинцитрат, т. пл. 143 - 145oC.
Пример 100 -/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/пропиламин (2,57 г) и L-/+/-винную кислоту (1,39 г) растворяют в теплом ТМС (10 мл) и оставляют для охлаждения. При соскребании получают выкристаллизовавшуюся соль. Соль отфильтровывают и перекристаллизовывают из ТМС с получением
-/1-/4-хлорфенил/-1-метилэтил/-3-/имидазол-1-ил/пропиламин (2,57 г) и L-/+/-винную кислоту (1,39 г) растворяют в теплом ТМС (10 мл) и оставляют для охлаждения. При соскребании получают выкристаллизовавшуюся соль. Соль отфильтровывают и перекристаллизовывают из ТМС с получением  -/1-/4-хлорфенил/-1- метилэтил/-3-/имидазол-1-ил/пропиламин/+/тартратдигидрата, т. пл. 76 - 78oC.
-/1-/4-хлорфенил/-1- метилэтил/-3-/имидазол-1-ил/пропиламин/+/тартратдигидрата, т. пл. 76 - 78oC.
Пример 101
a) По методике, аналогичной описанной в примере 68a (альтернативный вариант), смесь  -/1-/4-хлорфенил/-1-метилэтил/акриламида (6,7 г) 2-изопропилимидазол (3,3 г), 1,4-диоксан (100 мл) и бензилтриметиламмонийгидроксид (тритон B) (5 мл 40% раствора в метаноле) дает
-/1-/4-хлорфенил/-1-метилэтил/акриламида (6,7 г) 2-изопропилимидазол (3,3 г), 1,4-диоксан (100 мл) и бензилтриметиламмонийгидроксид (тритон B) (5 мл 40% раствора в метаноле) дает  -/1-/4-хлорфенил/- 1-метилэтил/-3-/2-изопропилимидазол-1-ил/пропионамид в виде масла, которое не перегоняют.
-/1-/4-хлорфенил/- 1-метилэтил/-3-/2-изопропилимидазол-1-ил/пропионамид в виде масла, которое не перегоняют.
b) По методике, аналогичной указанной в примере 65b, смесь амида из п. a) (5,8 г) и борана с тетрагидрофураном (70 мл, 1М раствор) дает  -/1-4-хлорфенил/-1-метилэтил/-3-/2-изопропилимидазол-1- ил/пропиламиндигидрохлорид, т. пл. 156oC.
-/1-4-хлорфенил/-1-метилэтил/-3-/2-изопропилимидазол-1- ил/пропиламиндигидрохлорид, т. пл. 156oC.
Пример 102
a) Натрий (26,7 г) растворяют в метаноле ( 600 мл) и охлаждают раствор до -45oC. Добавляют по каплям бром при интенсивном перемешивании, пока температура не установится на уровне -45oC. Как только произойдет изменение цвета, медленно добавляют раствор 2-метил-2/п-толил/-пропион амида (69,3 г) в 1,4-диоксане (257 мл) и метанол (350 мл). Добавление производят в течение 20 минут при -45oC. Смесь оставляют нагреваться постепенно до 20oC, после чего начинается выделение тепла и температура поднимается до 50oC. Экзотермический процесс контролируют с применением внешнего охлаждения. Затем смесь кипятят с обратным холодильником в течение 4,5 часов, и растворитель удаляют при пониженном давлении. Остаток разбавляют 5М раствора гидроокиси натрия и экстрагируют эфиром с получением  -/1-метил-1-/п-толил/этил/карбамата, т. пл. 42 - 43oC.
-/1-метил-1-/п-толил/этил/карбамата, т. пл. 42 - 43oC.
b) Смесь карбамата из п. a) (4,0 г),  -бромсукцинамида (3,8 г), четыреххлористого углерода (80 мл) и азобисизобуктиронитрила (0,12 г) кипятят с обратным холодильником с течение 18 часов. Смесь охлаждают, промывают водой, сушат, фильтруют, а растворитель удаляют путем перегонки при пониженном давлении с получением N -/1-/4-бромметилфенил-1-метилэтил/карбамата, т. пл. 74 - 76oC.
-бромсукцинамида (3,8 г), четыреххлористого углерода (80 мл) и азобисизобуктиронитрила (0,12 г) кипятят с обратным холодильником с течение 18 часов. Смесь охлаждают, промывают водой, сушат, фильтруют, а растворитель удаляют путем перегонки при пониженном давлении с получением N -/1-/4-бромметилфенил-1-метилэтил/карбамата, т. пл. 74 - 76oC.
c) Раствор цианида калия (24,4 г) в воде (70 мл) добавляют по каплям в течение 20 минут при 50oC в смесь продукта из п. b) (60,0 г) в ацетонитриле (500 мл). Смесь кипятят с обратным холодильником в течение 1 часа, затем растворитель удаляют при пониженном давлении. Остаток разбавляют водой и экстрагируют эфиром с получением остатка, который перекристаллизовывают из петролейного эфира, т. кип. 60 - 80oC (пропан-2-ол, с получением N -/1-/4- цианометилфенил/-1-метилэтил/карбамата, т. пл. 88 - 90oC.
d) Триметилсилилиодид (24,0 г) добавляют в течение 5 минут в раствор продукта из п. c) (28,0 г) в хлороформе (200 мл) при перемешивании в атмосфере азота при комнатной температуре. Смесь продолжают перемешивать при 60oC в течение 2,5 часов, затем охлаждают смесью воды со льдом, тушат насыщенным метанольным раствором хлористого водорода (20 мл) и перемешивают при температуре окружающей среды еще в течение 1 часа. Растворитель удаляют при пониженном давлении и остаток разбавляют эфир (250 мл) и перемешивают при той же температуре в течение 64 часов. Смесь фильтруют с получением 4-/1-амино-1-метилэтил/фенилацетонитрила.
e) Продукт из п. d) (8,0 г) и 6М хлористоводородной кислоты (100 мл) кипятят с обратным холодильником в течение 6 часов. Образующийся в результате отстаивания верхний слой жидкости сливают с нерастворимого продукта и выпаривают при пониженном давлении. Остаток хранят в условиях вакуума над пятиокисью фосфора в течение 16 часов. Остаток кипятят с обратным холодильником в пропан-1-оле (300 мл), содержащем концентрированную серную кислоту (5 мл) при 95oC в течение 64 часов. Растворитель удаляют при пониженном давлении и остаток разбавляют водой и промывают эфиром. Водный кислотный слой подщелачивают 5М раствором гидроокиси натрия и экстрагируют эфиром с получением пропил-4-/1-амино-1-метилэтил/фенилацетата в виде маслянистого продукта.
f) Раствор акрилоилхлорида (1,7 г) в дихлорметане (15 мл) добавляют по каплям в смесь продукта из п. e) (4,32 г), триэтиламина (2,6 мл) и дихлорметана (50 мл) при перемешивании в атмосфере азота. Смесь перемешивают при 0oC в течение 30 минут, а затем при комнатной температуре 2,5 часа. Смесь разбавляют дихлорметаном, промывают водой и органический слой сушат и выпаривают с получением маслянистого остатка. Образовавшийся остаток очищают методом флеш-хроматографии на двуокиси кремния, элюируя петролейным эфиром, т. кип. 60-80oC/этилацетатом (2: 1) в качестве мобильной фазы с получением пропил-4-/1-акриламидо-1-метилэтил/фенилацетата, т.пл. 71-72oC.
g) Смесь продукта из п. f) (1,7 г), имидазол (0,4 г), бензилтриметиламмонийгидроксид (Тритон ® B) (4,9 мг 40% раствора в метаноле) и 1,4-диоксан (20 мл) нагревают при 95oC в течение 18 часов. После обработки описанным в примере 68a способом (альтернативный вариант), но при использовании этилацетата в качестве экстрагирующего средства получают пропил 4/1-/3-/имидазол-1-ил/пропионамидо/-1-метилэтил/-фенилацетат в виде маслянистого продукта. Структуру продукта подтверждают по данным 1H ЯМР-спектроскопии.
h) Продукт из п. g) (460 мг), смесь борана и тетрагидрофурана (3,9 мл 1M раствора) и ТГФ (20 мл) перемешивают при комнатной температуре в течение 6 часов. Растворитель удаляют при пониженном давлении и добавляют пропан-1-ол (20 мл), насыщенный газообразным хлористым водородом. Смесь нагревают при 95oC в течение 1 часа, растворитель удаляют при пониженном давлении. Остаток добавляют в воду и раствор промывают этилацетатом. Водный кислотный слой отделяют, затем подщелачивают 5M раствором гидроокиси натрия и продукт экстрагируют этилацетатом с получением масла. Масло очищают методом флеш-хроматографии с двухокисью кремния, элюируя смесью метанола и этилацетата (1: 1) в качестве мобильной фазы, с получением пропил 4-/1-/3-/имидазол-1-ил/пропиламино/-1-метилэтил/фенил-ацетата в виде маслянистого продукта.
1H ЯМР (250 мГц) (CDCl3), 0,91 (3H, т), 1,42 (6H, с), 1,5 (1H, с.шир.), 1,65 (2H, секстет), 1,83 (2H, пентаплет), 2,32 (2H, т), 3,61 (2H, с), 3,98 (2H, т), 6,83 (1H, с), 7,02 (1H, с) и 7,2-7,45 (5H, м).
Пример 103
Раствор ацетилхлорида (0,24 мл) в дихлорметане (6 мл) добавляют по каплям в раствор 1-(3-(1-этил-1-фенилпропиламино)-пропил/имидазол- 4-илметанола (10 г, из примера 86b) в дихлорметане (18 мл), содержащем триэтиламин (0,46 мл) при перемешивании при температуре 0oC. Смесь продолжают перемешивать при указанной температуре 30 минут, затем при комнатной температуре еще 2 часа. После обработки описанным в примере 98b способом, но без обработки эфирным раствором хлористого водорода, получают 1-/3-/ α, α- диэтилбензиламино/пропил/имидазол-4-ил-метилацетат в виде маслянистого продукта.
Пример 104
Для получения продукта в виде капсул 10 частей на вес активного соединения и 240 частей на вес лактозы соединяют вместе и перемешивают. Смесь заполняют в жесткие желатиновые капсулы, каждая капсула содержит 10 мг активного вещества.
Пример 105
Таблетки получают из следующих ингредиентов (части на вес):
Активное вещество - 10
Лактоза - 190
Кукурузный крахмал - 22
Поливинилпирролидон - 10
Стеарат магния - 3
Активное вещество, лактозу и некоторое количество крахмала соединяют, перемешивают и полученную смесь гранулируют с раствором винилпирролидона в этаноле. Сухой гранулят перемешивают со стеаратом магния и остальным крахмалом. Смесь прессуют в таблетирующей машине с получением таблеток, содержащих 10 мг активного вещества.
Пример 106
Таблетки получают в соответствии с методом, описанным в предыдущем примере. Таблетки заключают в покрытия, растворяющиеся в кишечнике по традиционной методике при использовании раствора 20% ацетатфталата целлюлозы и 3% диэтилфталата в смеси этанола и дихлорметана (1:1).
Пример 107
Для получения лекарственной формы, представляющей собой свечи, 100 частей по весу активного вещества соединяют с 1300 частями по весу полусинтетических глицеридов в качестве основы для свечей и смесь перерабатывают в суппозории, содержащие по 100 мг активного ингредиента.
Пример 108
Для получения капсул 50 частей по весу активного вещества 300 частей лактозы и 3 части по весу стеарата магния соединяют вместе и перемешивают. Смесь заключают в жесткие желатиновые капсулы, каждая из которых содержит 50 мг активного ингредиента.
Пример 109
Активное соединение накладывают на основу методом гомогенизации, пока не произойдет равномерного распределения лекарства. Мазь расфасовывают в 10 г затемненные банки с завинчивающейся крышкой.
Активное вещество - 0,1 г
белый мягкий парафин - До 10 г
Получение исходных веществ
Используемые в примерах исходные материалы являются коммерчески доступными, т. е. всегда имеются в продаже, или же могут быть получены через Fine Chemicals Directory (Файн Кемикелз Директори).
2,4-диметилимидазол и 2-бензил-4/5/-метилимидазол получают с фирмы Полиорганикс Инкорпорейшн МА.
A/5/-метил-2-фенилимидазол является продуктом фирмы TCI (Токио Казей Когайо Корпорейшн, Лтд).
4-формилимидазол получают от Майбридж Кемикл Корпорейшн, Лтд). В соответствии с описанными в литературе методами были получены следующие вещества: 4,5-диметилимидазол (Chem. Ber. 86, 88 (1953), 2,4,5-триметилимидазол (Chem. Ber. 86, 96 (1953) и 2-бензоилимидазол (Synthesis, 1978, 675).
Пример A
а) Раствор имидазола (13,6 г) в сухом диметилформамиде (50 мл) добавляют по каплям при перемешивании в суспензию гидрида натрия (8,0 г 60% дисперсия в масле) в сухом ДМФ (250 мл) при комнатной температуре в атмосфере азота в течение 2,5 часов. Суспензию  -/4-бромбутил/фталимида (53,6 г) в сухом ДМФ (80 мл) добавляют в полученную смесь, после чего нагревают образовавшуюся массу при 95oC в течение 16 часов. Растворитель выпаривают при вакууме и остаток экстрагируют горячим толуолом. Объединенный экстракт толуола выпаривают досуха, а полученный остаток растирают с эфиром и сушат с получением
-/4-бромбутил/фталимида (53,6 г) в сухом ДМФ (80 мл) добавляют в полученную смесь, после чего нагревают образовавшуюся массу при 95oC в течение 16 часов. Растворитель выпаривают при вакууме и остаток экстрагируют горячим толуолом. Объединенный экстракт толуола выпаривают досуха, а полученный остаток растирают с эфиром и сушат с получением  -(4-имидазол-1-ил/бутил/фтальимида, т. пл. 76 - 79oC.
-(4-имидазол-1-ил/бутил/фтальимида, т. пл. 76 - 79oC.
b) Смесь фтальимида (19,5 г) и хлористоводородной кислоты (6М, 226 мл) кипятят с обратным холодильником в течение 8 часов, после чего выдерживают при комнатной температуре 18 часов. Смесь охлаждают до 0oC в течение 2 часов и образующееся твердое вещество отфильтровывают. Фильтрат выпаривают досуха и остаток разделяют на две порции между этилацетатом и водой. Водный слой подщелачивают концентрированным раствором гидроокиси натрия и экстрагируют дихлорметаном. Объединенный экстракт дихлорметана сушат, фильтруют и фильтрат выпаривают с получением 4-/имидазол-1-ил/бутиламина в виде маслянистого продукта, который перегоняют при 120oC (0,45 мм ртутного столба).
Пример B.
a) Раствор 2-фенилимидазола (14,4 г) в сухом диметилформамиде (25 мл) добавляют по каплям при перемешивании в суспензию гидрида натрия (4,0 г, 60% дисперсия в масле) в сухом ДМФ (125 мл) при комнатной температуре в атмосфере азота в течение 2 часов. Суспензию  -/3-бромпропил/фтальимида (25,5 г) в сухом ДМФ (40 мл) добавляют по каплям в полученную смесь и образовавшуюся массу нагревают при 100oC в течение 16 часов. Растворитель выпаривают и образующийся остаток экстрагируют горячим толуолом. Объединенный экстракт толуола выпаривают досуха и остаток растирают с эфиром и сушат с получением
-/3-бромпропил/фтальимида (25,5 г) в сухом ДМФ (40 мл) добавляют по каплям в полученную смесь и образовавшуюся массу нагревают при 100oC в течение 16 часов. Растворитель выпаривают и образующийся остаток экстрагируют горячим толуолом. Объединенный экстракт толуола выпаривают досуха и остаток растирают с эфиром и сушат с получением  -/3-/2-фенилимидазол-1-ил/пропил/-фтальимида, т. пл. 109 - 110oC.
-/3-/2-фенилимидазол-1-ил/пропил/-фтальимида, т. пл. 109 - 110oC.
b) Смесь  -/3-/2-фенилимидазол-1-ил/-пропил/фтальимида (17,0 г), гидроокись натрия (1,1 г) и воду (5,4 г) нагревают при 95oC в течение 48 часов. При охлаждении добавляют смесь концентрированной хлористоводородной кислоты (66 мл) и воды (13 мл) и кипятят смесь с обратным холодильником в течение 6 часов. После выдерживания при комнатной температуре в течение 16 часов смесь фильтруют и фильтрат выпаривают досуха при пониженном давлении. Остаток обрабатывают водой (16 мл), затем охлаждают и добавляют гидроокись натрия (24 г) порциями. Раствор экстрагируют диэтиловым спиртом, а затем дихлорметаном. Объединенный органический экстракт сушат и выпаривают с получением маслянистого продукта, который перегоняют при пониженном давлении с получением 3-/2-фенилимидазол-1-ил/пропиламина, т. кип. 128oC (0,05 мм ртутного столба).
-/3-/2-фенилимидазол-1-ил/-пропил/фтальимида (17,0 г), гидроокись натрия (1,1 г) и воду (5,4 г) нагревают при 95oC в течение 48 часов. При охлаждении добавляют смесь концентрированной хлористоводородной кислоты (66 мл) и воды (13 мл) и кипятят смесь с обратным холодильником в течение 6 часов. После выдерживания при комнатной температуре в течение 16 часов смесь фильтруют и фильтрат выпаривают досуха при пониженном давлении. Остаток обрабатывают водой (16 мл), затем охлаждают и добавляют гидроокись натрия (24 г) порциями. Раствор экстрагируют диэтиловым спиртом, а затем дихлорметаном. Объединенный органический экстракт сушат и выпаривают с получением маслянистого продукта, который перегоняют при пониженном давлении с получением 3-/2-фенилимидазол-1-ил/пропиламина, т. кип. 128oC (0,05 мм ртутного столба).
Пример C
Раствор 4'-хлор-2'-гидроксиацетофенона (1,0 г) в сухом ДМФ (5 мл) добавляют при перемешивании в смесь гидрида натрия (0,235 г, 60% дисперсия) в сухом ДМФ (5 мл) при 5oC в атмосфере азота. После добавления смесь перемешивают при 0oC в течение 15 минут, а затем при комнатной температуре в течение 1 часа. Раствор йодометана (0,92 г) в сухом ДМФ (5 мл) добавляют по каплям в образовавшуюся смесь, поддерживая температуру на уровне ниже 10oC. Реакционную смесь перемешивают при комнатной температуре в течение 5 часов, а затем выдерживают в течение 16 часов. Для подщелачивания смеси добавляют раствор карбоната калия и экстрагируют продукт дихлорметаном. Объединенный экстракт сушат и выпаривают. Остаток растворяют в эфире, промывают водой, затем сушат и выпаривают с получением 4'-(хлор-2'-метоксиацетофенона, метоксиацетофенона, который является достаточно чистым для использования для синтетических целей в примере 17.
Пример D
По методике, аналогичной описанной в примере C, 4'-хлор-2'-гидроксиацетофенон (1,0 г) обрабатывают гидридом натрия (0,235 г, 60% дисперсия), а затем йодэтаном (1,0 г) в ДМФ (15 мл, всего) с получением 4'-хлор-2'-этоксиацетофенона, т. пл. 92 - 93oC) после перекристаллизации из петролейного эфира, т. кип. 60 - 80oC).
Пример E
Раствор н-бутиллития в гексане (30,4 мл, 2,5 М) добавляют по каплям при перемешивании в атмосфере азота в раствор N,N,N-триметилэтилендиамина (7,9 г) в сухом тетрагидрофуране (150 мл) при -15 до -20oC. После добавления смесь перемешивают при -23oC в течение 15 минут, а затем при температуре минус 15 - 20oC добавляют по каплям 4-хлорбензальдегид (10,0 г). После добавления смесь перемешивают при -23oC в течение 15 минут, а затем еще добавляют по каплям н-бутиллитий в гексане (85,4 мл, 2,5 М) при -15oC. Смесь продолжают перемешивать при -23oC в течение 3 часов, охлаждают до -40oC и добавляют йодометан (60,6 г) при температуре -40 до -20oC. После добавления смесь перемешивают при -40oC в течение 5 минут, затем оставляют нагреваться до комнатной температуры и перемешивают при этой температуре 30 минут. Смесь осторожно выливают на охлаждаемую льдом 10% хлористоводородную кислоту (2 л) и выдерживают в течение 64 часов. Смесь экстрагируют диэтиловым эфиром с получением маслянистого продукта, который дважды перегоняют при вакууме с получением 4-хлор-2-метилбензальдегида, с т. кип. 105 - 110oC (15 мм ртутного столба), который является достаточно чистым для использования в синтетических целях в примере 40.
Пример F
1) По методике, аналогичной описанной в примере A, смесь 2,4-диметилимидазола (24,0 г) добавляют в суспензию гидрида натрия (10,0 г, 60% дисперсия) в диметилформамиде (300 мл). После перемешивания в течение 1,5 часов добавляют диметилформамид (80 мл), а затем суспензию  -(3-бромпропил/фтальимида (63,8 г) в диметилформамиде (100 мл). После окончания реакции смесь обрабатывают, как описано в примере A, и остаток растирают с петролейным эфиром, т. кип. 60-80oC, а затем с эфиром. Остаток перекристаллизируют из этилацетата с получением
-(3-бромпропил/фтальимида (63,8 г) в диметилформамиде (100 мл). После окончания реакции смесь обрабатывают, как описано в примере A, и остаток растирают с петролейным эфиром, т. кип. 60-80oC, а затем с эфиром. Остаток перекристаллизируют из этилацетата с получением  -/3-диметилимидазол-1-ил/пропил/фтальимида, т. пл. 191-192oC. По данным 1H-ЯМР-спектроскопии обнаруживают присутствие примерно 10%
-/3-диметилимидазол-1-ил/пропил/фтальимида, т. пл. 191-192oC. По данным 1H-ЯМР-спектроскопии обнаруживают присутствие примерно 10%  -/3-/2,5-диметилимидазол-1-ил/пропил/фтальимида.
-/3-/2,5-диметилимидазол-1-ил/пропил/фтальимида.
2) Фтальимид из п. 1) растворяют в TMC (600 мл) и обрабатывают гидразингидратом (19,3 г) при комнатной температуре при перемешивании. После перемешивания в течение 3 дней смесь фильтруют и остаток промывают TMC. Объединенный фильтрат и промывные воды выпаривают досуха. Остаток обрабатывают 10M гидроокисью натрия и смесь экстрагируют дихлорметаном. Объединенный органический экстракт промывают соляным раствором, сушат и выпаривают с получением 3-/2,4-диметилимидазол-1-ил/пропиламина в виде масла. По данным 1H-ЯМР-спектроскопии определяют присутствие 10% 3-/2,5-диметилимидазол-1-ил/пропиламина.
Примеры G - J
По методике, аналогичной описанной в примере F (1), соединения формулы XXI, в которой A представляет собой (CH2)2 и Z представляет собой бром, вступают во взаимодействие с имидазолами формулы YH, в которой Y представляет собой группу формулы XXVII, в которой R8, R9 и R10 имеют указанное ниже значение, с получением соединений формулы XIV (см. таблицу 1). Соединения формулы XIV обрабатывают в дальнейшем гидразингидратом по методике, описанной в примере F(2) с получением соединений формулы Y, в которой A представляет собой -(CH2)2 (см. таблицу K).
Соединения, полученные и представленные в таблице J:
Пример G(1): -/3-/2-метилимидазол-1-ил/пропил/фтальимид, т. пл. 119-121oC.
-/3-/2-метилимидазол-1-ил/пропил/фтальимид, т. пл. 119-121oC.
Пример H(1): -/3-/4,5-диметилимидазол-1-ил/пропил/фтальимид, т. пл. 119-121oC после перекристаллизации из этилацетата
-/3-/4,5-диметилимидазол-1-ил/пропил/фтальимид, т. пл. 119-121oC после перекристаллизации из этилацетата
Пример I(1): -/3-/4-метилимидазол-1-ил/пропил/фтальимид, т. пл. 82-90oC.
-/3-/4-метилимидазол-1-ил/пропил/фтальимид, т. пл. 82-90oC.
Пример J(1): -/3-/2-бензил-4-метилимидазол-1-ил/пропилфтальимид в виде масла.
-/3-/2-бензил-4-метилимидазол-1-ил/пропилфтальимид в виде масла.
Соединения, полученные и представленные в таблице K:
Пример G (2):
3-метилимидазол-1-ил/пропиламин в виде масла, которое не перегоняют.
Пример H/2/:
3-/4,5-диметилимидазол-1-ил/пропиламин в виде масла, которое не перегоняют.
Пример I/2/:
3-/4-метилимидазол-1-ил/пропиламин в виде масла, которое не перегоняют.
По данным 1H-ЯМР-спектроскопии обнаружено наличие примерно 33% 3-/5-метилимидазол-1-ил/пропиламина.
Пример J/2/:
3-/2-бензил-4-метилимидазол-1-ил/пропиламин, т. кип. 160-165oC при 0,35 мм ртутного столба. По данным анализа методом газожидкостной хроматографии обнаружено наличие примерно 20% 3-/2-бензил-5-метилимидазол-1-ил/пропиламина.
Пример K
(а) (+)-1-/4-хлорфенил/этиламин получают, как описано в примере 52а.
(+) Энантиомер (исходный продукт для примера 56) получают по традиционной методике, описанной ниже. Смесь (+) -/4-хлор-фенил/этиламина (73 г) и D/-/винной кислоты (70 г) в техническом метилированном спирте (TMC) (4,2 л) выдерживают при комнатной температуре в течение 2 дней. Образовавшийся твердый продукт отфильтровывают, промывают TMC и перекристаллизовывают из TMC с получением (+) 1-/4-хлорфенил/-этиламин (-)-тартрата, т. пл. 195-199oC. Соль суспендируют в воде и подщелачивают водным раствором аммиака (удельный вес 0,88). Смесь экстрагируют диэтиловым спиртом с получением (+)-4/-хлорфенил/-этиламина, который перегоняют при 120-125oC (30 мм ртутного столба). Хиральная высокоэффективная жидкостная хроматография показала чистоту энантиомерного продукта 97,4%.
(-)Энантиомер (исходный продукт для примера 57) получают по традиционной методике, описанной ниже. Теплый раствор (±)-1-/4-хлорфенил/этиламина (101 г) и L (+) винной кислоты в (97,3 г) в TMC (7 л) медленно охлаждают и выдерживают при комнатной температуре 3 дня. Твердое вещество отфильтровывают, промывают TMC и перекристаллизовывают дважды из TMC с получением (-) 1-/4-хлорфенил/этиламин (+) тартрата, т. пл. 195-196oC. Соль суспендируют в воде и подщелачивают водным раствором аммиака (удельный вес 0,88). Смесь экстрагируют диэтиловым эфиром с получением (-) 1-/4-хлорфенил/-этиламина/свободное основание), которое перегоняют при 122-124oC (28 мм ртутного столба). Хиральная высокоэффективная жидкостная хроматография показывает чистоту энантиомерного продукта 96,8%.
Пример L
а) Раствор 4-хлорфенилацетонитрила (70 г) в сухом тетрагидрофуране (50 мл) добавляют при перемешивании к суспензии гидрида натрия (39,7 г, 60% дисперсия) в кипящем тетрагидрофуране (100 мл) с обратным холодильником в атмосфере азота с такой скоростью, чтобы кипячение происходило без нагревания емкости. После добавления смесь кипятят с обратным холодильником в течение 2 часов. Добавляют еще ТГФ (100 мл) и охлаждают смесь до 10oC. Раствор йодометана (139 г) в тетрагидрофуране (50 мл) добавляют по каплям к полученной смеси в течение 2 часов, поддерживая температуру на уровне ниже 10oC. Смесь перемешивают при комнатной температуре в течение 18 часов, затем температуру опускают до ниже 10oC, добавляя по каплям метанол (30 мл), а затем воду (150 мл). После этого смесь нагревают до комнатной температуры, после чего концентрируют при пониженном давлении с удалением тетрагидрофурана. Остаток разбавляют водой и экстрагируют дихлорметаном. Объединенный экстракт сушат и выпаривают с получением масла, которое перегоняют при вакууме с получением 2-/4-хлорфенил-2-метилпропионитрила, т. кип. 90-94oC (0,5 мм ртутного столба).
б) Раствор пропионитрила (10 г) из п. а) в ТМС (30 мл) обрабатывают раствором гидроокиси натрия (0,67 г) в воде (3,3 мл). Смесь нагревают при до 50oC и добавляют по каплям при перемешивании перекись водорода (14 мл, 60% об/вес). Затем смесь перемешивают при комнатной температуре в течение 3 часов, после чего выпаривают досуха при пониженном давлении. Остаток разделяют на порции между этилацетатом и водой. Смесь разделяют и водный слой экстрагируют этилацетатом. Объединенный органический слой промывают, сушат и выпаривают с получением 2-/4-хлорфенил/-2-метилпропионамида, т.пл. 125oC.
с) Кипящий раствор амида из п. в) (68,3 г) в ацетонитриле (500 мл) добавляют в виде одной порции в теплую суспензию (примерно 50oC) гидрокси/тосилокси/йодобензола (165,3 г) в ацетонитриле (800 мл) при перемешивании. Происходящую при этом экзотермическую реакцию контролируют с применением внешнего охлаждения. Смесь кипятят с обратным холодильником при интенсивном перемешивании в течение 1 часа. Растворитель удаляют при пониженном давлении и остаток тщательно смешивают с этилацетатом (500 мл) и водой (500 мл). Твердый продукт отфильтровывают при использовании фильтрующего средства, представляющего собой двуокись кремния 95%, кислоту для промывки и целит ® 521.
Образовавший остаток добавляют в горячую воду (150 мл) с получением суспензии, которую подщелачивают твердой гиперокисью натрия при внешнем охлаждении. Смесь экстрагируют диэтиловым эфиром и объединенный экстракт сушат над сульфатом магния и фильтруют. Фильтрат подкисляют эфирным раствором хлористого водорода и образующееся твердое вещество отфильтровывают и перекристаллизируют из водного раствора ацетонитрила с получением 1-/4-хлорфенил/-1-метилэтиламингидрохлорида, т.пл. 246oC.
d) Акрилоилхлорид (0,88 г) добавляют по каплям при перемешивании к раствору 1-(4-хлорфенил)-1-метилэтиламингидрохлорида (2,0 г) и триэтиламина (2,07 мл) в дихлорметане (10 мл) при -15 до -20oC в атмосфере азота. После добавления смесь перемешивают при комнатной температуре в течение 2,5 часов. Смесь разбавляют 5M раствором гидроокиси натрия, а затем водой. Слой дихлорметана отделяют с получением  -/1-/4-хлорфенил/-1-метилэтил/акриламида, т. пл. 114-117oC (т.пл. 122-123o после перекристаллизации).
-/1-/4-хлорфенил/-1-метилэтил/акриламида, т. пл. 114-117oC (т.пл. 122-123o после перекристаллизации).
α, α- диалкилзамещенные бензиламины, используемые в качестве исходных веществ в таблице H, получают по методике, аналогичной описанной в таблицах L-O, суммирующих стадии a, b, c и d примера 1 соответственно.
В таблице 1 соединения формулы XXVII, в которой R4 и R5 представляют собой водород, алкилируют с получением соединений формулы XXVIII, в которой R4= R5. В таблице M соединения формулы XXVIII преобразуют в соединения формулы XXV.
В таблице N соединения формулы XXV преобразуют в соединения формулы XVII, в которой R6 представляет собой водород.
В таблице O соединения формулы VII, в которой R6 представляет собой водород, преобразуют в соединения формулы XVI, в которой R6 представляет собой водород.
Пример S, стадия c.
Бром добавляют по каплям при перемешивании (139 г) в 3-лярный раствор гидроокиси натрия (1712 мл) при 0oC. Когда растворится весь бром, добавляют порциями 2-(3,4-дихлорфенил)-2-метил-пропионамид (201 г) при 0oC. Смесь перемешивают при указанной температуре в течение 5 часов, а затем выдерживают при той же температуре 18 часов. Смесь нагревают при 95oC 1 час, затем охлаждают и экстрагируют эфиром. Объединенный эфирный экстракт промывают 5 M хлористоводородной кислотой, пока не выпадет твердый осадок. Твердый продукт отфильтровывают с получением 2-(3,4-дихлорфенил)-2-метилпропиламингидрохлорида, т. пл. 238-239oC.
Пример O. стадия b
2-/4-хлорфенил/-2-этилбутиронитрил (104,9 г) добавляют по каплям в кипящий раствор гидроокиси калия (40,3 г) в пентан-1-оле (450 мл) при перемешивании. Смесь кипятят с обратным холодильником 24 часа. Затем смесь охлаждают и выливают в такой же объем воды. Смесь промывают эфиром и водный слой экстрагируют дихлорметаном с получением масла, которое при выдерживании преобразуется в твердое вещество. Твердое вещество растирают с циклогексаном и фильтруют с получением 2-/4-хлорфенил/-2-/этилбутирамида, т. пл. 107-109oC.
Пример O, стадия b
a) Смесь метил-4-/1-циан-1-метилэтил/бензоата (1,0 г), гидроокиси натрия (0,4 г), воды (2 мл) и технического метилированного спирта (5 мл) нагревают до 50oC при перемешивании. Добавляют по каплям перекись водорода (60% вес/об/, 1,23 мл) и перемешивают реакционную смесь при 50oC в течение 1 часа, а затем при комнатной температуре 3 часа. Реакционную смесь выпаривают досуха при пониженном давлении. К образовавшемуся осадку добавляют воду (10 мл) и нагревают смесь при 95oC в течение 1 часа. Смесь охлаждают, промывают дихлорметаном, подкисляют 5M хлористоводородной кислотой и фильтруют с получением 4-/карбамоил-1-метилэтил/бензойной кислоты, т. пл. 218-219oC.
b) Кислоту из п. a) (0,70 г), абсолютный этанол (7 мл) и концентрированную серную кислоту (2 капли) кипятят с обратным холодильником в течение 4 часов. При пониженном давлении удаляют этанол и к образовавшемуся остатку добавляют воду. После экстрагирования дихлорметаном получают этил 4-/1-карбамоил-1-метилэтил/бензоат, т. пл. 104-109oC. (Газожидкостная хроматография показывает примерно 10% содержание этил 4-/1-этоксикарбонил-1-метилэтил/бензоата.
Пример V
a) Акрилоилхлорид (86,9 г) добавляют по каплям при перемешивании к раствору 4-хлорбензиламина (135,8 г) и триэтиламина (138, 8 мл) в дихлорметане (500 мл) при 15 до -20oC в атмосфере азота. После добавления смесь перемешивают при комнатной температуре в течение 2,5 часов. Смесь промывают разбавленным водным раствором перекиси водорода, а затем водой. Раствор дихлорметана сушат и выпаривают при пониженном давлении. Твердый остаток перекристаллизовывают из этилацетата с получением  /4-хлорбензил/акриламида, т. пл. 103-104oC.
/4-хлорбензил/акриламида, т. пл. 103-104oC.
Пример W
a) По методике, аналогичной описанной в примере 62a, смесь акрилоилхлорида (58,2 г) добавляют в 1-/4-хлорфенил/-этиламин (100 г) и триэтиламин (65,2 г) в дихлорметане (400 мл) с получением 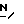 -1-/4-хлорфенил/этил/акриламида, т. пл. 103-104oC.
-1-/4-хлорфенил/этил/акриламида, т. пл. 103-104oC.
Пример X
a) По методике, аналогичной описанной в примере A, 4/5/-метил-2-фенилимидазол (25,0 г) взаимодействует с гидридом натрия (6,3 г, 60% дисперсия) в диметилформамиде и затем с  -/3-бромпропил/фтальимидом (40,4 г) с получением
-/3-бромпропил/фтальимидом (40,4 г) с получением  -/3-/4-/5-метил-2-пропилимидазол-1-ил/пропил/-фтальимида, который используют непосредственно в п. b).
-/3-/4-/5-метил-2-пропилимидазол-1-ил/пропил/-фтальимида, который используют непосредственно в п. b).
b) фтальимид (50,0 г) из п. a) обрабатывают гидразингидратом (4/7 г) в техническом метилированном спирте (1400 мл) по методике, описанной в примере F, с получением 3-/4-метил-2-фенилимидазол-1-ил/пропиламина в виде масла, т. кип. 156-160oC (0,4 мм ртутного столба), которое очищают путем преобразования в гидрохлоридную соль при использовании эфирного раствора хлористого водорода, а затем превращения обратно в свободное основание при использовании 5M гидроокиси натрия. По данным газожидкостной хроматографии продукт содержит около 12% 3-/5-метил-2-фенилимидазол-1-ил/-пропиламина.


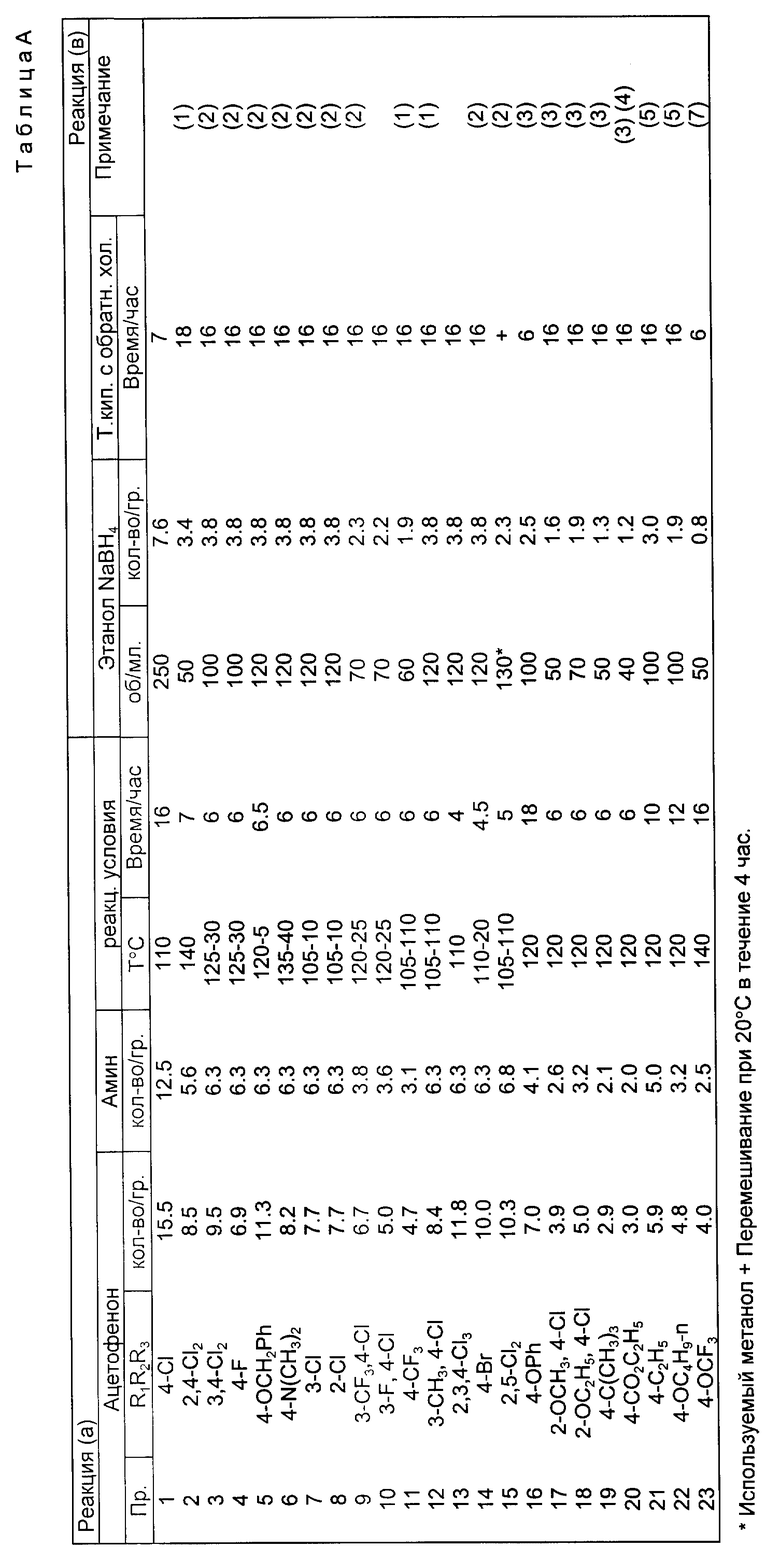
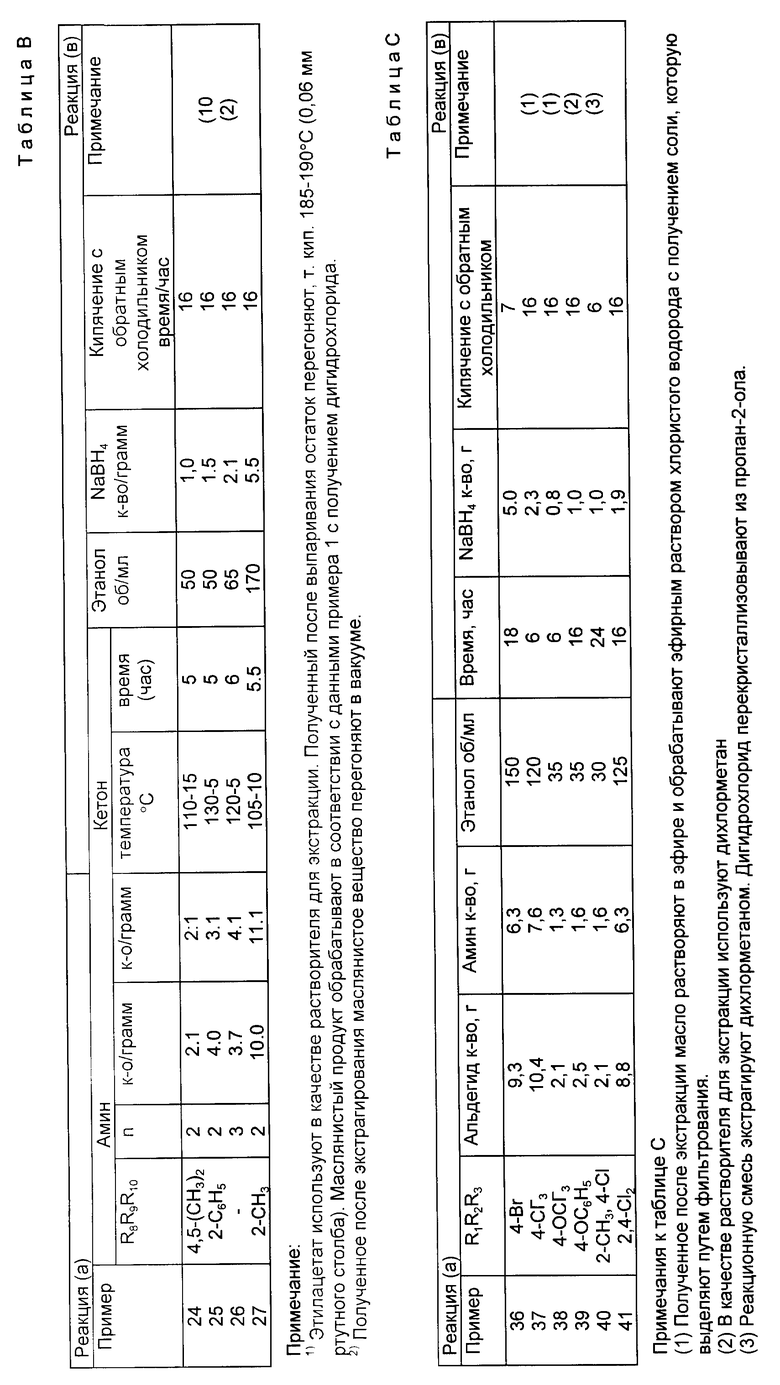
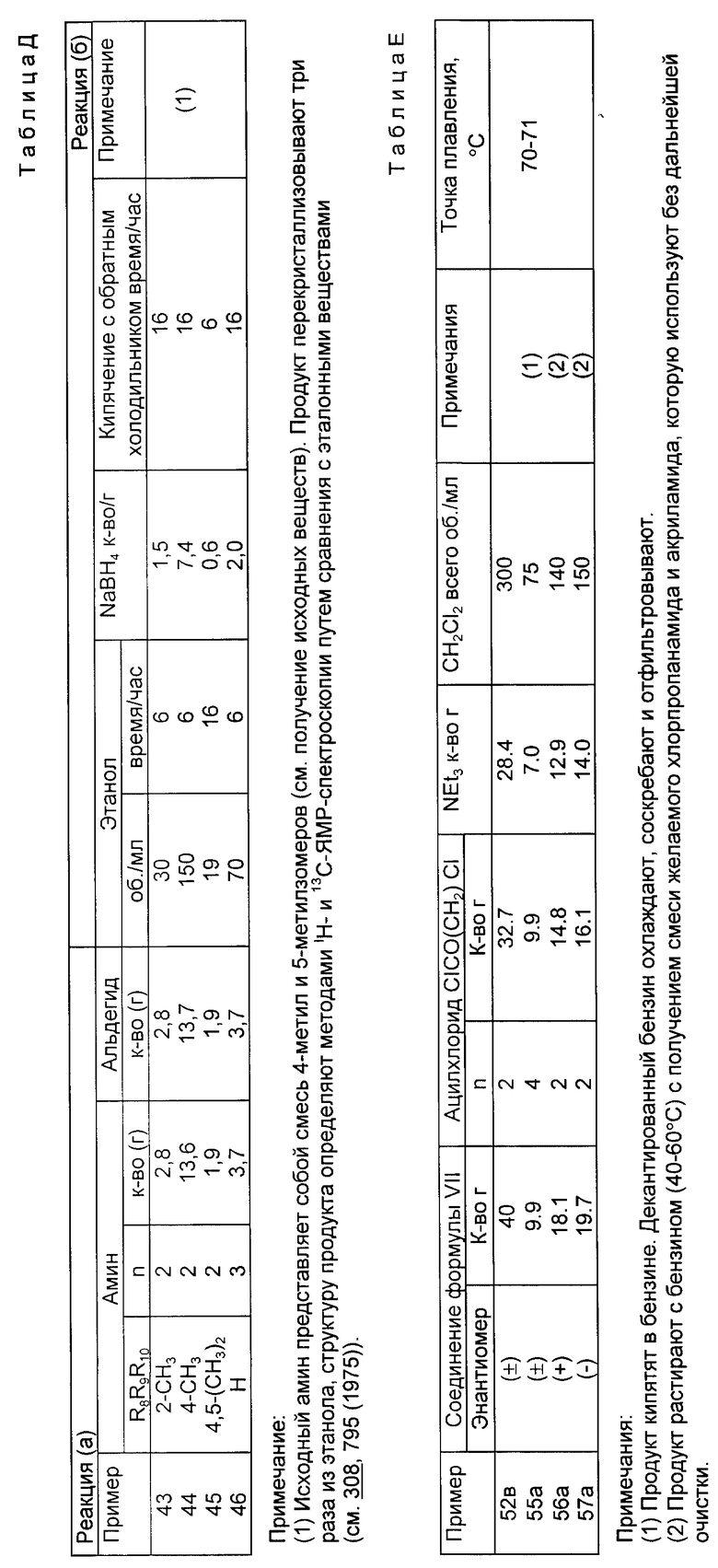
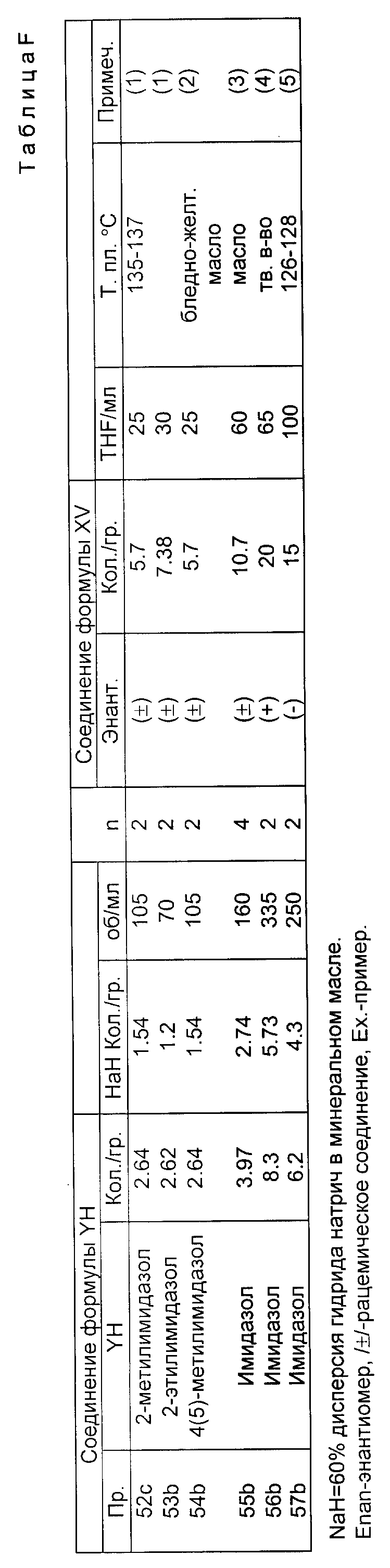




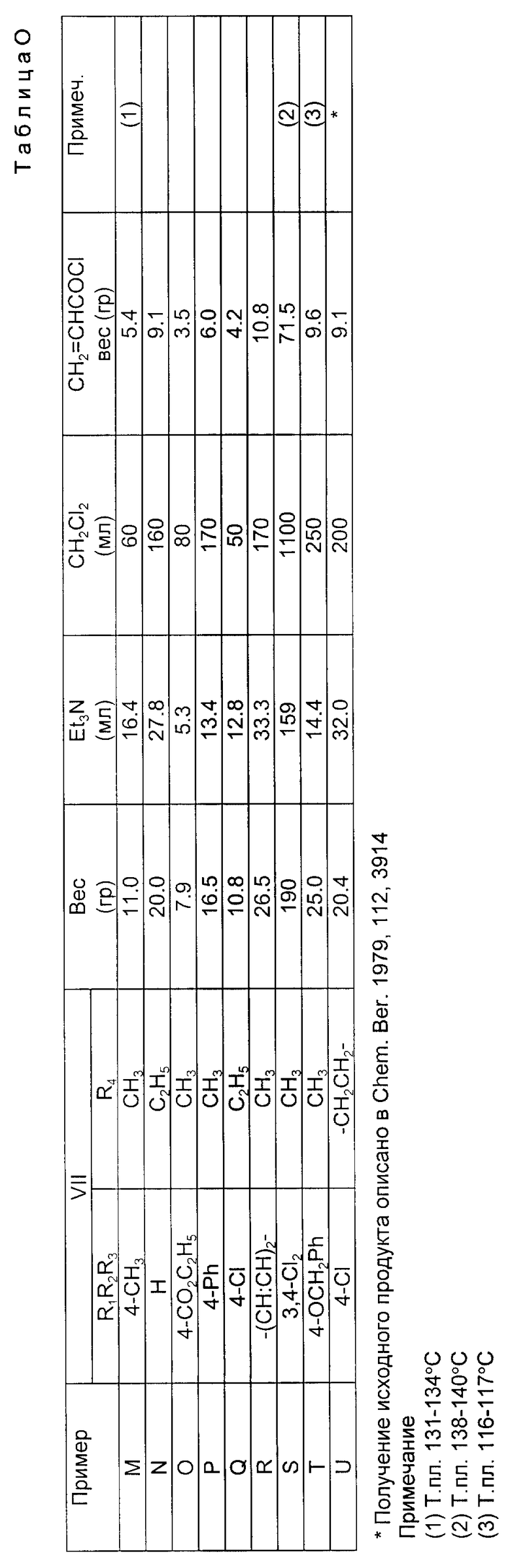
Изобретение касается производных имидазола формулы 1 и их фармацевтически приемлемых солей, где R1, R2, и R3 независимо друг от друга - водород, галоген, алкокси, фенокси, фенил, алкоксикарбонил, - NR13 R14, галоидированный алкокси, галоидированный алкил, бензилокси, гидрокси, гидроксиалкил, (C2-6-алкоксикарбонил) винил, S(O)n R7, карбамоилалкил, алкоксикарбонилалкил, -CONR11 R12 или R1 и R2 вместе с фенильным кольцом представляют собой нафтилогруппу, R4 и R5 представляют собой независимые друг от друга водород, алкил, фенил или вместе с атомом углерода представляют собой C3-6-циклоалкил, представляет собой водород, алкил или ω - гидроксиалкил, A представляет собой C2-5-алкилен, R8 представляет собой водород, алкил, галоген, алкокси, гидроксиалкил, бензил или фенил, R9 и R10 представляют собой независимые друг от друга водород, алкил, галоген, алкокси, фенил, гидроксиалкил, алкоксикарбонил, нитро, NR30 R31, алканоилоксиалкил или аминометил, которые являются противовоспалительными и антиаллергическими средствами. Описаны также составы, содержащие эти соединения, и способы их получения.
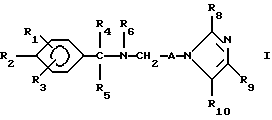 4 с. и 12 з.п. ф-лы, 18 табл.
4 с. и 12 з.п. ф-лы, 18 табл.
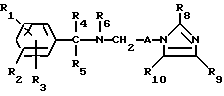
или их фармацевтически приемлемые соли,
в которых R1, R2 и R3, независимо друг от друга, представляют собой водород, галоген, C1-4-алкил, C1-4-алкоксигруппу, фенокси, фенил C2-6-алкоксикарбонильную группу, аминогруппу формулы -NR13R14, в которой R13 и R14, независимо друг от друга, представляют собой водород или C1-4-алкил; галоидированную C1-2-алкоксигруппу, галоидированную C1-2-алкилгруппу, бензилокси, гидрокси, C1-4-гидроксиалкил, (C2-6-алкоксикарбонил)винил, C2-6-алкоксикарбонил C1-2-алкил, или R1 и R2 вместе с фенильным кольцом, к которому они присоединены, представляют нафтил;
R4 и R5, независимо друг от друга, представляют водород, C1-4-алкил, фенил или R4 и R5 вместе с атомом углерода, к которому они присоединены, представляют собой C3-6-циклоалкил;
R6 - водород или C1-4-алкил;
A - C2-7-алкилен, который может быть прямым или разветвленным;
R8 - водород, C1-4-алкил, фенил, необязательно замещенный C1-4-алкилом, галогеном или C1-4-алкоксигруппой, или бензил, необязательно замещенный C1-4-алкилом, галогеном или C1-4-алкоксигруппой;
R9 и R10, независимо друг от друга, представляют собой водород, C1-3-алкил, галоген, C1-4-гидроксиалкил, C2-6-алкоксикарбонил, нитро- или C1-6-алканоилокси C1-2-алкил, при условии, что если A представляет собой (CH2)2 и R2, R3, R4, R5, R6, R8, R9 и R10 представляют собой водород, тогда R1 не является водородом или 4-хлором, а также если A представляет собой (CH2)5 и R1, R2, R3, R4, R5, R6, R9 и R10 представляют собой водород, тогда R8 не является метилом.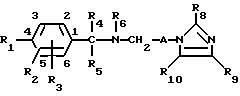
или их фармацевтически приемлемые соли,
в которых R1 - галоген, C1-4-алкильную группу, C2-4-алкоксигруппу, фенокси, фенил, C2-4-алкоксикарбонильную группу, галоидированную C1-2-алкоксигруппу, галоидированную C1-2-алкильную группу, бензилокси, аминогруппу формулы NR13R14, в которой R13 и R14 представляют собой, независимо друг от друга, водород или C1-2-алкильную группу, (C2-4-алкоксикарбонил) винильную группу, C2-6-алкоксикарбонил C1-2-алкильную группу или R1 и R2 вместе с фенильным кольцом, к которому они присоединены, представляют нафтил;
R2 и R3 - независимы друг от друга и представляют собой водород, галоген, C1-4-алкил, C1-4-алкоксигруппу, галоидированную C1-2-алкильную группу или гидрокси;
R4 и R5 - независимы друг от друга и представляют собой водород, C1-4алкильную группу, фенил или R4 и R5 вместе с соединенным с ними атомом углерода представляют собой C3-6-циклоалкильную группу;
R6 - водород или C1-3-алкильная группа;
A - этилен, триметилен, тетраметилен, 1,1-диметилэтилен или гептаметилен;
R8 - водород, C1-4-алкильная группа, фенил или бензил;
R9 и R10 - независимы друг от друга и представляют собой водород, C1-4-алкил, галоген, C1-4-гидроксиалкильную группу, C2-6-алкоксикарбонильную группу, нитро- или C1-6-алканоилокси C1-2-алкильную группу.
N-[1-(4-хлорфенил) этил]-3-(имидазол-1-ил)-пропиламин,
N-[2,4-дихлорфенил)этил]-3-(имидазол-1-ил)-пропиламин,
N-[1-(3-хлорфенил) этил]-3-(имидазол-1-ил)-пропиламин,
N-[1-(4-бромфенил)этил]-3-(имидазол-1-ил)-пропиламин,
N-[1-(4-хлорфенил)этил]-4-(имидазол-1-ил)-бутиламин,
N-[1-(4-хлорфенил)пропил]-3-(имидазол-1-ил)-пропиламин,
N-(3,4-дихлорбензил)-3-(имидазол-1-ил)-пропиламин,
N-(4-хлорбензил)-3-(2-метилмидазол-1-ил)-пропиламин,
N-[1-(4-хлорфенил)-этил]-3-(4-метилмидазол-1-ил)-пропиламин,
N-[1-(4-хлорфенил)этил]-3-(5-метилмидазол-1-ил)-пропиламин,
N-[1-(4-хлорфенил)этил]-5-(имидазол-1-ил)-пентиламин,
N-[1-(4-хлорфенил)-1-метилэтил]-3-(имидазол-1-ил)-пропиламин,
N-(1-этил-1-фенилпропил)-3-(имидазол-1-ил)-пропиламин,
N-[1-(4-хлорфенил)-1-метилэтил]-4-(имидазол-1-ил)-бутиламин,
N-[1-(4-хлорфенил)пропил]-3-(имидазол-1-ил)-N-метил-пропиламин,
или их фармацевтически приемлемые соли.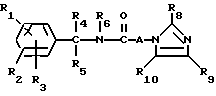
где значения R1 - R6 и R8 - R10 даны в п.1,
с восстановителем необязательно в присутствии инертной органической жидкости, предпочтительно, растворителя для соединения формулы IX, при атмосферном давлении, температуре 0 - 200oC при атмосферном давлении.
| Машковский М.Д | |||
| Лекарственные средства | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1998-09-20—Публикация
1992-12-12—Подача