Изобретение относится к водорастворимым производным камптотецина, их использования для лечения опухолей, а также способам их получения.
Камптотецин - природный цитотоксичный алкалоид - является ингибитором топоизомеразы I и мощным противоопухолевым препаратом. Впервые он был выделен из коры и листьев произрастающего в Китае растения Camptotheca accuminata Уоллом с соавторами /Wall et al. J. Am. Chem. Soc., 883888 (1966)/.
Как показано на рисунке, камптотецин представляет собой конденсированную кольцевую систему, состоящую из хинолина /A и B/, присоединенного к пирролидиновому кольцу (C), сцепленному с кольцом альфа-пиридона, которое, в свою очередь, присоединено к лактоновому кольцу (D и E соответственно).
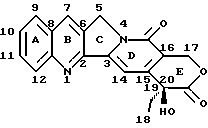
Камптотецин имеет асимметричный атом углерода, расположенный в положении 20, что делает возможным существование двух энантиоморфных модификаций. В природе, однако, это соединение встречается в S-форме, как и показано на рисунке выше.
Цитотоксичные вещества часто используют для контроля или ликвидации опухолей, таким образом, они являются химиотерапевтическими препаратами. Считается, что цитотоксичная активность камптотецина прямо связана со способностью камптотецина ингибировать топоизомеразу (детальное описание функции топоизомеразы, см. в: A. Lehninger, Principles of Biochemistry, 813, Worth Publishers, New York (1982); L.F. Liu, DNA Topoisomerases", CRC Critical Review in Biochemistry, 1-24, 15 (1983) and H.Vosberg, "DNA Topoisomerases; Enzymes that Control DNA Conformation", Current Topies in Mierobiology and Immunology, 19, Springer - Verlag, Berlin (1985)].
В частности, было показано, что камптотецин эффективен при лечении лейкемии /L-1210/ и некоторых твердых опухолей лабораторных животных: см., например, Chem. Rev. 23, 385 (1973); Cancer Treat, Rep., 60, 1007 (1967).
К сожалению, клинические обещания камптотецина как эффективного противоопухолевого препарата, оправдались не полностью. Камптотецин весьма труднорастворим в физиологически совместимых водных средах, и для того, чтобы сделать его достаточно растворимым для парентерального введения (предпочтительная форма лечения опухолей), его необходимо модифицировать. Он может быть сделан растворимым путем перевода в соль натрия, например, разрывом лактонового кольца гидроокисью натрия (см. F.M. Muggia, et al., Cancer Chemotherapy Reports, pt. 1, 56, N, 4, 515 (1972)).
Однако, как показал М. Уэйни с соавторами, для противоопухолевого действия абсолютно необходимо присутствие альфа-оксилактонового комплекса кольца E /M.C., Wani, et al., J. Med. Chem., 23, 554 (1980)/.
Для улучшения растворимости камптотецина в воде получен ряд его производных и модификаций. Несмотря на то, что многие из этих производных были активны "ин витро" и в ранних исследованиях на животных с использованием моделей лейкемии /L-1210/, на хронической стадии опыты на животных с использованием имплантированных твердых опухолей дали разочаровывающие результаты.
Миясака с соавторами в пат. США N 4399276 предложил группу производных камптотецина с заместителями в 7-м положении, среди которых были оксиметил и алкоксиметил. Далее, в пат. США N 4399276 Миясака с соавторами предложил камптотецин-7-альдегид и некоторые связанные производные на основе производных альдегида, таких как ацетали, оксимы и гидразоны. Позже Вишнуваййала с соавторами в пат. США N 4943579 заявил серию воднорастворимых производных камптотецина с заместителями в кольце A. Аналогичные производные были предложены Бемом с соавторами в Европейской патентной заявке 0321122 A2. Другие примеры производных камптотецина содержатся в пат. США N 4473692, 4545880 /Миясака с соавторами/ и журнале "J. Med. Chem, 34, 98" за 1991 г. /У. Кингсбери с соавторами/. Ни в одном из этих источников не сообщалось о том, что эти вещества имели большую противоопухолевую активность, чем сам камптотецин.
Уэйни с коллегами сообщил, что 10,11-метилендиоксикамптотецин имеет большую активность, чем незамещенный камптотецин /M.C.Wani et al., J. Med. Chem. , 29, 2358 (1986); 30, 2317 (1987)/, однако он тоже плохорастворим как и камптотецин, что серьезно ограничивает его клиническую применяемость.
Получены водорастворимые аналоги камптотецина, которые являются хорошими ингибиторами топоизомеразы I "ин витро" обладают значительной противоопухолевой активностью "ин виво".
Одним из предметов настоящего изобретения являются водорастворимые аналоги камптотецина, соответствующие формуле I.
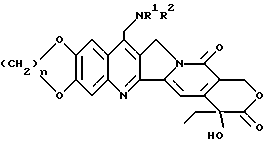
где
n принимает целые значения 1 или 2;
1) R1 и R2, взятые отдельно, представляют водород, низший алкил, (C3-7)циклоалкил, (C3-7)циклоалкил низший алкил, низший алкенил, окси низший алкил, низший алкокси низший алкил; 2) R1 представляет водород, низший алкил, (C3-7)циклоалкил, (C3-7)циклоалкил низший алкил, низший алкенил, окси низший алкил или низший алкокси низший алкил; R2 представляет -COR3, где R3 представляет водород, низший алкил, пергало-низший алкил, (C3-7)циклоалкил, (C3-7)циклоалкил низший алкил, низший алкенил, окси низший алкил, низший алкокси, низший алкокси, низший алкил;
3) R1 и R2, взятые вместе с соединительным атомом азота, образуют насыщенную 3 - 7 атомную гетероциклическую группу, соответствующую формуле IA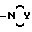
где
Y представляет O, S, CH2 или NR4, причем R4 представляет водород, низший алкил, пергало-низший алкил, арил, арил, замещенный одним или несколькими заместителями, выбранными из группы, включающей: низший алкил, галоген, нитро, амино, низший алкил амино, пергало-низший алкил, окси низший алкил, низший алкокси, низший алкокси низший алкил, COR5, причем R5 представляет водород, низший алкил, пергало-низший алкил, низший алкокси, арил, арил, замещенный одним или несколькими заместителями, выбранными из группы, включающей: низший алкил, пергало-низший алкил, окси низший алкил, низший алкокси низший алкил, а также их фармацевтически приемлемые соли.
Фармацевтически приемлемые соли включают в себя, но не ограничиваются ими, соли неорганических кислот, такие как гидрохлорид, сульфат, фосфат, дифосфат, бромгидрат и нитрат, либо соли органических кислот, такие как ацетат, малат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, p-толуолсульфонат, пальмоат, салицилат и стеарат. Другие кислоты, такие как щавелевая, не являясь сами по себе фармацевтически приемлемыми, могут оказаться полезными в качестве промежуточных продуктов при получении веществ, составляющих предмет изобретения, и их фармацевтически приемлемых солей.
Лактонное кольцо, кольцо E, может быть разорвано основаниями щелочных и щелочноземельных металлов, например, гидроокисью натрия или кальция, что приводит к образованию солей щелочных или щелочноземельных металлов соответствующей формы разорванного кольца E соединений, отвечающих формуле I. Поскольку разорванная форма кольца E имеет лучшую растворимость в воде, она может быть очищена обычными методами рекристаллизации, что дает положительный эффект. Соответственно, указанная разорванная форма кольца E может быть затем использована в качестве промежуточного продукта при получении соединений, отвечающих формуле I, например, путем обработки кислотой, в т.ч. соляной, что приводит к образованию очищенных форм соединений по формуле I.
Как отмечено выше, в камптотециновом комплексе имеется несимметричный атом углерода в положении 20, что делает возможным существование двух энанморфных изомеров, а именно R- и S-изомеров. Настоящее изобретение включает оба этих энанморфных изомера и любую их комбинацию. Для простоты в тех случаях, когда в структурных формулах в положении 20 не указана конкретная конфигурация, следует понимать, что она относится к обоим изомерам и их смесям. Если специально не указано иначе, обозначение R, S означает рацемическую смесь (примерно в равных долях) R- и S-энантиомеров, а R и S означают оптически существенно чистые энантиомеры R и S соответственно. Настоящее изобретение включает в себя также и другие формы соединения по формуле I, такие как сольваты, гидраты, полиморфы и т.п.
Другим предметом настоящего изобретения является метод ингибирования топоизомеразы типа I в клетках млекопитающих, заключающийся во введении пациенту соединения по формуле /I/ в количестве, достаточном для ингибирования топоизомеразы, и метод лечения опухолей млекопитающих, заключающийся во введении млекопитающему, имеющему опухоль, эффективного противоопухолевого количества соединения по формуле /I/. Следующим предметом изобретения является технология приготовления лекарственного средства, содержащего в качестве активного ингредиента соединение по формуле /I/. Как здесь показано, способы приготовления соединений по формуле /I/, а также связанные с этим новые химические промежуточные вещества, используемые в ходе синтеза, тоже входят в состав настоящего изобретения.
Термин "низший" здесь в отношении алкила и алкокси означает 1-6 атомов углерода, а в отношении алкенила - 3-6 атомов углерода (при условии, что у углерода, присоединенного к азоту, нет двойной связи). Термин "пергало" означает, что все атомы водорода замещены галогеном. Так, пергало низший алкил означает, например трифторметил. Термин "арил" означает фенил или нафтил.
Конкретно веществами по формуле /I/ являются те, в которых R1 и R2 представляют 1) взятые отдельные: водород, (C1-4)алкил, (C3-7)циклоалкил, (C3-7)циклоалкил (C1-4)алкил, (C3-4)алкенил, окси (C1-4)алкил, (C1-4)алкокси(C1-4)алкил); 2) взятые вместе с азотом - образуют азиридин, азетидин, пирролидин, пиперидин, гексаметиленимин, имидазолидин, пиразолидин, изоксазолидин, пиперазин, N-метилпиперазин, гомопиперазин, N-метилгомопиперазин, тиазолидин, изотиазолидин, морфолин, тиоморфолин.
Одной из предпочтительных групп соединений по изобретению является соединения формулы /I/, в которых n принимает целые значения 1 и 2; 1) R1 и R2, взятые отдельно, представляют водород, низший алкил (например, метил, этил), либо окси низший алкил (например, оксиэтил); 2) R1 представляет водород, а R2 представляет -COR3, где R3 представляет пергало-низший алкил (например, трифторметил); 3) R1 и R2, взятые вместе с соединительным атомом азота, образуют азетидин, пирролидин, пиперидин, морфолин, тиоморфолин либо пиперазин, по желанию N-замещенный низшим алкилом (например, метилом), фенил, фенил, замещенный одним или несколькими пергало-низшими алкилами (например, трифторметилом) или низшим алкокси (например, метокси) группами; -COR5, где R5 представляет низший алкокси (например, бутокси), а также их фармацевтически приемлемые соли.
Конкретными представителями соединений по формуле /I/ являются:
7-диметиламинометилен-10,11-метилендиокси-20(R,S)-камптотецин;
7-диметиламинометилен-10,11-метилендиокси-20(S)-камптотецин;
7-диметиламинометилен-10,11-этилендиокси-20(R,S)-камптотецин;
7-диметиламинометилен-10,11-этилендиокси-20(S)-камптотецин;
7-морфолинметилен-10,11-этилендиокси-20(R,S)-камптотецин;
7-морфолинметилен-10,11-этилендиокси-20(S)-камптотецин;
7-пирролидинметилен-10,11-этилендиокси-20(R,S)-камптотецин;
7-пиперидинметилен-10,11-метилендиокси-20(R,S)-камптотецин;
7-пиперидинметилен-10,11-этилендиокси-20(R,S)-камптотецин;
7-(4-метилпиперазинметилен)-10,11-этилендиокси-20(R,S)-камптотецин;
7-(4-метилпиперазинметилен)-10,11-этилендиокси-20(S)-камптотецин;
7-диэтиламинометилен-10,11-метилендиокси-20(S)-камптотецин;
7-диэтиламинометилен-10,11-этилендиокси-20(R,S)-камптотецин;
7-диметиламинометилен-10,11-этилендиокси-20(S)-камптотецин;
7-N-метилэтаноламинометилен-10,11-метилендиокси-20(R,S)-камптотецин;
7-N-метилэтаноламинометилен-10,11-этилендиокси-20(R,S)-камптотецин;
7-диэтаноламинометилен-10,11-этилендиокси-20(R,S)-камптотецин;
7-диэтаноламинометилен-10,11-этилендиокси-20(S)-камптотецин;
7-азетидинметилен-10,11-метилендиокси-20(R,S)-камптотецин;
7-азетидинэтилен-10,11-метилендиокси-20(S)-камптотецин;
7-тиоморфолинметилен-10,11-этилендиокси-20(S)-камптотецин;
7-азетидинметилен-10,11-этилендиокси-20(S)-камптотецин;
7-(4-метилпиперазинметилен)-10,11-метилендиокси-20(S)-камптотецин;
7-трифторацетамидметилен-10,11-этилендиокси-20(S)-камптотецин;
7-трифторацетамидметилен-10,11-метилендиокси-20(S)-камптотецин;
7-аминометилен-10,11-этилендиокси-20(S)-камптотецин дигидрохлорид;
7-три-бутилоксикарбонил-пиперазинметилен-10,11-этилендиокси-20(S)-камптотецин;
7-аминометилен-10,11-метилендиокси-20(S)-камптотецин дигидрохлорид;
7-пиперазинметилен-10,11-этилендиокси-(S)-камптотецин трифторацетат;
7-(α,α,α-трифтор-m-толил)-пиперазинметилен-10,11-этилендиокси-20(S)-камптотецин;
7-(2-метоксифенил-пиперазин)метилен-10,11-этилендиокси-20(S)-камптотецин;
7-фенилпиперазинметилен-10,11-этилендиокси-20(S)-камптотецин.
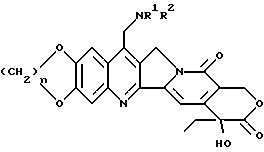
Другие конкретные соединения формулы /I/ выражаются формулой I'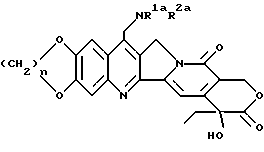
где n принимает целые значения 1 или 2;
R1a и R2a представляют: 1) взятые отдельно: водород, низший алкил, (C3-7)циклоалкил, (C3-7)циклоалкил низший алкил, низший алкенил, окси низший алкил, низший алкокси низший алкил; 2) взятые вместе с соединительным атомом азота - образуют 3-7 атомную гетероцикличную группу, выражаемую формулой IA'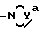
где Ya представляет O, S, CH2, NH или N (низший алкил), а также их фармацевтически приемлемые соли.
Приготовление соединений
По одному из общих процессов /A/ соединения по формуле /I/ могут быть приготовлены по методике, показанной ступенью 2 на нижеприведенной схеме 1.
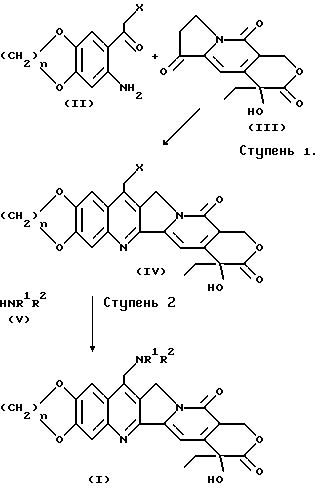
На ступени 1 схемы I вещество по формуле /II/, в которой X обозначает уходящую группу (в соответствии со стр.179 книги Y.March, Advanced Organic Chemistry, 3rd.Ed., John Wiley & Sons, New York (1985)). например, галоген, скажем хлор, может вступать в реакцию с веществом по формуле /III/ по методу, запатентованному в пат. США 4894456, выданному 16 января 1990 г. Уоллу с коллегами и включенному в настоящий документ ссылкой, в образованием вещества по формуле /IV/ - далее указанный патент обозначается '456.
На второй ступени (общего процесса A) вещества по формуле /IV/ могут быть переведены в вещества по формуле /I/ путем замещения уходящей группы X веществом по формуле /V/, в которой R1 и R2 означают те же группы, что и в формуле /I/. Указанная реакция замещения для удобства может быть проведена в среде растворителя, например, в воде (C1-4)алканоле, (C2-4)алкилен диоле, 1-окси-2-метоксиэтане, диметилацетамиде /DMAC/, N-метилпирролидиноне, диметилформамиде /ДМФ/, тетрагидрофуране /ТГФ/: диметилсульфоксиде /ДМСО/, толуоле либо в их комбинации в присутствии избытка амина, например, в присутствии избытка вещества по формуле /V/, с присутствием или без присутствия какого-либо основания, например, карбоната калия.
Указанный метод особенно эффективен для приготовления веществ по формуле /I/ в тех случаях, когда ни R1, ни R2 не являются водородом.
В другом общем процессе /B/ вещества по формуле /I/ могут быть приготовлены по методике, обозначенной как ступень 2a на схеме 1A.
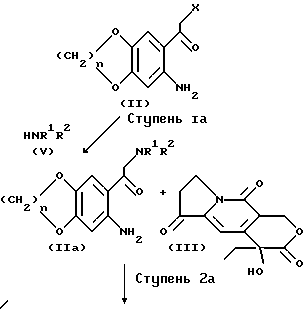
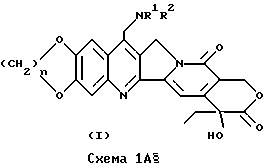
На ступени 1a вещество по формуле /V/ вступает в реакцию с веществом по формуле /II/, что приводит к образованию вещества по формуле /IIA/, в которой R1 и R2 обозначают те же группы, что и в формуле /I/. Указанная реакция может быть осуществлена при условиях, сходными с описанными для общего процесса A /схема 1, ступень 2/.
На ступени 2a /общего процесса B/ вещество по формуле /IIA/ реагирует с веществом по формуле /III/ с образованием вещества по формуле /I/ подобно тому, как это было показано на схеме 1, ступень 1.
В одной из конкретных реализаций процесса /B/ вещества по формуле /I/ могут быть получены по методике, показанной на схеме IB. (Схема IB).
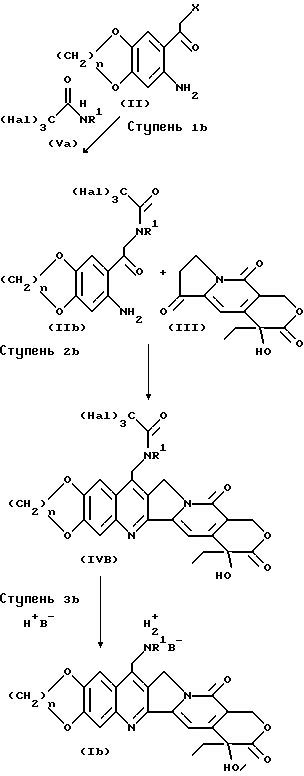
На ступени 1b вещество по формуле /Va/ (в которой "Hal" обозначает галоген, например, фтор, хлор, бром или йод), скажем, трифторацетамид, реагирует с веществом по формуле /II/ в полярном апротонном растворителе, например, ацетонитриле, в присутствии основания, растворимом в полярном апротонном растворителе, например, карбоната цезия, растворенного в ацетонитриле, с образованием вещества по формуле /IIb/.
На ступени 2b вещество по формуле /IVb/ реагирует с веществом по формуле /III/ с образованием вещества по формуле /IVb/ подобно тому как это показано на схеме 1, ступень 1.
На ступени 3b вещество по формуле /IVb/ обрабатывается кислотой H+B-, такой как минеральная кислота, например, соляная, что приводит к образованию вещества по формуле /Ib/, например, соли вещества по формуле /I/. Вещество по формуле /Ib/ может быть обработано по стандартному методу, соответствующего современному уровню развития техники, каким-либо основанием с получением соответствующего свободного основания. Затем, если потребуется, свободное основание обычными способами может быть переведено в фармацевтически приемлемую соль.
Этот альтернативный метод особенно эффективен при приготовлении веществ по формуле /I/ в тех случаях, когда и R1, и R2 либо только R2 являются водородом.
Вещества по формуле /II/ могут быть приготовлены в соответствии с методикой, показанной на схеме II.
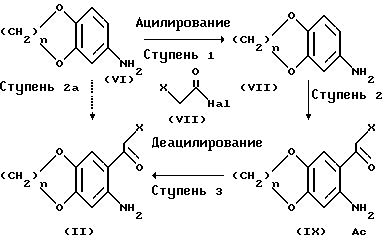
На ступени 1 схемы II вещество по формуле /IV/ в присутствии слабого основания, например, карбоната калия, вступает в реакцию с ацилирующим реагентом, таким как галид (C2-5)алканойной кислоты или ангидрида (C2-5)алканойной кислоты, например, ацетилхлоридом или ацетилангидридом, в среде полярного апротонного растворителя, например, хлороформа, с образованием вещества по формуле /VII/, в которой Ac обозначает группу (C2-5)ацил.
На ступени 2 вещество по формуле /VII/ в присутствии галогенида металла, например, хлорида цинка, вступает в реакцию с веществом по формуле /VIII/, в которой X обозначает уходящую группу /как в веществе по формуле /IV//, а Hal обозначает галоген, в среде полярного апротонного растворителя, например, нитрометана, с образованием вещества по формуле /IX/. Веществом по формуле /VIII/ может быть галоацетилгалид, например, хлорацетилхлорид, или галоацетонитрил, например, хлорацетонитрил.
На ступени 3 известными способами, например, в соответствии с книгой Т. Green, Protective Groups in Organic Chemistry, Chap. 7, John Wiley, New York (1981), получают вещество по формуле /II/ путем удаления ациловой группы Ac, т. е. путем деацилации. Так, вещество по формуле /IX/ может быть нагрето в сосуде с обратным холодильником вместе с концентрированной соляной кислотой; полученную в результате этого соль нейтрализуют основанием, например, гидроокисью натрия, и получают вещество по формуле /II/.
На ступени 2a схемы II для получения вещества, соответствующего формуле /II/, вещество по формуле /VI/ может вступать в реакцию непосредственно с веществом по формуле /VIII/ без предварительной защиты аминогруппы ацилированием - в том случае, если вещество по формуле /VI/ является этилендиоксиновым соединением, т.е. n = 2.
Альтернативным путем получения веществ по формуле /II/ может быть метод, описанный Т.Сугасава с коллегами /T.Sugasawa, et al., J.Org. Chem., 44, 578 (1979)/.
Вещество по формуле /III/ может быть приготовлено по методике Уолла /'456, колонка II, начиная со строки 30/. Из схемы I видно, что асимметричное положение атома углерода в веществе по формуле /III/ определяет конфигурацию веществ по формуле /I/. Рацемическое вещество по формуле /III/ может быть разделено на свои энантиомеры по методу, предложенному Уэйни в пат. США N 5 053 512 /далее '512/, включенному в настоящий документ ссылкой.
К настоящему изобретению относятся новые, промежуточные вещества по формуле /II/, /IIA/, и /IV/.
По другому общему процессу /Д/, вещество по формуле /I/ в соответствии с настоящим изобретением может быть переведено в другие вещества по настоящему изобретению с использованием обычных процессов.
Так, вещество по формуле /I/, в котором одна или более групп R1 и R2 являются атомом водорода, может быть алкилировано с использованием обычных технологий. Эта реакция может быть осуществлена с использованием подходящего алкилирующего средства, например, галоидного алкила, алкилтозилата либо диалкилсульфата. Для удобства реакция алкилирования может быть осуществлена в среде органического растворителя, такого как амид, например, диметилформамид, или такого как простой эфир, например, тетрагидрофуран, причем реакцию предпочтительнее осуществлять в присутствии какого-либо основания. Приемлемые для этой цели основания включают в себя, например, гидриды щелочных металлов, в частности гидрид натрия, карбонаты щелочных металлов, в частности карбонат натрия, алкоголяты щелочных металлов, в частности, метилаты, этилаты либо т-бутилаты натрия или калия. Реакцию алкилирования удобно осуществлять при 25 - 100oC.
Другим путем перевода вещества по формуле /I/, в которой одна или несколько групп R1 и R2 являются атомом водорода, в другое вещество по формуле /I/ является восстановительное алкилирование. Восстановительное алкилирование с использованием подходящего альдегида или кетона может быть осуществлено при помощи боргидрида либо цианборгидрида какого-либо щелочноземельного металла. Эта реакция может осуществляться в водной или неводной среде. Удобно ее проводить в спирте, например, метиловом или этиловом, простом эфире, например, диоксане или тетрагидрофуране, при желании также в присутствии воды. Указанную реакцию удобно осуществлять при 0 - 100oC, предпочтительно 5 - 50oC.
Кроме того, вещество по формуле /I/, в котором одна или несколько групп R1 и R2 представляют низший алкенил, может быть переведено в другое вещество по формуле /I/, в которой R1 или R2 представляют низший алкил. Восстановление удобно осуществлять в присутствии водорода и металлического катализатора, например, скелетного никелевого катализатора гидрирования или катализатора из благородного металла, такого как палладий, платина, окись платины или родий, которые могут закрепляться, например, на древесном угле. Реакция может осуществляться в таком растворителе как спирт, например, этанол при (-10) - (+50)oC, предпочтительно 20 - 30oC.
Еще одним путем получения веществ по формуле /I/, в которой R2 представляет оксиалкиловую группу, является восстановление вещества по формуле /I/, в которой R2 представляет COR3, где R3 представляет низшую алкокси группу. Восстановление удобно осуществлять с использованием в качестве восстановителя водородсодержащего вещества, например, гидрида лития или алюминия, либо триэтилборгидрида лития, в среде подходящего растворителя, например простого эфира, в т.ч. простого диэтилэфира, тетрагидрофурана, диоксана, либо углеводорода, в т. ч. толуола. Реакцию удобно проводить при температуре от -78 до 100oC, предпочтительно при температуре около 0oC.
По другому процессу /Е/ вещество по формуле /I/, соответствующее настоящему изобретению, или его соль могут быть приготовлены путем реакции удаления защищающей группы или групп из защищенного производного формулы /I/ или его соли.
Так, на ранней стадии приготовления вещества по формуле /I/ или его соли может оказаться необходимым и/или желательным защитить одну или несколько чувствительных групп в молекуле для того, чтобы избежать нежелательных побочных реакций.
Защитные группы, применяемые для приготовления веществ по формуле /I/, могут использоваться обычным путем. См., например, "Protective Groups in Organic Chemistry' Ed. J.F.W.McOmie (Plenum Press 1973) or' Protective Groups in Organic Synthesis' by Theodora W Greene (John Wiley and Sons 1981).
Обычные защитные аминогруппы могут включать, например, аралкилгруппы, такие как бензил, дифенилметил или трифенилметиловые группы, а также ацильные группы, такие как N-бензилоксикарбонил или t-бутоксикарбонил. Таким образом, вещества по общей формуле /I/, в которой одна или несколько групп R1 и R2 представляют водород, могут быть получены путем устранения защитных групп с соответствующего защитного вещества.
Гидроксильные группы могут быть защищены, например, аралкилгруппами, такими как бензил, дифенилметил или трифенилметил, ацильными группами, такими как ацетил, защитными кремниевыми группами, такими как триметилсилил или t-бутилдиметилсилиловые группы, либо же производными тетрагидропирана.
Удаление любых присутствующих защитных групп может осуществляться обычными способами. Так, аралкилгруппа, такая как бензил, может быть расщеплена гидрогенолизом в присутствии катализатора /например, палладия на древесном угле/; ацильная группа, такая как N-бензилоксикарбонил, может быть удалена гидролизом, например, при помощи бромистого водорода в уксусной кислоте, либо путем восстановления, например, каталитическим гидрированием, защитные кремниевые группы могут быть, например, удалены путем обработки ионом фтора либо гидролизом в кислой среде, тетрагидропирановые группы могут быть расщеплены гидролизом в кислой среде.
Понятно, что в любом из общих процессов от /А/ до /Д/, описанных выше, может оказаться необходимым либо желательным защитить какие-либо чувствительные группы в молекулах так, как только что было описано. Поэтому после вышеописанных процессов от /А/ до /Д/ может следовать ступень, включающая устранение защиты с защищенного производного от общей формулы /I/ или ее соли.
Таким образом, в соответствии с еще одним аспектом изобретения вслед за процессами от /А/ до /Д/ при необходимости и/или желательности могут осуществляться в любой приемлемой последовательности следующие реакции:
/I/ удаление каких-либо защитных групп;
/II/ перевод вещества по формуле /I/ либо его соли в его фармацевтически приемлемую соль.
Если желательно выделить какое-либо вещество по настоящему изобретению в виде соли, например, кислой соли, то это можно осуществить путем обработки свободного основания по общей формуле /I/ подходящей кислотой, предпочтительно в эквивалентном количестве, либо обработкой креатининсульфатом в подходящем растворителе /например, в водном этиловом спирте/.
Помимо применения в качестве главной финальной ступени в процессе приготовления, вышеописанные общие методы приготовления веществ, составляющих предмет настоящего изобретения, могут быть использованы и для введения желаемых групп на какой-либо промежуточной ступени процесса приготовления нужного вещества. При этом следует иметь ввиду, что в подобных многоступенчатых процессах последовательность реакций следует выбирать таким образом, чтобы условия протекания реакций не оказывали воздействия на те присутствующие в молекуле группы, которые хотят иметь в конечном продукте.
Представляется, что биологическая активность веществ по формуле /I/ определяется энантиомером S, а энантиомер R обладает лишь малой либо нулевой активностью. Поэтому в общем случае энантиомер S вещества по формуле /I/ предпочтительнее смеси R и S энантиомеров, например, рацемической смеси. Тем не менее, если необходим энантиомер R, например, для контрольных исследований или для синтеза других веществ, он может быть легко получен по вышеописанной процедуре, если использовать энантиомер вещества по формуле /III/, полученного по методу, описанному в '512.
Вещество по формуле /I/, полученное с использованием реакций в соответствии со схемами I, IA или IB, может быть очищено обычными методами, например, хроматографией, дистилляцией либо кристаллизацией.
Анализ по методу расщепляемого комплекса "ин витро".
В нижеследующей табл. A приведена ингибирующая активность веществ по формуле /I/ по отношению к топоизомеразе типа I. Анализ, выполненный по методу описанному Хсиянгом в Hsiang, et al., J. Biol. Chem., 260: 14873-14878 (1985), хорошо коррелирует с противоопухолевой активностью "ин виво" ингибиторов топоизомеразы, например, камптотехина и его аналогов, определенной на животных, зараженных раком. См. Hsiang et al., Cancer Research, 49: 4385-4389 (1989); Jaxel et al., Cancer Research, 49: 1465-1469 (1989).
Вещества, проявляющие заметную активность при концентрациях более 2000 наномолей (отмечены "+" в табл. A), считаются слабо либо умеренно активными, а вещества, активные при концентрациях менее 500 наномолей - весьма активными /в табл. A отмечены "++++"/. Термин "IC50" означает такую концентрацию вещества по формуле /I/, при которой 50% субстрата ДНК захватываются топоизомеразой I.
Было установлено также, что вещества по формуле /IV/ также обладают хорошей ингибирующей активностью по отношению к топоизомеразе 1.
Ксенотрансплантаты человеческой опухоли
В последние годы для оценки противоопухолевой активности противораковых химиотерапевтических препаратов широко использовалась ксенотрансплантация человеческих опухолей лабораторным мышам. - см. Giovanella, B.C., Stehlin, Jr. , J.S., Shepard, R.C. and Williams, Jr., L.J., "Correlation between response to chemotherapy of human tumors in patients and in nude mice", Cancer 52: 1146-1152, (1983); Boven, E. and winograd, B, Eds. The Nude Mouse in Oncology Research CRC Press, Inc., Boca Raton, FL, (1991); and Fiebig, H.H., "Comparison of tumor response in nude mice and in patients", Human Tumour Xenografts in Anticancer Drug Development, Winograd, B., Peckham, M.J., and Pinedo, H.M., Eds., E.S.O. Mongraphs, Springer, Heidelberg, 25 (1988).
В общем случае ксенотрансплантанты человеческих опухолей сохраняют не только гистологические, биохимические и антигенные характеристики, но и чувствительность к химиотерапевтическим препаратам исходной опухолевой ткани /Boven, et al. - цит. ист.). Продолжительные исследования предоставили свидетельства того, что ксенотрансплантаты человеческих опухолей сохраняют эти важные биологические свойства исходной опухоли, включая биологическую нестабильность, которая, как известно, встречается в опухолях у пациентов /Boven, et al. - цит. ист./. Особенно важно, что, как показал ряд исследователей, наблюдается хорошая корреляция между эффектами, оказываемыми медикаментами на ксенотрансплантаты человеческих опухолей, и клиническими результатами у пациентов /Giovanella и Fiebig - цит.ист./.
Тест "ин виво" на ксенотрансплантате человеческой колоректальной аденокарциномы НТ-29.
Для этой модифицированной версии теста, описанного Джованеллой /B.C. Giovanella, et al. , Science, 246, 1046 (1989)/ использовались самки мышей весом 21±2 г. В день 0 контрольным и подопытным животным в подлопаточную область подкожно вводилась суспензия, содержащая 106 жизнеспособных клеток человеческой опухоли толстой кишки НТ-29. Перед началом применения лекарственного средства опухолям была дана возможность расти в течение 2 недель. Основываясь на активности "ин витро" против типоизомеразы I, для каждого из лекарственных средств было выбрано несколько доз. Для каждого уровня доз подопытная группа состояла из 8 животных. Испытуемые вещества готовились в 0,1 М ацетатном буфере, pH 5 /носитель "а"/, либо в 87,5%-ном буферном солевом фосфатном растворе, 12,375%-ном диметилсульфоксиде и 0,125%-ном твин 80 /фирменная марка фирмы "Ай-Си-Ай Америка" для полиоксиэтиленсорбитанмоноолеата/ /носитель "б"/ и вводились подкожно дважды в неделю в течение 5 недель, начиная с дня 14. Дозы вводились на основе отношения мг/кг в соответствии со средним весом тела для каждой клетки.
Вес опухоли рассчитывался на основе данных двух перпендикулярных замеров опухоли циркулем по формуле: вес опухоли = длина х ширина2 /2/размеры в миллиметрах/. На всем протяжении эксперимента вес опухоли контролировался для каждого животного. Для каждой группы результаты эксперимента выражались отношением среднего веса опухоли сразу после 5 недель лечения /день 50/ к среднему весу опухоли непосредственно перед началом лечения /день 14/. В табл. B приведены результаты эксперимента. Для каждого из носителей в контрольной группе это отношение равно примерно 20, что означает, что опухоль при отсутствии лечебного воздействия за время эксперимента увеличилась по весу примерно в 20 раз. Если указанное отношение равно 1, то это означает стаз опухоли, а отношение меньше - 1 - регрессию опухоли. Следовательно, вещества 4 и 6 привели к стазу опухоли, а вещества 11 и 23 вызвали регрессию опухоли. Критерием наличия противоопухолевой активности является по меньшей мере 50%-ное подавление роста опухоли после 5 недель применения лекарственных доз /день 50/, что соответствует отношению меньшему или равному 10.
Практическая полезность
С точки зрения такой активности, вещества по формуле /I/ являются активными против широкого спектра опухолей млекопитающих (включая человека) и канцерогенных новообразований, таких как рак ротовой полости и глотки (губы, языка, рта, глотки), пищевода, желудка, тонкой, толстой и прямой кишок, печени и желчных проток, поджелудочной железы, гортани, легких (включая немелкоклеточную карциному легких), костной и соединительной тканей, кожи, ободочной кишки, молочной железы, шейки матки, матки, яичников, предстательной железы, яичек, мочевого пузыря, почек и других тканей мочевыделительной системы, глаз, мозга и центральной нервной системы, щитовидной и других эндокринных желез, лейкозы (лимфоцитарный, ганулоцитарный, моноцитарный), болезнь Ходжкина, лимфомы неходжкинского типа, множественная миелома и т.д. Здесь термины "опухоль", "рак", и "канцерогенное новообразование" использованы как синонимы.
Конечно, количество вещества по формуле /I/, необходимого для эффективного его использования в качестве противоопухолевого препарата, варьирует в зависимости от индивидуальных особенностей млекопитающего, подвергаемого лечению, и целиком относится к компетенции практикующего врача или ветеринара. При этом необходимо учитывать такие факторы, как состояние пациента или животного, способ введения препарата, характер препарата, вес тела млекопитающего, площадь поверхности, возраст, и общее состояние и конкретный состав, намечаемый к приему. Тем не менее, приемлемая эффективная противоопухолевая доза лежит в диапазоне от примерно 0,1 до примерно 200 мг/кг веса тела в день, предпочтительно, в диапазоне от примерно 1 до примерно 100 мг/кг в день. Полная дневная доза может даваться в один прием, в несколько приемов, например, от двух до шести раз в день, либо в виде внутривенных вливаний различной продолжительности. Дозы, превышающие либо лежащие ниже указанного выше диапазона, также попадают под настоящее изобретение, и могут даваться отдельным пациентам, в случае необходимости или желательности.
Например, для млекопитающего весом 75 кг величина дозы лежит в диапазоне от 75 до 7500 мг в день, а обычная доза - около 800 мг в день. Если указаны многократные дозы, то обычный курс может составлять 200 мг вещества по формуле /I/ 4 раза в день.
Лекарственные составы
В соответствии с настоящим изобретением составы для медицинского употребления включают в себя активное вещество, т.е. вещество во формуле /I/, а также его подходящий носители и, при желании, другие терапевтически активные ингредиенты. Носитель должен быть фармацевтически приемлемым в том смысле, что он должен быть совместимым с другими ингредиентами состава, и не оказывать вредного воздействия на пациента.
Таким образом, изобретение далее дает лекарственные составы, состоящие из вещества по формуле /I/ и его фармацевтически приемлемого носителя.
Составы включают составы, пригодные для перорального, ректального, вагинального, трансдермального либо парентерального (включая подкожного, внутримышечного, внутривенного) введения. Предпочтительными составами являются составы для перорального или парентерального введения.
Составы удобно готовить в дозированных формах, которые могут изготавливаться по любому из хорошо известных в фармацевтии методов. Все эти методы включают этап, на котором активное вещество входит в контакт с носителем, состоящим из одного или нескольких дополнительных ингредиентов. Обычно составы готовятся путем ввода активного вещества в равномерный и тесный контакт с жидким или тонкоизмельченным твердым носителем, после чего в случае необходимости полученному продукту придают желаемую форму, содержащую необходимую дозу.
Составы по изобретению, пригодные для перорального введения, могут делаться в виде отдельных единиц, таких как капсулы, крахмальные облатки, таблетки или лепешки, каждая из которых содержит заранее определенное количество активного вещества; в виде порошка или гранул; в виде суспензии или раствора водной или неводной жидкой среде, например в виде сиропа, эликсира, эмульсии или дозы.
Таблетка может быть изготовлена прессованием или формованием, с одним или несколькими дополнительными ингредиентами в зависимости от желания. Прессованные таблетки могут изготавливаться путем прессования в подходящей машине активного компонента, поступающего в свободнотекучей форме, например, в виде порошка, или гранул, при желании смешиваемого с дополнительными ингредиентами, например, связующими, смазками, инертными разбавителями, поверхностно-активными и диспергирующими веществами.
Формованные таблетки могут изготавливаться в подходящих машинах формовкой смеси порошкообразного активного вещества с любым приемлемым носителем.
Сироп или суспензия могут приготовляться путем добавки активного вещества в концентрированный водный раствор какого-либо сахара, например, сахарозы, к которому могут быть также добавлены любые дополнительные ингредиенты. Эти дополнительные ингредиенты (ингредиент) могут включать корригент, агент, подавляющий кристаллизацию сахара, или вещество, повышающее растворимость любого другого ингредиента, такого как многоатомный спирт, - например, глицерин или сорбит.
Составы для ректального или вагинального введения могут изготавливаться в виде суппозитория с обычным носителем, например, кокосовым маслом или витепсолом 55 /фирменная марка немецкой компании "Динамит Нобель кемикэл" для суппозиторной основы/.
Для трансдермального введения вещества, составляющие предмет изобретения, могут изготавливаться в виде кремов, гелей, мазей или лосьонов, а также в виде трансдермальных накладок. Такие составы могут приготавливаться на водной или масляной основе с добавкой подходящих сгущающих, желатинирующих, эмульсифирующих, димпергирующих, суспензирующих и/или окрашивающих агентов.
Составы, пригодные для парентерального введения, обычно представляют собой водный препарат активного вещества, предпочтительно изотонический крови пациента. Пригодными среди таких составов являются растворы или суспензии фармацевтически и фармакологически приемлемым кислых солей вещества по формуле /I/, изотоничные крови пациента. Так, подобные составы для удобства могут содержать дистиллированную воду, 5%-ный раствор декстрозы в дистиллированной воде или солевом растворе, а также фармацевтически и фармакологически приемлемую кислую соль вещества по формуле /I/, которая имеет достаточную растворимость в этих растворителях, например, хлоргидрат. Практически полезные составы также включают в себя концентрированные растворы или твердые вещества, содержащие вещество по формуле /I/, которые при разбавлении подходящим растворителем дают растворы, пригодные для вышеописанного парентерального введения.
В дополнение к вышеназванным ингредиентам, составы по настоящему изобретению могут включать один или несколько необязательных ингредиентов, которые используются в современных фармацевтических составах, например, разбавители, буферы, корригирующие вещества, связующие, поверхностно-активные вещества, сгустители, смазывающие вещества, суспензирующие вещества, консерванты (включая антиоксиданты) и т.п.
Различные аспекты изобретения иллюстрируются нижеследующими примерами, однако эти примеры не должны истолковываться как ограничивающие. Символы и условные термины, используемые в этих примерах, соответствуют тем, которые применяются в современной химической литературе, например, в "Журнале американского химического общества" /Journal of the American Chemical Society/. Термин "комнатная температура" здесь обозначает температуру примерно 25oC.
Пример 1. 7-диметиламинометилен-10,11-метилендиокси- 20(R,S)-камптотецин (вещество 1).
/A/ 3,4-метилендиоксиацетанилид.
К коммерчески производимым 3,4-метилендиоксианилину (17,0 г, 124 ммоль) и карбонату натрия (15,5 г, 136 ммоль) в хлороформе (90 мл) при 5oC по каплям и с перемешиванием добавляли хлористый ацетил (8,8 г, 124 ммоль). Реагентам давали возможность нагреться до комнатной температуры, и продолжали помешивание примерно 18 ч. Реакционная смесь дважды промывалась примерно 50 мл 1 H раствора HCl, органический слой высушивался (MgSO4), растворитель удалялся, после чего получался коричневый твердый продукт. Рекристаллизацией из воды при обработке активированным углем получали светло-коричневый твердый продукт - 3,4-метилендиоксиацетанилид (9,34 г, 42,1% от теоретического).
Элементный анализ: (C9H9NO3)
Определено, %: C 60,34; H 5,04; N 7,79.
Расчетное значение, %: C 60,33; H 5,06; N 7,82.
/B/ 2'-ацетиламино-4',5'-метилендиокси-2-хлорацетофенон.
К смеси хлористого цинка (24,3 г, 178,3 ммоль) и хлорацетилхлорида (16,1 мл, 202,1 ммоль) в нитрометане (85 мл) в азотной среде при комнатной температуре, перемешивали, по каплям добавляли 3,4-метилендиоксиацетанилид (8,96 г, 50,0 ммоль) в нитрометане (15 мл). Затем эту смесь нагревали с обратным холодильником в течение 1,5 ч, смеси давали возможность остыть до комнатной температуры, затем ее выливали на лед и проводили экстракцию метиленхлоридом, который после этого удалялся испарением и получали твердый коричневый продукт. Этот твердый продукт подвергался рекристаллизации из смеси этилацетата и гексана (включая обработку активированным углем), в результате чего получали 2'-ацетиламино-4', 5'-метилендиокси-2-хлорацетофенон в виде желтых кристаллов (831,3 мг, 6,5% от теоретического).
1H-NMR (CDCl3): δ 8,45 (s, 1H), 7,2 (s, 1H), 6,09 (s, 2H), 4,65 (s, 2H), 2,25 (s, 3H).
/C/ 3,4-метилендиоксипивалоиланилид.
Это вещество готовилось по методу, описанному в примере 1a, за исключением того, что вместо хлористого ацетила использовалось эквивалентное количество 2,2-диметилпропаноилхлорид.
/D/ 2'-пивоиламино-4',5'-метилендиокси-2-хлорацетофенон.
Это вещество готовилось по методу, описанному в примере 1b, за исключением того, что вместо 3,4-метилендиоксиацетанилида использовалось эквивалентное количество 3,4-метилендиоксипивалоиланилида.
/E/ 2'-амино-4',5'-метилендиокси-2-хлорацетофенон.
К 2'-ацетиламино-4', 5'-метилендиокси-2-хлорацетофенону (0,9 г, 3,53 ммоль) либо эквивалентному количеству 2'-пивоиламино-4',5'-метилендиокси-2-хлорацетофенона в этаноле (60 мл) при примерно 5oC по каплям добавлялась концентрированная HCl (12,5 мл, 149,7 ммоль). Затем реакционная смесь нагревалась с обратным холодильником в течение примерно одного часа, после чего выливалась на 2 H NaOH/лед (80 мл/60 г) и промывалась этилацетатом (3•70 мл). Органические части объединялись и промывались солевым раствором (50 мл), высушивались (безводным сульфатом натрия) и концентрировались под вакуумом, в результате чего получали желто-зеленый твердый продукт. Этот твердый продукт рекристаллизовывался из этилацетата/изопропанола/гексана, обрабатывался активированным углем, в результате чего получали 2'-амино-4', 5'-метилендиокси-2-хлорацетофенон (0,39 г, 52% от теоретического).
Элементный анализ: (C9H8NO3Cl)
Определено, %: C 50,66; H 3,80; N 6,47.
Расчетное значение, %: C 50,60; H 3,77; N 6,56.
/F/ 5'(R,S)-1,5-диоксо-(5'-эти-5'-окси-2'H,5'H,6'H-6- оксопирано)/3',4'- 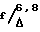 -тетрагидроиндолизин и 5'(S)-1,5-диоксо-(5'-этил-5'-окси-2'H, 5'H, 6'H-6-оксопирано)/3', 4'-
-тетрагидроиндолизин и 5'(S)-1,5-диоксо-(5'-этил-5'-окси-2'H, 5'H, 6'H-6-оксопирано)/3', 4'- 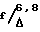 -тетрагидроиндолизин (вещества по формуле III).
-тетрагидроиндолизин (вещества по формуле III).
Эти соединения, которые в дальнейшем именуются "трицикличный кетон (R, S)" и "трицикличный кетон (S)" соответственно и совместно "вещество по формуле (III), готовились по методике, описанной Wani и др. в патенте США 5053512. Отметим, что соответствующий энантиомер R также может быть приготовлен по методике патента США 5053512.
/G/ 7-хлорметил-10,11-метилендиокси-20(R,S)-капмтотецин.
Следуя общей методике получения камптотецина, описанной в патенте США 5053512, 2'-амино-4,5-метилендиокси-2-хлорацетофенон перемешивался в орошающем толуоле (50 мл) с трицикличным кетоном (R,S) (256,3 мг, 0,97 ммоль) под ловушкой Дина-Старка в течение получаса. Затем реагенты охлаждались, твердый осадок отфильтровывался и промывался толуолом и этанолом, в результате чего получали 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецин (408,5 мг, 68,8%).
1H-300 NMR (DMCO-d6): δ 7,72 (s, 1H), 7,55 (s, 1H), 7,2 (s, 1H), 6,34 (s, 2H), 5,42 (s, 2H), 5,32 (s, 2H), 5,24 (s, 2H), 1,85 (m, 2H), 0,88 (t, 3H).
Номинальный масс-спектр M+1:
Расч.: 441;
Определено: 441.
/H/ 7-диметиламинометилен-10,11-метилендиокси-20(R,S)-камптотецин.
К перемешиваемой смеси 7-хлорметил-10,11-метилендиокси-(R,S)-камптотецину (0,11 г, 0,25 ммоль) и карбоната кальция (346 мг, 0,5 ммоль) в диметилформамиде (ДМФ) (1 мл) добавляли диметиламин (6,1 мл, 0,5 ммоль) в виде раствора в тетрагидрофуране (3,73 мг/мл) при температуре приблизительно 5oC. Реакционная смесь надежно закупоривалась, ей давали возможность прогреться до комнатной температуры и перемешивали в течение примерно 15 ч. После этого фильтрованием удаляли твердый материал. Фильтрат концентрировался вакуумным выпариванием до образования густого остатка. Остаток растворялся минимальным количеством хлороформа и разделялся хроматографированием на силикагеле марки "флэш" (flash grade), элюировавшимся последовательно порциями 250 мл этилацетата, затем 250 мл (9:1 этилацетата, изопропанола), и, наконец, 250 мл (4:1 этилацетата, изопропанола). Фракции собирались, анализировались на тонкослойном хроматографе (5%-ный метанол, этилацетат) и проявлялись ультрафиолетовой лампой. Нужные фракции собирались, концентрировались и высушивались под вакуумом, в результате чего получали 7-диметиламинометилен-10,11-метилендиокси-камптотецин (6,0 мг, 4,7%). Это вещество было идентифицировано как его соль уксусной кислоты.
Точка плавления (т.п.) >250oC.
Элементный анализ: (C24H23N3O3• C2H4O2)
Определено, %: C 61,64; H 5,17; N 8,73.
Расчетное значение, %: C 61,29; H 5,34; N 8,25.
/I/ Форма с разомкнутым кольцом E.
Вещество, описанное в разделе /H/, обрабатывалось эквивалентным количеством гидроокиси натрия, что приводило к получению соответствующей формы с разомкнутым кольцом E. Обработка последнего эквивалентным количеством соляной кислоты замыкает кольцо E, тем самым восстанавливая вещество по разделу /H/.
Пример 2. 7-диметиламинометилен-10,11-метилендиокси-20(S)-камптотецин (вещество 2).
/A/ 7-хлорметил-10,11-метилендиокси-20(S)-камптотецин
Это вещество получали по методике, описанной в примере 1, за исключением того, что в разделе /G/ вместо трицикличного кетона (R,S) использовался трицикличный кетон (S).
Т.п. >250oC.
/B/ 7-диметиламинометилен-10,11-метилендиокси-20(S)-камптотецин.
Это вещество получали по методике, описанной в примере 1, раздел /H/, за исключением того, что вместо 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-метилендиокси-20(S)-камптотецина, приготовленного согласно примеру 2, раздел /A/.
Т.п. >250oC.
Номинальный масс-спектр M+1:
Расч.: 450;
Определено: 450.
Пример 3. 7-диметиламинометилен-10,11-этилендиокси-20(R,S)-камптотецин (вещество 3)
/A/ 7-хлорметил-10,11-этилендиокси-20(R,S)-камптотецин.
Это вещество получали по методике, описанной в примере 1, за исключением того, что в разделах /A/ и /C/ вместо 3,4-метилендиоксианилина использовалось эквивалентное количество 3,4-этилендиоксианилина.
Масс-спектр высокого разрешения M+1:
Расч.: 455, 1009;
Определено: 455, 1005.
/B/ 7-демитиламинометилен-10,11-этилендиокси-20(R,S)-камптотецин.
Это вещество получали по методике, описанной в примере 1, раздел /H/, за исключением того, что вместо 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(R,S)-камптотецина.
Масс-спектр высокого разрешения M+1:
Расч.: 464, 1821;
Определено: 464, 1833.
Пример 4. 7-деметиламинометилен-10,11-этилендиокси-20(S)-камптотецин (вещество 4).
/A/ 7-хлорметил-10,11-этилендиокси-20(S)-камптотецин.
Это вещество получали по методике, описанной в примере 1, за исключением того, что в разделах /A/ и /C/ вместо 3,4-метилендиоксианилина использовалось эквивалентное количество 3,4-этилендиоксианилина, а в разделе /G/ вместо трициклического кетона (R,S) использовалось эквивалентное количество трицикличного кетона (S).
Масс-спектр высокого разрешения M+1:
Расч.: 455, 1009;
Определено: 455, 1000.
/B/ 7-диметиламинометилен-10,11-этилендиокси-20(S)- камптотецин.
Это вещество получали по методике, описанной в примере 1, раздел /H/, за исключением того, что вместо 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(S)-камптотецина.
Масс-спектр высокого разрешения:
Расч.: 464, 1821;
Определено: 464, 1811.
Пример 5. 7-морфолинметилен-10,11-этилендиокси-20(R, S)-камптотецин (вещество 5).
Использовалась та же методика, как и в примере 1, часть /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество морфолина, а вместо 7-хлорметил-10,11-метилендиокси-20(R, S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(R, S)-камптотецина, приготовленного в соответствии с примером 3, часть /B/.
Масс-спектр высокого разрешения:
Расч.: 506, 1942;
Определено: 506, 1925.
Пример 6. 7-морфолинметилен-10,11-этилендиокси-20(R, S)-камптотецин (вещество 6).
Использовалась та же методика, как и в примере 1, часть /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество морфолина, в вместо 7-хлорметил-10,11-метилендиокси-20(R, S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(R, S)-камптотецина, приготовленного в соответствии с примером 4, часть /B/.
Масс-спектр высокого разрешения:
Расч.: 506, 1942;
Определено: 506, 1929.
Пример 7. 7-пирролидинметилен-10,11-этилендиокси-20(R, S)-камптотецин (вещество 7).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество пирролидина, а вместо 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(R, S)-камптотецина, приготовленного в соответствии с примером 3, раздел /A/.
Масс-спектр высокого разрешения:
Расч.: 490, 1978;
Определено: 490, 1988.
Пример 8. 7-пиперидинметилен-10,11-метилендиокси-20(R, S)- камптотецин (вещество 8).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество пиперидина.
Номинальный масс-спектр M+1:
Расч.: 490;
Определено: 490.
1H-300 NMR (DMCO-d6): δ 7,95 (s, 1H), 7,62 (s, 1H), 7,29 (s, 1H), 6,35 (s, 2H), 5,49 (s, 2H), 5,41 (s, 2H), 4,85 (широкий s, 2H), 1,9-0,7 (m, 11H).
Пример 9. 7-пиперидинметилен-10,11-этилендиокси-20(R, S)-камптотецин (вещество 9).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество пиперидина, а вместо 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(R, S)-камптотецина, приготовленного в соответствии с примером 3, раздел /A/.
Масс-спектр высокого разрешения:
Расч.: 504, 2127;
Определено: 504, 2129.
Пример 10. 7-(4-метилпиперазинметилен)-10,11-этилендиокси-20(R, S)-камптотецин (вещество 10).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество 4-метилпиперазина, а вместо 7-хлорметил-10,11-метилендиокси-20(R, S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(R,S)-камптотецина, приготовленного в соответствии с примером 3, раздел /A/.
Масс-спектр высокого разрешения:
Расч.: 519, 2236;
Определено: 519, 2246.
Пример 11. 7-(4-метилпиперазинметилен)-10,11-этилендиокси-20(S)-камптотецин (вещество 11).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество 4-метилпиперазина, а вместо 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(S)-камптотецина, приготовленного в соответствии с примером 4, раздел /A/.
Т.п. = 261-264oC.
Номинальный масс-спектр M+1:
Расч.: 519;
Определено: 519.
Пример 12. 7-диэтиламинометилен-10,11-метилендиокси-20(S)-камптотецин (вещество 12).
Это вещество получали по методике, описанной в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество диэтиламина, а вместо 7-хлорметил-10,11-метилендиоксид-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-метилендиокси-20(S)-камптотецин, приготовленный согласно примера 2, раздел /A/.
Масс-спектр высокого разрешения:
Расч.: 478, 1978;
Определено: 478, 1963.
Пример 13. 7-диэтиламинометилен-10,11-этилендиокси-20(R,S)-камптотецин (вещество 13).
Использовалась та же методика, что и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество диэтиламина, а вместо 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(R, S)-камптотецина, приготовленного в соответствии с примером 3, раздел /A/.
Масс-спектр высокого разрешения:
Расч.: 492, 2134;
Определено: 492, 2140.
Пример 14. 7-диэтиламинометилен-10,11-этилендиокси-20(S)- амптотецин (вещество 14).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество диэтиламина, а вместо 7-хлорметил-10,11- метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(S)-камптотецина, приготовленного в соответствии с примером 4, раздел /A/.
Масс-спектр высокого разрешения:
Расч.: 492, 2134;
Определено: 492, 2122.
Пример 15. 7-N-метилэтаноламинометилен-10,11-метилендиокси-20(R,S)-камптотецин (вещество 15).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество N-метилэтаноламина.
Масс-спектр высокого разрешения:
Расч.: 480, 1771;
Определено: 480, 1776.
Пример 16. 7-N-метилэтаноламинометилен-10,11-этилендиокси-20(R,S)-камптотецин (вещество 16).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество N-метилэтаноламина, а вместо 7-хлорметил-10,11-метилендиокси-20(R, S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(R,S)-камптотецина, приготовленного в соответствии с примером 3, раздел /A/.
Масс-спектр высокого разрешения:
Расч.: 494, 1927;
Определено: 494, 1929.
Пример 17. 7-диэтаноламинометилен-10,11-этилендиокси-20(R,S)-камптотецин (вещество 17).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество диэтаноламина, а вместо 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(R, S)-камптотецина, приготовленного в соответствии с примером 3, раздел /A/.
Масс-спектр высокого разрешения:
Расч.: 524, 2024;
Определено: 524, 2026.
Пример 18. 7-диэтаноламинометилен-10,11-этилендиокси-20(S)-камптотецин (вещество 18) в тексте, очевидно, ошибочно, указано 19-прим.пер.
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество диэтаноламина, а вместо 7-хлорметил-10,11-метилендиокси-20(R,S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(S)-камптотецина, приготовленного в соответствии с примером 4, раздел /A/.
Т.п. = 230-233oC.
Номинальный масс-спектр M + 1:
Расч.: 524;
Определено: 524.
Пример 19. 7-азетидинметилен-10,11-метилендиокси-20(R, S)-камптотецин (вещество 19).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество азетидина.
Т.п. > 250oC.
Номинальный масс-спектр M + 1:
Расч.: 462;
Определено: 462.
Пример 20. 7-азетидинметилен-10,11-метилендиокси-20(S)-камптотецин (вещество 20).
Это вещество получали по методике, описанной в примере 1, за исключением того, что в разделе /G/ вместо трицикличного кетона /R,S/ использовалось эквивалентное количество трицикличного кетона (S), а в разделе /H/ вместо диметиламина использовалось эквивалентное количество азетидина.
Масс-спектр высокого разрешения:
Расч.: 462, 1665;
Определено: 462, 1667.
Пример 21. 7-тиоморфолинметилен-10,11-этилендиокси-20(S)-камптотецин (вещество 21).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество тиоморфолина, а вместо 7-хлорметил-10,11-метилендиокси-20(R, S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(S)-камптотецина, приготовленного в соответствии с примером 4, раздел /A/.
Т.п. = 249-252oC.
Номинальный масс-спектр M + 1:
Расч.: 522;
Определено: 522.
Пример 22. 7-азетидинметилен-10,11-этилендиокси-20(S)-камптотецин (вещество 22).
Использовалась та же методика, как и в примере 1, раздел /H/, за исключением того, что вместо диметиламина использовалось эквивалентное количество азетидина, а вместо 7-хлорметил-10,11-метилендиокси-20(R, S)-камптотецина использовалось эквивалентное количество 7-хлорметил-10,11-этилендиокси-20(S)-камптотецина, приготовленного в соответствии с примером 4, раздел /А\.
Т.п. = 208-210oC (декомпозиция).
Масс-спектр низкого разрешения: 476,2 (электронное распыление).
Пример 23. 7-4-метилпиперазинметилен-10,11-метилендиокси-20(S)-камптотецин (вещество 23).
Это вещество получали по методике, описанной в примере 1, за исключением того, что в разделе /G/ вместо трицикличного кетона (R,S) использовалось эквивалентное количество трицикличного кетона (S), а в разделе /H/ вместо диметиламина использовалось эквивалентное количество 4-метилпиперазина.
Масс-спектр высокого разрешения:
Расч.: 505, 2083;
Определено: 505, 2087.
Пример 24. 7-трифторацетамидметилен-10,11-этилендиокси-20(S)-камптотецин (вещество 24).
/A/ 2'-амино-4',5'-метилендиокси-2-трифторацетамидацетофенон.
Трифторацетамин (227 мг, 2 ммоль) добавлялся в раствор карбоната цезия (1,63 г, 5 ммоль) в безводном ацетонитриле (15 мл) при комнатной температуре и в азотной среде. Затем добавляли 2'-амино-4',5'-метилендиокси-2-хлорацетофенон, и смесь помещали в масляную ванну, нагретую до 90oC, на срок в 30 мин. Реагенты охлаждались до комнатной температуры и выливались прямо на кремнеземную пробку (15 г) в scintered стеклянной воронке. Кремнезем дважды промывался EtOAc, и летучие вещества от обеих промывок удалялись под вакуумом. Для растирания остатка в порошок использовался диэтиловый эфир, полученный светло-оранжевый твердый продукт отделялся фильтрацией и высушивался под вакуумом (498 мг, 86%).
Т.п. = 219-220oC.
1H NMR (300 MHz, DMSO-d6): δ 4,44 (d, 2H); 5,96 (s, 2H); 5,96 (s, 2H); 6,35 (s, 1H); 7,21 (s, 1H); 7,40 (bs, 2H); 9,59 (t, 1H).
Номинальная ожидаемая масса: MH+ = 291 м/е.
Определено: MH+ = 291 м/е.
/B/ 2'-амино-4',5'-этилендиокси-2-трифторацетамидацетофенон.
Это вещество получали по методу, описанному выше, за исключением того, что вместо 2'-амино-4',5'-метилендиокси-2-хлорацетофенона использовалось эквивалентное количество 2'-амино-4', 5'-этилендиокси-2-хлорацетофенона. Был выделен зеленый твердый продукт при выходе в 74%.
Т.п. = 154-155oC.
1H NMR (300 MHz, CDCl3): δ 4,08 (m, 2H); 4,13 (m, 2H); 4,60 (d, 2H); 6,0 (bs, 2H); 6,08 (s, 1H); 7,04 (s, 1H); 7,60 (t, 1H).
Номинальная ожидаемая масса: MH+ = 305 м/е.
Определено: MH+ = 305 м/е.
/C/ 10,11-этилендиокси-7-трифторацетамидметилен-20(S)-камптотецин.
В атмосфере азота смешивались 2'-амино-4',5'-этилендиокси-2-трифторацетамидацетофенон (71 мг, 0,234 ммоль), трицикличный кетон (S) (61 мг, 0,234 ммоль) и безводный толуол (2,0 мл) при 60oC. Перед тем как довести температуру реакции до начала дефлегмации, было добавлено каталитическое количество ледяной уксусной кислоты и моногидрата p-толуолсульфокислоты. Дефлегмация проводилась в течение 16 ч, после чего реагенты охлаждались до комнатной температуры. Зелено-желтый твердый продукт собирался при помощи фильтрования, промывался этанолом и диэтиловым эфиром и высушивался вод вакуумом (101 мг, 84%).
Т.п. = 249oC.
IH NMR (300 MHz, DMSO-d6) : δ 0,91 (t, 3H); 1,91 (m, 2H); 4,40 (s, 4H); 4,83 (d, 2H); 5,39 (s, 2H); 5,41 (s, 2H); 6,48 (s, 1H); 7,22 (s, 1H); 7,58 (s, 1H); 7,77 (s, 1H); 10,20 (t, 1H).
Номинальная ожидаемая масса: MH+ = 532 м/е.
Определено MH+ = 532 м/е.
Пример 25. 7-трифторацетамидметилен-10,11-метилендиокси-20(S)-камптотецин (вещество 25).
Это вещество получали по методу, описанному в вышеприведенном примере 24, за исключением того, что вместо 2'-амино-4',5'-этилендиокси-2-трифторацетамидацетофенона использовалось эквивалентное количество 2'-амино-4', 5'-метилендиокси-2-трифтор-ацетамидацетофенона. Зелено-желтый твердый продукт был выделен при выходе 15%.
Т.п. =238oC (д.).
1H-300 NMR (DMSO-d6): δ 0,91 (t, 3H); 1,95 (m, 2H); 4,92 (s, 2H); 5,38 (s, 2H); 5,40 (s, 2H); 6,28 (s, 2H); 6,49 (s, 1H); 7,13 (s, 1H); 7,58 (s, 1H); 7,78 (s, 1H), 10,21 (t, 1H).
Номинальная ожидаемая масса: MH+ = 518 м/е.
Определенно MH+ = 518 м/е.
Пример 26. 7-аминометилен-10,11-этилендиокси-20(S)-камптотецин дигидрохлорид (вещество 26).
7-трифторацетамидметилен-10,11-этилендиокси-20(S)-камптотецин (65 мг, 0,12 ммоль) в течение 20 мин нагревался в водной 2H соляной кислоте (1,2 мл) до 105oC в открытой колбе. Летучие вещества удалялись под вакуумом, остаток растирался с этилацетатом в порошок и собирался фильтрованием. Ярко-желтый твердый продукт промывался этилацетатом (3 мл), этанолом (2 мл) и диэтиловым эфиром (2 мл), высушивался под вакуумом (62 мг, 100%).
Т.п. >300oC.
1H NMR (300 MHz, DMSO-d6): δ 0,90 (t, 3H); 1,95 (m, 2H); 4,41 (s, 4H); 4,61 (d, 2H); 5,40 (s, 2H); 5,45 (s, 2H); 7,24 (s, 1H); 7,60 (s, 1H); 7,81 (s, 1H); 8,40 (bs, 2H).
Номинальная ожидаемая масса: MH+ = 436 м/е.
Определено: MH+ = 436 м/е.
Пример 27. 7-аминометилен-10,11-метилендиокси-20(S)-камптотецин дигидрохлорид (вещество 27).
Это вещество получали по методу, описанному в вышеприведенном примере 26, за исключением того, что вместо 7-трифторацетамидметилен-10,11-этилендиокси-20(S)-камптотецина было использовано эквивалентное количество 7-трифторацетамидметилен-10,11-метилендиокси-20(S)-камптотецина. Был выделен золотисто-желтый твердый продукт в ощутимом количестве.
T.п. = 270oC (д).
1H NMR (300 MHz, DMSO-d6): δ 0,90 (t, 3H); 1,9 (m, 2H); 4,6 (m, 2H); 5,4 (s, 2H); 5,4 (s, 2H); 5,5 (s, 2H); 6,3 (s, 2H); 7,2 (s, 1H); 7,6 (s, 1H); 7,9 (s, 1H); 8,4 (bs, 2H).
Номинальная ожидаемая масса: MH+ = 422 м/е.
Определено: MH+= 422 м/е.
Пример 28. 7-три-бутилоксикарбонил-пиперазинметилен-10,11-этилендиокси-(S)-камптотецин (вещество 28).
К раствору (S)-(-)-10,11-этилендиокси-7-хлорметил-камптотецину (35,8 мг, 78,7•10-3 ммоль), имевшему температуру -50oC, по каплям добавляли три-бутил-1-пиперазинкарбоксилат (34,6 мг, 186•10-3 ммоль) в N,N-диметилформамиде /ДМФ/ (0,45 мл). Темно-коричневая реакционная смесь в течение 10 мин перемешивалась при -50oC, после чего ей дали возможность нагреться до 0oC. Затем было дополнительно добавлено 8 мг (43•10-3 ммоль) три-бутил-1-пиперазинкарбоксилата в ДМФ (0,2 мл), и смеси дали возможность прогреться до комнатной температуры. В течение еще 90 мин смесь перемешивалась, после чего растворитель удалялся в роторном испарителе и был получен неочищенный продукт в виде коричневого остатка. В результате очистки силикагелевой хроматографией было получено 20,7 мг бледно-желтого твердого продукта (выход 58%).
1H NMR (300 MHz, CDCl3): δ 1,04 (t, 3H; J =7); 1,45 (s, 9H); 1,87 (m, 2H); 2,46 (s, 4H); 3,41 (s, 4H); 3,94 (s, 2H); 4,43 (s, 4H); 5,29 (s, 2H); 5,30 (d, 1H, J=16); 5,75 (d, 1H, J=16); 7,59 (s, 1H); 7,65 (s, 1H); 7,73 (s, 1H).
Номинальный масс-спектр M+1: 605.
Пример 29. 7-пиперазинметилен-10,11-этилендиокси-20(S)-камптотецин трифторацетат (вещество 29).
К раствору 7-три-бутилоксикарбонил-пиперазинметил-10,11-этилендиокси-20(S) -камптотецина (16,7 мг, 27,6 • 10-3 ммоль) в безводном CH2Cl2(5 мл), имевшем температуру 0oC, добавляли трифторуксусную кислоту (0,5 мг). Темно-желтому раствору давали возможность прогреться до комнатной температуры и перемешивали в течение 14 ч. Смесь концентрировалась в роторном испарителе, осадок очищался жидкостной хроматографией высокого давления с обратной фазой /колонна "Райнин дайнамакс" 60А, элюирование в пропорции 49:10:2,5:1 водой, ацетонитрилом, ТГФ, трифторуксусной кислотой/ и, после концентрации и лиофилизации главного активного УФ-пика (анализ при 254 нм), было получено 21,7 мг продукта в виде желтого рыхлого порошка.
1H NMR (300 MHz, DMSO-d6): δ 0,88 (t, 3H, J=7); 1,87 (m, 2H); 2,60-2,80 (m, 4H); 3,00-3,20 (bs, 4H); 5,29 (s,2H); 5,41 (s, 2H); 6,5 (bs, 1H); 7,25 (s, 1H); 7,56 (s, 1H); 7,80 (s, 1H), 8,50 (bs, 2H).
Номинальный масс-спектр M+1: 505.
Т.п. = 315oC (д).
Пример 30. 7-α,α,α-трифтор-m-толил)-пиперазинметилен-10,11-этилендиокси-20(S)-камптотецин (вещество 30).
Раствор 7-хлорметил-10,11-этилендиокси-20(S)-камптотецина (5,2 мг, 11,4•10-3 ммоль) в безводном DMCO (200 мкл) по каплям добавлялся в раствору 1-α,α,α-трифтор-m-толил)-пиперазина (10 мкл, 53•10-3 ммоль) в безводном толуоле (500 мкл) температурой 0oC. Темно-коричневая смесь перемешивалась при 0oC в течение 90 мин, затем ей была дана возможность прогреться до комнатной температуры. Растворитель удалялся в роторном испарителе и затем откачкой под высоким вакуумом, в результате чего получался неочищенный продукт, который очищался силикагелевой хроматографией /элюирование 100%-ным этилацетатом, затем 6: 5:1 этилацетатом, хлороформом, метанолом/, что дало 3,7 мг (выход 50%) продукта в виде бледно-желтого твердого вещества.
1H NMR (200 MHz, DMSO-d6): δ 0,90 (t, 3H, J= 7); 1,95 (q, 2H, J=7); 2,60-2,70 (m, 4H); 3,20-3,30 (m, 4H); 4,10 (s, 2H); 4,50 (s, 4H); 5,30 (s, 2H); 5,45 (s, 2H); 6,55 (s, 1H); 7,40 (t, 1H, J= 7); 7,60 (s, 1H); 7,85 (s, 1H).
Номинальный масс-спектр M+1: 649.
Пример 31. 7-(2-метоксифенил-пиперазин)метилен-10,11-этилендиокси-20(S)-камптотецин (вещество 31).
К раствору 2-метоксифенилпиперазина (17,9 мкл, 102•10-3 ммоль) в безводном толуоле (1 мл) при 0oC добавляли раствор 7-хлорметил-10,11-этилендиокси-20(S)-камптотецина (10 мг, 22•10-3 ммоль) в DMCO (200 мкл). Темная смесь перемешивалась в течение 10 мин при 0oC, затем ей дали возможность прогреться до комнатной температуры и перемешивали в течение 3 ч. Реакционная смесь концентрировалась в роторном испарителе, остатки растворителя удалялись откачкой под высоким вакуумом и получали неочищенный продукт. Очисткой силикагелевой хроматографией /элюирование 1:1 гексаном, этилацетатом, а затем 6:5:1 этилацетатом, хлороформом и метанолом/ получили 3,4 мг (выход 25%) твердого желтого продукта.
1H NMR (200 MHz, CDCl3): δ 1,05 (t, 3H, J=7); 1,90 (m, 2H); 2,75 (bs, 4H); 3,10 (bs, 4H); 3,75 (s, 1H); 3,85 (s, 3H); 4,01 (bs, 2H); 5,35 (s, 1H); 5,30 (d, 1H, J= 18); 5,35 (s, 1H); 5,75 (d, 1H, J=18); 6,80-7,00 (m, 4H); 7,60 (s, 1H); 7,65 (s, 1H); 7,75 (s, 1H).
Номинальный масс-спектр /M+1/:
Расч.: 611;
Определено: 611.
Пример 32. 7-фенилпиперазинметилен-10,11-этилендиокси-20(S)-камптотецин (вещество 32).
К раствору фенилпиперазина (15,6 мкл, 102•10-3 ммоль) в безводном толуоле (1 мл) температурой 0oC добавляли раствор 7-хлорметил-10,11-этилендиокси-20(S)-камптотецина (10,6 мг, 22•10-3 ммоль) в DMCO (300 мкл). Темная смесь 10 мин перемешивалась при 0oC, затем ей давали возможность прогреться до комнатной температуры и перемешивали в течение 3 ч. Смесь концентрировалась в роторном испарителе, остатки растворителя удаляли откачиванием под высоким вакуумом и получали неочищенный темный остаток. Очисткой силикагелевой хроматографией (элюирование 1:1 гексаном и этилацетатом, затем 6:5:1 этилацетатом, хлороформом и метанолом), получали 3,6 мг (выход 30%) желтого твердого продукта.
1H NMR (200 MHz, CDCl3): δ 1,00 (t, 3H, J=7); 1,90 (m, 2H); 2,75 (bs, 4H); 3,20 (bs, 4H); 3,75 (s, 1H); 4,05 (s, 2H); 4,45 (bs, 4H); 5,35 (s, 2H); 5,30 (d, 1H, J=18); 5,35 (s, 2H); 5,75 (d, 1H); 6,80-7,00 (m, 3H); 7,20-7,35 (m, 2H); 7,60 (s, 1H); 7,65 (s, 1H); 7,80 (s, 1H).
Номинальный масс-спектр /M+1/: 581.
Пример 33. 2'-амино-4',5'-метилендиокси-2-диметиламиноацетофенон.
2'-ацетиламин-4', 5'-метилендиокси-2-хлорацетофенон, приготовленный в примере 1, раздел /B/, вступал в реакцию с избытком диметиламина при тех же условиях, как и в примере 1, раздел /H/, в результате чего получался 2'-ацетиламино-4', 5'-метилендиокси-2-диметиламиноацетофенон, с которого затем снималась защита по методике, описанной в примере 1, раздел /E/, что приводило к образованию 2'-амино-4',5'-метилендиокси-2-диметиламиноацетофенон.
Номинальный масс-спектр M+1:
Расч.: 223;
Определено: 223.
Примеры 34-38. Следующие вещества по формуле /I/ готовились по методике, показанной на схемах 1, 1A или 1B аналогично процедурам, описанным в примерах 1 - 32 с использованием соответствующих промежуточных веществ по формулам /II/, /III/, /IV/ и /V/.
34. 7-(метил-2-метоксиэтиламинометилен)-10,11-метилендиокси-20(R,S)-камптотецин.
35. 7-гексиламинометилен-10,11-метилендиокси-20(R)-камптотецин.
36. 7-(2-бутенил)аминометилен-10,11-метилендиокси-20(R)-камптотецин.
37. 7-циклогексилметиламинометилен-10,11-этилендиокси-20(R)-камптотецин.
38. 7-тиазолидинометилен-10,11-метилендиокси-20(R,S)-камптотецин.
Пример 39. Лекарственные средства
/A/ Трансдермальная система.
Ингредиенты - Количество, мг
Активное вещество - 600,0
Силиконовое масло - 450,0
Коллоидная двуокись кремния - 25,0
Силиконовое масло смешивается с активным веществом и реагирует с коллоидной двуокисью кремния для увеличения вязкости, затем материал дозируется в слоистый полимерный лист, впоследствие термически запаиваемый, состоящий из: удаляемой полиэфирной пленки, липкой части, входящей в контакт с кожей и состоящей из полисилоксана либо акрилового полимера, контрольной пленки из полиолефина (например, полиэтилена), поливинилацетата, или полиуретана, и непроницаемой задней пленки, сделанной из многослойного полиэфира. Описанная система представляет собой лист площадью 10 см2.
/B/ Таблетка для перорального приема.
Ингредиенты - Количество, мг
Активное вещество - 200,0
Крахмал - 1,0
Стеарат магния - 1,0
Активное вещество и крахмал гранулируют с водой и высушивают. К высохшим гранулам добавляют стеарат магния и тщательно перемешивают. Полученную смесь прессуют в таблетку.
/C/ Суппозиторий.
Ингредиенты - Количество, мг
Активное вещество - 150,0
Теобромин салицилат натрия - 250,0
Витепсол 55 - 1725,0
Инертные ингредиенты смешиваются и расплавляются. В расплавленную смесь вводится активное вещество, продукт разливается в формы и охлаждается.
/D/ Инъекция.
Ингредиенты - Количество, мг
Активное вещество - 20,0
Буферные вещества - По надобности
Пропиленгликоль - 0,4
Вода для инъекции - 0,6 мл
Активное вещество и буферные вещества растворяют в пропиленгликоле при температуре примерно 50oC. Затем при помешивании добавляют воду для инъекций, полученный раствор фильтруют, заливают в ампулу, запаивают и стерилизуют в автоклаве.
/E/ Капсула.
Ингредиенты - Количество, мг
Активное вещество - 200,0
Лактоза - 450,0
Стеарат магния - 5,0
Мелко помолотое активное вещество смешивают с лактозой и стеаратом и упаковывают в желатиновую капсулу.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАРБОЦИКЛИЧЕСКИЕ АНАЛОГИ 20(S)-КАМПТОТЕЦИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1997 |
|
RU2200163C2 |
| СУЛЬФОНАМИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 1999 |
|
RU2197479C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЯ ГОЛОВНОГО МОЗГА | 2018 |
|
RU2797548C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ПОСТТРАВМАТИЧЕСКОГО СТРЕССОВОГО РАССТРОЙСТВА | 2011 |
|
RU2623209C9 |
| СОЕДИНЕНИЯ КАМПТОТЕЦИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2164515C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2742773C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1-[2-(БЕНЗИМИДАЗОЛ-1-ИЛ)ХИНОЛИН-8-ИЛ]ПИПЕРИДИН-4-ИЛАМИНА | 2004 |
|
RU2323214C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ПОСТТРАВМАТИЧЕСКОГО СТРЕССОВОГО РАССТРОЙСТВА | 2011 |
|
RU2775783C2 |
| СОЕДИНЕНИЯ ИМИДАЗОТРИАЗИНОНА | 2011 |
|
RU2603140C2 |
| ИМИДАЗОПИРИДИНОВЫЕ ИНГИБИТОРЫ IAP | 2007 |
|
RU2466131C2 |
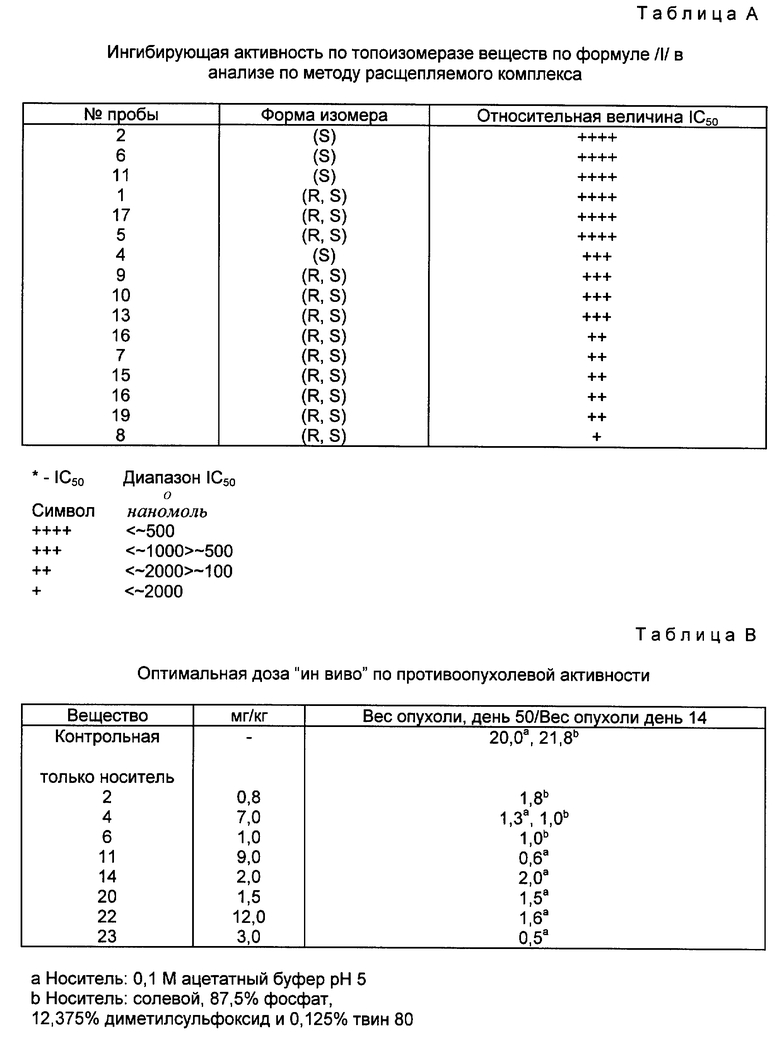
Изобретение относится к водорастворимым производным камптотецина, описываемым формулой (I)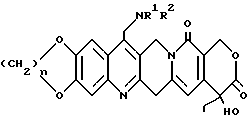
где n = 1 или 2; 1) R1 и R2, взятые отдельно, представляют водород, низший алкил, (С3-7)циклоалкил, (С3-7)циклоалкил низший алкил, низший алкенил, окси низший алкил, низший алкокси низший алкил; 2) R1 представляет водород, низший алкил, (С3-7)циклоалкил, (С3-7)циклоалкил низший алкил, низший алкенил, окси низший алкил или низший алкокси низший алкил; R2 представляет -COR3, где R3 представляет водород, низший алкил, пергало-низший алкил, (С3-7)циклоалкил, (С3-7)циклоалкил, низший алкил, низший алкенил, окси низший алкил, низший алкокси, низший алкокси низший алкил; 3) R1 и R2, взятое вместе с соединительным атомом азота, образуют насыщенную 3-7-атомную гетероциклическую группу формулы 1A
где Y представляет О, S, CH2, NR4, где R4 представляет водород, низший алкил, пергало-низший алкил, арил, арил, замещенный одним или несколькими заместителями, выбранными из группы, включающей низший алкил, галоген, нитро, амино, низший алкил амино, пергало-низший алкил, окси низший алкил, низший алкокси, низший алкокси низший алкил или COR5, где R5 представляет водород, низший алкил, пергало-низший алкил, низший алкокси, арил, арил, замещенный одним или несколькими заместителями, выбранными из группы, включающей: низший алкил, пергало-низший алкил, окси низший алкил, низший алкокси низший алкил; а также их фармацевтически приемлемые соли, их применение для лечения опухолей и методы из приготовления. 5 с. и 9 з.п. ф-лы, 2 табл.
где n = 1 или 2;
I) R1 и R2, взятые отдельно, представляют водород, (C1-C6)алкил, (C3-C7)циклоалкил, (C3-C7)циклоалкил (C1-C6) алкил, (C3-C6)алкенил, гидрокси (C1-C6)алкил, (C1-C6)алкокси (C1-C6) алкил;
II) R1 представляет водород, (C1-C6)алкил, (C3-C7)циклоалкил, (С3-С7)циклоалкил (С1-С6) алкил, (С3-С6)алкенил, гидрокси (C1-C6)алкил или (C1-C6)алкокси (C1-C6) алкил;
R2 представляет - COR3, где
R3 представляет водород, (C1-C6)алкил, пергало-(C1-C6)алкил, (C3-C7)циклоалкил, (C3-C7)циклоалкил (C1-C6)алкил, (C3-C6)алкенил, гидрокси (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкокси (C1-C6) алкил; или
III) R1 и R2, взятые вместе с соединительным атомом азота, образуют насыщенную 3 - 7 атомную гетероциклическую группу, соответствующую формуле
где Y представляет O, S, SO, SO2, CH2 или NR4, где R4 представляет водород, (C1-C6) алкил, пергало-(C1-C6)алкил, арил, арил, замещенный одним или более заместителями, выбранными из группы, включающей (C1-C6)алкил, галоген, нитро, амино, (C1-C6)алкиламино, пергало-(C1-C6)алкил, гидрокси (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкил, или -COR5, где
R5 представляет водород, (C1-C6)алкил, пергало-(C1-C6)алкил, (C1-C6)алкокси, арил, арил, замещенный одним или несколькими заместителями, выбранными из группы, включающей (C1-C6)алкил, пергало-(C1-C6)алкил, гидрокси (C1-C6) алкил, (C1-C6)алкокси (C1-C6)алкил,
а также их фармацевтически приемлемые соли и сольваты.
I) R1, и R2 взятые отдельно, представляют водород, (C1-C4) алкил или гидрокси (C1-C4)алкил;
II) R1 представляет водород, а R2 представляет -COR3-,
где R3 представляет пергало-(C1-C4)алкил, или
III) R1 и R2, взятые вместе с соединительным атомом азота, образуют азетидин, пирролидин, пиперидин, морфолин, тиоморфолин или пиперазин, необязательно N-замещенные (C1-C4)алкилом, фенилом, фенилом, замещенным одной или несколькими группами из числа пергало-(C1-C4)алкил или (C1-C4)алкокси, или -COR5, где R5 представляет (C1-C4) алкокси.
или их фармацевтически приемлемые соли и сольваты.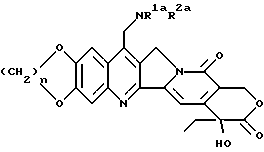
где n представляет целое число 1 или 2;
R1a и R2a представляют:
I) независимо: водород, (C1-C6)алкил, (C3- C7)циклоалкил, (C3-C7)циклоалкил (C1-C6)алкил, (C1-C6)алкенил, гидрокси (C1-C6)алкил, (C1-C6)алкокси (C1-C6) алкил, или
II) взятые вместе с соединительным атомом азота образуют 3 - 7 атомную гетероциклическую группу формулы (IA')
где Ya представляет O, S, CH2, NH или N(C1-C6)алкил,
или их фармацевтически приемлемые соли.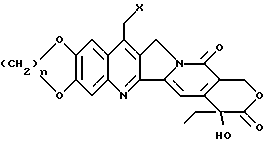
где X представляет галоген с соединением формулы V
HNR1R2
где R1 и R2 имеют те же значения, как и в формуле (I) и в случае необходимости и/или желании подвергают полученное таким путем соединение одной или более следующей дополнительной реакции:
(I) превращают полученное соединение формулы (I) либо его соль или его замещенное производное в другое соединение формулы (I) и/или
(II) удаляют любую защитную группу или группы, и/или
(III) превращают соединение формулы (I) или его соль в его физиологически приемлемую соль или сольват.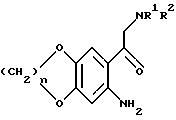
где R1 и R2 определены так же, как и в формуле (I) с соединением формулы III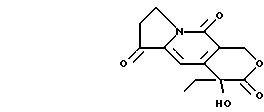
и в случае необходимости подвергают полученное таким путем соединение одной или более следующей дополнительной реакции:
(I) превращают полученное соединение формулы (I) либо его соль или его защищенное производное в другое соединение формулы (I) и/или
(II) удаляют любую защитную группу или группы, и/или
(III) превращают соединение формулы (I) или его соль в его физиологически приемлемую соль либо сольват.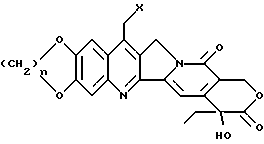
где X является галогеном;
n = 1 или 2.
Приоритеты по признакам:
29.10.91 все признаки по пп. 1 - 15 формулы изобретения, кроме таких соединений I по п. 5, как 7-азетидинметилен-10,11-метилендиокси-20(R,S)-камптотецин и 7-азетидинметилен-10,11-метилендиокси-20(S)-камптотецин;
28.01.92 все признаки по пп. 1 - 15 формулы изобретения.
| M.C | |||
| Wani et al J | |||
| Med | |||
| Chem | |||
| Солесос | 1922 |
|
SU29A1 |
| EP, A, 035244, C 07 D 471/04, 1981 | |||
| EP, A, 304175, A 61 K 31/475, 1989. | |||
Авторы
Даты
1998-10-10—Публикация
1992-10-28—Подача