ОБЛАСТЬ ТЕХНИКИ
Изобретение, описанное в настоящем документе, относится к соединениям, композициям, лекарственным средствам и способам лечения посттравматического стрессового расстройства с применением антагонистов вазопрессина.
УРОВЕНЬ ТЕХНИКИ И КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Посттравматическое стрессовое расстройство (ПТСР) признано Министерством обороны, Министерством по делам ветеранов и Национальным институтом психического здоровья основной медицинской проблемой как для развернутых, так и для возвращающихся войск США. В частности, последние исследования показывают, что случаи возникновения ПТСР среди ветеранов Ирака и Афганистана составляет 20% и может достигать 35%, что в 4-7 раз выше, чем среди остального населения. ПТСР является заболеванием, поражающим не только военнослужащих; по данным Национального института психического здоровья (NIMH), почти восемь миллионов американцев страдают данным расстройством, и оно входит в число наиболее распространенных психических расстройств в стране. ПТСР характеризуется пониженной эмоциональностью, нарушенными отношениями с семьей и друзьями, пониженным интересом к деятельности, приносящей удовольствие, раздражительностью, повышенной агрессией и иногда буйным поведением. Часто ПТСР сопутствуют дополнительные расстройства, включая депрессию, злоупотребление психоактивными веществами, другие тревожные расстройства, расстройства, связанные с гневом и импульсивностью, и т.п. Подобно другим психическим расстройствам, последствия ПТСР распространяются не только на пациента, но и на их семьи. Имеют место не только повышенные расходы на длительное лечение, но также и пониженная трудоспособность и неблагоприятное влияние на качество жизни. В совокупности данные обстоятельства образуют цикл набирающей обороты потребности в помощи федерального правительства, потерянных заработков и роста постоянных социальных и экономических затрат. Улучшенные способы лечения ПТСР и депрессии, особенно в течение первых двух лет после развертывания, могли бы снизить расходы на терапевтическое лечение для военнослужащих США (предполагаемые на уровне от 4,0 до 6,2 миллиардов долларов США) на 25%-40%.
Современные виды лекарственной терапии ПТСР основаны на существующих видоизмененных антидепрессантах и анксиолитиках, которые не продемонстрировали достаточной эффективности, включают нежелательные побочные эффекты и, как было признано, также ограничены из-за проблем, связанных с соблюдением пациентом режима лечения; см., например, Keane, et al. Posttraumatic stress disorder: etiology, epidemiology, and treatment outcome. Annu Rev Clin Psychol, 2: 61-97 (2006); Lader, Effectiveness of benzodiazepines: do they work or not? Expert Rev Neurother, 8(8): 1189-91 (2008); Marks, et al., Paroxetine: safety and tolerability issues. Expert Opin Drug Saf, 7(6):783-94 (2008). Приведенные выше публикации и каждая дополнительная публикация, указанная в настоящем документе, включены в настоящее описание посредством ссылки. Независимо от того, обусловлено ли это сложностью ПТСР или различиями лежащей в основе нейробиологии данного расстройства, доступные лекарственные средства приносят ограниченное облегчение. Для значительного улучшения клинических исходов необходим новый подход к фармакотерапии.
Согласно настоящему изобретению было обнаружено, что ПТСР и родственные заболевания и расстройства поддаются лечению селективными антагонистами Via вазопрессина формулы
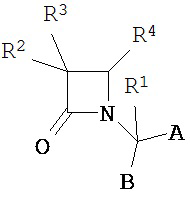
и их фармацевтически приемлемыми солями; где:
A представляет собой карбоновую кислоту, сложный эфир или амид;
B представляет собой карбоновую кислоту, сложный эфир или амид; или B представляет собой спирт или тиол, или их производное;
R1 представляет собой водород или C1-C6 алкил;
R2 представляет собой водород, алкил, алкенил, алкинил, алкокси, алкилтио, галоген, галогеналкил, циано, формил, алкилкарбонил или заместитель, выбранный из группы, состоящей из -CO2R8, -CONR8R8’ и -NR8(COR9); где R8 и R8’ каждый независимо выбран из водорода, алкила, циклоалкила, возможно содержащего заместители арила или возможно содержащего заместители арилалкила; или R8 и R8’ совместно с присоединенным атомом азота образуют гетероциклильную группу; и где R9 выбран из водорода, алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арила, возможно содержащего заместители арилалкила, возможно содержащего заместители гетероарила, возможно содержащего заместители гетероарилалкила и R8R8’N-(C1-C4 алкила);
R3 представляет собой амино-, амидо-, ациламидо- или уреидогруппу, которая возможно содержит заместители; или R3 представляет собой азотсодержащую гетероциклильную группу, присоединенную по атому азота; и
R4 представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкенил, алкилкарбонил, возможно содержащий заместители арил, возможно содержащий заместители арилалкил, возможно содержащий заместители арилгалогеналкил, возможно содержащий заместители арилалкоксиалкил, возможно содержащий заместители арилалкенил, возможно содержащий заместители арилгалогеналкенил или возможно содержащий заместители арилалкинил.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ.1 приведены трехмерные изображения нейронной цени Папеца (Papez circuit), где черные области обозначают среднюю значительную активацию BOLD (зависимость от уровня кислорода в крови) у восьми животных для (A) схемы безусловной активации в случае только с хорьком; (B) схемы безусловной активации в случае с хорьком после предварительного лечения AVN576 (5 мг/кг массы тела); (C) схемы условной активации, когда животных повторно подвергают действию только сахарозы в магните через две недели; (D) схемы условной активации, когда животных предварительно лечат AVN576 (5 мг/кг массы тела) и повторно подвергают действию только сахарозы в магните через две недели.
На ФИГ.2A показано среднее время, проведенное на свету; на ФИГ. 2B - время, проведенное в темноте; и на ФИГ.2C - количество смен состояний свет-темнота.
ПОДРОБНОЕ ОПИСАНИЕ
В настоящем документе описано применение антагонистов аргинин-вазопрессина (AVP) в качестве терапевтического подхода к лечению ПТСР. Соединения, описанные в настоящем документе, могут обладать действием, значительно улучшающим жизни военнослужащих, находящихся на действительной службе, возвращающихся ветеранов, их семей и остального населения благодаря удовлетворению нереализованной потребности медицины и снижению общего экономического бремени одного из наиболее распространенных и растущих психических расстройств в Соединенных Штатах.
В одном из иллюстративных вариантов реализации способов, описанных в настоящем документе, пациенту с ПТСР вводят одно или более соединений формулы:
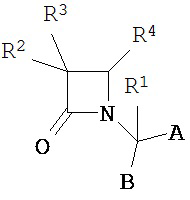
и их фармацевтически приемлемых солей; где
A представляет собой карбоновую кислоту, сложный эфир или амид;
B представляет собой карбоновую кислоту, сложный эфир или амид; или B представляет собой спирт или тиол, или их производное;
R1 представляет собой водород или C1-C6 алкил;
R2 представляет собой водород, алкил, алкенил, алкинил, алкокси, алкилтио, галоген, галогеналкил, циано, формил, алкилкарбонил или заместитель, выбранный из группы, состоящей из -CO2R8, -CONR8R8’ и -NR8(COR9); где R8 и R8’ каждый независимо выбран из водорода, алкила, циклоалкила, возможно содержащего заместители арила или возможно содержащего заместители арилалкила; или R8 и R8’ совместно с присоединенным атомом азота образуют гетероциклильную группу; и где R9 выбран из водорода, алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арила, возможно содержащего заместители арилалкила, возможно содержащего заместители гетероарила, возможно содержащего заместители гетероарилалкила и R8R8’ N-(C1-C4 алкила);
R3 представляет собой амино-, амидо-, ациламидо- или уреидогруппу, которая возможно содержит заместители; или R3 представляет собой азотсодержащую гетероциклильную группу, присоединенную по атому азота; и
R4 представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкенил, алкилкарбонил, возможно содержащий заместители арил, возможно содержащий заместители арилалкил, возможно содержащий заместители арилгалогеналкил, возможно содержащий заместители арилалкоксиалкил, возможно содержащий заместители арилалкенил, возможно содержащий заместители арилгалогеналкенил или возможно содержащий заместители арилалкинил.
В другом иллюстративном варианте реализации пациенту вводят одно или более соединений формулы (I):
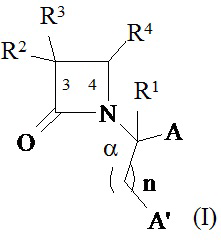
и их фармацевтически приемлемые соли; где
A и A’ каждый независимо выбран из –CO2H или его сложноэфирного, или амидного производного;
n представляет собой целое число, выбранное от 0 до примерно 3;
R1 представляет собой водород или C1-C6 алкил;
R2 представляет собой водород, алкил, алкенил, алкинил, алкокси, алкилтио, галоген, галогеналкил, циано, формил, алкилкарбонил или заместитель, выбранный из группы, состоящей из -CO2R8, -CONR8R8’ и -NR8(COR9); где R8 и R8 каждый независимо выбран из водорода, алкила, циклоалкила, возможно содержащего заместители арила или возможно содержащего заместители арилалкила; или R8 и R8’ совместно с присоединенным атомом азота образуют гетероцикл; и где R9 выбран из водорода, алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арила, возможно содержащего заместители арилалкила, возможно содержащего заместители гетероарила, возможно содержащего заместители гетероарилалкила и R8R8’N-(C1-C4 алкила);
R3 представляет собой амино-, амидо-, ациламидо- или уреидогруппу, которая возможно содержит заместители; или R3 представляет собой азотсодержащую гетероциклильную группу, присоединенную по атому азота; и
R4 представляет собой алкил, алкенил, алкинил, циклоалкил, циклоалкенил, алкилкарбонил, возможно содержащий заместители арил, возможно содержащий заместители арилалкил, возможно содержащий заместители арилгалогеналкил, возможно содержащий заместители арилалкоксиалкил, возможно содержащий заместители арилалкенил, возможно содержащий заместители арилгалогеналкенил или возможно содержащий заместители арилалкинил.
В другом иллюстративном варианте реализации пациенту вводят одно или более соединений формулы (II):
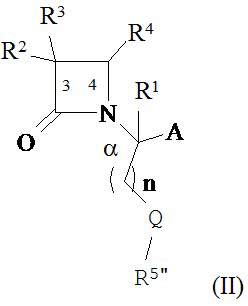
и их фармацевтически приемлемые соли; где
A представляет собой –CO2H или его сложноэфирное, или амидное производное;
Q представляет собой кислород; или Q представляет собой серу или дисульфид, или их окисленное производное;
n представляет собой целое число от 0 до 3;
R1, R2, R3 и R4 являются такими, как определено в формуле (I); и
R5” выбран из водорода, алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арилалкила, возможно содержащего заместители гетероциклила или возможно содержащего заместители гетероциклилалкила и возможно содержащего заместители аминоалкила.
В одном из вариантов соединений формул (I) или (II)A представляет собой -CO2R5; где R5 выбран из водорода, алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арилалкила, гетероциклила, гетероциклил (C1-C4 алкила) и R6R7N-(C2-C4 алкила). В другом варианте соединений формул (I) или (II)A представляет собой монозамещенный амидо, дизамещенный амидо или возможно содержащий заместители азотсодержащий гетероциклиламидо.
Следует понимать, что в каждом случае различных вариантов реализации, описанных в настоящем документе, гетероциклил независимо выбран в каждом случае. В одном из иллюстративных вариантов реализации гетероциклил независимо выбран из тетрагидрофурила, морфолинила, пирролидинила, пиперидинила, пиперазинила, гомопиперазинила или хинуклидинила; при этом указанный морфолинил, пирролидинил, пиперидинил, пиперазинил, гомопиперазинил или хинуклидинил возможно N-замещен C1-C4 алкилом или возможно содержащим заместители арил (C1-C4 алкилом).
Также следует понимать, что в каждом случае различных вариантов реализации, описанных в настоящем документе, R6 и R7 каждый независимо выбран в каждом случае. В соответствии с другим иллюстративным аспектом R6 независимо выбран из водорода или алкила; и R7 независимо выбран в каждом случае из алкила, циклоалкила, возможно содержащего заместители арила или возможно содержащего заместители арилалкила. В соответствии с другим иллюстративным аспектом R6 и R7 совместно с присоединенным атомом азота образуют возможно содержащий заместители гетероцикл, такой как пирролидинил, пиперидинил, морфолинил, пиперазинил и гомопиперазинил; при этом указанный пиперазинил или гомопиперазинил также возможно N-замещен R13; где R13 независимо выбран в каждом случае из водорода, алкила, циклоалкила, алкоксикарбонила, возможно содержащего заместители арилоксикарбонила, возможно содержащего заместители арилалкила и возможно содержащего заместители арилоила.
В другом варианте реализации описаны соединения формулы (I), где A и/или A’ представляет собой амид. В другом варианте реализации A и A’ представляют собой амиды. В другом варианте реализации A и/или A’ представляет собой амид вторичного амина, также называемый в настоящем описании вторичным амидом. В другом варианте реализации A и A’ оба представляют собой вторичные амиды. Следует понимать, что вторичные амиды включают амиды циклических аминов, присоединенные по азоту.
В другом варианте реализации описаны соединения формулы (II), где A представляет собой амид. В другом варианте реализации A представляет собой амид вторичного амина, также называемый в настоящем описании вторичным амидом.
В другом варианте реализации описаны соединения формулы (I), представляющие собой сложные диэфиры, кислые сложные эфиры или дикислоты, включая их фармацевтически приемлемые соли, где каждый из A и A’ независимо выбран. В другом варианте реализации описаны соединения формулы (I), представляющие собой эфир-амиды, где один из A и A’ представляет собой сложный эфир, а другой представляет собой амид. В другом варианте реализации описаны соединения формулы (I), представляющие собой диамиды, где каждый из A и A’ независимо выбран из монозамещенного амидо, дизамещенного амидо и возможно содержащего заместители азотсодержащего гетероциклиламидо.
В одном из вариантов соединений формулы (I) A и/или A’ представляет собой независимо выбранный монозамещенный амидо формулы C(O)NHX-, где X выбран из алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арила, возможно содержащего заместители арилалкила, гетероциклила, гетероциклил-(C1-C4 алкила), R6R7N- и R6R7N-(C2-C4 алкила), где каждый гетероциклил независимо выбран.
В другом варианте A и/или A’ представляет собой независимо выбранный дизамещенный амидо формулы C(O)NR14X-, где R14 выбран из гидрокси, алкила, алкоксиалкила и бензила; и X выбран из алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арила, возможно содержащего заместители арилалкила, гетероциклила, гетероциклил-(C1-C4 алкила), R6R7N- и R6R7N-(C2-C4 алкила), где каждый гетероциклил независимо выбран.
В другом варианте A и/или A’ представляет собой амид независимо выбранного, возможно содержащего заместители азотсодержащего гетероцикла, присоединенного по азоту. Иллюстративные азотсодержащие гетероциклы включают, но не ограничиваются ими, пирролидшшл, пиперидинил, пиперазинил, гомопиперазинил, триазолидинил, триазинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, 1,2-оксазинил, 1,3-оксазинил, морфолинил, оксадиазолидинил и тиадиазолидинил; каждый из которых возможно содержит заместители. Указанные возможные заместители включают группы R10, R12, R6R7N- и R6R7N-(C1-C4 алкил), определенные в настоящем описании. В одном из вариантов реализации A и/или A’ независимо выбран из пирролидинонила, пиперидинонила, 2-(пирролидин-1-илметил)пирролидин-1-ила или 1,2,3,4-тетрагидроизохинолин-2-ила, каждый из которых возможно содержит заместители и присоединен по азоту.
В другом варианте A и/или A’ представляет собой независимо выбранный амид, возможно содержащий заместители пиперидинила, присоединенного по азоту. Иллюстративные возможные заместители включают гидрокси, алкил, циклоалкил, алкокси, алкоксикарбонил, гидроксиалкилоксиалкил, включая (гидрокси(C2-C4 алкилокси))-(C2-C4 алкил), R6R7N-, R6R7N-алкил, включая R6R7N-(C1-C4-алкил), дифенилметил, возможно содержащий заместители арил, возможно содержащий заместители арил(C1-C4 алкил) и пиперидин- 1-ил(C1-C4 алкил). В одном из вариантов реализации A и/или A’ представляет собой независимо выбранный пиперидинил, содержащий заместители в 4-положении и присоединенный по азоту.
В другом варианте A и/или A’ представляет собой независимо выбранный амид, возможно содержащий заместители пиперазинила, присоединенного по азоту. Иллюстративные возможные заместители включают гидрокси, алкил, циклоалкил, алкокси, алкоксикарбонил, гидроксиалкилоксиалкил, включая (гидрокси(C2-C4 алкилокси))-(C2-C4 алкил), R6R7N-, R6R7N-алкил, включая R6R7N-(C1-C4-алкил), дифенилметил, возможно содержащий заместители арил, возможно содержащий заместители арил(C1-C4 алкил) и пиперидин-1-ил(C1-C4 алкил). В одном из вариантов реализации A и/или A’ представляет собой независимо выбранный пиперазинил, содержащий заместители в 4-положении и присоединенный по азоту.
В другом варианте A и/или A’ представляет собой независимо выбранный амид, возможно содержащий заместители гомопиперазинила, присоединенного по азоту. Иллюстративные возможные заместители включают гидрокси, алкил, циклоалкил, алкокси, алкоксикарбонил, гидроксиалкилоксиалкил, включая (гидрокси(C2-C4 алкилокси))-(C2-C4 алкил), R6R7N-, R6R7N-алкил, включая R6R7N-(C1-C4-алкил), дифенилметил, возможно содержащий заместители арил, возможно содержащий заместители арил(C1-C4 алкил) и пиперидин-1-ил(C1-C4 алкил). В одном из вариантов реализации A и/или A’ представляет собой независимо выбранный гомопиперазинил, содержащий заместители в 4-положении и присоединенный по азоту. В другом варианте реализации A и/или A’ представляет собой независимо выбранный гомопиперазинил, содержащий в качестве заместителей алкил, арил, арил(C1-C4 алкил) в 4-положении и присоединенный по азоту.
В другом варианте соединений формулы (I) A’ представляет собой монозамещенный амидо, дизамещенный амидо или возможно содержащий заместители азотсодержащий гетероциклиламидо. В другом варианте соединений формулы (I) A’ представляет собой -CO2R5’; где R5’ выбран из водорода, алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арилалкила, гетероциклила, гетероциклил(C1-C4 алкила) и R6R7N-(C2-C4 алкила); где гетероциклил в каждом случае независимо выбран из тетрагидрофурила, морфолинила, пирролидинила, пиперидинила, пиперазинила, гомопиперазинила или хинуклидинила; при этом указанный морфолинил, пирролидинил, пиперидинил, пиперазинил, гомопиперазинил или хинуклидинил возможно N-замещен C1-C4 алкилом или возможно содержащим заместители арил(C1-C4 алкилом). В одном из вариантов R5 представляет собой возможно содержащий заместители гетероциклилалкил или возможно содержащий заместители аминоалкил, включая R6R7N-(C2-C4 алкил).
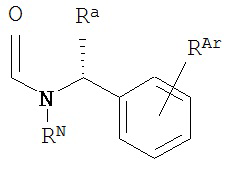
В другом варианте соединений формул (I) или (II) A имеет формулу
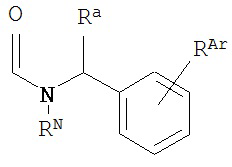 ,
,
где RN представляет собой водород или возможно содержащий заместители алкил, или амидную группу, образующую пролекарство; Ra представляет собой водород или возможно содержащий заместители алкил; и RAr представляет собой водород или один или более арильных заместителей, таких как, но не ограниченных ими, галоген, гидрокси, возможно содержащий заместители алкил, возможно содержащий заместители алкокси, нитро и т.п. В другом варианте реализации по меньшей мере один из RN, Ra и RAr не представляет собой водород. В другом варианте реализации по меньшей мере один из RN и Ra не представляет собой водород. В другом варианте реализации A имеет формулу
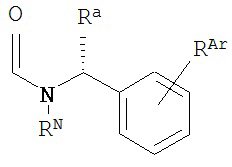 ,
,
где RN, Ra и RAr являются такими, как определено в настоящем описании.
В другом варианте реализации описаны соединения формулы (II), где A выбран из монозамещенного амидо, дизамещенного амидо и возможно содержащего заместители азотсодержащего гетероциклиламидо. В другом варианте реализации A представляет собой амид возможно содержащего заместители 1-тетрагидронафтиламина.
В одном из вариантов A и/или A’ представляет собой монозамещенный амидо формулы C(O)NHX, где X выбран из алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арила, возможно содержащего заместители арилалкила, гетероциклила, гетероциклил-(C1-C4 алкила), R6R7N- и R6R7N-(C2-C4 алкила), где каждый гетероциклил независимо выбран.
В другом варианте A и/или A’ представляет собой дизамещенный амидо формулы C(O)NR14X, где R14 выбран из гидрокси, алкила, алкоксиалкила и бензила; и X выбран из алкила, циклоалкила, алкоксиалкила, возможно содержащего заместители арила, возможно содержащего заместители арилалкила, гетероциклила, гетероциклил-(C1-C4 алкила), R6R7N- и R6R7N-(C2-C4 алкила), где каждый гетероциклил независимо выбран.
В другом варианте A и/или A’ представляет собой амид возможно содержащего заместители азотсодержащего гетероцикла, присоединенного по азоту. Иллюстративные азотсодержащие гетероциклы включают, но не ограничиваются ими, пирролидинил, пиперидинил, пиперазинил, гомопиперазинил, триазолидинил, триазинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, 1,2-оксазинил, 1,3-оксазинил, морфолинил, оксадиазолидинил и тиадиазолидинил; каждый из которых возможно содержит заместители. Указанные возможные заместители включают группы R10, R12, R6R7N- и R6R7N-(C1-C4 алкил), определенные в настоящем описании. В одном из вариантов реализации А представляет собой пирролидинонил, пиперидинонил, 2-(пирролидин-1-илметил)пирролидин-1-ил или 1,2,3,4-тетрагидроизохинолин-2-ил, каждый из которых возможно содержит заместители и присоединен по азоту.
В другом варианте A и/или A’ представляет собой амид, возможно содержащий заместители пиперидинила, присоединенного по азоту. Иллюстративные возможные заместители включают гидрокси, алкил, циклоалкил, алкокси, алкоксикарбонил, гидроксиалкилоксиалкил, включая (гидрокси(C2-C4 алкилокси))-(C2-C4 алкил), R6R7N-, R6R7N-алкил, включая R6R7N-(C1-C4-алкил), дифенилметил, возможно содержащий заместители арил, возможно содержащий заместители арил(C1-C4 алкил) и пиперидин-1-ил(C1-C4 алкил). В одном из вариантов реализации A и/или A’ представляет собой пиперидинил, содержащий заместители в 4-положении и присоединенный по азоту.
В другом варианте A и/или A’ представляет собой амид, возможно содержащий заместители пиперазинила, присоединенного по азоту. Иллюстративные возможные заместители включают гидрокси, алкил, циклоалкил, алкокси, алкоксикарбонил, гидроксиалкилоксиалкил, включая (гидрокси(C2-C4 алкилокси))-(C2-C4 алкил), R6R7N-, R6R7N- алкил, включая R6R7N-(C1-C4-алкил), дифенилметил, возможно содержащий заместители арил, возможно содержащий заместители арил(C1-C4 алкил) и пиперидин-1-ил(C1-C4 алкил). В одном из вариантов реализации A и/или A’ представляет собой пиперазинил, содержащий заместители в 4-положении и присоединенный по азоту.
В другом варианте A и/или A’ представляет собой амид, возможно содержащий заместители гомопиперазинила, присоединенного по азоту. Иллюстративные возможные заместители включают гидрокси, алкил, циклоалкил, алкокси, алкоксикарбонил, гидроксиалкилоксиалкил, включая (гидрокси(C2-C4 алкилокси))-(C2-C4 алкил), R6R7N-, R6R7N- алкил, включая R6R7N-(C1-C4-алкил), дифенилметил, возможно содержащий заместители арил, возможно содержащий заместители арил(C1-C4 алкил) и пиперидин-1-ил(C1-C4 алкил). В одном из вариантов реализации A и/или A’ представляет собой гомопиперазинил, содержащий заместители в 4-положении и присоединенный по азоту. В другом варианте реализации A и/или A’ представляет собой гомопиперазинил, содержащий в качестве заместителей алкил, арил, арил(C1-C4 алкил) в 4-положении и присоединенный по азоту.
В другом варианте A и/или A’ представляет собой амид гетероцикла, присоединенного по азоту, при этом указанный гетероцикл содержит в качестве заместителей гетероциклил, гетероциклилалкил, циклоалкил, циклоалкилалкил, арил и арилалкил.
В другом варианте реализации A и/или A’ в формуле (I) или (II) представляет собой амид возможно содержащего заместители бензил-, возможно содержащего заместители 1-нафтилметил- или возможно содержащего заместители 2-нафтилметиламина. Возможные заместители включают, но не ограничиваются ими, 2,3-дихлор, 2,5-дихлор, 2,5-диметокси, 2-трифторметил, 2-фтор-3-трифторметил, 2-фтор-5-трифторметил, 2-метил, 2-метокси, 3,4-дихлор, 3,5-дитрифторметил, 3,5-дихлор, 3,5-диметил, 3,5-дифтор, 3,5-диметокси, 3-бром, 3-трифторметил, 3-хлор-4-фтор, 3-хлор, 3-фтор-5-трифторметил, 3-фтор, 3-метил, 3-нитро, 3-трифторметокси, 3-метокси, 3-фенил, 4-трифторметил, 4-хлор-3-трифторметил, 4-фтор-3-трифторметил, 4-метил и т.п.
В другом варианте реализации A и/или A’ в формуле (I) или (II) представляет собой амид, возможно содержащий заместители бензил-N-метиламина. В другом варианте реализации A в формуле (I) или (II) представляет собой амид, возможно содержащий заместители бензил-N-бутиламина, включая н-бутил и трет-бутил. В другом варианте реализации A в формуле (I) или (II) представляет собой амид, возможно содержащий заместители бензил-N-бензиламина. Возможные заместители включают, но не ограничиваются ими, 2,3-дихлор, 3,5-дихлор, 3-бром, 3-трифторметил, 3-хлор, 3-метил и т.п.
В другом варианте реализации A и/или A’ в формуле (I) или (II) представляет собой амид, возможно содержащий заместители 1-фенилэтил-, 2-фенилэтил-, 2-фенилпропил-или 1-фенилбензиламина. В другом варианте реализации A и/или A’ в формуле (I) или (II) представляет собой амид, возможно содержащий заместители 1-фенилэтил-, 2-фенилэтил-, 2-фенилпропил-, 1-фенилбензиламино-N-метиламина. В другом варианте реализации A и/или A’ в формуле (I) или (II) представляет собой амид возможно содержащего заместители 2-фенил-β-аланина или его производного, 1-фенилпропаноламина и т.п. Возможные заместители включают, но не ограничиваются ими, 3-трифторметокси, 3-метокси, 3,5-диметокси, 2-метил и т.п.
В другом варианте реализации A и/или A’ в формуле (I) или (II) представляет собой амид возможно содержащего заместители 1-фенилциклопропил-, 1-фенилциклопентил- или 1-фенилциклогексиламина. Возможные заместители включают, но не ограничиваются ими, 3 фтор, 4-метокси, 4-метил, 4-хлор, 2-фтор и т.п.
В другом варианте реализации A и/или A’ в формуле (I) или (II) представляет собой амид возможно содержащего заместители гетероарилметиламина, включая, но не ограничиваясь ими, 2-фурил, 2-тиенил, 2-пиридил, 3-пиридил, 4-пиридил и т.п. Возможные заместители включают, но не ограничиваются ими, 5-метил, 3-хлор, 2-метил и т.п.
В другом варианте реализации A и/или A’ в формуле (I) или (II) представляет собой амид частично насыщенного бициклического арила, включая, но не ограничиваясь ими, 1-, 2-, 4- и 5-инданиламин, 1- и 2-тетрагидронафтиламин, индолинил, тетрагидрохинолинил, тетрагидроизохинолинил и т.п., каждый из которых возможно содержит заместители.
В другом варианте реализации A и/или A’ в формуле (I) или (II) представляет собой амид содержащего заместители пиперидина или пиперазина. Заместители в пиперидине или пиперазине включают гетероциклил, гетероциклилалкил, возможно содержащий заместители арил и возможно содержащий заместители арилалкил. Иллюстративные пиперидины и пиперазины включают формул:
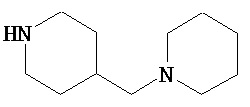
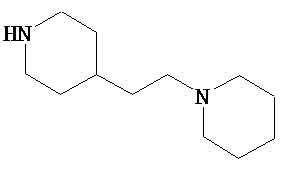
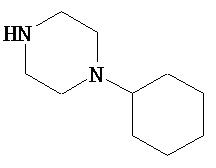
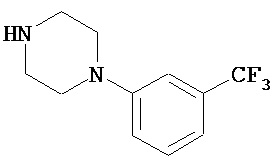
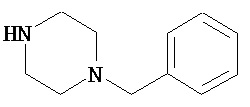
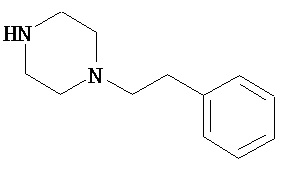
В другом варианте реализации A’ в формуле (I) представляет собой амид содержащего заместители гетероцикла, присоединенного по азоту. Заместители включают алкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, арил и арилалкил. В одном из вариантов реализации A’ в формуле (I) представляет собой амид гетероцикла, присоединенного по азоту, содержащего в качестве заместителей алкил, циклоалкил, циклоалкилалкил, гетероциклил или гетероциклилалкил.
В другом варианте реализации A’ в формуле (I) представляет собой амид, возможно содержащий заместители арилгетероциклиламина, арилалкилгетероциклиламина, гетероциклилалкиламина или гетероарилалкиламина. В другом варианте реализации A’ представляет собой амид пиперидин-1-илпиперидина или пиперидин-1-илалкилпиперидина. В другом варианте реализации алкил представляет собой C1-C2-алкил.
Очевидно, что в вышеприведенных иллюстративных примерах A и/или A’, содержащих хиральный центр, любой из оптически чистых энантиомеров может быть включен в соединения, описанные в настоящем документе; в качестве альтернативы можно использовать рацемическую форму. Например, любой из или оба следующих энантиомера могут быть включены в соединения, описанные в настоящем документе, (R)-1-(3-метоксифенил)этиламин, (R)-1-(3-трифторметил фенил)этиламин, (R)-1,2,3,4-тетрагидро-1-нафтиламин, (R)-1-инданиламин, (R)-α,N-диметилбензиламин, (R)-α-метилбензиламин, (S)-1-(3-метоксифенил)этиламин, (S)-l-(3-трифторметилфенил)этиламин, (S)-1,2,3,4-тетрагидро-1-нафтиламин, (S)-1-инданиламин и (S)-α-метилбензиламин, и т.п.
В другом варианте соединений формулы (II) Q представляет собой кислород или серу. В другом варианте соединений формулы (II) R” представляет собой возможно содержащий заместители арилалкил. В другом варианте соединений формулы (II) A представляет собой амид содержащего заместители пиперидина или пиперазина.
В другом варианте соединений формулы (I) n равно 1 или 2. В другом варианте соединений формулы (I) n равно 1. В другом варианте соединений формулы (II) n равно 1 или 2. В другом варианте соединений формулы (II) n равно 1.
В другом варианте соединений формул (I) или (II) R2 представляет собой водород, алкил, алкокси, алкилтио, циано, формил, алкилкарбонил или заместитель, выбранный из группы, состоящей из -CO2R8 и -CONR8R8’, где R8 и R8’ каждый независимо выбран из водорода и алкила. В другом варианте соединений формул (I) или (II) R2 представляет собой водород или алкил. В другом варианте соединений формул (I) или (II) R2 представляет собой водород.
В другом варианте соединений формул (I) или (II) R1 представляет собой водород. В другом варианте соединений формул (I) или (II) R1 представляет собой метил. В другом варианте соединений формул (I) или (II) как R1, так и R2 представляют собой водород.
В другом варианте соединений формул (I) или (II) R3 имеет формулы:
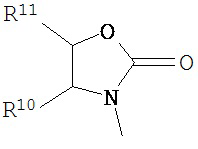
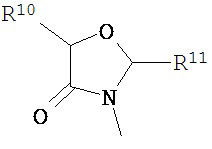
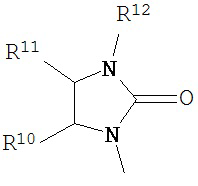
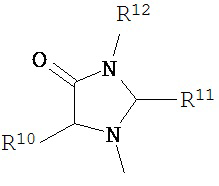
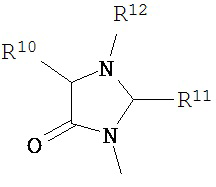
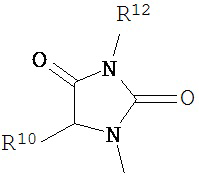
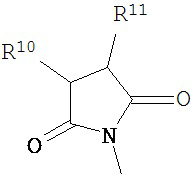
 ,
,
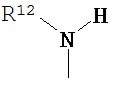
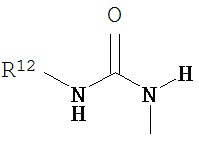
где R10 и R11 каждый независимо выбран из водорода, возможно содержащего заместители алкила, возможно содержащего заместители циклоалкила, алкоксикарбонила, алкилкарбонилокси, возможно содержащего заместители арила, возможно содержащего заместители арилалкила, возможно содержащего заместители арилалкилокси, возможно содержащего заместители арилалкилкарбонилокси, дифенилметокси, трифенилметокси и т.п.; и R12 выбран из водорода, алкила, циклоалкила, алкоксикарбонила, возможно содержащего заместители арилоксикарбонила, возможно содержащего заместители арилалкила, возможно содержащего заместители арилоила и т.п.
В другом варианте соединений формул (I) или (II) R3 имеет формулы:







где R10, R11 и R12 являются такими, как определено в настоящем документе.
В другом варианте соединений формул (I) или (II) R3 имеет формулы:



 ,
,
где R10, R11 и R12 являются такими, как определено в настоящем документе.
В другом варианте соединений формул (I) или (II) R3 имеет формулу:
 ,
,
где R10 и R11 являются такими, как определено в настоящем документе.
В другом варианте соединений формул (I) или (II) R4 имеет формулы:
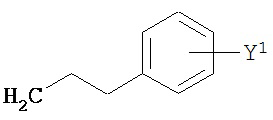
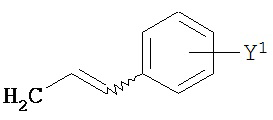
 ,
,
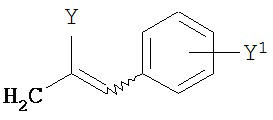
где Y представляет собой электроноакцепторную группу, такую как галоген, и представляет собой водород или один или более арильных заместителей, например, но не ограниченных ими, галоген, гидрокси, амино, нитро, возможно содержащий заместители алкил, возможно содержащий заместители алкокси и т.п. Следует понимать, что двойные связи в указанных формулах может быть все или по существу все (E), все или по существу все (Z) или представлять собой их смесь. В другом варианте реализации двойные связи в формулах все или по существу все (E). В другом варианте соединений формул (I) или (II) R4 имеет формулу:
 ,
,
где Y1 является таким, как определено в настоящем описании. В другом варианте реализации Y1 не представляет собой водород.
Очевидно, что соединения формул (I) и (II) являются хиральными по а-углероду, за исключением случаев, когда A=A’ и n=0. В одном из вариантов соединений формулы (I), когда n равно 1, стереохимия α-углерода представляет собой (S) или (R), или эпимерную смесь. В другом варианте соединений формулы (I), когда n равно 1, стереохимия α-углерода представляет собой (R). В другом варианте соединений формулы (I), когда n равно 2, стереохимия α-углерода представляет собой (S). В одном из вариантов соединений формулы (II), когда n равно 1, и Q представляет собой кислород, стереохимия α-углерода представляет собой (R). В другом варианте соединений формулы (II), когда n равно 1, и Q представляет собой серу, стереохимия α-углерода представляет собой (S).
В другом варианте реализации описаны соединения формулы (II), где R5” представляет собой возможно содержащий заместители арил(C2-C4 алкил). В другом варианте реализации R5” представляет собой возможно содержащий заместители арил(C1-C4-алкил). В другом варианте реализации R5” представляет собой возможно содержащий заместители бензил. В другом варианте реализации R5” представляет собой возможно содержащий заместители алкил.
Следует понимать, что каждый из вышеприведенных вариантов формулы (I), различных типов, подтипов и видов каждого из A, A’, Y, Y1, n, Rl, R2, R3, R4, R5 и т.п. может быть комбинирован без ограничения и, следовательно, каждый такой дополнительный вариант реализации настоящего изобретения, таким образом, описывается указанной комбинацией. Также следует понимать, что каждый из вышеприведенных вариантов формулы (II), различных типов, подтипов и видов каждого из A, Q, Y, Y1, n, R1, R2, R3, R4, R5, R5" и т.п. может быть комбинирован без ограничения и, следовательно, каждый такой дополнительный вариант реализации настоящего изобретения, таким образом, описывается указанной комбинацией. Например, в другом варианте реализации описаны соединения формулы (I), где:
(a) A имеет формулу
 ,
,
где RN Ra и RAr являются такими, как определено в настоящем описании; и n равно 1;
(b) n равно 1 и R1 представляет собой водород;
(c) A имеет формулу
 ,
,
где RN, Ra и RAr являются такими, как определено в настоящем описании; n равно 1; и R1 представляет собой водород;
(d) R1 и R3 оба представляют собой водород;
(e) R1 и R2 оба представляют собой водород; и R3 имеет формулу



 ,
,
где R10 R11 и R12 являются такими, как определено в настоящем описании;
(f) A имеет формулу
 ,
,
где RN, Ra и RAr являются такими, как определено в настоящем описании; n равно 1; R1 и R2 оба представляют собой водород; и R3 имеет формулу
 ,
,
где R10 и R11 являются такими, как определено в настоящем описании;
(g) A имеет формулу
 ,
,
где RN, Ra и RAr являются такими, как определено в настоящем описании; n равно 1; R1 и R2 оба представляют собой водород; и A’ имеет формулу
 или
или  ;
;
и т.п.
В настоящем описании термин «алкил» включает цепь атомов углерода, которая возможно является разветвленной. В настоящем описании термин «алкенил» и «алкинил» включает цепь атомов углерода, которая возможно является разветвленной и содержит по меньшей мере одну двойную связь или тройную связь, соответственно. Следует понимать, что алкинил также может содержать одну или более двойных связей. Также следует понимать, что в некоторых вариантах реализации алкил предпочтительно имеет ограниченную длину, включая C1-C24, C1-C12, C1-C8, C1-C6 и C1-C4. Также следует понимать, что в некоторых вариантах реализации алкенил и/или алкинил каждый может предпочтительно иметь ограниченную длину, включая C-C24, C2-C12, C2-C8, C2-C6 и C2-C4. В настоящем описании очевидно, что более короткие алкильные, алкенильные и/или алкинильные группы могут придавать меньше липофильности соединению и, соответственно, будут обладать другим фармакокинетическим поведением. Иллюстративные алкильные группы представляют собой, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, 2-пентил, 3-пентил, неопентил, гексил, гептил, октил и т.п.
В настоящем описании термин «циклоалкил» включает цепь атомов углерода, которая возможно является разветвленной, при этом по меньшей мере часть указанной цепи является циклической. Следует понимать, что циклоалкилалкил представляет собой подгруппу циклоалкила. Следует понимать, что циклоалкил может быть полициклическим. Иллюстративный циклоалкил включает, но не ограничивается ими, циклопропил, циклопентил, циклогексил, 2-метилциклопропил, циклопентилэт-2-ил, адамантил и т.п. В настоящем описании термин «циклоалкенил» включает цепь атомов углерода, которая возможно является разветвленной и содержит по меньшей мере одну двойную связь, при этом по меньшей мере часть указанной цепи является циклической. Следует понимать, что одна или более двойных связей могут находиться в циклической части циклоалкенила и/или нециклической части циклоалкенила. Следует понимать, что циклоалкенилалкил и циклоалкилалкенил каждый представляет собой подгруппу циклоалкенила. Следует понимать, что циклоалкил может быть полициклическим. Иллюстративный циклоалкенил включает, но не ограничивается ими, циклопентенил, циклогексилэтен-2-ил, циклогептенилпропенил и т.п. Также следует понимать, что цепь, образующая циклоалкил и/или циклоалкенил, предпочтительно имеет ограниченную длину, включая C3-C24, C3-C12, C3-C8, C3-C6 и C5-C6. В настоящем описании очевидно, что более короткие алкильные и/или алкенильные цепи, образующие циклоалкил и/или циклоалкенил соответственно, могут придавать меньше липофильности соединению и, соответственно, будут обладать другим фармакокинетическим поведением.
В настоящем описании термин «гетероалкил» включает цепь атомов, которая содержит как углерод, так и по меньшей мере один гетероатом и, возможно является разветвленной. Иллюстративные гетероатомы включают азот, кислород и серу. В некоторых вариантах иллюстративные гетероатомы также включают фосфор и селен. В настоящем описании термин «циклогетероалкил», включая гетероциклил и гетероцикл, включает цепь атомов, которая содержит как углерод, так и по меньшей мере один гетероатом, например, гетероалкил, и возможно является разветвленной, при этом по меньшей мере часть указанной цепи является циклической. Иллюстративные гетероатомы включают азот, кислород и серу. В некоторых вариантах иллюстративные гетероатомы также включают фосфор и селен. Иллюстративный циклогетероалкил включает, но не ограничивается ими, тетрагидрофурил, пирролидинил, тетрагидропиранил, пиперидинил, морфолинил, пиперазинил, гомопиперазинил, хинуклидинил и т.п.
В настоящем описании термин «арил» включает моноциклические и полициклические ароматические карбоциклические группы, каждая из которых может содержать заместители. Иллюстративные ароматические карбоциклические группы, описанные в настоящем документе, включают, но не ограничиваются ими, фенил, нафтил и т.п. В настоящем описании термин «гетероарил» включает ароматические гетероциклические группы, каждая из которых может содержать заместители. Иллюстративные ароматические гетероциклические группы включают, но не ограничиваются ими, пиридинил, пиримидинил, пиразинил, триазинил, тетразинил, хинолинил, хиназолинил, хиноксалинил, тиенил, пиразолил, имидазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, бензимидазолил, бензоксазолил, бензтиазолил, бензизоксазолил, бензизотиазолил и т.п.
В настоящем описании термин «амино» включает группу NH2, алкиламино и диалкиламино, при этом две алкильные группы в диалкиламино могут быть одинаковыми или различными, т.е. алкилалкиламино. В качестве иллюстрации амино включает метил амино, этил амино, диметиламино, метилэтиламино и т.п. Кроме того, следует понимать, что, когда амино модифицирует или модифицируется другим термином, таким как аминоалкил или ациламино, в термин «амино» включены вышеуказанные варианты. В качестве иллюстрации аминоалкил включает H2N-алкил, метиламиноалкил, этиламиноалкил, диметиламиноалкил, метилэтиламиноалкил и т.п. В качестве иллюстрации ациламино включает ацилметиламино, ацилэтиламино и т.п.
В настоящем описании термин «амино и его производные» включает аминогруппу, описанную в настоящем документе, и алкиламино, алкениламино, алкиниламино, гетероалкиламино, гетероалкениламино, гетероалкиниламино, циклоалкиламино, циклоалкениламино, циклогетероалкиламино, циклогетероалкениламино, ариламино, арилалкиламино, арилалкениламино, арилалкиниламино, гетероариламино, гетероарилалкиламино, гетероарилалкениламино, гетероарилалкиниламино, ациламино и т.п., каждый из которых возможно содержит заместители. Термин «аминопроизводное» также включает мочевину, карбамат и т.п.
В настоящем описании термин «гидрокси и его производные» включает OH и алкилокси, алкенилокси, алкинилокси, гетероалкилокси, гетероалкенилокси, гетероалкинилокси, циклоалкилокси, циклоалкенилокси, циклогетероалкилокси, циклогетероалкенилокси, арилокси, арилалкилокси, арилалкенилокси, арилалкинилокси, гетероарилокси, гетероарилалкилокси, гетероарилалкенилокси, гетероарилалкшшлокси, ацилокси и т.п., каждый из которых возможно содержит заместители. Термин «гидроксипроизводное» также включает карбамат и т.п.
В настоящем описании термин «тио и его производные» включает SH и алкилтио, алкенилтио, алкинилтио, гетероалкилтио, гетероалкенилтио, гетероалкинилтио, циклоалкилтио, циклоалкенилтио, циклогетероалкилтио, циклогетероалкенилтио, арилтио, арилалкилтио, арилалкенилтио, арилалкинилтио, гетероарилтио, гетероарилалкилтио, гетероарилалкенилтио, гетероарилалкинилтио, ацилтио и т.п., каждый из которых возможно содержит заместители. Термин «тиопроизводное» также включает тиокарбамат и т.п.
В настоящем описании термин «ацил» включает формил и алкилкарбонил, алкенилкарбонил, алкинилкарбонил, гетероалкилкарбонил, гетероалкенилкарбонил, гетероалкинилкарбонил, циклоалкилкарбонил, циклоалкенилкарбонил, циклогетероалкилкарбонил, циклогетероалкенилкарбонил, арилкарбонил, арилалкилкарбонил, арилалкенилкарбонил, арилалкинилкарбонил, гетероарилкарбонил, гетероарилалкилкарбонил, гетероарилалкенилкарбонил, гетероарилалкинилкарбонил, ацилкарбонил и т.п., каждый из которых возможно содержит заместители.
В настоящем описании термин «карбоксилат и его производные» включает группу CO2H и ее соли, и ее сложные эфиры и амиды, и CN.
В настоящем описании термин «возможно содержащий заместители» включает замещение атомов водорода другими функциональными группами в радикале, который возможно содержит заместители. Указанные другие функциональные группы в качестве иллюстрации включают, но не ограничиваются ими, амино, гидроксил, галоген, тиол, алкил, галогеналкил, гетероалкил, арил, арилалкил, арилгетероалкил, гетероарил, гетероарилалкил, гетероарилгетероалкил, нитро, сульфоновые кислоты и их производные, карбоновые кислоты и их производные, и т.п. В качестве иллюстрации любая группа из: амино, гидроксила, тиола, алкила, галогеналкила, гетероалкила, арила, арилалкила, арилгетероалкила, гетероарила, гетероарилалкила, гетероарилгетероалкила и/или сульфоновой кислоты возможно содержит заместители.
В настоящем описании термин «возможно содержащий заместители арил» и «возможно содержащий заместители гетероарил» включает замещение атомов водорода другими функциональными группами в ариле или гетероариле, который возможно содержит заместители. Указанные другие функциональные группы в качестве иллюстрации включают, но не ограничиваются ими, амино, гидрокси, галоген, тио, алкил, галогеналкил, гетероалкил, арил, арилалкил, арилгетероалкил, гетероарил, гетероарилалкил, гетероарилгетероалкил, нитро, сульфоновые кислоты и их производные, карбоновые кислоты и их производные, и т.п. В качестве иллюстрации любая группа из: амино, гидрокси, тио, алкила, галогеналкила, гетероалкила, арила, арилалкила, арилгетероалкила, гетероарила, гетероарилалкила, гетероарилгетероалкила и/или сульфоновой кислоты возможно содержит заместители.
Иллюстративные заместители включают, но не ограничиваются ими, радикал -(CH2)xZX, где x представляет собой целое число от 0 до 6, и ZX выбран из галогена, гидрокси, алканоилокси, включая C1-C6 алканоилокси, возможно содержащего заместители ароилокси, алкила, включая C1-C6 алкил, алкокси, включая C1-C6 алкокси, циклоалкила, включая C3-C8 циклоалкил, циклоалкокси, включая C3-C8 циклоалкокси, алкенила, включая C2-C6 алкенил, алкинила, включая C2-C6 алкинил, галогеналкила, включая C1-C6 галогеналкил, галогеналкокси, включая C1-C6 галогеналкокси, галогенциклоалкила, включая C3-C8 галогенциклоалкил, галогенциклоалкокси, включая C3-C8 галогенциклоалкокси, амино, C1-C6 алкиламино, (C1-C6 алкил)(C1-C6 алкил)амино, алкилкарбониламино, N-(C1-C6 алкил)алкилкарбониламино, аминоалкила, C1-C6 алкиламиноалкила, (C1-C6 алкил)(C1-C6 алкил)аминоалкила, алкилкарбониламиноалкила, N-(C1-C6 алкил)алкилкарбониламиноалкила, циано и нитро; или ZX выбран из -CO2R4 и -CONR5R6, где R4, R5 и R6 каждый независимо выбран в каждом случае из водорода, C1-C6 алкила, арил-C1-C6-алкила и гетероарил-C1-C6-алкила.
Термин «защищенная аминогруппа» относится к амину, защищенному защитной группой, которая может быть использована для защиты азота, например, азота в β-лактамном кольце, во время получения или последующих реакций. Примерами таких групп являются бензил, 4-метоксибензил, 4-метоксифенил, триалкилсилил, например, триметилсилил, и т.п.
Термин «защищенная карбоксигруппа» относится к карбоксигруппе, защищенной или блокированной традиционной защитной группой, обычно используемой для временного блокирования кислой карбоксигруппы. Примеры таких групп включают низший алкил, например, трет-бутил, низший алкил, содержащий в качестве заместителей галоген, например, 2-иодэтил и 2,2,2-трихлорэтил, бензил и содержащий заместители бензил, например, 4-метоксибензил и 4-нитробензил, дифенилметил, алкенил, например, аллил, триалкилсилил, например, триметилсилил и трет-бутилдиэтилсилил, и подобные карбоксизащитные группы.
Следует понимать, что в вариантах реализации, описанных в настоящем документе, иллюстративным вариантом алкила является C1-C6 алкил, такой как метил, этил, пропил, проп-2-ил и т.п.; иллюстративным вариантом алкенила является C2-C6 алкенил, такой как винил, аллил и т.п.; иллюстративным вариантом алкинила является C2-C6 алкинил, такой как этинил, пропинил и т.п.; иллюстративным вариантом алкокси является C1-C4 алкокси, такой как метокси, пент-3-окси и т.п.; иллюстративным вариантом алкилтио является C1-C4 алкилтио, такой как этилтио, 3-метилбут-2-илтио и т.п.; иллюстративным вариантом алкилкарбонила является C1-C3 алкилкарбонил, такой как ацетил, пропаноил и т.п.; иллюстративным вариантом циклоалкила является C3-C8 циклоалкил; иллюстративным вариантом циклоалкенила является C3-C9 циклоалкенил, такой как лимоненил, пиненил и т.п.; иллюстративным вариантом возможно содержащего заместители арилалкила является возможно содержащий заместители арил(C1-C4 алкил); иллюстративным вариантом возможно содержащего заместители арилалкенила является возможно содержащий заместители арил(C2-C4 алкенил); иллюстративным вариантом возможно содержащего заместители арилалкинила является возможно содержащий заместители арил(C2-C4 алкинил); иллюстративным вариантом алкоксиалкила является (C1-C4 алкокси)-(C1-C4 алкил); иллюстративным вариантом возможно содержащего заместители гетероарилалкила является возможно содержащий заместители гетероарил(C1-C4 алкил); и иллюстративным вариантом алкоксикарбонила является C1-C4 алкоксикарбонил.
В настоящем описании термин «пролекарство» в целом относится к любому соединению, которое при введении в биологическую систему образует биологически активное соединение в результате одной или более спонтанных химических реакций, химических реакций, катализируемых ферментами, и/или метаболических химических реакций, или их комбинаций. In vivo пролекарство, как правило, подвергается действию фермента (например, эстераз, амидаз, фосфатаз и т.п.), простой биологической химии или другому процессу in vivo с высвобождением или регенерацией более фармакологически активного лекарственного средства. Данная активация может происходить в результате действия эндогенного фермента хозяина или неэндогенного фермента, который вводят хозяину до, после или во время введения пролекарства. Дополнительные подробности, касающиеся использования пролекарств, описаны в патенте США No. 5627165; и Pathalk et al., Enzymic protecting group techniques in organic synthesis, Stereosel. Biocatal. 775-797 (2000). Очевидно, что пролекарство предпочтительно превращается в исходное лекарственное средство как только достигается цель, например, целевая доставка, безопасность, стабильность и т.п., с последующим быстрым устранением высвобожденных остатков группы, образующей пролекарство.
Пролекарства могут быть получены из соединений, описанных в настоящем документе, путем присоединения групп, которые в конечном итоге расщепляются in vivo, к одной или более функциональным группам, присутствующим в соединении, таким как -OH-, -SH, -CO2H, -NR2. Иллюстративные пролекарства включают, но не ограничиваются ими, карбоксилатные эфиры, в которых указанная группа представляет собой алкил, арил, арилалкил, гетероарил, гетероарилалкил, ацилоксиалкил, алкоксикарбонилоксиалкил, а также сложные эфиры гидроксила, тиола и аминов, в которых присоединенная группа представляет собой ацильную группу, алкоксикарбонил, аминокарбонил, фосфат или сульфат. Иллюстративные сложные эфиры, также называемые активными сложными эфирами, включают, но не ограничиваются ими, 1-инданил, N-оксисукцинимид; ацилоксиалкильные группы, такие как ацетоксиметил, пивалоилоксиметил, β-ацетоксиэтил, β-пивалоилоксиэтил, 1-(циклогексилкарбонилокси)проп-1-ил, (1-аминоэтил)карбонилоксиметил и т.п.; алкоксикарбонилоксиалкильные группы, такие как этоксикарбонилоксиметил, α-этоксикарбонилоксиэтил, β-этоксикарбонилоксиэтил и т.п.; диалкиламиноалкильные группы, включая ди(низший)алкиламиноалкильные группы, такие как диметиламинометил, диметиламиноэтил, диэтиламинометил, диэтиламиноэтил и т.п.; 2-(алкоксикарбонил)-2-алкенильные группы, такие как 2-(изобутоксикарбонил)пент-2-енил, 2-(этоксикарбонил)бут-2-енил и т.п.; и лактоновые группы, такие как фталидил, диметоксифталидил и т.п.
Дополнительные иллюстративные пролекарства содержат химическую группу, такую как амидная или фосфорная группа, функционирующую с повышением растворимости и/или стабильности соединений, описанных в настоящем документе. Дополнительные иллюстративные пролекарства для аминогрупп включают, но не ограничиваются ими, (C3-C20)алканоил; галоген-(C3-C20)алканоил; (C3-C20)алкеноил; (C4-C7)циклоалканоил; (C3-C6)-циклоалкил(C2-C16)алканоил; возможно содержащий заместители ароил, такой как не содержащий заместители ароил или ароил, содержащий от 1 до 3 заместителей, выбранных из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-C3)алкила и (C1-C3)алкокси, каждый из которых возможно дополнительно содержит в качестве заместителей один или более из 1-3 атомов галогена; возможно содержащий заместители арил(C2-C16)алканоил и возможно содержащий заместители гетероарил(C2-C16)алканоил, такой как арильный или гетероарильный радикал, не содержащий заместители или содержащий от 1 до 3 заместителей, выбранных из группы, состоящей из галогена, (C1-C3)алкила и (C1-C3)алкокси, каждый из которых возможно дополнительно содержит в качестве заместителей от 1 до 3 атомов галогена; и возможно содержащий заместители гетероарилалканоил, содержащий от одного до трех гетероатомов, выбранных из O, S и N, в гетероарильной группе и от 2 до 10 атомов углерода в алканоильной группе, такой как гетероарильный радикал, не содержащий заместители или содержащий от 1 до 3 заместителей, выбранных из группы, состоящей из галогена, циано, трифторметансульфонилокси, (C1-C3)алкила и (C1-C3)алкокси, каждый из которых возможно дополнительно содержит в качестве заместителей от 1 до 3 атомов галогена. Проиллюстрированные группы являются типичными, их перечень не является исчерпывающим, и они могут быть получены традиционными способами.
Очевидно, что пролекарства сами по себе могут не обладать значительной биологической активностью, а вместо этого подвергаются одной или более спонтанным химическим реакциям, химическим реакциям, катализируемым ферментами, и/или метаболическим химическим реакциям, или их комбинации после введения in vivo с образованием соединения, описанного в настоящем документе, являющегося биологически активным или являющегося предшественником биологически активного соединения. Однако очевидно, что в некоторых случаях пролекарство является биологически активным. Также очевидно, что пролекарства часто могут служить для повышения эффективности или безопасности лекарственного средства за счет улучшенной оральной биодоступности, фармакодинамического периода полувыведения и т.п. Пролекарства также относятся к производным соединений, описанных в настоящем документе, содержащим группы, которые просто маскируют нежелательные свойства лекарственного средства или улучшают доставку лекарственного средства. Например, одно или более соединений, описанных в настоящем документе, могут проявлять нежелательное свойство, которое предпочтительно блокировано или минимизировано и может стать фармакологическим, фармацевтическим или фармакокинетическим барьером в клиническом применении лекарственного средства, таким как низкая оральная абсорбция лекарственного средства, отсутствие специфичности, химическая нестабильность, токсичность и плохое принятие пациентом (неприятный вкус, запах, боль в месте инъекции и т.п.), и другие. В настоящем описании очевидно, что пролекарство или другая стратегия с использованием обратимых производных могут быть полезны в оптимизации клинического применения лекарственного средства.
В настоящем описании термин «антагонист» относится к полному или частичному антагонисту. Принимая во внимание тот факт, что подходящим может быть частичный антагонист с любой собственной активностью, частичные антагонисты в качестве иллюстрации демонстрируют по меньшей мере примерно 50% антагонистический эффект или по меньшей мере примерно 80% антагонистический эффект. Указанный термин также включает соединения, которые являются полными антагонистами одного или более рецепторов вазопрессина. Очевидно, что для иллюстративных способов, описанных в настоящем документе, необходимы терапевтически эффективные количества антагонистов рецептора вазопрессина; следовательно, соединения, проявляющие частичный антагонизм к одному или более рецепторам вазопрессина, могут быть введены в более высоких дозах для проявления достаточной антагонистической активности для ингибирования эффектов вазопрессина или агониста вазопрессина.
В настоящем описании термин «терапевтически эффективное количество» относится к такому количеству активного соединения или фармацевтического агента, которое вызывает биологический или медицинский ответ в системе тканей, у животного или человека, которого добивается исследователь, ветеринар, врач или другой клиницист, включающий облегчение симптомов заболевания или расстройства, которое лечат. В соответствии с одним из аспектов терапевтически эффективным количеством является такое количество, которое может лечить или облегчать заболевание или симптомы заболевания при разумном соотношении польза/риск, применимом к любому терапевтическому лечению. Однако следует понимать, что суммарное ежедневное потребление соединений и композиций, описанных в настоящем документе, может быть определено лечащим врачом в рамках тщательного медицинского обследования. Конкретный уровень терапевтически эффективной дозы для каждого конкретного пациента будет зависеть от множества факторов, включая вылечиваемое расстройство и тяжесть указанного расстройства; активность конкретного применяемого соединения; конкретную применяемую композицию; возраст, массу тела, общее состояния здоровья, пол и диету пациента; время введения, путь введения и скорость выведения конкретного применяемого соединения; продолжительность лечения; лекарственные средства, применяемые в комбинации или одновременно с конкретным применяемым соединением; и подобных факторов, хорошо известных исследователю, ветеринару, врачу или другому среднему клиницисту.
В настоящем описании термин «композиция», в целом, относится к любому продукту, содержащему указанные ингредиенты в указанных количествах, а также любому продукту, получаемому напрямую или опосредованно из комбинаций указанных ингредиентов в указанных количествах. Следует понимать, что композиции, описанные в настоящем документе, могут быть получены из выделенных соединений, описанных в настоящем документе, или из солей, растворов, гидратов, сольватов и других форм соединений, описанных в настоящем документе. Также следует понимать, что композиции могут быть получены из различных аморфных, неаморфных, частично кристаллических, кристаллических и/или других морфологических форм соединений, описанных в настоящем документе. Также следует понимать, что композиции могут быть получены из различных гидратов и/или сольватов соединений, описанных в настоящем документе. Соответственно, следует понимать, что такие фармацевтические композиции, которые содержат соединения, описанные в настоящем документе, содержат каждую из или любую комбинацию различных морфологических форм и/или сольватных или гидратных форм соединений, описанных в настоящем документе. В качестве иллюстрации композиции могут содержать один или более носителей, разбавителей и/или наполнителей. Соединения, описанные в настоящем документе, или композиции, их содержащие, могут быть получены в терапевтически эффективном количестве в любых традиционных лекарственных формах, подходящих для способов, описанных в настоящем документе. Соединения, описанные в настоящем документе, или композиции, их содержащие, включая такие составы, могут быть введены самыми разнообразными традиционными путями для способов, описанных в настоящем документе, и в самых разнообразных форматах доз с использованием известных методик (в общем, см. Remington: The Science and Practice of Pharmacy, (21st ed., 2005)).
В настоящем описании термин «введение» включает все способы введения пациенту соединений и композиций, описанных в настоящем документе, включая, но не ограничиваясь ими, пероральный (по), внутривенный (вв), внутримышечный (вм), подкожный (пк), трансдермальный, ингаляционный, трансбуккальный, глазной, сублингвальный, вагинальный, ректальный и т.п. Соединения и композиции, описанные в настоящем документе, могут быть введены в дозированных лекарственных формах и/или составах, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители.
Иллюстративные пути перорального введения включают таблетки, капсулы, эликсиры, сиропы и т.п. Иллюстративные пути парентерального введения включают внутривенное, внутриартериальное, интраперитонеальное, эпидуральное, внутриуретральное, интрастернальное, внутримышечное и подкожное введение, а также любой другой путь парентерального введения, принятый в данной области техники.
Следует понимать, что в способах, описанных в настоящем документе, индивидуальные компоненты совместного введения или комбинации можно вводить любыми подходящими способами, одновременно, совместно, последовательно, отдельно или в одном фармацевтическом составе. В случае, когда совместно вводимые соединения или композиции вводят в отдельных лекарственных формах, количество доз, вводимых в сутки, для каждого соединения может быть одинаковым или разным. Соединения или композиции могут быть введены посредством одинаковых или разных путей введения. Соединения или композиции могут быть введены согласно режимам одновременного или чередующегося введения, в одно и то же или разное время на протяжении курса терапии, одновременно в разделенной или единой форме.
Доза каждого соединения заявленных комбинаций зависит от нескольких факторов, включая: способ введения, состояние, которое лечат, тяжесть состояния, необходимость лечения или необходимость предотвращения состояния, а также возраст, массу и состояние здоровья человека, которого лечат. Кроме того, на используемую дозировку может влиять фармакогеномная (влияние генотипа на фармакокинетические, фармакодинамические характеристики или характеристики эффективности лекарственного средства) информация о конкретном пациенте.
Не являясь связанными рамками какой-либо конкретной теории, согласно настоящему изобретению считается, что AVP и родственные пептиды представляют собой семейство химических сигналов у позвоночных и выполняют важную функцию в контроле социального поведения и эмоций. AVP синтезируется в нейронах в гипоталамусе всех млекопитающих. Он освобождается из нервных окончаний в медианном возвышении и переносится в гипофиз, где увеличивает высвобождение адренокортикотропного гормона (АКТГ) и, в конечном счете, уровень гормонов стресса в кровообращении за счет действия на рецепторы AVP гипофиза. Из нервных окончаний в гипофизе AVP также поступает в общий кровоток, где действует на сердце и кровеносные сосуды, влияя на работу сердца и на почки с уменьшением объема мочи. Нейроны AVP и нервные волокна также обнаружены во всей лимбической системе головного мозга. AVP оказывает физиологическое действие и влияние на поведение путем связывания со специфическими рецепторами, сопряженными с G-белком (GPCR), в центральной нервной системе и некоторых периферических тканях/участках. Были идентифицированы три различных подтипа рецепторов AVP–V1a, V1b и V2. V1a является преобладающим рецептором AVP, обнаруживаемым в лимбической системе и коре головного мозга, рецептор V1b находится в лимбической системе и гипофизе, хотя он менее распространен, чем V1a. Рецептор V2 локализован в почках, где он опосредует антидиуретические эффекты вазопрессина. В целом считается, что V2 не экспрессируется в нервной системе взрослых животных или людей. Данные обнаружения привели к широкому интересу к рецепторам V1a и V1b как потенциальным мишеням для лекарственных средств, действующих на ЦНС.
Согласно настоящему изобретению было обнаружено, что основным в ПТСР и сопутствующих ПТСР заболеваниях является нарушение гипоталамо-гипофизарно-надпочечниковой оси (HPA) и измененная передача сигнала вазопрессина, например, посредством и между лимбической системой, корой головного мозга, передней долей гипофиза и корой надпочечников, и/или задержка передачи сигнала некоторых нейромедиаторов (CRH, AVP и т.п.) по принципу обратной связи, чувствительная к скорости обратная связь некоторых нейромедиаторов и других сигнальных молекул (АКТГ в плазме крови, кортикостерон в плазме крови и т.п.), и их дисфункции.
Не являясь связанными рамками какой-либо конкретной теории, согласно настоящему изобретению считается, что низкая эффективность существующих методов лечения и нехватка новых возможностей каждая может быть обусловлена сложностью ПТСР и различиями нейробиологии, лежащей в основе расстройства. Например, хотя и не являясь связанными рамками какой-либо конкретной теории, согласно настоящему изобретению считается, что ПТСР является совокупностью расстройств. Иллюстративные сопутствующие расстройства, включают, но не ограничиваются ими, глубокую депрессию, тревожные расстройства, расстройства, связанные с импульсивностью и гневом, периодическое взрывное расстройство, злоупотребление различными веществами и т.п.
Согласно другому варианту реализации в настоящем документе описаны соединения, композиции, лекарственные средства и способы для лечения пациента, нуждающегося в облегчении ПТСР (Диагностическое и статистическое руководство по психическим расстройствам, IV издание (DSM-IV): 309.81). Согласно другому варианту реализации в настоящем документе описаны соединения, композиции, лекарственные средства и способы для лечения пациента, нуждающегося в облегчении ПТСР с распространенными сопутствующими расстройствами, такими как другие тревожные расстройства, включая одно или более из: общее тревожное расстройство или родственные тревожные расстройства и т.п. Согласно другому варианту реализации в настоящем документе описаны соединения, композиции, лекарственные средства и способы для лечения пациента, нуждающегося в облегчении ПТСР с сопутствующим периодическим взрывным расстройством, таким как DSM-IV: 312.34 и т.п. Согласно другому варианту реализации в настоящем документе описаны соединения, композиции, лекарственные средства и способы для лечения пациента, нуждающегося в облегчении ПТСР с сопутствующим одним или более депрессивными расстройствами, включая глубокую депрессию и депрессию, резистентную к лечению, такую как DSM-IV: 296.33, и т.п. Согласно другому варианту реализации в настоящем документе описаны соединения, композиции, лекарственные средства и способы для лечения пациента, нуждающегося в облегчении ПТСР с сопутствующим одним или более расстройствами импульсного контроля/расстройствами, связанными с гневом, такими как DSM-IV: 301.7, 301.83, 312.82 и т.п. Согласно другому варианту реализации в настоящем документе описаны соединения, композиции, лекарственные средства и способы для лечения пациента, нуждающегося в облегчении комбинаций таких сопутствующих расстройств.
Периодическое взрывное расстройство и ПТСР, и другие тревожные расстройства признаны Министерством обороны и Национальным институтом психического здоровья основной медицинской проблемой. Данные состояния наблюдали с высокой частотой у солдат, находящихся на действительной службе, и возвращающихся ветеранов. Кроме того, очевидно, что эмоциональные, социальные и медицинские последствия распространяются не только на солдат, страдающих данными расстройствами, но и на их семьи. Существующие возможности лечения включают видоизмененные антидепрессанты и анксиолитики, но данные режимы лечения не продемонстрировали достаточной эффективности, могут давать нежелательные и побочные эффекты и по имеющимся данным приносят ограниченное облегчение. В частности, существуют данные о том, что такие лекарственные средства, используемые в настоящее время, которые не являются специфичными в отношении периодического взрывного расстройства, являются минимально эффективными и могут давать нежелательные побочные эффекты, включая половую дисфункцию, нарушения сна и в некоторых случаях суицидальные мысли. Необходимы улучшенные способы лечения, которые являются более эффективными, а также имеют меньше побочных эффектов. Соответственно, существует необходимость в способах лечения периодического взрывного расстройства и других связанных со стрессом психических заболеваний. Согласно другому варианту реализации в настоящем документе описаны способы, применение, композиции и соединения для лечения ПТСР, включая ПТСР с сопутствующими заболеваниями и расстройствами, не вызывающих половую дисфункцию или не вызывающих существенную половую дисфункцию.
Соединения, описанные в настоящем документе, прицельно воздействующие на рецепторы вазопрессина в головном мозге, представляют собой новый терапевтический подход к лечению периодического взрывного расстройства и других связанных со стрессом психических заболеваний. Возможная польза антагонистов вазопрессина (AVP) основана на доклинических и клинических наблюдениях. Не являясь связанными рамками какой-либо конкретной теории, согласно настоящему изобретению считается, что повышенные уровни AVP являются клиническим показателем индивидуумов, проявляющих неадекватную агрессию и гнев, и могут быть комбинированы с нарушениями реакции на стресс.
Согласно другому варианту реализации соединения, описанные в настоящем документе, являются активными в отношении рецептора Via AVP. Согласно другому варианту реализации соединения, описанные в настоящем документе, являются селективно активными в отношении рецептора V1a AVP и менее активными, по существу менее активными и/или неактивными в отношении другого рецептора AVP, такого как подтипы V1b и/или V2 рецепторов AVP. Согласно другому варианту реализации соединения, описанные в настоящем документе, обладают 10-кратной селективностью в отношении рецептора V1a по сравнению с рецептором V1b и/или V2. Согласно другому варианту реализации соединения, описанные в настоящем документе, обладают 100-кратной селективностью в отношении рецептора V1a по сравнению с рецептором V1b и/или V2. Согласно другому варианту реализации соединения, описанные в настоящем документе, обладают 1000-кратной селективностью в отношении рецептора V1a по сравнению с рецептором V1b и/или V2. Согласно другому варианту реализации соединения, описанные в настоящем документе, обладают 10000-кратной селективностью в отношении рецептора V1a по сравнению с рецептором V1b и/или V2.
Согласно другому варианту реализации соединения, описанные в настоящем документе, проходят через гематоэнцефалический барьер (ГЭБ) и демонстрируют высокую проницаемость в ЦНС. Согласно другому варианту реализации соединения, описанные в настоящем документе, демонстрируют эффективные уровни доз в головном мозге для лечения ПТСР. Согласно другому варианту реализации соединения, описанные в настоящем документе, демонстрируют эффективные уровни доз в головном мозге для лечения периодического взрывного расстройства. Согласно другому варианту реализации соединения, описанные в настоящем документе, демонстрируют эффективные уровни доз в головном мозге для лечения ПТСР с сопутствующими периодическими взрывными расстройствами. Согласно другому варианту реализации соединения, описанные в настоящем документе, демонстрируют уровни в плазме крови, равные или выше уровней, необходимых для клинической эффективности в лечении ПТСР и ПТСР с сопутствующими другими расстройствами, включая, но не ограничиваясь ими, одно или более из: периодическое взрывное расстройство, глубокое депрессивное расстройство, тревога и/или другие связанные со стрессом расстройства настроения. Согласно другому варианту реализации соединения, описанные в настоящем документе, демонстрируют фармакокинетику, согласующуюся с введением доз два раза в сутки (b.i.d.). Согласно другому варианту реализации соединения, описанные в настоящем документе, демонстрируют фармакокинетику, согласующуюся с введением доз один раз в сутки (q.d.). В настоящем описании очевидно, что введение доз как два раза в сутки, так и один раз в сутки может быть важным элементом в улучшении соблюдения пациентом режима и схемы лечения, приводящим к общей повышенной клинической эффективности. Согласно другому варианту реализации соединения, описанные в настоящем документе, являются метаболически стабильными в желудке и крови. Согласно другому варианту реализации соединения, описанные в настоящем документе, демонстрируют характеристики безопасности в отношении сердечно-сосудистой системы как in vivo, так и in vitro, соответствующие лечению ПТСР и ПТСР с сопутствующими другими расстройствами, включая, но не ограничиваясь ими, одно или более из: периодическое взрывное расстройство, глубокое депрессивное расстройство, тревожные расстройства, расстройства импульсного контроля и связанные с гневом расстройства, и/или другие связанные со стрессом расстройства настроения. Согласно другому варианту реализации соединения, описанные в настоящем документе, демонстрируют безопасность в отношении дыхательной системы in vivo.
Согласно другому варианту реализации соединения, описанные в настоящем документе, а также фармацевтические композиции и лекарственные средства, их содержащие, демонстрируют высокие уровни в плазме крови и высокие уровни в головном мозге, в том числе при пероральном введении. Согласно другому варианту реализации соединения, описанные в настоящем документе, а также фармацевтические композиции и лекарственные средства, их содержащие, способны проходить через гематоэнцефалический барьер (ГЭБ), в том числе при пероральном введении. Согласно другому варианту реализации соединения, описанные в настоящем документе, и фармацевтические композиции и лекарственные средства, их содержащие, демонстрируют высокую биодоступность ЦНС и высокую аффинность без значительного или конкурентного связывания с другими заранее определенными GPCRs или другими заранее определенными рецепторами, включая, но не ограничиваясь ими, рецепторы, связанные с нейромедиаторами, стероидные рецепторы, ионные каналы, рецепторы вторичных мессенджеров, рецепторы простагландина, рецепторы факторов роста и гормонов, другие пептидные рецепторы головного мозга и желудочно-кишечного тракта, другие ферменты и т.п. В соответствии с одним из аспектов, соединения, описанные в настоящем документе, а также фармацевтические композиции и лекарственные средства, их содержащие, являются неактивными или по существу неактивными при 100 нМ в отношении стандартной панели 64 рецепторов, включая 35 GPCRs (панель Novascreen), включая рецепторы, связанные с нейромедиаторами, стероидные рецепторы, ионные каналы, рецепторы вторичных мессенджеров, рецепторы простагландина, рецепторы факторов роста, гормональные рецепторы, пептиды головного мозга/кишечника (не включая вазопрессин 1) и ферменты.
Согласно другому варианту реализации соединения, описанные в настоящем документе, а также фармацевтические композиции и лекарственные средства, их содержащие, оказывают специфическое влияние на поведение, которое зависит от ситуации (см., например, Ferris & Potegal (1988)). Например, согласно другому варианту реализации соединения, описанные в настоящем документе, а также фармацевтические композиции и лекарственные средства, их содержащие, блокируют агрессию, но мало влияют или не влияют на половое поведение. Согласно другому варианту реализации соединения, описанные в настоящем документе, и фармацевтические композиции и лекарственные средства, их содержащие, блокируют вспоминание страха, но мало влияют или не влияют на распознавание страха в соответствующих обстоятельствах.
ПРИМЕРЫ
ПРИМЕРЫ СПОСОБОВ
ПРИМЕР. Анализ связывания с рецепторами V1a вазопрессина человека. Линию клеток, экспрессирующих рецептор V1a человека в клетках CHO (далее называемую линией клеток hV1a) получали от доктора Майкла Браунштейна (Dr. Michael Brownstein), NIMH, Батесда, Мэриленд, США. Последовательность кДНК hV1a описана Thibonnier et al., Journal of Biological Chemistry, 269, 3304-3310 (1994), и способ экспрессии был таким же, как описано Morel et al. (1992). Линию клеток hV1a выращивали в альфа-MEM с 10% фетальной бычьей сывороткой и 250 мкг/мл G418 (Gibco, Grand Island, Нью-Йорк, США). Для анализа конкурентного связывания клетки hV1a высевали в 6-луночный культуральный планшет в разведении 1:10 из колбы с конфлюэнтностью и выдерживали в культуре в течение по меньшей мере двух дней. Затем культуральную среду удаляли, клетки промывали 2 мл связывающего буфера (25 мМ Hepes, 0,25% BSA, 1x DMEM, pH=7,0). В каждую лунку добавляли 990 мкл связывающего буфера, содержащего 1 нМ 3H-AVP, с последующими 10 мкл серийно разведенных соединений из Примеров, растворенных в ДМСО. Все инкубации проводили в трех повторностях, кривые зависимости ингибирования от дозы состояли из точек, соответствующих общему связыванию (ДМСО) и 5 концентрациям (0,1, 1,0, 10, 100 и 1000 нМ) тестируемых агентов, включая IC50. 100 нМ холодный AVP (Sigma) использовали для оценки неспецифического связывания. Клетки инкубировали в течение 45 минут при 37°C, удаляли аналитическую смесь и каждую лунку промывали три раза фосфатно-солевым буферным раствором (ФСБР) (pH=7,4). Добавляли 1 мл 2% додецилсульфата натрия (ДСН) на лунку и планшеты оставляли стоять в течение 30 минут. Все содержимое лунки переносили в сцинтилляционный флакон. Каждую лунку промывали 0,5 мл ФСБР, который затем добавляли в соответствующий флакон. Затем добавляли сцинтилляционную жидкость (Ecoscint, National Diagnostics, Атланта, Джорджия) по 3 мл на флакон. Проводили подсчет образцов на жидкостном сцинтилляционном счетчике (Beckman LS3801). Значения IC50 рассчитывали с помощью программного обеспечения Prism Curve для построения кривых по точкам.
В данном анализе тестировали все алканди-сложные эфиры и амиды, представленные в вышеприведенных примерах, растворенные в ДМСО. Кривые связывания получали в соответствии со способами, описанными Thibonnier et al. (1994). К культурам клеток hV1a добавляли [3H]-AVP с последующими 10-кратными разведениями каждого тестируемого соединения. Все активные соединения демонстрировали кривую дозозависимого конкурентного связывания со значениями IC50 и Ki, характерными для высокой аффинности к связыванию с рецепторами V1a в клетках CHO, экспрессирующих рецептор V1a человека (линия клеток hV1a). Например, Пример 225 демонстрировал кривую дозозависимого конкурентного связывания со значениями IC50 (1,86-2,13 нМ) и Ki (1,14-1,30 нМ).
Значения аффинности к связыванию (IC50) и константы ингибирования (Ki иллюстративных соединений представлены в следующей Таблице.
ПРИМЕР. Клетки, экспрессирующие рецепторы V1b вазопрессина человека. кДНК рецепторов 1b вазопрессина человека (hV1b) (см., Lolait et al., "Extrapituitary expression of the rat V1b vasopressin receptor gene" Proc. Natl. Acad. Sci. USA. 92:6783-7 (1995); de Keyzer et al., "Cloning and characterization of the human V3(V1b) pituitary vasopressin receptor" FEBS Lett. 356:215-20 (1994); Sugimoto et al., "Molecular cloning and functional expression of a cDNA encoding the human V1b vasopressin receptor" J. Biol. Chem. 269:27088-92 (1994)) встраивали в в вектор экспрессии клеток млекопитающих PCI-neo (Promega) в участке EcoRl. Рекомбинантную плазмиду, несущую кДНК hV1b, выделяли из трансформированных клонов E.Coli и использовали для трансфекции клетки яичника китайского хомячка (CHO-K1, ATCC). Два микрограмма ДНК рецептора hV1b вводили в 105 клеток CHO, которые культивировали в 6-луночном планшете, с использованием технологии трансфекции, опосредованной Fugene-6 (Boehringer Mannheim). Через двадцать четыре часа после трансфекции клетки культивировали в условиях отбора G-418 (0,25 мг/мл), добавленного в культуральную среду. Через три дня проводили ограниченное разведение с получением одноклеточных клонов в 96-луночных планшетах. После 2-недельного периода роста моноклоны распределяли по двум группам 12-луночных планшетов. По достижении конфлюентности одну группу лунок анализировали на предмет способности связывать меченный тритием аргинин-вазопрессин (NEN). Изначально идентифицировали девять положительных клонов из 60 подвергнутых скринингу клонов, и клоны, демонстрировавшие наибольшее связывание AVP, сохраняли в качестве перманентных линий клеток для скрининга по аффинности к hV1b.
ПРИМЕР. Анализ связывания рецепторов V1b вазопрессина человека или крысы на основе клеток. Линии клеток V1b (клетки, экспрессирующие рецептор V1b человека, либо крысы) выращивали в среде альфа-MEM с добавлением 10% фетальной бычьей сыворотки и 250 мкг/мл G418 (Gibco, Grand Island, Нью-Йорк) в колбе объемом 75 см3. Для анализа конкурентного связывания клетки hV1b диссоциировали с помощью не содержащего ферментов раствора для диссоциации клеток на основе ФСБР (Speciality Media, Филлипсберг, Нью-Джерси) в соответствии с протоколом производителя. Клетки высевали в 12-луночные культуральные планшеты в количестве одна колба на 18 планшетов (количество следует регулировать в зависимости от степени конфлюэнтности) и выдерживали в культуре в течение 2-3 дней. Затем культуральную среду удаляли, клетки один раз промывали 2 мл связывающего буфера (25 мМ Hepes, 0,25% BSA, 1xDMEM, pH=7,0) при комнатной температуре. В каждую лунку добавляли 990 мкл связывающего буфера, содержащего 1 нМ 3H-AVP, с последующим добавлением 10 мкл серийно разведенных тестируемых соединений или холодного AVP, все из которых растворены в ДМСО. Все инкубации проводили в трех повторностях и кривые зависимости ингибирования от дозы состояли из точек, соответствующих общему связыванию (только ДМСО) и 5 концентрациям (0,1, 1,0, 10, 100 и 1000 нМ) тестируемого агента или холодного AVP, включая IC50. Клетки инкубировали в течение 30 минут при 37°C в увлажненном инкубаторе. Затем аналитическую смесь удаляли и каждую лунку три раза промывали ФБР (pH=7,4). После промывки добавляли 1 мл 2% SDS на лунку и планшеты оставляли стоять в течение 15 минут при комнатной температуре. Осторожно постукивали по планшету, чтобы убедиться в отделении лизированных клеток. Все содержимое лунки переносили в сцинтилляционный флакон. Затем каждую лунку промывали 0,5 мл ФБР и добавляли в соответствующий флакон. Затем добавляли сцинтилляционную жидкость (Ecoscint, National Diagnostics, Атланта, Джорджия) по 3 мл на флакон. Проводили подсчет образцов на жидкостном сцинтилляционном счетчике (Beckman LS3801). Значения IC50 и Ki рассчитывали с использованием программного обеспечения Prism Curve для построения кривых по точкам. Иллюстративные соединения, представленные в предыдущей таблице, демонстрируют константу связывания больше 100 нМ или больше 1000 нМ. Иллюстративные данные ингибирования (Ki, нМ) представлены в следующей таблице для выбранных соединений из Примеров.
ПРИМЕР. Ингибирование метаболизма фосфатидилинозита (V1a). Физиологические эффекты вазопрессина опосредованы специфическими рецепторами, сопряженными с G-белком. Рецептор V1a вазопрессина сопряжен с семейством Gq/G11 G-белков и опосредует метаболизм фосфатидилинозита. Агонистический или антагонистический характер соединений согласно настоящему изобретению может быть определен по их способности ингибировать метаболизм фосфатидилинозита, опосредуемый вазопрессином, с применением методики, описанной в следующих абзацах. В данном анализе тестировали иллюстративные соединения, Примеры 35, 44, 88, 110 и 133, и обнаруживали, что они являются антагонистами V1a вазопрессина.
ПРИМЕР. Ингибирование метаболизма фосфатидилинозита, опосредуемого V1b вазопрессина, функциональный анализ активности антагонистов. Физиологические эффекты вазопрессина опосредованы специфическими рецепторами, сопряженными с G-белком. Рецептор V1b вазопрессина сопряжен с G-белком, который сопряжен с цАМФ. Агонистический или антагонистический характер соединений, описанных в настоящем документе, может быть определен по их способности ингибировать метаболизм фосфатидилинозита, опосредуемый вазопрессином, путем использования традиционных способов, включая методику, описанную в следующих абзацах.
Культура клеток и мечение клеток. За три дня до анализа близкие к конфлюэнтности культуры клеток hV1a или hV1b диссоциировали и высевали в 6-луночные планшеты для тканевой культуры, при этом примерно 100 лунок засевали из каждой колбы объемом 75 см3 (эквивалентно индексу разведения 12:1). Каждая лунка содержала 1 мл питательной среды с 2 мкКи [3H]миоинозита (American Radiolabeled Chemicals, Сент-Луис, Миссури, США).
Клетки, экспрессирующие рецепторы V1b человека или крысы, выращивали в альфа-модифицированной минимальной питательной среде, содержащей 10% фетальную бычью сыворотку и 0,25 мг/мл G418. За три дня до анализа близкие к конфлюэнтности культуры диссоциировали и высевали в 6-луночные планшеты для тканевой культуры, при этом примерно 100 лунок засевали из каждой колбы объемом 75 см3 (эквивалентно индексу разведения 12:1). Каждая лунка содержала 1 мл питательной среды с 2 мкКи [3H]миоинозита (American Radiolabeled Chemicals, Сент-Луис, Миссури, США).
Инкубации (V1a и V1b). Все анализы проводили в трех повторностях за исключением исходного и 10 нМ AVP (для обоих n=6). AVP ((аргинин вазопрессин) Peninsula Labs, Белмонт, Калифорния, США (#8103)) растворяли в 0,1 н. уксусной кислоте. Тестируемые агенты растворяли в ДМСО и разбавляли ДМСО до 200 раз, конечной тестируемой концентрации. Тестируемые агенты и AVP (или соответствующие объемы ДМСО) по отдельности добавляли в виде 5 мкл в ДМСО в стеклянные пробирки 12×75 мм, содержащие 1 мл буфера для анализа (сбалансированный солевой раствор Тироде, содержащий 50 мМ глюкозу, 10 мМ LiCl, 15 мМ HEPES, pH 7,4, 10 мкМ фосфорамидон и 100 мкМ бацитрацин). Инкубирование проводили в случайном порядке. Инкубирование инициировали путем удаления среды, содержащей метку, промывания монослоя 1 мл 0,9% NaCl один раз и переноса содержимого аналитических пробирок в соответствующие лунки. Планшеты инкубировали в течение 1 часа при 37°C. Инкубирование завершали путем удаления инкубационной среды и добавления 500 мкл ледяной 5% (масс/об.) трифторуксусной кислоты, и оставляя лунки стоять в течение 15 минут.
Измерение [3H]инозитфосфатов (V1a и V1b). Колонки Poly-Prep Econo-Columns BioRad заполняли 0,3 мл формиатной смолы AG 1 X-8 100-200. Смолу смешивали с водой 1:1 и 0,6 мл добавляли в каждую колонку. Затем колонки промывали 10 мл воды. Под каждую колонку помещали сцинтилляционные флаконы (20 мл). Содержимое каждой лунки переносили в миниколонку, после чего лунку промывали 0,5 мл дистиллированной воды, которую также добавляли в указанную миниколонку. Затем колонки дважды промывали 5 мл 5 мМ миоинозита для элюирования свободного инозита. Аликвоты (1 мл) переносили в 20 мл сцинтилляционные флаконы и добавляли 10 мл Beckman Ready Protein Plus. После завершения промывки миоинозитом пустые сцинтилляционные флаконы помещали под колонки и элюировали [3H]инозитфосфаты с помощью трех добавлений 1 мл 0,5 М формиата аммония, содержащего 0,1 н. муравьиную кислоту. Условия элюирования оптимизировали для извлечения инозит моно-, бис- и трисфосфатов без элюирования более метаболически инертных тетракис-, пентакис- и гексакисфосфатов. К каждому образцу добавляли 10 мл сцинтилляционной жидкости с высокой солевой емкостью, такой как Tru-Count High Salt Capacity или Packard Hionic-Fluor. Содержание инозитсодержащих липидов измеряли путем добавления 1 мл 2% додецилсульфата натрия (ДСН) в каждую лунку, после чего лунки оставляли стоять в течение по меньшей мере 30 минут, и переноса раствора в 20 мл сцинтилляционные флаконы, в которые затем добавляли 10 мл сцинтилляционной жидкости Beckman Ready Protein Plus. Для образцов проводили измерения на жидкостном сцинтилляционном счетчике Beckman LS 3801 в течение 10 минут. Общее включение инозита для каждой лунки рассчитывали как сумму свободного инозита, инозитфосфатов и инозитсодержащих липидов.
Анализ данных (V1a и V1b): эксперименты концентрация-ингибирование. Кривые концентрация-эффект для AVP и кривые концентрация-ингибирование для тестируемых агентов по отношению к 10 нМ AVP анализировали нелинейным методом наименьших квадратов, соотнося кривые с логистической функцией с 4 параметрами. Параметры основного и максимального уровней инозитфосфатов, EC50 или IC50, и коэффициент Хилла варьировали для достижения наилучшего соответствия. Подгонку кривых оценивали в соответствии с предположением о том, что стандартное отклонение пропорционально числу радиоактивных распадов в минуту (dpm). В каждом эксперименте строили полные кривые концентрация-эффект для AVP. Значения IC50 преобразовывали в значения K;, отражающие антагонистическую активность в отношении AVP при образовании сигнальной молекулы IP3, путем использования уравнения Ченга-Прусоффа (Cheng-Prusoff) на основе EC50 для AVP в том же эксперименте. Содержание инозитфосфатов выражали в виде числа распадов в минуту (dpm) на 106 распадов в минуту (dpm) общего включения инозита.
Анализ данных (V1a и V1b): эксперименты по определению конкурентоспособности. Эксперименты по определению конкурентоспособности в отношении Via тестируемых агентов состояли из построения кривых концентрация-эффект для AVP в отсутствии и в присутствии двух или более концентраций тестируемого агента. Эксперименты по определению конкуренции в отношении V1b тестируемых агентов состояли из построения кривых концентрация-эффект для AVP в отсутствии и в присутствии по меньшей мере пяти концентраций тестируемого агента. Данные подбирали в соответствии с логистическим уравнением, описывающим конкурентное связывание:
где Y представляет собой dpm инозитфосфатов, B представляет собой концентрацию исходных инозитфосфатов, M представляет собой максимальное увеличение концентрации инозитфосфатов, A представляет собой концентрацию агониста (AVP), E представляет собой EC50 для агониста, D представляет собой концентрацию антагониста (тестируемого агента), К представляет собой Ki для антагониста, и Q представляет собой кооперативность (коэффициент Хилла).
Соединение из Примера 225 вызывает дозозависимое подавление действия AVP с IC50 (2,68 нМ) и Ki (0,05 нМ). Данные значения согласуются с высокой аффинностью Примера 225 к связыванию и ингибированием синтеза инозитсодержащих липидов через рецептор V1a человека.
ПРИМЕР. Применимость соединений и композиций, описанных в настоящем документе, для лечения ПТСР и связанного со стрессом аффективного расстройства устанавливают с использованием модели выработки условного рефлекса страха перед хищником. В данной модели используют данные фМРТ крыс, увидевших хорька, естественного хищника в качестве безусловного стимула, тогда как ощущение вкуса сахарозы, которое является сильно подкрепляющим, используют в качестве условного стимула. Вкус сахарозы становится связанным с травматической памятью о хорьке. Крысы демонстрируют схему излишней активации (гипервозбуждения) головного мозга в лимбической коре и гиппокампе в ответ на один лишь вкус сахарозы спустя несколько недель. Данная схема излишней активации головного мозга в ответ на стимул, связанный с травматической памятью, характерна для ПТСР. Данные показывают, что активность головного мозга, связанная с памятью на страх, вызываемой воздействием сахарозы, выше, чем первоначальное воздействие хищника. Таким образом, память на страх сильнее, чем сам страх. Лечение соединениями и композициями, описанными в настоящем документе, блокирует излишнюю активацию, наблюдаемую в случае связанной с сахарозой травматической памятью у животных, не получающих лечение. Соединения, описанные в настоящем документе, являются эффективными в данной новой доклинической модели ПТСР у крыс, в которой использовали страх перед хищником в качестве безусловного стимула и вкус сахарозы в качестве условного стимула. Предварительное лечение антагонистом рецептора V1a AVN576 блокировало схему излишней активации головного мозга, вызываемую вкусом сахарозы через несколько недель после воздействия хищника. Соединения, описанные в настоящем документе, также являются эффективными в установленных моделях депрессии (тест социального взаимодействия), тревоги (приподнятый крестообразный лабиринт, темно-светлая камера (Light:Dark Shuttle Box)) и агрессии (тест чужак: резидент).
Выработка условного рефлекса страха перед хищником соединяет аверсивный безусловный стимул (угроза истребления хищником) со вкусом сахарозы в качестве условного стимула. Во время сеанса визуализации бодрствующим крысам показывали живого черного хорька, помещенного в отверстие магнита. Данный показ хищника проводили, помещая или не помещая сахарозу на язык крысы. Возвращение памяти через несколько недель при использовании только сахарозы (в качестве условного стимула) в отсутствии хорька вызывало сильное увеличение активности головного мозга, которое значительно превышает увеличение при первоначальном показе хищника. Данная схема излишней активации головного мозга сосредоточена на лимбической коре, гиппокампе и миндалевидной железе - нервных цепях, вовлеченных в эмоциональный опыт, обучение и память, и которые вовлечены в ПТСР и другие нейропсихиатрические расстройства, включая расстройства, часто сопутствующие ПТСР, см., например, (Ferris et al., Imaging the Neural Circuitry and Chemical Control of Aggressive Motivation. BMC Neurosci, 9(1):111 (2008); Shin & Liberzon, The neurocircuitry of fear, stress, and anxiety disorders. Neuropsychopharmacology. 35(l):169-91 (2010).; Price and Drevets, 2009; Rodriguez et al, 2009). Данная модель является уникальной по нескольким причинам, но самое главное она связывает страх перед хищником с сильно подкрепляющим гедоническим стимулом, сахарозой. Не будучи связанными рамками какой-либо конкретной теории, согласно настоящему изобретению считается, что данная модель проводит параллель с эмоциональной дилеммой, которая вполне может отражать сложные ассоциации, подкрепляющие ПТСР у солдат, возвращающихся из районов боевых действий.
Протокол функциональной МРТ. Эксперименты проводят в 7,0T/20-см USR горизонтальном магните Bruker Biospec (Bruker, Биллерика, Массачусетс, США) и вставке с градиентом магнитного поля 20-Г/см (ID=12 см), допускающей время нарастания 120-мкс (Bruker). Радиочастотные сигналы посылаются и принимаются с помощью двухкатушечного электронного устройства, встроенного в фиксирующий бокс для животных (Ludwig et al., 2004). В начале каждого сеанса визуализации получают набор анатомических данных с высоким разрешением с использованием последовательности импульсов RARE (срез 14; 1,2 мм; FOV 3,0 см, 256×256; TR 2,1 сек; TE 12,4 мс; NEX 6; время исследования 6,5 мин). Функциональные изображения получают с использованием многосрезовой последовательности быстрое спин-эхо. За один сеанс сканирования получают четырнадцать срезов каждые 6 секунд (TR=2108 мс, TEeff=53,2 мс, фактор RARE=16, NEX 1), повторяемые 100 раз в течение 10-минутного сканирования. Через 5 минут получения исходных функциональных изображений помещают хорька/вводят сахарозу или только вводят сахарозу и получают функциональные изображения в течение еще 5 минут.
Сеанс сканирования. Во время сеанса визуализации самцам крыс линии Long Evans показывали взрослого самца черного хорька, которого удерживали в виварии, или показывали пустой виварий, помещенный в отверстие магнита. Трубку PE 10 пропускали через отверстие в передней части удерживающей системы и располагали во рту крысы. Рот крыс держали слегка приоткрытым с помощью пластины для кусания, встроенной в держатель для головы. При помещении хорька или пустого вивария производили введение 0,1 мл 10% раствора сахарозы или воды через трубку. Изменения частоты сердечных сокращений, дыхания и температуры неинвазивно контролировали на протяжении всех 10 минут сеанса сканирования. После сеанса визуализации крыс возвращали в домашнюю клетку и не трогали до следующего сеанса визуализации через 14 дней. Животных помещали по одному в цикл света-темноты 12:12 и обеспечивали едой и водой без ограничения.
Получали трехмерные изображения нейронной цепи Папеца (лимбическая кора, вовлеченная в эмоциональный опыт) наряду с миндалевидной железой и гиппокампом крысы. Области корковой нейронной цепи Папеца включали прелимбическую кору, вторую двигательную область коры, переднюю поясную кору, первичную соматосенсорную кору, энторинальную кору, передний таламус, мамиллярные тела, ретроспленальную кору, островковую кору и надглазничную кору. Области миндалевидной железы включали опорное ядро терминальной полоски, переднее ядро, базальное ядро, заднее ядро, медиальное ядро, корковое ядро, латеральное ядро и центральное ядро. Области гиппокампа включали зубчатое ядро, опорную структуру, CA1 и CA3. В отношении Фиг.1, черные области обозначают среднюю значительную активацию BOLD восьми животных для каждого состояния.
Все животные находились в полном сознании в течение 10 минутного сеанса визуализации (5 контрольных и 5 со стимулом). (A) показывает схему безусловной активации в случае только с хорьком. (B) показывает схему безусловной активации в случае только с хорьком после предварительного лечения AVN576 (5 мг/кг массы тела). (C) показывает схему условной активации, когда животных повторно подвергают действию только сахарозы в магните через две недели. (D) показывает схему условной активации, когда животных предварительно лечат AVN576 (5 мг/кг массы тела) и повторно подвергают действию только сахарозы в магните через две недели. Также получали данные для схемы безусловной активации в случае только хорька+сахароза (не представлены). Все области корковой нейронной цепи Папеца, миндалевидной железы и гиппокампа демонстрировали увеличение активации, когда животных повторно подвергали действию только сахарозы (C) по сравнению с хорьком (C) или хорьком и сахарозой (не представлено). Все увеличения были значимыми (p<0,05) за исключением энторинальной коры, передней поясной коры, коркового ядра и центрального ядра. Данные на (D) показывают, что предварительное лечение крыс соединениями, описанными в настоящем документе, значительно снижает активацию головного мозга в нейронных цепях, связанных с эмоциональным опытом, обучением и памятью, когда животных повторно подвергают действию только сахарозы после выработки условного рефлекса. Данные на (C) показывают, что ответ на страх перед хищником у тестируемого животного с невыработанным условным рефлексом сохраняется.
AVN576 (Пример 266) эффективно блокировал возвращение памяти на страх перед хищником. Не являясь связанными рамками какой-либо конкретной теории, согласно настоящему изобретению считается, что вазопрессин вовлечен в память на страх, а не в сам ответ на страх. Соединения, описанные в настоящем документе, ослабляют схему излишней активации головного мозга, связанную с возвращением аверсивной памяти. Существуют данные о схеме излишней активации в цепях страха у пациентов с ПТСР (см., например, Shin et al, Regional cerebral blood flow in the amygdala and medial prefrontal cortex during traumatic imagery in male and female Vietnam veterans with PTSD. Arch Gen Psychiatry Feb;61(2):168-76 (2004); Shin and Liberzon, 2010).
ПРИМЕР. Модель стресса и агрессии «чужак-резидент» у крыс. Нейровизуализацию используют для оценки блокады стресса/возбуждения тестируемым соединением по сравнению с контролем. Действие AVN251-HCl на функциональную схему исследовали с использованием метода визуализации для бодрствующих крыс. Дополнительные детали анализа описаны у Ferris et al. (2008). Данное исследование обеспечивало представление действия AVN251-HCl на ЦНС и дифференцированных нейробиологических изменений, производимых AVN251-HCl по сравнению с флуоксетином (fluoxetine) (AVN251-HCl оставлял половую мотивацию нетронутой, тогда как флуоксетин заметно уменьшал активацию данной цепи).
У самцов крыс, находящихся вместе с самкой в одной клетке, будет происходить пилоэрекция в присутствии самца-чужака. Данная пилоэрекция является признаком стресса и агрессивного намерения, и связана с активацией цепей стресса/возбуждения в головном мозге. Лечение AVN251-HCl (5 мг/кг) блокирует активацию данной цепи стресса. Важно отметить, что данный эффект, по-видимому, является специфичным, поскольку функция мезокортиколимбической дофаминовой подкрепляющей системы в ответ на половой мотивирующий стимул (самка, примированная эстроген-прогестероном) оставалась нетронутой в присутствии AVN251-HCl. Самцов крыс-резидентов из шести пар самецхамка подвергали визуализации пока они находились в полностью бодрствующем состоянии. Во время одного сеанса визуализации данных самцам давали носитель или AVN251-HCl (5 мг/кг).
Общий объем активации головного мозга для самцов-резидентов, столкнувшихся только с «товарищем», с «товарищем» и чужаком, и с «товарищем» и чужаком в присутствии AVN251-HCl, можно оценить в виде трехмерных моделей. Тогда как, по-видимому, происходит общее снижение сигнала BOLD в основных областях при лечении AVN251-HCl, блокада рецепторов V1a не влияла на половую мотивацию, оцениваемую путем представления новой воспринимающей самки. Визуализация демонстрирует сильную активацию разных областей головного мозга, когда в качестве стимула представляют новую самку. Более того, самцы-резиденты, которых лечат AVN251-HCl, демонстрируют нормальное половое поведение по отношению к воспринимающим самкам (новые самки после овариэктомии, получающие лечение эстрогеном/прогестероном) в условиях домашней клетки.
Активацию цепи стресса в ответ на самца-чужака оценивают путем получения сканов головного мозга, если смотреть с каудальной/дорсальной позиции, в виде просвечивающих раковин. Локализация активированных вокселей отображается в виде трехмерных объемов активации, каждый из который состоит из 10 объектов. После полной регистрации и сегментации статистические ответы для каждого объекта усредняют на основе воксел-за-вокселем (voxel-by-voxel). Данные усредненные воксели, превышающие 2,0% порог, представлены в соответствующем пространственном расположении. Функциональные изображения получают у бодрствующих крыс при 4,7T.
Пероральное введение каждого из соединений из Примера 34A (AVN251) или Примера 331 (AVN246) блокировало стресс и агрессивную мотивацию по сравнению с контролями. Тестируемые соединения ослабляют активность цепи стресса/возбуждения, обычно возникающую в ответ на стимул в виде чужака.
Половая мотивация также активизирует подкрепляющую схему в присутствии AVN251. AVN251-HCl селективно блокирует агрессивную мотивацию («товарищ»/чужак), но не половую мотивацию (новая самка), как видно в трехмерных моделях активности в первичной обонятельной системе и подкрепляющих (мезокортиколимбическая дофаминергическая система) путях. Трехмерные объемы активации состоят из результатов, полученных у 10 объектов в каждом состоянии. Существенное снижение на основе воксел-за-вокселем наблюдали в обеих системах в сценарии «товарищ»/чужак в группе лечения. Однако в сценарии с новыми самками обе системы демонстрировали сохраненную активность. Конкретные измеряемые обонятельные системы включали переднее обонятельное ядро, обонятельный бугорок, пириформную кору, латеральный обонятельный тракт и энторинальную кору. Конкретные измеряемые дофаминергические системы включали прелимбическую кору, прилежащие области, вентральный паллидум, медиальный дорсальный таламус и вентральную покрышку.
ПРИМЕР. Нейровизуализация демонстрирует блокаду стресса в важных областях головного мозга. Бодрствующих крыс подвергали визуализации, когда им представляли их «товарища»+чужака, крайне стрессовый стимул. Предварительное лечение AVN251 (5 мг/кг) за 90 минут до сеанса тестирования блокировало ответ на стресс/возбуждение. Половая мотивация и поведение оставались нетронутыми. Оценивали отдельные области головного мозга, включая миндалевидную железу, кору, гиппокамп и таламус, каждая из которых демонстрировала схожие результаты.
ПРИМЕР. Модель «чужак-резидент» у хомяка. Помещение незнакомого самца хомяка в домашнюю клетку другого самца хомяка вызывает хорошо определенную последовательность агонистического поведения у резидента, включающую наступательную агрессию.
Самцов сирийских золотистых хомячков (Mesocricetus auratus) (140-150 г), полученных от Harlan Sprague-Dawley Laboratories (Индианаполис, Индиана), индивидуально размещали в клетки из плексигласа (24 см×24 см×20 см), содержали в режиме обратного цикла свет: темнота (14C:10T; свет включали в 19:00) и обеспечивали едой и водой без ограничения. Животных приспосабливали к обратному циклу свет: темнота в течение по меньшей мере двух недель до тестирования. Все поведенческие тесты проводили во время темной фазы циркадного цикла.
Измерение и анализ поведения. Хомяки ведут ночной образ жизни, и поэтому поведенческие тесты проводят в течение первых четырех часов темной фазы при слабом красном освещении. Резидента оценивают на предмет стресса, например, задержки перед тем, как укусить чужака, общего времени контакта с чужаком, общего числа укусов и мечения боковой поверхностью тела (flank marking), на протяжении 10-минутного периода тестирования (Ferris, C.F., Potegal, М. Physiology and Behavior, 44,235-239 (1988)). Мечение боковой поверхностью тела представляет собой форму обонятельной коммуникации, при которой хомяк выгибает спину и трется вырабатывающими феромоны боковыми железами о предметы в окружающей обстановке (Johnston, R.E. Communication, In: THE HAMSTER REPRODUCTION AND BEHAVIOR. Ed Siegel, H.I. Plenum Press, New York, pp 121-154 (1985)). Частота мечения боковой поверхностью тела значительно повышается во время агрессивных столкновений и является особенно высокой у доминирующих животных, инициирующих и выигрывающих схватки (Ferris, C.F., et al., Physiology and Behavior, 40, 661-664 (1987)).
Соединения, описанные в настоящем документе, тестируют с использованием пяти групп по пять животных каждая в диапазоне доз (100 нг/кг, 10 мкг/кг, 1 мг/кг, 10 мг/кг и носитель-физиологический раствор в качестве контроля). Через девяносто минут после введения лекарственного средства через оральный зонд чужака помещают в домашнюю клетку и оценивают резидента на предмет наступательной агрессии. После тестирования агрессии животных подвергают скринингу на предмет двигательной активности в парадигме открытого поля и половой мотивации.
Параметрические данные, т.е. задержки и время контакта, анализируют с помощью однофакторного дисперсионного анализа (ANOVA) с последующими апостериорными тестами Ньюмана-Кеулса. Непараметрические данные, т.е. количество укусов и меток на боках анализируют с помощью критериев Крускала-Уоллиса с последующими U-критериями Манна-Уитни с определением различий между группами.
Задержка перед укусом увеличивается, а количество укусов уменьшается при введении соединений, описанных в настоящем документе, что указывает на более низкий уровень стресса у животных, получающих лечение. Время контакта также может быть увеличено.
ПРИМЕР. Хроническая субординационная модель депрессии у мышей. Социальный стресс является одним из факторов в этиологии нескольких психопатологий, при этом индивидуумы отличаются восприимчивостью. Взрослых самцов мышей подвергают модели хронического психосоциального стресса, в которой пары резидент/чужак постоянно живут в сенсорном контакте и ежедневно физически взаимодействуют. Животные-чужаки, хронически подчиненные с помощью данной методики, демонстрируют поведение, характерное для депрессии и расстройств, связанных с депрессией.
ПРИМЕР. Антидепрессантное действие в тесте социального взаимодействия. Постоянное социальное подчинение является стандартным способом получения животных, демонстрирующих подобные депрессии физиологические и поведенческие характеристики. Парадигма быстрого подчинения у мышей приводит к снижению поведения социального взаимодействия, при этом зависимыми мерами являются пройденное расстояние и время нахождения в зоне взаимодействия. 28-дневный режим лечения флуоксетином, стандартным антидепрессантом, вызывал обратное развитие дефицита, вызываемого хроническим подчинением, тогда как такой же режим с использованием хлордиазепоксида (chlordiazepoxide) (CDP), стандартного анксиолитика, не оказывал действия. Данные наблюдения согласуются с моделью субординации/социального взаимодействия в качестве быстро поведенческого скрининга на предмет потенциальных антидепрессантов. Дополнительные подробности описаны в Berton et al. (2006).
Вкратце, самцы C57B1/6J ежедневно в течение 10 дней терпели поражение со стороны резидентов, крайне агрессивных самцов CF-1. Через 5 минут прямого воздействия в клетку помещали перфорированную пластиковую перегородку, обеспечивающую обонятельный и зрительный контакт без физического поражения на протяжении оставшихся 23 часов 55 минут каждый день. Самцам C57 показывали другого самца-резидента в другой клетке каждый день с увеличением стресса от методики (наблюдали, что все самцы CF-1 атаковали чужака каждый день). В конце 10-дневной методики нанесения поражения самцов C57 тестировали в аппарате открытого поля во время темной фазы. Доминирующего самца сажали в клетку в области аппарата открытого поля, называемой «зоной социального взаимодействия». Фиксировали время и расстояние, пройденное в данной зоне. Затем самцов C57 случайным образом делили на группы следующего лечения: AVN246-HCl (2 мг/кг), носитель-физиологический раствор (0,45%) или хлордиазепоксид (10 мг/кг). Лечение осуществляли ежедневно (интраперитонеально) в течение 28 дней и животных повторно тестировали. Изменения в поведении определяли путем расчета разности баллов (Post-Pretest) и анализировали данные баллы.
Как показано в Таблице, лечение AVN246-HCl значительно увеличивало как пройденное расстояние, так и время в зоне взаимодействия, что указывает на то, что соединения, описанные в настоящем документе, вызывают обратное развитие дефицита в поведении социального взаимодействия после социального подчинения.
Статистически значимое различие (p<0,05) наблюдали между тестируемым соединением и как контролем (физиологический раствор), не получавшим лечение, так и отрицательным контролем (CDP). Флуоксетин, антидепрессант, вызывал сопоставимые улучшения; хлордиазепоксид (CDP), стандартный анксиолитик, не оказывал действия. Данные результаты подтверждают, что дефицит социального взаимодействия, индуцированный хроническим подчинением, восприимчив к антидепрессантам, но не к анксиолитикам. Наблюдают, что AVN246 дает схожие результаты.
ПРИМЕР. Анксиолитический эффект в Темно-светлой камере. Анализ с применением темно-светлой камеры представляет собой стандартный и хорошо изученный анализ для оценки анксиолитических эффектов тестируемого соединения. Крысы естественным образом избегают светлой стороны камеры, потому что она вызывает стресс. Увеличенное время на светлой стороне у группы лечения по сравнению с контролем отражает анксиолитический эффект (Bourin and Hascoet, 2003). Взрослым самцам крыс линии Long Evans вводили AVN251 (0,1-2 мг/кг) через оральный зонд за 90 минут до тестирования в темно-светлой камере. Наблюдали дозозависимое снижение тревоги в ответ на AVN251 по сравнению с носителем. В зависимости от дозы тестируемые животные проводили значительно больше времени на свету (ФИГ.2A), меньше времени в темноте (ФИГ.2B) и осуществляли больше входов свет-темнота (ФИГ.2C) после лечения 1 или 2 мг/кг AVN251.
ПРИМЕР. Общие пути синтеза. Подход с использованием проксимального амида, обеспечивающий вариацию синтеза в дистальном амидном участке; сначала получают проксимальный амид с последующим разнообразием дистального амида посредством параллельного синтеза.
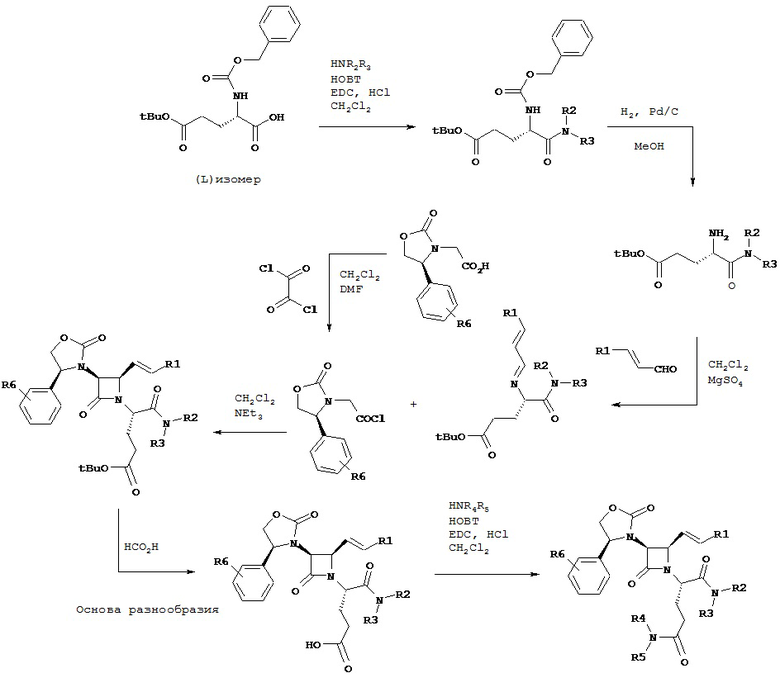
Подход с использованием дистального амида, обеспечивающий вариации синтеза в проксимальном участке; сначала получают дистальный амид с последующим разнообразием проксимального амида посредством параллельного синтеза.
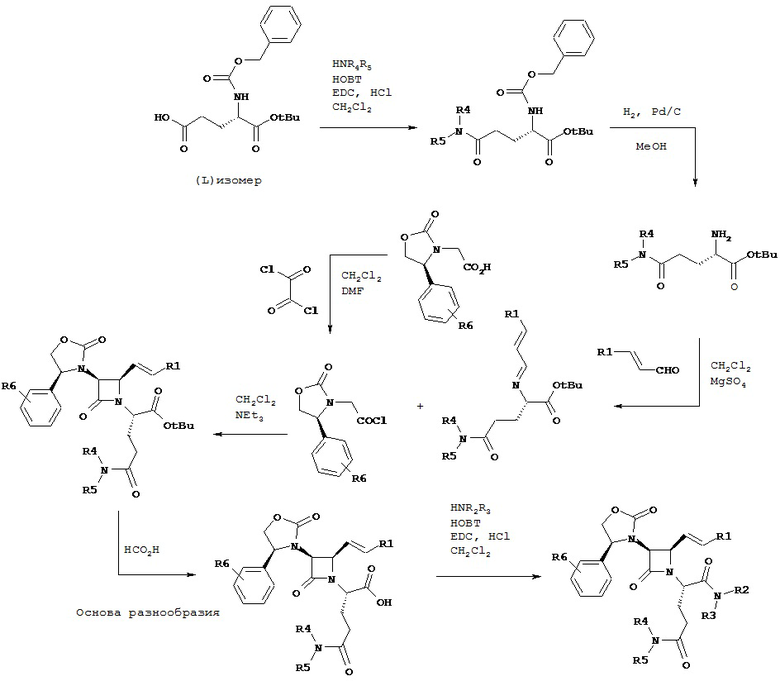
Синтез AVN251 представлен ниже. Все остальные соединения получают аналогичным образом при соответствующем выборе исходных веществ.
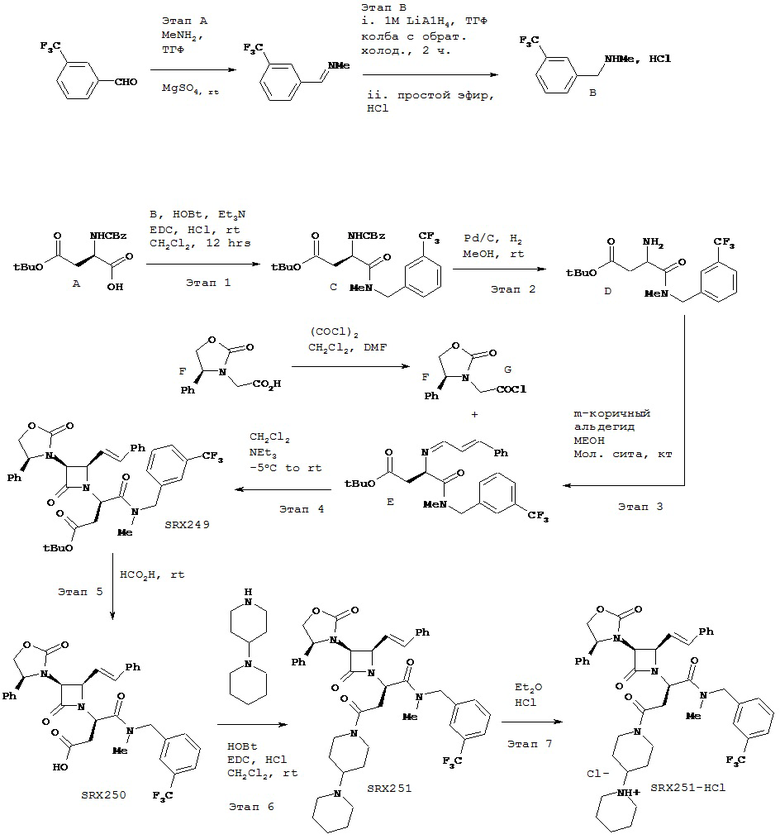
Дополнительные подробности и альтернативные синтезы для получения соединений, описанных в настоящем документе, описаны в патенте США No. 7119083, полное содержание которого включено в настоящее описание посредством ссылки. Соединения, описанные в настоящем документе, могут быть приготовлены в определенной форме и введены в соответствии со способами, описанными в патенте США No. 7119083. Дополнительные подробности описаны в Guillon, CD., et al., Azetidinones as vasopressin V1a antagonists. Bioorg Med Chem, 15(5):2054-80 (2007).
ПРИМЕРЫ СОЕДИНЕНИЙ
Пример 1. (4(S)-Фенилоксазолидин-2-он-3-ил)ацетилхлорид. Раствор 1,0 эквивалента (4 (S)-фенилоксазолидин-2-он-3-ил)уксусной кислоты (Evans, патент США No. 4665171) и 1,3 эквивалента оксалилхлорида в 200 мл дихлорметана обрабатывали каталитическим количеством безводного диметилформамида (85 мкл/миллиэквивалент производного уксусной кислоты), что приводило к интенсивному выделению газа. Через 45 минут выделение газа полностью прекращалось и реакционную смесь концентрировали при пониженном давлении с получением соединения, указанного в названии, в виде грязно-белого твердого вещества после сушки в течение 2 часов под вакуумом.
Пример 1A. (4(R)-Фенилоксазолидин-2-он-3-ил)ацетилхлорид. Соединение из Примера 1A получали в соответствии с методикой из Примера 1, за исключением того, что (4(R)-фенилоксазолидин-2-он-3-ил)уксусную кислоту использовали вместо (4(S)-фенилоксазолидин-2-он-3-ил)уксусной кислоты (см. Evans & Sjogren, Tetrahedron Lett. 26:3783 (1985)).
Пример 1B. Метил(4(S)-фенилоксазолидин-2-он-3-ил)ацетат. Раствор (4(S)-фенилоксазолидин-2-он-3-ил)уксусной кислоты (1 г, 4,52 ммоль) (полученной в соответствии с Evans в патенте США No. 4665171) в 20 мл безводного метанола каждый час обрабатывали 5 эквивалентами ацетилхлорида, в общей сложности 20 эквивалентами. Полученный раствор перемешивали в течение ночи. Остаток, полученный после выпаривания MeOH, повторно растворяли в 30 мл CH2Cl2 и его обрабатывали 50 мл насыщенного водного Na2CO3. Органическую фазу выпаривали и сушили (MgSO4) с получением соединения, указанного в названии, в виде бесцветного масла (1,001 г, 94%); 1H ЯМР (CDCl3) δ 3,37 (d, J==18,0 Гц, 1H), 3,69 (s, 3H), 4,13 (t, J=8,3 Гц, 1H), 4,28 (d, J=18,0 Гц, 1H), 4,69 (t, J=8,8 Гц, 1H), 5,04 (t, J=8,4 Гц, 1H), 7,26-7,29 (m, 2H), 7,36-7,42 (m, 3H).
Пример 1C. Метил-2-(4(8)-фенилоксазолидин-2-он-3-ил)пропаноат. Раствор метил(4(S)-фенилоксазолидин-2-он-3-ил)ацетата (1 г, 4,25 ммоль) в 10 мл безводного ТГФ при -78°C обрабатывали 4,68 мл (4,68 ммоль) 1 М раствора бис(триметилсилил)амида лития в ТГФ. Реакционную смесь перемешивали в течение 1 часа при примерно -70°C перед добавлением MeI (1,59 мл, 25,51 ммоль). После полного превращения азетидинона реакцию гасили насыщенным водным NH4Cl и разделяли на EtOAc и воду. Органическую фазу последовательно промывали насыщенным водным бисульфитом натрия и насыщенным водным NaCl. Полученную органическую фазу сушили (MgSO4) и выпаривали с получением соединения, указанного в названии (смесь диастереомеров), в виде белого твердого вещества (1,06 г, 93%); 1Н ЯМР (CDCl3) δ 1,07/1,53 (d/d, J=7,5 Гц, 3H), 3,59/3,74 (s/s, 3H), 3,85/4,48 (q/q, J=7,5 Гц, 1H), 4,10-4,14 (m, 1H), 4,60-4,64/4,65-4,69 (m/m, 1H), 4,88-4,92/4,98-5,02 (m/m, 1H), 7,24-7,40 (m, 5H).
Пример 1D. 2-(4(S)-Фенилоксазолидин-2-он-3-ил)пропановая кислота. К раствору метил-2-(4(S)-фенилоксазолидин-2-он-3-ил)пропаноата (1 г, 4,01 ммоль) в 35 мл MeOH добавляли при 0°C 14,3 мл (12,04 ммоль) 0,84 М раствора LiOH в воде. Затем реакционную смесь перемешивали в течение 3 часов при температуре окружающей среды. После полного гидролиза азетидинона MeOH удаляли путем выпаривания, неочищенный остаток растворяли в CH2Cl2 и обрабатывали его насыщенным водным NaCl. Полученную органическую фазу сушили (MgSO4) и выпаривали с получением соединения, указанного в названии (рацемическая смесь) в виде белого твердого вещества (0,906 г, 96%); 1Н ЯМР (CDCl3) δ 1,13/1,57 (d/d, J=7,5 Гц, 3H), 3,75/4,50 (q/q, J=7,5 Гц, 1H), 4,10-4,16 (m, 1H), 4,62-4,72 (m, 1H), 4,92-5,03 (m, 1H), 7,32-7,43 (m, 5H).
Пример 1E. 2-(4(S)-Фенилоксазолидин-2-он-3-ил)пропаноилхлорид. Раствор 1 эквивалента соединения из Примера 1D и 1,3 эквивалента оксалилхлорида в 200 мл CH2Cl2 (150 мл/г производного пропановой кислоты) обрабатывали каталитическим количеством безводного диметилформамида (ДМФА) (85 мкл/ммоль производного пропановой кислоты), что приводило к интенсивному выделению газа. Через 45 минут выделение газа полностью прекращалось и реакционную смесь концентрировали при пониженном давлении с получением соединения, указанного в названии, в виде грязно-белого твердого вещества после сушки в течение 2 часов под вакуумом.
Пример 2. Общая методика получения амида из активированного производного сложного эфира. N-Бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламид. Раствор N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-N-гидроксисукцинимидного эфира (1,95 г, 4,64 ммоль, Advanced ChemTech) в 20 мл сухого тетрагидрофурана обрабатывали 0,68 мл (4,74 ммоль) 3-(трифторметил)бензиламина. После завершения (ТСХ, гексаны/этилацетат 60:40) смесь выпаривали и полученное масло распределяли между дихлорметаном и насыщенным водным раствором бикарбоната натрия. Органическую фазу выпаривали с получением 2,23 г (количественный выход) соединения, указанного в названии, в виде белого твердого вещества; 1H ЯМР (CDCl3) δ 1,39 (s, 9H), 2,61 (dd, J=6,5 Гц, J=17,2 Гц, 1H), 2,98 (dd, J=3,7 Гц, J=17,0 Гц, 1H), 4,41 (dd, J=5,9 Гц, J=15,3 Гц, 1H), 4,50-4,57 (m, 2H), 5,15 (s, 2H), 5,96-5,99 (m, 1H), 6,95 (s, 1H), 7,29-7,34 (m, 5H), 7,39-7,43 (m, 2H), 7,48-7,52 (m, 2H).
Соединения из Примеров 2A-2C и 3-5 получали в соответствии с методикой из Примера 2 за исключением того, что N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-N-гидроксисукцинимидный эфир заменяли на соответствующее производное аминокислоты, а 3-(трифторметил)бензиламин заменяли на соответствующий амин.
Пример 2A. N-Бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамид. Из N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-N-гидроксисукцинимидного эфира (5,0 г, 12 ммоль, Advanced ChemTech) и 4-(фенилэтил)пиперазина 2,27 мл (11,9 ммоль) получали 5,89 г (количественный выход) соединения, указанного в названии, в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,40 (s, 9H), 2,45-2,80 (m, 10H), 3,50-3,80 (m, 4H), 4,87-4,91 (m, 1H), 5,08 (s, 2H), 5,62-5,66 (m, 1H), 7,17-7,33 (m, 10H).
Пример 2B. N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-L-глутаминовой кислоты β-трет-бутилового эфира α-N-гидроксисукцинимидного эфира (4,83 г, 11,1 ммоль, Advanced ChemTech) и 3-(трифторметил)бензиламина 1,63 мл (11,4 ммоль) получали 5,41 г (98%) соединения, указанного в названии, в виде грязно-белого твердого вещества; 1Н ЯМР (CDCl3) δ 1,40 (s, 9H), 1,88-1,99 (m, 1H), 2,03-2,13 (m, 1H), 2,23-2,33 (m, 1H), 2,38-2,47 (m, 1H), 4,19-4,25 (s, 1H), 4,46-4,48 (m, 2H), 5,05-5,08 (m, 2H), 5,67-5,72 (m, 1H), 7,27-7,34 (m, 5H), 7,39-7,43 (m, 2H), 7,48-7,52 (m, 2H).
Пример 2C. N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамид. Из N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-N-гидроксисукцинимидного эфира (5,0 г, 12 ммоль, Advanced ChemTech) и 4-(фенилэтил)пиперазина 2,19 мл (11,5 ммоль) получали 5,87 г (количественный выход) соединения, указанного в названии, в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,43 (s, 9H); 1,64-1,73 (m, 1H); 1,93-2,01 (m, 1H); 2,23-2,40 (m, 2H); 2,42-2,68 (m, 6H); 2,75-2,85 (m, 2H); 3,61-3,74 (m, 4H); 4,66-4,73 (m, 1H); 5,03-5,12 (m, 2H); 5,69-5,72 (m, 1H); 7,16-7,34 (m, 10H).
Пример 3. N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамид. Из N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-N-гидроксисукцинимидного эфира (5,0 г, 12 ммоль, Advanced ChemTech) и 4-(фенилэтил)пиперазина 2,27 мл (11,9 ммоль) получали 5,89 г (количественный выход) соединения, указанного в названии, в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,40 (s, 9H), 2,45-2,80 (m, 10H), 3,50-3,80 (m, 4H), 4,87-4,91 (m, 1H), 5,08 (s, 2H), 5,62-5,66 (m, 1H), 7,17-7,33 (m, 10H).
Пример 4. N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-L-глутаминовой кислоты β-трет-бутилового эфира α-N-гидроксисукцинимидного эфира (4,83 г, 11,1 ммоль, Advanced ChemTech) и 3-(трифторметил)бензиламин 1,63 мл (11,4 ммоль) получали 5,41 г (98%) соединения, указанного в названии, в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,40 (s, 9H), 1,88-1,99 (m, 1H), 2,03-2,13 (m, 1H), 2,23-2,33 (m, 1H), 2,38-2,47 (m, 1H), 4,19-4,25 (s, 1H), 4,46-4,48 (m, 2H), 5,05-5,08 (m, 2H), 5,67-5,72 (m, 1H), 7,27-7,34 (m, 5H), 7,39-7,43 (m, 2H), 7,48-7,52 (m, 2H).
Пример 5. N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамид. Из N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-N-гидроксисукцинимидного эфира (5,0 г, 12 ммоль, Advanced ChemTech) и 4-(фенилэтил)пиперазина 2,19 мл (11,5 ммоль) получали 5,87 г (количественный выход) соединения, указанного в названии, в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,43 (s, 9H); 1,64-1,73 (m, 1H);1,93-2,01 (m, 1H); 2,23-2,40 (m, 2H); 2,42-2,68 (m, 6H); 2,75-2,85 (m, 2H); 3,61-3,74 (m, 4H); 4,66-4,73 (m, 1H); 5,03-5,12 (m, 2H); 5,69-5,72 (m, 1H); 7,16-7,34 (m, 10H).
Пример 5A. N-[(9H-флуорен-9-ил)метоксикарбонил]-O-(бензил)-D-серина трет-бутиловый эфир. N-[(9H-флуорен-9-ил)метоксикарбонил]-O-(бензил)-D-серин (0,710 г, 1,70 ммоль) в дихлорметане (8 мл) обрабатывали трет-бутилацетатом (3 мл) и концентрированной серной кислотой (40 мкл) в герметичной колбе при 0°C. После завершения (ТСХ) реакцию гасили дихлорметаном (10 мл) и насыщенным водным бикарбонатом калия (15 мл). Органическую фазу промывали дистиллированной водой и выпаривали. Полученный остаток очищали путем колоночной флэш-хроматографии (дихлорметан/метанол 98:2) с получением соединения, указанного в названии, в виде бесцветного масла (0,292 г, 77%); 1H ЯМР (CDCl3) δ 1,44 (s, 9H); 3,68 (dd, J=2,9 Гц, J=9,3 Гц, 1H); 3,87 (dd, J=2,9 Гц, J=9,3 Гц, 1H); 4,22 (t, J=7,l Гц, 1H); 4,30-4,60 (m, 5H); 5,64-5,67 (m, 1H); 7,25-7,39 (m, 9H); 7,58-7,61 (m, 2H); 7,73-7,76 (m, 2H).
Пример 5B. O-(бензил)-D-серина трет-бутиловый эфир. Соединение из Примера 5A (0,620 г, 1,31 ммоль) в дихлорметане (5 мл) обрабатывали трис(2-аминоэтил)амином (2,75 мл) в течение 5 часов. Полученную смесь два раза промывали фосфатным буфером (pH=5,5), один раз насыщенным водным бикарбонатом калия и выпаривали с получением 0,329 г (количественный выход) соединения, указанного в названии, в виде грязно-белого твердого вещества; 1H ЯМР (CD3OD) δ 1,44 (s, 9H); 3,48 (dd, J=J’=4,2 Гц, 1H); 3,61 (dd, J=4,0 Гц, J=9,2 Гц, 1H); 3,72 (dd, J=4,6 Гц, J=9,2 Гц, 1H); 4,47 (d, J=12,0 Гц, 1H); 4,55 (d, J=12,0 Гц, 1H); 7,26-7,33 (m, 5H).
Пример 6. Общая методика получения амида из карбоновой кислоты. N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламид. Раствор 1 г (2,93 ммоль) N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрата (Novabiochem) в 3-4 мл дихлорметана обрабатывали путем последовательного добавления 0,46 мл (3,21 ммоль) 3-(трифторметил)бензиламина, 0,44 г (3,23 ммоль) 1-гидрокси-7-бензотриазола и 0,62 г (3,23 ммоль) 1-[3-(диметиламино)пропил]-3-этилкарбодиимида гидрохлорида. По истечении по меньшей мере 12 часов при температуре окружающей среды или до завершения, определяемого путем тонкослойной хроматографии (элюент дихлорметан/метанол 95:5), реакционную смесь последовательно промывали насыщенным водным раствором бикарбоната натрия и дистиллированной водой. Органическую фазу выпаривали с получением 1,41 г (количественный выход) соединения, указанного в названии, в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,39 (s, 9H); 2,61 (dd, J=6,5 Гц, J=17,2 Гц, 1H); 2,98 (dd, J=4,2 Гц, J=17,2 Гц, 1H); 4,41 (dd, J=5,9 Гц, J=15,3 Гц, 1H); 4,50-4,57 (m, 2H); 5,10 (s, 2H); 5,96-6,01 (m, 1H); 6,91-7,00 (m, 1H); 7,30-7,36 (m, 5H); 7,39-7,43 (m, 2H); 7,48-7,52 (m, 2H).
Соединения из Примеров 7-7H получали в соответствии с методикой из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соответствующее производное аминокислоты, а 3-(трифторметил)бензиламин заменяли на соответствующий амин.
Пример 7. N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира (1,14 г, 3,37 ммоль) и 0,53 мл (3,70 ммоль, Novabiochem) 3-(трифторметил)бензиламина получали 1,67 г (количественный выход) соединения из Примера 7 в виде грязно-белого твердого вещества. Соединение из Примера 7 демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 7A. N-Бензилоксикарбонил-L-глутаминовой кислоты α-трет-бутилового эфира γ-(4-циклогексил)пиперазинамид. Из N-Бензилоксикарбонил-L-глутаминовой кислоты α-трет-бутилового эфира (1,36 г, 4,03 ммоль) и 0,746 г (4,43 ммоль) 1-циклогексилпиперазина получали 1,93 г (98%) соединения из Примера 7A в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,02-1,12 (m, 5H); 1,43 (s, 9H), 1,60-1,64 (m, 1H); 1,80-1,93 (m, 5H); 2,18-2,52 (m, 8H); 3,38-3,60 (m, 4H); 4,20-4,24 (m, 1H); 5,03-5,13 (m, 2H); 5,53-5,57 (m, 1H); 7,28-7,34 (m, 5H).
Пример 7B. N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-(2-фтор-3-трифторметил)бензиламид. Из N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрата (Novabiochem) (0,25 г, 0,73 ммоль) и 0,12 мл (2-фтор-3-трифторметил)бензиламина получали 0,365 г (количественный выход) соединения из Примера 7 B в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,38 (s, 9H); 2,59 (dd, J=6,5 Гц, J=17,0 Гц, 1H); 2,95 (dd, J=4,3 Гц, J=17,0 Гц, 1H); 4,46-4,56 (m, 3H); 5,11 (s, 2H); 5,94-5,96 (m, 1H); 7,15 (t, J=8,0 Гц, 1H); 7,30-7,36 (m, 5H); 7,47-7,52 (m, 2H).
Пример 7C. N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[(S)-α-метилбензил]амид. Из N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрата (Novabiochem) (0,25 г, 0,73 ммоль) и 0,094 мл (S)-α-метилбензиламина получали 0,281 г (90%) соединения из Примера 7C в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,41 (s, 9H); 1,44 (d, J=7,0 Гц, 3H); 2,61 (dd, J=7,0 Гц, J=17,0 Гц, 1H), 2,93 (dd, J=4,0 Гц, J=17,5 Гц, 1H); 4,50-4,54 (m, 1H); 5,04-5,14 (m, 3H); 5,94-5,96 (m, 1H); 6,76-6,80 (m, 1H); 7,21-7,37 (m, 10H).
Пример 7D. N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[(R)-α-метилбензил]амид. Из N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрата (Novabiochem) (0,25 г, 0,73 ммоль) и 0,094 мл (R)-α-метилбензиламина получали 0,281 г (90%) соединения из Примера 7D в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,38 (s, 9H); 1,43 (d, J=6,9 Гц, 3H); 2,54 (dd, J=7,3 Гц, J=17,2 Гц, 1H); 2,87 (dd, J=4,l Гц, J=17,3 Гц, 1H); 4,46-4,50 (m, 1H); 4,99-5,15 (m, 3H); 5,92-5,96 (m, 1H); 6,78-6,82 (m, 1H); 7,21-7,33 (m, 10H).
Пример 7E. N-Бензилоксикарбонил-D-аспарагиновой кислоты γ-трет-бутилового эфира α-[N-метил-N-(3-трифторметилбензил)]амид. Из N-Бензилоксикарбонил-D-аспарагиновой кислоты γ-трет-бутилового эфира (0,303 г, 0,89 ммоль, Novabiochem) и 0,168 г (0,89 ммоль) N-метил-N-(3-трифторметилбензил)амина получали 0,287 г (65%) соединения из Примера 7E в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,40 (s, 9H); 2,55 (dd, J=5,8 Гц, J=15,8 Гц, 1H); 2,81 (dd, J=7,8 Гц, J=15,8 Гц, 1H); 3,10 (s, 3H); 4,25 (d, J=15,0 Гц, 1H); 4,80 (d, J=15,5 Гц, 1H); 5,01-5,13 (m, 3H); 5,52-5,55 (m, 1H); 7,25-7,52 (m, 10H).
Пример 7F. N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[(S)-1-(3-трифторметилфенил)этил]амид. Из N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрата (Novabiochem) (84 мг, 0,25 ммоль) и 47 мг (S)-1-(3-трифторметилфенил)этиламина получали 122 г (количественный выход) соединения из Примера 7F в виде грязно-белого твердого вещества. Соединение из Примера 7F демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 7G. N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[(R)-1-(3-трифторметилфенил)этил]амид. Из N-Бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрата (Novabiochem) (150 мг, 0,44 ммоль) и 83 мг (R)-1-(3-трифторметилфенил)этиламина получали 217 г (количественный выход) соединения из Примера 7G в виде грязно-белого твердого вещества. Соединение из Примера 7G демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 7H. N-Бензилоксикарбонил-D-глутаминовой кислоты α-метилового эфира γ-(3-трифторметил)бензиламид. Из N-Бензилоксикарбонил-D-глутаминовой кислоты α-метилового эфира (508 мг, 1,72 ммоль) и 317 мг (1,81 ммоль) 3-(трифторметил)бензиламина получали 662 мг (85%) соединения из Примера 7H в виде грязно-белого твердого вещества. Соединение из Примера 7Н демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 8. Общая методика гидрирования бензилоксикарбониламина. L-аспарагиновой кислоты β-трет-бутилового эфира α-(3-три фторметил)бензил амид. Суспензию 2,23 г (4,64 ммоль) N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламида и палладия (5 масс.% на активированном угле, 0,642 г) в 30 мл метанола выдерживали в атмосфере водорода до полного превращения, определяемого путем тонкослойной хроматографии (элюент дихлорметан/метанол 95:5). Реакционную смесь фильтровали с удалением палладия на угле и фильтрат выпаривали с получением 1,52 г (96%) соединения, указанного в названии, в виде масла; 1H ЯМР (CDCl3) δ 1,42 (s, 9H); 2,26 (brs, 2H); 2,63-2,71 (m, 1H); 2,82-2,87 (m, 1H); 3,75-3,77 (m, 1H); 4,47-4,50 (m, 2H); 7,41-7,52 (m, 4H); 7,90 (brs, 1H).
Соединения из Примеров 9-13P получали в соответствии с методикой из Примера 8 за исключением того, что N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламид заменяли на соответствующее производное аминокислоты.
Пример 9. L-Аспарагиновой кислоты β-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамид. Из N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамида (5,89 г, 11,9 ммоль) получали 4,24 г (98%) соединения из Примера 9 в виде грязно-белого масла; 1H ЯМР (CDCl3): δ 1,42 (s, 9H); 2,61-2,95 (m, 10H); 3,60-3,90 (m, 4H); 4,35-4,45 (m, 1H); 7,17-7,29 (m, 5H).
Пример 10. D-Аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламида (1,41 г, 2,93 ммоль) получали 0,973 г (96%) соединения из Примера 10 в виде грязно-белого масла; 1H ЯМР (CDCl3): δ 1,42 (s, 9H); 2,21 (brs, 2H); 2,67 (dd, J=7,l Гц, J=16,8 Гц, 1H); 2,84 (dd, J=3,6 Гц, J=16,7 Гц, 1H); 3,73-3,77 (m, 1H); 4,47-4,50 (m, 2H); 7,41-7,52 (m, 4H); 7,83-7,87 (m, 1H).
Пример 11. L-Глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламида (5,41 г, 10,9 ммоль) получали 3,94 г (количественный выход) соединения из Примера 11 в виде грязно-белого масла; 1H ЯМР (CDCl3): δ 1,41 (s, 9H); 1,73-1,89 (m, 3H); 2,05-2,16 (m, 1H); 2,32-2,38 (m, 2H); 3,47 (dd, J=5,0 Гц, J=7,5 Гц, 1H); 4,47-4,49 (m, 2H); 7,36-7,54 (m, 4H); 7,69-7,77 (m, 1H).
Пример 12. L-Глутаминовой кислоты γ-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамид. Из N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамида (5,86 г, 11,50 ммоль) получали 4,28 г (99%) соединения из Примера 12 в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,39 (s, 9H); 2,00-2,08 (m, 1H); 2,38-2,46 (m, 1H); 2,55-2,90 (m, 9H); 3,61-3,82 (m, 4H); 4,48-4,56 (m, 1H); 7,17-7,26 (m, 5H).
Пример 13. D-Глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-D-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламида (1,667 г, 3,37 ммоль) получали 1,15 г (94%) соединения из Примера 13 в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,41 (s, 9H); 1,80-2,20 (m, 4H); 2,31-2,40 (m, 2H); 3,51-3,59 (m, 1H); 4,47-4,49 (m, 2H); 7,39-7,52 (m, 4H); 7,71-7,79 (m, 1H).
Пример 13A. L-Глутаминовой кислоты α-трет-бутилового эфира γ-(4-циклогексил)пиперазинамид. Из N-бензилоксикарбонил-L-глутаминовой кислоты α-трет-бутилового эфира γ-(4-циклогексил)пиперазинамида (1,93 г, 3,96 ммоль) получали 1,30 г (93%) соединения из Примера 13A в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,02-1,25 (m, 5H); 1,41 (s, 9H); 1,45-1,50 (m, 1H); 1,56-1,60 (m, 1H); 1,69-1,80 (m, 6H); 3,30 (dd, J=4,8 Гц, J=8,5 Гц, 1H); 3,44 (t, J=9,9 Гц, 2H); 3,56 (t, J=9,9 Гц, 2H).
Пример 13B. D-Аспарагиновой кислоты β-трет-бутилового эфира α-(2-фтор-3-трифторметил)бензиламид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-(2-фтор-3-трифторметил)бензиламида (0,36 г, 0,72 ммоль) получали 0,256 г (92%) соединения из Примера 13B в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,39 (s, 9H); 2,50 (brs, 2H); 2,74 (dd, J=7,0 Гц, J=16,5 Гц, 1H); 2,86 (dd, J=4,8 Гц, J=16,8 Гц, 1H); 3,89 (brs, 2H); 4,47-4,57 (m, 2H); 7,16 (t, J=7,8 Гц, 1H); 7,48 (t, J=7,3 Гц, 1H); 7,56 (t, J=7,3 Гц, 1H); 7,97-8,02 (m, 1H).
Пример 13C. D-Аспарагиновой кислоты β-трет-бутилового эфира α-[(S)-α-метил]бензиламид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[(S)-α-метилбензил]амида (0,275 г, 0,65 ммоль) получали 0,17 г (90%) соединения из Примера 13C в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,40 (s, 9H); 1,47 (d, J=6,9 Гц, 3H); 1,98 (brs, 2H); 2,49 (dd, J=7,9 Гц, J=17,7 Гц, 1H); 2,83 (dd, J=3,6 Гц, J=16,7 Гц, 1H); 3,69 (brs, 1H); 4,99-5,10 (m, 1H); 7,19-7,33 (m, 5H); 7,65-7,68 (m, 1H).
Пример 13D. D-Аспарагиновой кислоты β-трет-бутилового эфира α-[(R)-α-метилбензил]амид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[(R)-α-метилбензил]амида (0,273 г, 0,64 ммоль) получали 0,187 г (количественный выход) соединения из Примера 13D в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,38 (s, 9H); 1,46 (d, J=6,9 Гц, 3H); 1,79 (brs, 2H); 2,51 (dd, J=7,8 Гц, J=17,5 Гц, 1H); 2,87 (dd, J=3,6 Гц, J=16,9 Гц, 1H); 4,19 (brs, 1H); 4,99-5,11 (m, 1H); 7,18-7,34 (m, 5H); 7,86-7,90 (m, 1H).
Пример 13E. D-Аспарагиновой кислоты β-трет-бутилового эфира α-[N-метил-N-(3-трифторметилбензил)]амид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[N-метил-N-(3-трифторметилбензил)]амида (0,282 г, 0,57 ммоль) получали 0,195 г (95%) соединения из Примера 13E в виде грязно-белого масла. Соединение из Примера 13Е демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 13F. L-Аспарагиновой кислоты β-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамид. Из N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамида (5,89 г, 11,9 ммоль) получали 4,24 г (98%) соединения из Примера 13F в виде грязно-белого масла; 1H ЯМР (CDCl3): δ 1,42 (s, 9H); 2,61-2,95 (m, 10H); 3,60-3,90 (m, 4H); 4,35-4,45 (m, 1H); 7,17-7,29 (m, 5H).
Пример 13G. D-Аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламида (1,41 г, 2,93 ммоль) получали 0,973 г (96%) соединения из Примера 13G в виде грязно-белого масла; 1H ЯМР (CDCl3): δ 1,42 (s, 9H); 2,21 (brs, 2H); 2,67 (dd, J=7,l Гц, J=16,8 Гц, 1H); 2,84 (dd, J=3,6 Гц, J=16,7 Гц, 1H); 3,73-3,77 (m, 1H); 4,47-4,50 (m, 2H); 7,41-7,52 (m, 4H); 7,83-7,87 (m, 1H).
Пример 13H. L-Глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламида (5,41 г, 10,9 ммоль) получали 3,94 г (количественный выход) соединения из Примера 13H в виде грязно-белого масла; 1H ЯМР (CDCl3): δ 1,41 (s, 9H); 1,73-1,89 (m, 3H); 2,05-2,16 (m, 1H); 2,32-2,38 (m, 2H); 3,47 (dd, J=5,0 Гц, J=7,5 Гц, 1H); 4,47-4,49 (m, 2H); 7,36-7,54 (m, 4H); 7,69-7,77 (m, 1H).
Пример 13I. L-Глутаминовой кислоты γ-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамид. Из N-бензилоксикарбонил-L-глутаминовой кислоты γ-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамид (5,86 г, 11,50 ммоль) получали 4,28 г (99%) соединения из Примера 13I в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,39 (s, 9H); 2,00-2,08 (m, 1H); 2,38-2,46 (m, 1H); 2,55-2,90 (m, 9H); 3,61-3,82 (m, 4H); 4,48-4,56 (m, 1H); 7,17-7,26 (m, 5H).
Пример 13J. D-Глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-D-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламида (1,667 г, 3,37 ммоль) получали 1,15 г (94%) соединения из Примера 13J в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,41 (s, 9H); 1,80-2,20 (m, 4H); 2,31-2,40 (m, 2H); 3,51-3,59 (m, 1H); 4,47-4,49 (m, 2H); 7,39-7,52 (m, 4H); 7,71-7,79 (m, 1H).
Пример 13K. L-Глутаминовой кислоты α-трет-бутилового эфира γ-(4-циклогексил)пиперазинамид. Из N-Бензилоксикарбонил-L-глутаминовой кислоты α-трет-бутилового эфира γ-(4-циклогексил)пиперазинамида (1,93 г, 3,96 ммоль) получали 1,30 г (93%) соединения из Примера 13K в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,02-1,25 (m, 5H); 1,41 (s, 9H); 1,45-1,50 (m, 1H); 1,56-1,60 (m, 1H); 1,69-1,80 (m, 6H); 3,30 (dd, J=4,8 Гц, J=8,5 Гц, 1H); 3,44 (t, J=9,9 Гц, 2H); 3,56 (t, J=9,9 Гц, 2H).
Пример 13L. D-Аспарагиновой кислоты β-трет-бутилового эфира α-(2-фтор-3-трифторметил)бензиламид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-(2-фтор-3-трифторметил)бензиламида (0,36 г, 0,72 ммоль) получали 0,256 г (92%) соединения из Примера 13L в виде грязно-белого масла; 1H ЯМР (CDCl3) δ 1,39 (s, 9H); 2,50 (brs, 2H); 2,74 (dd, J=7,0 Гц, J=16,5 Гц, 1H); 2,86 (dd, J=4,8 Гц, J=16,8 Гц, 1H); 3,89 (brs, 2H); 4,47-4,57 (m, 2H); 7,16 (t, J=7,8 Гц, 1H); 7,48 (t, J=7,3 Гц, 1H); 7,56 (t, J=7,3 Гц, 1H); 7,97-8,02 (m, 1H).
Пример 13M. D-Аспарагиновой кислоты β-трет-бутилового эфира α-[(S)-1-(3-трифторметилфенил)этил]амид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[(S)-1-(3-трифторметилфенил)этил]амида (120 г, 0,24 ммоль) получали 91 мг (91%) соединения из Примера 13M в виде грязно-белого масла, и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 13N. D-Аспарагиновой кислоты β-трет-бутилового эфира α-[(R)-l-(3-трифторметилфенил)этил]амид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[(R)-1-(3-трифторметилфенил)этил]амида (217 г, 0,44 ммоль) получали 158 мг (количественный выход) соединения из Примера 13N в виде грязно-белого масла, и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 13O. D-Аспарагиновой кислоты β-трет-бутилового эфира α-[N-метил-N-(3-трифторметилбензил)]амид. Из N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира α-[N-метил-N-(3-трифторметилбензил)]амида (0,282 г, 0,57 ммоль) получали 0,195 г (95%) соединения из Примера 13O в виде грязно-белого масла, и оно демонстрировало спектр 1Н ЯМР, соответствующий установленной структуре.
Пример 13P. D-Глутаминовой кислоты α-метилового эфира γ-(3-трифторметил)бензиламид. Из N-бензилоксикарбонил-D-глутаминовой кислоты α-метилового эфира γ-(3-трифторметил)бензиламида (764 мг, 1,69 ммоль) получали г (516 мг, 96%) соединения из Примера 13P в виде грязно-белого масла, и оно демонстрировало спектр [Н ЯМР, соответствующий установленной структуре.
Пример 14. Общая методика получения 2-азетидинона из имина и ацетилхлорида.
Этап 1: Общая методика получения имина из производного аминокислоты. Раствор 1 эквивалента сложного эфира или амида a-аминокислоты в дихлорметане последовательно обрабатывали 1 эквивалентом соответствующего альдегида и высушивающим агентом, таким как сульфат магния или силикагель, в количестве примерно 2 грамма высушивающего агента на грамм исходного сложного эфира или амида α-аминокислоты. Реакционную смесь перемешивали при температуре окружающей среды до полного расходования всех реагентов, измеряемого путем тонкослойной хроматографии. Реакции, как правило, завершались в течение часа. Затем реакционную смесь фильтровали, остаток на фильтре промывали дихлорметаном и фильтрат концентрировали при пониженном давлении с получением целевого имина, который использовали как на следующем этапе.
Этап 2: Общая методика 2+2 циклоприсоединения имина и ацетилхлорида. Раствор имина в дихлорметане (10 мл дихлорметана/1 грамм имина) охлаждали до 0°C. К данному охлажденному раствору добавляли 1,5 эквивалента соответствующего амина, как правило, триэтиламина с последующим добавлением по каплям раствора 1,1 эквивалента соответствующего ацетилхлорида в дихлорметане, такого как описан, например, в Примере 1 (10 мл дихлорметана/1 г соответствующего ацетилхлорида). Реакционной смеси давали нагреться до температуры окружающей среды в течение 1 часа, а затем реакцию гасили путем добавления насыщенного водного раствора хлорида аммония. Полученную смесь распределяли между водой и дихлорметаном. Фазы разделяли, и органическую фазу последовательно промывали 1н. соляной кислотой, насыщенным водным бикарбонатом натрия и насыщенным водным хлоридом натрия. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток можно использовать напрямую для последующих реакций или очищать путем хроматографии или путем кристаллизации из соответствующей системы растворителей при необходимости. В каждом случае после 2+2 реакции стереохимия β-лактама может быть подтверждена посредством кругового дихроизма/оптической ротационной дисперсии (CD/ORD). В качестве иллюстрации примеры (αR, 3S, 4R) и (αS, 3S, 4R) стереохимических конфигураций β-лактамной основы из предыдущих синтезов можно использовать в качестве стандартов CD/ORD.
Пример 15. Трет-бутил[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил] ацетат. С использованием методики из Примера 14 имин, полученный из 4,53 г (34,5 ммоль) трет-бутилового эфира глицина и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 5,5 г (30%) соединения из Примера 15 в виде бесцветных кристаллов (перекристаллизованные, н-хлорбутан); T.пл. 194-195°C.
Пример 16. Общая методика ацилирования азетидин-2-он-1-илацетата. Раствор (азетидин-2-он-1-ил)ацетата в тетрагидрофуране (0,22 M в азетидиноне) охлаждали до -78°C и смешивали с бис(триметилсилил)амидом лития (2,2 эквивалента). Полученный анион обрабатывали соответствующим ацилгалогенидом (1,1 эквивалент). После полного превращения азетидинона реакцию гасили насыщенным водным хлоридом аммония и распределяли между этилацетатом и водой. Органическую фазу последовательно промывали 1н. соляной кислотой, насыщенным водным бикарбонатом натрия и насыщенным водным хлоридом натрия. Полученную органическую фазу сушили (сульфат магния) и выпаривали. Остаток очищали путем хроматографии на силикагеле с соответствующим элюентом, таким как гексан/этилацетат 3:2.
Пример 17. 2,2,2-Трихлорэтил-2(RS)-(трет-бутоксикарбонил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]ацетат.
С использованием методики из Примера 16 9,0 г (20 ммоль) соединения из Примера 15 ацилировали 4,2 г (20 ммоль) трихлорэтилхлорформиата с получением 7,0 г (56%) соединения из Примера 17; T.пл. 176-178°C.
Пример 18. 2(RS)-(Трет-бутоксикарбонил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Раствор 0,20 г (0,32 ммоль) соединения из Примера 17 и 52 мкл (0,36 ммоль) (3-трифторметилбензил)амина в ТГФ нагревали в колбе с обратным холодильником. После полного превращения (ТСХ) выпаривали растворитель и остаток перекристаллизовывали (хлороформ/гексан) с получением 0,17 г (82%) соединения из Примера 18 в виде белого твердого вещества; T.пл. 182-184°C.
Пример 18A. 2(RS)-(Трет-бутоксикарбонил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(2-фтор-3-трифторметилбензил)амид. Соединение из Примера 18A получали в соответствии с методикой из Примера 18 с использованием 2-фтор-3-(трифторметил)бензиламина вместо (3-трифторметилбензил)амина. Соединение из Примера 18A получали в виде белого твердого вещества (140 мг, 41%) и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Соединение из Примеров 19-25AF получали в соответствии с методикой из Примера 14, при этом на Этапе 1 использовали соответствующее производное аминокислоты и альдегид, а на Этапе 2 использовали соответствующий ацетилхлорид.
Пример 19. 2(S)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Имин, полученный из 1,52 г (4,39 ммоль) L-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 2,94 г оранжево-коричневого масла, из которого после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30) 2,06 г (70%) получали соединения из Примера 19 в виде белого твердого вещества; 1H ЯМР (CDCl3) δ 1,39 (s, 9H); 2,46 (dd, J=ll,l Гц, J=16,3 Гц, 1H); 3,18 (dd, J=3,8 Гц, J=16,4 Гц, 1H); 4,12-4,17 (m, 1H); 4,26 (d, J=5,0 Гц, 1H); 4,45 (dd, J=6,0 Гц, J=14,9 Гц, 1H); 4,54 (dd, J=5,3 Гц, J=9,8 Гц, 1H); 4,58-4,66 (m, 3H); 4,69-4,75 (m, 1H); 4,81 (dd, J=3,8 Гц, J=l 1,1 Гц, 1H); 6,25 (dd, J=9,6 Гц, J=15,8 Гц, 1H); 6,70 (d, J=15,8 Гц, 1H); 7,14-7,17 (m, 2H); 7,28-7,46 (m, 11H); 7,62 (s, 1H); 8,27-8,32 (m, 1H).
Пример 19A. 2(S)-(Трет-бутоксикарбонилметил)-2-[3(R)-(4(R)-фенилоксазолидин-2-он-3-ил)-4(S)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 19A получали в соответствии со способом из Примера 19 за исключением того, что 2-(4(R)-фенилоксазолидин-2-он-3-ил)ацетилхлорид (Пример 1A) использовали вместо 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлорида. Соединение из Примера 19A получали в виде белого твердого вещества (41 мг, 13%); 1H ЯМР (CDCl3) δ 1,37 (s, 9H); 3,11 (dd, J=3,7 Гц, J=17,8 Гц, 1H); 3,20 (dd, J=10,6 Гц, J=17,8 Гц, 1H); 4,02 (dd, J=3,7 Гц, J=10,6 Гц, 1H); 4,10-4,17 (m, 1H); 4,24 (d, J=4,9 Гц, 1H); 4,4652-4,574 (dd, J=5,9 Гц, J=15,l Гц, 1H); 4,58-4,76 (m, 4H); 6,27 (dd, J=9,6 Гц, J=15,8 Гц, 1H); 6,79 (d, J=15,8 Гц, 1H); 7,23-7,53 (m, 13H); 7,63 (s, 1H); 8,51-8,55 (m, 1H).
Пример 20. 2(S)-(Трет-бутоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Имин, полученный из 3,94 г (10,93 ммоль) L-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 5,53 г (75%) соединения из Примера 20 после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,36 (s, 9H); 1,85-1,96 (m, 1H); 2,18-2,49 (m, 3H); 4,14-4,19 (m, 1H); 4,30 (d, J=4,9 Гц, 2H); 4,44 (dd, J=6,l Гц, J=14,9 Гц, 1H); 4,56-4,67 (m, 4H); 4,71-4,75 (m, 1H); 6,26 (dd, J=9,6 Гц, J=15,8 Гц, 1H); 6,71 (d, J=15,8 Гц, 1H); 7,16-7,18 (m, 2H); 7,27-7,49 (m, 11H); 7,60 (s, 1H); 8,08-8,12 (m, 1H).
Пример 21. 2(S)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[4-(2-фенилэтил)]пиперазинамид. Имин, полученный из 4,20 г (11,6 ммоль) L-аспарагиновой кислоты β-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 4,37 г (55%) соединения из Примера 21 после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 50:50); 1H ЯМР (CDCl3) δ 1,34 (s, 9H); 2,26-2,32 (m, 1H); 2,46-2,63 (m, 4H); 2,75-2,89 (m, 4H); 3,24-3,32 (m, 1H); 3,49-3,76 (m, 3H); 4,07-4,13 (m, 1H); 4,30 (d, J=4,6 Гц, 1H); 4,22-4,48 (m, 1H); 4,55-4,61 (m, 1H); 4,69-4,75 (m, 1H); 5,04-5,09 (m, 1H); 6,15 (dd, J=9,3 Гц, J=15,9 Гц, 1H); 6,63 (d, J=15,8 Гц, 1H); 7,18-7,42 (m, 15H).
Пример 22. 2(S)-(Трет-бутоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[4-(2-фенилэтил)]пиперазинамид. Имин, полученный из 2,54 г (6,75 ммоль) L-глутаминовой кислоты γ-трет-бутилового эфира α-[4-(2-фенилэтил)]пиперазинамида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 3,55 г (76%) соединения из Примера 22 после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 50:50); 1H ЯМР (CDCl3) δ 1,32 (s, 9H); 1,96-2,07 (m, 1H); 2,15-2,44 (m, 6H); 2,54-2,62 (m, 2H); 2,69-2,81 (m, 3H); 3,28-3,34 (m, 1H); 3,59-3,68 (m, 1H); 4,08-4,13 (m, 1H); 4,33-4,44 (m, 2H); 4,48-4,60 (m, 2H); 4,67-4,77 (m, 1H); 6,14 (dd, J=8,9 Гц, J=16,0 Гц, 1H); 6,62 (d, J=16,0 Гц, 1H); 7,16-7,42 (m, 15H).
Пример 23. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Имин, полученный из 0,973 г (2,81 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламида и коричного альдегида, смешивали с 2-(4(δ)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 1,53 г (82%) соединения из Примера 23 после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,37 (s, 9H); 3,10 (dd, J=3,7 Гц, J=17,8 Гц, 1H); 3,20 (dd, J-10,7 Гц, J=17,8 Гц, 1H); 4,02 (dd, J=3,6 Гц, J=10,6 Гц, 1H); 4,11-4,17 (m, 1H); 4,24 (d, J=4,9 Гц, 1H); 4,46 (dd, J=5,8 Гц, J=15,l Гц, 1H); 4,58-4,67 (m, 3H); 4,70-4,76 (m, 1H); 6,27 (dd, J=9,5 Гц, J=15,8 Гц, 1H); 6,79 (d, J=15,8 Гц, 1H); 7,25-7,50 (m, 13H); 7,63 (s, 1H); 8,50-8,54 (m, 1H).
Пример 23A. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(R)-(4(R)-фенилоксазолидин-2-он-3-ил)-4(S)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 23A получали в соответствии со способом из Примера 23 за исключением, что 2-(4(R)-фенилоксазолидин-2-он-3-ил)ацетилхлорид (Пример 1A) использовали вместо 2-(4(R)-фенилоксазолидин-2-он-3-ил)ацетилхлорида. Соединение из Примера 23A получали в виде белого твердого вещества (588 мг, 49%); 1H ЯМР (CDCl3) δ 1,39 (s, 9H); 2,47 (dd, J=l 1,2 Гц, J=16,3 Гц, 1H); 3,18 (dd, J=3,8 Гц, J=16,3 Гц, 1H); 4,15 (t, J=8,25, Гц 1H); 4,26 (d, J=5,0 Гц, 1H); 4,45 (dd, J=6,0 Гц, J=15,0 Гц, 1H); 4,52-4,57 (m, 3H); 4,63 (t, J=9 Гц, 1H); 4,70 (t, J=8 Гц, 1H); 4,81 (dd, J=3,8 Гц, J=10,8 Гц, 1H); 6,25 (dd, J=9,8 Гц, J=15,8 Гц, 1H); 6,70 (d, J=15,8 Гц, 1H); 7,15-7,17 (m, 2H); 7,27-7,51 (m, 11H); 7,62 (s, 1H); 8,27-8,32 (m, 1H).
Пример 24. 2(R)-(Трет-бутоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Имин, полученный из 1,15 г (3,20 ммоль) D-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 1,84 г (85%) соединения из Примера 24 после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,37 (s, 9H); 2,23-2,39 (m, 4H); 3,71-3,75 (m, 1H); 4,13-4,18 (m, 1H); 4,31 (d, J=4,9 Гц, 1H); 4,44-4,51 (m, 2H); 4,56-4,68 (m, 2H); 4,71-4,76 (m, 1H); 6,26 (dd, J=9,5 Гц, J=15,8 Гц, 1H); 6,71 (d, J=15,8 Гц, 1H); 7,25-7,52 (m, 13H); 7,63 (s, 1H); 8,25-8,30 (m, 1H).
Пример 25. 2(S)-(Трет-бутоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(4-циклогексил)пиперазинамид. Имин, полученный из 2,58 г (5,94 ммоль) L-глутаминовой кислоты γ-трет-бутилового эфира α-(4-циклогексил)пиперазинамида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 3,27 г (94%) соединения из Примера 25 после очистки путем колоночной флэш-хроматографии (дихлорметан/метанол 95:5); 1H ЯМР (CDCl3) δ 1,32 (s, 9H); 1,10-1,18 (m, 1H); 1,20-1,31 (m, 2H); 1,38-1,45 (m, 2H); 1,61-1,66 (m, 1H); 1,84-1,89 (m, 2H); 1,95-2,01 (m, 1H); 2,04-2,14 (m, 3H); 2,20-2,24 (m, 1H); 2,29-2,35 (m, 1H); 2,85-2,92 (m, 1H); 3,24-3,32 (m, 1H); 3,36-3,45 (m, 2H); 3,80-3,86 (m, 1H); 4,08 (t, J=8,3 Гц, 1H); 4,27 (d, J=5,0 Гц, 1H); 4,31-4,55 (m, 4H); 4,71 (t, J=8,3 Гц, 1H); 4,83-4,90 (m, 1H); 6,18 (dd, J=9,l Гц, J=15,9 Гц, 1H); 6,67 (d, J=15,9 Гц, 1H); 7,25-7,44 (m, 10H); 8,22 (brs, 1H).
Пример 25A. Трет-бутил-2(S)-(2-(4-циклогексилпиперазинилкарбонил)этил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-ои-1-ил]ацетат. Имин, полученный из 1,282 г (3,63 ммоль) L-глутаминовой кислоты α-трет-бутилового эфира γ-(4-циклогексил)пиперазинамида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 1,946 г (80%) соединения из Примера 25A после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 50:50); 1H ЯМР (CDCl3) δ 1,15-1,26 (m, 6H); 1,39 (s, 9H); 1,55-1,64 (m, 2H); 1,77-1,83 (m, 3H); 2,22-2,35 (m, 2H); 2,40-2,50 (m, 6H); 2,75-2,79 (m, 1H); 3,43-3,48 (m, 1H); 3,56-3,60 (m, 2H); 3,75-3,79 (m, 1H); 4,10 (t, J=8,3 Гц, 1H); 4,31-4,35 (m, 2H); 4,58 (t, J=8,8 Гц, 1H); 4,73 (t, J=8,4 Гц, 1H); 6,17 (dd, J=8,6 Гц, J=16,0 Гц, 1H); 6,65 (d, J=16,0 Гц, 1H); 7,27-7,42 (m, 10H).
Пример 25B. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(2-фтор-3-трифторметилбензил)амид. Имин, полученный из 0,256 г (0,70 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира α-(2-фтор-3-трифторметил)бензиламида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 0,287 г (60%) соединения из Примера 25B после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,38 (s, 9H); 3,12 (dd, J=4,0 Гц, J=17,8 Гц, 1H); 3,20 (dd, J=10,4 Гц, J=17,8 Гц, 1H); 4,05 (dd, J=3,9 Гц, J=10,4 Гц, 1H); 4,14 (dd, J=J’=8,2 Гц, 1H); 4,25 (d, J=4,9 Гц, 1H); 4,59-4,67 (m, 4H); 4,74 (t, J=8,3 Гц, 1H); 6,36 (dd, J=9,6 Гц, J=15,8 Гц, 1H); 6,83 (d, J=15,8 Гц, 1H); 7,02-7,07 (m, 1H); 7,28-7,55 (m, 12H); 8,44-8,48 (m, 1H).
Пример 25C. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(S)-α-метилбензил]амид. Имин, полученный из 0,167 г (0,57 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира [(S)-α-метилбензил]амида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 0,219 г (63%) соединения из Примера 25C после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,35 (s, 9H); 1,56 (d, J=7,0 Гц, 3H); 2,97 (dd, J=3,5 Гц, J=18,0 Гц, 1H); 3,15 (dd, J=11,0 Гц, J=17,5 Гц, 1H); 4,01 (dd, J=3,0 Гц, J=l 1,0 Гц, 1H); 4,14 (t, J=8,5 Гц, 1H); 4,24 (d, J=5,0 Гц, 1H); 4,57 (dd, J=5,0 Гц, J=9,5 Гц, 1H); 4,64 (t, J=8,8 Гц, 1H); 5,07 (t, J=8,5 Гц, 1H); 5,03-5,09 (m, 1H); 6,43 (dd, J=9,5 Гц, J=16,0 Гц, 1H); 6,83 (d, J=16,0 Гц, 1H); 7,16-7,20 (m, 1H); 7,27-7,49 (m, 14H); 8,07-8,10 (m, 1H).
Пример 25D. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(R)-α-метилбензил]амид. Имин, полученный из 0,187 г (0,46 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира [(R)-α-метилбензил]амида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 0,25 г (64%) соединения из Примера 25D после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,36 (s, 9H); 1,59 (d, J=7,l Гц, 3H); 3,10 (dd, J=3,5 Гц, J=17,8 Гц, 1H); 3,22 (dd, J=10,9 Гц, J=17,8 Гц, 1H); 3,93 (dd, J=3,5 Гц, J=10,8 Гц, 1H); 4,14 (t, J=8,l Гц, 1H); 4,24 (d, J=5,0 Гц, 1H); 4,58 (dd, J=5,0 Гц, J=9,5 Гц, 1H); 4,65 (t, J=8,7 Гц, 1H); 4,74 (t, J=8,2 Гц, 1H); 5,06-5,14 (m, 1H); 6,32 (dd, J=9,5 Гц, J=15,8 Гц, 1H); 6,74 (d, J=15,8 Гц, 1H); 7,19-7,43 (m, 15H); 8,15-8,18 (m, 1H).
Пример 25E. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-метил-N-(3-трифторметилбензил)амид. Имин, полученный из 0,195 г (0,41 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира α-[N-метил-N-(3-трифторметил бензил)] амида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 0,253 г (69%) соединения из Примера 25E после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,36 (s, 9H); 2,53 (dd, J=4,0 Гц, J=17,0 Гц, 1H); 3,06 (dd, J=10,8 Гц, J=16,8 Гц, 1H); 3,13 (s, 3H); 4,12 (dd, J=8,0 Гц, J=9,0 Гц, 1H); 4,26 (d, J=5,0 Гц, 1H); 4,38 (d, J=15,0 Гц, 1H); 4,46 (dd, J=5,0 Гц, J=9,5 Гц, 1H); 4,56 (t, J=6,8 Гц, 1H); 4,70-4,79 (m, 2H); 5,27 (dd, J=4,0 Гц, J=11,0 Гц, 1H); 6,22 (dd, J=9,3 Гц, J=15,8 Гц, 1H); 6,73 (d, J=15,8 Гц, 1H); 7,33-7,45 (m, 14H).
Пример 25F. 2(S)-(Трет-бутоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3 -ил)-4(R)-(2-хлорстир-2-ил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Имин, полученный из 1,62 г (4,44 ммоль) L-глутаминовой кислоты γ-трет-бутилового эфира α-(3-трифторметил)бензиламида и α-хлоркоричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 0,708 г (22%) соединения из Примера 25F после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,35 (s, 9H); 1,68 (brs, 1H); 2,19-2,35 (m, 2H); 2,40-2,61 (m, 2H); 4,13 (dd, J=7,5 Гц, J=9,0 Гц, 1H); 4,22 (t, J=7,0 Гц, 1H); 4,34 (d, J=4,5 Гц, 1H); 4,45 (dd, J=5,5 Гц, J=15,0 Гц, 1H); 4,51-4,60 (m, 3H); 4,89 (dd, J=7,5 Гц, J=8,5 Гц, 1H); 6,89 (s, 1H); 7,28-7,54 (m, 14H).
Пример 25G. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2’-метоксистир-2-ил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Имин, полученный из 0,34 г (0,98 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметилбензил)амида и 2’-метоксикоричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 0,402 г (59%) соединения из Примера 25G после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,35 (s, 9H); 1,68 (brs, 1H); 2,19-2,35 (m, 2H); 2,40-2,61 (m, 2H); 4,13 (dd, J=7,5 Гц, J=9,0 Гц, 1H); 4,22 (t, J=7,0 Гц, 1H); 4,34 (d, J=4,5 Гц, 1H); 4,45 (dd, J=5,5 Гц, J=15,0 Гц, 1H); 4,51-4,60 (m, 3H); 4,89 (dd, J=7,5 Гц, J-8,5 Гц, 1H); 6,89 (s, 1H); 7,28-7,54 (m, 14H).
Пример 25H. Трет-бутил-(2R)-(бензилоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]ацетат. Имин, полученный из 0,329 г (1,31 ммоль) O-(бензил)-D-серина трет-бутилового эфира (Пример 5B) и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 0,543 г (73%) соединения из Примера 25H после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 90:10); 1H ЯМР (CDCl3) δ 1,39 (s, 9H); 3,56 (dd, J=2,7 Гц, J=9,5 Гц, 1H); 3,82 (dd, J=4,8 Гц, J=9,5 Гц, 1H); 4,11 (t, J=8,3 Гц, 1H); 4,21-4,29 (m, 2H); 4,50-4,58 (m, 3H); 4,71-4,78 (m, 2H); 6,19 (dd, J=9,l Гц, J=16,0 Гц, 1H); 6,49 (d, J=16,0 Гц, 1H); 7,07-7,11 (m, 1H); 7,19-7,40 (m, 14H).
Пример 25I. Трет-бутил-2(S)-(2-(4-циклогексилпиперазинилкарбонил)метил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]ацетат. Имин, полученный из 0,3 г (0,88 ммоль) L-аспарагиновой кислоты α-трет-бутилового эфира γ-(4-циклогексил)пиперазинамида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 464 мг (80%) соединения из Примера 25I в виде белого твердого вещества после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 50:50). Соединение из Примера 25I демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 25J. Трет-бутил-3(R)-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-3-метил-4(R)-(стир-2-ил)азетидин-2-он-1-ил]-3-[(3-трифторметил)фенилметиламинокарбонил]пропаноат. Имин, полученный из 0,307 г (0,89 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламида (Пример 20) и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)пропаноилхлоридом (Пример 1E) с получением 120 мг (20%) после очистки путем колоночной флэш-хроматографии (70% гексаны/30% EtOAc); 1H ЯМР (CDCl3) δ 1,25 (s, 3H), 1,38 (s, 9H); 3,09 (dd, J=3,0 Гц, J=18,0 Гц, 1H); 3,33 (dd, J=12,5 Гц, J=18,0 Гц, 1H); 4,01 (dd, J=3,0 Гц, J=ll,5 Гц, 1H); 4,04 (dd, J=3,5 Гц, J=8,8 Гц, 1H); 4,42 (d, J=9,0 Гц, 1H); 4,45-4,51 (m, 3H); 4,61-4,66 (m, 1H); 4,75 (dd, J=3,5 Гц, J=8,5 Гц, 1H); 6,23 (dd, J=9,0 Гц, J=15,5 Гц, 1H); 6,78 (d, J=15,5 Гц, 1H); 7,23-7,53 (m, 13H); 7,64 (s, 1H).
Пример 25K. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(проп-1-енил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Имин, полученный из 0,289 г (0,83 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламида и кротонового альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 381 мг (76%) соединения из Примера 25K после очистки путем колоночной флэш-хроматографии (CH2Cl2/MeOH 99:1); 1H ЯМР (CDCl3) δ 1,36 (s, 9H), 1,69 (dd, J=2 Гц, J=6,5 Гц, 3H); 3,08 (dd, J=3,3 Гц, J=17,8 Гц, 1H); 3,18 (dd, J=11 Гц, J=17,5 Гц, 1H); 3,94 (dd, J=3,5 Гц, J=11 Гц, 1H); 4,12 (d, J=5 Гц, 1H); 4,15 (dd, J=7 Гц, J=8 Гц, 1H); 4,35 (dd, J=4,8 Гц, т=9,8 Гц, 1H); 4,44 (dd, J=6 Гц, J=15 Гц, 1H); 4,61 (dd, J=6 Гц, J=15 Гц, 1H); 4,67-4,75 (m, 2H); 5,52-5,58 (m, 1H); 5,92-6,00 (m, 1H); 7,33-7,60 (m, 9H); 8,47-8,50 (m, 1H).
Пример 25O. Метил-2(S)-(трет-бутоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]ацетат. Имин, полученный из 433 мг (1,99 ммоль) D-глутаминовой кислоты γ-трет-бутилового эфира α-метилового эфира и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 682 мг (64%) соединения из Примера 250 после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) 5 1,32 (s, 9H); 2,10-2,26 (m, 1H); 2,30-2,41 (m, 3H); 3,66 (s, 3H); 3,95-3,99 (m, 1H); 4,16 (dd, J=7,5 Гц, J=9 Гц, 1H); 4,38 (dd, J=5 Гц, J=9 Гц, 1H); 4,55 (d, J=5 Гц 1H); 4,61 (t, J=9 Гц, 1H); 4,86 (dd, J=7,5 Гц, J=9 Гц, 1H); 6,00 (dd, J=9 Гц, J=16 Гц, 1H); 6,60 (d, J=16 Гц, 1H); 7,26-7,43 (m, 10H).
Пример 25M. Трет-бутил-2(S)-(метоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]ацетат. Имин, полученный из 428 мг (1,97 ммоль) L-глутаминовой кислоты γ-трет-бутилового эфира α-метилового эфира и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 864 мг (82%) соединения из Примера 25M после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30); 1H ЯМР (CDCl3) δ 1,40 (s, 9H); 2,12-2,27 (m, 1H); 2,32-2,55 (m, 3H); 3,50 (s, 3H); 3,72 (dd, J=4,6 Гц, J=10,4 Гц, 1H); 4,12-4,17 (m, 1H); 4,34 (dd, J=5 Гц, J=9 Гц, 1H); 4,50 (d, J=5 Гц, 1H); 4,60 (t, J=8,9 Гц, 1H); 4,81-4,86 (m, 1H); 6,06 (dd, J=9 Гц, J=16 Гц, 1H); 6,59 (d, J=16 Гц, 1H); 7,25-7,42 (m, 10H).
Пример 25P. Метил-2(S)-(трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]ацетат. Имин, полученный из 424 мг (2,09 ммоль) L-аспарагиновой кислоты γ-трет-бутилового эфира α-метилового эфира и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 923 мг (85%) соединения из Примера 25P после перекристаллизации из смеси CH2Cl2/гексаны; 1H ЯМР (CDCl3) δ 1,41 (s, 9H); 2,77 (dd, J=7,5 Гц, J=16,5 Гц, 1H); 3,00 (dd, J=7 Гц, J=16,5 Гц, 1H); 4,16 (dd, J=7, 5 Гц, J=9 Гц, 1H); 4,41-48 (m, 2H); 4,55 (d, J=5 Гц, 1H); 4,60 (t, J=8,8 Гц, 1H); 4,86 (dd, J=7,5 Гц, J=9 Гц, 1H); 5,93 (dd, J=9,5 Гц, J=15,5 Гц, 1H); 6,61 (d, J=15,5 Гц, 1H); 7,25-7,43 (m, 10H).
Пример 25L. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(R)-l-(3-трифторметилфенил)этил]амид. Имин, полученный из 160 мг (0,44 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира α-[(R)-l-(3-трифторметилфенил)этил]амида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 166 мг (55%) соединения из Примера 25L после очистки путем колоночной флэш-хроматографии (гексаны/EtOAc 70:30). Соединение из Примера 25L демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 25N. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(S)-1-(3-трифторметилфенил)этил]амид. Имин, полученный из 120 мг (0,22 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира α-[(S)-l-(3-трифторметилфенил)этил] амида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 75 мг (50%) соединения из Примера 25N после очистки путем колоночной флэш-хроматографии (гексаны/EtOAc 70:30). Соединение из Примера 25N демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 25Q. Метил-2(R)-(2-(3-трифторметилбензил)аминокарбонил)этил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]ацетат. Имин, полученный из 517 мг (1,62 ммоль) D-глутаминовой кислоты α-метилового эфира γ-(3-трифторметил)бензиламида и коричного альдегида, смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 527 мг (51%) соединения из Примера 25Q после очистки путем колоночной флэш-хроматографии (гексаны/EtOAc 50:50). Соединение из Примера 25Q демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Следующие соединения получали в соответствии со способами, описанными в настоящем документе:
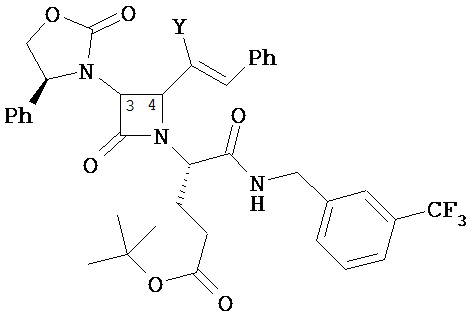
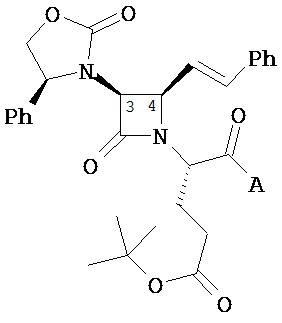
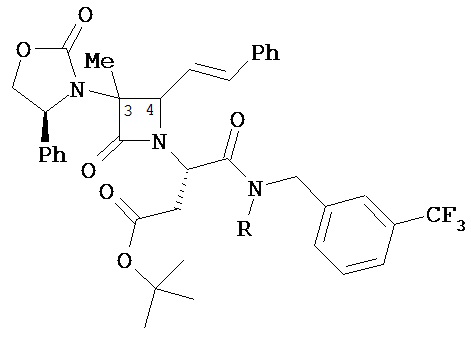
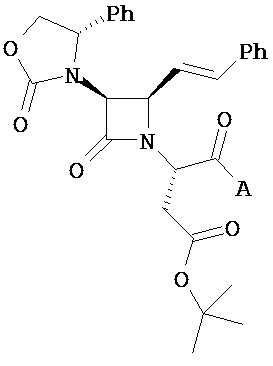
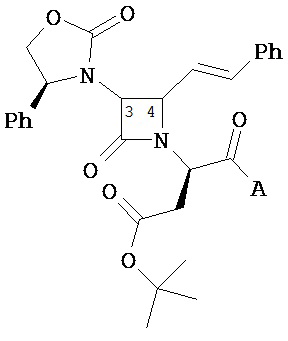
Пример 25AF. Трет-бутил-2(S)-(2-(3-трифторметилбензил)аминокарбонил)этил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]ацетат.
Пример 26. Общая методика гидролиза трет-бутилового эфира. Раствор производного трет-бутилового эфира в муравьиной кислоте, как правило, 1 г в 10 мл, перемешивали при температуре окружающей среды до момента, когда эфир больше не обнаруживается методом тонкослойной хроматографии (дихлорметан 95%/метанол 5%), обычное время реакции составляет около 3 часов. Муравьиную кислоту выпаривали при пониженном давлении; полученный твердый остаток распределяли между дихлорметаном и насыщенным водным бикарбонатом натрия. Органическую фазу выпаривали с получением грязно-белого твердого вещества, которое может быть использовано напрямую для последующих реакций или перекристаллизовано из соответствующей системы растворителей при необходимости.
Соединения из примеров 27-34AE получали из соответствующего трет-бутилового эфира в соответствии с методикой, используемой в Примере 26.
Пример 27. 2(R,S)-(Карбокси)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 18 (0,30 г, 0,46 ммоль) гидролизовали с получением 0,27 г (количественный выход) соединения из Примера 27 в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 4,17-5,28 (m, 9H); 6,21-6,29 (m, 1H), 6,68-6,82 (m, 1H); 7,05-7,75 (m, 13H); 9,12-9,18 (m, 1H).
Пример 28. 2(S)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 19 (1,72 г, 2,59 ммоль) гидролизовали с получением 1,57 г (количественный выход) соединения из Примера 28 в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 2,61 (dd, J=9,3 Гц, J=16,6 Гц, 1H); 3,09-3,14 (m, 1H); 4,10-4,13 (m, 1H); 4,30 (d, J=4,5 Гц, 1H); 4,39-4,85 (m, 6H); 6,20 (dd, J=9,6 Гц, J=15,7 Гц, 1H); 6,69 (d, J=15,8 Гц, 1H); 7,12-7,15 (m, 2H); 7,26-7,50 (m, 11H); 7,61 (s, 1H); 8,41-8,45 (m, 1H).
Пример 28A. 2(S)-(Карбоксиметил)-2-[3(R)-(4(R)-фенилоксазолидин-2-он-3-ил)-4(S)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 19A (41 мг, 0,06 ммоль) гидролизовали с получением 38 мг (количественный выход) соединения из Примера 28A в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 2,26 (d, J=7 Гц, 1H); 4,03 (t, J=7 Гц, 1H); 4,16 (t, J=8 Гц, 1H); 4,26 (d, J=4,3 Гц, 1H); 4,46 (dd, J=5,7 Гц, J=15,1, 1H); 4,53-4,75 (m, 5H); 6,25 (dd, J=9,5 Гц, J=15,7 Гц, 1H); 6,77 (d, J=15,7 Гц, 1H); 7,28-7,53 (m, 13H); 7,64 (s, 1H); 8,65-8,69 (m, 1H).
Пример 29. 2(S)-(Карбоксиэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 20 (4,97 г, 7,34 ммоль) гидролизовали с получением 4,43 г (97%) соединения из Примера 29 в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,92-2,03 (m, 1H); 2,37-2,51 (m, 3H); 4,13-4,19 (m, 1H); 3,32 (d, J=4,9 Гц, 1H); 4,35-4,39 (m, 1H); 4,44 (dd, J=5,9 Гц, J=14,9 Гц, 1H); 4,50-4,57 (m, 2H); 4,61-4,67 (m, 1H); 4,70-4,76 (m, 1H); 6,24 (dd, J=9,6 Гц, J=15,8 Гц, 1H); 6,70 (d, J=15,8 Гц, 1H); 7,18-7,47 (m, 14H).
Пример 30. 2(S)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[4-(2-фенилэтил)]пиперазинамид. Соединение из Примера 21 (1,88 г, 2,78 ммоль) гидролизовали с получением 1,02 г (60%) соединения из Примера 30 в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 2,63 (dd, J=6,0 Гц, J=16,5 Гц, 1H); 2,75-2,85 (m, 1H); 3,00 (dd, J=8,2 Гц, J=16,6 Гц, 1H); 3,13-3,26 (m, 4H); 3,37-3,56 (m, 4H); 3,86-4,00 (m, 1H); 4,05-4,11 (m, 1H); 4,24 (d, J=5,0 Гц, 1H); 4,46-4,66 (m, 1H); 4,65-4,70 (m, 1H); 5,10-5,15 (m, 1H); 6,14 (dd, J=9,3 Гц, J=15,9 Гц, 1H); 6,71 (d, J=15,9 Гц, 1H); 7,22-7,41 (m, 15H); 12,02 (s, 1H).
Пример 31. 2(S)-(Карбоксиэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[4-(2-фенилэтил)]пиперазинамид. Соединение из Примера 22 (0,383 г, 0,55 ммоль) гидролизовали с получением 0,352 г (количественный выход) соединения из Примера 31 в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,93-2,01 (m, 1H); 2,07-2,36 (m, 6H); 2,82-2,90 (m, 1H); 3,00-3,20 (m, 4H); 3,36-3,54 (m, 4H); 3,74-3,82 (m, 1H); 4,06-4,11 (m, 1H); 4,29 (d, J=4,9 Гц, 1H); 4,33-4,46 (m, 2H); 4,50-4,58 (m, 2H); 4,67-4,72 (m, 1H); 4,95-5,00 (m, 1H); 6,18 (dd, J=9,2 Гц, J=16,0 Гц, 1H); 6,67 (d, J=15,9 Гц, 1H); 7,19-7,42 (m, 15H); 8,80 (brs, 1H).
Пример 32. 2(R)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 23 (1,51 г, 2,27 ммоль) гидролизовали с получением 1,38 г (количественный выход) соединения из Примера 32 в виде грязно-белого твердого вещества.
Пример 32A. 2(R)-(Карбоксиметил)-2-[3(R)-(4(R)-фенилоксазолидин-2-он-3-ил)-4(S)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 23A (550 мг, 0,83 ммоль) гидролизовали с получением 479 мг (95%) соединения из Примера 32A в виде грязно-белого твердого вещества. Соединение из Примера 32A демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 33. 2(R)-(Карбоксиэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 24 (0,604 г, 0,89 ммоль) гидролизовали с получением 0,554 г (количественный выход) соединения из Примера 33 в виде грязно-белого твердого вещества.
Пример 34. 2(S)-(Карбоксиэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(4-циклогексил)пиперазинамид. Соединение из Примера 25 (0,537 г, 0,80 ммоль) гидролизовали с получением 0,492 г (количественный выход) соединения из Примера 34 в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,09-1,17 (m, 1H); 1,22-1,33 (m, 2H); 1,40-1,47 (m, 2H); 1,63-1,67 (m, 1H); 1,85-1,90 (m, 2H); 1,95-2,00 (m, 1H); 2,05-2,15 (m, 3H); 2,20-2,24 (m, 1H); 2,30-2,36 (m, 1H); 2,85-2,93 (m, 1H); 3,25-3,33 (m, 1H); 3,36-3,46 (m, 2H); 3,81-3,87 (m, 1H); 4,08 (t, J=8,3 Гц, 1H); 4,28 (d, J=5,0 Гц, 1H); 4,33-4,56 (m, 4H); 4,70 (t, J=8,3 Гц, 1H); 4,83-4,91 (m, 1H); 6,17 (dd, J=9,l Гц, J=15,9 Гц, 1H); 6,67 (d, J=15,9 Гц, 1H); 7,25-7,44 (m, 10H); 8,22 (brs, 1H).
Пример 34A. 2(S)-(2-(4-Циклогексилпиперазинилкарбонил)этил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусная кислота. Соединение из Примера 25A (0,787 г, 1,28 ммоль) гидролизовали с получением 0,665 г (92%) соединения из Примера 34A в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,05-1,13 (m, 1H); 1,20-1,40 (m, 5H); 1,60-1,64 (m, 1H); 1,79-1,83 (m, 2H); 2,00-2,05 (m, 2H); 2,22-2,44 (m, 3H); 2,67-2,71 (m, 1H); 2,93-3,01 (m, 4H); 3,14-3,18 (m, 1H); 3,38-3,42 (m, 1H); 3,48-3,52 (m, 1H); 3,64-3,69 (m, 1H); 4,06-4,14 (m, 2H); 4,34-4,43 (m, 2H); 4,56 (t, J=8,8 Гц, 1H); 4,73 (t, J=8,4 Гц, 1H); 6,15 (dd, J-9,1 Гц, J=16,0 Гц, 1H); 6,65 (d, J=16,0 Гц, 1H); 7,25-7,42 (m, 10H).
Пример 34B. 2(R)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(2-фтор-3-трифторметилбензил)карбоксамид. Соединение из Примера 25B (0,26 г, 0,38 ммоль) гидролизовали с получением 0,238 г (количественный выход) соединения из Примера 34B в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 3,27 (d, J=7,2 Гц, 1H); 4,06 (t, J=7,2 Гц, 1H); 4,15 (t, J=8,l Гц, 1H); 4,27 (d, J=4,8 Гц, 1H); 4,56-4,76 (m, 5H); 6,34 (dd, J=9,5 Гц, J=15,7 Гц, 1H); 6,80 (d, J=15,7 Гц, 1H); 7,06 (t, J=7,7 Гц, 1H); 7,31-7,54 (m, 12H); 8,58 (t, J=5,9 Гц, 1H).
Пример 34C. 2(R)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(S)-α-метилбензил]амид. Соединение из Примера 25C (0,215 г, 0,35 ммоль) гидролизовали с получением 0,195 г (количественный выход) соединения из Примера 34С в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,56 (d, J=7,0 Гц, 1H); 3,10 (dd, J=4,5 Гц, J=17,9 Гц, 1H); 3,18 (dd, J=9,8 Гц, J=17,9 Гц, 1H); 4,00 (dd, J=4,5 Гц, J=9,7 Гц, 1H); 4,14 (t, J=8,2 Гц, 1H); 4,26 (d, J=4,7 Гц, 1H); 5,02-5,09 (m, 1H); 6,41 (dd, J=9,4 Гц, J=15,8 Гц, 1H); 6,78 (d, J=15,8 Гц, 1H); 7,18 (t, J=7,3 Гц, 1H); 7,26-7,43 (m, 12H); 8,29 (d, J=8,2 Гц, 1H).
Пример 34D. 2(R)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты М-[(R)-α-метилбензил]амид. Соединение из Примера 25D (0,22 г, 0,35 ммоль) гидролизовали с получением 0,20 г (количественный выход) соединения из Примера 34D в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,59 (d, J=7,0 Гц, 1H); 3,25 (d, J=7,0 Гц, 2H); 3,92 (t, J=7,3 Гц, 1H); 4,15 (t, J=8,3 Гц, 1H); 4,26 (d, J-5,0 Гц, 1H); 4,52 (dd, J=4,8 Гц, J=9,3 Гц, 1H); 4,65 (t, J=8,8 Гц, 1H); 4,72 (t, J=8,3 Гц, 1H); 5,07-5,28 (m, 1H); 6,29 (dd, J=9,5 Гц, J=15,6 Гц, 1H); 6,71 (d, J=16,0 Гц, 1H); 7,20-7,43 (m, 13H); 8,31 (d, J=8,0 Гц, 1H).
Пример 34E. 2(R)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-метил-N-(3-трифторметилбензил)амид. Соединение из Примера 25E (0,253 г, 0,37 ммоль) гидролизовали с получением 0,232 г (количественный выход) соединения из Примера 34E в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 3,07-3,15 (m, 4H); 4,13 (t, J=8,2 Гц, 1H); 4,30 (d, J=4,9 Гц, 1H); 4,46-4,78 (m, 5H); 5,23 (dd, J=4,6 Гц, J=9,7 Гц, 1H); 6,20 (dd, J=9,4 Гц, J=15,9 Гц, 1H); 6,73 (d, J=15,9 Гц, 1H); 7,25-7,43 (m, 15H).
Пример 34F. 2(S)-(Карбоксиэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-хлорстир-2-ил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 25F (0,707 г, 0,99 ммоль) гидролизовали с получением 0,648 г (99%) соединения из Примера 34F в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 2,22-2,28 (m, 2H); 2,49-2,64 (m, 2H); 4,09 (t, J=8,0 Гц, 1H); 4,25-4,62 (m, 6H); 4,87 (t, J=8,0 Гц, 1H); 6,88 (s, 1H); 7,25-7,66 (m, 15H).
Пример 34G. 2(R)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2’-метоксистир-2-ил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 25G (0,268 г, 0,39 ммоль) гидролизовали с получением 0,242 г (98%) соединения из Примера 34G в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 3,26 (d, J=7,l Гц, 1H); 3,79 (s, 3H); 4,14 (t, J=8,2 Гц, 1H); 4,25 (d, J=4,5 Гц, 1H); 4,51 (dd, J=5,9 Гц, J=15,5 Гц, 1H); 4,53-4,66 (m, 4H); 6,36 (dd, J=9,4 Гц, J=15,8 Гц, 1H); 8,88 (t, J=8,2 Гц, 1H); 6,70 (d, J=15,8 Гц, 1H); 7,18 (d, J=6,5 Гц, 1H); 7,25-7,48 (m, 10H); 7,48 (s, 1H); 8,66-8,69 (m, 1H).
Пример 34H. 2(R)-(Бензилоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусная кислота. Соединение из Примера 25H (0,16 г, 0,28 ммоль) гидролизовали с получением 0,144 г (количественный выход) соединения из Примера 34H в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 3,65 (dd, J=4,0 Гц, J=9,5 Гц, 1H); 3,82 (dd, J=5,5 Гц, J=9,5 Гц, 1H); 4,11 (dd, J=7,8 Гц, J=8,8 Гц, 1H); 4,33 (s, 2H); 4,50 (d, J=5,0 Гц, 1H); 4,57 (t, J=9,0 Гц, 1H); 4,67 (dd, J=4,0 Гц, J=5,0 Гц, 1H); 4,69 (dd, J=5,0 Гц, J=9,5 Гц, 1H); 4,75 (t, J=8,0 Гц, 1H); 6,17 (dd, J=9,3 Гц, J=15,8 Гц, 1H); 6,55 (d, J=16,0 Гц, 1H); 7,09-7,12 (m, 2H); 7,19-7,42 (m, 13H).
Пример 34I. 2(S)-(2-(4-Циклогексилпиперазинилкарбонил)метил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусная кислота. Соединение из Примера 25I (737 мг, 1,12 ммоль) гидролизовали с получением 640 мг (95%) соединения из Примера 341 в виде грязно-белого твердого вещества. Соединение из Примера 341 демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 34J. 3(R)-[3(S)-(4(S)-Фенилоксазолидин-2-он-3-ил)-3-метил-4(R)-(стир-2-ил)азетидин-2-он-1-ил]-3-[(3-трифторметил)фенилметиламинокарбонил]пропановая кислота. С использованием общего способа из Примера 26 гидролизовали 120 мг (0,18 ммоль) соединения из Примера 25J с получением 108 мг (98%) соединения из Примера 34J в виде грязно-белого твердого вещества; 1H ЯМР (CDCl3) δ 1,22 (s, 3H); 3,25 (dd, J=3,5 Гц, J=18,0 Гц, 1H); 3,36 (dd, J=10,8 Гц, J=18,2 Гц, 1H); 4,01 (dd, J=4,0 Гц, J=10,5 Гц, 1H); 4,05 (dd, J=3,8 Гц, J=8,8 Гц, 1H); 4,33 (d, J=9,0 Гц, 1H); 4,44-4,51 (m, 3H); 4,61-4,66 (m, 1H); 4,73 (dd, J=3,8 Гц, J=8,8 Гц, 1H); 6,19 (dd, J=9,0 Гц, J=16,0 Гц, 1H); 6,74 (d, J=16,0 Гц, 1H); 7,22-7,54 (m, 13Н); 7,65 (s, 1H).
Пример 34K. 2(R)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(К)-(пропен-1-ил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. С использованием общего способа из Примера 26 гидролизовали 160 мг (0,27 ммоль) соединения из Примера 25K с получением 131 мг (90%) соединения из Примера 34К в виде грязно-белого твердого вещества. 1H ЯМР (CDCl3) 5 1,69 (dd, J=1 Гц, J=6,5 Гц, 3H); 3,23 (d, J=7 Гц, 1H); 3,93 (t, J=7,3 Гц, 1H); 4,14-4,20 (m, 3H); 4,29 (dd, J=5 Гц, J=9,5 Гц, 1H); 4,43 (dd, J=6 Гц, J=15 Гц, 1H); 4,61 (dd, J=6,5 Гц, J=15 Гц, 1H); 4,66 -4,74 (m, 2H); 5,50-5,55 (m, 1H); 5,90-5,98 (m, 1H); 7,32-7,60 (m, 9Н); 8,60-8,64 (m, 1H).
Пример 34L. 2(R)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(R)-1-(3-трифторметилфенил)этил]амид. Соединение из Примера 25L (166 мг, 0,24 ммоль) гидролизовали с получением 152 мг (количественный выход) соединения из Примера 34L в виде грязно-белого твердого вещества; и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 34M. 2(S)-(Метоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил] уксусная кислота. Соединение из Примера 25M (875 мг, 1,64 ммоль) гидролизовали с получением 757 мг (97%) соединения из Примера 34M в виде грязно-белого твердого вещества и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 34N. 2(R)-(Карбоксиметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(S)-1-(3-трифторметилфенил)этил]амид. Соединение из Примера 25N (38,5 мг, 0,057 ммоль) гидролизовали с получением 35 мг (количественный выход) соединения из Примера 34N в виде грязно-белого твердого вещества; и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 34O. 2(S)-(Трет-бутоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусная кислота. Соединение из Примера 250 (97 мг, 0,18 ммоль) растворяли в смеси метанол/тетрагидрофуран (2,5 мл/2 мл) и подвергали взаимодействию с гидроксидом лития (0,85 мл 0,85 М раствора в воде; 0,72 ммоль) в течение 6 часов при комнатной температуре. Реакционную смесь разбавляли 15 мл дихлорметана и добавляли водный раствор соляной кислоты (1M) до достижения pH водной фазы, равного 5 (измеряемый с помощью стандартной индикаторной бумаги). Затем отделяли органическую фазу и выпаривали досуха с получением 84 мг (89%) соединения из Примера 340 в виде грязно-белого твердого вещества, и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 34P. 2(S)-(Трет-бутоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусная кислота. Соединение из Примера 25P (200 мг, 0,39 ммоль) гидролизовали в соответствии со способом, используемым для Примера 340, с получением 155 мг (88%) соединения из Примера 34Р в виде грязно-белого твердого вещества; и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 34Q. 2(R)-(2-(3-Трифторметилбензил)амино-1-илкарбонил)этил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусная кислота. Соединение из Примера 25Q (150 мг, 0,24 ммоль) гидролизовали в соответствии со способом, используемым для Примера 340, с получением 143 мг (97%) соединения из Примера 34Q в виде грязно-белого твердого вещества и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 34R. 2(R)-(Трет-бутоксикарбонилметил)-2-[3(RS)-2-тиенилметил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Имин, полученный из 290 мг (0,84 ммоль) D-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламида и коричного альдегида, смешивали с 2-тиофенацетилхлоридом с получением 42 мг (8%) соединения из Примера 34R после очистки путем колоночной флэш-хроматографии (гексаны/этилацетат 70:30), и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Следующие соединения получали в соответствии со способами, описанными в настоящем документе:
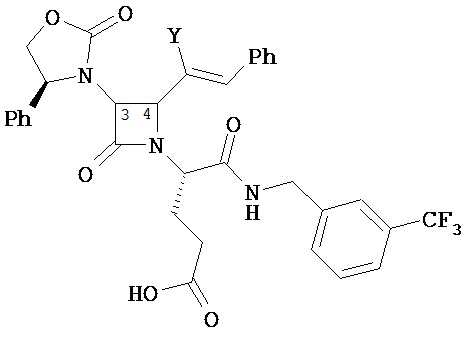
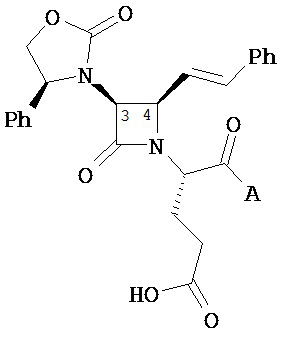
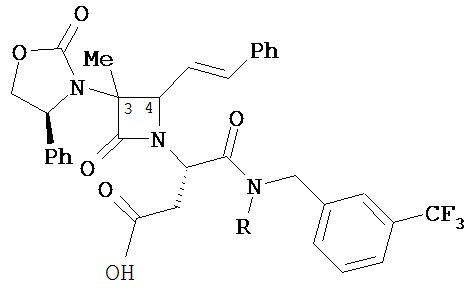
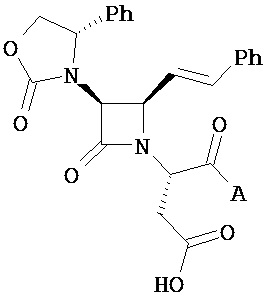
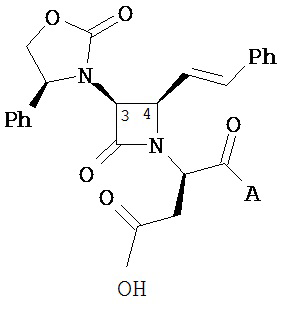
Соединения из Примеров 36-42A, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 27, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
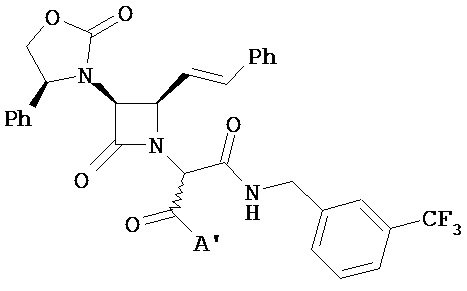
Соединения из Примеров 43-86A, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 28, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
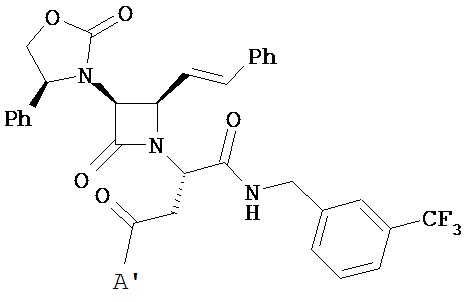
Пример 86B. Соединение из Примера 63 (44 мг, 0,06 ммоль) растворяли в 4 мл дихлорметана и подвергали реакции с 3-хлорпероксибензойной кислотой (12 мг, 0,07 ммоль) до завершения реакции, оцениваемого путем ТСХ (дихлорметан 94%/метанол 6%, УФ-детектирование). Реакцию гасили водным сульфитом натрия, фазу дихлорметана промывали 5% водным бикарбонатом натрия и дистиллированной водой. В результате выпаривания фазы дихлорметана получали соединение из Примера 86B в виде грязно-белого твердого вещества (35 мг, 78%), и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Соединения из Примеров 121-132, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 30, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
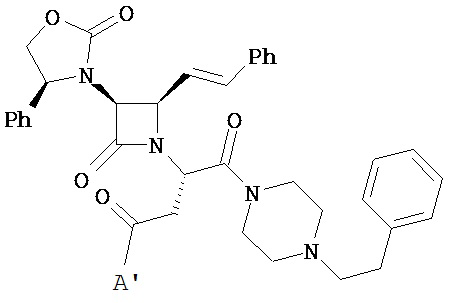
Соединения из Примеров 132A-132B, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34I, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
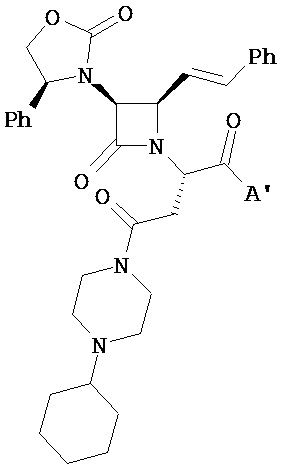
Пример 132C. 2(S)-(Трет-бутоксикарбонилметил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(4-циклогексил)пиперазинамид. Соединение из Примера 132C получали с использованием методики из Примера 6 за исключением того, что M-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34P, а 3-(трифторметил)бензиламин заменяли на 1-циклогексилпиперазин. Соединение из Примера 132C демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Соединения, представленные в следующей таблице, получали в соответствии со способами, описанными в настоящем документе.
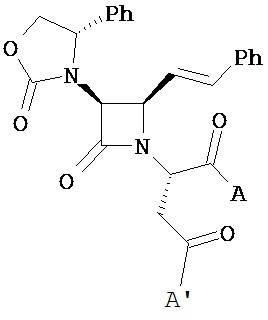
Соединения из Примеров 133-134G, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 32, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
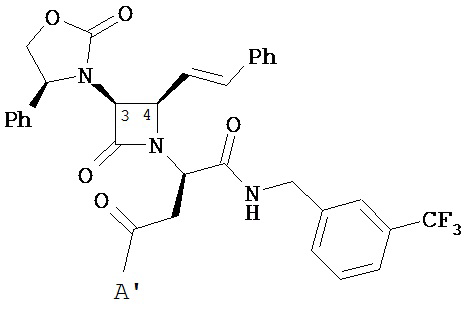
Пример 134H. Соединение из Примера 134H получали с использованием методики из Примера 86B за исключением того, что соединение из Примера 133 заменяли на соединение из Примера 110. Соединение из Примера 134H получали в виде грязно-белого твердого вещества (48 мг, 94%) и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 134I. 2(R)-[[4-(Пиперидинил)пиперидинил]карбоксиметил]-2-[3(S)-(4(R)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 134I получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 32A, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин, и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Соединения, представленные в следующей таблице, получали в соответствии со способами, описанными в настоящем документе.
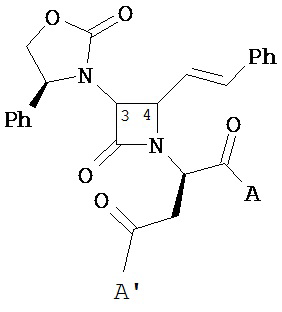
Пример 222. 2(R)-[[4-(Пиперидинил)пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(2-фтор-3-трифторметилбензил)карбоксамид. Соединение из Примера 222 получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34B, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин; соединение из Примера 222 демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 223. 2(R)-[[4-(Пиперидинил)пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(S)-α-метилбензил]амид. Соединение из Примера 223 получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34C, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин; соединение из Примера 223 демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 224. 2(R)-[[4-(Пиперидинил)пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(R)-α-метилбензил]амид. Соединение из Примера 224 получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34D, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин; соединение из Примера 224 демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 225. 2(R)-[[4-(Пиперидинил)пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-метил-N-(3-трифторметилбензил)амид. Соединение из Примера 225 получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34E, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин; соединение из Примера 225 демонстрировало спектр 1H ЯМР, соответствующий установленной структуре; Вычислено для C43H48F3N5O5: C, 66,91; H, 6,27; N, 9,07; обнаружено C, 66,68; H, 6,25; N, 9,01.
Пример 225 Гидрохлоридная соль. Соединение из Примера 225 (212,5 мг) растворяли в 30 мл сухого Et2O. Сухой газ HCl барботировали через данный раствор, что приводило к быстрому образованию грязно-белого осадка. Добавление HCl прекращали, когда больше не наблюдали образование осадка (приблизительно 5 минут). Твердое вещество выделяли путем фильтрации с отсасыванием, дважды промывали 15 мл сухого Et2O и сушили с получением 213,5 мг (выход 96%) грязно-белого твердого вещества; Вычислено для C43H49ClF3N5O5: C, 63,89; H, 6,11; N, 8,66; Cl, 4,39; обнаружено C, 63,41; H, 5,85; N, 8,60; Cl,4,86.
Пример 225A. 2(R)-[[4-[2-(Пиперидинил)этил]пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(S)-α-метилбензил]амид. Соединение из Примера 225A получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34C, а 3-(трифторметил)бензиламин заменяли на 4-[2-(пиперидинил)этил]пиперидин. Соединение из Примера 225A демонстрировало спектр: 1H ЯМР, соответствующий установленной структуре.
Пример 225B. 2(R)-[[4-[2-(Пиперидинил)этил]пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(S)-α-метилбензил]амид. Соединение из Примера 225B получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34D, а 3-(трифторметил)бензиламин заменяли на 4-[2-(пиперидинил)этил]пиперидин. Соединение из Примера 225B демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 225C. 2(R)-[[4-(Пиперидинил)пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(R)-1-(3-трифторметилфенил)этил]амид. Соединение из Примера 225C получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34L, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин. Соединение из Примера 225C демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 225D. 2(R)-[[4-(Пиперидинил)пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[(S)-1-(3-трифторметилфенил)этил]амид. Соединение из Примера 225D получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34N, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин. Соединение из Примера 225D демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Соединения из Примеров 87-120E, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 29, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
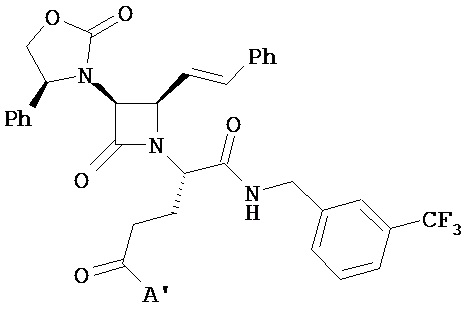
Пример 120F. Соединение из Примера 120F получали с использованием методики из Примера 86B за исключением того, что соединение из Примера 63 заменяли на соединение из Примера 110 с получением грязно-белого твердого вещества (54,5 мг, 98%). Соединение из Примера 120F демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 120G. 2(S)-(Метоксикарбонилэтил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 120G получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34M, и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 35. 2(S)-[4-(2-фенилэтил)пиперазинилкарбонилэтил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение, указанное в названии, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на карбоновую кислоту из Примера 29, а 3-(трифторметил)бензиламин заменяли на 4-(2-фенилэтил)пиперазин; 1H ЯМР (CDCl3) δ 2,21-2,23 (m, 1H); 2,25-2,45 (m, 6H); 2,52-2,63 (m, 3H); 2,72-2,82 (m, 2H); 3,42-3,48 (m, 2H); 3,52-3,58 (m, 1H); 4,13-4,18 (m, 1H); 4,26 (dd, J=5,l Гц, J=8,3 Гц, 1H); 4,29 (d, J=5,0 Гц, 1H); 4,44 (dd, J=6,0 Гц, J=15,0 Гц, 1H); 4,54 (dd, J=6,2 Гц, J=14,9 Гц, 1H); 4,61-4,68 (m, 2H); 4,70-4,75 (m, 1H); 6,27 (dd, J=9,6 Гц, J=15,8 Гц, 1H); 6,73 (d, J=15,8 Гц, 1H); 7,16-7,60 (m, 19H); 8,07-8,12 (m, 1H); FAB+(M+H)+/z 794; Элементный анализ, рассчитанный для C45H46F3N5O5: C, 68,08; H, 5,84; N, 8,82; обнаружено: C, 67,94; H, 5,90; N, 8,64.
Соединения из Примеров 141-171, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
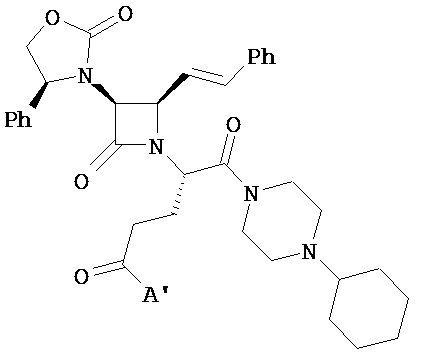
Соединения из Примеров 172-221R, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34A, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
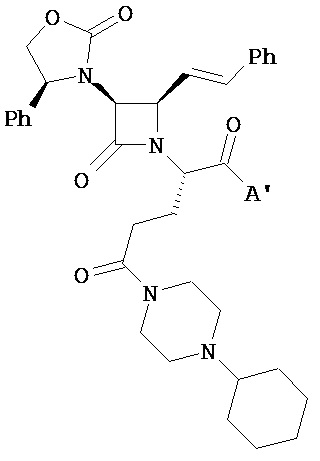
Соединения, представленные в следующей таблице, получали в соответствии со способами, описанными в настоящем документе.
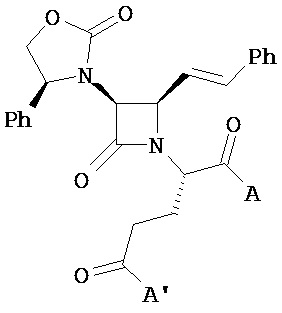
Соединения из Примеров 135-140, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 33, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
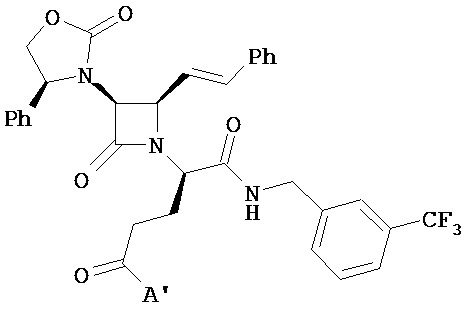
Пример 140A. 2(R)-(2-(3-Трифторметилбензил)амино-1-илкарбонил)этил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(4-циклогексил)пиперазинамид. Соединение из Примера 140A получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34Q, а 3-(трифторметил)бензиламин заменяли на 1-циклогексилпиперазин, и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Соединения из Примеров 226-230C, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34F, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
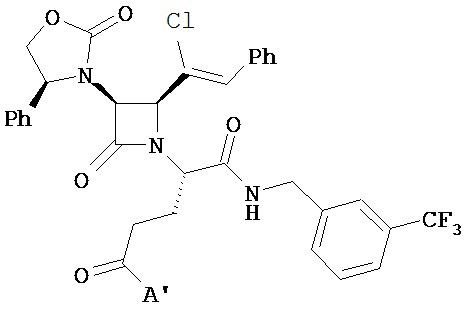
Следующие соединения получали в соответствии со способами, описанными в настоящем документе:
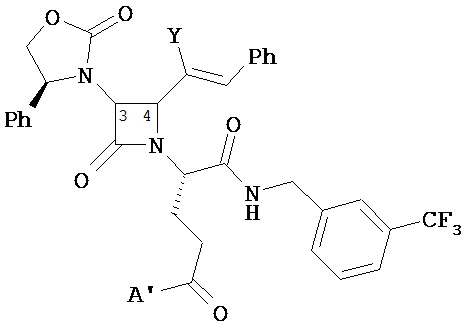
Пример 86C. 2(S)-[[4-(Пиперидинил)пиперидинил]карбонилметил]-2-[3(S)-(4(R)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 86C получали с использованием методики из Примера 6 за исключением того, что N-4-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 28A, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин, и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 231. 2(R)-[[4-(Пиперидинил)пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2’-метоксистир-2-ил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 231 получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34G, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин, и оно демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Соединения из Примеров 232-233A, представленные в следующей таблице, получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34H, а 3-(трифторметил)бензиламин заменяли на соответствующий амин; все соединения из перечисленных Примеров демонстрировали спектр 1H ЯМР, соответствующий установленной структуре.
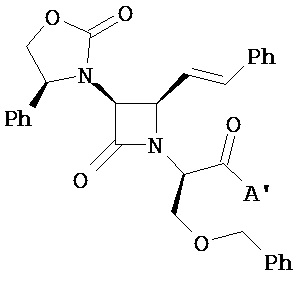
Пример 234. (2RS)-[4-(Пиперидинил)пиперидинилкарбонил]-2-метил-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид.
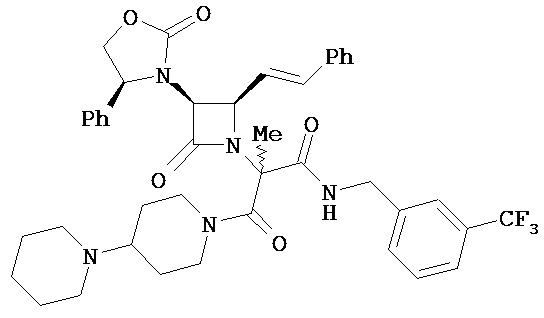
Соединение из Примера 37 (50 мг, 0,067 ммоль) в тетрагидрофуране (4 мл) последовательно обрабатывали гидридом натрия (4 мг, 0,168 ммоль) и метилиодидом (6 мкл, 0,094 ммоль) при -78°C. Полученную смесь медленно нагревали до температуры окружающей среды и выпаривали. Полученный остаток разделяли на дихлорметан и воду, и выпаривали органическую фазу. Полученный остаток очищали путем хроматографии на силикагеле (хлороформ/метанол 95:5) с получением 28 мг (55%) соединения, указанного в названии, в виде грязно-белого твердого вещества; MS(ES+):m/z=757(М+).
Пример 234A. 4-(Пиперидинил)-пиперидинил-3(R)-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-3-метил-4(R)-(стир-2-ил)азетидин-2-он-1-ил]-3-[(3-трифторметил)фенилметиламинокарбонил]пропановая кислота.
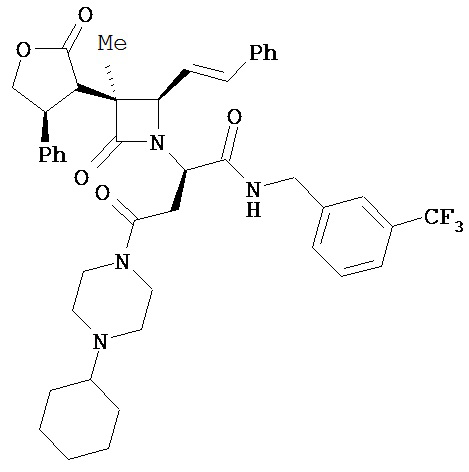
С использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на карбоновую кислоту из Примера 34J, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин, получали соединение, указанное в названии, с количественным выходом; MS(m+H)+772.
Соединения, представленные в следующей таблице, получали в соответствии со способами, описанными в настоящем документе.
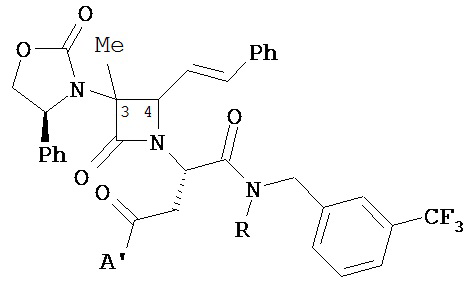
Пример 235. 2(S)-[[(1-Бензилпиперидин-4-ил)амино]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-фенилэт-1-ил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 235 получали с использованием методики из Примера 8 за исключением того, что N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламид заменяли на соединение из Примера 63 (50 мг, 0,064 ммоль) с получением 40 мг (80%) соединения из Примера 235 в виде грязно-белого твердого вещества; соединение из Примера 235 демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 236. (2S)-[(4-Циклогексилпиперазинил)карбонилэтил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-фенилэт-1-ил)азетидин-2-он-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 236 получали с использованием методики из Примера 8 за исключением того, что N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламид заменяли на соединение из Примера 110 (50 мг, 0,065 ммоль) с получением 42 мг (84%) соединения из Примера 236 в виде грязно-белого твердого вещества; соединение из Примера 236 демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 236A. (2S)-[(4-Циклогексилпиперазинил)карбонилэтил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-фенилэт-1-ил)азетидин-2-он-1-ил]уксусной кислоты N-[(R)-1,2,3,4-тетрагидронафт-1-ил]амид. Соединение из Примера 236A получали с использованием методики из Примера 8 за исключением того, что N-бензилоксикарбонил-L-аспарагиновой кислоты β-трет-бутилового эфира α-(3-трифторметил)бензиламид заменяли на соединение из Примера 215 (76 мг, 0,10 ммоль) с получением 69 мг (90%) соединения из Примера 236A в виде грязно-белого твердого вещества. Соединение из Примера 236A демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 237. (2R)-[[4-(Пиперидинил)пиперидинил]карбонилметил]-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-пропен-1-ил)азетидин-2-оы-1-ил]уксусной кислоты N-(3-трифторметилбензил)амид. Соединение из Примера 237 получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соединение из Примера 34K, а 3-(трифторметил)бензиламин заменяли на 4-(пиперидинил)пиперидин. Соединение из Примера 237 демонстрировало спектр 1H ЯМР, соответствующий установленной структуре.
Пример 238. (2S)-(Бензилтиометил)-2-[3(S)-(4(S)-фенилоксазолидин-2-он-3-ил)-4(R)-(2-стирил)азетидин-2-он-1-ил]уксусной кислоты N-[4-[2-(пиперид-1-ил)этил]пиперидин-1-ил]амид. Соединение из данного Примера получали с использованием методики из Примера 6 за исключением того, что N-бензилоксикарбонил-D-аспарагиновой кислоты β-трет-бутилового эфира моногидрат заменяли на соответствующий бензил-защищенный аналог цистеина, а 3-(трифторметил)бензиламин заменяли на 4-[2-(пиперид-1-ил)этил]пиперидин.
Этап 1. N-Трет-бутилоксикарбонил-(S)-(бензил)-D-цистеин-[4-(2-(1-пиперидил)этил)]пиперидинамид. Из N-трет-бутилоксикарбонил-(S)-(бензил)-N-(трет-бутилоксикарбонил)-D-цистеина (0,289 г, 0,93 ммоль) и 4-[2-(1-пиперидил)этил]пиперидина (0,192 г, 0,98 ммоль) в дихлорметане (20 мл) получали 0,454 г (количественный выход) соединения из Примера X в виде грязно-белого твердого вещества. 1H ЯМР (CDCl3) δ 0,89-1,15 (m, 2H); 1,39-1,44 (m, 16H); 1,54-1,61 (m, 4H); 1,62-1,71 (m, 1H); 2,21-2,35 (m, 5H); 2,49-2,58 (m, 2H); 2,66-2,74 (m, 1H); 2,79-2,97 (m, 1H); 3,67-3,76 (m, 3H); 4,48-4,51 (m, 1H); 4,72-4,75 (m, 1H); 5,41-5,44 (m, 1H); 7,19-7,34 (m, 5H).
Этап 2. (S)-(Бензил)-D-цистеин-[4-(2-(1-пиперидил)этил)]пиперидинамид, дигидрохлорид. N-Трет-бутилоксикарбонил-(S)-(бензил)-D-цистеин-[4-(2-(1-пиперидил)этил)]пиперидинамид (0,453 г, 0,93 ммоль) в течение ночи подвергали взаимодействию с ацетилхлоридом (0,78 мл, 13,80 ммоль) в безводном метаноле (15 мл). Соединение, указанное в названии, получали в виде грязно-белого твердого вещества путем выпаривания реакционной смеси досуха (0,417 г, 97%). 1H ЯМР (CD3OD) δ 0,94-1,29 (m, 2H); 1,49-1,57 (m, 1H); 1,62-1,95 (m, 10H); 2,65-2,80 (m, 2H); 2,81-2,97 (m, 4H); 3,01-3,14 (m, 2H); 3,50-3,60 (m, 3H); 3,81-3,92 (m, 2H); 4,41-4,47 (m, 2H); 7,25-7,44 (m, 5H).
Этап 3. С использованием общих методик, описанных в настоящем документе, имин, полученный из (S)-(бензил)-D-цистеин-[4-(2-(1-пиперидил)этил)]пиперидинамида, дигидрохлорида (0,417 г, 0,90 ммоль) и коричного альдегида в присутствии триэтиламина (0,26 мл, 1,87 ммоль), смешивали с 2-(4(S)-фенилоксазолидин-2-он-3-ил)ацетилхлоридом (Пример 1) с получением 0,484 г (76%) соединения из Примера 238 в виде грязно-белого твердого вещества после перекристаллизации из смеси дихлорметан/гексаны.] 1H ЯМР (CDCl3) δ 0,89-1,06 (m, 2H); 1,40-1,44 (m, 5H); 1,57-1,67 (m, 6H); 2,25-2,43 (m, 6H); 2,45-2,59 (m, 2H); 2,71-2,88 (m, 2H); 3,55-3,70 (m, 3H); 4,11-4,17 (m, 1H); 4,37-4,47 (m, 2H); 4,54-4,61 (m, 1H); 4,64-4,69 (m, 1H); 4,76-4,84 (m, 2H); 6,05-6,19 (m, 1H); 6,66-6,71 (m, 1H); 7,12-7,40 (m, 15H).
Описаны следующие соединения
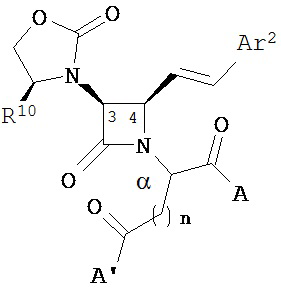
Описаны следующие соединения
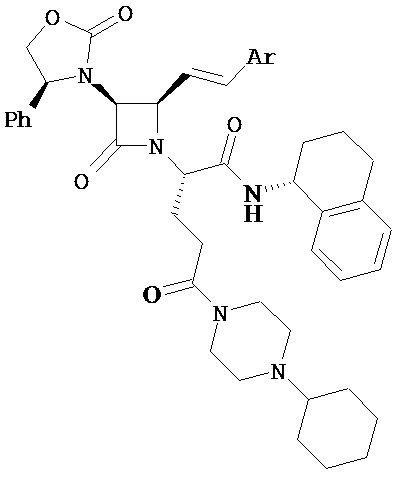
Описаны следующие соединения
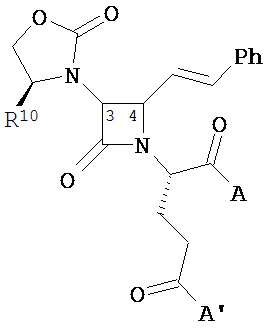
Описаны следующие соединения
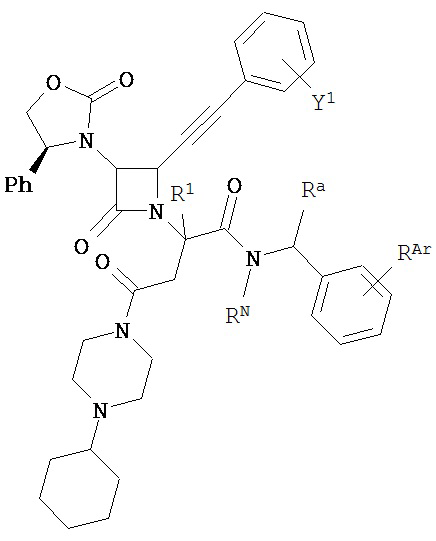
Описаны следующие соединения
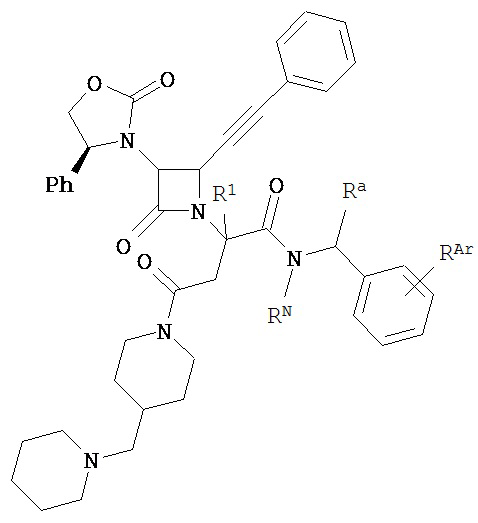
Описаны следующие соединения
В следующей таблице показаны выбранные соединения, дополнительно охарактеризованные путем масс-спектрального анализа с использованием FAB+ для обнаружения соответствующего исходного иона (M+H)+.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ ПОСТТРАВМАТИЧЕСКОГО СТРЕССОВОГО РАССТРОЙСТВА | 2011 |
|
RU2775783C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2742773C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЯ ГОЛОВНОГО МОЗГА | 2018 |
|
RU2797548C2 |
| ПИРРОЛОПИРАЗИНОВЫЕ ИНГИБИТОРЫ КИНАЗЫ | 2012 |
|
RU2673064C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1-[2-(БЕНЗИМИДАЗОЛ-1-ИЛ)ХИНОЛИН-8-ИЛ]ПИПЕРИДИН-4-ИЛАМИНА | 2004 |
|
RU2323214C2 |
| ИЗОКСАЗОЛИНЫ И ИЗОКСАЗОЛЫ, СПОСОБ ПОДАВЛЕНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОДАВЛЯЮЩАЯ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 1994 |
|
RU2149871C1 |
| ПРОИЗВОДНЫЕ 5-АМИНОЦИКЛИЛМЕТИЛОКСАЗОЛИДИН-2-ОНА | 2008 |
|
RU2492169C2 |
| ЗАМЕЩЕННЫЕ 2,6-ДИОКСОПИПЕРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ СНИЖЕНИЯ УРОВНЕЙ TNF-АЛЬФА | 1997 |
|
RU2595250C1 |
| ЗАМЕЩЕННЫЕ 2,6-ДИОКСОПИПЕРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ СНИЖЕНИЯ УРОВНЕЙ TNF-α | 1997 |
|
RU2177944C2 |
| ОКСАЗОЛИДИНИЛОВЫЕ АНТИБИОТИКИ | 2009 |
|
RU2516701C2 |
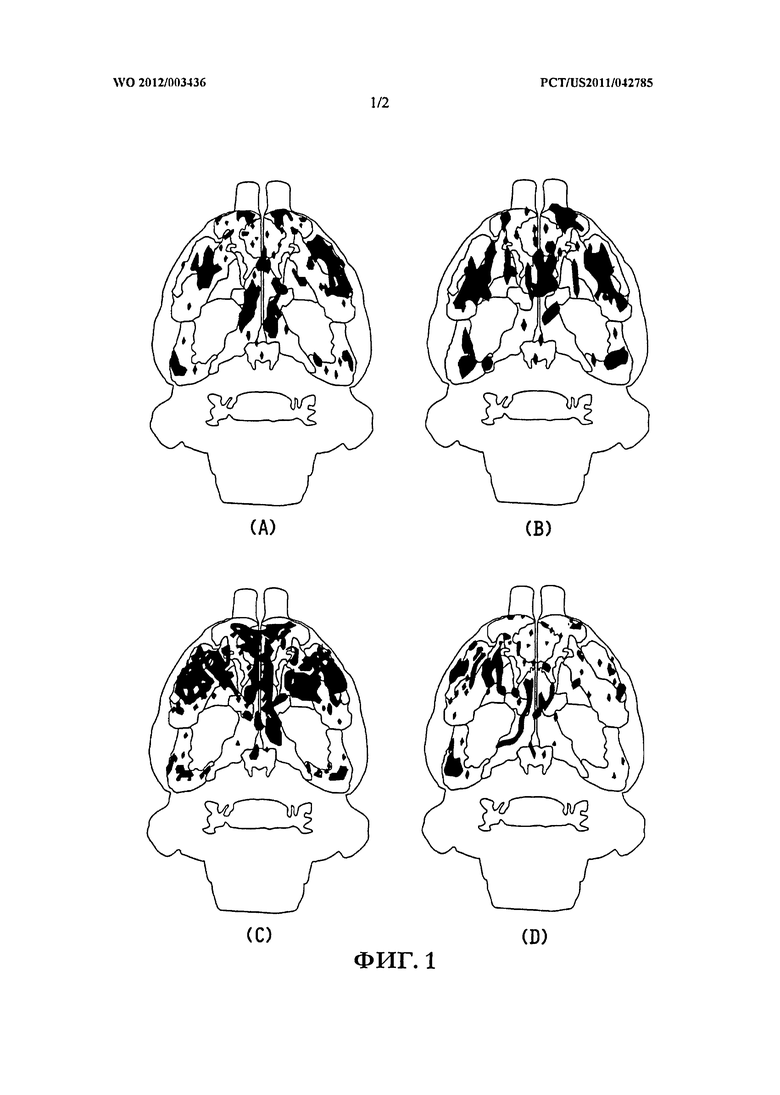
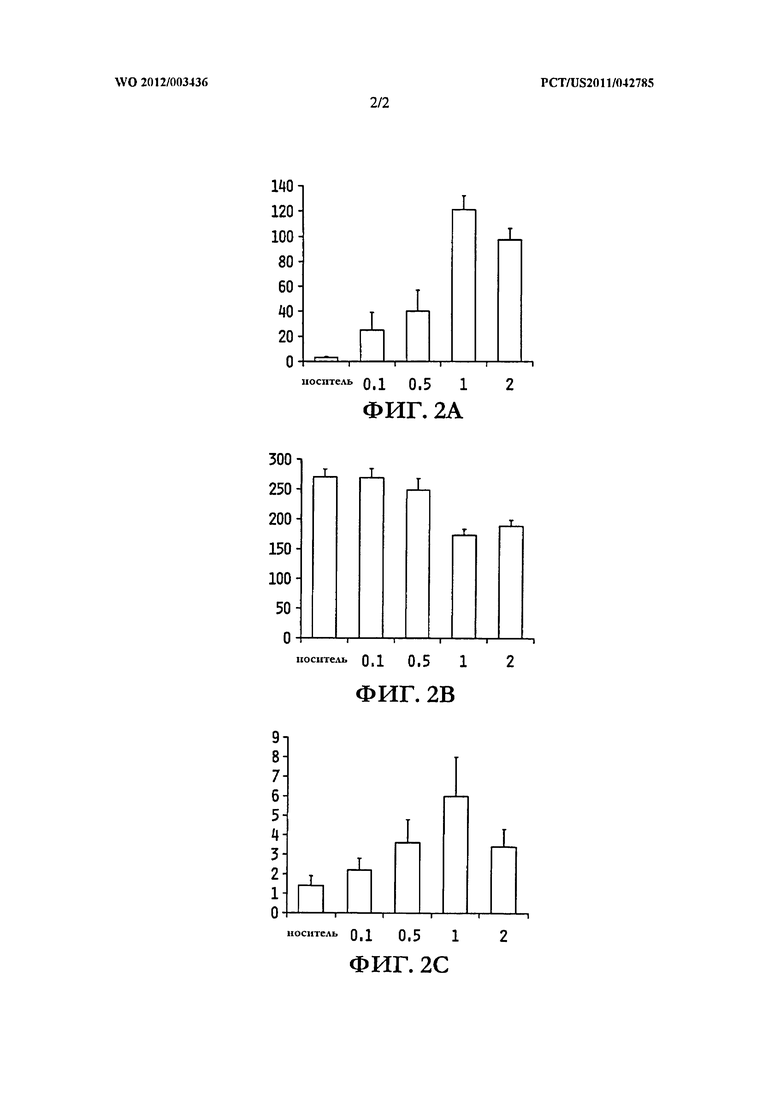
Изобретение относится к медицине, а именно к терапии и неврологии, и касается лечения посттравматического стрессового расстройства. Для этого вводят эффективное количество антагониста вазопрессина формулы  , или
, или 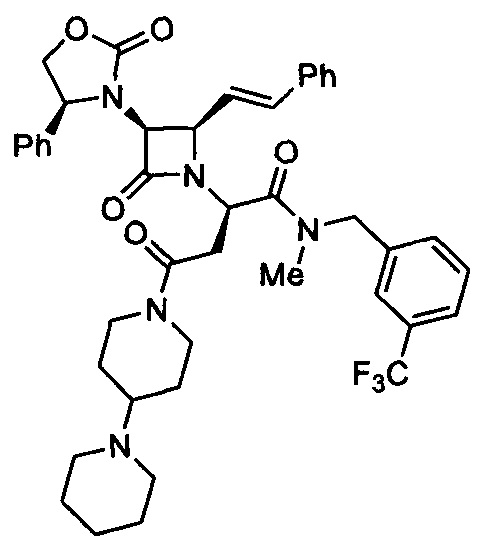 , или
, или 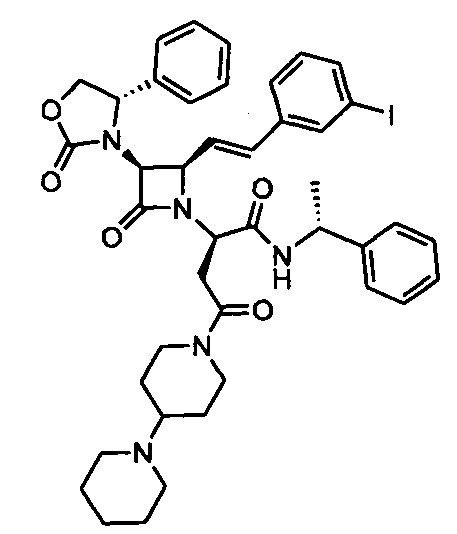
Способ обеспечивает эффективную коррекцию посттравматического стрессового расстройства за счет селективного воздействия этих соединений на рецепторы вазопрессина в головном мозге. 10 з.п. ф-лы, 238 пр., 2 ил.
1. Способ лечения пациента с посттравматическим стрессовым расстройством, включающий этап введения указанному пациенту соединения, выбранного из
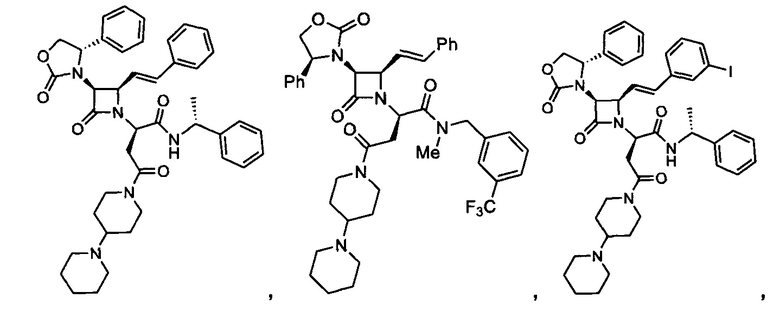
и их фармацевтически приемлемых солей.
2. Способ по п. 1, отличающийся тем, что пациент также имеет одно или более расстройств импульсного контроля или расстройств, связанных с гневом, или их комбинацию.
3. Способ по п. 1, отличающийся тем, что пациент также имеет одно или более из общего тревожного расстройства или родственных тревожных расстройств.
4. Способ по п. 1, отличающийся тем, что пациент также имеет одно или более депрессивных расстройств.
5. Способ по п. 1, отличающийся тем, что пациент также имеет глубокую депрессию.
6. Способ по п. 1, отличающийся тем, что соединение представляет собой соединение формулы
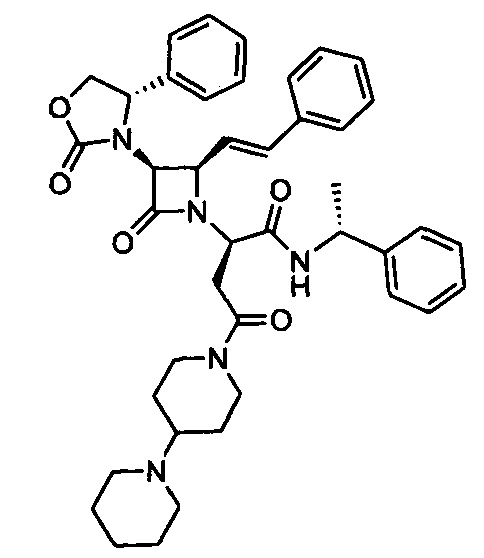
или его фармацевтически приемлемую соль.
7. Способ по п. 6, отличающийся тем, что соединение представляет собой гидрохлоридную соль.
8. Способ по п. 1, отличающийся тем, что соединение представляет собой соединение формулы
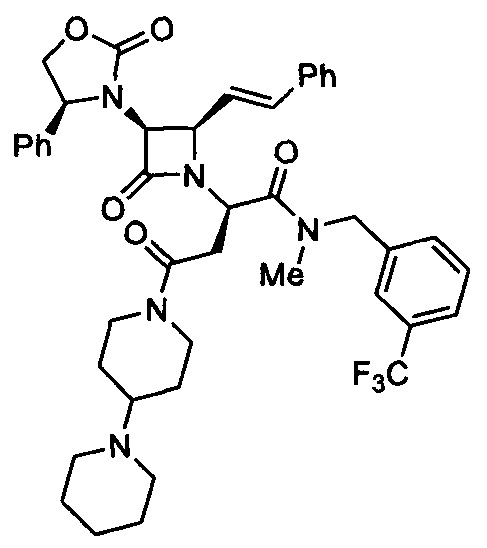
или его фармацевтически приемлемую соль.
9. Способ по п. 8, отличающийся тем, что соединение представляет собой гидрохлоридную соль.
10. Способ по п. 1, отличающийся тем, что соединение представляет собой соединение формулы
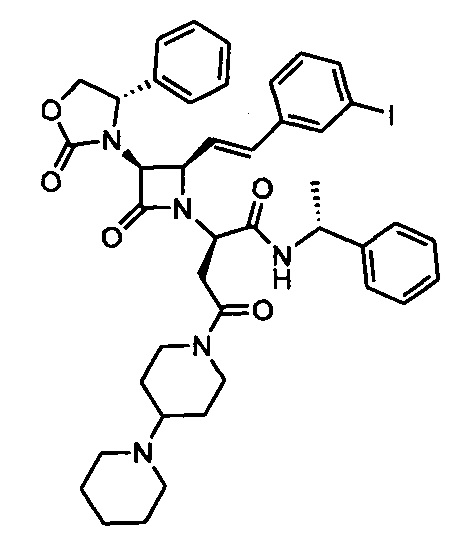
или его фармацевтически приемлемую соль.
11. Способ по п. 10, отличающийся тем, что соединение представляет собой гидрохлоридную соль.
Авторы
Даты
2017-06-22—Публикация
2011-07-01—Подача