Изобретение относится к области вирусологии и биотехнологии и может быть использовано при получении лечебно-профилактических иммунобиологических препаратов против вирусных болезней плотоядных.
Для лечения и профилактики вирусных заболеваний в настоящее время применяют препараты как специфического, так и неспецифического действия. Среди препаратов, обладающих неспецифической противовирусной активностью, широкое распространение получили лекарственные формы на основе α-, β- и γ-интерферонов, представляющие собой композиции интерферона с дополнительными веществами, которые могут иметь разное функциональное назначение и применяться для стабилизации активности при хранении, усиления противовирусных свойств, повышения специфичности против конкретных инфекционных агентов.
Известны способы получения жидких композиций и препаратов, основанных на сочетании интерферона с веществами, стабилизирующими его активность или усиливающими противовирусное действие. Так, предложен способ получения препарата на основе рекомбинантного β-интерферона, который дополнительно содержит в качестве стабилизирующих добавок глицерин и додецилсульфат натрия [1].
Другим примером композиции интерферона с веществами, обладающими дополнительным противовирусным действием, может служить способ получения комплексов интерферона с бактерицидными и антитоксичными веществами, основанный на получении сывороток от животных доноров, которым предварительно, в строго заданные сроки, инъекционно вводят вещество - индуктор интерферона и антиген (или токсин), индуцирующий образование специфических антител [2]. Полученный препарат представляет собой лечебную сыворотку, обладающую кроме неспецифического, обусловленного наличием интерферона, специфическим действием по отношению к тем возбудителям инфекционных заболеваний, включая вирусные, антигены которых использовали на стадии иммунизации.
Основной недостаток данных способов [1, 2] приготовления препаратов обусловлен их жидкой формой, которая не способствует длительному сохранению биологической активности интерферонов, что особенно актуально для интерферонов, полученных по рекомбинантной технологии.
Проблема стабильности при хранении имеет прямое отношение к лекарственным средствам на основе рекомбинантного α-2-интерферона. Для повышения стабильности высокоочищенного от балластных белков субстрата культивирования α-2-интерферона широко используют лиофильное высушивание в присутствии наполнителя, обеспечивающего сохранение биологической активности в течение срока годности, составляющего до 2-х и более лет. В качестве наполнителя используют вещества белковой природы, биополимеры или композиции веществ, разрешенных для применения в иммунобиологических препаратах. Без наполнителя, обеспечивающего на стадии лиофилизации необходимые условия для получения объемной таблетки и служащего в качестве стабилизатора, очищенный интерферон нестабилен и в ходе хранения теряет свою биологическую активность. В настоящее время имеются примеры приготовления сухих лекарственных форм как в виде композиции α-2-интерферона с веществами, усиливающими противовирусное действие препарата, так и с веществами - стабилизаторами.
Известен способ приготовления сухого, лиофилизированного, препарата, включающий внесение полиглюкина в раствор очищенного α-2-интерферона, который служит наполнителем и стабилизатором при последующем высушивании [3] (препарат "Реальдирон", выпускаемый в г. Вильнюсе).
Недостатком данного способа является то, что внесение данного компонента в препарат не приводит к усилению его противовирусного действия.
Для лечения вирусных заболеваний, злокачественных новообразований и сахарного диабета предложена композиция из двух препаратов, первый из которых состоит из порошка, представляющего собой α-интерферон с активностью 2•107 МЕ, высушенный в присутствии наполнителя, включающего (в мг/мл): 2,27 NaHPO4, 0,55 NaH2PO4, 20 глицина и 1 альбумина, а второй представляет собой раствор, содержащий (в мг/мл): 4 (AcO)2Zn, 2,5 протаминсульфата и 0,6 NaOH. Перед применением порошок первого препарата растворяют в растворе второго и полученное средство используют путем инъекций [4].
Данный способ позволяет получить композицию с повышенной противовирусной активностью и высокой стабильностью компонента на основе интерферона, однако при этом обладает рядом недостатков. Так, стабильность достигается за счет раздельного приготовления компонентов. Наполнитель-стабилизатор, состоящий из глицина и альбумина, не обладает дополнительными противовирусными или лечебными свойствами. Неудобной является и подготовка к применению препарата путем объединения компонентов, растворения одного в другом для получения конечной инъекционной формы.
Наиболее близким техническим решением, выбранным в качестве прототипа, является способ получения препарата "Реаферон", Россия [5], представляющего собой лиофильно высушенную композицию высокоочищенного рекомбинантного α-2-интерферона с активностью 106 МЕ с наполнителем, в качестве которого используют человеческий сывороточный альбумин (ЧСА) в концентрации 0,5%. Препарат используют при комплексном лечении инфекционных болезней собак. При лечении аденовироза, чумы плотоядных и вирусного энтерита, а также смешанных инфекциях используют инъекции реаферона в первые два-три дня болезни собаки 1 раз в день в дозе 1 млн. МЕ в комплексе с антибиотиками и витаминами.
Отличие и преимущество прототипа от аналогов состоит в использовании в качестве стабилизатора единственного компонента, сывороточного белка - ЧСА, который обеспечивает повышенную устойчивость интерферона к инактивирующим факторам высушивания и температурным воздействиям при последующем хранении препарата.
Недостаток данного способа получения препарата - высокая стойкость ЧСА, который получают из крови доноров, а также отсутствие дополнительного лечебного или профилактического противовирусного действия, обусловленного за счет его введения в состав препарата в вышеуказанной концентрации.
Задачей предлагаемого изобретения является создание такого способа получения препарата на основе α-2-интерферона, который обеспечивал бы препарату более высокую противовирусную активность и стабильность при хранении.
Поставленная цель достигается тем, что в способе получения лиофилизированного противовирусного препарата на основе рекомбинантного α-2-интерферона, включающем очистку рекомбинантного α-2-интерферона, смешивание его с наполнителем-стабилизатором и высушивание, согласно изобретению в качестве наполнителя-стабилизатора используют иммунную сыворотку или иммуноглобулины, содержащие специфические антитела к одному или нескольким вирусным агентам.
Смешивание α-2-интерферона с иммунной сывороткой (иммуноглобулинами) проводят в соотношении, обеспечивающем количество α-2-интерферона в одной дозе препарата, равное 1•106 - 1•107 МЕ, и конечную концентрацию сыворотки (иммуноглобулинов) по общему белку, равную 0,5-10,0%.
Для лечения и профилактики у животных семейства псовых чумы плотоядных и/или парвовирусного энтерита, и/или инфекционного гепатита смешивание сыворотки или иммуноглобулина с α-2-интерфероном проводят из расчета получения конечной концентрации специфических антител в препарате, выражающейся в титре: не менее 1:100 против вируса чумы плотоядных в реакции нейтрализации; не менее 1:128 против вируса энтерита в реакции торможения гемагглютинации; не менее 1:4 против вируса инфекционного гепатита в реакции диффузной преципитации.
Новыми, отличительными от прототипа, являются следующие признаки способа получения препарата. В качестве дополнительного вещества, обеспечивающего стабилизацию α-2-интерферона и одновременно обладающего противовирусной активностью, используют иммунные сыворотки или иммуноглобулины, содержащие специфические антитела к одному или нескольким вирусным агентам. Конечная концентрация данного сывороточного компонента по общему белку составляет 0,5-10,0% и определяется, исходя из необходимости достижения требуемого количества специфических антител в одной дозе препарата.
Сравнение заявляемого способа получения противовирусного препарата с известными показывает, что отличительные от прототипа признаки проявляют новые, неизвестные ранее свойства, а именно: 1) полученный препарат обладает одновременно специфической и неспецифической противовирусной активностью, причем объединение α-2-интерферона с сывороточным белковым компонентом, содержащим антитела к одному или нескольким вирусам, не сказывается на биологической активности каждого из них; 2) использование в качестве такого компонента иммуноглобулина из сывороток человека и животных или иммунных противовирусных сывороток человека и животных позволяет не вводить в препарат дополнительных веществ для стабилизации α-2-интерферона, так как введение их в препарат до конечных концентраций 0,5-10,0% обеспечивает эффект стабилизации, равный или превышающий таковой для других наполнителей на основе сывороточных альбуминов и полимеров.
Снижение содержания компонента сывороточной природы до концентрации менее 0,5% нецелесообразно, так как ниже этой концентрации, во-первых, сложно достичь уровня специфических антител, обеспечивающего лечебное и профилактическое действие, во-вторых, наблюдается снижение стабилизирующих свойств по отношению к α-2-интерферону при высушивании препарата. Превышение концентрации по белку выше 10% также нецелесообразно, так как это значение соответствует верхнему оптимальному пределу для сывороточных иммунобиологических препаратов, предназначенных для инъекций.
В отличие от аналога [2] комплекс интерферона со специфическими антителами по заявляемому способу получают в результате смешивания отдельных, заранее полученных компонентов: очищенного рекомбинантного α-2-интерферона и иммунной сыворотки (иммуноглобулинов). Способ позволяет получать препарат с заданными показателями по содержанию специфических антител и α-2-интерферона, что практически невозможно достичь, используя технологию иммунизации животных, ввиду имеющихся у них индивидуальных отличий в характере иммунного ответа на введение антигенов и индукторов интерферона.
В связи с изложенным техническое решение соответствует критерию "изобретательский уровень".
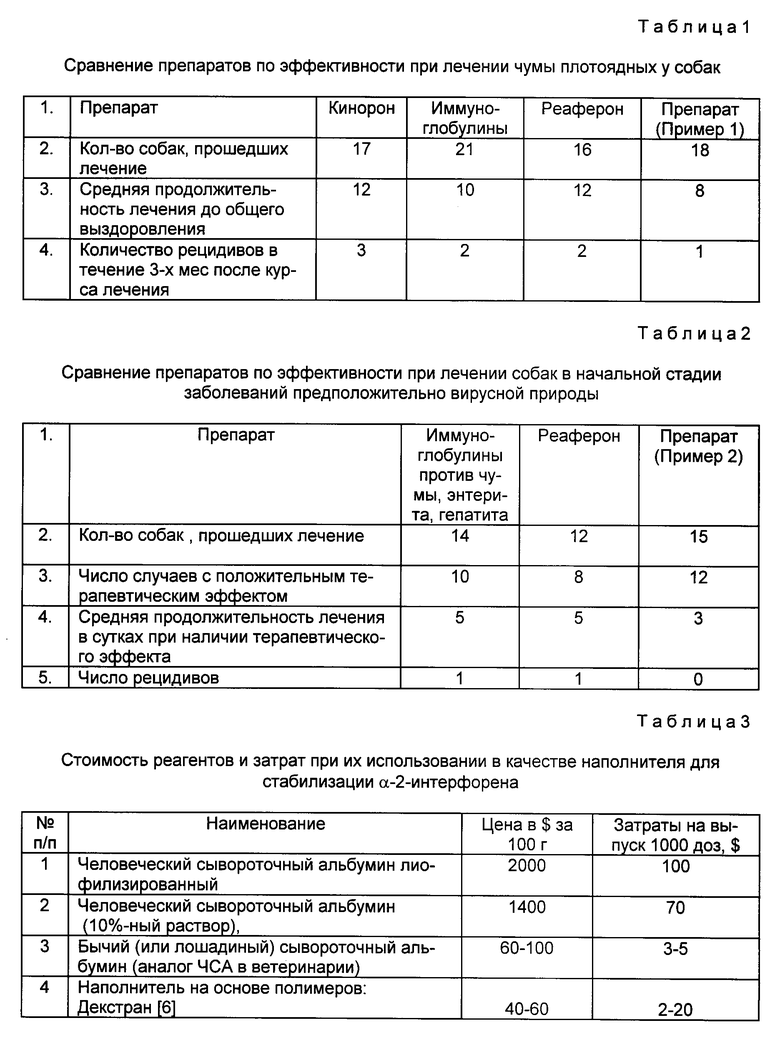
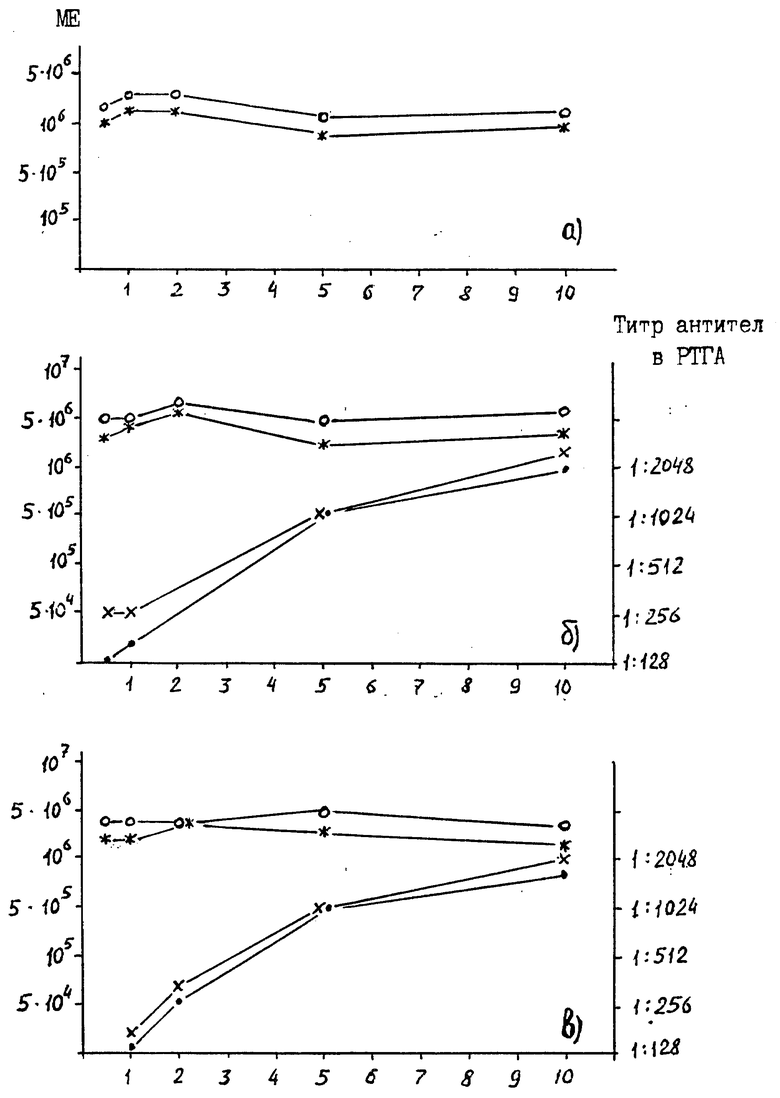
Сущность изобретения поясняется графиками, где на чертеже (а, б, в) приведены результаты теста хранения α-интерферона в течение 1 года при температуре 4±2oC, лиофилизированного в присутствии наполнителей, различающихся по концентрации белка (а - α-2-интерферон, высушенный в присутствии ЧСА; б - то же при использовании в качестве наполнителя иммуноглобулина против парвовирусного энтерита; в - то же, при использовании в качестве наполнителя сыворотки против парвовирусного энтерита).
По оси ординат слева - содержание интерферона в одной дозе препарата в МЕ, справа - титр специфических антител в исходном разведении препарата в реакции торможения гемагглютинации;
по оси ординат - процентное содержание сывороточного компонента по общему белку.
На графиках приведены следующие условные обозначения:
- 0 - - уровень исходного содержания интерферона;
- * - - содержание интерферона через 2 года хранения;
- x - - титр противовирусных антител;
- . - - то же через год хранения.
Способ получения препарата реализуется следующим образом.
Пример 1. Получение препарата для профилактики и лечения чумы плотоядных у животных семейства псовых.
Для приготовления препарата используют полуфабрикат α-2-интерферона рекомбинантного по ВФС 42-227ВС-89, представляющего собой стерильный раствор с pH 7,0-7,6, с концентрацией белка 0,1-0,2 мг/мл и специфической активностью (1-2) • 107 МЕ/мл. Данный полуфабрикат смешивают 1:5-1:9 с сывороткой против чумы плотоядных по ТУ 10-07-03-92 или специфическими иммуноглобулинами против чумы плотоядных по ТУ 10-07-04-92, доводят pH до значений 7,2-7,4. Полученную смесь разливают по 3,0 или 5,0 мл в ампулы (пенфлаконы), замораживают в холодильной камере при температуре не выше -30oC, после чего лиофилизируют. Время высушивания на установке типа TG-50 составляет 48 час при остаточном давлении в камере лиофилизатора 10-50 мкм рт.ст. и температуре подогрева полок не выше 20oC.
Противовирусную активность сывороточного компонента определяют в реакции нейтрализации до смешивания с α-2-интерфероном в соответствии с ТУ 10-07-04-92, она должна составлять не менее 2,3 lg. Противовирусную активность α-2-интерферона определяют на культуре клеток Л-68 вируса везикулярного стоматита (ВВС). ВВС предварительно пассируют на куриных эмбрионах по ТУ 42-14-99-77, проводят не менее 3-х пассажей при заражающей дозе 100-1000 ТЦД50/0,1 мл. Инфекционная активность материала должна составлять 1•106-1•107 ТЦД50/мл. Монослой клеток Л-68 выращивают на матраце вместимостью 1000 мл в присутствии ростовой среды (среда Игла МЕМ с двойным набором ингредиентов - 90% по ФС 42-7ВС-90, сыворотка плодов коровы по ФС 42-7ВС-90 - 10%) с антибиотиками (канамицина 100000 Ед/мл, гентамицина 16 Ед/мл), после чего клетки снимают со стекла, суспендируют в 40 мл ростовой среды и подсчитывают их количество в счетной камере Горяева. После этого клеточную взвесь разводят ростовой средой из расчета, чтобы в 1,0 мл содержалось 200 тыс/мл. В лунки микропланшетов вносят по 0,1 мл клеточной взвеси и через 2-3 суток инкубации при 37oC получают монослойную культуру. Содержание активного α-2-интерферона определяют в готовом, сухом, препарате, для чего его растворяют, используя воду для инъекций, до исходного объема. Затем готовят двукратные разведения (выше и ниже предполагаемого титра) испытуемого препарата и отраслевого стандартного образца (ОСО) активности в среде 199 или Игла с 2% сыворотки плодов коровы и антибиотиками (пенициллин, стрептомицин). На каждое разведение используют не менее 4-х лунок с культурой клеток. Из лунок удаляют среду и вносят по 0,1 мл каждого разведения интерферона, 16 лунок оставляют для контроля инфицирующей дозы и 4 лунки - для контроля клеточной культуры. Инкубацию проводят в течение суток при 37oC в атмосфере с 5,0±0,5% CO2, после чего в каждую лунку, включая контрольные, вносят дозу ВВС, равную 100 ТЦД50 в 0,1 мл. После внесения индикаторного вируса культуру клеток инкубируют в течение 2-3 суток. Учет проводят, если нет признаков дегенерации в контрольной культуре. За титр интерферона принимают величину, обратную разведению препарата, при котором клеточная культура в 50% лунок оказалась полностью защищенной от цитопатического действия вируса. Пересчет активности в МЕ осуществляют во формуле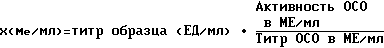
Данный способ приготовления обеспечивает получение препарата, одна доза которого содержит одну лечебную дозу сыворотки или иммуноглобулинов с нейтрализующей активностью не менее 1:100 и интерферон в количестве не менее 1•106 МЕ.
Пример 2. Получение препарата для профилактики и лечения парвовирусного энтерита у животных семейства псовых.
Полуфабрикат α-2-интерферона рекомбинантного по ВФС 42-227ВС-89, представляющего собой стерильный раствор с pH 7,0-7,6, с концентрацией белка 0,1-0,2 мг/мл и специфической активностью (1-2)•107 МЕ/мл, смешивают 1:5-1:9 с сывороткой против парвовирусного энтерита плотоядных по ТУ 10-07-01-92 или специфическими иммуноглобулинами против парвовирусного энтерита плотоядных по ТУ 10-07-02-92, доводят pH до значений 7,2-7,4. Полученную смесь разливают по 3,0 или 5,0 мл в ампулы (пенфлаконы), замораживают в холодильной камере при температуре не выше -30oC, после чего лиофилизируют и определяют содержание α-2-интерферона в сухом препарате аналогично примеру 1. Определение противовирусной активности сывороточного компонента в готовом препарате проводят после его растворения в исходном объеме физраствора (раствора для инъекций) путем постановки реакции торможения гемагглютинации (РТГА) в соответствии с ТУ 10-07-92-02. Титр спефицических антител должен быть не менее 1: 128. Содержание интерферона в одной дозе препарата должно быть не менее 1•106 МЕ.
Пример 3. Получение препарата для профилактики и лечения вирусных болезней плотоядных (чумы плотоядных, парвовирусного энтерита, инфекционного гепатита).
Препарат готовят, смешивая 1:1 - 1:9 полуфабрикат α-2-интерферона рекомбинантного с активностью 106 - 107 МЕ/мл с полуфабрикатом специфических поливалентных иммуноглобулинов для профилактики и лечения чумы, инфекционного гепатита и парвовирусного энтерита по ТУ 10-07-008-92. Концентрация иммуноглобулина в препарате перед высушиванием должна быть не менее 0,5%, pH 7,2-7,4. Иммуноглобулины перед смешиванием с интерфероном можно разводить физраствором с учетом предельной минимальной концентрации по белку (0,5%) и с учетом сохранения необходимого уровня специфической активности в соответствии с ТУ 10-07-008-92. Полученную смесь разливают в ампулы (пенфлаконы) по 2, 3 или 5 мл и лиофилизируют с последующим определением содержания интерферона в одной дозе препарата аналогично примеру 1. Одна доза препарата должна содержать α-2-интеферон в количестве не менее 106 МЕ.
Для определения специфической активности препарата против вируса энтерита используют РТГА, при этом титр специфических антител должен быть не менее 1: 128. Активность антител к возбудителю инфекционного гепатита определяют в реакции диффузной преципитации (РДП), она должна наблюдаться в разведении не менее 1:4. Активность специфических антител к вирусу чумы плотоядных определяют в исходном растворе иммуноглобулинов, до смешивания с интерфероном, в реакции нейтрализации. Она должна составлять не менее 2,3 lg.
Пример 4. Исследование эффективности действия препарата, изготовленного по предлагаемому способу.
Эффективность препаратов, приготовленных согласно примерам 1, 2 и 3, была исследована при лечении вирусных заболеваний у собак. На первом этапе изучали возможность совместного применения для профилактики чумы плотоядных и парвовирусного энтерита препаратов "Кинорон" и "Реаферон" с иммуноглобулинами против чумы плотоядных и парвовирусного энтерита соответственно согласно наставлениям по применению этих лечебных средств. Препараты вводились в профилактических целях здоровым собакам, и при этом было отмечено отсутствие побочных явлений, выходящих за рамки, оговоренные для каждого препарата в отдельности.
Второй этап работы по исследованию свойств препаратов, приготовленных согласно заявляемому способу, заключается в постановке экспериментов по сравнению их эффективности при лечении чумы плотоядных с эффективностью ранее применявшихся средств на фоне общей комплексной терапии (введение антибиотиков, анальгин с димедролом, комплекс витаминов, сердечные средства). Схема применения всех противовирусных препаратов ("Кинорон", "Реаферон"; специфические иммуноглобулины против чумы плотоядных; препарат, приготовленный по заявляемому способу) была единой, соответствовала наставлениям и заключалась в 3-кратном введении лечебной дозы с интервалом 12-24 час в первые 2-3 дня болезни. В таблице 1 приведены результаты сравнения вышеназванных вариантов лечения. На основании этих результатов можно сделать вывод с более высокой эффективности заявляемого препарата, проявляющейся в снижении продолжительности лечения и уменьшения числа рецидивов.
Аналогичная схема применения препарата, приготовленного по заявляемому способу (пример 2), давала хороший результат при лечении энтерита у собак в ранние сроки заболевания. Сравнивали его эффективность по сравнению с иммуноглобулинами. Обработка статистических данных по лечению 36 животных показала, что применение комплексного препарата на основе интерферона и специфических антител давало большее число выздоровлений (на 17%) в течение первых трех дней лечения по сравнению с иммуноглобулинами.
Эффективность препарата, приготовленного по заявляемому способу на основе α-2-интерферона и поливалентных иммуноглобулинов (пример 3), была показана при лечении заболеваний предположительно вирусной природы в их начальной стадии. Лечению подвергали собак в возврате 6-12 мес, клинические признаки заболевания которых выражались в угнетенном состоянии, незначительном повышении температуры, рвоте, энтеритных явлениях. Данные по сравнению эффективности препаратов при лечении собак с неустановленным окончательным диагнозом приведены в таблице 2.
Результаты, приведенные в таблице 2, свидетельствуют о высокой эффективности заявляемого препарата в случае его применения в начальной стадии заболеваний предположительно вирусной природы. При этом не было отмечено рецидивов (появление вновь признаков заболевания в течение месяца после завершения лечения). Отсутствие терапевтического эффекта наблюдали в каждой группе животных (по 3 случая), однако все они были связаны с бактериальной или гельминтной природой заболевания, что требовало изменения схемы лечения с использованием антибиотиков и противопаразитарных средств.
Данный способ приготовления препаратов может быть использован для получения противовирусных средств для профилактики и лечения разных вирусных заболеваний человека и животных при условии, если в каждом отдельном случае будет экспериментально показан терапевтический эффект при совместном введении α-2-интерферона со специфическими противовирусными антителами. В настоящее время нами экспериментально установлено, что сывороточный компонент в пределах указанных концентраций и содержащий специфические АТ, в равной степени обладает протективным действием в отношении интерферона на стадиях высушивания и хранения независимо от специфики и вида вирусных агентов, для которых получали иммунные сыворотки. Так, например, не было отмечено различий по термоустойчивости при применении в качестве стабилизатора иммуноглобулина человека нормально по ФС-42-79ВС-87, иммуноглобулина противогриппозного человека по ФС 42-74ВС-87, иммуноглобулина человека против гепатита B по ФС 42-330ВС-90, иммуноглобулина против клещевого энцефалита по ФС 42-119ВС-93, а также противокоревой, противопаратитной сывороток человека, иммунных сывороток и иммуноглобулинов от различных животных.
Технико-экономические преимущества способа
Экономический эффект при использовании препарата, приготовленного по заявляемому способу, обусловлен сокращением сроков лечения, а также отсутствием дополнительных затрат, связанных с необходимостью внесения в состав препарата наполнителей для стабилизации интерферона. В таблице 3 приведены данные по стоимости реагентов, используемых для стабилизации интерферона в составе выпускаемых в настоящее время препаратов. Цены приведены в долларах по каталогу фирмы "Sigma" (1994 г.).
Таким образом, при использовании препаратов, приготовленных по заявляемому способу и совмещающих α-2-интерферон с противовирусными иммуноглобулинами или сыворотками, экономия, за счет неприменения дополнительных веществ-стабилизаторов α-2-интерферона, может составлять в расчете на 1000 доз не менее 2 $ для ветеринарных средств и до 70 $ (в случае неприменения ЧСА) для медицинских препаратов.
Промышленная применимость. Изобретение может быть использовано в ветеринарии и медицине.
Источники информации
1. Заявка ЕПВ N 270799, A 61 K 45/02, 47/00, опубл. 15.06.88.
2. Заявка РСТ (WO) N 82/03012, A 61 K 45/02, 37/10, опубл., 16.09.82 (аналог).
3. Методические основы применения реаферона - человеческого рекомбинантного интерферона α-2B-белка. // Сборник материалов научной конференции для врачей-практиков, Кольцово, 25-29 января 1993 г., - Кольцово, 1993, - с. 15-19, 22-23 (аналог).
4. Патент США N 4853218, МКИ A 61 K 45/02, опубл. 1.08.88 (аналог).
5. Методические основы применения реаферона - человеческого рекомбинантного интерферона α-2B-белка. // Сборник материалов научной конференции для врачей-практиков, Кольцово, 25-29 января 1993 г., - Кольцово, 1993, - с. 115-117 (прототип).
6. Патент США N 471461, МКИ A 61 K 45/02, опубл. 22.12.87 (аналог).

Изобретение относится к области вирусологии и биотехнологии и может быть использовано при получении лечебно-профилактических иммунобиологических препаратов, обладающих противовирусным действием. Сущность изобретения заключается в получении лиофилизированного препарата на основе α-2-интерферона, в состав которого вводят сывороточный компонент, содержащий антитела к одному или нескольким возбудителям вирусных заболеваний. В качестве сывороточного компонента могут быть использованы иммунные сыворотки или иммуноглобулины в конечной концентрации по общему белку 0,5-10,0%. Технический результат изобретения заключается в повышении противовирусной активности и стабильности при хранении. 1 з.п.ф-лы, 3 табл., 1 ил.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Сборник материалов научной конференции для врачей-практиков, Кольцово, 28-29 января 1993, г | |||
| Кольцово, 1993, с | |||
| Ударно-долбежная врубовая машина | 1921 |
|
SU115A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| ВЫХОДНОЕ УСТРОЙСТВО МНОГОКАНАЛЬНОГО КОММУТАТОРА ИМПУЛЬСОВ | 0 |
|
SU270799A1 |
| Соловьев В.Д., Бектемиров Т.А | |||
| Интерферон в теории и практике | |||
| - М.: Медицина, 1981 | |||
| Ершов Ф.И., Новохатский А.С | |||
| Интерферон, теория и практика | |||
| XLXX сессия общего собрания АМН СССР | |||
| Тезисы докладов | |||
| - М., 1993, с | |||
| Способ сопряжения брусьев в срубах | 1921 |
|
SU33A1 |
Авторы
Даты
1998-11-10—Публикация
1995-11-03—Подача