Изобретение относится к биотехнологии, а именно генетической инженерии, и может быть использовано в медицине и ветеринарии для получения препаратов против вирусных и бактериальных инфекций.
Однако известный природный штамм не обладает противовирусной активностью. Кроме того штамм имеет недостаточную антагонистическую активность, что экспериментально подтверждено, например, в отношении таких тест-культур, как Pseudomonas vulgaris и Pseudomonas fluorescens. В этой связи препараты, изготовленные на основе данного штамма также будут обладать низкой антагонистической активностью и не иметь антивирусную активность.
Известен штамм бактерий Bacillus licheniformis N 31 (Институт микробиологии и вирусологии им. акад. Д.З. Заболотного АН Украины), используемый в качестве одного из компонентов препарата биоспорин [2], предназначенного для лечения гнойно-септических послеродовых заболеваний.
Однако указанный штамм не обладает противовирусной активностью.
Известен бактериальный препарат на основе штамма Bacillus subtilis C-3102 [4]. Препарат содержит указанную бактериальную культуру в сухой форме, а также пищевые добавки-наполнители для получения фармацевтических или ветеринарных препаратов. Технология получения препарата включает суспензионное культивирование штамма бактерий в питательной среде, содержащей источник углерода, источник азота, неорганические вещества, витамины, аминокислоты при pH 6-8 и температуре 35-40oC в течение от 0,5 до 7 дней. Бактериальную культуру отделяют от питательной среды, промывают и концентрируют. Полученный продукт высушивают и смешивают с добавками-наполнителями.
Недостатком данного препарата является то, что он не обладает противовирусной активностью. Кроме того препарат имеет сложную технологию получения, т. к. включает операции по отмывке бактериальных клеток от компонентов питательной среды, а затем концентрирование бактерий центрифугированием.
Наиболее близким аналогом предлагаемого препарата (прототипом) является бактериальный лечебно-профилактический препарат в жидкой форме, включающий биомассу бактерий Bac. subtilis 5/6, биомассу бактерий Bac. subtilis 2/10 и биомассу бактерий Bac, licheniformis 31. Смесь указанных компонентов препарата представляет собой микробную ассоциацию при объемном их соотношении 1:1: 1 (содержание каждого компонента препарата 100-150 млрд. микробных клеток в 1 мл физраствора). Указанную жидкую форму препарата используют для лечения гнойно-септических послеродовых заболеваний [5]. Препарат имеет широкий спектр антагонистической активности.
Недостатком данного препарата является то, что он имеет жидкую форму, которая долго не хранится и не удобна в применении, а также не обладает противовирусной активностью.
Задачей предлагаемых изобретений является получение бактериальных штаммов Bacillus subtilis, Bacillus licheniformis и на их основе создание комплексного бактериального препарата, обладающего более широким спектром антивирусной и антибактериальной активности.
Для решения указанной задачи предлагается:
- штамм бактерий Bacillus subtilis IC-9, депонированный во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ), ГНИИ Генетика под номером ВКПМ В-7048 от 31.05.95 г. Штамм получен из природного изолята селекционным путем. Штамм подвергался селекции на подавление бактериального и грибкового роста. С лучшими вариантами проводили эксперименты по подавлению роста: трихофитов, микроспориумов, эпидермофитонов, кандидомикозов и других грибков.
- штамм бактерий Bacillus licheniformis IC-1, депонированный во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ), ГНИИ Генетика под номером ВКПМ И-7038 от 30.05.95 г. Штамм получен из природного изолята селекционным путем. Штамм подвергался селекции на подавление бактериального и грибкового роста. С лучшими вариантами проводили эксперименты по подавлению роста болезнетворных штаммов: стафилококка, стрептококка, сальмонелл, трихофитов, микроспориумов, эпидермофитонов, кандидомикозов и др.
- штамм бактерий Bacillus subtilis IC-16 (pBMB5), полученный путем трансформации штамма B. subtilis ВКПМ В-7048 (IC-9) рекомбинантной плазмидой ДНК pBMB 5, содержащий ген α-2 интерферона. Полученный штамм IC-16 депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) ГНИИ Генетика под номером ВКПМ В-7092. Плазмида pBMB 5 способна реплицироваться в бациллах и содержит в своем составе ген α-2- интерферона человека, промотор для экспрессии этого гена, сайт посадки рибосом (SD-сайт) и сигнальный пептид α-амилазы B. amyloliquefaciens для секреции интерферона в культуральную среду, а также несущую устойчивость к канамицину.
Кроме того, указанная задача решается тем, что в препарате против вирусных и бактериальных инфекций, включающем смесь биомассы штаммов Bacillus subtilis и Bacillus licheniformis в равных соотношениях, согласно изобретению, он дополнительно содержит крахмал и сахар, а в качестве биомассы штаммов бактерий Bacillus subtilis и Bacillus licheniformis используют биомассу штаммов бактерий Bacillus subtilis ВКПМ В-7092, ВКПМ В-7048 и Bacillus licheniformis ВКПМ В-7038 в споровой форме с титром не менее 3•1010 спор/г при следующем количественном соотношении компонентов (мас.%):
Смесь спор бактерий Bacillus subtilis и Bacillus licheniformis в равных соотношениях - 0,1 - 1,0
Крахмал - 1,0 - 3,0
Сахар - Остальное
Высокий титр спор бактерий (1010 спор/г и более) обеспечивается за счет создания одинаковых условий спорообразования для каждой бактериальной клетки.
Иммобилизация спор бактерий на крахмале обеспечивает им дополнительную механическую защиту, предотвращает слипание спор бактерий и обеспечивает более равномерное их распределение в массе наполнителя.
При применении препарата крахмал способствует ускорению прорастания спор бактерий, что повышает эффективность его действия.
Сахар является не только сорбентом-наполнителем, но и оказывает на препарат стабилизирующий и консервирующий эффект, создает более мягкие условия для хранения спор бактерий.
Кроме того, предлагаемый способ значительно упрощает технологию получения препарата как на этапах культивирования (в технологии отсутствует использование дорогих ферментов, не требуется очистка и концентрирование препарата), так и на этапах получения готовой его формы (удаление или перераспределение влаги совмещено с получением готовой формы препарата).
Культурально-морфологические и биохимические свойства штамма Bac. subtilis ВКПМ В-7048
Штамм ВКПМ В-7048 относится к аэробам, грамположительная бактерия. При росте на среде LA дает форму колоний, похожую на ромашку. Колонии белесые. Штамм имеет вид палочек. Величина клеток односуточный агаровой культуры (2-4)•(0,5-0,8) мкм. Споры образуют. Капсулы не образуют. По Граму окрашиваются положительно. Штамм размножается при 15-50oC, оптимальный рост при температуре 36-37oC.
Хорошо образуют эндоспоры на картофельном агаре. Эндоспоры эллипсоидные, расположены центрально и не выходят из размеров спорангия. Околоспоральных включений не обнаружено.
Через 48 ч роста при +37oC на суслоагаре культура имеет непрозрачные матовые колонии с фестончатым краем. Хорошо снимается петлей с поверхности агара.
FH среды: минимальные 4; максимальные 8; оптимальные 6-7.
Штамм размножается при 37oC на средах МПВ и МПА.
Биохимические свойства. Вызывает гидролиз крахмала, редукцию нитратов. Расщепляет глюкозу, сахарозу, маннит мальтозу и лактозу.
Штамм не является фитопатогенным.
Штамм ВКПМ В-7048 продуцирует антибиотик широкого спектра действия, подавляющий рост грибков, стафилокков, стрептококков и синегнойной палочки.
Культура не растет в анаэробных условиях и при 10% NaCl, не образует газ из NO в анаэробных условиях.
При длительном хранении штамма субстанцию лиофильно высушивают. Для размножения бактерий используют мясопептонный агар (МПА), а культивирование проводят при температуре 37oC.
Культурально-морфологические и биохимические свойства штамма Bac. licheniformis ВКПМ В-7038
Штамм ВКПМ В-7038 относится к аэробам; грамположительная палочка, способная образовывать споры. Размеры вегетативных клеток (0,5-0,8) мкм и (1,5-3) мкм, иногда достигают до 5 мкм. Споры эллиптические, преимущественно расположены центрально, не более одной в клетке-спорангии, без отчетливой раздутости спорангии.
Вегетативные клетки B. licheniformis ВКПМ В-7038 хорошо растут на богатых питательных средах (мясопептонный бульон - МПБ и мясопептонный агар - МПА) при температуре (37-40)oC. Нет роста в присутствии 0,02% азида, но наблюдается рост на агаре Сабуро, при 7% NaCl и при добавлении 0,001% лизоцима.
Наблюдается слабый рост в анаэробном агаре.
На мясопептонном бульоне pH (7,3±0,1) через 48 часов инкубации при температуре (37±1)oC образует помутнение среды, а на поверхности - сухую пленку; на мясопептонном агаре Хоттингера pH (7,3±0,1) - слабовыпуклые сухие непрозрачные белесые колонии, полиморфные, мелкозернистые диаметром (4-6) мм, врастающие в питательную среду.
Для получения спор культуру, выращенную на твердой питательной среде, бактериологической петлей пересевают в пробирки или флаконы на картофельный или пшеничный агар, закрывают ватно-марлевыми тампонами и инкубируют при температуре 37oC в течение (7-10) суток под углом 45oC агаром вверх. После завершения споруляции культуру хранят при 4oC в холодильнике.
Биохимические свойства. Вегетативные клетки B. licheniformis ВКПМ В-7038 гидролизуют казеин и крахмал, каталазоположительны. Реакция Фогес-Проскауэра положительная.
Штамм не является патогенным для растений, животных и человека.
Штамм ВКПМ В-7038 продуцирует антибиотик широкого спектра действия, подавляющий рост грибков, стафилокков, стрептококков и синегнойной палочки.
При длительном хранении штамма субстацию лиофильно высушивают.
Технология получения рекомбинантного штамма B. subilis ВКПМ В-7092 (IC-16) и характеристика его свойств
Для передачи генетической информации используют метод трансформации протопластов B. subtilis, описанный Chang and Cohen [6]. Методика состоит в следующем. 50 мл среды LB (бульон Лурия) в колбе на 500 мл инокулируют 2,5 мл ночной культуры B. subtilis ВКПМ В-7048 (IC-9) и растят в условиях интенсивной аэрации до D600=0,4ое/мл. Затем клетки осаждают центрифугированием в роторе JA-20 при 6000 об/мин в течение 10 мин, удаляют надосадочную жидкость, а клетки ресуспендируют в 5 мл среды SMMP. Среду SMMP приготавливают, смешивая равные объемы 2хSMM и LBP. Состав 2хSMM-буфера: 0,5 М сахароза, 0,02 М малеат Na, 0,02 М MgCl2, pH 6,5. Среду автоклавируют при 0,7 атм. Состав среды LBP (на 1 л): 20 г триптона ("Difco"), 10 г NaCl, 10 г дрожжевого экстракта ("Difco"), 80 г поливинилпирролидона ("Fluka"). Среду автоклавируют при 0.7 атм.
К ресуспендированным клеткам добавляют 0,5 мл раствора, содержащего 20 мг/мл лизоцима (раствор лизоцима в SMMP готовят незадолго до использования и стерилизуют фильтрованием через фильтры "Millipore" с размером пор 0,2 нм).
Клетки инкубируют при 37oC при мягком перемешивании. Через определенные промежутки времени отбирают аликвоты и исследуют их в фазово-контрастном микроскопе, чтобы определить количество протопластов. Когда в протопласты превратятся не менее 99% клеток (1-1,5 часа), их осаждают в роторе JA-20 в течение 15 мин при 5000 об/мин, промывают 1 раз с помощью ресуспендирования в SMMP и вновь центрифугируют в тех же условиях.
Далее протопласты ресуспендируют в 1/15 объема стартовой культуры. т.е. в 3,3 мл SMMP, добавляют 5-10 мкг плазмидной ДНК и 1,5 мл 40%-ного раствора полиэтиленгликоля, растворяют 50 мл 2хSMM, доводят водой до 100 мл, автоклавируют при 0,7 атм, осторожно перемешивают и оставляют на 2 мин при комнатной температуре. Затем добавляют 5 мл среды SMMP для разбавления полиэтиленгликоля, перемешивают и центрифугируют в роторе JA-20 при 5000 об/мин в течении 10 мин. Протопласты ресуспендируют в 1 мл среды SMMP и инкубируют при 37oC при мягком перемешивании в течение 1,5 часов. Аликвоты по 0,1 мл рассевают на чашки со средой ДМ3, содержащей 1 мг/мл канамицина, для регенерации протопластов. Состав среды ДМ3 (на 1 л): 200 мл 4% агара ("Difco"), 500 мл 1 М сукцината Na, pH 7,3, 100 мл 5%-ных казаминовых кислот (Difco), 50 мл 10% дрожжевого экстракта ("Difco"), 100 мл 3,5% K2HPO4 и 1,5% KH2PO4, 25 мл 20% глюкозы, 20 мл 1 М MgCl2. После автоклавирования при 0,7 атм в среду добавляют 5 мл 2%-ного BSA.
В качестве контроля трансформации протопластов B.subtilis используют описанную выше процедуру, но вместо плазмидной ДНК добавляют такой же объем буфера TE (10 мМ HCl), pH 8,0, 1 мМ ЭД-ТА) или воды. Для контроля интактности и жизнеспособности протопластов одну аликвоту высевают на среду, не содержащую канамицина).
В результате проделанных процедур на среде с канамицином получено 7 клонов (после трансформации B. subtilis плазмидной ДНК pBMB 5). Контрольные чашки, содержащие протопласты после добавления к ним буфера ТЕ были пусты. На чашке со средой без канамицина протопласты выросли сплошным газоном.
Протопласты, устойчивые к канамицину, рассевали штрихом на чашки Петри со средой LA (агаризованный бульон Лурия), содержащий 50 мкг/мл канамицина. Для контроля используют среду LA с 50 мкг/мл ампициллина, а также LA с 10 мкг/мл тетрациклина. Все 7 протопластов дали хороший рост на среде с канамицином, слабый рост на среде с ампициллином и отсутствие роста на среде с тетрациклином. Исходный штамм B. subtilis не дает роста на среде с канамицином или тетрациклином и имеет слабый рост на среде с ампициллином.
Для описания морфологии колоний полученных 7 протопластов суспензию этих культур в физиологическом растворе (0,85% NaCl), высевают на среду JA и растят при 37oC 18 часов. В качестве контроля используют исходный штамм B. subtilis IC-9 (ВКПМ-7048).
5 из 7 колоний протопластов имеют такую же морфологию, как исходный штамм B. subtilis IC-9. Диаметр колоний составляет 0,3- 0,5 мм. Колонии шероховатые, напоминают ромашку, т.е. углубление в середине, а затем плотный валик, окаймляющий "сердцевину", и более прозрачные края, слегка волнистые.
При окраске по Ожешко [7] и микроскопии мазков культур, выращенных на среде JA в течение ночи при 37oC и выдержанных в течение 3 часов в холодильнике, обнаружены продолговатые вегетативные палочки и овальные споры. Все 7 протопластов и исходном штамме B. subtilis имеют одинаковую картину.
Все протопласты обнаруживают стабильность поддержания плазмиды в клетках, т. е. при хранении на среде JA с 50 мкг/мг канамицина и последующих пересевах на аналогичную среду не наблюдалось утери признака устойчивости к канамицину.
Для выделения плазмиды из клонов после трансформации исходного штамма использовали методику Birnboim and Doly [8]. С помощью электрофореза в 0,8% агарозном геле и последующей окраски бромистым этидием было показано наличие плазмиды в трансформированных клонах.
Штамм B. subtilis ВКПМ В-7092 характеризуется следующими свойствами.
Культурально - морфологические свойства. B. subtilis относится к аэробам. При росте на среде LA дает форму колоний, похожую на ромашку. Колонии белесые. Бактерии имеют вид палочек. Величина клеток односуточной агаровой культуры (2-4)•(0,5-0,8) мкм. Споры образуют. Капсулы не образуют. По Граму окрашиваются положительно. Штамм размножается при 15-50oC, оптимальный рост при температуре 36-37oC.
Биохимические свойства. Вызывает гидролиз крахмала, редукцию нитратов. Расщепляет глюкозу, сахарозу, маннит, мальтозу и лактозу.
Штамм устойчив к канамицину и не является фитопатогенным.
Штамм ВКПМ В-7092 синтезирует α2- интерферон и антибиотик широкого спектра действия, подавляющий рост грибков, стафилококков, стрептококков и синегнойной палочки.
При длительном хранении штамма субстацию лиофильно высушивают. Для размножения бактерий используют мясопептонный агар (МПА), а культивирование проводят при температуре 37oC.
Пример 1. Исследование непатогенности B. subtilis ВКПМ-7048
Исследование проведено в лаборатории антибактериальных средств и микробиологической токсикологии Всероссийского научного центра по безопасности биологически активных веществ (ВНЦ БАВ).
Патогенность микроорганизма оценивали по выживаемости инфицированных животных, по их внешнему виду и общему поведению, высеваемости бактерий из крови и органов в различные сроки после заражения, а также по макроскопической картине внутренних органов при вскрытии животных в конце срока наблюдения.
В работе использованы лабораторные животные двух видов. Опыты поставлены на 12 нелинейных белых мышах (18-20 г) и 4 белых крысах (180-200 г).
Исследуемый штамм B. subtilis выращен на агаре Хоттингера при 32oC в течение суток. Заражающая доза для животных составляла 10 микробных тел на животное. Микробную взвесь вводили внутрибрюшинно в 0,5 мл изотонического раствора хлорида натрия. Животных наблюдали на протяжении 30 суток.
Высевы микроорганизмов из крови и органов проводили на агар Хоттингера в чашки Петри. У мышей микробиологической анализ крови, печени и селезенки производили трехкратно за период наблюдения - через 3, 7 и 14 суток после введения изучаемого штамма, у крыс - однократно через 14 суток. Во всех случаях брали по 2 животных каждого вида.
В конце срока наблюдения (30 суток) по 2 животных каждого вида забивали этиловым эфиром, вскрывали и производили макроскопическую оценку внутренних органов: сердца, легких, желудка, печени, почек и селезенки.
В результате проведенных исследований установлено нижеследующее. В течение опыта не зарегистрировано гибели животных. Не отмечено каких-либо изменений в их внешнем виде и поведении. При макроскопической оценке внутренних органов на 30 день наблюдения патологических изменений не обнаружено.
Микробиологический анализ не показал высеваемости микроорганизма из крови и внутренних органов животных во все сроки исследования.
На основании отсутствия гибели животных и каких-либо изменений в их внешнем виде и общем поведении на протяжении 30-ти дневного наблюдения, отрицательных результатов микробиологического анализа крови, печени и селезенки, нормальной картины внутренних органов животных при вскрытии в конце срока наблюдения сделан вывод, что штамм Bacillus subtilis IC-9 (ВКПМ В-7048) является непатогенным.
Пример 2. Исследование непатогенности штамма Bacillus licheniformis ВКПМ-7038
Исследуемый штамм B. licheniformis выращен на агаре Хоттингера при 35oC в течение суток.
Исследования проводились на белых мышах. Заражающая доза для животных составляла 1010 микробных тел на животное. Микробную взвесь вводили внутрибрюшинно в 0,5 мл изотонического раствора хлорида натрия. Животных наблюдали на протяжении 30 суток.
Высевы микроорганизмов из крови и органов проводили на агар Хоттингера в чашки Петри. У мышей микробиологический анализ крови, печени и селезенки производили трехкратно за период наблюдения - через 3, 7 и 14 суток после введения изучаемого штамма, у крыс - однократно через 14 суток. Во всех случаях брали по 2 животных каждого вида.
В конце срока наблюдения (30 суток) животных забивали этиловым эфиром, вскрывали и производили макроскопическую оценку внутренних органов: сердца, легких, желудка, печени, почек и селезенки.
В результате проведенных исследований установлено нижеследующее. В течение опыта не зарегистрировано гибели животных. Не отмечено каких-либо изменений в их внешнем виде и поведении. При макроскопической оценке внутренних органов на 30 день наблюдения патологических изменений не обнаружено.
Микробиологический анализ не показал высеваемости микроорганизма из крови и внутренних органов животных после 7 суток исследования.
На основании отсутствия гибели животных и каких-либо изменений в их внешнем виде и общем поведении на протяжении 30-ти дневного наблюдения, отрицательных результатов микробиологического анализа крови, печени и селезенки, нормальной картины внутренних органов животных при вскрытии в конце срока наблюдения сделан вывод, что штамм Bacillus licheniformis ВКПМ В-7038 является непатогенным.
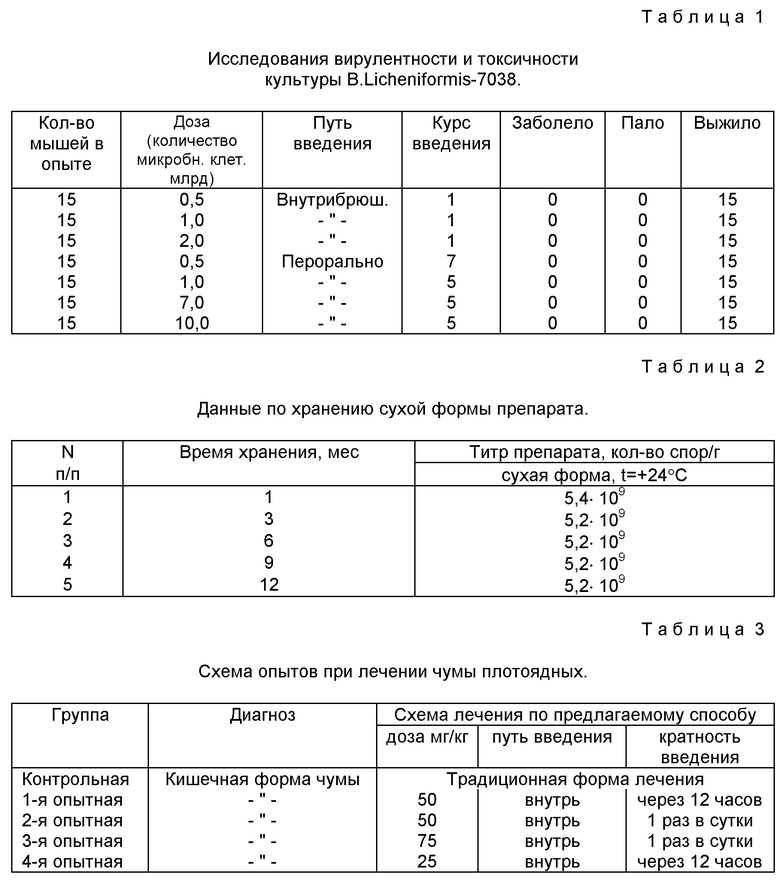
Данные о непатогенности штамма Bac. licheniformis ВКПМ В-7038 представлены в таблице 1.
Анализ таблицы 1 показывает, что предлагаемый штамм является безвредным для животных.
Пример 3. Исследование непатогенности штамма бактерий Bacillus subtilis ВКПМ-7092
Исследование проведено в лаборатории антибактериальных средств и микробиологической токсикологии Всероссийского научного центра по безопасности биологически активных веществ (ВНЦ БАВ).
Патогенность микроорганизма оценивали по выживаемости инфицированных животных, по их внешнему виду и общему поведению, высеваемости бактерий из крови и органов в различные сроки после заражения, а также по макроскопической картине внутренних органов при вскрытии животных в конце срока наблюдения.
В работе использованы лабораторные животные двух видов. Опыты поставлены на 12 нелинейных белых мышах (18-20 г) и 4 белых крысах (180-200 г).
Исследуемый штамм B. subtilis выращен на агаре Хоттингера при 32oC в течение суток. Заражающая доза для животных составляла 10 микробных тел на животное. Микробную взвесь вводили внутрибрюшинно в 0,5 мл изотонического раствора хлорида натрия. Животных наблюдали на протяжении 30 суток.
Высевы микроорганизмов из крови и органов проводили на агар Хоттингера в чашки Петри. У мышей микробиологический анализ крови, печени и селезенки производили трехкратно за период наблюдения - через 3, 7 и 14 суток после введения изучаемого штамма, у крыс - однократно через 14 суток. Во всех случаях брали по 2 животных каждого вида.
В конце срока наблюдения (30 суток) по 2 животных каждого вида забивали этиловым эфиром, вскрывали и производили макроскопическую оценку внутренних органов: сердца, легких, желудка, печени, почек и селезенки.
В результате проведенных исследований установлено нижеследующее. В течение опыта не зарегистрировано гибели животных. Не отмечено каких-либо изменений в их внешнем виде и поведении. При макроскопической оценке внутренних органов на 30 день наблюдения патологических изменений не обнаружено.
Микробиологический анализ не показал высеваемости микроорганизма из крови и внутренних органов животных во все сроки исследования.
На основании отсутствия гибели животных и каких-либо изменений в их внешнем виде и общем поведении на протяжении 30-ти дневного наблюдения, отрицательных результатов микробиологического анализа крови, печени и селезенки, нормальной картины внутренних органов животных при вскрытии в конце срока наблюдения сделан вывод, что штамм Bacillus subtilis IC-16 (ВКПМ В-7092) является непатогенным.
Пример 4. Исследование антагонистической активности штаммов B. subitilis ВКПМ В-7048, ВКПМ В-7092 и B. licheniformis ВКПМ В-7038
Селективно полученный штамм B. subtilis ВКПМ В-7048 характеризуется высокой антагонистической активностью в отношении патогенных и условно патогенных микроорганизмов.
Антагонистическую активность в отношении тест-культур проверяют методом отсроченного антагонизма. В качестве тест-культур используют Shigella sonnei, Salmonella typhimurium. S. stenly, S. reading, S. derby, Staphylococous aureus, Pseudomonas aeruginose, Proteus vulgaris, Klebsiella pneumoniae, Candida albicans, C. tropicalis и др. Используемые тест-микробы должны удовлетворять следующим требованиям: находиться в S-форме, иметь типичные морфологические и ферментативные свойства.
Используемые штаммы тест-микробов давали положительную кератоконъюнктивальную пробу на морских свинках.
Тест-штаммы стафилококков образовывали зону гемолиза размером 3-5 мм вокруг своих колоний через 18-20 часов роста на кровяном агаре, коагулировали плазму крови кролика в течение 2-х часов, вызывали некроз в течение 48-72 часов при внутрикожном введении кролику 200 млн микробных клеток суточной культуры в 0,2 мл физиологического раствора.
Исследование антагонистической активности штаммов B. subtilis ВКПМ В-7048, ВКПМ В-7092 и B. licheniformis ВКПМ В-7038 производят на плотной среде Гаузе N 2.
Рецептура плотной среды Гаузе N 2 на 1 л:
1. Бульон Хоттингера (700 мг% общего азота) - 30 мл
2. Пептон - 5 г
3. Натрия хлорид - 5 г
4. Глюкоза - 10 г
5. Агар микробиологический - 15 г
6. Дистиллированная вода - до общего объема 1 л.
После смешивания компонентов среду разогревают до полного растворения агара и фильтруют через ватно-марлевый фильтр в колбы по 0,3 - 0,4 л. Колбы со средой стерилизуют в автоклаве при давлении 0,1 МПа в течение 15 мин. После остывания до температуры (45±2)oC среду разливают по стерильным чашкам Петри. Чашки Петри со средой помещают в термостат и выдерживают при температуре (37±1)oC в течение (24±2) часов для проверки стерильности.
Культуры Shigella sonnei, Salmonella typhimurium, Staphylococcus aureus, Candida albicans и другие вышеуказанные тест-культуры выращивают на чашках Петри в течение (18+2) часов на мясопептонном агаре (МПА). В стерильные пробирки приливают по 1 мл физиологического раствора и готовят суспензии тест-штаммов с концентрацией (5,0 ± 0,5)•108 клеток/мл.
Для проведения испытания от каждой серии отбирают 4 пробы по 2 г.
Далее 0,5 г препарата на основе штамма B. subtilis 7048 разводят в 1 мл физиологического раствора. Полученную взвесь высевают штрихом с помощью микробиологической петли по диаметру чашки Петри с плотной средой Гаузе N 2. Посевы инкубируют в термостате при (37±1)oC в течение (72±2) часов. Затем к выросшей культуре подсеивают посевной материал тест-микробов методом перпендикулярных штрихов.
Учет результатов проводят через 18 часов инкубирования при (37±1)oC по величине зон отсутствия роста тест-культур. Контролем роста тест-культур служит их параллельный высев на чашки с той же плотной средой Гаузе N 2 без исследуемой ассоциации культур.
Штаммы B. subtilis ВКПМ В-7048 и ВКПМ В-7092 характеризуются следующими показателями зон задержки роста тест-культуры (мм):
Shigella sonnei - 17-22
Salmonella typhimarium - 21-25
S. stenly - 13-17
S. reading - 14-18
S. derby - 15-18
Staphylococcus aureus - 22-27
Pseudomonas fluoresocens - 8-10
Pseudomonas vulgaris - 10-12
Pseudomonas aeruginose - 7-9
Proteus vulgaris - 12-14
Klebsiella pheumoniae - 13-15
Candida albicans - 25-29
C. tropicalis - 22-26
Штамм B. licheniformis 7038 характеризуется следующими показателями зон задержки роста тест-культуры (мм):
Shigella sonnei - 22-27
Salmonella typhimurim - 26-30
S. stenly - 18-22
S. reading - 19-23
S. derby - 20-23
Stapgylococcus aureus - 27-33
Pseudomonas aeruginose - 12-15
Proteus vulgaris - 17-19
Klebsiella pneumoniae - 18-20
Candida albicans - 30-34
C. tropicalis - 27-31
Таким образом исследуемые штаммы бактерий имеют высокую антагонистическую активность в отношении широкого спектра патогенных и условно патогенных микроорганизмов.
Кроме того, исследована антибиотическая активность производственных штаммов R. subtilis ВКПМ В-7048, ВКПМ В-7092 и B. licheniformis ВКПМ В-7038 по отношению друг к другу как составных частей комплексных препаратов. При этом можно сделать вывод, что антагонизм клеток B. subtilis и B. licheniformis не является существенной помехой для их совместного использования в препаратах.
Пример 5. Исследование антивирусной активности штамма B. subtilis ВКПМ И-7092
Для исследования антивирусной активности штамм бактерий культивируют на плотной питательной среде следующего состава:
Агар-агар - 20 г/л
Пептон - 12 г/л
Дрожжевой экстракт - 5 г/л
NaCl - 5 г/л
Вода - До 1 литра
Канамицин - 50 г/л
На 1 литр агаризованной среды требуется 25-30 мл бактерий с титром около 108 кл/мл. Питательную среду формируют в емкости в виде слоя, на который укладывают полупроницаемую мембрану, например целлофановую пленку. Сверху на пленку наносят посевную дозу штамма бактерий. Культивирование осуществляют в термостате при температуре 34-37oC в течение 20-24 часов. Далее емкость переносят в термостат с температурой +(6-10)oC и выдерживают при этой температуре в течение 1 суток до образования спор бактерий. При указанном способе культивирования может быть получен титр спор 3•1010 спор/г. Споры бактерий снимают стеклянным шпателем с поверхности целлофановой пленки и собирают в стерильную емкость. Указанные споры бактерий представляют собой чистый концентрат биомассы, которую исследуют на противовирусную активность.
Противовирусную активность штамма ВКПМ В-7092 определяют по ингибированию цитопатического действия вируса везикулярного стоматита (ВВС) на культуре клеток Л-68.
ВВС предварительно пассируют на куриных эмбрионах по ТУ 42-14-99-77, проводят не менее 3-х пассажей при заражающей дозе 100-1000 ТЦД50/0,1 мл. Инфекционная активность материала должна составлять 1•106 - 1•107 ТЦД50/мл. Монослой клеток Л-68, выращивают на матраце вместимостью 1000 мл в присутствии ростовой среды (среда Игла MEM с двойным набором ингредиентов - 90% по ФС 42-7ВС-90, сыворотка плодов коровы по ФС 42-7ВС-90-10%) с антибиотиками (канамицин 100 тыс. Ед/мл, гентамицин 16 Ед/мл), после чего клетки снимают со стекла, суспендируют в 40 мл ростовой среды и подсчитывают их количество в счетной камере Горяева. После этого клеточную взвесь разводят ростовой средой из расчета, чтобы в 1,0 мл содержалось 200 тыс. кл/мл. В лунки микропланшетов вносят по 0,1 мл клеточной взвеси и через 2-3 суток инкубации при 37oC получают монослойную культуру.
После сформирования монослоя отсасывают ростовую среду, в первую лунку вносят 20 мкл образца стерильного фильтрата клеток штамма ВКПМ В-7092, полученного как описано выше, и 180 мкл поддерживающей среды; после осторожного перемешивания 100 мкл из первой лунки переносят во вторую лунку, смешивают со 100 мкл поддерживающей среды и т.д. Клетки выдерживают 24 ч при 37oC и после этого в каждую лунку вносят 100 тканевых цитопатических доз, вызывающих поражение в половине проб, вируса ВВС и выдерживают при 37oC 24-48 ч. Через 1 сутки проводят первый учет, через 2 суток - второй. Величину антивирусной активности в исследуемых образцах определяют методом сравнения с антивирусной активностью рефренс-препарата, в качестве которого используют препарат реаферона, и выражают в международных единицах (ME).
Все исследуемые образцы обладают антивирусной активностью 3•105-5•105ME/л, в то время как в образцах, полученных из бесплазмидного штамма B.subtilis IC-9 антивирусная активность не выявлена.
Пример 6. Определение стабильности рекомбинантной плазмиды рВМВ 5, несущей синтетический ген α-2 интерферона человека, в бактериальных клетках B. subtilis ВКПМ В-7092.
Клетки B. subtilis выращивают в среде 2.LB с крахмалом до поздней стационарной фазы, затем переносят в свежую среду и выращивают снова до поздней стационарной фазы и т.д., всего 10 пересевов. После каждого пересева проводят высев на МПА без антибиотика. Выросшие изолированные колонии перекалывают на чашки с МПА с канамицином и без антибиотика на нитроцеллюлозный фильтр. После подращивания подсчитывают и сравнивают число колоний, выросших на МПА с антибиотиком и без антибиотика. Таким образом определяют количество клонов, потерявших рекомбинантную плазмиду после каждого пересева. Отсутствие плазмиды подтверждают методом выделения плазмидной ДНК.
Сохранность гена интерферона человека типа α-2 в рекомбинантной плазмиде pВМВ 5 после пересевов подтверждают методом гибридизации. Фильтры с отпечатками колоний после пересевов ингибируют с меченым фрагментом, содержащим ген интерферона типа α-2, выделенным из плазмиды рВМВ 5. Все клоны, не потерявшие рекомбинантные плазмиды после пересевов, гибридизируют с меченым фрагментом, содержащим ген интерферона, что свидетельствует о сохранности гена интерферона типа α-2 в составе плазмиды рВМВ 5. Кроме того, из случайно отобранных клонов выделяют плазмидную ДНК и анализируют с помощью эндонуклеаз рестрикции.
Установлено, что плазмидная ДНК сохраняется и наследуется в течение 10 пересевов на МПА, что свидетельствует о ее стабильности.
Пример 7. Методика культивирования бактерий рода Bacillus для получения бактериальной биомассы
Для получения биомассы спор бактерий раздельно культивируют штаммы бактерий B.licheniformis ВКПМ-7038, B.subtilis ВКПМ В-7092, B.subtilis ВКПМ В-7048 на плотной питательной среде следующего состава:
Агар-агар - 20 г/л
Пептон - 12 г/л
Дрожжевой экстракт - 5 г/л
NaCl - 5 г/л
Вода - До 1 литра
На 1 литр агаризованной среды требуется 25-30 мл бактерий одного вида с титром (106-10)8 кл/мл. Питательную среду формируют в емкостях в виде слоев, на которые наносят посевные дозы каждого указанного вида бактерий рода Bacillus. Культивирование каждого вида бактерий осуществляют раздельно в термостате при температуре +(34-37)oCo в течение 20-24 часов. Далее емкости переносят в термостат с температурой +(6-10)oC и выдерживают при этой температуре в течение 1-2 суток до образования спор бактерий. При указанном способе культивирования может быть получен титр спор (3-10)•1010 спор/г.
Пример 8. Получение готовой формы препарата на основе микробной ассоциации рода Bacillus
Вначале приготавливают раздельно для биомассы каждого вида бактерий смесь сахара с крахмалом в соотношении 1:1. Далее к 5 частям полученной смеси наполнителя добавляют 1 часть биомассы спор бактерий штамма ВКПМ В-7092 или ВКПМ В-7048 и перемешивают При этом происходит иммобилизация спор бактерий на частицах крахмала. Далее в полученную смесь вводят сахар при соотношении биомассы спор бактерий и сахара не более 1:50. В результате получают составные части препарата в сухой форме при следующем соотношении компонентов (мас.%):
1. компонент А
Споры бактерий Bac. subtilis ВКПМ В-7092 с титром не менее 3•1010спор/г - 0,1-1,0
Крахмал - 1,0-3,0
Сахар - Остальное
2. компонент Б
Споры бактерий Bac.subtilis ВКПМ В-7048 с титром не менее 3•1010спор/г - 0,1-1,0
Крахмал - 1,0-3,0
Сахар - Остальное
3. компонент В
Споры бактерий Bac. subtilis ВКПМ В-7092 с титром не менее 3•1010 спор/г - 0,1-1,0
Крахмал - 1,0-3,0
Сахар - Остальное
Далее компоненты А, Б, и В препарата в сухой форме смешивают в соотношении 1:1:1 и получают готовую форму препарата.
Остаточная влажность препарата составляет не более 2-5%
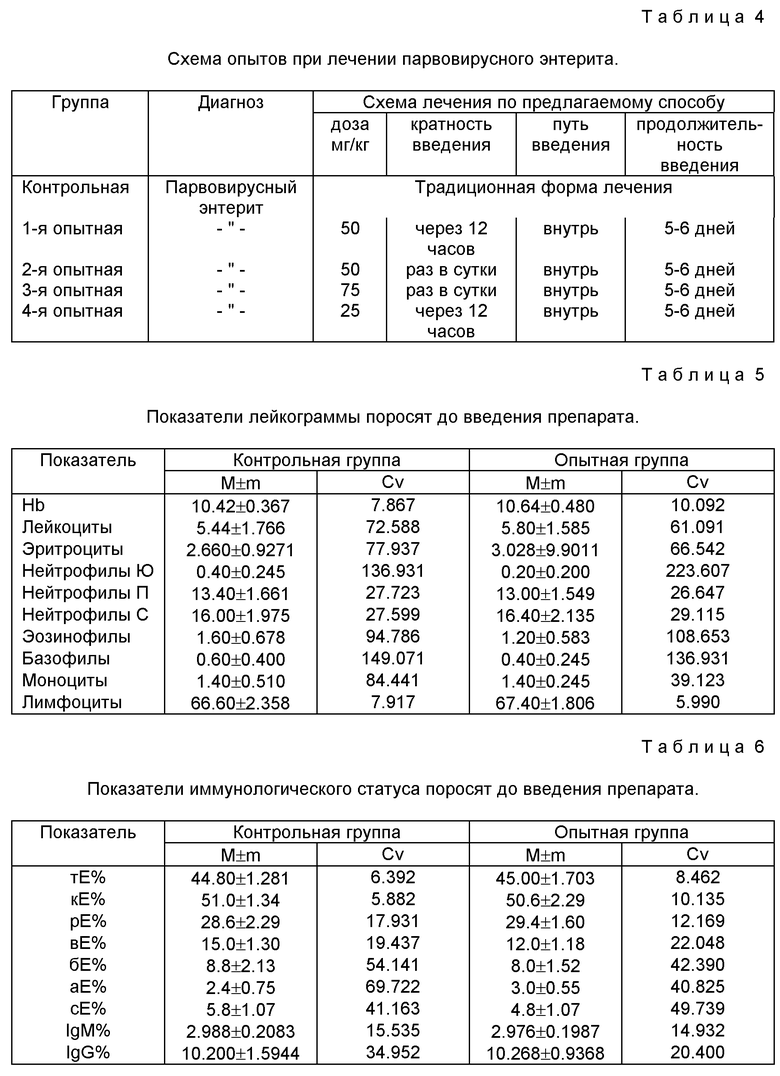
Пример 9. Данные по хранению сухой формы препарата на основе ассоциации спор бактерий рода Bacillus
Для установления срока годности и условий хранения препаратов проведены соответствующие исследования.
Из таблицы 2 следует, что в течение 12 месяцев хранения сухой формы препарата при температуре +24oC титр практически не изменился, что подтверждает высокую термостабильность препаратов в споровой форме, обеспечивающую значительное упрощение технологии их применения в сельском хозяйстве и медицине.
Пример 10. Применение сухой формы препарата на основе ассоциации спор бактерий рода Bacillus
Препарат обладает одновременно антибактериальной и антивирусной активностью за счет высокой антагонистической активности микробной ассоциации опор бактерий рода Bacillus и действия альфа-2-интерферона, а также стимулирует клеточные и гуморальные факторы иммунитета и способен повышать неспецифическую резистентность организма.
Препарат применяют перорально всем видам млекопитающих для лечения и профилактики колибактериозов, дисфункций и дисбактериозов различной природы, чумки, парагриппа, гриппа, диспепсии, сальмонеллезов, инфекционного ринотрахеита крупнорогатого скота, вирусной диареи, ротавирусного энтерита, дизентерии, стафилококковых инфекций, везикулярного стоматита, язвенного дерматита, а также для профилактики иммунодефицитных состояний.
Для лечения препарат назначают перорально в дозе 50 мг/кг массы два раза в сутки с интервалом 12 часов или в дозе 75 мг/кг массы один раз в сутки до выздоровления организма.
Ассоциация бактерий, используемая в препарате, отличается высокой устойчивостью к пищеварительным сокам и ферментам желудочно-кишечного тракта млекопитающих и способностью к быстрому заселению желудка и кишечника. При приеме внутрь с водой или пищей бактерии размножаются в желудочно-кишечном тракте в течение 3-6 суток, затем они полностью выводятся из организма, не вызывая негативных последствий даже при передозировке.
Размножаясь, бактерии своими протеазами лизируют все несвойственные организму млекопитающего белки, денатурированные белки и нуклеопротеиды. При этом уничтожаются бактериальные токсины, элементы опухолевых новообразований и другие дефектные клетки. Здоровые клетки остаются неповрежденными благодаря наличию в них ингибиторов-антиферментов. Бактерии штамма B. subtilis ВКПМ В-7092 в процессе своей жизнедеятельности вырабатывают интерферон. Через стенки кишечника интерферон попадает в кровь. При этом повышается фагоцитарная активность лейкоцитов крови, повышается иммунный статус организма и устойчивость к различным видам вирусных и других заболеваний. Стабилизируются регенерационные процессы тканей организма. Нормализуется обмен веществ. Стимулируется гуморальный иммунный ответ, а антигенреактивные Т-лимфоциты активизируют функции перитонеальных макрофагов.
Пример 11. Исследование эффективности лечения чумы плотоядных
Для этого из заболевших собак с диагнозом кишечная форма чумы плотоядных в начальной стадии было сформировано 1 контрольная и 4 опытных группы по 5 животных в каждой (табл. 3).
Схема опытов при лечении чумы плотоядных
Лечение по предлагаемому способу проводили в течение 5-6 дней. После исчезновения клинических признаков животным предлагаемый препарат в течении 3-5 дней вводили перорально однократно через двое суток с целью профилактики возможных рецидивов. В контрольной группе для лечения применяли сыворотку гипериммунную, γ-глобулины, антибиотики, сульфаниламиды, витамины, сердечные.
Результаты лечения чумы плодоядных
При применении предлагаемого способа эффективность лечения кишечной формы чумы собак повышается. Причем просматривается прямая зависимость между дозой предлагаемого препарата и выраженностью его терапевтического эффекта. Так, при назначении препарата в дозе 50 мг/кг массы через 12 часов и в дозе 75 мг/кг раз в сутки получены оптимальные результаты. При лечении животных больных чумой с использованием предлагаемого препарата в указанных выше дозировках достигнут 100% положительный эффект без применения традиционных сывороток и иммуноглобулинов. Улучшение в течении заболевания наблюдается уже на 2-3 сутки и в дальнейшем болезнь протекает в более легкой форме в сравнении с аналогами из контрольной группы.
Под влиянием лечения предлагаемым способом происходит функциональная перестройка организма позитивного характера. Стимулируются функции жизненно важных органов и систем. Повышаются окислительно-восстановительные процессы и активизируется обмен веществ. Увеличение количества лимфоцитов и лейкоцитов может свидетельствовать о повышении защитных функций организма собак.
В контрольной группе при использовании комплексной терапии заболевание протекало тяжело и продолжительность лечения колебалась в пределах (10 -12) дней.
Таким образом, предлагаемый способ является эффективным при лечении кишечной формы чумы собак в начале заболевания. Оптимальные результаты получены при использовании препарата в дозе 50 мг/кг массы через 12 часов и в дозе 75 мг/кг массы раз в сутки.
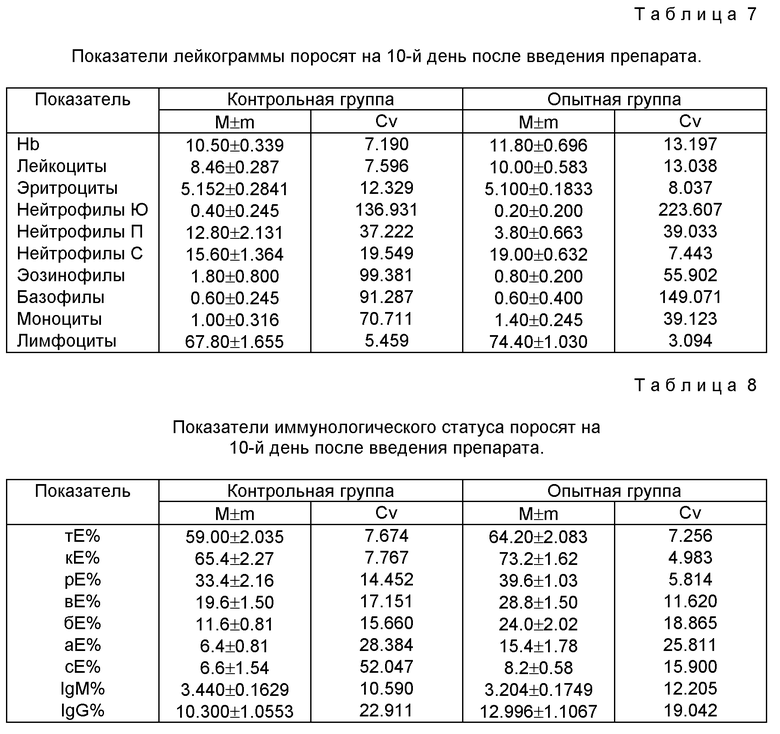
Пример 12. Исследование эффективности лечения парвовирусного энтерита
Для изучения эффективности предлагаемого способа при лечении парвовирусного энтерита собак также были сформированы 1 контрольная и 4 опытных группы по 5 собак в каждой с диагнозом парвовирусный энтерит (табл. 4).
Продолжительность лечения определялась наличием симптомов заболевания. После исчезновения клинических признаков, с учетом особенностей течения заболевания, переболевшим животным в течении 3-4 дней продолжали проводить профилактический курс в дозе 50 мг/кг, один раз в две суток. Животным всех опытных групп назначали регидратационные средства.
Для лечения животных контрольной группы применяли сердечные, противоспазмолитические и противорвотные препараты, антибиотики, регидратационные средства и гиперимунную сыворотку.
Критериями оценки эффективности курса лечения служили продолжительность, характер и степень тяжести течения заболевания, исход, изменения морфологических показателей крови животных. Кровь у собак исследовали до назначения лечения, в период лечения (на 5 день) и после выздоровления.
Результаты лечения парвовирусного энтерита
При парвовирусном энтерите собак предлагаемый способ оказывает выраженное терапевтическое действие. Оптимальные результаты получены при назначении препарата внутрь, в начальный период заболевания, в дозах 50 мг/кг массы через 12 часов и в дозе 75 мг/кг массы 1 раз в сутки до выздоровления животных.
Продолжительность лечения парвовирусного энтерита предлагаемым способом с использованием препарата в дозах 50 мг/кг массы через 12 часов и в дозе 75 мг/кг массы 1 раз в сутки в зависимости от тяжести заболевания колебалась от 2 до 5 дней.
Под влиянием предлагаемого препарата изменяется характер проявления и развития патологического процесса. При назначении препарата в начальной стадии заболевания, воспаление кишечника носило преимущественно катаральный характер и у собак отсутствовали геморрагические выделения. Одним из основных клинических симптомов при парвовирусном энтерите является резкое угнетение лейкопоэза. Предлагаемый способ исключает развитие лейкопении. В меньшей степени у животных развиваются явления интоксикации и дегидратации организма.
Под влиянием предлагаемого препарата профилактируется развитие других вирусных инфекций собак (чума, гепатит) и вторичных бактериальных инфекций, которые часто наблюдаются у собак, переболевших парвовирусным энтеритом, и, как правило, часто приводят к летальному исходу.
У животных контрольной группы заболевание протекало со средней степенью тяжести, преимущественно с геморрагическим воспалением кишечника и выраженной лейкопенией. Продолжительность лечения животных контрольной группы, в зависимости от тяжести заболевания колебалась от 5 до 7 дней.
Пример 13. Исследование эффективности профилактики поросят предлагаемым способом
В опыте использовались две свиноматки с пометом в возрасте 19 дней. Поросятам опытной группы внутрь назначали препарат в дозе 50 мг/кг через 12 часов в течении 5 дней. Поросятам контрольной группы препарат не вводили. В опытной группе было 9 поросят, а в контрольной - 10 поросят.
Для определения эффективности профилактического действия препарата в крови определяли содержание эритроцитов, лейкоцитов, гемоглобина, РОЭ, лейкограмму, субпопуляции Т-лимфоцитов, IgM и IgG. Также учитывали показатели сохранности поросят до отъема. В случае заболевания поросят устанавливали продолжительность, характер течения и исход заболевания.
При исследовании крови поросят до введения препарата не регистрировалось характерных различий морфологических и иммунологических показателей сыворотки крови животных опытной и контрольной групп (таблицы 5, 6).
Результаты исследования крови на 10-й день эксперимента свидетельствуют об увеличении количества эритроцитов на 14,2% и содержания гемоглобина на 10%. Содержание лейкоцитов повышалось на 32,7%, сегментоядерных нейтрофилов на 18% и лимфоцитов на 9% в сравнении с аналогами из контрольной группы (табл. 7).
Как у поросят опытной, так и контрольной группы количественные изменения всех субпопуляций Т-лимфоцитов, IgM и IgG происходят в сторону их увеличения, что обусловлено возрастной спецификой. Однако у животных опытной группы эти показатели были значительно выше, чем у аналогов из контрольной группы (табл. 8).
Таким образом предлагаемый препарат стимулирует образование и выход:
- малодифференцированных Т-лимфоцитов;
- функционально зрелых Т-индукторов-хелперов и Т-киллеров
- супрессоров;
- Т-активных лимфоцитов.
Под влиянием препарата в крови увеличивается содержание IgG. Следовательно препарат в предлагаемом способе повышает естественную резистентность организма, активизируя Т- и В-звенья иммунитета. Препарат интенсивнее стимулирует факторы клеточного иммунитета и в меньшей степени влияет на гуморальные факторы. В крови опытных поросят значительно увеличивается содержание Т-киллеров-супрессоров (на 32%), повышается активность Т-лимфоцитов (на 51,7%), увеличивается содержание посттимических предшественников функционально зрелых клеток (на 58,5%). Концентрация IgG в крови увеличивается на 20,8% в сравнении с контролем. Уменьшение содержания IgM в опытной группе связано с тем, что они вероятно принимают участие в антигенно зависимой клеточной цитотоксичности и интенсивно фиксируются клетками-киллерами и антигенами, а следовательно, их выход в реакции радиальной простой иммунодиффузии ниже.
Поросята в опытной группе не болели, лучше росли и развивались. Сохранность поросят в опытной группе составила 100%, а в контрольной группе - 83,3%. Средний прирост живой массы на период отъема в контрольной группе равнялся (14,5 + 4,45) кг, в опытной - (15,2 + 1,35) кг. Следовательно в опытной группе средний прирост живой массы на 4,83% выше аналогов из контрольной группы. В опытной группе интенсивность роста поросят была равномерной, за исключением одного поросенка, разница в приросте составляла 1 кг, а в контрольной группе - до 8 кг.
Животные хорошо переносят препарат, побочных отрицательных явлений у поросят не наблюдалось.
Пример 14. Исследование эффективности профилактики телят предлагаемым способом
Для проведения исследования были сформированы опытная и контрольная группы по пять животных в каждой группе в возрасте семь дней. Телятам опытной группы вводили предлагаемым способом препарат на основе Bac. subtilis в дозе 50 мг/кг массы через 48 часов в течение 20 дней.
Животным контрольной группы препараты не вводили.
Критериями оценки эффективности профилактики предлагаемым способом в сравнении с контролем служили: изменения уровня гемоглобина в крови, эритроцитов, лейкоцитов, субпопуляций Т-лимфоцитов и данных лейкограммы; общее состояние телят; показатели по заболеваемости телят.
Т-лимфоциты определяли с использованием метода спонтанного розеткообразования, основанного на взаимодействии мембранного Е-рецептора Т-лимфоцитов с эритроцитами барана.
Результаты исследований. При исследовании крови телят до проведения профилактических мероприятий не регистрировалось характерных различий морфологических и иммунологических показателей сыворотки крови животных опытной и контрольной групп. Анализы показали низкое содержание в крови животных активированных Т-лимфоцитов и посттимических предшественников.
Далее исследования показывают, что в процессе проведения профилактики, как у телят опытной, так и контрольной групп количественные изменения гематологических показателей и всех популяций Т-лимфоцитов происходят в сторону их увеличения, что обусловлено возрастной спецификой. Однако у животных опытной группы происходили более выраженные их изменения, в сравнении с контролем.
У телят опытной группы при исследовании крови через 10 дней после начала профилактики по сравнению с контролем увеличивается уровень лейкоцитов на 6,2%, содержание лимфоцитов на 6,6%, тЕ-рок - на 51,85%, рЕ-рок на 43,3%, вЕ-рок на 67,2%, бЕ-рок на 168,2% и аЕ-рок на 225%.
На 20 день исследования из изучаемых гематологических показателей в сравнении с контролем в опытной группе регистрировалось увеличение лимфоцитов на 14,6% и лейкоцитов на 6,3%, а исследование крови на содержание субпопуляций Т-лимфоцитов показало увеличение соответственно содержание тЕ-рок на 18,1%, рЕ-рок на 10,6%, вЕ-рок на 33,7%, бЕ-рок на 34,1%, аЕ-рок на 40,5%.
Промышленная применимость. Изобретение может быть использовано в медицине, ветеринарии и биотехнологии.
Источники научно-технической и патентной информации:
1. Авт. свид. СССР N 681923, МКИ C 12 N 15/00, опубл. 1979 г.
2. Авт. свид. СССР N 1722502, МКИ A 61 K 39/02, 1989 г.
3. Патент РФ N 1839459, МКИ C 12 N 1/21, опубл. 1995 г.
4. Заявка ЕПВ N 0287699, МКИ C 12 N 1/20, опубл. 26.10.88 г.
5. Авт. свид. СССР N 1398868, МКИ A 61 K 35/74, опубл. 1988 г.
6. Chang S. , Cohen S.N. High frequency transformationof Bac. subtilis protoplasts by plasmid DNA.-Mol. Gen. Genet., 1976, v. 168, p. 111 - 115.
7. Лабинская А.С. Микробиология с техникой микробиологических исследований. - М., "Медицина", 1978. - с. 47.
8. Birnboim H. C. , Doly J. A rapid alkaline eatraction procedure for screening recombinant plasmid DNA. - Nucleic Acids Res., 1979. - v. 7, p. 1513 - 1523.
Изобретение предназначено для медицины и ветеринарии. Штаммы бактерий Bacillus Sabtilis ВКПМ В-7092, ВКПМ В-7048 и штамм бактерий Bacillus licheniformis ВКПМ В-7038 используются в качестве компонентов препарата против вирусных и бактериальных инфекций. Препарат содержит смесь биомассы указанных штаммов в споровой форме с титром не менее 3•1010 спор/г. В состав препарата входят также крахмал и сахар при определенном количественном соотношении компонентов. Комплексный бактериальный препарат обладает более широким спектром антивирусной и антибактериальной активности. 4 с.п.ф-лы, 8 табл.
Смесь спор бактерий Bacillus subtilis и Bacillus licheniformis в равных соотношениях - 0,1 - 1,0
Крахмал - 1,0 - 3,0
Сахар - Остальное
| ПРОФИЛАКТИЧЕСКИЙ БИОПРЕПАРАТ СУБАЛИН | 1992 |
|
RU2035185C1 |
| Способ лечения гнойно-септических послеродовых заболеваний | 1985 |
|
SU1398868A1 |
| Препарат биоспорин для профилактики и лечения желудочно-кишечных заболеваний человека | 1989 |
|
SU1722502A1 |
| ШТАММ БАКТЕРИЙ BACILLUS SUBTILIS, НЕСУЩИЙ СВОЙСТВО АНТИБИОТИКОРЕЗИСТЕНТНОСТИ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТА "БАКТИСПОРИН" | 1995 |
|
RU2067616C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОБИОТИКА ДЛЯ ВЕТЕРИНАРИИ | 1994 |
|
RU2084233C1 |
| СИНФАЗНАЯ АНТЕННА С АКТИВНЫМ РЕФЛЕКТОРОМ | 0 |
|
SU287699A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
Авторы
Даты
1999-12-10—Публикация
1997-12-16—Подача