Изобретение относится к неорганической химии, конкретно к способам получения тетрафторбората нитрония.
Тетрафторборат нитрония - эффективный агент для нитрования ароматических соединений, аминов, спиртов и олефинов, который также может выступать в роли окислителя, фторирующего агента и инициатора катионной полимеризации.
Аналоги заявляемого способа отличаются друг от друга, главным образом, используемыми источниками нитроний-катиона, в то время как анион тетрафторбората образуется in situ при взаимодействии фтористого водорода с трифторидом бора.
Известен способ (см. Aynsley E. et al., J. Chem. Soc., 1954, p. 1119; Griffits J. E. , Sunder W.A., J. Fluor. Chem., 1975, 6(6) 533, Р.Ж. Химия, 1976, 8В17) получения тетрафторбората нитрония реакцией фтористого нитрила и трифторида бора при низкой температуре NO2F + BF3 -> NO2BF4.
В качестве источника нитроний-катиона может использоваться азотный ангидрид (Schmeisser M., Elischer S., Z. Naturforsch., Pt.B, 1952, 7b, S. 583, см. Olah G.A., Quinn H.W., Kuhn S.J., J. Am. Chem. Soc., 1960, 82(2) 426-30), 1 моль которого растворяют в 150 г нитрометана, добавляют к раствору 1 моль безводного фтористого водорода и затем насыщают систему трифторидом бора при -20oC. В другом варианте этого способа (см. Kranke P., Wahren M., Isotopenpraxis, 1984, 20(3) 108-9, Р.Ж. Химия, 1984, 17Б4380) сначала проводят взаимодействие между азотным ангидридом и трифторидом бора в нитрометановом растворе, получая аддукт состава N2O5•BF3, дозируя в него затем фтористый водород. Осадок отделяют фильтрованием, сушат в вакууме и получают тетрафторборат нитрония с выходом 94%.
Целевой продукт может быть получен и без участия фтористого водорода при взаимодействии трифторида бора и окислов азота или нитратов (см. Ray A.B., Inorg. Chem., 1967, 6(1) 110 - 113).
В нашедшем промышленное применение методе Куна (см. Kuhn S.J., US Pat. 3403987, 1.10.68, C. A. 69: 108228u; Kuhn S.J., Olah G.A., J. Am., Chem., Soc., 1961, 83(22) 4564; Физер Л., Физер М., Реагенты для органического синтеза, т. II, М.: Мир, 1971, с. 467) к смеси 1 моль красной 95%-ной азотной кислоты и 1 моль безводного фтористого водорода в 150 г нитрометана дозируют при -20 - 0oC 2 моль трифторида бора. Осадок продукта отделяют фильтрованием, промывают нитрометаном, фреоном-113 или дихлорметаном и сушат в вакууме при 40 - 50oC. Выход тетрафторбората нитрония составляет 92%. Сохраняя соотношение реагентов и последовательность операций, процесс ведут в дихлорметане (400 мл на 1 моль фтористого водорода), выход 64 - 80% (см. Физер Л. , Физер М. , Реагенты для органического синтеза, т. V, М.: Мир, 1971, с. 336). Вместо красной азотной кислоты рекомендуется использовать белую 100% (Elsenbaumer R. L., J. Org. Chem., 1988, 53(2) 437-9), что способствует повышению чистоты продукта.
Вместо азотной кислоты используют алкилнитраты (см. Kuhn S.J., US Pat. 3431087, 4.03.69, C. A. 70: 79636p; Huhn S.J., Can. J. Chem., 1962, 40(8) 1660), дозируя при -20 - -15oC 1 моль трифторида бора к перемешиваемому раствору 0,5 моль этилнитрата и 0,5 моль фтористого водорода в 60 г нитрометана. Выход продукта, "свободного от примеси нитрозония", 93,4%.
Известен также способ (Kuhn S.J., Can. J. Chem., 1967, 45(24) 3207; US Pat. 3375083, 26.01.68, C.A. 68: 106508r) получения тетрафторбората нитрония из нитрилхлорида. Согласно описанию, к раствору 0,5 моль нитрилхлорида и 0,5 моль фтористого водорода в 200 мл жидкого диоксида серы при температуре ниже -10oC дозируют при перемешивании 0,5 моль трифторида бора. Продукт выделяют упариванием растворителя при температуре выше -10oC или фильтрацией и получают выход 96%. В другом варианте в качестве растворителя используют нитрометан, поддерживая температуру ниже 0oC.
Общий недостаток описанных методов, препятствующий их широкому использованию в лабораторной практике - необходимость применения трифторида бора и безводного фтористого водорода, а также фтористого или хлористого нитрила - летучих токсичных веществ с высокой коррозионной активностью, требующих повышенной осторожности в обращении, специального оборудования и приемов дозировки.
Потребность в использовании трифторида бора отпадает при получении тетрафторбората нитрония ионным обменом между тетрафторборатом тетраметиламмония и гексахлорантимонатом нитрония в жидком диоксиде серы (см. Реми Г. Курс неорганической химии, т. 1, М.: Мир, 1972, с. 600) - наиболее близкий аналог. Однако, гексахлорантимонат нитрония является малодоступным продуктом, получаемым реакцией петахлорида сурьмы и хлористого нитрила в среде жидкого хлора, что сводит на нет все преимущества по сравнению с другими аналогами.
Задачей предлагаемого способа является получение целевого продукта без использования высоколетучих токсичных коррозионно-активных и малодоступных компонентов.
Поставленная задача решается тем, что тетрафторборат нитрония получают ионным обменом в среде не имеющего основных свойств апротонного растворителя из тетрафторбората тетраалкиламмония, используя в качестве источника нитроний-катиона азотный ангидрид:
Alk4NBF4 + N2O5 -> NO2BF4 + Alk4NNO3,
где
Alk - алкил.
При конкретной реализации данного способа проводят реакцию, например, между тетрафторборатом тетрабутиламмония и азотным ангидридом в среде дихлорметана или нитрометана (примеры 1, 2). Тетрафторборат тетрабутиламмония с высоким выходом получают ионным обменом между тетрафторборатом аммония или тетрафторборной кислотой и бромидом или гидроокисью тетрабутиламмония (House H.O., др., J. Org. Chem., 1971, 36(16) 2371; Wheeler Ch. M., Sandstedt R.A., J. Am. Chem. Soc., 1955, 77, p. 2025). Азотный ангидрид получают, в частности, деградацией азотной кислоты фосфорным ангидридом, выделяя перегонкой и фильтрацией. При комнатной и пониженных температурах представляет собою кристаллическое вещество, хорошо растворимое в большинстве широко применяемых растворителей, в том числе плохо растворяющих тетрафторборат нитрония дихлорметане, нитрометане и т.д.
В связи с тем, что в подобных растворителях азотный ангидрид находится преимущественно в форме молекул или тесных ионных пар, диссоциируя очень слабо, выход целевого продукта мал, и для его повышения в реакционную среду добавляют азотную кислоту, способствующую повышению активности нитроний-катиона в растворе (см. примеры 3 - 6). Поскольку растворимость азотного ангидрида в азотной кислоте выше, чем в используемых растворителях, в наиболее удобной реализации способа насыщенный при комнатной температуре раствор азотного ангидрида в азотной кислоте дозируют при перемешивании и охлаждении в раствор тетрафторбората тетрабутиламмония в дихлорметане (см. пример 6).
Таким образом решается поставленная задача получения тетрафторбората нитрония из легкодоступных компонентов, находящихся при обычных условиях в конденсированном состоянии.
Для проведения реакции используют обычную стеклянную посуду. Получаемый продукт не уступает качеством приготовленному по методу Куна, содержание в нем тетрафторбората нитрозония не превышает 1%, содержание основного вещества - не менее 90 - 95%.
Сопоставление с ближайшим аналогом показывает, что заявляемый способ отличается от известного применением другого компонента в качестве источника нитроний-катиона - азотного ангидрида, а также использованием для повышения выхода продукта добавки азотной кислоты, причем для проведения процесса берут раствор азотного ангидрида в азотной кислоте. Ранее азотный ангидрид не применялся для получения целевого продукта ионным обменом с тетрафторборатами тетраалкиламмония. Таким образом, заявляемое техническое решение удовлетворяет критерию новизны.
Возможность получения тетрафторбората нитрония данным способом неочевидна и не вытекает явно при анализе известных способов из-за упомянутой преимущественно молекулярной структуры азотного ангидрида в малоосновных апротонных растворителях. Это дает основание считать предлагаемое техническое решение имеющим изобретательский уровень.
Сведения, подтверждающие возможность осуществления способа.
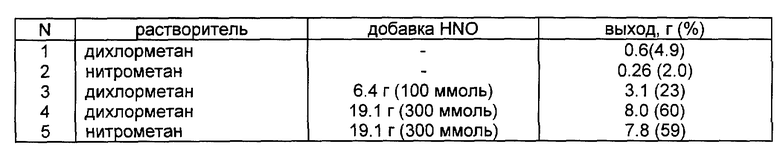
Примеры 1 - 5. К раствору 32,9 г (100 ммоль) тетрафторбората тетрабутиламмония в 50 мл дихлорметана или 70 мл нитрометана, охлаждаемому ледяной баней или льдом с солью, приливают раствор 10,8 г (100 ммоль) азотного ангидрида, соответственно в 65 или 30 мл того же растворителя. Массу взбалтывают, добавляют необходимое количество азотной кислоты, снова взбалтывают и дают охладиться до -5 - -10oC, после чего фильтруют (фильтрацию проводят в условиях минимального контакта продукта с атмосферной влагой). Промывают осадок 2 раза по 5 мл охлажденного сухого дихлорметана, отжимают и сушат. Остальные параметры примеров 1 - 5 приведены в таблице:
Пример 6. В четырехгорлую колбу емкостью 2 л, снабженную мешалкой с затвором, термометром и хлоркальциевой трубкой, загружают 500 мл сухого дихлорметана, 329 г (1 моль) тетрафторбората тетрабутиламмония, перемешивают до растворения и охлаждают до -10 - -12oC. Затем через дозировочную воронку с противодавлением при энергичном перемешивании и охлаждении приливают раствор 125 г (1,16 моль) азотного ангидрида в 246 г (3,9 моль) азотной кислоты, поддерживая температуру не выше -5oC (использование избытка азотного ангидрида вызвано более высокой стоимостью тетраалкиламмониевых солей). Охлаждают образовавшуюся суспензию до -10 - -12oC и отфильтровывают осадок на фильтре Шотта, промывают его в три-четыре приема охлажденным сухим дихлорметаном (общий объем 120 - 150 мл), сушат под вакуумом при 40 - 50oC, получая 97,5 г (74% на тетрафторборат тетрабутиламмония) продукта, содержание основного вещества не менее 95%, содержание тетрафторбората нитрозония - не более 1%.
Использование данного способа позволяет решить поставленную задачу - получение целевого продукта без применения высокотоксичных газообразных или летучих сырьевых компонентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2, 4, 6, 8, 10, 12-ГЕКСАНИТРО-2, 4, 6, 8, 10, 12-ГЕКСААЗАТЕТРАЦИКЛО [5, 5, 0, 0, 0]ДОДЕКАНА | 2001 |
|
RU2199540C2 |
| Способ получения соли нитрозония | 1981 |
|
SU1043184A1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,5-ДИНИТРО-3,7-ЭНДОМЕТИЛЕН-1,3,5,7-ТЕТРАЗАЦИКЛООКТАНА | 2001 |
|
RU2198886C1 |
| Способ синтеза кристаллических нитратометаллатных (металл = V, Mn, Fe, Cu, Zn, Dy, Er, Yb) комплексов с катионом N-нитропиридиния | 2023 |
|
RU2811196C1 |
| СПОСОБ НИТРОВАНИЯ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ | 2002 |
|
RU2318797C2 |
| Тетранитратоборат нитрония и способ его получения | 2017 |
|
RU2654982C1 |
| СПОСОБ ОЧИСТКИ СИНТЕТИЧЕСКИХ УЛЬТРАДИСПЕРСНЫХ АЛМАЗОВ | 1999 |
|
RU2168462C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГАЛОГЕНПРОИЗВОДНЫХ АРОМАТИЧЕСКИХ И ГЕТЕРОАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ | 2019 |
|
RU2711558C1 |
| СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОГО 2,4,6,8,10,12-ГЕКСАНИТРО-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0,0,0]ДОДЕКАНА С ЗАДАННЫМ ПОЛИМОРФНЫМ СОСТАВОМ (ВАРИАНТЫ) | 2010 |
|
RU2452739C9 |
| СПОСОБ ПОЛУЧЕНИЯ 2,4,6,8,10,12-ГЕКСАНИТРО-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0,03,11,05,9]ДОДЕКАНА | 2015 |
|
RU2607517C1 |
Использование: изобретение относится к способу получения тетрафторбората нитрония, используемого для нитрования ароматических соединений, аминов, спиртов и олефинов, а также в качестве окислителя. Сущность: тетрафторборат нитрония получают ионным обменом в среде не проявляющего основных свойств апротонного растворителя между тетрафторборатом тетраалкиламмония и азотным ангидридом. Способ позволяет получить целевой продукт без использования высоколетучих токсичных коррозионно-активных и малодоступных компонентов. 2 з. п. ф-лы., 1 табл.
| Реми Г | |||
| Курс неорганической химии, т.1 | |||
| - М.: Мир, 1972, с.600 | |||
| Химическая энциклопедия | |||
| - М.: Советская энциклопедия, с.1, 1988, т.96 | |||
| Успехи химии фтора /Под ред | |||
| А.П.Сергеева | |||
| - М | |||
| - Л., 1964, с.236. |
Авторы
Даты
1998-12-10—Публикация
1997-05-15—Подача