Настоящее изобретение относится к новым производным пиперазина общей формулы (I):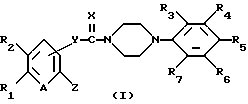
в которой R1 и R2, независимо друг от друга, представляют собой водород, замещенный или незамещенный C1-С8 алкил, замещенный или незамещенный С3-C6 циклоалкил, замещенный или незамещенный C2-C8 ненасыщенный алкил, кетонную группу, замещенный или незамещенный арил, замещенную или незамещенную C1-C4 алкокси, замещенную или незамещенную арилгидрокси, замещенную или незамещенную амино-группу, C1-C4 низшую сложноэфирную группу, C1-C4 низшую тиоэфирную группу, тиольную группу, замещенный или незамещенный карбоксил, эпокси, замещенную или незамещенную C1-C4 низшую тиоалкокси; либо R1 и R2 соединены друг с другом с образованием C3-C4 насыщенной или ненасыщенной цепочки;
R3, R4, R5, R6 и R7, независимо друг от друга, представляют собой водород, галоген, гидрокси, нитро, C1-C4 низшую сложноэфирную группу, C1-C4 низший алкил, C1-C4 низший тиоалкил, замещенный или незамещенный С3-С6 циклоалкил, C1-C4 низшую алкокси, C1-C4 низшую тиоалкокси, замещенный или незамещенный арил, замещенную или незамещенную низшую арилалкокси, замещенную или незамещенную низшую алкиламино-группу либо замещенный низшим алкилом или незамещенный карбамат; или две соседние группы из R3, R4, R5 R6 и R7 связаны друг с другом с образованием 1,2-фенилена или 2,3-нафтилена;
X представляет собой кислород, серу либо замещенную или незамещенную имино-группу;
Y связан с положением 3- или 4- ароматической кольцевой части молекулы, в которой Y представляет собой кислород или группу -NR8- (в которой R8 имеет те же значения, что указаны выше для R3);
Z представляет собой гидрокси, C1-С4 низшую алкокси, C1-C4 низшую тиоалкокси, замещенную или незамещенную арилокси, C1-C4 низшую алкиламино, замещенную или незамещенную циклоамино-группу, содержащую 1-5 атомов азота;
А представляет собой азот или -CH=;
фармацевтически приемлемым солям присоединения кислоты таких производных и к способам их получения.
В приведенных выше определениях, термин "C1-C8 алкил" обозначает такую алкильную группу нормального или изо-строения, как метил, этил, пропил, изопропил, н-бутил, изобутил, трет.-бутил, пентил, изопентил, гексил, гептил, октил, 2-метилпентил и т.п.
C2-C4 низший алкил обозначает метил, этил, пропил, изо-пропил, н-бутил, изобутил или трет.-бутил.
Замещенный или незамещенный C3-C6 циклоалкил обозначает такой замещенный или незамещенный циклоалкил, как циклопропил, циклобутил, циклопентил, циклогексил, замещенный циклопропил, замещенный циклопентил, замещенный циклогексил и т.п.
C1-C4 низшая сложноэфирная группа обозначает карбоксильную группу, этерифицированную низшей алкильной группой.
Термин "C1-C4 низшая алкокси группа" обозначает метокси, этокси, пропокси, изопропокси, бутилокси, изобутилокси, трет.-бутилокси группу или аналогичные группы.
C1-C4 низшая тиоалкокси обозначает метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, трет.-бутилтио группу или аналогичные группы.
C1-C4 низшая алкиламино обозначает метиламино, этиламино, пропиламино, бутиламино-группу или аналогичные группы.
Арилокси обозначает фенокси, замещенную фенокси-группу, нафтилокси или замещенную нафтилокси или аналогичные группы,
Термин "циклоамино-группа, содержащая 1-5 атомов азота" обозначает пирролидинил, пирролинил, имидазолил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, триазолил, тетразолил, пиперазинил или аналогичные группы.
Авторы настоящего изобретения в течение длительного времени проводили исследования, направленные на поиск соединений, обладающих повышенной противоопухолевой активностью, В результате этих исследований в настоящее время были окончательно установлены факты, свидетельствующие о том, что соединения настоящего изобретения, отвечающие общей формуле (I), и их соли присоединения кислот обладают не только значительными противоопухолевыми активностями, но и очень низкими токсичностями.
В соответствии с этим одна из целей настоящего изобретения состоит в разработке новых соединений общей формулы (I) и их солей присоединения кислот, обладающих не только высокими противоопухолевыми активностями, но и очень низкими токсичностями.
Другая цель настоящего изобретения заключается в создании способа получения соединений общей формулы (I) и их солей присоединения кислот.
Соединения настоящего изобретения могут быть смешаны с фармацевтически приемлемыми носителями с использованием известного способа с получением фармацевтических композиций, и такие фармацевтические композиции могут применяться для профилактики или лечения различных видов опухолей у людей или млекопитающих.
В связи с этим еще одна цель настоящего изобретения заключается в создании фармацевтических композиций, содержащих соединения общей формулы (I) или их соли присоединения кислот в качестве активных ингредиентов.
Кислоты, которые могут реагировать с соединениями общей формулы (I) с образованием солей присоединения кислоты, представляют собой фармацевтически приемлемые неорганические или органические кислоты; например, такие неорганические кислоты, как хлористоводородная кислота, бромноватая кислота, серная кислота, фосфорная кислота, азотная кислота; такие органические кислоты, как муравьиная кислота, уксусная кислота, пропионовая кислота, янтарная кислота, лимонная кислота, малеиновая кислота, малоновая кислота, гликолевая кислота, молочная кислота; такие аминокислоты, как глицин, аланин, валин, лейцин, изолейцин, серин, цистеин, цистин, аспарагиновая кислота, глутаминовая кислота, лизин, аргинин, тирозин, пролин; такие сульфоновые кислоты, как метансульфокислота, этансульфокислота, бензолсульфокислота, толуолсульфокислота; или аналогичные соединения.
Носители, которые могут применяться для получения фармацевтических композиций, содержащих соединения общей формулы (I) в качестве активных ингредиентов, включают подслащивающее вещество, связующее вещество, растворяющий агент, средства для растворения, смачивающее вещество, эмульгатор, изотонический агент, адсорбент, деградирующий агент, антиоксидант, антисептики, замасливатель, наполнитель, отдушку и т. п. ; например, такие вещества, как лактоза, декстроза, сахароза, маннит, сорбит, целлюлоза, глицин, диоксид кремния, тальк, стеариновая кислота, стеарин, стеарат магния, стеарат кальция, смешанный силикат магния и алюминия, крахмал, желатин, трагакантовая камедь, глицин, диоксид кремния, альгиновая кислота, альгинат натрия, метилцеллюлоза, натрий карбоксиметилцеллюлоза, агар, вода, этанол, полиэтиленгликоль, поливинилпирролидон, хлористый натрий, хлористый калий, апельсиновая эссенция, клубничная эссенция, ваниль или аналогичные вещества. Ежедневная дозировка соединения формулы (I) может изменяться в зависимости от возраста, пола пациента и степени заболевания. Дневная дозировка в интервале 1,0 мг - 5,000 мг может применяться от одного до нескольких раз.
Соединения общей формулы (I) в соответствии с настоящим изобретением могут быть получены по схеме I (см. в конце текста), в которой R1, R2, R3, R4, R5, R6, R7, A, X, Y и Z имеют указанные выше значения, a Lie обозначает такую уходящую группу, как атом галогена, сульфонил или аналогичные фрагменты.
Описанный выше процесс включает реакцию соединения общей формулы (а) с агентом, поставляющим -С(= Х)-группу, в среде органического растворителя с получением соединения общей формулы (b) и последующую реакцию соединения общей формулы (b) с соединением общей формулы (с) с получением соединения общей формулы (I). Используемый агент, поставляющий -С(=Х)-группу, предпочтительно выбирать из 1,1-карбонилдиимидазола, 1,1-карбонилтиодиимидазола, фосгена, тиофосгена, карбонилдифеноксида, фенилхлорформиата или аналогичных соединений. Реакцию можно проводить в среде такого общепринятого органического растворителя, как например, тетрагидрофуран, дихлорметан, хлороформ, ацетонитрил.
Кроме этого, такую реакцию предпочтительно проводить в присутствии такого сшивающего агента, как общепринятое неорганическое или органическое основание. К таким традиционным неорганическим или органическим основаниям, используемым в реакции, относятся гидрид натрия, гидрид калия, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, карбонат цезия, бикарбонат натрия, бикарбонат калия, триэтиламин, пиридин, DBU и аналогичные соединения, причем можно использовать 1-1,5 эквивалента, предпочтительно 1-1,1 эквивалента такого соединения.
Такую реакцию можно проводить в интервале температур от 3oC до точки кипения используемого растворителя, предпочтительно при 50-100oC, в течение 5-48 часов, предпочтительно 10-24 часов.
Агент, поставляющий -С(= Х)-группу, может использоваться в количестве 1-1,5 эквивалента, предпочтительно 1-1,1 эквивалента, в расчете на исходное соединение.
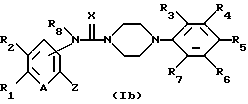
Соединение общей формулы (I), в которой Y представляет собой -NR8-, может быть получено в соответствии со схемой II (см. в конце текста), в которой R1, R2, R3, R4, R5, R6, R7, A, X, Y и Z имеют указанные выше значения.
Соединение указанной выше общей формулы (Ib) может быть с успехом получено путем введения агента, поставляющего R8, в соединение общей формулы (Ia).
Агент, поставляющий R8, предпочтительно используемый в описанной выше реакции, представляет собой C1-C8 низший алкилгалоген, C1-C8 низший алкилсульфонат, замещенный или незамещенный С3-С8 циклоалкилгалоген, арилгалоген, замещенный или незамещенный С3-С8 циклоалкилсульфонат, арилсульфонат или аналогичные соединения.
К C1-C8 низшему алкилгалогену относятся метилхлорид, метилбромид, метилиодид, этилхлорид, этилбромид, этилиодид, пропилхлорид, пропилбромид, пропилиодид, бутилхлорид, бутилбромид, бутилиодид, пентилхлорид, пентилбромид, пентилиодид, этилбромацетат или аналогичные группы.
Термин "C1-C8 низший алкилсульфонат" обозначает метилсульфонат, этилсульфонат, пропилсульфонат, бутилсульфонат, пентилсульфонат или аналогичные группы.
Термин "замещенный или незамещенный С3-С8 циклоалкилгалоген" обозначает циклопропилхлорид, циклопропилбромид, циклопропилиодид, циклобутилхлорид, циклобутилбромид, циклобутилиодид, циклопентилхлорид, циклопентилбромид, циклопентилиодид, циклогексилхлорид, циклогексилбромид, циклогексилиодид, циклопропилметилхлорид, циклопропилметилбромид, циклопропилметилиодид, циклобутилметилхлорид, циклобутилметилбромид, циклобутилметилиодид, циклопентилметилхлорид, циклопентилметилбромид, циклопентилметилиодид, циклогексилметилхлорид, циклогексилметилбромид, циклогексилметилиодид или аналогичные группы.
Арилгалоген обозначает бензилхлорид, бензилбромид, бензилиодид, бензоилхлорид, бензоилбромид, бензоилиодид, толуилхлорид, толуилбромид, толуилиодид или аналогичные группы.
Термин "замещенный или незамещенный С3-С8 циклоалкилсульфонат" обозначает циклопропилсульфонат, циклобутилсульфонат, циклопентилсульфонат, циклогексилсульфонат, метилциклопропилсульфонат, метилциклобутилсульфонат, метилциклопентилсульфонат, метилциклогексилсульфонат или аналогичные группы.
Арилсульфонат обозначает бензилсульфонат, бензоилсульфонат, толуилсульфонат или аналогичные группы.
Более конкретно соединение общей формулы (Ia) может реагировать с алкилирующим агентом или арилирующим агентом в среде растворителя при температуре 25-80oC в течение времени от 30 минут до 20 часов с образованием целевого соединения общей формулы (Ib).
Алкилирующий агент или арилирующий агент могут применяться в количестве 1,0-1,5 эквивалента.
В описанной выше реакции могут использоваться такие общепринятые органические растворители, как например, тетрагидрофуран, дихлорметан, ацетонитрил, диметилформамид.
Если в описанной выше реакции образуется какой-либо кислотный материал, то предпочтительно добавлять в качестве его акцептора любой основной материал с целью выведения кислотного материала из реакционной фазы. В качестве такого основного материала можно использовать гидроксид щелочного металла, гидроксид щелочноземельного металла, оксид щелочного металла, оксид щелочноземельного металла, карбонат щелочного металла, карбонат щелочноземельного металла, бикарбонат щелочного металла, бикарбонат щелочноземельного металла, например гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид магния, оксид магния, оксид кальция, карбонат калия, карбонат натрия, карбонат кальция, карбонат магния, бикарбонат магния, бикарбонат натрия, бикарбонат кальция или аналогичные соединения, либо органические амины.
Соединение общей формулы (а) описано в литературе (J. Med. Chem., 1992, 35, 3784, 3792) или может быть получено способом, аналогичным литературному.
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие ниже примеры, которые не ограничивают сферу изобретения.
Соединения общей формулы (I) и формулы (Ib) получены в следующих ниже примерах в соответствии с описанным выше способом: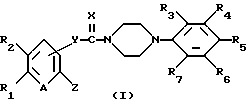
где R1, R2, R3, R4, R5, R6, R7, A, X, Y и Z имеют указанные выше значения.
ПРИМЕР 1. 1-[(5,6-Диметил-2-метоксипиридин-3-ил)аминокарбонил] -4-(2-метилтиофенил) пиперазин:
а) Фенил N-(5,6-диметил-2-метоксипиридин-3-ил)карбамат:
3-Амино-5,6-диметил-2-метоксипиридин (1,52 г, 0,01 моля) и фенилхлорформиат (1,56 г, 0,01 моля) растворяли в дихлорметане и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Смесь концентрировали при пониженном давлении для удаления растворителя. Концентрат очищали методом колоночной хроматографии (этилацетат: гексан = 1:6) с получением целевого соединения. Выход: 92%.
Спектр 1H-ЯМР (CDCl3) δ: 2.18(3H, с), 2.36(3H, с), 4.00(3H, с), 7.31(5H, м), 8.07(1H, с).
b) 1-[(5,6-Диметил-2-метоксипиридин-3-ил)аминокарбонил] - 4-(2-метилтиофенил)пиперазин:
Фенил N-(5,6-диметил-2-метоксипиридин-3-ил) карбамат (136 мг, 0,5 ммоля) и 1-(2-метилтиофенил)пиперазин (104 мг, 0,5 ммоля) растворяли в безводном тетрагидрофуране и добавляли DBU (76 мг, 0,5 ммоля). Полученную смесь перемешивали при комнатной температуре в течение 2 часов и концентрировали при пониженном давлении с целью удаления тетрагидрофурана. Концентрат очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 59%
Т.пл.: 167-169oC
Спектр 1H ЯМР (CDCl3) δ: 2.21 (3H, с), 2.43(6H, с), 3.06 (4H, т), 3.68(4H, т), 4.09(3H, с), 6.89(1H, с), 7.06(1H, м), 7.14 (3H, с), 8.26(1H, с).
ПРИМЕР 2. 1-[(5,6-Диметил-2-метоксипиридин-3-ил)аминокарбонил] -4-(2-изопропенилфенил)пиперазин:
По методике, описанной в примере 1, проводили реакцию между фенил N-[5,6-диметил-2-метоксипиридин-3-ил)карбаматом и 1-(2- изопропенилфенил)пиперазином с получением целевого соединения.
Выход: 62%
Т.пл.: 139-140oC
Спектр 1H ЯМР (CDCl3) δ: 2.20(3H, с), 2,21(6H, с), 3.10(4H,т), 3,64(4H, т), 3.84(3H, с), 5.07(1H, с), 5.13(1H, с), 6.64(1H, с), 6.98(1H, с), 7.04(3H, дд), 7.18(1H, д), 7.91(1H, с).
ПРИМЕР 3. 1-[(5,6-Диметил-2-метоксипиридин-3-ил)аминокарбонил] -4-(2, 3, 5, 6-тетраметилфенил)пиперазин:
По методике, описанной в примере 1, проводили реакцию между фенил N-(5,6-диметил-2-метоксипиридин-3-ил)карбаматом и 1-(2,3,5,6-тетраметилфенил)пиперазином с получением целевого соединения.
Выход: 71%
Т.пл.: 190-192oC
Спектр 1H ЯМР (CDCl3) δ: 2.21(15H, с), 2.42(3H, с), 3.17(4H, т), 3.61(4H, т), 4.08(3H, с), 6.84(1H, с), 6.89(1H, с), 8.26(1H, с).
ПРИМЕР 4. 1-[(5-Этил-6-метил-2-метоксипиридин-3-ил)аминокарбонил] -4- (2-метилтиофенил)пиперазин:
Тем же способом, что и в примере 1, проводили реакцию между фенил H-(5-этил-6-метил-2-метоксипиридин-3-ил)карбаматом и 1-(2-метилтиофенил)пиперазином с получением целевого соединения.
Выход: 56%
Т.пл.: 160-161 С
Спектр 1H ЯМР (CDCl3) δ: 1.19(3H, т), 2.43(3H, с), 2.50(3H, с), 2.58(2H, кв), 3.07(4H, т), 3.69(4H, т), 4.15(3H, с), 6.93(1H, с), 7.06(1H, м), 7.14(3H, м), 8.35(1H, с).
Масс-спектр (EI) m/z: вычислено для C21H28N4O2 400.1932, найдено 400,1925.
ПРИМЕР 5. 1-[(5-Этил-6-метил-2-метоксипиридин-3-ил)аминокарбонил] -4-(2-изопропенилфенил)пиперазин:
По методике, описанной в примере 1, проводили реакцию между фенил N-(5-этил-6-метил-2-метоксипиридин-3-ил)карбаматом и 1-(2- изопропенилфенил)пиперазином с получением целевого соединения.
Выход: 51%
Т.пл.: 185-187oC
Спектр 1H ЯМР (CDCl3) δ: 1.18(3H, т), 2.21(3H, с), 2.42(3H, с), 2.56(2H, кв), 3.08(4H, т), 3.62(4H, т), 4.03(3H, с), 5.08(1H, с), 5.13(1H, с), 6.90(1H, с), 7.02(3H, м), 7.18(1H, д), 8.25(1H, с).
Пример 6. 1-[(5-Этил-2-метокси-6-метилпиридин-3-ил)аминокарбонил] -4- (2, 3, 5, 6-тетраметилфенил)пиперазин:
По методике, описанной в примере 1, проводили реакцию между фенил N-(5-этил-2-метокси-6-метилпиридин-3-ил)карбаматом и 1- (2,3,5,6-тетраметилфенил)пиперазином с получением целевого соединения.
Выход: 69%
Т.пл.: 176-177oC
Спектр 1H ЯМР (CDCl3) δ: 1.19(3H, т), 2.21(12H с), 2.44 (3H, с), 2.57(2H, кв), 3.17(4H, т), 3.62(4H, т), 4.06(3H, с), 6.84(1H, с), 6.9(1H, с), 8.30(1H, с).
ПРИМЕР 7. 1-[(5-Этил-2-метокси-6-метилпиридин-3-ил)аминокарбонил] -4-(3-тиофенил)пиперазин:
По методике, описанной в примере 1, проводили реакцию между фенил N-(5-этил-2-метокси-6-метилпиридин-3-ил)карбаматом и 1-(3- тиофенил)пиперазином с получением целевого соединения.
Выход: 63%
Т.пл.: 108-110oC
Спектр 1H ЯМР (CDCl3) δ: 1.17(3H, т), 2.37(3H, с), 2.49(2H, кв), 3.28(4H, т), 3.60(4H, т), 3.98(3H, с), 6.87(4H, м), 6.98(1H, с), 8.18(1H, с).
ПРИМЕР 8. 1-[(2-Метокси-6-метил-5-пропилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N- (2-метокси-6-метил-5-пропилпиридин-3- ил)карбаматом и 1-(3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 67%
Т.пл. 82-84oC
Спектр 1H ЯМР (CDCl3) δ: 0.94(3H, т), 1.58(2H, м), 2.37(3Н, с), 2.49(2H, кв), 3.25(4H, т), 3.66(4H, т), 3.78(6H, с), 3.99(3H, с), 6.07(3H, м), 6.88(1H, с), 8.16(1H, с).
Масс-спектр (EI) m/z: вычислено для C23H32N4O1 428.2423, найдено 428.2447.
ПРИМЕР 9. 1-[(2-Метокси-6-метил-5-пропилпиридин-3-ил) аминокарбонил] -4-(3,5-диметилфенил)пиперазин:
Следуя методике, описанной в примере 1, проводили реакцию между фенил N-(2-метокси-6-метил-5-пропилпиридин-3-ил)-карбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 64%
Т.пл.: 145-146oC
Спектр 1Н ЯМР (CDCl3) δ: 0.95(3H, т), 1.59(2H, м), 2.29(6H, с), 2.41(3Н, с), 2.49(2Н, кв), 3.24(4Н, т), 3.67(4H, т), 3.98(3H, с), 6.59(3H, м), 6.89(1H, с), 8.17(1H, с).
Масс-спектр (EI) m/z: вычислено для С23H32N4О4 428,2423, найдено 428,2385.
ПРИМЕР 10. 1-[(2-Метокси-6-метил-5-пропилпиридин-3-ил) аминокарбонил] -4-(3, 5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(2-метокси-6-метил-5-пропилпиридин-3- ил)карбаматом и 1-(3,5-дифторфенил)пиперазином с получением целевого соединения.
Выход: 57%
Т.пл.: 121-123oC
Спектр 1H ЯМР (CDCl3) δ: 0.95(3H, т), 1.59(2H, м), 2.38(3H, с), 2.50(2H, кв), 3.29(3H, т), 3.66(3H, т), 4.00(3H, с), 6.28(1H, м), 6.36(2H, д), 6.87(1H, с), 8.17(1H, с).
ПРИМЕР 11. 1-[(2-Метокси-6-метил-5-пропилпиридин-3-ил) аминокарбонил]-4- (2-метоксифенил)пиперазин:
По той же методике, что описана в примере 1, проводили реакцию между фенил N-(2-метокси-6-метил-5-пропилпиридин-3- ил)карбаматом и 1-(2-метоксифенил)пиперазином с получением целевого соединения.
Выход: 71%
Т.пл.: 109-110oC
Спектр 1H ЯМР (CDCl3) δ: 0.95(3H, т), 1.59(2H, м), 2.37(3H, с), 2.49(2H, кв), 3.12(4H, т), 3.70(4H, т), 3.89(3H, с), 3.97(3H, с), 6.91(4H, м), 6.95(1H, с), 8.19(1H, с).
ПРИМЕР 12. 1-[(6-Этил-2-метокси-5-метилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Следуя методике, описанной в примере 1, проводили реакцию между фенил N-(6-этил-2-метокси-5-метилпиридин-3-ил)-карбаматом и 1-(3,5- диметоксифенил)пиперазином с получением целевого соединения.
Выход: 65%
Т.пл.: 115-116oC
Спектр 1H ЯМР (CDCl3) δ: 1.21(3H, т), 2.21(3H, c), 2.65 (2H, кв), 3.27(4H, т), 3.64(4H, т), 3.79(6H, c), 3.98(3H, c), 6.09(3H, м), 6.86(1H, c), 8.12(1H, c).
Масс-спектр (EI) m/z: вычислено для C22H30N4O4 414.2267, найдено 414.2240.
ПРИМЕР 13. 1-[(6-Этил-2-метокси-5-метилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(6-этил-2-метокси-5-метилпиридин-3-ил)-карбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 61 %
Т.пл.: 135-136oC
Спектр 1H ЯМР (CDCl3) δ: 1.22(3H, т), 2.21(3H, с), 2.29 (6H, с), 2.65(2H, кв), 3.24(4H, т), 3.66(4H, т), 3.98(3H, c), 6.59(3H, м), 6.87(1H, с), 8.12(1H, с).
Масс-спектр (EI) m/z: вычислено для C22H30N4O2 382.2368, найдено 382.2376.
ПРИМЕР 14. 1-[(6-Этил-2-метокси-5-метилпиридин-3-ил)аминокарбонил] -4- (3-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(6-этил-2-метокси-5-метилпиридин-3-ил)-карбаматом и 1-(3-гидроксифенил)пиперазином с получением целевого соединения.
Выход: 56%
Т.пл.: 168-170oC
Спектр 1H ЯМР (CDCl3) δ: 1.21(3H, т), 2.20(2H, с), 2.63(2H, т), 3.28(4H, т), 3.68(4H, т), 3.98(3H, с), 6.41(1H, д), 6.55 (1H, д), 6.84(1H, м), 6.87(1H, с), 7.13(1H, т), 8.10(1H, с).
Масс-спектр (EI) m/z: вычислено для С20H26N4O3 370.2004, найдено 370.1992.
ПРИМЕР 15. 1-[(2-Метокси-5-метил-6-пропилпиридин-3-ил) аминокарбонил]-4-(3,5-диметоксифенил) пиперазин:
По способу, описанному в примере 1, проводили реакцию между фенил N-(2-метокси-5-метил-6-пропилпиридин-3-ил)карбаматом и 1- (3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 57%
Т.пл.: 121-122oC
Спектр 1H ЯМР (CDCl3) δ: 0.96(3H, т), 1.67(2H, м), 2.21 (3H, с), 2.58(2H, т), 3.26(4H, т), 3.68(4H, т), 3.79(6H, с), 3.97 (3H, с), 6.14(3H, м), 6.89(1H, с), 8.11(1H, с).
Масс-спектр (EI) m/z: вычислено для С23H32N4O4 428.2423, найдено 428.2423.
ПРИМЕР 16. 1-[(2-Метокси-5-метил-6-пропилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
По методике, описанной в примере 1, проводили реакцию между фенил N-(2-метокси-5-метил-6-пропилпиридин-3-ил)карбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 54%
Т.пл.: 138-139oC
Спектр 1H ЯМР (CDCl3) δ: 0.96(3H, т), 1.72(2H, м), 2.21(6H, с), 2.30. (3H, с), 2.59(2H, т), 3.28(4H, т), 3.76(4H, т), 3.97(3H, с), 6.70(3H, м), 6.87(1H, с), 8.11(1H, с).
Масс-спектр (EI) m/z: вычислено для С23H32N4О2 396.2525, найдено 396.2432.
ПРИМЕР 17. 1-[(2-Метокси-5-метил-6-пропилпиридин-3-ил) аминокарбонил] -4- (3-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(2-метокси-5-метил-6-пропилпиридин-3-ил)карбаматом и 1-(3-гидроксифенил) пиперазином с получением целевого соединения.
Выход: 52%
Т.пл.: 153-155oC
Спектр 1H ЯМР (CDCl3) δ: 0.95(3H, т), 1.69(3H, м), 2.19 (3H, с), 2.59(2H, т), 3.22(4H, т), 3.68(4H, т), 3.97(3H, с), 6.42 (1H, д), 6.52(1H, д), 6.87(1H, с), 7.12(1H, т), 8.09(1H, с).
Масс-спектр (EI) m/z: вычислено для С21H28N4О3 384.2161, найдено 384.2153.
ПРИМЕР 18. 1-[N-(2-Метокси-6,7-дигидро-5H-циклопента- [b] пиридин-3-ил) аминокарбонил] -4- (3,5-диметоксифенил) пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(2-метокси-6,7-дигидро-5H-циклопента[b] пиридин-3- ил)карбаматом и 1-(3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 59%
Т.пл.: 143-144oC
Спектр 1H ЯМР (CDCl3) δ: 2.10(2H, м), 2.87(4H, м), 3.12(4H, т), 3.70(4H, т), 3.78(6H, с), 4.00(3H, с), 6.08(3H, м), 6.90(1H, с), 8.24(1H, с).
ПРИМЕР 19. 1-[N-(2-Метокси-6,7-дигидро-5H-циклопента- [b] пиридин-3-ил) аминокарбонил] -4- (3,5-диметилфенил) пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(2-метокси-6,7-дигидро-5H-циклопента-[b] пиридин-3- ил)карбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 55%
Т.пл.: 183-185oC
Спектр 1H ЯМР (CDCl3) δ: 2.28(2H, м), 2.28(6H, с), 2.87 (4H, м), 3.22(4H, т), 3.67(4H, т), 4.00(3H, с), 6.57(3H, м), 6.89 (1H, с), 8.24(1H, с).
ПРИМЕР 20. 1-[(2-Метокси-5,6,7,8-тетрагидрохинолин-3- ил) аминокарбонил] -4- (3,5-диметоксифенил)пиперазин.
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(2-метокси-5,6,7,8-тетрагидрохинолин-3-ил)карбаматом и 1-(3, 5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 54%
Т.пл.: 161-163oC
Спектр 1H ЯМР (CDCl3) δ: 1.75(2H, м), 1.84(2H, м), 2.67 (2H, т), 2.73(2H, т), 3.27(4H, т), 3.71(4H, т), 3.79(6H, с), 3.97(3H, с), 6.10(3H, м), 6.90(1H, с), 8.07(1H, с).
ПРИМЕР 21. 1-[(2-Метокси-5,6,7,8-тетрагидрохинолин-3- ил) аминокарбонил] -4- (3,5-диметилфенил)пиперазин.
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(2-метокси-5,6,7,8-тетрагидрохинолин-3-ил)карбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 51%
Т.пл.: 143-144oC
Спектр 1H ЯМР (CDCl3) δ: 1.75(2H, м), 1.84(2H, м), 2.30(6H, с), 2.68(2H, т), 2.72(2H, т), 3.26(4H, т), 3.67(4H, т), 3.97(3H, с), 6.61(3H, м), 6.91(1H, с), 8.07(1H, с).
ПРИМЕР 22. 1-[(5, 6-Диметил-2-метоксипиридин-3-ил)аминокарбонил] -4-(3,5-диметилфенил)пиперазин:
Фенил N- (5, 6-диметил-2-метоксипиридин-3-ил)тиокарбамат (200 мг, 0,7 ммоля) и 1-(3,5-диметилфенил)пиперазин (154 мг, 0,7 ммоля) растворяли в безводном тетрагидрофуране и в полученную смесь добавляли DBU (106 мг). Смесь перемешивали при комнатной температуре в течение 2 часов и концентрировали при пониженном давлении с целью удаления растворителя. Полученный концентрат очищали методом колоночной хроматографии (этилацетат:гексан = 1: 2) с получением целевого соединения.
Выход: 50%
Т.пл.: 192-193oC
Спектр 1H ЯМР (CDCl3) δ: 2.21(3H, с), 2.29(6H, с), 2.36(3H, с), 3.33(4H, т), 3.96(3H, с), 4.09(4H, т), 6.57(3H, м), 7.33(1H, с), 8.11(1H, с).
Масс-спектр (El) m/z: вычислено для C21H28N4O1S1 384.1983, найдено 384.1992.
ПРИМЕР 23. 1-[(5,6-Диметил-2-метоксипиридин-3-ил)аминотиокарбонил] -4- (3,5-дифторфенил)пиперазин:
Следуя методике, описанной в примере 22, проводили реакцию между фенил N-(5,6-диметил-2-метоксипиридин-3-ил)тиокарбаматом и 1-(3,5-дифторфенил)пиперазином с получением целевого соединения.
Выход: 47%
Т.пл.: 60-62oC
Спектр 1H ЯМР (CDCl3) δ: 2.21(3H, с), 2.36(3H, с), 3.39 (4H, т), 3.96(3H, с), 4.10(3H, т), 6.29(3H, м), 7.33(1H, с), 8.14 (1H, с).
ПРИМЕР 24. 1-[(5,6-Диметил-2-метоксипиридин-3-ил)амино- тиокарбонил] -4- (3-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 22, проводили реакцию между фенил N-(5,6-диметил-2-метоксипиридин-3-ил)тиокарбаматом и 1-(3-гидроксифенил)пиперазином с получением целевого соединения.
Выход: 43%
Т.пл.: 185-186oC
Спектр 1H ЯМР (CDCl3) δ: 2.14(3H, с), 2.36(3H, с), 3.25(4H, т), 3.89(3H, с), 4.09(4H, т), 6.30(1H, д), 6.36(2H, м), 7.03 (1H, т), 7.48(1H, с), 8.56(1H, с).
ПРИМЕР 25. 1-[(2-Метокси-6-метил-5-пропилпиридин-3-ил) аминотиокарбонил] -4- (3,5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 22, проводили реакцию между фенил N-(2-метокси-6-метил-5-пропилпиридин-3- ил)тиокарбаматом и 1-(3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 55%
Т.пл.: 143-144oC
Спектр 1H ЯМР (CDCl3) δ: 0.93(3H, т), 1.66(2H, м), 2.17(3H, с), 2.65(2H, т), 3.38(4H, т), 3.79(6H, с), 3.98(3H, с), 4.15(4H, т), 6.11(3H, м), 7.43(1H, с), 8.25(1H, с).
ПРИМЕР 26. 1-[(2-Метокси-5-метил-6-пропилпиридин-3-ил) аминотиокарбонил] -4- (3,5-диметоксифенил)пиперазин:
Следуя методике, описанной в примере 22, проводили реакцию между фенил N-(2-метокси-5-метил-6-пропилпиридин-3- ил)тиокарбаматом и 1-(3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 52%
Т.пл.: 183-184oC
Спектр 1H ЯМР (CDCl3) δ: 0.98(3H, т), 1.72(2H, м), 2.17(3H, с), 2.62(2H, т), 3.39(4H, т), 3.79(6H, с), 3.96(3H, с), 4.19(4H, т), 6.15(3H, м), 7.42(1H, с), 8.08(1H, с).
Масс-спектр (EI) m/z: вычислено для С23H32N4O3S1 444.2195, найдено 444.2171.
ПРИМЕР 27. 1-[(2-Метокси-5-метил-6-пропилпиридин-3-ил) аминотиокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 22, проводили реакцию между фенил N-(2-метокси-5-метил-6-пропилпиридин-3- ил)тиокарбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 49%
Т.пл.: 195-197oC
Спектр 1H ЯМР (CDCl3) δ: 0.98(3H, т), 1.73(2H, м), 2.18 (6H, с), 2.34(3H, с), 2.62(2H, т), 3.47(4H, т), 3.96(3H, с), 4.01 (4H, т), 6.59(3H, м), 7.02 (1H, с), 7.99(1H, с).
Масс-спектр (EI) m/z: вычислено для C23H32N4O1S1 412.2296, найдено 412.2266.
ПРИМЕР 28. 1-[(2-Метокси-5-метил-6-пропилпиридин-3-ил) аминотиокарбонил] -4- (3-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 22, проводили реакцию между фенил N-(2-метокси-5-метил-6-пропилпиридин-3- ил)тиокарбаматом и 1-(3-гидроксифенил)пиперазином с получением целевого соединения.
Выход: 48%
Т.пл.: 160-162oC
Спектр 1H ЯМР (CDCl3) δ: 0.98(3H, т), 1.72(2H, м), 2.22(3H, с), 2.61(3H, т), 3.31(4H, т), 3.95(3H, с), 4.10(4H, т), 6.45 (3H, м), 7.12(1H, т), 7.41(1H, с), 8.08(1H, с).
Масс-спектр (EI) m/z: вычислено для C21H28N4O2S1 400.1932, найдено 400.1969.
ПРИМЕР 29. 1-[N-(2-Метокси-6,7-дигидро-5Н-циклопента [b] пиридин-3-ил) аминотиокарбонил] -4- (3,5-диметоксифенил)пиперазин:
Следуя методике, описанной в примере 22, проводили реакцию между фенил N-(2-метокси-6,7-дигидро-5H-циклопента-[b] пиридин-3- ил) тиокарбаматом и 1-(3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 55%
Т.пл.: 169-170oC
Спектр 1H ЯМР (CDCl3) δ: 2.10(2H, м), 2.89(4H, м), 3.30(4H, т), 3.77(6H, с), 3.98(3H, с), 4.20(4H, т), 6.05(3H, м), 7.37(1H, с), 8.25(1H, с).
ПРИМЕР 30. 1-[N-(2-Метокси-6,7-дигидро-5H-циклопента- [b] пиридин-3-ил) аминотиокарбонил] -4- (3, 5-диметилфенил) пиперазин:
Тем же способом, что описан в примере 22, проводили реакцию между фенил N-(2-метокси-6,7-дигидро-5H-циклопента [b] пиридин-3- ил) тиокарбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 53%
Т.пл.: 159-161oC
Спектр 1H ЯМР (CDCl3) δ: 2.09(2H, м), 2.28(6H, с), 2.87(4H, м), 3.67(4H, т), 4.00(3H, с), 4.21(4H, т), 6.57(3H, м), 6.93(1H, с), 8.24(1H, с).
ПРИМЕР 31. 1-[(2-Метокси-5,6,7,8-тетрагидрохинолин-3- ил) аминотиокарбонил] -4- (3,5-диметоксифенил)пиперазин:
Следуя методике, описанной в примере 22, проводили реакцию между фенил N-(2-метокси-5,6,7,8-тетрагидрохинолин-3-ил)тиокарбаматом и 1-(3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 56%
Т.пл.: 160-161oC
Спектр 1H ЯМР(CDCl3) δ: 1.77(2H, м), 1.83(2H, м), 2.70 (2H, т), 2.76(2H, т), 3.38(4H, т), 3.79(6H, с), 3.96(3H, с), 4.16 (4H, т), 6.12(3H, м), 7.45(1H, с), 8.03(1H, с).
ПРИМЕР 32. 1-[(2-Метокси-5,6,7,8-тетрагидрохинолин-3- ил) аминотиокарбонил] -4- (3,5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 22, проводили реакцию между фенил N-(2-метокси-5,6,7,8-тетрагидрохинолин-3- ил)тиокарбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 54%
Т.пл.: 200-201oC
Спектр 1H ЯМР (CDCl3) δ: 1.77(2H, м), 1.84(2H, м), 2.34(6H, с), 2.71(3H, т), 2.75(3H, т), 3.47(4H, т), 3.97(3H, с), 4.42 (4H, т), 6.35(3H, м), 6.91(1H, с), 7.91(1H, с).
ПРИМЕР 33. 1-[(5,6-Диметил-2-метиламинопиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пипераpин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(5,6-диметил-2-метиламинопиридин-3-ил)карбаматом и 1-(3, 5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 53%
Т.пл.: 150-151oC
Спектр 1H ЯМР (CDCl3) δ: 2.29(3H, с), 2.48(3H, с), 3.29(4H, т), 3.45(3H, с), 3.77(6H, с), 3.79(4H, т), 6.10(3H, м), 7.40 (1H, с).
ПРИМЕР 34. 1-[(5,6-Диметил-2-метиламинопиридин-3-ил) аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(5,6-диметил-2-метиламинопиридин-3-ил) карбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 52%
Т.пл.: 160-162oC
Спектр 1H ЯМР (CDCl3) δ: 2.30(9H, с), 2.48(3H, с), 3.31 (4H, т), 3.46(3H, с), 3.78(4H, т), 6.60(3H, м), 7.41(1H, с).
ПРИМЕР 35. 1-[(5-Этил-6-метил-2-метиламинопиридин-3- ил) аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Следуя методике, описанной в примере 1, проводили реакцию между фенил N-(5-этил-6-метил-2-метиламинопиридин-3-ил)-карбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 56%
Т.пл.: 143-145oC
Спектр 1H ЯМР (CDCl3) δ: 1.22(3H, т), 2.28(6H, с), 2.52 (3H, с), 2.72(2H, кв), 3.29(4H, т), 3.45(3H, с), 3.78(4H, т), 6.59(3H, м), 7.41(1H, с).
ПРИМЕР 36. 1-[(2-Метиламино-6,7-дигидро-5H-циклопента [b] пиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-(2-метиламино-6,7-дигидро-5H-циклопента [b] пиридин- 3-ил) карбаматом и 1-(3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 49%
Т.пл.: 148-150oC
Спектр 1H ЯМР (CDCl3) δ: 2.09(2H, м), 2.95(4H, м), 3.30(4H, т), 3.47(3H, с), 3.77(4H, т), 3.80(6H, с), 6.10(3H, м), 7.49(1H, с).
ПРИМЕР 37. 1-[(2-Метиламино-6,7-дигидро-5H-циклопента [b] пиридин-3-ил (аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Следуя методике, описанной в примере 1, проводили реакцию между фенил N-(2-метиламино-6,7-дигидро-5H-циклопента [b]пиридин- 3-ил)карбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 48%
Т.пл.: 105-187oC
Спектр 1H ЯМР (CDCl3) δ: 2.14(2H, м), 2.29(6H, с), 2.95(4H, м), 3.32(4, т), 3.47(3H, с), 3.79(4H, т), 6.59(3H, м), 7.48 (1H, с).
ПРИМЕР 38. 1- {[5, 6-Диметил-2- (4'-трет. -бутоксикарбонил- пиперазинил) пиридин-3-ил] аминокарбонил}-4- (3, 5- диметоксифенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N- [5, 6-диметил-2- (4' -трет. -бутоксикарбонилпиперазинил) пиридин-3-ил] карбаматом и 1-(3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 58%
Т.пл.: 74-75oC
Спектр 1H ЯМР (CDCl3) δ: 1.46(9H, с), 2.20(3H, с), 2.21 (3H, с), 2.90(4H, т), 3.20(4H, т), 3.55(4H, т), 3.65(4H, т), 3.98 (3H, с), 6.02(3H, м), 8.20(1H, с).
ПРИМЕР 39. 1- {[5, 6-Диметил-2- (4'-трет. -бутоксикарбонил- пиперазинил) пиридин-3-ил] аминокарбонил}-4- (3,5-диметилфенил)пиперазин:
Следуя методике, описанной в примере 1, проводили реакцию между фенил N-[5,6-диметил-2-(4'-бутоксикарбонилпиперазинил) пиридин-3-ил] карбаматом и 1-(3, 5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 56%
Т.пл.: 155-156oC
Спектр 1H ЯМР (CDCl3) δ: 1.48(9H, с), 2.22(3H, с), 2.29 (6H, с), 2.35(3H, с), 2.95(4H, т), 3.25(4H, т), 3.57(4H, т), 3.67 (4H, т), 6.59(3H, м), 8.21(1H, с).
ПРИМЕР 40. 1-{[5-Этил-6-метил-2'-(4'-трет.-бутоксикарбонилпиперазинил) пиридин-3-ил] аминокарбонил}-4- 3,5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-[5-этил-6-метил-2-(4'-трет. -бутоксикарбонилпиперазинил) пиридин-3-ил] карбаматом и 1-(3, 5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 52%
Т.пл.: 119-120oC
Спектр 1H ЯМР (CDCl3) δ: 1.25(3H, т), 1.48(9H, с), 2.38 (3H, с), 2.51(2H, кв), 2.96(4H, т), 3.27(4H, т), 3.58(8H, м), 3.78(6H, с), 6.08(3H, м), 8.24(1H, с).
ПРИМЕР 41. 1-{ [5-Этил-6-метил-2-(4'-трет.-бутоксикарбонилпиперазинил) пиридин-3-ил] аминокарбонил}-4- (3,5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 1, проводили реакцию между фенил N-[5-этил-6-метил-2- (4' -трет. -бутоксикарбонилпиперазинил) пиридин-3-ил] карбаматом и 1-(3, 5- диметилфенил)пиперазином с получением целевого соединения.
Выход: 50%
Т.пл.: 126-128oC
Спектр 1H ЯМР (CDCl3) δ: 1.20(3H, т), 1.49(9H, с), 2.39(3H, с), 2.52(2H, кв), 2.98(4H, т), 3.23(4H, т), 3.59(8H, м), 6.59(3H, м), 7.58(1H, с), 8.26(1H, с).
ПРИМЕР 42. 1-[(5,6-Диметил-2-пиперазинилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
1- { [5, 6-Диметил-2- (4' -трет. -бутоксикарбонилпиперазинил) пиридин-3-ил] аминокарбонил}-4- (3, 5-диметоксифенил) пиперазин (0,218 г, 0,4 ммоля) растворяли в смеси дихлорметан:нитрометан = 2:1 (10 мл) и в полученную смесь медленно добавляли анизол (0,26 г, 2,4 ммоля) и хлористый алюминий (0,3 г, 2,4 ммоля). Смесь перемешивали при комнатной температуре в течение 20 минут. В смесь добавляли дистиллированную воду (50 мл) и полученную смесь подщелачивали насыщенным раствором NaHCO3 и экстрагировали дихлорметаном, затем концентрировали при пониженном давлении с целью удаления растворителя. Концентрат очищали методом колоночной хроматографии (метанол:дихлорметан = 8:1) с получением целевого соединения
Выход: 89%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.21(3H, с), 2.35(3H, с), 3.02 (4H, т), 3.34(4H, т), 3.59(4H, т), 3.62(4H, т), 3.78(6H, с), 6.08 (3H, м), 8.18(1H, с).
ПРИМЕР 43. 1-[(5,6-Диметил-2-пиперазинилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Следуя методике, описанной в примере 42, проводили реакцию с использованием 1-{[5,6-диметил-2-(4'-трет.-бутоксикарбонилпиперазинил) пиридин-3-ил] аминокарбонил} -4- (3, 5- диметилфенил)пиперазина с получением целевого соединения.
Выход: 85%
Т.пл.: 103-105oC
Спектр 1H ЯМР (CDCl3) δ: 2.16(3H, с), 2.24(6H, с), 2.40(3H, с), 3.30(4H, т), 3.44(4H, т), 3.50(4H, т), 3.81(4H, т), 6.95 (3H, м), 7.72(1H, с).
ПРИМЕР 44. 1-[(5-Этил-6-метил-2-пиперазинилпиридин-3- ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
По методике, описанной в примере 42, проводили реакцию с использованием 1-{ [5-этил-6-метил-2-(4'-трет. -бутоксикарбонилпиперазинил) пиридин-3-ил] аминокарбонил} -4- (3, 5-диметоксифенил)пиперазина с получением целевого соединения.
Выход: 88%
Т.пл.: 68-70oC
Спектр 1H ЯМР (CDCl3) δ: 1.20(3H, т), 2.40(3H, с), 2.52 (2H, кв), 2.75(4H, т), 3.32(4H, т), 3.70(8H, м), 3.78(6H, с), 6.09(3H, м), 7.68(1H, с), 8.23(1H, с).
ПРИМЕР 45. 1-[(5-Этил-6-метил-2-пиперазинилпиридин-3-ил) аминокарбонил] -4-(3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 42, проводили реакцию с использованием 1-{[5-этил-6-метил-2-(4'-трет.-бутоксикарбонилпиперазинил) пиридин-3-ил] аминокарбонил}-4- (3, 5- диметилфенил)пиперазина с получением целевого соединения.
Выход: 85%
Т.пл.: 100-102oC
Спектр 1H ЯМР (CDCl3) δ: 1.20(3H, т), 2.28(6H, с), 2.39(3H, с), 2.65(2H, кв), 2.76(4H, т), 3.00(4H, т), 3.23(4H, т), 3.70(4H, т), 6.58(3H, м), 7.66(1H, с), 8.24(1H, с).
ПРИМЕР 46. 1-[(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Фенил N- (5-ацетил-2-метокси-6-метилпиридин-3-ил)карбамат (200 мг, 0,67 ммоля) и 1-(3,5-диметоксифенил)пиперазин (150 мг, 0,67 ммоля) растворяли в безводном тетрагидрофуране (15 мл) и добавляли DBU (100 мг, 0,67 ммоля). Полученную смесь перемешивали при комнатной температуре в течение 2 часов и концентрировали при пониженном давлении с целью удаления тетрагидрофурана. Концентрат очищали методом колоночной хроматографии (этилацетат:гексан = 1: 2) с получением целевого соединения.
Выход: 83%
Т.пл.: 149-151oC
Спектр 1H ЯМР (CDCl3) δ: 2.57(3H, с), 2.65(3H, с), 3.28 (4H, т, J=4.65 Гц), 3.70(4H, т, J= 4.65 Гц), 3.79(6H, с), 4.06 (3H, с), 6.09(1H, с), 6.14(2H, д), 6.94(1H, с), 8.87(1H, с).
ПРИМЕР 47. 1-[(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4-(3, 5-диметилфенил)пиперазин:
По методике, описанной в примере 46, проводили реакцию с участием фенил N-(5-ацетил-2-метокси-6-метилпиридин-3-ил) карбамата и 1-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 82%
Т.пл.: 66-69oC
Спектр 1H ЯМР (CDCl3) δ: 2.31(6H, с), 2.57(3H, с), 2.65(3H, с), 3.08(4H, т), 3.30(4H, т), 4.10(3H, с), 6.71(2H, д), 6.94(1H, с), 8.89(1H, с).
ПРИМЕР 48. 1-[(5-Ацетил-2-метокси-6- метилпиридин-3-ил) аминокарбонил] -4- (3, 5-дифторфенил)пиперазин:
Следуя методике, описанной в примере 46, проводили реакцию между фенил N- (5-ацетил-2-метокси-6-метилпиридин-3-ил)карбаматом и 1-(3,5- дифторфенил)пиперазином с получением целевого соединения.
Выход: 77 %
Т.пл.: 180-181oC
Спектр 1H ЯМР (CDCl3) δ: 2.57(3H, с), 2.65(3H, с), 3.33 (4H, т, J=5.0 Гц), 3.74(4H, т, J=5.0 Гц), 4.07(3H, с), 6.37 (1H, с), 6.46(2H, д), 6.93(1H, с), 8.85(1H, с).
ПРИМЕР 49. 1-[(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (3, 5-дихлорфенил)пиперазин:
Тем же способом, что описан в примере 46, проводили реакцию между фенил N-(5-ацетил-2-метокси-6-метилпиридин-3-ил)карбаматом и 1-(3, 5-дихлорфенил)пиперазином с получением целевого соединения.
Выход: 81%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.57(3H, с), 2.65(3H, с), 3.34(4H, т), 3.78(4H, т), 4.04(3H, с), 6.93(3H, м), 8.80(1H, с).
ПРИМЕР 50. 1-[(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (2, 3-диметилфенил)пиперазин:
Следуя методике, описанной в примере 46, проводили реакцию между фенил N- (5-ацетил-2-метокси-6-метилпиридин-3-ил)карбаматом и 1-(2, 3-диметилфенил)пиперазином с получением целевого соединения.
Выход: 81%
Т.пл.: 173-174oC
Спектр 1H ЯМР (CDCl3) δ: 2,29(6H, с), 2.58(3H, с), 2.65(3H, с), 2.98(4H, т), 3.70(4H, т), 4.06(3H, с), 6.91(1H, д), 6.97(1H, с), 7.10(1H, т), 8.89(1H, с).
ПРИМЕР 51. 1-[(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (2-метоксифенил)пиперазин:
Тем же способом, что описан в примере 46, проводили реакцию между фенил N-(5-ацетил-2-метокси-6-метилпиридин-3-ил)карбаматом и 1-(2-метоксифенил)пиперазином с получением целевого соединения.
Выход: 79%
Т.пл.: 153-154oC
Спектр 1H ЯМР (CDCl3) δ: 2.58(3H, с), 2.65(3H, с), 3.15 (4H, т), 3.73(4H, т), 3.90(3H, с), 4.06(3H, с), 6.91(1H, д), 6.96 (1H, д), 6.97(1H, с), 7.10(1H, т), 8.89(1H, с).
ПРИМЕР 52. 1-[(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (3-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 46, проводили реакцию между фенил N-(5-ацетил-2-метокси-6-метилпиридин-3-ил)карбаматом и 1-(3-гидроксифенил)пиперазином с получением целевого соединения.
Выход: 76%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.60(3H, с), 2.72(3H, с), 3.34 (4H, т), 3.79(4H, т), 3.98(3H, с), 6.45(3H, м), 6.98(1H, м), 8.97 (1H, с).
ПРИМЕР 53. 1-[(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминотиокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
По методике, описанной в примере 22, проводили реакцию между фенил N-(5-ацетил-2-метокси-6-метилпиридин-3-ил)тиокарбаматом и 1-(3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 77%
Т.пл.: 167-169oC
Спектр 1H ЯМР (CDCl3) δ: 2.58(3H, с), 2.68(3H, с), 3.47(4H, т), 3.81(6H, с), 4.05(3H, с), 4.36(4H, т), 6.42(3H, м), 7.49(1H, с), 9.05(1H, с).
ПРИМЕР 54. 1-[(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминотиокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 22, проводили реакцию между фенил N-(5-ацетил-2-метокси-6-метилпиридин-3- ил)тиокарбаматом и 1-(3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 75%
Т.пл.: 176-177oC
Спектр 1H ЯМР (CDCl3) δ: 2.34(6H, с), 2.58(3H, с), 2.68(3H, с), 3.48(4H, т), 4.06(3H, с), 4.43(4H, т), 7.05(3H, м), 7.52(1H, с), 9.04 (1H, с).
ПРИМЕР 55. 1-[(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминотиокарбонил] -4- (3-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 22, проводили реакцию между фенил N-(5-ацетил-2-метокси-6-метилпиридин-3- ил)тиокарбаматом и 1-(3-гидроксифенил)пиперазином с получением целевого соединения.
Выход: 71%
Т.пл.: 114-115oC
Спектр 1H ЯМР (CDCl3) δ: 2.56(3H, с), 2.75(3H, с), 3.68(4H, т), 4.05(3H, с), 4.45(4H, т), 7.30(4H, м), 9.03(1H, с).
Масс-спектр (EI) m/z: вычислено для C23H30N4O4S1 458.1987, найдено 458.2527.
ПРИМЕР 56. 1-{[5-(1-Гидроксиэтил)-2-метокси-6-метилпиридин- 3-ил] аминокарбонил}-4- (3, 5-диметоксифенил)пиперазин:
1- [(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] - 4-(3,5-диметоксифенил)пиперазин (100 мг, 0,23 ммоля) растворяли в безводном этаноле (15 мл) и добавляли NaBH4 (8,66 мг). Реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Смесь концентрировали при пониженном давлении с целью удаления этанола и очищали методом колоночной хроматографии (этилацетат:гексан = 2:1) с получением целевого соединения.
Выход: 97%
Т.пл.: 124-126oC
Спектр 1H ЯМР (CDCl3) δ: 1.48(3H, д), 2.42(3H, с), 3.27 (4H, т), 3.69(4H, т), 3.79(6H, с), 3.99(3H, с), 5.03(1H, кв), 6.09(1H, с), 6.15(2H, д), 6.90(1H, с), 8.46(1H, с).
Масс-спектр (EI) m/z: вычислено для С22H30N4O5 430.2216, найдено 430.2265.
ПРИМЕР 57. 1{[5-(1-Гидроксиэтил)-2-метокси-6-метилпиридин- 3-ил] аминокарбонил}-4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 56, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил)аминокарбонил] -4-(3, 5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 95%
Т.пл.: 153-154oC
Спектр 1H ЯМР (CDCl3) δ: 1.48(3H, д), 2.30(6H, с), 2.42(3H, с), 3.26(4H, т), 3.68(4H, т), 3.99(3H, с), 5.05(1H, кв), 6.71(2H, д), 6.96(1H, с), 8.46(1H, с).
Масс-спектр (EI) m/z: вычислено для C22H30N4O3 398.2317, найдено 398.2343.
ПРИМЕР 58. 1-{[5-(1-Гидроксиэтил)-2-метокси-6-метилпиридин- 3-ил] аминокарбонил}-4- (2, 3-диметилфенил)пиперазин:
По той же методике, что описана в примере 56, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3- ил) аминокарбонил] -4- (2, 3-диметилфенил)пиперазина с получением целевого соединения.
Выход: 96%
Т.пл.: 100-102oC
Спектр 1H ЯМР (CDCl3) δ: 1.47(3H, д), 1.59 (3H, с), 2.25(3H, c), 2.28(3H, c), 2.43(3H, c), 2.93(4H, т), 3.66(4H, т), 3.99(3H, с), 5.05(1H, кв), 6.93(3H, м), 7.11(1H, м), 8.48(1H, с).
ПРИМЕР 59. 1-{ [5-(1-Гидpoкcиэтил)-2-мeтoкcи-6-мeтилпиридин-3-ил] аминокарбонил}-4- (3,5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 56, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3- ил)аминокарбонил] -4-(3,5-дифторфенил)пиперазина с получением целевого соединения.
Выход: 97%
Т.пл.: 184-186oC
Спектр 1H ЯМР (CDCl3) δ: 1.48(3H, д), 2.50(3H, с), 3.30(4H, т), 3.70(4H, т), 4.11(3H, с), 5.06(1Н, кв), 6.33(1Н, с), 6.42(2Н, д), 6.92(1Н, с), 8.54(1Н, с).
ПРИМЕР 60. 1-{[5-(1-Гидроксиэтил)-2-метокси-6-метилпиридин- 3-ил] аминокарбонил}-4- (3, 5-дихлорфенил)пиперазин:
Тем же способом, что описан в примере 56, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (3, 5-дихлорфенил) пиперазина с получением целевого соединения:
Выход: 95%
Т.пл.: 197-200oC
Спектр 1H ЯМР (CDCl3) δ: 1.46(3H, д), 2.41(3H, с), 3.28(4H, т), 3.66(4H, т), 3.96(3H, с), 5.20(1H, кв), 7.02(1H, м), 8.42 (1H, с).
ПРИМЕР 61. 1-{[5-(1-Гидроксиэтил)-2-метокси-6-метил- пиридин- 3-ил] аминокарбонил}-4- (2-метоксифенил)пиперазин:
Тем же способом, что описан в примере 56, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил]-4-(2-метоксифенил)пиперазина с получением целевого соединения.
Выход: 97%
Т.пл.: 88-90oC
Спектр 1H ЯМР (CDCl3) δ: 1.47(3H, д), 2.42(3H, с), 3.11(4H, т), 3.70(4H, т), 3.89(3H, с), 3.99(3H, с), 5.03(1H, кв), 6.89(3H, м), 6.94(1H, с), 7.05(1H, м), 8.48(1H, с).
ПРИМЕР 62. 1-{[5-(1-Гидроксиэтил)-2-метокси-6-метилпиридин-3-ил] аминокарбонил}-4- (3-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 56, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (3-гидроксифенил) пиперазина с получением целевого соединения.
Выход: 87%
Т.пл.: 194-196oC
Спектр 1H ЯМР (CDCl3) δ: 1.47(3H, д), 2.41(3H, с), 3.27(4H, т), 3.79(4H, т), 3.98(3H, с), 5.04(1H, кв), 6.57(3H, м), 6.90(1H, с), 7.13(1H, т), 8.41(1H, с).
ПРИМЕР 63. 1-{[5-(1-Гидроксиэтил)-2-метокси-6-метилпиридин- 3-ил]аминотиокарбонил}-4- (3,5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 56, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминотиокарбонил] -4- (3, 5-диметоксифенил)пиперазина с получением целевого соединения.
Выход: 89%
Т.пл.: 189-190oC
Спектр 1H ЯМР (CDCl3) δ: 1.47(3H, д), 2.43(3H, с), 3.35(4H, т), 3.78(6H, с), 3.97(3H, с), 4.09(4H, т), 5.05(1H, кв), 6.07(3H, м), 7.35(1H, с), 8.42(1H, с).
ПРИМЕР 64. 1-([5-(1-Гидроксиэтил)-2-метокси-6-метилпиридин- 3-ил] аминотиокарбонил}-4- (3, 5-диметилфенил) пиперазин:
Тем же способом, что описан в примере 56, с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминотиокарбонил] -4- (3, 5-диметилфенил)пиперазина проводили реакцию с получением целевого соединения.
Выход: 88%
Т.пл.: 170-172oC
Спектр 1H ЯМР (CDCl3) δ: 1.46(3H, д), 2.29(6H, с), 2.43(3H, с), 3.43(4H, т), 3.97(3H, с), 4.10(4H, т), 5.06(1H, кв), 6.60(3H, м), 7.37(1H, с), 8.40(1H, с).
ПРИМЕР 65. 1-{[5-(1-Гидрокси-1-метилэтил)-2-метокси-6- метилпиридин-3-ил] аминокарбонил}-4- (3, 5-диметоксифенил) пиперазин:
1- [(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил]- 4-(3, 5-диметоксифенил)пиперазин (214 мг, 0,50 ммоля) растворяли в тетрагидрофуране (10 мл) и медленно добавляли CH3MgBr (0,50 мл, 1,50 ммоля). Полученный в результате раствор нагревали с обратным холодильником в течение 15 часов и концентрировали при пониженном давлении с целью удаления растворителя, после чего раствор экстрагировали этилацетатом, сушили и отфильтровывали. Полученное в результате вещество очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 84 %
Т.пл.: 146-148oC
Спектр 1H ЯМР (CDCl3) δ: 1.64(6H, с), 2.64(3H, с), 3.25(4H, т), 3.67(4H, т), 3.78(6H, с), 3.99(3H, с), 6.07(3H, м), 6.86 (1H, с), 8.47(1H, с).
ПРИМЕР 66. 1-{[5-(1-Гидрокси-1-метилэтил)-2-метокси-6- метилпиридин-3-ил] аминокарбонил}-4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 65, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4-(3, 5-диметилфенил) пиперазина с получением целевого соединения.
Выход: 81%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.64(6H, с), 2.29(6H, с), 2.65(3H, с), 3.24(4H, т), 3.67(4H, т), 3.99(3H, с), 6.59(3H, м), 7.05(1H, с), 8.48(1H, с).
ПРИМЕР 67. 1-{ [5-(1-Гидрокси-1-метилпропил)-2-метокси- 6- метилпиридин-3-ил] аминокарбонил}-4- (3,5- диметоксифенил) пиперазин:
1- [(5-Ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4-(3, 5-диметоксифенил)пиперазин (214 мг, 0,50 ммоля) растворяли в тетрагидрофуране (10 мл) и медленно добавляли C2H5MgBr (0,50 мг, 1,50 ммоля). Полученный раствор нагревали с обратным холодильником в течение 15 часов и концентрировали при пониженном давлении с целью удаления растворителя и экстрагировали этилацетатом, сушили и фильтровали. Полученное в результате вещество очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 76%
Т.пл.: 127-129oC
Спектр 1H ЯМР (CDCl3) δ: 0.83(3H, т), 1.63(3H, с), 1.94 (2H, м), 2.61(3H, с), 3.26(4H, т), 3.68(4H, т), 3.79(6H, с), 3.99 (3H, с), 6.08(3H, м), 6.86(1H, с), 8.44(1H, с).
ПРИМЕР 68. 1-{ [5-(1-Гидрокси-1-метилпропил)-2-метокси- 6- метилпиридин-3-ил] аминокарбонил} 1-4- (3, 5- диметилфенил) пиперазин:
Тем же способом, что описан в примере 67, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 74%
Т.пл.: 164-165oC
Спектр 1H ЯМР (CDCl3) δ: 0.83(3H, т), 1.60(3H, с), 1.95(2H, м), 2.29(6H, с), 2.61(3H, с), 3.23(4H, т), 3.67(4H, т), 3.99(3H, с), 6.59(3H, м), 6.87(2H, с), 8.45(1H, с).
ПРИМЕР 69. 1- [5- ({[4- (3, 5-диметоксифенил)пиперазино] карбонил}амино)-6-метокси-2-метилпиридин-3-ил]этил этантиоат:
Трифенилфосфин (262 мг, 1,0 ммоля) растворяли в тетрагидрофуране (15 мл) и добавляли диэтилазодикарбоксилат (157 мкг, 1,0 ммоля), после чего полученную смесь перемешивали при 0oC в течение 30 минут.
1-{ [5-(1-Гидроксиэтил)-2-метокси-6-метилпиридин- 3-ил] аминокарбонил}-4-(3,5-диметоксифенил)пиперазин (213 мг, 0,5 ммоля) и тиоуксусную кислоту (72 мкл, 1,0 ммоля) растворяли в тетрагидрофуране и полученную смесь добавляли в приготовленный выше раствор. Смешанный раствор перемешивали при 0oC в течение 1 часа и в течение 1 часа при комнатной температуре, затем концентрировали при пониженном давлении с целью удаления растворителя. Полученный концентрат очищали методом колоночной хроматографии (этилацетат: гексан = 1:2) с получением целевого соединения.
Выход: 62%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.55(3H, д), 2.20(3H, с), 2.39(3H, с), 3.15(4H, т), 3.57(4H, т), 3.69(6H, с), 3.90(3H, с), 4.74 (1H, кв), 6.01(3H, м), 6.89(1H, с), 8.33(1H, с).
ПРИМЕР 70. 1-[5-({[4- (3,5-Диметилфенил)пиперазино]карбонил}амино) -6-метокси-2- метилпиридин-3-ил]этил этантиоат:
По методике, описанной в примере 69, проводили реакцию с использованием 1-{[5-(1- гидроксиэтил)-2-метокси-6-метилпиридин-3-ил] аминокарбонил}-4- (3, 5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 60%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.60(3H, д), 2.26(6H, с), 2.52 (3H, с), 3.20(4H, т), 3.64(4H, т), 3.96(3H, с), 4.80(1H, кв), 6.56(3H, м), 6.91(1H, с), 8.38 (1H, с).
ПРИМЕР 71. 1-{[2-Метокси-6-метил-5-(1-сульфанилметил)] аминокарбонил}-4- (3,5-диметоксифенил)пиперазин:
1-[5-({ [4-(3, 5-Диметоксифенил) пиперазино] карбонил}амино) -6-метокси-2-метилпиридин-3-ил]этил этантиоат (180 мг, 0,37 ммоля) растворяли в тетрагидрофуране (15 мл) и добавляли LiAlH4 (15 мг, 0,4 ммоля), после чего полученную смесь перемешивали при 0oC в течение 20 минут. В полученный раствор добавляли 2N-HCl. Смесь концентрировали при пониженном давлении с целью удаления растворителя и экстрагировали дихлорметаном, сушили и фильтровали. Полученное в результате вещество концентрировали при пониженном давлении и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 88%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.42(3H, д), 2.39(3H, с), 3.25(4H, т), 3.66(4H, т), 3.76(6H, с), 3.96(3H, с), 5.02(1H, кв), 6.17(3H, м), 6.87(1H, с), 8.41(1H, с).
ПРИМЕР 72. 1-{[2-Метокси-6-метил-5-(1-сульфанилметил)] аминокарбонил}-4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 71, проводили реакцию с использованием 1-[5-({[4-(3,5-диметилфенил)пиперазино] карбонил}амино) -6-метокси-2-метилпиридин-3-ил]этил этантиоата с получением целевого соединения.
Выход: 87%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.43(3H, д), 2.28(6H, с), 2.40(3H, с), 3.25(4H, т), 3.72(4H, т), 5.03(1H, кв), 6.64(3H, м), 6.88(1H, с), 8.42(1H, с).
ПРИМЕР 73. 1-[(2-Метокси-6-метил-5-винилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
1-{[5-(1-Гидроксиэтил) -2-метокси-6-метилпиридин-3-ил]
аминокарбонил} -4-(3,5-диметоксифенил)пиперазин растворяли в хлороформе (15 мл) и добавляли п-толуолсульфонат пиридиния (60 мг, 0,23 ммоля), после чего смешанный раствор нагревали с обратным холодильником в течение 16 часов. Полученный раствор концентрировали при пониженном давлении с целью удаления хлороформа и очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 93%
Т.пл.: 140-141oC
Спектр 1H ЯМР (CDCl3) δ: 2.43(3H, с), 3.27(4H, т), 3.69(4H, т), 3.79(6H, с), 4.00(3H, с), 5.25(1H, д), 5.65(1H, д), 6.08(1H, с), 6.13(2H, д), 6.82(1H, д), 6.91(1H, с), 8.53(1H, с).
Масс-спектр (EI) m/z: вычислено для C22H28N4O4 412.2110, найдено 412.2119.
ПРИМЕР 74. 1-[(2-Метокси-6-метил-5-винилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 73, проводили реакцию с использованием 1-{[5-(1-гидроксиэтил)-2-метокси-6-метилпиридин- 3-ил] аминокарбонил} -4- (3, 5-диметилфенил) пиперазина с получением целевого соединения.
Выход: 94%.
Т.пл.: 131-132oC
Спектр 1H ЯМР (CDCl3) δ: 1.57(3H, с), 2.31(6H, с), 2.43(1H, с), 3.25(4H, т), 3.68(4H, т), 4.00(3H, с), 5.25(1H, д), 5.65(1H, д), 6.60(3H, м), 6.82(1H, дд), 6.92(1H, с), 8.53(1H, с).
Масс-спектр (EI) m/z: вычислено для C22H28N4O2 380.2212, найдено 380.2236.
ПРИМЕР 75. 1-[(2-Метокси-6-метил-5-винилпиридин-3-ил) аминокарбонил] -4- (3, 5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 73, проводили реакцию с использованием 1-{ [5-(1-гидроксиэтил)-2-метокси-6-метилпиридин- 3-ил] аминокарбонил}-4- (3, 5-дифторфенил) пиперазина с получением целевого соединения.
Выход: 93%
Т.пл.: 160-161oC
Спектр 1H ЯМР (CDCl3) δ: 2.44(3H, с), 3.30(4H, т, J=5.5 Гц), 3.68(4H, т, J=5.5 Гц), 4.01(3H, с), 5.26(1H, д), 5.65 (1H, д), 6.30(1H, с), 6.39(2H, д), 6.81(1H, дд), 8.53(1H, с).
Масс-спектр (EI) m/z: вычислено для С22H28N4O4 412.2110, найдено 412.2102.
ПРИМЕР 76. 1-[(5-Изопропенил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
В соответствии с методикой, описанной в примере 73, проводили реакцию с использованием 1-{[5-(1-гидрокси-1-метилэтил) -2-метокси-6-метилпиридин-3-ил] аминокарбонил} -4-(3,5-диметоксифенил)пиперазина с получением целевого соединения.
Выход: 96%
Т.пл.: 83-85oC
Спектр 1H ЯМР (CDCl3) δ: 2.01(3H, с), 2.38(3H, с), 3.25 (4H, т), 3.66(4H, т), 3.78(6H, с), 3.99(3H, с), 4.86(1H, с), 5.30 (1H, с), 6.11(3H, м), 6.90(1H, с), 8.18(1H, с).
ПРИМЕР 77. 1-[(5-Изопропенил-2-метокси-6-метилфенил-3-ил) аминокарбонил] -4-(3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 73, с использованием 1-{[5-(1-гидрокси-1-метилэтил)-2-метокси-6-метилпиридин-3-ил] аминокарбонил} -4- (3, 5-диметилфенил) пиперазина проводили реакцию с получением целевого соединения.
Выход: 93%
Т.пл.: 140-142oC
Спектр 1H ЯМР (CDCl3) δ: 2.01(3H, с), 2.29(6H, с), 2.28(3H, с), 3.23(4H, т), 3.66(4H, т), 3.99(3H, с), 4.86(1H, с), 5.18 (1H, с), 6.59(3H, м), 6.91(1H, с), 8.18(1H, с).
ПРИМЕР 78. Этил 2-{1-[5-({[4-(3,5-диметоксифенил)пиперазино] карбонил} амино) -6-метокси-2-метилпиридин-3-ил] этокси} ацетат:
1-{[5- (1-Гидрокси) -2-метокси-6-метилпиридин-3-ил] аминокарбонил}-4-(3, 5-диметоксифенил)пиперазин (0,5 ммоля) растворяли в диметилформамиде (15 мл) и к смеси добавляли NaH (18,5 мг, 0,5 ммоля), после чего полученный раствор перемешивали при комнатной температуре в течение 15 минут. К полученной смеси добавляли этилбромацетат (83,5 мг, 0,5 ммоля) и смесь перемешивали при комнатной температуре в течение 3 часов. Полученную смесь концентрировали при пониженном давлении с целью удаления растворителя и очищали методом колоночной хроматографии (этилацетат: гексан = 1:2) с получением целевого соединения.
Выход: 89%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.25(3H, т), 1.34(3H, д), 2.42(3H, с), 3.00(4H, т), 3.29(4H, т), 3.74(6H, с), 3.97(3H, с), 4.16 (4H, с), 4.53(1H, кв), 6.03(3H, м), 7.58(1H, с).
ПРИМЕР 79. 4-{1-[5-({[4-(3,5-диметоксифенил)пиперазино] карбонил}амино) -6-метокси-2-метилпиридин-3-ил] этокси}-4- оксобутановая кислота:
1-{ [5- (1-Гидроксиэтил) -2-метокси-6-метилпиридин-3-ил] аминокарбонил} -4-(3,5-диметоксифенил)пиперазин (107 мг, 0,25 ммоля) и диметиламинопиридин (3 мг, 0,025 ммоля) растворяли в пиридине и добавляли безводную янтарную кислоту (50 мг, 0,5 ммоля). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. В полученную смесь добавляли дистиллированную воду. Раствор экстрагировали CH2Cl2 и органическую фару промывали IN-HCl и затем концентрировали при пониженном давлении с целью удаления растворителя. Концентрат очищали методом колоночной хроматографии (дихлорметан:метанол = 20:1) с получением целевого соединения.
Выход: 78%
Т.пл.: 158-160oC
Спектр 1H ЯМР (CDCl3) δ: 1.42(3H, д), 2.43(3H, с), 2.61(4H, м), 3.24(4H, т), 3.66(4H, т), 3.76(6H, с), 3.95(3H, с), 5.94(1H, кв.), 6.04(3H, м), 6.89(1H, с), 8.13(1H, с).
ПРИМЕР 80. 4-{1-[5-({[4-(3, 5-диметилфенил)пиперазино] карбонил}амино) -6-метокси-2-метилпиридин-3-ил] этокси}-4- оксобутановая кислота:
Тем же способом, что описан в примере 79, с использованием 1-([5-(1-гидроксиэтил)-2-метокси-6-метилпиридин-3-ил] аминокарбонил} -4- (3, 5-диметилфенил) пиперазина проводили реакцию с получением целевого соединения.
Выход: 76%
Т.пл.: 138-140oC
Спектр 1H ЯМР (CDCl3) δ: 1.43(3H, д), 2.27(6H, с), 2.55(3H, с), 2.65(4H, м), 3.24(4H, т), 3.69(4H, т), 3.95(3H, с), 5.95 (1H, кв), 6.60(3H, м), 6.88(1H, с), 8.11(1H, с).
ПРИМЕР 81. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (3,5- диметоксифенил)пиперазин:
а) Фенил N-(2-метоксихинолин-3-ил)карбамат:
3-Амино-2-метоксихинолин (4 г, 23 ммоля) и фенилхлорформиат (4,04 г, 25 ммолей) растворяли в дихлорметане и перемешивали при комнатной температуре в течение 2 часов. Полученную смесь концентрировали при пониженном давлении с целью удаления дихлорметана и очищали методом колоночной хроматографии (гексан:эфир = 8:1) с получением целевого соединения.
Выход: 75%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 4.01(3H, с), 7.30(5H, с), 7.41(1H, т), 7.70(1H, д), 7.71(1H, д), 8.71(1H, с).
b) 1-[(2-метоксихинолин-3-ил)аминокарбонил] -4-(3,5-диметоксифенил)пиперазин:
Фенил N-(2-метоксихинолин-3-ил)карбамат (148 мг, 0,5 ммоля) и 1- (3,5-диметоксифенил)пиперазин (112 мг, 0,5 ммоля) растворяли в безводном тетрагидрофуране и добавляли DBU (117 мг, 0,75 ммоля). Полученный раствор перемешивали при комнатной температуре в течение 2 часов. Смесь концентрировали при пониженном давлении с целью удаления тетрагидрофурана и очищали методом колоночной хроматографии (гексан:эфир = 5:1) с получением целевого соединения.
Выход: 81%
Т.пл.: 200-201oC
Спектр 1H ЯМР (CDCl3) δ: 3.31(4H, т, J=5.0 Гц), 3.74(4H, т), 3.79(6H, с), 4.17(3H, с), 6.09(1H, с), 6.17(2H, с), 7.35 (1H, т), 7.49(1H, т), 7.71(1H, д), 7.78(1H, д), 8.78(1H, с).
Масс-спектр (EI) m/z: вычислено для С23H26N4О4 422.1954, найдено 422.1952.
ПРИМЕР 82. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (3,5- диметилфенил) пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(3,5- диметилфенил)пиперазином с получением целевого соединения.
Выход: 79%
Т.пл.: 143-145oC
Спектр 1H ЯМР (CDCl3) δ: 2.30(6H, с), 3.29(4H, т), 3.80 (4H, т), 4.18(3H, с), 6.62(3H, м), 7.36(1H, т), 7.49(1H, т), 7.71 (1H, д), 7.78(1H, д), 8.79(1H, с).
Масс-спектр (EI) m/z: вычислено для C23H26N4O2 390.2055, найдено 390.2066.
ПРИМЕР 83. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (2,3- диметилфенил) пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(2,3- диметилфенил)пиперазином с получением целевого соединения.
Выход: 83%
Т.пл.: 174-175oC
Спектр 1H ЯМР (CDCl3) δ: 2.20(3H, с), 2.39(3H, с), 3.28(4H, т), 3.69(4H, т), 3.93(3H, с), 5.98(1H, с), 6.30(1H, т), 6.37 (1H, с), 6.39(1H, с), 6.63(1H, с).
ПРИМЕР 84. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (3,5- дифторфенил) пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(3,5- дифторфенил)пиперазином с получением целевого соединения.
Выход: 78%
Т.пл.: 158-159oC
Спектр 1H ЯМР (CDCl3) δ: 3.32(4H, т, J=5.0 Гц), 3.72(4H, т, J=5.0 Гц), 4.19(3H, с), 6.29(1H, с), 6.39(2H, д), 7.36 (1H, т), 7.50(1H, т), 7.71(1H, д), 7.81(1H, д), 8.78(1H, с).
ПРИМЕР 85. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (3,5- дихлорфенил) пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(3,5- дихлорфенил)пиперазином с получением целевого соединения.
Выход: 56%
Т.пл.: 156-158oC
Спектр 1H ЯМР (CDCl3) δ: 3.33(4H, т), 3.73(4H, т), 4.21(3H, с), 6.79(1H, с), 6.83(1H, д), 6.93(1H, т), 7.26(1H, т), 7.38 (1H, т), 7.52(1H, т), 7.71(1H, д), 7.83(1H, д).
Масс-спектр (EI) m/z: вычислено для C21H20N4O2Cl 430.0963, найдено 430.0977.
ПРИМЕР 86. 1-[(2-Метоксихинолин-3-ил)аминокарбонил] -4- (2- фторфенил)пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(2- фторфенил)пиперазином с получением целевого соединения.
Выход: 81%
Т.пл.: 156-158oC
Спектр 1H ЯМР (CDCl3) δ: 3.18(4H, т), 3.74(4H, т), 4.18 (3H, с), 6.99(2H, кв), 7.07(2H, м), 7.35(2H, м), 7.50(1H, т), 7.70(1H, д), 7.77(1H, д).
ПРИМЕР 87. 1-([2-Метоксихинолин-3-ил)аминокарбонил] -4- (2- хлорфенил)пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(2- хлорфенил)пиперазином с получением целевого соединения.
Выход: 78%
Т.пл.: 79-80oC
Спектр 1H ЯМР (CDCl3) δ: 3.32(4H, т), 3.74(4H, т), 4.20(3H, с), 6.82(2H, кв), 6.94(2H, м), 7.34(2H, м), 7.48(1H, д), 7.70(1H, д), 7.78(1H, д).
ПРИМЕР 88. 1-[(2-Метоксихинолин-3-ил)аминокарбонил] -4- (3- хлорфенил)пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(3- хлорфенил)пиперазином с получением целевого соединения.
Выход: 73%
Т.пл.: 97-98oC
Спектр 1H ЯМР (CDCl3) δ: 3.31(4H, т), 3.73(4H, т), 4.18(3H, с), 6.82(1H, д), 6.87(1H, д), 6.92(1H, с), 7.21(1H, т), 7.32 (1H, с), 7.37(1H, т), 7.51(1H, т), 7.70(1H, д), 7.78(1H, д), 8.80 (1H, с).
ПРИМЕР 89. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (3- гидроксифенил) пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N- (2-метоксихинолин-3-ил) карбаматом и 1-(3- гидроксифенил)пиперазином с получением целевого соединения.
Выход: 75%
Т.пл.: 190-191oC
Спектр 1H ЯМР (CDCl3) δ: 3.33(4H, т), 3.80(4H, т), 4.19(3H, с), 6.47(1H, с), 6.62(2H, с), 7.16(1H, т), 7.32(1H, с), 7.37 (1H, т), 7.51(1H, т), 7.72(1H, д), 7.78(1H, д), 8.78(1H, с).
ПРИМЕР 90. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (2- метоксифенил) пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(2- метоксифенил)пиперазином с получением целевого соединения.
Выход: 88%
Т.пл. 159-161oC
Спектр 1H ЯМР (CDCl3) δ: 3.28(4H, т), 3.71(4H, т), 3.81(3H, с), 4.18(3H, с), 6.52(2H, с), 6.62(1H, с), 7.23(1H, т), 7.31-7.53(3H, м), 7.72(2H, м), 8.81(1H, с).
ПРИМЕР 91. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (2- метилтиофенил) пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(2- метилтиофенил)пиперазином с получением целевого соединения.
Выход: 78%
Т.пл.: 147-149oC
Спектр 1H ЯМР (CDCl3) δ: 2.44(3H, с), 3.07(4H, т), 3.75(4H, т), 4.18(3H, с), 7.13(3H, м), 7.18(1H, д), 7.39(2H, м), 7.70 (3H, м), 8.81(1H, с).
ПРИМЕР 92. 1- [(2-Метоксихинолин-3-ил) аминокарбонил] -4- (3- изопропоксифенил)пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(3- изопропоксифенил)пиперазином с получением целевого соединения.
Выход: 93%
Т.пл.: 111-113oC
Спектр 1H ЯМР (CDCl3>) δ: 1.34(6H, д), 3.30(4H, т), 3.74(4H, т), 4.18(3H, с), 4.55(1H, м), 6.49(2H, с), 7.05(1H, с), 7.20 (1H, т), 7.32(1H, с), 7.37(1H, т), 7.50(1H, т), 7.70(1H, д), 7.77 (1H, д), 8.80(1H, с).
ПРИМЕР 93. 1-[(2-Метоксихинолин-3-ил)аминокарбонил] -4- (3- циклопропилметоксифенил)пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(3- циклопропилметоксифенил)пиперазином с получением целевого соединения.
Выход: 90%
Т.пл.: 146-147oC
Спектр 1H ЯМР (CDCl3) δ: 0.36(2H, т), 0.65(2H, м), 1.28(1H, м), 3.31(4H, т), 3.75(4H, т), 3.80(2H, д), 4.18(3H, с), 6.50 (1H, с), 6.60(1H, с), 7.19(1H, т), 7.32(1H, с), 7.37(1H, т), 7.50 (1H, т), 7.70(1H, д), 7.77(1H, д), 8.79(1H, с).
ПРИМЕР 94. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (2- метокси-5-метилфенил)пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(2-метокси-5- метилфенил)пиперазином с получением целевого соединения.
Выход: 76%
Т.пл.: 115-116oC
Спектр 1H ЯМР (CDCl3) δ: 2.30(3H, с), 3.14(4H, т), 3.75 (4H, т), 3.87(3H, с), 4.18(3H, с), 6.79(2H, м), 6.84(1H, д), 7.35 (2H, м), 7.50(1H, т), 7.72(1H, д), 7.77(1H, д), 8.82(1H, с).
ПРИМЕР 95. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (2- метокси-5-фенилфенил)пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(2-метокси-5- фенилфенил)пиперазином с получением целевого соединения.
Выход: 77%
Т.пл.: 122-123oC
Спектр 1H ЯМР (CDCl3) δ: 3.38 (4H, т), 3.86(4H, т), 3.97(3H, с), 4.18(3H, с), 7.05(2H, м), 7.34-7.45(6H, м), 7.50(1H, т), 7.56(2H, д), 7.71(2H, д), 7.78(2H, д), 8.88(1H, с).
ПРИМЕР 96. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (5- метокси-2-метилфенил) пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(5-метокси-2- метилфенил)пиперазином с получением целевого соединения.
Выход: 82%
Т.пл.: 128-130oC
Спектр 1H ЯМР (CDCl3) δ: 2.30(3H, с), 3.37(4H, т), 3.84(4H, т), 3.78(3H, с), 3.97(3H, с), 7.05(2H, м), 7.13(1H, д), 7.38(3H, м), 7.62(1H, д), 7.80(1H, с), 8.88(1H, с).
ПРИМЕР 97. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (1- нафтил) пиперазин:
Тем же способом, что описан в примере 81, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)карбаматом и 1-(1- нафтил)пиперазином с получением целевого соединения.
Выход: 68%
Т.пл.: 158-160oC
Спектр 1H ЯМР (CDCl3) δ: 3.22(4H, т), 3.86(4H, т), 4.20(3H, с), 7.13(1H, д), 7.38(2H, м), 7.43(1H, т), 7.53(3H, м), 7.62(1H, д), 7.72(1H, д), 7.80(1H, д), 7.86(1H, д), 8.24(1H, д), 8.84(1H, с).
ПРИМЕР 98. 1-[N-(2-Метоксихинолин-3-ил)-N-метиламинокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
1- [(2-Метоксихинолин-3-ил) аминокарбонил] -4- (3, 5- диметоксифенил)пиперазин (106 мг, 0,25 ммоля) растворяли в диметилформамиде (15 мл) и добавляли гидрид натрия (6,0 мг, 0,25 ммоля), после чего раствор перемешивали при комнатной температуре в течение 15 минут. В полученный раствор добавляли иодометан (35 мг, 0,25 ммоля). Смесь перемешивали при комнатной температуре в течение 16 часов и концентрировали при пониженном давлении с целью удаления диметилформамида. Концентрат очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 93%
Т.пл.: 88-89oC
Спектр 1H ЯМР (CDCl3) δ: 2.93(4H, т), 3.17(3H, с), 3.34(4H, т), 3.72(6H, с), 4.15(3H, с), 5.95(2H, с), 5.98(1H, с), 7.40(1H, т), 7.61(2H, м), 7.73(1H, с), 7.84(1H, д).
Масс-спектр (EI) m/z: вычислено для C24H28N4O4 436.2110, найдено 436.2105.
ПРИМЕР 99. 1-[N-Этил-N-(2-метоксихинолин-3-ил)аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
1-[(2-Метоксихинолин-3-ил) аминокарбонил] -4- (3, 5- диметоксифенил)пиперазин (106 мг, 0,25 ммоля) растворяли в диметилформамиде (15 мл) и добавляли гидрид натрия (6,0 г, 0,25 ммоля), после чего раствор перемешивали при комнатной температуре в течение 15 минут. К раствору добавляли иодоэтан (35 мг, 0,25 ммоля). Полученную смесь перемешивали при комнатной температуре в течение 16 часов и концентрировали при пониженном давлении с целью удаления диметилформамида. Концентрат очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 91%
Т.пл.: 118-120oC
Спектр 1H ЯМР (CDCl3) δ: 1.16(3H, т), 2.89(4H, т), 3.30(4H, т), 3.63(2H, м), 3.71(6H, с), 4.13(3H, с), 5.93(2H, с), 5.98 (1H, с), 7.41(1H, т), 7.60(1H, т), 7.66(1H, д), 7.71(1H, с), 7.84 (1H, д).
Масс-спектр (EI) m/z: вычислено для С25H30N4О4 450.2227, найдено 450.2206.
ПРИМЕР 100. 1-(N-Изопропил-N-(2-метоксихинолин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)фенил:
1-[(2-Метоксихинолин-3-ил) аминокарбонил] -4 (3, 5- диметоксифенил)пиперазин (106 мг, 0.25 ммоля) растворяли в диметилформамиде (15 мл) добавляли гидрид натрия (6,0 мг, 0,25 ммоля) и реакционный раствор перемешивали при комнатной температуре в течение 15 минут. В полученный раствор добавляли 2- пропилиодид (42 мг, 0.25 ммоля). Смесь перемешивали при комнатной температуре в течение 16 часов и концентрировали при пониженном давлении с целью удаления диметилформамида. Концентрат очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 87%
Т.пл.: 123-125oC
Спектр 1H ЯМР (CDCl3) δ: 1.21(6H, д), 2.79 (4H, т), 3.29 (4H, т), 3.70(6H, с), 4.08(3H, с), 4.41(1H, м), 5.90(2H, с), 5.96 (1H, с), 7.43(1H, т), 7.63(1H, т), 7.69(1H, д), 7.75(1H, с), 7.83 (1H, д).
ПРИМЕР 101. 1-[N-Циклопропилметил-N-(2-метоксихинолин- 3-ил) аминокарбонил] -4- (3, 5-диметоксифенил) пиперазин:
1- [(2-Метоксихинолин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин (106 мг, 0,25 ммоля) растворяли в диметилформамиде (15 мл), добавляли гидрид натрия (6,2 мг, 0,26 ммоля) и раствор перемешивали при комнатной температуре в течение 15 минут. В полученный раствор добавляли бромометилциклопропан (22 мг, 0,26 ммоля). Смесь перемешивали при комнатной температуре в течение 16 часов и концентрировали при пониженном давлении с целью удаления диметилформамида. Концентрат очищали методом колоночной хроматографии (этил-ацетат:гексан = 1:2) с получением целевого соединения.
Выход: 78%
Т.пл.: 118-120oC
Спектр 1H ЯМР (CDCl3) δ: 0.41(2H, м), 0.85(2H, м), 1.28(1H, м), 2.88(4H, т), 3.24(4H, т), 3.42(2H, д), 3.71(6H, с), 4.13 (3H, с), 5.94(3H, с), 7.44(1H, д), 7.62(1H, д), 7.78(3H, м).
ПРИМЕР 102. 1-[N-Бензил-N-(2-метоксихинолин-3-ил) аминокарбонил] -4- (3,5-диметоксифенил)пиперазин:
1- [(2-Метоксихинолин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин (114 мг, 0,27 ммоля) растворяли в диметилформамиде (15 мл), добавляли гидрид натрия (6,6 мг, 0,27 ммоля) и полученный раствор перемешивали при комнатной температуре в течение 15 минут. К полученному раствору добавляли бензилбромид (46 мг, 0.27 ммоля). Смесь перемешивали при комнатной температуре в течение 16 часов и концентрировали при пониженном давлении с целью удаления диметилформамида. Концентрат очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 90%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.92(4H, т), 3.39(4H, т), 3.72(6H, с), 4.13(3H, с), 4.79(2H, с), 6.01(3H, м), 7.21(1H, м), 7.25 (2H, м), 7.33(3H, м), 7.51(1H, с), 7.57(2H, м), 7.81(2H, д).
ПРИМЕР 103. 1-[N-(2-Метоксихинолин-3-ил)-N-метиламинокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 98, проводили реакцию с использованием 1-[(2-метоксихинолин-3-ил)аминокарбонил]-4- (3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 92%
Т.пл.: 142-143oC
Спектр 1H ЯМР (CDCl3) δ: 2.27(6H, д), 2.90(4H, т), 3.17(3H, с), 3.34(4H, т), 4.15(3H, с), 6.41(2H, с), 6.49(1H, с), 7.40 (1H, т), 7.63(1H, т), 7.65(1H, д), 7.73(1H, с), 7.84(1H, д).
Масс-спектр (EI) m/z: вычислено для C24H28N4O2 404.2212, найдено 404.2225.
ПРИМЕР 104. 1-[N-Этил-N-(2-метоксихинолин-3-ил)аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 99, с использованием 1- [(2-метоксихинолин-3-ил) аминокарбонил] -4- (3, 5- диметилфенил)пиперазина с получением целевого соединения.
Выход: 89%
Т.пл.: 84-86oC
Спектр 1H ЯМР (CDCl3) δ: 1.16(3H, т), 2.21(6H, с), 2.87(4H, т), 3.30(4H, т), 3.64(2H, кв), 4.13(3H, с), 6.40(2H, с), 6.48(1H, с), 7.40(1H, т), 7.62(1H, т), 7.66(1H, д), 7.71(1H, с), 7.84(1H, д).
ПРИМЕР 105. 1-[N-Изопропил-N-(2-метоксихинолин-З-ил) аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 100, с использованием 1- [(2-метоксихинолин-З-ил) аминокарбонил] -4- (3, 5- диметилфенил)пиперазина проводили реакцию с получением целевого соединения.
Выход: 84%
Т.пл.: 114-115oC
Спектр 1H ЯМР (CDCl3) δ: 1.21(6H, д), 2.20(6H, с), 2.77(4H, т), 3.28(4H, т), 4.08(3H, с), 4.39(1H, м), 6.37(2H, с), 6.46 (1H, с), 7.41(1H, т), 7.63(1H, т), 7.69(1H, д), 7.75(1H, с), 7.83 (1H, д).
ПРИМЕР 106. 1-[N-Бензил-N-(2-метоксихинолин-3-ил)аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 102, с использованием 1-[(2-метоксихинолин-3-ил)аминокарбонил] -4-(3, 5-диметилфенил)пиперазина проводили реакцию с получением целевого соединения.
Выход: 90%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.24(6H, с), 2.87(4H, т), 3.31(4H, т), 4.13(3H, с), 4.80(2H, с), 6.42(3H, с), 7.49(1H, т), 7.62 (2H, м), 7.72(2H, м).
ПРИМЕР 107. 1-[N-(2-Метоксихинолин-3-ил)-N-метиламинокарбонил] -4- (3-изопропоксифенил)пиперазин:
Тем же способом, что описан в примере 98, с использованием 1- [(2-метоксихинолин-3-ил) аминокарбонил] -4- (3- изопропоксифенил)пиперазина проводили реакцию с получением целевого соединения.
Выход: 92%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.28(6H, д), 2.97(4H, т), 3.18(3H, с), 3.37(4H, т), 4.14(3H, с), 4.49(1H, м), 6.41(3H, м), 7.13 (1H, м), 7.40(1H, т), 7.62(1H, т), 7.66(1H, д), 7.74(1H, с), 7.84(1H, д).
ПРИМЕР 108. 1-[N-Этил-N-(2-метоксихинолин-3-ил)аминокарбонил] -4- (3-изопропоксифенил)пиперазин:
Тем же способом, что описан в примере 99, с использованием 1-[(2-метоксихинолин-3-ил)аминокарбонил] -4- (3- изопропоксифенил)пиперазина проводили реакцию с получением целевого соединения.
Выход: 87%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.16(3H, т), 1.34(6H, д), 2.89(4H, т), 3.30(4H, т), 3.63(2H, м), 4.13(3H, с), 4.55(1H, м), 6.49 (2H, с), 7.05(1H, с), 7.20(1H, т), 7.32(1H, с), 7.37(1H, т), 7.50 (1H, т), 7.70(1H, д), 7.77(1H, д), 8.80(1H, с).
ПРИМЕР 109. 1-[(2-Метоксихинолин-3-ил)аминотиокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Фенил N-(2-метоксихинолин-3-ил)тиокарбамат (56 мг, 0,5 ммоля) и 1-(3,5-диметоксифенил)пиперазин (111 мг, 0,5 ммоля) растворяли в безводном тетрагидрофуране и добавляли DBU (117 мг, 0,75 ммоля). Реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Полученный раствор концентрировали при пониженном давлении с целью удаления тетрагидрофурана и концентрат очищали методом колоночной хроматографии (гексан:эфир = 5:1) с получением целевого соединения.
Выход: 76%
Т.пл.: 171-172oC
Спектр 1H ЯМР (CDCl3) δ: 3.41(4H, т), 3.81(6H, с), 4.17 (3H, с), 4.21(4H, т), 6.12(1H, с), 6.20(1H, д), 7.38(1H, т), 7.54 (1H, т), 7.74(1H, д), 7.81(1H, д), 8.96(1H, с).
ПРИМЕР 110. 1-[(2-Метоксихинолин-3-ил)аминотиокарбонил] - 4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 109, проводили реакцию с использованием фенил N-(2-метоксихинолин-3-ил)тиокарбамата и 1- (3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 79%
Т.пл.: 170-171oC
Спектр 1H ЯМР (CDCl3) δ: 2.30(6H, с), 3.38(4H, т), 4.09(3H, с), 4.17(4H, т), 6.63(3H, м), 7.38(1H, т), 7.54(1H, т), 7.72 (1H, д), 7.81(1H, д), 8.96(1H, с).
ПРИМЕР 111. 1-[(2-Метоксихинолин-3-ил)аминотиокарбонил] -4- (3, 5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 109, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)тиокарбаматом и 1-(3,5- дифторфенил)пиперазином с получением целевого соединения.
Выход: 78%
Т.пл.: 140-142oC
Спектр 1H ЯМР (CDCl3) δ: 3.44(4H, т), 4.20(4H, т), 4.25(3H, с), 6.33(2H, м), 6.45(1H, д), 7.41(1H, т), 7.56(1H, м), 7.72 (1H, м), 7.97(1H, м), 8.96(1H, с).
ПРИМЕР 112. 1-[(2-Метоксихинолин-3-ил)аминотиокарбонил] - 4- (3, 5-дихлорфенил)пиперазин:
Тем же способом, что описан в примере 109, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)тиокарбаматом и 1-(3, 5- дихлорфенил)пиперазином с получением целевого соединения.
Выход: 62%
Т.пл.: 181-183oC
Спектр 1H ЯМР (CDCl3) δ: 3.44(4H, т), 4.20(4H, т), 4.26(3H, с), 6.77(1H, с), 6.88(2H, т), 7.41(1H, т), 7.59(1H, т), 7.70 (2H, м), 8.01(1H, т), 8.11(1H, с), 8.93(1H, с).
ПРИМЕР 113. 1-[(2-Метоксихинолин-3-ил)аминотиокарбонил] -4- (3-метоксифенил)пиперазин:
Тем же способом, что описан в примере 109, проводили реакцию между фенил N-(2-метоксихинолин-3-ил)тиокарбаматом и 1-(3- метоксифенил)пиперазином с получением целевого соединения.
Выход: 81%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 3.17(4H, т), 3.89(3H, с), 4.17(4H, т), 6.90(4H, м), 7.34(1H, т), 7.48(1H, т), 7.70(1H, д), 7.77 (1H, д), 8.80(1H, с).
ПРИМЕР 114. 1-[(2-Метилхинолин-3-ил)аминокарбонил]-4- (3,5- диметоксифенил)пиперазин:
а) Фенил N-(2-метилхинолин-3-ил)карбамат:
3-Амино-2-метилхинолин (4 г, 25 ммолей) и фенилхлорформиат (4,04 г, 20 ммолей) растворяли в хлористом метилене и смесь перемешивали при комнатной температуре в течение 2 часов. Смешанный раствор концентрировали при пониженном давлении с целью удаления хлористого метилена и очищали методом колоночной хроматографии (этилацетат:гексан = 1:10) с получением целевого соединения.
Выход: 88%
Спектр 1H ЯМР (CDCl3) δ: 2.77(3H, с), 7.30-7.53(9H, м), 8.67(1H, с).
b) 1- [(2-Метилхинолин-3-ил) аминокарбонил] -4- (3, 5- диметоксифенил)пиперазин:
Фенил N-(2-метилхинолин-3-ил)карбамат (140 мг, 0,5 ммоля) и 1-(3,5-диметоксифенил)пиперазин (112 мг, 0,5 ммоля) растворяли в тетрагидрофуране и добавляли DBU (117 мг, 0,75 ммоля), после чего смесь перемешивали при комнатной температуре в течение 2 часов. Полученный раствор концентрировали при пониженном давлении с целью удаления тетрагидрофурана и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 84%
Т.пл.: 199-200oC
Спектр 1H ЯМР (CDCl3) δ: 2.81(3H, с), 3.30(4H, т), 3.76 (4H, т), 3.80(6H, с), 6.08(1H, с), 6.12(2H, д), 7.48(1H, т), 7.62(1H, т), 7.71(1H, д), 8.03(1H, д), 8.59(1H, с).
ПРИМЕР 115. 1-[(2-Метилхинолин-3-ил)аминокарбонил]-4-(3,5- диметилфенил)пиперазин:
Тем же способом, что описан в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1-(3,5- диметилфенил)пиперазином с получением целевого соединения.
Выход: 86%
Т.пл.: 230-232oC
Спектр 1H ЯМР (CDCl3) δ: 2.31(6H, с), 2.82(3H, с), 3.29(4H, т), 3.76 (4H, т), 6.60(3H, с), 7.49(1H, т), 7.63(1H, т), 7.73(1H, д), 8.05(1H, д), 8.61(1H, с).
ПРИМЕР 116. 1-[(2-Метилхинолин- 3-ил)аминокарбонил]-4-(2,3-диметилфенил)пиперазин:
Тем же способом, что описан в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3- ил)карбаматом и 1-(2,3-диметилфенил)пиперазином с получением целевого соединения.
Выход: 81%
Т.пл.: 169-170oC
Спектр 1H ЯМР (CDCl3) δ: 2.28(6H, д), 2.84(3H, с), 3.00(4H, т), 3.76(4H, т), 6.94(2H, м), 7.11(1H, т), 7.49(1H, т), 7.63(1H, т), 7.72(1H, д), 8.07(1H, д), 8.64(1H, с).
ПРИМЕР 117. 1-[(2-Метоксихинолин-3-ил)аминокарбонил]-4- (3,5-дифторфенил) пиперазин:
Тем же способом, что описан в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1-(3,5- дифторфенил)пиперазином с получением целевого соединения.
Выход: 81%
Т.пл.: 238-240oC
Спектр 1H ЯМР (CDCl3) δ: 2.81(3H, т), 3.34(4H, т), 3.77(4H, т), 6.32(1H, т), 6.39(2H, д), 7.49(1H, т), 7.63(1H, т), 7.72(1H, д), 8.03(1H, д), 8.58(1H, с).
ПРИМЕР 118. 1-[(2-Метилхинолин-3-ил)аминокарбонил]- 4- (3,5- дихлорфенил) пиперазин:
По той же методике, что описана в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1-(3,5- дихлорфенил)пиперазином с получением целевого соединения.
Выход: 65%
Т.пл.: 247-249oC
Спектр 1H ЯМР (CDCl3) δ: 2.79(3H, с), 3.33(4H, т), 3.75 (4H, т), 6.78(2H, с), 6.87(1H, с), 7.49(1H, т), 7.63(1H, т), 7.72 (1H, д), 8.56(1H, с).
ПРИМЕР 119. 1-[(2-Метилхинолин-3-ил)аминокарбонил]-4- (2- метоксифенил) пиперазин:
Тем же способом, что описан в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1-(2- метоксифенил)пиперазином с получением целевого соединения.
Выход: 83%
Т.пл.: 135-136oC
Спектр 1H ЯМР (CDCl3) δ: 2.82(3H, с), 3.18(4H, т), 3.79(4H, т), 3.91(3H, с), 6.88(1H, д), 6.97(2H, с), 7.07(1H, м), 7.48 (1H, т), 7.62(1H, т), 7.72(1H, д), 8.04(1H, д), 8.63(1H, с).
ПРИМЕР 120. 1-[(2-Метилхинолин-3-ил)аминокарбонил] -4- (2- фторфенил)пиперазин:
Тем же способом, что описан в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1- (2- фторфенил)пиперазином с получением целевого соединения.
Выход: 84%
Т.пл.: 201-203oC
Спектр 1H ЯМР (CDCl3) δ: 2.84(3H, с), 3.20 (4H, т), 3.80 (4H, т), 6.99(2H, м), 7.07(2H, м), 7.49(1H, т), 7.62(1H, т), 7.71 (1H, д), 8.04(1H, д), 8.62(1H, с).
ПРИМЕР 121. 1-[(2-Метилхинолин-3-ил)аминокарбонил] -4- (2- хлорфенил)пиперазин:
Тем же способом, что описан в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1-(2- хлорфенил)пиперазином с получением целевого соединения.
Выход: 72%
Т.пл.: 180-181oC
Спектр 1H ЯМР (CDCl3) δ: 2.83(3H, с), 3.16(4H, т), 3.80 (4H, т), 7.04(3H, м), 7.40(1H, д), 7.49(1H, т), 7.63(1H, т), 7.71 (1H, д), 8.05(1H, д), 8.62(1H, с).
ПРИМЕР 122. 1-[(2-Метилхинолин-3-ил)аминокарбонил]-4- (2- метилтиофенил) пиперазин:
Тем же способом, что описан в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1-(2- метилтиофенил)пиперазином с получением целевого соединения.
Выход: 76%
Т.пл.: 165-166oC
Спектр 1H ЯМР (CDCl3) δ: 2.45(3H, с), 2.85(3H, с), 3.11(4H, т), 3.79(4H, т), 7.05(1H, м), 7.15(3H, д), 7.49(1H, т), 7.63 (1H, т), 7.69(1H, д), 8.07(1H, д), 8.62(1H, с).
ПРИМЕР 123. 1-[(2-Метилхинолин-3-ил)аминокарбонил]-4- (2- метокси-5-метилфенил)пиперазин:
Тем же способом, что описан в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1- (2-метокси-5- метилфенил)пиперазином с получением целевого соединения.
Выход: 80%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.30(3H, с), 2.72(3H, с), 3.17 (4H, т), 3.70(4H, т), 3.87(3H, с), 6.77(1H, с), 6.82(2H, с), 7.73 (4H, м), 8.60(1H, с).
ПРИМЕР 124. 1-[(2-Метилхинолин-3-ил)аминокарбонил]-4- (1- нафтил)пиперазин:
Тем же способом, что описан в примере 114, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1-(1- нафтил)пиперазином с получением целевого соединения.
Выход: 64%
Т.пл.: 220-222oC
Спектр 1H ЯМР (CDCl3) δ: 2.83(3H, с), 3.23(4H, т), 3.80(4H, т), 6.91(1H, с), 7.12(1H, д), 7.44(1H, д), 7.50(3H, м), 7.61(2H, м), 7.73(1H, д), 7.86(1H, д), 8.05(1H, д), 8.23(1H, д), 8.64(1H, с).
ПРИМЕР 125. 1-[(2-Метилхинолин-3-ил)аминотиокарбонил]- 4- (3,5-диметоксифенил)пиперазин:
а) фенил N-(2-метилхинолин-3-ил)тиокарбамат:
3-Амино-2-метилхинолин (4 г, 25 ммолей) и фенилхлортионоформиат (4,32 г, 25 ммолей) растворяли в хлористом метилене и затем перемешивали при комнатной температуре в течение 2 часов. Полученный раствор концентрировали при пониженном давлении с целью удаления хлористого метилена и очищали методом колоночной хроматографии (этилацетат: гексан = 1:2) с получением целевого соединения.
Выход: 78%
Спектр 1H ЯМР (CDCl3) δ: 2.77(3H, с), 7.09-7.90(9H, м), 9.14(1H, с).
b) 1-[(2-Метилхинолин-3-ил)аминотиокарбонил] -4-(3,5- диметоксифенил)пиперазин:
Фенил N-(2-метилхинолин-3-ил)тиокарбамат (147 мг, 0,5 ммоля) и 1- (3,5-диметоксифенил)пиперазин (112 мг, 0,5 ммоля) растворяли в безводном тетрагидрофуране, добавляли DBU (117 мг, 0,75 ммоля) и затем смесь перемешивали при комнатной температуре в течение 2 часов, полученный раствор концентрировали при пониженном давлении с целью удаления тетрагидрофурана и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 86%
Т.пл.: 211-212oC
Спектр 1H ЯМР (CDCl3) δ: 2.81(3H, с), 3.35(4H, т), 3.79(6H, с), 4,14(4H, т), 6.07(3H, с), 7.49(2H, т), 7,68(2H, м), 8.01(1H, с), 8.07(1H, д).
ПРИМЕР 126. 1-[(2-Метилхинолин-3-ил)аминотиокарбонил] - 4- (3,5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 125, проводили реакцию между фенил N-(2-метилхинолин-3-ил)карбаматом и 1-(3,5- диметилфенил)пиперазином с получением целевого соединения.
Выход: 81%
Т.пл.: 196-197oC
Спектр 1H ЯМР (CDCl3) δ: 2.27(6H, с), 2.81(3H, с), 3.31(4H, т), 4.11(4H, т), 6.53(2H, с), 6.58(1H, с), 7.48(2H, т), 7.67(2H, м), 7.96(1H, с), 8.04(1H, д).
ПРИМЕР 127. 1-[(2-Метилхинолин-3-ил)аминотиокарбонил]- 4- (3,5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 125, проводили реакцию между фенил N-(2-метилхинолин-3-ил)тиокарбаматом и 1-(3, 5- дифторфенил)пиперазином с получением целевого соединения.
Выход: 74%
Т.пл.: 211-213oC
Спектр 1H ЯМР (CDCl3) δ: 2.85(3H, с), 3.43(4H, т), 4.22(4H, т), 6.33(2H, м), 7.49(1H, т), 7.64(1H, д), 7.72(1H, т), 8.16(2H, м).
ПРИМЕР 128. 1-{[2-(Пиридин-2-ил)хинолин-4-ил]аминокарбонил}-4- (3,5-диметоксифенил)пиперазин:
Фенил N-[2-(пиридин-3-ил)хинолин-4-ил] карбамат (171 мг, 0,5 ммоля) и 1-(3,5-диметоксифенил)пиперазин (111 мг, 0,5 ммоля) растворяли в безводном тетрагидрофуране, добавляли DBU (117 мг, 0,75 ммоля) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Полученный раствор концентрировали при пониженном давлении с целью удаления тетрагидрофурана и очищали методом колоночной хроматографии (дихлорметан: метанол = 20:1) с получением целевого соединения.
Выход: 73%
Т.пл.: 97-98oC
Спектр 1H ЯМР (CDCl3) δ: 3.34 (4H, т), 3.79(6H, с), 3.90(4H, т), 6.07(1H, с) 6.12(2H, с), 7.43(1H, т), 7.50(1H, т),
7.68(1H, т), 7.93(1H, т), 8.26(1H, д), 8.59(1H, д), 8.80(1H, д), 8.98 (1H, c).
Масс-спектр (EI) m/z: вычислено для С31H27N5O3 517.2113, найдено 517.3244.
ПРИМЕР 129. 1-{[2-(Пиридин-3-ил)хинолин-4-ил]аминокарбонил}-4- (3, 5-диметоксифенил)пиперазин:
Фенил N-[(2-пиридин-3-ил)хинолин-4-ил] карбамат (171 мг, 0,5 ммоля) и 1-(3,5-диметоксифенил)пиперазин (111 мг, 0,5 ммоля) растворяли в безводном тетрагидрофуране, добавляли DBU (117 мг, 0,75 ммоля) и затем смесь перемешивали при комнатной температуре в течение 2 часов. Полученный раствор концентрировали при пониженном давлении с целью удаления тетрагидрофурана и очищали методом колоночной хроматографии (дихлорметан:метанол = 20:1) с получением целевого соединения.
Выход: 67%
Т.пл.: 95-96oC
Спектр 1H ЯМР (CDCl3) δ: 3,36(4H, т), 3.87(6H, с), 3.90 (4H, т), 6.08(1H, с), 6.12(2H, с), 7.50(1H, т), 7.71(1H, т), 7.93 (1H, т), 8.25(1H, д), 8.53(1H, д), 8.67(1H, с), 8.73(1H, д), 9.35(1H, с).
ПРИМЕР 130. 1-{[2-Тиен-2-ил)хинолин-4-ил]аминокарбонил}-4- (3, 5-диметоксифенил)пиперазин:
Фенил N-[2-(тиен-2-ил)хинолин-4-ил] карбамат (173 мг, 0,5 ммоля) и 1-(3,5-диметоксифенил)пиперазин (111 мг, 0,5 ммоля) растворяли в безводном тетрагидрофуране и добавляли DBU (117 мг, 0,75 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 2 часов, концентрировали при пониженном давлении с целью удаления тетрагидрофурана и очищали методом колоночной хроматографии (этилацетат:гексан = 1:1) с получением целевого соединения.
Выход: 61%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 3.37(4H, т), 3.59(6H, с), 3.97(4H, т), 7.01(3H, м), 7.49(1H, т), 7.69(1H, т), 7.93(1H, т), 8.20(1H, д), 8.52(1H, д), 8.64(1H, с), 8.71(1H, д), 9.35(1H, с).
ПРИМЕР 131. 1-([2-(Пиридин-3-ил)хинолин-4-ил] аминокарбонил}-4- (3,5-диметилфенил)пиперазин:
Фенил N-[2-(пиридин-3-ил)хинолин-4-ил] карбамат (171 мг, 0,5 ммоля) и 1-(3,5-диметилфенил)пиперазин (95 мг, 0,5 ммоля) растворяли в безводном тетрагидрофуране и добавляли DBU (117 мг, 0,75 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 2 часов, концентрировали при пониженном давлении с целью удаления тетрагидрофурана и очищали методом колоночной хроматографии (этилацетат:гексан = 1:1) с получением целевого соединения.
Выход: 64%
Т.пл.: 211-213oC
Спектр 1Н ЯМР (CDCl3) δ: 2.31(6H, с), 3.32 (4H, т), 3.85(4H, т), 6.61(3H, c), 7.47(1H, т), 7.55(1H, т), 7.72(1H, т), 7.86(1H, т), 8.25(1H, д), 8.53(1H, д), 8.66(1H, с), 8.72(1H, д), 9.37(1H, c).
ПРИМЕР 132. 1-[N-(5,6-Диметил-2-метоксипиридин-3-ил)-N- метиламинокарбонил] -4- (3,5-диметоксифенил)пиперазин:
1-[(5, 6-Димeтил-2-мeтoкcипиpидин-3-ил) аминокарбонил] - 4- (3,5-диметоксифенил)пиперазин (100 мг, 0,25 ммоля) растворяли в диметилформамиде (15 мл) и добавляли гидрид натрия (6,0 г, 0,25 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 15 минут и добавляли иодометан (35 мг, 0,25 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 16 часов, концентрировали при пониженном давлении с целью удаления диметилформамида и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 94%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.17(3H, с), 2.38(3H, с), 2.92 (4H, т), 3.04(3H, с), 3.29(4H, т), 3.74(6H, с), 3.96(3H, с), 6.00 (3H, м), 7.08(1H, с).
ПРИМЕР 133. 1-[N-Этил-N-(5,6-диметил-2-метоксипиридин- 3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
1-[(5,6-Диметил-2-метоксипиридин-3-ил)аминокарбонил] -4- (3,5-диметоксифенил)пиперазин (100 мг, 0,25 ммоля) растворяли в диметилформамиде (15 мл) и добавляли гидрид натрия (6,0 мг, 0,25 ммоля), после чего смесь перемешивали при комнатной температуре в течение 15 минут и добавляли иодоэтан (39,2 мг, 0,25 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 16 часов, концентрировали при пониженном давлении с целью удаления диметилформамида и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 86%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.08(3H, т), 2.04(3H, с), 2.38(3H, с), 2.90(4H, т), 3.26(4H, т), 3.52(2H, кв), 3.74(6H, с), 5.99(3H, м), 7.06(1H, с).
ПРИМЕР 134. 1-[N-Изопропил-М-(5,6-диметил-2-метоксипиридин-3-ил)аминокарбонил]-4-(3,5-диметоксифенил)пиперазин:
1- [(5, 6-Диметил-2-метоксипиридин-3-ил) аминокарбонил] -4- (3,5-диметоксифенил)пиперазин (100 мг, 0,25 ммоля) растворяли в диметилформамиде (15 мл) и добавляли гидрид натрия (6,0 мг, 0,25 ммоля), после чего смесь перемешивали при комнатной температуре в течение 15 минут и добавляли 2-иодпропан (42 мг, 0,25 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 16 часов, концентрировали при пониженном давлении с целью удаления диметилформамида и очищали методом колоночной хроматографии (этилацетат: гексан = 1:2) с получением целевого соединения.
Выход: 78%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.13(6H, д), 2.19(3H, с), 2.38(3H, с), 2.82(4H, т), 3.26(4H, т), 3.74(6H, с), 3.89(3H, с), 4.27(1H, м), 6.06(1H, с), 6.10(2H, д), 7.07(1H, с), 8.14(1H, с).
Масс-спектр (EI) m/z: вычислено для С24H34N4О4 442.2580, найдено 442.2538.
ПРИМЕР 135. 1-[N-(5,6-диметил-2-метоксипиридин-3-ил)-N- метиламинокарбонил] -4- (3,5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(5,6-диметил-2-метоксипиридин-3- ил)аминокарбонил] -4-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 97%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.15(6H, с), 2.23(3H, с), 2.37(3H, с), 2.89(4H, т), 3.04(3H, с), 3.30(4H, т), 3.97(3H, с), 6.46 (3H, м), 7.08(1H, с).
ПРИМЕР 136. 1-[N-(5,6-Диметил-2-метоксипиридин-3-ил)-N- метиламинокарбонил] -4- (2-метоксифенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(5,6-диметил-2-метоксипиридин-3-ил) аминокарбонил] -4- (2-метоксифенил) пиперазина с получением целевого соединения.
Выход: 94%
Т.пл.: 131-132oC
Спектр 1H ЯМР (CDCl3) δ: 2.16(3H, с), 2.38(4H, с), 2.80 (4H, т), 3.05(3H, с), 3.35(4H, т), 3.82(3H, с), 3.97(3H, с), 6.83 (4H, м), 7.08(1H, с).
ПРИМЕР 137. 1-[N-Этил-N-(5,6-диметил-2-метоксипиридин-3- ил) аминокарбонил] -4- (2-метоксифенил)пиперазин:
Тем же способом, что описан в примере 133, проводили реакцию с использованием 1-[(5,6-диметил-2-метоксипиридин-3-ил) аминокарбонил]-4-(2-метоксифенил)пиперазина с получением целевого соединения.
Выход: 87%
Т.пл.: 112-113oC
Спектр 1H ЯМР (CDCl3) δ: 1.08(3H, т), 2.16(3H, с), 2.38(3H, с), 2.77(4H, т), 3.31(4H, т), 3.58(2H, кв), 3.81(3H, с), 3.96(3H, с), 6.88(4H, м), 7.06(1H, с)
ПРИМЕР 138. 1-[N-Бензил-N-(5,6-диметил-2-метоксипиридин-3-ил) аминокарбонил] -4- (2-метоксифенил)пиперазин:
1- [(5, 6-Диметил-2-метоксипиридин-3-ил) аминокарбонил] -4- (2-метоксифенил) пиперазин (100 мг, 0,27 ммоля) растворяли в диметилформамиде (15 мл) и добавляли гидрид натрия (6,5 мг, 0.27 ммоля), после чего смесь перемешивали при комнатной температуре в течение 1 часа и затем добавляли бромистый бензил (46,2 мг, 0,27 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 16 часов, концентрировали при пониженном давлении и очищали методом колоночной хроматографии (этилацетат:гексан = 1: 2) с получением целевого соединения.
Выход: 93%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.08(3H, с), 2.35(3H, с), 2.85(4H, т), 3.32(4H, т), 3.81(3H, с), 3.96(3H, с), 4.76(2H, с), 6.96 (4H, м), 7.41(5H, м).
ПРИМЕР 139. 1-[N-Циклопропилметил-N-(5,6-диметил-2-метоксипиридин-3-ил)аминокарбонил]-4-(2-метоксифенил) пиперазин:
1- [(5, 6-Диметил-2-метоксипиридин-3-ил) аминокарбонил] -4- (2-метоксифенил)пиперазин (100 мг, 0,26 ммоля) растворяли в диметилформамиде (15 мл) и добавляли гидрид натрия (6,2 мг, 0,26 ммоля), после чего смесь перемешивали при комнатной температуре в течение 15 минут и добавляли бромометилциклопропан (21,8 мг, 0,26 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 16 часов, концентрировали при пониженном давлении и очищали методом колоночной хроматографии (этилацетат:гексан = 1: 2) с получением целевого соединения.
Выход: 78%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 0.34(2H, м), 0.49(2H, м), 1.35(1H, м), 2.85(4H, т), 3.28(4H, т), 3,40(2H, с), 3.89(3H, с), 3.97 (3H, с), 6.97(4H, м), 7.11(1H, с).
ПРИМЕР 140. 1-[N-(5,6-Диметил-2-метоксипиридин-3-ил)-N- метиламинокарбонил] -4- (5-метокси-2-метилфенил) пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(5,6-диметил-2-метоксипиридин-3- ил)аминокарбонил]-4-(5-метокси-2-метилфенил)пиперазина с получением целевого соединения.
Выход: 74%
Т.пл.: 91-93oC
Спектр 1H ЯМР (CDCl3) δ: 2.15(3H, с), 2.18(3H, с), 2.39(3H, с), 2.67(4H, т), 3.05(3H, с), 3.30(4H, т), 3.75(3H, с), 3.97 (3H, с), 6.48(3H, м), 7.10(1H, с).
ПРИМЕР 141. 1-[N-Этил-N-(5,6-диметил-2-метоксипиридин-3-ил) аминокарбонил] -4- (5-метокси-2-метилфенил)пиперазин:
Тем же способом, что описан в примере 133, проводили реакцию с использованием 1-[(5,6-диметил-2-метоксипиридин-3-ил) аминокарбонил] -4- (5-метокси-2-метилфенил)пиперазина с получением целевого соединения.
Выход: 94%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.09(3H, т), 2.15(3H, с), 2.18 (3H, с), 2.39(3H, с), 2.60(4H, т), 3.27(4H, т), 3.59(2H, кв), 3.75(3H, с), 3.96(3H, с), 6.45(3H, м), 7.08(1H, с).
ПРИМЕР 142. 1-[N-Бензил-Н-(5,6-диметил-2-метоксипиридин-3- ил) аминокарбонил] -4- (5-метокси-2-метилфенил)пиперазин:
Тем же способом, что описан в примере 138, проводили реакцию с использованием 1-[(5,6-диметил-2-метоксипиридин-3-ил)аминокарбонил] -4-(5-метокси-2-метилфенил)пиперазина с получением целевого соединения.
Выход: 97%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.25(3H, т), 2.08(3H, с), 2.14(3H, с), 2.35(3H, с), 2.60(4H, т), 3.32(4H, т), 3.74(3H, с), 3.95 (3H, с), 4.66(2H, с), 6.44(4H, м), 6.96(5H, м), 7.12(1H, с).
ПРИМЕР 143. 1-[N-(5-Этил-2-метокси-6-метилпиридин-3- ил) -N- метиламинокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(5-этил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазина с получением целевого соединения.
Выход: 87%
Т.пл.: 78-79oC
Спектр 1H ЯМР (CDCl3) δ: 1.14(3H, т), 2.41(3H, с), 2.52(2H, кв), 2.91(4H, т), 3.02(3H, с), 3.28(4H, т), 3.74(6H, с), 3.98(3H, с), 5.98(3H, м), 7.11(1H, с).
Масс-спектр (EI) m/z: вычислено для C23H32N4O4 428.2423, найдено 428.2434.
ПРИМЕР 144. 1-[N-(5-Этил-2-метокси-6-метилпиридин-3-ил) -N- метиламинокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(5-этил-2-метокси-6-метилпиридин-3- ил)аминокарбонил]-4-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 84%
Т.пл.: 86-87oC
Спектр 1H ЯМР (CDCl3) δ: 1.14(3H, т), 2.23(6H, с), 2.45(3H, с), 2.58(2H, кв), 2.87(4H, т), 3.05(3H, с), 3.30(4H, т), 3.98(3H, с), 6.46(3H, м), 7.11(1H, с).
Масс-спектр (EI) m/z: Вычислено для С23H32N4O2 396.2525, найдено 396.2575.
ПРИМЕР 145. 1-[N-Этил-N-(5-этил-2-метокси-6-метилпиридин-3- ил) аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 133, проводили реакцию с использованием 1-[(5-этил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4-(3, 5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 86%
Т.пл.: 84-85oC
Спектр 1H ЯМР (CDCl3) δ: 1.13(6H, м), 2.23(6H, с), 2.41(3H, с), 2.58(2H, кв), 2.85(4H, т), 3.26(4H, т), 3.46(2H, кв), 3.96(3H, с), 6.45(3H, м), 7.08(1H, с).
ПРИМЕР 146. 1-[N-(2-Метокси-6-метил-5-пропилпиридин-3-ил) - N-метиламинокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(2-метокси-6-метил-5-пропилпиридин-3- ил)аминокарбонил]-4-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 89%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.01(3H, т), 1.78(2H, с), 2.21(3H, с), 2.78(2H, т), 3.78(6H, с), 3.86(4H, т), 3.99(3H, с), 4.00 (3H, с), 4.22(4H, т), 6.01(3H, м), 7.02(1H, с).
ПРИМЕР 147. 1-[N-(6-Этил-2-метокси-5-метилпиридин-3-ил)-N- метиламинокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с участием 1-[(6-этил-2-метокси-5-метилпиридин-3-ил) аминокарбонил] -4-(3,5-диметоксифенил)пиперазина с получением целевого соединения.
Выход: 85%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.21(3H, т), 2.21(3H, с), 2.45(2H, кв), 3.21(4H, т), 3.40(3H, с), 3.67(4H, т), 3.77(6H, с), 4.01(3H, с), 6.07(3H, м), 6.96(1H, с), 8.07(1H, с).
ПРИМЕР 148. 1-[N-(2-Метокси-5-метил-6-пропилпиридин-3- ил) - N-метиламинокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(2-метокси-5-метил-6-пропилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил) пиперазина с получением целевого соединения.
Выход: 86%
Т.пл.: 106-107oC
Спектр 1H ЯМР (CDCl3) δ: 0.98(3H, т), 1.73(2H, кв), 2.18(3H, с), 2.63(2H, т), 2.92(4H, т), 3.05(3H, с), 3.29(4H, т), 3.74 (6H, с), 3.96(3H, с), 6.00(3H, м), 7.11(1H, с).
Масс-спектр (EI) m/z: вычислено для C24H34N4O4 442.2580, найдено 442.2543.
ПРИМЕР 149. 1-[N-(5-Ацетил-2-метокси-6-метилпиридин-3-ил) - N-метиламинокарбонил] -4- (3, 5-диметоксифенил) пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил]-4-(3, 5-диметилфенил) пиперазина с получением целевого соединения.
Выход: 89%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.50(3H, с), 2.70(3H, с), 2.97(4H, т), 3.09(3H, с), 3.33(4H, т), 3.75(6H, с), 4.06(3H, с), 6.03 (3H, м), 7.72(1H, с).
Масс-спектр (EI) m/z: вычислено для С23H30N4O5 442.2216, найдено 442.2229.
ПРИМЕР 150. 1-[N-Этил-N-(5-ацетил-2-метокси-6-метилпиридин- 3-ил) аминокарбонил] -4- (3, 5-диметоксифенил) пиперазин:
Тем же способом, что описан в примере 133, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил)аминокарбонил]-4-(3,5-диметоксифенил)пиперазина с получением целевого соединения.
Выход: 87%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.09(3H, т), 2.49(3H, с), 2.70(3H, с), 3.00(4H, т), 3.32(4H, т), 3.77(6H, с), 4.01(3H, с), 4.09(2H, кв), 5.98(3H, м), 7.76(1H, с).
ПРИМЕР 151. 1-[N-(5-Ацетил-2-метокси-6-метилпиридин-3-ил) - N-метиламинокарбонил] -4- (3, 5-диметилфенил) пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил]-4-(3, 5-диметилфенил) пиперазина с получением целевого соединения.
Выход: 88%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.24(6H, с), 2.50(3H, с), 2.70(3H, с), 2.93(4H, т), 3.09(3H, с), 3.28(4H, т), 4.06(3H, с), 6.46 (3H, м), 7.73(1H, с).
ПРИМЕР 152. 1-{N-[5-(1-Гидроксиэтил)-2-метокси-6-метилпиридин-3-ил] -N-метиламинокарбонил}-4-(3, 5- диметоксифенил) пиперазин:
1- [N- (3-Ацетил-2-метокси-6-метилпиридин-3-ил) -N- метиламинокарбонил] -4-(3, 5-диметоксифенил)пиперазин (0.47 ммоля) растворяли в безводном этаноле (15 мл) и в полученную смесь добавляли борогидрид натрия (17,3 мг), после чего смесь перемешивали при комнатной температуре в течение 2 часов. Полученную в результате смесь концентрировали при пониженном давлении с целью удаления этанола и очищали методом колоночной хроматографии (этилацетат: гексан = 2:1) с получением целевого соединения.
Выход: 97%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.14(3H, д), 2.44(3H, с), 2.93(4H, т), 3.06(3H, с), 3.30(4H, т), 3.74(6H, с), 3.98(3H, с), 5.03 (1H, кв), 6.02(3H, м), 7.50(1H, с).
ПРИМЕР 153. 1-{ N-Этил-N-[5-(1-гидроксиэтил)-2-метокси- 6- метилпиридин-3-ил] аминокарбонил}-4- (3, 5- диметоксифенил) пиперазин:
Тем же способом, что описан в примере 152, проводили реакцию с использованием 1-[N-этил-N-(5-ацетил-2-метокси-6-метилпиридин-3- ил) аминокарбонил] -4- (3, 5-диметоксифенил) пиперазина с получением целевого соединения.
Выход: 96%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.09(3H, т), 1.41(3H, д), 2.44(3H, с), 2.91(4H, т), 3.27(4H, т), 3.54(1H, кв), 3.74(6H, с), 3.96(3H, с), 5.03(1H, кв), 6.02(3H, м), 8.46(1H, с).
ПРИМЕР 154. 1-{ N-[5-(1-Гидроксиэтил)-2-метокси-6-метил- пиридин-3-ил] -N-метиламинокарбонил}-4- (3,5- диметилфенил) пиперазин:
Тем же способом, что описан в примере 152, проводили реакцию с использованием 1-[N-метил-N-(5-ацетил-2-метокси-6-метилпиридин- 3-ил) аминокарбонил] -4- (3, 5-диметилфенил) пиперазина с получением целевого соединения.
Выход: 97%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.41(3H, д), 2.24(6H, с), 2.44 (3H, с), 2.91(4H, т), 3.06(3H, с), 3.26(4H, т), 3.99(3H, с), 5.03(1H, кв), 6.49(3H, м), 7.50(1H, с).
ПРИМЕР 155. 1-{ N-[5-(1-Гидрокси-1-метилэтил)-2-метокси- 6- метилпиридин-3-ил] -N-метиламинокарбонил} - 4- (3,5- диметоксифенил)пиперазин:
1- [N-Метил-N-(5-ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил]-4-(3, 5-диметоксифенил)пиперазин (221 мг, 0,5 ммоля) растворяли в тетрагидрофуране (10 мл) и в смесь добавляли бромистый метилмагний (0,50 мл, 1,50 ммоля). Полученную в результате смесь нагревали с обратным холодильником в течение 15 часов, концентрировали при пониженном давлении с целью удаления растворителя, экстрагировали этилацетатом, фильтровали досуха и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 92%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.59(6H, с), 2.66(3H, с), 2.93(4H, т), 3.06(3H, с), 3.30(4H, т), 3.74(6H, с), 3.99(3H, с), 6.03 (3H, м), 7.45(1H, с).
ПРИМЕР 156. 1-{N-[5-(1-Гидрокси-1-метилпропил)-2-метокси-6- метилпиридин-3-ил] -N-метиламинокарбонил} - 4- (3,5-диметилфенил)пиперазин:
1-[N-Метил-N- (5-ацетил-2-метокси-6-метилпиридин-3-ил) аминокарбонил]-4-(3, 5-диметилфенил)пиперазин (213 мг, 0,5 ммоля) растворяли в тетрагидрофуране (10 мл), в полученный раствор медленно добавляли бромистый метилмагний (0,50 мл, 1,50 ммоля) и полученный раствор нагревали с обратным холодильником в течение 15 часов. Полученную в результате смесь концентрировали при пониженном давлении с целью удаления используемого растворителя, экстрагировали этилацетатом, фильтровали досуха и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 88%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 0.79(3H, т), 1.58(3H, с), 1.85(2H, кв), 2.61(3H, с), 2.99(4H, т), 3.07(3H, с), 3.30(4H, т), 3.76(6H, с), 6.12(3H, м), 7.47(1H, с).
ПРИМЕР 157. 1-{N-[2-Meтокcи-5-(1-мeтoкcиэтил)-6-мeтилпиридин-3-ил] -N-метиламинокарбонил}-4- (3, 5- диметоксифенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-{ N-[5-(1-гидроксиэтил)-2-метокси-6- метилпиридин-3-ил] аминокарбонил} -4- (3, 5-диметоксифенил) пиперазина с получением целевого соединения.
Выход: 95%
Т.пл.: 117-119oC
Спектр 1H ЯМР (CDCl3) δ: 1.34(3H, т), 2.43(3H, с), 2.94(4H, т), 3,06(3H, с), 3.18(3H, с), 3.30(4H, т), 3.74(6H, с), 3.99(3H, с), 4.44(1H, кв), 6.02(3H, м), 7.37(1H, с).
ПРИМЕР 158. 1-[N-(2-Метокси-6-метил-5-винилпиридин-3- ил) -N- метиламинокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(2-метокси-6-метил-5-винилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил) пиперазина с получением целевого соединения.
Выход: 94%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.46(3H, с), 2.93(4H, т), 3.07(3H, с), 3.30(4H, т), 3.73(6H, с), 3.99(3H, с), 5.25(1H, д), 5.48(1H, д), 6.01(3H, м), 6.78(1H, с), 7.43(1H, с).
ПРИМЕР 159. 1-[N-(2-Метокси-6-метил-5-винилпиридин-3- ил) -N- метиламинокарбонил]-4-(3,5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(2-метокси-6-метил-5-винилпиридин-3- ил)аминокарбонил]-4-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 89%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 2.24(6H, с), 2.43(3H, с), 2.90(4H, т), 3.04(3H, с), 3.27(4H, т), 3.99(3H, с), 5.23(1H, д), 5.45(1H, д), 6.05(3H, м), 6.77(1H, с), 7.40(1H, с).
ПРИМЕР 160. 1-[N-Этил-N-(2-метокси-6-метил-5-винилпиридин- 3-ил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 133, проводили реакцию с использованием 1-[(2-метокси-6-метил-5-винилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил) пиперазина с получением целевого соединения.
Выход: 92%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.09(3H, т), 2.43(3H, с), 2.94(4H, т), 3.28(4H, т), 3.77(6H, с), 4.01(3H, с), 4.11(2H, кв), 5.25(1H, д), 5.49(1H, д), 5.98(3H, м), 6.77(1H, с), 7.44(1H, с).
ПРИМЕР 161. l-[N-(5-Изoпpoпенил-2-мeтoкcи-6-мeтилпиpидин- 3-ил) -N-метиламинокарбонил] -4- (3, 5-димeтоксифенил) пиперазин:
Тем же способом, что описан в примере 132, проводили реакцию с использованием 1-[(5-изопропенил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметоксифенил) пиперазина с получением целевого соединения.
Выход: 92%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.98(3H, с), 2.43(3H, с), 2.92(4H, т), 3.06(3H, с), 3.29(4H, т), 3.74(6H, с), 3.99(3H, с), 4.84 (1H, с), 5.30(1H, с), 6.01(3H, м), 7.10(1H, с).
ПРИМЕР 162. 1-[N-(5-Изопропенил-2-метокси-5-метилпиридин- 3-ил) -N-метиламинокарбонил] -4- (3, 5- диметилфенил) пиперазин:
Тем же способом, что описан в примере 132, с использованием 1-[(5-изопропенил-2-метокси-6-метилпиридин-3-ил) аминокарбонил] -4- (3, 5-диметилфенил)пиперазина проводили реакцию с получением целевого соединения.
Выход: 91%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.98(3H, с), 2.24(6H, с), 2.43 (3H, с), 2.90(4H, т), 3.06(3H, с), 3.28(4H, т), 4.00(3H, с), 4.84 (1H, с), 5.19(1H, с), 6.46(3H, м), 7.10(1H, с).
ПРИМЕР 163. Этил 2-({[4-(3, 5-диметоксифенил)пиперазино] карбонил} (5-ацетил-2-метокси-6-метилпиридин -3-ил) амино) ацетат:
1- [(5-Ацетил-2-метокси-6- метилпиридин-3-ил) аминокарбонил]-4-(3,5-диметоксифенил)пиперазин (200 мг, 0,5 ммоля) растворяли в диметилформамиде (15 мл) и добавляли гидрид натрия (18,5 мг, 0,5 ммоля), после чего полученный раствор перемешивали при комнатной температуре в течение 15 минут и добавляли этилбромацетат (83,5 мг, 0,5 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 3 часов, концентрировали при пониженном давлении с целью удаления растворителя и очищали методом колоночной хроматографии (этилацетат: гексан = 1:2) с получением целевого соединения.
Выход: 84%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.26(3H, т), 2.51(3H, с), 2.69(3H, с), 3.04(4H, т), 3.43(4H, т), 3.75(6H, с), 4.05(3H, с), 4.15 (2H, кв), 4.19(2H, с), 6.08(3H, с), 7.96(1H, с).
ПРИМЕР 164. Этил 2- ({[4- (3, 5-диметилфенил)пиперазино] карбонил} (5-ацетил-2-метокси-6-метилпиридин-3-ил)амино) ацетат:
Тем же способом, что описан в примере 163, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-6-метилпиридин-3- ил)аминокарбонил]-4-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 80%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.25(3H, т), 2.56(3H, с), 2.69(3H, с), 3.00(4H, т), 3.29(4H, т), 3.78(6H, с), 4.06(3H, с), 4.18(2H, с), 5.99(3H, м), 7.98(1H, с).
ПРИМЕР 165. 2- ({[4- (3, 5-Диметоксифенил)пиперазино]карбонил} (5-ацетил-2-метокси-6-метилпиридин-3- ил) амино) уксусная кислота:
Этил ({ [4-(3,5-диметоксифенил)пиперазино]карбонил} (5- ацетил-2-метокси-6-метилпиридин-3-ил) амино) ацетат (200 мг, 0,38 ммоля) растворяли в смешанном растворителе диоксан:дистиллированная вода = 4:1 (15 мл), добавляли гидрат гидроксида лития (48,1 мг, 1,14 ммоля), после чего смесь перемешивали при комнатной температуре в течение 3 часов. Полученную в результате смесь подкисляли IN-HCl, экстрагировали этилацетатом, фильтровали досуха, концентрировали при пониженном давлении и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 94%
Т.пл.: 135-137oC
Спектр 1H ЯМР(CDCl3) δ: 2.52(3H, с), 2.69(3H, с), 3.11 (4H, т), 3.49(4H, т), 3.74(6H, с), 4.05(3H, с), 4.24(2H, с), 6.15 (3H, м), 7.83(1H, с).
ПРИМЕР 166. Этил 2-({[4-(3, 5-диметоксифенил)пиперазино] карбонил} [5- (1-гидроксиэтил) -2-метокси- 6-метилпиридин-3-ил] амино)ацетат:
Тем же способом, что описан в примере 152, проводили реакцию с использованием этил 2- ({ [4- (3,5-диметоксифенил)пиперазино] карбонил} (5-ацетил-2-метокси-6-метилпиридин-3- ил)амино) ацетата с получением целевого соединения.
Выход: 97%
Т.пл.: 125-127oC
Спектр 1H ЯМР (CDCl3) δ: 1.26(3H, т), 1.42(3H, д), 2.44(3H, с), 3.04(4H, т), 3.31(4H, т), 3.75(6H, с), 3.97(3H, с), 4.16 (2H, кв), 4.19(2H, с), 6.15(3H, м), 7.69(1H, с).
ПРИМЕР 167. Этил 2-({[4-(3,5-диметоксифенил)пиперазино] карбонил} [5- (1-гидроксиэтил) -2-метокси-6-метилпиридин-3-ил] амино)ацетат:
Тем же способом, что описан, в примере 164, проводили реакцию с использованием этил 2-({[4-(3,5-диметоксифенил)пиперазино] карбонил} [5- (1-гидроксиэтил)-2-метокси-6-метилпиридин-3-ил]амино)ацетата с получением целевого соединения.
Выход: 92%
Т.пл.: масляная фаза
Спектр 1H ЯМР (CDCl3) δ: 1.41(3H, д), 2.44(3H, с), 2.98(4H, т), 3.36(4H, т), 3.74(6H, с), 3.98(3H, с), 4.40(2H, с), 5.00 (1H, кв), 6.08(3H, м), 7.69(1H, с).
ПРИМЕР 168. Этил 2-({ [4-(3,5-диметилфенил)пиперазино] карбонил} [5- (1-гидроксиэтил)-2-метокси-6-метилпиридин-3-ил] амино)ацетат:
Тем же способом, что описан в примере 152, проводили реакцию с использованием этил 2-({[4-(3, 5-диметилфенил) пиперазино] карбонил} (5-ацетил-2-метокси-6-метилпиридин-3-ил) амино)ацетата с получением целевого соединения.
Выход: 94%
Т.пл.: 68-70oC
Спектр 1H ЯМР (CDCl3) δ: 1.13(3H, т), 1.47(3H, д), 2.33 (6H, с), 2.44(3H, с), 2.95(4H, т), 3.30(4H, т), 3.98(3H, с), 4.10 (2H, кв), 5.01(1H, кв), 6.46(3H, м), 7.71(1H, с).
ПРИМЕР 169. 2-({ [4-(3,5-Диметилфенил)пиперазино]карбонил} [5- (1-гидроксиэтил)-2-метокси-6-метилпиридин-3-ил]амино)уксусная кислота:
Тем же способом, что описан в примере 165, проводили реакцию с использованием этил 2- ({[4- (3, 5-диметилфенил)пиперазино] карбонил} [5- (1-гидроксиэтил) -2-метокси-6-метилпиридин-3-ил] амино)ацетата с получением целевого соединения.
Выход: 92%
Т.пл.: 114-116oC
Спектр 1H ЯМР (CDCl3) δ: 1.40(3H, д), 2.23(6H, с), 2.40(3H, с), 2.91(4H, т), 3.21(4H, т), 3.98(3H, с), 4.06(2H, с), 4.90(1H, кв), 6.50(3H, м), 6.51(1H, с).
ПРИМЕР 170. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4-фенилпиперазин
а) 3,4-Диметиланизол:
К 3,4-диметилфенолу (19,3 г, 0,16 моля) добавляли метанол (150 мл) и КОН (9,65 г, 0,25 моля), полученную смесь нагревали с обратным холодильником в течение 2 часов. В смесь добавляли йодистый метил (36,5 г, 0,25 моля), полученную смесь нагревали с обратным холодильником в течение 3 часов и после этого добавляли воду (150 мл). Полученную в результате смесь экстрагировали этилацетатом и очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 81%
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.24(3H, с), 3.77(3H, с) 6.71(2H, м), 6.97(1H, с).
b) 4,5-Диметил-2-нитроанизол:
Трифторуксусную кислоту (250 мл) добавляли к 3,4-диметиланизолу (17,1 г, 0,13 моля), после чего при нагревании на водяной бане медленно добавляли нитрит натрия (16,6 г, 0,24 моля) и полученную смесь перемешивали при комнатной температуре в течение 14 часов. После удаления трифторуксусной кислоты и добавления воды полученную в результате смесь экстрагировали эфиром и очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 55%
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.25(3H, с), 2.32(3H, с), 3.94(3H, с), 6.85(1H, с), 7.70(1H, с).
с) 4,5-Диметил-2-метоксианилин:
Тетрагидрофуран (100 мл) и этанол (40 мл) добавляли к 4,5-диметил-2-нитроанизолу (7,80 г, 0,043 моля) и после медленного добавления системы 10% Pd/активированный уголь (0,57 г) в течение 5 часов проводили гидрирование. Реакцию проводили тем же способом, что описан выше, и полученный в результате продукт очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 82%
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.23(3H, с), 2.27(3H, с), 3.90(3H, с), 6.80(1H, с), 7.68(1H, с).
d) Фенил N-(4,5- диметил-2-метоксифенил)карбамат:
К 4,5-диметил-2-метоксианилину (4,50 г, 0,03 моля) добавляли хлористый метилен (100 мл) и медленно прибавляли фенил хлорформиат (4,80 г, 0,03 моля). Полученный в результате раствор перемешивали в течение 2 часов и добавляли воду (150 мл), после чего смесь экстрагировали хлористым метиленом и очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 98%
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.24(3H, с), 2.27(3H, с), 3.89(3H, с), 6.85(1H, с), 7.20(5H, м), 7.90(1H, с).
е) 1-[(4, 5-Диметил-2-метоксифенил) аминокарбонил] -4-фенилпиперазин:
Фенил N-(4, 5-диметил-2-метоксифенил) карбамат (5,422 г, 0.02 моля) и 1-фенилпиперазин (3,44 г, 0,02 моля) растворяли в тетрагидрофуране (10 мл). После добавления DBU (3,04 г, 0.02 моля) полученный в результате раствор перемешивали при комнатной температуре в течение 2 часов, концентрировали и очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 85%
Т.пл.: 143-144oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(3H, с), 3.25(4H, т), 3.67(4H, т), 3.85(3H, с), 6.64(1H, с), 6.94(3H, м), 6.99(1H, с), 7.29(1H, т), 7.91(1H, с).
ПРИМЕР 171. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(3,5- диметоксифенил)пиперазином с получением целевого соединения.
Выход: 85 %
Т.пл.: 119-120oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(3H, с), 3.27(4H, т), 3.70(4H, т), 3.79(6H, с), 3.85(3H, с), 6.17(2H, м), 6.65(1H, с), 6.98(1H, с), 7.90(1H, с).
Масс-спектр (EI) m/z: вычислено для C22H29N3O4 399.2158, найдено 399.2168.
ПРИМЕР 172. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(3,5- диметилфенил)пиперазином с получением целевого соединения.
Выход: 88%
Т.пл.: 177-178oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(3H, с), 2.29(6H, с), 3.23(4H, т), 3.66(4H, т), 3.85(3H, с), 6.58(2H, м), 6.65(1H, с), 6.99(1H, с), 7.92(1H, с).
Масс-спектр (EI) m/z: вычислено для C22H29N3O2 367.2259, найдено 367.2290.
ПРИМЕР 173. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4-(2,3-диметилфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(2,3- диметилфенил)пиперазином с получением целевого соединения.
Выход: 95%
Т.пл.: 140-142oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.21(3H, с), 2.22(3H, с), 2.27(3H, с), 2.29(3H, с), 2.95(4H, т), 3.67(4H, т), 3.85(3H, с), 6.65(1H, с), 7.01(3H, м), 7.93(1H, с).
ПРИМЕР 174. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (2,3,5, 6-тетраметилфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил М-(4,5-диметил-2-метоксифенил)карбаматом и 1-(2, 3, 5, 6-тетраметилфенил) пиперазином с получением целевого соединения.
Выход: 93%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(9H, с), 2.21(9H, с), 3.17(4H, т), 3.63(4H, т), 3.84(3H, с), 6.64(1H, с), 6.84(1H, с), 7.95(1H, с).
ПРИМЕР 175. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (3, 5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(3,5- дифторфенил)пиперазином с получением целевого соединения.
Выход: 89%
Т.пл.: 102-103oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.22(3H, с), 3.29(4H, т), 3.68(4H, т), 3.85(3H, с), 6.65(1H, с), 6.97(3H, м), 7.89(1H, с).
ПРИМЕР 176. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (2-хлорфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил М-(4,5-диметил-2-метоксифенил)карбаматом и 1-(2- хлорфенил)пиперазином с получением целевого соединения.
Выход: 90%
Т.пл.: 176-177oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.21(3H, с), 2.22(3H, с), 3.10(4H, т, J= 5.0 Гц), 3.69(4H, т, J=5.0 Гц), 3.85(3H, с), 6.65(1H, с), 7.02(2H, м), 7.24(1H, м), 7.39(1H, д, J=4.0 Гц), 7.92 (1H, с).
ПРИМЕР 177. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4-(3-хлорфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(3- хлорфенил)пиперазином с получением целевого соединения.
Выход: 84%
Т.пл.: 75-76oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.22(3H, с), 3.27(4H, т, J= 5.0 Гц), 3.68(4H, т, J=5.0 Гц), 3.85(3H, с), 6.65(1H, с), 6.90(3H, м), 7.21(1H, т), 7.90(1H, с).
Масс-спектр (El) m/z: вычислено для C20H24N3O2Cl1 373.1557, найдено 373.1590.
ПРИМЕР 178. 1- [(4,5-Диметил-2-метоксифенил) аминокарбонил] -4- (2-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4, 5-Диметил-2-метоксифенил) карбаматом и 1-(2- гидроксифенил)пиперазином с получением целевого соединения.
Выход: 87%
Т.пл.: 197-199oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(3H, с), 2.98(4H, т), 3.72(4H, т), 3.84(3H, с), 6.65(1H, с), 6.89(1H, т), 7.00(2H, м), 7.13(2H, м), 7.89(1H, с).
ПРИМЕР 179. 1-[(4, 5-Диметил-2-метоксифенил)аминокарбонил] -4- (3-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5- диметил-2-метоксифенил)карбаматом и 1-(3-гидроксифенил)пиперазином с получением целевого соединения.
Выход: 88%
Т.пл.: 177-178oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.19(3H, с), 2.21(3H, с), 3.24(4H, т), 3.68(4H, т), 3.85(3H, с), 6.41(3H, м), 6.65(1H, с), 6.98(1H, с), 7.13(1H, т), 7.88(1H, с).
ПРИМЕР 180. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (3-тиофенил) пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(3-тиофенил)пиперазином с получением целевого соединения.
Выход: 79%
Т.пл.: 108-110oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(3H, с), 3.26(4H, т), 3.65(4H, т), 3.84(3H, с), 6.64(1H, с), 6.97(4H, м), 7.05(1H, с), 7.89(1H, с).
ПРИМЕР 181. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (2-ацетоксифенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом
и 1-(2-ацетоксифенил)пиперазином с получением целевого соединения.
Выход: 84%
Т.пл.: 129-131oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(3H, с), 2.32(3H, с), 3.05(4H, т), 3.63(4H, т), 3.85(3H, с), 6.64(1H, с), 6.99(1H, с), 7.04(1H, м), 7.17(2H, м), 7.22(1H, м), 7.90(1H, c).
ПРИМЕР 182. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (3-ацетоксифенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбатом и 1-(3- ацетоксифенил)пиперазином с получением целевого соединения.
Выход: 87%
Т.пл.: 154-156oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(3H, с), 2.29(3H, с), 3.27(4H, т), 3.68(4H, т), 3.85(3H, с), 6.64(1H, с), 6.66(2H, м), 6.82(1H, м), 6.98(1H, с), 7.90(1H, с).
ПРИМЕР 183. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (2-метоксифенил) пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(2- метоксифенил)пиперазином с получением целевого соединения.
Выход: 90%
Т.пл.: 144-145oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.22(3H, с), 2.26(3H, с), 2.95(4H, т, J= 5.0 Гц), 3.65(4H, т, J=5.0 Гц), 3.78(3H, с), 3.85(3H, с), 6.59(1H, с), 6.65(1H, с), 7.00(1H, с), 7.11(1H, с), 7.93(1H, с).
ПРИМЕР 184. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (5-метокси-2-метилфенил) пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(5- метокси-2-метилфенил)пиперазином с получением целевого соединения.
Выход: 88%
Т.пл.: 140-141oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.22(3H, с), 2.26(3H, с), 2.95(4H, т, J= 5.0 Гц), 3.65(4H, т, J=5.0 Гц), 3.78(3H, с), 3.85(3H, с), 6.59(1H, с), 6.65(1H, с), 7.00.(1H, с), 7.11(1H, с), 7.93(1H, с).
ПРИМЕР 185. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (2-метокси-5-метилфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(2-метокси-5-метилфенил)пиперазином с получением целевого соединения.
Выход: 80%
Т.пл.: 107-108oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(3H, с), 2.29(3H, с), 3.10(4H, т, J= 5.0 Гц), 3.69(4H, т, J=5.0 Гц), 3.85(3H, с), 3.86(3H, с), 6.55(1H, с), 6.79(2H, м), 7.01(1H, с), 9.94(1H, с).
ПРИМЕР 186. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] -4- (2-метокси-5-фенилфенил)пиперазин:
По методике, описанной в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(2-метокси-5- фенилфенил)пиперазином с получением целевого соединения.
Выход: 91%
Т.пл.: 139-140oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.21(3H, с), 2.22(3H, с), 3.20(4H, т), 3.74(4H, т), 3.85(3H, с), 3.94(3H, с), 6.65(1H, с), 7.02(2H, м), 7.32(2H, м), 7.42(2H, т), 7.55(2H, д), 7.93(1H, с).
ПРИМЕР 187. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (2-изопропенилфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(2-изопропенилфенил)пиперазином с получением целевого соединения.
Выход: 80%
Т.пл.: 134-135oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(6H, с), 3.10(4H, т), 3.64(4H, т), 3.85(3H, с), 5.08(1H, с), 5.14(1H, с), 6.64(1H, с), 7.05(3H, м), 7.70(1H, м), 7.92(1H, с).
ПРИМЕР 188. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (1-нафтил)пиперазин:
По методике, описанной в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(1- нафтил)пиперазином с получением целевого соединения.
Выход: 92%
Т.пл.: 160-162oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.24(3H, с), 3.31(4H, т, J= 5.0 Гц), 3.83(3H, с), 4.04(4H, т), 6.39(2H, м), 6.69(1H, с), 7.13(1H, т), 7.30(1H, с), 7.46(1H, с).
ПРИМЕР 189. 1-[(4,5-Диметил-2-метоксифенил)аминокарбонил] - 4- (1-антранил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)карбаматом и 1-(1- антранил)пиперазином с получением целевого соединения.
Выход: 94%
Т.пл.: 74-75oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.22(3H, с), 3.24(4H, т), 3.70(4H, т), 3.86(3H, с), 6.70(1H, с), 7.05(3H, м), 7.45(5H, м), 8.00(2H, м).
ПРИМЕР 190. 1-[N-(4,5-диметил-2-метоксифенил)-N- метиламинокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
1- [(4, 5-Диметил-2-метоксифенил) аминокарбонил] -4- (3, 5- диметоксифенил)пиперазин (0,2 г, 0,5 ммоля) растворяли в диметилформамиде (15 мл), медленно добавляли гидрид натрия (12 мг, 0,5 ммоля), после чего полученную в результате смесь перемешивали при комнатной температуре в течение 15 минут, добавляли иодметан (71 мг, 0,5 моля) и полученную смесь перемешивали при комнатной температуре в течение 16 часов. Полученную в результате смесь концентрировали при пониженном давлении с целью удаления используемого растворителя, экстрагировали хлористым метиленом, сушили, фильтровали и очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 92%
Т.пл.: 86-88oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.21(3H, с), 2.24(3H, с), 2.92(4H, т), 3.06(3H, с), 3.31(4H, т), 3.75(6H,), 3.83(3H, с), 6,00(3H, м), 6.71(1H, с), 6.83(1H, с).
Масс-спектр (EI) m/z: вычислено для C23H31N3O4 413.2314, найдено 413.2293.
ПРИМЕР 191. 1- [N- (4, 5-Диметил-2-метоксифенил) -N-метил- аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 190, проводили реакцию с использованием 1-[(4,5-диметил-2-метоксифенил)аминокарбонил] -4-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 90%
Т.пл.: 137-138oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.15(3H, с), 2.24(9H, с), 2.88(4H, т), 3.06(3H, с), 3.29(4H, т), 3.83(3H, с), 6.45(3H, м), 6.71(1H, с), 6.83(1H, с).
Масс-спектр (EI) m/z: вычислено для C23H29N3O2 381.2416, найдено 381.2436.
ПРИМЕР 192. 1-[N-(4,5-Димeтил-2-мeтoкcифeнил)-N-метилaминокарбонил] -4- (3, 5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 190, проводили реакцию с использованием 1-[(4,5-диметил-2-метоксифенил)аминокарбонил] -4- (3,5-дифторфенил)пиперазина с получением целевого соединения.
Выход: 87%
Т.пл.: 98-100oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.16(3H, с), 2.25(3H, с), 2.92(4H, т), 3.06(3H, с), 3.29(4H, т), 3.83(3H, с), 6.23(3H, м), 6.72(1H, с), 6.83(1H, с).
ПРИМЕР 193. 1- [N-Этил-N-(4, 5-диметил-2-метоксифенил) аминокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
1- [(4, 5-Диметил-2-метоксифенил) аминокарбонил] -4- (3, 5- диметоксифенил) пиперазин (0,2 г, 0,5 моля) растворяли в диметилформамиде (15 мл) и в полученный раствор медленно добавляли гидрид натрия (12 мг, 0,5 ммоля). Полученную в результате смесь перемешивали при комнатной температуре в течение 15 минут. После добавления иодметана (78 мг, 0,5 ммоля) полученную смесь перемешивали при комнатной температуре в течение 16 часов. Полученную в результате смесь концентрировали при пониженном давлении с целью удаления используемого растворителя, экстрагировали хлористым метиленом, сушили, фильтровали и очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 89%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.09(3H, т), 2.16(3H, с), 2.24(3H, с), 2.75(4H, т), 3.28(4H, т), 3.52(2H, кв), 3.75(6H, с), 3.81(3H, с), 5.98(3H, м), 6.70(1H, с), 6.80(1H, с).
ПРИМЕР 194. 1-[N-(4,5-Диметил-2-метоксифенил)-N-этиламинокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 193, проводили реакцию с использованием 1-[(4,5-диметил-2-метоксифенил)аминокарбонил] -4-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 93%
Т.пл.: 80-82oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.21(3H, т), 2.15(3H, с), 2.23(9H, с), 2.90(4H, т), 3.25(4H, т), 3.59(2H, кв), 3.81(3H, с), 6.45(3H, м), 6.69(1H, с), 6.81(1H, с).
ПРИМЕР 195. 1- [N- (4, 5-Диметил-2-метоксифенил) -N-этиламинокарбонил] -4- (3, 5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 193, проводили реакцию с использованием 1-[(4,5-диметил-2-метоксифенил)аминокарбонил] -4- (3,5-дифторфенил)пиперазина с получением целевого соединения.
Выход: 87%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.09(3H, т), 2.16(3H, с), 2.25(3H, с), 2.90(4H, т), 3.27(4H, т), 3.52(2H, кв), 3.81(3H, с), 6.24(3H, м), 6.70(1H, с), 6.81(1H, с).
ПРИМЕР 196. 1-[N-Изопропил-N-(4,5-диметил-2-метоксифенил) аминокарбонил] -4- (3, 5-дифторфенил)пиперазин:
1- [(4, 5-Диметил-2-метоксифенил) аминокарбонил] -4- (3, 5- дифторфенил) пиперазин (0,2 г, 0,52 ммоля) растворяли в диметилформамиде (15 мл) и медленно добавляли гидрид натрия (12,48 мг, 0,52 моля). Полученную в результате смесь перемешивали при комнатной температуре в течение 15 минут. После добавления 2- иодпропана (87,88 мг, 0,52 ммоля) полученную в результате смесь перемешивали при комнатной температуре в течение 16 часов. Полученную смесь концентрировали при пониженном давлении с целью удаления используемого растворителя, экстрагировали хлористым метиленом, сушили, фильтровали и очищали методом колонной хроматографии с получением целевого соединения.
Выход: 84%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.10(3H, с), 1.26(3H, с), 2.20(3H, с), 2.25(3H, с), 2.86(4H, т), 3.26(4H, т), 3.77(3H, с), 4.25(1H, м), 6.17(3H, м), 6.68(1H, с), 6.82(1H, с).
ПРИМЕР 197. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил]-4-(3,5-диметоксифенил) пиперазин:
а) Фенил N-(4,5-диметил-2-метоксифенил)тиокарбамат:
К 3,4-диметил-2-метоксианилину (4,50 г, 0,03 моля) добавляли хлористый метилен (100 мл) и затем медленно добавляли фенилхлортионоформиат (5,16 г, 0,03 моля). Полученную в результате смесь перемешивали в течение 2 часов, после чего добавляли воду (150 мл). Полученную смесь экстрагировали хлористым метиленом и очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 92%
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.21(3H, с), 2.25(3H, с), 3.85(3H, с), 6.80(1H, с), 6.93(5H, м), 7.31(1H, с).
b) 1- [(4, 5-Диметил-2-метоксифенил) аминотиокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Фенил N-(4,5-диметил-2-метоксифенил)тиокарбамат (0,2 г, 0,7 ммоля) и 1-(3,5-диметоксифенил) пиперазин (0,16 г, 0,7 ммоля) растворяли в тетрагидрофуране (10 мл) и добавляли DBU (0,11 г, 0,7 ммоля), после чего смесь перемешивали при комнатной температуре в течение 2 часов. Полученный в результате продукт концентрировали и очищали методом хроматографии с получением целевого соединения.
Выход: 84%
Т.пл.: 128-129oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.24(3H, с), 2.32(6H, с), 3.37(4H, т), 3.83(3H, с), 4.08(4H, т), 6.69(3H, м), 7.39(1H, м), 7.47(1H, с).
Масс-спектр (EI) m/z: вычислено для C22H29N3O3S1 415.1929, найдено 415.1912.
ПРИМЕР 198. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил]-4-(3,5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(3,5- диметилфенил)пиперазином с получением целевого соединения.
Выход: 90%
Т.пл.: 164-165oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.24(3H, с), 2.32(6H, с), 3.37(4H, т), 3.83(3H, с), 4.08(4H, т), 6.69(3H, м), 7.39(1H, м), 7.47(1H, с).
Масс-спектр (EI) m/z: вычислено для C22H29O1S1 383.2031, найдено 383.2086.
ПРИМЕР 199. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил]-4-(2, 3-диметилфенил)пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифонил)тиокарбаматом и 1-(2, 3- диметилфенил) пиперазином с получением целевого соединения.
Выход: 89%
Т.пл.: 151-152oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.21(3H, с), 2.24(3H, с), 2.29(6H, с), 3.03(4H, т), 3.83(3H, с), 4.10(4H, т), 6.69(1H, с), 6.97(2H, м), 7.11(1H, т).
ПРИМЕР 200. 1- [(4, 5-Диметил-2-метоксифенил) аминотиокарбонил] -4- (3, 5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(3,5-дифторфенил)пиперазином с получением целевого соединения.
Выход: 92%
Т.пл.: 167-168oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.24(3H, с), 2.27(3H, с), 2.32(3H, с), 3.39(4H, т, J=5.0 Гц), 3.83(3H, с), 4.14(4H, т), 6.70(1H, с), 6.80(2H, м), 7.36(1H, с), 7.44(1H, с).
ПРИМЕР 201. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил]-4-(3, 5-дихлорфенил)пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(3,5-дихлорфенил)пиперазином с получением целевого соединения.
Выход: 85%
Т.пл.: 188-189oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.24(3H, с), 3.35(4H, т, J= 5.0 Гц), 3.83(3H, с), 4.04(4H, т, J=5,0 Гц), 6.70(2H, м), 6.83(1H, с), 7.30(1H, с), 7.48(1H, с).
Масс-спектр (EI) m/z: вычислено для C20H24N3O2Cl1 423.0938, найдено 423.0956.
ПРИМЕР 202. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил] -4- (2-фторфенил) пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(2-фторфенил)пиперазином с получением целевого соединения.
Выход: 87%
Т.пл.: 139-140oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.21(3H, с), 2.24(3H, с), 3.40(4H, т), 3.83(3H, с), 4.25(4H, т), 6.70(1H, с), 7.13(3H, м), 7.37 (2H, м).
ПРИМЕР 203. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил] -4- (2-хлорфенил) пиперазин:
По методике, описанной в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(2- хлорфенил)пиперазином с получением целевого соединения.
Выход: 85%
Т.пл.: 115-116oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.21(3H, с), 2.24(3H, с), 3.18(4H, т), 3.83(3H, с), 4.09(4H, т), 6.69(1H, с), 7.05(2H, м), 7.33(1H, с), 7.41(2H, м).
ПРИМЕР 204. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил] -4- (2-метоксифенил) пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(2- метоксифенил) пиперазином с получением целевого соединения.
Выход: 90%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.23(3H, с), 3.14(4H, т, J= 5.0 Гц), 3.82(3H, с), 3.88(3H, с), 4.06(4H, т, J= 5.0 Гц), 6.69(1H, с), 6.94(3H, м), 7.30(1H, с), 7.40(1H, с).
ПРИМЕР 205. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил]-4-(2-метилтиофенил)пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(2- метилтиофенил)пиперазином с получением целевого соединения.
Выход: 93%
Т.пл.: 136-137oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2,26(3H, с), 2.45(3H, с), 3.33(4H, т), 3.82(3H, с), 4.39(4H, т), 6.74(1H, с), 7.16(3H, м), 7,47(2H, м).
ПРИМЕР 206. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил]-4-(3-гидроксифенил)пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(3- гидроксифенил)пиперазином с получением целевого соединения.
Выход: 77%
Т.пл.: разложение (200oC)
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.17(3H, с), 2.23(3H, с), 3.31(4H, т), 3,82 (3H, с),4.03(3H, т), 6,37(2, м), 6.47(1H, д), 6.69(1H, с), 7.13(1H, т), 7.45(1H, с).
ПРИМЕР 207. l-[(4,5-Диметил-2-мeтoкcифeнил)aминoтиoкарбонил] -4- (2-феноксифенил) пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(2- феноксифенил) пиперазином с получением целевого соединения.
Выход: 86%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.17(3H, с), 2.24(3H, с), 3.19(4H, т), 3.80(3H, с), 3.85(4H, т), 6.66(1H, с), 6.91(2H, м), 6.98(1H, м), 7.05(3H, м), 7.13(1H, м), 7.23(1H, м), 7.31(2H, м), 7.36(1H, с).
ПРИМЕР 208. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил]-4-(2-изопропенилфенил)пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(2-изопропенилфенил)пиперазином с получением целевого соединения.
Выход: 75%
Т.пл.: 157-158oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.21(3H, с), 2.24(3H, с), 3.19(4H, т), 3.82(3H, с), 4.05(4H, т), 5.07(1H, с), 5.16(1H, с), 6.69(1H, с), 7.11(3H, м), 7.33(1H, с), 7.45(1H, с).
ПРИМЕР 209. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил] -4- (2-метокси-5-метилфенил) пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(2- метокси-5-метилфенил) пиперазином с получением целевого соединения.
Выход: 87%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.23(3H, с), 2.29(3H, с), 3.13(4H, т), 3.83(3H, с), 3.85(3H, с), 4.05(4H, т), 6.69(1H, с), 6.83(2H, м), 7.30(1H, с), 7.40(1H, с).
ПРИМЕР 210. 1-[(4,5-Диметил-2-метоксифенил)аминотиокарбонил] -4- (1-нафтил) пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(4,5-диметил-2-метоксифенил)тиокарбаматом и 1-(1- нафтил)пиперазином с получением целевого соединения.
Выход: 87%
Т.пл.: 139-140oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.23(3H, с), 2.24(3H, с), 3.21(4H, т), 3.84(3H, с), 4.09(4H, т), 6.70(1H, с), 7.10(1H, д), 7.48(5H, м), 7.85(1H, м), 8.22(1H, д).
ПРИМЕР 211. 1-[(5-Ацетил-2-метокси-4-метилфенил)аминокарбонил] -4-(3,5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(5-ацетил-2-метокси-4-метилфенил)карбаматом и 1- (3,5-диметоксифенил)пиперазином с получением целевого соединения.
Выход: 91%
Т.пл.: 103-105oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.54(3H, с), 2.59(3H, с), 3.27(4H, т), 3.70(4H, т), 3.79(6H, с), 3.94(3H, с), 6.13(3H, м), 6.70(1H, с), 7.05(1H, с), 8.72(1H, с).
ПРИМЕР 212. 1-[(5-Ацетил-2-метокси-4-метилфенил)аминокарбонил] -4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(5-ацетил-2-метокси-4-метилфенил)карбаматом и 1- (3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 88
Т.пл.: 140-142oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.30(3H, с), 2.54(3H, с), 2.59(3H, с), 3.26(4H, т), 3.70(4H, т), 3.97(3H, с), 6.61(3H, м), 6.70(1H, с), 7.06(1H, с), 8.72(1H, с).
ПРИМЕР 213. 1-[(5-Aцeтил-2-метoкcи-4-метилфeнил)aминoкарбонил] -4- (3, 5-дихлорфенил)пиперазин:
Тем же способом, что описан в примере 170, проводили реакцию между фенил N-(5-ацетил-2-метокси-4-метилфенил)карбаматом и 1- (3,5-дихлорфенил)пиперазином с получением целевого соединения.
Выход: 78%
Т.пл.: 170-172oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.54(3H, с), 2.59(3H, с), 3.32(4H, т), 3.74(4H, т), 3.94(3H, с), 6.69(1H, с), 6.86(3H, с), 7.04(1H, с), 8.69(1H, с).
ПРИМЕР 214. 1-{[5-(1-Гидроксиэтил)-2-метокси-4-метилфенил] аминокарбонил}-4- (3, 5-диметоксифенил)пиперазин:
1- [(5-Ацетил-2-метокси-4-метилфенил) аминокарбонил] -4- (3,5-диметоксифенил) пиперазин (0,2 г, 0.47 ммоля) растворяли в безводном этаноле (15 мл), добавляли борогидрид натрия (17 мг) и затем полученную в результате смесь перемешивали при комнатной температуре в течение 2 часов, концентрировали при пониженном давлении с целью удаления этанола и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 96%
Т.пл.: 152-154oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.41(3H, д), 2.32(3H, с), 3.27(4H, т), 3.71(4H, т), 3.79(6H, с), 3.87(3H, с), 5.04(1H, кв), 6.10(3H, м), 6.63(1H, с), 7.01(1H, с), 8.22(1H, с).
ПРИМЕР 215. 1-{[5-(1-Гидроксиэтил)-2-метокси-4-метилфенил] аминокарбонил}-4- (3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 214, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-4-метилфенил) аминокарбонил]-4-(3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 96%
Т.пл.: 140-142oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.48(3H, д), 2.33(3H, с), 3.26(4H, т), 3.68(4H, т), 3.87(3H, с), 5.06(1H, кв), 6.61(1H, м), 6.64(1H, с), 7.01(1H, с), 8.22(1H, с).
ПРИМЕР 216. 1-[(2-Метокси-4-метил-5-винилфенил)аминокарбонил]-4-(3,5-диметоксифенил)пиперазин:
1-{ [5- (1-Гидроксиэтил) -2-метокси-4-метилфенил] аминокарбонил}- 4-(3,5-диметоксифенил)пиперазин (0,2 г, 0,47 ммоля) растворяли в хлороформе (15 мл), добавляли п-толуолсульфонат пиридиния (0,12 г, 0,47 ммоля) и полученную в результате смесь нагревали с обратным холодильником в течение 16 часов, концентрировали при пониженном давлении с целью удаления хлороформа и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 84%
Т.пл.: 163-165oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.31(3H, с), 3.23(4H, т), 3.58(4H, т), 3.77(6H, с), 3.87(3H, с), 5.20(1H, д), 5.62(1H, д), 6.59(3H, м), 6.63(1H, с), 6.88(1H, т), 6.99(1H, с), 8,32(1H, с).
ПРИМЕР 217. 1-[(2-Метокси-4-метил-5-винилфенил)аминокарбонил] -4-(3, 5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 216, проводили реакцию с использованием 1-{[5-(1-гидроксиэтил)-2-метокси-4-метилфенил] аминокарбонил}-4- (3, 5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 82%
Т.пл.: 201-203oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.29(6H, с), 2.34(3H, с), 3.24(4H, т), 3.68(4H, т), 3.87(3H, с), 5.22(1H, д), 5.66(1H, д), 6.59(3H, м), 6.63(1H, с), 6.86(1H, т), 7.02(1H, с), 8.32(1H, с).
ПРИМЕР 218. 1-[(5-Ацетил-2-метокси-4-метилфенил)аминотиокарбонил]-4-(3,5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(5-ацетил-2-метокси-4-метилфенил)тиокарбаматом и 1- (3,5-диметоксифенил) пиперазином с получением целевого соединения.
Выход: 82%
Т.пл.: 163-165oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.16(3H, с), 2.56(3H, с), 3.35(4H, т), 3.91(6H, с), 4.03(4H, т), 4.13(4H, т), 6.06(3H, м), 6.73(1H, с), 8.62(1H, с).
ПРИМЕР 219. 1-[(5-Ацетил-2-метокси-4-метилфенил)аминотиокарбонил] -4- (3, 5-диметилфенил) пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(5-ацетил-2-метокси-4-метилфенил)тиокарбаматом и 1- (3,5-диметилфенил)пиперазином с получением целевого соединения.
Выход: 79%
Т.пл.: 180-182oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2,29(6H, с), 2.57(6H, с), 3.32(4H, т), 3.92(3H, с), 4.12(4H, т), 6.56(3H, м), 6.72(1H, с), 7.39(1H, с), 8.63(1H, с).
ПРИМЕР 220. 1-[(5-Ацетил-2-метокси-4-метиленил)аминотиокарбонил] -4- (3, 5-дихлорфенил)пиперазин:
Тем же способом, что описан в примере 197, проводили реакцию между фенил N-(5-ацетил-2-метокси-4-метилфенил)тиокарбаматом и 1- (3,5-дихлорфенил)пиперазином с получением целевого соединения.
Выход: 79%
Т.пл.: 201-203oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.20(3H, с), 2.57(3H, с), 3.46(4H, т), 3.92(3H, с), 4.25(4H, т), 6.64(1H, с), 6.88(3H, м), 7.72(1H, с), 8.57(1H, с).
ПРИМЕР 221. 1-{[5-(1-Гидроксиэтил)-2-метокси-4-метилфенил) аминотиокарбонил] -4- (3, 5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 214, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-4-метилфенил) аминотиокарбонил]-(3,5-диметоксифенил)пиперазина с получением целевого соединения.
Выход: 94%
Т.пл.: 146-148oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.44(3H, д), 2.32(3H, с), 3.35(4H, т), 3.78(6H, с), 3.84(3H, с), 4.11(4H, т), 5.06(1H, кв), 6.13(3H, м), 6.66(1H, с), 7.41(1H, с), 7.77(1H, с).
ПРИМЕР 222. 1-{ [5-(1-Гидроксиэтил)-2-метокси-4-метилфенил] аминотиокарбонил}-4- (3,5-диметилфенил)пиперазин:
Тем же способом, что описан в примере 214, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-4-метилфенил) аминотиокарбонил]-4-(3, 5-диметилфенил) пиперазина с получением целевого соединения.
Выход: 93%
Т.пл.: 150-152oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.44(3H, д), 2.29(6H, с), 2.32(3H, с), 3.30(4H, т), 3.84(3H, с), 4.07(4H, т), 5.06(1H, кв), 6.61(3H, м), 6.66(1H, с), 7.38(1H, с), 7.79(1H, с).
ПРИМЕР 223. 1-{ [5-(1-Гидроксиэтил)-2-метокси-4-метилфенил] аминотиокарбонил} -4- (3, 5-дихлорфенил)пиперазин:
Тем же способом, что описан в примере 214, проводили реакцию с использованием 1-[(5-ацетил-2-метокси-4-метилфенил) аминотиокарбонил]-4-(3, 5-дихлорфенил)пиперазина с получением целевого соединения.
Выход: 77%
Т.пл.: 166-168oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.45(3H, д), 2.33(3H, с), 3.35(4H, т), 3.84(3H, с), 4.03(4H, т), 5.07(1H, кв), 6.68(3H, м), 6.83(1H, с), 7.37(1H, с), 7.82(1H, с).
ПРИМЕР 224. Этил 2-({[4-(3,5-диметоксифенил)пиперазино] - карбонил}-2-метокси-4,5-диметиланилино)ацетат:
1- [(4, 5-Диметил-2-метоксифенил) аминокарбонил] -4- (3, 5- диметоксифенил)пиперазин (0,2 г, 0,5 ммоля) растворяли в диметилформамиде (15 мл), добавляли гидрид натрия (18,5 г, 0,5 ммоля) и полученную в результате смесь перемешивали при комнатной температуре. Затем добавляли этилбромацетат (83,5 мг, 0,5 ммоля) и полученную в результате смесь перемешивали в течение 3 часов, концентрировали при пониженном давлении с целью удаления используемого растворителя и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 79%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.36(3H, т), 2.15(3H, с), 2.23(3H, с), 2.91(4H, т), 3.22(4H, т), 3.82(6H, с), 4.12(3H, с), 4.18(2H, с), 5.98(3H, м), 6.69(1H, с), 7.03(1H, с).
ПРИМЕР 225. Этил 2-({[4-(3,5-диметилфенил)пиперазино]карбонил}- 2-метокси-4,5-диметиланилино)ацетат:
Тем же способом, что описан в примере 224, проводили реакцию с использованием 1-[(4,5-диметил-2-метоксифенил)аминокарбонил] -4- (3,5-диметилфенил)пиперазина с получением целевого соединения.
Выход: 78%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 1.26(3H, т), 1.56(6H, с), 2.17(3H, с), 2.24(3H, с), 3.32(4H, т), 3.52(4H, т), 3.82(3H, с), 4.15(2H, кв), 4.18(2H, с), 6.70(3H, м), 6.94(1H, с), 7.46(1H, с).
ПРИМЕР 226. 2-({ [4-(3,5-Диметоксифенил)пиперазино]карбонил}- 2-метокси-4,5-диметиланилино)уксусная кислота:
Этил 2-({[4-(3,5-диметоксифенил)пиперазино]карбонил}-2- метокси-4,5-диметиланилино)ацетат (200 мг, 0,41 ммоля) растворяли в смеси диоксан: дистиллированная вода (4:1, 15 мл), добавляли моногидрат гидроксида лития (50,7 мг, 1,23 ммоля) и полученную в результате смесь перемешивали при комнатной температуре в течение 3 часов, подкисляли 1N-хлористоводородной кислотой, экстрагировали этилацетатом, фильтровали досуха, концентрировали при пониженном давлении с целью удаления используемого растворителя и очищали методом колоночной хроматографии (этилацетат:гексан = 1:2) с получением целевого соединения.
Выход: 80%
Т.пл.: 188-189oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.14(3H, с), 2.23(3H, с), 2.93(4H, т), 3.35(4H, т), 3.75(6H, с), 3.87(3H, с), 4.18(2H, с), 5.96(3H, м), 6.71(1H, с), 7.71(1H, с).
ПРИМЕР 227. 2-({[4-(3, 5-Диметилфенил) пиперазино] карбонил}- 2-метокси-4,5-диметиланилино)уксусная кислота:
Тем же способом, что описан в примере 226, проводили реакцию с использованием этил 2-({[4-(3, 5-диметилфенил) пиперазино] карбонил}-2-метокси-4, 5-диметиланилино)ацетата с получением целевого соединения.
Выход: 78%
Т.пл.: 170-171oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.13(3H, с), 2.24(9H, с), 2.91(4H, т), 3.35(4H, т), 3.83(3H, с), 4.18(2H, с), 6.45(3H, м), 6.70(2H, с), 6.80(1H, с).
ПРИМЕР 228. 1-[(2-Гидрокси-4,5-диметилфенил) аминокарбонил] -4- (3, 5-диметоксифенил) пиперазин:
а) 4,5-Диметил-2-нитрофенол:
К 3,4-диметилфенолу (12,1 г, 0,1 моля) добавляли трифторуксусную кислоту (250 мл) и при нагревании на водяной бане медленно добавляли нитрит натрия (12,4 г, 0,18 моля). Полученную в результате смесь перемешивали при комнатной температуре в течение 14 часов и концентрировали при пониженном давлении с целью удаления трифторуксусной кислоты, после чего добавляли воду (150 мл), экстрагировали эфиром и очищали метолом колоночной хроматографии с получением целевого соединения.
Выход: 80%
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.23(3H, с), 2.29(3H, с), 6.93(1H, с), 7.84(1H, с).
b) 4,5-Диметил-2-гидроксианилин:
К 4,5-диметил-2-нитрофенолу (11,7 г, 0,07 моля) добавляли тетрагидрофуран (100 мл) и этанол (40 мл), далее добавляли 10% палладий/активированный уголь (0,57 г) и после этого смесь гидрировали в течение 5 часов. Реакционную смесь концентрировали и подвергали хроматографической очистке в соответствии с описанной выше методикой с получением целевого соединения.
Выход: 77%
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.11(6H, с), 6.56(2H, с).
с) Фенил N-(4, 5-диметил-2-гидроксифенил) карбамат:
К 4,5-диметил-2-гидроксианилину (6,80 г, 0,05 моля) добавляли хлористый метилен (100 мл) и затем медленно добавляли фенилхлорформиат (8,0 г, 0,05 моля). После перемешивания в течение 2 часов, добавления воды (150 мл), экстракции хлористым метиленом и очистки методом колоночной хроматографии получали целевое соединение.
Выход: 92%
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.17(6H, с), 6.74(1H, с), 7.15(5H, м), 7.31(1H, с).
d) Фенил N-[2-(трет.-бутилдиметилсилилокси)-4, 5-диметилфенил]карбамат:
К смеси фенил N-(4,5-диметил-2-гидроксифенил)карбамата (7,72 г, 0,03 моля) и имидазола (2,2 г, 33 ммоля) добавляли хлористый метилен (100 мл) и при перемешивании добавляли трет.-бутилдиметилсилил хлорид (5,0 г, 33 ммоля). Затем смесь перемешивали в течение 2 часов и добавляли воду (150 мл). Полученную в результате смесь экстрагировали хлористым метиленом, сушили, концентрировали при пониженном давлении и очищали методом колоночной хроматографии с получением целевого соединения.
Выход: 83%
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 0.27(6H, с), 0.98(9H, с), 2.17(6H, с), 7.12(5H, м), 7.30(2H, с).
е) 1-[(2-Гидрокси-4,5-диметилфенил)аминокарбонил] -4-(3,5-диметоксифенил)пиперазин:
Фенил N- [2- (трет.-бутилдиметилсилилокси) -4, 5-диметилфенил]карбамат (0,17 г, 0,5 ммоля) и 1-(3,5-диметоксифенил)пиперазин (0,13 г, 0,6 ммоля) растворяли в тетрагидрофуране (10 мл) и при перемешивании добавляли DBU (0,09 г, 0,6 ммоля), после чего полученную в результате смесь перемешивали в течение 2 часов, концентрировали и подвергали хроматографической очистке с получением целевого соединения.
Выход: 87%
Т.пл.: 145-146oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.14(3H, с), 2.18(3H, с), 3.26(4H, т), 3,67(4H, т), 3,79(6H, с), 6,07(3H, м), 6.40(3H, м), 6.67(1H, с), 6.82(1H, с), 8.87(1H, с).
ПРИМЕР 229. 1-[(2-Гидрокси-4,5-диметилфенил)аминокарбонил]-4-(3,5-диметоксифенил)пиперазин:
Тем же способом, что описан в примере 228, проводили реакцию между фенил N-(2-гидрокси-4,5-диметилфенил)карбаматом и 1-(3,5- диметилфенил)пиперазином с получением целевого соединения.
Выход: 84%
Т.пл.: 160-162oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.13(3H, с), 2.17(3H, с), 2.31(6H, с), 3.26(4H, т), 3.75(4H, т), 6.73(3H, м), 6.81(1H, с), 8.86(12H, с).
ПРИМЕР 230. 1-[(2-Гидрокси-4,5-диметилфенил)аминокарбонил] -4- (3, 5-дифторфенил)пиперазин:
Тем же способом, что описан в примере 228, проводили реакцию между фенил N-(2-гидрокси-4,5-диметилфенил)карбаматом и 1-(3, 5- дифторфенил)пиперазином с получением целевого соединения.
Выход: 80%
Т.пл.: 152-154oC
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.17(3H, с), 2.20(3H, с), 3.30(4H, т), 3.70(4H, т), 6.40(3H, м), 6.70(1H, с), 6.82(1H, с), 6.98 (1H, с).
ПРИМЕР 231. 1-[(2-Гидрокси-4,5-диметилфенил)аминокарбонил] -4- (3, 5-дихлорфенил)пиперазин:
Тем же способом, что описан в примере 228, проводили реакцию между фенил N-(2-гидрокси-4,5-диметилфенил)карбаматом и 1-(3, 5- дихлорфенил) пиперазином с получением целевого соединения.
Выход: 77%
Т.пл.: масляная фаза
Спектр 1H ЯМР (500 МГц, CDCl3) δ: 2.15(3H, с), 2.20(3H, с), 3.32(4H, т), 3.69(4H, т), 6.29(3H, м), 6.69(1H, с), 6.81(1H, с), 8.65(1H, с).
Противоопухолевые активности соединений настоящего изобретения испытывали in vitro против 5 видов человеческих опухолевых клеточных линий лейкемии. Методы и результаты in vitro приведены ниже.
Экспериментальный пример 1: In vitro противоопухолевый эффект против человеческих опухолевых клеточных линий.
А. Опухолевая клеточная линия: А549 (человеческая не-малая легочная клетка)
SKOV-3 (человеческая яичниковая)
НСТ-15 (человеческая толстая кишка)
XF 498 (человеческая CNS)
SKMEL (человеческая меланома)
В. Методика SRB анализа.
а. Клеточные линии твердой опухоли человека, А549 (не-малая легочная клетка), SKMEL-2 (меланома), НСТ-15 (толстая кишка), SKOv-3 (яичниковая), XF 498 (CNS) культивировали при 37oC в инкубаторах с 5% CO2 с использованием среды RPMI 1640, содержащей 10% FBS, при этом их последовательно, один или два раза в неделю, подвергали культивированию с переносом. Клеточные культуры растворяли в растворе, содержащем 0,25% трипсина и 3 мМ СДТА PBS(-), после этого клетки отделяли от среды, на которой они были закреплены.
b. 5•103 ~ 2•104 клеток добавляли в каждую лунку 96-луночного планшета и культивировали в инкубаторе с 5% CO2 при 37oC в течение 24 часов.
c. Каждый образец лекарственного средства растворяли в небольшом количестве DMSO и разбавляли используемой средой до заранее установленной экспериментальной концентрации, причем конечную концентрацию DMSO регулировали на значении ниже 0,5%.
d. Среду каждой лунки, культивируемую в течение 24 часов, как описано выше в пункте (b), удаляли аспирацией. Каждые 200 мкл лекарственных образцов, приготовленных в пункте (с), добавляли в каждую лунку и лунки культивировали в течение 48 часов. Tz (нулевое время) планшеты собирали в момент времени, соответствующий введению лекарственного средства.
е. В соответствии с методикой, SRB анализа, на Tz планшетах и планшетах конца культивации осуществляли фиксацию клеток с помощью TCA, окрашивание 0,4% SRB раствором, промывку 1% уксусной кислотой и элюирование красителя 10 мМ Трис раствором, после чего измеряли значения оптической плотности (ОД) при длине волны 520 нм.
С. Количественная обработка результатов.
а. Значение нулевого времени (Tz) определяли измерением SRB белкового индекса в момент времени, соответствующий введению лекарственного средства.
b. Контрольное значение (С) определяли по величине ОД в лунке, не обработанной лекарственным средством.
c. Опытное значение лекарственной обработки (Т) определяли по величине ОД лунки, обработанной лекарственным средством.
d. Эффекты действия лекарственных препаратов оценивали по стимуляции роста, нетто ингибированию роста, нетто уничтожению и т.п., используя для расчета значения Tz, C и Т.
е. Если Т ≥ Tz, то функцию клеточной реакции рассчитывали по формуле
100 • (T-Tz)/(C-Tz),
и если Т < Tz, по формуле
100 • (T-Tz)/Tz.
Полученные результаты представлены в таблице 1.
Литература
1. P.Skehan, R.Strong, D.Scudiero, A.Monks, J.B.McMahan. D.T.Vistica, J. Warren, H. Bokesh, S. Kenny and M. R.Boyd: Proc. Am.Assoc.Cancer Res.30, 612(1989).
2. L. V. Rubinstein, R.H.Shoemaker, K.D.Paull, R.M.Simon, S.Tosini, P. Skehan, D. Scudiero, A. Monks and M. R. Boyd: J.Natl. Cancer Inst., 82, 1113(1990).
3. P.Skehan, R.Strong, D.Scudiero, A.Monks, J.B.McMahan, D.T.Vistica, J. Warren, H.Bokesh, S.Kenny and M.R.Boyd: J.Natl. Cancer Inst., 82, 1107(1990).
D. Результаты
Было установлено, что соединения настоящего изобретения превосходят по противоопухолевым активностям цисплатин, являющийся одним из контрольных агентов, и обладают одинаковыми или более высокими противоопухолевыми активностями, чем адриамицин, другой контрольный агент, в отношении клеточных линий твердых раковых опухолей человека.
Экспериментальный пример 2. In vitro противоопухолевые эффекты против клеток животной лейкемии
А. Материалы
Опухолевые клеточные линии: L1210 (клетка мышиной лейкемии)
P388 (клетка мышиной лимфоидной неоплазмы)
В. Метод: Анализ на вытеснение красителя
1. Концентрации L1210 и P388 клеток, подлежащих культивации в RPMI 1640 среде, содержащей 10% FBS, устанавливали равными 1•106 клеток/мл.
2. Образцы лекарственных средств с соответствующими концентрациями, разбавленными в соотношении log дозировок, добавляли в клеточную среду и проводили культивацию при 37oC в течение 48 часов в инкубаторе с 50% CO2, после чего измеряли число выживших клеток с помощью теста на вытеснение красителя с использованием трипана голубого.
3. Определяли концентрацию образцов соединений, демонстрирующих 50% ингибирование клеточного роста (IC50) по сравнению с контрольным веществом; полученные результаты представлены в таблице 2.
Литература
1. P.Skehan, R.Strong, D.Scudiero, A.Monks, J.B.McMahan. D.T.Vistica, J. Warren, H. Bokesh, S. Kenny and M. R.Boyd: Proc. Am.Assoc.Cancer.Res 30, 612(1989).
2. L. V. Rubinstein, R.H.Shoemaker, K.D.Paull, R.M.Simon, S.Tosini, P. Skehan, D.Scudiero, A.Monks: J.Natl. Cancer Inst., 82, 1113(1990).
3. P.Skehan, R.Strong, D.Scudiero, J.B.McMahan, D.T. Vistica, J.Warren, H.Bokesh, S.Kenny and M.R.Boyd: J.Natl. Cancer Inst., 82, 1107(1990).
C. Результаты.
В результате измерений противоопухолевых активностей соединений настоящего изобретения против L1210 и P388 мышиных раковых клеток было установлено, что испытанные соединения обладают противоопухолевыми активностями, которые равны или выше соответствующих значений для контрольного лекарства, митомицина C.
Экспериментальный пример 3. In vitro противоопухолевые эффекты против P388 клеток мышиной лейкемии.
A. Экспериментальный материал
Использовали мышей разновидности BDFl.
В. Методика эксперимента.
1. Лейкозные P388 клетки, подвергнутые последовательной культивации с переносом в DBA/2 мышах, трансплантировали в каждую мышь из группы, состоящей из 8 мышей вида BDFl в возрасте 6 недель, с дозировкой 1•106 клеток/0,1 мл.
2. Образцы лекарственных средств растворяли в PBS или суспендировали в 0,5% Твине 80 и затем инъектировали в брюшную полость мышей с каждой предписанной концентрацией в 1, 5 и 9 дни эксперимента, соответственно.
3. Осуществляя ежедневное наблюдение, измеряли времена выживания испытуемых мышей. Противоопухолевые активности определяли путем расчета увеличивающегося отношения (T/C%) среднего числа дней выживания в группах, обработанных лекарством, в сравнении с контрольной группой с использованием средних времен выживания для каждой тестируемой группы.
Полученные результаты представлены в таблице 3.
Литература
A.Goldin с сотр., Euro.J.Cancer, 17, 129(1981).
C. Результаты
В ходе in vivo экспериментов с использованием P388 мышиных раковых клеток наблюдался значительный противоопухолевый эффект соединений, указанных в примерах.
Экспериментальный пример 4. Тест на острую токсичность (LD50): метод Litchfield-Wilcoxon
ICR мышам в возрасте 6 недель (самцы 30±2,0 г) обеспечивали свободное кормление твердой пищей и водой при комнатной температуре 23±1oC и влажности 60±5%. Образцы лекарственных средств инъектировали в брюшные полости мышей, причем каждая испытуемая группа включала 6 мышей. В течение 14-дневного наблюдения регистрировали данные о внешнем виде, жизнеспособности и смертности, а затем в результате вскрытия умерших мышей наблюдали визуальные патогенезы. Значения LD50 рассчитывали методом Litchfield-Wilcoxon.
Полученные результаты представлены в следующей ниже таблице 4.
В соответствии с представленными выше результатами было установлено, что соединения настоящего изобретения более безопасны и превосходят по противоопухолевым активностям цисплатин, и, соответственно, решены такие проблемы, присущие известным лекарствам, как ограничение дозировки, токсичность и т.д.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1996 |
|
RU2126001C1 |
| ПРОИЗВОДНЫЕ 9-АМИНОАКРИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2269524C2 |
| НОВЫЕ ПРОТИВОВИРУСНЫЕ ГОМОКАРБОЦИКЛИЧЕСКИЕ НУКЛЕОЗИДНЫЕ ПРОИЗВОДНЫЕ ЗАМЕЩЕННЫХ ПИРИМИДИНДИОНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 1996 |
|
RU2138487C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОПОЛИМЕРА ЭТИЛЕН-α-ОЛЕФИНДИЕНА | 2012 |
|
RU2599626C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА | 1994 |
|
RU2124511C1 |
| АРОМАТИЧЕСКОЕ АМИДИНОВОЕ ПРОИЗВОДНОЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2139851C1 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНИЛПИРАЗОЛА И ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1995 |
|
RU2146675C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2176640C2 |
| 2-ПИРИДИЛЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ALK5 И/ИЛИ ALK4 | 2012 |
|
RU2612958C2 |
| НОВОЕ ПРОИЗВОДНОЕ 3-(4-(БЕНЗИЛОКСИ)ФЕНИЛ)ГЕКС-4-ИНОВОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКОГО ЗАБОЛЕВАНИЯ, ВКЛЮЧАЮЩАЯ ЕГО В КАЧЕСТВЕ ЭФФЕКТИВНОГО ИНГРЕДИЕНТА | 2014 |
|
RU2628077C2 |
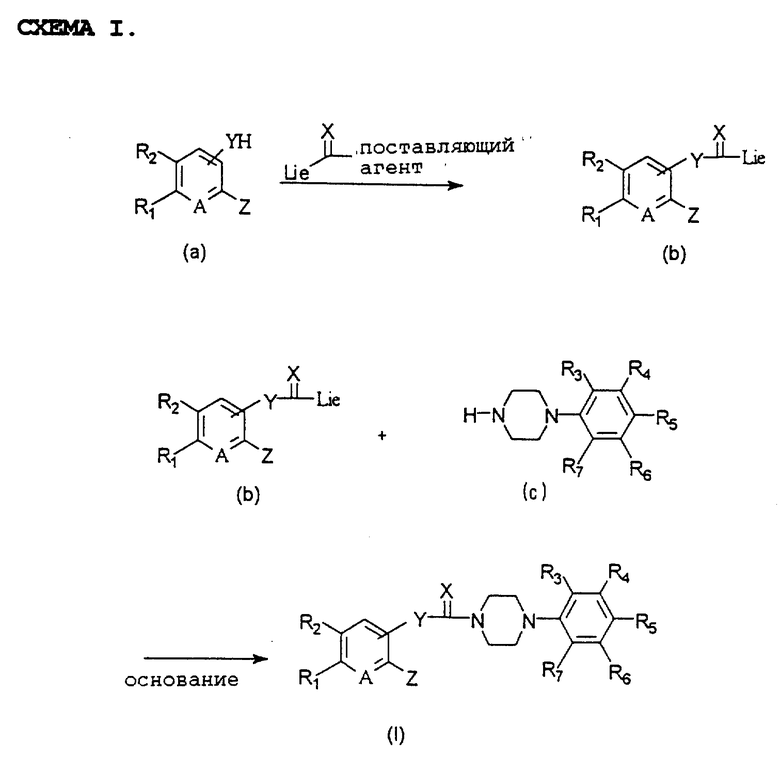
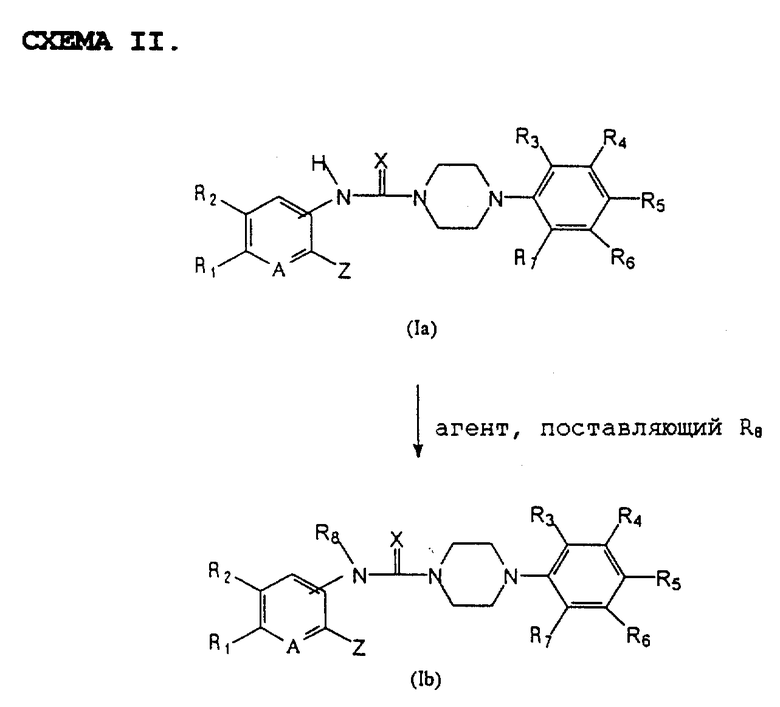
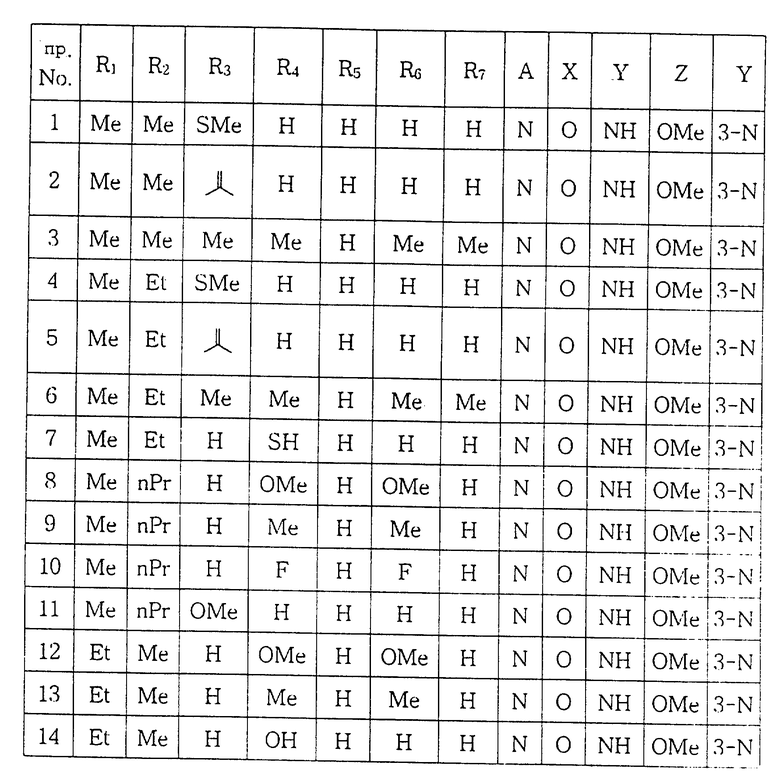
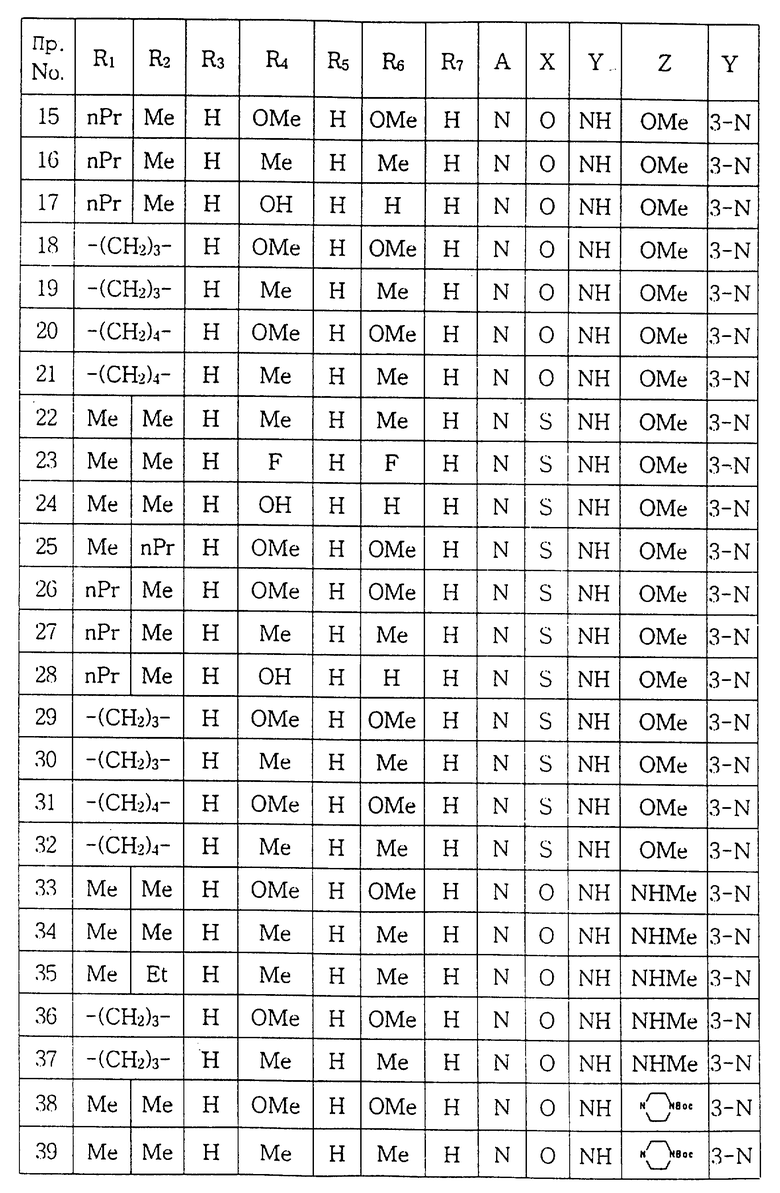
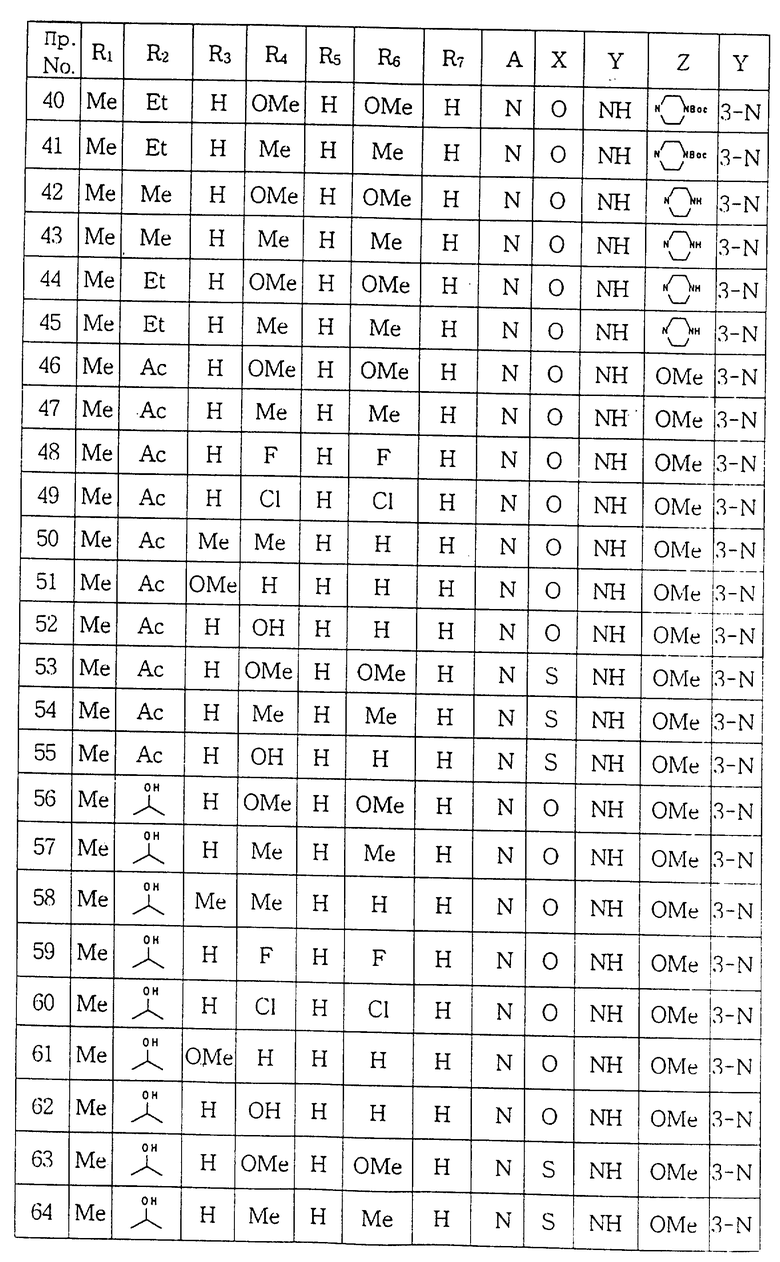
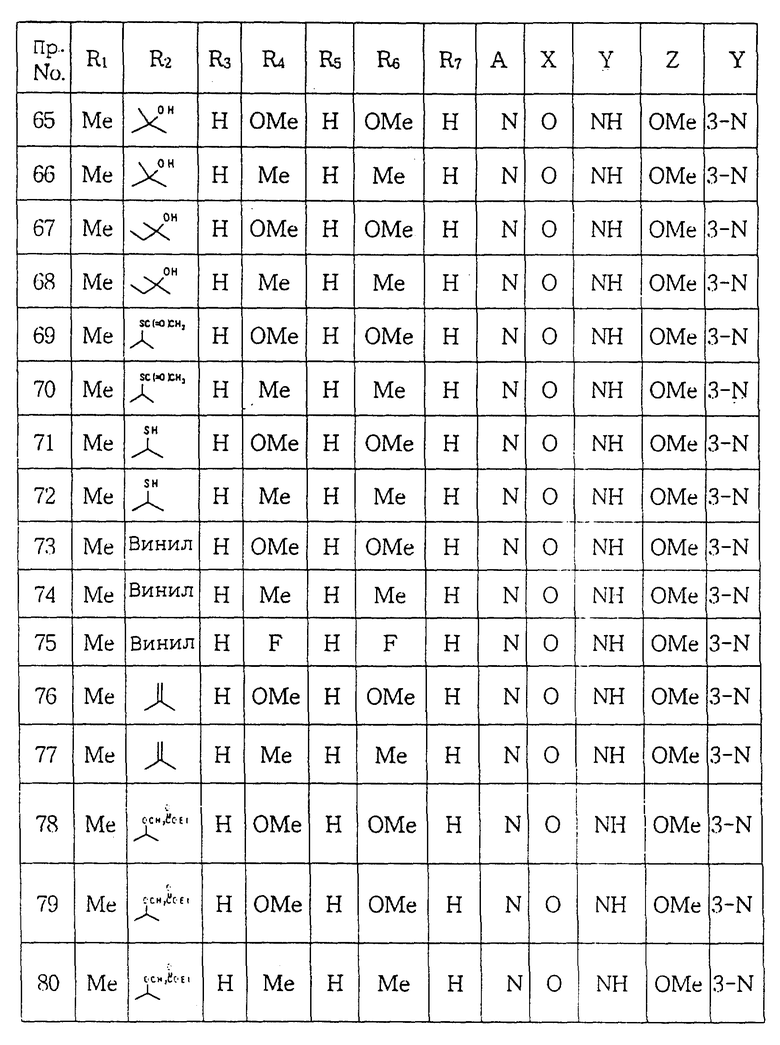
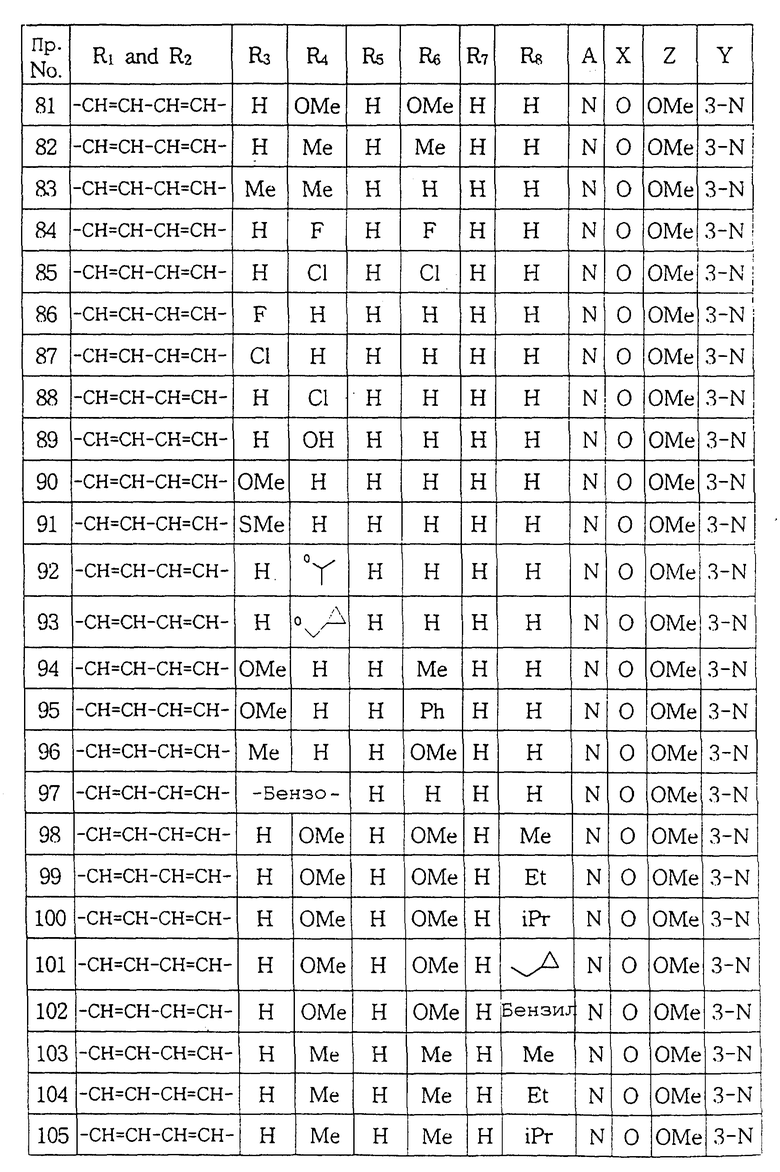
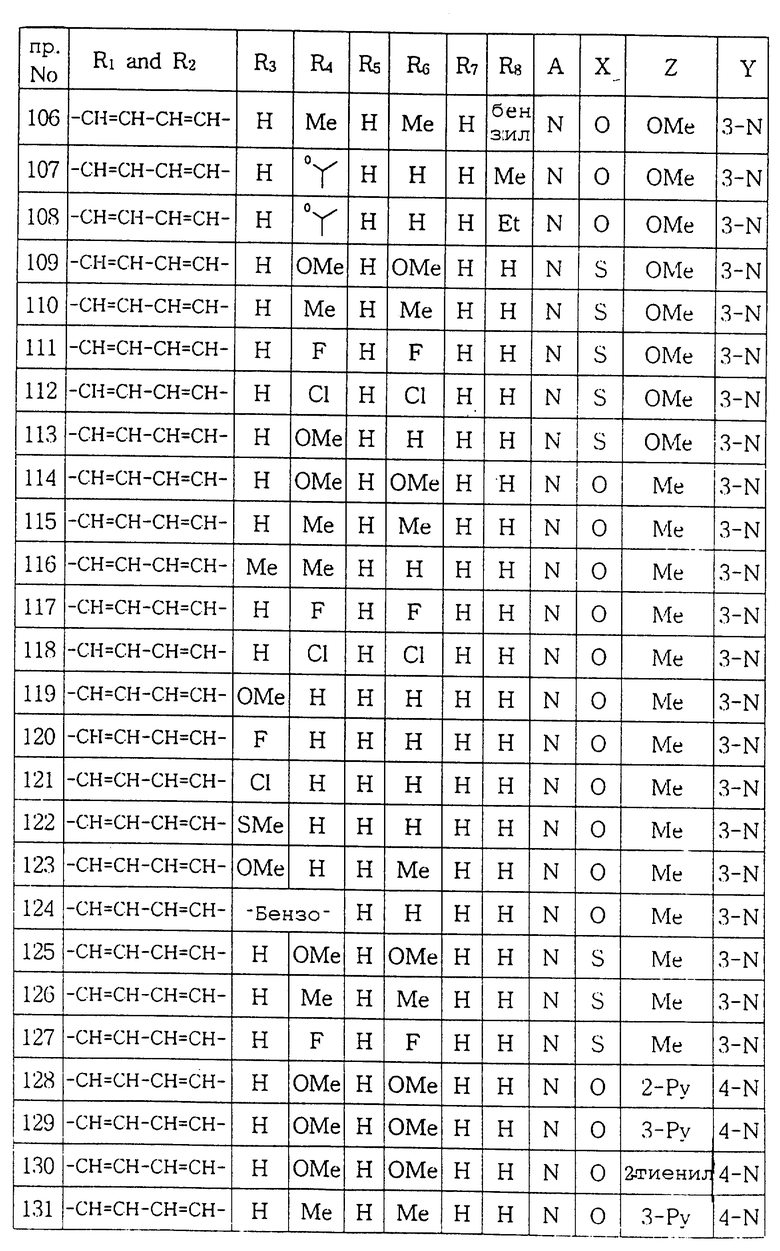
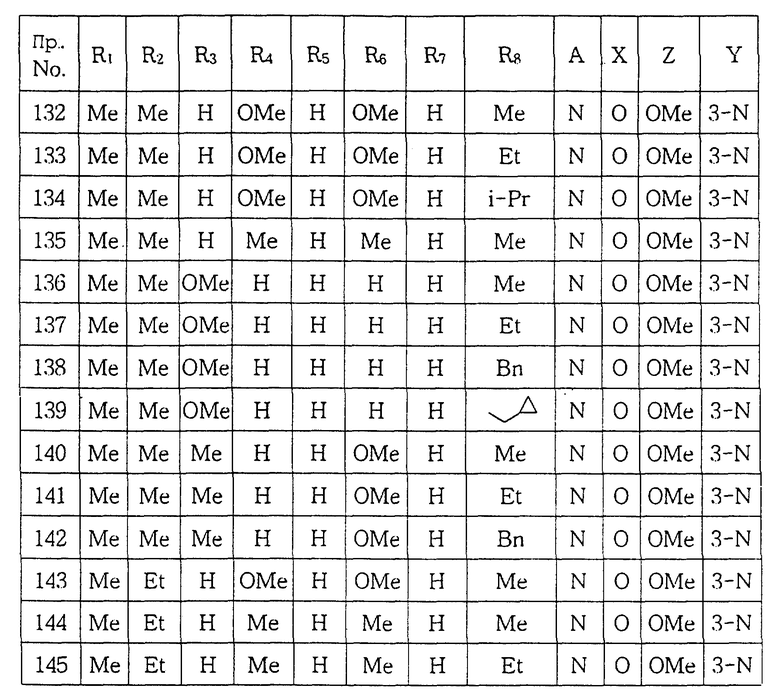
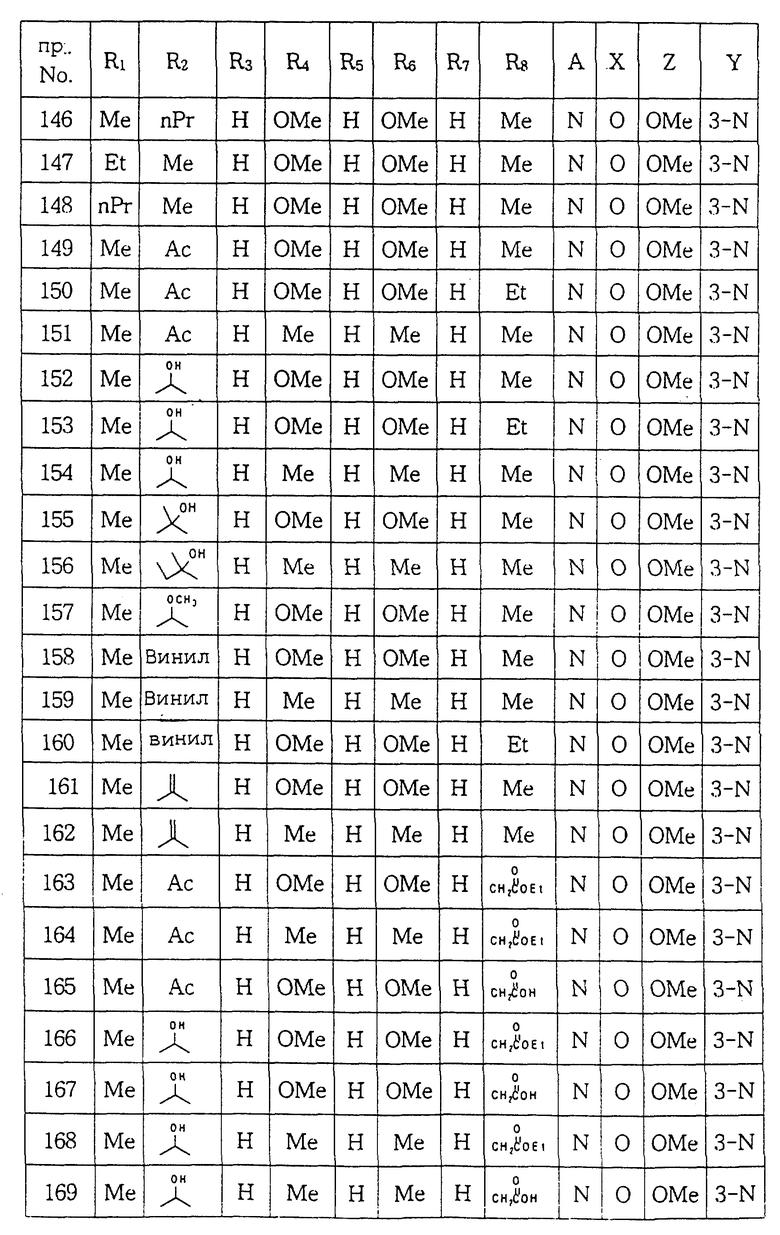
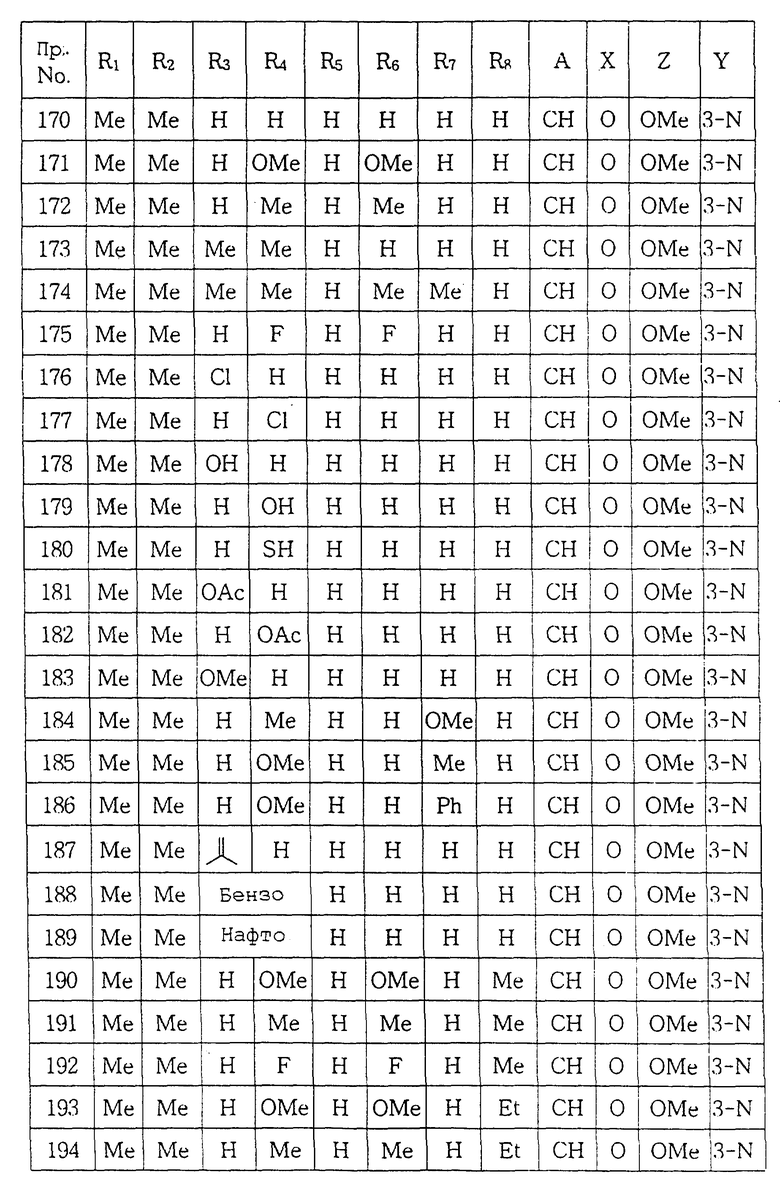
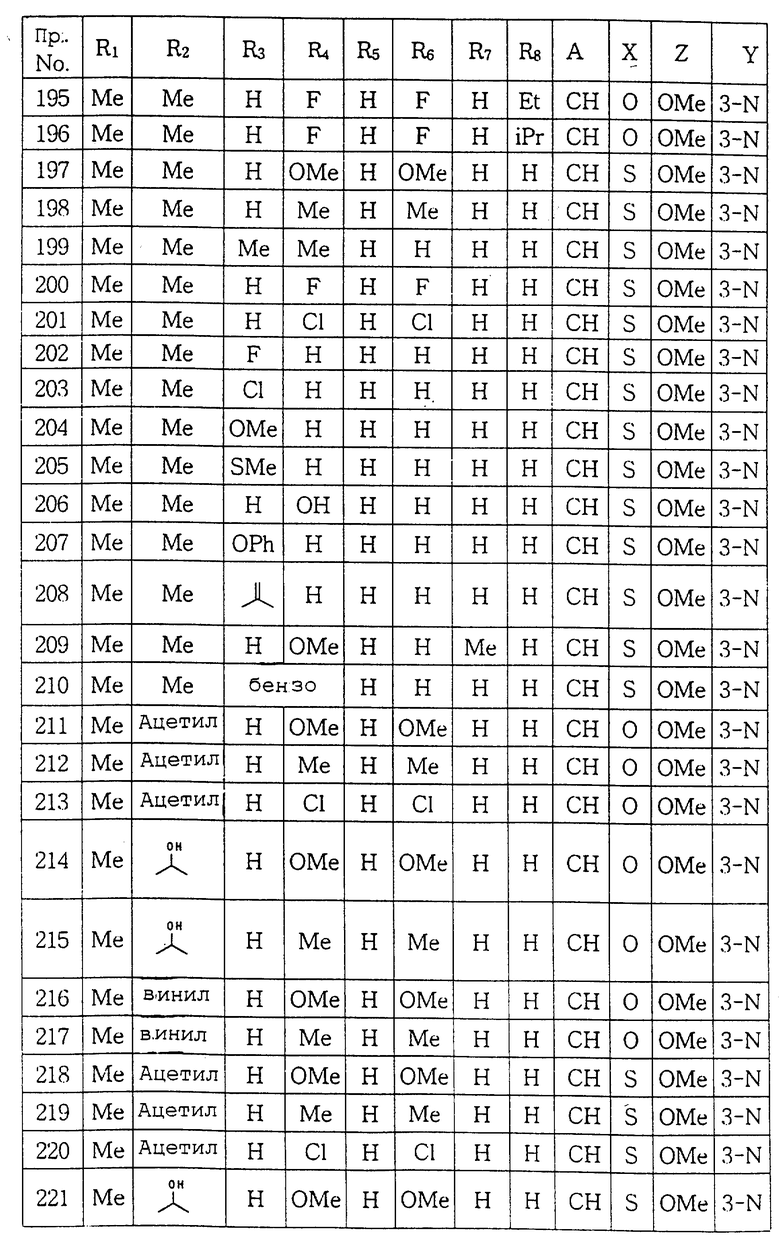
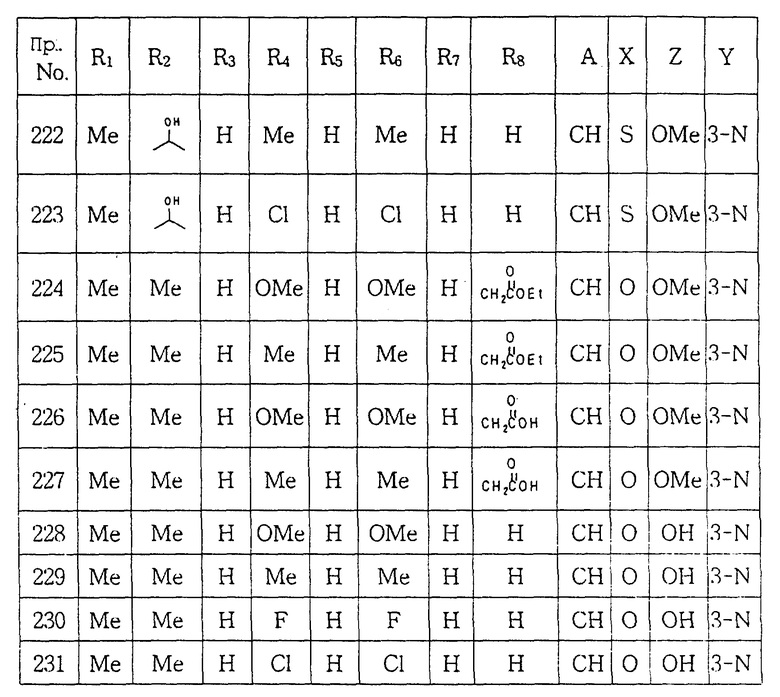
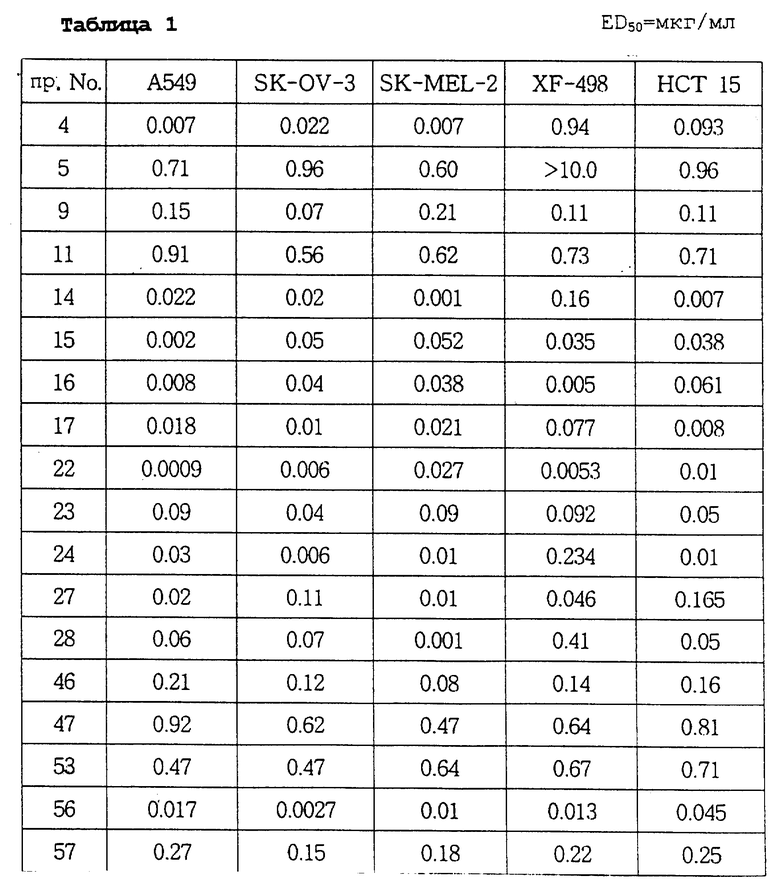
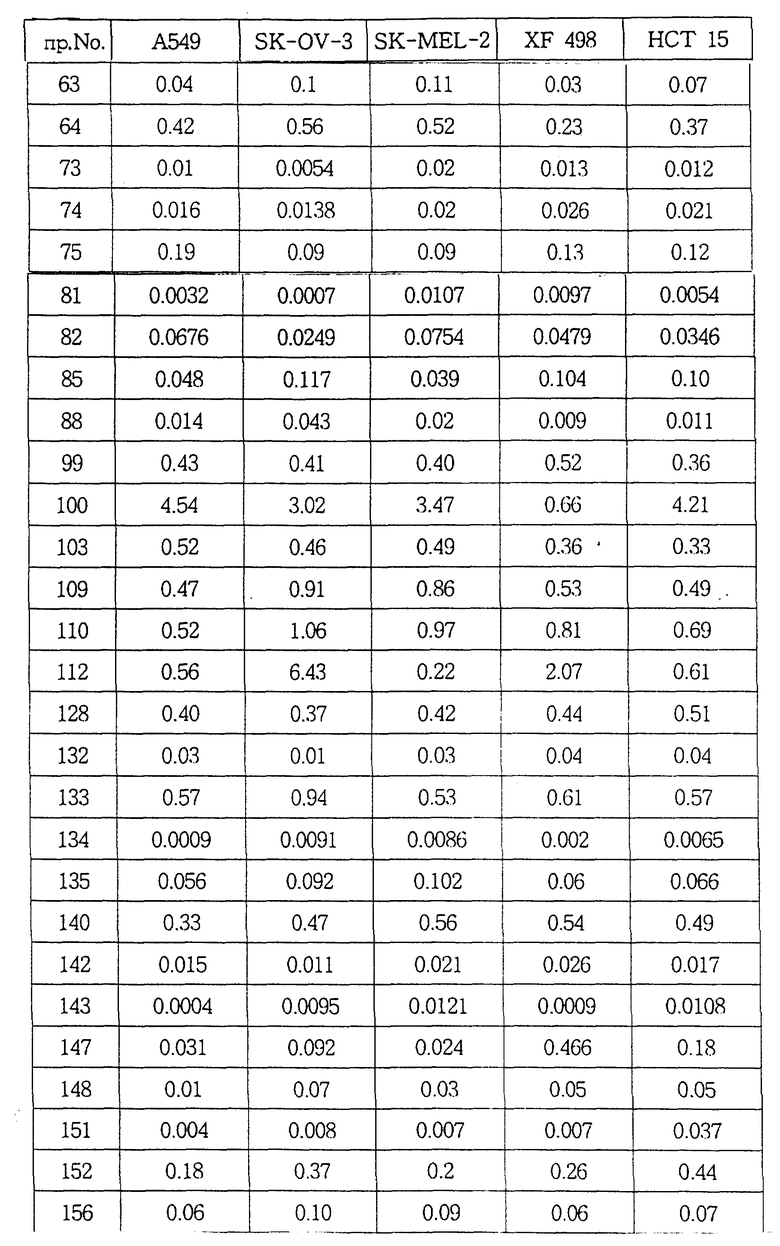
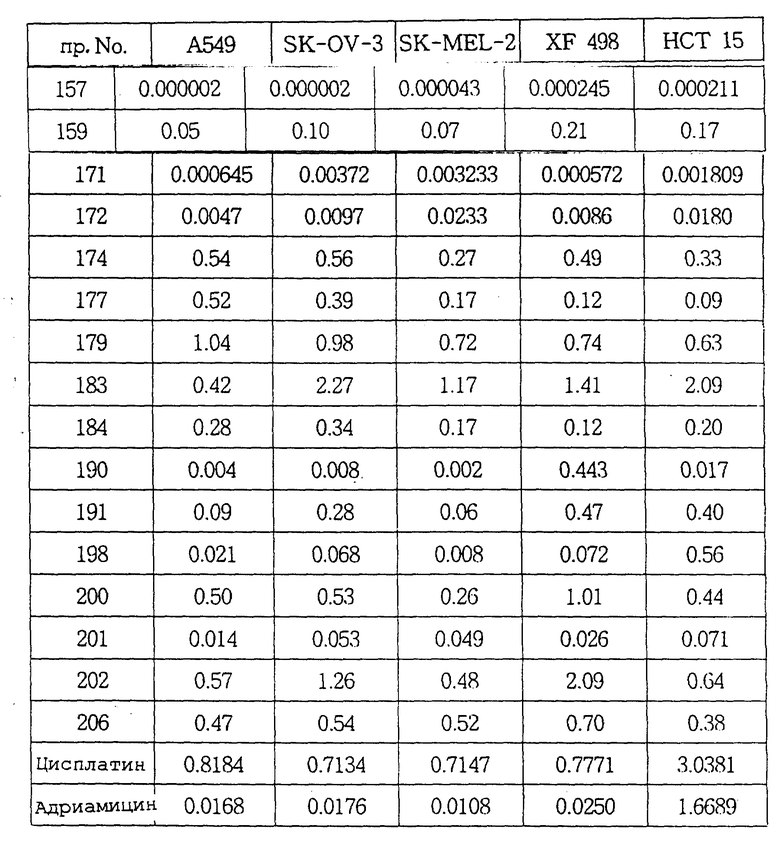
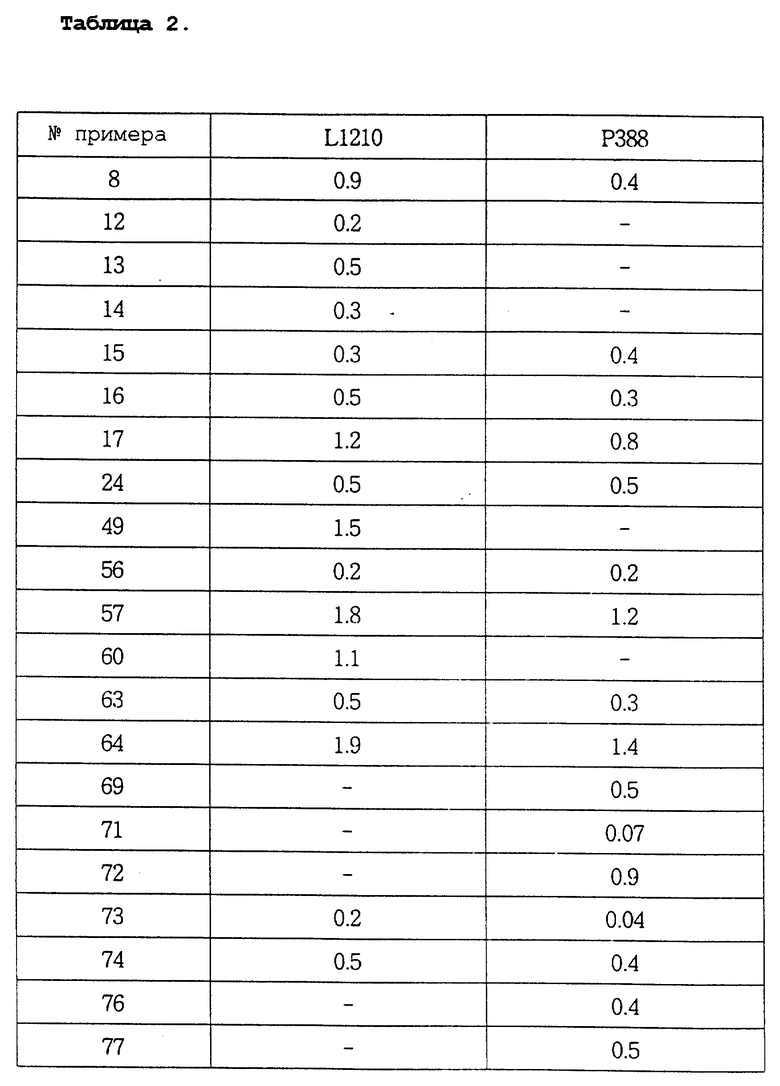
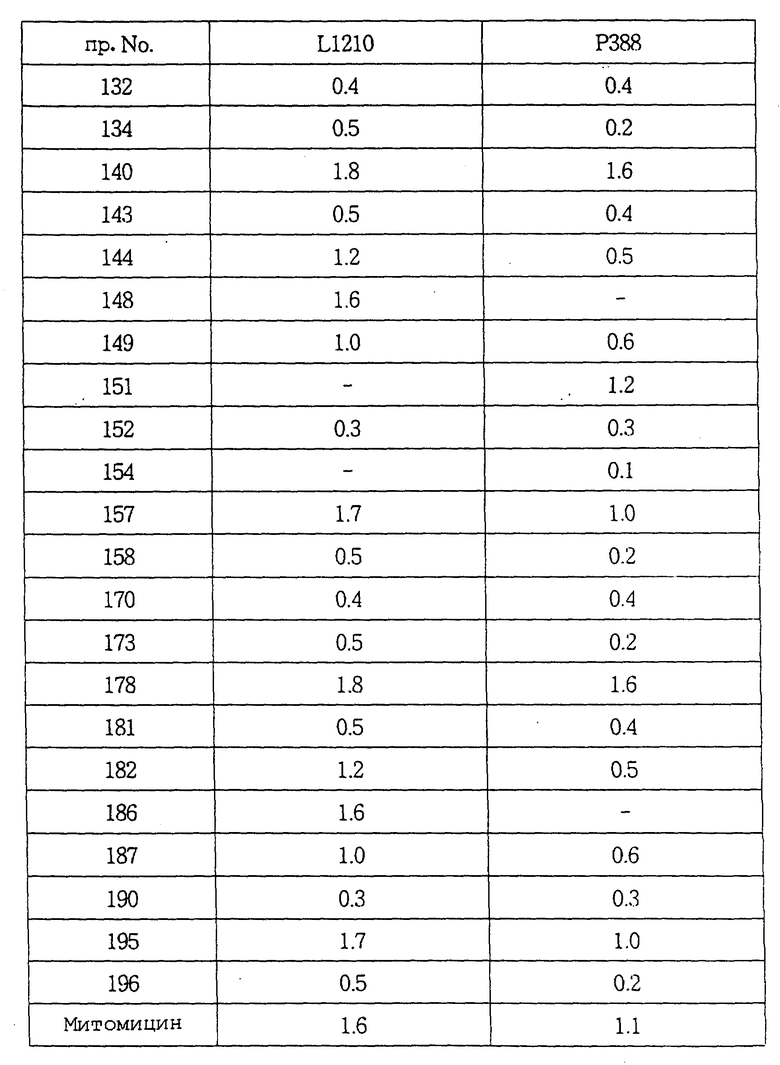
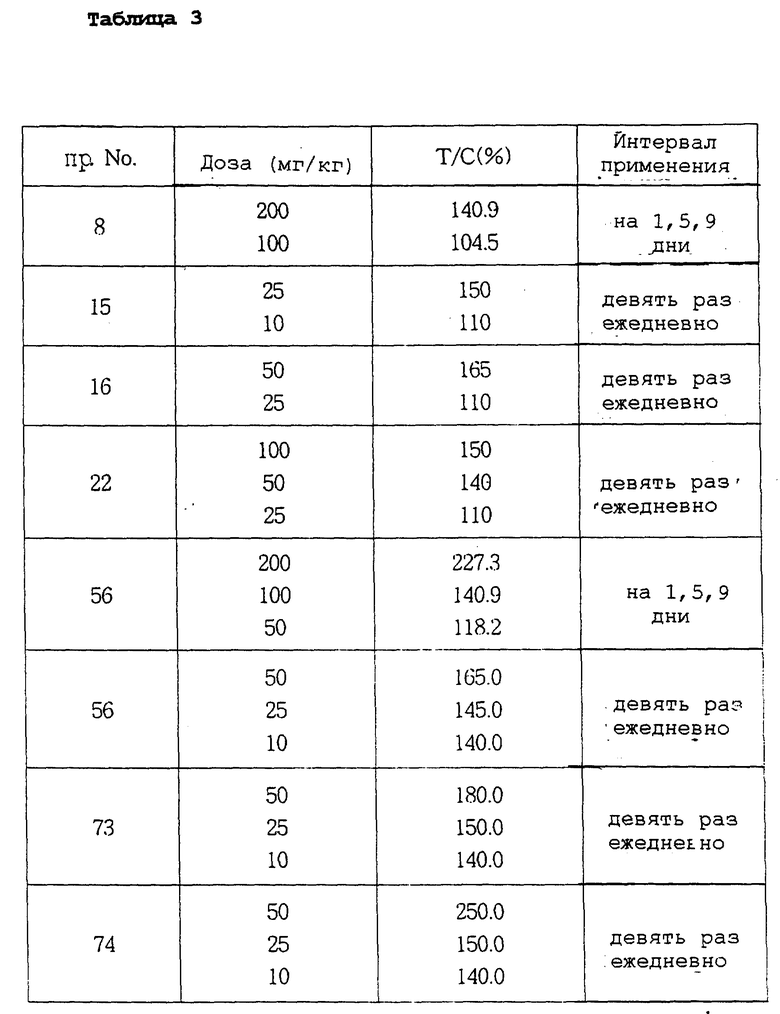
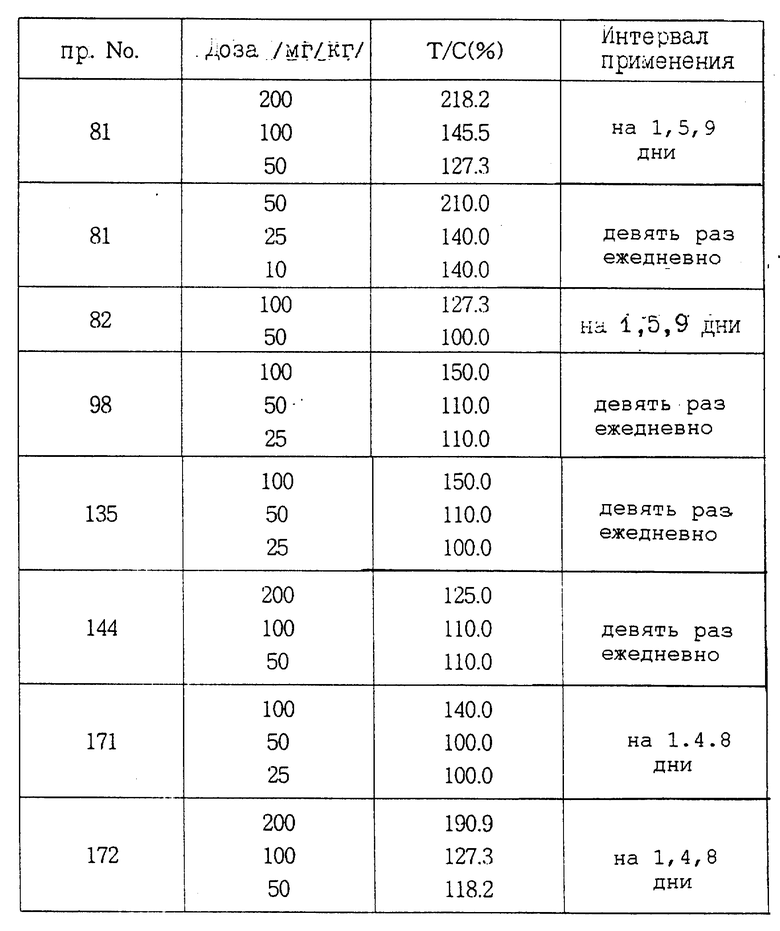
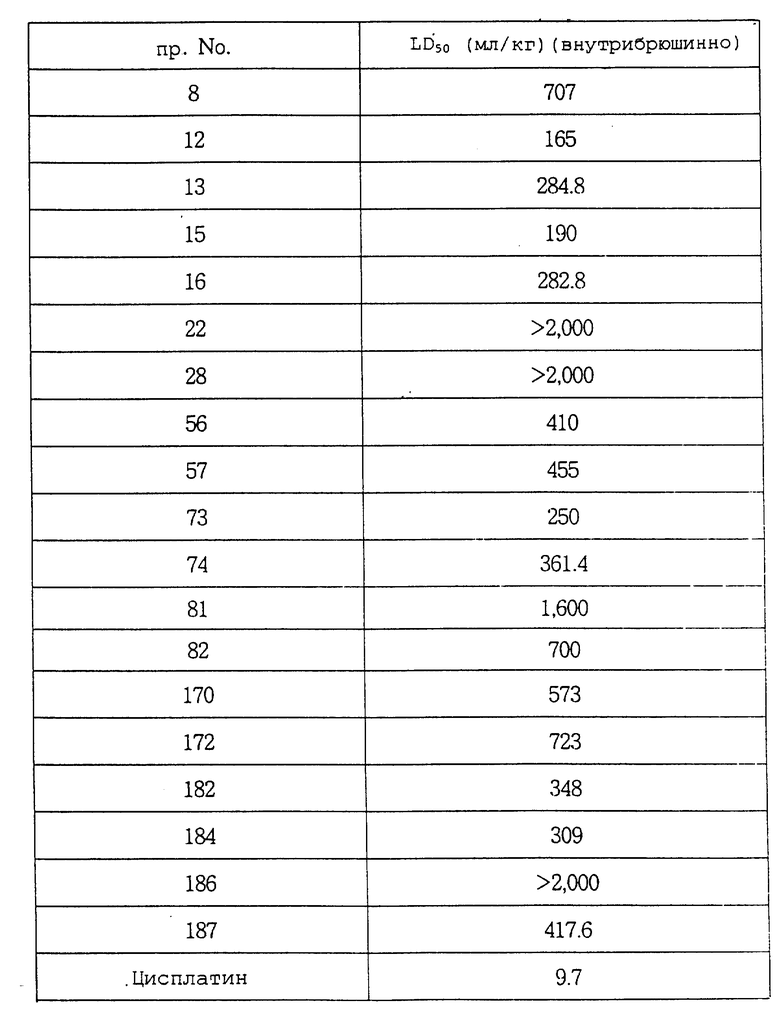
Изобретение относится к новым соединениям, обладающим сильной противоопухолевой активностью, отвечающим общей формуле (I), где значения R1 - R7, A, Z, Y, Х указаны в п.1 формулы. Описывается также способ их получения. 3 с.п.ф-лы, 4 табл.
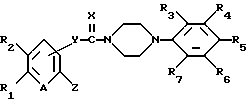
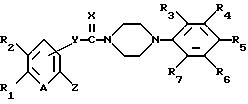
в которой R1 и R2 независимо друг от друга представляют С1 - C8-алкил, возможно замещенный группами OH, SH, SC(= O)CH3, OCH2C(=O)OC2H5; C2 - C8-алкенил, C1 - C4-алкоксигруппу, С1 - C4-низшую сложноэфирную группу, С1 - C4-тиоалкоксигруппу; либо R1 и R2 соединены друг с другом с образованием С3 - C4 насыщенной или ненасыщенной цепочки;
R3, R4, R5, R6 и R7 независимо друг от друга представляют собой водород, галоген, гидрокси, С1 - C4 низшую сложноэфирную группу, C1 - C4 низший алкил, С1 - C4 низший тиоалкил, С1 - C4 низшую алкокси, С1 - C4 низшую тиоалкокси, либо две соседние группы из R3, R4, R5, R6 и R7 связаны друг с другом с образованием 1,2-фенилена или 2,3-нафтилена;
X представляет собой кислород или серу;
Y связан с положением 3- или 4-ароматической кольцевой части молекулы, в которой Y представляет собой группу -NR8-, где R8 - водород, С1 - C4 низшая сложноэфирная группа, С1 - C4 низший алкил, С3 - C6-циклоалкил, бензил;
Z представляет собой С1 - C4 низшую алкокси, С1 - C4 низшую алкиламино, незамещенную циклоаминогруппу, содержащую 2 атома азота;
A представляет собой азот или -CH=,
или их фармацевтически приемлемые соли присоединения кислоты.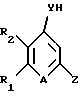
подвергают взаимодействию с агентом, поставляющим группу -C(=X)-, в присутствии органического растворителя с получением соединения общей формулы b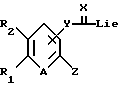
и последующим взаимодействием соединения формулы b с соединением общей формулы с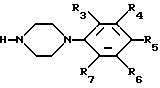
где R1, R2, R3, R4, R5, R6, R7, A, X и Z имеют указанные в п.1 значения;
Lie представляет уходящую группу; .
.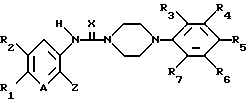 Ia
Ia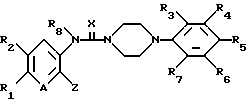 Ib
Ib
где R1, R2, R3, R4, R5, R6, R7, A, X и Z имеют указанные в п.1 значения.
Приоритет по пунктам и признакам:
29.06.96 - по пп.1 - 3, где R1 и R2 независимо друг от друга представляют незамещенный или замещенный С1 - C8-алкил, или С2 - C8-алкенил, R3, R4, R5, R6 и R7 независимо друг от друга представляют водород, галоген, гидрокси, С1 - C4 низшую сложноэфирную группу, С1 - C4 низший алкил, С1 - C4 низшую алкокси или С1 - C4 низшую тиоалкокси, X представляет кислород или серу, Y связан с положением 3-ароматической кольцевой части молекулы, в которой Y представляет собой группу -NR8-, где R8 - водород, С1 - C4 низшая сложноэфирная группа, С1 - C4 низший алкил, С3 - C6-циклоалкил, бензил, Z представляет собой С1 - C4 низшую алкокси, С1 - C4 низшую алкиламино, незамещенную циклоаминогруппу, содержащую 2 атома азота, А представляет собой азот;
18.09.96 - по пп.1 - 3, где R1 и R2 независимо друг от друга представляют С1 - C4 алкоксигруппу или С1 - C4 тиоалкоксигруппу, R3, R4, R5, R6 и R7 независимо друг от друга представляют С1 - C4 низший тиоалкил, А представляет -CH=;
03.06.97 - по пп.1, 2 и 3, где Y связан с положением 4- ароматической кольцевой части молекулы, в которой Y представляет собой группу -NR8-, где R8 - водород, С1 - C4 низшая сложноэфирная группа, С1 - C4 низший алкил, С3 - C6-циклоалкил, бензил;
04.06.97 - по пп.1 - 3, где R1 и R2 независимо друг от друга представляют С1 - C4 низшую сложноэфирную группу или R1 и R2 соединены друг с другом с образованием С3 - C4 насыщенной или ненасыщенной цепочки, две соседние группы из R3, R4, R5, R6 и R7 связаны друг с другом с образованием 1,2-фенилена или 2,3-нафтилена.
| Дозатор для штучных предметов | 1974 |
|
SU486734A2 |
| 2-Арилпиперазино-2-фенилинданоны,обладающие психотропными свойствами | 1974 |
|
SU551871A1 |
| Способ получения хлористого олова путем хлорирования олова | 1959 |
|
SU128007A1 |
Авторы
Даты
2000-03-10—Публикация
1997-06-28—Подача