Изобретение относится к способу получения трансгенного растения, проявляющего резистентность к многим вирусам, который содержит генетически сконструированную ДНК-последовательность, содержащую фрагмент, кодирующий полипептид, имеющий активность 2,5A-синтетазы.
В литературе описано несколько методов конструирования вирус-резистентных растений. Наиболее близким к способу по изобретению является способ получения резистентных к вирусу трансгенных растений путем экспрессии белка оболочки соответствующего растительного вируса в указанных растениях (Beachy et aL, Annu. Rev. Phytopathol., 28 (1990), 451-474).
Существенная вирусная резистентность к нескольким растительным вирусам продемонстрирована путем экспрессии специфической вирусной антисмысловой РНК в трансгенных растениях (Cuozzo et aL, Bio/Technology, 6 (1988), 549- 557; Hemenway et al. , EMBO J.7 (1988), 1273-1280). Вирусная антисмысловая РНК проявляет свою функцию либо гибридизацией со специфическими последовательностями вирусной ДНК или РНК, тем самым блокируя последующие реакции, которые важны для вирусного размножения, либо активностью рибозима, которая приводит к специфическому расщеплению вирусной РНК после гибридизации с указанной вирусной РНК. Основным недостатком вышеупомянутых методов конструирования вирус-резистентных трансгенных растений является то, что указанные трансгенные растения резистентны только к одному вирусу или специфической группе вирусов.
Путь метаболизма 2,5A-олигоаденилата является частью системы антивирусного ответа, индуцируемой интерферонами в клетках млекопитающих (Lengyel, Annu. Rev. Biochem., 51 (1982), 251-282). Некоторые компоненты пути метаболизма 2,5A обнаружены также в организмах (помимо млекопитающих) птиц, рептилий и амфибий, насекомых, в дрожжах и даже в бактериях (Stark et al., Nature, 278 (1979), 471-473; Cayley et al" Biochem. Biophys. Res. Corn., 108 (1982), 1243-1250; Laurence et al. , Proc. Natl. Acad. Sci. U.S.A., 81, (1984), 2322-15 2326).
В растениях антивирусный фактор (АВФ), производство которого стимулировано вирусным заражением, частично очищен, и его ген, как оказалось, гомологичен человеческому интерферону; Sela et al., in: Plant Resistance To Viruses: Ciba Symp., 133 (1987), 109-119. Обработка вирусом табачной мозаики (ВТМ) зараженных протопластов табака с помощью человеческого интерферона привела к ингибированию ВТМ-репликации; Sela et al., Meth. in Enzymology, 119 (1986), 744-752. Кроме того, продемонстрировано, что 2,5A может ингибировать ВТМ-репликацию в растениях табака; Devash et al., J. Biol. Chem., 259 (1984), 3482-3486. ДНК-последовательности, гомологичные человеческой 2,5A-синтетазе, также обнаружены в геномной ДНК табака; Sela et а1.. (1987), (см. выше).
Однако в литературе о растениях отсутствуют сведения о 2,5A-зависимой РНКазе, которая является частью пути метаболизма 2,5A-олигоаденилата у млекопитающих. Это позволяет сделать вывод, что 2,5A не ингибирует вирусную инфекцию в растениях посредством 2,5A-зависимой эндонуклеазы; Devash et al., Biochemistry, 24 (1985), 593-599.
Кроме того, описано, что интерферон, продуцируемый в трансгенных растениях, не ингибирует вирусное размножение; De Zoeten et al. Virology, 172 (1989), 213-222.
В основном, известный уровень техники не позволяет сделать вывод о том, что путь метаболизма 2,5А-олигоаденилата может быть использован в качестве основы для конструирования трансгенных растений, проявляющих резистентность к многим вирусам.
Таким образом, технической задачей настоящего изобретения является создание трансгенного растения, проявляющего резистентность к многим вирусам, с использованием частей пути метаболизма 2,5А-олигоаденилата.
Согласно настоящему изобретению предлагается способ получения резистентного к вирусу трансгенного растения, включающий генетическое конструирование ДНК-последовательности, содержащей фрагмент ДНК, кодирующий полипептид, с активностью 2,5A-синтетазы, обеспечивающий устойчивость к вирусу, введение полученной ДНК в клетки растений, получение регенерантов и отбор регенерантов, экспрессирующих указанный полипептид. Отличием от указанного известного способа (Ann. Rev. Phytopatholog., 28. (1990), 451-490) является то, что конструируют ДНК-последовательность, содержащую фрагмент, кодирующий полипептид с активностью 2,5А-синтетазы.
Обычно генетически сконструированную ДНК последовательность предварительно встраивают в вектор под управлением промотора, позволяющего осуществить ее экспрессию в данном трансгенном растении.
Как правило, вектор представляет собой pHТТ2-5+ (DSM N 6815). (Вектор депонирован в соответствии с требованиями Будапештского договора в "Deutsche Sammiung fur Microorganismen (DSM)" под депозитарным номером DSM 6815).
Предпочтительно введение ДНК в клетки растений осуществляют путем трансфекции с использованием системы Agrobacterium.
Полученное трансгенное растение, проявляющее резистентность к многим вирусам, содержит генетически сконструированную ДНК-последовательность, кодирующую по крайней мере один полипептид, имеющий активность 2,5A-синтетазы, причем указанный полипептид после экспрессии способен активировать эндонуклеазу, вызывающую разрушение вирусной РНК.
Термин "резистентность ко многим вирусам" относится к трансгенным растениям, которые в основном резистентны к вариетету вирусных групп, таких как потекc-, карла- и тобамовирусы.
Термин "генетически сконструированная ДНК-последовательность" относится к ДНК- последовательности, которой манипулируют методами генной инженерии, такими как методы рекомбинантных ДНК.
Термин "полипептид, имеющий активность 2,5-синтетазы" относится к любому полипептиду, который способен ферментативно синтезировать 5'-дефосфорилированные или фосфорилированные 2,5-олигонуклеотиды с тремя или более остатками аденозина, например, 2,5A3, который является тримером аденилата, связанного 2',5'-фосфодиэфирными связями, и дефосфорилирован у своего 5'-окончания.
Термин "эндонуклеаза, вызывающая разрушение вирусной РНК" относится к гетерологичной или гомологичной эндонуклеазе, которая способна разрушать вирусную РНК путем ферментативного расщепления. Указанная эндонуклеаза активируется с помощью 2,5A, который синтезируется полипептидом, имеющим активность 2,5A-синтетазы.
Предпочтительно, чтобы указанная ДНК-последовательность или по крайней мере одна часть указанной ДНК-последовательности была гомологична или гетерологична указанному трансгенному растению.
Возможно также, чтобы указанная ДНК-последовательность являлась химерной ДНК-последовательностью.
Как правило, указанная ДНК-последовательность дополнительно кодирует по крайней мере один селектируемый маркер и/или по крайней мере один дополнительный полипептид, такой, как указанная эндонуклеаза.
Обычно ДНК-последовательность, кодирующую указанный полипептид, получают из млекопитающего гена, растительного гена или гена микроорганизма, либо она является синтетическим геном.
В частности, ДНК-последовательность, кодирующая указанный полипептид, представляет собой ген крысиной 2,5A-синтетазы (см. фиг. 1).
При этом предпочтительно, чтобы указанная эндонуклеаза представляла собой растительную РНКазу L.
Экспрессию указанного полипептида осуществляют под управлением индуцируемого или конститутивного промотора, функционирующего в растениях и позволяющего осуществлять индуцированную и/или повышенную экспрессию указанного полипептида. Примерами таких промоторов являются промотор 35S вируса мозаики цветной капусты, промотор рисового актина, промотор rbc S от различных видов, промотор TR2' Agrobacter, промотор гена фазеолина или промотор NOS. В предпочтительном варианте настоящего изобретения экспрессию 2,5A-синтезирующего полипептида осуществляют под управлением промотора 35S вируса мозаики цветной капусты.
Трансгенное растение является однодольным или двудольным растением. В частности, трансгенное растение, например, представляет собой табак, рис, пшеницу, ячмень, кукурузу, томат, огурец, сою, сладкий картофель, виноград, капусту, сахарную свеклу, хлопчатник, чай, подсолнечник, землянику, розу, хризантему, перец сладкий или картофель.
Из полученного трансгенного растения, проявляющего резистентность к многим вирусам, можно получить размножающийся материал.
Термин "размножающийся материал" относится к интактным растениям, либо дифференцированной или недифференцированной растительной ткани, такой как корень, стебель, лист, каллюс, протопласт, суспензионные культуры и семена.
Предлагаемый согласно изобретению способ предусматривает введение генетически сконструированной ДНК-последовательности, кодирующей по крайней мере один полипептид, имеющий активность 2,5A-синтетазы, в генетический материал соответствующего растения.
Термин "генетический материал" относится к нуклеарному геному растительной клетки, органоидному геному растительной клетки или экстрахромосомной форме.
Термин "введение" относится к методу, который способен ввести (интродуцировать) указанную генетически сконструированную ДНК-последовательность в указанный генетический материал растительной клетки. Предпочтительными примерами указанного метода являются Agrobacterium-опосредованный перенос, растительным вирусом опосредованный перенос, микроинъекция, микропрожектильная бомбардировка, электропорация, ПЭГ-опосредованная трансформация и трансформация растительных протопластов со стабильными векторами на основе вирусов.
Ниже приводится описание представленных фигур.
Фиг. 1. Конструирование плазмиды pHТТ2-5A+. Фрагмент EcoRI. содержащий кДНК гена крысиной 2,5A-синтетазы, отрезают от плазмиды pSK2-5A+, липкие концы заполняют и полученный фрагмент лигируют в сайт BamHI вектора pHТТ202 с использованием линкеров BamHI. Это позволяет получить вектор pHТТ2-5A+, содержащий ген крысиной 2,5A-синтетазы под управлением промотора CaMV 35S.
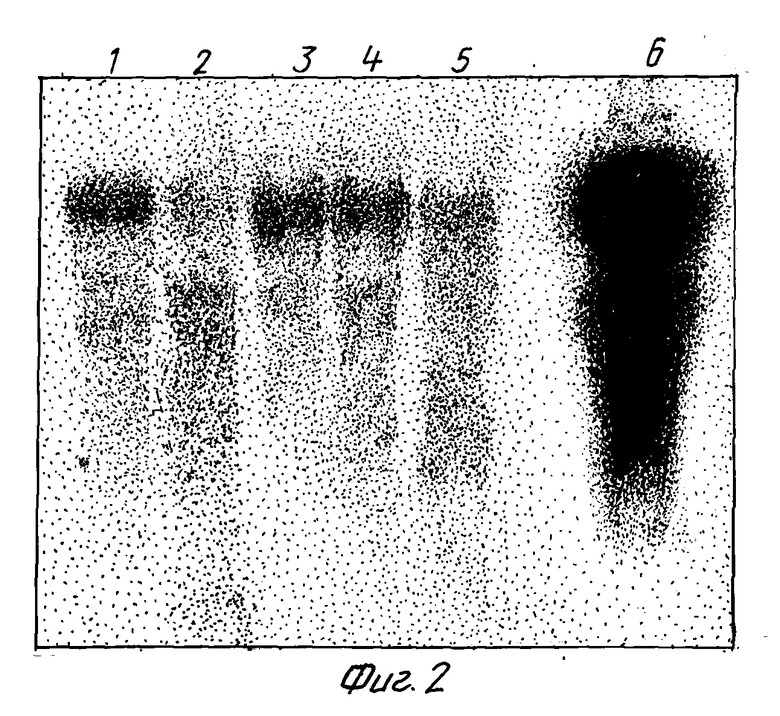
Фиг. 2. Назерн-блоттинг целой РНК из трансгенных табачных растений, трансформированных с геном 2,5A-синтетазы. 10 мкг целой РНК на каждую дорожку зондируют с помощью [32P]-меченой кДНК 2,5A-синтетазы. Дорожки 1-5 являются линиями трансгенного табака, а дорожка 6 является кДНК крысиной 2,5A-синтетазы.
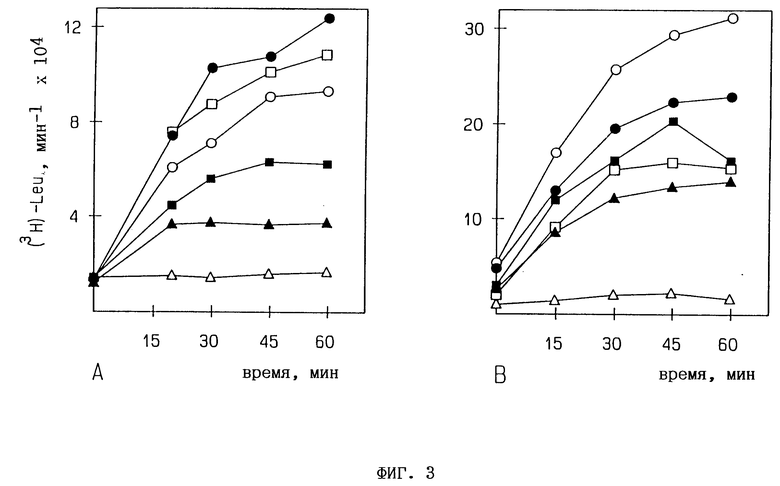
Фиг. 3. Эффект различно фосфорилированных форм 1 мкМ тримеров 2,5A (A) и тетрамеров 2,5A (B) на трансляцию in vitro РНК ВТМ (вируса табачной мозаики) в экстракте пшеничных зачатков. 0,8 мкг ВТМ-РНК транслируют m vitro. [35S] -меченые белки, полученные из 5 мкл проб, преципицируют на стекловолокнистых фильтрах, после чего измеряют введенную радиоактивность: 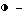 без 2,5A,
без 2,5A,  pppAn,
pppAn,  ppAn, □ - pAn, Δ - An,
ppAn, □ - pAn, Δ - An, 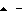 без РНК.
без РНК.
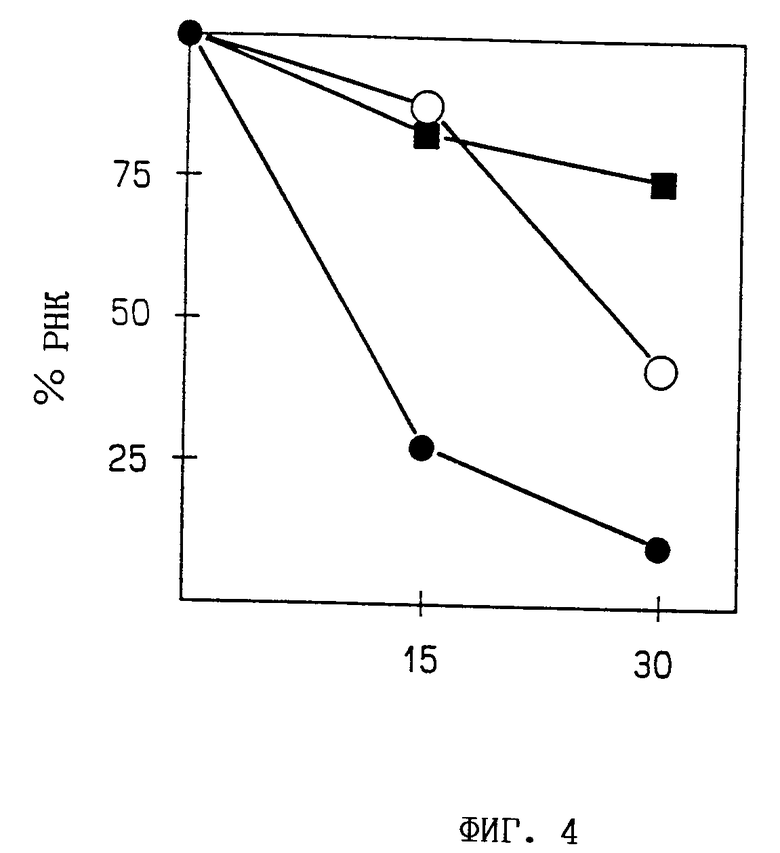
Фиг. 4. Влияние различных тримеров 2,5A на скорость разрушения РНК ВТМ в экстракте пшеничных зачатков. ВТМ-РНК выделяют из проб экстракта пшеничных зачатков, содержащего 1 мкМ тримеров 2,5A, подвергают Назерн-блоттингу и гибридизируют с [32P]-меченой кДНК ВТМ. Величину РНК оценивают из авторадиографических снимков при помощи лазерной денситометрии:  без 2,5A,
без 2,5A,  pppA3,
pppA3, 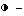 A3.
A3.
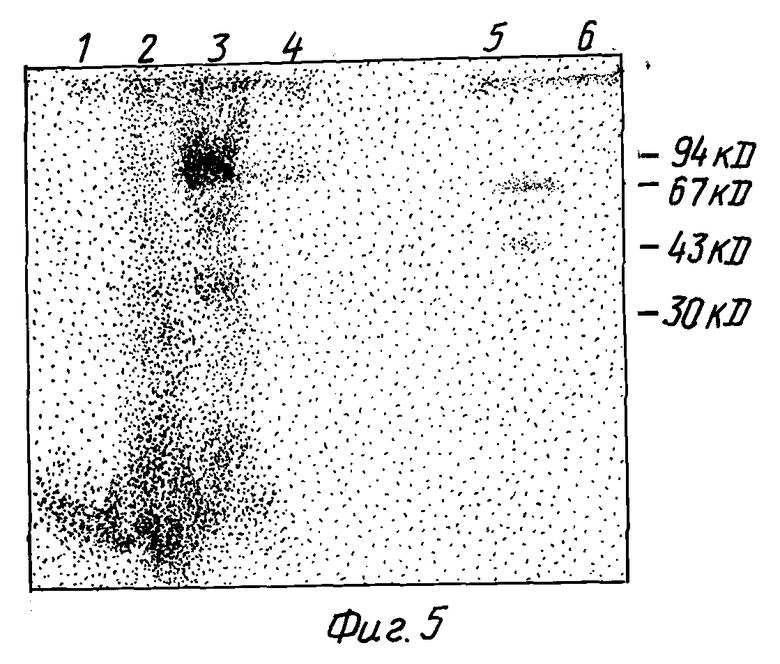
Фиг. 5. Связывание 2,5A с белками экстракта растительных клеток. [32P] -меченую 2,5A ковалентно структурируют с белками клеточных экстрактов методом NaIO4-окисления и разделяют с помощью 12% электрофореза в полиакриламидных гелях с додецилсульфатом натрия. Дорожка 1 представляет лизат ретикулоцитов кролика (получен в соответствии с работой Sambrook et al., "Molecular Cloning: A Laboratory Manual", Cold Spring Harbour Laboratory, Cold Spring Harbour Laboratory Press (1989)), дорожка 2 представляет экстракт мышиных L-клеток с немеченой 2,5A, дорожка 3 представляет экстракт мышиных L-клеток, дорожка 4 представляет лизат ретикулоцитов кролика (Amersham), дорожка 5 представляет экстракт картофельных листьев и дорожка 6 представляет экстракт картофельных листьев с немеченой 2,5A.
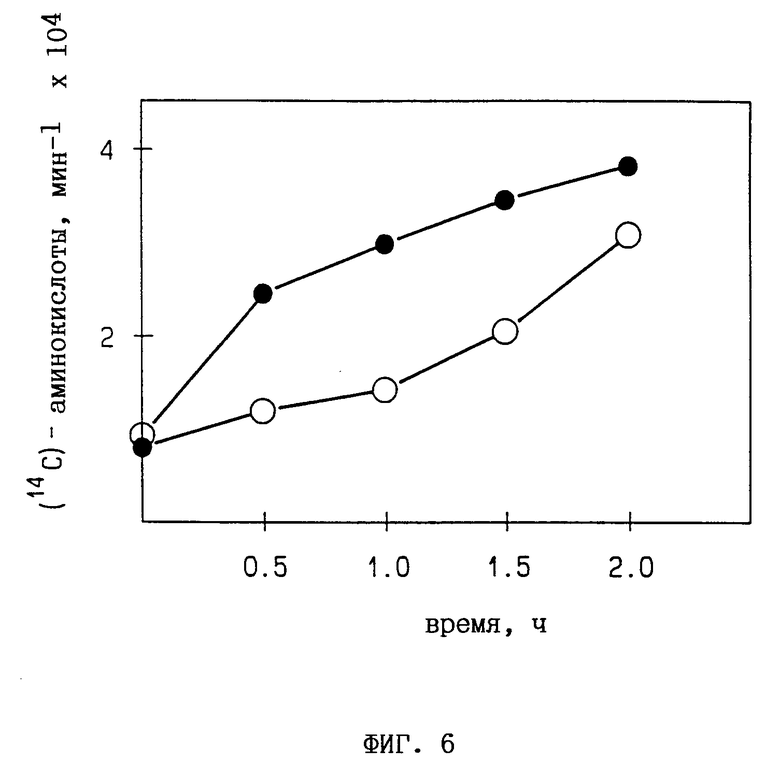
Фиг. 6. Эффект "сердцевины" тримера 2,5A на белковый синтез в табачных протопластах. [14C] -меченый белковый гидролизат прибавляют в культуру табачных протопластов, после чего измеряют общую радиоактивность клеток: 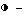 без 2,5A,
без 2,5A,  1 мкМ A3.
1 мкМ A3.
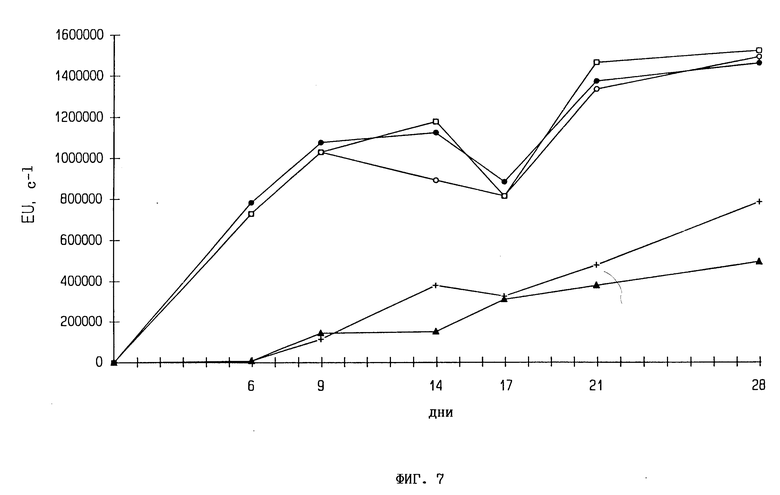
Фиг. 7. Размножение PVX в трансгенных растениях, содержащих ген 2,5A-синтетазы. Интактные растения инфицируют 10 мкг/мл PVX и пробы листьев анализируют TRFIA с использованием антител 21XD2 и конъюгата европия 21XD2. Концентрацию вирусов определяют по величине флуоресценции европия в секунду:  контроль SRI,
контроль SRI,  4N1, □ - 4N5, + - 4N11, * -4N12.
4N1, □ - 4N5, + - 4N11, * -4N12.
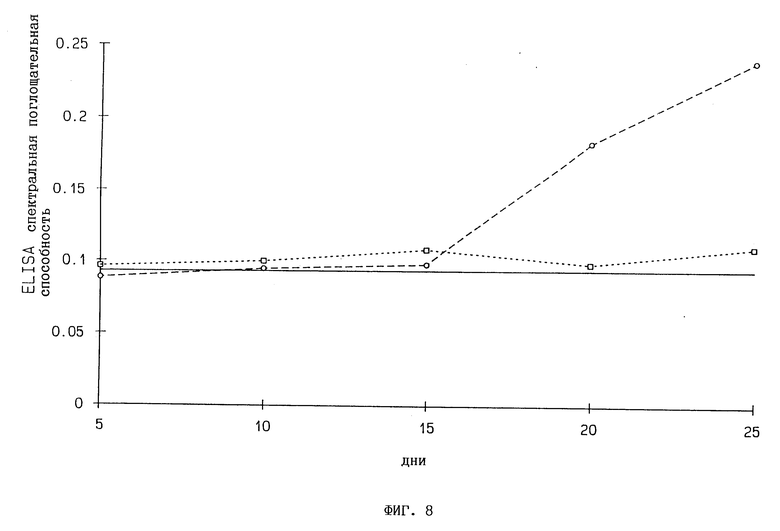
Фиг. 8. Размножение PVS в трансгенных табачных растениях, содержащих ген 2,5A-синтетазы. Интактные растения инфицируют 10 мкг/мл PVS и пробы листьев анализируют методом ELISA (ферментным иммуносорбентным анализом) с использованием антител S4A4 и конъюгата пероксидазы из хрена S4A4. Концентрацию вирусов определяют по оптической плотности цветной реакции при 450 нм:  контроль SRI,
контроль SRI,  трансгенные растения с геном 2,5A-синтетазы в "смысловой" ориентации, - - фон ELISA.
трансгенные растения с геном 2,5A-синтетазы в "смысловой" ориентации, - - фон ELISA.
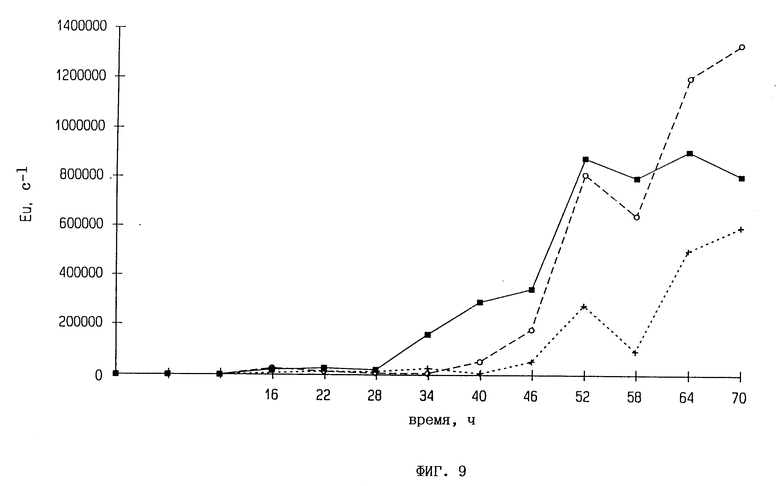
Фиг. 9. Размножение PVX в дисках листьев трансгенных растений, содержащих ген 2,5A-синтетазы. Листья инфицируют 10 мкг/мл PVX, диски диаметром 8 мм штампуют и содержат в стерильной воде. Диски анализируют как PVX-инфицированные интактные растения (см. фиг. 7):  контроль SRI,
контроль SRI,  4N10, + - 41112.
4N10, + - 41112.
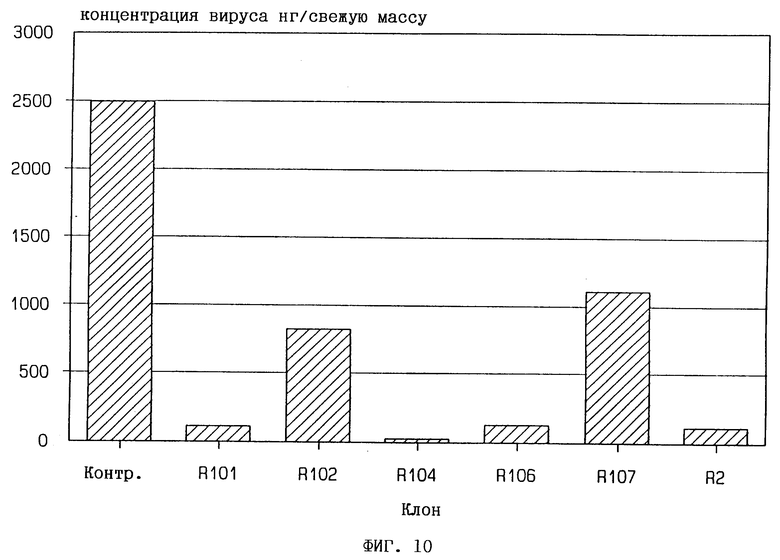
Фиг. 10. Концентрация вирусов (PVX) в выращенных в поле трансгенных картофельных растениях, содержащих ген 2,5A-синтетазы. Интактные растения инфицируют соком, собранным с PVX-инфицированных табачных растений.
Пробы листьев анализируют методом ELISA с использованием иммунодиагностического набора для PVX (Boehringer Mannheim). Концентрацию вирусов определяют по оптической плотности цветной реакции при 405 нм. Контр. = контрольный клон; R101, R102, R104, R106, R107 и R2 = трансгенные клоны.
Следующие примеры иллюстрируют изобретение. Дополнительные пояснения в отношении методов молекулярной биологии, применяемых в данном изобретении, можно найти в работе Sambrook et al., "Molecular Cloning: A Laboratory Manual", (см. выше).
Пример 1.
A. Конструирование гена 2.5A. содержащего плазмиду pHТТ2-5A+. кДНК крысиной 2,5A-синтетазы выделяют из кДНК-библиотеки крысиного гиппокампа в векторе λ gt10 в соответствии с протоколами Amersham, используя кДНК мышиной 2,5A-синтетазы в качестве зонда. кДНК субклонируют в сайт EcoRI вектора экспрессии pBluescript SK+ (Stratagene). Полученную плазмиду называют pSK2-5A.
Для трансформации табачных растений кДНК крысиной 2,5A-синтетазы субклонируют в растительный экспрессирующий вектор pHТТ202. кДНК отрезают от pSK2-5A с помощью EcoR1. липкие концы наполняют и кДНК клонируют в BamH1-линеаризованную плазмиду pHТТ202 с использованием синтетических линкеров BamHI (фиг. 1). Полученную плазмиду pHТТ2-5A+ используют для трансформации клеток Agrobacterium.
B. Трансформация Agrobacterium плазмидой pHТТ2-5A+
Плазмида pHТТ202 в большей степени основана на последовательности плазмиды pBR322. Векторы клонирования на основе pBR322 обычно не мобилизуются из клетки-хозяина в другую бактерию, однако они содержат "основу мобилизации", сайт bom. Когда функции "хелпера", кодируемые генами mob хелперных плазмид, обеспечены, векторы клонирования на основе pBR322 также мобилизуются. Для этой цели используют спаривание двух родителей на основе системы, описанной Van Haute et al., EMBO J. 2 (1983), 411-417.
E. coli- содержащую плазмиду pHТТ2-5A+ (ampR, spc/strR) спаривают на L-чашках с E. coli хелперным штаммом GJ23, который содержит плазмиду R64drd11 1 α -типа (tetR, strR) для необходимых функций tra и вторую хелперную плазмиду pGJ28 (kanR, neoR), обеспечивающую функции mod в условиях in trans с тем, чтобы комплементировать трансмиссию плазмид mob bom+ на основе pBR.
Клетки с хелперными плазмидами отбирают на L-чашках, содержащих 5 ампициллин, тетрациклин и канамицин. Эти клетки совместно культивируют в L-бульоне со штаммом C58C1 Agrobacterium tumefaciens. содержащим Ti-плазмиду pGV2260 (rifR, cbR), когда гены, отвечающие за туморогенез в растительных клетках, замещены последовательностями плазмиды pBR322. Конъюгированные клетки Agrobacterium отбирают на чашках, содержащих рифампицин, спектиномицин и стрептомицин. Поскольку вектор на основе pBR322 нельзя реплицировать в Agrobacterium, только Agrobacteria, когда рекомбинация между pBR322 с последовательностью pGV2260 и pHТТ202 привела в образованию совместно интегрированной молекулы, могут вырасти на селективных чашках. С целью подтверждения того, что Т-ДНК рекомбинантных плазмид содержит ген 2,5A-синтетазы, выделяют полную ДНК полученных Agrobacteria (Dhaese et al., Nycl. Acids Res. , 7, (1979), 1837-1849) и анализируют блоттинг-методом по Саузерну.
Пример 2.
Трансформация табачных растений с помощью гена 2,5A-синтетазы.
Трансгенные растения SRI Nicotiana tabacum получают путем Agrobacterium-опосредованного переноса (Zambryski, Annu. Rev. Genet. 22 (1988), 1-30). Метод основан на том явлении, что Agrobacterium устойчиво переносит сегмент своей Ti-плазмиды в растительный геном после взаимодействия с ранеными растительными клетками. Сегмент, называемый "Т-ДНК", определяется его сохранившимися граничными последовательностями. Генетическую информацию между граничными последовательностям можно заменить без воздействия на эффективность переноса Т-ДНК.
Трансформацию табачных растений с помощью гена 2,5A-синтетазы осуществляют в соответствии с работой Horsch et al., Science, 227, (1985), 1229-1231. Листья SRI N. tabacum растений, выращенных на среде MS/2 (Murashige and Skoog, Phys. Plant, 18 (1962), 437-497) в стерильных условиях при температуре 24oC в течение 16-часовых фотопериодов, помещают вверх дном в среду сахарозы КЗ-400 мМ (Nagy and Maliga, Z. Pflanzenphysiology, 78 (1976), 453-455) и разрезают на части размером 0,5-1 кв. см так, чтобы все края были отрезаны. Agrobacterium с совместным интегратом Т-ДНК, выращенным в минимальной питательной среде М9 (Sambrook et al., "Molecular Cloning, A Laboratory Manual" (1989), см.выше), добавляют в среду сахарозы КЗ-400 мМ, и чашки сохраняют в течение трех дней при тех же условиях, что и для растений. Диски листьев промывают и переносят вверх дном в твердую среду LS (Linsmaier and Skoog, Phys. Plant., (1965), 100-127), содержащую Клафоран для уничтожения Agrobacteria, бензиламинопурин (БАП) для индуцирования корней из дисков листьев и канамицин для отбора на трансформированные клетки, поскольку сегмент плазмиды pHТТ2-5A+, совместно интегрированный в Т-ДНК плазмиды pGV2260, также содержит ген nos-npt2. придающий устойчивость к канамицину для трансформированных клеток. После появления корней их отрезают и высевают на аналогичную среду без БАП. Полностью укорененные растения сохраняют на среде MS/2 при условиях, описанных выше.
С целью проверки того, что растения являются действительно трансформированными, полные ДНК и РНК из тканей листьев выделяют в соответствии с методом Dellaporta et al., Plant. Mol. Biol. Rep., 1 (1983), 19-21, и Verwoerd et al., Nucl. Acids Res., 17 (1989), 2362, соответственно. Блоттинг-анализы по Назерну и Саузерну осуществляют в соответствии с протоколами Amersham с использованием [32P]-меченой кДНК 2,5A-синтетазы в качестве зонда (фиг. 2).
Пример 3.
Идентификация активности 2,5A-зависимой РНКазы.
Исследования по воздействию различных 2,5-олигоаденилатных форм под влиянием вируса табачной мозаики (ВТМ) во время трансляции in vitro в экстракте пшеничных зачатков (ЭПЗ) показывают, что нефосфорилированные три- и тетрамеры 2,5A могут эффективно ингибировать трансляцию РНК ВТМ в ЭПЗ (фиг. 3). Скорости разрушения РНК ВТМ во время трансляции in vitro в присутствии и отсутствии 2,5A анализируют путем взятия проб из трансляционной смеси и выделения РНК, как описано в работе Toots et al., Mol. Biol. (USSR), 22 (1988), 1473-1481. После электрофореза в агарозно/формамидном геле и блоттинга по Назерну концентрацию РНК в пробах оценивают путем сканирования авторадиограмм [32P] -меченных фильтров с помощью лазерного денситометра. Прибавление "сердцевины" тримера 2,5A приводит к быстрому разрушению РНК ВТМ, тогда как скорость разрушения РНК ВТМ намного ниже в контрольных экспериментах с применением и без применения трифосфорилированной 2,5A (фиг. 4). В заключение, ингибирующее влияние "сердцевины" 2,5A на трансляцию in vitro в растительном бесклеточном экстракте вызвано быстрым разрушением субстрактной РНК.
С целью идентификации 2,5A-связывающих белков в растительных экстрактах, 2,5A лигируют к [32P] pCp, как описано в работе Knight et al., Methods in Enzymology, 79 (1981), 216-227. [32P]-меченую 2,5A ковалентно структурируют с белками картофельных клеточных экстрактов методом NalO4-окисления в соответствии с работой Wreschner et al., Eur. J. Biochem., 124 (1982), 261-268. Специфичность связывания контролируют сравнительным анализом, согласно которому немеченую 2,5A прибавляют в избытке в реакционные смеси. Реакционные смеси разделяют гель-электрофорезом в 12% полиакриламиде с додецилсульфатом натрия.
Белок размером 70 кД идентифицируют в экстрактах картофельных листьев, которые специфическим образом связываются с меченой 2,5A (фиг. 5). Специфичность связывания показана в конкурентном анализе, где немеченая 2,5A полностью замещает [32Р] 2,5A в картофельных P экстрактах (фиг. 5).
Поскольку 2,5A-индуцированное ингибирование трансляции in vitro в ЭПЗ вызвано быстрым разрушением РНК ВТМ, 2,5A связывающий белок массой 70 кД из растительного экстракта представляет собой 2,5A-активированную растительную эндорибонуклеазу.
Также исследуют воздействие 2,5A на белковый синтез в протопластах SRI N. tabacum. Протопласты получают в соответствии с описанием в работе Horkanen et al., "Biotechnology in tropical crop improvement: proceedings of the international biotechnology workshop", (1988), из лиственного мезофилла растений, выращенных в стерильных условиях, и сохраняют в среде сахарозы КЗ-400 мМ. После прибавления [14C]-меченого аминокислотного гидролизата пробы собирают из смеси протопластов для анализа концентрации белков, синтезированных de novo. Белки преципицируют трихлоруксусной кислотой и измеряют инкорпорированную радиоактивность. 2,5A эффективно ингибирует белковый синтез в табачных протоплатах (фиг. 6), что еще раз показывает влияние 2,5A в качестве ингибитора белкового синтеза в растительных системах in vivo.
Идентифицировав 2,5A-зависимую активность РНКазы в картофеле и табаке, можно сделать вывод о том, что существует путь метаболизма в растениях, который частично напоминает интерферон-индуцированный путь метаболизма млекопитающих, который вызывает вирусную резистентность.
Пример 4.
Размножение картофельных вирусов X и S и вируса табачной мозаики в 2.5A трансгенных растениях.
С целью исследования размножения различных вирусов в трансгенных растениях, экспрессирующих 2,5A-синтетазу, осуществляют различные эксперименты по заражению. Растения, растущие на среде MS/2, переносят на почву за две недели до заражения. С целью заражения 2-3 нижних листа обрабатывают карборундом, 10 мкг/мл вируса вручную инокулируют на поверхность листьев и карборунд промывают через 30 минут стерильной водой. Растения сохраняют в течение 16-часовых фотопериодов на один месяц.
Пробы собирают путем отбора одного из маленьких верхних листьев каждый пятый день и замораживания их в жидком азоте. Пробы листьев гомогенизируют в ступке, прибавляя 1 мл буфера для иммуноанализа на грамм лиственного материала. Для обнаружения картофельного вируса X (PVX) используют моноклональные антитела 21XD2 и фтороиммуноанализ с разрешением по времени (TRFIA), как описано в работе Sober et al., J. gen. Virol., 69 (1988), 1799-1807, и Sinijarv et al., J. gen. Virol., 69 (1988), 991- 998, соответственно. Концентрацию PVS измеряют методом DAS-ELISA с использованием моноклональных антител S4A4 (Sinijarv et al., 1988, выше).
Через один месяц после заражения с использованием 10 мкг/мл PVX все трансгенные растения содержат поддающиеся определению уровни PVX, однако вирусная концентрация намного ниже, чем в контрольных растениях (фиг. 7). Кроме того, в этих растениях обнаруживаемое размножение PVX начинается на 1-2 недели позднее, нежели в контрольных растениях.
Через один месяц после заражения 10 мкг/мл PVS все трансгенные табачные линии показывают полную резистентность к заражению PVS и 5 содержат едва лишь обнаруживаемый уровень PVS (фиг. 8).
Осуществляют также заражение дисков листьев с помощью PVX и дополнительно с помощью ВТМ. Листья трансгенных табачных линий заражают, как описано выше. Диски диаметром 8 мм штампуют из листьев и хранят вверх дном в стерильной воде при температуре 24oC в течение от 16-часовых фотопериодов до пяти дней. Диски замораживают в жидком азоте и гомогенизируют. Заражение 10 мкг/мл PVX дает результаты, аналогичные тем, которые наблюдают у интактных растений. Диски листьев некоторых трансгенных табачных линий содержат меньше вируса, а определяемое размножение картофельных вирусов начинается намного раньше, нежели в интактных растениях. Концентрация ВТМ в дисках листьев через пять дней после заражения показывает явное ингибирование вирусного размножения в отношении контрольных растений.
Пример 5.
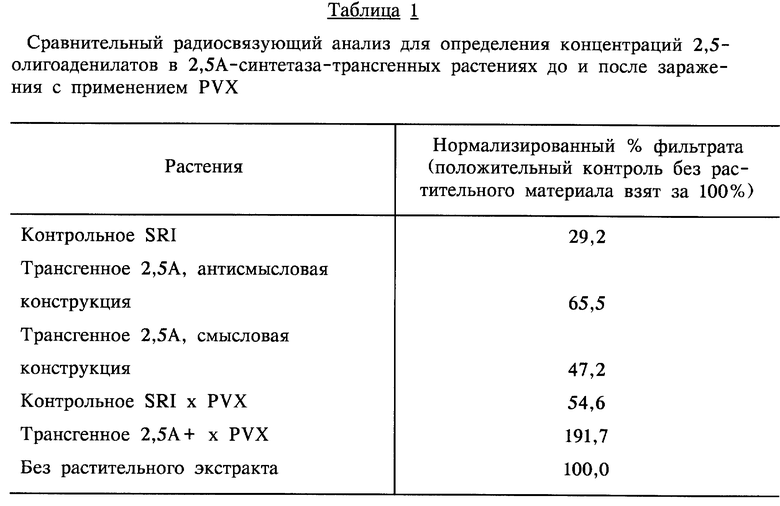
Обнаружение 2.5 - олигоаденилатов в трансгенных растениях
С целью определения концентрации 2,5A в трансгенных растениях SRI табака, экспрессирующих 2,5A-синтетазу, получают экстракты листьев от зараженных и незараженных вирусом растений. Сравнительный анализ проводят в сравнении с немеченой 2,5A из растительных экстрактов с помощью 2,5A[32P]pCp. Мышиный экстракт клеток линии L используют в качестве источника для 2,5A-связывающей эндорибонуклеазы L (РНКазы L). Смесь меченой 2,5A, экстракта L-клеток и экстракта листьев инкубируют в течение 90 минут на льду. Белки из смеси преципитируют на нитроцеллюлозных фильтрах, после чего подсчитывают радиоактивность фильтров и фильтрата. Смесь без растительного экстракта используют в качестве положительного контроля, тогда как в качестве отрицательного контроля используют смесь, в которой 10-7 М тримера немеченой 2,5A полностью замещают меченую 2,5A.
Результаты показывают, что незараженные трансгенные растения, экспрессирующие 2,5A-синтетазу, содержат малое (если только оно есть) обнаруживаемое количество 2,5A аналогично тому, что наблюдается у контрольных растений и трансгенных растений, несущих ген 2,5A-синтетазы в антисмысловой ориентации. (Таблица 1). Это вызвано тем, что 2,5A-синтетаза экспрессируется как неактивный фермент, который может быть активирован двухцепочечной РНК. Когда трансгенные растения, экспрессирующие 2,5A-синтетазу, заражены PVX, 2,5A становится обнаруживаемой и ее внутриклеточные концентрации даже более высокие, чем в контрольных смесях. Такое повышение уровня содержания 2,5A не обнаруживается в контрольных SRI-растениях. Повышение уровня содержания 2,5A в трансгенных растениях приводит к ингибированию PVX-, PVS-и ВТМ-размножения.
Из представленных данных видно, что двухцепочечные реплицирующие промежуточные продукты РНК PVX способны активировать неактивную 2,5A-синтетазу, что приводит к синтезу внутриклеточной 2,5A.
Пример 6.
Определение заражения PVX в трансгенных растениях картофеля.
Полевое испытание.
Интактные растения картофеля, содержащие ген 2,5A-синтетазы, заражают соком, собранным с PVX-зараженных табачных растений и выращенных в поле.
Пробы листьев анализируют через пять недель после заражения методом ELISA с использованием иммунодиагностического комплекса для PVX (Boehringer Mannheim). Вирусную концентрацию определяют по оптической плотности цветной реакции при 405 нм (см. фиг. 10).
Концентрация PVX в растениях, содержащих ген 2,5A-синтетазы, заметно снижается по сравнению с контрольными растениями.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ОБЕСПЕЧИВАЮЩАЯ ЭКСПРЕССИЮ ГЕНА ЭКСТРАКЛЕТОЧНОЙ РИБОНУКЛЕАЗЫ Zinnia elegans ZRNaseII В ТРАНСГЕННЫХ РАСТЕНИЯХ (ВАРИАНТЫ), И СПОСОБ ПОЛУЧЕНИЯ ВИРУСОУСТОЙЧИВЫХ ФОРМ РАСТЕНИЙ | 2009 |
|
RU2393226C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ, УСТОЙЧИВЫХ К ВИРУСНОЙ ИНФЕКЦИИ | 2005 |
|
RU2300567C1 |
| Способ получения антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, в растении, антитело, полученное этим способом, и его применение | 2016 |
|
RU2648161C2 |
| Способ получения трансгенных растений табака, устойчивых к вирусу табачной мозаики | 1990 |
|
SU1782991A1 |
| БЕЛКИ, ИНДУЦИРУЮЩИЕ МНОЖЕСТВЕННУЮ УСТОЙЧИВОСТЬ РАСТЕНИЙ К ФИТОПАТОГЕНАМ И ВРЕДИТЕЛЯМ | 2004 |
|
RU2333220C2 |
| ПРИМЕНЕНИЕ ДЕНДРИМЕРНОЙ НАНОТЕХНОЛОГИИ ДЛЯ ДОСТАВКИ БИОМОЛЕКУЛ В РАСТИТЕЛЬНЫЕ КЛЕТКИ | 2010 |
|
RU2571928C2 |
| РЕКОМБИНАНТНЫЙ ВИРУСНЫЙ ВЕКТОР ДЛЯ ПРОДУКЦИИ В РАСТЕНИЯХ БЕЛКА Е1 ВИРУСА КРАСНУХИ (ВАРИАНТЫ) И СИСТЕМА ЭКСПРЕССИИ БЕЛКА Е1 ВИРУСА КРАСНУХИ В КЛЕТКАХ РАСТЕНИЯ (ВАРИАНТЫ) | 2008 |
|
RU2390563C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBi101-IL18, КОДИРУЮЩАЯ СИНТЕЗ ИНТЕРЛЕЙКИНА-18 ЧЕЛОВЕКА В ТРАНСГЕННЫХ РАСТЕНИЯХ | 2005 |
|
RU2302460C1 |
| КОНСТРУКЦИЯ ДНК, КОНСТРУКЦИЯ РЕКОМБИНАНТНОЙ ДНК И СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ | 1994 |
|
RU2136757C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ПРОЛИНА | 2006 |
|
RU2324737C1 |
Изобретение относится к биотехнологии и может быть использовано для получения резистентного к вирусу трансгенного растения. Генетически сконструированную ДНК-последовательность, кодирующую полипептид, обеспечивающий устойчивость растения к вирусу 2,5 А-синтетазы, вводят в клетки растений. Регенеранты, экспрессирующие полипептид, отбирают. Способ позволяет получить растение, резистентное к многим вирусам. 3 з.п. ф-лы, 10 ил., 1 табл.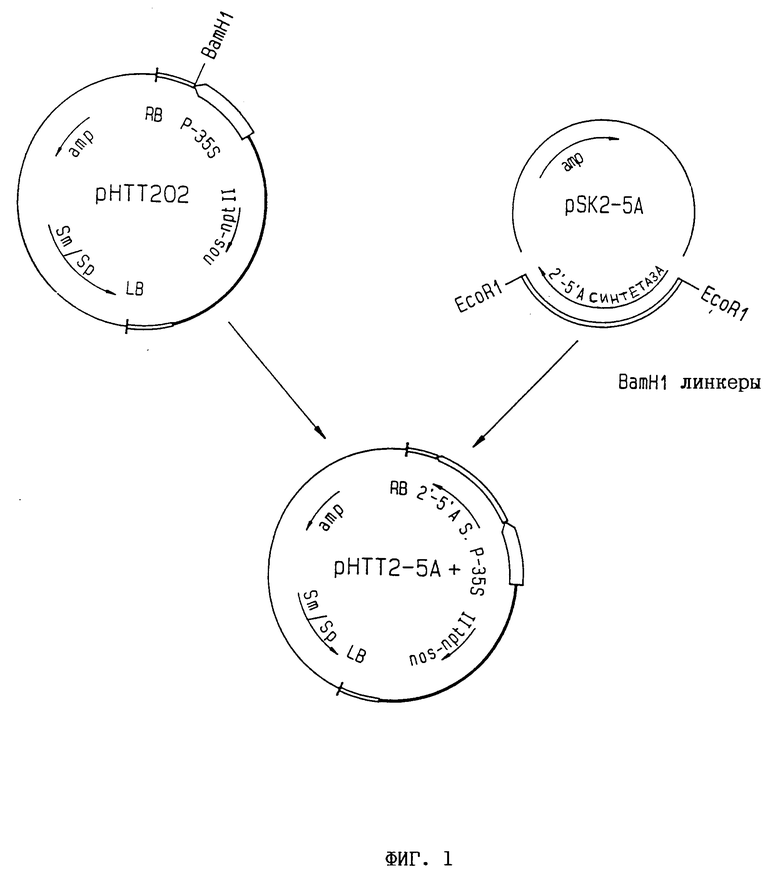
| Btachy et al., Annu | |||
| Rev | |||
| Phytopathol., v.29, p | |||
| ИГРУШКА С ПЛАВАЮЩЕЙ ФИГУРОЙ | 1922 |
|
SU451A1 |
Авторы
Даты
1999-01-27—Публикация
1992-09-24—Подача