Таксол представляет собой соединение таксанового семейства дитерпенов, имеющее следующую структуру:
Примененная для таксола нумерическая система рекомендована IUPAC (Международный союз по теоретической и прикладной химии, 1978). В работе David J. I. Kingston, The Chemistry of Taxol [(Химия таксола), Pharmac. Ther. Vol.52, pp. 1-34, 1991)] дается обзор химических свойств таксола как мощного противоопухолевого дитерпеноида, а также его аналогов, с акцентом на выделении, анализе, структурных модификациях, частичном синтезе и структурно-функциональной взаимозависимости.
Клиническая фармакология таксола представлена в обзоре Eric K. Rowinsky & Ross C. Donehower, The Clinical Phabmacology and Use of Antimicrotubule Agents in Cancer Chemotherapeutics (Агенты, действующие на микроканальцы, их клиническая фармакология и использование в клинической химиотерапии), Pharmac. Ther. vol. 52, pp.35-84, 1991. Обзор клинических и доклинических исследований таксола представлен в работе
William J. Slichemayer & Daniel D. von Hoff, Taxol: A New and Effective Anti-Cancer Drug
(Таксол: новый эффективный противоопухолевый препарат), Anti-Cancer Drugs, vol. 2, pp. 519-530, 1991.
Таксол и его аналоги описаны в различных патентах, таких, в частности, как патенты США NN 4814470, 4857653, 4942184,4924011, 4924012, 4960790, 5015744, 5157049, 5059699, 5136060, 4876399, 5227400, в публикации PCT N WO 92109589, в заявке на Европейский патент 90305845.1 (Публикация N A2 0400971), 90312366.9 (публикация N A1 0428376), 89400935.6 (публикация N A1 0366841) и 90402333.0 (публикация N 0414610 A1), 87401669.4 (A1 534709), 92308608.6 (A1 0534708), 92308609.4 (A1 534709), а также в публикациях PCT под номерами WO 91/17977, W 091/17976, WO 91/13066, WO/13053.
В литературе описаны различные способы получения таксола (его интермедиатов и аналогов): Tetrahedron Letters, 1992, 33, 5185: J.Org.Chem. 1991, 56, 1681 и J.Org.Chem. 1991, 56, 5114.
Чен с соавторами (Chen et al.) в работе ("Seren-dipitous Synthesis of a Cyclopropan - Containing Taxol Analog via Anchimeric Participation of a Unactivated Angular Methyl Group, Advance ACS Abstracts, vol. 1, N 2., July 15, 1993) сообщили о наблюдении неожиданной реакции, возникшей при обработке 7-эпи-производного таксола DAST в дихлорметане, которая при участии C-19 метильной группы ведет к образованию циклопропанового кольца. См. также J. Org. Chem., 1993, 58, 4520 (август, 13, 1993).
Патент США 5248796 (полученный 28 сентября 1993) относится к 10-дезацетокси-11,12-дигидротаксол-10,12(18)-диеновым производным и к получению 10-дезацетокситаксола.
Изобретение относится к 7-дезокси-аналогам таксола, имеющим формулу I:
Соединение формулы I используются для лечения тех же видов рака, в отношении которых была продемонстрирована противоопухолевая активность таксола; последние включают рак яичников человека, рак молочной железы, злокачественную меланому, рак легкого, рак желудка, рак толстой кишки, рак головы и шеи, а также лейкоз.
Принятые правила написания формул и определение переменных
Химические формулы, отражающие различные соединения и фрагменты молекул в спецификации и формуле изобретения, могут содержать, в дополнение к четко обозначаемым структурным единицам, переменные заместители. Такие переменные заместители идентифицируют с помощью буквы или буквенно-цифрового символа, например "Z1" или "Ri", где "i" представляет собой целое число. Описываемые переменные заместители, будучи моновалентными или бивалентными, обозначают группу, присоединяемую к соединению указанной формулы с помощью одной или двух химических связей. Так, например, группа Z1, в случае присоединения ее к формуле CH3-C(=Z1)H отражает двухвалентную переменную. А группы Ri и Rj, будучи присоединенными к формуле CH3-CH2-C(Ri)(Rj)-H, обозначают одновалентные переменные заместители. Когда химические формулы записывают в линейном виде, как это показано выше, те переменные заместители, которые заключены в скобки, присоединяются к атому, указанному слева от переменного заместителя, заключенного в скобки. В случае, если в скобки заключены последовательно два или больше переменных заместителя, каждый из этой последовательности переменных заместителей присоединяется к расположенному сразу же слева атому, не заключенному в скобки. Кроме того, для молекул с установленной системой нумерации углеродных атомов, к которым принадлежит и таксол, такие углеродные атомы обозначают как Ci, где "i" представляет собой целое число, соответствующее номеру углеродного атома. Так, символ C6 обозначает шестую позицию или номер углеродного атома в ядре в соответствии с традиционно принятой нумерацией.
Химические формулы соединений или их части, написанные в линейной форме, представляют атомы в линейной цепи. Символ "-" отражает, в общем случае, связь между двумя атомами в такой цепи. Так, цепь CH3-O-CH2-CH(Ri)-CH3 обозначает 2-замещенное-1-метоксипропановое соединение. Сходным образом, символ "= " обозначает двойную связь, то есть CH2=C(Ri)-O-CH3, а символ "≡" обозначает тройную связь, то есть HC≡C-CH(Ri)-CH2-CH3. Контрольные группы обозначают одним из двух способов: -CO- или C(=O)-, при этом в связи с простотой первому способу отдают предпочтение.
Химические формулы циклических соединений (колец) или фрагментов молекул могут также быть приведены в линейной форме. Так, соединение 4-хлор-2-метилпиридин может быть представлено в виде N* = C(CH3)-CH = CCl-CH = C*H2 при условии, что атомы, помеченные звездочкой (*), соединяются друг с другом с образованием кольца. Аналогично, циклический молекулярный фрагмент 4-(этил)-1-пиперазинил может быть записан в виде N*-(CH2)2 - N(C2H5)-CH2-C*H2. Сходным образом, 2-фурил может быть представлен линейной формулой -C*O-CH = CH-C*H=, а 2-тиенил может быть представлен в виде -C*-S-CH = CH-C*H-.
Ригидная циклическая (кольцевая) структура для каждого из описываемых здесь соединений определяет ориентацию относительно плоскости кольца для всех заместителей, присоединяемых к каждому углеродному атому данного ригидного циклического соединения. В случае насыщенных соединений, которые имеют два заместителя, присоединенных к углеродному атому, входящему в циклическое соединение, оба этих заместителя -C(X1)(X2) могут располагаться либо в вертикальной, либо в горизонтальной плоскости относительно кольца, а также могут менять свое вертикальное/горизонтальное положение. Однако положение обоих заместителей относительно кольца и относительно друг друга остается фиксированным. Так, даже в том случае, если заместитель чаще располагается по горизонтали, чем сверху или снизу от кольца, один из заместителей оказывается выше другого. В химических структурных формулах, отражающих такие соединение, заместитель (X1), который располагается "ниже" другого заместителя (X2), определяется как находящийся в альфа-конфигурации, которая обозначается в виде пунктирной линии или многоточия, идущих к атому углерода, то есть с помощью символов "---" или "...". Соответствующий заместитель, присоединенный "выше" (X2) другого (X1) заместителя, идентифицируется как находящийся в бета-конфигурации, которая обозначается в виде непрерывной линии, идущей к атому углерода.
В случае, если переменный заместитель двухвалентный, обе валентности могут иметь место либо вместе, либо отдельно, либо в разных случаях действительны оба варианта. Например, переменная Ri, присоединяемая к атому углерода в виде -C(=Ri), может быть бивалентной и представлять собой оксо- или кетогруппу [с образованием карбонильной группы (-CO)] или два присоединяемых отдельно друг от друга моновалентных переменных заместителя α-Ri-j и β-Ri-k . Когда бивалентная переменная Ri определяется как составленная из двух моновалентных переменных заместителей, для записи такой бивалентной переменной используют форму "α-Ri-j: β-Ri-k" или некоторые ее варианты. В указанном случае и α-Ri-j, и β-Ri-k присоединяются к одному углеродному атому с образованием -C(α-Ri-j)(β-Ri-k)-. Так, например, если бивалентная переменная R6, -C(= R6) определяется в качестве состоящей из двух моновалентных переменных заместителей и эти моновалентные переменные заместители представляют собой α-R6-1:β-R6-2,...α-R6-9:β-R6-10 и т. д. , то происходит образование -C(α-R6-1)(β-R6-2)-,...,-C(α-R6-9)(β-R6-10) и т.д. Аналогично, в случае бивалентной переменной R11, -C(=R11)-, два моновалентных переменных заместителя могут быть представлены в виде α-R11-1:β-R11-2. Для случая, если заместителем является кольцо, в котором не осуществляет отдельной α и β ориентации (в связи с наличием в кольце двойной углеродной связи), а также для случая заместителя, присоединенного к атому углерода, который не входит в состав кольца, вышеприведенное соглашение имеет силу, однако, при этом опускают обозначения α и β.
Так же, как бивалентная переменная может определяться в виде двух отдельных моновалентных переменных заместителей, два отдельных моновалентных переменных заместителя могут быть представлены в объединенной форме с образованием бивалентной переменной. Так, например, в формуле -C1(Ri)H-C2(Rj)H- (при этом C1 и C2 традиционно определяют соответственно первый и второй атомы углерода) Ri и Rj могут быть взяты вместе для обозначения полученной при этом (I) второй связи между C1 и C2 или (2) бивалентной группы, такой, в частности, как оксо-(O)-, или формулы, определяющей эпоксид. Когда Ri и Rj объединяются для обозначения образованной при этом более сложной структурной единицы, такой как -X-Y- группа, то в подобном случае ориентация группы такова, что C1 в вышеупомянутой формуле присоединяется к X, а C2 присоединяется к Y. Таким образом, в соответствии с приведенным соглашением, выражение ". .. Ri и Rj берутся вместе, с образованием -CH2-CH2-O-CO" означает лактон, в котором карбонильная группа присоединяется к C2. Однако в случае записи ". . . Ri и Rj берутся вместе, с образованием -CO-O-CH2-CH2-" принятые правила дают обозначение лактона, в котором карбонил присоединяется к C1.
Количество атомов углерода в переменных заместителях указывается одним из двух способов. В первом способе используется префикс, присоединяемый к обозначению целой переменной, например "C1-C4", где "1" и "4" представляют собой натуральные целые числа, отражающие минимальное и максимальное число атомов углерода в переменной. Префикс пространственно отделяется от переменной. Например, запись "C1-C4 алкил" обозначает алкил, содержащий от 1 до 4 атомов углерода (включая их изомерные формы, если при этом не даны какие-либо иные указания). В случае записи единичного префикса, этот префикс обозначает общее число атомов углерода в определенной ранее переменной. Так, выражение "C2-C4 алкилкарбонил" описывает группу CH3-(CH2)n-O-CO-, в которой n означает 0, 1 или 2. По второму способу количество атомов углерода в каждой определенной части указывается отдельно путем заключения обозначения "CiCj" в скобки и помещения его сразу же (без пространственного интервала) перед той частью формулы, к которой оно относится и которая была ранее определена. По этому факультативному условию (C1-C3)алкилкарбонил имеет то же самое значение, что и C2-C4 алкилкарбонил, поскольку "C1-C3" относится только к содержанию углеродных атомов в алкокси-группе. Сходным образом, при том, что C2-C6 алкоксиалкил и (C1-C3)алкокси(C1C3)алкил определяют алкоксиалкильные группы, содержащие от 2 до 6 атомов углерода, эти два определения различаются тем, что по первому и алкокси, и алкильная части могут содержать от 4 до 5 атомов углерода каждая, тогда как второе определение ограничивает всевозможное количество атомов углерода в каждой из этих групп тремя.
Когда формула изобретения содержит сложный (циклический) заместитель, в конце формулировки, называющей/обозначающей конкретный заместитель, должно даваться примечание (в скобках), которое относится к тому же самому названию/обозначению, что приводится на схемах и которое дальше проставляется рядом со структурной формулой данного заместителя.
Более специфично настоящее изобретение относится к аналогам 7-дезокси-таксола с общей формулой 1
где R1 отбирается из группы, состоящей из
-CH3,
-C6H5 или фенила, замещенного одной, двумя или тремя C1-C4алкил, C1-C3алкокси-, гало-, C1-C3алкилтио-, трифторметил-, C2-C6диалкиламино-, гидрокси- или нитро-группами,
-2-фурило, 2-тиенило-, 1-нафтило-, 2-нафтило или 3,4-метилендиоксифенило-групп;
R2 отбирается из группы, состоящей из -H, -NHC(O)H, -NHC(O)C1-C10 алкила (предпочтительно -NHC(O)C4-C6 алкила), -NHC(O)-фенила, -NHC(O)-фенила, замещенного одной, двумя или тремя C1-C4алкил-, C1-C3алкокси-, гало-, C1-C3алкилтио-, трифтрометил-, C2-C6диалкиламино-, гидрокси- или нитро-группами, -NHC(O)C(CH3)= CHCH3, -NHC(O)OC(CH3)3, -NHC(O)OCH2-фенила, -NH2, -NHSO2-4-метилфенила, -NHC(O)-(CH2)3COOH, -NHC(O)-4-(SO3)H фенила, -OH, -NHC(O)- 1-адамантила, -NHC(O)O-3-тетрагидрофуранила, -NHC(O)O-4-тетрагидропиранила, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10алкила, -NHC(O)NHC1-C10алкила, -NHC(O)NHPh, -NHC(O)NHPh, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3 алкокси-, гало-, C1-C3-алкилтио-, трифенилметил, C2-C6 диалкиламино или нитрогруппами, -NHC(O)C3-C8, циклоалкила, -NHC(O)C(CH2CH3)2CH3, -NHC(O)C(CH3)CH2Cl, -NHC(O)C(CH3)2CH2CH3, фталимидо-группы, -NHC(O)-1-фенил-1-циклопентила, -NHC(O)-1-метил-1-циклогексила, -NHC(S)NHC(CH3)3, -NHC(O)NHCC(CH3)3 или -NHC(O)NHPh;
R3 отбирается из группы, состоящей из -H, -NHC(O)-фенила или -NHC(O)OC(CH3), при общем условии, что один из двух заместителей R2 и R3 представляет собой -H, но оба, R2 и R3, не могут одновременно быть представлены радикалом -H;
R4 представляет собой -H или отбирается из группы, состоящей из -OH, -OAc(-OC(O)CH3), -OC(O)OCH2C(Cl)3, -OCOCH2CH2NH
-CH2CH2COOH, -(CH2)3NHC(=NH)NH2], остатка аминокислоты пролина, -OC(O)CH= CH2, -C(O)CH2CH2C(O)NH-CH2CH2SO- 3Y+, - OC(O)CH2CH2C(O)NHCH2CH2CH2SO- 3Y+, где Y+ представляет собой Na+ или N+(Bu)4, -OC(O)CH2CH2C(O)OCH2CH2OH;
R5 представляет собой -H или -OH при общем условии, что когда R5 представляет собой -OH, R4 представляет собой -H, и, кроме того, при условии, что когда R5 представляет собой -H, R4 отличен от -H;
R6 представляет собой -H:-H, когда R7 представляет собой 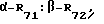 где один из R71 и R72 есть -H, а другой из R71 и R72 есть -X, где X представляет собой гало-группу, а R8 представляет собой -CH3;
где один из R71 и R72 есть -H, а другой из R71 и R72 есть -X, где X представляет собой гало-группу, а R8 представляет собой -CH3;
R6 представляет собой -H:-H, когда R7 представляет собой α-H:β-R74, где R74 и R8 соединяются вместе с образованием циклопропилового кольца;
R10 представляет собой -H или -C(O)CH3; и их фармацевтически приемлемые соли, когда соединение содержит либо кислую, либо основную функциональную группу.
Предпочтительным вариантом объекта изобретения являются соединения формулы I, где R1 представляет собой фенил или фенил, замещенный гало-группой, R2 представляет собой -NHC(O)C6H5, R3 и R5 представляют собой -H, R4 представляет собой -OH, а R10 является -H или -CO(O)CH3. К другим предпочтительным вариантам объекта настоящего изобретения относятся соединения формулы I, R1 является предпочтительно фенилом или фенилом, замещенным гало-группой, R2 представляет собой -NHC(O)OC(CH3)3, R3 и R5 представляют собой -H, R4 представляет собой -OH, а R10 является -H или -COCH3. Кроме того, предпочтительными вариантами объекта настоящего изобретения являются соединения формулы I, где R1 представляет собой фенил или фенил, замещенный гало-группой, R2 представляет собой -NHC(O)NHC(CH3)3, R3 и R5 представляют собой -H, R4 представляет собой -OH, а R10 является -H или -COCH3.
Одним из вариантов объекта настоящего изобретения являются соединения формулы I, где R1 отбирается из группы, состоящей из -CH3, -C6H5 или фенила, замещенного одной, двумя или тремя C1-C4 алкил, C1-C3 алкокси, гало-, C1-C3 алкилтио, трифторметил-, C2-C6 диалкиламино-, гидрокси- или нитро- группами, а R2 отбирается из группы, состоящей из -H, NHC(O)H, -NHC(O)C1-C10, алкила (предпочтительно -NHC(O)C4-C6-алкила), -NHC(O) фенила, -NHC(O) фенила, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3 алкокси-, гало-, C1-C3-алкилтио, трифторметил-, C2-C6 диалкиламино-, гидрокси- или нитро-группами, -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NHC(O)OCHH2, фенила, -NH2, -NHSO2-4-метилфенила, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO2H)фенила, -OH, -NHC(O)-1-адамантила, -NHC(O)O-3-тетрагидрофуранила, -NHC(O)-4-тетрагидрофуранила, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10 алкила, -NHC(O)NHC1-C10алкила, -NHC(O)NHPh, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3 алкокси-, гало-, C1-C3 алкилтио, трифторметил-, C2-C6 диалкиламино- или нитро-группами.
Настоящее изобретение также относится к аналогам таксола общей формулы II
и формулы III
где X представляет собой атом галогена, отобранный из группы, состоящей из -F, -Br, -Cl и -I; и где R1, R2, R3, R4, R5 и R10 соответствуют определению, данному выше.
Один из вариантов настоящего изобретения относится к аналогам 7-дезокси -7β,8β- метано-таксола с общей формулой II, где:
R1 выбирается из группы, состоящей из -CH3, -C6H5 или фенила, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3 алкокси, гало-, C1-C3 алкилтио-, трифтрометил-, C2-C6-диалкиламино-, гидрокси- или нитро-группами;
R2 отбирается из группы, состоящей из -H, -NHC(O)C1-C10-алкила (предпочтительно -NHC(O)C4-C6 алкила), -NHC(O)фенила, -NHC(O)фенила, замещенного одной, двумя или тремя C1-С4 алкил-, C1-C3 алкокси-, гало-, C1-C3 алкилтио-, трифторметил-, C2-C6-диалкиламино-, гидрокси- или нитро-группами, -NHC(O)C(CH3)= CHCH3, -NHC(O)OC(CH3)3, -NH2, -NHSO2-4-метилфенила, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенила или -OH;
R3 отбирается из группы, состоящей из -H, -NHC(O)фенила или -NHC(O)OC(CH3)3, при общем условии, что один из R2 и R3 представляет собой -H,но оба вместо R2 и R3 не могут представлять собой -H;
R4 представляет собой -H или отбирается из группы, состоящей из -OH, -OAc(-OC(O)CH3), -OC(O)OCH2C(Cl)3, -OCOCH2CH2NH+HCOO-, NHC(O)фенила, -NHC(O)OC(CH3)3, -OCOCH2CH2COOH и других фармацевтически приемлемых солей, -OCO(CH2)3COOH и ее фармацевтически приемлемых солей и -OC(O)-Z-C(O)-R' [где Z представляет собой этилен (-CH2-CH2-), пропилен (-CH2-CH2-CH2-), -CH=CH-, 1,2-циклогексан или 1,2-фенилен, а R' представляет собой -H, -OH, -OH основание, -NR'2R'3, -OR'3, -SR'3, -OCH2C(O)NR'4R'5, где R'2 представляет собой -H или -CH3, R'3 представляет собой -(CH2)nNR'6R'7 или (CH2)nN+R'6R'7R'8X-, где n имеет значение 1-3, R'4 представляет собой -H или -C1-C4 алкил, R'5 представляет собой -H, -C1-C4 алкил, бензил, гидроксиэтил-, -CH2CO2H или диметиламиноэтил, R'6 и R'7 представляет собой -CH3, -CH2CH3, бензил или R'6 и R'7 вместе с азотом NR'6R'7 образуют пирролидино-, пиперидино-, морфолино- или N-метилпиперазино-группу, R'8 представляет собой -CH3, CH2CH3 или бензил, X- представляет собой галид, а основание представлено NH3, (HOC2H4)3N, N(CH3)3, CH3N(C2H4)2NH, NH2(CH2)6NH2, глюкамином, NaOH или KOH] , -OC(O)(CH2)nNR2R3 [где n имеет значение 1-3, R2 представляет собой -H или -C1-C3 алкил, R3 представляет собой -H или -C1-C3алкил], -OC(O)CH(R'')NH2 [где R'' отбирается из группы, состоящей из -H, -CH3, -CH2CH(CH3)2, -CH(CH3)CH2CH3, -CH(CH3)2, -CH2 фенила, -(CH2)4NH2, -CH2CH2COOH, -(CH2)3NHC(= NH)NH2], остатка аминокислоты пролина, -OC(O)CH=CH2, -C(O)CH2CH2C(O)NHCH2CH2SO
R5 представляет собой -H или -OH при общем условии, что, когда R5 представляет собой -OH, R4 представляет собой -H, и, кроме того, при условии, что, когда R5 представляет собой -H, R4 - отличен от -H,
R10 представляет собой -H или -C(O)CH3; и их фармацевтически приемлемые соли, когда соединение содержит либо кислую, либо основную функциональную группу.
Другой вариант настоящего изобретения представляет аналоги 7-дезокси -7β,8β- метано-таксола с общей формулой II, где:
R1 отбирается из группы, состоящей из -CH3, -C6H5 или фенила, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3-алкокси-, гало-, C1-C3 алкилтио-, трифторметил-, C2-C6 диалкиламино-, гидрокси- или нитро-группами;
R2 отбирается из группы, состоящей из -NHC(O)-1-адамантила, -NHC(O)O-3-тетрагидрофуранила, -NHC(O)-O-4-тетрагидропиранила, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10 алкила, -NHC(O)NHC1-C10 алкила, -NHC(O)NHPh, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3-алкокси-, гало-C1-C3 алкилтио-, трифторметил-, C2-C6 диалкиламино- или нитро-группами, -NHC(O)C3-C8 циклоалкила; а
R3, R4, R5 и R10 соответствуют определению, данному выше.
Предпочтительным вариантом объекта изобретения являются соединения формулы I где R1 представляет собой фенил или фенил, замещенный гало-группой, R2 представляет собой -NHC(O)C6H5, R3 и R5 представляют собой -H, а R10 является -H или -C(O)CH3. Другим предпочтительным вариантом объекта изобретения являются соединения формулы II, где R1 представляет собой предпочтительно фенил или фенил, замещенный гало-группой, R2 представляет собой -NHC(O)OC(CH3)3, а R3, R5 и R10 представляют собой -H. Следующим предпочтительным вариантом объекта изобретения являются соединения формулы II, где R1 представляет собой предпочтительно фенил или фенил, замещенный гало-группой, R2 представляет собой -NHC(O)OC(CH3)3, R3 и R5 представляют собой -H, а R10 представляет собой -C(O)CH3. Другим предпочтительным вариантом объекта изобретения являются соединения формулы II, где R1 представляет собой предпочтительно фенил или фенил, замещенный гало-группой, R2 представляет собой -NHC(O)NHC(CH3)3, R3 и R5 представляют собой -H, R4 представляет собой -OH, а R10 представляет собой -H или -C(O)CH3.
Дополнительно предпочтительные варианты формулы II включают:
- соединения, отвечающие формуле II, а именно 7-дезокси -7β,8β- метано-таксол,
- соединения, отвечающие формуле II, а именно 2'-[{(2,2,2- трихлорэтил)окси}карбонил]-7-дезокси -7β,8β- метано-таксол, и
- соединения, отвечающие формуле II, а именно 10-ацетил-7- дезокси -7β,8β- метано-таксотер, и
- соединения, отвечающие формуле II, а именно N- Дебензоил- n-(t-бутил)аминокарбонил-7-дезокси -7β,8β- метано-таксол.
Другим вариантом настоящего изобретения являются аналоги 7-галотаксола с общей формулой III, где:
X представляет собой атом галогена, отобранный из группы, состоящей из -F, -Br, -Cl и -I,
R1 отбирается из группы состоящей из -CH3, -C6H5 или фенила, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3 алкокси-, гало-, C1-C3 алкилтио-, трифторметил-, C2-C6 диалкиламино- гидрокси или нитро-группами,
R2 отбирается из группы, состоящей из -H, -NHC(O)фенила, -NHC(O)фенила, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3 алкокси-, гало-, C1-C3 алкилтио-, трифторметил-, C2-C6 диалкиламино-, гидрокси- или нитро-группами, -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NH2, -NHSO2-4-метилфенила,
-NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенила или -OH,
R3 отбирается из группы, состоящей из -H, -NHC(O)-фенила или -NHC(O)OC(CH3)3, при общем условии, что один из R2 и R3 представляет собой -H, но оба вместе R2 и R3 не могут представлять собой -H,
R4 представляет собой -H или отбирается из группы, состоящей из -OH, -OAc(-OC(O)CH3), -OC(O)OCH2C(Cl)3, -OCOCH2CH2NH
R5 представляет собой -H или -OH при общем условии, что, когда R5 представляет собой -OH, R4 представляет собой -H, и, кроме того, при условии, что когда R5 представляет собой -H, R4 отличен от -H,
R10 представляет собой -H или -C(O)CH3, и их фармацевтически приемлемые соли, когда соединение содержит либо кислую, либо основную функциональную группу.
Следующий вариант настоящего изобретения представляет собой аналоги 7-галотаксола с общей формулой III, где:
X представляет собой атом галогена, отобранный из группы, состоящей из -F, -Br, -Cl и -I,
R1 отбирается из группы, состоящей из -CH3, -C6H5 или фенила, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3 алкокси-, гало-, C1-C3 алкилтио-, трифторметил-, C2-C6 алкиламино- гидрокси- или нитро-группами,
R2 отбирается из группы, состоящей из -NHC(O)-1-адамантила, -NHC(O)O-3-тетрагидрофуранила, -NHC(O)O-4-тетрагидропиранила, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10 алкила, -NHC(O)NHC1-C10 алкила, -NHC(O)NHPh, замещенного одной, двумя или тремя C1-C4 алкил, C1-C3 алкокси-, гало-, C1-C3 алкилтио-, трифторметил-, C2-C6 диалкиламино- или нитро-группами, -NHC(O)C3-C8 циклоалкила, а
R3, R4, R5 и R10 соответствуют определению, данному выше.
Соединения формулы III включают y как 7-α, так и 7-β конфигурации в 7-гало-положении. При этом к гало-группе относятся -F, -Br, -Cl и -I.
В соединениях формулы III: X обозначает предпочтительно -F, R3 и R5 - предпочтительно -H, а R1 представляет собой предпочтительно фенил или фенил, замещенный гало-группой.
Другие предпочтительные варианты формулы III включают:
- соединения по формуле III, где R4 представляет собой -H, а R5 представляет собой -OH,
-соединения по формуле III, где R4 отличается от -H, а R5 представляет собой -H,
- соединения по формуле III, где R3 представляет собой -H, а R1 представляет собой Ph или замещенный фенил, и
- соединения по формуле III, где X представляет собой -F,
- соединения по формуле III, где X представляет собой -α-F;
- соединения по формуле III, где X представляет собой -F, и
R4 отличен о -H, а R5 представляет собой -H,
- соединения по формуле III, где X представляет собой -F,
R3 представляет собой -H, а R1 представляет собой Ph или замещенный фенил, и
- соединения по формуле III, отобранные из группы, состоящей из 7-дезокси-7-фтортаксола и 2'-[{2,2,2-трихлорэтил)окси}карбонил] -7-дезокси-7-фтортаксола, и
- соединения по формуле II, а именно N-Дебензоил-N-(t- бутил)аминокарбонил-7-дезокси-7-фтор-таксол.
Дополнительный предпочтительный вариант формулы III охватывает соединения, отобранные из группы, состоящей из 7-дезокси- 7α- фтортаксола, 7-дезокси -7β- фтортаксола, 2'-[{(2,2,2-трихлорэтил) -окси}карбонил]-7-дезокси-7α- фтортаксола и 2'-[{(2,2,2- трихлорэтил)окси}карбонил]-7-дезокси -7β- фтортаксола.
Предпочтительный вариант объекта изобретения охватывает соединения формулы III, где R1 представляет собой предпочтительно фенил или фенил, замещенный гало-группой, R2 представляет собой -NHC(O)NHC(CH3)3, R3 и R5 представляют собой -H или -COCH3.
Примеры -NHC(O)C1-C10 алкила включают -NHC(O)-n-пентил и -NHC(O)CH(CH3)CH2CH3.
Примеры C1-C6 алкила включают прямые и разветвленные алкильные цепи, представленные, в частности, метилом, этилом, изопропилом, t-бутилом, изобутилом и 2-метил-пентилом.
Примеры C1-C3 алкокси-групп включают метокси-, этокси-, пропокси-группы и их изомерные формы.
Гало-группы относятся к -F, -Br, -Cl или -I.
Примеры соединений формулы III настоящего изобретения включают:
2'-[{ 2,2,2-трихлорэтил)окси} карбонил] -7-дезокси -7β,8β- метано-таксол (соединение 14AA, соединение 11a),
7-дезокси -7β,8β- метано-таксол (соединение 11b);
2'-сукцинил-7-дезокси -7β,8β- метано-таксол,
2′-(β- аланил)-7-дезокси -7β,8β- метано-таксоловый эфир муравьиной кислоты,
2'-глутарил-7-дезокси -7β,8β- метано-таксол,
2'-[-C(O)(CH2)3C(O)NH(CH2)3N (CH3)2]-7-дезокси -7β,8β- метано-таксол,
2′(β- сульфопропионил)-7-дезокси -7β,8β- метано-таксол,
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси -7β,8β- метано-таксол,
2'-(3-сульфопропиламидо)сукцинил-7-дезокси -7β,8β- метано-таксол,
2'-(триэтилсилил)-7-дезокси -7β,8β- метано-таксол,
2'-(t-бутилдиметилсилил)-7-дезокси -7β,8β-/ метано-таксол,
2'-(N,N-диэтиламинопропионил)-7-дезокси -7β,8β- метанотаксол,
2'-(N,N-диметилглицил)-7-дезокси -7β,8β- метано-таксол,
2'-(глицил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-аланил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-лейцил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-изолейцил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-валил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-фенилаланил)-7-дезокси -7β,8β- метано-таксол;
2'-(L-проил)-7-дезокси -7β,8β- метано-таксол;
2'-(L-лизил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-глутамил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-аргинил)-7-дезокси -7β,8β- метано-таксол,
7-дезокси -7β,8β- метано-таксотер,
10-ацетил -7β,8β- метано-таксотер (соединение 23),
N-дебензоил-N-тетрагидрофуран-3-илоксикарбонил-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(1-адамантоил)-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-фениламинокарбонил-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-t-бутиламинокарбонил-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(1-метил-1-циклогексаноил)-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(1-фенил-1-циклопентаноил)-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-фталимидо-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-t-бутиламинотиокарбонил-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-t-амилоксикарбонил-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-неопентилоксикарбонил-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(2-хлоро-1,1-диметилэтил)оксикарбонил-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(3-метил-3-пентил)оксикарбонил-7-дезокси -7β,8β- метанотаксол;
3'-десфенил-3'-(2-фурил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(2-тиенил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(1-нафтил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(2-нафтил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(4-метоксифенил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(4-хлорофенил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(4-бромофенил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(3,4-метилендиоксифенил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(3,4-диметоксифенил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(4-нитрофенил)-7-дезокси -7β,8β- метанотаксол,
3'-десфенил-3'-(4-фторфенил)-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-бромбензоил)-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-метилбензоил)-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-L-бутилбензоил)-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-метоксибензоил)-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-фторфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-фторбензоил)-7-дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-фторфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-фторфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-фторфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-хлорфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-хлорфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-t-бутилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-t-бутилбензоил)-3'-десфенил-3'-(4-фторфенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(4-t-бутилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси -7β,8β-/ метанотаксол,
N-дебензоил-N-(4-метоксибензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси -7β,8β- метанотаксол,
N-дебензоил-N-(t-бутил)аминокарбонил)-7-дезокси -7β,8β- метано-таксол (соединение 29),
и их фармацевтически приемлемые соли, когда соединение содержит либо кислую, либо основную функциональную группу.
Примеры соединений формулы III данного изобретения включают:
2'-[{2,2,2-трихлорэтил)окси}карбонил]-7-дезокси-7-фтортаксол (соединение 13AA_ 111c)
7-дезокси-7-фтортаксол (соединение 111b);
2'-сукцинил-7-дезокси-7-фтортаксол,
муравьиный эфир 2′-(β- аланил)-7-дезокси--7-фтортаксола,
2'-глутарил-7-дезокси-7-фтортаксол,
2'-[-C(O)(CH2)3C(O)NH(CH2)3N (CH3)2]-7-дезокси 7-фтортаксол,
2′-(β- сульфопропионил)-7-дезокси-7-фтортаксол,
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-фтортаксол,
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7-фтортаксол,
2'-(триэтилсилил)-7-дезокси-7-фтортаксол,
2'-(t-бутилдиметилсилил)-7-дезокси-7-фтортаксол,
2'-(N,N-диэтиламинопропионил)-7-дезокси-7-фтортаксол,
2'-(N,N-диметилглицил)-7-дезокси-7-фтортаксол,
2'-(глицил)-7-дезокси-7-фтортаксол,
2'-(L-аланил)-7-дезокси-7-фтортаксол,
2'-(L-лейцил)-7-дезокси-7-фтортаксол,
2'-(L-изолейцил)-7-дезокси-7-фтортаксол,
2'-(L-валил)-7-дезокси-7-фтортаксол,
2'-(L-фенилаланил)-7-дезокси-7-фтортаксол,
2'-(L-пролил)-7-дезокси-7-фтортаксол,
2'-(L-лизил)-7-дезокси-7-фтортаксол,
2'-(L-глутамил)-7-дезокси-7-фтортаксол,
2'-(L-аргинил)-7-дезокси-7-фтортаксол,
7-дезокси-7-фтортаксотер,
10-ацетил-7-дезокси-7-фтортаксотер (соединение 20),
N-дебензоил-N-тетрагидрофуран-3-илоксикарбонил-7-дезокси-7-фтортаксол,
N-дебензоил-N-пивалоил-7-дезокси-7-фтортаксол,
N-дебензоил-N-n-гексиламинокарбонил-7-дезокси-7-фтортаксол,
N-дебензоил-N-t-бутиламинокарбонил-7-дезокси-7-фтортаксол,
N-дебензоил-N-(1-метил-1-циклогексаноил)-7-дезокси-7-фтортаксол,
N-дебензоил-N-(1-фенил-1-циклопентаноил)-7-дезокси-7-фтортаксол,
N-дебензоил-N-фталимидо-7-дезокси-7-фтортаксол,
N-дебензоил-N-t-бутиламинотиокарбонил-7-дезокси-7-фтортаксол,
N-дебензоил-N-t-амилоксикарбонил-7-дезокси-7-фтортаксол,
N-дебензоил-N-неопентилоксикарбонил-7-дезокси-7-фтортаксол,
N-дебензоил-N-(2-хлоро-1,1-диметилэтил)оксикарбонил-7-дезокси- 7-фтортаксол,
N-дебензоил-N-(3-метил-3-пентил)оксикарбонил-7-дезокси-7-фтортаксол;
3'-десфенил-3'-(2-фурил)-7-дезокси-7-фтортаксол,
3'-десфенил-3'-(2-тиенил)-7-дезокси-7-фтортаксол,
3'-десфенил-3'-(1-нафтил)-7-дезокси-7-фтортаксол,
3'-десфенил-3'-(2-нафтил)-7-дезокси-7-фтортаксол,
3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7-фтортаксол,
3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7-фтортаксол,
3'-десфенил-3'-(4-бромфенил)-7-дезокси-7-фтортаксол;
3'-десфенил-3'-(3,4-метилендиоксифенил)-7-дезокси-7-фтортаксол,
3'-десфенил-3'-(3,4-диметоксифенил)-7-дезокси-7-фтортаксол,
3'-десфенил-3'-(4-нитрофенил)-7-дезокси-7-фтортаксол,
3'-десфенил-3'-(4-фторфенил)-7-дезокси-7-фтортаксол,
N-дебензоил-N-(4-бромбензоил)-7-дезокси-7-фтортаксол,
N-дебензоил-N-(4-метилбензоил)-7-дезокси-7-фтортаксол,
N-дебензоил-N-(4-t-бутилбензоил)-7-дезокси-7-фтортаксол,
N-дебензоил-N-(4-метоксибензоил)-7-дезокси-7-фтортаксол,
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7- фтортаксол,
N-дебензоил-N-(4-фторбензоил)-7-дезокси-7-фтортаксол,
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7- фтортаксол,
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7- фтортаксол,
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7- фтортаксол,
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7- фтортаксол,
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси- 7-фтортаксол,
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксибензил)-7-дезокси- 7-фтортаксол,
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7- фтортаксол,
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси- 7-фтортаксол,
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси- 7-фтортаксол,
N-дебензоил-N-(4-t-бутилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси- 7-фтортаксол,
N-дебензоил-N-(4-t-бутилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси- 7-фтортаксол,
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси- 7-фтортаксол,
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7-фтортаксол,
N-дебензоил-N-(4-t-бутилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси- 7-фтортаксол,
N-дебензоил-N-(4-метоксибензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси-7-фтортаксол,
N-дебензоил-N-(4-t-бутил)аминокарбонил-7-дезокси-7-фтортаксол (соединение 28), и
их фармацевтически приемлемые соли, когда соединение содержит либо кислую, либо основную функциональную группу.
Настоящее изобретение предусматривает также способ получения оксазолидинов по формуле 5
в которой
R1 соответствует ранее данному описанию.
R9 отбирается из C1-C6 алкилов, R11 представляет собой фенил, замещенный -(OC1-C2алкил)n, где n принимает значения от 1 до 3,
R12 отбирается из группы, состоящей из -C(O)C1-C10алкила (предпочтительно -C(O)C4 -C6 алкила), -C(O)фенила, -C(O)фенила, замещенного одним, двумя или тремя C1-C4алкил-, C1-C3 алкокси-, гало-, C1-C3 алкилтио-, трифторметил-, C2-C6 диалкиламино-, гидрокси- или нитро-группами, -NHC(O)C(CH3)= CHCH3, -C(O)OC(CH3)3, -C(O)OCH2 фенила, -SO2-4-метилфенила, -C(O)(CH2)3COOH, -C(O)-4-(SO3H)фенила, -C(O)-1-адамантила, -C(O)O-3-тетрагидрофурана, -C(O)O-4-тетрагидропиранила, -C(O)CH2C(CH3)3, -C(O)OC1-C10 алкила, -C(O)NHC1-C10 алкила, -C(O)NHPh, замещенного одним, двумя или тремя C1-C4 алкилами, C1-C3 алкокси-, гало-, C1-C3 алкилтио, трифторметил-, C2-C6-диалкиламино-, или нитрогруппами, или -C(O)C3-C8 циклоалкила, -C(O)C(CH2CH3)2CH3, -(C(O)C(CH3)2CH2Cl, -C(O)C(CH3)2CH2CH3, -C(O)-1-фенил-1-циклопентила, -C(O)-1-метил-1-циклогексила, -C(S)NHC(CH3)3, -C(O)NHCC(CH3)3 или -C(O)NHPh, который включает реакцию гидрокси-амина формулы 3
в которой R1 и R3 соответствуют ранее данному описанию, а R2 отбирается из группы, состоящей из -NHC(O)H, -NHC(O)C1-C10 алкила (предпочтительно - NHC(O)C4-C6 алкила), -NHC(O)фенила, -NHC(O)фенила, замещенного одной, двумя или тремя C1-C4 алкил-, C1-C3алкокси-, гало-, C1-C3 алкилтио-, трифторметил-, C2-C6 диалкиламино-, гидрокси или нитрогруппами, -NHC(O)C(CH3)=CHCH3, NHC(O)OC(CH3)3, -NHC(O)OCH2-фенила, -NHSO2-4-метилфенила, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H) фенила, -NHC(O)-1-адамантила, -NHC(O)O-3-тетрагидрофуранила, NHC(O)О-4-тетрагидропиранила, -NHC(O)CH2С(CH3)3, -NHC(O)C(CH3)3, - NHC(O)OC1-C10алкила, -NHC(O)NHC1-C10 алкила, -NHC(O)NHPh, замещенного одним, двумя или тремя C1-C4алкилами, C1-C3алкокси-, гало-, C1-C3алкилтио-, трифторметил-, C2-C6диалкиламино-, или нитрогруппами, или -NHC(O)C3-C8 циклоалкила, NHC(O)C(CH2CH3)2CH3, -NHC(O)С(CH3)2CH2Cl, -NHC(O)C(CH3)2CH2CH3,
-NHC(O)-1-фенил-1-цикло-пентила, -NHC(O)-1-метил-1-циклогексила, -NHC(S)NHC(CH3)3, -NHC(O)NHCC(CH3)3 или -NHC(O)NHPh;
с(1) электронно-обогащенным бензальдегидом формулы 4A
или (2) электронно-обогащенного ацетона формулы 4
где n принимает значения 1-3.
Кроме того, настоящее изобретение относится к способу получения
который включает реакцию свободной кислоты оксазолидина формулы 7
с соединением баккатина формулы 8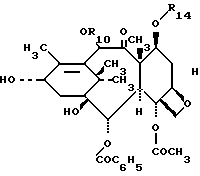
в присутствии дегидратирующего агента. При этом R10 и R14 могут быть одинаковыми или различаться и отбираются из группы, состоящей из -C(O)C1-C6алкила (предпочтительно -C(O)CH3), - C(O)OC1-C6 алкила, -C(O)OCH2CX3, где
X представляет собой галогруппу, -C(O)OCH2CH2SiR20 (где R20 представляет собой C1-C6алкил) или Si(R20)3; а R11 и R12 определяются в соответствии с ранее приведенным описанием.
Соединения настоящего изобретения получают в соответствии со способами, показанными на схемах A, A', B и C.
Исходной точкой способа, показанного на схеме А, является таксол или аналоговое производное таксола А-1. Реакция соединения А-1 с таким реагентом, как диэтиламиносульфуртрифторид (ДАСТ), с таким реагентом, как диэтиламиносульфуртрифторид (ДАСТ), диметиламиносульфуртрифторид (метилДАСТ), бис(диметиламино)сульфурдифторид, бис(диэтиламино)сульфурдифторид или (диэтиламино(диметиламино)сульфурдифторид, дает 7-дезокси -7β,8β- метано-аналог A'-2 (схема A-II), а также 7-дезокси-7-фтор-аналог A''-2 (схема A-III). Предпочтительным методом для такой конверсии является метод, включающий ДАСТ или метилДАСТ. Реакция с ДАСТ или метилДАСТ выполняется в апротонном растворителе, таком как метиленхлорид (CH2Cl2), хлороформ (CHCl3), фтортрихлорметан (фреон IIR), диметиловый эфир этиленгликоля (глим), 2-метоксиэтиловый эфир (диглим), пиридин, углеводы, такие как пентан, гексан или изооктан, тетрагидрофуран (ТГФ), бензол, толуол, ксилол. Предпочтительным растворителем является метиленхлорид. Реакция может проводиться в диапазоне температур от -100oC до 100oC и выше. В общем случае, реакция начинается в условиях низкой температуры, например -78oC, и проходит затем при более высокой температуре, в частности при 25oC. Реакцию останавливают добавлением воды, выделяют грубый продукт с помощью стандартных методик экстракции и очищают стандратными хроматографическими методами и/или кристаллизацией. [В том случае, когда R4 представляет собой -OC(O)OCH2C(Cl)3, обработка A'-2 (схема A-II) активированным цинком в растворе метанол : уксусная кислота служит для удаления защитной группы и получения искомого 7-дезокси -7β,8β-/ метано-таксола или аналога 7-дезокси -7β,8β- метано-таксола A''-3 (схема A-II). Когда R4 представляет собой -OC(OCH2C(Cl)3, обработка A''-2 (схема A-III) активированными цинком в растворе метанол : уксусная кислота служит для удаления защитной группы и получения искомого 7-дезокси-7-фтортаксола или аналога 7-дезокси-7-фтортаксола A''-3 (схема A-III)]. Методики, используемые для введения различных защищающих групп в таксол и аналоги таксола и для удаления таких групп, можно найти в работе: Greene, T.W. and P.G. M. Wuts, "Protective Groups in Organic Synthesis", 2nd Ed., pages 10-142, Wiley, N.Y., 1991.
Альтернативно, соединения (формула II) настоящего изобретения могут быть получены обработкой производного 7-эпитаксола с помощью ДАСТ в дихлорметане, как это было описано в работе Чена с соавторами (Chen et al., Serendipitous Synthesis of a Cyclopropane - Containing Taxol Analog via Anchimeric Participation of an Unactivated Angular Methyl Group, Advance ACS Abstracts, Vol. 1, No. 2, July 15, 1993 and J. Org. Chem., 1993, 56, 4520, (August 13, 1993).
Соединения (формула II) настоящего изобретения могут быть также получены с помощью метода, показанного на схеме B-11. По этому методу, когда Z' = H в формуле II (когда Z' = H, R10 = -C(O)CH3, эта структура формулы II известна, так же как баккатин III), обработка баккатина III или соответствующим образом защищенной (Z' = трок) молекулы B-1 баккатина III методом, описанным выше, дает 7-дезокси -7β,8β- метано-баккатин III (B-2) после удаления защитной группы. Реакция B-2 с активированной боковой цепью предшественника B-3 с помощью одного из нескольких методов, описанных в литературе (см.: Kingston, D. G.I. Pharmac. Ther., 1991, 52, 1-34, Commercon A.; Bezard, D.; Bernard, F. ; Bourzat, J.D. Tetrahedron Lett., 1922, 33, 5188, Georg, G.I.; Cheruvallath, Z.S.; Himes, R.H.; Mejillano, M.R. Bio Med. Chem. Lett. 1992, 2, 295) дает B-4. Так, например, связывание 7-дезокси -7β,8β- метано-баккатина III с (4S,5R)-N-БОК-2,2-диметил-4-фенил-5-оксазолидинкарбоновой кислотой в соответствии с процедурой Коммерсона с соавторами дает промежуточный продукт, который может быть использован для дальнейших трансформаций в 7-дезокси -7β,8β- метано-таксол, 7-дезокси -7β,8β- метано-таксотер (соединение формулы II, где R1 = Ph, R2 = NHC(O)O-t -Bu; R3 = R5 = H; R4 = R6 = OH] и другие аналоги 7-дезокси -7β,8β- метано-таксона.
Соединения (формула II) настоящего изобретения могут быть получены также из таксола или аналогов таксола, имеющих в положении C-7 в качестве заместителя группу, обладающую высокой подвижностью, то есть (a) предшественник иона диазония, такой как -NH2, (б) эфир сульфоната, -OSO2R (где R представляет собой группу, такую, например, как -CH3, -CF3, C6H4-(p)-Br, C6H4-(p) -NO2) или (в) один из галогенов - иод или бром (-I или -Br). Аминный заместитель в положении C-7 при реакции с азотистой кислотой (HNO2) превращается в ион диазония. Ион диазония спонтанно теряет азот, что приводит к образованию 7β,8β- метано-функциональной группы. C-7-Сульфонатный эфир при растворении в полярном растворителе (таком, как метанол: вода, этанол: вода, трифторуксусная кислота) подвергается ионизации, приводящей к образованию 7β,8β- метано-функциональной группы. Ионизация C-7-сульфнатного эфира может быть усилена путем добавления в реакционную среду ненуклеофильного основания (такого, как карбонат калия, бикарбонат калия, 1,4-диазобицикло-[2.2.2]-октана (DABCO)] . C-7-Иодид или бромид также подвергаются ионизации с образованием 7β,8β- метанофункциональной группы в полярном растворителе в присутствии солей металлов, в частности солей серебра, таких как ацетат серебра, трифторацетат серебра, тетрафторборат серебра.
Соединения (формула III) настоящего изобретения могут быть также получены с помощью метода, показанного на схеме B-III. По этому методу, когда Z' = Н в формуле II (когда Z' = H, R10 = -COCH3, эта структурная формула II известна так же, как баккатин III), фторирование баккатина III или соответствующим образом защищенной (Z' = troc) молекулы 8-1 баккатина III по методу, описанному выше, дает 7-фторбаккатин III (B-2) после удаления защитной группы. Реакция B-2 активированной боковой цепью предшественника B-3 одним из методов, описанных в литературе (см.: Kingston, D.G.I. Pharmac. Ther., 1991, 52, 1-34; Commercon, A. ; Berard, D.; Bernard, F.; Bourzat, J.D.'; Tetrahedron Lett. , 1992, 33, 5185, Georg, G.I.; Cheruvallath, Z.S.; Himes, R.H.; Mejillano, M.R. BioMed. Chem. Lett. 1992, 2, 295), дает B-4. Например, связывание 7-фторбаккатина III c (4S,5R)-N-БОК-2,2-диметил-4-фенил-5-оксазолидинкарбоновой кислотой с последующей трансформацией по процедуре Коммерсона с соавторами дает промежуточный продукт, который может быть использован для дальнейших трансформаций в 7-дезокси -7β,8β- фтортаксол, 7-дезокси -7β,8β- фтортаксотер (соединение формулы III, где R1 = Ph, R2 = NHC(O)O-t-Bu; R3 = R5 = H, R4 = OH, R10 = -C(O)CH3] или другие аналоги 7-дезокси -7β,8β- фтортаксона.
Соединения (формула I, включая формулы III и III) настоящего изобретения могут быть получены с помощью новой усовершенствованной процедуры, показанной на схемах A', B и C. Получение эфиров 1 3-азидо-2-гидрокси-карбоновой кислоты может быть осуществлено, как описано в литературе (см.: Denis, J-N.; Correa, A. ; Greene, A.E. J. Org. Chem. 1990, 55, 1957). Эти вещества легко гидрогенизируются с образованием свободных аминов 2, несмотря на то, что в приводимых в литературе данных избегают использовать этот промежуточный продукт для получения гидрокси-ацилированного интермедиата перед восстановлением азида. Амин 2 достаточно стабилен, так что не возникает никаких проблем при его выделении и непосредственном использовании для получения N-ацилированных свободных гидрокси-соединений 3. Соединения 3 использовались с целью защиты гидроксигрупп, для гидролиза эфира в кислоту и прямой конденсации с производным баккатина III или после конверсии в оксазинон (Европейский Патент 0428376 A1, США 436235). Эти процедуры недостаточно совершенны, так как требуют большого избытка ациллирующего агента и, как правило, не дают возможности провести процесс более чем на 60%. Описаны и другие процедуры, использующие бета-лактамный интермедиат, однако, они также требуют большого избытка реагента или введения очень сильных оснований, таких как LDA, что усложняет проведение данного процесса и делает его непригодным для получения определенных аналогов (Ojima, I.; Habus, I.; Zhao, M.; George, G. I.; Jayasinghe, L.R. J. Org., Chem., 1991, 56, 1681, EP 0400971 A2). Группой исследователей был описан очень эффективный процесс конденсации, включающий конверсию гидрокси-аминного производного 3 в оксазолидин с двумя заместителями, отличающимися от водорода во 2 положении (Commercon, A.; Berard, D.; Bernard, F.; Bourzat, J.D. in Tetrahedron Lett., 1992, 33, 5185, и Patent WO 92/09589). Процесс конденсации дает очень большой выход, однако для удаления защищающей группы требуется достаточно сильная кислота, так что чувствительные аналоги таксола разрушаются в столь жестких условиях депротекции. Мы модифицировали и улучшили эту процедуру путем образования оксазолидинов 5 не через кетон, как это делали вышеуказанные исследователи, а через обогащенный электронами бензальдегид 4. Оксазолидины, полученные через бензальдегид 4, образуют смесь диастереомеров, но в ряде случаев их удалось разделить и показать, что все диастереомеры обладают одинаковыми свойствами, полезными для проведения синтеза. Оксазолидины 5 легко гидролизуются с образованием солей 6 и кислот 7. Кислота лабильна, поэтому необходимо использовать ее сразу после получения. Оба изомера оксазолидина одинаково эффективны в реакции конденсации с защищенными баккатинами 8, давая в результате реакции хороший выход защищенных оксазолидиновых аналогов 9 таксола. Более существенным является тот факт, что оба изомера оксазолидина, полученные через такие богатые электронами бензальдегиды, легко гидролизуются при очень мягких кислотных условиях, что позволяет проводить депротекцию без нежелательной трансформации производных таксола, высокочувствительных к кислоте, таких, как 10, которые и являются объектом настоящего изобретения. В литературе имеются ссылки на использование богатых электронами альдегидов для защиты 1,2-диолов, в частности, диоксоланов, но не было данных об использовании таких альдегидов для защиты 2-гидрокси-защищенных аминов. Депротекция может быть проведена так, что и оксазолидин, и 7-защищенный гидроксил 9 могут быть удалены либо в одно и то же время, либо независимо друг от друга. На схеме 8 дополнительно описывается процедура депротекции ряда аналогов 10 уретана с получением свободного амина 11. При этом полученные соединения могут быть заново превращены в множество различных аминоацилированных аналогов 10.
Известно, что на ход процесса конверсии азида 1 в амин 2 воздействуют восстановительные агенты. Так, реакция может быть проведена путем гидрогенизации в присутствии множества катализаторов гидрогенизации, таких как палладий, платина, родий или рутений. Альтернативно, азид может быть восстановлен при обработке фосфином, таким как трифенил- или трибутилфосфин, или кислотой, такой как соляная, серная, трифторуксусная или бромистоводородная, в присутствии металла, в частности цинка, железа или олова. Эти реакции могут быть проведены в таких растворителях, как этанол, этилацетат, метил-t-бутиловый эфир, тетрагидрофуран и т.п. Конверсии амина 2 в его ацилированное производное 3 способствует обработка амина в пиридине или неосновном растворителе, таком как метиленхлорид или тетрагидрофуран, содержащем четвертичный амин, такой как триэтиламин или этилдиизопропиламин, совместно с ацетилирующим агентом. Если 3 представляет собой уретан, 2 обрабатывают такими агентами, как бензилхлорформиат, 2,2,2-трихлорэтоксикарбонил, ди-трет-бутилдикарбонат или другим образующим уретан агентом, известным в технике. Если 3 - представляет собой амид, 2 обрабатывают с помощью ацилирующего агента, такого как ацил-галид или ацил-ангидрид, или других известных в технике ацилирующих агентов. Если 3 представляет собой мочевину или тиомочевину, то 2 обрабатывают таким агентом, как алкил- или арил-изотиоцианат, или другим известным в технике агентом, образующим мочевину или тиомочевину.
Гидроксиамид или уретан 3 превращают в оксазолидин 5 путем обработки обогащенным электронами бензальдегидом или его ацеталями, такими как диметил- или диэтил-ацеталем 4, и кислым катализатором, таким как п-толуолсульфоновая кислота, п-толуолсульфонат пиридиния. или другими известными в технике кислыми катализаторами в растворителе, таком как тетрагидрофуран, толуол, метиленхлорид, или другом апротонном растворителе. Примеры богатых электронами бензальдегидов включают, не ограничиваясь, однако, ими, 2-, 3-, 4-метоксибензальдегид, 2,4-, 3,5-, 2,5-диметоксибензальдегид, 2,4,6-триметоксибензальдегид и 4-этоксибензальдегид. Предпочтительным бензальдегидом является 2,4-диметоксибензальдегид. Образование оксазолидина осуществляют, как правило, нагреванием при температуре кипения с обратным холодильником до дистилляции обоих растворителей и отгона воды или спирта. Эфир 5 гидролизуют до соли 6 путем обработки щелочью или гидроксидом четвертичного амина, или карбонатом щелочного металла, или другим основанием, известным в технике, в таком растворителе, как вода, метанол, этанол или ином протонном растворителе. Реакция может быть проведена при температуре от -78oC до 100oC. Продукт 6 стабилен и может быть выделен путем выпаривания растворителей и храниться далее в виде твердого вещества, или же реакция может быть направлена на превращение 6 в кислоту 7 за счет обработки кислотой. В общем случае, 7 получают путем обработки водного раствора 6 в делительной воронке достаточным количеством кислоты, такой как соляная, серная, бисульфатом калия и другими и распределением искомой кислоты в органическом растворителе, таком как этилацетат, метиленхлорид, эфир и другие, с последующим выпариванием растворителя. Полученная кислота 7 является достаточно чистой и стабильной для использования в следующей реакции, но, как правило, недостаточно стабильна для целей длительного хранения. Кислота 7 конденсируется с производным баккатина 8 с образованием эфира 9 в присутствии дегидратирующего агента. Наиболее предпочтительным для этой процедуры является карбодиимид, такой как дициклогексилкарбодиимид, диизопропилкарбодиимид, ди-п-толилкарбодиимид, солянокислая соль этилдиметиламинопропилкарбодиимида и им подобные, а также основной катализатор, предпочтительно 4-диметиламинопиридин. В общем случае, реакцию проводят в апротонном растворителе, таком как толуол, бензол, тетрагидрофуран, диоксан и им подобные, при температуре от 25oC до 100oC. Для образования 9 могут быть применены иные процедуры дегидратации, в частности, превращение 7 в его смешанный эфир с сульфоновой кислотой, реакция вместе с толуолсульфонилхлоридом или бензолсульфонилхлоридом или образование галида кислоты из сухого 6 в присутствии оксалихлорида в соответствии с тем, что известно в технике относительно карбоновых кислот, чувствительных к кислоте. Оксазолидины 9 могут быть подвергнуты депротекции таким образом, что группы, защищающие оксазолидин, и группы, блокирующие гидроксил баккатина в 7 положении, удаляются либо последовательно, либо вместе, в зависимости от нахождения защищающей группы в положении 7 и от условий реакции. Если R14 представляет собой кислую лабильную группу, подобную эфиру силила, то гидролиз оксазолидина может быть выполнен в мягких кислотных условиях и привести к депротекции 7 положения с образованием непосредственно 10MZ. Условия, необходимые для таких превращений, включают гидролиз в водной уксусной кислоте, водной спиртовой кислоте с концентрацией от 0,01 до 0,1 N при температуре от 0oC до 50oC или в спиртовой кислоте с концентрацией от 0,01 до 0,1 N при температуре от 0oC до 50oC. Альтернативно, протекция в 7 положении может быть удалена на второй стадии, если соединение не является кислотолабильным. Например, трихлорэтоксикарбонильная группа в положении 7 может быть удалена из 10MY (схема B) с помощью известного в технике способа восстановления с получением в итоге 10MZ. В зависимости от природы группы, защищающей азот (то есть R2 или R3) в 10MZ (схема B), защищающая группа может быть удалена с получением 11Z. Например, когда R2 представляет собой PhCH2OC(O)NH, она может быть удалена с помощью мягкого гидрогенолиза. Условия, необходимые для такого превращения, включают восстановление в атмосфере водорода с применением металлического катализатора, такого как палладий, в растворителе, которым может быть этанол или этилацетат, при комнатной температуре, под давлением от одной до трех атмосфер. В технике известны и другие методы проведения такого процесса. Полученные амин 11Z может быть снова превращен в амид или уретан 10MZ (схема B) с помощью процедуры ацилирования, как описано выше для превращения 2 в 3. Продукт 10MZ может быть защищен по 2'-гидроксильной группе с образованием 12MZ (схема B). Например, 2'-гидроксильная группа может быть ацилирована с помощью трихлорэтоксикарбонилхлорида в пиридине или других растворителях на основе ароматических аминов или в неосновном растворителе, таком как толуол, метиленхлорид или тетрагидрофуран, содержащем основание четвертичного амина. Реакция может быть проведена в диапазоне температур от -50oC до 100oC. В технике известны также другие методы проведения подобного ацилирования.
Реакция таксола аналогов таксола 10MZ (R15 представляет собой ацетат или другую подходящую ацильную группировку), баккатина III или аналогов 8 баккатина III (R6 представляет собой ацетат или другую подходящую ацильную группировку) с гидразином основана на весьма удобном методе, применяемом для получения 10-деацетил таксола, аналогов 10-деацил таксола (10MZ, R15 = H), 10-деацетил баккатина III и аналогов 10-деацетил баккатина III (8, R6 = H). В то время, как известный в литературе метод (Samaranayake. G., et al., J. Org. Chem., 1991, 56, 5114) удаления ацильной группы из данной позиции таксоловой и баккатиновой структур с помощью бромида цинка в метаноле дает множество других продуктов в дополнение к искомому NO2 - продукту деацилирования, описываемая реакция с гидразином дает практически только лишь нужный продукт деацилирования. Реакция может проводиться при комнатной температуре в органическом растворителе и требует для проведения, как правило, от минимум 15 минут до максимум 24 часов в зависимости от субстрата. Предпочтительным растворителем для реакции является 95% этанол, а предпочтительной формой реагента - 98% гидразин.
Препарат N1:
Приготовление метилового эфира (2R,3S) -β- фенил-изосерина (2)
Метиловый эфир (2R,3S)-3-азидо-2-гидрокси-3-фенилпропионовой кислоты (1, 0,5 г) гидрогенизруется в присутствии 10% палладия на угле (0,1 г) в этаноле при атмосферном давлении в течение 1 часа.
Затем реакционную смесь фильтруют и выпаривают с получением искомого амина. Т.пл. =- 106-108oC.
ЯМР (CDCl3, TMS): δ 2,1 (шс), 3,80 (с., 3H), 4,31 (м., 2H), 7,28 - 7,45 (м., 5H).
Препарат N2:
Получение метилового эфира (4S,5R)-N-Бензоил-2(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5Aa и 5Ab)
Метиловый эфир N-Бензоил -β- фенилизосерина (3A, 0,5 г, 1,67 мМ) растворяют в сухом ТГФ (10 мл) и бензоле (10 мл), затем раствор обрабатывают диметиловым ацеталем 2,4-диметоксибензальдегида (4, 0,420 г, 1,98 мМ) и п-толуолсульфонатом пиридиния (12 мг), после чего раствор нагревают и кипятят с обратным холодильником. Через 30 мин реакционную смесь охлаждают до комнатной температуры и оставляют стоять в течение ночи. Затем ее снова нагревают с целью медленной отгонки 1/2 растворителя в течение часа. ТСХ показывает, что реакция к этому моменту завершается. Реакционную смесь концентрируют в вакууме и хроматографируют остаток на 50 г силикагеля в смеси (5:95) метанол: толуол. Колонку элюируют смесью (5:95) метанол:толуол. Собирают фракции объемом 12 мл. Продукт элюируется в виде смеси. Далее, фракции, содержащие смесь 5Aa и 5Ab, вновь объединяют и выпаривают. Остаток (0,90 г) рехроматорафируют на силикагеле (100 г). Колонку элюируют смесью этилацетат:толуол (500 мл смеси 15:85 и 500 мл смеси 20:80). Фракции объемом 20 мл собирают и анализируют с помощью ТСХ. Фракции, содержащие каждый из 5Aa и 5Ab, объединяют и выпаривают под вакуумом.
Менее полярный изомер 5Aa
Смесь менее полярного и более полярного изомеров 5Aa и 5Ab
Более полярный изомер 5Ab
Изомер 5Ab кристаллизуют из EtOAc с получением белых кристаллов (142 мг, Тпл. = 138 - 141oC).
Данные для 5Aa:
ТСХ: силикагель: 20% EtOAc: 80% толуол, Rf: 0,50.
1H ЯМР (CDCl3, TMS): δ, 3,69 (с, 3H), 3,77 (с, 3H), 3,86 (с, 3H), 4,93 (д, 1H), 5,6 (шс, 1H), 6,28 - 6,37 (м, 2H), 6,90 (с, 1H), 7,03 (д, 1H), 7,15 - 7,55 (м, 9H).
Данные для 5Ab:
ТСХ: силикгаель: 20% EtOAc: 80% толуол, Rf: 0,41.
1H ЯМР (CDCl3, TMS): δ, 3,62 (шс, 3H), 3,75 (шс, 6H), 4,65 (д., 1H), 5,68 (шс, 1H), 6,2 - 6,5 (м, 2H), 6,8 - 7,55 (м., 11H).
УФ: EtOH, 229 (16,000), 277 (3,240), 281 sh (3,170).
Аналитические данные:
Рассчитано (%): C - 69,79, H - 5,63, N - 3,13.
Найдено (%): C - 69,61, H 5,61, N - 2,93
Препарат N 3:
Получение калиевой соли (4S,5R)-N-бензил-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты 6Ab
Метиловый эфир (4S,5R)-N-бензил-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (Препарат N 2, 5Ab, 355 мг, 0,96 мМ) растворяли в 9 мл метанола. К раствору добавляют воду (350 мкл) и карбонат калия (155 мг, 1,12 мМ). После перемешивания в течение 5 часов не остается никаких нерастворенных компонентов, а ТСХ показывает очень небольшое количество оставшегося метилового эфира. Растворитель концентрируют в вакууме и добавляют в масло воду (10 мл). Раствор высушивают при замораживании с получением 500 мг легкого мелкокристаллического порошка белого цвета, содержащего 374 мг калиевой соли.
ТСХ: силикагель 60, 1:2, EtOAc: гексан,Rf: начало
Препарат N 4:
Получение эфира 7-ТЭС-баккатин 111-13-(4S, 5R)-N-Бензоил- 2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9AbA)
Раствор калиевой соли (4S, 5R)-N-бензил-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (6Ab, препарат N 3, 91,4 мг, примерно 0,15 мМ) в этилацетате промывают 5% водным NaHSO4. Этилацетатный раствор высушивают и выпаривают с получением соответствующей кислоты 7Ab. Остаток растворяют в метиленхлориде (0,8 мл) и толуоле (1,75 мл) и объединяют с 7-триэтилсилил-баккатином 111 (68 мг). Смесь обрабатывают 4-диметиламинопиридином (6,3 мг) и 1,3-дициклогексилкарбодиимидом (34 мг). Реакционную смесь нагревают до 80oC в течение 90 минут, охлаждают, фильтруют и хроматографируют на силикагеле в смеси этилацетат: гексан. В результате был достигнут 86% выход объединенного продукта 9AbA.
ЯМР (CDCl3, TMS) : δ 0,58 (м, 6H), 0,90 (м.), 1,73 (с., 3H), 1,87 (м, 1H), 2,03 (м, 3H), 2,17 (шс, 3H), 2,20 (с, 3H), 2,23 (м, 2H), 2,50 (м., 1H), 3,76 (шс, 3H), 3,80 (с, 3H), 3,85 (д., 1H), 4,13 (д., 1H), 4,27 (д., 1H), 4,50 (м., 1H), 4,90 (м, 2H), 5,63 (шс, 1H), 5,68 (д, 1H), 6,25-6,48 (м, 3H), 6,50 (с, 1H), 6,86 (с, 1H), 7,09 (м, 1H), 7,15-7,65 (м., 13H), 8,05 (д, 2H),
Препарат N 5:
Приготовление таксола (соединение 10AA)
Эфир 7-ТЭС-баккатин 111-13-(4S, 5R)-N-Бензоил-2-(2,4-диметилоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты 9AbA) подвергают депротекции при перемешивании в 0,1 М HCl в метаноле в течение 10 минут. После разбавления этилацетатом раствор промывают 5% NaCHO, высушивают и выпаривают. Продукт чистят хроматографированием на колонке с силикагелем в смеси ацетон: гексан. Для натурального таксола данные ЯМР по протону и углероду идентичны.
Препарат N 6:
Получение метилового эфира (4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5Ba и 5Bb)
Метиленовый эфир N-БОК -β- фенилизосерина (3B) (0,5 г, 1,69 мМ) растворяют в сухом ТГФ (10 мл) и толуоле (10 мл) и концентрируют досуха с удалением любой воды, в том числе кристаллизационной. Затем остаток растворяют в сухом ТГФ (10 мл) и полученный раствор обрабатывают диметилацеталем 2,4-диметоксибензальдегида (4) (0,425 г, 2,0 мМ) и п-толуолсульфонатом пиридиния (12 мг), после чего раствор нагревают и кипятят с обратным холодильником. Через 30 минут реакционную смесь охлаждают до комнатной температуры и оставляют стоять на ночь. Затем ее снова нагревают и кипятят с обратным холодильником в течение 3 часов. Ход реакции отслеживается с помощью ТСХ, при этом найдено, что реакция оказывается незавершенной. Далее, реакционную смесь нагревают до 85oC с целью отгонки примерно 2/3 ТГФ. Затем добавляют свежий ТГФ (10 мл) и ацеталь (200 мг) и кипятят реакционную смесь с обратным холодильником еще 2 часа. Результаты ТСХ показывают, что к этому моменту реакция завершается. Затем реакционную смесь концентрируют в вакууме и хроматографируют остаток на 100 г силикагеля в смеси ацетон:гексан (15:85). Элюцию колонки проводят смесью ацетон:гексан (500 мг 15:85 и 500 мл 20:80). Собирают фракции объемом 20 мл.
Изомеры искомого продукта выходят в виде смеси. Фракции, содержащие смесь 5Ba и 5Bb, объединяют и концентрируют в вакууме с получением белого пенистого вещества. Затем пенистое вещество повторно хроматографируют через 100 г силикагеля и элюируют смесью (10:90) EtOAс:толуол. Собирают фракции объемом 20 мл и анализируют с помощью ТСХ. Таким образом было выделено 34 мг менее полярного изомера 5Вa, 187 мг смеси менее полярного и более полярного изомеров 5Ba и 5Bb и 500 мг более полярного изомера 5Bb.
Изомер 5Bb кристаллизуют из EtOAс:гексана с получением белых кристаллов (378 мг).
Смесь изомеров также кристаллизуют из EtOAс:гексана с получением кристаллического 5Bb (113 мг) со степенью чистоты, подтвержденной ТСХ, такой же, как в маточных растворах, из которых был кристаллизован изомер 5Bb. Эти кристаллы и маточные растворы объединяют и подвергают повторной кристаллизации из EtOAс:гексана с получением более чистого 5Bb (160 мг).
Данные для 5Ba:
ТСХ: силикагель 60, 10% EtOAc: 90% толуол, Rf : 0,44.
1H ЯМР (CDCl3, TMS): δ 1,26 (с., 9H), 3,80 (с., 3H), 3,84 (с., 3H), 3,85 (с, 3H), 4,86 (д., 1H), 5,24 (с, 1H), 6,40 (дд., 1H), 6,47 (д., 1H), 6,72 (с.,1Н), 7,12 (д., 1H), 7,30-7,43 ( м., 3H), 7,53 (д., 2H).
Данные для 5Bb:
ТСХ: силикагель 60: 10% EtOAc: 90% толуол, Rf : 0,38.
1H ЯМР (CDCl3, TMS) : δ 1,10 (с., 9H), 3,52 (шд., 3H), 3,81 (с., 3H), 3,87 (с., 3H), 4,54 (д., 1H), 5,43 (шс., 1H), 6,48 (с., 2H), 6,81 (шс, 1H), 7,13 (шс., 1H), 7,30-7,48 (м., 5H).
УФ: EtOH, 233 (10,600), 260 sh (1010), 277 (2840), 281 sh (2680).
Аналитические данные:
Рассчитано (%): C-65,00, H-6,59, N-3,16.
Найдено (%): C-64,86, H-6,42, N-3,24.
Препарат N 7
Получение калиевой соли (4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты 7Ba
100 мг (0,23 мМ) метилового эфира (4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (препарат N 6, 5Ba) перемешивают при комнатной температуре в атмосфере азота в 3 мл MeOH. Добавляют 0,1 мл воды и 43 мг (0,31 мМ) карбоната калия. Через 1 час данные ТСХ показывают отсутствие исходного материала. Смесь хранят в морозильной камере в течение ночи. На следующее утро растворитель выпаривают с получением калиевой соли (4S, 5R)-N-БОК-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (68a). Остаток распределяют между метиленхлоридом и водой, содержащей 0,9 мл 1N HCl. Фазы разделяют и водный слой подвергают повторной экстракции метиленхлоридом. Органические фазы объединяют, высушивают над сульфатом натрия и выпаривают. Это дает (4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновую кислоту (7Ba) в виде белого твердого вещества.
ТСХ (силикагель 60): 20% EtOAc: 80% толуол: 2% HOAc, Rf : 0,07.
1H ЯМР (CDCl3, TMS) : δ 1,26 (с., 9H), 3,76 (с., 6H), 4,77 (с., 1H), 5,34 (с. , 1H), 6,33-6,45 (д. , 2H), 6,60 (с., 1H), 7,07-7,16 (д., 1H), 7,24-7,40 (м., 3H), 7,42-7,54 (д., 2H).
Препарат N 8:
Получение эфира 7-ТЭС-баккетин 111-13-(4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9BaA)
0,23 мМ (4S, 5R)-N-бОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (препарат 7, 7Ba) растворяют в смеси 1,5 мл метиленхлорида и 3 мл толуола. К полученной смеси добавляют 106 мг (0,15 мМ) 7-ТЭС-баккатина 111 (8A), 11 мг (0,09 мМ) ДМАП и 49 мг (0,24 мМ) ДЦК. Реакционную смесь перемешивают в атмосфере азота и нагревают до 75oC в течение 90 минут, после чего охлаждают до комнатной температуры. Полученный побочный продукт в виде мочевины удаляют фильтрацией, а фильтрат выпаривают в вакууме. Остаток хроматографируют на 20 г силикагеля, элюируя смесью 30:70 EtOAc : гексан. Собирают фракции объемом 5 мл и анализируют их с помощью ТСХ. Фракции 17-34, содержащие искомый продукт, объединяют и выпаривают. Эфир 7-ТЭС-баккатин III-13-(4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9BaA) получают в виде белого твердого вещества.
ТСХ: силикагель 60: 30% EtOAc: 70% гексан, Rf:0,56.
Масс-спектр (FAB, m/z) 1112, 1012, 874, 328, 284, 115, 105, 87.
1H ЯМР (CDCl3, TMS) : δ 0,52-0,66 (м., 6H), 0,85-1,00 (м., 9H), 1,80-1,93 (м. , 1H), 2,15 (с., 3H), 2,20 (c., 3H), 2,21-2,30 (м., 1H), 2,40-2,54 (м. , 1H), 3,82 (c., 3H), 3,87 (с., 3H), 3,81 (д., 1H), 4,10 (д., 1H), 4,26 (д. , 1H), 4,49 (м., 1H), 4,83-4,93 (м., 2H), 5,31 (д., 1H), 5,67 (д., 1H), 6,29 (т. , 1H), 6,38-6,53 (м., 3H), 6,69 (с., 1H), 7,13 (д., 1H), 7,29-7,65 (м., 8H), 8,05 (д., 2H).
Препарат N 9:
Получение 13-(N-БОК -β- фенилизосеринил)-баккатина III (10BA)
0,1 М раствор HCl готовят на смеси 0,071 мл ацетилхлорида и 9,929 мл MeOH и выдерживают перед использованием 30 минут.
К 57 мг (0,051 мМ) эфира 7-ТЭС-баккатин-III-13-(4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидин карбоновой кислоты (Препарат N 8, 9BaA) добавляют 0,5 мл вышеупомянутого метанольного HCl при перемешивании в атмосфере азота. Как показывают результаты ТСХ, реакция заканчивается через 75 минут. Реакционную смесь распределяют в смеси этилацетат: 5% бикарбонат натрия. Слои разделяют и водный слой подвергают повторной экстракции этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают в вакууме.
Полученный грубый продукт подвергают хроматографированию на 10 г силигагеля, используя для элюирования смесь 50:50 этилацетата:толуола. Собирают фракции объемом 2 мл и анализируют их с помощью ТСХ. Чистый продукт обнаруживают во фракциях 19-42, которые объединяют и выпаривают. 13-(N-БОК -β- фенилизосеринил)баккатин III (10BA) получают в виде белого твердого вещества.
ТСХ: силикагель 60, 50:50, EtOAc : толуол, Rf : 0,38.
Масс-спектр (FAB) : (M+H) измерен при 850, 3680, теоретический расчет для C45H56N1O15 составляет 850, 3650: m/z 794, 569, 509, 105, 57.
1H ЯМР (CDCl3, TMS) : δ 1,14 (с., 3H), 1,27 (с., 3H), 1,33 (с., 9H), 1,67 (с. , 3H), 1,84 (с., 3H), 2,24 (с., 3H), 2,38 (с., 3H), 3,44 (д., 1H), 3,81 (д., 1H), 4,17 (д., 1H), 4,30 (д., 1H), 4,41 (м., 1H), 4,63 (шс., 1H), 4,95 (д., 1H), 5,26 (шд., 1H), 5,43 (шд., 1H), 5,67 (д., 1H), 6,23 (т., 1H), 6,28 (с. , 1H), 7,27-7,45 (м., 5H), 7,50 (т., 2H), 7,62 (т., 1H), 8,11 (д., 2H)
Препарат N 10:
Получение калиевой соли (4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (6Bb)
Раствор метилового эфира (4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (препарат N 6, 5Bb, 374 мг, 0,84 мМ) в MeOH (11 мл) перемешивают при комнатной температуре в атмосфере азота и добавляют воду (0,37 мл) и карбонат калия (161 мг, 1,17 мМ). Через 2 часа ТСХ показывает, что реакция прошла примерно на 70%. После перемешивания в течение ночи реакция, как было показано завершается. Растворитель выпаривают, а полученный остаток растворяют в 10 мл воды и высушивают при замораживании. В результате этого процесса получают 507 мг легкого мелкокристаллического твердого вещества белого цвета, которое содержит калиевую соль (4S,5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (6Bb, 393 мг).
ТСХ: силикагель, 20% EtOAc: 80% гексана, Rf: старт.
Препарат N 11:
Получение эфира 7-ТЭС-баккатин III-13-(4S,5R)-N-БОК-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9BbA)
0,12 мМ неочищенного препарата калиевой соли (4S,5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (препарат N 10, 6Bb) распределяют между этилацетатом: 5% бисульфатом натрия. Слои разделяют, и водный слой подвергают повторной экстракции этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом.
Полученную кислоту 7Bb растворяют в смеси 0,8 мл метиленхлорида: 1,5 мл толуола совместно с 53 мг (0,076 мМ) 7-ТЭС-баккатина III (8A, см. Denis, J. -N. , Greene, A.E.; Guenard, D., Gueritte-Vogeline F., Mangatal, L.; Potier, P. J. Am. Chem. Soc. 1988, N 110, 59167), 6 мг (0,049 мМ) 4-диметиламинопиридина (ДМАП) и 25 мг (0,12 мМ) дициклогексилкарбодиимида (ДЦК). Реакционную смесь перемешивают в атмосфере азота и нагревают до 75oC в течение 90 минут. Затем реакционную смесь охлаждают до комнатной температуры и отфильтровывают побочный продукт мочевину. Полученный фильтрат выпаривают в вакууме.
Остаток хроматографируют на 15 г силикагеля, элюируя смесью 30:70 EtOAc: гексан. Фракции объемом 7 мл отбирают и анализируют с помощью ТСХ. Фракции 16-38, содержащие искомый продукт, объединяют и выпаривают. Эфир 7-ТЭС-баккатин III-13-(4S, 5R)-N-БОК-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9BbA) получают в виде белого твердого вещества.
ТСХ: силикагель 60, 30% EtOAc : 70% гексан, Rf: 0,33.
Масс-спектр (FAB, m/z): 1112, 1012, 384, 328, 284, 115, 105, 87, 57.
1H ЯМР (CDCl3, TMS): δ 0,50-0,61 (м, 6H), 0,84-0,97 (м., 9H), 1,08 (с., 9H), 2,21 (с., 3H), 3,67 (д., 1H), 3,80 (с., 3H), 3,90 (с., 3H), 4,07 (д., 1H), 4,23 (д., 1H), 4,40 (м., 1H), 4,53 (шд., 1H), 4,87 (д., 1H), 5,44 (шд., 1H), 5,60 (д., 1H), 6,34 (с., 1H), 6,44 (шс., 1H), 6,48 (с., 1H), 7,20 (шс., 1H), 7,30-7,50 (м., 7H), 7,60 (т., 1H), 8,01 (д., 2H).
Препарат N 12:
Получение 13-(N-БОК -β- фенилизосеринил)-баккатина III (10BA)
0,1 М раствор HCl готовят на смеси 0,071 мл ацетилхлорида и 9,929 мл MeOH и выдерживают перед использованием 30 минут.
К 45 мг (0,040 мМ) эфира 7-ТЭС-баккатин III-13-(4S,5R)-N-БОК-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (препарат N 11, 9BbA) добавляют 0,395 мл вышеупомянутого метанольного раствора HCl при перемешивании в атмосфере азота. Как показывают результаты ТСХ, реакция заканчивается через 20 минут.
Через 30 минут реакционную смесь распределяют между фазами этилацетата: 5% бикарбоната натрия. Слои разделяют и водный слой подвергают повторной экстракции этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают в вакууме.
Грубый продукт хроматографируют на 5 г силикагеля, используя для элюции смесь 50:50 этилацетат:толуол. Собирают фракции объемом 5 мл и анализируют с помощью ТСХ. Чистый продукт обнаруживают во фракциях 5-12, которые объединяют и выпаривают. 13-(N-БОК -β- фенилизосеринил)-баккатин III (10BA) получают в виде твердого белого вещества.
ТСХ: силикагель 60, 50:50, EtOAc:толуол, Rf: 0,42.
1H ЯМР (CDCl3, TMS): δ 1,15 (с., 3H), 1,27 (с., 3H), 1,33 ((с., 9H), 1,68 (с. , 3H), 1,85 (с., 3H), 2,25 (с., 3H), 2,38 (с., 3H), 3,44 (д., 1H), 3,80 (д., 1H), 4,17 (д., 1H), 4,30 (д., 1H), 4,41 (м., 1H), 4,62 (шс., 1H), 4,95 (д., 1H), 5,26 (шд., 1H), 5,43 (шд., 1H), 5,67 (д., 1H), 6,23 (т., 1H), 6,29 (с. , 1H), 7,13-7,45 (м., 5H), 7,49 (т., 2H), 7,62 (т., 1H), 8,11 (д., 2H).
Препарат N 13:
Получение эфира 7-(2,2,2-трихлорэтоксикарбонил)-баккатин-III- 13-(4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9BaB, 9BbB)
0,39 мМ калиевой соли (4S,5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил- 5-оксазолидинкарбоновой кислоты (6Ba, 6Bb) распределяют между фазами этилацетат: 5% бисульфат натрия. Фазы разделяют и водную фазу повторно экстрагируют этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом.
Остаток кислоты 7Ba, 7Bb растворяют при перемешивании в атмосфере азота в смеси 2 мл метиленхлорида: 6 мл толуола. К полученному раствору добавляют 187 мг (0,245 мМ) 7-(2,2,2-трихлорэтоксикарбонил)-баккатина III (8B, см., например, Mangatal, L.; Adeline, M.-T.; Guenard, D., Gueritte-Vogelein, F.; Potier, P. Tetrahedron 1989, 45, 4177), после чего прибавляют 22 мг (0,18 мМ) ДМАП и 80 мг (0,39 мМ) ДЦК. Вскоре после добавления всех этих компонентов в раствор начинается выпадение в осадок побочного продукта в виде мочевины. Реакционную смесь нагревают до 80oC в течение 70 минут, отслеживая реакцию с помощью ТСХ. После охлаждения до комнатной температуры нерастворимую фракцию отделяют фильтрованием, а фильтрат выпаривают в вакууме. Грубый продукт подвергают хроматографированию в 50 г силикагеля, используя для элюирования последовательно 400 мл 30:70, 200 мл 40:60, 100 мл 70:30 смеси этилацетат: гексан. Фракции объемом 15 мл собирают и анализируют с помощью ТСХ. Перечисленные ниже фракции объединяют и выпаривают под вакуумом с получением белого твердого вещества.
Фракции 14-20, менее полярный изомер 9BaB
Фракции 21-26, смесь изомеров 9BaB, 9BbB
Фракции 27-32, более полярный изомер 9BbB
Фракции 37-44, выход исходного спирта 8B
Данные для изомера 9BaB:
ТСХ: силикагель 60, 40:60, этилацетат:гексан, Rf: 0,67.
1H ЯМР (CDCl3, TMS): δ 1,26 (с.), 1,82 (с., 3H), 2,12 (с., 3H), 2,19 (с. , 3H), 2,58 (м., 1H), 3,81 (с., 3H), 3,91 (с., 3H), 3,97 (д., 1H), 4,13 (д., 1H), 4,28 (д., 1H), 4,66 (д., 1H), 4,92 (м., 2H), 5,03 (д., 1H), 5,36 (д., 1H), 5,83 (м., 1H), 5,67 (д., 1H), 6,32 (м., 1H), 6,40 (с., 1H), 6,51 (д., 1H), 6,69 (с., 1H), 7,16 (д., 1H), 7,37-7,62 (м., 8H), 8,02 (д., 2H).
Данные для изомера 9BbB:
ТСХ: силикагель 60, 40:60, этилацетат:гексан, Rf: 0,55.
1H ЯМР (CDCl3, TMS): δ 2,17 (шс.), 3,47 (м.), 3,79-3,94 (м.,), 4,08 (д. ), 4,27 (д), 4,54 (м.), 4,65 (м.), 4,89 (д.), 5,01 (м.), 5,40 (м.), 5,50 (м. ), 5,62 (д.), 6,24 (шс.), 6,49 (шс.), 7,37-7,65 (м.), 8,03 (д).
Препарат N 14:
Получение 7-(2,2,2-трихлорэтоксикарбонил)-13-(N-БОК -β- фенилизосеринил)-баккатина III 10BB
0,1 М раствор HCl в MeOH готовят на смеси 0,071 мл ацетилхлорида и 9,929 мл MeOH и выдерживают перед использованием 30 минут.
252 мг (0,216 мМ) эфира 7-(2,2,2-трихлорэтоксикарбонил)-баккатин III-13-(4S, 5R)-N-БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (препарат N 13, 9BaB, 9BbB) перемешивают при комнатной температуре в атмосфере азота с 2,2 мл вышеуказанного 0,1 М раствора HCl в MeOH. Ход реакции отслеживают с помощью ТСХ и, поскольку через 20 минут она не завершается, добавляют еще 0,5 мл раствора HCl и продолжают проведение реакции в течение 15 минут.
Затем реакционную смесь разбавляют этилацетатом и промывают 5% бикарбонатом натрия. Слои разделяют и водную фракцию повторно экстрагируют этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом. Грубый продукт хроматографируют на 30 г силикагеля, используя для элюирования последовательно 200 мл 35:65 и 300 мл 40:60 смеси этилацетат:гексан. Фракции объемом 5 мл собирают и анализируют с помощью ТСХ. Фракции 25-54, содержащие чистый продукт, объединяют и высушивают под вакуумом с получением 7-(2,2,2-трихлорэтоксикарбонил)- 13-N-БОК -β- фенилизосеринил-баккатина III 10BB в виде твердого вещества.
ТСХ: силикагель 60, 40:60, этилацетат:гексан, Rf: 0,36.
Масс-спектр (FAB, m/z) (M+H) при 1024, 1026, 1028, (M+H) измеренный при 1024, 2656, расчет для C48H57Cl3N1O17 составляет 1024, 2692, 1024, 968, 924, 743, 683, 105, 57.
1H ЯМР (CDCl3, TMS): δ 1,17 (с., 3H), 1,24 (с., 3H), 1,34 (с., 3H), 1,34 (с. , 9H), 1,83 (с., 3H), 1,91 (с., 3H), 2,17 (с., 3H), 2,39 (с., 3H), 2,62 (м., 1H), 3,60 (д., 1H), 3,94 (д., 1H), 4,16 (д., 1H), 4,30 (д., 1H), 4,63 и 5,04 (2д., 2H), 4,62 (шс., 1H), 4,95 (д., 1H), 5,26 (шд., 1H), 5,45-5,60 (м. , 2H), 5,66 (д., 1H), 6,20 (т., 1H), 6,36 (с., 1H), 7,24-7,44 (м., 5H), 7,49 (т., 2H), 7,61 (т., 1H), 8,08 (д., 2H).
Препарат N 15:
Получение 13-(N-БОК -β- фенилизосеринил)-баккатина III (10BA) и 7-(2,2-дихлорэтоксикарбонил)-13-(N-БОК -β- фенилизосеринил)-баккатина III 10BG.
150 мг (0,146 мМ) 7-(2,2,2-трихлорэтоксикарбонил)-13-(N-БОК -β- фенилизосеринил)-баккатина III (препарат N 14, 10BB) перемешивают при комнатной температуре в атмосфере азота в смеси 13,5 мл MeOH и 1,5 мл OHAc. К полученной смеси прибавляют 150 мг активированного цинка и нагревают ее до 50oC в течение 60 минут. Ход реакции отслеживают с помощью ТСХ, по результатам которой добавляют цинк еще 4 раза порциями по 150 мг, нагревая реакционную смесь после каждого добавления в течение 45 минут. Затем реакционную смесь фильтруют и фильтрат выпаривают под вакуумом. Полученный остаток распределяют между фракциями метиленхлорид: вода. Фракции разделяют и водный слой повторно экстрагируют метиленхлоридом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают.
Грубый продукт хроматографируют на 20 г силикагеля, элюируя последовательно 200 мл 70:30 и 200 мл 70:30 смеси этилацетат : гексан. Фракции объемом 5 мл собирают и анализируют с помощью ТСХ. Перечисленные ниже фракции объединяют и выпаривают под вакуумом с получением белых твердых веществ.
Фракции 9 - 13, 7-(2,2-дихлорэтоксикарбонил)-13-(N-БОК) -β- фенилизосеринил)-баккатин III 10BG.
Фракции 14 - 44, 13-(N-БОК -β- фенилизосеринил)-баккатин II (10BA)
Данные для 7-(2,2-дихлорэтоксикарбонил)-13-(N-БОК -β- фенилизосеринил)-баккатина III 10BG:
ТСХ: силикагель 60, 50:50, этилацетат : гексан, Rf: 0,81 (в этой системе ТСХ данный продукт и исходный материал идут вместе).
1H ЯМР (CDCl3, TMS): δ 1,17 (с, 3H), 1,24 (с., 3 H), 1,35 (с., 9H), 1,61 (с., 3H), 1,81 (с., 3H), 2,19 (с., 3H), 2,39 (с., 3H), 2,52 - 2,68 (м., 1H), 3,37 (д. , 1H), 3,92 (д., 1H), 4,16 (д., 1H), 4,32 (д., 1H), 4,53 (м., 2H), 4,63 (шс. , 1H), 4,95 (д., 1H),) 5,26 (шд., 1H), 5,40 (щд., 1H), 5,48 (м., 1H), 5,67 (д., 1H), 5,96 (м., 1H), 6,20 (т., 1H), 6,45 (с., 1H), 7,28 - 7,44 (м., 5H), 7,50 (т., 2H), 7,62 (т., 1H), 8,10 (д., 2H).
Данные для 10BA:
ТСХ: силикагель 60, 50:50, этилацетат : гексан, Rf: 0,32
1H ЯМР (CDCl3, TMS): δ 1,14 (с., 3H), 1,24 (с, 3H), 1,32 (с., 9H), 1,67 (с., 3H), 1,84 (с., 3H), 2,23 (с., 3H), 2,37 (с., 3H), 2,44 - 2,59 (м., 1H), 2,64 (шд., 1H), 3,70 (шс., 1H), 3,78 (д., 1H), 4,15 (д., 1H), 4,28 (д., 1H), 4,40 (м. , 1H), 4,61 (шс., 1H), 4,94 (д., 1H), 5,25 (шд., 1H), 5,57 (шд., 1H), 5,65 (д, 1H), 6,22 (т., 1H), 6,29 (с., 1H), 7,24 - 7,44 (м., 5H), 7,48 (т., 2H), 7,60 (т., 1H), 8,08 (д., 2H).
Препарат N 16:
Получение эфира 7,10-бис-Трок-баккатин III-13-(4S,5R)-N- БОК-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9ВbC)
Грубый препарат калиевой соли (4S,5R)-N-БОК-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (препарат N 10 6Вb) (0,089 мМ) распределяют между фазами смеси этилацетат: 5% NaHSO4. Слои разделяют и водную фракцию повторно экстрагируют этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом с получением (4S,5R)-N-БОК-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (7Вb). Остаток перемешивают при комнатной температуре в атмосфере азота в смеси, содержащей метиленхлорид (0,8 мл) и толуол (1,5 мл). К этой смеси добавляют 7,10-бис-Трок-10-деацетилбаккатина III (8C, см., например, Senilh, V., Gueritte-Vogelein, F., Guenard, D., Colin, M., Potier, P.C.R. Acad. Sci. Paris 1984, 229, 4177), 50 мг, 0,056 мМ. Полученный раствор обрабатывают 4-диметиламинопиридином (5 мг, 0,04 мМ) и 1,3-дициклогексилкарбодиимидом (18 мг, 0,087 мМ), после чего нагревают смесь до 75oC (25 минут). После 15 минут нагревания результаты анализа, проведенного с помощью ТСХ, показывают завершение реакции.
Осажденную дициклогексилмочевину отфильтровывают. Фильтрат наносят на силикагель (1 г) и хроматографируют на силикагеле 10 г), который элюируют смесью этилацетат : гексан (30:70). Фракции объемом 4 мл собирают и анализируют с помощью ТСХ, фракции 16 - 42, содержащие продукт, объединяют и выпаривают под вакуумом. Это дает эфир 7,10-бис-Трок-баккатин III-13-(4S,5R)-N-БОК-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (8BbC) в виде белого твердого вещества.
ТСХ (силикагель 60): 40% EtOAc: 60% гексан, Rf: 0,56.
Масс-спектр (FAB, m/z): 1304, 1306, 1308, (M+H), 1024, 875, 683, 384, 328, 284, 105 (основание), 57.
1H ЯМР (CDCl3, TMS): δ 1,07 (с., 3H), 1,14 (с., 3H), 1,22 (с., 3H), 1,79 (с. , 3H), 2,56 (м., 1H), 3,79 (д., 1H), 3,81 (с., 3H), 3,89 (с., 3H), 4,08 (д., 1H), 4,25 (д., 1H), 4,54 (д., 1H), 4,59 и 4,88 (2д, 2H), 4,78 (с., 2H), 4,89 (шт., 1H), 5,43 (м., 1H), 5,50 (м., 1H), 5,62 (д., 1H), 6,05 (шс., 1H), 6,12 (с. , 1H), 6,47 (д., 1H), 6,49 (с, 1H), 6,75 (шс., 1H), 7,21 (м, 1H), 7,35 - 7,53 (м., 7H), 7,62 (т., 1H), 8,01 (д., 2H).
Препарат N 17:
Получение 7,10-бис-Трок-13-(N-БОК -β- фенилизосеринил)-баккатина III (10BC)
Ацетилхлорид (0,071 мл, 80 мг, 0,056 мМ) прибавляют к метанолу (10 мл) и раствор оставляют стоять 30 минут, получая в итоге 0,1 N раствор HCl. Эфир 7,10-бис-Трок-Баккатин III-13-(4S, 5R)-N-БОК-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (препарат N 16, 9BbC) (73 мг, 0,056 мМ) растворяют в вышеупомянутом метанольном растворе HCl (0,553 мл) и оставляют стоять на 25 минут. После этого реакционную смесь разбавляют EtOAc и промывают 5% бикарбонатом натрия. Слои разделяют и водную фракцию повторно экстрагируют EtOAc. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом. Грубый продукт наносят на силикагель (1 г) и хроматографируют на силикагеле (10 г). Элюцию с колонки осуществляют смесью 20% EtOAc: 80% толуол. Фракции объемом 4 мл собирают и анализируют с помощью ТСХ. Чистый продукт обнаруживается во фракциях 10 - 20, которые объединяют и выпаривают. Недостаточно чистый продукт во фракциях 7 - 9 повторно хроматографируют, как описано выше. Фракции 11 - 26, содержащие чистый продукт, объединяют с продуктом, полученным с первой колонки. В результате получают 7,10-бис-Трок-13-(N-БОК- -β- фенилизосеринил)-баккатин III (10BC) в виде белого твердого вещества.
ТСХ (силикагель 60): 30% EtOAc: 70% толуол, Rf : 0,59, побочный продукт 2,4-диметоксибензальдегид идет на хроматограмме впереди искомого продукта и справа от стартового материала.
Масс-спектр (FAB, m/z) 1156, 1158, 1160 (M+H), 1100, 1056, 701, 685, 105 (основание), 57.
1H ЯМР (CDCl3, TMS): δ 1,20 (с., 3H), 1,27 (с., 3H), 1,35 (с., 9H), 1,85 (с. , 3H), 1,95 (с., 3H), 2,35 (с., 3H), 3,41 (д, 1H), 3,90 (д., 1H), 4,17 (д. , 1H), 4,33 (д., 1H), 4,60 и 4,93 (2д., 2H), 4,62 (шс., 1H), 4,78 (с., 2H), 4,95 (д., 1H), 5,26 (шд., 1H), 5,42 (шд., 1H), 5,54 (дд., 1H), 5,69 (д. , 1H), 6,21 (т., 1H), 6,24 (с., 1H), 7,12 - 7,42 (м., 6H), 7,49 (т., 2H), 7,62 (т., 1H), 8,09 (д., 2H).
Препарат N 18:
Получение 7-(2,2-дихлорэтоксикарбонил)-13-(N-БОК -β- фенилизосеринил)-баккатина III (10BD),
10-(2,2-дихлорэтоксикарбонил)- 13-(N-БОК -β- фенилизосеринил)-баккатина III (10BE) и
13-(N-БОК -β- фенилизосеринил)-баккатина III (10BF, Таксотер)
7,10-бис-Трок-13-(N-БОК -β- фенилизосеринил)-баккатин III (препарат N 17: 10BC) (48 мг, 0,041 мМ) перемешивают при комнатной температуре в атмосфере азота в смеси 90% MeOH: 10% HOAc (3 мл) и обрабатывают полученный раствор активированным цинком (85 мг). Через 30 минут наблюдается помутнение реакционной смеси. Добавляют еще 1 мл смеси MeOH : HOAc, после чего реакционная смесь становится прозрачной. Результаты ТСХ через 30 и 60 минут выглядят примерно одинаковыми, а именно: не отмечается исходного материала, а имеются два минорных продукта и один более полярный продукт в достаточно большом количестве. Через 70 минут после начала реакции отфильтровывают твердый цинк. Фильтрат выпаривают под вакуумом. Остаток распределяют между фазами метиленхлорида и воды. Слои разделяют и водный слой повторно экстрагируют метиленхлоридом. Органические экстракты снова промывают водой, высушивают над сульфатом натрия, объединяют и выпаривают под вакуумом. Смесь грубого продукта наносят на силикагель (1 г) и хроматографируют на силикагеле 5 г. Колонку элюируют смесью EtOAc: гексан (по 100 мл 40:60, 50:50, 60:40 и 70:30). Фракции объемом 4 мл собирают и анализируют с помощью ТСХ. Перечисленные ниже фракции объединяют и выпаривают под вакуумом.
Фракции 12 - 24, 10BD
Фракции 29 - 42 - 10BE
Фракции 48 - 84, 10BF
Данные для 10BD:
ТСХ (силикагель 60): 60% EtOAc: 40% гексан, Rf : 0,92.
Масс-спектр (FAB, m/z) 948, 950, 952 (M + H), 892, 848, 830, 667, 649, 105 (основание), 57
1H ЯМР (CDCl3, TMS): δ 1,09 (с., 3H), 1,23 (с, 3H), 1,34 (с., 9H), 1,86 (с, 3H), 1,89 (с., 3H), 2,04 (м., 1H), 2,29 (д, 2H), 2,39 (с., 3H), 3,4 (шс. , 1H), 3,99 (д., 1H), 4,05 (с., 1H), 4,20 (д., 1H), 4,33 (д., 1H), 4,48 (м., 2H), 4,62 и 4,93 (2д., 2H), 5,30 (м., 1H), 5,37 (с., 1H), 5,46 (д., 1H), 5,68 (д., 1H), 5,83 (т., 1H), 6,21 (т., 1H), 7,3 - 7,45 (м., 6H), 7,50 (т., 2H), 7,62 (т., 1H), 8,10 (д., 2H).
Данные для 10BE:
ТСХ (силикагель 60): 60% EtOAc: 40% гексан, Rf : 0,65.
Масс-спектр (FAB, m/z) 948, 950, 952 (M+H), 892, 848, 667, 527, 509, 105 (основание), 57.
1H ЯМР (CDCl3, TMS): δ 1,16 (с., 3H), 1,27 (с., 3H), 1,33 (с., 9H), 1,70 (с. , 3H), 1,89 (с., 3H), 2,39 (с., 3H), 2,57 (м., 1H), 3,40 (д., 1H), 3,75 (д. , 1H), 4,17 (д., 1H), 4,33 (д., 1H), 4,35 (м., 1H), 4,56 (дд., 2H), 4,64 (м. , 1H), 4,95 (д., 1H), 5,28 (м., 1H), 5,37 (д., 1H), 5,68 (д., 1H), 5,92 (д., 1H), 6,16 (с., 1H), 6,25 (т., 1H), 7,20 - 7,45 (м., 6H), 7,50 (т., 2H), 7,64 (т., 1H), 8,10 (д., 2H).
Данные для 10BF:
ТСХ (силикагель 60): 60% EtOAc: 40% гексан, Rf : 0,23.
Масс-спектр (FAB, m/z) 808 (M+H), 790, 752, 708, 527, 509, 105 (основание), 57.
1H ЯМР (CDCl3, TMS): δ 1,12 (с., 3H), 1,23 (с., 3H), 1,33 (с., 9H), 1,74 (с. , 3H), 1,84 (с., 3H), 2,37 (с., 3H), 2,56 (м., 1H), 3,60 (шс., 1H), 3,89 (д. , 1H), 4,18 (д., 1H), 4,21 (м., 1H), 4,30 (д., 1H), 4,32 (с., 1H), 4,62 (шс., 1H), 4,94 (д., 1H), 5,23 (с., 1H), 5,28 (шс., 1H), 5,54 (д., 1H), 5,66 (д., 1H), 6,20 (т., 1H), 7,25 - 7,45 (м., 6H), 7,50 (т., 2H), 7,61 (т., 1H), 8,09 (д., 2H).
Препарат N 19:
Получение метилового эфира (2R,3S)-N-карбобензилокси -β- фенилизосерина (3C)
Раствор метилового эфира (2R,3S) -β- фенилизосерина (2) (препарат N 1, 2 мМ), в пиридине, содержащем небольшое количество ДМАП, охлаждают в ледяной бане и обрабатывают бензиловым эфиром хлормуравьиной кислоты (0,8 мл). После перемешивания в течение ночи при комнатной температуре реакционную смесь разбавляют этилацетатом, промывают 5% раствором бисульфата натрия, высушивают и выпаривают. Чистый продукт получают после применения хроматографии на силикагеле с элюцией смесями этилацетат : гексан.
Т. пл. = 120 - 121oC.
ЯМР (CDCl3, TMS): δ/ 3,26 (м., 1H), 3,79 (с., 3H), 4,47 (м., 1H), 5,06 (м., 2H), 5,27 (д., 1H), 5,75 (м., 1H), 7,20 - 7,50 (м., 10H).
Препарат N 20:
Получение метилового эфира (4S,5R)-N- Карбобензилокси-2-(2,4-диметилфенил)-4-фенил-5-оксазолидинкарбоновой кислоты 5Cb
Метиловый эфир N-Карбобензилокси -β- фенилизосерина (препарат N 19, 3C, 0,375 г, 1,14 мМ), растворяют в сухом ТГФ (10 мл), обрабатывают раствор диметилацеталем 2,4-диметоксибензальдегида (4, 0,300 г, 1,42 мм) и п-толуолсульфонатом пиридиния (10 мг) и нагревают реакционную смесь для отгонки ТГФ и метанола. После отгонки 1/2 ТГФ добавляют еще 10 мл ТГФ и снова отгоняют 1/2 объема реакционной смеси. Процесс повторяют трижды. Затем реакционную смесь концентрируют в вакууме и хроматографируют остаток на 75 г силикагеля, элюируя колонку смесью ацетон : гексан (300 мл 20:80 и 300 мл 25:75). Фракции объемом 20 мл собирают и анализируют с помощью ТСХ. Приведенные ниже фракции объединяют и выпаривают под вакуумом.
Фракции 26 - 44, 543 мг, изомер 5Cb' (другие разделяемые компоненты, как было показано, являются более полярными изомерами)
Данные для 5Cb:
ТСХ: силикагель 60; 20% ацетон: 80% гексан, Rf: 0,19.
1H-ЯМР (CDCl3, TMS): δ 3,51 (шс, 3H), 3,81 (шс, 6H), 4,56 (д, 1H), 4,8 (шд, 1H), 4,94 (д., 1H), 5,54 (д, 1 H), 6,4 (шс., 2H), 6,78 (д., 3H), 7,05 - 7,50 (м, 9H).
Препарат N 21:
Получение калиевой соли (4S,5R)-N-CBZ-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты 6Cb
Метиловый эфир (4S,5R)-N-CBZ-2-(2,4-диметоксифенил)-4-фенил -5-оксазолидинкарбоновой кислоты (препарат N 20, 5Cb, 444 мг, 0,93 мМ) растворяют в 10 мл метанола. К полученному раствору прибавляют воду (400 мкл) и карбонат калия (200 мг, 1,45 мМ). После перемешивания в течение ночи в реакционной смеси не остается нерастворимых компонентов, а данные ТСХ показывают очень малый остаток метилового эфира. Раствор концентрируют в вакууме и добавляют к маслу воду (20 мл). Раствор высушивают при замораживании, получая 6,38 мг легкого мелкокристаллического белого порошка, содержащего 466 мг калиевой соли 6Cb.
ТСХ: силикагель 60, 1:4 EtOAc:толуол, Rf: старт.
Препарат N 22:
Получение эфира 7-Триэтилсилил-Баккатин III-13-(4S,5R)-N- CBZ-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты, 9CbA
Грубый препарат калиевой соли (4S,5R)-N-CBZ-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (препарат N 21, 75 мг, 0,11 мМ) распределяют между фазами смеси CH2Cl2 и 5% раствора NaHSO4. Слои разделяют и водный слой экстрагируют EtOAc. Объединенные органические экстракты фильтруют через безводный сульфат натрия и концентрируют в вакууме, получая 51 мг (4S,5R)-N-CBZ-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (7Cb).
7-Триэтилсилил-баккатин III (8A, 50 мг, 0,07 мМ) растворяют в 700 мкл толуола. Всю (4S, 5R)-N-CBZ-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновую кислоту добавляют в растворе CH2Cl2. К раствору прибавляют также ДЦК (25 мг, 0,11 мМ) и ДМАП (4 мг, 0,04 мМ) и нагревают реакционную смесь до 80oC для удаления CH2Cl2. Ход реакции контролируют с помощью ТСХ и, как показывают ее данные, через 1,5 часа обнаруживаются лишь очень малые количества 7-триэтилсилил-баккатина III. Реакционную смесь охлаждают и фильтруют от шлама. Фильтрат концентрируют в вакууме и хроматографируют на колонке с 7 г силикагеля в смеси 1:3 EtOAc: гексан. Колонку элюируют 40 мл смеси 1:3 EtOAc: гексан и 75 мл смеси 1:2 EtOAc: гексан, собирая фракции объемом 3 мл. Искомый продукт обнаруживается во фракциях 17 - 32.
Масс-спектр (FAB-Высокое разрешение)
Рассчитано: 1146, 4882
Найдено: 1146, 4915
1H-ЯМР (CDCl3, TMS): δ 0,51 - 0,59 (м., 6H), 0,88 - 0,94 (м.), 1,13 (с., 3H), 1,18 (с. , 3H), 1,79 - 1,89 (м., 1H), 2,17 (с., 3H), 2,40 - 2,50 (м., 1H), 3,67 (д., 1H), 3,80 (шс., 6H), 4,07 (д., 1 H), 4,22 (д., 1H), 4,39 (м., 1H), 4,54 (д. , 1H), 4,77 (д., 1H), 4,86 (д., 1H), 4,94 (д, 1H), 5,54 (д., 1H), 5,61 (д., 1H), 5,90 (м., 1H), 6,33 (с., 1H), 6,43 (м., 2H), 6,78 (м., 3H), 7,12 - 7,21 (м., 4H), 7,38 - 7,50 (м., 7H), 7,59 (м., 1H), 8,01 (д., 2H).
Препарат N 23:
Получение 13-(N-CBZ -β- фенилизосеринил)-баккатина III 10CA и 10-деацетил-13-(N-CBZ -β- фенилизосеринил)-баккатина III 10СВ
Эфир 7-Триэтилсилил-Баккатин III-13-(4S,5R)-N-CBZ-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9CbA, препарат N 22, 630 мг, 0,55 мМ) растворяют в 10 мл 0,1N раствора HCl в метаноле. 0,1N раствор HCl приготавливают разведением 71 мкл ацетилхлорида до 10 мл метанолом с последующей реакцией в течение, как минимум, 0,5 часа. Ход реакции контролируют с помощью ТСХ, при этом показано отсутствие через 0,5 часа исходных материалов. Реакционную смесь распределяют между солевым раствором, 5% раствором NaHCO3 и EtOAc. Слои разделяют и органический слой экстрагируют 5% раствором NaHCO3. Объединенные водные слои экстрагируют EtOAc и объединенные органические экстракты фильтруют через безводный сульфат натрия. Растворитель концентрируют в вакууме и остаток хроматографируют на колонке с 60 г силикагеля в смеси 1:1 EtOAc:гексан. Колонку элюируют 500 мл смеси 1:1 EtOAc:Гексан, 250 мл смеси 3:2 EtOAc:гексан, 240 мл смеси 2:1 EtOAc:гексан, собирая фракции объемом 25 мл.
Фракции 16 -36, 13-(N-CBZ- -β- фенилизосеринил)-баккатин III, 10CA.
Фракции 44 - 52, 10-деацетил-13-(N-CBZ -β- фенилизосеринил)-баккатин III, 10CB
Данные для 10CA:
Масс-спетр (FAB-Высокое разрешение)
Рассчитано: 884, 3493
Найдено: 884, 3490
1H-ЯМР (CDCl3, TMS): δ 1,13 (с., 3H), 1,80 (с., 3H), 1,86 (м., 1H), 2,24 (с. , 3H), 2,37 (с., 3H), 2,54 (м., 2H), 3,43 (м., 1H), 3,76 (д., 1H), 4,19 (д. , 1H), 4,28 (д., 1H), 4,39 (м., 1H), 4,66 (шс., 1H), 4,90 - 4,97 (м., 1H), 4,94 (д., 1H), 5,05 (д., 1H), 5,34 (д., 1H), 5,64 (д., 1H), 5,75 (д., 1H), 6,23 (м. , 1H), 6,25 (с., 1H), 7,17 (шс., 2H), 7,25 (шс., 3H), 7,29 - 7,41 (м., 5H), 7,50 (м., 2H), 7,61 (м., 1H), 8,21 (д., 2H).
Данные для 10CB
Масс-спектр (FAB-Высокое разрешение)
Рассчитано: 842, 3388
Найдено: 842, 3364
1H-ЯМР (CDCl3, TMS): δ 2,37 (с., 3H), 2,57 (м., 1H), 3,40 (д., 1H), 3,87 (д. , 1H), 4,18 - 4,32 (м.), 4,65 (шс., 1H), 4,92 (д., 1H), 4,95 (д., 1H), 5,06 (д. , 1H), 5,18 (с., 1H), 5,35 (д., 1H), 5,65 (д., 1H), 5,78 (д., 1H), 6,20 (м. , 1H), 7,18 (м., 1H), 7,22 - 7,46 (м.), 7,50 (м., 2H), 7,61 (м., 1H), 8,11 (д., 2H).
Препарат N 24:
Получение 13 -(β- фенилизосеринил)-баккатина III (IIA) из 13-(N-CBZ -β- фенилизосеринил)-баккатина III (10CA)
405 мг (0,45 мМ) 13-(N-CBZ -β- фенилизосеринил)-баккатина III (препарат N 23, 10CA) перемешивают при комнатной температуре и гидрогенизируют при атмосферном давлении в присутствии 40 мл абсолютного этанола и 100 мг 10% Pd/C (палладия на угле). Реакция, отслеживаемая с помощью ТСХ, заканчивается через 5 часов.
Реакционную смесь фильтруют через Целит и промывают этилацетатом. Объединенные фильтрат и промывочные смеси выпаривают под вакуумом. Остаток обрабатывают небольшим количеством этилацетата и несколько большим количеством гексана и выпаривают еще дважды. 13 -(β- фенилизосеринил)-баккатин III (11A) получают в виде белого твердого вещества.
ТСХ: силикагель 60, 70:30, EtOAc:гексан, Rf:полоса между стартом и 1/3 высоты пластины.
1H-ЯМР (CDCl3, TMS): δ 1,13 (с., 3H), 1,24 (с., 3H), 1,66 (с., 3H), 1,88 (с., 3H), 2,23 (с., 3H), 2,24 (с., 3H), 2,45 - 2,61 (м., 1H), 3,75 (д., 1H), 4,14 (д., 1H), 4,23 - 4,33 (м., 3H), 4,40 (м., 1H), 4,93 (д., 1H), 5,63 (д., 1H), 6,13 (т., 1H), 6,27 (с., 1H), 7,26 (м., 1H), 7,39 (д., 4H), 7,52 (т., 2H), 7,65 (т., 1H), 8,06 (д., 2H).
Препарат N 25:
Получение эфира (2R, 3S)-N-(2,2,2-трихлорэтоксикарбонил) -β- фенилизосерина (3D)
Следуя общей процедуре получения препарата N 19 (метилового эфира (2R, 3S)-N-карбобензилокси -β- фенилизосерина (3C)), но начиная реакцию с ацилирования метилового эфира -β- метилизосерина (2) с применением 2,2,2-трихлорэтоксикарбонилхлорида, получают искомый - метиловый эфир N-(2,2,2-трихлорэтоксикарбонил) -β- фенилизосерина (3D).
Препарат N 26:
Получение метилового эфира (4S, 5R)-N-(2,2,2-трихлорэтоксикарбонил)-2-(2,4-диметоксифенил)-4-фенил -5-оксазолидинкарбоновой кислоты 5Da и 5Db
Следуя общей процедуре 20 (получение метилового эфира (4S, 5R)-N-Карбобензилокси-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (5Cb)), но начиная реакцию с метилового эфира 2,2,2-трихлорэтоксикарбонил -β- фенилизосерина (3D), получают искомый продукт - метиловый эфир (4S, 5R)-N-(2,2,2- трихлорэтоксикарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (5Da и 5Db)
Препарат N 27:
Получение калиевой соли (4S, 5R)-N-(2,2,2-трихлорэтоксикарбонил-2-(2,4-диметоксифенил)-4-фенил -5-оксазолидинкарбоновой кислоты (6Da и 6Db)
Следуя общей процедуре получения препарата N 21 (калиевой соли (4S, 5R)-N-карбобензилокси-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (6Cb)), но начиная реакцию с метилового эфира (4S,5R)-N-(2,2,2-трихлорэтоксикарбонил) 2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5Da и 5Db), получают искомый продукт - калиевую соль (4S, 5R)-N-(2,2,2- трихлорэтоксикарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты ( 6Da и 6Db).
Препарат N 28:
Получение эфира 7-Триэтилсилил-Баккатин III-13-(4S, 5R)-N-2 (2,2,2-трихлорэтоксикарбонил)-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (9DaA, 9DbA)
Следуя общей процедуре получения препарата N 22 (эфира 7-Триэтилсилил-баккатин-III-13-(4S, 5R)-N-CBZ-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты, 9CbA), но начиная реакцию с (4S,5R)-N-(2,2,2-трихлорэтоксикарбонил)-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (6Da, 6Db), получают искомый эфир 7-Триэтилсилил-Баккатин III-13-(4S,5R)-N-2-(2,2,2- трихлорэтоксикарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (9DaA, 9DbA).
Препарат N 29:
Получение 13-(N-(2,2,2-трихлорэтоксикарбонил) -β- фенил-изосеринил)баккатина III (10DA)
Следуя общей процедуре получения препарата N 23 [13-(N-CBZ -β- фенил-изосеринил)-баккатина III (10CA)], но начиная реакцию иначе, а именно с эфира 7-Триэтилсилил-баккатин III-13-(4S,5R)-N-2-(2,2,2- трихлорэтоксикарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (9Da, 9Db), получают искомый продукт - 13-(N-(2,2,2-трихлорэтоксикарбонил) -β- фенил-изосеринил)-баккатин III (10DA).
Препарат N 30:
Получение 13 -(β- фенил-изосеринил)-баккатин III (11A) из 13-(N- (2,2,2-трихлорэтоксикарбонил) -β- фенил-изосеринил)-баккатина III (10DA)
13 -(β- (2,2,2-Трихлорэтоксикарбонил) -β- фенил-изосеринил)-баккатин III (препарат N 29, 10DA, 1 г) растворяют в метаноле 950 мл), после чего раствор обрабатывают цинковым порошком (2 г) и хлоридом аммоний (2 г) при перемешивании при комнатной температуре. После перемешивания в течение 3 часов реакционную смесь фильтруют и фильтрат выпаривают под вакуумом (менее чем 20 мм рт.ст.). Остаток распределяют между этилацетатом и 5% водным раствором бикарбоната натрия. Органический слой отделяют, высушивают (сульфат натрия) и концентрируют под вакуумом с получением искомого продукта - 13 -(β- фенил-изосеринил)-баккатина III (11A).
Препарат N 31:
Получение 13-(N-БОК -β- фенилизосеринил)-баккатина III (10BA)
68 мг (0,09 мМ) 13 -(β- фенил-изосеринил)-баккатина III (препарат N 24, 11A) перемешивают при комнатной температуре в атмосфере азота в 0,5 мл сухого ТГФ. К этой смеси добавляют 20 мг (0,092 мм) ди-t-бутил-бикарбоната в 0,2 мл сухого ТГФ и 0,013 мл (0,093 мМ) триэтиламина. Смесь оставляют для реакции на 24 часа, результаты ТСХ после 5 часов показывают, что реакция в основном прошла.
Реакционную смесь распределяют между этилацетатом и солевым раствором. Слои отделяют и водный слой подвергают повторной экстракции этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом.
Грубый продукт хроматографируют на 10 г силикагеля, элюируя смесью 60:40 этилацетат: гексан. Фракции объемом 2 мл собирают и анализируют с помощью ТСХ. Фракции 12-30, содержащие искомый продукт, объединяют и выпаривают под вакуумом. Эта процедура дает искомое соединение - 10AB - в виде белого твердого вещества.
ТСХ: силикагель 60, 60:40, EtOAc: гексан, Rf: 0,46.
1H ЯМР (CDCl3, TMS) δ 1,15 (с., H), 1,33 (с., 9H), 1,85 (с., 3H), 2,25 (с., 3H), 2,30 (м.), 2,38 (с., 3H), 2,54 (мт), 3,46 (д., 1H), 3,80 (д., 1H), 4,17 (д., 1H), 4,31 (д., 1H), 4,41 (м., 1H), 4,63 (шс., 1H), 4,95 (д., 1H), 5,28 (шд, 1H), 5,42 (шд., 1H), 5,67 (д., 1H), 6,24 (т., 1H), 6,29 (с., 1H), 7,18 (д., 1H), 7,38 (м., 5H), 7,50 (т., 2H), 7,62 (т, 1H), 8,10 (д., 2H).
Пример N 32:
Получение 13-(N-(1-адамантоил) -β- фенилизосеринил)-баккатина III (10EA)
44 мг (0,06 мМ) 13 -(β- фенилизосеринил)-баккатина III (препарат N 24; 11A) перемешивают при температуре 0oC в атмосфере азота в 1 мл сухого пиридина. К этом смеси добавляют 0,2 мл метиленхлорида, содержащего 13 мг (0,06 мМ) 1-адамантан-карбонилхлорида. Через 30 минут после начала реакции, ТСХ показывает, что реакция полностью завершена.
Реакционную смесь распределяют между IN HCl и этилацетатом. Органический слой промывают солевым раствором, высушивают над сульфатом натрия и выпаривают под вакуумом.
Остаток хроматографируют на 5 г силикагеля, элюируя смесью 65:35 EtOAc: гексан. Фракции объемом 2 мл собирают и анализируют с помощью ТСХ. Искомый продукт обнаруживают во фракциях 8-23, которые объединяют и выпаривают, получая 33 мг (60% выход) белого твердого вещества. Данные спектрального анализа все еще показывают некоторое присутствие 1-адамантокарбоновой кислоты.
Неочищенный продукт растворяют в 1 мл свежеотогнанного ТГФ. Затем добавляют избыток диазометана и оставляют реакционную смесь на 30 минут. После этого реакционную смесь выпаривают под вакуумом и хроматографируют, как было описано выше. Чистый продукт обнаруживают во фракциях 6-25, которые выпаривают, получая 13-(N-(1-адамантоил) -β- фенилизосеринил)-баккатин III IOEA в виде твердого вещества.
ТСХ: силикагель 60, 50:50, EtOAc:гексан, Rf:0,48.
Масс-спектр (FAB, m/z): (M+H) измеренный при 912, 4168, расчет для C51H62N1O14 составляет 912, 4170; 912, 852, 834, 569, 551, 509, 344, 326, 298, 268, 180, 135, 105
1H ЯМР (CDCl3, TMS): δ 1,16 (с.), 1,27 (с.), 1,60 - 2,10 (м.), 2,24 (с., 3H), 2,30 (м.), 2,36 (с., 3H), 2,52 (м.), 3,54 (д., 1H), 3,77 (д., 1H), 4,18 (д. , 1H), 4,29 (д., 1H), 4,40 (м., 1H), 4,68 (м., 1H), 4,94 (д., 1H), 5,56 (дд. , 1H), 5,68 (д., 1H), 6,15 (т., 1H), 6,28 (с., 1H), 6,47 (д., 1H), 7,37 (м., 5H), 7,50 (т., 2H), 7,61 (т., 1H), 8,10 (д., 2H).
Препарат N 33:
Получение 13-(N-(3-тетрагидрофуранилоксикарбонил) -β- фенил-изосеринил)-баккатина III (10FA)
13 -(β- Фенил-изосеринил)-баккатина III (препарат N 24: IIA, 16,8 мг, 0,022 мМ) обрабатывают рацемической смесью 3-тетрагидрофуранолсукцинимидилкарбоната (5,0 мг, 0,023 мМ), пиридином (5 мкл) и метиленхлоридом (180 мкл). Реакционную смесь перемешивают при комнатной температуре в течение 2 дней. Затем ее разбавляют этилацетатом и промывают 5% водным раствором бисульфата натрия и 5% водным раствором бикарбоната натрия. Органический раствор высушивают и выпаривают, получая смесь диастереомеров 13-(N-(3-тетрагидрофуранилоксикарбонил) -β- фенилизосеринил)-баккатина III (10FA).
ТСХ: силикагель 60; 50:40, ацетон:гексан: Rf:0,16.
1H ЯМР (CDCl3, TMS): δ 1,16 (с.), 1,27 (с.), 1,66 (с.+м.), 1,83 (с.), 1,90 (м. ), 2,25 (с.+м,), 2,37 (с.), 2,55 (м.), 3,7 - 4,0 (м.), 4,18 (д., 1H), 4,30 (д., 1H), 4,43 (м., 1H), 4,64 (м., 4H), 4,95 (дд., 1H), 5,09 (м., 1H), 5,30 (м. , 1H), 5,67 (м., 2H), 6,28 (с.+ м., 2H), 6,39 (м., 5H), 7,50 (т., 2H), 7,62 (м., 1H), 8,12 (д., 2H).
Препарат N 34:
Получение 13-(N-(4-тетрапиранилоксикарбонил) -β- фенилизосеринил)-баккатина III (10GA)
13 -(β- Фенил-изосеринил)-баккатина III (препарата N 24, 11A, 10 мг, 0,013 мМ) обрабатывают 4-тетрагидропиронолсукцинимидилкарбонатом (3,3 мг, 0,014 мМ), пиридином (5 мкл) и метиленхлоридом (100 мкл). Смесь перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют этилацетатом и промывают 5% водным раствором биосульфата натрия и 5% водным раствором бикарбоната натрия. Этилацетатный раствор высушивают и выпаривают, получая 10,3 мг неочищенного продукта. Очистка хроматографированием на колонке с силикагелем в смеси (40:60) ацетон:гексан дает чистый 13-(N-(4-тетрапиранил-оксикарбонил) -β- фенилизосеринил)-баккатин III (10GA).
ТСХ:силикагель 60, 40:60, ацетон:гексан, Rf:0,17.
1H ЯМР (CDCl3, TMS) : δ 1,15 (с), 1,27 (с.), 1,5 - 1,8 (м.), 1,68 (с.), 1,84 (с.), 1,89 (м.), 2,1 - 2,4 (м.), 2,25 (с., 3H), 2,41 (с., 3H), 2,49 (д. , 1H), 2,55 (м., 1H), 3,08 (м., 1H), 3,27 (м., 1H), 3,33 (д., 1H), 3,70 (м., 1H), 3,80 (д. + м.,2H), 4,16 (д., 1H), 4,29 (д., 1H), 4,42 (м., 1H), 4,66 (м. , 2H), 4,94 (д., 1H), 5,33 (м., 1H), 5,67 (м., 1H), 5,65 (д. 1H), 6,28 (с. + м., 2H) 7,37 (м., 5H), 7,51 (м., 2H), 7,61 (м., 1H), 8,14 (д., 2H).
Препарат N 35:
Получение 13-(N-(трет-бутилацетил) -β- фенилизосеринил)-баккатина III (10HA) и
2'-t-бутилацетил-13-(N-(трет. -бутилацетил) -β- фенилизосеринил)-баккатина III (12CA)
51 мг (0,068 мМ) 13 -(β- фенилизосеринил)-баккатина III (препарат N 24; 11A) перемешивают в атмосфере азота при температуре 0oC в 1 мл сухого пиридина, 0,01 мл (9,1 мг, 0,068 мМ) трет-бутилацетилхлорида растворяют в 0,1 мл метиленхлорида. Этот раствор по каплям прибавляют к исходному амину. Смесь оставляют для реакции при температуре 0oC на 3 часа и помещают на ночь в морозильник.
Реакционную смесь разбавляют этилацетатом и промывают 1N HCl и 5% водным раствором бикарбоната натрия. Водные слои повторно экстрагируют этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом.
Неочищенный продукт хроматографируют на 7 г силикагеля, элюируя смесью 50: 50 и 70:30 EtOAс:гексан. Фракции объемом 2 мл собирают и анализируют с помощью ТСХ. Перечисленные ниже фракции объединяют и выпаривают под вакуумом.
Фракции 11-21, неочищенный 2'-t-бутилацетил-13-(N-(трет-бутилацетил) -β- фенилизосеринил)-баккатин III - (12CA)
Фракции 22-45, 13-(N-трет-бутилацетил) -β- фенилизосеринил)баккатин III (10HA) в виде белого твердого вещества.
12CA, все еще представляющий собой неочищенный продукт, повторно хроматографируют на 3 г силикагеля, элюируя смесью 10:90 ацетон:метиленхлорид. Фракции объемом 1 мл собирают и анализируют с помощью ТСХ. Фракции 11-28, содержащие искомый продукт, объединяют и выпаривают под вакуумом, получая чистый 2'-t-бутилацетил-13-(N-(трет-бутилацетил) -β- фенилизосеринил)-баккатин III (12CA) в виде белого твердого вещества.
Данные для 12CA:
ТСХ: силикагель 60: 60:40, этилацетат:гексан, Rf: 0,70.
Масс-спектр (FAB, m/Z): (M+H) измеренный при 946, 4618,
расчет для C52H68N1O15 составляет 946, 4589, 946, 509, 378, 360, 280, 262, 234, 105, 99, 57, 43.
1H ЯМР (CDCl3, TMS) : δ 0,98 (с.), 1,28 (с., 3H), 2,23 (с., 3H), 2,42 (с. , 3H), 2,53 (м.), 3,81 (д. 1H), 4,19 (д., 1H), 4,31 (д., 1H), 4,45 (м., 1H), 4,97 (д. , 1H), 5,34 (д, 1H), 5,67 (д., 1H), 5,75 (м., 1H), 6,08 (д., 1H), 6,24 (м., 1H), 6,31 (с., 1H), 7,28 - 7,45 (м., 5H), 7,51 (т., 2H), 7,61 (т., 1H), 8,11 (д., 2H).
Данные для 10HA:
ТСХ: силикагель 60: 60:40, этилацетат:гексан; Rf:0,27
Масс-спектр (FAB, m/Z): (M+H) измеренный при 848, 3863
расчет для C46H58N1O14 составляет 848, 3857, 848, 830, 788, 770, 569, 551, 509, 280, 262, 234, 182, 136, 115, 105, 99, 57, 43.
1H ЯМР (CDCl3, TMS): δ 0,97 (с.), 1,26 (с., 3H), 2,24 (с., 3H), 2,33 (с. , 3H), 2,52 (м., 2H), 3,60 (д., 1H), 3,78 (д., 1H), 4,18 (д., 1H), 4,29 (д., 1H), 4,39 (м., 1H), 4,65 (м., 1H), 4,93 (д., 1H), 5,55 (дд, 1H), 5,67 (д., 1H), 6,19 (т., 1H), 6,28 (с., 1H), 7,39 (м., 5H), 7,50 (т., 2H), 7,62 (т., 1H), 8,10 (д., 2H).
Препарат N 36:
Получение 13-(N-(пивалоил) -β- фенилизосеринил)-баккатина III (10IA)
44 мг (0,06 мМ) 13 -(β- фенилизосеринил)-баккатина III (препарат N 24, 11A) перемешивают при температуре 0oC в атмосфере азота в 1 мл сухого пиридина. К этой смеси добавляют в течение 5 минут раствор 8 мг (0,06 мМ) триметилацетилхлорида в 0,2 мл метиленхлорида. Через 30 минут после начала реакции ТСХ показывает, что большая часть амина прореагировала.
Реакционную смесь распределяют между 1N HCl и этилацетатом. Органический слой промывают солевым раствором, высушивают над сульфатом натрия и выпаривают под вакуумом.
Грубый продукт хроматографируют на 5 г силикагеля, элюируя смесью 65:35 EtOAc: гексан. Фракции объемом 2 мл собирают и анализируют с помощью ТСХ. Продукт обнаруживается во фракциях 10-38, которые объединяют и выпаривают под вакуумом, получая искомое соединение.
Данные спектрального анализа показывают наличие в продукте небольшого количества триметилуксусной кислоты. Поэтому продукт растворяют в этилацетате, промывают 5% раствором бикарбоната натрия, высушивают над сульфатом натрия и выпаривают под вакуумом. Это дает 101A в виде белого твердого вещества.
ТСХ: силикагель 60; 50:50 EtOAc: гексан, Rf: 0,29.
Масс-спектр (FAB, m/z): (M+H) измеренный при 834, 3712,
расчет для C45H56N1O14 составляет 834, 3700, 834, 816, 774, 569, 551, 509, 387, 327, 266, 248, 220, 190, 105, 57.
1H ЯМР (CDCl3, TMS) : δ 1,16 (с.), 1,23 (с.), 2,23 (с., 3H), 2,29 (д, 1H), 2,35 (с., 3H), 2,51 (м., 1H), 3,77 (д., 1H), 4,17 (д., 1H), 4,28 (д., 1H), 4,38 (м., 1H), 4,68 (д., 1H), 4,93 (д., 1H), 5,56 (дд., 1H), 5,66 (д., 1H), 6,17 (м. , 1H), 6,28 (с.,1H), 6,54 (д.,1H), 7,35 (м., 5H), 7,49 (м., 2H), 7,60 (м.,1H), 8,10 (д., 2H).
Препарат N 39:
Получение 7-фтор-13-(N-CbZ -β- фенил-изосеринил)-баккатина III (18) из 7-фтор-13-(N-CbZ -β- фенил-изосеринил)-2-трок-баккатина III(13BA)
Раствор 7-фтор - 13-(N-CbN -β- фенил-изосеринил)-2'- трок-баккатина III (13BA, пример 3) (0,079 г) в смеси 9:1 метанол/уксусная кислота (20 мл) и этилацетата (8 мл) перемешивают с активированным цинком (0,153 мг) при комнатной температуре в течение двух часов. После этого полученный грубый продукт хроматографируют на силикагеле, используя для элюции 40% EtOAc в гексане, с получением 7-фтор-13 (N-CbZ -β-/ фенил-изосеринил)-баккатина III(18): масс-спектр 886, 571, 511, 371, 347, 329, 316, 298, 105, 91 m/z.
Препарат N 40:
Получение 7-фтор-13 -(β- фенилизосеринил)-баккатина III (19)
23,5 мг (0,027 мМ) 7-фтор-13- (N-CbZ -β- фенил-изосеринил) баккатина III(18) (препарат N 39, 18) растворяют в 3 мл абсолютного этанола, обрабатывают полученный раствор 7 мг 10% палладия на угле (Pd/C) и гидрогенизируют при атмосферном давлении и комнатной температуре в течение 4,5 часов. Исчезновение исходного материала отслеживают с помощью ТСХ. Реакционную смесь фильтруют через Целит, промывая Целит этилацетатом. Объединенные фильтрат и промывочную жидкость выпаривают под вакуумом. Остаток дважды обрабатывают смесью этилацетат:гексан и выпаривают под вакуумом. Эти процедуры приводят к получению 7-фтор-13 -(β- фенил-изосеринил)-баккатина III (19) в виде белого твердого вещества.
ТСХ: силикагель 60, 50:50, этилацетат:гексан, Rf : 0,11.
1H ЯМР (CDCl3, TMS): δ 2,20 (с., 3H), 2,26 (c., 3H), 2,54 (м., 1H), 3,99 (д. , 1H), 4,24 (д., 1H), 4,27-4,42 (м., 3H), 4,55 (дд., J =48 Гц, 1H), 4,99 (д,1H), 5,72 (д., 1H), 6,11 (м., 1H), 6,55 (c., 1H), 7,27 (c., 1H), 7,39 (м. , 4H), 7,51 (м.,2H), 7,64 (м., 1H), 8,08 (д.,2H).
Препарат N 41:
Получение 7-фтор-13-(N-БОК -β- фенилизосеринил)-баккатина III (20) и
7-фтор-2'-БОК-13-(N-БОК -β- фенилизосеринил)-баккатина III(13CA)
0,027 мМ 7-фтор-13 -(β- фенилизосеринил)-баккатина III (препарат N 40, 19) растворяют при перемешивании в 0,2 мл свежеотогнанного ТГФ при комнатной температуре в атмосфере азота. Затем прибавляют 6 мг (0,027 мМ) ди-трет-бутилбикарбоната и 0,004 м (0,029 мМ) триэтиламина. Смесь составляют для реакции на 20 часов.
Реакционную смесь распределяют между этилацетатом и солевым раствором. Слои отделяют и водный слой подвергают повторной экстракции этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом.
Смесь продуктов хроматографируют на 3 г силикагеля, элюируя смесью 30:70 этилацетат: гексан до выхода с колонки первого продукта, переходя затем на смесь 50:50 этилацетат:гексан. Перечисленные ниже фракции объединяют и выпаривают, получая белые твердые вещества.
Фракции 16-30, 13CA
Фракции 32-46, 20
Данные для 13CA:
ТСХ: силикагель 60, 50:50 этилацетат:гексан, Rf:0,83.
Масс-спектр (FAB, m/z) 952 (M+H), 878, 822, 778, 571, 511, 389, 329, 106, 162, 105, 57.
1H ЯМР (CDCl3, TMS): δ 1,17 (c., 3H), 1,24 (c. 3H), 1,25 (c., 9H), 1,90 (c., 9H), 2,08 (c., 3H), 2,22 (c., 3H), 2,0-2,7 (м.,4H), 4,02 (д., 1H), 4,24 (д. , 1H), 4,36 (д., 1H), 4,59 (дд., J=48 Гц, J = 5 Гц, 1H), 4,77 (шс., 1H), 5,02 (д., 1H), 5,22 (шс., 1H), 5,68 (м., 1H), 5,77 (д., 1H), 6,27 (м., 1H), 6,57 (с.,1H), 7,27-7,70 (м., 9H), 8,09 (д.,2H).
Данные для 20:
ТСХ: силикагель 60, 50:50 этилацетат:гексан, Rf:0,54.
Масс-спектр (FAB, m/z): (M+H) измеренный при 852, 3638, расчет для C45H55N1O14 составляет 852, 3606; 852, 796, 752, 692, 674, 571, 511, 389, 347, 329, 105, 57, 43.
1H ЯМР (CDCl3, TMS): δ 1,17 (c., 3H), 1,23 (с., 3H), 1,34 (с., 9H), 2,22 (с. , 3H), 2,39 (с.,3H), 2,0 - 2,7 (м., 4H), 3,36 (м., 1H), 4,04 (д., 1H), 4,28 (д. , 1H), 4,37 (д., 1H), 4,48-4,68 (м., 2H), 5,01 (д., 1H), 5,30 (м., 1H), 5,45 (м., 1H), 5,76 (д., 1H), 6,21 (м., 1H), 6,56 (с., 1H), 7,30-7,70 (м., 9H), 8,13 (д., 2H).
Препарат N 42:
Получение 13-(N-Бензилоксикарбонил -β- фенил-изосеринил)-7-дезокси -7β,8β- метанобаккатина III (21) из 13-(N-Бензилоксикарбонил -β- фенил-изосеринил)-2'-трок-7-дезокси -7β,8β- метанобаккатина III (14BA)
Раствор 13-(N-бензилоксикарбонил -β- фенил-изосеринил) -2' -трок-7-дезокси -7β,8β- метанобаккатина III (14BA пример 3) (0,040 г) в смеси 9:1 метанол/уксусная кислота (10 мл) перемешивают при комнатной температуре с активированным цинком (0,144 г) в течение 3 часов. Полученный в результате грубый продукт реакции хроматографируют на силикагеле, используя для элюирования 40% EtOAc в гексане, с получением в итоге 13-(N-Бензоилоксикарбонил -β- фенил-изосеринил)-7-дезокси -7β,8β- метанобаккатина III (21):
масс-спектр
Найдено: 866, 3423, C48H51NO14+H требует 866, 3388, 848, 806, 788, 551, 533, 491, 105, 91 m/z.
Препарат N 43:
Получение 13 -(β- фенилизосеринил)-7-дезокси -7β,8β- метанобаккатина III (22)
14 мг (0,016 мМ) 13-(N- Бензилоксикарбонил -β- фенилизосеринил)-7-дезокси -7β,8β- метанобаккатина III (препарат N 42, 21) растворяют в 2 мл абсолютного этанола. Добавляют 5 мг 10% палладия на угле (Pd/C) и гидрогенизируют при комнатной температуре и атмосферном давлении в течение 6 часов. Ход реакции отслеживают с помощью ТСХ и по завершении отфильтровывают смесь через Целит, промывая его этилацетатом. Фильтрат и промывочную жидкость объединяют и выпаривают под вакуумом. Дважды добавляют смесь этилацетат: гексан и проводят повторное выпаривание, получая 22 в виде белого твердого вещества. После хранения в морозильной камере в течение ночи его используют для получения препарата N 44.
ТСХ: силикагель 60, 50:50, EtOAc:гексан, Rf: полоса от старта несколько вверх по пластине.
1H ЯМР (CDCl3, TMS): δ 5,62 (д., 1H), 6,11 (т., 1H), 6,31 (с., 1H), 7,39 (м.), 7,53 (м., 2H), 7,66 (м., 1H), 8,08 (д., 2H).
Препарат N 44:
Получение 13- (N-БОК -β- фенилизосеринил)-7-дезокси -7β,8β- метанобаккатина III (23) и 13- (N-БОК-2'-БОК-β- -фенилизосеринил)-7-дезокси -7β,8β- метанобаккатина III (14CA)
0,016 мМ 22 (препарат N 44) растворяют при перемешивании в атмосфере азота в 0,12 мл сухого ТГФ. К этой смеси добавляют 3,5 мг (0,016 мМ) ди-t-бутилбикарбоната в 0,05 мл сухого ТГФ и 0,0025 мл (0,018 мМ) триметиламина в 0,015 мл сухого ТГФ. Смесь оставляют для реакции на 27 часов, после чего ТСХ указывает на практически полное завершение реакции.
Реакционную смесь распределяют между этилацетатом и солевым раствором. Слои разделяют и водный слой повторно экстрагируют этилацетатом. Объединенные органические экстракты высушивают над сульфатом натрия и выпаривают под вакуумом.
Смесь неочищенных продуктов хроматографируют на 3 г силикагеля. Элюцию проводят в градиенте от 30:70 до 50:60 смеси EtOAc:гексан. Фракции объемом 1 мл собирают и анализируют с помощью ТСХ. Перечисленные ниже фракции объединяют и выпаривают, получая белые твердые вещества.
Фракции 16-30, 14CA
Фракции 33-53, 23
23 не является чистым продуктом, в связи с чем его подвергают повторному хроматографированию на 1 г силикагеля, проводя элюирование в градиенте от 40:60 до 50:50 смеси EtOAc:гексан. Фракции объемом 0,5 мл собирают и анализируют с помощью ТСХ. Чистый продукт находится во фракциях 11-20, которые объединяют и выпаривают под вакуумом, получая в итоге искомый продукт в виде 4 мг белого твердого вещества.
Данные для 14CA:
ТСХ: силикагель 60, 50:50, EtOAc:гексан, Rf:0,87.
Масс-спектр (FAB, m/z) 858, 803, 798, 551, 491, 369, 327, 206, 105, 57.
1H ЯМР (CDCl3, TMS) : δ 1,25 (с.), 2,01 (с., 3H), 2,21 (с., 3H), 2,43 (м. ), 4,01 (д., 1H), 4,07 (д.,1H), 4,28 (д., 1H), 4,70 (м., 2H), 5,18 (шс. 1H), 5,64 (м.,2H), 6,25 (м., 1H), 6,33 (с.,1H), 7,39 (с.,5H), 7,51 (м.,2H), 7,64 (м., 1H), 8,09 (д.,2H).
Данные для 23:
ТСХ: силикагель 60, 50:50 EtOAc: гексан, Rf:0,77.
Масс-спектр (FAB m/z):(M+H) измеренный: 832, 3588, расчет для C45H54N1O14 составляет 832, 3544, 832, 814, 776, 732, 714, 696, 672, 551, 491, 105, 57.
1H ЯМР (CDCl3, TMS): δ 1,28 (с.), 1,37 (м.), 1,68 (м.) 1,85 (с.), 2,10 (м.), 2,21 (с.,3H), 2,26 (м.), 2,39 (с., 3H), 2,47 (м.), 3,30 (м., 1H), 4,06 (м. ,2H), 4,31 (д.,1H), 4,63 (м.,1H), 4,74 (д.,1H), 5,30 (м., 1H), 5,36 (д., 1H), 5,66 (д.,1H), 6,28 (м.,1H), 6,33 (с., 1H), 7,37 (м.,5H), 7,51 (м., 2H), 7,61 (м.,1H), 8,15 (д.,2H).
Препарат N 45:
Получение 13- (N-фенилмочевины -β- фенил-изосеринил)-баккатина III; 13 -(β- фенилизосеринил)-баккатин III N-фенилмочевина (10JA)
48 мг (0,064) 13 -(β- Фенил-изосеринил)-баккатина III (препарат N 24 11A) растворяют в 700 мкл ТГФ и добавляют 6,5 мкл (0,060 мМ) фенилизоцианата. ТСХ не обнаруживает амина в реакционной смеси. Раствор разбавляют EtOAc и экстрагируют насыщенным CuSO4. Органическую фазу фильтруют через Na2SO4, концентрируют в вакууме и хроматографируют на колонке с 5 г силикагеля в смеси: 1:1 EtOAc:гексан. Колонку элюируют последовательно 20 мл 1:1 EtOAc:гексан, 20 мл 3:2 EtOAc:гексан и 20 мл 2:1 EtOAc:гексан, собирая фракции объемом 3 мл. Искомые продукты находятся во фракциях 17-31.
Масс-спектр (FAB-высокое разрешение)
Рассчитано: 869, 3512
Найдено: 869, 3512
1H ЯМР (CDCl3, TMS) : δ 1,13 (с, 3H), 1,19 (с, 3H), 1,81 (с., 3H), 2,19 (с. , 3H), 2,27 (м.), 2,37 (с, 3H), 2,51 (м., 1H), 2,66 (м., 1H), 3,76 (д., 1H), 4,18 (д., 1H), 4,28 (д., 1H), 4,37 (м., 1H), 4,67 (м., 1H), 4,93 (д., 1H), 5,49 (дд., 1H), 5,67 (д., 1H), 6,21 (м., 1H), 6,27 (с., 1H), 6,93 (м., 2H), 7,07 (м., 2H), 7,19 (м., 3H), 7,26-7,40 (м.), 7,48 (м., 1H), 7,60 (м., 1H), 8,10 (д., 2H).
Препарат N 46:
Получение N-дебензоил-N-(t-бутил)аминокарбонил-таксола, 13 -(β- фенил-изосеринил)-баккатин III N-t-бутилмочевины (10KA)
N-дебензоил-N-(t-бутил)аминокарбонил-таксол (51 мг, 0,07 мМ). Препарат N 24, 11A) растворяют в 700 мкл ТГФ и добавляют 7 мкг (0,061 мМ) t-бутилизоцианата. TCX обнаруживает присутствие амина в реакционной смеси, поэтому прибавляют еще 3 мкл. Эту процедуру повторяют еще дважды (3 мкл и 4 мкл) до тех пор, пока TCX не покажет очень малое количество остаточного амина. Раствор концентрируют в вакууме и хроматографируют на колонке с 5 г силикагеля в смеси 1: 1 EtOAc:гексан. Колонку элюируют последовательно 50 мл 1:1 EtOAc: гексан, 25 мл 3: 2 EtOAc:гексан и 25 мл 2:1 EtOAc:гексан, собирая фракции объемом 3 мл. Искомый продукт находится во фракциях 21-40.
Масс-спектр (FAB-Высокое разрешение)
Рассчитано: 849, 3809
Найдено: 849, 3809
1H ЯМР (CDCl3, TMS) : δ 1,14 (с., 3H), 1,22 (с.), 1,24 (с.), 1,83 (с., 3H), 2,23 (с., 3H), 2,44 (с., 3H), 2,50 (м., 1H), 3,77 (д., 1H), 4,17 (д., 1H), 4,29 (д., 1H), 4,38 (м., 1H), 4,61 (м., 1H), 4,94 (д., 1H), 5,29 (м., 2H), 5,67 (д., 1H), 6,18 (м., 1H), 6,29 (c., 1H), 7,33 (м., 5H), 7,49 (м., 1H), 7,61 (м., 1H), 8,09 (д., 2H).
Препарат N 47:
Получение 13-(N-1-метил-1-циклогексамид -β- фенил-изосеринил)- баккатина III, 13-(N-(1-метил-1-циклогексаноил) -β- фенил-изосеринил)- баккатина III (10MA)
30 мг (0,04 мМ) 13 -(β- фенил-изосеринил)-баккатина III (препарат N 24, 11A) растворяют в 400 мкл пиридина и охлаждают до 0oC. Сразу после охлаждения добавляют 20 мкл (0,037 мМ) раствора 300 мг 1-метил-1-циклогексил-карбонилхлорида в 1 мл CH2Cl2. Так как TCX после этого показывает наличие некоторого количества оставшегося амина, добавляют еще 10 мкл вышеуказанного раствора. После этого TCX показывает малое количество остаточного амина. Затем реакционную смесь разбавляют EtOAc и экстрагируют насыщенным CuSO4. Органическую фазу фильтруют через Na2SO4, концентрируют в вакууме и хроматографируют на колонке с 3 г силикагеля в смеси 1:1 EtOAc:гексан. Для элюирования используют последовательно 50 мл 1:1 EtOAc:гексан и 20 мл 3:2 EtOAc:гексан, собирая фракции объемом 2 мл. Искомый продукт находится во фракциях 11-28.
Масс-спектр (FAB-высокое разрешение)
Рассчитано: 874, 4013
Найдено: 874, 4011
1H ЯМР (CDCl3, TMS) : δ 1,12 (с., 3H), 1,15 (с., 3H), 1,26 (с., 3H), 1,81 (с. , 3H), 1,87 (м., 3H), 2,24 (с., 3H), 2,36 (с., 3H), 2,54 (м., 1H), 3,78 (д. , 1H), 4,18 (д., 1H), 4,29 (д., 1H), 4,40 (м., 1H), 4,70 (д., 1H), 4,94 (д., 1H), 5,61 (дд., 1H), 5,67 (д., 1H), 6,19 (м., 1H), 6,28 (с., 1H), 6,51 (д. 1H), 7,38 (м., 5H), 7,50 (м., 2H), 7,61 (м., 1H), 8,11 (д., 2H)
Препарат N 48:
Получение 13-(N-1-фенил-1-циклопентамид -β- фенил-изосеринил)- баккатина III, 13-(N-(1-фенил-1-циклопентаноил) -β- фенил- изосеринил)-баккатина III (10NA)
26 мг (0,035 мМ) 13 -(β- фенил-изосеринил)-баккатина III (препарат N 24, 11A) растворяют в 400 мкл пиридина и охлаждают до 0oC. Сразу после охлаждения добавляют 20 мкл (0,033 мМ) раствора 350 мг/мл 1-фенил-1-циклопентилкарбонилхлорида в CH2Cl2. Так как TCX после этого показывает наличие некоторого количества оставшегося амина, добавляют еще 20 мкл вышеуказанного раствора. После этого TCX показывает малое количество остаточного амина. Затем реакционную смесь разбавляют EtOAc и экстрагируют насыщенным CuSO4. Органическую фазу фильтруют через NaSO4, концентрируют в вакууме и хроматографируют на колонке 3 г силикагеля в смеси 1:1 EtOAc:гексан. Для элюирования используют последовательно 50 мл 1:1 EtOAc:гексан и 20 мл 3:2 EtOAc:гексан, собирая фракции объемом 2 мл. Исходный продукт находится во фракциях 12-29.
Масс-спектр (FAB - высокое разрешение)
Рассчитано: 922, 4013
Найдено: 922, 4022
1H ЯМР (CDCl3, TMS) : δ 1,16 (с., 3H), 1,27 (с., 3H), 1,77 (с., 3H), 1,60-2,10 (м.), 2,25 (с., 3H), 2,35 (с., 3H), 2,25-2,65 (м.), 3,75 (д., 1H), 4,19 (д. , 1H), 4,28 (д., 1H), 4,38 (м., 1H), 4,59 (д., 1H), 4,92 (д., 1H), 5,49 (дд., 1H), 5,66 (д., 1H), 6,10 (м., 2H), 6,26 (с., 1H), 7,08 (м., 2H), 7,29 (м.), 7,53 (м., 2H), 7,63 (м., 1H), 8,12 (д., 2H).
Препарат N 49:
Получение 13-(N-фталимид -β- фенил-изосеринил)-баккатина III, 13 -(β- фенил-изосеринил)-баккатин III N-фталимида (10PA)
29 мг (0,04 мМ) 13 -(β- фенил-изосеринил)-баккатина III (препарат N 24, 11A) растворяют в 400 мкл пиридина и 15 мг (0,07 мМ) карбэтоксифталимида. Ход реакции контролируют с помощью TCX, показывающей через 72 часа полное отсутствие амина. Далее реакционную смесь разбавляют EtOAc и экстрагируют насыщенным CuSO4. Органическую фазу фильтруют через Na2SO4, концентрируют в вакууме и хроматографируют на колонке с 4 г силикагеля в смеси 1:1 EtOAc: гексан. Для элюирования используют последовательно 20 мл 1:1 EtOAc:гексан, 20 мл 3: 2 EtOAc:гексан, 20 мл 2:1 EtOAc:гексан и 20 мл 4:1 EtOAc:гексан, собирая фракции объемом 2 мл. Искомый продукт находится во фракциях 16-28.
1H ЯМР (CDCl3 : TMS) : δ 1,09 (с., 3H), 1,16 (с., 3H), 1,81 (с., 3H), 2,21 (с. , 3H), 2,44 (с., 3H), 2,52 (м., 2H), 3,76 (д., 1H), 4,15 (д., 1H), 4,28 (д. , 1H), 4,41 (м., 2H), 4,96 (д., 1H), 5,31 (м., 1H), 5,61 (д., 1H), 5,76 (д. , 1H), 6,08 (м., 1H), 6,24 (с., 1H), 7,23 (м., 1H), 7,36 (м., 2H), 7,52 (м., 4H), 7,66 (м., 1H), 7,80 (м., 4H), 8,10 (д., 2H).
Препарат N 50:
Получение N-дебензоил-N-(t-бутил)аминотиокарбонилтаксола (10LA)
24 мг (0,032 мМ) 13 -(β- фенил-изосеринил)-баккатина III (препарат N 24, 11A) перемешивают при комнатной температуре в атмосфере азота в 0,2 мл сухого ТГФ. Затем прибавляют 4 мкл (0,032 мМ) t-бутил-изотиоцианата. Через 5 часов результаты ТСХ показывают, что реакция не завершена. Добавляют еще 4 мкл t-бутил-изотиоцианата и реакция протекает в течение ночи. Неочищенный продукт наносят на 0,5 г силикагеля и хроматографируют на 3 г силикагеля, используя для элюирования смесь 60:40 этилацетат:гексан. Фракции объемом 1 мл собирают и анализируют с помощью ТСХ. Фракции 7-20, содержащие искомый продукт, объединяют и выпаривают под вакуумом, получая нужный продукт.
ТСХ: силикагель 60, 60:40, EtOAc:гексан, Rf : 0,40.
1H ЯМР (CDCl3, TMS) : δ 1,14 (с., 3H), 1,40 (с., 9H), 1,80 (с., 3H), 2,25 (с. , 3H), 2,40 (с., 3H), 3,50 (с., 1H), 3,80 (д., 1H), 4,23 (м., 2H), 4,40 (шс, 1H), 4,86 (с., 1H), 4,93 (д., 1H), 5,66 (д., 1H), 6,18 (с., 1H), 6,27 (с. 1H), 6,28-6,40 (м., 2H), 6,59 (д., 1H), 7,30-7,54 (м., 7H), 7,58 (т., 1H), 8,09 (д., 2H).
Масс-спектр (FAB, m/z) : (M+H), измеренный при 865, 3577, расчет для C45H57N2O13S составляет 865, 3581, 865, 569, 509, 297, 251, 133, 105, 77, 57.
Препарат N 51:
Получение Таксотера (10BF) из 10-АцетилТаксотера (10BA)
25 мг (0,029 мМ) 10-ацетилТаксотера (препарат 1, 10BA) перемешивают при комнатной температуре в атмосфере азота в 1,0 мл 95% этанола. Затем добавляют 2 капли безводного гидразина и оставляют смесь для прохождения реакции на 1,5 часа, после чего ТСХ показывает, что реакция практически полностью завершена. Реакционную смесь распределяют между водой и метиленхлоридом. Водный слой подвергают повторной экстракции метиленхлоридом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом.
Неочищенный продукт хроматографируют на 3 г силикагеля, используя для элюирования смесь 70:30 этилацетат:гексан. Фракции объемом 1 мл собирают и анализируют с помощью ТСХ. Фракции 14-28, содержащие искомый продукт, объединяют и выпаривают под вакуумом.
ТСХ: силикагель 60, 70:30, EtOAc:гексан, Rf:0,33.
1H ЯМР (CDCl3, TMS) : δ 1,12 (с., 3H), 1,23 (с., 3H), 1,74 (с., 3H), 1,85 (с., 3H), 2,37 (с., 3H), 2,56 (м., 1H), 3,53 (шс., 1H), 3,90 (д., 1H), 4,18 (д., 1H), 4,21 (м., 1H), 4,30 (д., 1H), 4,32 (с., 1H), 4,62 (шс., 1H), 4,94 (д., 1H), 5,23 (с., 1H), 5,28 (шс., 1H), 5,52 (д., 1H), 5,66 (д., 1H), 6,20 (т. , 1H), 7,25-7,45 (м., 6H), 7,50 (т., 2H), 7,61 (т., 1H), 8,11 (д., 2H)
Препарат N 52:
Получение 13 -(β- фенил-изосеринил)-баккатин III N-t- амилуретана (10RA)
Часть A:
Получение t-амил 4-нитрофенилкарбоната
Раствор t-амилового спирта (0,54 мл, 5,0 мМ) в пиридине (1 мл) обрабатывают при 0oC 4-нитрофенилхлорформатом (1,00 г, 4,97 мМ). После добавления 1,5 мл метиленхлорида, реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем ее разбавляют толуолом и фильтруют. Примеси кристаллизуют в смеси метилен-хлорид:гексане.
ЯМР δ 0,981 (т., 3H), 1,54 (с., 6H), 1,88 (к., 2H), 7,36 (д., 2H), 8,28 (д., 2H).
Часть B:
29 мг (0,039 мМ) 13 -(β- фенил-изосеринил)-баккатина III (препарат N 24, 11A) и t-амил 4-нитрофенилкарбонат (13 мг, 0,051 мМ) в пиридине (0,10 мл) перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь разбавляют этилацетатом и промывают 5% водным бисульфатом натрия. Этилацетатный раствор высушивают над безводным сульфатом натрия, выпаривают и хроматографируют на колонке с силикагелем (3 г, 230 - 400 меш.). Колонку элюируют смесью этилацетат:гексан. Искомый продукт при этом не является полностью чистым, поэтому его повторно хроматографируют в системе ацетон:гексан.
ЯМР ((CDCl3, TMS) : δ 0,86 (т. 3H), 1,15 (c., 3H), 1,27 (с., 3H), 1,29 (c. , 3H), 1,30 (c., 3H), 1,68 (c., 3H), 1,85 (с. + м., 4H), 2,25 (с. + м., 4H), 2,38 (с,., 3H), 2,53 (м., 2H), 3,37 (д., 1H), 3,80 (д., 1H), 4,17 (д., 1H), 4,30 (д. , 1H), 4,41 (м., 1H), 4,63 (м., 1H), 4,95 (д, 1H), 5,30 (м., 1H), 5,40 (м., 1H), 5,67 (д., 1H), 6,24 (м., 1H), 6,29 (с., 1H), 7,31 - 7,68 (м., 8H), 8,11 (д., 2H)
13C-ЯМР (CDCl3, TMS): 8,16; 9,53; 14,85; 20,85; 21,86; 22,61; 25,25; 25,71; 25,91; 26,73; 33,22; 35,42; 35,56; 43,18; 45,59; 56,05; 58,53; 72,14; 72,36, 73,57; 74,94; 75,55; 76,44; 79,03; 79,28; 81,05; 82,68; 84,37; 126,67; 128,05; 128,68; 128,84; 128,91; 130,16; 132,95; 133,69; 138,28; 142,28; 155,25; 167,03; 170,16; 171,27; 172,92; 203,66.
МС (FAB): (m + H)+ = 864. Большие ионы m/z 794, 569, 527, 509, 345, 327.
Препарат N 53:
Получение 13 -(β- фенил-изосеринил)-баккатин III N-неопентил- уретана (10UA)
Часть A:
Получение Неопентил 4-Нитрофенилкарбоната
Раствор неопентилового спирта (0,54 мл, 5,01 мМ), пиридина (1 мл), 4-нитрофенилхлорформата (1,00 г, 5,0 мМ) и перегнанного ТГФ (2 мл) в высушенной над огнем колбе перемешивают при комнатной температуре в течение 40 часов. Реакционную смесь разбавляют гексаном, фильтруют и выпаривают. Продукт хроматографируют на силикагеле с применением смеси этилацетат:гексан. Продукт, элюированный с колонки, подвергают затем перекристаллизации из смеси метиленхлорид:гексан.
ЯМР (CDCl3, TMS): δ 1,02 (с., 9H), 3,99 (с., 2H), 7,39 (д., 2H), 8,29 (д, 2H).
Часть Б:
20 мг (0,027 мМ) 13 -(β- фенил-изосеринил)-баккатина III (препарат N 24, 11A) и неопентил 4-нитрофенилкарбонат (7,4 мг, 0,031 мМ) в пиридине (80 мкл) перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют этилгептаном и промывают 5% водным раствором бисульфата натрия. Органический раствор высушивают над безводным сульфатом натрия и концентрируют. Неочищенный продукт дважды хроматографируют на силикагеле, вначале в системе ацетон:гексан, а затем в системе этилацетат:гексан, получая в итоге искомый продукт.
ЯМР (CDCl3, TMS) : δ/ 0,82 (c., 9H), 1,15 (с, 3H), 1,26 (с., 3H), 1,68 (с. , 3H), 1,84 (с. + м., 4H), 2,25 (с. + м., 4H), 2,38 (с., 3H), 2,52 (м., 2H), 3,40 (д, 1H), 3,61 (д, 1H), 3,72 (м., 1H), 3,79 (д., 1H), 4,18 (д, 1H), 4,29 (д. , 1H), 4,41 (м., 1H), 4,66 (м., 1H), 4,94 (д., 1H), 5,33 (м., 1H), 5,59 (м., 1H), 5,66 (д., 1H), 6,28 (с + м., 2H), 7,30 - 7,70 (м., 8H), 8,12 (д., 2H).
13C-ЯМР (CDCl3, TMS): 9,45, 14,74, 20,73, 21,79, 22,47, 26,09, 26,72, 31,32, 35,46, 43,05, 45,50, 45,38, 58,45, 72,03, 73,47, 74,57, 75,42, 76,36, 79,02, 81,00, 84,28, 126,61, 128,09, 128,58, 128,79, 128,96, 130,11, 132,97, 133,61, 138,10, 141,97, 156,30, 166,91, 170,23, 171,14, 172,47, 203,50.
MC (FAB):(m + H)+ = 864. Большие ионы m/z 569, 551, 509, 327, 296, 250.
Препарат N 54:
Получение 13 -(β- фенил-изосеринил)-баккатин III N-(2-хлор-1,1- диметилэтил)уретана (10SA)
ЧАСТЬ А:
Раствор 1-хлор-2-метил-2-пропанола (0,51 мл, 5,0 мМ), 4-нитрофенилхлорформата (0,999 г, 5,00 мМ), пиридина (400 мкл., 5,00 мМ) и ТГФ (2 мл) в сухой колбе перемешивают при комнатной температуре в течение 40 часов. Реакционную смесь разбавляют гексаном и фильтруют. Фильтрат выпаривают и перекристаллизовывают из смеси метиленхлорид: гексан, получая искомый продукт.
ЯМР (CDCl3, TMS): δ 1,64 (с., 6H), 3,87 (с., 2H), 7,38 (д., 2H), 8,28 (д., 2H)
ЧАСТЬ Б:
28 мг (0,037 мМ) 13 -(β- фенил-изосеринил)-баккатина III (препарат N 24, 11A) и хлор-t-бутил-4-нитрофенилкарбоната (12,0 мг, 0,044 мМ) в пиридине (0,10 мл) перемешивают при комнатной температуре в течение ночи. Затем реакционную смесь разбавляют этилацетатом и промывают 5% водным раствором бисульфата натрия. Органическую фазу высушивают над безводным сульфатом натрия и выпаривают. Грубый продукт чистят хроматографированием на колонке с силикагелем в системе ацетон:гексан.
ЯМР (CDCl3, TMS): δ 0,82 (с., 9H), 1,15 (с., 3H), 1,26 (с., 3H), 1,68 (с. , 3H), 1,84 (с. + м., 4H), 2,25 (с. + м., 4H), 2,38 (с., 3H), 2,52 (м., 2H), 3,40 (д, 1H), 3,61 (д., 1H), 3,72 (м., 1H), 3,79 (д., 1H), 4,18 (д., 1H), 4,29 (д., 1H), 4,41 (м., 1H), 4,66 (м., 1H), 4,94 (д., 1H), 5,33 (м., 1H), 5,59 (м., 1H), 5,66 (д., 1H), 6,28 (с. + и., 2H) 7,30 - 7,70 (м., 3H), 8,12 (д., 2H)
13C-ЯМР (CDCl3, TMS): 9,45, 14,74, 20,73, 21,79, 22,47, 26,09, 26,71, 31,32, 35,46, 43,05, 45,50, 56,38, 58,45, 72,03, 73,47, 74,57, 75,42, 76,36, 79,02, 81,00, 84, 28, 126,61, 128,09, 128,58, 128,79, 128,96, 130,11, 132,97, 133,61, 138,10, 141,97, 156,30, 166,91, 170,23, 171,14, 172,47, 203,50.
MC (FAB): (m + H)+ = 864. Большие ионы m/z 569, 551, 509, 327, 296, 250.
Препарат N 55:
Получение 13 -(β- фенил-изосеринил)-баккатин III N-(3-метил-3- пентил)уретана (10TA)
ЧАСТЬ А:
Получение 3-метил-3-пентил-4-нитрофенилкарбоната
Смесь 3-метил-3-пентанола (0,62 мл, 5,0 мМ), 4-нитрофенил хлорформата (1,01 г, 5,0 мМ), ТГФ (2 мл), пиридина (1 мл) перемешивают при комнатной температуре в течение 40 часов. Добавляют ацетонитрил (2 мл) и продолжают перемешивание в течение ночи. Затем реакционную смесь разбавляют метиленхлоридом и гексаном, фильтруют и выпаривают. Полученный продукт хроматографируют на силикагеле в смеси этилацетат: гексан.
ЯМР (CDCl3, TMS): δ 0,95 (т., 6H), 1,50 (с., 3H), 1,90 (м., 4H), 7,35 (д., 2H), 3,27 (д., 2H).
ЧАСТЬ Б:
32 мг (0,043 мМ) 13 -(β- фенил-изосеринил)-баккатина III (препарат N 24, 11A) и 3-метил-3-пентил-4-нитро-фенилкарбонат (12,5 мг, 0,047 мМ) в пиридине (0,15 мл) перемешивают при комнатной температуре в течение 60 часов. Затем реакционную смесь разбавляют аэтилацетатом, промывают 5% водным бисульфатом натрия, высушивают над безводным сульфатом натрия и выпаривают. Полученный продукт очищают хроматографированием на колонке с силикагелем в смеси ацетон:гексан.
ЯМР (CDCl3, TMS): δ 0,76 (т., 6H), 1,15 (с., 3H), 1,24 (с., 3H), 1,27 (с. , 3H), 1,50 - 1,98 (3с. + м., 12H), 2,25 (с. + м., 5H), 2,38 (с., 3H), 2,53 (м., 2H), 3,37 (шс., 1H), 3,80 (д., 1H), 4,17 (д., 1H), 4,30 ( д., 1H), 4,41 (м. , 1H), 4,64 (м., 1H), 4,95 (д., 1H), 5,29 (м., 1H), 5,42 (м., 1H), 5,66 (д., 1H), 6,24 (м., 1H), 6,29 (с., 1H), 7,30 - 7,70 (м., 8H), 8,11 (д., 2H).
13C-ЯМР (CDCl3, TMS): 7,61, 9,27, 14,58, 20,58, 21,63, 22,35, 22,58, 26,46, 30,18, 30,26, 35,15, 35,29, 42,91, 45,31, 55,68, 58,26, 71,88, 72,13, 73,27, 74,71, 75,29, 76,31, 78,78, 80,79, 84,10, 84,95, 126,38, 127,77, 128,41, 128,58, 128,81, 129,90, 132,71, 133,41, 138,06, 142,03, 154,86, 166,70, 169,88, 171,00, 172,68, 203,40.
MC (FAB): (m + H)+ = 878. Большие ионы m/z 794, 569, 527, 509, 345, 327.
Препарат N 56:
Получение метилового эфира N-(t-бутиламинокарбонил) -β- фенилизосерин (ЗK)
Метиловый эфир (2R,3S) -β- фенил-изосерина (4,35 г, 22 мМ) растворяют в 100 мл сухого ТГФ и охлаждают колбу до 0oC. К раствору добавляют t-бутилизоцианат (2,8 мл, 25 мМ). Через 15 минут ТСХ показывает присутствие некоторого количества исходного материала, в связи с чем добавляют еще 0,5 мл изоцианата. Через 1 час ТСХ уже не обнаруживает в реакционном растворе исходного материала, так что раствор концентрируют в вакууме, получая метиловый эфир N-(t-бутиламинокарбонил) -β- фенилизосерина (3K).
Протонный ЯМР (CDCl3, TMS) : δ 1,27 (с., 9H), 3,43 (д., 1H), 3,81 (с., 3H), 4,34 (шс., 1H), 4,48 (м., 1H), 5,27 (м, 1H), 5,32 (м., 1H), 7,29 (м., 29), 7,34 (м., 3H).
Масс-спектр (FAB-высокое разрешение)
Рассчитано для C15H22N2O4 + H : 295, 1658
Найдено: 295, 1663.
Препарат N 57:
Получение метилового эфира (4S,5R)-N-(t-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-оксазолидин- карбоновой кислоты (5Ka и 5Kb)
Метиловый эфир N-(t-бутиламинокарбонил) -β- фенил-изосерина (68 мг, 0,23 мМ, 3K, препарат N 56) растворяют в 5 мл сухого Т ГФ, обрабатывают полученный раствор диметилацеталем 2,4-диметоксибензальдегида (70 мг, 0,33 мМ) и n-толуолсульфонатом пиридиния (6 мг, 0,02 мМ) и нагревают смесь до кипения с обратным холодильником. В течение 45 минут три раза удаляют кипячением примерно по 2 мл растворителя, каждый раз добавляя по 2 мл свежего ТГФ, к этому времени ТСХ не обнаруживает в растворе стартовых материалов. Раствор концентрируют в вакууме и хроматографируют на колонке с 7 г силикагеля в смеси 1:3 EtOAc: гексан. Колонку элюируют с использованием 80 мл 1:3 EtOAc: гексан, 45 мл 1:2 EtOAc:гексан, 35 мл 2:3 EtOAc:гексан и 30 мл 1:1 EtOAc: гексан, собирая фракции объемом 3 мл.
Менее полярный изомер - метиловый эфир (4S,5R)-N-(t- бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (5Ka) - обнаруживают во фракциях 21 - 31.
Протонный ЯМР (CDCl3, TMS): δ 1,19 (с., 9H), 3,82 (с., 3H), 3,85 (с., 3H), 3,89 (с., 3H), 4,68 (шс., 1H), 4,88 (д, 1H), 5,52 (д., 1H), 6,46 (м.), 6,70 (с., 1H), 7,25 - 7,50 (м.).
Масс-спектр (FAB-высокое разрешение)
Рассчитано для C24H31N2O6 + H: 443,2182
Найдено: 443,2172
Более полярный изомер - метиловый эфир (4S, 5R)-N-(t - бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (5Kb) - обнаруживают во фракциях 33 - 42.
Протонный ЯМР (CDCl3, TMS): δ 0,99 (м., 9H), 3,53 (м., 3H), 3,81 (м., 3H), 3,38 (м., 3H), 4,05 (м., 1H), 4,55 (м., 1H), 5,45 (м., 1H), 6,48 (м., 2H), 6,79 (м., 1H), 7,25 - 7,50 (м.).
Масс-спектр (FAB-высокое разрешение)
Рассчитано для C24H31N2O6 + H: 443, 2182
Найдено: 443, 2180
Препарат N 58:
Получение калиевой соли (4S,5R)-N-(t-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (6Ka) и ее свободной кислоты (7Ka)
100 мг (0,23 мМ) менее полярного изомера метилового эфира (4S,5R)-N-(t-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (препарат N 57, 5Ka) перемешивают при комнатной температуре в атмосфере азота в 3 мл MeOH. К этой смеси добавляют 0,1 мл воды и 43 мг (0,31 мМ) карбоната калия. Через 1 час данные TCX показывают отсутствие исходного материала. В течение ночи смесь выдерживают в морозильной камере. На следующее утро растворитель выпаривают, получая калиевую соль (4S,5R)-N-(t-бутил-аминокарбонил)-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (6Ka).
Протонный ЯМР (d6-DMSO): δ 1,20 (с., 9H), 3,51 (с, 1H), 3,76 (с., 3H), 3,96 (с., 3H), 4,32 (д., 2H), 4,80 (с., 1H), 5,29 (д., 1H), 6,60 - 6,68 (м., 2H), 6,71 (д. , 1H), 7,26 (д., 1H), 7,35 (5, 1H), 7,45 (т., 2H), 7,53 (д., 2H).
Препарат N 59:
Получение (4S, 5R)-N-(t-бутиламинокарбонил)-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (7Ka)
Калиевую соль (4S, 5R)-N-(t-бутиламинокарбонил)-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (6Ka, препарат 58) распределяют между фазами метиленхлорида и воды, содержащей 0,9 мл IN HCl. Слои разделяют и водную фазу подвергают повторной экстракции метиленхлоридом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают. В результате получают (4S,5R)-N-(t-бутиламинокарбонил)-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновую кислоту (7Ka) в виде белого твердого вещества.
Препарат N 60:
Получение эфира 7-ТЭС-баккатин 111-13-(4S, 5R)-N-(t- бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (9KaA)
(4S, 5R)-N-(t-бутиламинокарбонил)-2-(2,4-диметоксифенил)- 4-фенил-5-оксазолидинкарбоновую кислоту (1,07 мМ, препарат 59, 7Ka) растворяют в смеси 1,5 мл метиленхлорида и 3 мл толуола. К полученной смеси добавляют 7-ТЭС-баккатин III (500 мг, 0,71 мМ, 8A), ДМАП (45 мг, 0,36 мМ) и ДЦК (240 мг, 1,15 мМ). Реакционную смесь перемешивают в атмосфере азота в течение 1 часа при комнатной температуре. Образовавшийся побочный продукт в виде мочевины удаляют фильтрованием, а фильтрат выпаривают под вакуумом. Остаток хроматографируют на силикагеле (80 г), элюируя его последовательно смесями 25:75 EtOAc:гексан (200 мл) и 33:67 EtOAc:гексан (1 л). Фракции объемом 20 мл собирают и анализируют с помощью TCX. Фракции 28 - 47, содержащие искомый продукт, объединяют и выпаривают. Эфир 7-ТЭС-баккатин 111-13-(4S,5R)-N-(t-бутиламинокарбонил)-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9KaA) получают в виде белого твердого вещества.
Масс-спектр (FAB, M + H):
Рассчитано для C60H79N2O16Si: 1111, 5198,
Найдено: 1111, 5189.
Препарат N 61:
Получение 13-(N-(t-бутиламинокарбонил) -β- фенилизосеринил) -баккатина III; N-дебензоил-N-(t-бутил)аминокарбонилтаксола;
13 -(β- фенилизосеринил)-баккатин III N-t-бутилмочевины (10KA)
Раствор 0,1M HCl готовят из 0,071 мл ацетилхлорида и 9,929 мл MeOH, выдерживая смесь 30 минут перед использованием.
Эфир 7-ТЭС-баккатин III-13-(3S,6R)-N-(t-бутиламинокарбонил)- 2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (100 мг, препарат 60, 9KaA) обрабатывают вышеупомянутым метанольным раствором HCl (0,5 мл) при перемешивании в атмосфере азота. Как показывают данные TCX, через 45 минут реакция полностью завершается. Реакционную смесь распределяют между фазами этилацетата и 5% бикарбоната натрия. Слои разделяют и водную фазу повторно экстрагируют этилацетатом. Органические экстракты объединяют, высушивают над сульфатом натрия и выпаривают под вакуумом.
Неочищенный продукт хроматографируют на силикагеле (8 г), элюируя последовательно смесью 33: 67 ацетон:гексан (70 мл) и 40:60 ацетон:гексан (35 мл). Фракции объемом 2 мл собирают и анализируют с помощью TCX. Чистый продукт обнаруживают во фракциях 18 - 29, которые объединяют и выпаривают. 13-(N-(t-бутиламинокарбонил) -β- фенил-изосеринил)-баккатин III (10Ka) получают в виде белого твердого вещества. Его физические характеристики соответствуют данным, полученным ранее для препарата N 46.
ПРЕПАРАТ 1A
2'-[{(2,2,2-Трихлорэтил)окси}карбонил]-таксол, 7-Метилксантат
Иодистый метил (1,3 эквивалента) добавляют к хорошо перемешанному раствору 2'-[{ (2,2,2-трихлорэтил)окси} карбонил] -таксола (1 эквивалент) в дисульфиде углерода. Затем добавляют гидрид натрия (2,1 эквивалента) и перемешивают полученную смесь, контролируя образованием метилксантата с помощью TCX. По завершении реакции избыток дисульфида углерода и иодистого метила удаляют путем выпаривания. Полученный остаток распределяют между водой и эфиром, слои разделяют, органический слой высушивают, фильтруют и концентрируют, получая искомое соединение.
ПРЕПАРАТ 2A
2'-[{(2,2,2-Трихлорэтил)окси}карбонил]-таксол, 7-Метансульфонат
Метансульфонилхлорид (1,2 эквивалента) прибавляют по каплям к раствору 2'-[{ (2,2,2-трихлорэтил)окси} карбонил]таксола (1 эквивалент) и пиридина (5 эквивалентов) в CH2Cl2, который перемешивают на ледяной бане. Затем реакционную смесь переносят в тепло и продолжают перемешивать до тех пор, пока данные TCX не покажут, что реакция полностью завершена. Реакционную смесь охлаждают в ледяной воде и экстрагируют CH2Cl2, эти экстракты последовательно промывают разбавленной водой кислотой, разбавленным водным NaHCO и водой, а затем высушивают, фильтруют и концентрируют, получая грубый продукт реакции. Хроматографирование грубого продукта на силикагеле дает чистый целевой продукт.
ПРЕПАРАТ 3A
2'-[{(2,2,2-Трихлорэтил)окси]карбонил]-таксол, 7-Трифторметилсульфонат
Трифторметансульфоновый ангидрид (1,3 эквивалента) прибавляют по каплям к раствору 2'-[{(2,2,2-трихлорэтил)-окси}карбонил]таксола (1 т эквивалент) в пиридине, который перемешивают и охлаждают до -30oC. Затем реакционную смесь переносят в тепло и продолжают перемешивать до тех пор, пока данные TCX не покажут, что реакция полностью завершена. Реакционную смесь охлаждают в ледяной воде и экстрагируют CHCl2. CH2Cl2-Экстракты последовательно промывают холодной разбавленной водой кислотой, разбавленным водным NaHCO и водой, a затем высушивают, фильтруют и концентрируют, получая грубый продукт реакции. Хроматографирование грубого продукта на силикагеле дает чистый целевой продукт.
ПРЕПАРАТ 4A
2'-[{(2,2,2-Трихлорэтил)окси}карбонил]-7-дезокси-7-азидотаксол
Раствор 2'-[{ (2,2,2-трихлорэтил)окси} карбонил] -таксола, 7-трифторметилсульфоната (1 эквивалент) и 18-краун-6 (1 эквивалент) N,N-диметилпропиленмочевины перемешивают с азидом калия (10 эквивалентов). Смесь перемешивают и нагревают до тех пор, пока данные TCX не подтвердят завершение реакции. Реакционную смесь охлаждают в ледяной воде и экстрагируют эфиром. Эфирный экстракт тщательно промывают водой, высушивают, фильтруют и концентрируют, получая грубый продукт реакции. Хромтографирование грубого продукта на силикагеле дает чистый целевой продукт.
ПРЕПАРАТ 5A
2'-[{(2,2,2-Трихлорэтил)окси}карбонил]-7-дезокси-7-аминотаксол
Раствор 2'-[{(2,2,2-трихлорэтил)окси}карбонил]-7-дезокси-7- азидотаксола в этаноле перемешивают с 10% палладием-на-угле в качестве катализатора в атмосфере водорода. По окончании реакции катализатор удаляют фильтрованием, а фильтрат концентрируют с получением грубого продукта реакции. Хроматографирование грубого продукта на силикагеле дает чистое целевое соединение.
ПРЕПАРАТ 6A
Получение N-Дезбензоил-N-бензилоксикарбонил-2'-[{ (2,2,2- трихлорэтил)окси} карбонил] -таксол, ((Эфир  (Бензилоксикарбониламино) -α- { [(2,2,2-трихлорэтокси)-карбонил] окси}бензолпропионовая кислота, 6,12b-Бис-(ацетилокси)-12- (бензоилокси)-2a,3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро- 4,11-дигидрокси-4a,8,13,13-тетраметил-5-оксо-7,11-метано- 1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила)) (12BA), и
(Бензилоксикарбониламино) -α- { [(2,2,2-трихлорэтокси)-карбонил] окси}бензолпропионовая кислота, 6,12b-Бис-(ацетилокси)-12- (бензоилокси)-2a,3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро- 4,11-дигидрокси-4a,8,13,13-тетраметил-5-оксо-7,11-метано- 1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила)) (12BA), и
N-Дезбензоил-N-бензилоксикарбонил-2', 7-бис{ [(2,2,2- трихлорэтил)окси] карбонил}-таксол, ((эфир {2αR-[2aα,4β,4aβ, 6β,9α,(αR*,βS*),11α,12α,12aα,12ba]}-β- (бензилоксикарбониламино) -α- { [(2,2,2-трихлорэтокси)- карбонил} окси]бензолпропионовая кислота, 6, 12-b-Бис(ацетилокси)-12-(бензоилокси)-4-{ [(трихлорэтокси)карбонил] окси} - 2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро-11-гидрокси- 4a,8,13,13-тетраметил-5-оксо-7,11-метано-1H-циклодека[3,4]бенз[1,2-b]- оксет-9-ила)).
Процедура проводится по методике, описанной для получения 2'-трок-таксола [Magri et al., J. Org. Chem., 1986, 51, 797], с использованием N-дезбензоил-N-бензилоксикарбонилтаксола (0,290 г, 0,328 мМ) и 2,2,2-трихлорэтилхлорформата (59 мкл, 0,091 г, 0,43 мМ) и (CH2Cl2 (11 мл), содержащем пиридин (1,6 мл). Следуя данной процедуре, получают грубый продукт (0,340 г), который хроматографируют на силикагеле (40-63 мкм, колонка Мерк, размер B) с использованием CH2Cl2-раствора для нанесения материала на колонку и смесей 40% EtOAc:гексан (90 фракций), 60% EtOAc:гексан (30 фракций) и EtOAc для элюирования с колонки (собирают фракции объемом 8 мл). N-Дезбензоил-N-бензилоксикарбонил-2', 7-бистрокстаксол (0,053 г, 13%) элюируется во фракциях 14-23. Исходный материал (0,014 г, 5%) выходит во фракциях 139-143. Искомый N-Дезбензоил-N-бензилоксикарбонил-2'-трок-таксол 12BA (0,248 г, 0,234 мМ, 71%) элюируется во фракциях 49-80 и характеризуется следующими спектральными данными:
1H ЯМР (CDCl3, TMS): δ 8,15 (д., 2H, ароматический), 7,62 (т., 1H, ароматический), 7,52 (т. , 2H, ароматический), 7,30-7,50 (м., 5H, ароматический), 7,17 (м. , 2H, ароматический), 6,26 (м., 1H, H13), 6,25 (с., 1H, H10), 5,71 (м., 1H, -NH-), 5,67 (д., 1H, H2), 5,58 (м., 1H, H3), 5,41 (д., 1H, H2), 5,08 (д. , 1H, PhCHaHO-); 4,96 (д., 1H, PhCHHbO-), 4,94 (м., 1H, H5), 4,79 (д., 1H, -OCHaHCCl3), 4,68 (д., 1H, J = 11,8 Гц, -OCHHbCCl3), 4,42 (м. , 1H, H7), 4,31 (д., 1H, H20a), 4,18 (д., 1H, H20b), 3,78 (д., 1H, H3), 2,55 (м., 1H, H6a), 2,47 (м., 1H, H14a), 2,45 (с., 3H, -CH3), 2,31 (м., 1H, H14), 2,24 (с., 3H, -CH3), 1,92(м., 1H, H6b), 1,86 (с., 3H, -CH3), 1,68 (с., 3H, -CH3), 1,23 (с., 3H, -CH3), 1,14 (с., 3H, -CH3),
масс-спектр 1058, 569, 551, 509, 105, 91 m/z.
Препарат 7A
10-Деацетилтаксол
Раствор таксола (0,026 г, 0,030 мМ) и 98% гидразина (0,035 г, 1,1 мМ) в 95% этаноле (1,0 мл) перемешивают при комнатной температуре в течение 2 часов. Этот раствор вливают в смесь воды и эфира, хорошо перемешивают и разделяют слои. Водную фазу экстрагируют дополнительной порцией эфира. Объединенные эфирные экстракты высушивают над Na2SO4, фильтруют и концентрируют, получая 0,021 г целевого соединения:
1H ЯМР спектр в CDCl3 идентичен спектру, полученному для 10-деацетилтаксола (Ringel, I.; Horwitz, S.B. J. Pharmacol. Exp. Ther., 1987, 242, 692) и идентичен спектру аутентичного образца.
Препарат 8A
10-Деацетилбаккатин III
Раствор баккатина III (0,024 г, 0,041 мМ) в 95% этаноле (1,0 мл) готовят при нагревании смеси. Затем раствор охлаждают до комнатной температуры, добавляют 98% гидразин (0,035 г, 1,1 мМ) и перемешивают смесь при комнатной температуре в течение 24 часов. Раствор вливают в смесь вода/эфир, хорошо перемешивают и разделяют слои. Эфирный слой промывают водой, высушивают (Na2SO4) фильтруют и концентрируют, получая 0,010 г целевого соединения:
1H ЯМР спектр в CDCl3 (умеренно растворим) идентичен спектру аутентичного образца 10-деацетилбаккатина III.
Препарат 10A
N-Дебензоил-N-[{(2,2,2-трихлорэтил)окси]карбонил}-2'-триэтилсилилтаксол
N-Дебензоил-N-[{ (2,2,2-трихлорэтил)окси] карбонил} -таксол ((13-[N-(2,2,2-трихлорэтоксикарбонил) -β- фенилизосеринил] -баккатин III, 10DA, препарат 28)) подвергается селективному введению силильных групп посредством реакции с триэтилсилилхлоридом в пиридине, содержащем 4-диметиламинопиридин в количестве, необходимом для катализа. Реакционную смесь вливают в холодную воду и экстрагируют CH2Cl2. Экстракт высушивают, фильтруют, концентрируют и чистят грубый продукт хроматографированием на силикагеле, получая чистое целевое соединение.
Препарат 13A
N-Дебензоил-N-(t-бутил)оксикарбонил-2'-{ [(2,2,2- трихлорэтил)окси]карбонил}таксол A (Соединение 12DA), ((Эфир  { [(2,2,2-трихлорэтокси)карбонил] окси} бензолпропионовая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b- додекагидро-4,11-дигидрокси-4a,8,13,13-тетраметил-5-оксо-7,11-метано-1H- циклодека[3,4]бенз[1,2-b]-оксет-9-ила)), и N-Дебензоил-N-(t- бутил)оксикарбонил-2', 7-бис{ [(2,2,2-трихлор-этил)окси]карбонил}-таксол ((Эфир
{ [(2,2,2-трихлорэтокси)карбонил] окси} бензолпропионовая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b- додекагидро-4,11-дигидрокси-4a,8,13,13-тетраметил-5-оксо-7,11-метано-1H- циклодека[3,4]бенз[1,2-b]-оксет-9-ила)), и N-Дебензоил-N-(t- бутил)оксикарбонил-2', 7-бис{ [(2,2,2-трихлор-этил)окси]карбонил}-таксол ((Эфир  [{ (2,2,2-трихлорэтокси)карбонил} -окси] бензолпропионовая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-4-{[(трихлорэтокси) карбонил]окси}-2a,3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро-11-гидрокси- 4a, 8,13,13-тетраметил-5-оксо-7,11-метано-1H-циклодека[3,4]бенз[1,2-b]- оксет-9-ила)).
[{ (2,2,2-трихлорэтокси)карбонил} -окси] бензолпропионовая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-4-{[(трихлорэтокси) карбонил]окси}-2a,3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро-11-гидрокси- 4a, 8,13,13-тетраметил-5-оксо-7,11-метано-1H-циклодека[3,4]бенз[1,2-b]- оксет-9-ила)).
Примеряя процедуру получения препарат 2'-трок-таксола (Magri et. al., J. Org. Chem., 1986, 51, 797), но начиная ее с N-Дебензоил-N-(t-бутил)оксикарбонилтаксола (соединение 10BA, 1,98 г, 2,33 мМ) и 2,2,2-трихлорэтилхлорформата (405 мкл, 0,622 г, 2,94 мМ) в CH2Cl2 (80 мл), получают продукт 12DA. Следуя методике, получают грубый продукт, который хроматографируют на силикагеле 40-63 мкм, 37 х 350 мм, 190 г), используя CH2Cl2-раствор для нанесения материала на колонку и 40% EtOAc:гексан (63 фракции), а затем 75% EtOAc: гексан для элюирования продуктов с колонки (собирают фракции объемом 45 мл). N-Дебензоил-N-(t-бутил)оксикарбонил-2', 7-бистрок-таксол (0,140 г) элюируется во фракции 6. Исходный материал (0,192 г) обнаруживают во фракциях 70-78. Искомый N-Дебензоил-N-(t-бутил)оксикарбонил-2'-трок-таксол (Соединение 12DA) элюируется во фракциях 18-38 и характеризуется следующими спектральными данными:
1H ЯМР (CDCl3, TMS): δ 8,12 (д., 2H, J = 8,1 Гц), 7,62 (т., 1H, J = 7,2 Гц), 7,51 (т., 2H, J = 7,7 Гц), 7,30-7,44 (м., 5H), 6,30 (с., 1H, H10), 6,30 (т. , 1H, H13), 5,68 (д., 1H, J = 7,1 Гц, H2), 5,48 (д., 1H, -NH- или H3), 5,44 (д., 1H, H3 или -NH-), 5,36 (д., 1H,J = 2,2 Гц, H2), 4,98 (д., 1H, J = 9,3 Гц, H5), 4,79 (д., 2H, J = 11,9 Гц, 2'-трок-Ha), 4,70 (д., 2H, J = 11,8 Гц, 2'-трок-Hb), 4,44 (м., 1H, H7), 4,32 (д., 1H, J = 8,4 Гц, H20a), 4,18 (д., 1H, J = 8,4 Гц, H20b), 3,82 (д., 1H, J = 6,8 Гц, H3).
Препарат 14A
2'-Триэтилсилил-таксол, 7-метилксантат
500 мг (0,52 мМ) 2'-Триэтилсилил-таксола растворяют в 5 мл перегнанного ТГФ. К раствору добавляют 50 мкл (0,80 мМ) иодистого метила и 155 мкл (2,58 мм) сероуглерода. Готовят кашицеобразную массу из 40 мг (60%-ный гидрид натрия в масле) в перегнанном ТГФ и примерно половину ее прибавляют в реакционную смесь, которую перемешивают и с помощью ТСХ проверяют на образование метилксантата. Через 0,5 часа остаток распределяют между насыщенным раствором NH4Cl и EtOAc, слои разделяют, органическую фазу фильтруют через Na2SO4 и концентрируют с получением целевого соединения. Продукт чистят с помощью колоночной хроматографии, используя 60 г силикагеля в системе 1:4 EtOAc: гексан. Продукт наносят, применяя метиленхлорид, и элюируют колонку последовательно 400 мл 1:4, 400 мл 1:3 и 300 мл 1:2 смеси EtOAc:гексан. Фракции, содержащие продукт, определяют с помощью ТСХ, объединяют и выпаривают, получая 2'-Триэтилсилил-таксол, 7-метилксантат в виде белого твердого вещества.
ТСХ: силикагель 60; 33% EtOAc: 67% гексан, Rf: 0,40.
1H ЯМР (CDCl3, TMS): δ 0,44 (м., 6H), 0,81 (м.), 1,19 (с., 3H), 1,22 (с. , 3H), 2,16 (с., 3H), 2,48 (с., 3H), 2,58 (с., 3H), 2,94 (м., 1H), 4,03 (д., 1H), 4,25 (д., 1H), 4,37 (д., 1H), 4,70 (с., 1H), 5,00 (д., 1H), 5,73 (м., 2H), 6,28 (м., 1H), 6,32 (с., 1H), 6,40 (м., 1H), 7,11 (д., 1H), 7,30-7,65 (м.), 7,75 (д., 2H), 8,15 (д., 2H).
Препарат 15A
2'-Таксол 7-Трифлат
Раствор 2'-Триэтилсилилтаксола [0,10 г, Chaudhary et al., J. Org. Chem., 1993, 58, 3798] и сухого пиридина (0,29 мл) в CH2Cl2 (4 мл) охлаждают до температуры -20oC и добавляют трифлевый ангидрид (0,17 мл). Раствор перемешивают и подогревают до температуры примерно -10oC. Через 3 часа добавляют насыщенный NH4Cl и экстрагируют смесь, используя EtOAc. Органический экстракт промывают разбавленным водным NaHSO4, насыщенным раствором NAHCO, высушивают над Na2SO4, фильтруют и концентрируют при комнатной температуре. Грубый продукт реакции хроматографируют на силикагеле (флэш-хроматография), используя 30% EtOAc в гексане для элюции колонки и собирая фракции объемом 5 мл. Фракции (4-10), содержащие искомый продукт, объединяют, получая целевое соединение (0,094 г.).
Препарат 16A
Баккатин III 7-O-трифлат (24)
Раствор баккатина III (5,25 г, 8,93 мМ) в CH2Cl2 (21 мл) и пиридине (18,1 мл) охлаждают в бане с температурой -30oC. Добавляют трифторметансульфоновый ангидрид (3,76 мл, 6,31 г, 22,3 мМ) и перемешивают полученную смесь, позволяя ей нагреться до комнатной температуры в течение часа. Через 4 часа реакция полностью завершается, после этого добавляют насыщенный водный NH4Cl (50 мл) и экстрагируют реакционную смесь с помощью CH2Cl2. Органический экстракт последовательно промывают 1 М водным NaHSO4 (50 мл), насыщенным водным NaHCO3 (2х50 мл) и насыщенным водным NaCl, высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении. Следует принять меры, препятствующие нагреванию раствора до температуры выше 40oC в процессе удаления растворителя. В итоге получают желтый твердый продукт, который подвергают флэш-хроматографированию на силикагеле (6'' силикагеля в 75 мм колонке, фракции по 125 мл). Материал наносят на колонку в растворе CH2Cl2 и элюируют с колонки 5% CH3CN : CH2Cl2. Фракции 19-35 содержат искомый баккатин III 7-0-трифлат (4,837 г, 6,71 мМ, 75%) в виде белого твердого вещества.
1H ЯМР (CDCl3, TMS): δ 8,10 (д., 2H, J = 7,2 Гц), 7,63 (т., 1H, J = 7,4 Гц), 7,49 (т., 2H, J = 7,6 Гц), 6,63(с., 1H, H10), 5,68 (д., 1H, J = 7,0 Гц, H2), 5,52 (дд., 1H, J = 7,5 Гц, 10,1 Гц, H7, 4,94 (д., 1H, J = 8,4 Гц, H5), 4,86 (м. , 1H, H3), 4,35 (д., 1H, J = 8,4 Гц, H20a), 4,15 (д., 1H, J = 8,4 Гц, H20b), 4,01 (д., 1H, J = 7,0 Гц, H3), 2,87 (5 линий, H14a), 2,30 (с., 3H, -CH3), 2,20 (с., 3H, -CH3), 2,10 - 2,30 (м., H6a, H6b, H14b), 1,87 (с., 3H, -CH3), 1,59 (с., 3H, -CH3), 1,19 (с., 3H, -CH3), 1,05 (с., 3H, -CH3).
Препарат 18A
7-Дезокси -7β,8β- метано-баккатин III (26)
Раствор 7-трифторметансульфонил-баккатина III (24,87 мг, 0,12 мМ) в перегнанном диоксане (1,5 мл) обрабатывают водным раствором азида натрия (0,10 г, 1,5 мМ NaN3 в 0,30 мл воды). Реакционную смесь кипятят с обратным холодильником в атмосфере азота в течение одного часа. Затем смесь разбавляют этилацетатом, промывают водой и солевым раствором, высушивают над безводным сульфатом натрия и выпаривают. Полученный продукт чистят хроматографирвоанием на колонке с силикагелем 60 смесью 25% этилацетат : метиленхлорид, получая 56% выход (39 мг) белого кристаллического 7-Дезокси -7β,8β- метано-баккатина III.
ЯМР (CDCl3, TMS): δ 1,10 (с, 3H), 1,22 (с, 3H), 1,35 (м, 1H), 1,64 (м, 1H), 1,78 (с, 1H), 2,03 (с. + м., 4H), 2,21 (с, 3H), 2,26 (с, 3H), 2,20 - 2,55 (м, 5H), 4,04 (д., 1H, J = 8,5 Гц), 4,18 (д., 1H, J = 7,5 Гц), 4,30 (д. , 1H, J = 8,5 Гц), 4,74 (д., 1H), 4,83 (м., 1H), 5,63 (д., 1H, J = 7,5 Гц), 6,35 (с, 1H), 7,49 (м, 2H), 7,62 (м, 1H), 8,13 (м, 2H).
13C-ЯМР (CDCl3, TMS): 15,15, 15,28, 20,43, 20,82, 21,99, 25,90, 26,35, 31,63, 35,19, 38,57, 42,20, 67,51, 75,30, 76,20, 76,49, 79,23, 79,91, 84,73, 128,50, 129,33, 129,99, 132,59, 133,54, 144,19, 167,20, 169,63, 170,00, 202,08.
Препарат 19A
7-Дезокси -7α- азидо-баккатин III (27)
Смесь 7-трифторметансульфонил-баккатина III (24,102 мг, 0,14 мМ), азида натрия (13 мг, 0,20 мМ) и 18-краунсоединения-6 (32 мг, 0,12 мМ) в 13-диметил-3,4,5,6-тетрагидро-2(1H)-пиридиноне (1,0 мл) перемешивают при комнатной температуре в течение ночи в атмосфере инертного газа. Реакционную смесь распределяют между этилацетатом и водой. Органическую фазу высушивают над безводным сульфатом натрия и выпаривают. Грубый продукт чистят хроматографированием на колонке с силикагелем 60 в смеси 15% этилацетат : метиленхлорид. Далее продукт чистят путем кристаллизации из смеси метиленхлорид : гексан, получая 37 мг 7-дезокси- 7альфа- азидо-баккатина III.
ЯМР (DMCO-d6, TMS): δ 0,96 (с., 6H), 1,59 (с., 3H), 1,91 (с., 3H), 2,13 (с., 3H), 2,25 (с., 3H), 2,10 - 2,35 (м., 4H), 2,47 (м., 1H), 3,60 (м., 2H), 4,07 (д. , 1H, J = 8,0 Гц), 4,33 (д., 1H, J = 8,0 Гц), 4,60 (с. + м., 2H), 4,99 (дд. , 1H), 5,35 (д., 1H), 5,48 (д., 1H, J = 7,2 Гц), 6,79 (с., 1H), 7,59 (м., 2H), 7,69 (м., 1H), 8,05 (м., 2H).
13C-ЯМР (DMCO-d6, TMS): 15,40, 17,31, 20,67, 22,20, 25,93, 29,81, 39,22, 40,63, 41,73, 55,57, 64,28, 65,91, 75,33, 76,91, 77,33, 78,22, 80,44, 80,94, 128,77, 129,58, 129,98, 130,28, 133,33, 145,43, 165,30, 168,75, 169,09, 207,11.
Приводимые ниже примеры продолжают иллюстрировать объект настоящего изобретения.
Пример 1.
Получение: 2'{[(2,2,2-Трихлорэтил)-окси]карбонил}-7-дезокси-7- фтортаксола (соединение 13AA, 111a), ((Эфира {2aR[2a,альфа  {[(2,2,2- трихлорэтокси)карбонил]-окси} бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a,3,4,4a, 5,6,9,10,11, -12,12a,12b-додекагидро-4-фтор-11-гидрокси-4a,8,13, 13-тетраметил-5-оксо-7,11-метано-1H-циклодека[3,4]бенз[1,2-b]-оксет-9- ила)), и
{[(2,2,2- трихлорэтокси)карбонил]-окси} бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a,3,4,4a, 5,6,9,10,11, -12,12a,12b-додекагидро-4-фтор-11-гидрокси-4a,8,13, 13-тетраметил-5-оксо-7,11-метано-1H-циклодека[3,4]бенз[1,2-b]-оксет-9- ила)), и
2'{ [(2,2,2-трихлорэтил)-окси] карбонил}-7-дезокси -7β,8β- метанотаксола (соединение 14AA), ((Эфира  { [(2,2,2- трихлорэтокси)карбонил] -окси} бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9-, 10,11, 12,12a,12b-додекагидро-11-гидрокси-8,13, 13-триметил-5-оксо-4,4a,7,11-бисметано-1H-циклодека[3,4]бенз [1,2-b]-оксет-9-ила)).
{ [(2,2,2- трихлорэтокси)карбонил] -окси} бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9-, 10,11, 12,12a,12b-додекагидро-11-гидрокси-8,13, 13-триметил-5-оксо-4,4a,7,11-бисметано-1H-циклодека[3,4]бенз [1,2-b]-оксет-9-ила)).
Диметиламиносульфуртрифторид (метилДАСТ) (250 мкл, 0,340 г, 2,56 мМ) с помощью шприца быстро вводят в хорошо перемешиваемый и охлажденный (баня со смесью ацетон-сухой лед) раствор 2'-{[(2,2,2-трихлорметил)карбонил}таксола 12AA [Magri, N.F.; Kingston, D.G.I. J. Org. Chem., 1986, 51, 797] (1,60 г, 1,55 мМ) в CH2Cl2 (180 мл). Охлаждающую баню убирают и позволяют реакционной смеси нагреться до комнатной температуры. Реакционную смесь продолжают перемешивать и через 70 минут результаты ТСХ показывают, что исходный материал практически полностью израсходован. Реакцию останавливают добавлением воды и переносят реакционную смесь в делительную воронку, используя дополнительную порцию CH2Cl2. Слои разделяют, органическую фазу один раз промывают водой, высушивают (Na2SO4), фильтруют и концентрируют, получая белое твердое вещество (1,65 г). Остаток хроматографируют на силикагеле (40-63 мкм, 195 г в колонке 3,7 х 35 см, фракции объемом 40 мл), используя для нанесения материала на колонку CH2Cl2 раствор, а для элюирования с колонки 25% ацетон в гексане.
Фракции 32-39 содержат смесь по крайней мере двух соединений.
Фракции 40-42 содержат смесь, которая может включать некоторые соединения 14AA.
Фракции 43-49 (0,391 г) содержат прежде всего соединение 14AA (Rf = 0,22 в смеси 30% ацетон:гексан) вместе с двумя минорными компонентами.
Фракции 50-54 содержат 0,162 г смеси 14AA и 13AA. Эту смесь хроматографируют на силикагеле (колонка Merck Lobar®, размер 8, фракции объемом 8 мл), используя CH2Cl2 для нанесения на колонку и смесь 25% ацетон:гексан для элюирования с колонки. Фракции 58-70, содержащие 0,056 г 14AA, объединяют (пул A) с вышеупомянутыми (0,391 г) фракциями 43-49 (общее содержание 0,447 г), фракции же 76-92 содержат 0,053 г 13AA.
Один из двух минорных компонентов пула A отделяют и получают в виде чистого соединения повторным хроматографированием на силикагеле (две колонки Merck Lobar®, размер B, фракции объемом 9 мл). Смесь наносят на колонку в CH2Cl2, а элюируют с колонки растворами 25% EtOAc:гексан до фракции 72, 30% EtOAc: гексан до фракции 180 и 40% EtOAc:гексан далее до окончания элюции.
Фракции 195-215 (0,373 г) содержат 14AA и второй минорный компонент, который не отделяется вплоть до удаления трок-защищающих групп, несмотря на присутствие минорного компонента, соединение 14AA образует красивые кристаллы при медленном выпаривании растворителя и воспроизводит следующие спектральные характеристики:
FAB масс-спектр дает пики при 1012, 1010, 551, 533, 511, 491, 450 и 442 масс-единиц.
1H ЯМР (CDCl3, TMS): δ 8,19 (д., 2H, J = 7,1 Гц), 7,71 (д., 2H, J = 7,2 Гц), 7,59 (т., 1H), 7,48 (м.), 7,36 (м.), 6,98 (д., 1H, -NH-), 6,57 (с., 1H, H10), 6,28 (т., 2H, J = 8,7 Гц, H13), 6,08 (дд., 1H, J = 9,5, 2,7 Гц, H3), 5,67 (д., 1H, J = 7,6 Гц, H2), 5,54 (д., 1H, J = 2,8 Гц, H2), 4,77 (дд., 2H, 2'-трок-CH2-), 4,74 (1H, H5), 4,32 (д., 1H, J = 8,6 Гц, H20a), 4,09 (д., 1H, J = 8,6 Гц, H20b), 4,07 (1H, H3), 2,47 (с., 3H, -CH3), 2,23 (дд., 1H, JH-7 = 9,9 Гц, JH-19a = 5,3 Гц, H19b), 2,19 (с., 3H, -CH3), 1,90 (д., 3H, J = 1,3 Гц, -CH3), 1,67 (дд., 1H, JH-7 = 7,2 Гц, JH-19a = 5,3 Гц, Н19b), 1,38 (м., 1H, H7), 1,26 (с., 3H, -CH3) и 1,21 (с., 3H, -CH3),
13C ЯМР (CDCl3, TMS) 201,88, 169,64, 169,59, 167,45, 167,03, 166,96, 153,24, 140,41, 136,43, 133,89, 133,61, 133,36, 132,05, 130,31, 129,25, 129,15, 129,07, 128,95, 128,75, 128,68, 128,59, 127,17, 126,49, 93,82, 84,83, 80,11, 79,56, 79,47, 77,88, 77,23, 75,66, 75,41, 72,17, 52,58, 42,85, 38,57, 35,93, 35,04, 32,26, 26,05, 22,30, 21,60, 20,83, 15,82, 14,56 ppm.
Фракции 55-65 (0,480 г) содержат чистое соединение 13AA и после объединения с 13AA, полученным при вышеупомянутом повторном хроматографировании смешанных фракций, дает 13AA в виде бесцветного кристаллического твердого вещества:
Rf = 0,19 в 30% ацетон:гексане,
FAB масс-спектр дает пики при 1034, 1032, 1030, 571, 511, 460, 442, 210 и 105 масс-единиц,
1H ЯМР (CDCl3, TMS): δ 8,18 (дд., 2H, J = 7,0, 1,5 Гц), 7,76 (дд., 2H, J = 7,0, 1,5 Гц), 7,62 (т., 1H), 7,50 (м.), 7,43 (м.), 6,95 (д., 1H, -NH-), 6,57 (с., 1H, H10), 6,27 (т., 1H, H13), 6,08 (дд., 1H, J = 9,5, 2,6 Гц, H3), 5,78 (д. , 1H, J = 7,3, H2), 5,55 (д., 1H, J = 2,7, H2), 5,05 (д., 1H, J = 7,5, H5), 4,78 (д., 1H, J = 11,8, H20a), 4,74 (д., 1H, J = 11,8, H20a), 4,48 (дд. , 1H, JF = 48 Гц, H7), 4,40 (д., 1H, J = 8,4 Гц, H20a), 4,31 (д., 1H, J = 8,2 Гц, H20b), 4,04 (д., 1H, J = 7,2 Гц, H3), 2,63 - 2,45 (м.), 2,49 (с., 3H), 2,27 - 2,10 (м.), 2,20 (с., 3H), 1,91 (с., 3H), 1,74 (с., 3H), 1,20 (с. , 3H) и 1,17 (с., 3H).
13C ЯМР (CDCl3, TMS) 206,0, 169,9, 168,8, 167,2, 167,17, 153,2, 140,9, 136,4, 133,7, 133,5, 132,1, 130,3, 129,3, 129,2, 128,8, 128,7, 128,6, 127,2, 126,5, 96,2, 93,9, 81,9, 80,8, 78,8, 77,9, 77,8, 77,4, 77,2, 75,0, 72,1 56,8 (д., J = 18 Гц), 52,7, 42,7, 40,1, 35,7, 33,9, 33,6, 25,8, 22,6, 21,3, 20,8, 14,6, 14,4 ppm.
Пример 3.
Получение:
N-Дезбензоил-N-бензилоксикарбонил-2'-{ [(2,2,2-трихлорэтил)окси] карбонил}-7-дезокси-7-фтораксола (13BA), ((Эфира { [(2,2,2-трихлорэтокси)-карбонил] -окси} бензолпропаноевая кислота, 6, 12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b- додекагидро-4-фтор-11-гидрокси-4a,8,13,13-тетраметил-5-оксо-7,11- метано-1H-циклодека[3,4]бенз[1,2-b] оксет-9-ила)), и
{ [(2,2,2-трихлорэтокси)-карбонил] -окси} бензолпропаноевая кислота, 6, 12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b- додекагидро-4-фтор-11-гидрокси-4a,8,13,13-тетраметил-5-оксо-7,11- метано-1H-циклодека[3,4]бенз[1,2-b] оксет-9-ила)), и
N-Дезбензоил-N-бензилоксикарбонил-2'-{[(2,2,2-трихлорэтил)окси]карбонил} -7-дезокси -7β,8β-/ метанотаксола(14BA), ((Эфира,{2aR  { [(2,2,2-трихлорэтокси)карбонил] окси} бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,-12,12a,12b- додекагидро-11-гидрокси-8,13,13-триметил-5-оксо-4,4a; 7,11-бисметано-1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила)).
{ [(2,2,2-трихлорэтокси)карбонил] окси} бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,-12,12a,12b- додекагидро-11-гидрокси-8,13,13-триметил-5-оксо-4,4a; 7,11-бисметано-1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила)).
Используется процедура, описанная для обработки 2'-трок-таксола с помощью метилДАСТ (пример 1), с использованием N-дезбензоил-N-бензилоксикарбонил-2'-трок-таксола (12BA, препарат 6A, 0,223 г, 0,21 мМ) и диметиламиносульфуртрифторида (метилДАСТ, 49 мкл, 0,066 г, 0,50 мМ всего, добавляемые двумя порциями) в CH2Cl2 (20 мл) в атмосфере N2 при температуре -78oC. С использованием данной методики получают грубый продукт в виде реакционной смеси (0,211 г, белое твердое вещество), который хроматографируют на силикагеле (40-63 мкм, две колонки Мерк размер B), используя раствор CH2Cl2 для нанесения материала на колонку и смесь 25% ацетон:гексан для элюции материала с колонки. Собирают фракции объемом 8 мл. Фракции 107 - 118 содержат смесь двух компонентов (0,065 г), которые разделяют повторным хроматографированием, как описано ниже.
Фракции 128 - 140 содержат соединение 13BA (0,081 г, 0,076 мМ, 36%), которое характеризуется следующими спектральными данными:
1H ЯМР (CDCl3, TMS): δ 8,16 (д., 2H, J = 7,2 Гц, ароматический); 7,63 (т. , 1H, J = 7,5 Гц, ароматический), 7,53 (т., 2H, J = 7,6 Гц, ароматический), 7,30 - 7,45 (м., 5H, ароматический), 7,24 (м., ароматический) 7,12 - 7,19 (м. , 2H, ароматический), 6,56 (с., 1H, H10) 6,24 (т., 1H, H13), 5,74 (д. , 1H, J = 7,4 Гц, H2), 5,74 (1H, -NH-), 5,62 (д., 1H, H3), 5,44 (д., 1H, H2), 5,09 (д., 1H, J = 12,5 Гц, PhCHaHO-), 5,03 (д., 1H, H5), 4,97 (д., 1H, PhCHHbО-), 4,77 (д. , 1H, J = 11,9 Гц, -OCHaHCCl3), 4,68 (д., 1H, J = 11,9 Гц, -OCHHbCCl3), 4,56 (дд., 1H, JF = 50 Гц, H7), 4,37 (д., 1H, H20a), 4,30 (д., 1H, H20b), 4,00 (д., 1H, J = 7,3 Гц, H3), 2,57 (м., 1H, H6a), 2,46 (с., 3H, -CH3), 2,40 (м., 1H, H14a), 2,21 (с., 3H, -CH3), 2,15 (м., 1H, H14b), 1,89 (с. , 3H, -CH3), 1,85 (м., 1H, H6b), 1,74 (с., 3H, CH3), 1,19 (с., 3H, -CH3), 1,16 (с., 3H, -CH3),
масс-спектр (FAB) 1060, 2466, C51H53Cl3FNO16 + H
требует 1060, 2492, 571, 553, 511, 472, 389, 347, 329, 105, 91 m/z.
Объединенные фракции 107-118 (0,065 г), полученные при элюировании с предшествующей колонки, подвергают повторному хроматографированию на силикагеле (40-63 мкм, одна колонка Мерк размер B), используя CH2Cl2 для нанесения материла на колонку и смесь 10% MeCN: CH2Cl2 для элюции с колонки. Собирают фракции объемом 8 мл.
Фракции 96 - 120 содержат 0,043 г (0,041 мМ, 20%) соединения 14BA.
1H ЯМР (CDCl3, TMS): δ 8,17 (д., 2H, J = 7,1 Гц, ароматический), 7,59 (т. , 1H, ароматический), 7,52 (т., 2H, ароматический), 7,31 - 7,46 (м., 5H, ароматический), 7,24 (м., ароматический), 7,09 (м., 2H, ароматический), 6,32 (с. , 1H, H10), 6,28 (т., 1H, J = 8,6 Гц, H13), 5,75 (д., 1H, J = 10,0 Гц, -NH-), 5,64 (д. , 1H, J = 7,8 Гц, H2), 5,59 (д, 1H, H3), 5,41 (д., 1H, J = 2,6 Гц, H2), 5,00 (д., 1H, J = 12,5 Гц, ArCHaHO-), 4,91 (д., 1H, J = 12,6 Гц, ArCHHbO-), 4,76 (д., 1H, J = 9,8 гц, -OCHaCCl3), 4,73 (д., 1H, H5), 4,68 (д., 1H, J = 9,9 Гц, -OCHHbCCl3), 4,30 (д., 1H, JF = 8,6 Гц, H20a), 4,07 (д. , 1H, H3), 4,05 (д., 1H, H20b), 2,50 (м., 1H, H14a), 2,43 (с., 3H-CH3), 2,36 (м. , 1H, H6a), 2,24 (м., 1H, H19a), 2,20 (с., 3H, -CH3), 2,10 (д., 1H, J = 16,1 Гц, H14b), 1,88 (с., 3H-CH3), 1,66 (м., 1H, H19b), 1,38 (м., 1H, H7), 1,26 (с., 3H-CH3 ), 1,21 (с., 3H-CH3),
масс-спектр (FAB) 1040, 2416, C51H52Cl3NO16 + H требует 1040, 2430, 980, 962, 551, 491, 369, 105, 91 m/z.
Пример 10
Получение эфира [2aR-  [{ (2,2,2-трихлорэтокси)карбонил} окси] бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b- додекагидро-4-фтор-11-гидрокси-4a, 8,13,13-тетраметил-5-оксо-7,11-метан о-1H-циклодека[3,4] бенз[1,2-b] -оксет-9-ила, 2'-[{(2,2,2-Трихлорэтил)окси}карбонил] -7-дезокси-7-фтортаксола (соединение 13AA, IIIa)
[{ (2,2,2-трихлорэтокси)карбонил} окси] бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b- додекагидро-4-фтор-11-гидрокси-4a, 8,13,13-тетраметил-5-оксо-7,11-метан о-1H-циклодека[3,4] бенз[1,2-b] -оксет-9-ила, 2'-[{(2,2,2-Трихлорэтил)окси}карбонил] -7-дезокси-7-фтортаксола (соединение 13AA, IIIa)
Раствор 2'-[{ (2,2,2-Трихлорэтил)окси} карбонил] таксола [Magri, N.F.; Kingston, D.C.I. J. Org. Chem., 1986, 51, 797] (0,021 г, 0,020 мМ) в CH2Cl2 (1,5 мл) добавляют с помощью шприца в течение 5 минут к перемешиваемому и охлажденному (баня со смесью ацетон : сухой лед) раствору диметиламиносульфуртрифторида (ДВСТ) (2 мкл, 0,014 мМ) в CH2Cl2 (0,5 мл), помещенному в ампулу Реакти-виал (Reactivial®) объемом 3 мл. Через 15 минут охлаждающую баню убирают и позволяют реакционной смеси нагреться до комнатной температуры. Реакционную смесь перемешивают, снова охлаждают в бане со смесью ацетон : сухой лед и добавляют еще одну порцию ДАСТ (4 мкл, 0,028 мМ) в CH2Cl2.Через 15 минут убирают охлаждающую баню, а через 90 минут реакционную смесь разбавляют добавлением CH2Cl2 и промывают ее водой. Слои разделяют, органическую фазу высушивают (Na2SO4), фильтруют и концентрируют, получая остаток 0,017 г). Остаток хроматографируют на силикагеле (40 - 63 мкм, 60 г), используя для нанесения на колонку CH2Cl2-раствор и смесь 30% ацетона в гексане для элюирования с колонки с получением искомого целевого продукта, имеющего Rf = 0,19 (30% ацетон : гексан):
FAB масс-спектр дает пики при 1034, 1032, 1030, 571, 511, 460, 442, 210 и 105 единицах массы,
1H ЯМР (CDCl3, TMS): δ 8,18 (дд., 2H), 2,76 (дд., 2H), 7,62 (т., 1H), 7,50 (м.), 7,43 (м.), 6,95 (д., 1H), 6,57 (с., 1H), 6,27 (т., 1H), 6,08 (дд. , 1H), 5,78 (д., 1H), 5,55 (д., 1H), 5,05 (д., 1H), 4,78 и 4,76 (д., 2H), 4,66 (д., 0,5H), 4,40 (д, 1H), 4,31 (д, 1H), 4,04 (д., 1H), 2,63 - 2,45 (м. ), 2,49 (с., 3H), 2,27 - 2,10 (м.), 2,20 (с., 3H), 1,91 (с., 3H), 1,74 (с., 3H), 1,20 (с., 3H) и 1,17 (с., 3H),
13C ЯМР (CDCl3, TMS) 206,0 169,9, 168,8, 167,2, 167,17, 153,2, 140,9, 136,4, 133,7, 133,5, 132,1, 130,3, 129,3, 129,2, 128,8, 128,7, 128,6, 127,2, 126,5, 96,2, 93,9, 81,9, 80,8, 78,8, 77,9, 77,8, 77,4, 77,2, 75,0, 72,1, 56,8, (д., J = 18 Гц), 52,7, 42,7, 40,1, 35,7, 33,9, 33,6, 25,8, 22,6, 21,3, 20,8, 14,6, 14,4 ppm.
Пример 11
Получение Эфира [2aR-  гидроксибензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b- додекагидро-4-фтор-11-гидрокси-4a,8,13,13-тетраметил-5-оксо-7,11- метано-1H-циклодека[3,4]бенз[1,2-b]оксет-9-ила;
гидроксибензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b- додекагидро-4-фтор-11-гидрокси-4a,8,13,13-тетраметил-5-оксо-7,11- метано-1H-циклодека[3,4]бенз[1,2-b]оксет-9-ила;
7-дезокси-7-фтортаксола (соединение IIIb)
Раствор 2'-[{ (2,2,2-Трихлорэтил)окси}карбонил]-7-дезокси-7-фтортаксола (соединения 13AA, IIIa, 0,010 г, 0,0097 мМ) в смеси 9:1 метанол/уксусная кислота (1 мл) перемешивают с активированными металлическим цинком (0,012 г) при комнатной температуре. Через 90 минут реакцию заканчивают путем удаления цинка фильтрованием с последующим концентрированием фильтрата при пониженном давлении. Остаток растворяют в CH2Cl2 и последовательно промывают полученный раствор 0,1N HCl, 5% водным NaHCO3 и водой. Водные слои повторно экстрагируют CH2Cl2, затем органические экстракты сушат (Na2SO4), фильтруют и концентрируют, получая остаток (0,009 г). Остаток хроматографируют на силикагеле (40 - 63 мкм, колонка 8 мм х 250 мм), используя для нанесения материала на колонку раствор в CH2Cl2. Колонку элюируют сначала 60 мл 20% этилацетата в гексане, а затем - 40% этилацетата в гексане. Искомый продукт (соединение IIIb) получают в виде твердого вещества:
FAB масс-спектр 856, 571, 511, 286, 268, 240, 210, 105 единиц массы,
1H ЯМР (CDCl3, TMS): δ 8,15 (дд, 2H), 7,75 (дд, 2H), 7,63 (т., 1H), 7,50 (м.), 7,38 (м.), 7,06 (д, 1H), 6,53 (с., 1H), 6,18 (т., 1H), (дд., 1H), 5,76 (д. , 1H), 5,02 (д., 1H), 4,80 (т., 1H), 4,65 (д., 0,5H), 4,50 (д., 0,5H), 4,38 (д., 1H), 4,29 (д., 1H), 4,04 (д., 1H), 3,55 (д., 1H), 2,70 - 2,40 (м. ), 2,40 (с., 3H), 2,37 - 2,25 (м.), 2,21 (с., 3H), 1,75 (3H), 1,62 (с., 3H), 1,20 (с., 3H), 1,18 (с., 3H);
13C ЯМР (CDCl3, TMS) 205,7, 172,4, 169,5, 169,4, 167,1, 166,9, 140,4, 138,0, 133,8, 133,7, 132,4, 131,9, 130,2, 129,2, 129,0, 128,75, 128,71, 128,3, 127,02, 126,98, 81,9, 81,0, 78,6, 77,2, 74,8, 73,2, 72,1, 57,0 (J = 17 Гц), 54,7, 42,6, 39,9, 35,8, 16,0, 22,5, 21,0, 20,8, 14,7, 14,2 ppm.
Используя процедуру, описанную Магри и Кингстоном для получения 2'-[{ (2,2,2-Трихлорэтил)окси} карбонил] таксола, получают 2'-[{(2,2,2-Трихлорэтил)окси}карбонил]-производные 7-эпитаксола (ref.: Rengel, I.; Horwitz, S.B. J. Pharmacol. Exp. Ther., 1987, 242, 692: Preferably Chaudhary et al., J. Org. Chem., 1993, 58, 3798).
Пример 12.
2'-[{(2,2,2-Трихлорэтил)окси}карбонил]-7-дезокси-7-эпифтортаксол
Используя процедуру примера 10, но с заменой 2'-[{(2,2,2-трихлорэтил)окси} карбонил] -7-таксола на 2'-[{(2,2,2-трихлорэтил)окси}карбонил]-7-эпитаксол, получают целевое соединение. Термин 7-дезокси-7-эпифтортаксол, использованный в наименовании целевого соединения, означает только то, что конфигурация фтор-заместителя эпимерна относительно конфигурации 2'-[{ (2,2,2-Трихлорэтил)окси} карбонил]-7-дезокси-7-фтортаксола (соединение 13AA, IIIa, пример 1) и не включает конфигурацию, аналогичную конфигурации 7-эпитаксола.
Пример 13.
7-Дезокси-7-эпифтортаксол
Используя процедуру примера 11, но с заменой 2'-[{(2,2,2- трихлорэтил)окси} карбонил]-7-дезокси-7-фтортакола на 2'-[{(2,2,2- трихлорэтил)окси} карбонил] -7-дезокси-7-эпитаксол, получают, целевое соединение. Термин 7-дезокси-7-эпифтортаксол, использованный в наименовании целевого соединения, означает только то, что конфигурация фтор-заместителя эпимерна относительно конфигурации 7-дезокси-7-фтортаксола (соединение IIIb, пример II) и не включает конфигурацию, аналогичную конфигурации 7-эпитаксола.
Пример 14.
2'-[{(2,2,2-Трихлорэтил)окси}карбонил]таксол, 7-Метансульфонат
Метансульфонил хлорид (1,2 эквивалента) по каплям прибавляют к раствору 2'-[{ (2,2,2-Трихлорэтил)окси} карбонил]таксола (1 эквивалент) и пиридина (5 эквивалентов) в CH2Cl2, который перемешивают при температуре ледяной бани. Затем реакционной смеси позволяют нагреться, продолжая перемешивание до тех пор, пока результаты ТСХ не подтвердят завершение реакции. Реакционную смесь охлаждают ледяной водой, экстрагируют с помощью CH2Cl2, полученный экстракт промывают последовательно разбавленным водным раствором кислоты, разбавленным водным раствором NaHCO3 и водой, затем его высушивают, фильтруют и концентрируют, получая грубый реакционный продукт, хроматографирование грубого продукта на силикагеле дает чистый целевой продукт.
Пример 15.
2'-[{(2,2,2-Трихлорэтил)окси}карбонил]-7-дезокси-7альфа- хлортаксол
Раствор 2'-[{(2,2,2-Трихлорэтил)окси}карбонил]таксол, 7-Метансульфоната (1 эквивалент) в N,N-диметилформамиде (ДМФ) перемешивают с хлоридом калия (10 эквивалентов). Добавляют катализатор фазового перехода и нагревают реакционную смесь для повышения скорости реакции. Ход реакции отслеживают с помощью ТСХ. Реакционную смесь разбавляют добавлением воды и экстрагируют CH2Cl2. Органический экстракт сушат, фильтруют и концентрируют, а грубый продукт реакции хроматографируют на силикагеле, что дает в итоге чистый целевой продукт.
Пример 16.
7-Дезокс -7α- хлортаксол
Применяя процедуру примера 11, но с замещением 2'-[{(2,2,2-трихлорэтил)окси} карбонил] -7-дезокси-7альфа фтортаксола на 2'-[{(2,2,2-трихлорэтил)окси}карбонил]-7-дезокси-7-хлортаксол получают целевое соединение.
Пример 17.
7-Дезокси -7β- хлортаксол
Применяя процедуры из примеров 14 и 15, но начиная реакцию с 2'-[{ (2,2,2-трихлорэтил)окси}карбонил]-7-эпитаксола, получают целевое соединение.
Применяя, в целом, процедуры из примеров 15 и 11, но используя в процедуре примера 15 соответствующие соли металлов, такие как бромид натрия или калия и иодид натрия или калия, получают следующие соединения:
7-Дезокси -7α- бромтаксол,
7-Дезокси -7β- бромтаксол,
7-Дезокси -7α- иодтаксол,
7-Дезокси -7β- иодтаксол.
Соединения формулы III<в которых X = хлор, бром или иод, могут также быть получены путем реакции соответствующего предшественника (т.е. 1 при R1 = -C6H5, R2 = -NHC(O)C6H5, R3 = H, R4 = -OTROC, R5 = H, R10 = -COCH3, а X = (OH) с (C6H5)3P/X2; (C6H5)3P/CX4 или (C6H5O)3P/X2 в следующих, к примеру, многочисленных примерах и экспериментальных условиях, описанных Кастро (Castro, B.R., Organic Reactions, 1983, 29, pp. 1-162).
Производные 7-дезокси-7-галотаксолов, в которых 2'-гидроксильная группа этерифицирована, получают непосредственно из искомого 7-дезокси-7-галотаксола с применением методов, описанных в: Mathew, A.E.; et al., J. Med. Chem. , 1992, 35, 145, Патент США 4942184, Патент США 5059699.
В соответствии с общей процедурой, Мэтью с соавторами (см. также патент США 4960790, 4924184 и 5059699) при использовании соответствующей замены в аналоге 7-дезокси-7-галотаксола получают следующие соединения:
2'-сукцинил-7-дезокси-7-фтортаксол,
2′-(β- аланил)-7-дезокси-7-фтортаксоловый эфир муравьиной кислоты,
2'-глутарил-7-дезокси-7-фтортаксол,
2'-[-C(O)(CH2)3C(O)NН(CH2)3 N(CH3)2]-7-дезокси-7-фтортаксол,
2′-(β- сульфопропионил)-7-дезокси-7-фтортаксол,
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-фтортаксол,
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7-фтортаксол,
2'-(триэтилсилил)-7-дезокси-7-фтортаксол,
2'-(t-бутилдиметилсилил)-7-дезокси-7-фтортаксол,
2'-(N,N-диэтиламинопропионил)-7-дезокси-7-фтортаксол,
2'-(N,N-диметилглицил)-7-дезокси-7-фтортаксол,
2'-(глицил)-7-дезокси-7-фтортаксол,
2'-(L-аланил)-7-дезокси-7-фтортаксол,
2'-(L-лейцил)-7-дезокси-7-фтортаксол,
2'-(L-изолейцил)-7-дезокси-7-фтортаксол,
2'-(L-валил)-7-дезокси-7-фтортаксол,
2'-(L-фенилаланил)-7-дезокси-7-фтортаксол,
2'-(L-пролил)-7-дезокси-7-фтортаксол,
2'-(L-лизил)-7-дезокси-7-фтортаксол,
2'(L-глутамил)-7-дезокси-7-фтортаксол,
2'-(L-аргинил)-7-дезокси-7-фтортаксол,
7-дезокси-7-фтортаксол,
2'-сукцинил-7-дезокси-7-хлортаксол,
2′-(β- аланил)-7-дезокси-7-хлортаксоловый эфир муравьиной кислоты,
2'-глутарил-7-дезокси-7-хлортаксол,
2'-[-C(O)(CH2)3C(O)NH(CH2)3 N(CH3)2]-7-дезокси-7-хлортаксол,
2′-(β- сульфопропионил)-7-дезокси-7-хлортаксол,
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-хлортаксол,
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7-хлортаксол,
2'-(триэтилсилил)-7-дезокси-7-хлортаксол,
2'-(t-бутилдиметилсилил)-7-дезокси-7-хлортаксол,
2'-(N,N-диэтиламинопропионил)-7-дезокси-7-хлортаксол,
2'-(N,N-диметилглицил)-7-дезокси-7-хлортаксол,
2'-(глицил)-7-дезокси-7-хлортаксол,
2'-(L-аланил)-7-дезокси-7-хлортаксол,
2'-(L-лейцил)-7-дезокси-7-хлортаксол,
2'-(L-изолейцил)-7-дезокси-7-хлортаксол,
2'-(L-валил)-7-дезокси-7-хлортаксол,
2'-(L-фенилаланил)-7-дезокси-7-хлортаксол,
2'-(L-пролил)-7-дезокси-7-хлортаксол,
2'-(L-лизил)-7-дезокси-7-хлортаксол,
2'-(L-глутамил)-7-дезокси-7-хлортаксол,
2'-(L-аргинил)-7-дезокси-7-хлортаксол,
7-дезокси-7-хлортаксотер,
2'-сукцинил-7-дезокси-7-бромтаксол,
2′-(β- аланил)-7-дезокси-7-бромтаксоловый эфир муравьиной кислоты,
2'-глутарил-7-дезокси-7-бромтаксол,
2' -[-C(O)(CH2)3C(O)NH(CH2)3 N(CH3)2]-7-дезокси-7-бромтаксол,
2′-(β- сульфопропионил)-7-дезокси-7-бромтаксол,
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-бромтаксол,
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7-бромтаксол,
2'-(триэтилсилил)-7-дезокси-7-бромтаксол,
2'-(t-бутилдиметилсилил)-7-дезокси-7-бромтаксол,
2'-(N,N-диэтиламинопропионил)-7-дезокси-7-бромтаксол,
2'-(N,N-диметилглицил)-7-дезокси-7-бромтаксол,
2'-(глицил)-7-дезокси-7-бромтаксол,
2'-(L-аланил)-7-дезокси-7-бромтаксол,
2'-(L-лейцил)-7-дезокси-7-бромтаксол,
2'-(L-изолейцил)-7-дезокси-7-бромтаксол,
2'-(L-валил)-7-дезокси-7-бромтаксол,
2'-(L-фенилаланил)-7-дезокси-7-бромтаксол,
2'-(L-пролил)-7-дезокси-7-бромтаксол,
2'-(L-лизил)-7-дезокси-7-бромтаксол,
2'-(L-глутамил)-7-дезокси-7-бромтаксол,
2'-(L-аргинил)-7-дезокси-7-бромтаксол,
7-дезокси-7-бромтаксотер,
2'-сукцинил-7-дезокси-7-иодтаксол,
2′-(β- аланил)-7-дезокси-7-иодтаксоловый эфир муравьиной кислоты,
2'-глутарил-7-дезокси-7-иодтаксол,
2-[-C(O)(CH2)3C(O)NH(CH2)3 N(CH3)2]-7-дезокси-7-иодтаксол,
2′-(β- сульфопропионил)-7-дезокси-7-иодтаксол,
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-иодтаксол,
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7-иодтаксол,
2'-(триэтилсилил)-7-дезокси-7-иодтаксол,
2'(t-бутилдиметилсилил)-7-дезокси-7-иодтаксол,
2'-(N,N-диэтиламинопропионил)-7-дезокси-7-иодтаксол,
2'-(N,N-диметилглицил)-7-дезокси-7-иодтаксол,
2'-(глицил)-7-дезокси-7-иодтаксол,
2'-(L-аланил)-7-дезокси-7-иодтаксол,
2'-(L-лейцил)-7-дезокси-7-иодтаксол,
2'-(L-изолейцил)-7-дезокси-7-иодтаксол,
2'-(L-валил)-7-дезокси-7-иодтаксол,
2'-(L-фенилаланил)-7-дезокси-7-иодтаксол,
2'-(L-пролил)-7-дезокси-7-иодтаксол,
2'-(L-лизил)-7-дезокси-7-иодтаксол,
2'-(L-глутамил)-7-дезокси-7-иодтаксол,
2'-(L-аргинил)-7-дезокси-7-иодтаксол,
7-дезокси-7-иодтаксотер и
их фармацевтически приемлемые соли, когда соединение содержит либо кислую, либо основную функциональную группу.
Пример 18.
Приготовление эфира  { [(2,2,2-трихлорэтокси)карбонил] окси} бензолпропановая кислота, 6,12b-бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a,5,6,9,10,11,12,12a,12b-додекагидро-11-гидрокси-8,13,13-триметил -5-оксо-4,4a, 7,11-бисметано-1H-циклодека[3,4] бенз[1,2-b]оксет-9-ила, 2'-{[(2,2,2-Трихлорэтил)окси]карбонил}-7-дезокси -7β,8β- метанотаксола (соединение 14AA, 11a)
{ [(2,2,2-трихлорэтокси)карбонил] окси} бензолпропановая кислота, 6,12b-бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a,5,6,9,10,11,12,12a,12b-додекагидро-11-гидрокси-8,13,13-триметил -5-оксо-4,4a, 7,11-бисметано-1H-циклодека[3,4] бенз[1,2-b]оксет-9-ила, 2'-{[(2,2,2-Трихлорэтил)окси]карбонил}-7-дезокси -7β,8β- метанотаксола (соединение 14AA, 11a)
Раствор 2'-{[(2,2,2-Трихлорэтил)окси]карбонил}таксола [Magri, N.E.; Kingston, D.G.I. J.Org.Chem., 1986, 51, 797] (0,021 г, 0,020 мМ) в CH2Cl2 (1,5 мл) добавляют с помощью шприца в течение 5 минут к перемешиваемому и охлажденному (баня со смесью ацетон:сухой лед) раствору диметиламиносульфуртрифторида (ДАСТ) (2 мкл, 0,014 М) в CH2Cl2 (0,5 мл), помещенному в ампулу Реакти-виал (Reactivial®) объемом 3 мл. Через 15 минут охлаждающую баню убирают и позволяют реакционной смеси нагреться до комнатной температуры. Реакционную смесь перемешивают, снова охлаждают в бане со смесью ацетон:сухой лед и добавляют еще одну порцию ДАСТ (4 мкл, 0,028 мМ) в CH2Cl2. Через 15 минут убирают охлаждающую баню, а через 90 минут реакционную смесь разбавляют добавлением CH2Cl2 и промывают ее водой. Слои разделяют, органическую фазу высушивают (Na2SO4), фильтруют и конденсируют, получая остаток (0,017 г). Остаток хроматографируют на силикагеле (40-63 мкм, 60 г), используя для нанесения на колонку CH2Cl2-раствор и смесь 30% ацетона в гексане для элюирования с колонки. Искомое целевое соединение имеет Rf = 0,22 (30% ацетон: гексан) и кристаллизуется из смеси ацетон:гексан в виде бесцветных игольчатых кристаллов:
FAB масс-спектр дает пики при 1020, 1010, 551, 533, 511, 491, 460 и 442 единицах массы.
1H ЯМР (CDCl3, TMS) δ 8,19 (д., 2H), 7,71 (д., 2H), 7,59 (т., 1H), 7,48 (м.), 7,36 (м.), 6,98 (д., 1H) 6,57 (с., 1H), 6,28 (т., 1H), 6,08 (дд., 1H), 5,67 (д., 1H), 5,54 (д., 1H), 4,77 (дд., 2H), 4,74, 4,32 (д., 1H), 4,09 (д., 1H), 4,07, 2,47 (с., 3H), 2,19 (с., 3H), 1,90 (с., 3H), 1,67 (дд., 1H), 1,38 (м., 1H), 1,26 (с., 3H) и 1,21 (с., 3H).
13C ЯМР (CDCl3, TMS) 201,88, 169,64, 169,59, 167,45, 167,03, 166,96, 153,24, 140,41, 136,43, 133,89, 133,61, 133,36, 132,05, 130,31, 129,25, 129,15, 129,07, 120,95, 128,75, 128,68, 128,59, 127,17, 126,49, 93,82, 84,83, 80,11, 79,56, 79,47, 77,78, 77,23, 75,66, 75,41, 72,17, 52,58, 42,85, 38,57, 35,93, 33,04, 32,26, 26,05, 22,30, 21,60, 20,83, 15,82, 14,56 ppm.
Пример 19.
Получение Эфира  гидроксибензолпропаноевая кислота, 6, 12b-бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b- додекагидро-11-гидрокси 8,13,13-триметил-5-оксо-4,4a,7,11-бисметано-1H-циклодека[3,4]- бенз[1,2-b]-оксет-9-ила,
гидроксибензолпропаноевая кислота, 6, 12b-бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b- додекагидро-11-гидрокси 8,13,13-триметил-5-оксо-4,4a,7,11-бисметано-1H-циклодека[3,4]- бенз[1,2-b]-оксет-9-ила,
7-Дезокси -7β,8β- метанотаксола (соединение 11b)
Раствор 2'-{ [(2,2,2-трихлорэтил)окси]карбонил}-7-дезокси -7β,8β- метанотаксола (соединение 14AA, 11a, 0,008 г, 0,0079 мМ) в смеси 9:1 метанол/уксусная кислота (1,0 мл) перемешивают с активированным металлическим цинком (0,010 г) при комнатной температуре. Через 60 минут добавляют новую порцию цинка (0,010 г) и продолжают перемешивание еще в течение 30 минут. Твердые вещества удаляют из реакционной смеси с помощью фильтрования, а фильтрат концентрируют при пониженном давлении. Полученный в результате этого остаток растворяют в CH2Cl2 и промывают последовательно 0,1 N водным раствором HCl, 5% водным раствором NaHCO3 и водой. Органический слой высушивают (Na2SO4), фильтруют и концентрируют, а остаток хроматографируют на силикагеле (40-63 мкм, колонка 8 х 250 мм, нанесение материала в растворе CH2Cl2, элюирование смесью 40% этилацетата в гексане). Целевое соединение представляет собой бесцветное твердое вещество:
FAB масс-спектр дает пики при 836, 776, 758, 551, 533, 491, 286, 240 и 105 единицах массы.
1H ЯМР (CDCl3, TMS) δ 8,19 (д., 2H), 7,69 (д., 2H), 7,60 (т., 1H), 7,60-7,35 (м.), 6,95 (д., 1H), 6,31 (с., 1H), 6,25 (т., 1H), 5,82 (д., 1H), 5,66 (д., 1H), 4,78 (дд., 1H), 4,72 (д., 1H), 4,31 (д., 1H), 4,07 (д., 1H), 4,06 (м. , 1H), 2,40 (с., 3H), 2,20 (с., 3H), 1,60 (с., 3H), 1,38 (м., 1H), 1,26 (с., 3H) и 1,22 (с., 3H),
13C ЯМР (CDCl3, TMS) 204,45, 201,81, 172,74, 169,87, 169,56, 167,41, 166,96, 140,12, 138,04, 134,07, 133,53, 131,93, 130,33, 129,28, 129,04, 128,74, 128,55, 128,32, 127,04, 126,86, 84,86, 80,08, 79,57, 79,40, 77,21, 75,66, 75,46, 73,22, 72,28, 54,79, 42,86, 38,54, 36,07, 35,09, 32,15, 26,11, 22,27, 21,49, 20,88, 15,77 и 14,59 ppm.
Пример 20.
Получение 2'-[{ (2,2,2-трихлорэтил)окси]карбонил]-7-дезокси -7β,8β- метано-таксола (14AA, 11a) из 2'-[{(2,2,2-Трихлорэтил)-окси}карбонил]-7-дезокси-7-аминотаксола
Охлажденный во льду раствор нитрита натрия (1,5 эквивалента) прибавляют порциями к энергично размешиваемой охлажденной во льду двухфазной смеси раствора 2'-[{ (2,2,2-Трихлорэтил)окси} карбонил] -7-дезокси-7-аминотаксола (1 эквивалент) в эфире и раствора серной кислоты в воде. Смесь перемешивают при температуре ледяной бани в течение нескольких часов после добавления компонентов. Затем избыток азотной кислоты связывают добавлением водного раствора мочевины. Путем осторожного добавления карбоната натрия доводят pH водной фазы смеси до примерно нейтрального значения, слои разделяют и экстрагируют водную фазу дополнительным количеством эфира. Объединенные эфирные экстракты высушивают, фильтруют и концентрируют, получая грубый реакционный продукт. Хроматографирование грубого продукта на силикагеле дает чистое соединение 14AA.
Пример 21.
Получение 2'-[{ (2,2,2-трихлорэтил)окси}карбонил]-7-дезокси -7β,8β- метано-таксола (14AA, 11a) из 2'-[{(2,2,2-Трихлорэтил)окси}карбонил]таксол 7-Трифторметил-сульфоната
Раствор 2'-[{ (2,2,2-Трихлорэтил)-окси} карбонил] -таксола 7-Трифторметилсульфоната в смеси 80% этанол:вода нагревают и анализируют реакционную смесь с помощью ТСХ. По завершению реакции раствор нейтрализуют бикарбонатом натрия, избыток этанола удаляют при пониженном давлении, а водную фазу экстрагируют с помощью метиленхлорида. Экстракты высушивают, фильтруют и концентрируют с получением грубого реакционного продукта. Грубый продукт хроматографируют на силикагеле, получая чистое соединение 14AA.
Пример 22.
N-Дебензоил-N-бензилоксикарбонил-7-дезокси-7-фтортаксол (соединение 18);
((Эфир  гидроксибензолпропаноевая кислота, 6, 12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро-4-фтор-11-гидрокси- 4a,8,13,13-тетраметил-5-оксо-7,11-метано-1H-циклодека[3,4]бенз [1,2-b]-оксет-9-ила))
гидроксибензолпропаноевая кислота, 6, 12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро-4-фтор-11-гидрокси- 4a,8,13,13-тетраметил-5-оксо-7,11-метано-1H-циклодека[3,4]бенз [1,2-b]-оксет-9-ила))
Применяя, в целом, процедуру примера N 11 (реакция 2'-трок-7-дезокси-7-фтортаксола с активированным цинком), но с использованием N-дебензоил-N-бензилоксикарбонил-2'-{ [(2,2,2-трихлорэтил)окси] карбонил} -7-дезокси-7-фтортаксола (пример 3, соединение 13BA, 0,079 г, 0,074 мМ) и активированного металлического цинка (0,153 г) в смеси CH3ОН:HOAc (9:1,16 мл) EtOAc (8 мл), получают искомый продукт 18. Следуя приведенной методике (время реакции 2 часа) и проведя хроматографирование (силикагель, 40% EtOAс:гексан, фракции по 8 мл) грубого продукта, получают искомый продукт 18, который элюируется во фракциях 59-76, в виде твердого вещества, характеризующегося следующими основными аналитическими показателями:
1H ЯМР (CDCl3, TMS) δ 8,14 (д., 2H, J = 7,4 Гц), 7,62 (т., 1H, J = 7,4 Гц), 7,52 (т. , 2H, J = 7,75, 7,30 Гц), 7,30-7,42 (м., 5H), 7,17 (м., 2H), 6,53 (с., 1H, H10), 6,18 (т, 1H, H13), 5,75 (д., 1H, -NH-), 5,73 (д., 1H, J = 7,2 Гц, H2), 5,38 (д., 1H, H3), 5,09 (д., 1H, J = 12,5 Гц, -OCHaHPh), 4,99 (д. , 1H, H5), 4,96 (д., 1H, J = 12,3 Гц, -OCHHbPh), 4,66 (д., 1H, H2), 4,57 (дд. , 1H, JF = 54 Гц, H7), 4,36 (д., 1H, J = 8,4 Гц, H20a), 4,29 (д., 1H, H20b), 3,41 (д., 1H, J = 7,3 Гц, H3), 2,63-2,46 (7 линий, 1H), 2,38 (c, 3H, -CH3), 2,43-2,30 (м., 1H), 2,28-2,10 (м., 1H), 2,22 (с., 3H, -CH3), 2,01 (м. , 1H), 1,77 (с., 3H, -CH3), 1,73 (с., 3H, -CH3), 1,19 (с., 3H, -CH3), 1,16 (с., 3H, -CH3).
13C ЯМР (CDCl3, TMS) 206, 172, 169,5, 169,3, 166,9, 156, 140,5, 138, 137, 133,7, 132, 130,2, 129,3, 128,8, 128,7, 128,4, 128,0, 127,6, 126,7, 96, 93, 81,9, 80,9, 78,6, 78, 74,8, 73,6, 71,8, 66,8, 57, 56, 42,5, 39,9, 35,9, 34, 34, 25,9, 22,4, 21,0, 20,8, 14,5, 14 ppm,
масс-спектр 886, 571, 511, 371, 347, 329, 316, 298, 105, 91 m/z.
Пример 23.
N-Дебензоил-N-бензилоксикарбонил-7-дезокси -7β,8β- метанотаксол (соединение 21),
((Эфир  гидроксибензилпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро-11-гидрокси-8,13,13- триметил-5-оксо-4,4a; 7,11-бисметано-1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила))
гидроксибензилпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро-11-гидрокси-8,13,13- триметил-5-оксо-4,4a; 7,11-бисметано-1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила))
Применяя, в целом, процедуру примера 11 [реакция 2'-трок-7-дезокси-7-фтортаксола с активированным цинком], но с использованием N-дебензоил-N-бензилоксикарбонил-2'-{[(2,2,2- трихлорэтил)окси]карбонил}-7-дезокси -7β,8β- метанотаксола (14BА, 0,040 г, 0,038 мМ и активированного металлического цинка (0,072 г с последующим добавлением еще 0,072 г ) в смеси CH3OH:HOAc (9: 1, 10 мл), получают искомый продукт 21. Действуя в соответствии с приведенной методикой, через 3 часа прохождения реакции и после хроматографирования (силикагель, 40% EtOAc:гексан, фракции по 8 мл) грубого продукта, получают исходный материал (0,007 г) во фракциях 30-37, а искомый продукт (21, 0,020 г, 0,023 мМ, 61%), который элюируется во фракциях 75-100, в виде твердого вещества, характеризующегося следующими основными аналитическими показателями:
1H ЯМР (CDCl3, TMS) δ 8,17 (д, 2H, J=7,3 Гц), 7,58 (м., 1H), 7,50 (т., 2H), 7,30 - 7,42 (м., 5H), 7,24 (м.), 7,08 (м., 2H), 6,31 (с., 1H, H10), 6,26 (т., 1H, J=8,6 Гц, H13), 5,70(д., 1H, J=9,6 Гц, -NH-), 5,64 (д., 1H, J= 7,7 Гц, Н2), 5,38 (д. , 1H, J=8,6 Гц, H3), 4,98 (д., 1H, J=12,5 Гц, -OCHaHPh), 4,88 (д., 1H, J=12,5 Гц, -OCHHbPh), 4,71 (д., 1H, J=3,7 Гц, H5), 4,65 (с., 1H, H2), 4,28 (д., 1H, J=8,6 Гц, H20a), 4,07 (д., 1H, H3) 4,05 (д. , 1H, H20b), 2,49-2,34 (м., 1H), 2,38 (с., 3H, -CH3), 2,23 (м.), 2,21 (с., 3H, -CH3), 2,08 (м. ), 1,94 (м.), 1,82 (с., 3H, -CH3), 1,37 (м., 1H, H7), 1,25 (с., 3H, -CH3), 1,21 (с., 3H, -CH3),
13C ЯМР (CDCl3, TMS) 202, 172,5, 169,2, 169,1, 167, 155,5, 149,5, 138, 136, 133,5, 133, 130,0 128,6, 128,4, 128,1, 127,7, 127,2, 126,3, 84,5, 79,9, 79,2, 79,0 75,3, 75,2, 73,0, 71,7, 66,5, 56,0, 42,5, 38,2, 36,0, 34,7, 32,0, 25,7, 21,5, 21,0, 20,5, 15,5, 14,2 ppm,
масс-спектр 886,3423, C48H51NO14 + H требует 866, 3388, 848, 806, 788, 511, 533, 491, 105, 91 m/z.
Пример 24.
N-Дебензоил-N-(t-бутил)оксикарбонил-2'-{ [(2,2,2-трихлорэтил)окси] карбонил} -7-дезокси-7-фтортаксол(соединение 13DA),
((Эфир  { [(2,2,2-трихлорэтокси) карбонил] окси} бензопропаноевая кислота, 6,12b- Бис(ацетокси)-12-(бензоилокси)-2a, 3, 4, 4a, 5, 6, 9, 10, 11, 12, 12a, 12b-додекагидро-4-фтор-11-гидрокси-4a, 8, 13, 13-тетраметил-5-оксо-7,11-метано-1H-циклодека [3,4]бенз[1,2-b]-оксет-9-ила)), и
{ [(2,2,2-трихлорэтокси) карбонил] окси} бензопропаноевая кислота, 6,12b- Бис(ацетокси)-12-(бензоилокси)-2a, 3, 4, 4a, 5, 6, 9, 10, 11, 12, 12a, 12b-додекагидро-4-фтор-11-гидрокси-4a, 8, 13, 13-тетраметил-5-оксо-7,11-метано-1H-циклодека [3,4]бенз[1,2-b]-оксет-9-ила)), и
N-Дебензоил-N-(t-бутил)оксикарбонил-2'-{[(2,2,2-трихлорэтил)окси]карбонил} -7-дезокси- -7β,8β- метанотаксол (соединение 14DA),
((Эфир  { [2,2,2-трихлорэтокси)карбонил] окси}бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-)бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b-додекагидро-11-гидрокси-8,13,13-триметил-5-оксо- 4,4a,7,11-бисметано-1H-циклодека [3,4]-бенз[1,2-b] -оксет-9-ила)).
{ [2,2,2-трихлорэтокси)карбонил] окси}бензолпропаноевая кислота, 6,12b-Бис(ацетилокси)-12-)бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a,12b-додекагидро-11-гидрокси-8,13,13-триметил-5-оксо- 4,4a,7,11-бисметано-1H-циклодека [3,4]-бенз[1,2-b] -оксет-9-ила)).
Используют общую процедуру примера 10 (реакция 2'-трок-таксола с метилДАСТ) с использованием N-дебензоил-N-(t-бутил)оксикарбонил-2'-трок-таксола (соединение 12 DA, 1,800 г, 1,75 мМ) и диметиламиносульфуртрифторида (метилДАСТ, 286 мкл, 0,390 г, 2,93 мМ) в CH2Cl2(120 мл) в атмосфере N2 при температуре -78oC. Следуя приведенной методике, полученную смесь грубого продукта (1,77 г) хроматографируют на силикагеле (40-63 мкм, 191 г в колонке 37 х 350 мм, фракции объемом 45 мл) с использованием раствора в CH2Cl2 для нанесения материала на колонку и смеси 20% ацетон:гексан (1,5 л) и затем смеси 25% ацетон-гексан для элюирования продуктов с колонки. Смесь, содержащая 14DA (0,511 г) элюируется во фракциях 41-46. Фракции 47-48 (0,085 г) содержат смесь продуктов. Фракции 49-61 (0,814) содержат чистый 13DA. Повторное хроматографирование объединенных фракций 47-48 дает дополнительное количество смеси, содержащей 14DA и чистый 13DA.
Чистое соединение 13DA получают в виде твердого вещества, которое характеризуется следующими основными аналитическими показателями:
1H ЯМР (CDCl3, TMS) δ/ 8,15 (д., 2H, J=7,2 Гц), 7,62 (т., 1H, J=7,2 Гц), 7,51 (т., 2H, J=7,7 Гц), 7,25 - 7,44 (м., 5H), 6,58 (с., 1H, H10), 6,28 (т. , 1H, J= 7 Гц, H13), 5,77 (д., 1H, J=7,2 Гц, H2), 5,51 (д., 1H, -NH-), 5,48 (д., 1H, J=10,0 Гц, H3), 5,40 (д., 1H, J=2,0 Гц, H2), 5,05 (д., 1H, J= 8,1 Гц, H5), 4,77 (д., 1H, J=11,8 Гц, трок-Ha), 4,68 (д., 1H, J= 11,8 Гц, трок-Hb), 4,58 (дд. 1H, J=4,6, 46,9 Гц, H7), 4,39 (д., 1H, J=8,4 Гц, H20a), 4,27 (д. , 1H, J=8,4 Гц, H20b), 4,04 (д., 1H, J=7,1 Гц, H3), 2,57 (м., 1H, H6a), 2,48 (с. , 3H, -CH3), 2,21 (с., 3H, -CH3), 1,91 (с., 3H, -CH3), 1,73 (с. , 3H, -CH3), 1,34 (с., 9H, Me3C-), 1,23 (с., 3H, -CH3), 1,17 (с., 3H, -CH3),
масс-спектр 1026, 2660, C48H55Cl3FNO16 + H требует 1026, 2648, 970, 571, 511, 407, 389, 347, 329, 105, 57 m/z.
Все фракции, содержащие смесь, в состав которой входит 14 DA, объединяют и повторно хроматографируют на силикагеле (две колонки Merck Lobar размер B, фракции объемом 9 мл), нанося материал на колонку в растворе CH2Cl2 и используя для элюирования колонки последовательно смесь 10% CH3CN: CH2Cl2 (68 фракций) и 15% CH3CN:CH2Cl2.
Чистое соединение 14DA элюируется с колонки во фракциях 100-131 и выделяется в виде твердого вещества, которое характеризуется следующими основными аналитическими показателями:
1H ЯМР (CDCl3, TMS) δ 8,15 (д., 2H, J=7,1 Гц), 7,61 (т., 1H, J=7,3 Гц), 7,51 (т. , 2H, J=7,5 Гц), 7,30-7,44 (м., 5H), 6,34 (с., 1H, H10), 6,30 (т., 1H, J= 8,6 Гц, H13), 5,67 (д., 1H, J=7,6 Гц, H2), 5,54 (д., 1H, -NH-), 5,45 (д. , 1H, J=10,1 Гц, H3), 5,38 (д., 1H, J=2,3 Гц, H2) 4,76 (д., 1H, J=11,8 Гц, трок-Ha), 4,76 (1H, H5), 4,69 (д., 1H, J=11,8 Гц), трок-Hb), 4,33 (д., 1H, J= 8,6 Гц, H20a), 4,09 (д., 1H, J=7,5 Гц, H3) 4,04 (д., 1H, J=8,7 Гц, H20b), 2,48 (м. , 1H, H14a), 2,44 (с., 3H, -CH3), 2,37 (м., 1H, H6a), 2,24 (м., 1H, H19a), 2,20 (c., 3H, -CH3) 2,11 (д., 1H, J=16,0 Гц, H14b), 1,90 (с. , 3H, -CH3), 1,66 (м., 1H, H19b), 1,37 (м., 1H, H7); 1,28 (с., 9H, Me3C-), 1,27 (с., 3H, -CH3), 1,25 (c., 3H, -CH3),
масс-спектр, найдено: 1006, 2560, C48H54Cl3NO16 + H требует 1006, 2486; 950, 551, 533, 491, 369, 327, 105, 57 m/z.
Пример 25.
N-Дебензоил-N-(t-бутил)оксикарбонил-7-дезокси-7-фтор таксол (соединение 20),
((Эфир  гидроксибензол-пропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро-4-фтор-11-гидрокси-4a,8,13,13-тетраметил-5-оксо-7,11- метано-1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила))
гидроксибензол-пропаноевая кислота, 6,12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b-додекагидро-4-фтор-11-гидрокси-4a,8,13,13-тетраметил-5-оксо-7,11- метано-1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила))
Применяют общую процедуру примера 11 [реакция 2'-трок-7-дезокси-7-фтортаксола с активированным цинком] с использованием N-дебензоил-N-(t-бутил)оксикарбонил-2'-{ [(2,2,2-трихлорэтил)окси] карбонил}-7-дезокси-7-фтортаксола (13DA, 0,100 г, 0,097 мМ) и активированного металлического цинка (0,183 г с последующим добавлением еще 0,50 г) в смеси CH3OH: OHAc (9:1, 10 мл). Через 1 час после начала реакции реакционную смесь оставляют на ночь при температуре -33oC, затем реакцию прекращают и хроматографируют грубый продукт (силикагель, 40% EtOAc: гексан, фракции объемом 8 мл), с получением искомого соединения 20 из фракций 53-76 в виде твердого вещества, характеризующегося следующими основными аналитическим показателями:
1H ЯМР (CDCl3, TMS) δ 8,13 (д., 2H, J = 7,2 Гц), 7,62 (т., 1H, J=7,4 Гц), 7,51 (т., 2H, J=7,5 Гц), 7,30 - 7,42 (м., 5H), 6,56 (с., 1H, H10), 6,21 (т. , 1H, H13), 5,76 (д., 1H, J=7,2 Гц, H2), 5,42 (д., 1H, J=9,7 Гц, -NH-), 5,29 (д., 1H, H3), 5,01 (д., 1H, J=7,5 Гц, H5), 4,63 (м., 1H, H2), 4,57 (дд. , 1H, J=4,3, 46,8 Гц, H7), 4,37 (дд., 1H, J= 8,4 Гц, H20a), 4,27 (д., 1H, J= 8,4 Гц, H20b), 4,04 (д., 1H, J= 7,1 Гц, H3), 2,56 (7 линий, 1H, H6a), 2,39 (с., 3H, -CH3), 2,31 (м., 1H), 2,25 (м., 1H), 2,22 (с., 3H, -CH3), 2,14 (дд. , 1H), 1,81 (с., 3H, -CH3), 1,73 (с., 3H, -CH3), 1,34 (с., 9H, Me3C-), 1,23 (c., 3H, -CH3), 1,18 (с., 3H, -CH3).
Пример 26.
N-Дебензоил-N-(t-бутил)оксикарбонил-7-дезокси -7β,8β- метанотаксол (соединение 23)
((Эфир  гидроксибензолпропаноевая кислота, 6, 12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b- додекагидро-11-гидрокси-8,13,13-триметил-5-оксо-4,4а; 7,11-бисметано- 1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила))
гидроксибензолпропаноевая кислота, 6, 12b-Бис(ацетилокси)-12-(бензоилокси)-2a, 3,4,4a, 5,6,9,10,11,12,12a, 12b- додекагидро-11-гидрокси-8,13,13-триметил-5-оксо-4,4а; 7,11-бисметано- 1H-циклодека[3,4]бенз[1,2-b]-оксет-9-ила))
Применяют общую процедуру примера 11 [реакция 2'-трок-7-дезокси-7-фтортаксола с активированным цинком] с использованием N-дебензоил-N-(t-бутил)оксикарбонил-2'-{ [(2,2,2-трихлорэтил)окси] карбонил} -7-дезокси -7β,8β- метанотаксола (14DA, 0,100 г, 0,099 мМ) и активированного металлического цинка (0,200 г с последующим добавлением еще 0,050 г) у смеси CH3OH: OHAc (9: 1, 10 мл). Применяя указанную методику, через 3 часа проведения реакции и хроматографирования грубого продукта (силикагель, 40% EtOAc: гексан, фракции объемом 8 мл), получают искомый продукт 23, который элюируется во фракциях 58-86, в виде твердого вещества, характеризующегося следующими основными аналитическими показателями:
1H ЯМР (CDCl3, TMS) δ 8,15 (д, 2H, J = 7,2 Гц), 7,61 (т, 1H, J = 7,3 Гц), 7,51 (т, 2H, J = 7,7Гц), 7,28-7,45 (м, 5H), 6,33 (с., 1H, H10), 6,27 (т, 1H, H13), 5,67 (д, 1H, J = 7,6 Гц), 5,36 (д, 1H, J = 9,6 Гц, H3), 5,30 (м., 1H, -NH-), 4,73 (д, 1H, J = 3,7 Гц, H2), 4,62 (м, 1H, H5), 4,31 (д, 1H, J = 8,6 Гц, H20a), 4,09 (д, 1H, J = 7,5 Гц, H3), 4,04 (д, 1H, J = 8,7 Гц, H20b) 2,46 (д-т. , 1H, J = 4,3, 16,1 Гц, H6a), 2,38(с, 3H, -CH3), 2,24 (м, 1H), 2,21 (с, 3H, -CH3), 2,10 (д, 1H, J = 16,0 Гц), 1,85 (с, 3H, -CH3), 1,67 (дд. , 1H, J = 7,1, 5,2 Гц), 1,36 (м, 1H, H7), 1,28 (с, 12H, Me3C- CH3-), 1,25 (с, 3H, -CH3),
Пример 29.
2'-ТЭС-7-дезокси -7α- хлортаксол
Раствор 2'-ТЭС-таксол 7-трифлата (препарат 15A, 1 эквивалент) в N,N-диметилформамиде (ДМФ) перемешивают с хлоридом калия (10 эквивалентов). Добавляют катализатор фазового перехода и нагревают реакционную смесь для повышения скорости реакции. Ход реакции отслеживают с помощью ТСХ. Для остановки реакции в реакционную смесь добавляют воду и проводят экстракцию с применением CH2Cl2. Органические экстракты высушивают, фильтруют и концентрируют, а полученный грубый продукт хроматографируют на силикагеле, получая в итоге чистое целевое соединение.
Пример 30.
7-Дезокси -7α- хлортаксол
Применяя процедуру получения препарата 12A, но начиная ее с 2'-ТЭС-7-дезокси -7α- хлортаксола, получают целевое соединение.
Применяя в целом процедуры примера 29 и 30, но используя соответствующие соли металлов, такие как бромид натрия или калия и иодид калия, по процедуре примера 29 получают следующие соединения:
7-Дезокси -7α- бромтаксол,
7-Дезокси -7β- бромтаксол,
7-Дезокси -7α- иодтаксол,
7-Дезокси -7β- иодтаксол.
Пример 31.
Получение N-дебензоил-N-(t-бутил)аминокарбонил-7-дезокси- 7-фтор-таксола (соединение 28)
N-Дебензоил-N-CbZ-7-дезокси-7-фтор-таксол 18 (60 мг, 0,07 мМ, препарат 39) растворяют в 3 мл абсолютного этанола и прибавляют 20 мг 10% палладия-на-угле. Смесь гидрогенизируют при атмосферном давлении в течение 6 часов. К этому моменту ТСХ показывает отсутствие в реакционной смеси исходного материала, поэтому реакционную смесь фильтруют через Целит и концентрируют в вакууме. Остаток, представляющий собой 13-(β- фенил-изосеринил)-7-фтор-баккатин III (19,52 мг, 0,07 мМ, препарат 40), растворяют в 700 мкл ТГФ, охлаждают до 0oC и прибавляют 7 мкл (0,061 мМ) t-бутилизоцианата. Так как ТСХ после этого еще показывает некоторое количество остаточного амина, добавляют еще 7 мкл. Через 20 часов реакционную смесь концентрируют в вакууме и хроматографируют на колонке с 6 г силикагеля в смеси 1:2 EtOAc:гексан. Колонку элюируют последовательно D 30 мл смеси 1:2 EtOAc: гексан, 60 мл смеси 2:3 EtOAc: гексан, 50 мл смеси 1:1 EtOAc:гексан и 20 мл смеси 2:1 EtOAc:гексан, собирая фракции объемом 3 мл. Искомый N-дебензоил-N-(t-бутил)аминокарбонил -7-дезокси-7-фтор-таксол находится во фракциях 35-52.
Масс-спектр (FAB - Высокое разрешение)
Расчетное значение 851,3766
Найдено: 851,3792.
1H ЯМР (CDCl3, TMS) δ 1,16 (с., 3H), 1,20 (с.), 1,72 (с., 3H), 1,80 (с, 3H), 2,15-2,60 (м.), 2,19 (с., 3H), 2,52 (с., 3H), 4,02 (д., 1H), 4,28 (д., 1H), 4,35 (д., 1H), 4,55 (дд., 1H), 4,59 (д., 1H), 4,88 (шс., 1H), 4,99 (д., 1H), 5,34 (м., 2H), 5,76 (д., 1H), 6,13 (м., 1H), 6,55 (с., 1H), 7,32 (м.), 7,49 (м., 2H), 7,61 (м., 1H), 8,11 (д., 2H).
Пример 32.
Получение N-дебензоил-N-(t-бутил)аминокарбонил-7-дезокси -7β,8β- метано-таксола, Соединение 29
N-дебензоил-N-CbZ-7-дезокси -7β,8β- метано-таксол (60 мг, 0,07 мМ, препарат 42) растворяют в 3 мл абсолютного этанола и добавляют 20 мг 10% Pd на угле. Полученную смесь подвергают гидрогенизации при атмосферном давлении в течение 5,5 часов. Данные ТСХ показывают отсутствие исходных материалов, поэтому реакционную смесь фильтруют через Целит и концентрируют в вакууме.
Остаток, который представляет собой 13(β-фенил-изосеринил)-7-дезокси-7β,8β- метано-баккатин III (22,52 мг, 0,07 мМ, препарат 43), растворяют в 1 мл ТГФ и добавляют 8 мл (0,07 мМ) t-бутил-изоцианата. ТСХ показывает наличие некоторого количества амина, поэтому реакционную смесь охлаждают до 0oC и добавляют 7 мл t-бутил-изоцианата. Амин все еще остается, поэтому добавляют еще 7 мл и еще 3 • 5 мл и перед каждым добавлением контролируют состав реакционной смеси с помощью ТСХ. Для остановки реакции к смеси добавляют воду и распределяют раствор между подкисленным солевым раствором и EtOAc. Слои разделяют, а органический слой фильтруют через Na2SO4, концентрируют в вакууме и хроматографируют на 6 г силикагеля, внесенного на колонку в смеси 1:2 EtOAc-гексан. Элюцию с колонки проводят 30 мл 1:2 EtOAc:гексан, 50 мл 2:3 EtOAc:гексан и 80 мл 1:1 EtOAc:гексан с получением 3 мл фракций. Искомый N-дебензоил-N-(t-бутил)- аминокарбонил-7-дезокси -7β,8β- метано-таксол обнаруживается во фракциях 29-48.
Масс-спектр (FAB-высокое разрешение)
Расчет: 831, 3704,
Найдено: 381, 3717.
1H ЯМР (CDCl3, TMS): δ 1,18 (с.), 1,23 (с., 3H), 1,26 (с., 3H), 1,66 (м. ), 1,82 (с. , 3H), 1,98-2,48 (м.), 2,20 (с., 3H), 2,38 (с., 3H), 4,05 (м., 2H), 4,30 (д., 1H), 4,50 (м., 1H), 4,60 (д., 1H), 4,73 (М., 1H), 5,33 (м., 1H), 5,66 (д., 1H), 6,19 (м., 1H), 6,31 (с., 1H), 7,32 (м.), 7,51 (м., 2H), 7,61 (м., 1H), 8,13 (д., 2H).
Производные 7-дезокси -7β,8β- метано-таксолов, в которых 2'-гидроксильная группа этерифицирована, получают прямо из искомого 7-дезокси -7β,8β- метано-таксола с помощью методов, приведенных в: Mathew, A.E., et al., J. Med. Chem., 1992, 35, 145, патент США 4942184, патент США 4059699.
В соответствии с общей методикой Мэтью с соавторами (см. также патент США 4960790, 4924184 и 5059699) при введении соответствующей замены для аналога 7-дезокси -7β,8β- метано-таксола получают следующие соединения:
2'-сукцинил-7-дезокси -7β,8β- метано-таксол,
2′-(β-аланил)-7-дезокси-7β,8β- метано-таксоловый эфир муравьиной кислоты,
2'-глутарил-7-дезокси -7β,8β- метано-таксол,
2'-[C(O)(CH2)3C(O)NH(CH2)3 N(CH3)2]-7-дезокси -7β,8β- метано-таксол,
2′-(β-сульфопропионил)-7-дезокси-7β,8β- метано-таксол,
2'-(2-сульфониламидо)сукцинил-7-дезокси -7β,8β- метано-таксол,
2'-(3-сульфонилпропиламино)сукцинил-7-дезокси -7β,8β- метано-таксол,
2'-(триэтилсилил)7-дезокси -7β,8β- метано-таксол,
2'-(t-бутилдиметилсилил)-7-дезокси -7β,8β- метано-таксол,
2'-(N,N-диэтиламинопропионил)-7-дезокси -7β,8β- метано-таксол,
2-(N,N-диметилглицил)-7-дезокси -7β,8β- метано-таксол,
2'-(глицил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-аланил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-лейцил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-изолейцил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-валил)-7-дезокси -7β,8β- амино-таксол,
2'-(L-фенилаланин)-7-дезокси -7β,8β- метано-таксол,
2'-(L-пролил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-лизил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-глутамил)-7-дезокси -7β,8β- метано-таксол,
2'-(L-аргинил)-7-дезокси -7β,8β- метано-таксол,
7-дезокси -7β,8β- метано-таксотер, и
их фармацевтически приемлемые соли, когда соединение содержит либо кислую, либо основную функциональную группу.
Таксол и другие производные таксола известны или могут быть получены известными методами.
(См. The Chemistry of Taxol, Pharmal. Ther., Vol. 52, pp. 1-34, 1991, а также патент США N 4181470, 4857638, 4942184, 4924011 4924012, 4960790, 5015744, 5059699, 5136060, 5157049, 4876399, 5227400, а также PCT публикация N WO 92/09589, Заявка на Европейский патент 90305845.1 (публикация N A2 0400971), 89400935.6 (публикация N .A1 0366841) и 90 402333.0 (публикация N A1 0414610), 87401669.4 (A1 0253739), 92308608.6 (A1 0534708), 92308609.4 (A1 534709) и PCT публикация N WO 91/17977, WO 91/17976, WO 91/13066, WO 91/13053, которые все приведены здесь в качестве ссылок).
Соединения настоящего изобретения могут быть введены в фармацевтические композиции или представлены в форме их фармацевтически приемлемых солей, в частности в виде нетоксичных фармацевтически приемлемых солей применения кислоты или фармацевтически приемлемых солей присоединения основания. Эти соли могут быть получены с применением традиционных химических методов из тех соединений настоящего изобретения, которые содержат кислые или основные группировки.
В обычном случае соли получают посредством реакции свободного основания или кислоты, взятых в стехиометрическом количестве или в избытке, с неорганической или органической кислотой, образующей нужную соль в подходящем растворителе или в различных комбинациях растворителей. Например, свободное основание может быть растворено в водном растворе соответствующей кислоты, при этом полученная соль может быть выделена с помощью стандартных методик, например путем выпаривания раствора. Альтернативно, свободное основание может быть растворено в органическом растворителе, таком как низший алканоил, эфир, алкильный эфир или в их смесях, например в метаноле, этаноле, эфире, смеси этилацетат: эфир и т. д., после чего его обрабатывают соответствующей кислотой с получением соответствующей соли. Соль выделяют с помощью стандартных технологий, например, путем фильтрации для отделения нужной соли от раствора или, в ином случае, она может быть осаждена добавлением растворителя, в котором эта соль нерастворима и в итоге может быть выделена из него.
Производные таксола настоящего изобретения могут использоваться для лечения рака в связи с их цитотоксической, противоопухолевой активностью. Новые соединения могут вводиться в форме таблеток, пилюль, порошкообразных смесей, капсул, инъекций, растворов, суппозиториев, эмульсий, дисперсий, пищевых добавок и в виде других подходящих форм. Фармацевтическую композицию, которая содержит соединения настоящего изобретения, обычно смешивают с нетоксичным фармацевтическим органическим носителем или нетоксичным фармацевтическим неорганическим носителем, обычно в пределах от 0,01 мг до 2500 мг или выше на единицу дозы, предпочтительно 50 - 500 мг. Типичными фармацевтически приемлемыми носителями являются, например, маннит, мочевина, декстран, лактоза, картофельный и кукурузный крахмал, стеарат магния, растительные масла, полиалкиленгликоли, этилцеллюлоза, поли(винилпирролидон), карбонат кальция, этилолеат, изопропилмиристат, бензилбензоат, карбонат натрия, желатин, карбонат калия, кремневая кислота и другие приемлемые традиционно используемые носители. Фармацевтическая композиция может также содержать нетоксичные дополнительные вещества, такие как эмульгаторы, консерванты, увлажняющие вещества и другие, например сорбитанмонолаурат, триэтаноламинолеат, полиоксиэтиленмоностеарат, глицерилтрипальмитат, диоктил-натрий-сульфосукцинат и т.д.
В типичном случае способ приготовления таблеток, содержащих активные агенты, включает, во-первых, перемешивание этого агента с нетоксичным связывающим веществом, таким как желатин, мазь на основе аравийской камеди, этилцеллюлоза и пр. Смешивание обычно проводится в стандартном V-образном блендере и обычно в безводных условиях. Затем только что полученная смесь может быть медленно пропущена через обычную таблеточную машину, а полученная вязкая масса сформирована в таблетки. Свежеприготовленные таблетки могут содержать или не содержать покрытие. Примерами подходящих видов покрытия могут быть нетоксичные покрытия, включающие щеллак, метилцеллюлозу, карнаубский воск, сополимеры стирола-малеиновой кислоты и др. Для перорального введения спрессованные таблетки, содержащие 0,01 мг, 5 мг, 25 мг, 50 мг, 500 мг и т. д. вплоть до 2500 мг, производятся на основе вышеприведенного раскрытия и с помощью известных в технике способов производства, широко применимых и представленных далее в Ремингтон'с фармацевтикал. Сайенс (Remington's Pharmaceutical Science, Chapter 39, Mack Publishing Co. 1965).
Для получения таблеток активное соединение, кукурузный крахмал, лактозу, дикальцийфосфат и карбомат кальция равномерно перемешивают в сухих условиях в обычном V-образном блендере до тех пор, пока все ингредиенты не будут равномерно перемешены друг с другом. Далее готовят 10% пасту на основе крахмала, которую перемешивают с только что приготовленной смесью до тех пор, пока не образуется однородная масса. Полученную смесь пропускают через сито с тонкими отверстиями, высушивают в безводной атмосфере, а затем перемешивают со стеаратом кальция, прессуют в таблетки и, если нужно, создают покрытие. Другие таблетки, содержащие 10, 50, 100, 150 мг и т.д., получают сходным образом.
Приводимая ниже композиция 1 представляет собой полимер получения таблеток, включающих соединения настоящего изобретения.
Композиция 1
Ингредиенты: - Количество на таблетку, мг
Активное соединение - 50,0
Кукурузный крахмал - 15,0
Клейстер из кукурузного крахмала - 4,5
Карбонат кальция - 15,0
Лактоза - 67,0
Стеарат кальция - 2,0
Дикальцийфосфат - 50,0
Получение для перорального использования капсул, содержащих от 10 мг до 2500 мг, включает, прежде всего, смешивание активного соединения с нетоксичным носителем и включение полученной смеси в полимерную капсулу, обычно желатиновую или подобную ей. Капсулы могут быть представлены в виде известных в технике мягких форм, или же они могут быть созданы путем включения соединения в тщательно перемешанную дисперсию на основе пищевого совместимого носителя, в другом случае капсула может представлять собой твердую капсулу, состоящую в основном из нового соединения, смешанного с нетоксичным твердым веществом, таким как тальк, стеарат кальция, карбонат кальция и т.п. Капсулы, содержащие 25 мг, 75 мг, 125 мг и т.д. нового соединения, единичного или в виде смеси двух и более новых соединений, приготавливают, например, следующим образом:
Композиция 2
Ингредиенты: - Количество на капсулу, мг
Активное соединение - 50,0
Карбонат кальция - 100,0
Лактоза, фармакопея США - 200,0
Крахмал - 130,0
Стеарат магния - 4,5
Вышеприведенные ингредиенты смешивают друг с другом в стандартном блендере, который затем выгружают в коммерчески применимые капсулы. В случае использования более высоких концентраций активного вещества соответствующим образом уменьшают количество лактозы.
Соединения настоящего изобретения могут быть высушены при замораживании и, если необходимо, объединены с другими фармацевтически приемлемыми наполнителями для приготовления композиций, пригодных для парентерального введения или для инъекций. Для такого введения композиций могут быть созданы с применением воды (обычной, солевой) или смеси воды и органического растворителя, такого как пропиленгликоль, этанол и т.д.
Для каждого конкретного соединения вводимая доза, единичная доза, множественная доза или дневная доза будет, конечно, варьировать в связи с различным потенциалом соединения, избранным способом введения, весом реципиента и состоянием больного. Нет определенных рамок, ограничивающих вводимую дозу, однако, в обычном случае это должно быть эффективное количество, или представляющее собой молярный эквивалент фармакологически активной свободной формы, получаемой на основе дозируемой композиции в условиях метаболического высвобождения активного лекарственного вещества, необходимого для достижения желаемого фармакологического и физиологического эффектов.
В типовом случае соединения настоящего изобретения могут вводиться путем внутривенной инъекции в дозах 1 - 500 мг на одного пациента в курсе лечения, предпочтительно в дозах от 2 до 100 мг, точная доза зависит от возраста, веса и состояния больного. Один из примеров подходящей для инъекции композиции включает раствор соединения настоящего изобретения в смеси эфира, спирта и полисорбиновой кислоты и обезвоженного спирта (т.е. 1:1), который в дальнейшем, непосредственно перед инфузией или инъекцией, разводится 5% раствором декстрозы в воде.
Соединения формулы I (включая II и III используются для лечения некоторых видов рака, в отношении которых была показана активность таксола, включая опухоли яичников человека, опухоли молочной железы и злокачественную меланому, рак легкого, рак желудка, рак толстого кишечника, рак головы и шеи и лейкозы). Относительно клинической фармакологии таксола см. также обзор, сделанный Eric K. Rowinsky & Ross C. Donehower, The Clinical Pharmacology and USE of Antimicrotubule Agents in Canser Chemotherapeutics, Pharmac. Ther. , vol. 52, pp. 35 - 84, 1991. Обзор клинических и доклинических исследований таксола сделан в работе William J. Slichenmyer & Daniel D. Von Hoff, Taxol: A New and Effective Anticancer Drugs, vol. 2, pp. 519 - 530, 1991.
Биологическая активность соединений 7-дезокси -7β,8β- метано-таксола (формула II) настоящего изобретения была подтверждена с использованием хорошо известных методик. Например, сравнение цитотоксичности 7-дезокси -7β,8β- метано-таксола (Соединение IIb, продукт примера 19) с самим таксолом в культуре мышиных лейкозных клеток линии L 1210 показывает, что ИК90 (90% от концентрации, вызывающей ингибирование роста) для 7-дезокси -7β,8β- метано-таксола составляет 0,025 мкг/мл, а для таксола она равна 0,06 мкг/мл. В проведенном in vitro тексте на полимеризацию тубулина по методу Гаскин с соавторами (F. Gaskin et al., J. Mol. Biol. 89, 737, 1974), 7-дезокси -7β,8β- метано-таксол продемонстрировал очень сходную с таксолом способностью индуцировать полимеризацию тубулина in vitro при 20oC.
Биологическая активность соединений 7-дезокси-7-галотаксола (формула III) настоящего изобретения была подтверждена с использованием хорошо известных методов.
Например, при сравнении цитотоксичности 7-дезокси-7-фтортаксола (соединение IIIb, продукт примера II) и самого таксола в культуре клеток A2780 (клетки рака яичников человека) показывает, что ИК90 (концентрация, вызывающая 90% ингибирование роста) для 7-дезокси-7-фтортаксола составляет 0,016 мкг/мл, а для таксола равна 0,007 мкг/мл. В тексте in vitro по индукции полимеризации тубулина, проведенном по методу Ф. Гаскина с соавт. (F. Gaskin et al., J. Mol. Biol., 89; 737, 1974) 7-дезокси-7-фтортаксол-продемонстрировал способность индуцировать полимеризацию тубулина in vitro при 20oC сходным с таксолом образом. В этом тесте 7-дезокси-7-фтортаксол обладал половинной по сравнению с таксолом активностью.
Биологическая активность соединений настоящего изобретения была далее подтверждена с использованием хорошо известной процедуры, проводимой с использованием лейкозных клеток L 1210, результаты этого исследования представлены в таблице. Для его проведения была использована хорошо известная методика (Li, L. H., Kuentzel, S.L. Murch, L.L., Pschigoga, L.M., и Krueger, "Comparative biological and biochemical effects of nogalamycin and its analogs on L 1210 Leukemia", Canser Res., 39:4816 - 4822 (1979)).
Результаты выражены в виде показателя ИК50, который означает концентрацию лекарственного препарата, необходимую для ингибирования пролиферации клеток до 50% уровня в сравнении с пролиферацией необработанных клеток. Меньшие значения означают более высокую активность.

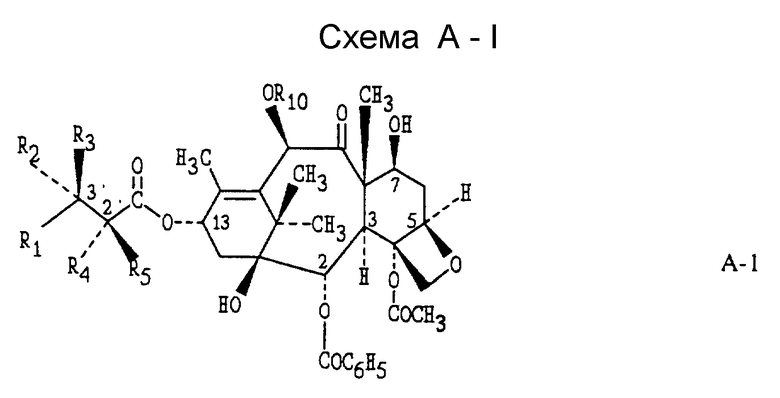


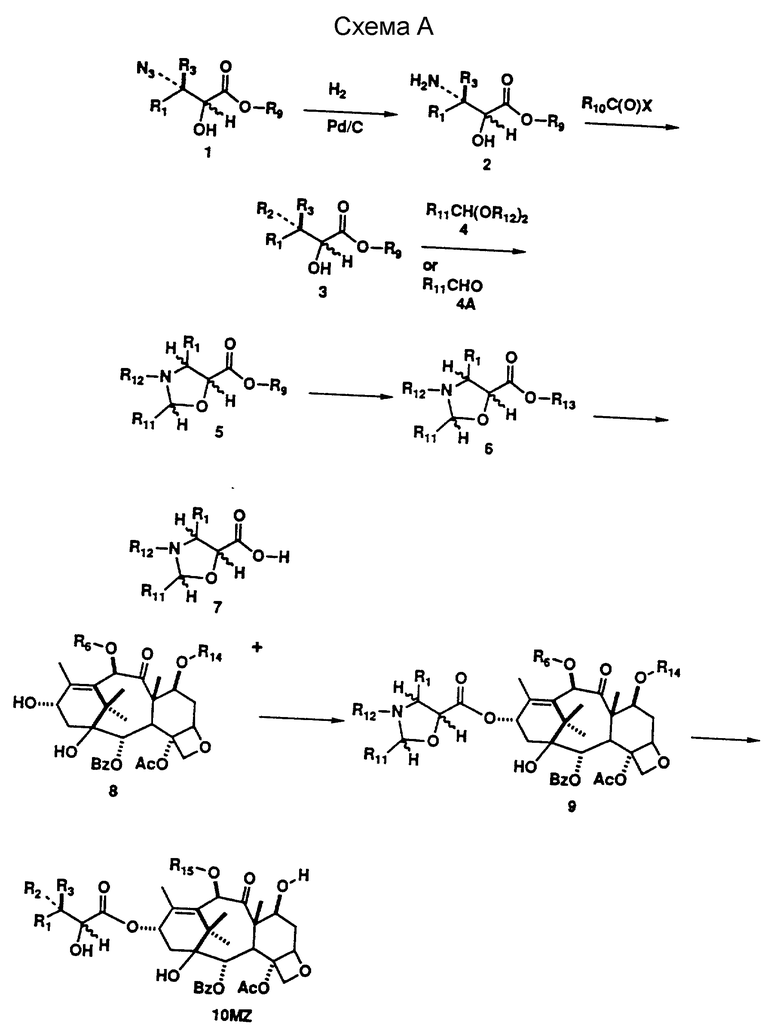


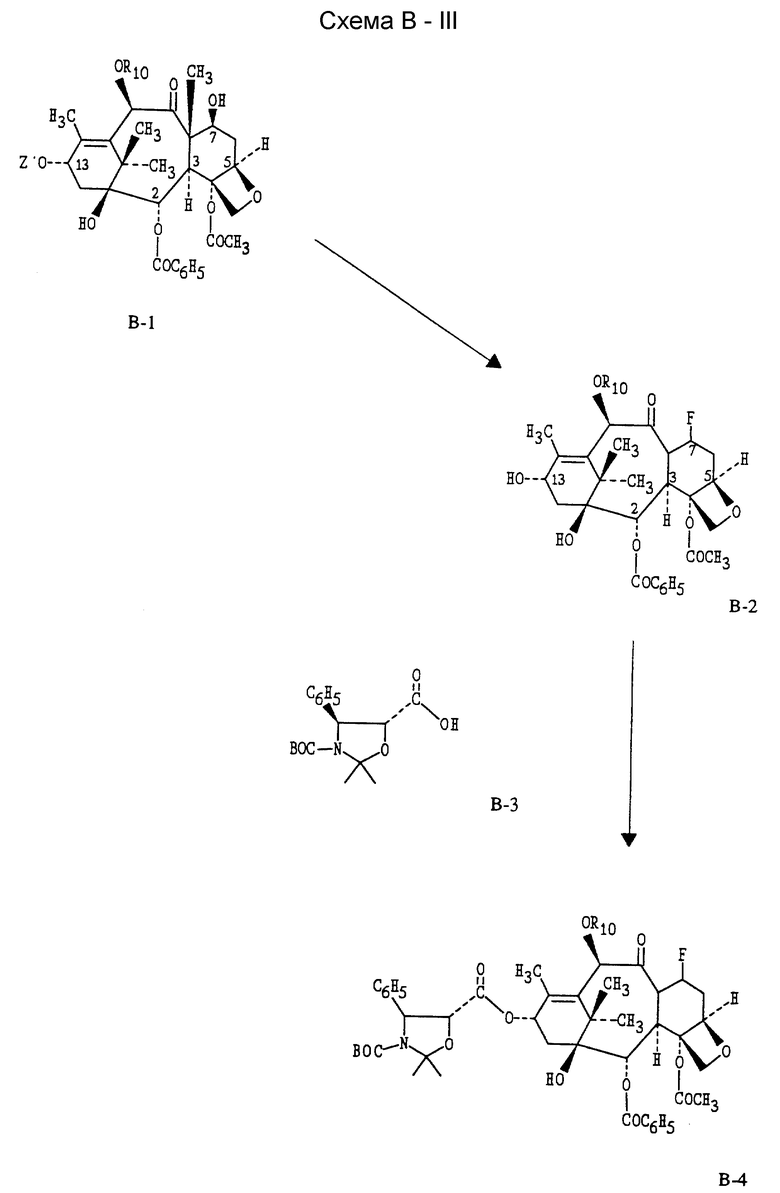

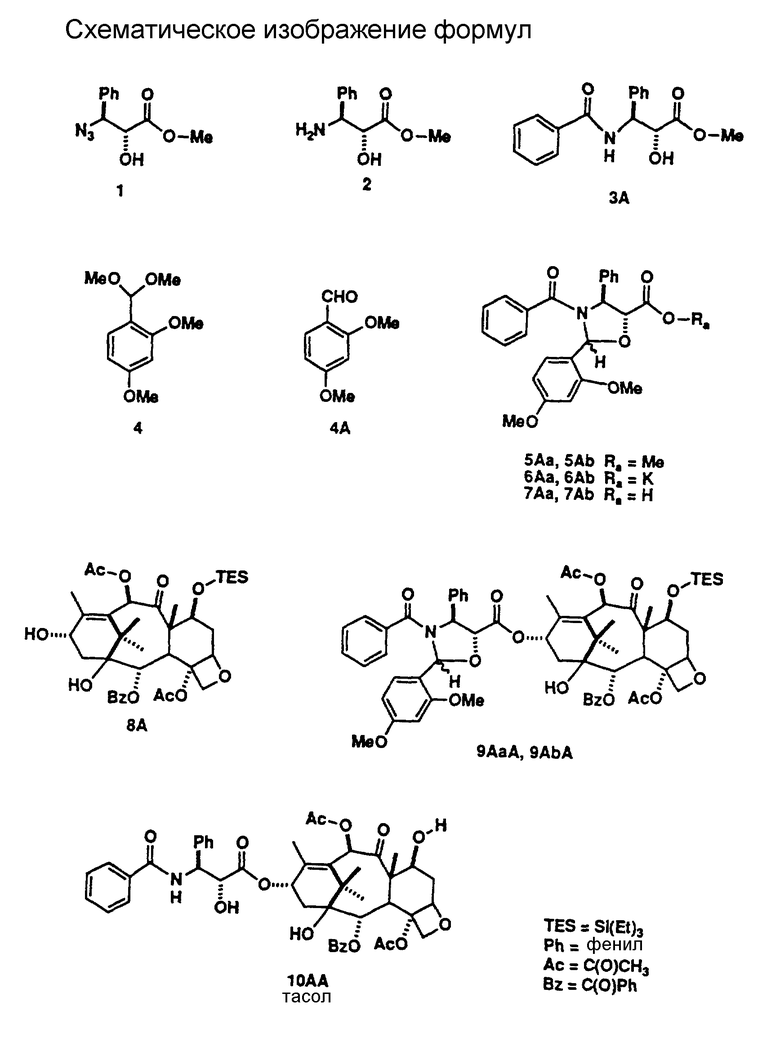



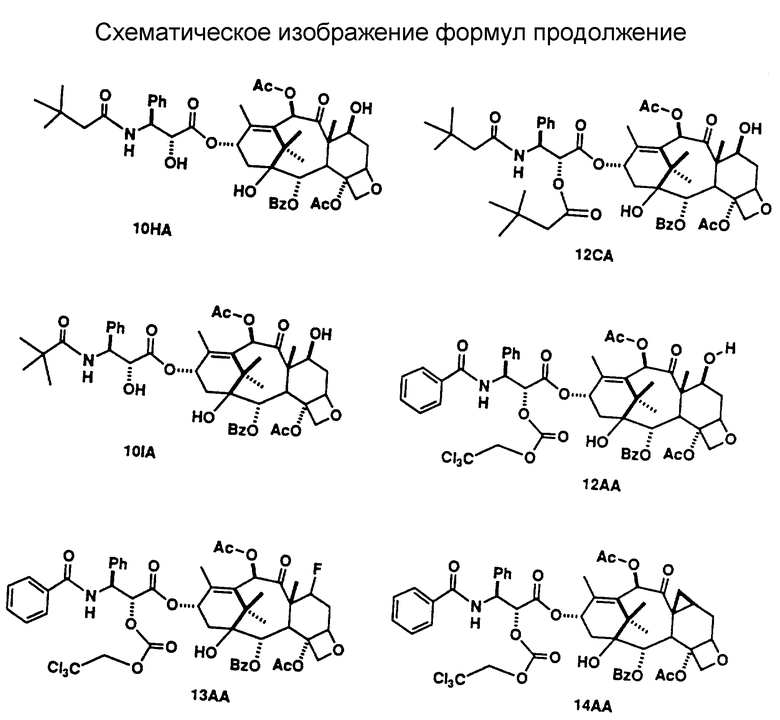


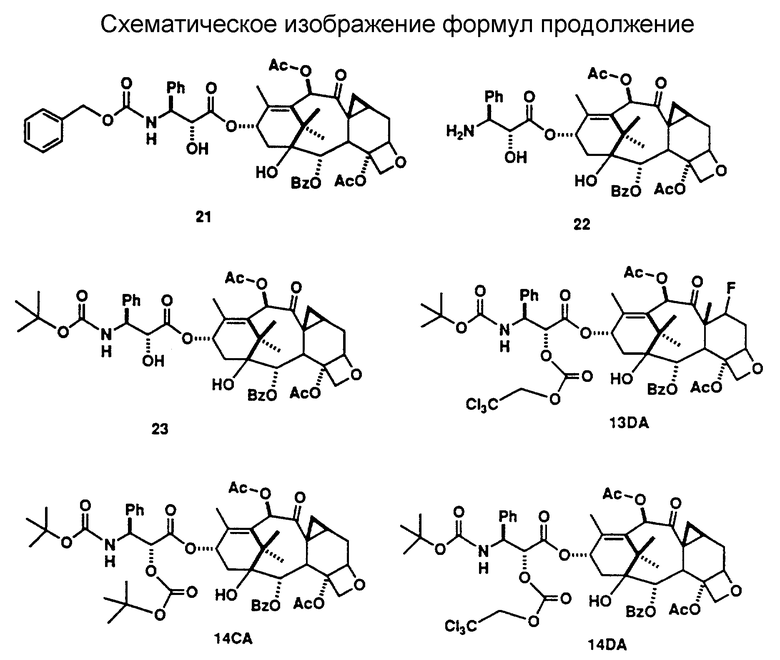






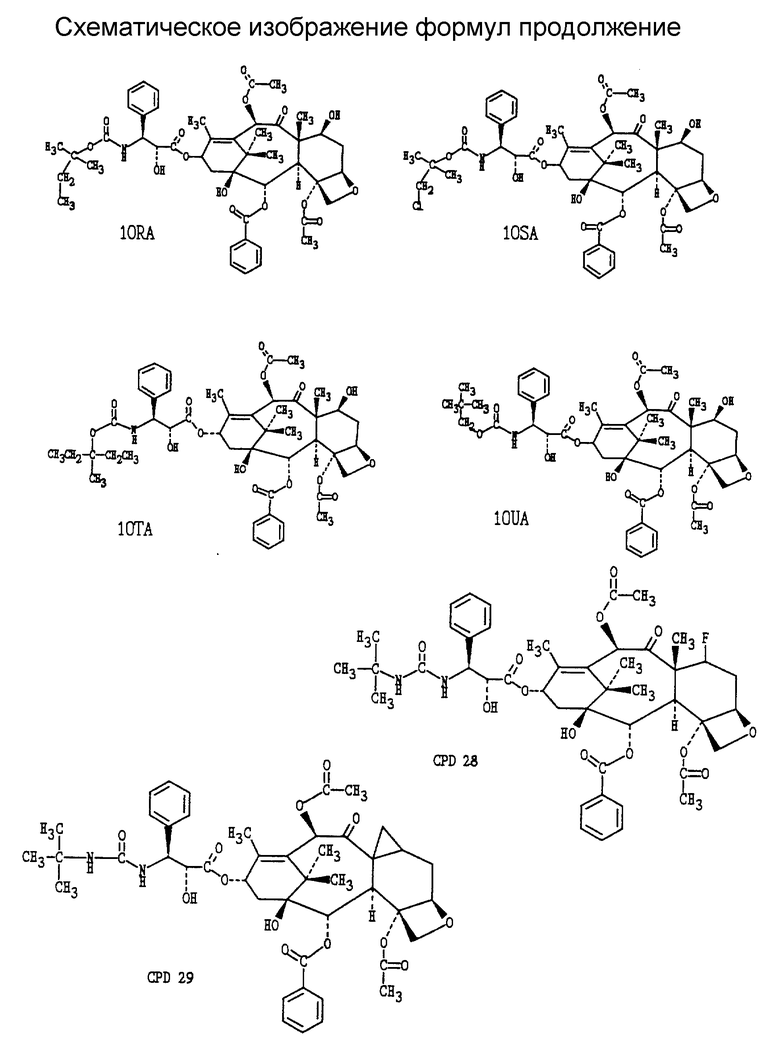

Производные таксолов общей формулы I, где R1-метил или фенил, R2 - H, NHC(O)H, NHC(O)-алкил, NHC(O)-фенил, NHC(O)OCH2-фенил, NH2, NHC(O)-1-адамантил, NHCOO-3-тетрагидрофуранил, NHCOO-4-тетрагидропиранил, NHCO-CH2C(CH3)3, NHCOC(CH3)3, NHCONHPh, NHCOC(CH2CH3)CH3, NHCOC(CH3)2CH2Cl,
NHCOC(CH3)2CH2CH3, фталимидогруппа, NHC(O)-1-фенил-1-циклопентил, NHC(O)-1-метил-1-циклогексил, NHC(S)NHC(CH3)3, NHC(O)NHC(CH3)3 или NHCONHPh; R3-H, NHCO-фенил или NHC(O)OC(CH3)3; R4-H, OC(O)ОCH2CCl3 или NHC(O)-фенил; R5-H или OH; R6-H, когда R7 представляет собой α-R71 или β-R72, где один из R71, R72-H, а другой - Х; Х - атом галогена; R8 - метил; R10 - H или C(O)CH3 или их фармацевтически приемлемые соли. Соединения формулы I обладают противоопухолевой активностью и полезны в случае некоторых видов рака.
 7 с. и 12 з.п.ф-лы, 1 табл.
7 с. и 12 з.п.ф-лы, 1 табл.

где R1 -метил или фенил;
R2 - атом водорода, -NHC(O)H, -NHC(O) C1-C10-алкил, -NHC(O)фенил, -NHC(O)OCH2фенил, -NH2, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)-O-4-тетрагидропиранил, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)NHPh, -NHC(O)C(CH2CH3)2CH3, -NHC(O)C(CH3)2CH2Cl, -NHC(O)C(CH3)2CH2CH3, фталимидогруппа, -NHC(O)-1-фенил-1-циклопентил, -NHC(O)-1-метил-1-циклогексил, -NHC(S)NHC(CH3)3, -NHC(O)NHC(CH3)3 или -NHC(O)NHPh;
R3 - атом водорода, -NHC(O)фенил или -NHC(O)OC(CH3)3, при условии, что один из двух заместителей R2 и R3 представляет собой атом водорода, но оба R2 и R3 не могут одновременно быть представлены радикалами - H;
R4 - атом водорода или выбирается из группы из -OC(O)OCH2C(Cl)3 или -NHC(O)фенила;
R5 - атом водорода или OH группа, при условии, что когда R5 - OH-группа, R4 - атом водорода, и кроме того при условии, что когда R5 представляет собой атом водорода, R4 отличен от атома водорода;
R6 - атом водорода, когда R7 представляет собой α-R71 или β-R72, где один из R71, R72 - атом водорода, а другой из R71 и R72 - X, где X представляет атом галогена, а R8 - метил, или при R6 - атом водорода, R7 представляет собой α-H; β-R74, где R74 и R8 соединяются вместе с образованием циклопропилового кольца;
R10 - атом водорода или -C(O)CH3-группа,
или их фармацевтически приемлемые соли, когда соединение содержит либо кислую, либо основную функциональную группу.
N-дебензоил-N-бензилоксикарбонил-7-дезокси-7-фтортаксола,
N-дебензоил-N-бензилоксикарбонил-7-дезокси--7β, 8β-метанотаксола,
N-дебензоил-N-(т. -бутил)оксикарбонил- 2'-{[(2,2,2-трихлорэтил)окси]карбонил}-7-дезокси-7β, 8β-метанотаксол,
N-дебензоил-N-(т. -бутил)оксикарбонил- 2'-{[(2,2,2-трихлорэтил)окси]карбонил}-7-дезокси-7-фтортаксол,
N-дебензоил-N-бензилоксикарбонил- 2'-{[(2,2,2-трихлорэтил)окси]карбонил} -7-дезокси-7-фтортаксол,
N-дебензоил-N-бензилоксикарбонил- 2'-{[(2,2,2-трихлорэтил)окси]карбонил} -7-дезокси-7β, 8β-метанотаксол.
где R1 - метил или фенил;
R2 - атом водорода, -NHC(O)H, -NHC(O) C1-C10-алкил, -NHC(O)фенил, -NHC(O)OCH2-фенил, - NH2, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2-C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)NHPh, -NHC(O)C(CH2CH3)2CH3, -NHC(O)C(CH3)2CH2Cl, -NHC(O)C(CH3)2CH2CH3, фталимидогруппа, -NHC(O)-1-фенил-1-циклопентил, -NHC(O)-1-метил-1-циклогексил, -NHC(S)NHC(CH3)3, -NHC(O)NHC(CH3)3 или -NHC(O)NHPh;
R3 - атом водорода, -NHC(O)фенил или -NHC(O)OC(CH3)3, при условии, что один из двух заместителей R2 и R3 представляет собой атом водорода, но оба R2 и R3 не могут одновременно быть представлены радикалами -H;
R4 - атом водорода или выбирается из группы из -OC(O)OCH2C(Cl3) или -NHC(O)фенила;
R5 - атом водорода или OH группа, при условии, что когда R5 - OH-группа, R4 - атом водорода, кроме того при условии, что, когда R5 представляет собой атом водорода, R4 отличен от атома водорода,
R6 - атом водорода, когда R7 представляет собой α-R71 или β-R72, где один из R71, R72 - атом водорода, а другой из R71 и R72 - X, где X представляет атом галогена, а R8 - метил, или при R6 - атом водорода, R7 представляет собой α-H; β-R74, где R74 и R8 соединяются вместе с образованием циклопропилового кольца;
R10 - атом водорода или -C(O)CH3-группа,
или их фармацевтически приемлемые соли, когда соединение содержит либо кислую, либо основную функциональную группу и фармацевтически приемлемый носитель.
где R1 - метил или фенил;
R9 - C1-C6-алкил,
R11 - фенил, замещенный (OC1-C2-алкил), где n - целое число, равное 1 - 3,
R12 - выбирают из группы, состоящей из -C(O)H, -C(O)C1-C10-алкила, -C(O)-фенила, -C(O)OC(CH3)3, -C(O)OCH2-фенила, -C(O)-1-адамантила, -C(O)O-3-тетрагидрофуранила, -C(O)O-4-тетрагидропиранила, -C(O)CH2C(CH3)3, -C(O)C(CH3)3, -NHC(O)C(CH2CH3)2CH3, -NHC(O)C(CH3)2CH2CH3, фталимидо,
-NHC(O)-1-фенил-1-циклопентила, -NHC(O)-1-метил-1-циклогексила, -NHC(S)NHC(CH3)3, -NHC(O)NHCC(CH3)3 взаимодействием гидроксиламина формулы III
где R1 и R9 имеют вышеуказанные значения, а R2 и
R3 имеют значения, указанные в п.1, с бензальдегидом формулы IV
или ацеталем формулы Ivа
где n - целое число, равное 1 - 3.
где R1, R10, R11 и R12 имеют вышеуказанные значения,
R14 выбирают из группы, состоящей из -C(O)C1-C6-алкила, -C(O)OC1-C6-алкила, -C(O)OCH2CX3, где X3 - атом галогена, -C(O)OCH2SiR20, где R20-C1-C6-алкил; или Si(R20)3,
отличающийся тем, что свободную кислоту оксазолидина формулы VII
где R1, R11 и R12 имеют вышеуказанные значения, подвергают взаимодействию с соединением баккатина формулы VIII
где R10 и R14 имеют вышеуказанные значения, в присутствии дегидратирующего агента.
где Bz-бензил, Ac-ацетил.
отличающийся тем, что соединены формулы VIIIв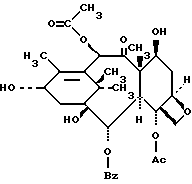
где Bz и Ac имеют вышеуказанные значения,
подвергают взаимодействию с гидразином.

Приоритет по признакам:
15.12.92 - раскрывает 7-галогенсодержащие соединения, где R2 выбирают из группы, состоящей из H, -NHC(O)-фенила, -NHC(O)C(CH3)3, -NH2, и R7 обозначает галоген;
02.02.93 - раскрывает 7β, 8β-метаносоединения, где R2 выбирают из группы, состоящей из H, -NHC(O)-C1-C10-алкила, (предпочтительно NHC(O)-C4-C6-алкила), -NHC(O)-фенила, -NHC(O)C(CH3)3, -NH2, и R7 представляет собой α-H; β-R74, где R74 и R8 вместе образуют циклопропильную группу;
11.06.93 - раскрывает 7-гало- и 7β, 8β-метансоединения, где R2 выбирают из группы, состоящей из -NHC(O)-1-адамантила, -NHC(O)O-3-тетрагидрофуранила, -NHC(O)O-4-тетрагидропиранила, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3.
Приоритет по пунктам, относящимся к способу:
17.09.93 - раскрывает 7-галоген и 7β, 8β-метаносоединения, где R2 выбирают из группы, состоящей из H, -NHC(O)H, -NHC(O)-C1-C10-алкила, -NHC(O)-фенила, -NHC(O)OCH2-фенила, -NH2, -NHC(O)-1-адамантила, -NHC(O)O-3-тетрагидрофуранила, -NHC(O)O-4-тетрагидропиранила, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)C(CH3)2CH2Cl, -NHC(O)C(CH3)2CH2CH3-фталимидо,
-NHC(O)-1-фенил-1-циклопентила, -NHC(O)-1-метил-1-циклогексила, NHC(S)NHC(CH3)3, -NHC(O)NHC(CH3)3 или -NHC(O)NHPh.
| US 4942184 A, 1990 | |||
| US 4960790 A, 1990 | |||
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| 0 |
|
SU400971A1 | |
| Способ получения 5-(замещенный фенил)-оксазолидинонов или их серусодержащих аналогов | 1977 |
|
SU888821A3 |
Авторы
Даты
1999-02-10—Публикация
1993-12-13—Подача