Таксол является членом таксанового семейства дитерпенов, имеющих показанную ниже структуру: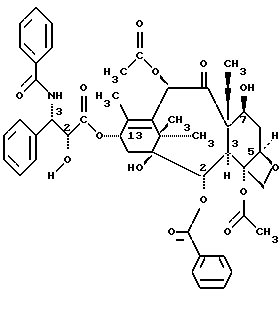
Система нумерации, приведенная для таксола, соответствует рекомендациям Международного союза теоретической и прикладной химии (МСТПХ, Комиссия по номенклатуре органической химии, 1978 г.).
Химия эффективного противоракового средства на основе дитерпеноидного таксола и его аналогов описана Дэвидом Г.И. Кингстоном, который особое внимание уделил его выделению и анализу, структурным модификациям, частичному синтезу и зависимости структура-активность. Chemistry of Taxol, Pharmac. Ther., т. 52, стр. 1-34, 1991 г.
Клиническая фармакология таксола описана Эриком К. Ровински и Россом К. Доунхавером, The Clinical pharmacology and Use of Antimicrotubule Agents in Cancer Chemotherapeutics, Pharmac. Ther., т. 52, стр. 35-84, 1991 г. Клинические и доклинические исследования таксола описаны Уильямом Дж. Шлихенмайером и Даниэлом Д. фон Хоффом, Taxol: A New and Effective Anti-cancer Drug, Anti-Cancer Drugs, т. 2, стр. 519-530, 1991 г.
Таксол и его аналоги являются предметом рассмотрения в различных патентах, включающих, например, патенты США, N 4814470, 4857653, 4942184, 4924011, 4924012, 4960790, 5015744, 5157049, 5059699, 5136060, 4876399, 5227400, 5248796, а также в публикации по договору о патентной кооперации N WO 92/09589, заявках на Европейский патент 90305845.1 (публикация N A2 0400971), 90312366.9 (публикация N A1 0428376), 89400935.6 (публикация N A1 0366841) и 90402333.0 (публикация N 0414610 A1), 87401669.0 (A1 0253739), 92308608.0 (A1 0534708), 92308609.4 (A1 534709), и публикациях по договору о патентной кооперации N WO 91/17977, WO 91/17976, WO 91/13066, WO 91/13053.
Различные способы получения таксола (промежуточных соединений и его аналогов) описываются в журнале Tetrahedron Letters, 1992, 33, 5183; J.Org. Chem., 1991,56,1681 и J.Org.Chem., 1991,56, 5114, в публикациях WO 94/07876, WO 94/07877, WO 94/07878 и WO 94/07879. См. также патент США N 4924011 (и заменяющий патент N 34277 от 8 июня 1993 г.) и журнал Tetrahedron Letters, 35, 4483 (1994).
Чен и др. , Serendipitous Synthesis of a Cyciopropane-Containing Taxol Analog via Anchimeric Participation of Unactivated Angular Methyl Group, Advance ACS Abstracts, т. 1, N 2, 15 июля 1993 г., описали способ обработки производного 7-эпитаксола с помощью трехфтористой диэтиламиносеры в дихлорметане, в результате чего произошла неожиданная реакция, в которой участвовала C-19 метильная группа и произошло образование циклопропанового кольца. См. также журнал J. Org.Chem., 1993, 58, 4520 (13 августа 1993 г.) и патент США N 5254580 (выданный 19 октября 1993 г.).
В патенте США N 5248796 (выдан 28 сентября 1993 г.) описаны производные 10-дезацетокси-11,12-дигидротаксол-10,12(18)-диенов и способ получения 10-дезацетокситаксола.
В заявке на Европейский патент N 0558959 A1 рассматриваются различные фосфонокси- и карбонат-2'-таксольные производные таксола с повышенной растворимостью в воде.
Водорастворимые аналоги протаксола описаны Николау К. К., Римером К., Керром М.А., Райдаутом Д., Вразидло В., Nature, 364:464-66 (1993 г).
Аналоги таксола на основе C-2 замещенного бензоата и их синтез описаны в журналах J.Am.Chem.Soc., 1994, 116, 4097-98 и Bioorganic & Medical Chemistry Letters, т. 4, N 3, 479-82, 1994 г.
Предметом настоящего изобретения являются аналоги Δ12,13- изотаксола формулы I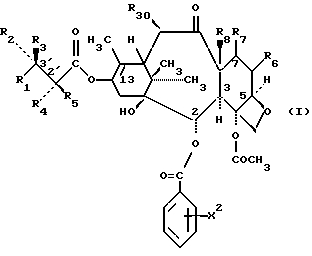
Соединения формулы I являются полезными для лечения таких же раковых заболеваний, для которых была показана активность таксола, в том числе рак яичников, рак молочной железы и злокачественная меланома, а также рак легких, рак желудка, рак прямой кишки, рак головы и шеи и лейкоз.
Химические формулы различных соединений или молекулярных фрагментов, приведенные в описании и формуле изобретения, могут содержать разные заместители, помимо четко указанных в структуре. Эти заместители обозначаются буквой или буквой с последующим цифровым подстрочным индексом, например, Zi или Ri, где i - целое число. Эти заместители являются одновалентными или двухвалентными, то есть они представляют собой группу, присоединенную к соединению с помощью одной или двух химических связей. Например, группа Z1 является двухвалентным заместителем, присоединяемым к соединению формулы CH3-C(= Z1)H. Группы Ri и Rj представляют собой одновалентные заместители, присоединяемые к соединению формулы CH3-CH2-С(Ri)(Rj)-H. Если химические формулы представлены как линейные, как это было показано выше, заместители, находящиеся в скобках, присоединены непосредственно к атому, расположенному слева от заместителя, заключенного в скобки. Если в скобки заключены два или большее число последовательных заместителей, то каждый последующий заместитель присоединен к предшествующему атому слева, который не заключен в скобки.
Таким образом, в приведенной выше формуле Ri и Rj присоединены к предшествующему атому углерода. Кроме того, для любой молекулы с установленной системой нумерации атомов углерода, такой, как таксол, атомы углерода обозначаются как Ci, где i является целым числом, соответствующим номеру атома углерода. Например, C6 обозначает 6-положение атома углерода или номер атома углерода в ядре в соответствии с традиционным обозначением, принятом в этой области.
В химических формулах или их частях, представленных как линейные, атомы располагаются в виде линейной цепи. Символ " - " означает связь между двумя атомами в цепи. Так, CH3-O-CH2-CH(Ri)-CH3 означает соединение 2-замещенного-1-метоксипропана. Аналогичным образом, символ "=" означает двойную связь, например, CH2=C(Ri)-O-CH3, а символ ≡ означает тройную связь, например, HC ≡ C-CH(Ri)-CH2-CH3. Карбонильные группы представлены одним из двух способов: -CO- или -C(=O)-, причем предпочтительно в более простой форме.
Химические формулы циклических (кольцевых) соединений или молекулярных фрагментов могут иметь линейное обозначение. Так, соединение 4-хлор-2-метилпиридина можно представить линейно с помощью формулы N*=C(CH3)-CH-CCl-CH= C*H с учетом того, что атомы, отмеченные звездочкой (*), присоединены друг к другу, образуя кольцо. Аналогичным образом, циклический молекулярный фрагмент, 4-(этил)-1-пиперазинил, можно представить в виде -N*-(CH2)2-N(C2H5)-CH2-C*H2.
Точно так же 2-фурил можно представить в виде -C*-O-CH=CH-C*H=, а 2-тиенил в виде -C*-S-CH=CH-C*H=.
Жесткая циклическая (кольцевая) структура для представленных здесь соединений определяет ориентацию в отношении плоскости кольца для заместителей, присоединенных к каждому атому углерода жесткого циклического соединения. У насыщенных соединений, имеющих два заместителя, присоединенных к атому углерода, который является частью циклической системы, -C(X1)(X2)-, два заместителя могут находиться в аксиальном или экваториальном положении относительно кольца и могут менять аксиальное положение на экваториальное и наоборот. Однако положение двух заместителей относительно кольца и друг друга остается постоянным. Хотя любой заместитель может периодически находиться в плоскости кольца (экваториальное положение), а не выше или ниже этой плоскости (аксиальное положение), один заместитель постоянно находится над другим. В химических структурных формулах, определяющих такие соединения, заместитель (X1), который находится "под" другим заместителем (X2), определяется как имеющий альфа (α)- конфигурацию, и присоединение к атому углерода обозначается пунктирной или точечной линией, то есть символом "_ _ _ " или "...". Соответствующий заместитель (X2), присоединенный "над" другим заместителем (X1), определяется как имеющий бета (β)- конфигурацию, и присоединение к атому углерода обозначается сплошной линией. Если заместитель является двухвалентным, валентность может быть указана в определении этого заместителя совместно или отдельно либо обеими способами. Например, заместитель Ri присоединенный к атому углерода как -C(=Ri) - может быть двухвалентным и определяться как оксо или кето (образуя карбонильную группу (-CO-)) или как два отдельно присоединенных одновалентных заместителя α-Ri-j и β-Ri-k. Если двухвалентный заместитель Ri определяется как два одновалентных заместителя, то обозначение двухвалентного заместителя осуществляется как α-Ri-j:β-Ri-k или подобным образом. В таком случае оба заместителя α-Ri-j и β-Ri-k присоединяются к атому углерода с образованием -C(α-Ri-j)(β-Ri-k). Например, если двухвалентный заместитель R6, -C(=R6) - состоит из двух одновалентных заместителей, то двумя одновалентными заместителями являются α-R6-1:β-R6-2 ... α-R6-9:β-R6-10 и т.д., образуя -C(α-R6-1)(β-R6-2)-, ... -C(α-R6-9)(β-R6-10)- и т. д. Аналогичным образом, для двухвалентного заместителя R11'-C(=R11) - двумя одновалентными заместителями являются α-R11-1:β-R11-2. В случае заместителя в кольце, для которого отсутствуют α- и β- ориентации (например, из-за наличия двойной углеродной связи в кольце), и в случае заместителя, присоединенного к атому углерода, который не является частью кольца, используется вышеуказанное обозначение, но обозначения α и β опускаются.
Аналогично тому, как двухвалентный заместитель можно определить в виде двух отдельных одновалентных заместителей, два одновалентных заместителя можно определить вместе с образованием двухвалентного заместителя. Например, в формуле -C-1(Ri)H-C2(Rj)H- (C1 и C2 произвольно обозначают соответственно первый и второй атомы углерода) Ri и Rj можно определить вместе с образованием (1) второй связи между C1 и C2 или (2) в виде такой двухвалентной группы как окса (-O-), и такая формула представляет эпоксид. Если Ri и Rj определяются вместе с образованием более сложной части, такой, как группа -X-Y-, то ее ориентация такова, что C1 в вышеуказанной формуле присоединяется к X, а C2 - к Y. Таким образом, определение ...Ri и Rj, вместе взятые, образуют -CH2-CH2-O-CO-... означает лактон, в котором карбонил присоединен к C2. Однако определение ...Ri и Rj, вместе взятые, образуют -CO-O-CH2-CH2- означает лактон, в котором карбонил присоединен к C1.
Число атомов углерода в заместителях обозначается одним из двух способов. В соответствии с первым способом перед обозначением заместителя ставится префикс C1-C4, где 1 и 4 являются целыми числами, соответствующими минимальному и максимальному числу атомов углерода в заместителе. Этот префикс отделяется от названия заместителя пробелом. Например, C1-C4-алкил означает алкил, содержащий от 1 до 4 атомов углерода (включая его изомерные формы, если не дано четкое указание обратного). Этот префикс без последующего названия означает общее число атомов углерода в заместителе. Так, C2-C4-алкоксикарбонил означает группу CH3-(CH2)n-O-CO, в которой n = 1 или 2. В соответствии со вторым способом обозначается число атомов углерода каждой части путем заключения определения Ci-Cj в скобки и расположения непосредственно (без пробела) перед определяемой частью названия заместителя. При таком обозначении (Ci-Cj)алкоксикарбонил имеет такое же значение, что и C2-C4-алкоксикарбонил, так как C1-C3 относится только к числу атомов углерода в алкоксильной группе. Аналогичным образом, хотя как C2-C6-алкоксиалкил, так и (C1-C3)алкокси (C1-C3)алкил определяют алкоксиалькильные группы, содержащие от 2 до 6 атомов углерода, они отличаются друг от друга, так как в соответствии с первым определением алкоксильная или алкильная часть может одна содержать 4 или 5 атомов углерода, а в соответствии со вторым определением это число ограничивается в любой из этих групп 3 атомами углерода.
Если соединения по настоящему изобретению содержат достаточно сложный (циклический) заместитель, его обозначение приводится в (скобках), при этом оно имеет такое же определение в одной из схем, где также дается химическая структурная формула этого заместителя.
Термин Boc означает С(O)O-трет-бутил, Troc означает C(O)CH2CCl3, TES означает Si(Et)3, Ph означает фенил, Ac означает С(O)CH3 и Bz, означает C(O)Ph.
Предметом настоящего изобретения являются аналоги 7-дезокси -Δ12,13- изотаксола общей формулы I
в которой X2 выбирают из группы, включающей -H, -C1-C4-алкил, -C1-C3-алкокси (предпочтительно -OCH3), галоген (предпочтительно -Cl), -C1-C3-алкилтио, -трифторметил, -C2-C6- диалкиламино, бензилоксиметил, циано, азид (N3) или нитро;
R1 выбирают из группы, включающей -CH3, -C6-H5 или фенол, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро; -2-фурил, 2-тиенил, 1-нафтил, 2-нафтил или 3,4-метилендиоксифенил;
R2 выбирают из группы, включающей -H, -NHC(O)H, -NHC(O)C1-C10-алкил (предпочтительно -NHC(O)C4-C6-алкил), -NHC(О)фенил, -NHC(О)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NHC(O)OCH2фенил, -NH2, -NHSO2-4-метил-фенил, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -HC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(О)O-4-тетрагидропиранил, -NHC(O)CH2С(CH3)3, -NHC(O)C(CH3)3, -NHC(O)ОС1-С10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)NHPh, -NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -NHC(O)C3-C6-циклоалкил, -NHC(O)OC(CH2CH3)2CH3-, -NHC(O) ОС(CH3)2CH2Cl,
-NHC(O)ОС(CH3)2CH2CH3, фталимидо, -NHC(O)-1-фенил-1-циклопентил, -NHC(O)-1-метил-1-циклогексил,- NHC(S)NHC(CH3)3 или -NHC(O)NHCC(CH3)3;
R3 выбирают из группы, включающей -H, -NHC(O)ОС(CH3)3, при условии, что один из R2 и R3, представляет -H, и оба R2 и R3 не являются одновременно -H;
R4 является -H или его выбирают из группы, включающей -OH, -OAc (-ОС(O)CH3), -ОС(O)OCH2С(Cl)3, -OCOCH2CH2NH3+ HCOO, -NHC(O)фенил, -NHC(O)ОС(CH3), -OC2CH2COOH и его фармацевтически приемлемую соль, -OCO(CH2)3COOH и его фармацевтически приемлемую соль, и -ОС(O)-Z-С(O)R'[где Z-этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), -CH=CH-, 1,2-циклогексан или 1,2-фенилен, R'- -OH, -OH основание, -NR2'R3', -OR3', -SR3', -OCH2C(O)NR4'R5', где R2' является -H или -CH3, R3' является -(CH2)nNR6'R7' или (CH2)nN+R6'R7'R8'X, где n = 1-3, R4' является -H или -C1-C4-алкил, R5' представляет -H, -C1-C4-алкил, бензил, гидроксиэтил, -CH2СО2H или диметиламиноэтил, R6' и R7' представляют -CH3, -CH2CH3, бензил или R6' и R7' вместе с атомом азота из группы NR6'R7' образуют пирролидино, пиперидино, морфолино или N-метилпиперазино группу; R8' представляет -CH3, -CH2CH3 или бензил, X - галогенид, а основанием является NH3, (HOC2H4)N, CH3N(С2H4)NH, NH2(CH2)6NH2, N - метилглюкамин, NaOH или KOH], -ОС(О)(CH2)nNR2R3 [где n означает 1-3, R2 представляет -H или -C1-C3алкил, a R3 представляет -H или -C1-C3алкил], -ОС(O)CH(R'')NH2 [где R'' выбирают из группы, включающей -H, -CH3), -CH2CH(CH3)2, - CH(CH3)CH2CH3, -CH(CH3)2, CH2фенил, -(CH2)4NH2, -CH2 CH2COOH, -(CH2)3NHC(=NH)NH2, остаток пролина аминокислоты, -ОС(O)CH=CH2, -С(O)CH2CH2С(O)NHCH2CH2SO3Y+, -ОС(O)CH2CH2С(O)NHCH2CH2CH2SO3) Y+, где Y+ является Na+ или
или N+(Bu)4, -ОС(O)CH2CH2С(O)OCH2CH2OH;
R5 означает -H или -OH при условии, что, если R5 является -OH, R4 представляет -H, и также при условии, что если R5 является -H, R4 не является -H;
R6 означает -H:-H, если 5-7 является α-R71:β-R72, где один из R71 и R72 является -H, а второй из R71 и R72 является -X7 , где X7, представляет галоген или азидо (-N3) и R8 представляет -CH3;
R6 означает -H: -H, если R7 является α-H:β-R74, где R74 и R8, вместе взятые, образуют циклопропиловое кольцо;
R6 означает R65: R66, если R7 является R75:R76, где один из R65 и R66 вместе с одним из R75:R76 образуют вторую связь между атомами углерода, к которым они присоединяются, а второй из R65 и R66 является -H и второй из R75 и R76 является -H и где R8 представляет - CH3;
R6 означает -H:-H, если R7, является α-R81:β-R82, где один из R81 и R82 представляет -H, а второй из R81 и R82 представляет -OH или -H и R8 является -CH3;
R6 означает -H:-H, если R7 является α-R91:β-R92, где один из R91 и R92 представляет -H, а второй из R91 и R92 представляет -W, где W выбирают из группы, включающей -ОС(О)H, -O-C1-C6-алкил, -O-C3-C6-циклоалкил, -O-(CH2)nфенил, где n = 1-6, -O-С(O)C1-C10-алкил, -O-С(О)фенил, -O-С(О)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3- алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-С(О)нафтил, -O-С(О)нафтил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C4-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-С(O)Oфенил, -O-С(О)Oфенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-С(О)Онафтил, -O-С(О)Oнафтил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-С(О) OC1-C10алкил, -O-С(O)NHC1-C10-алкил, -O-С(О)NHфенил, -O-С(O)NHфенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-С(O)NHнафтил, -O-С(O)NHнафтил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-С(O)OCH2CHCl2, -O-C(O)OCH2CCl3, OSi(R16)3[где R16, имеющий одинаковые или разные значения, выбирают из C1-C6-алкила или цикло(C5-C8)-алкила], -O-CH2-O-C1-C6-алкил, -O-CH2O-(CH2)nфенил, где n = 1-3, -O-CH2-O-(CH2)nфенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, и где n = 1-3, -O-CH2-O-CH2-CXqH3-q, где q = 0-3, X - галоген, а R8 представляет -CH3;
R30 означает -H, OH или -OC(O)CH3;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу.
Предпочтительными соединениями по настоящему изобретению являются соединения формулы I, в которой R1 - фенил или фенил, замещенный галогеном, R2 является -NHC(O)C2H5, R3 и R5 представляют -H, R4 является -OH и R30 означает -OH или -OC(O)CH3. Другими предпочтительными соединениями по настоящему изобретению являются соединения формулы I, в которой R1 предпочтительно является фенилом или фенилом, замещенным галогеном, R2 является -NHC(O)OC(CH3)3, R3 и R5 являются -H, R4 является -OH и R30 представляет -H или -COCH3. Еще один предпочтительный вариант осуществления настоящего изобретения включает соединения формулы I, в которых R1 предпочтительно является фенилом или фенилом, замещенным галогеном, R2 является -NHC(O)NHC(CH3)3, R3 и R5 представляют -H, R4 представляет -OH и R30 представляет -OH или -OCOCH3.
Один из вариантов осуществления настоящего изобретения включает соединения формулы I, в которой R1 выбирают из группы, включающей -CH3, -C6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6- диалкиламино, гидрокси или нитро, a R2 выбирают из группы, включающей -H,-NHC(O)H, -NHC(O)C1-C10-алкил (предпочтительно -NHC(O)C4-C6-алкил), -NHC(O)фенил, -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NHC(O)OCH2фенил, -NH2, -NHSO2-4-метилфенил, -NHC(O)CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)O-4- тетрагидропиранил, -NHC(O)CH2 C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро.
Другой вариант осуществления настоящего изобретения включает соединения формулы I, в которой X2 является -H.
Еще один вариант осуществления настоящего изобретения включает соединения формулы I, в которой X2 является -H;
R1 выбирают из группы, включающей -CH3, -C6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -2-фурил, 2-тиенил, 1-нафтил, 2-нафтил или 3,4-метилендиоксифенил;
R2выбирают из группы, включающей -H, -NHC(O)H, -NHC(O)C1-C10-алкил (предпочтительно -NHC(O)C4-C6-алкил), -NHC(O)фенил, -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NHC(O)OCH2фенил, -NH2, -NHSO4-4-метилфенил, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)NHPh, -NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -NHC(O)C3-C8-циклоалкил, -NHC(O)OC(CH2CH3)2CH3, -NHC(O)OC(CH2)3CH2CI,
-NHC(O)OC(CH3)2CH2CH3: фталимидо, -NHC(O)-1-фенил-1-циклофенил, -NHC(O)-1-метил-1-циклогексил, -NHC(S)NHC(CH3)3 или -NHC(O)NHCC(CH3)3;
R3 выбирают из группы, включающей -H, -NHC(O)фенил или -NHC(O)OC(CH3)3, при условии, что один из элементов R2 и R3, является -H, а оба элемента R2 и R3 не являются -H;
R4 является -H или его выбирают из группы, включающей -OH, -OAc (-OC(O)CH3), -OC(O)OCH2C(Cl)3, OCOCHNH3 + HCOO-, -NHC(O)фенил, -NHC(O)OC(CH3)3, - OCOCH2CH2COOH и его фармацевтически приемлемые соли, -OCO(CH2)3COOH и его фармацевтически приемлемые соли и -OC(O)-Z-C(O)-R'[где Z представляет этилен (-CH2CH2), пропилен (-CH2CH2CH2-), -CH=CH-, 1,2-циклогексан или 1,2-фенилен, R1 представляет -OH, -OH основание, -NR'2R'3, -OR'3, -OCH2C(O)NR'4R'5, где R'5 является -H или -CH3, R'3 является -(CH2)nNR'6R'7, или (CH2)nNR'6R'7R'8X, где n = 1-3, R'4 является -H или -C1-C4-алкилом, R'5 представляет -H, -C1-C4алкил, бензил, гидроксиэтил, -CH2CO2H или диметиламиноэтил, R'6 и R7' являются -CH3, -CH2CH3, бензилом, или R6' и R7' вместе с атомом азота из группы NR'6R'7 образуют пирролидино, пиперидино, морфолино или N-метилпиперизино группу; R'8 является -CH3, -CH2CH3 или бензилом, X - галогенид, и основанием является NH3, (HOC2H4)3, N(CH3)3, CH3N(C2H4)2NH,
NH2(CH2)6NH2, N-метилглюкамин, NaOH или KOH], -OC(O)(CH2)nNR2R2 [где n = 1-3, R2 является -H или C1-C3-алкилом или R3 является -H или -C1-C3-алкилом] , - OC(O)CH(R'') NH2 [где R'' выбирают из группы, включающей -H, -CH3, -CH2 CH(CH3)2, -CH(CH3)CH2CH3, -CH(CH3)2, CH2фенил, -(CH2)4 NH2, -CH2CH2COOH,
-(CH2)3NHC(= NH)NH2] , остаток пролина аминокислоты, OC(O)CH= CH2, -C(O)CH2CH2C(O)NHCH2CH2SO3, Y+, OC(O)CH2CH2C(O)NHCH2CH2CH2SO3-,
Y+, где Y+ означает Na+ или N+(Bu)4, -OC(O)CH2CH2C(O)OCH2CH2OH;
R5 является -H или -OH при условии, что если R5 является -OH, R4 представляет -H, а также при условии, что если R5 является -H, то R4 не является -H;
R6 означает -H:-H, если R7 является α-R71:β-R72, где один из R71 и R72 представляют -H, а второй из R71и R72 представляет -X7, где X7 - галоген или азидо (-N3), и R8 является -CH3;
R6 означает -H: -H, если R7 является α-H:β-R74, где R74 и R8, вместе взятые, образуют циклопропильное кольцо;
R6 означает R65: R66, если R7 является R75:R76, где один из R65 и R66 вместе с одним из R75 и R76 образуют вторую связь между атомами углерода, к которым они присоединяются, а второй из R65 и R66 представляет -H, второй из R75 и R76 представляет -H, и где R8 является -CH3;
R6 означает -H:-H, если R7 является α-R81:β-R82, где один из R81 и R82 представляет -H, а второй из R81 и R82 представляет -OH или -H, и R8 является -CH3;
R6 означает -H:-H, если R7 является α-R91:β-R92, где один из R91 и R92 представляет -H, а второй из R91 и R92 представляет -W, где W выбирают из группы, включающей -OC(O)H, -O-C1-C6-алкил, - O-C1-C6-циклоалкил, -O-(CH2)nфенил, где n = 1-6, -O-C(O)C1-C10-алкил, -O-C(O)фенил, -O-C(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-C(O)нафтил, -O-C(O)нафтил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-C(O)Oфенил, -O-C(O)Oфенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-C(O)Oнафтил, -O-C(O)Oнафтил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-C(O)OC1-C10-алкил, -O-C(O)NHC1-C10-алкил, -O-C(O)NHфенил, -O-C(O)NHфенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C6-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-C(O)NНнафтил, -O-C(O)NHнафтил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, -O-C(O)OCH2CHCl2, -O-C(O)OCH2CCl3, -OSi(R16)3 [где R16 является C1-C6-алкилом] , - O-CH2-O-C1-C6-алкил, -O-CH2-O-(CH2)nфенил, где n = 1- 3, -O-CH2-O-(CH2)nфенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро, и где n = 1-3, -O-CH2-O-CH2-CXqH3-q, где q = 0-3 и X - галоген, и R8 является -CH3;
R30 является -H, OH или -OC(O)CH3;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу.
Еще один вариант осуществления настоящего изобретения включает соединения формулы I, в которой X2 находится в орто-, мета- или пара-положении (предпочтительно в мета- или пара-положении, еще предпочтительнее в мета-положении) и его выбирают из группы, включающей -C1-C4-алкил, -C1-C3-алкокси (предпочтительно -OCH3), галоген (предпочтительно -Cl), -C1-C3-алкилтио, трифторметил, -C2-C6диалкиламино, бензилоксиметил, циано, азид (N3) или нитро.
Еще один вариант осуществления настоящего изобретения включает соединения формулы I, в которой X2 находится в орто,- мета- или пара-положении (предпочтительно в мета- или пара-положении, еще предпочтительнее в мета-положении) и его выбирают из группы, включающей -N3, -CN, -OCH3 или -Cl.
Еще один вариант осуществления настоящего изобретения включает соединения формулы I, в которой X2 находится в орто-, мета- или пара-положении (предпочтительно в мета- или пара-положении, еще предпочтительнее в мета-положении) и его выбирают из группы, включающей -N3, -CN, -OCH3 или Cl, и R1 является фенилом или фенилом, замещенным галогеном, R2 является - NHC(O)C6H5, R3 и R5 является -H, R4 является -OH и R30 представляет -OH или -OC(O)CH3.
Еще один вариант осуществления настоящего изобретения включает соединения формулы I, в которой X2 находится в орто-, мета- или пара-положении (предпочтительно в мета- или пара-положении, еще предпочтительнее в мета-положении) и его выбирают из группы, включающей -N3, -CN, -OCH3 или -C1, и R1, предпочтительно представляет фенил или фенил, замещенный галогеном, R2 является -NHC(O)OC(CH3)3, R3, и R5 являются -H, R4 является -OH и R30 представляет -H или -COCH3.
Один из предпочтительных вариантов осуществления настоящего изобретения включает соединения формулы I, в которой X2 представляет -H, R1 представляет фенил или фенил, замещенный галогеном, R2 является -NHC(O)C6H5, R3 и R5 являются -H, R4 является -OH и R30 представляет -OH или -OH(O)CH3.
Еще один предпочтительный вариант осуществления настоящего изобретения включает соединения формулы I, в которой
X2 представляет -H, R1, предпочтительно представляет фенил или фенил, замещенный галогеном, R2 представляет -NHC(O) OC(CH3)3, R3 и R5 являются -H, R4 является -OH и R30 представляет -H или -COCH3.
Предпочтительный вариант осуществления настоящего изобретения включает соединения формулы I, в которой X2 представляет -H, R1 предпочтительно представляет фенил или фенил, замещенный галогеном, R2 является -NHC(O)NHC(CH3)3, R3 и R5 являются -H, R4 является -OH и R30 представляет -OH или -OCOCH3.
Предпочтительный вариант осуществления настоящего изобретения включает соединения формулы I, в которой X2 представляет -H, R1 выбирают из группы, включающей -CH3, -С6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3- алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, и R2 выбирают из группы, включающей -H, -NHC(O)H, -NHC(O)C1-C10-алкил (предпочтительно -NHC(O)C4-C6-алкил), -NHC(O)фенил, -NH(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)С(CH3)=CHCH3, -NHC(O) OC(CH3)3, -NHC(O)фенил, -NH3, -NHSO2-4-метилфенил, -NHC(O) (CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2С(CH3), -NHC(O)С(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)HPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C4-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино или нитро.
Предметом настоящего изобретения являются также аналоги Δ12,13- изотаксола общей формулы IIa: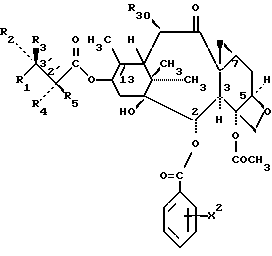
формулы IIIa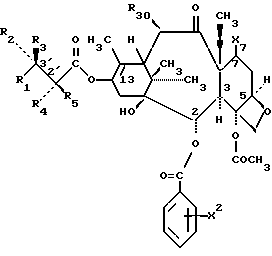
формула IVa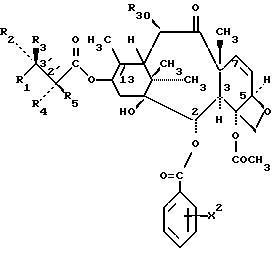
формула Va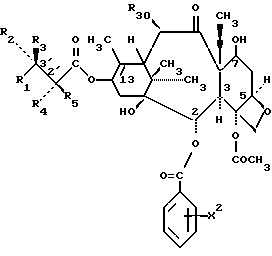
формула IVa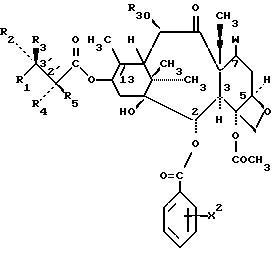
в которых X7 выбирают из группы, включающей -F, -Br, -Cl, -I или -N3; и где W, R1, R2, R3, R4, R5 и R30 и X2 имеют указанные выше значения.
Это изобретение относится также к аналогам Δ12,13 изотаксола общей формулы II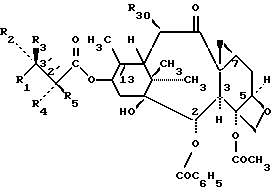
формулы III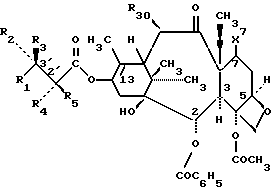
формула IV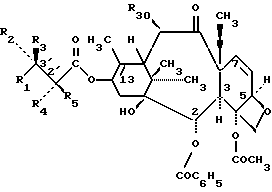
формулы V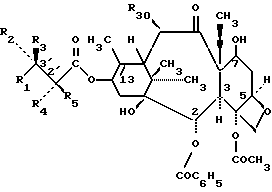
формулы VI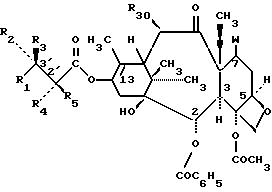
в которых X7 выбирают из группы, включающей -F, -Br, -Cl, -I или -N3; и где W, R1, R2, R3, R4, R5 и R30 имеют указанные выше значения.
В объем настоящего изобретения входят аналоги 7-дезокси -7β,8β- метан -Δ12,13- изотаксола общей формулы II (или IIa), в которой R1 выбирают из группы, включающей -CH3, - C6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C10-алкилтио, трифторметил, C2-C6- лиалкиламино, гидрокси или нитро;
R2 выбирают из группы, включающей -H, -NHC(O)C1-C10-алкил (предпочтительно -NHC(O)C4-C6-алкил), -NHC(O)фенил, -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C10-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NH2, -NHSO2-4-метилфенил, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C10-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C3-C8-циклоалкил;
R3 выбирают из группы, включающей -H, -NHC(O)фенил или -NHC(O)OC(CH3)3, при условии, что один из R2 и R3 является -H, а оба R2 и R3 не являются -H;
R4 является -H или его выбирают из группы, включающей -OH, -OAc (-OC(O)CH3), -OC(O)OCH2C(Cl)3, -OCOCH2CH2NH+ 3HCOO-, -NHC(O)фенил, -NHC(O)OC(CH3)3, -OCOCH2CH2COOH и его фармацевтически приемлемые соли, -OCO(CH2)3COOH и его фармацевтически приемлемые соли, и -OC(O)-Z-C(O)-R1 [где Z-этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), -CH=CH-, 1,2-циклогексан или 1,2-фенилен, R1 является -OH, -OH основанием, -NR'2R'3, -OR'3 -SR'3-, OCH2C(O)NR'4R'5, где R'2 является -H или -CH3, R'3 является - (CH2)nNR'6R'7 или (CH2)nN+R'6R'7R'8X-, где n = 1-3, R'4 является -H или -C1-C4-алкилом, R'5 представляет -H, -C1-C4-алкил, бензил, гидроксиэтил, -CH2CO2H или диметиламиноэтил, R'6 и R'7 представляют -CH3, -CH2CH3, бензил или R'6 и R'7 вместе с атомом азота из группы NR'6R'7 образуют пирролидино, пиперидино, морфолино или N-метилпиперизино группу; R'8 представляет -CH3, - CH2CH3 или бензил, X- представляет галогенид, и основанием является NH3, (HOC2H4)3N, N(CH3)3, CH3(C2H4)2NH, NH2(CH2)6 NH2, N-метилглюкамин, NaOH или KOH], -OC(O) (CH2)nNR2R3 [где n = 1-3, R2 является -H или -C1-C3-алкилом, и R3 является -H или -C1-C3-алкилом] , -OC(O)CH(R'')NH2 [где R'' выбирают из группы, включающей -H, -CH3, -CH2CH(CH3)2, - CH(CH3)CH2CH3, -CH(CH3)2, -CH2фенил,
-(CH2)4H2, -CH2CH2 COOH, -(CH2)3, NHC(=NH)NH2], остаток пролина аминокислоты, OC(O)CH=CH2, -C(O)CH2CH2C(O)NCH2CH2SO- 3, Y+, -OC(O)CH2 CH2C(O)NHCH2CH2CH2SO- 3 Y+, где Y+ является Na+ или N+(Bu)4, -OC(O)CH2CH2C(O)OCH2CH2OH;
R5 представляет -H или -OH при условии, что если R5 является -OH, R4 является -H, а также при условии, если R5 является -H, R4 не является -H;
R30 представляет -H, -OH или -O-C(O)CH3;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу.
Предпочтительный вариант осуществления настоящего изобретения включает соединения формулы II или (IIa), в которой R1 является фенилом или фенилом, замещенным галогеном, R2 является -NHC(O)C6H5, R3 и R5 являются -H и R30 является -C(O)CH3. Другой предпочтительный вариант осуществления настоящего изобретения включает соединения формулы II (или IIa), в которой R1 предпочтительно является фенилом или фенилом, замещенным галогеном, R2 представляет -NHC(O)OC(CH3)3, а R3, R5 или R30 являются -OH. Еще один предпочтительный вариант осуществления этого изобретения включает соединения формулы II (или IIa), в которой R1 предпочтительно является фенилом или фенилом, замещенным галогеном, R2 является - NHC(O)OC(CH3)3, R3 и R5 представляют -H, и R30 является - OC(O)CH3. Еще один предпочтительный вариант осуществления этого изобретения включает соединения формулы I, в которой R1 предпочтительно является фенилом или фенилом, замещенным галогеном, R2 представляет -NHC(O)NHC(CH3)3, R3 и R5 представляют -H, R4 является -OH и R30 является -OH или -OCOCH3.
Дополнительные предпочтительные соединения формулы II включают:
соединение формулы II, а именно 7-дезокси 7β,8β- метан -Δ12,13- изотаксол;
соединение формулы II, а именно 2' [{(2,2,2-трихлорэтил) окси}карбонил] -7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
соединение формулы II, а именно 10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол; и
соединение формулы II, а именно N-дебензоил-n-(третбутил)амино-карбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол.
Предпочтительными соединениями по настоящему изобретению являются соединения формулы II (или IIA), в которой R1 предпочтительно является фенилом или фенилом, замещенным галогеном, R2 представляет -NHC(O)NHC(CH3)3, R3 и R5 являются -H, R4 является -OH и R30 представляет -OH или -OCOCH3.
Другой предпочтительный вариант осуществления настоящего изобретения исключает аналоги 7-галоген -Δ12,13- изотаксола общей формулы III (или IIIa), в которой X7, выбирают из группы, включающей -F, -Br, -Cl, -I или -N3; выбирают из группы, включающей -CH3, -C6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро;
R2 выбирают из группы, включающей -H, -NHC(O)фенил, -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-лиалкиламино, гидрокси или нитро, - -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NH2, -NHSO2-4-мeтилфeнил, -NHC(O)(CH2)3COOH, -NH(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, - NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C3-C8-цикоалкил;
R3 выбирают из группы, включающей -H, -NHC(O)фенил или -NHC(O)OC(CH3)3, при условии, что один из элементов R2 и R3 является -H, а оба элемента R2 и R3 не являются -H;
R4 является -H или его выбирают из группы, включающей -OH, -OAc (-OC(O)CH3), -OC(O)OCH2C(Cl)3, -OCOCH2CH2NH+ 3HCOO_, - NHC(O)фенил, -NHC(O)OC(CH3)3, -OCOCH2CH2COOH и его фармацевтически приемлемые соли, -CO(CH2)3COOH и его фармацевтически приемлемые соли, и -OC(O)-Z-C(O)-R1 [где Z - этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), -CH=CH-, 1,2-циклогексан или 1,2-фенилен, R1 представляет -OH, -OH основание, -NR'2R'3-, -OR'3, -SR'3, -OCH2C(O)NR'4R'5, где R'2 является -H или -CH3, R'3, является -(CH2)nNR'6R'7 или (CH2)nN+R'6R'7R'8X-, где n = 1-3, R'4 является -H или -C1-C4-алкилом, R'5 представляет -H, -C1-C4-алкил, бензил, гидроксиэтил, -CH2CO2H или диметиламиноэтил, R'6 и R'7 представляют -CH3, -CH2CH3, бензил, или R'6 и R'7 вместе с атомом азота из группы NR'6R'7 образуют пирролидино, пиперидино, морфолино или N-метилпиперизино группу; R'8 представляет -CH3, -CH2CH3 или бензил, X- представляет галогенид, и основанием является NH3, (HOC2H4)3N, N(CH3)3, CH3N(C2H4)2NH, NH2(CH2)6NH2, N - метилглюкамин, NaOH или KOH], -OC(O)(CH2)nNR2R3 [где n = 1-3, R2 представляет -H или -C1-C3-алкил и R3 представляет -H или -C1-C3-алкил), -OC(O)CH(R'')NH2 (где R'' выбирают из группы, включающей -H, -CH3, -CH2CH(CH3)2, -CH(CH3)CH2CH3, - CH(CH3)2, -CH2фенил, -(CH2)4NH2, CH2CH2COOH, -(CH2)3NHC(= NH)NH2] , остаток пролина аминокислоты, OC(O)CH=CH2, -C(O)CH2CH2C(O) NHCH2CH2SO3- Y+, -OC(O)CH2CH2C(O)NHCH2CH2CH2 SO- 3Y, где Y+ является Na+ или Na+(Bu)4, -OC(O)CH2CH2C(O)OCH2OH;
R5 представляет -H или - OH при условии, что если R5 является -OH, то R4 является -H, а также при условии, что если R5 является -H, то R4 не является - H;
R30 представляет -H, -OH или -OC(O)CH3;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу.
Соединения формулы III (или IIIa) включают как 7-α- так и 7-β- конфигурацию заместителя галогена в 7-положении. Галогенами являются -F, -Br, -Cl, -I или N3.
В соединениях формулы III (или IIIa): X7 предпочтительно является -F, R3 и R5 предпочтительно являются -H, и R1, предпочтительно является фенилом или фенилом, замещенным галогеном.
Предпочтительными соединениями по настоящему изобретению являются соединения формулы III (или IIIa), в которой R1 предпочтительно является фенилом или фенилом, замещенным галогеном, R2 представляет -NHC(O)NHC(CH3)3, R3 и R5 представляют -H, R4 представляет - OH, и R30 является -OH или -OCOCH3.
Дополнительные предпочтительные соединения формулы III (или IIIa) включают:
соединение формулы III (или IIIa), в которой R4 является -H, a R5 представляет -OH;
соединение формулы III (или IIIa), в которой R4 не является -H, a R5 является -H;
соединение формулы III (или IIIa), в которой R3 является -H, R1 представляет Ph или замещенный фенил;
соединение формулы III (или IIIa), в которой X7 является -F;
соединение формулы III (или IIIa), в которой X7 является -α-F;
соединение формулы III (IIIa), в которой X7, является -F, R4 не является -H и R5 представляет -H;
соединение формулы III (или IIIa), в которой X7 является -F, R3 является -H, и R1 представляет Ph или замещенный фенил;
соединение формулы III, выбираемое из группы, включающей 7-дезокси-7-фтор -Δ12,13- изотаксол и 2'[{(2,2,2-трихлорэтил)окси}карбонил] -7-дезокси-7-фтор- -Δ12,13- изотаксол;
соединение формулы III, в частности N-дебензоил-N-(трет-бутил)амино- карбонил-7-дезокси-7-фтор -Δ12,13- изотаксол.
Дополнительными предпочтительными соединениями формулы III являются соединения, выбираемые из группы, включающей 7-дезокси-7a-фтор- -Δ12,13- изотаксол, 7-дезокси -7β- фтор -Δ12,13- изотаксол, 2'-[{(2,2,2-трихлорэтил)-окси} карбонил] -7-дезокси -7α- фтор -Δ12,13- изотаксол и 2'{(2,2,2-трихлорэтил)-окси} карбонил]-7-дезокси -7β- фтор -Δ12,13- изотаксол.
Другой вариант осуществления настоящего изобретения включает аналоги Δ6,7-Δ12,13- изoтaкcoлa общей формулы IV (или IVa), в которой:
R1 выбирают из группы, включающей -CH3, -C6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро;
R2 выбирают из группы, включающей -H, -NHC(O)H, -NHC(O) C1-C10-алкил, -NHC(O)фенил, -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио,
трифторметил, C2-C6- диалкиламино, гидрокси или нитро, NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NH2, -NHSO2-4-метил-фенил, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-адамантил, -NHC(O)O-3-тeтpaгидpoфуpaнил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2C-(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C3-C8-циклоалкил, а R3, R4, R5 и R30 имеют указанные выше значения.
Предпочтительный вариант осуществления настоящего изобретения включает аналоги Δ6,7-Δ12,13- изотаксола общей формулы IV (или IVa), в которой R1 является фенилом или фенилом, замещенным галогеном, R2 представляет -NHC(O)C6H5, R3 и R5 представляют -H, и R30 является -OC(O)CH3. Другой предпочтительный вариант осуществления этого изобретения включает соединения формулы IV (или IVa), в которой R1 предпочтительно представляет фенил или фенил, замещенный галогеном, R2 представляет -NHC(O)OC(CH3)3, R3 и R5 являются - H, и R30 является -OH.
Еще один предпочтительный вариант осуществления настоящего изобретения включает соединения формулы IV (или IVa), в которой R1 предпочтительно представляет фенил или фенил, замещенный галогеном, R2 является -NHC(O)NHC(CH3)3, R3 и R5 представляют -H, R4 является -OH, и R30 является -OH или - OCOCH3.
Предпочтительными соединениями формулы IV являются:
соединение формулы IV, а именно 7-дезокси -Δ6,7-Δ12,13- изотаксол;
соединение формулы IV, а именно 2'-[{(2,2,2-трихлорэтил)окси}карбонил] -7-дезокси -Δ6,7-Δ12,13- изотаксол; и
соединение формулы IV, а именно 10-ацетил-7-дезокси- Δ6,7-Δ12,13- изотаксол; и
соединение формулы IV, а именно N-дебензоил-N-(третбутил)амино-карбонил -7-дезокси -Δ6,7-Δ12,13- изотаксол.
Предпочтительный вариант осуществления настоящего изобретения включает соединения формулы V (или Va), в которой R1 представляет фенил или фенил, замещенный галогеном, R2 представляет -NHC(O)C6H5, R3 и R5 являются -H и R30 является -C(O)CH3.
Другой предпочтительный вариант осуществления настоящего изобретения включает соединения формулы V (или Va), в которой R1 предпочтительно представляет фенил или фенил, замещенный галогеном, R2 представляет -NHC(O)OC(CH3)3, а R3, R5 и R30 являются -H. Еще один предпочтительный вариант осуществления настоящего изобретения включает соединения формулы II, в которой R1 предпочтительно представляет фенил или фенил, замещенный галогеном, R2 представляет -NHC(O)OC(CH3)3, R3 и R5 являются -H, и R30 является -C(O)CH3. Другой предпочтительный вариант осуществления настоящего изобретения включает соединения формулы I, в которой R1, предпочтительно представляет фенил или фенил, замещенный галогеном, R2 представляет -NHC(O)NHC(CH3)3, R3 и R5 представляют -H, R4 является -OH и R30 является -OH или -OCOCH3.
Еще одним вариантом осуществления настоящего изобретения являются аналоги изотаксола общей формулы V (или Va), в которой R1 выбирают из группы, включающей -CH3, -C6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро; R2 выбирают из группы, включающей -H, -NHC(O)фенил, -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C(CH3)=CHCH3, - NHC(O)OC(CH3)3, -NH2, -NHSO2-4-метилфенил, - NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-aдaмaнтил, -NHC(O)-3-тетрагидрофуранил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C3-C8циклоалкил; а R3, R4, R5 и R30 имеют указанные выше значения.
Соединения формулы V (или Va) включают как 7-α-, так и 7-β- конфигурацию гидрокси-заместителя в 7-положении.
Один из вариантов осуществления настоящего изобретения включает аналоги 7-дезокси-7-W -Δ12,13- изотаксола общей формулы VI (и VIa), в которой R1 выбирают из группы, включающей -CH3, -C6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро;
R2 выбирают из группы, включающей -H, -NHC(O)C1-C10-алкил (предпочтительно - NHC(O)C4-C6-алкил), -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C(CH3)= CHCH3, -NHC(O)OC(CH3)3, -NH2, -NHSO2-4-метилфенил, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C3-C8-циклоалкил;
R3 выбирают из группы, включающей -H, -NHC(O)фенил или -NHC(O)OC(CH3)3, при условии, что один из элементов R2 и R3 является -H, а оба элемента R2 и R3 не являются -H;
R4 представляет -H или его выбирают из группы, включающей -OH, -OAc (-OC(O)CH3), -OC(O)OCH2C(Cl), -OCOCH2CH2NH+ 3HCOO-, -NHC(O)фенил, NHC(O)OC(CH3)3, -OCOCH2CH2COOH или его фармацевтически приемлемые соли, -OCO(CH2)3COOH и его фармацевтически приемлемые соли, и -OC(O)-Z-C(O)-R', [где Z-этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), -CH=CH-, 1,2-циклогексан или 1,2-фенилен, R1 представляет -OH, -OH основание, -NR'2R'3, -OR'3, SR'3, - OCH2C(O)NR'4R'5, где является -H или -CH3, R'3 является -(CH2)nR'6R'7 или (CH2)nN+R'6R'7R'8X-, где n = 1-3, R'4 представляет -H или -C1-C4-алкил, R'5 представляет -H, -C1-C4-алкил, бензил, гидроксиэтил, -CH2CO2H или диметиламиноэтил, R'6 и R'7 представляют -CH3, -CH2CH3, бензил, или R'6 и R'7 вместе с атомом азота из группы NR'6R'7 образуют пирролидино, пиперидино, морфолино или N-метил-пиперизино группу; R'8 представляет -CH3 , -CH2CH3 или бензил, X- представляет галогенид, и основанием является NH3, (HOC2H4)3N, N(CH3)3, CH3N(C2H4)NH, NH2(CH2)6NH2, N-метилглюкамин, NaOH или KOH], -OC(O)(CH2)n NR2R3 (где n = 1-3, R2 представляет -H или -C1-C3-алкил и R3 является -H или -C1-C3-алкилом], -OC(O)CH(R'')NH2 [где R'' выбирают из группы, включающей -H, -CH3, -CH2CH (CH3)2, -CH(CH3)CH2CH3, -CH(CH3)2, -CH2фенил, -(CH2)4NH2, -CH2CH2COOH, -(CH2)3 NHC(=NH)NH2], остаток пролина аминокислоты, -OC(O)CH=CH2, -C(O)CH2CH2C(O)NHCH2CH2SO3-Y+, -OC(O)CH2CH2C(O)NHCH2CH2CH2 SO- 3Y, где Y+ является Na+ или Na+(Bu)4, -OC(O)CH2CH2C(O)OCH2CH2OH;
R5 представляет -H или -OH при условии, что если R5 является -OH, то R4 является -OH, а также при условии, что если R5 является -H, то R4 не является -H;
R30 представляет -H, -OH или -OC(O)CH3;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу.
Другой вариант осуществления настоящего изобретения включает аналоги 7-дезокси-7-W -Δ12,13- изотаксола общей формулы VI (и VIa), в которой:
R1 выбирают из группы, включающей -CH3, -C6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро;
R2 выбирают из группы, включающей -H, -NHC(O)C1-C10-алкил (предпочтительно -NHC(O)C4-C6-алкил), -NHC(O)фенил, -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NH2, -NHSO4-4-метилфенил, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C3-C8-циклоалкил; и
W выбирают из группы, включающей пропионил, O-(2,2-дихлорэтил)-карбонат, O-(2-хлорэтил)карбонат, O-метил, O-пропил, O-аллил, O-метокси-метил, O-этоксиметил, O-метокси-этоксиметил, O-бензилоксиметил, O-(2,2,2-трихлорэтокси)метил, O-(2,2,2-трихлорэтокси)метоксиметил, и
R3, R4, R5 и R30 имеют указанные выше значения.
Еще один предпочтительный вариант осуществления настоящего изобретения включает 7-дезокси-7-W -Δ12,13- изотаксола общей формулы VI, в которой:
R1 выбирают из группы, включающей -CH3, -C6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро;
R2 выбирают из группы, включающей -H, -NHC(O)C1-C10-алкил (предпочтительно -NHC(O)C4-C6-алкил), -NHC(O)фенил, -NHC(O)фенил, замещенный, одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C(CH3)=CHCH3, -NHC(O)OC(CH3)3, -NH2, -NHSO2-4-метилфенил, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -OH, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -NHC(O)C3-C8циклоалкил;
W выбирают из группы, включающей O-этоксиметил, O-метоксиэтокси-метил, O-бензилоксиметил, O-(2,2,2-трихлорэтокси) метил, O-(2,2,2-трихлорэтокси)метоксиметил, и
R3, R4, R5 и R30 имеют указанные выше значения.
Предпочтительный вариант осуществления настоящего изобретения включает соединения формулы VI, в которой R1 представляет фенил или фенил, замещенный галогеном, R2 является -NHC(O)C6H5, R3 и R5 являются -H, и R30 является -C(O)CH3. Другой предпочтительный вариант осуществления настоящего изобретения включает соединения формулы VI, в которой R1 предпочтительно представляет фенил или фенил, замещенный галогеном, R2 представляет -NHCOOC(CH3)3, и R3, R5 и R30 являются -H.
Еще один предпочтительный вариант осуществления настоящего изобретения включает соединения формулы VI, в которой R1 предпочтительно представляет фенил или фенил, замещенный галогеном, R2 представляет -NHCOOC(CH3)3, R3 и R5 представляют -H и R30 является -OC(O)CH3.
Еще один предпочтительный вариант осуществления настоящего изобретения включает соединения формулы VI, в которой R1 предпочтительно представляет фенил или фенил, замещенный галогеном, R2 представляет -NHC(O)NHC(CH3)3, R3 и R5 представляют -H, R4 представляет -OH и R30 представляет -OH или -OCOCH3.
В соединениях формулы VI W предпочтительно выбирают из группы, включающей пропионил. O-(2,2-дихлорэтил) карбонат, O-(2-хлорэтил) карбонат, O-метил, O-пропил, O-аллил, O-метоксиметил, O-этоксиметил, O-метокси-этоксиметил, O-бензилоксиметил, O-(2,2,2-трихлорэтокси)метил, O-(2,2,2-трихлорэтокси)метоксиметил, а еще предпочтительнее O-метоксиметил, O-этоксиметил, O-метоксиэтоксиметил, O-бензилоксиметил, O-(2,2,2-трихлорэтокси)метил и O-(2,2,2-трихлоэтокси) метоксиметил.
Примеры -NHC(O)C1-C10-алкила включают - NHC(O)-н-пентил и -NHC(O)CH(CH3)CH2CH3.
Примеры C1-C6-алкила включают алкил с прямолинейными и разветвленными цепями, в частности, метил, этил, изопропил, трет-бутил, изобутил и 2-метил-пентил.
Примеры C1-C3-алкокси включают метокси, этокси, пропокси и их изомерные формы.
Галогеном является -F, -Br, -Cl, -I или N3.
Примеры соединений формулы II по этому изобретению включают:
2'-[{ (2,2,2-трихлорэтил)окси}карбонил]-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-сукцинил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
формиат 2'- β- аланил)-7-дезокси -7β,8β- метан Δ12,13- изотаксола;
2'-глутарил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3N(CH3)2] -7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-( β- сульфопропионил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-(2-сульфоэтиламино)сукцинил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-(триэтилсилил)-7-дезокси -7β-,8β- метан -Δ12,13- изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
2'-(N,N-диэтиаминопропионил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-(N,N-диметилглицил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-(глицил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-(L-аланил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
2'-(L-лeйцил)-7-дeзoкcи -7β,8β- метан -Δ12,13- изотаксол;
2'- (L-изолейцил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-(L-валил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
2'-(L-фенилаланил)-7-дeзoкcи -7β,8β- метан -Δ12,13- изотаксол;
2'-(L-пpoпил)-7-дeзoкcи -7β,8β- метан Δ12,13- изотаксол;
2'-(L-лизил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
2'-(L-глутамил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2'-(L-аргинил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
7-дезокси -7β,8β- метан -Δ12,13- изотаксотир;
10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксотир;
N-дебензоил-N-тетрагидрофуран-3-илоксикарбонил-7-дезокси -7β,8β- метан -Δ12,13 изотаксол;
N-дебензоил-N-(1-адамантоил)-7-дезокси -7β,8β- метан Δ12,13 изотаксол;
N-дебензоил-N-фениламинокарбонил-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
N-дебензоил-N-трет-бутиламинокарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(1-метил-1-циклогексиланоил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(1-фенил-1- циклопентаноил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-фталимидо-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дeбeнзoил-N-тpeт-бутилaминoтиoкapбoнил-7-дeзoкcи -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-трет-амилоксикарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-неопентилоксикарбонил-7-дезоки -7β,8β- метан Δ12,13- изотаксол;
N-дебензоил-N-(2-хлор-1,1-диметилэтил)оксикарбонил-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
N-дебензоил-N-(3-метил-3-пентил)оксикарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
3'-десфенил-3'-(2-фурил)-7-дезокси 7β,8β- метан -Δ12,13- изотаксол;
3'-десфенил-3'-(2-тиенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
3'-десфенил-3'-(1-нафтил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
3'-десфенил-3'-(2-нафтил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
3'-десфенил-3'-(4-метоксифенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
3'-десфенил-3'-(4-хлорфенил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
3'-десфенил-3'-(4-бромфенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
3'-десфенил-3'-(3,4-метилендиоксифенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
3'-десфенил-3'-(3,4-диметоксифенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
3'-десфенил-3'-(4-нитрофенил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
3'-десфенил-3'-(4-фторфенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-метоксибензоил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-хлорфенил) -7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'- (4-фторфенил) -7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3' -десфенил-3'- (4-xлopфeнил)-7- дeзoкcи -7β,8β- метан -Δ12,13 изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-фтopфeнил)-7- дeзoкcи -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дeзoкси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дeзoкcи -7β,8β- метан Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-мeтoкcифeнил)-7- дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дeбeнзoил-N-(4-метоксибензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси -7β,8β- метан -Δ12,13- изотаксол;
N-дебензоил-N-(трет-бутил)аминокарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу.
Примеры соединений формулы III по настоящему изобретению включают:
2'-[{ (2,2,2-трихлорэтил)окси} карбонил] -7-дезокси-7-фтор -Δ12,13- изотаксол;
7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-сукцинил-7-дезокси-7-фтор -Δ12,13- изотаксол;
Формиат 2'- (β- аланил)-7-дезокси-7-фтор -Δ12,13- изотаксола;
2'-глутарил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3N (CH3)2] -7-дезокси-7-фтор- -Δ12,13- изотаксол;
2'-( β- сульфопропионил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(триэтилсилил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(N,N-диэтиламинопропионил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(N,N-диметилглицил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(глицил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-аланил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-лейцил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-изолейцил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-валил)-7-дезокси-7-фтор Δ12,13- изотаксол;
2'-(L-фенилаланил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-пролил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-лизил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-глутамил)-7-дезокси-7-фтор -Δ12,13- изатоксол;
2'-(L-аргинил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
7-дeзoкcи-7-фтop -Δ12,13- изотаксотир;
10-ацетил-7-дезокси-7-фтор -Δ12,13- изотаксотир;
N-дебензоил-N-тетрагидропиран-4-илоксикарбонил-7-дезокси- 7-фтор -Δ12,13- изотаксол;
N-дeбeнзoил-N-пивaлoил-7-дeзoкcи-7-фтop -Δ12,13- изотаксол;
N-дебензоил-N-n-гексиламинокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-трет-бутиламинокарбонил-7-дезокси-7-фтор Δ12,13- изотаксол;
N-дебензоил-N-(1-метил-1-циклогексиланоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(1-фенил-1-циклопентаноил)-7-дезокси-7-фтор Δ12,13- изотаксол;
N-дебензоил-N-фталимидо-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-трет-бутиламинотиокарбонил-7-дезокси-7-фтор Δ12,13- изотаксол;
N-дебензоил-N-трет-амилоксикарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дeбeнзoил-N-нeoпeнтилoкcикapбoнил-7-дeзoкcи-7-фтop -Δ12,13- изотаксол;
N-дебензоил-N-(2-хлор-1,1-диметилэтил)оксикарбонил-7-дeзoкcи-7-фтop -Δ12,13- изотаксол;
N-дебензоил-N-(3-метил-3-пентил)оксикарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
3'-десфенил-3'-(2-фурил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
3'-десфенил-3'-(2-тиенил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
3'-десфенил-3'-(1-нафтил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
3'-десфенил-3'-(2-нафтил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
3'-десфенил-3'-(4-бромфенил)-7-дезокси-7-фтор Δ12,13- изотаксол;
3'-десфенил-3'-(3,4-метилендиоксифенил)-7-дезокси-7-фтор Δ12,13- изотаксол;
3'-десфенил-3'-(3,4-диметоксифенил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
3'-десфенил-3'-(4-нитрофенил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
3'-десфенил-3'-(4-фторфенил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-метоксибензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-фторфенил)- 7-дезокси-7-фтор -Δ12,13- изотаксол;
N-бензоил-N-(4-фторбензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7- фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7- фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7- фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7- фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси -7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дeзoкcи -7-фтop -Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7- фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил) -7-дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси- 7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7- дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-фторфенил)-7- дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-мeтoкcифенил)-7-дезокси -7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-мeтoкcифенил)-7-дезокси -7-фтор -Δ12,13- изотаксол;
N-бензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси-7-фтор -Δ12,13- изотаксол;
N-дебензоил-N-(4-метоксибензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7- фтор -Δ12,13- изотаксол;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу.
Примеры соединений формулы IV по настоящему изобретению включают:
2'-{ [(2,2,2-трихлорэтил)окси] карбонил]-7-дезокси -Δ6,7-Δ12,13- изотаксол;
7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дезбензоил-N-бензилоксикарбонил-2'-{(2,2,2-трихлорэтил) окси]карбонил} -7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дезбензоил-N-бензилоксикарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-сукцинил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
Формиат 2'- β- аланил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-глутарил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3N (CH3)2]-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'- β- сульфопропионил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(2-сульфоэтиламино)сукцинил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(триэтилсилил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(N,N-диэтиламинопропионил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(N,N-диметилглицил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(глицил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(L-aлaнил)-7-дeзoкcи -Δ6,7-Δ12,13- изотаксол;
2'-(L-лейцил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(L-изолейцил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(L-валил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(L-фенилаланил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(L-пролил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(L-лизил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(L-глутамил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2'-(L-аргинил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
7-дезокси -Δ6,7-Δ12,13- изотаксотир;
10-ацетил-7-дезокси -Δ6,7-Δ12,13- изотаксотир;
N-дебензоил-N-(1-метил-1-циклогексиланоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(1-фенил-1-циклопентаноил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-фталимидо-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-трет-бутиламинотиокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-трет-амилоксикарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-неопентилоксикарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(2-хлор-1,1-диметилэтил) oкcикapбoнил-7-дeзокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(3-метил-З-пентил) оксикарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(2-фурил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(2-тиенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(1-нафтил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(2-нафтил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(4-метоксифенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(4-хлорфенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(4-бромфенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(3,4-метилендиоксифенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(3,4-диметоксифенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
3'-дecфeнил-3'-(4-нитpoфeнил)-7-дeзoкcи -Δ6,7-Δ12,13- изотаксол;
3'-десфенил-3'-(4-фторфенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дeбeнзoил-N-(4-тpeт-бутилбeнзoил)-7-дeзoкcи -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-метоксибензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-фторфенил)- 7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дeзoкcи -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-3'-(4-фтopфeнил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7- дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-фторфенил)-7- дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси -Δ6,7-Δ12,13- изoтaкcoл;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дeзoкcи -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7- дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксифенил) -7-дезокси -Δ6,7-Δ12,13- изотаксол;
N-дебензоил-N-(трет-бутил)аминокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу.
Примеры соединений формулы V по этому изобретению включают:
2'-[{(2,2,2-трихлорэтил)окси}карбонил] -Δ12,13- изотаксол;
-Δ12,13- изотаксол;
2'-сукцинил -Δ12,13- изотаксол;
2'-( β- аланил) -Δ12,13- изотаксол;
2'-глутарил -Δ12,13- изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)N(CH3)2] -Δ12,13- изотаксол;
2'-( β- сульфопропионил) -Δ12,13- изотаксол;
2'-(2-сульфоэтиламидо)сукцинил -Δ12,13- изотаксол;
2'-(3-сульфопропиламидо)сукцинил -Δ12,13- изотаксол;
2'-(триэтилсилил) -Δ12,13- изотаксол;
2'-(трет-бутилдиметилсилил) -Δ12,13- изотаксол;
2'-(N,N-диэтиламинопропионил) -Δ12,13- изотаксол;
2'-(N,N-диметилглицил) -Δ12,13- изотаксол;
2'-(глицил) -Δ12,13- изотаксол;
2'-(L-аланил) -Δ12,13- изотаксол;
2'-(L-лейцил) -Δ12,13- изотаксол;
2'-(L-изолейцил) -Δ12,13- изотаксол;
2'-(L-валил) -Δ12,13- изотаксол;
2'-(L-фенилаланил) -Δ12,13- изотаксол;
2'-(L-пролил) -Δ12,13- изотаксол;
2'-(L-лизил) -Δ12,13- изотаксол;
2'-(L-глутамил) -Δ12,13- изотаксол;
2'-(L-аргинил) -Δ12,13- изотаксол;
-Δ12,13- изотаксотир;
10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-тетрагидропиран-4-илоксикарбонил -Δ12,13- изотаксол;
N-дебензоил-N-пивалоил -Δ12,13- изотаксол;
N-дебензоил-N-n-гексаминокарбонил -Δ12,13- изотаксол;
N-дебензоил-N-(1-метил-1-циклогексиланоил) -Δ12,13- изотаксол;
N-дебензоил-N-(1-фенил-1-циклопентаноил) -Δ12,13- изотаксол;
N-дебензоил-N-фталимидо -Δ12,13- изотаксол;
N-дeбeнзoил-N-тpeт-бутилaминoтиокapбoнил -Δ12,13- изотаксол;
N-дебензоил-N-трет-амилоксикарбонил -Δ12,13- изотаксол;
N-дебензоил-N-неопентилоксикарбонил -Δ12,13- изотаксол;
N-дебензоил-N-(2-хлор-1,1-диметилэтил)оксикарбонил -Δ12,13- изотаксол;
N-дебензоил-N-(3-метил-3-пентил)оксикарбонил -Δ12,13- изотаксол;
3'-десфенил-3'-(2-фурил) -Δ12,13- изотаксол;
3'-десфенил-(2-тиенил) -Δ12,13- изотаксол;
3'-десфенил-3'-(1-нафтил -Δ12,13- изотаксол;
3'-десфенил-3'-(2-нафтил) -Δ12,13- изотаксол;
3'-десфенил-3'-(4-метоксифенил) -Δ12,13- изотаксол;
3'-десфенил-3'-(4-хлорфенил) -Δ12,13- изотаксол;
3'-десфенил-3'-(4-бромфенил) -Δ12,13- изoтaкcoл;
3'-десфенил-3'-(3,4-метилендиоксифенил) -Δ12,13- изотаксол;
3'-десфенил-3'-(3,4-диметоксифенил) -Δ12,13- изотаксол;
3'-десфенил-3'-(4-нитрофенил) -Δ12,13- изотаксол;
3'-десфенил-3'-(4-фтopфeнил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил) -Δ12,13- изотаксол;
N-бензоил-N-(4-трет-бутилбензоил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-метоксибензоил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-фторфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-фтopбeнзoил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-хлорфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-фторфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-фторфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-фторфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-метоксифенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксифенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-хлорфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-хлорфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-хлорфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-фторфенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-метоксифенил -Δ12,13- изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-метоксифeнил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-метоксифенил) -Δ12,13- изотаксол;
N-дебензоил-N-(4-метоксибензоил)-3'-десфенил-3'-(4-метоксифенил) -Δ12,13- изотаксол;
N-дебензоил-N-(трет-бутил)аминокарбонил-3'-десфенил-3'- (4-хлорфенил) -Δ12,13- изотаксол;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу
Дополнительными предпочтительными соединениями по настоящему изобретению являются 7-дезокси -7β,8β- метан -Δ12,13- изотаксотир; N-де (трет-бутилоксикарбонил)-N-(трет-бутил)аминокарбонил-7-дезокси- -7β,8β- метан -Δ12,13- изотаксотир; 7-дезокси-7-фтор -Δ12,13- изотаксотир; N-де (трет-бутилоксикарбонил)-N-(трет-бутил)аминокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксотир; 7-дезокси -Δ6,7-Δ12,13- изотаксотир; и N-де(трет-бутилоксикарбонил)-N-(трет-бутил)аминокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксотир.
Примеры соединений формулы IIa по настоящему изобретению включают:
2-дебензоил-2-(метацианобензоил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
2-дебензоил-2-(метацианобензоил)-2'-[{ (2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(метацианобензоил)-10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксотир;
2-дебензоил-2-(метацианобензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
2-дебензоил-22(метаметоксибензоил)-2'-[{ (2,2,2-трифторэтил)окси} карбонилl -7-дeзoкcи -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-N-дебензоил-N-(трет-бутил)- aминoкapбoнил-7-дeзoкcи -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-2'-[{ (2,2,2-трихлорэтил) окси] -карбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-метахлорбензоил)-10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксотир;
2-дебензоил-2-(метахлорбензоил)-N-дебензоил-N-(трет-бутил) -аминокарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-2'-[{ (2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксотир;
2-дебензоил-2-(метаазидобензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-7-дезокси -7β,8β- метан -Δ12,13- зотаксол;
2-дебензоил-2-(парацианобензоил)-2'-[{ (2,2,2-трихлорэтил)окси} -кapбoнил]-7-дeзoкcи -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксотир;
2-дебензоил-2-(парацианобензоил)-N-дебензоил-N- (трет-бутил)-аминокарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-2'-[{(2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксотир;
2-дебензоил-2-(параметоксибензоил)-N-дебензоил-N- (трет-бутил)-аминокарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-2'-[{ (2,2,2-трихлорэтил)окси}-карбонил] -7-дезокси -7β,8β- метан -Δ12,13 изотаксол;
2-дебензоил-2-(парахлорбензоил)-10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксотир;
2-дебензоил-2-(парахлорбензоил)-N-дебензоил-N-(трет-бутил)аминокарбонил -7-дезокси -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-7-дезокси -7β,8β- метан Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-2'-[{ (2,2,2-трихлорэтил) окси}-карбонил]-7-дезокски -7β,8β- метан -Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-10-ацетил-7-дезокси -7β,8β- метан -Δ12,13- изотаксотир; и
2-дебензоил-2-(параазидобензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -7β,8β- метан -Δ12,13- изотаксол.
Примеры соединений формулы IIIa по настоящему изобретению включают:
2-дебензоил-2-(метацианобензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метацианобензоил)-2'-[{(2,2,2-трихлорэтил) окси}карбонил] -7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метацианобензоил)-N-дебензоил-N-(трет-бутил) -аминокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-2'-[{(2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-N-дебензоил-N-(трет-бутил) -аминокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-2'-[{ (2,1, 2-трихлорэтил) окси}-карбонил]-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-N-дебензоил-N-(трет-бутил) -аминокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-2'-[{ (2,2,2-трихлорэтил)окси} -карбонил]-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-N-дебензоил-N- (трет-бутил)-аминокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-2'-[{(2,2,2-трихлорэтил)окси}-карбонил] -7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-2'-[{ (2,2,2-трихлорэтил)окси} -карбонил] -7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-2'-[{(2,2,2-трихлорэтил) окси}-карбонил] -7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-N-дебензоил-N- (трет-бутил)аминокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-7-дезокси-7-фтор Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-2'-[{ (2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-N-дeбeнзoил-N- (трет-бутил)-аминокарбонил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2-дебензоил-2-(метацианобензоил)-10-ацетил-7-дезокси-7- фтор -Δ12,13- изотаксотир;
2-дебензоил-2-(метаметоксибензоил)-10-ацетил-7-дезокси-7- фтор -Δ12,13- изотаксотир;
2-дебензоил-2-(метахлорбензоил)-10-ацетил-7-дезокси-7- фтор -Δ12,13- изотаксотир;
2-дебензоил-2-(парахлорбензоил)-10-ацетил-7-дезокси-7-фтор -Δ12,13- изотаксотир;
2-дебензоил-2-(парацианобензоил)-10-ацетил-7-дезокси-7-фтор -Δ12,13- изотаксотир;
2-дебензоил-2-(параазидобензоил)-10-ацетил-7-дезокси-7- фтор -Δ12,13- изотаксотир;
2-дебензоил-2-(метаазидобензоил)-10-ацетил-7-дезокси-7- фтор -Δ12,13- изотаксотир;
Примеры соединений формулы IVa по настоящему изобретению включают:
2-дебензоил-2-(метацианобензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метацианобензоил)-2'-[{ (2,2,2-трихлорэтил) окси}-карбонил]-7-дeзoкcи -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метацианобензоил)-10-ацетил-7-дезокси -Δ6,7-Δ12,13- изотаксотир;
2-дебензоил-2-(метацианобензоил)-N-дебензоил-N- (трет-бутил)-аминокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-2'-[{(2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-10-ацетил-7-дезокси -Δ6,7-Δ12,13- изотаксотир;
2-дебензоил-2-(метаметоксибензоил)-N-дебензоил-N-(трет-бутил) -аминокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-2'-[{(2,2,2-трихлорэтил) окси}-карбонил] -7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-10-ацетил-7-дезокси -Δ6,7-Δ12,13- изотаксотир;
2-дебензоил-2-(метахлорбензоил)-N-дебензоил-N-(трет-бутил) аминокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-2'- [{ (2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-10-ацетил-7-дезокси -Δ6,7-Δ12,13- изотаксотир;
2-дебензоил-2-(метаазидобензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-2'-{ [(2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-10-ацетил-7-дезокси -Δ6,7-Δ12,13- изотаксотир;
2-дебензоил-2-(парацианобензоил)-N-дебензоил-N-(трет-бутил) -аминокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-2'-{[(2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-10-ацетил-7-дезокси -Δ6,7-Δ12,13- изотаксотир;
2-дебензоил-2-(параметоксибензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-2'-{[(2,2,2-трихлорэтил) окси}-карбонил] -7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-10-ацетил-7-дезокси -Δ6,7-Δ12,13- изотаксотир;
2-дебензоил-2-(парахлорбензоил)-N-дебензоил-N-(трет-бутил) аминокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дeбeнзoил-2-(пapaaзипoбeнзoил)-7-дeзoкcи -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-2'-{ [(2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -Δ6,7-Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-ацетил-7-дезокси -Δ6,7-Δ12,13- изотаксотир; и
2-дебензоил-2-(параазидобензоил)-N-дебензоил-N- (трет-бутил)-аминокарбонил-7-дезокси -Δ6,7-Δ12,13- изотаксол;
Примеры соединений формулы Va по настоящему изобретению включают:
2-дебензоил-2-(метацианобензоил)-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метацианобензоил)-2'-[{ (2,2,2-трихлорэтил) окси}-карбонил]-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метацианобензоил)-10-ацетил-7-дезокси -Δ12,13- изотаксотир;
2-дебензоил-2-(метацианобензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-2'-[{(2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метаметоксибензоил)-10-ацетил-7-дезокси -Δ12,13- изотаксотир;
2-дебензоил-2-(метаметоксибензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-2'-[{(2,2,2-трихлорэтил) окси}-карбонил] -7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метахлорбензоил)-10-ацетил-7-дезокси -Δ12,13- изотаксотир;
2-дебензоил-2-(метахлорбензоил)-N-дебензоил-N-(трет-бутил) аминокарбонил-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-2'-[{ (2,2,2-трихлорэтил) окси}-карбонил]-7-дeзoкcи -Δ12,13- изотаксол;
2-дебензоил-2-(метаазидобензоил)-10-ацетил-7-дезокси -Δ12,13- изотаксотир;
2-дебензоил-2-(метаазидобензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-2'-[{ (2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(парацианобензоил)-10-ацетил-7-дезокси -Δ12,13- изотаксотир;
2-дебензоил-2-(парацианобензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-2'-[{(2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(параметоксибензоил)-10-ацетил-7-дезокси -Δ12,13- изотаксотир;
2-дебензоил-2-(параметоксибензоил)-N-дебензоил-N- (трет-бутил)-аминокарбонил-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-2'-[{(2,2,2-трихлорэтил)окси} -карбонил] -7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(парахлорбензоил)-10-ацетил-7-дезокси -Δ12,13- изотаксотир;
2-дебензоил-2-(парахлорбензоил)-N-дебензоил-N-(трет-бутил) аминокарбонил-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-2'-[{ (2,2,2-трихлорэтил) окси}-карбонил]-7-дезокси -Δ12,13- изотаксол;
2-дебензоил-2-(параазидобензоил)-10-ацетил-7-дезокси -Δ12,13- изотаксотир и
2-дебензоил-2-(параазидобензоил)-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -Δ12,13- изотаксол.
Предметом настоящего изобретения является также способ получения оксазолидинов формулы 5: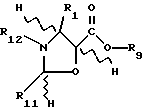
в которой R1 имеет указанные выше значения;
R9 выбирают из C1-C6-алкила;
R11 - фенил, замещенный -(OC1-C2-алкилом)n, где n = 1, 2, 3;
R12 выбирают из группы, включающей -C(O)H, -C(O)C1-C10-алкил (предпочтительно -C(O)C4-C6-алкил), -C(O) фенил, -C(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -C(O)C(CH3)=CHCH3, -C(O)OC(CH3)3, -C(O)OCH3фенил, -SO2-4-метилфенил, -C(O)(CH2)3COOH, -C(O)-4-(SO3H)-фенил, -C(O)-1-адамантил, -C(O)O-3-тетрагидрофуранил, -C(O)O-4-тетрагидропиранил, -C(O)CH2C(CH3)3, -C(O)C(CH3)3, -C(O)OC1-C10-алкил, -C(O)NHC1-C10-алкил, -C(O)NHPh, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6- диалкиламино, гидрокси или нитро, -C(O)C3-C8-циклоалкил, -C(O)C(CH2CH3)2CH3, -C(O)C(CH3)2 CH2Cl, -C(O)C(CH3)2CH2CH3, -C(O)-1-фенил-1-циклопентил, -C(O)-1-метил-1-циклогексил, -C(S)NHC(CH3)3, - C(O)NHCC (CH3)3 или -C(O)HPh;
который включает взаимодействие гидроксиамина формулы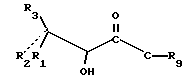
в которой R1 и R3 имеют указанные выше значения, а R2 выбирают из группы, включающей -NHC(O)H, -NHC(O)C1-C10 алкил (предпочтительно -NHC(O)C4-C6-алкил), -NHC(O)фенил, -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6- диалкиламино, гидрокси или нитро, -NHC(O)C(CH3)= CHCH3, -NHC(O)OC(CH3)3, -NHC(O)OCH2фенил, -NHSO2-4-метилфенил, -NHC(O)(CH2)3COOH, -NHC(O)-4-(SO3H)фенил, -NHC(O)-1-адамантил, -NHC(O)O-3-тетрагидрофуранил, -NHC(O)O-4-тетрагидропиранил, -NHC(O)CH2C(CH3)3, -NHC(O)C(CH3)3, -NHC(O)OC1-C10-алкил, -NHC(O) HC1-C10-алкил, -NHC(O)NHPh-, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6- диалкиламино, гидрокси или нитро; -NHC(O)C3-C8-циклоалкил, -NHC(O)C(CH2CH3)2CH3, -NHC(O)C(CH3)2CH2Cl, -NHC(O)C(CH3)2 CH2CH3, -NHC(O)-1-фенил-1-циклопентил, -NHC(O)-1-метил-1-циклогексил, -NHC(S)NHC(CH3)3, -NHC(O)NHCC(CH3)3 или -NHC(O)NHPh;
с (1) богатым электронами бензальдегидом формулы 4A:
или с (2) богатым электронами ацеталем формулы 4:
в которой n = 2.
Кроме того, настоящим изобретением предлагается способ получения соединения: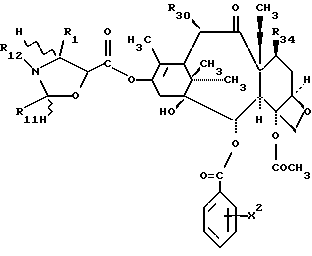
который включает взаимодействие оксазолинсодержащей свободной кислоты формулы 7: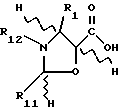
с соединением баккатина формулы 8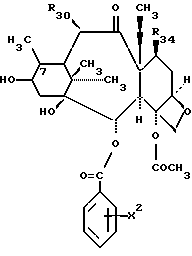
в присутствии дегидратирующего агента, где R30 и R34, имеющие одинаковые или разные значения, выбирают из группы, включающей -OC(O)C1-C6-алкил, -OC(O)OC1-C6-алкил, -OC(O)OCH2CX3, где X - галоген, -OC(O)OCH2CH2SiR20 (где R20 - C1-C6-алкил или -OSi(R16)3, [где R16, имеющий одинаковые или разные значения, выбирают из C1-C6-алкила или цикло(C5-C8)-алкила]; a X2, R11 и R12 имеют указанные выше значения.
Настоящим изобретением предусматривается также способ получения соединения: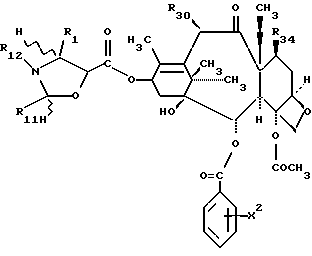
который включает взаимодействие оксазолинсодержащей свободной кислоты формулы 7: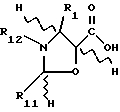
с соединением баккатина формулы 8':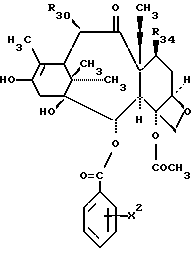
в присутствии дегидратирующего агента, где R30 и R34, имеющие одинаковые или разные значения, выбирают из группы, включающей - OC(O)C1-C6-алкил, -OC(O)OC1-C6-алкил, -OC(O)OCH2CX3, где X - галоген, -OC(O)OCH2CH2SiR20 (где R20 - C1-C6-алкил или - OSi(R16)3 [где R16, имеющий одинаковые или разные значения, выбирают из C1-C6-алкила или цикло(C5-C8)-алкила]; а X2, R11 и R12 имеют указанные выше значения.
Еще один вариант осуществления настоящего изобретения включает новые соединения формулы 8: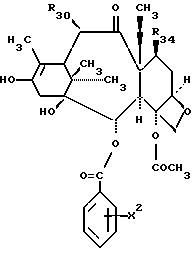
в которой R34 выбирают из группы, включающей 2-(3-метилбутил)диметилсилил-O-, (н-бутил)3силил-O-, 2-(2-метилэтил)диэтилсилил-O-, циклогексилдиметилсилил-O-, циклогептилдиметилсилил-O-.
Другой вариант осуществления настоящего изобретения включает новые соединения формулы 8':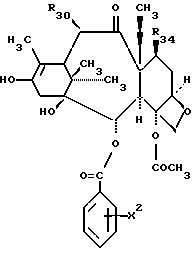
в которой R34 выбирают из группы, включающей 2-(3-метилбутил)-диметилсилил-O-, (н-бутил)3силил-O-, 2-(2-метилэтил)-диэтилсилил-O-, циклогексилдиметилсилил-O-, циклогептилдиметилсилил-O-.
Соединения по настоящему изобретению получают в соответствии со способом (способами), представленными на схемах с 1 по 7 и на схеме 46. Соединения настоящего изобретения обычно получают путем окисления защищенного аналога баккатина со свободным 13-гидроксилом, таким как соединение iii представленное на схемах 1 и 2, или соединение xvii представленное на схеме 7, в результате чего образуются 13- кето-баккатины формул v или xviii.
Соответствующие енолы затем восстанавливают активированным цинком или посредством электролитического восстановления либо путем восстановления другими металлами, такими как натрий или амальгама алюминия, соли хрома (II), или с помощью других способов восстановления с нужным восстановительным потенциалом. Полученные енолы формулы vi, представленные на схеме 3, и формулы xix, представленные на схеме 7, присоединяют к промежуточному продукту с защищенной боковой цепью с помощью одного из следующих способов. Наиболее преимущественным способом присоединения енолов формул vi или xix является способ, описанный в заявке, поданной по договору о патентной кооперации PCT/US93/11827 (дело 4809. P CP); см. стр. 24, строка 14, а также способы получения N. 8, 11, 13, 16, 22, 28 и 60.
Так, енолы формул vi или xix конденсируют с защищенной изосеринилкарбоновой кислотой, такой как кислота формулы vii, в присутствии такого дегидратирующего агента, как дициклогексилкарбодиимид или другой карбодиимид, карбонилдиимидазол, 2,2-дипиридилкарбонат, алкил- или арилсульфонилхлорид или ангидрид сульфокислоты, или другого дегидратирующего агента, известного в области получения сложных эфиров, с образованием защищенного аналога таксола формулы viii или xi. Енолы формулы vi или xix можно также конденсировать с использованием промежуточного продукта, имеющего боковую цепь, с помощью способов, описанных в литературе (см. Kingston D.G.I., Pharmac. Ther., 1991, 52, 1-34; Commercon A., Bezard D., Bernard F., Bourzat J.D., Tetrahedron Lett., 1992, 33b 5185; Georg G.I., Cheruvallath Z.S., Himes R.H., Mejillano M. R., BioMed. Chem. Lett. 1992, 2, 295; Kingston D.G.I., Molinero A.A., Rimoldi J.M., Prog. Org. Nat. Prod., 1993, 61, стр. 1-206). У полученного защищенного аналога таксола формулы viii или xi можно удалить защитную группу с образованием аналогов таксола формулы ix и xii.
В частности, соединения по настоящему изобретению можно получить так, как показано на схемах 1, 2 и 3. Так, 10-деацетилбаккатин III (Chauviere G., Guenard D., Picot F., Senihl V., Potier P. C.R., Acad. Sc. Paris, Serie II, 1981, 93, 501) можно избирательно защищать в 7-положении, например, карбонатной, сложноэфирной или силильной защитной группой с образованием защищенного баккатина (II). Защищенный в 7-положении баккатин (II) можно затем защитить в 10-положении карбонатной или сложноэфирной группой с образованием соединения формулы iii. Если защитной группой в 10-положении является ацетат, тогда соединением формулы iii является защищенное в 7-положении производное баккатина III. Аналогичное 10-ацетил-производное можно получить так, как показано на схеме 2. Так, защищенный в 10-положении баккатин, особенно если защитной группой в 10-положении является ацетил, представляет собой баккатин III (iv). Защита соединения формулы iv аналогично защите соединения формулы ii, показанного на схеме 1, позволяет получить соединение iii, в частности такое соединение, в котором R10 является ацетатом. 13-Карбоксильная группа соединения формулы iii может быть окислена с образованием кетона формулы v. Окисление может производиться с использованием диоксида марганца в таких апротонных растворителях, как метиленхлорид, тетрагидрофуран, диоксан, хлороформ, толуол или алканы, такие как гексан, пентан или гептан. Эту реакцию можно осуществлять при температуре от 0oC до 60oC, в большинстве случаев при комнатной температуре. Окисление можно производить при использовании других окислителей, таких как триксид хрома в пиридине, дихромат пиридина, хлорхромат пиридина, перманганат калия, перрутенат тетрапропиламмония, периодинан Десса-Мартина, или других известных окислителей. Как показано на схеме 3, кетон формулы у можно восстановить до енола формулы vi. Такое восстановление хорошо проходит при использовании металлического цинка, активированного последовательной промывкой 1 н. раствором хлористоводородной кислоты, водой, этанолом и простым эфиром. Восстановление осуществляется в уксусной кислоте при температуре 25oC в течение 2-4 часов. Эта реакция может протекать при температуре 0oC в течение 24-48 часов или при температуре 70oC в течение 10-20 минут. Эту реакцию можно также осуществлять в водном растворе уксусной кислоты, метаноле, содержащем хлористый аммоний, или в смешиваемых с водой растворителях, таких как тетрагидрофуран или диоксан, содержащих уксусную кислоту, муравьиную кислоту, другую карбоновую кислоту или водный раствор такой кислоты, как хлористоводородная кислота, бисульфат натрия или фосфорная кислота. Восстановление можно также производить электролитическим путем в таких растворителях, как метанол, пиридин, тетрагидрофуран или диоксан, с использованием угольного или платинововго электрода и с достаточно высоким электролитическим потенциалом. Восстановление можно также производить с использованием других металлов, таких как натрий или амальгама алюминия, или солей хрома (II). Енол формулы vi, легко соединяется с оксазолидинкарбоновой кислотой формулы vii в таком растворителе, как толуол, ксилол, тетрагидрофуран, диоксан или подобные растворители в присутствии такого осушителя, как дициклогексилкарбодиимид, или другой карбодиимид, карбонилдиимидазол, 2,2-дипиридилкарбонат, алкил или арилсульфонилхлорид, ангидрид сульфокислоты, или другого дегидратирующего агента, известного в области получения сложных эфиров в присутствии такого катализатора, как 4-диметиламинопиридин или три-н-бутилфосфин с образованием защищенного сложного енольного эфира формулы viii. Если защитная группа R14, находящаяся в 7-положении, отличается по своей избирательности от группы R10, ее можно удалить с помощью слабой кислоты или путем гидрогенолиза, после чего защищенный сложный енольный эфир viii может быть превращен в незащищенный аналог Δ12,13 изотаксола формулы ix. Например, если R14 представляет силильную группу, такую как триметил или триэтилсил, а R10 - ацетат, то обработка защищенного сложного енольного эфира формулы viii такой слабой кислотой, как 80% смесь уксусной кислоты и воды в течение 4-110 часов при температуре 10-60oC позволяет получить аналог Δ12,13 изотаксола формулы ix. Альтернативно, защитную группу можно удалить с помощью слабой кислоты, такой как 0,1 н. раствор хлористоводородной кислоты в метаноле или этаноле, или с помощью других кислот, таких как трифторуксусная кислота, метансульфокислота или другая кислота, в спиртовом растворителе и смешанных спиртовых и водных растворителях. Если защитную группу R14 можно удалить путем гидрогенирования, например, бензилоксиметиловым эфиром, то превращение защищенного сложного енольного эфира формулы viii в незащищенный аналог Δ12,13 изотаксола формулы ix можно произвести путем гидрогенирования в таких растворителях, как метанол, этанол, этилацетат, тетрагидрофуран или подобный растворитель, в присутствии катализатора гидрогенолиза, такого как металлический палладий, палладированный никель, скелетный никелевый катализатор или подобный катализатор.
Соединения настоящего изобретения включают аналоги Δ12,13 изотаксола с модификациями в 6,7-, 7- и 7,8-положениях, как показано на схемах с 4 по 7. Избирательное удаление защитной группы R14 из соединения формулы viii позволяет получить 7-гидроксисоединение формулы x. Если группа R14 в соединении viii представляет, например, трихлорэтилкарбонат, а группа R10 является сложноэфирной или простой группой, то восстановление цинком в слабо кислой среде, такой как смесь уксусной кислоты и воды, метанол, этанол или другой спиртовой растворитель, подкисленной хлористоводородной кислотой или хлоридом аммония, позволяет получить 7-гидроксисоединение формулы x. Если группа R14 в соединении формулы viii представляет, например, силилэфирную группу, такую как триметил или триэтилсилил, а R10 представляет сложноэфирную, простую эфирную или карбонатную группу, то обработка фторидом тетра-н-бутиламмонием, смесью пиридина и гидрофторида или гидрофторидов триэтиламмония в таких растворителях, как тетрагидрофуран, диоксан или спиртовые растворители, такие как метанол или этанол, позволяет получить 7-гидроксисоединение формулы x.
Соединение формулы xi, в которой R6 и R7, вместе взятые, представляют двойную связь, а R8 является метилом, защищенным аналогом 7-дезокси -Δ6,7-Δ12,13 изотаксола, предпочтительно можно получить из соединения x путем превращения 7-гидроксильной группы соединения формулы x в трифлат с последующим отщеплением. Так, в результате обработки 7-гидроксисоединения формулы x ангидридом трифторметансульфокислоты в метиленхлориде, 1,2-дихлорэтане, хлороформе или другом приемлемом апротонном растворителе в присутствии такого основания, как пиридин, 2-метилпиридин, 2,6-диметилпиридин или 2,4,6-триметилпиридин, или другого приемлемого основания при температуре от -20oC до 60oC в течение от 10 минут до 10 часов, можно получить трифторметансульфонат спирта формулы x. Обработка этого трифторметансульфоната 1,8- диазабицикло [5.4.0]-ундец-7-еном, 1,5-диазабицикло [4.3.0]нон-5-еном или другим сильным основанием амина в тетрагидрофуране, диоксане или другом приемлемом апротонном растворителе при температуре 0-90oC в течение периода времени от 10 минут до 10 часов делает возможным получение Δ6,7 соединения формулы xi. Отщепление трифторметансульфоната соединения формулы x можно также проводить с помощью других сильных оснований, таких как дисилазан лития, калия или натрия, диэтил- или диизопропиламид лития, трет-бутоксид натрия или калия или другое сильное основание, в приемлемом растворителе, таком как тетрагидрофуран, диоксан, трет-бутиловый спирт или подобный растворитель, при температуре от -80oC до 90oC в течение периода времени от 10 минут до 5 часов.
Соединение формулы xi, в которой R6 - водород, а R7 и R8, вместе взятые, представляют 7β,8β метан, являющееся защищенным аналогом 7-дезокси -7β,8β- метан -Δ12,13 изотаксола, можно также получить из трифторметансульфоната спирта формулы x. Так, в результате обработки трифторметансульфоната соединения формулы x азидом натрия, хлоридом натрия, сульфатом натрия, азидом калия, хлоридом калия, сульфатом калия или другой солью в водном тетрагидрофуране, водном диоксане, водном метаноле или водном этаноле, других водных растворителях или смешиваемых с водой растворителях при температуре от 0oC до 90oC в течение периода времени от 20 минут до 48 часов. Альтернативно, трифлат формулы x, можно обработать 10-500-кратным весовым избытком силикагеля путем медленного элюирования с помощью хроматографии или в периодическом режиме в таком растворителе, как толуол, тетрагидрофуран, диоксан, метиленхлорид, этилацетат, диметилформамид, диметилацетамид, или другом растворителе в течение 1-200 часов при комнатной температуре.
Соединение формулы xi, в которой R6 - водород, R7 - фторид и R8 - метил, являющееся защищенным аналогом 7-дезокси-7-фтор -Δ12,13 изотаксола, предпочтительно можно получить из спирта формулы x путем взаимодействия с таким реагентом, как трифторид диэтиламиносеры (DAST), трифторид диметиламиносеры (метилDAST), дифторид бис(диметиламино) серы, дифторид бис(диэтиламино) серы или дифторид (диэтиламино) (диметиламино) серы. Такое превращение предпочтительно осуществляется с помощью трифторида диэтиламиносеры или трифторида диметиламиносеры. Взаимодействие с трифторидом диэтиламиносеры или трифторидом диметиламиносеры осуществляется в апротонном растворителе, таком как метиленхлорид (CH2Cl2), хлороформ (CHCl3), фтортрихлорметан (фреон 11®, простой диметиловый эфир этиленгликоля (глим), 2-метокси этиловый эфир (диглим), пиридин, углеводороды, такие как пентан, гексан или изооктан, тетрагидрофуран, бензол, толуол, ксилол. Предпочтительным растворителем является метиленхлорид. Такое взаимодействие может осуществляться в интервале температур от -100oC до 100oC или выше. Обычно эта реакция начинается в условиях низкой температуры, например при -78oC, после чего температуру повышают, например, до 25oC. Реакционную смесь охлаждают водой, неочищенный продукт отделяют с помощью стандартных способов экстракции и очищают стандартными хроматографическими способами и/или кристаллизацией.
Соединение формулы xi, в которой R6 и R7, вместе взятые, образуют двойную связь, а R8 представляет метил, являющееся защищенным аналогом 7-дезокси -Δ6,7-Δ12,13- изотаксола, можно также получить путем взаимодействия спирта формулы x с таким реагентом, как трифторид диэтиламиносеры, трифторид диметиламиносеры, дифторид бис(диметиламино) серы, дифторид бис(диэтиламино) серы или дифторид (диэтиламино) (диметиламино) серы, как это описывалось выше.
Соединение формулы xi, в которой R6 - водород, а R7 и R8 вместе взятые, представляют 7β,8β- метан, являющееся защищенным аналогом 7-дезокси -7β,8β- метан -Δ12,13 изотаксола, можно также получить путем взаимодействия спирта формулы x с таким реагентом, как трифторид диэтиламиносеры, трифторид диметиламиносеры, дифторид
бис(диметиламино) серы, дифторид бис(диэтиламино) серы или дифторид (диэтиламино) (диметиламино) серы, как это описывалось выше.
Защищенный аналог Δ12,13- изотаксола формулы xi по схеме 4 можно превратить в аналог Δ12,13- изотаксола формулы xii путем удаления защитной группы. Так, в результате взаимодействия оксазолидина формулы xi со слабой кислотой в водном или спиртовом растворителе можно получить 13-изосеринил -Δ12,13- баккатин III, (аналог Δ12,13- изотаксола) формулы xiii. В частности, путем обработки оксазолидина формулы xi слабой кислотой, такой как 80% смесь уксусной кислоты и воды, в течение 4-110 часов при температуре 10-60oC можно получить аналог Δ12,13- изотаксола формулы xii. Альтернативно, защитную группу можно удалить с помощью такой слабой кислоты, как 0,1 н. раствор хлористоводородной кислоты в метаноле или этаноле, или с помощью других кислот, таких как трифторуксусная кислота, метансульфокислота или другая кислота, в спиртовом растворителе и смешанных спиртовых и водных растворителях. Оксазолидин формулы xi можно удалить путем гидрирования. Так, в результате гидрирования оксазолидина формулы xi в таких растворителях, как метанол, этанол, этилацетат, тетрагидрофуран или подобный растворитель, в присутствии катализатора гидрогенолиза, такого как металлический палладий, палладий на угле, никель Ренея или подобный катализатор, можно получить аналог Δ12,13- изотаксола формулы xii.
Аналоги Δ12,13- изотаксола формулы xiii по схеме 5, в которой R14 представляет карбонатную, карбаматную, простую эфирную, сложноэфирную или силилэфирную группу, можно получить путем избирательного расщепления оксазолидина формулы viii. Таким образом, как описывалось выше, в результате взаимодействия оксазолидина формулы viii со слабой кислотой в водном или спиртовом растворителе образуется 13-изосеринил -Δ12,13- баккатин III (аналог Δ12,13- изотаксола) формулы xiii. В частности, при обработке оксазолидина формулы viii слабой кислотой, такой как 80% смесь уксусной кислоты и воды, в течение 4-110 часов при температуре 10-80oC можно получить аналог Δ12,13- изотаксола формулы xiii. Альтернативно, защитную группу можно удалить с помощью слабой кислоты, такой, как 0,1 н. раствор хлористоводородной кислоты в метаноле или этаноле, или с помощью других кислот, таких, как трифторуксусная кисло та, метансульфокислота или другая кислота, в спиртовом растворителе и смешанных спиртовых и водных растворителях. Кроме того, оксазолидин формулы viii можно удалить путем гидрирования. Так, гидрирование оксазолидина формулы viii в таких растворителях, как метаном, этанол, этилацетат, тетрагидрофуран или другие, в присутствии катализатора гидрогенолиза как металлический палладий, палладированный уголь, скелетный никелевый катализатор или аналогичные им, позволяет получить аналог Δ12,13- изотаксола формулы xiii.
Аналог Δ12,13- изотаксола формулы xv, в которой R17 представляет сложноэфирную, карбонатную, карбаматную или простую эфирную группу по схеме 6, можно получить из оксазолидинил-7-гидрокси -Δ12,13- изотаксола формулы x путем превращения в замещенный в 7-положении оксазолидин формулы xiv с последующим расщеплением оксазолидинового кольца. Оксазолидин формулы xiv, имеющий сложноэфирную группу в 7-положении, можно получить из оксазолидинил-7-гидрокси- Δ12,13- изотаксола формулы x путем этерификации ацилгалогенидом, ацилангидридом или карбоновой кислотой и известным дегидратирующим агентом. Оксазолидин формулы xiv, имеющий карбонатную группу в 7-положении, можно получить из оксазолидинил-7-гидрокси -Δ12,13- изотаксол формулы x взаимодействием с алкоксихлорформиатом или ангидридом алкоксикарбоната в соответствии с известным способом. Оксазолидин формулы xiv, имеющий карбонатную группу в 7-положении, можно также получить из оксазолидинил-7-гидрокси -Δ12,13- изотаксола формулы x взаимодействием с фосгеном, дифосгеном, трифосгеном или паранитрофенилхлорформиатом с последующим взаимодействием промежуточного хлорформиата или паранитрофенилкарбоната со спиртом в соответствии с известным способом. Оксазолидин формулы xiv, имеющий карбаматную группу в 7-положении, можно получить из оксазолидинил-7-гидрокси -Δ12,13- изотаксола формулы x взаимодействием с алкил- или арилизоцианатом в соответствии с известным способом. Оксазолидин формулы xiv, имеющий карбаматную группу в 7-положении, можно также получить из 7-гидрокси- Δ12,13- изотаксола формулы x взаимодействием полученного выше карбоната с амином в соответствии с известным способом. Оксазолидин формулы xiv, имеющий карбаматную группу в 7-положении, можно также получить из 7-гидрокси -Δ12,13- изотаксола формулы x взаимодействием с фосгеном, дифосгеном, трифосгеном или паранитрофенилхлорформиатом и последующим взаимодействием промежуточного хлорформиата или паранитрофенилкарбоната с амином в соответствии с известным способом. Оксазолидин формулы xiv, имеющий алкоксиметил- или арилоксиметилэфирную группу в 7-положении, можно получить из 7-гидрокси -Δ12,13- изотаксола формулы x взаимодействием с хлорметилалкиловым или хлорметилариловым простым эфиром в соответствии с известным способом. Оксазолидин формулы xiv, имеющий алкил- или арилэфирную группу в 7-положении, можно получить из 7-гидрокси -Δ12,13- изотаксола формулы x взаимодействием с таким основанием, как гидрид натрия, гидрид калия или диэтиллитий, диизопропиламид, гексаметилдисилазан натрия или калия, или другим сильным основанием в таком растворителе, как тетрагидрофуран, диоксан, диметоксиэтан или другой подобный растворитель, при температуре от -78oC до 60oC в присутствии алкилгалогенида, такого, как метилиодид, этилиодид, бензилхлорид, аллилхлорид или бромид, в течение периода времени от 10 минут до 48 часов, с образованием оксазолидина формулы xiv, имеющего алкокси- или арилоксиметилэфирную группу в 7-положении. Оксазолидин формулы xiv, имеющий алкил- или арилэфирную группу в 7-положении, можно также получить из 7-гидрокси -Δ12,13- изотаксола формулы 10 взаимодействием с диазоалканом или арилдиазосоединением в присутствии катализатора из переходного металла, такого, как родий, рутений или палладий в протонном растворителе, таком как тетрагидрофуран, диоксан или дииметилформамид, при температуре от -20oC до 150oC.
У замещенного в 7-положении оксазолидина формулы xiv, имеющего сложноэфирную, карбонатную, карбаматную или простую эфирную группу в 7-положении, полученного выше и показанного на схеме 6, можно удалить защитную группу с образованием аналога Δ12,13- изотаксола формулы xv в соответствии со способами, описанными для превращения оксазолидина формулы viii; в аналог Δ12,13- изотаксола формулы xiii по схеме 5.
Аналог баккатина III формулы xvi, по схеме 7 можно превратить в аналог баккатина III формулы xviii, в которой R6 и R7, вместе взятые, образуют двойную связь и R8 - метил, в которой R6 - водород, а R7 и R8, вместе взятые, представляют 7β,8β- метан, или в которой R6 - водород, R7, - фтор и R8 - метил, можно получить так, как описывалось выше и показано на схеме 4 для превращения 7-гидроксисоединения формулы x в соответствующий аналог 7-дезокси -Δ12,13- изотаксола, аналог 7-дезокси -7β,8β- метан -Δ12,13- изотаксола и аналог 7-дезокси-фтор -Δ12,13- изотаксола формулы xi. Аналог 13-гидроксибаккатина формулы xvii можно окислить с образованием аналога 13-кетобаккатина формулы xviii так же, как это описывалось выше и показано на схеме 2 для окисления аналога 13-гидроксибаккатина формулы iii в аналог 13-кетобаккатина формулы v. Аналог 13-кетобаккатина формулы xviii можно восстановить с образованием аналога -Δ12,13- изобаккатина формулы xix, как это описывалось выше и показано на схеме 3 для восстановления аналога 13-кетобаккатина формулы v в аналог Δ12,13- изобаккатина формулы vi. Аналог Δ12,13- изобаккатина формулы xix можно превратить в защищенный аналог Δ12,13- изотаксола формулы xi, как это описывалось выше и показано на схеме 13 для превращения аналога Δ12,13- изобаккатина формулы vi в защищенный аналог Δ12,13- изотаксола формулы viii. Защищенный аналог Δ12,13- изотаксола формулы xi по схеме 7 можно превратить в аналог Δ12,13- изотаксола формулы xii, как это описывалось выше и показано на схеме 4.
Соединение формулы I, в которой X2 не является -H, можно получить в соответствии со способами, раскрытыми в журнале J. Am. Chem. Soc. 1994, 116, 4097-98 и Bioorganic & Medical Chemistry Letters, т. 4, N. 3, 479-82, 1994; и Tetrahedron Lett. 1994, 35, 8931, которые включены в описание изобретения в качестве ссылок.
Альтернативно соединения по этому изобретению (формулы I)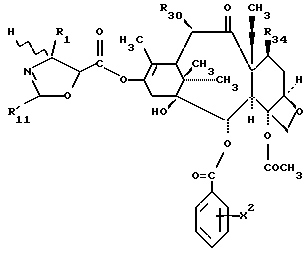
можно получить взаимодействием оксазолинсодержащей свободной кислоты формулы 7'
с соединением баккатина формулы 8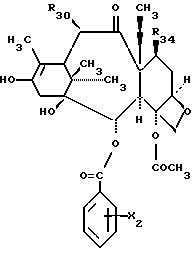
в присутствии дегидратирующего агента,
в котором R30 и R34 имеют одинаковые или разные значения, выбираются из группы, включающей -OC(O)C1-C6-алкил, -OC(O)OC1-C6-алкил - OC(O)OCH2CX3, где X - галоген, -OC(O)OCH2CH2SiR20 (где R20 - C1-C6-алкил) или -OSi(R16) [где R16 имеет одинаковые или разные значения и выбираются из C1-C6-алкила или цикло(C5-C8-алкила];
X2 выбирают из группы, включающей -H, -C1-C4-алкил, -C1-C3-алкокси, галоген, -C1-C3-алкилтио, -трифторметил, -C2-C6-диалкиламино, бензилоксметил, циано, азид (N3) или нитро;
R1 выбирают из группы, включающей -CH3, -С6,H4 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, 2-фурил, 2-тиенил, 1-нафтил, 2-нафтил или 3,4-метилендиоксифенил; и
R'11 выбирают из группы, включающей -C1-C10-алкил, фенил, фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -1-адамантил, -3-тетрагидрофуранил, -4-тетрагидропиранил или -CH2С(CH3)3.
Другим аспектом настоящего изобретения является способ получения соединения: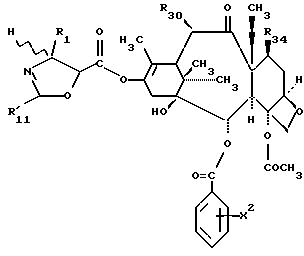
который включает взаимодействие оксазолинсодержащей свободной кислоты формулы 7'
с соединением баккатина формулы 8'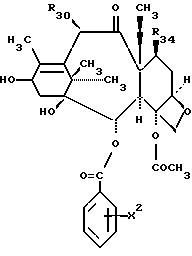
в присутствии дегидрирующего агента;
в котором R30 и R34, имеющие одинаковые или разные значения, выбирают из группы, включающей -ОС(О)C1-C6-алкил, -ОС(O)OC1-C6-алкил, -ОС(O)OCH2CX3, где X - галоген, - OC(O)OCH2CH2SiR20 (где R20 - C1-C6-алкил) или -OSi(R16) [где R16, имеющий одинаковые или разные значения, выбирают из C1-C6-алкила или цикло(C5-C8)-алкила];
X2 выбирают из группы, включающей -H, -C1-C4-алкил, -C1-C3-алкокси, галоген, -C1-C3-алкилтио, -трифторметил, -C2-C6-диалкиламино, бензилоксиметил, циано, азид (N3) или нитро;
R1 выбирают из группы, включающей -CH3, -С6H5 или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3- алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиамино, гидрокси или нитро, 2-фурил, 2-тиенил, 1-нафтил, 2-нафтил или 3,4-метилендиоксифенил; и
R'11 выбирают из группы, включающей -C1-C10-алкил, -фенил, -фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил, C1-C3-алкокси, галоген, C1-C3-алкилтио, трифторметил, C2-C6-диалкиламино, гидрокси или нитро, -1-адамантил, -3-тетрагидрофуранил, -4-тетрагидропиранил или -CH2С(CH3)3.
Общая методика присоединения оксазолинсодержащей кислоты к силилзащищенному баккатину III с последующим удалением защитной группы включает:
Часть A. К оксазолинсодержащей кислоте, суспендированной в толуоле, добавляли 0,5-1 эквивалент такого дегидратирующего агента, как карбодиимид, и оставляли для взаимодействия. В полученный раствор добавляли каталитическое количество диметиламинопиридина или аналогичного катализатора и защищенный баккатин III. Когда результаты тонкослойной хроматографии показали, что реакция закончилась, эту суспензию фильтровали для удаления мочевины, выливали в водный раствор бикарбоната натрия и экстрагировали метил-трет-бутиловым эфиром. После концентрирования и очистки с помощью хроматографии был получен связанный сложный эфир.
Часть B. Полученный выше сложный эфир объединяли с метанолом и обрабатывали HCl. Раствор нагревали с обратным холодильником до тех пор, пока результаты тонкослойной хроматографии не показали, что реакция закончилась. Реакционную смесь охлаждали раствором бикарбоната натрия и перемешивали при комнатной температуре для осуществления замены O на N в ациле. После выделения этилацетатом и хроматографией был получен таксол.
Силилирование 10-деацетилбаккатина (79).
10-деацетилбаккатин (79) и пиридин соединяли в соотношении 3 мл пиридина на 1 г 10-деацетилбаккатина и обрабатывали 5 эквивалентами силилхлорида при комнатной температуре. Раствор перемешивали при комнатной температуре до тех пор, пока результаты жидкостной хроматографии высокого давления не показали, что реакция закончилась. После окончания реакции раствор выливали в воду и выделяли целевой продукт с помощью приемлемого растворителя, обычно этилацетата или метил-трет-бутилового эфира. Органические слои сушили над сульфатом магния и концентрировали с образованием силильного производного (80).
Пример 1. Получение 13-кето-7-TES-баккатина III (2)
5 г (7,13 ммоля) 7-TES-баккатина III (1. Denis J.N., Greene A.E., J. Am. Chem. Soc. 1988, 110, 5917) растворяли в 75 мл метиленхлорида, и полученный раствор обрабатывали 5 г (57,5 ммоля) диоксида марганца. Смесь перемешивали с помощью магнитной мешалки в течение 19 часов, после чего с помощью тонкослойной хроматографии было установлено, что исходного вещества не осталось. Реакционную смесь фильтровали через целит, и фильтрат концентрировали в условиях вакуума с образованием 13-кето-TES-баккатина III.
Тонкослойная хроматография (силикагель GF): Rf исходного вещества = 0,24, Rf продукта = 0,50 в смеси этилацетата и гексана (1:2).
Спектр протонного ЯМР (CDCl3, TMS): δ 8,08 (д, 2H), 7,47-7,63 (м, 3H), 6,59 (с, 1H), 5,70 (д, 1H), 4,93 (д, 1H), 4,48 (м, 1H), 4,31 (д, 1H), 4,12 (д, 1H), 3,91 (д, 1H), 2,95 (д, 1H), 2,65 (д, 1H), 2,55 (м, 1H), 2,23 (с, 3H), 2,19 (с, 3H), 2,18 (с, 3H), 1,88 (м, 1H), 1,67 (с, 3H), 1,28 (с, 3H), 1,19 (с, 3H), 0,92 (м, 9H), 0,58 (с, 6H).
Спектр углеродного ЯМР (CDCl3, TMS): δ 199,95, 198,07, 169,85, 168,64, 166,53, 152,75, 139,96, 133,67, 129,76, 128,46, 83,65, 80,25, 78,20, 75,89, 75,77, 72,59, 72,98, 59,16, 45,94, 43,15, 42,18, 36,90, 32,74, 21,44, 20,56, 17,94, 13,25, 9,30, 6,46, 4,96.
Пример 1A. 13-Кето-7-TES-баккатин III (2)
К суспензии активированного оксида марганца (IV) (14,7 г, Aldrich) в CH2Cl2 (80 мл) с помощью капельной воронки в течение 5 минут добавляли раствор 7-TES-баккатина (7,14 г) в CH2Cl2 (320 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Окончание реакции определяли тонкослойной хроматографией (смесь 30% ацетона и гексана и 50% EtOAc и гексана). Смесь фильтровали с целью удаления твердых веществ и еще раз промывали CH2Cl2. Объединенные фильтраты выпаривали до сухого состояния и подвергали воздействию высокого вакуума, что позволило получить 13-кето-7-TES-баккатин III в виде белого вещества (6,81 г, выход 96%); тонкослойная хроматография: силикагель; смесь 50% EtOAc и гексана; исходного вещества = 0,41, Rf кетона 2 = 0,59.
Спектр 1H ЯМР (CDCl3, TMS) δ 8,07 (м, 2H), 7,63 (м, 1H), 7,50 (м, 2H), 6,59 (с, 1H), 5,70 (д, J = 6,8 Гц, 1H), 4,93 (д, J = 9,5 Гц, 1H), 4,48 (м, 1H), 4,33 (д, J = 8,4, 1H), 4,12 (д, J =8,4 Гц, 1H), 3,92 (д, J = 6,7 Гц, 1H), 2,96 (д, J = 19,9 Гц, 1H), 2,66 (д, 3 = 20,0 Гц, 1H), 2,55 (м, 1H), 2,23 (с, 3 H), 2,194 (с, 3H), 2,188 (с, 3H), 1,88 (м, 1H), 1,85 (с, 1H), 1,67 (с, 3H), 1,28 (с, 3H), 1,19 (с, 3H), 0,92 (т, J = 7,8 Гц, 9H), 0,59 (к, J = 7,6 Гц, 6H).
Пример 2. Получение 7-TES -Δ12,13- изобаккатина III (3)
Цинковую пыль (2,82 г, 43,1 мг-атом) последовательно промывали разбавленной HCl, водой (6 раз), метанолом (6 раз) и простым эфиром (3 раза), каждый раз сливая промывочную жидкость. Цинк сушили в условиях вакуума. Активированный цинк добавляли к раствору 13-кето-7-TES-баккатина III (2, 0,498 г, 0,71 ммоля) в уксусной кислоте (4 мл). Реакционную смесь 4 часа перемешивали в атмосфере азота при комнатной температуре. Реакционную смесь разбавляли этилацетатом, фильтровали через диатомовую землю. После выпаривания фильтрата его разбавляли толуолом и еще раз выпаривали 7-TES -Δ12,13- изобаккатин III.
Спектр протонного ЯМР (CDCl3, TMS): δ 0,53 (м, 6H), 0,89 (м, 9H), 1,11 (с, 3H), 1,14 (с, 3H), 1,61 (с, 3H), 1,82 (с, 3H), 1,87 (м, 1H),2,09 (д, 1H, J = 18,0 Гц), 2,18 (с, 3H), 2,33 (с, 3H), 2,30-2,58 (м, 2H), 2,74 (д, 1H , J = 18,0 Гц), 4,14 (д, 1H , J = 5,3 Гц), 4,25 (д, 1H , J = 8,4 Гц), 4,37 (м, 1H), 4,39 (д, 1H, J = 8,4 Гц), 4,37 (с, 1H), 4,93 (двойной дублет, 1H), 5,48 (двойной дублет, 1H), 5,91 (с, 1H), 7,48 (м, 2H), 7,61 (м, 1H), 8,08 (м, 2H).
Спектр углеродного ЯМР (CDCl3, TMS): 5,36, 6,69, 9,08, 12,75, 18,75, 21,18, 23,14, 29,89, 32,43, 37,17, 38,59, 39,66, 56,52, 59,09, 73,05, 73,36, 75,56, 76,82, 80,92, 84,50, 102,44, 128,53, 129,03, 129,90, 133,57, 146,02, 166,57, 168,83, 170,82, 205,52.
Элементный анализ. Высчитано для C37H52O11Si1: 63,41% C, 7,48% H. Обнаружено: 63,31% C, 7,45% H.
Инфракрасный спектр (нуджол): 1112, 1241, 1281, 1375, 1454, 1687, 1716, 1725, 1741, 3402, 3508 см-1.
Пример 2A. 7-Триэтилсилил-12,13-изобаккатин III (3)
Раствор 13-кето-7-TES-баккатина III (2) (7,90 г, 11,3 ммоля) в дегазированном HOAc (80 мл, аргон) выливали в 250 мл трехгорлую круглодонную колбу, оснащенную механической мешалкой. Раствор продували азотом, после чего одной порцией добавляли цинковую пыль (82 г) в виде сухого порошка. Реакционную смесь интенсивно перемешивали. Тонкослойная хроматография показала, что через два часа исходное вещество полностью прореагировало (смесь 50% EtOAc и гексана). Реакционную смесь разбавляли EtOAc (который дегазирован аргоном). Реакционную смесь фильтровали через целит в атмосфере азота. Колбу и фильтровальный осадок тщательно промывали дегазированным EtOAc. Соединенные фильтраты выпаривали при пониженном давлении. К остатку добавляли дегазированный толуол и еще раз выпаривали. Добавление и выпаривание толуола повторяли до полного удаления HOAc (еще два раза). В испарителе повышали давление и каждый раз заменяли атмосферу азотом. Полученное белое твердое вещество помещали на ночь в условия высокого вакуума (0,02 Top), что позволило получить 7,57 г (96%) 7-триэтилсилил-12,13-изобаккатина III.
Спектр 1H ЯМР (CDCl3, TMS) δ 8,8 (д, 2H, J = 7,1 Гц), 7,61 (т, 1H, J = 7,5 Гц), 7,49 (т, 2H, J = 7,5 Гц), 5,92 (с, 1H), 5,49 (д, 1H, J = 5,3 Гц), 4,93 (м, 1H), 4,40 (д, 1H, J = 8,1 Гц), 4,37 (м, 1H), 4,26 (д, 1H, J = 8,5 Гц), 4,14 (д, 1H, J = 5,3 Гц), 2,75 (д, 1H, J = 18,0 Гц), 2,54-2,46 (м, 1H), 2,41 (м, 1H), 2,33 (с, 3H), 2,17 (с, 3H), 2,07 (м, 1H), 1,89 (м, 1H), 1,81 (с, 3H), 1,14 (с, 3H), 1,11 (с, 3H), 0,89 (м, 9H), 0,52 (м, 6H).
Пример 3. Получение сложного эфира 7-TES- -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-диметилфенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5)
(4S, 5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновую кислоту получали из соли с боковой цепью следующим образом. Соль калия (4S, 5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (1,5 ммоля) суспендировали в этилацетате, и полученный раствор дважды промывали 5% водным раствором бисульфата натрия, один раз рассолом, сушили и выпаривали. Карбоновую кислоту обрабатывали метиленхлоридом (2 мл), 4-диметиламинопиридином (48 мг), раствором 7-TES -Δ12,13- изобаккатина III (3, 0,492 г, 0,702 ммоля) в толуоле (5 мл) с метиленхлоридом (8 мл) и 1,3-дициклогексилкарбодиимидом (0,316 г, 1,53 ммоля). Раствор перемешивали 2,5 часа в атмосфере инертного газа. Реакционную смесь разбавляли этилацетатом, промывали водным раствором бисульфата натрия и водным раствором бикарбоната с рассолом. Слои фильтровали и отделяли, а органический слой сушили и выпаривали. Полученный продукт очищали хроматографией на силикагеле в смесях ацетона и гексана.
Был получен сложный эфир 7-TES -Δ12,13- изобаккатин III-13-(4S,5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (4a,b).
Спектр протонного ЯМР (CDCl3, TMS): δ 0,54(м), 0,89 (м), 1,05 (с), 1,57 (с), 1,87 (м), 2,15 (с), 2,16 (с), 2,19 (с), 2,50 (м), 3,82 (с), 3,86 (с), 3,89 (с), 4,35 (м), 4,88 (м), 5,30 (м), 5,50 (2д), 5,88 (с), 5,99 (с), 6,50 (м), 7,35-7,65 (м), 8,02 (м).
Разделение соединений 5a и 5b
Вышеуказанное взаимодействие осуществляли c использованием 7-TES -Δ12,13- изобаккатина III (3, 0,5 г, 0,71 ммоля). Неочищенный продукт, полученный после водной экстракции, хроматографировали на колонке E. Merck. размер B со средним давлением, проводя элюирование смесями ацетона и н-гексана (20-80) (300 мл), (25-75) (300 мл) и (30-70) (300 мл). Фракции объемом 15 мл собирали. С помощью тонкослойной хроматографии было установлено, что фракции 24-28 содержат смесь 50-50 менее и более полярных изомеров сложного эфира 7-TES -Δ12,13- изобаккатин III-13-(4S,5R) -N-Boc-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5a и 5b, 355 мг). Фракции 1-4, 15-23 и 29 соединяли и выпаривали, в результате чего было установлено, что они содержат неочищенные соединения 5a и 5b. Эту смесь еще раз хроматографировали на колонке E. Merck размер B со средним давлением, проводя элюирование смесями этилацетата и н-гексана (25-75) (200 мл), (30-70) (500 мл) и (40-60) (500 мл). Фракции объемом 15 мл собирали. Менее полярный изомер сложного эфира 7-TES Δ12,13- изобаккатин III-13-(4S,5R)-N-Вос-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5a) был обнаружен во фракциях 25-30, а более полярный изомер сложного эфира 7-TES -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Вос-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5b) был обнаружен во фракциях 31- 39.
Менее полярный изомер сложного эфира 7-TES -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (5a):
Тонкослойная хроматография (силикагель GF): смесь этилацетата и гексана (30-70); Rf: 0,50.
Спектр протонного ЯМР (CDCl3, TMS) δ 0,47-0,63 (к, 6H), 0,84-0,99 (т, 9H), 1,24 (с, 9H), 2,16 (с, 3H), 2,19 (с, 3H), 3,81 (с, 3H), 3,86 (с, 3H), 4,24-4,30 (д, 1H), 4,35-4,42(д, 1H), 4,42-4,50 (к, 1H), 4,83-4,93 (д, 1H), 4,97 (с, 1H), 5,35-5,50 (д, 1H), 5,51-5, 58 (д, 1H), 6,00 (с, 1H), 6,39-6,46 (двойной дублет, 1H), 6,48-6,53 (д, 1H), 6,72 (с, 1H), 7,10-7,19 (д, 1H), 7,29-7,65 (м, 8H), 8,0-8,11 (д, 2H).
Более полярный изомер сложного эфира 7-TES -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5b):
Тонкослойная хроматография (силикагель GF): смесь этилацетата и гексана (30-70); Rf 0,37.
Спектр протонного ЯМР (CDCl3, TMS) δ 0,45-0,59 (к, 6H), 0,83-0,96 (т, 9H), 1,05 (с, 9H), 2,16 (с, 3H), 3,69-3,75 (д, 1H), 3,82 (с, 3H), 3,90 (с, 3H), 4,18-4,25 (д, 1H), 4,30-4,36 (д, 1H), 4,27-4,43 (м, 1H), 4,56-4,64 (широкий дублет, 1H), 4,80-4,86 (д, 1H), 5,25-5,33 (д, 1H), 5,45-5,51 (д, 1H), 5,88 (с, 1H), 6,36-6,45 (двойной дублет, 1H), 6,45-6,54 (д, 1H), 7,30-7,68 (м, 9H), 8,00-8,06 (д, 2H).
Пример 4. Получение 7-TES-13-(N-Boc -β- фенил-изосеринил -Δ12,13- изобаккатина III (6)
Сложный эфир 7-TES -Δ12,13- изобаккатин III-13(4S,5R)- N-Вос-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5a,b 355 мг 0,319 ммоля) перемешивали при комнатной температуре в атмосфере азота в смеси 8 мл уксусной кислоты и 2 мл воды. После окончания реакции проводили тонкослойную хроматографию, результаты которой показали, что через 24 часа более полярный изомер 5b полностью прореагировал и оставалось лишь некоторое количество менее полярного изомера 5a. Реакционную смесь разбавляли 100 мл этилацетата, промывали 50 мл 1 н. раствора гидроксида натрия и трижды промывали 50 мл 5% бикарбоната натрия. Органический слой сушили над сульфатом натрия и выпаривали в условиях вакуума. Неочищенный продукт хроматографировали на колонке из силикагеля E. Merck размер B. Фракции объемом 10 мл собирали и анализировали тонкослойной хроматографией. Колонку элюировали смесями ацетона и н-гексана (20-80) (800 мл), (30-70) (300 мл) и (40-60) (300 мл). Было установлено, что фракции 22-36 содержат в виде смеси 7-TES-13-(N-β-Вос-фенил-изосеринил) -Δ12,13- изобаккатин III (6). Фракции 59-63 содержали 13-(N-Воc -β- фенил-изосеринил)- Δ12,13- изобаккатин III (7). Остаток, полученный после выпаривания фракций 22-36, еще раз хроматографировали на колонке из силикагеля E. Merck размер B, элюируя смесью ацетона и толуола (5-95). Фракции 30-60 содержали 7-TES-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III (6).
Тонкослойная хроматография (силикагель GF): смесь ацетона и толуола (10-90); Rf: 0,31.
Спектр протонного ЯМР (CDCl3, TMS) δ 0,48-0,61 (к, 6H), 0,84-0,96 (т, 9H), 1,14 (с, 3H), 1,23 (с, 9H), 1,26 (с, 3H), 1,62 (с, 3H), 1,84-1,98 (т, 1H), 2,03-2,15 (д, 1H), 2,17 (с, 3H), 2,83-2,94 (д, 1H), 3,18-3,25 (д, 1H), 3,82-3,89 (д, 1H), 4,26-4,34 (д, 1H), 4,38-4,45 (д, 1H), 4,36-4,48 (м, 1H), 4,67-4,74 (д, 1H), 4,89-4,97 (д, 1H), 5,40 (с, 1H), 5,53-5,57 (д, 1H), 5,97 (с, 1H), 7,13-7,63 (м, 9H), 8,08-8,17 (д, 2H).
Масс-спектр: (M+H)+, измеренный при 964,4547; теоретическое значение для C51H69NO15Si+H равно 964,4514.
Пример 5. Получение 13-(N-Вос -β- фенил-изосеринил) Δ12,13- изобаккатина III (7)
Сложный эфир 7-TES -Δ12,13- изобаккатин III-13-(4S,5R)-N- Boc-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5a,b: 0,69 ммоля) в течение 4-х дней
перемешивали в смеси уксусной кислоты (16 мл) и воды (4 мл) при комнатной температуре в атмосфере инертного газа. Реакционную смесь разбавляли этилацетатом и несколько раз промывали водой и водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и выпаривали. Полученный продукт хроматографировали на силикагеле 60 (230-400 меш) в смесях ацетона и гексана, в результате чего был получен 13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III.
Спектр протонного ЯМР (CDCl3, TMS): δ 1,06 (с, 3H), 1,22 (с, 9H), 1,30 (с, 3H), 1,92 (м, 1H), 2,08 (д, 1H, J = 19 Гц), 2,23 (с, 3H), 2,51 (м, 1H), 2,57 (с, 3H), 2,76 (с, 1H), 2,92 (д, 1H, J = 19 Гц), 3,21 (широкий синглет), 3,52 (д, 1H, J = 4 Гц), 3,71 (д, 1H, J = 6 Гц), 4,33 (д, 1H, J = 8 Гц), 4,36 (м, 1H), 4,42 (д, 1H, J = 8 Гц), 4,70 (д, 1H), 4,94 (двойной дублет, 1H), 5,40 (м, 1H), 5,48 (с, 1H), 5,58 (д, 1H, J = 6 Гц), 7,30-7,67 (м, 8H), 8,13 (д, 2H, J = 7 Гц).
Спектр углеродного ЯМР (CDCl3, TMS): 9,12, 14,38, 19,97, 21,07, 22,65, 28,13, 29,78, 32,73, 35,30, 38,78, 39,53, 55,72, 57,94, 71,54, 73,57, 73,71, 77,66, 77,77, 80,19, 81,05, 84,58, 121,90, 126,56, 128,04, 128,74, 128,89, 128,95, 130,27, 133,52, 138,52, 143,33, 155,16, 166,77, 170,74, 170,90, 172,04, 206,64.
Масс-спектр (FAB): Высчитано для C45H55N1O15: 850,3650.
Обнаружено: 850,3650.
Основные ионы соответствуют 794, 594, 105.
Пример 6. Получение 7-TES-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатина III (6) и 13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатина III (7)
Менее полярный изомер сложного эфира 7-TES -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Вос-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (5a, 50 мг, 0,045 ммоля) обрабатывали 0,5 мл 0,1 н. раствором HCl в метиловом спирте, производя перемешивании в атмосфере азота при комнатной температуре. После окончания реакции выполняли тонкослойную хроматографию, результаты которой показали, что исходное вещество прореагировало через 30 минут. Реакционную смесь распределяли между этилацетатом и 5% раствором бикарбоната натрия. Органический слой отделяли, сушили над ацетатом натрия и выпаривали в условиях вакуума. Неочищенный продукт хроматографировали на колонке из силикагеля E. Merck размер A, элюируя градиентом смеси ацетона и толуола с соотношением от (10-90) до (20-80). Фракции объемом 5 мл собирали и анализировали методом тонкослойной хроматографии. Было установлено, что фракции 4-14 содержат 7-TES-13-(N-Вос β- фенил-изосеринил -Δ12,13 изобаккатин III (б), а фракции 18-26 содержат 13-(N-Boc -β- фeнил-изocepинил) -Δ12,13- изобаккатин III (7). Данные для соединений 6 и 7 сравнимы с данными, приведенными в примерах 4 и 5.
Пример 7. Получение 10-деацетил-13-(N-Воc -β- фенил-изосеринил) -Δ12,13- изобаккатин III (8)
13-(N-Вос -β- фенил-изосеринил) Δ12,13- изобаккатин III (7,25 мг, 0,029 ммоля) перемешивали в 1 мл 95% этанола при комнатной температуре в атмосфере азота. К этому раствору добавляли 2 капли безводного гидразина. Большая часть исходного вещества прореагировала через 5 минут, о чем свидетельствовали результаты тонкослойной хроматографии. Через 1 час реакционную смесь распределяли между метиленхлоридом и водой. Слои разделяли и водный слой еще раз экстрагировали метиленхлоридом. Органические слои соединяли, сушили над сульфатом натрия и выпаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке из силикагеля E. Merck размер A. Колонку элюировали смесью ацетона и гексана (40-60) и собирали 3 мл фракции. Эти фракции анализировали методом тонкослойной хроматографии. Чистый продукт, обнаруженный во фракциях 16-23, соединяли и выпаривали, в результате чего был получен 10-деацетил-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III (8) в виде твердого вещества.
Тонкослойная хроматография (силикагель GF): смесь ацетона и гексана с соотношением 40-60; Rf: 0,28.
Спектр протонного ЯМР (CDCl3, TMS) d 1,02 (с, 3H), 1,23 (с, 9H), 1,25 (с, 3H), 1,68 (с, 3H), 1,71 (с, 3H), 2,57 (с, 3H), 3,38 (широкий синглет, 1H), 3,76-3,82 (д, 1H), 4,16 (широкий синглет, 1H), 4,27-4,33 (д, 1H), 4,39-4,46 (д, 1H), 4,50-4,56 (широкий дублет, 1H), 4,56-4,63 (широкий дублет, 1H), 4,70 (широкий синглет, 1H), 4,90-4,97 (д, 1H), 5,33-5,44 (широкий дублет, 1H), 5,44-5,54 (широкий дублет, 1H), 5,52-5,59 (д, 1H), 7,30-7,45 (м, 5H), 7,45-7,56 (т, 2H), 7,56-7,66 (т, 1H), 8,09-8,18 (д, 2H).
Пример 8. 2'Troc-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III.
Раствор 13-(N-Воc -β- фенил-изосеринил) -Δ12,13- изобаккатина III (7,0 г, 0,12 ммоля) и сухого пиридина (0,6 мл) в метиленхлориде (10 мл) охлаждали до -20oC в атмосфере азота. К этому раствору одной порцией добавляли 2,2,2-трихлорэтилхлорформиат. Реакционную смесь анализировали через 1 час с помощью тонкослойной хроматографии, которая показала, что реакции не произошло. Добавляли еще одну порцию 2,2,2-трихлорэтилхлорформиата (20 мкл, 0,15 ммоля), и реакционную смесь перемешивали в течение еще 1,75 часа. Хотя данные тонкослойной хроматографии свидетельствовали о неполной реакции на этот момент (реакционная смесь содержала исходное вещество и продукт с соотношением 1: 1), реакционную смесь охлаждали и промывали охлажденным льдом 0,1 н. раствором HCl (2 раза), насыщенным раствором NaHCO3 и водой. Органический слой сушили (NaSO4), фильтровали и выпаривали, что позволило получить остаточную смесь (0,139 г). Эту смесь хроматографировали на силикагеле (одна колонка Lobar с силикагелем E. Merck размер B) с использованием CH2Cl2 для ввода в колонку вещества и смеси 50% EtOAc и гексана для элюирования колонки. Собирали фракции объемом 8 мл. Более поздние фракции (42-60) содержали исходное вещество, а более ранние фракции (20-25) содержали 2'-Troc-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III (9).
Спектр протонного ЯМР (CDCl3, TMS) δ 8,13 (д, 2H, J = 7,3 Гц), 7,59 (т, 1H, J = 7,3 Гц), 7,30-7,52 (м, 7H), 5,66 (д, 1H, J = 10,0 Гц), 5,58 (д, 1H, J= 5,7 Гц, H2), 5,45-5,53 (м, 3H), 4,96 (двойной дублет, 1H, J= 3,2, 9,6 Гц, H5), 4,71 (с, 2H, troc-СH2-), 4,42 (д, 1H, J = 8,8 Гц, H20a), 4,39 (м, 1H, H7), 4,34 (д, 1H, J = 8,6 Гц, H20b), 3,71 (д, 1H, J = 5,7 Гц, H3), 2,94 (д, 1H, J = 19,0 Гц, H14a), 2,76 (с, 1H, H11), 2,61 (с, 3H, -CH3), 2,53 (7 линий, 1H, JH7 = 6,2 JH5 = 9,5, Jgem = 15,0 Гц, H6a), 2,23 (с, 3H, -CH3), 2,17 (д, 1H, J = 19,3 Гц, H14b), 1,93 (7 линий, 1H, JH7 = 11,3, JH5 = 3,3, Jgem = 14,6 Гц, H6b), 1,67 (-CH3), 1,64 (-CH3), 1,28 (с, 3H, -CH3), 1,22 (с, 9H, -CMe3), 1,05 (с, 3H, -CH3).
Пример 9. Получение сложного эфира Δ12,13- изобаккатин III-13-(4S,5R) -N-Вос-2-(2, 4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (10a)
Менее полярный изомер сложного эфира 7-TES -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Вос-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (5a, 45 мг, 0,41 ммоля) растворяли в 1 мл сухого тетрагидрофурана, перемешивая при комнатной температуре в атмосфере азота. К этому раствору добавляли тригидрат фтористого тетрабутиламмония (15 мг, 0,041 ммоля). Реакция заканчивалась через час, после чего проводили тонкослойную хроматографию. Реакционную смесь распределяли между этилацетатом и 5% раствором бикарбоната натрия. Органический слой сушили над сульфатом натрия и выпаривали в условиях вакуума. Неочищенный продукт очищали хроматографией на колонке из силикагеля E. Merck размер A. Эту колонку элюировали смесями этилацетата и гексана (40-60) и (60-40). Фракции объемом 5 мл собирали и анализировали методом тонкослойной хроматографии. Основной продукт был обнаружен во фракциях 12-18, из которых после соединения и выпаривания в вакууме был получен сложный эфир Δ12,13- изобаккатин III-13-(4S,5R)-N-Boc-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (10a) в виде твердого вещества.
Тонкослойная хроматография (силикагель GF): смесь этилацетата и гексана (40-60); Rf: О-,44.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,07 (с, 3H), 1,25 (с, 9H), 1,33 (с, 3H), 1,62 (с, 3H), 1,70 (с, 3H), 2,17 (с, 3H), 2,24 (с, 3H), 3,51-3,56 (д, 1H), 3,68-3,75 (д, 1H), 3,82 (с, 3H), 3,88 (с, 3H), 4,28-4,36 (д, 1H), 4,38-4,44 (д, 1H), 4,36-4,47 (м, 1H), 4,86-4,96 (двойной дублет, 1H), 4,99 (с, 1H), 5,33-5,41 (д, 1H), 5,50 (с, 1H), 5,56-5,63 (д, 1H), 6,40-6,46 (двойной дублет, 1H), 6,50-6,54 (д, 1H), 6,72 (с, 1H), 7,09-7,16 (д, 1H), 7,33-7,68 (м, 8H), 8,01-8,10 (д, 2H).
Масс-спектр: (М+H)+ при 998. Другие ионы соответствовали 942, 898, 384, 284, 105, 57.
Пример 10. Получение сложного эфира 7-Troc -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Вос-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (11a)
Сложный эфир Δ12,13- изобаккатин III-13-(4S,5R)-N-Вос-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (10a, 81 мг, 0,081 ммоля) перемешивали в 1 мл сухого пиридина в атмосфере азота при комнатной температуре. К этому раствору добавляли 140 мкл трихлорэтилхлорформиата в 200 мкл метиленхлорида. Реакционную смесь оставляли на ночь. Проведенная на следующий день тонкослойная хроматография показала, что исходное вещество полностью прореагировало.
Реакционную смесь распределяли между метиленхлоридом и 1 н. раствором HCl. Слои разделяли и водный слой еще раз экстрагировали метиленхлоридом. Органические слои соединяли, сушили над сульфатом натрия и выпаривали в вакууме. Неочищенный продукт хроматографировали на колонке из силикагеля E. Merck размер A, элюируя смесью этилацетата и гексана (30-70). Фракции объемом 5 мл собирали и анализировали с помощью тонкослойной хроматографии. Сложный эфир 7-Troc -Δ12,13- изобаккатин III-13-(4S,5R)-N-Boc-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (11a) был обнаружен во фракциях 9-15, из которых после соединения и выпаривания в условиях вакуума было получено твердое, вещество.
Тонкослойная хроматография (силикагель GF): смесь этилацетата и гексана (30-70); Rf: 0,14.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,10 (с, 3H), 1,26 (с, 9H), 1,32 (с, 3H), 1,77 (с, 3H), 2,16 (с, 3H), 2,19 (с, 3H), 3,82 (с, 3H), 3,86 (3H), 3,92-3,98 (д, 1H), 4,24-4,34 (д, 1H), 4,36-4,44 (д, 1H), 4,54-4.63 (д, 1H), 4,85-4,94 (д, 1H), 4,85-4,94 (м, 1H), 4,99 (широкий синглет, 1H), 5,26-5,36 (м, 1H), 5,36-5,44 (с, 1H), 5,54-5,60 (д, 1H), 5,63 (с, 1H), 6,38-4,46 (двойной дублет, 1H), 6,48-6,53 (двойной дублет, 1H), 6,72 (с, 1H), 7,10- 7,18 (д, 1H), 7,34-7,66 (м, 8H), 8,01-8,10 (д, 2H).
Пример 11. Получение 7-Troc-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III (12)
Сложный эфир 7-Troc -Δ12,13- изобаккатин III-13-(4S,5R)-N- Boc-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (11a, 82 мг, 0,07 ммоля) обрабатывали 800 мкл 0,1 н. раствора HCl в метаноле, производя перемешивание в атмосфере азота при комнатной температуре. Реакция закончилась через 1 час, что подтвердили результаты тонкослойной хроматографии. Реакционную смесь распределяли между этилацетатом и 5% раствором бикарбоната натрия. Слои разделяли и водный слой еще раз экстрагировали этилацетатом. Органические слои соединяли, сушили над сульфатом натрия и выпаривали в вакууме. Неочищенный продукт хроматографировали на колонке из силикагеля E. Merck размер A, элюируя градиентом смесей этилацетата и гексана с соотношением от (30-70) до (40-60). Фракции объемом 5 мл собирали и анализировали методом тонкослойной хроматографии. Целевой продукт был обнаружен во фракциях 11-17, из которых после соединения и выпаривания в вакууме был получен 7-Troc-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III (12) в виде твердого вещества.
Тонкослойная хроматография (силикагель CF): смесь этилацетата и гексана (30-70); Rf: 0,14.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,08 (с, 3H), 1,25 (с, 9H), 1,29 (с, 3H), 1,77 (с, 3H), 1,90-2,03 (т, 1H), 2,14 (с, 3H), 2,59 (с, 3H), 3,30-3,36 (д, 1H), 3,90-3,99 (д, 1H), 4,26-4,33 (д, 1H), 4,39-4,47 (д, 1H), 4,54-4,63 (д, 1H), 4,72 (широкий синглет, 1H), 4,86-4,93 (д, 1H), 4,90-4,98 (д, 1H), 5,23-5,33 (к, 1H), 5,34-5,51 (к, 1H), 5,52-5,60 (д, 1H), 5,62 (с, 1H), 7,30-7,45 (м, 5H), 7,45-7,55 (т, 2H), 7,55-7,65 (т, 1H), 8,08-8,17 (д, 1H).
Пример 12. 2'-Troc-13-(N-Вос -β- фенил-изосеринил)-7- дезокси-7-фтор -Δ12,13- изобаккатин III (13), 2'-Troc-13- (N-Вос -β- фенил-изосеринил)-7-дезокси -7β,8β- метан Δ12,13- изобаккатин III (14) и 2'-Troc-13-(N-Вос -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатин III (15)
Трифторид диметиламиносеры (метил DAST, 8 мкл, 0,011 г, 0,08 ммоля) добавляли к холодному (баня с температурой -78oC раствору 2'-Troc-13-(N- Boc -β- фенил-изосеринил) -Δ12,13- изобаккатина III (9, 0,050 г, 0,048 ммоля) в CH2Cl2 (4 мл) в атмосфере азота. Охлаждающую баню удаляли, и через 1,75 часа результаты тонкослойной хроматографии показали, что реакция еще не закончилась. Этот раствор еще раз охлаждали до -78oC, и добавляли дополнительное количество трифторида диметиламиносеры (12 мкл). Охлаждающую баню удаляли, и результаты тонкослойной хроматографии, проведенной через 1,25 часа, показали, что реакция закончилась. Реакционную смесь охлаждали водой и разбавляли CH2Cl2. Слои разделяли и органический слой промывали водой, родные слои соединяли и еще раз экстрагировали CH2Cl2. Соединенные экстракты CH2Cl2 сушили (NaSO4), фильтровали и концентрировали с образованием белого твердого вещества. Это твердое вещество хроматографировали на силикагеле (две колонки Lobar с силикагелем E. Merck размер A) с использованием раствора в CH2Cl2 для ввода этого вещества в колонку и сначала 5% раствора CH3CN-CH2Cl2 (115 фракций), а затем 10% раствора CH3CN-CH2Cl2 для элюирования колонки. Собирали фракции объемом 3 мл до фракции 100, а затем собирали фракции объемом 8 мл. Фракции 56-98 содержали 2'-Troc-13-(N-Вос -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатин III (15).
Спектр протонного ЯМР (CDCl3, TMS): δ 8,18 (д, 2H, J = 7,1 Гц), 7,60 (т, 1H, J = 7,3 Гц), 7,50 (т, 2H, J = 7,5 Гц), 7,30-7,45 (м, 5H), 6,10 (двойной дублет, 1H, J = 5,1, 9,9 Гц, H6), 6,04 (д, 1H, J = 9,8 Гц, H7), 5,73 (д, 1H, J = 5,6 Гц, H2), 5,66 (д, 1H, J = 10,1 Гц), 5,50 (2H), 5,18 (с, 1H, H10), 5,14 (д, 1H, J = 5,0 Гц, H5), 4,70 (с, 2H, troc-CH2-), 4,55 (д, 1H, J= 8,3 Гц, H20A), 4,35 (д, 1H, J = 8,3 Гц, H20b), 3,68 (д, 1H, J = 5,6 Гц, H3), 2,97 (д, 1H, J= 19,1 Гц, H14a), 2,75 (с, 1H, H11), 2,64 (с, 3H , -CH3), 2,19 (с, 3H, -CH3), 2,11 (д, 1H, J = 19,3 Гц, H14b), 1,75 (с, 3H, -CH3), 1,58 (с, -CH3), 1,30 (с, 3H, -CH3), 1,20 (с, 9H, -CMe3), 1,04 (с, 3H, -CH3).
Фракции 106-124 содержали смесь, в которой главным компонентом был 2'-Troc-13-(N-Boc- -β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13 изобаккатин III (14).
Спектр протонного ЯМР (CDCl3, TMS): δ 8,18 (д, 2H, J = 7,2 Гц), 7,58 (т, 1H, J = 7,3 Гц), 7,49 (т, 2H, J = 7,4 Гц), 7,30-7,45 (м, 5H), 5,65 (м, 2H, H2, H2), 5,48 (м, 2H, -H -, H3), 5,22 (д, 1H, J = 2,0 Гц, H10), 4,80 (д, 1H, J = 3,2 Гц, H5), 4,70 (с, 2H, troc-CH2-), 4,43 (д, 1H, J = 8,7 Гц, H20a), 4,11 (д, 1H, J = 8,6 Гц, H20b), 3,87 (д, 1H, J= 6,7 Гц, H3), 2,96 (д, 1H, J = 19,2 Гц, H14a), 2,57 (с, 1H, H11), 2,58 (с, 3H, -CH3), 2,46 (двойной триплет, 1H, J = 4,4, 16,1 Гц, H6a), 2,17 (с, 3H, -CH3), 2,15 (м, 3H, H6b, H19a, H20b), 1,68 (мд, H19b), 1,63 (с, 3H, -CH3), 1,31 (м, H7), 1,31 (с, 3H, -CH3), 1,13 (с, 9H , -CMe3), 1,12 (с, 3H, -CH3).
Спектр углеродного ЯМР (CDCl3, TMS): δ- 203,5, 169,7, 167,3, 164,8, 154,7, 153,2, 144,4, 137,1, 133,6, 130,3, 129,1, 129,0, 128,7, 128,3, 126,3, 123,1, 85,1, 80,4, 79,0, 78,6, 78,4, 77,2, 75,6, 55,0, 54,1, 39,7, 36,6, 32,9, 32,4, 30,2, 28,9, 28,0, 25,8, 22,4, 21,1, 20,8, 14,2, 12,8.
2'-Troc-13-(N-Вос -β- фенил-изосеринил)-7-дезокси-7-фтор -Δ12,13- изобаккатин III (13) составляет незначительное количество в смеси и был обнаружен при проведении следующего эксперимента после удаления защитной группы 2'-Troc и отделения от -7β,8β- метан- аналога 13-(N-Вос -β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатина III (17, в примере 13).
Пример 13. 13-(N-Boc -β- фенилизосеринил)-7-дезокси-7-фтор -Δ12,13- изобаккатин III (16) и 13-(N-Boc -β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатин III (17)
Раствор смеси 2'-Troc-13-(N-Вос -β- фенил-изосеринил)-7-дезокси-7-фтор -Δ12,13- изобаккатина III (13) и 2'-Troc-13-(N-Boc -β- фeнил-изocepинил)-7-дeзoкcи -7β,8β- метан Δ12,13- изобаккатина III (14) по примеру 12 с соотношением 1: 9 (0,029 г, 0,029 ммоля) в CH3OH-OHAc (9:1) перемешивали с активированной цинковой пылью (0,074 г) в атмосфере азота при комнатной температуре. Через 4 часа оставалось небольшое количество исходного вещества; в эту смесь вводили дополнительное количество цинковой пыли (0,025 г) и продолжали перемешивать еще в течение одного часа. Смесь фильтровали для удаления твердых веществ и фильтрат выпаривали при пониженном давлении с образованием остатка, который растворяли в CH2Cl2 и дважды промывали водой. Водные экстракты снова экстрагировали
CH2Cl2, а соединенные органические экстракты сушили (Na2SO4), фильтровали и выпаривали с образованием белого твердого остатка (0,027 г). Этот остаток хроматографировали на силикагеле (две колонки Lobar с силикагелем E. Merck размер A, 3,5 мл фракции). Его вводили в колонку в растворе CH2Cl2 и элюировали колонку смесью 40% EtOAc и гексана. Фракции 41-58 содержали чистый 13-(N-Вос -β- фенил-изосеринил-7- дезокси -7β,8β- метан -Δ12,13- изобаккатин III (17) (66%).
Спектр протонного ЯМР (CDCl3, TMS): δ 8,19 (д, 2H , J= 7,2 Гц), 7,29-7,62 (м, 8H), 5,62 (д, 1H , J = 6,7 Гц, H2), 5,41 (с, 2H, -H-, H3'), 5,22 (д, 1H , J = 2,0 Гц, H10), 4,79 (д, 1H, J = 3,1 Гц, H5), 4,69 (д, 1H, J = 3,8 Гц, H2'), 4,42 (д, 1H, J = 8,7 Гц, H20a), 4,09 (д, 1H, J = 8,8 Гц, H20b), 3,87 (д, 1H, J = 6,7 Гц, H3), 2,96 (д, 1H, J = 19,3 Гц, H14a), 2,75 (с, 1H, H11), 2,56 (с, 3H , -CH3), 2,45 (двойной триплет, 1H, J = 4,3, 16,1 Гц, H6a), 2,17 (с, -CH3), 2,05-2,21 (м, 3H, H6b, H14b, H19a), 1,72 (т, 1H, J = 6,2 Гц, H19b), 1,58 (с, 3H, -CH3), 1,13 (с, 12H, -CMe3, -CH3).
Масс-спектр: обнаружено 832,3529, C34H53NO14 + H требует 832, 3544, 776, 732, 551, 73, 57 m/z.
Фракции 62-75 содержали 13-(n-Вос -β- фенил-изосеринил)-7-дезокси-7-фтор -Δ12,13- изобаккатин III (16).
Спектр протонного ЯМР (CDCl3, TMS): δ 8,13 (д, 2H, J = 7,2 Гц), 7,60 (т, 1H), 7,49 (т, 2H), 7,30-7,42 (м, 5H), 5,87 (д, 1H, J = 6,1 Гц, H2), 5,54 (д, 1H, J = 5,8 Гц, H3), 5,41 (с, 2H, -NH-, H10), 5,11 (д, 1H, J = 7,2 Гц, H5), 4,71 (м, 1H, H2), 4,58 (д, 1H, J = 47 Гц, H7), 4,49 (д, 1H, J = 8,4 Гц, H20a), 4,36 (д, 1H, J = 8,5 Гц, H20b), 4,11 (д, 1H, J = 5,6 Гц, H3), 2,92 (д, 1H, J = 19 Гц, H 14a), 2,74 (с, 1H, H11), 2,59 (с, 3H, -CH3), 2,20 (с, 3H, -CH3), 2,10 (д, 1H, J = 19 Гц, H14b), 1,64 (с, 3H, -CH3), 1,27 (с, 9H, -CMe3), 1,08 (с, 3H, -CH3).
Масс-спектр: обнаружено 852,3597, C45H54FNO14 + H требует 852,3606, 832, 796, 752, 692, 180, 105, 57 m/z.
Пример 14. 13-(N-Вос -β- фенил-изосеринил)-7-дезокси- Δ6,7-Δ12,13- изобаккатин III (18)
Раствор 2'-Troc-13-(N-Boc -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (15, 0.0080 г, 0,0079 ммоля) в смеси CH3OH и HOAc с соотношением 9: 1 (2 мл) в течение 3-х часов перемешивали с активированной цинковой пылью (0,020 г) в атмосфере азота при комнатной температуре, после чего вводили дополнительное количество цинковой пыли (0,050 г) и продолжали перемешивать еще 1,25 часа. Эту смесь фильтровали для удаления твердых веществ, фильтрат выпаривали, остаток растворяли в CH2Cl2, а раствор промывали насыщенным водным раствором NaHCO3 и дважды водой. Объединенные промывочные воды снова экстрагировали CH2Cl2. Объединенные экстракты CH2Cl2 сушили (Na2SO3), фильтровали и выпаривали с образованием белого твердого вещества (0,008 г). Твердое вещество хроматографировали на силикагеле (две колонки Lobar с силикагелем E. Merck размер A, 3 мл фракции).
Раствор вводили в колонку в CH2Cl2, элюировали колонку смесью 40% EtOAc и гексана. Чистый 13-(N-Вос -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатин III (18) был обнаружен во фракциях 31-51.
Спектр протонного ЯМР (CDCl3, TMS): δ 8,18 (д, 2H, J = 7,2 Гц), 7,61 (т, 1H, J = 7,3 Гц), 7,50 (м, 2H), 7,30-7,44 (м, 5H), 6,09 (двойной дублет, 1H, J = 5,1, 9,9 Гц, H6), 6,05 (д, 1H, J = 9,8 Гц, H7), 5,73 (д, 1H, J = 5,5 Гц, H2), 5,40 (с, 2H, -NH-, H3), 5,18 (с, 1H, H10), 5,13 (д, 1H, J = 5,1 Гц, H5), 4,70 (м, 1H, H2), 4,55 (д, 1H, J = 8,3 Гц, H20a), 4,34 (д, 1H, J = 8,4 Гц, H20b), 3,68 (д, 1H, J = 5,4 Гц, H3), 2,97 (д, 1H, J = 18,9 Гц, H14a), 2,74 (с, 1H, H11), 2,61 (с, 3H, -CH3), 2,20 (с, 3H, -CH3), 2,09 (д, 1H, J = 18,0 Гц, H14b), 1,75 (с, 3H, -CH3), 1,52 (с, 3H, -CH3), 1,32 (с, 1H, -CH3), 1,20 (с, 9H, -CMe3), 1,05 (с, 3H, -CH3).
Масс-спектр: обнаружено 832,3579, C45H53NO14 + H требует 832,3544, 776, 732, 180, 105, 57 m/z.
Пример 15. Баккатин-III-7-О-трифлат (20)
Раствор баккатина-III (5,25 г, 8,93 ммоля) в CH2Cl2 (21 мл) и пиридине (18,1 мл) охлаждали в ванне с температурой -30oC. Добавляли ангидрид трифторметансульфокислоты (3,76 мл, 6,31 г, 22,3 ммоля), полученную смесь перемешивали и оставляли на одни час для нагревания до комнатной температуры. Реакция закончилась через 4 часа, после чего добавляли насыщенный водный раствор NH4Cl (50 мл) и смесь экстрагировали CH2Cl2. Органический экстракт последовательно промывали 1 М водным раствором NaHSO4 (50 мл), насыщенным водным раствором NaHCO3 (2 x 50 мл), насыщенным водным раствором NaCl, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Во время удаления растворителя особенно тщательно следили за тем, чтобы не нагреть раствор выше 40oC. Было получено бледно-желтое твердое вещество, которое подвергали испарительной хроматографии на силикагеле (152 мм слой силикагеля в 75 мм колонке, 125 мл фракции). Это вещество вводили в колонку в растворе CH2Cl2, а для элюирования колонки использовали смесь 5% CH3CN и CH2Cl2. Фракции 19-35 содержали требуемый 7-O-трифлат (20) в виде твердого вещества.
Спектр протонного ЯМР (CDCl3, TMS): δ 8,10 (д, 2H, J = 7,2 Гц), 7,63 (т, 1H, J = 7,4 Гц), 7,49 (т, 2H, J = 7,6 Гц), 6,63 (с, 1H, H10), 5,68 (д, 1H, J = 7,0 Гц, H2), 5,52 (двойной дублет, 1H, J = 7,5, 10,1 Гц, H7), 4,94 (д, 1H, J = 8,4 Гц, H5), 4,86 (м, 1H, H13), 4,35 (д, 1H, J = 8,4 Гц, H20a), 4,15 (д, 1H, J = 8,4 Гц, H20b), 4,01 (д, 1H, L = 7,0 Гц, H3), 2,87 (5 линий, H14a), 2,30 (с, 3H, -CH3), 2,20 (с, 3H, -CH3), 2,10-2,30 (м, H6a, H6b, H14b), 1,87 (с, 3H, -CH3), 1,59 (с, 3H, -CH3), 1,19 (с, 3H, -CH3), 1,05 (с, 3H, -CH3).
Пример 16. Δ6,7 Баккатин-III (21)
Раствор баккатин-III-7-О-трифлата (20, 0,97 г, 1,35 ммоля) и 1,8-диазабицикло[5.4.0]ундец-7-ена (1,01 мл, 1,03 г, 6,76 ммоля) в тетрагидрофуране (6 мл) перемешивали 1 час при комнатной температуре, 2,5 часа при температуре 50oC и 3 часа при температуре кипения с обратным холодильником, после чего реакция заканчивалась. Добавляли EtOAc, и промывали раствор насыщенным водным раствором NaHCO4 и насыщенным водным раствором NaCl. Органический слой сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении. Остаток (0,876 г) подвергали испарительной хроматографии на силикагеле (152 мм слой силикагеля в 45 мм колонке), используя для его ввода в колонку раствор в CH2Cl2 (1 мл). Колонку элюировали смесью 10% CH3CN и CH2Cl2 (1 л), смесью 15% CH3CN и CH2Cl2 (0,5 л) и смесью 20% CH3CN-CH2Cl2 (0,5 л). Фракции, содержащие требуемое вещество, определяли посредством тонкослойной хроматографии, после чего их соединяли, что позволило получить Δ6,7 баккатин-III (21).
Спектр протонного ЯМР (CDCl3, TMS): δ 8,14 (д, 2H, J = 7,2 Гц), 7,63 (т, 1H, J = 7,3 Гц), 7,50 (т, 2H, J = 7,6 Гц), 6,24 (с, 1H, H10), 6,07 (двойной дублет, 1H, J = 5,7, 9,9 Гц, H6), 5,87 (д, 1H, J = 9,9 Гц, H7), 5,80 (д, 1H, J = 6,6 Гц, H2), 5,12 (д, 1H, J = 5,5 Гц, H5), 4,87 (м, 1H, H13), 4,43 (д, 1H, J = 8,1 Гц, H20a), 4,29 (д, 1H, J = 8,1 Гц, H20b), 4,10 (д, 1H, J= 6,6 Гц, H3), 2,31 (с, 3H, -CH3), 2,20-2,31 (м, 2H, H14a,b), 2,24 (с, 3H, -CH3), 1,97 (с, 3H, -CH3), 1,97 (с, 3H, -CH3), 1,85 (с, 3H, -CH3), 1,12 (с, 6H, 2 -CH3).
Спектр углеродного ЯМР (CDCl3, TMS): δ 205,6, 170,3, 169,7, 167,0, 145,5, 139,8, 133,7, 132,6, 130,1, 129,4, 128,6, 126,2, 81,2, 81,0, 78,7, 76,4, 75,5, 67,9, 55,5, 42,7, 41,7, 39,0, 30,9, 26,3, 22,7, 21,0, 20,9, 20,2, 15,0.
Пример 17. Получение Δ6,7 13-кето-баккатина III (22)
Δ6,7 Баккатин III (100 мг, 0,17 ммоля) растворяли в 2 мл CH2Cl2 и добавляли 300 мг активированного MnO2. Результаты тонкослойной хроматографии показали, что через 18 часов все исходное вещество прореагировало, после чего реакционную смесь фильтровали через целит и концентрировали в условиях вакуума с образованием Δ6,7 13-кетобаккатина III (22).
Спектр протонного ЯМР (CDCl2, TMS): δ 1,19 (с, 3H), 1,24 (с, 3H), 1,81 (с, 3H), 2,03 (с, 3H), 2,19 (с, 3H), 2,28 (с, 3H), 2,67 (д, 1H), 3,01 (д, 1H), 4,22 (м, 2H), 4,45 (д, 1H), 5,09 (д, 1H), 5,87 (м, 2H), 6,09 (двойной дублет, 1H), 6,32 (с, 1H), 7,50 (м, 2H), 7,64 (м, 1H), 8,10 (д, 2H).
Масс-спектр (FAB): высчитано для С31H35О10: 567,2230; обнаружено: 567,216.
Пример 18. Получение Δ6,7-Δ12,13- изобаккатина III (23)
Δ6,7-13-Кето-баккатин III (22, 90 мг 0,16 ммоля) растворяли в 750 мкл HOAc и добавляли 560 мг активированного цинка. Результаты тонкослойной хроматографии показали, что через 1 час все исходное вещество прореагировало, после чего реакционную смесь фильтровали через целит и концентрировали в вакууме с образованием Δ6,7-Δ12,13- изобаккатина III (23).
Спектр протонного ЯМР (CDCl3, TMS): δ 1,02 (с, 3H), 1,14 (с, 3H), 1,56 (с, 3H), 1,72 (с, 3H), 2,18 (с, 3H), 2,35 (с, 3H), 3,83 (д, 1H), 4,32 (д, 1H), 4,52 (д, 1H), 5,09 (с, 1H), 5,14 (д, 1H), 5,66 (д, 1H), 6,05 (м, 2H), 7,49 (м, 2H), 7,62 (м, 1H), 8,11 (д, 2H).
Масс-спектр: [M+H]+ = 569; С31H37О10 требует 569, другие ионы обнаружены при m/z 105.
Пример 19. Получение сложного эфира 7-дезокси- Δ6,7-Δ12,13- изобаккатин III-13-(4S, 5R)-N-Вос-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (23a,b)
Неочищенную соль калия (4S,5R)-N-Вос-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (116 мг, 0,25 ммоля) распределяли между CH2Cl2 и 5% раствором NaHCO3. Слои разделяли, и водный слой экстрагировали EtOAc. Объединенные органические слои фильтровали через безводный сульфат натрия и концентрировали в вакууме с образованием 112 мг (4S,5R)-N-Вос-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (4a, b) Δ6,7-Δ12,13- изобаккатин III (23, 94 мг, 0,16 ммоля) растворяли в 1 мл толуола. Всю (4S, 5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновую кислоту (4a,b) выливали в раствор CH2Cl2. К этому раствору добавляли
N, N'-дициклогексилкарбодиимид (60 мг, 0,29 ммоля) и диметилацетилфталат (10 мг, 0,08 ммоля). После перемешивания в течение ночи реакционную смесь фильтровали через целит. Фильтрат концентрировали в условиях вакуума и хроматографировали на колонке из силикагеля E. Merck размер A в смеси 10% EtOAc и толуола. Колонку элюировали смесью 10% EtOAc и толуола (25 мл), смесью 15% EtOAc и толуола (40 мл), смесью 20% EtOAc и толуола (100 мл) и смесью 25% EtOAc и толуола (50 мл). Фракции объемом 3 мл собирали. Менее полярный изомер сложного эфира 7-дезокси -Δ6,7-Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (24a) был обнаружен во фракциях 27-37. Более полярный изомер сложного эфира 7-дезокси -Δ6,7-Δ12,13- изобаккатин III-13-(4S,5R)-N-Вос-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (24b) был обнаружен во фракциях 44-54.
Данные для менее полярного изомера сложного эфира 7-дезокси -Δ6,7-Δ12,13- изобаккатин III-13-(4S,5R)-N-Вос-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (24a).
Спектр протонного ЯМР (CDCl3, TMS): δ 1,00 (с, 3H), 1,16 (с), 1,18 (с), 1,26 (с, 3H), 1,66 (с, 3H), 2,11 (с, 3H), 13 (с, 3H), 2,21 (м, 1H), 2,77 (д, 1H), 3,60 (д, 1H), 3,73 (с, 3H), 3,7 (с, 3H), 4,25 (д, 1H), 4,46 (д,.1H), 4,90 (широкий синглет, 1H), 5,05 (широкий синглет, 1H), 5,11 (с, 1H), 5,27 (широкий синглет, 1H), 5,65 (д, 1H), 5,99 (м, 2H), 6,33 (двойной дублет, 1H), 6,41 (д, 1H), 6,65 (с, 1H), 7,31 (м), 7,46 (м, 3H), 7,56 (м, 1H), 8,04 (д, 2H).
Данные для более полярного изомера сложного эфира 7-дезокси -Δ6,7-Δ12,13- изобаккатин III-13-(4S,5R)-N- Вос-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (24b).
Спектр протонного ЯМР (CDCl3, TMS): δ 1,04 (с), 1,27 (с), 1,69 (с), 2,17 (с, 3H), 2,67 (м, 1H), 3,56 (д, 1H), 3,80 (с, 3H), 3,84 (м), 3,88 (с, 3H), 4,26 (д, 1H), 4,47 (д, 1H), 4,59 (д, 1H), 5,03 (д, 1H), 5,08 (с, 1H), 5,27 (д, 1H), 5,67 (д, 1H), 6,00 (м, 2H), 6,48 (д, 2H), 7,40 (широкий синглет), 7,50 (м, 2H), 7,64 (м, 1H), 8,06 (д, 2H).
Пример 20. Получение 13-(N-Boc -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (18)
Сложный эфир 7-дезокси -Δ6,7-Δ12,13- изобаккатин III-13-(4S,5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (24b, 36 мг, 0,037 ммоля) растворяли в 800 мкл метанола и добавляли 200 мкл уксусной кислоты. После перемешивания в течение 17 часов результаты тонкослойной хроматографии показали, что реакция завершилась примерно на 50%, и через 20 часов не наблюдалось никаких дальнейших изменений. Добавляли еще 400 мкл метанола и 100 мкл уксусной кислоты. Через 41 час добавили еще 150 мл уксусной кислоты. Через 48 часов реакционную смесь распределяли между 5% раствором NaHCO3, рассолом и EtOAc. Слои разделяли, и водный слой еще экстрагировали с использованием EtOAc. Соединенные органические слои фильтровали через Na2SO4 и концентрировали в условиях вакуума. Остаток хроматографировали на 4 мг силикагеля с использованием смеси 25% EtOAc и толуола. Колонку элюировали смесью 20% EtOAc и толуола (20 мл), смесью 25% EtOAc и толуола (40 мл) и смесью 33% EtOAc и толуола (24 мл). Фракции объемом 2 мл собирали-13-(N-Вос -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатин III (18) был обнаружен во фракциях 19-33. Смешанные фракции 14-18 еще раз хроматографировали на 1 г силикагеля в растворе 20% EtOAc и толуола. Колонку элюировали смесью 20% EtOAc и толуола (10 мл), смесью 33% EtOAc и толуола (6 мл) и смесью 50% EtOAc и толуола (6 мл), собирая 0,5 мл фракции. 13-(N-Вос -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатин (III) был обнаружен во фракциях 25-34. Физические данные сопоставимы с аналогичными показателями, приведенными в примере 14.
Пример 21. Получение сложного метилового эфира N-(третбутиламинокарбонил) -β- фенил-изосерина (26)
Сложный метиловый эфир (2R,3S) -β- фенил-изосерина (4,35 г, 22 ммоля) растворяли в 100 мл сухого тетрагидрофурана и охлаждали колбу с этим раствором до 0oC. К этому раствору добавляли трет-бутилизоцианат (2,8 мл, 23 ммолей). Результаты тонкослойной хроматографии, проведенной через 15 минут, показали, что в реакционной смеси оставалось некоторое количество исходного вещества, поэтому добавили еще 0,5 мл изоцианата. С помощью тонкослойной хроматографии, выполненной через 1 час, установили, что исходное вещество полностью прореагировало, поэтому растворитель концентрировали в вакууме. Спектр протонного ЯМР (CDCl2, TMS): δ 1,27 (с, 9H), 3,43 (д, 1H), 3,81 (с, 3H), 4,34 (широкий синглет, 1H), 4,48 (м, 1H), 5,27 (м, 1H), 5,32 (м, 1H), 7,29 (м, 2H), 7,34 (м, 3H).
Масс-спектр (FAB с высоким разрешением). Теоретическое значение для C15H22N2O4+H: 295,1658. Обнаружено: 295,1663.
Пример 22. Получение сложного метилового эфира (4S,5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (28a и b)
Сложный метиловый эфир N-трет-бутил -β- фенил-изосерина (26,68 мг, 0,23 ммоля) растворяли в 5 мл сухого тетрагидрофурана и полученный раствор обрабатывали диметилацеталем 2,4-диметокси-бензальдегида (70 мг, 0,33 ммоля), пара-толуолсульфонатом пиридина (6 мг, 0,02 ммоля), после чего раствор, кипятили с обратным холодильником. А в течение 45 минут трижды испарялось примерно 2 мл растворителя, который пополняли 2 мл свежего тетрагидрофурана, после чего методом тонкослойной хроматографии было установлено, что все исходное вещество прореагировало. Растворитель концентрировали в вакууме и хроматографировали на 7 г силикагеля в смеси EtOAc и гексана с соотношением 1: 3. Колонку элюировали 80 мл смеси EtOAc и гексана с соотношением 1:3, 40 мл смеси EtOAc и гексана с соотношением 1:2, 30 мл смеси EtOAc и гексана с соотношением 2:3 и 30 мл смеси EtOAc и гексана с соотношением 1:1, собирая 3 мл фракции.
Менее полярный изомер сложного метилового эфира (4S,5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (28a) был обнаружен во фракциях 21-31. Более полярный изомер сложного метилового эфира (4S,5R)-N-(трет-бутиламинокарбонил)-2-(2, 4-диметоксифенил)-4-фенил- 5-оксазолидинкарбоновой кислоты (28b) был обнаружен во фракциях 33-42.
Менее полярный продукт 28a
Спектр протонного ЯМР (CDCl3, TMS): δ 1,19 (с, 9H), 3,82 (с,3H), 3,85 (с, 3H), 3,89 (с, 3H),4,68 (широкий синглет, 1H), 4,88 (д, 1H), 5,52 (д, 1H), 46(М), 6,70 (с, 1H), 7,25- 7,50 (м).
Масс-спектр (FAB с высоким разрешением). Теоретическое значение для C24H31N2O6+H : 443,2182. Обнаружено: 443,2172.
Более полярный продукт 28b
Спектр протонного ЯМР (CDCl3, TMS): δ 0,99 (м, 9H), 3,53 (м, 3H), 3,81 (м, 3H), 3,88 (м, 3H), 4,05 (м, 1H), 4,55 (м, 1H), 5,45 (м, 1H), 6,48 (м, 2H), 6,79 (м, 1H), 7,25-7,50 (м).
Масс-спектр (FAB с высоким разрешение). Теоретическое значение для С24H31N2O6+H : 443,2182. Обнаружено: 443,2180.
Пример 23. Получение соли калия (4S,5R)-N-(трет-бутиламинокарбонил) 2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (29a)
Сложный метиловый эфир (4S,5R)-N-(трет-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (Пример N 22, 28a, 6,27 г, 14,2 ммоля) перемешивали в метаноле (50 мл) при комнатной температуре в атмосфере азота. К этому продукту добавляли раствор карбоната калия (2,50, 18,1 ммоля) в воде (6 мл). Через 6 часов реакционную смесь выпаривали при пониженном давлении с целью удаления метанола, а остаток сушили вымораживанием. Был достигнут количественный выход соли калия (4S,5R)-N-Вос-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (29a) в виде порошка в смеси с солями карбоната калия.
Спектр протонного ЯМР (DMSO-d6, TMS): δ 1,10 (с, 9H), 3,77 (с, 3H), 4,17 (д, 1H J = 2,3 Гц), 4,70 (широкий синглет, 1H), 5,16 (д, 1H, J = 2,3 Гц), 6,50 (с+м, 2H), 6,60 (д, 1H), 7,14-7,42 (м, 6H).
Пример 23a. Получение соли калия (4S,5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновый кислоты
Сложный метиловый эфир (4S,5R)-N-(трет-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (пример N 22, 28b, 0,98 г, 2,2 ммоля) перемешивали в метаноле (50 мл) при комнатной температуре в атмосфере азота. К этому продукту добавляли раствор карбоната калия (0,39 г, 2,5 ммоля) в воде (1,1 мл). Через 5 часов реакционную смесь выпаривали при пониженном давлении с целью удаления метанола, а остаток сушили вымораживанием. Был достигнут количественный выход соли калия (4S,5R)-N-Вос-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты в виде порошка в смеси с солями карбоната калия.
Спектр протонного ЯМР (DMSO-d6, TMS): δ 0,81 (с, 9H), 3,80 (с, 3H), 3,85 (с, 3H), 3,92 (д, 1H, J = 6,4 Гц), 4д, H8 (широкий синглет, 1H), 5,16 (д, 1H, J = 6,4 Гц), 6,43 (с, 1H), 6,56 (м, 2H), 7,30-7,47 (м, 6H).
Пример 24. Получение (4S,5R)-N-(трет-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (30a)
Соль калия (4S, 5R)-N-Вос-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (29a, пример 23) распределяли между метиленхлоридами водой, содержащей 0,9 мл 1 н. раствора HCl. Слои разделяли и водный слой еще раз экстрагировали метиленхлоридом. Органические слои объединяли, сушили над сульфатом натрия и выпаривали. В результате этого была получена (4S,5R)-N-Вос-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновая кислота (30a) в виде твердого вещества.
Пример 25. Получение сложного эфира 7-TES -Δ12,13- изобаккатин III-13-(4S, 5R)-N-(трет-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (31a)
(4S,5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновую кислоту (3 ммоля, способ получения N 24, 30a) растворяли в смеси 20 мл метиленхлорида (11 мл) и толуола (5 мл). К этому раствору добавляли 7-TES- -Δ12,13- изобаккатин III (1,0 г, 1,4 ммоля, 3, пример 1), 4-диметиламинопиридин (93 мг, 0,76 ммоля) и 1,3-дициклогексилкарбодиимид (0,63 г, 3,1 ммоля), после чего реакционную смесь перемешивали в течение 3 часов в атмосфере азота. Реакционную смесь разбавляли толуолом и фильтровали. Фильтрат промывали 1н. раствором хлористоводородной кислоты, 5% водным раствором бикарбоната натрия и рассолом. Органический раствор сушили над безводным сульфатом натрия и выпаривали. Полученный продукт очищали хроматографией на колонке из силикагеля 60 в смесях ацетона и гексана. С помощью тонкослойной хроматографии было установлено, что в результате концентрирования фракций был получен сложный эфир 7-TES -Δ12,13- изобаккатин III-13-(4S, 5R)- N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил- 5-оксазолидинкарбоновой кислоты (31a) в виде твердого вещества.
Спектр протонного ЯМР (CDCl3, TMS): δ 0,54 (м, 6H), 0,90 (м, 12H), 1,16 (с, 3H), 1,17 (с, 9H), 1,80 (с, 3H), 1,89 (м, 1H), 2,15 (с, 3H), 2,18 (с, 3H), 2,30 (д, 1H), 2,50 (м, 2H), 2,78 (д, 1H), 3,83 (с, 3H), 3,85 (д, 1H), 3,91 (с, 3H), 4,28 (д, 1H), 4,38 (д, 1H), 4,43 (м, 1H), 4,64 (широкий синглет, 1H), 4,88 (м, 1H), 5,04 (д, 1H), 5,55 (м, 1H), 5,65 (д, 1H), 5,99 (с, 1H), 6,49 (м, 2H), 6,74 (с, 1H), 7,22 (д, 1H), 7,34-7,68 (м, 8H), 8,07 (м, 2H)
Спектр углеродного ЯМР (CDCl3, TMS): δ 5,27, 6,55, 8,99, 13,83, 14,11, 18,92, 20,90, 22,30, 28,79, 29,67, 32,86, 36,94, 38,75, 39,63, 50,59, 55,13, 55,28, 56,42, 58,40, 62,81, 72,50, 73,15, 74,10, 76,88, 80,58, 84,28, 85,81, 98,11, 104,94, 117,48, 122,28, 126,75, 127,66, 128,41, 128,49, 128,76, 129,76, 133,43, 139,81, 142,87, 154,95, 158,14, 161,68, 166,33, 168,33, 168,55, 170,12, 204,76.
Пример 26. Получение 7-TES-13-(N-трет-бутиламинокарбонил) -β- фенил-серинил) -Δ12,13- изобаккатина III (32a) и 13-N-(трет-бутиламинокарбонил -β- фенил-серинил) -Δ12,13- изобаккатина III (32b)
Сложный эфир 7-TES- -Δ12,13- изобаккатин III-13-(4S,5R)-N- (трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (31a, пример 25, 0,102 г, 0,092 ммоля) перемешивали 65 часов в смеси уксусной кислоты (4 мл) и воды (1 мл) при комнатной температуре в атмосфере инертного газа. Реакционную смесь разбавляли этилацетатом и промывали 5% водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и выпаривали. Полученный продукт очищали хроматографией на колонке из силикагеля 60 в смеси ацетона и гексана с соотношением (30-70) и (40-60). Фракции объемом 4 мл собирали. В результате концентрирования фракций 13-22 был получен 7-TES-13-(N-(трет-бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатин III (32a). В результате концентрирования фракций 35-40 был получен 13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатин III (32b).
Данные для продукта 32a.
Спектр протонного ЯМР (CDCl3, TMS): δ 0,53 (м, 6H), 0,89 (т, 9H), 1,13 (с, 12H), 1,24 (с, 4H), 1,57 (широкий синглет, 1H), 1,62 (с, 3H), 1,68 (с, 3H), 1,89 (м, 1H), 2,07 (д, 1H), 2,16 (с, 3H), 2,50 (м, 2H), 2,58 (с, 3H), 2,86 (д, 1H), 3,84 (д, 1H, J = 5,6 Гц), 4,34 (м, 4H), 4,71 (д, 1H, J = 2,9 Гц), 4,92 (двойной дублет, 1H), 5,03 (д, 1H, J = 9,0 Гц), 5,53 (м, 2H), 5,97 (с, 1H), 7,28-7,68 (м, 8H), 8,11 (м, 2H).
Данные для продукта 32b.
Спектр протонного ЯМР (CDCl3, TMS): δ 1,05 (с, 3H), 1,13 (с, 9H), 1,29 (с, 3H), 1,55 (с, 3H), 1,62 (с, 3H), 1,65 (широкий синглет, 1H), 1,89 (м, 1H), 2,11 (д, 1H), 2,23 (с, 3H), 2,47 (м, 2H), 2,54 (с, 3H), 2,72 (широкий синглет, 1H), 2,87 (д, 1H), 3,58 (д, 1H), 3,68 (д, 1H), 4,10 (широкий синглет, 1H), 4,31 (м, 2H), 4,39 (д, 1H), 4,62 (широкий синглет, 1H), 4,71 (д, 1H), 4,90 (двойной дублет, 1H), 5,44 (с+м, 2H), 5,57 (м, 2H), 7,36 (м, 5H), 7,49 (м, 1H), 8,10 (д, 2H).
Спектр углеродного ЯМР (CDCl3, TMS): δ 9,07, 14,41, 19,80, 21,03, 23,19, 29,30, 29,81, 32,87, 35,30, 38,66, 39,50, 50,47, 55,75, 57,93, 71,66, 73,50, 74,70, 77,21, 77,64, 77,73, 81,09, 84,47, 121,69, 126,66, 127,93, 128,75, 128,86, 130,22, 133,69, 138,88, 143,26, 156,52, 166,63, 170,69, 171,33, 171,99, 206,71.
Масс-спектр (FAB с высоким разрешением). Теоретическое значение для С45H56N2О14+H : 849,3809. Обнаружено: 849,3842.
Пример 27. Получение сложного эфира Δ12,13- изобаккатин III-13-(4S, 5R)-N- (трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (33a)
Сложный эфир 7-TES -Δ12,13- изобаккатин III-13-(4S,5R)-N- -(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (31a, способ получения 26, 460 мг, 0,413 ммоля) растворяли в ацетонитриле (0,5 мл), и этот раствор обрабатывали фтористоводородным триэтиламином (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Затем ее разбавляли этилацетатом и промывали 5% водным раствором бикарбоната натрия, 5% водным раствором бисульфата натрия и насыщенным рассолом. Органический слой сушили над сульфатом натрия и выпаривали в условиях вакуума. Неочищенный продукт очищали хроматографией на 50 г силикагеля, предназначенного для высокоэффективной жидкостной хроматографии, элюируя смесями 30% и 40% ацетона в гексане. Фракции объемом 10 мл собирали и анализировали с помощью тонкослойной хроматографии. Целевой продукт был обнаружен во фракциях 24-30, из которых после соединения и выпаривания в вакууме был получен сложный эфир Δ12,13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил) -2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (33a).
Спектр протонного ЯМР (CDCl3, TMS): δ 1,07 (с, 3H), 1,17 (с, 9H), 1,32 (с, 3H), 1,62 (с, 3H), 1,67 (с, 3H), 1,91 (м, 1H), 2,16 (с, 3H), 2,24 (с, 3H), 2,31 (д, 1H), 2,49 (м, 1H), 2,81 (м, 2H), 3,54 (д, 1H), 3,71 (д, 1H), 3,83 (с, 3H), 3,92 (с, 3H), 4,35 (м, 3H), 4,65 (широкий синглет, 1H), 4,89 (м, 1H), 5,06 (д, 1H), 5,49 (широкий синглет, 1H), 5,58 (д, 1H), 5,67 (д, 1H), 6,47 (м, 1H), 6,53 (д, 1H), 6,73 (с, 1H), 7,20 (д, 1H), 7,34-7,65 (м, 8H), 8,07 (м, 2H)
Спектр углеродного ЯМР (CDCl3, TMS): δ 9,14, 13,83, 14,39, 19,85, 21,09, 22,50, 29,12, 29,93, 31,8, 33,2, 35,35, 38,69, 39,60, 50,92, 55,45, 55,82, 57,99, 63,16, 71,60, 73,68, 77,37, 77,72, 80,96, 84,62, 86,27, 98,43, 105,27, 117,5, 121,81, 127,02, 128,76, 128,83, 130,09, 133,79, 140,2, 143,21, 155,4, 158,4, 162,1, 166,6, 168,7, 170,56, 172,0, 206,74.
Пример 28. Получение сложного эфира 7-трифторметансульфонил -Δ12,13- изобаккатин III-13-(4S, 5R)-N- (трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (34a)
Раствор сложного эфира Δ12,13- изобаккатин III-13- (4S,5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (33a, 63 мг, 0,063 ммоля) в CH2Cl2 (0,4 мл) и пиридине (0,15 мл)
охлаждали на бане с температурой -78oC. После добавления ангидрида трифторметансульфокислоты (33 мкл, 0,20 ммоля) реакционная смесь затвердевала. Ее нагревали до расплавления, а затем вновь охлаждали. Через 1 час реакционную смесь нагревали до комнатной температуры и перемешивали в течение 10 минут, выливали в насыщенный водный раствор NH4Cl и экстрагировали с помощью CH2Cl2. Органический экстракт промывали 1 М водным раствором NaHSO4 (50 мл), сушили и концентрировали при пониженном давлении. Остаток хроматографировали на силикагеле (3 г), элюировали смесью 30% ацетона и гексана. Фракции объемом 1 мл собирали. В результате концентрирования фракций 17, 18 был получен сложный эфир 7-трифторметансульфонил -Δ12-13- изобаккатин III-13-(4S, 5R)- -N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (34a).
Спектр протонного ЯМР (CDCl3, TMS): δ 1,11 (с, 3H), 1,17 (с, 9H), 1,77 (с, 6H), 2,20 (с, 3H), 2,21 (с, 3H), 2,34 (д, 1H), 2,68 (широкий синглет, 1H), 2,80 (д, 1H), 2,95 (м, 1H), 3,83 (с, 3H), 3,88 (м, 1H), 3,93 (с, 3H), 4,34, (д, 1H), 4,43 (д, 1H), 4,67 (широкий синглет, 1H), 4,86 (м, 1H), 5,05 (м, 1H), 5,53 (м, 1H), 5,60 (м, 1H), 5,88 (с, 1H), 6,47 (м, 1H), 6,53 (м, 1H), 6,72 (с, 1H), 7,20 (д, 1H), 7,30-7,70 (м, 8H), 8,07 (м, 2H).
Спектр углеродного ЯМР (CDCl2, TMS): δ 10,17, 14,12, 14,42, 19,71, 20,71, 22,36, 22,65, 29,10, 29,93, 31,59, 33,24, 38,75, 39,67, 50,93, 55,16, 55,44, 55,69, 57,57, 63,04, 72,95, 74,73, 77,20, 79,68, 80,87, 83,38, 85,86, 86,06, 98,38, 105,33, 117,61, 122,78, 127,00, 127,98, 128,81, 130,09, 133,98, 140,17, 142,78, 155,29, 158,46, 162,06, 166,41, 168,91, 168,99, 170,90, 203,44.
Пример 29. Получение сложного эфира 7-дезокси -7β,8β- метан -Δ12-13- изобаккатин III-13-(4S, 5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (35a)
К раствору сложного эфира 7-трифторметансульфонил -Δ12-13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (34a, пример 28) в перегнанном диоксане добавляли водный раствор азида натрия. Реакционную смесь нагревали с обратным холодильником в атмосфере азота в течение одного часа. Эту смесь разбавляли этилацетатом, промывали водой и рассолом, сушили над безводным сульфатом натрия и выпаривали. Полученный продукт очищали хроматографией на колонке из силикагеля 60 в смесях этилацетата и метиленхлорида. С помощью тонкослойной хроматографии было установлено, что в результате выпаривания фракций был получен сложный эфир 7-дезокси -7β,8β- метан Δ12-13- изобаккатин III-13-(4S, 5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (35a).
Пример 30. Получение 13-(N-(трет-бутиламинокарбонил) β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12-13- изобаккатина III (36)
В соответствии с методикой, описанной в примере 5, сложный эфир 7-дeзoкcи -7β,8β- метан -Δ12-13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (35a) в течение 4-х дней перемешивали в смеси уксусной кислоты и воды с соотношением 4: 1 при комнатной температуре в атмосфере инертного газа. Реакционную смесь разбавляли этилацетатом и несколько раз промывали водой и водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и выпаривали. Полученный продукт хроматографировали на силикагеле 60 (230-400 меш) в смесях ацетона и гексана. Результаты тонкослойной хроматографии показали, что в результате выпаривания фракций был получен 13-(N-(трет-бутиламинокарбонил) β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12-13- изобаккатин III (36).
Пример 31. Получение 13-(N-(трет-бутиламинкарбонил) β- фенилизосеринил)-7-дезокси -7β,8β- метан -Δ12-13- изобаккатина III (36) и 13-(N-(трет-бутиламинокарбонил) -β- фенилизосеринил)-7-трифторметансульфонил -Δ12-13- изобаккатина III (37)
Раствор Δ12-13- изобаккатин III-13-[сложный эфир (4S,5R)-N- трет-бутиламинокарбонил-(2,4-диметоксифенил)-4-фенил- 5-оксазолидинкарбоновой кислоты]-7-трифлата (0,20 г, 0,18 ммоля) в 2 мл смеси уксусной кислоты и метанола (80: 20) перемешивали при комнатной температуре в течение 1,3 часа. Реакционную смесь разбавляли этилацетатом и промывали 5% водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и концентрировали. Неочищенный продукт хроматографировали на силикагеле 60 в смесях ацетона и гексана, в результате чего произошло его частичное превращение в 7,19-метан-13-(N-трет-бутиламинокарбонил -β- фенилизосеринил) -Δ12-13- изобаккатин III. Элюируемые из колонки продукты еще раз хроматографировали в смесях этилацетата и метиленхлорида с образованием 13-(N-(трет-бутиламинокарбонил) -β- фенилизосеринил)-7- трифторметансульфонил -Δ12-13- изобаккатина III (37, 70 мг) и 13-(N-(трет-бутиламинокарбонил) -β- фенилизосеринил)-7-дезокси -7β,8β- метан -Δ12-13- изобаккатина III (36, 41 мг).
Данные для 13-(N-трет-бутиламинокарбонил) -β- фенилизосеринил)-7- трифторметансульфонил -Δ12-13- изобаккатина III (37).
Спектр протонного ЯМР (CDCl2, TMS): δ 1,09 (с), 1,11 (с), 1,17 (с), 1,24 (с), 1,76 (с), 2,1 (м), 2,18 (с), 2,47 (с), 2,65 (м), 2,90 (м), 3,83 (д), 4,31 (д), 4,43 (д), 4,88 (м), 5,32 (широкий синглет), 5,47 (м), 5,58 (д), 5,85 (с), 7,30-7,63 (м), 8,0 (д).
Спектр углеродного ЯМР (CDCL3, TMS): δ 10,09, 14,36, 19,69, 20,68, 22,62, 23,00, 29,13, 29,22, 29,73, 31,01, 22,53, 38,67, 39,57, 50,68, 55,13, 55,41, 57,50, 72,79, 74,24, 74,66, 79,59, 83,30, 85,89, 122,70, 126,72, 127,99, 128,61, 128,81, 128,86, 130,22, 133,88, 138,65, 142,85, 156,47, 166,41, 168,98, 170,68, 171,16, 203,40.
Данные для 13-(N-(трет-бутиламинокарбонил) -β- фенилизосеринил)-7- дезокси -7β,8β- метан -Δ12-13- изобаккатина III (36).
Спектр протонного ЯМР (CDCl3, TMS): δ 1,04 (с, 9H), 1,12 (с), 1,31 (с+м), 1,55 (с), 1,73 (м), 2,17 (с+м), 2,41 (м, 1H), 2,55 (с, 3H), 2,73 (широкий синглет, 1H), 2,91 (д, 1H), 3,86 (д, 1H), 4,09 (д, 1H), 4,29 (широкий синглет, 1H), 4,41 (д, 1H), 4,70 (д, 1H), 4,78 (м, 1H), 5,08 (д, 1H), 5,21 (д, 1H), 5,50 (м, 1H), 5,62 (д, 1H), 7,27-7,65 (м, 10 H), 8,18 (м, 2H).
Спектр углеродного ЯМР (CDCl3, TMS): δ 12,80, 14,22, 20,86, 21,08, 22,44, 25,79, 28,77, 29,20, 30,09, 32,44, 32,81, 36,69, 39,70, 50,38, 55,03, 55,22, 74,39, 75,70, 78,29, 78,41, 78,87, 80,47, 85,15, 122,40, 126,65, 127,83, 128,77, 129,02, 130,38, 133,64, 139,15, 141,77, 156,19, 167,28, 169,76, 170,36. 171,02, 203,64.
Пример 32. Получение 13-(N-трет-бутиламинокарбонил) β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12-13- изобаккатина III (38)
В соответствии с методикой, описанной в примере 16, раствор 13-(N-(трет-бутиламинокарбонил) β- фенил-изосеринил)-7- трифторметансульфонил -Δ12-13- изобаккатина III (37) и 1,8-диазабицикло-[5.4.0] ундец-7-ена в тетрагидрофуране перемешивали 1 час при комнатной температуре, 2,5 часа при температуре 50oC и 3 часа при кипячении с обратным холодильником, после чего реакция прекращалась. Добавляли EtOAc, полученный раствор промывали насыщенным водным раствором NaHCO3 и насыщенным водным раствором NaCl. Органический слой сушили (NaSO4), фильтровали и выпаривали при пониженном давлении. Остаток анализировали посредством испарительной хроматографии на силикагеле с использованием раствора в CH2Cl2 для ввода данного вещества в колонку. Колонку элюировали смесями ацетонитрила и метиленхлорида. Фракции, содержащие целевое вещество, определяли методом тонкослойной хроматографии и объединяли с образованием 13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12-13- изобаккатина III (38).
Пример 33. Получение сложного эфира 7-дезокси -7β,8β- метан -Δ12-13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (39a).
В соответствии с методикой, описанной в примере 16, раствор сложного эфира 7-трифторметансульфонил -Δ12-13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (34a) и 1,8-диазабицикло-[5.4.0]ундец-7-ена в тетрагидрофуране перемешивали 1 час при комнатной температуре, 2,5 часа при температуре 50oC и 3 часа при кипячении с обратным холодильником, после чего реакция прекращалась. Добавляли EtOAc, и полученный раствор промывали насыщенным водным раствором NaHCO3 и насыщенным водным раствором NaCl. Органический слой сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении. Колонку элюировали смесями ацетонитрила и метиленхлорида. Фракции, содержащие требуемое вещество, определяли посредством тонкослойной хроматографии и соединяли с образованием сложного эфира 7-дезокси -Δ6,7-Δ12-13- изобаккатин III-13-(4S, 5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (39a).
Пример 34. Получение 13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12-13- изобаккатина III (38)
В соответствии с методикой, описанной в примере 5, сложный эфир 7-дезокси -Δ6,7-Δ12-13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (39a) 4 дня перемешивали в смеси уксусной кислоты и воды с соотношением 4:1 при комнатной температуре в атмосфере инертного газа. Реакционную смесь разбавляли этилацетатом и несколько раз промывали водой и водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и выпаривали. Полученный продукт хроматографировали на силикагеле 60 (230-400 меш) в смесях ацетона и гексана. Результаты тонкослойной хроматографии показали, что после выпаривания этих фракций был получен 13-[N-(трет-бутиламинокарбонил) -β- фенил-изосеринил-7-дезокси -Δ6,7-Δ12-13- изобаккатин III (38).
Пример 35. Получение сложного эфира 7-(O-этоксиметил)- Δ12-13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-диметоксифенил- (-4-фенил-5-оксазолидинкарбоновой кислоты (40a)
Сложный эфир Δ12-13- изобаккатин III-13-(4S,5R)-N-Вос-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (10a) перемешивали в метиленхлориде при комнатной температуре в атмосфере азота, после чего этот раствор обрабатывали простым хлорэтиловым эфиром и диизопропилэтиламином. Реакционную смесь перемешивали в течение 2 дней до тех пор, пока реакция на закончилась, о чем свидетельствовали результаты тонкослойной хроматографии. Реакционную смесь распределяли между метиленхлоридом и водой. Слои разделяли и водный слой еще раз экстрагировали метиленхлоридом. Органические слои сушили над сульфатом натрия, соединяли и выпаривали в условиях вакуума. Неочищенный продукт хроматографировали на силикагеле, элюируя смесями ацетона и гексана. С помощью тонкослойной хроматографии были обнаружены фракции, содержащие целевой продукт. Их соединяли и выпаривали в вакууме с образованием сложного эфира 7-(O-этоксиметил -Δ12-13- изобаккатин III-13-(4S,5R)-N-Boc-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (40a).
Пример 36. Получение 7-(O-этoкcимeтил)-13-(N-Boc -β- фенил-изосеринил) -Δ12-13- изобаккатина III (41)
В соответствии с методикой, описанной в примере 5, сложный эфир 7-(O-этоксиметил) -Δ12-13- изобаккатин III-13-(4S,5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (40a) 4 дня перемешивали в смеси уксусной кислоты и воды с соотношением 4:1 при комнатной температуре в атмосфере инертного газа. Реакционную смесь разбавляли этилацетатом и несколько раз промывали водой и водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и выпаривали. Полученный продукт хроматографировали на силикагеле 60 (230-400 меш) в смесях ацетона и гексана. С помощью тонкослойной хроматографии было установлено, что в результате выпаривания этих фракций был получен 7-(O-этоксиметил)-13-(N-Вос -β- фенил-изосеринил -Δ12-13- изобаккатин III (41).
Пример 37. Получение сложного эфира 7-(O-этоксиметил) Δ12-13- изобаккатин III-13-(4S, 5R)-N-(трет-бутиламинокарбонил)- 2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (42a)
Сложный эфир Δ12-13- изобаккатин III-13-(4S,5R)-N- (трет-бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (33a, 70 мг, 0,070 ммоля) перемешивали в 1 мл метиленхлорида при комнатной температуре в атмосфере азота, после чего полученный раствор обрабатывали простым хлорметиловым эфиром (32 мкд, 0,35 ммоля) и диизопропилэтиламином (61 мкл, 0,35 ммоля). Через 1 час реакционную смесь обрабатывали дополнительным количеством диизопропилэтиламина (5 мкл). Реакционную смесь перемешивали в течение 2 дней, причем по истечении этого срока реакция еще не закончилась, о чем свидетельствовали результаты тонкослойной хроматографии. Вводили дополнительное количество простого хлорметилэтилового эфира (15 мкл) и диизопропилэтиламина (30 мкл) и реакционную смесь перемешивали еще 12 дней. После этого реакционную смесь распределяли между метиленхлоридом и водой. Слои разделяли и водный слой еще раз экстрагировали метиленхлоридом. Органические слои сушили над сульфатом натрия, соединяли и выпаривали в условиях вакуума. Неочищенный продукт хроматографировали на силикагеле (10 г), производя элюирование смесью ацетона и толуола (10-90). Фракции объемом 3 мл собирали и анализировали методом тонкослойной хроматографии. Неочищенный продукт был обнаружен во фракциях 9-20. Эти фракции соединяли, выпаривали в вакууме, а остаток еще раз хроматографировали на колонке из силикагеля E. Merck размер A, производя элюирование смесью ацетона и гексана (10-90). Фракции объемом 3 мл собирали. Требуемый продукт был обнаружен во фракциях 10-15, из которых после соединения и выпаривания в вакууме был получен сложный эфир 7-этокси-метил -Δ12-13- изобаккатин III-13-(4S,5R)-N-(трет-бутилоаминокарбонил) -2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (42a).
Тонкослойная хроматография (силикагель GF): смесь ацетона и гексана (2-80); Rf: 0,59.
Спектр протонного ЯМР (CDCl3, TMS): δ 1,07-1,18 (т, 3H), 1,18 (с, 9H), 1,30 (с, 3H), 1,68 (с, 3H), 1,72 (с, 3H), 1,89-2,03 (м, 1H), 2,16 (с, 3H), 2,19 (с, 3H), 2,26-2,39 (д, 1H), 2,64 (с, 1H), 2,73-2,85 (д, 1H), 2,84-2,96 (м, 1H), 3,30-3,43 (м, 1H), 3,61-3,75 (м, 1H), 3,83 (с, 3H), 3,86-3,92 (d, 1H), 3,92 (с, 3H), 4,00-4,10 (к, 1H), 4,25-4,34 (д, 1H), 4,36-4,44 (д, 1H), 4,60-4,74 (м, 3H), 4,84-4,93 (двойной дублет, 1H), 5,04-5,09 (д, 1H), 5,50-5,58 (д, 1H), 5,64-5,70 (д, 1H), 6,44-6,51 (двойной дублет, 1H), 6,51-6,56 (д, 1H), 6,57 (с, 1H), 7,16-7,24 (д, 1H), 7,32-7,57 (м, 7H), 7,57-7,65 (т, 1H), 8,03-8,10 (д, 2H).
Пример 38. Получение 7-(O-этоксиметил)-13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12-13- изобаккатина III (43)
Сложный эфир 7-(O-этоксиметил) -Δ12-13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (42 а, 45 мг, 0,043 ммоля) перемешивали в смеси уксусной кислоты (1,5 мл) и воды (0,5 мл) при комнатной температуре. Результаты тонкослойной хроматографии показали, что реакция закончилась через 3 часа. После этого реакционную смесь сушили вымораживанием. Неочищенный продукт очищали высокоэффективной жидкостной хроматографией на колонке из силикагеля E. Merck размер A, элюируя градиентом смесей ацетона и гексана с соотношением от (2-75) до (35-65). Фракции объемом 3 мл собирали и анализировали методом тонкослойной хроматографии. Целевой продукт был обнаружен во фракциях 7-11, которые соединяли и выпари вали в вакууме с образованием 7-(O-этоксиметил)-13-(N-(трет-бутиламинокарбонил) -β- фенилизосеринил) -Δ12-13- изобаккатина III (43) в виде твердого вещества.
Тонкослойная хроматография (силикагель 60): смесь ацетона и гексана (30-70); Rf: 0,24.
Спектр протонного ЯМР (CDCl2, TMS): δ 1,07-1,20 (м, 15H), 1,24 (с, 3H), 1,58 (с, 3H), 1,67 (с, 3H), 1,87-2,02 (т, 1H), 2,02-2,14 (д, 1H), 2,16 (с, 3H), 2,55 (с, 3H), 2,77-2,94 (м, 2H), 3,27-3,42 (м, 1H), 3,60-3,72 (м, 1H), 3,84-3,90 (д, 1H), 3,97-4,06 (двойной дублет, 1H), 4,24-4,31 (д, 1H), 4,37-4,44 (д, 1H), 4,54 (с, 1H), 4,57-4,64 (д, 1H), 4,64-4,72 (м, 2H), 4,87-4,95 (двойной дублет, 1H), 5,27-5,35 (д, 1H), 5,42-5,49 (двойной дублет, 1H), 5,49-5,55 (д, 1H), 5,75 (с, 1H), 7,14-7,42 (м, 5H), 7,44- 7,55 (т, 2H), 7,55-7,63 (т, 1H), 8,07-8,15 (д, 2H).
Пример 39. Получение 7-дезокси -7β,8β- метан-баккатина III (44)
К раствору 7-трифторметансульфонил-баккатина III (87 мг, 0,12 ммоля) в перегнанном диоксане (1,5 мл) добавляли водный раствор азида натрия (0,10 г, 1,5 моля NaN3 в 0,30 мл воды). Реакционную смесь в течение одного часа кипятили с обратным холодильником в атмосфере азота. Эту смесь разбавляли этилацетатом, промывали водой и рассолом, сушили над безводным сульфатом натрия и выпаривали. Полученный продукт очищали хроматографией на колонке из силикагеля 60 в смеси 25% этилацетата и метилена. Результаты тонкослойной хроматографии показали, что после выпаривания этих фракций был получен продукт, представляющий собой 7-дезокси -7β,8β- метан-баккатин III (44) в виде кристаллов.
Спектр протонного ЯМР (CDCl3, TMS): δ 1,10 (с, 3H), 1,22 (с, 3H), 1,35 (м, 1H), 1,64 (м, 1H), 1,78 (с, 1H), 2,03 (с+м, 4H), 2,21 (с, 3H), 2,20-2,55 (м, 5H), 4,04 (д, 1H, J = 8,5 Гц), 4,18 (д, 1H, J = 7,5 Гц), 4,30 (д, 1H, J = 8,5 Гц), 4,74 (д, 1H), 4,83 (м, 1H), 5,63 (д, 1H, J = 7,5 Гц), 6,35 (с, 1H), 7,49 (м, 2H), 7,62 (м, 1H), 8,13 (м, 2H).
Спектр углеродного ЯМР (CDCl3, TMS): 15,15, 15,28, 20,43, 20,82, 21,99, 25,90, 26,35, 31,63, 35,19, 38,57, 38,76, 42,20, 67,51, 75,30, 76,20, 76,49, 79,23, 79,91, 84,73, 128,50, 129,33, 129,99, 132,59, 133,54, 144,19, 167,20, 169,63, 170,00, 202,08.
Пример 40. Получение 7 -α- азидо-баккатина III (45)
Смесь 7-трифторметансульфонил-баккатина III (102 мг, 0,14 ммоля), азида натрия (13 мг, 0,20 ммоля) и 18-краун-6 (32 мг, 0,12 ммоля) в 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидиноне (1,0 мл) перемешивали в течение ночи при комнатной температуре в атмосфере инертного
газа. Реакционную смесь распределяли между этилацетатом и водой. Органический слой сушили над безводным сульфатом натрия и выпаривали. Неочищенный продукт очищали хроматографией на колонке из силикагеля 60 в смеси 15% этилацетата и метиленхлорида. Полученный продукт далее очищали кристаллизацией из смеси метиленхлорида и гексана с образованием 7 -α- азидо-баккатина III (45).
Спектр протонного ЯМР (CDCl3, TMS): δ 0,96 (с, 6H), 1,59 (с, 3H), 1,91 (с, 3H), 2,13 (с, 3H), 2,25 (с, 3H), 2,10-2,35 (м, 4H), 2,47 (м, 1H), 3,80 (м, 2H), 4,07 (д, 1H, J = 8,0 Гц), 4,33 (д, 1H, J = 8,0 Гц), 4,60 (с+м, 2H), 4,99 (двойной дублет, 1H), 5,35 (д, 1H), 5,48 (д, 1H, J = 7,2 Гц), 6,79 (с, 1H), 7,59 (м, 2H), 7,69 (м, 1H), 8,05 (м, 2H).
Спектр углеродного ЯМР (CDCl3, TMS): 15,40, 17,31, 20,67, 22,20, 25,93, 29,81, 39,22, 40,63, 41,73, 55,57, 64,28, 65,91, 75,33, 76,91, 77,33, 78,22, 80,44, 80,94, 128,77, 129,58, 129,98, 130,28, 133,33, 145,43, 165,30, 168,75, 169,09, 207,11.
Пример 41. Получение 13-(N-Вос-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (46)
13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III (7,60 мг, 0,071 ммоля) перемешивали в свежеперегнанном пиридине (0,7 мл) при комнатной температуре в атмосфере азота. Раствор охлаждали на ледяной бане и обрабатывали триэтилсилилхлоридом (13 мкл, 0,078 ммоля). После окончания реакции проводили тонкослойную хроматографию. Через 1 час при температуре 0oC и через 1 час при комнатной температуре признаков прохождения реакции обнаружено не было. После этого вновь добавляли триэтилсилилхлорид указанными выше порциями до тех пор, пока не было введено в общей сложности 12 эквивалентов, после чего реакция закончилась. Общее время реакции составило 18 часов. Реакционную смесь распределяли между водой и этилацетатом. Слои разделяли и водный слой еще раз экстрагировали этилацетатом. Органические слои соединяли, сушили над сульфатом натрия и выпаривали в условиях вакуума. Добавляли толуол и снова выпаривали. Неочищенный продукт хроматографировали на силикагеле (10 г), производя элюирование смесью ацетона и гексана (30-70). Фракции объемом 3 мл собирали и анализировали методом тонкослойной хроматографии. Фракции 7-11 соединяли и выпаривали в вакууме с образованием 13-(N-Boc-2'-TES -β- фенил-изосеринил -Δ12,13- изобаккатина III (46) в виде твердого вещества.
Тонкослойная хроматография (силикагель 60): смесь ацетона и гексана 30-70; Rf: 0,43.
Спектр протонного ЯМР (CDCl3, TMS): δ 0,23-0,49 (м, 6H), 0,69-0,82 (т, 9H), 1,05 (с, 3H), 1,18 (с, 9H), 132 (с, 3H), 1,62 (с, 3H), 1,63 (с, 3H), 1,87-2,02 (м, 1H), 2,03-2,146 (д, 1H), 2,22 (с, 3H), 2,46-2,60 (м, 1H), 2,64 (с, 3H), 2,79 (с, 1H), 2,84-2,99 (д, 1H), 3,59-3,57 (д, 1H), 3,70-3,77 (д, 1H), 4,32-4,46 (м, 3H), 4,62 (с, 1H), 4,92- 5,00 (двойной дублет, 1H), 5,39-5,47 (широкий дублет, 1H), 5,49 (с, 1H), 5,53-5,63 (м, 2H), 7,24-7,43 (м, 5H), 7,44-7,53 (т, 2H), 7,53-7,62 (т, 1H), 8,07-8,16 (д, 2H).
Пример 42. Получение 7-(О-этоксиметил)-13-(N-Вос-2'- -TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (47)
13-(N-Вос-2'-TES -β- фенил-изосеринил -Δ12,13- изобаккатин III (46, 59 мг, 0,061 ммоля) перемешивали в метиленхлориде (0,5 мл) при комнатной температуре в атмосфере азота, после чего к этому раствору добавляли диизопропилэтиламин (55 мкл, 0,31 ммоля) и простой хлорметилэтиловый эфир (28 мкл, 0,305 ммоля). В результате выполнения тонкослойной хроматографии было установлено, что реакция закончилась через 3,5 дня. Неочищенную реакционную смесь очищали высокоэффективной жидкостной хроматографией на колонке из силикагеля E. Merck размер A, элюируя смесью ацетона и гексана (20-80). Фракции объемом 3 мл собирали и анализировали с помощью тонкослойной хроматографии. Целевой продукт был обнаружен во фракциях 10-16, из которых после объединения и выпаривания в вакууме был получен 7-(О-этоксиметил)-13-(N-Boc-2'-TES -β- фeнил-изocepинил) -Δ12,13- изобаккатин III (47) в виде твердого вещества.
Тонкослойная хроматография (силикагель 60): смесь ацетона и гексана (25-75); Rf: 0,50.
Спектр протонного ЯМР (CDCl3, TMS): δ 0,22-0,49 (м, 6H), 0,70-0,80 (т, 9H), 1,08-1,16 (м, 3H), 1,20 (с, 9H), 1,27 (с, 3H), 1,30 (с, 3H), 1,66 (с, 3H), 1,69 (с, 3H), 1,90-2,04 (т, 1H), 2,04-2,14 (д, 1H), 2,17 (с, 3H), 2,64 (с, 3H), 2,80-2,98 (мд, 2H), 3,30-3,42 (м, 1H), 3,61-3,75 (м, 1H), 4,62 (с, 1H), 4,67-4,75 (мультиплетный дублет, 1H), 4,90-4,98 (двойной дублет, 1H), 5,38-5,49 (широкий дублет, 1H), 5,51-5,60 (м, 2H), 5,80 (с, 1H), 7,25-7,53 (м, 7H), 7,53-7,61 (т, 1H), 8,08-8,16 (д, 2H).
Пример 43. Получение 7-(O-этоксиметил)-13-(N-Воc- -β- фенил-изocepинил) -Δ12,13- изобаккатина III (41)
7-этоксиметил)-13-(N-Boc-2'-TES -β- фенил-изосеринил) Δ12,13- изобаккатин III (47,62 мг, 0,061 ммоля) перемешивали в смеси уксусной кислоты и воды (80-20) (4 мл) при комнатной температуре в атмосфере азота. В результате проведения тонкослойной хроматографии было установлено, что реакция закончилась через 24 часа. Реакционную смесь сушили вымораживанием. Неочищенный продукт очищали высокоэффективной жидкостной хроматографией на колонке из силикагеля E. Merck, размер A, элюируя смесью ацетона и гексана (25-75). Фракции объемом 3 мл собирали и анализировали с помощью тонкослойной хроматографии. Требуемый продукт был обнаружен во фракциях 17-24, из которых после соединения и выпаривания в вакууме был получен 7-(O-этоксиметил)-13- (N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III (41) в виде твердого вещества.
Тонкослойная хроматография (силикагель 60): смесь ацетона и гексана (25-75); Rf: 0,33.
Спектр протонного ЯМР (CDCl3, TMS): δ 1,10-1,18 (м, 6H), 1,24 (с, 9H), 1,62 (с, 3H), 1,68 (с, 3H), 1,88-2,04 (т, 1H), 2,04-2,15 (д, 1H), 2,18 (с, 3H), 2,60 (с, 3H), 2,83-2,97 (м, 2H), 3,28-3,42 (м, 1H), 3,60-3,73 (м, 1H), 3,84-3,90 (д, 1H), 4,00-4,10 (двойной дублет, 1H), 4,25-4,34 (д, 1H), 4,36-4,45 (д, 1H), 4,57-4,65 (д, 1H), 4,66-4,74 (м, 2H), 4,87-4,96 (двойной дублет, 1H), 5,36-5,50 (м, 2H), 5,50-5,57 (д, 1H), 5,77 (с, 1H), 7,30-7,55 (м, 7H), 7,55-7,64 (т, 1H), 8,07-8,17 (д, 2H).
Пример 44. Получение 13-(N-(трет-бутиламинокарбонил)-2'-TES -β- фенил-изосеринил -Δ12,13- изобаккатина III (48)
В соответствии с методикой, описанной в примере 41, но при использовании в качестве исходного вещества 13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатина III (32b) был получен 13-(N-(трет-бутиламинокарбонил)-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатин III (48).
Пример 45. Получение 7-(O-этоксиметил)-13-(N- (трет-бутиламинокарбонил)-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (49)
В соответствии с методикой, описанной в примере 42, но при использовании в качестве исходного вещества 13-(N-(трет-бутиламинокарбонил)-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (48) был получен 7-(O-этоксиметил)-13-(N- (трет-бутиламинокарбонил)-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатин III (49).
Пример 46. Получение 7-(O-этоксиметил)-13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатина III (43)
В соответствии с методикой, описанной в примере 43, но при использовании в качестве исходного вещества 7-(O-этоксиметил)-13-(N- (трет-бутиламинокарбонил)-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (4) был получен 7-(О-этоксиметил)-13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатин III (43).
Пример 47. Сложный эфир 7-триэтилсилил-12,13-изобаккатин III-13-(4S, 5R)-N-кapбoбeнзилoкcи-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (51a,b)
Суспензию соли калия (4S,5R)-карбобензилокси-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (9,63 г, 19,2 ммоля) в EtOAc (1,2 л) интенсивно перемешивали во время добавления 5% раствора NaHSO4 до тех пор, пока показатель pH не стал < 2. Слои EtOAc разделяли, и слой промывали дополнительным количеством 5% раствора NaHSO4. Слои EtOAc соединяли, промывали полунасыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении. Остаток вновь растворяли в EtOAc (50 мл), добавляли толуол, и растворитель снова выпаривали. Добавляли толуол и выпаривали еще два раза, что позволило получить масло (10,37 г). Это масло растворяли в CH2Cl2 (60 мл, продутым аргоном) и толуоле (75 мл, продутым аргоном), после чего добавляли 4-диметиламинопиридин (0,965 г, 7,91 ммоля). Этот раствор продували аргоном и добавляли к раствору 7-TES-12,13- изобаккатина III (3) (11,3 ммоля, продутому аргоном) в CH2Cl2 (125 мл) и толуоле (65 мл). Кислоту промывали дополнительным количеством CH2Cl2 (2 x 25 мл), а затем толуолом (10 мл). Сразу же после этого растворы соединяли при комнатной температуре и добавляли 1,3-дициклогексилкарбодиимид (4,66 г, 22,6 ммоля). В результате проведения тонкослойной хроматографии было установлено, что реакция закончилась через один час. Через 0,75 часа реакционную смесь разбавляли толуолом и охлаждали на водно-ледяной бане. Осажденные твердые вещества (дициклогексилмочевина) удаляли фильтрованием. Фильтраты разбавляли EtOAc и промывали 50 раствором NaHSO4 и 5% раствором NaHCO3. Во время промывки NaHCO3 образовался осадок дополнительного количества дициклогексилмочевины, который удаляли фильтрованием через целит. Последней выполняли промывку полунасыщенным рассолом. Органический слой сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении с образованием масла. Это масло хроматографировали на 790 г силикагеля 40-63 мкм в двух колонках Мичела-Миллера (47 x 450 мм. Ace Glass), соединенных последовательно. Образец вводили в минимальном количестве ацетона и элюировали смесью 20% ацетона и гексана (3 л), смесью 25% ацетона и гексана (4 л) и смесью 30% ацетона и гексана, после чего собирали фракции объемом 50 мл. Фракции 100-104 (0,50 г) содержали примесь, которую удаляли повторным хроматографированием. Фракции 105-127 (14,31 г) содержали дициклогексилмочевину в виде примеси, которую удаляли повторной хроматографией на силикагеле 40-63 мкм (две колонки Мичела-Миллера размером 47 x 450 мм) при использовании минимального количества EtOAc для введения данного вещества в колонку. Полученный продукт элюировали смесью 10% EtOAc и толуола и собирали фракции объемом 50 мл. Во фракциях 24-40 (1,30 г, 7%) был первым элюирован сложный эфир 7-триэтилсилил-12,13-изобаккатин III, 13-(4S, 5R)-N-карбобензилокси-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты, являющейся менее полярным изомером (51a).
Спектр 1H ЯМР (CDCl3, TMS): δ 8,05 (м, 2H), 7,63-7,37 (м, 8H), 7,22-6,99 (м, 6H), 6,48-6,39 (м, 2H), 5,97 (с, 1H), 5,54 (д, 1H, J = 5,4 Гц), 5,45 (д, 1H, J = 2,6 Гц), 5,01 (м, 3H, -OCH2Ph), 4,88 (м, 1H), 4,43 (м, 1H), 4,38 (д, 1H, J = 8,5 Гц), 4,27 (д, 1H, J = 8,5 Гц), 3,85 (м, 1H), 3,82 (с, 6H), 2,77 (д, 1H, J = 18,1 Гц), 2,52 (с, 1H), 2,47 (м, 1H), 2,27 (д, 1H, J = 17,4 Гц), 2,19 (с, 3H), 2,15 (с, 3H), 1,88 (м, 1H), 1,78, 1,61, 1,28, 1,16 (4c, 12H), 0,89 (м, 9H), 0,53 (м, 6H).
Масс-спектр: 1146, 4927, C63H75NO17Si + H требует 1146, 4882, 1146, 1116, 1038, 1010, 418, 374, 284, 254, 151, 105, 91, 43 m/z.
Фракции 41-62 (5,14 г, 28%) содержали смесь изомеров.
Фракции 63-130 (7,08 г, 38%) содержали сложный эфир 7-триэтилсилил-12,13-изобаккатин III-13-(4S, 5R)-N-карбобензилокси-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты, являющейся более полярным изомером (51b).
Спектр 1H ЯМР (CDCl3, TMS): δ 8,02 (м, 2H), 7,62 (м, 1H), 7,48, 7,40 (м, 8H), 7,24-7,14 (м, 5H), 6,74 (м, 2H), 6,44 (м, 2H), 5,87 (с, 1H), 5,48 (д, 1H, J = 4,7 Гц), 5,38 (д, 1H, J = 5,9 Гц), 4,88 (д, 1H, 12,2 Гц), 4,81 (м, 1H), 4,73 (д, 1H, J = 11,8 Гц), 4,61 (д, 1H, J= 5,9 Гц), 4,34 (м, 1H), 4,33 (д, 1H, J = 8,6 Гц), 4,22 (д, 1H, J = 8,9 Гц), 3,82 (с, 3H), 3,72 (д, 1H, J = 5,5 Гц), 2,58 (д, 1H, J = 17,5 Гц), 2,43 (м, 2H), 2,16 (с, 3H), 2,14 (м, 1H), 1,89 (с, 3H), 1,82 (м, 1H), 1,56, 1,42, 1,21, 1,10 (4c, 12H), 0,88 (м, 9H), 0,51 (м, 6H).
Масс-спектр: 1146, 4904, C63H75NO17Si + H требует 1146, 488, 1146, 1116, 1103, 1038, 1010, 446, 418, 374, 284, 254, 151, 105, 91, 43 m/z.
Тонкослойная хроматография: Rf (смесь 15% этилацетата и толуола) = 0,22, 0,33 для двух изомеров продукта.
Пример 48. N-Дебензоил-N-бензилоксикарбонил-12,13-изотаксол (52)
Раствор сложного эфира 7-триэтилсилил-12,13-изобаккатин III 13-(4S, 5R)-N-карбобензилокси-2-(2,4-диметоксифенил)-4-фенил- 5-оксазолидинкарбоновой кислоты (51a, b, 646,5 мг, 0,564 ммоля) в метиловом спирте (35 мл) охлаждали на ледяной бане до 0-10oC. Одновременно готовили 0,1 М раствор HCl в метиловом спирте путем медленного добавления ацетилхлорида (0,46 мл) к слегка охлажденному спирту (30 мл). Этот раствор в виде одной порции добавляли к раствору соединений 51a, b. Полученный раствор оставляли для нагревания до комнатной температуры. Исчезновение исходного вещества и появление промежуточного сложного ортоэфира определяли с помощью тонкослойной хроматографии (смесь 50% ацетона и гексана и смесь 5% CH3CN и CH2Cl2) и через 1,5 часа к раствору синего цвета добавляли воду (6,2 мл). В течение следующего часа менее полярный промежуточный сложный ортоэфир превращался в требуемый продукт. Реакционную смесь разбавляли EtOAc (200 мл) и добавляли насыщенный водный раствор Na2CO3 (200 мл). Примерно половину органического слоя удаляли путем ротационного выпаривания с целью максимального увеличения выхода продукта. Слои разделяли, водный слой еще раз экстрагировали EtOAc, а соединенные органические слои промывали насыщенным водным раствором NaCl. Органический слой фильтровали через Na2SO4 и выпаривали в условиях вакуума. Неочищенные твердые вещества (0,589 г) анализировали методом испарительной хроматографии с использованием 152 мм слоя силикагеля в 30 мм колонке. В качестве раствора для элюирования применяли смесь 42,5% EtOAc и гексана (250 мл), смесь 45% E-tOAc и гексана (250 мл) и смесь 50% EtOAc и гексана (250 мл), при этом собирали 20 мл фракции. Фракции 13-16 соединяли, растворитель выпаривали и заменяли смесью ацетона и гексана. В результате выпаривания смеси ацетона и гексана при пониженном давлении был получен N-дебензоил-N-бензилоксикарбонил-12,13-изотаксол (0,434, 87%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь 40% ацетона и гексана; Rf исходного вещества = 0,53, Rf сложного орто-эфира = 0,39.
Спектр 1H ЯМР (CDCl3, TMS): δ 8,18 (д, J = 7,2 Гц, 2H), 7,33-7,60 (м, 9H), 7,19 (м, 3H), 6,96 (м, 2H), 5,75 (д, 1H, J = 10,0 Гц), 5,56 (д, 1H, J = 5,9 Гц), 5,51 (д, 1H, J= 10,0 Гц), 5,44 (с, 1H), 4,91 (м, 1H), 4,84 (двойной дублет, 2H, J = 12,6 Гц), 4,74 (с, 1H), 4,33-4,42 (м, 3H, H7), 3,67 (д, 1H, J = 3,7 Гц), 3,47 (широкий синглет, 1H), 3,26 (широкий синглет, 1H), 2,94 (д, 1H, J = 19,0 Гц), 2,74 (с, 1H), 2,59 (с, 3H), 2,50 (м, 1H), 2,23 (с, 3H), 1,92 (м, 1H), 1,88 (д, 1H, J = 19,0 Гц), 1,62 (с, 3H), 1,58 (с, 3H), 1,25 (с, 3H), 1,04 (с, 3H).
Пример 49. N-Дебензоил-N-бензилоксикарбонил-2'- триэтилсилил-12,13-изотаксол (53)
Раствор N-дебензоил-N-бензилоксикарбонил-12,13-изотаксола (52; 6,61 г, 7,48 ммоля) в свежеперегнанном пиридине (60 мл), находящийся в атмосфере азота, охлаждали на водно-ледяной бане до 0oC. В течение трех минут из шприца по каплям добавляли хлортриэтилсилан (5,0 мл, 30,6 ммоля). Температуру тщательно контролировали, не давая ей подниматься выше 1oC. После окончания добавления охлаждающую баню удаляли. Результаты тонкослойной хроматографии показали, что реакция закончилась через один час. Этот раствор разбавляли EtOAc (600 мл) и промывали полунасыщенным раствором CuSO4 (2 x 100 мл), насыщенным раствором CuSO4 (2 x 50 мл), водой (2 x 100 мл), NaHCO3 (1 x 100 мл) и рассолом (1 x 100 мл). Все водные слои экстрагировали еще раз. Органические слои соединяли, сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении с образованием 8,23 г (теоретическое значение = 7,47 г) маслянистого белого твердого вещества. Это твердое вещество хроматографировали на 400 г силикагеля 40-63 мкм в колонке Мичела-Миллера (47 x 450 мм). Образец вводили в минимальном количестве EtOAc, элюировали смесью 30% EtOAc и гексана и собирали фракции объемом 50 мл. N-Дебензоил-N-бензилоксикарбонил-2'-триэтилсилил-12,13- изотаксол был получен во фракциях 25-45 (6,45 г, 86%).
Тонкослойная хроматография: силикагель; смесь EtOAc и гексана с соотношением 1:1, Rf исходного вещества = 0,27; Rf продукта = 0,62.
Спектр 1H ЯМР (CDCl3, TMS): δ/ 8,17 (д, 2H, J = 7,1 Гц), 7,55-6,97 (м, 15H), 5,82 (д, 1H, J = 9,8 Гц), 5,56 (д, 1H, J = 5,9), 5,51 (д, 1H, J = 9,9 Гц), 5,46 (с, 1H), 4,94 (м, 1H), 4,80 (м, 2H), 4,64 (д, 1H), 4,38 (м, 1H), 3,69 (д, 1H, J = 6,0 Гц), 3,49 (д, 1H, J = 4,2), 2,92 (д, 1H, J = 18,5 Гц), 2,76 (с, 1H), 2,64 (с, 3H), 2,50 (м, 1H), 2,22 (с, 3H), 1,96 (м, 1H), 1,88 (м, 1H), 1,63, 1,59, 1,26, 1,04 (4c, 12H), 0,74 (м, 9H), 0,35 (м, 6H).
Пример 50. N-Дебензоил-N-бензилоксикарбонил-12,13- изотаксол-7-О-трифлат (54)
Раствор N-дебензоил-N-бензилоксикарбонил-2'-триэтилсилил-12,13- изотаксола (53, 2,0 г) в CH2Cl2 (12,2 мл) и пиридине (4,12 мл) охлаждали до -30oC на бане с 33% метиловым спиртом, водой и сухим льдом. В течение 5 минут с помощью шприца медленно добавляли ангидрид трифторметансульфоновой кислоты (2,02 мл), сохраняя температуру ниже -14oC. В конце добавления реакционную смесь оставляли для нагревания до комнатной температуры. Через 6 часов брали аликвоты желто-оранжевого раствора и вводили в EtOAc и насыщенный водный раствор CuSO4. Органический слой анализировали методом тонкослойной хроматографии (смесь 25% EtOAc и гексана), и через 6 часов в нем были обнаружены лишь следовые количества исходного вещества. Реакционную смесь выливали в EtOAc (100 мл) и насыщенный водный раствор CuSO4 (100 мл). Слои разделяли и органический слой промывали отдельно насыщенным водным раствором сульфата меди (100 мл) и водой (100 мл). Промывочные воды еще раз экстрагировали с помощью EtOAc (25 мл) и объединяли с основным органическим слоем, а потом промывали насыщенным водным раствором NaHCO3 и раствором NaCl. Органический слой сушили в Na2SO4, а растворитель удаляли выпариванием на роторе. Оставшееся масло растворяли в небольшом количестве ацетона и добавляли гексан до тех пор, пока масло не становилось мутным. Растворитель удаляли, а остаток подвергали воздействию высокого вакуума, что позволило получить N-дебензоил-N-бензилоксикарбонил-12,13-изотаксол-7-O-трифлат (54) в виде желтого твердого вещества (2,20 г, 97%).
Тонкослойная хроматография: силикагель; смесь 50% EtOAc и гексана; Rf исходного вещества = 0,35, Rf трифлата 54 = 0,57.
Спектр 1H ЯМР (CDCl3, TMS) δ 8,16 (д, J = 7,1 Гц, 2H), 7,60-7,50 (м, 3H), 7,48-7,29 (м, 5H), 7,17 (м, 3H), 6,96 (м, 2H), 5,86 (с, 1H), 5,83 (д, J = 10,0 Гц, 1H), 5,54 (м, 1H), 5,50 (д, J = 8,1 Гц, 1H), 4,90 (м, 1H), 4,86 (д, J = 12,8 Гц, 1H), 4,79 (д, J = 12,5 Гц, 1H), 4,64 (д, J = 1,8 Гц, 1H), 4,43 (д, J = 8,7 Гц, 1H), 4,38 (д, J = 8,7 Гц, 1H), 3,83 (д, J = 5,7 Гц, 1H), 2,99 (м, 1H), 2,89 (д, J = 20,6 Гц, 1H), 2,66 (с, 3H), 2,22 (м, 1H), 2,19 (с, 3H), 1,87 (д, J = 19,2 Гц, 1H), 1,77 (с, 3H), 1,66 (с, 3H), 1,25 (с, 3H), 1,07 (с, 3H), 0,74 (т, J = 7,8 Гц, 9H), 0,33 (м, 6H).
Пример 51. 2'-Триэтилсилил-N-дебензоил-N-бензилоксикарбонил-7-дезокси -7β,8β- метан-12,13- изотаксол (55) и 2'-триэтилсилил-N-дебензоил-N-бензилоксикарбонил-7- дезокси -Δ6,7- 12,13-изотаксол (56)
Раствор N-дебензоил-N-бензилоксикарбонил-12,13-изотаксол-7-О-трифлата (54, 1,02 г) в этилендихлориде (95 мл) 1,5 часа перемешивали с силикагелем (35 г, ЕМ, 40-63 мкм) на масляной бане при температуре 55-65oC. Одну аликвоту фильтровали, и с помощью тонкослойной хроматографии (смесь 5% CH3CN и CH2Cl2) фильтрата определили, что реакция закончилась. Реакционную смесь фильтровали через среднюю воронку со стеклянным фильтром и в качестве промывочной жидкости использовали ацетон (600 мл). Растворитель удаляли в вакууме. Неочищенные твердые вещества (1,1 г) подвергали испарительной хроматографии с использованием 152 мм слоя силикагеля в 55 мм колонке. В качестве растворителя для элюирования использовали 6% смесь CH2CN и CH2Cl2 (750 мл), 8% смесь (750 мл), 10% смесь (750 мл) и 12% смесь (750 мл). Собирали 40 мл фракции. Соединенные фракции концентрировали, добавляли смесь ацетона и гексана и еще раз концентрировали с образованием белого твердого вещества.
Фракции 29-37 содержали 2'-триэтилсилил-N-дебензоил-N- бензилоксикарбонил-7-дезокси -Δ6,7- 12,13-изoтaкcoл (56, 0,174 г, 18%).
Спектр 1H ЯМР идентичен спектру соединения 56, представленному в примере 57.
Фракции 41-64 содержали 2'-триэтилсилил-N-дебензоил-N- бензилоксикарбонил-7-дезокси -7β,8β- метан-12,13-изотаксол (55, 0,659 г, 67%).
Тонкослойная хроматография: силикагель; смесь 25% EtOAc и гексана; Rf исходного вещества = 0,63, Rf циклопропана 55 = 0,35, Rf олефина 56 = 0,43.
Спектр 1H ЯМР (CDCl3, TMS) δ 8,21 (д, J = 6,6 Гц, 2H), 7,54-7,18 (м, 11H), 6,93 (м, 2H), 5,82 (д, J = 9,9 Гц, 1H), 5,60 (д, J = 6,5 Гц, 1H), 5,51 (д, J = 10,6 Гц, 1H), 5,23 (д, J = 1,97 Гц, 1H), 2,79 (с, 1H), 4,67 (с, 2H), 4,63 (д, J = 1,8 Гц, 1H), 4,39 (д, J = 8,6 Гц, 1H), 4,13 (д, 3 = 8,7 Гц, 1H), 2,96 (д, 3 = 18,6 Гц, 1H), 2,75 (с, 1H), 2,62 (с, 3H), 2,47 (двойной триплет, J = 16,0), 4,05 (Гц, 1H), 2,17 (м, 4H, H7), 2,11 (д, 1H), 1,97 (д, J = 18,9 Гц), 1,73 (м, 1H), 1,59 (с, 3H), 1,31 (с, 3H), 1,11 (с, 3H), 0,73 (т, J = 7,9 Гц, 9H), 0,34 (м, 6H).
Спектр 13C ЯМР (CDCl3, TMS) δ 203,7, 170,1, 169,7, 168,8, 167,1, 155,6, 141,5, 138,7, 136,1, 133,6, 130,5, 129,2, 128,7, 128,6, 128,3, 127,9, 127,4, 126,4, 122,5, 85,1, 80,5, 78,9,78,7, 78,3, 75,6, 75,2, 66,8, 57,4, 54,9, 39,7, 36,6, 33,1, 32,3, 30,3, 29,7, 29,4, 25,9, 22,4, 21,3, 20,9, 14,1, 13,0, 6,5, 4,1.
Пример 52. 2'-Триэтилсилил-N-дебензоил-7-дезокси- -7β,8β- метан-12,13-изотаксол (57) 27548-PJD-152
Формиат аммония (0,96 г) и 10% палладированный уголь (0,44 г) добавляли к раствору 2'-триэтилсилил-N-дебензоил- N-бензилоксикарбонил-7-дезокси -7β,8β- метан-12,13-изотаксола (55, 1,343 г) в метиловом спирте (18 мл) и тетрагидрофуране (12 мл). Эту смесь перемешивали в течение 10 минут при комнатной температуре, а затем охлаждали до 0oC. Реакционную смесь анализировали методом тонкослойной хроматографии (смесь 50% EtOAc и гексана), результаты которой показали, что реакция закончилась после перемешивания в течение 2 часов. Эту смесь фильтровали через целит и промывали EtOAc (150 мл). Фильтрат промывали насыщенным водным раствором NaHCO3, (100 мл). Водный слой еще раз экстрагировали с помощью EtOAc и соединенные органические слои промывали насыщенным водным раствором NaCl. Органический слой сушили в Na2SO4, растворитель удаляли в условиях вакуума, а твердые вещества подвергали воздействию высокого вакуума, что позволило получить 2'-триэтилсилил-N- дебензоил-7-дезокси -7β,8β- метан-12,13-изотаксол (1,114 г).
Тонкослойная хроматография: силикагель; смесь 50% EtOAc и гексана; Rf исходного вещества = 0,64, Rа амина 57 = 0,42.
Спектр 1H ЯМР (CDCl2, TMS) δ 8,09 (м, 2H), 7,65 (м, 1H), 7,53 (м, 2H), 7,34 (м, 4H), 7,17 (м, 1H), 5, 59 (д, J = 6,65 Гц, 1H), 5,19 (д, J = 1,91, 1H), 4,76 (д, J = 3,1 Гц, 1H), 4,4 (м, 2H), 4,30 (д, J= 5,4 Гц, 1H), 4,08 (д, J = 8,6 Гц, 1H), 3,81 (д, J = 6,6 Гц, 1H), 2,72 (с, 1H), 2,53-2,39 (м, 2H), 2,30 (с, 3H), 2,16 (с, 3H), 1,92 (д, J = 18,5 Гц, 1H), 1,69 (с, 3H), 1,28 (с, 3H), 1,10 (с, 3H), 0,90 (т, J = 8,0 Гц, 9H), 0,56 (м, 6H).
Пример 53. 2'-Триэтилсилил-N-дебензоил-N-(трет-бутил) oкcикapбoнил-7-дeзoкcи -7β,8β- мeтaн-12,13-изoтaкcoл (58)
Раствор 2'-триэтилсилил-N-дебензоил-7-дезокси -7β,8β- метан-12,13-изотаксола (57, 0,438 г), триэтиламина (88 мкл) и ди-трет-бутилдикарбоната (0,125 г) в тетрагидрофуране (10 мл) перемешивали в течение ночи при комнатной температуре. С помощью тонкослойной хроматографии было установлено, что реакция закончилась (смесь 50% EtOAc и гексана). Эту смесь разбавляли EtOAc (100 мл) и полученный органический слой промывали насыщенными водными растворами NaHCO3 и NaCl. Органический слой сушили в Na2SO4, растворитель удаляли в условиях вакуума, а неочищенные твердые вещества подвергали воздействию высокого вакуума, что позволило получить 2'-триэтилсилил-N-дебензоил- N-(трет-бутил-оксикарбонил-7-дезокси -7β,8β- метан-12,13- изотаксол (0,495 г).
Тонкослойная хроматография: силикагель; смесь 50% EtOAc и гексана; Rf исходного вещества = 0,45, Rf = 0,66.
Спектр 1H ЯМР (CDCl2, TMS) δ 8,18 (д, j = 7,2 Гц, 2H), 7,59-7,24 (м, 8H), 5,62 (д, J = 6,8 Гц, 1H), 5,55 (д, j = 10,0 Гц, 1H), 5,43 (д, J = 10,0 Гц, 1H), 5,24 (д, J = 2,0 Гц, 1H), 4,81 (с, 1H), 4,60 (с, 1H), 4,42 (д, J = 8,6 Гц, 1H), 4,11 (д, J = 8,6 Гц, 1H), 3,88 (д, J = 6,7 Гц, 1H), 2,93 (д, J = 18,5 Гц, 1H), 2,76 (с, 1H), 2,61 (с, 3H), 2,47 (двойной триплет, J = 4,21 и 16,0 Гц, 1H), 2,17 (м, 4H), 2,00 (д, J = 16,0 Гц, 1H), 16,1 (м, 1H), 1,52 (с, 3H), 1,26 (м, 1H), 1,12 (с, 3H), 1,10 (с, 3H), 0,74 (т, J = 3,4 Гц, 9H), 0,34 (м, 6H).
Пример 54. N-Дебензоил-N-(трет-бутил)оксикарбонил-7- дезокси -7β,8β- метан-12,13-изотаксол (17)
К раствору 2'-триэтилсилил-N-дебензоил-N-(трет-бутил)- оксикарбонил-7-дезокси -7β,8β- метан-12,13-изотаксола (58, 0,49 г) в CH3CN (2,45 мл) добавляли Et3N(HF)3, (1,47 мл) и перемешивали при комнатной температуре. С помощью тонкослойной хроматографии (смесь 50% EtOAc и гексана) было установлено, что реакция закончилась через 30 минут. Реакционную смесь разбавляли EtOAc (100 мл), а органический слой промывали насыщенными водными растворами NaHCO3 и NaCl. Органический слой сушили в Na2SO4, растворитель удаляли в вакууме, а неочищенные твердые вещества подвергали воздействию высокого вакуума (0,422 г). Неочищенные твердые вещества очищали методом испарительной хроматографии с использованием 152 мм слоя силикагеля в 30 мм колонке. В качестве раствора для элюирования использовали 42,5% смесь EtOAc и гексана (300 мл), 45% смесь (200 мл) и 50% смесь (200 мл). Фракции объемом 20 мл собирали. Фракции 9-14 содержали 0,308 г (71%) N-дебензоил-N-(трет-бутил- оксикарбонил-7-дезокси -7β,8β- метан-12,13-изотаксола.
Тонкослойная хроматография: силикагель; смесь 50% EtOAc и гексана Rf исходного вещества = 0,70, Rf17 = 0,47.
Спектр 1H ЯМР (CDCl3, TMS) δ 8,19 (д, J = 7,3 Гц, 2H), 7,61-7,29 (м, 8H), 5,62 (д, J = 6,7 Гц, 1H), 5,42 (м, 2H), 5,22 (д, J = 2,0 Гц, 1H), 4,79 (д, J = 3,2 Гц, 1H), 4,69 (д, J = 3,4 Гц, 1H), 4,42 (д, J = 8,6 Гц, 1H), 4,09 (д, J = 8,6, 1H), 3,87 (д, J = 6,7 Гц, 1H), 3,24 (д, J = 4,4 Гц, 1H), 2,96 (д, J = 19,1 Гц, 1H), 2,75 (с, 1H), 2,56 (с, 3H), 2,45 (двойной триплет, J = 4,3 и 16,1 Гц, 1H), 2,17 (м, 5H), 2,10 (д, J = 16,0 Гц, 1H), 1,69 (м, 4H), 1,58 (с, 3H), 1,33 (м, 4H), 1,13 (с, 9H).
Спектр 13C ЯМР (CDCl3, TMS) δ 203,5, 171,0, 170,1, 169,7, 167,3, 155,0, 141,8, 138,8, 133,6, 130,4, 129,1, 128,8, 128,7, 128,0, 126,5, 122,6, 85,2, 80,4, 80,0, 76,9, 78,6, 78,4, 75,7, 73,7, 55,6, 55,0, 39,8, 36,7, 32,9,32,4, 30,1, 29,0, 28,0, 25,8, 22,4, 21,1, 20,9, 14,2, 12,9.
Масс-спектр: 832,3538 C45H53NO14 + H требует 832,3544), 986, 832, 776, 758, 732, 551, 387, 180, 105, 77, 57, 43 m/z.
Пример 55. 2'-Триэтилсилил-N-дебензоил-N-(трет-бутил) - aминoкapбoнил-7-дeзoкcи -7β,8β- мeтaн-12,13-изoтaкcoл (59) ((6, 12b-бис(ацетилокси)-12(бензоилокси) -2a, 3,4,4a, 5,6,7,10,11,12,12a, 12b-додекагидро-11-гидрокси-8,13,13- триметил-5-оксо-4,4a; 7,11-бисметан-1H-циклодека[3,4]бенз[1,2-b] -оксет-9-иловый эфир { 2aR- 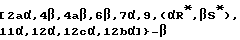 (трет-бутил)-аминокарбониламино]- -α- -триэтилсилилоксибензолпропановой кислоты))
(трет-бутил)-аминокарбониламино]- -α- -триэтилсилилоксибензолпропановой кислоты))
Раствор неочищенного 2'-триэтилсилил-n-дебензоил-7- дезокси -7β,8β- метан-12,13-изотаксола (57, 1,11 г) и трет-бутилизоцианата (0,6 мл, 5,25 ммоля) в тетрагидрофуране (15 мл) и EtOAc (18 мкл) перемешивали в течение ночи при комнатной температуре, растворитель удаляли при пониженном давлении, а остаток подвергали воздействию высокого вакуума, в результате чего был получен 2'-триэтилсилил-N-дебензоил- N-(трет-бутил)аминокарбонил-7-дезокси -7β,8β- метан-12,13- изотаксол (59, 1,225 г).
Спектр 1H ЯМР (CDCl3, TMS) δ 8,18 (д, 2H, J = 6,8 Гц), 7,57 (т, 1H), 7,49 (м, 2H), 7,35 (м, 2H), 7,27 (м, 3H), 5,64 (д, 1H, J = 6,6 Гц), 5,56 (д, 1H, J = 9,3 Гц), 5,23 (д, 1H, J = 1,9 Гц), 5,18 (д, 1H, J = 9,2 Гц), 4,82 (с, 1H), 4,60 (д, 1H, J = 1,9 Гц), 4,42 (д, 1H, 3= 8,7 Гц), 4,12 (д, 1H, J = 8,5 Гц), 3,90 (д, 1H, J = 6,6 Гц), 2,95 (д, 1H, J = 19,5 Гц), 2,76 (с, 1H), 2,64 (с, 3H), 2,44 (двойной триплет, 1H, J = 16,2 Гц), 2,17 (с, 3H), 2,16 (м, 2H), 2,11 (д, 1H, J = 16,0 Гц), 1,34 (с, 3H), 1,13 (с, 3H), 1,00 (с, 9H), 0,74 (т, 9H), 0,30 (м, 6H).
Пример 56. N-Дебензоил-N-(трет-бутил-аминокарбонил-7- дезокси -7β,8β- метан-12,13-изотаксол (36) ((6,12b-бис(ацетил окси)-12(бензоилокси)-2a, 3,4,4a, 5,6,7,10,11,12,12a, 12b-додекагидро-11-гидрокси-8,13,13-триметил-5-оксо-4,4a; 7,11-бисметан-1H-циклодека[3,43]бенз[1,2-b]-оксет-9- иловый эфир { 2aR- 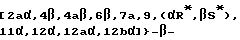 (трет-бутил)-амонокарбониламино] α гидроксибензолпропановой кислоты))
(трет-бутил)-амонокарбониламино] α гидроксибензолпропановой кислоты))
Раствор неочищенного 2'-триэтилсилил-N-дебензоил-N- (трет-бутил)аминокарбонил-7-дезокси -7β,8β- метан-12,13- изотаксола (59, 1,225 г) и тригидрофторида триэтиламина (3,66 мл) в CH2CN (6 мл) получали при температуре 0oC в соответствии с методикой, описанной для получения соединения 17, после чего его оставляли для нагревания до комнатной температуры при постоянном перемешивании в течение 1 часа. В результате проведения испарительной хроматографии на силикагеле был получен N-дебензоил-N-(трет-бутил)аминокарбонил-7-дезокси -7β,8β- метан-12,13-изотаксола (36, 0,919 г, 2,10 ммоля, 81% из 55).
Спектр 1H ЯМР (CDCl3, TMS) δ 8,17 (д, 2H, J = 7,0 Гц), 7,59 (т, 1H, J = 7,3 Гц), 7,50 (т, 2H, J = 7,6 Гц), 7,36 (м, 4H), 7,29 (м, 1H), 5,62 (д, 1H, J = 6,5 Гц), 5,48 (двойной дублет, 1H, J = 2,7, 9,2 Гц), 5,26 (д, 1H, J = 9,2 Гц), 5,20 (д, 1H, J = 9,2 Гц), 5,20 (д, 1H, J = 1,9 Гц), 4,77 (м, 1H), 4,69 (м, 1H), 4,41 (д, 1H), 4,09 (д, 1H, J = 8,6 Гц), 3,85 (д, 1H, J = 6,6 Гц), 2,91 (д, 1H, J = 19,0 Гц), 2,72 (c, 1H), 2,53 (c, 3H), 2,40 (двойной триплет, 1H, J = 16,1 Гц), 2,16 (c, 3H), 2,11 (м, 2H), 2,07 (д, 1H, J = 16,1 Гц), 1,71 (т, 1H, J = 6,1 Гц), 1,54 (с, 3H), 1,30 (с, 3H), 1,30 (м, 1H), 1,11 (с, 3H), 1,04 (с, 9H).
Спектр 13C ЯМР (CDCl3, TMS) δ 203,6, 171,0, 170,4, 169,8, 167,3, 156,2, 141,8, 139,2, 133,6, 130,4, 129,0, 128,78, 128,76, 127,8, 126,6, 122,4,85,2,80,5, 78,4, 78,3, 75,7, 74,4, 55,2, 55,0, 50,4, 39,7, 36,7, 32,8, 32,5, 30,1, 29,2, 28,8, 25,8, 22,4, 21,1, 20,9, 14,2, 12,8.
Масс-спектр (FAB): обнаружено: 831,3701 (C45H54N2O13 + H требует 831,3704), 732,263, 235, 205, 179, 136, 119, 106, 105, 57 m/z.
Пример 57. 2'-Триэтилсилил-N-дебензоил-N-бензилоксикapбoнил-7-дeзoкcи -Δ6,7- 12,13-изoтaкcoл (56)
Раствор N-дебензоил-N-бензилоксикарбонил-12,13-изотаксол- 7-О-трифлата (54, 2,348 г) и дибензилмочевины (3,11 мл) в толуоле (180 мл) нагревали на масляной бане с температурой 60oC в течение 4 часов. С помощью тонкослойной хроматографии (смесь 5% CH2CN и CH2Cl2) было обнаружено следовое количество исходного вещества. Реакционную смесь разбавляли EtOAc (100 мл). Полученный органический слой промывали насыщенным водным раствором CuSO4, водой, насыщенными водными растворами NaHCO3 и NaCl. Органический слой сушили в Na2SO4, а растворитель удаляли в вакууме. Неочищенные твердые вещества (2,07 г) очищали методом испарительной хроматографии с использованием 152 мм слоя силикагеля в 55 мм колонке. В качестве раствора для элюирования использовали 4% смесь CH3CN и CH2Cl2 (1000 мл), 5% смесь (1000 мл), 6% смесь (1000 мл), 8% смесь (1000 мл) и 15% смесь (1000 мл). Фракции объемом 40 мл собирали. Фракции 27-74 содержали 2'-триэтилсилил-N-бензилоксикарбонил-7-дезокси -Δ6,7- 12,13-изотаксол (56, 1,43 виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь 5% CH3CN и CH2Cl2; Rf исходного вещества = 0,64, Rf олефина 56 0,47, Rf циклопропана 55 = 0,36.
Спектр 1H ЯМР (CDCL3, TMS) δ 8,21 (д, J = 7,1 Гц, 2H), 7,60-7,47 (м, 3H), 7,41-7,26 (м, 6H), 7,19-7,13 (2H), 6,97 (м, 2H), 6,09 (двойной дублет, J = 5,3 и 9,9 Гц, 1H), 6,02 (д, J = 9,8 Гц, 1H), 5,82 (д, J = 9,8, 1H), 5,72 (д, J = 5,8 Гц, 1H), 5,51 (д, J = 10,3, 1H), 5,18 (с, 1H), 5,12 (д, J = 5,3 Гц, 1H), 4,83 (д, J = 12,5 Гц, 1H), 4,76 (д, J = 12,4, 1H), 4,64 (д, J = 1,8, 1H), 4,52 (д, J = 8,4, 1H), 4,37 (д, J = 8,3 Гц, 1H), 3,67 (д, J = 5,6 Гц, 1H), 2,95 (д, J = 18,6 Гц, 1H), 2,75 (с, 1H), 2,67 (с, 3H), 2,18 (с, 3H), 1,90 (д, J = 18,5 Гц, 1H), 1,76 (с, 3H), 1,53 (с, 3H), 1,28 (с, 3H), 1,03 (с, 3H), 0,73 (т, J = 8,0, 9H), 0,35 (м, 6H).
Спектр 13C ЯМР (CDCl3, TMS) δ 207,7, 169,9, 169,6, 168,8, 166,7, 155,7, 142,2, 138,8, 138,6, 136,1, 133,7, 130,3, 129,2, 128,7, 128,6, 128,4, 127,9, 127,9, 127,4, 126,4, 125,6, 122,1, 81,2, 80,8, 79,1, 77, 75,0, 73,7, 66,8, 57,3, 56,0, 54,1, 39,6, 36,5, 32,6, 29,9, 23,3, 21,0, 20,8, 18,5, 14,1, 6,4, 4,1.
Фракции 82-90 содержали 2'-триэтилсилил-N-дебензоил-N- бензилоксикарбонил-7-дезокси -7β,8β- метан-12,13-изотаксол (55, 0,14 г, 7%).
Спектр 1H ЯМР был идентичен спектру соединения 55, представленному в примере 51.
Пример 58. 2'-Tpиэтилcилил-N-дeбeнзoил-7-дeзoкcи -Δ6,7- 12,13-изотаксол (60) ((6,12b-бис(ацетилокси)-12-(бензоилокси)-2a, 4a, 5, 6,7,10,11,12,12a, 12b-декагидро-11-гидрокси- 4a, 8,13,13-тетраметил-5-оксо-7,11-метан-1H-циклодека [3,4]бенз[1,2-b]-оксет-9-иловый эфир{2aR- 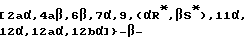 амино -α- триэтилсилилоксибензолпропановой кислоты))
амино -α- триэтилсилилоксибензолпропановой кислоты))
В соответствии с методикой, описанной для получения соединения 57, раствор 2'-триэтилсилил-N-дебензоил-N-бензил-oкcикapбoнил-7- дeзoкcи -Δ6,7- 12,13-изотаксола (56, 1,721 г, 1,75 ммоля) и формиата аммония (1,07 г, 16,97 ммоля) в метиловом спирте (23 мл) и тетрагидрофуране (12,6 мл) перемешивали с 10% палладием на угле в течение 10 минут при комнатной температуре, а потом еще один час при 0oC. В результате этого был получен 2'-триэтилсилил-N-дебензоил-7-дезокси -Δ6,7- 12,13-изотаксол (60, 1,47 г).
Спектр 1H ЯМР (CDCl3, TMS) δ 8,11 (д, 2H, J = 8,0 Гц), 7,67 (т, 1H, J = 7,4 Гц), 7,54 (т, 2H), 7,35 (м, 4H), 7,18 (м, 1H), 6,05 (м, 2H), 5,68 (д, 1H, J = 5,1 Гц), 5,13 (с, 1H), 5,10 (д, 1H, J = 4,5 Гц), 4,51 (д, 1H, J = 8,2 Гц), 4,32 (м, 3H), 3,62 (д, 1H, J = 5,3 Гц), 2,71 (с, 1H), 2,45 (д, 1H, J = 17,9 Гц), 2,30 (с, 3H), 2,17 (с, 3H), 1,83 (д, 1H, J = 17,9 Гц), 1,69 (с, 3H), 1,44 (с, 3H), 1,27 (с, 3H), 1,01 (с, 3H), 0,91 (т, 9H), 0,56 (м, 6H).
Пример 59. 2'-Триэтилсилил-N-дебензоил-N-(трет-бутил)- оксикарбонил-7-дезокси -Δ6,7- 12,13-изотаксол (61) ((6,12b- бис(ацетилокси)-12-(бензилокси)-2a, 4a, 5,6,7,10,11,12,12a, 12b- декагидро-11-гидрокси-4a, 8,13,13-тетраметил-5-оксо-7,11-метан- 1H-циклодека[3,4] бенз[1,2-b]-оксет-9-иловый эфир{ 2aR 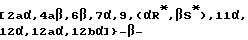 [(трет-бутил) оксикарбонил-аминов- α- -гидроксибензолпропановой кислоты))
[(трет-бутил) оксикарбонил-аминов- α- -гидроксибензолпропановой кислоты))
В соответствии с методикой, описанной для получения соединения 58, раствор неочищенного 2'-триэтилсилил-N- дебензоил-7-дезокси -Δ6,7- 12,13-изотаксола (60, 0,15 г) и ди-трет-бутил-дикарбоната ("ВОС-ангидрид", 0,147 г, 0,675 ммоля) в тетрагидрофуране (12 мл) и Et3N (0,10 мл) перемешивали в течение ночи при комнатной температуре. Входили дополнительное количество ди-трет-бутилкарбоната (0,013 г, 0,059 ммоля) и перемешивали раствор еще 2 часа. В результате был получен 2'-триэтилсилил-N- дебензоил-N-(трет-бутил)оксикарбонил-7-дезокси -Δ6,7- 12,13- изотаксол (61, 0,546 г).
Спектр 1H ЯМР (CDCl3, TMS) δ 8,17 (д,2H, J = 7,3 Гц), 7,58 (т, 1H, J = 7,4 Гц), 7,49 (2H), 7,38 (м, 2H), 7,27 (м, 3H), 6,10 (двойной дублет, 1H, J = 5,2, 9,9 Гц), 6,04 (д, 1H, J = 9,8 Гц), 5,73 (д, 1H, J = 4,3 Гц), 5,55 (д, 1H, J = 10,0 Гц), 5,44 (д, 1H, J = 10,5 Гц), 5,19 (с, 1H), 5,14 (д, 1H, J = 5,1 Гц), 4,62 (с, 1H), 4,55 (д, 1H, J = 8,1 Гц), 4,35 (д, 1H, J = 8,3 Гц), 3,69 (д, 1H, J = 5,4 Гц), 2,94 (д, 1H, J = 18,8 Гц), 2,77 (к, 1H), 2,67 (с, 3H), 2,19 (с, 3H), 2,07 (д, 1H, J = 10,9 Гц), 1,76 (с, 3H), 1,28 (с, 3H), 1,16 (с, 9H), 1,05 (с, 3H), 0,74 (т, 9H), 0,37 (м, 6H).
Пример 60. N-Дебензоил-N-(трет-бутил)оксикарбонил-7-дезокси -Δ6,7- 12,13- изотаксол (18) ((6,12b)-бис(ацетилокси)-12- (бензоилокси)-2a, 4a, 5,6,7,10,11,12,12a, 12b-декагидро-11- гидрокси-4a, 8,13,13-тетраметил-5-оксо-7,11-метан-1H- циклодека[3,4] бенз[1,2-b] -оксет-9-иловый эфир{ 2aR- 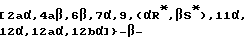 [(трет-бутил)оксикарбониламино] - -α- гидроксибензолпропановой кислоты))
[(трет-бутил)оксикарбониламино] - -α- гидроксибензолпропановой кислоты))
В соответствии с методикой, описанной для получения соединения 17, раствор 2'-триэтилсилил-N-дебензоил-N- (трет-бутил)-оксикарбонил-7-дезокси -Δ6,7- 12,13-изотаксола (61, 0,546 г) из предыдущего примера и тригидрофторида триэтиламина (1,64 мл) в CH2CN (2,7 мл) перемешивали в течение 1 часа при температуре 0-25oC. После хроматографической очистки на силикагеле был получен N-дебензоил-N-(трет-бутил)оксикарбонил-7-дезокси -Δ6,7- 12,13-изотаксол (18, 0,445 г, 0,547 ммоля, 87% из 56).
Спектр 1H ЯМР (CDCl3, TMS) δ 8,1 (д, 2H, J = 7,2 Гц), 7,61 (т, 1H, J = 7,3 Гц), 7,50 (т, 2H), 7,35 (м, 5H), 6,09 (двойной дублет, 1H, J = 5,1, 9,9 Гц), 6,04 (д, 1H, J = 9,8 Гц), 5,73 (д, 1H, J = 5,5 Гц), 5,40 (с, 2H), 5,18 (с, 1H), 5,13 (д, 1H, J = 5,1 Гц), 4,70 (с, 1H), 4,55 (д, 1H, J = 8,3 Гц), 4,34 (д, 1H, J = 8,4 Гц), 3,68 (д, 1H, J = 5,4 Гц), 2,97 (д, 1H, J = 18,9 Гц), 2,74 (c, 1H), 2,61 (с, 3H), 2,20 (с, 3H), 2,09 (д, 1H, J = 18,0 Гц), 1,75 (с, 3H), 1,53 (с, 3H), 1,32 (с, 3H), 1,20 (с, 9H), 1,05 (с, 3H).
Масс-спектр (FAB): обнаружено 832,3538 (C45H53NO14 + H требует 832,3544), 776,732, 180, 150, 105, 57 m/z.
Пример 61. 2'-Триэтилсилил-N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -Δ6,7- 12,13-изотаксол (62) ((6,12b- бис(ацетилокси)-12(бензоилокси)-2a, 4a, 5,6,7,10,11,12,12a, 12b- декагидро-11-гидрокси-4a, 8,13,13-тетраметил-5-оксо- 7,11-метан-1H-циклодека[3,4] бенз[1,2-b]-оксет-9-иловый эфир{2aR 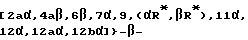 (трет-бутил) аминокарбониламино] -α- триэтилсилилоксибензолпропановой кислоты))
(трет-бутил) аминокарбониламино] -α- триэтилсилилоксибензолпропановой кислоты))
Раствор 2'-тpиэтилcилил-N-дeбeнзoил-9-дeзoкcи -Δ6,7- 12, 13-изотаксола (60, 0,956 г) и трет-бутилизоцианата (0,52 мл, 4,52 ммоля) в тетрагидрофуране (19 мл) и Et3CN (16 мл) получали при температуре ледяной бани в соответствии с методикой, описанной для получения соединения 59, после чего этот раствор оставляли для нагревания и перемешивали в течение ночи при комнатной температуре. В результате этого был получен 2'-триэтилсилил-N-дебензоил-N-(трет-бутил)аминокарбонил-7- дезокси -Δ6,7- 12,13-изотаксол (62, 1,027 г).
Спектр 1H ЯМР (CDCl3, TMS) δ 8,17 (д, 2H, J = 7,0 Гц), 7,59 (т, 1H, J = 7,3 Гц), 7,50 (т, 2H), 7,35 (м, 2H), 7,26 (м, 3H), 6,08 (м, 2H), 5,73 (д, 1H, J = 5,4 Гц), 5,51 (д, 1H, J = 8,9 Гц), 5,18 (м, 3H), 4,60 (д, 1H, J = 1,1 Гц), 4,55 (д, 1H), 4,37 (д, 1H, J = 8,3 Гц), 3,70 (д, 1H, J = 5,3 Гц), 2,95 (д, 1H, J = 19,0 Гц), 2,76 (с, 1H), 2,70 (с, 3H), 2,19 (с, 3H), 2,11 (д, 1H, J = 20,5 Гц), 1,76 (с, 3H), 1,55 (с, 3H), 1,32 (с, 3H), 1,07 (с, 9H), 1,06 (с, 3H), 0,73 (т, 9H), 0,30 (м, 6H).
Пример 62. N-дебензоил-N-(трет-бутил)аминокарбонил-7- дeзoкcи -Δ6,7- 12,13-изотаксол (62) ((6,12b-бис(ацетилокси)-12- (бензоилокси)-2a, 4a, 5,6,7,10,11,12,12a, 12b-декагидро-11- гидрокси-4a, 8,13,13-тетраметил-5-оксо-7,11-метан-1H- циклодека[3,4] бенз[1,2-b] -оксет-9-иловый эфир{ 2aR 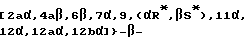 (трет-бутил)аминокарбониламино -α- гидроксибензолпропановой кислоты))
(трет-бутил)аминокарбониламино -α- гидроксибензолпропановой кислоты))
Раствор неочищенного 2'-триэтилсилил-N-дебензоил-N- (трет-бутил)аминокарбонил-7-дезокси -Δ6,7- 12, 13-изотаксола (62, 1,02 г) и Et3N(HF)3 в CH2CN (5 мл) получали при температуре 0oC в соответствии с методикой, описанной для получения соединения 17, после чего этот раствор перемешивали для нагревания до комнатной температуры в течение 1 часа. В результате проведения испарительной хроматографии на силикагеле был получен N-дебензоил-N-(трет-бутил)аминокарбонил-7-дезокси -Δ6,7- 12,13-изотаксол (38, 0,842 г, 1,01 ммоля, выход 91% из 56).
Спектр 1H ЯМР (CDCl3, TMS) δ 8,16 (д, 2H, J = 7,1 Гц), 7,60 (т, 1H, J = 7,3 Гц), 7,50 (т, 2H), 7,35. (м, 4H), 7,30 (м, 1H), 6,05 (м, 2H), 5,71 (д, 1H, J = 5,2 Гц), 5,46 (двойной дублет, 1H, J = 2,5, 9,1 Гц), 5,39 (д, 1H, J = 9,2 Гц), 5,12 (м, 2H), 4,69 (двойной дублет, 1H, J = 2,5, 5,1 Гц), 4,53 (д, 1H), 4,33 (д, 1H, J = 8,2 Гц), 3,77 (д, 1H, J = 5,5 Гц), 3,65 (д, 1H, J = 5,3 Гц), 2,92 (д, 1H, J = 18,7 Гц), 2,71 (с, 1H), 2,58 (с, 3H), 2,19 (с, 3H), 2,10 (д, 1H, J = 18,3 Гц), 1,74 (с, 3H), 1,47 (с, 3H), 1,30 (с, 3H), 1,10 (с, 9H), 1,04 (с, 3H).
Спектр 13С ЯМР (CDCl3, TMS) δ 206,7, 172,0, 171,3, 170,7, 166,6, 156,5, 143,3, 138,9, 133,7, 130,2, 128,9, 128,8, 127,9, 126,7, 121,7, 84,5, 81,1, 77,7 77,6, 77,2, 74,7, 73,5, 71,7, 57,9, 55,7, 50,5, 39,5, 38,7, 35,3, 32,9, 29,8, 29,3, 23,2, 21,0, 19,8, 14,4, 9,1.
Масс-спектр (FAB): обнаружено: 831,3701 (C45H54N2O13 требует 831,3704), 732, 263, 235, 205, 136, 106, 105, 57 m/z.
Пример 63. Получение (O-метоксиметил)-13-(N-Cbz-2'-TES -β- -фенил-изосеринил -Δ12,13- изобаккатина III (63)
В соответствии с методикой, описанной в примере 45, но при использовании в качестве исходного вещества 13-(N-Cbz-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (53) и хлорметил-метилового эфира вместо хлорметилового эфира был получен (O-метоксиметил)-13-(N-Cbz-2'-OTES' -фенил-изосеринил) -Δ12,13- изобаккатин III (63).
Пример 64. Получение 7-(O-метоксиметил)-13-(N-Cbz- -β- фенил-изосеринил -Δ12,13- изобаккатина III (64)
В соответствии с методикой, описанной в примере 43, но при использовании в качестве исходного вещества (O-метоксиметил)-13-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (63) вместо 7-(O-этоксиметил)-13-(N-Вос- 2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III был получен 7-(O-метоксиметил)-13-(N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатин III (64).
Пример 65. Получение 7-(O-метоксиметил)-13-( β- фенил- изосеринил) -Δ12,13- изобаккатина III (65)
7-(O-метоксиметил)-13-(N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатин III (64, 450 мг, 0,485 ммоля) перемешивали в метаноле (7,5 мл) и сухом тетрагидрофуране (5 мл) в атмосфере азота при комнатной температуре. К этому раствору добавляли формиат аммония (225 мг) и 10% палладий на угле (125 мг). Реакционную смесь оставляли для взаимодействия при комнатной температуре в течение 10 минут, а потом охлаждали на ледяной бане, после чего ее анализировали методом высокоэффективной жидкостной хроматографии при температуре 0oC. После взаимодействия в течение 55 минут катали затор отфильтровывали, а фильтрат разбавляли этилацетатом. Органический раствор промывали 5% раствором бикарбоната натрия, сушили над сульфатом натрия и выпаривали в вакууме. После двукратного выпаривания остатка с использованием смеси этилацетата и толуола был получен 7-(O-метоксиметил)-13-( β- фенил-изосеpинил) -Δ12,13- изобаккатин III (65).
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана 40-60: Rf: начальное значение.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,09 (с, 3H), 1,25 (с, 3H), 1,61 (с, 3H), 1,66 (с, 3H), 2,16 (с, 3H), 2,18 (с, 3H), 3,25 (с, 3H), 3,76- 3,83 (д, 1H), 3,93-4,05 (двойной дублет, 1H), 4,20-4,40 (м, 4H), 4,45-4,54 (д, 1H), 4,62-4,72 (д, 2H), 4,80-4,90 (двойной дублет, 1H), 5,44-5,53 (д, 1H), 5,73 (с, 1H), 7,26-7,40 (м, 5H), 7,45- 7,55 (т, 2H), 7,57-7,67 (т, 1H), 7,99-8,09 (д, 2H).
Пример 66. Получение 7-(O-метоксиметил)-13-(N-Вос -β- фенил-изосеринил -Δ12,13- изобаккатина III (66)
7-(O-метоксиметил)-13-( β- -фенил-изосеринил) Δ12,13- изобаккатин III (65, 0,194 ммоля) перемешивали в сухом тетрагидрофуране (1 мл) при комнатной температуре в атмосфере азота, после чего в этот раствор добавляли ди-трет-бутилдикарбонат (43 мг, 0,197 ммоля) в сухом тетрагидрофуране (0,4 мл), а потом триэтиламин (0,26 мл). Реакционную смесь анализировали методом высокоэффективной жидкостной хроматографии, и через 3,5 часа вводили дополнительное количество ди-трет-бутилдикарбоната (5 мг). После взаимодействия в течение 5,5 часов растворитель выпаривали в вакууме. Неочищенный продукт очищали методом высокоэффективной жидкостной хроматографии на колонке из силикагеля E. Merck размер B, производя элюирование смесью этилацетата и гексана (50-50). Фракции объемом 7 мл собирали и анализировали при помощи тонкослойной хроматографии. Было установлено, что фракции 39-46 содержат чистый продукт. Их собирали и выпаривали в вакууме с образованием 7-(O-метоксиметил)-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатина III (66, выход 71%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана 60-40; Rf: 0,69.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,11 (с, 3H), 1,24 (с, 9H), 1,27 (с, 3H), 1,62 (с, 3H), 1,69 (с, 3H), 1,87-2,15 (м, 3H), 2,17 (с, 3H), 2,56 (с, 3H), 2,62 (с, 1H), 2,76-2,94 (м, 2H), 3,26 (с, 3H), 3,42-3,50 (д, 1H), 3,82-3,89 (д, 1H), 3,98-4,10 (двойной дублет, 1H), 4,24-4,33 (д, 1H), 4,36-4,44 (д, 1H), 4,46-4,54 (д, 1H), 4,63-4,73 (д+с, 2H), 4,85-4,93 (двойной дублет, 1H), 5,34-5,45 (д, 1H), 5,50-5,59 (м, 2H), 5,77 (с, 1H), 7,27-7,43 (м, 5H), 7,43-7,53 (т, 2H), 7,54-7,63 (т, 1H), 8,04-8,16 (д, 2H).
Пример 67. Получение 7-(O-метоксиметил)-13-(N-трет- бутил-аминокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (67)
7-(O-метоксиметил)-13-(β- -фенил-изосеринил) -Δ12,13- изобаккатин III (65, 0,485 ммоля) перемешивали в сухом тетрагидрофуране (5 мл) при температуре 0oC в атмосфере азота. После чего этот раствор обрабатывали трет-бутилизоцианатом (75 мл). После взаимодействия в течение 5 минут реакционную смесь оставляли для нагревания до комнатной температуры. Реакционную смесь анализировали методом высокоэффективной жидкостной хроматографии и оставляли для выстаивания на ночь. Через 18 часов растворитель выпаривали в вакууме, неочищенный продукт очищали при помощи хроматографии на силикагеле, элюируя градиентом смесей этилацетата и гексана с соотношением от (50-50) до (60-40). Фракции объемом 15 мл собирали и анализировали посредством тонкослойной хроматографии. Было установлено, что фракции 44-66 содержат чистый продукт. Их собирали и выпаривали в вакууме с образованием 7-(O-метоксиметил)-13-(N-трет-бутиламинокарбонил- -β- -фенил-изосеринил) -Δ12,13- изобаккатина
III (67, выход 85%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетат и гексана (50-50); Rf: 0,33.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,1 (с, 3H), 1,14 (с, 9H), 1,25 (с, 3H), 1,59 (с, 3H), 1,69 (с, 3H), 1,88-2,15 (м, 3H), 2,17 (с, 3H), 2,56 (с, 3H), 2,60 (с, 1H), 2,77-2,93 (м, 2H), 3,26 (с, 3H), 3,70-3,76 (д, 1H), 3,83-3,90 (д, 1H), 3,97-4,06 (двойной дублет, 1H), 4,24-4,32 (д, 1H), 4,36-4,44 (д, 1H), 4,44-4,54 (д+с, 2H), 4,65-4,73 (д+с, 2H), 4,86-4,94 (двойной дублет, 1H), 5,19-5,26 (д, 1H), 5,44-5,51 (двойной дублет, 1H), 5,51-5,56 (д, 1H), 5,76 (с, 1H), 7,27-7,43 (м, 5H), 7,44-7,55 (т, 2H), 7,55-7,63 (т, 1H), 8,07-8,14 (д, 2H).
Пример 68. Получение 7-(O-этоксиметил)-13-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (68)
В соответствии с методикой, описанной в примере 42, но при использовании в качестве исходного вещества 13-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (53) вместо 13-(N-Boc-2'-TES- -β- фенил-изосеринил) -Δ12,13- изобаккатина III (46) был получен 7-(О-этоксиметил)-13-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатин III (68).
Пример 69. Получение 7-(О-этоксиметил)-13-(N-Cbz- -β- фенил-изосеринил -Δ12,13- изобаккатина III (69)
В соответствии с методикой, описанной в примере 43, но при использовании в качестве исходного вещества 7-(O-этоксиметил)-13-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина (68) вместо 7-(O-этоксиметил)-13-(N-Вос-2'-TES -β- фенил-изосеринил -Δ12,13- изобаккатина III (47) был получен 7-(O-этоксиметил)-13-(N-Cbz -β- фенил-изосеринил -Δ12,13- изобаккатин III (69).
Пример 70. Получение 7-(O-этоксиметил)-13-( β- фенил-изосеринил) -Δ12,13- изобаккатина III (70)
7-(O-Этоксиметил)-13-(N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатин III (69, 99 мг, 0,105 ммоля) перемешивали в метаноле (2 мл) и сухом тетрагидрофуране (1 мл) при комнатной температуре в атмосфере азота. К этому раствору добавляли формиат аммония (50 мг) и 10% палладий на угле (30 мг). Эту смесь оставляли для взаимодействия при комнатной температуре в течение 10 минут, а потом охлаждали на ледяной бане, после чего анализировали с помощью высокоэффективной жидкостной хроматографии. Через 35 минут катализатор отфильтровывали. Реакционную смесь разбавляли этилацетатом, промывали 5% раствором бикарбоната натрия, сушили над сульфатом натрия и выпаривали в условиях вакуума. Остаток дважды выпаривали с использованием смеси этилацетата и толуола, что позволило получить 7-(O-этоксиметил)-13-( β- фенил- изосеринил) -Δ12,13- изобаккатин III (70)
Высокоэффективная жидкостная хроматография: "Versapack C18" 229 нм; 1 мл/мин; смесь воды, ацетонитнила и тетрафторамина (TFA) (25-75-0,2); время удерживания: 3,80 минут.
Спектр протонного ЯМР (CDCl2, TMS) δ 1,07-1,18 (т+с, 6H), 1,26 (с, 3H), 1,63 (с, 3H), 1,66 (с, 3H), 1,34-2,00 (м, 1H), 2,00-2,15 (д, 1H), 2,17 (с, 3H), 2,22 (с, 3H), 2,80-2,94 (м, 1H), 3,26-3,40 (м, 1H), 3,59-3,70 (м, 1H), 3,79-3,86 (д, 1H), 3,94-4,07 (двойной дублет, 1H), 4,22-4,44 (м, 3H), 4,56-4,64 (д, 1H), 4,64-4,74 (д, 1H), 4,83-4,94 (д, 1H), 5,44-5, 54 (д, 1H), 5,74 (с, 1H), 7,23-7,47 (м, 5H), 7,47-7,59 (т, 2H), 7,59-7,70 (т, 1H), 8,00-8,10 (д, 2H).
Пример 71. Получение 7-(O-этоксиметил)-13-(N-Вос -β- фенил- изосеринил) -Δ12,13- изобаккатина III (41)
7-(O-Этоксиметил)-13- ( β- фенил-изосеринил) -Δ12,13- изобаккатин III (70,031 ммоля) перемешивали в сухом тетрагидрофуране (3 мл) при комнатной температуре в атмосфере азота, после чего этот раствор обрабатывали ди-трет-бутилдикарбонатом (116 мг) в сухом тетрагидрофуране (1 мл), а затем триэтиламином (0,076 мл). Реакционную смесь анализировали с помощью высокоэффективной жидкостной хроматографии и через 2 часа вводили дополнительное количество ди-трет-бутилдикарбоната (15 мг). Через 4,5 часа добавляли метанол (0,05 мл). Растворитель выпаривали в вакууме, а остаток дважды выпаривали с использованием смеси метиленхлорида и гексана. Неочищенный продукт очищали методом высокоэффективной жидкостной хроматографии на колонке из силикагеля E. Merck размер B, элюируя смесью ацетона и гексана (30-70). Фракции объемом 15 мл собирали и анализировали методом тонкослойной хроматографии. Было установлено, что фракции 18-22 содержат чистый продукт. Их соединяли и выпаривали в вакууме с образованием 7-(O-этоксиметил)-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатина III 41, 82%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь ацетона и гексана с соотношением 30-70; Rf: 0,33.
Спектр протонного ЯМР (CDCl2, TMS) δ 1,09-1,17 (т, 3H), 1,24 (с, 9H), 1,27 (с, 3H), 1,62 (с, 3H), 1,68 (с, 3H), 1,90-2,02 (т, 1H), 2,02-2,14 (д, 1H), 2,17 (с, 3H), 2,18 (с, 3H), 2,57 (с, 3H), 2,62 (с, 1H), 2,80-2,98 (м, 2H), 3,30-3,40 (м, 1H), 3,62- 3,73 (м, 1H), 3,84-3,90 (д, 1H), 4,00-4,10 (двойной дублет, 1H), 4,26-4,34 (д, 1H), 4,38-4,45 (д, 1H), 4,57-4,64 (д, 1H), 4,65-4,74 (м, 2H), 4,87-4,95 (д, 1H), 5,35-5,49 (м, 2H), 5,50-5,57 (д, 1H), 5,77 (с, 1H), 7,30-7,44 (м, 5H), 7,44-7,53 (т, 2H), 7,55- 7,64 (т, 1H), 8,07-8,18 (д, 2H).
Пример 72. Получение 7-(O-этоксиметил)-13-(N-трет-бутил-аминокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (43)
7-(O-Этоксиметил)-13-( β- фенил-изосеринил) -Δ12,13- изобаккатин III (70, 0,105 ммоля) перемешивали в сухом тетрагидрофуране (1 мл) при температуре 0oC в атмосфере азота, после чего этот раствор обрабатывали трет-бутилизоцианатом (20 мкл). Через 5 минут реакционную смесь оставляли для нагревания до комнатной температуры. Реакционную смесь анализировали с помощью высокоэффективной жидкостной хроматографии и оставляли для дальнейшего взаимодействия на 50 минут.
Растворитель выпаривали в вакууме, а остаток очищали методом хроматографии на силикагеле, элюируя смесью ацетона и гексана (30-70). Фракции объемом 7 мл собирали и анализировали методом тонкослойной хроматографии. Было установлено, что фракции 50-67 содержат чистый продукт. Их собирали и выпаривали в вакууме с образованием 7-(O-этоксиметил)- 13-(N-трет-бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (43, 74%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь ацетона и гексана (30-70); Rf: 0,22.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,04-1,18 (м, 15H), 1,23 (с, 3H), 1,57 (с, 3H), 1,67 (м, 3H), 1,86-2,00 (т, 1H), 2,00-2,13 (д, 1H), 2,15 (с, 3H), 2,53 (с, 3H), 2,58 (с, 1H), 2,73-2,93 (м, 2H), 3,26-3,39 (м, 1H), 3,58-3,70 (м, 1H), 3,82-3,89 (д, 1H), 3,96-4,05 (двойной дублет, 1H), 4,21-4,30 (д, 1H), 4,34-4,43 (д, 1H), 4,55-4,64 (д, 1H), 4,64-4,73 (м, 2H), 4,84-4,94 (д, 1H), 5,37-5,53 (м, 3H), 5,74 (с, 1H), 7,25-7,40 (м, 5H), 7,43-7,53 (т, 2H), 7,54-7,63 (т, 1H), 8,04-8,12 (д, 2H).
Пример 73. Получение сложного эфира 7-(O-метилтиометил) Δ12,13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (71a, b)
Сложный эфир Δ12,13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил) -2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (3a, b, 100 мг, 0,10 ммоля) перемешивали в ацетонитриле при температуре 0oC в атмосфере азота. К этому раствору с помощью шприца добавляли диметилсульфид (0,060 мл), а затем с промежутками в 5 минут четыре раза добавляли пероксид бензоила (по 25 мг). Через 30 минут происходило полное растворение, и через 2 часа с помощью тонкослойной хроматографии было установлено, что реакция закончилась. Реакционную смесь распределяли между этилацетатом и 5% раствором бикарбоната натрия. После отделения водной фазы органический слой сушили над сульфатом натрия и выпаривали в вакууме. Остаток хроматографировали на силикагеле (10 г), элюируя смесями этилацетата и гексана с соотношением (40-60) и (50-50). Фракции объемом 4 мл собирали и анализировали методом тонкослойной хроматографии. Было установлено, что фракции 19-40 содержат чистый продукт. Их собирали и выпаривали в вакууме с образованием сложного эфира 7-(O-метилтиометил) -Δ12,13- изобаккатин III-13-(4S,5R)-N- (трет-бутиламинокарбонил)-2-(2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (71a, b, 72 мг, выход 68%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана (50-50); Rf: 0,47.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,06 (с, 3H), 1,10 (с, 9H), 1,22 (с, 3H), 1,61 (с, 3H), 1,69 (с, 3H), 2,03 (с, 3H), 2,08 (с, 3H), 2,12 (с, 3H), 3,74 (с, 3H), 3,78- 3,85 (с, 3H + м, 1H), 4,00-4,13 (двойной дублет, 1H), 4,13- 4,24 (д, 1H), 4,6-4,36 (д, 1H), 4,42-4,52 (д, 1H), 4,52-4,61 (д, 1H), 4,62 (c, 1H), 4,78-4,86 (д, 1H), 4,99 (с, 1H), 5,42-5,50 (д, 1H), 5,56-5,63 (д, 1H), 5,81 (c, 1H), 6,33-6,42 (д, 1H), 6,44 (c, 1H), 6,68 (c, 1H), 7,03-7,13 (д, 1H), 7,23-7,49 (м, 6H), 7,49-7,58 (т, 1H), 7,93-8,03 (д, 2H).
Пример 74. Получение 7-(O-метилтиометил)-13-(N-трет- бутиламинокарбонил -β- фенил-изосеринил) Δ12,13- изобаккатина III (72)
Сложный эфир 7-(O-метилтиометил) -Δ12,13- изобаккатин III-13-(4S,5R)-N-(трет-бутиламинокарбонил)-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (71a, b, 72 мг, 0,068 ммоля) перемешивали в смеси уксусной кислоты и воды (80-20) (5 мл) при комнатной температуре в атмосфере азота. Результаты тонкослойной хроматографии, выполненной через 5 часов, показали, что реакция закончилась. Реакционную смесь сушили вымораживанием. Остаток хроматографировали на силикагеле (13 г), элюируя смесью этилацетата и гексана (50-50). Фракции объемом 4 мл собирали и анализировали метолом тонкослойной хроматографии. Было установлено, что фракции 11-24 содержат 7-(O-метилтиометил)-13-(N-трет-бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатин III (72, 57 мг, 92%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана 50-50; Rf: 0,39.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,03 (с, 3H), 1,06 (с, 9H), 1,17 (с, 3H), 1,56 (с, 3H), 1,60 (с, 3H), 1,73-1,87 (т, 1H), 2,02 (с, 3H), 2,09 (с, 3H), 2,48 (с, 3H), 3,77-3,85 (д, 1H), 4,00-4,10 (двойной дублет, 1H), 4,16-4,24 (д, 1H), 4,29-4,36 (д, 1H), 4,41-4,49 (д, 1H), 4,49-4,56 (д, 1H), 4,57 (с, 1H), 4,61 (с, 1H), 4,80-4,88 (д, 1H), 5,31-5,41 (с+т, 2H), 5,41-5,48 (д, 1H), 5,80 (с, 1H), 7,20-7,34 (м, 5H), 7,37-7,47 (т, 2H), 7,47-7,56 (т, 1H), 7,99-8,06 (д, 2H).
Масс-спектр (FAB, m/z) (M+H)+, измеренный при значении 909,3840; теоретическое значение для C47H61O14N2S1, равно 909,3843; 861, 847, 831, 263, 235, 136, 119, 105, 61, 57.
Пример 75. Получение 7-(O-метил)-13-(N-трет-бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (73)
Никель Ренея (8 мл), предварительно промытый 5% раствором бикарбоната натрия, водой и этанолом, перемешивали при температуре 0oC в атмосфере азота. К нему с помощью шприца добавляли 7-(O-метитиометил)-13-(N-трет-бутиламинокapбoнил -β- фенил-изосеринил) -Δ12,13- изобаккатин III (72, 100 мг, 0,11 ммоля) в абсолютном этаноле (10 мл). На протяжении всей реакции температуру поддерживали на уровне 0oC и выполняли описанную ниже процедуру последующей промывки. Реакционную смесь анализировали методом тонкослойной хроматографии и оставляли на 4 часа для дальнейшего взаимодействия, когда результаты анализа показали, что реакция заканчивалась. Никель Ренея выпадал в осадок, после чего верхний слой жидкости удаляли отсасыванием. Остаток, представляющий собой никель Ренея, обрабатывали тетрагидрофураном (40 мл) и перемешивали в течение 2 минут. После осаждения катализатора жидкость удаляли так же, как описывалось выше. Процедуру промывки повторяли 9 раз. Все промывочные воды соединяли и выпаривали в вакууме, в результате чего было получено 65 мг твердого вещества. Остаток хроматографировали на силикагеле (10 г), элюируя смесями этилацетата и гексана (50-50, 100 мл) и (60-40, 200 мл). Фракции объемом 3 мл собирали и анализировали методом тонкослойной хроматографии. Было установлено, что фракции 13-18 содержат исходное вещество, а фракции 19-28 содержат 7-(О-метил)-13-(N-трет-бутиламинокарбонил -β- фенил-изосеринил -Δ12,13- иизобаккатин III (73, 43 мг, 43%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана (50-50); Rf:0,33.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,03 (с, 3H), 1,06 (с, 9H), 1,17 (с, 3H), 1,52 (с, 3H), 1,56 (с, 3H), 1,90-2,05 (д, 2H), 2,10 (с, 3H), 2,48 (с, 3H), 2,56-2,68 (м, 1H), 2,68-2,83 (д, 2H), 3,13 (с, 3H), 3,69-3,82 (м, 2H), 4,14-4,24 (д, 1H), 4,27-4,36 (д, 1H), 4,55 (с, 1H), 4,61 (с, 1H), 4,80-4,91 (д, 1H), 5,25-5,43 (т, 2H), 5,43- 5,49 (д, 1H),5,76 (с, 1H), 7,16-7,35 (м, 5H), 7,35-7,46 (т, 2H), 7,46-7,57 (т, 1H), 7,96-8,07 (д, 2H).
Масс-спектр (FAB, m/z) (M+H)+ равен 863,3981; теоретическое значение для C46H59O14N2 равно 863,3966; 563, 263, 235, 205, 179, 136, 119, 106, 105, 58, 57, 43.
Пример 76. Получение сложного эфира Δ12,13- изобаккатин III-13-(4S, 5R)-N-Cbz-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (74a, b)
Сложный эфир 7-TES -Δ12,13- изобаккатин III-13-(4S,5R)-N- Cbz-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (51a b, 215 мг, 0,188 ммоля) перемешивали в ацетонитриле (0,75 мл) и 98% тригидрофториде триэтиламина (0,25 мл) при комнатной температуре в атмосфере азота. Реакционную смесь анализировали методом тонкослойной хроматографии и установили, что реакция закончилась через 7,5 часов. Реакционную смесь разбавляли этилацетатом и промывали 5% раствором бикарбоната натрия, 5% раствором бисульфата натрия и рассолом. Органический слой сушили над сульфатом натрия и выпаривали в вакууме. Неочищенный продукт хроматографировали на силикагеле (20 г), элюируя смесью ацетона и гексана (40-60). Фракции объемом 7 мл собирали и анализировали методом тонкослойной хроматографии. Фракции 13-22 соединяли и выпаривали в вакууме с образованием сложного эфира Δ12,13- изобаккатин III-13-(4S, 5R)-N- -Cbz-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (74a, b, 182 мг, выход 94%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана (40-60); Rf: 0,23.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,16 (с, 12H), 1,28 (с, 3H), 1,66 (с, 3H), 1,90 (с, 3H), 1,98 (с, 3H), 2,26 (с, 3H), 2,43-2,55 (м, 2H), 3,73-3,81 (д, 1H), 3,84 (с, 3H), 3,91 (с, 3H), 4,11-4,16 (д, 1H), 4,21-4,27 (д, 1H), 4,36-4,47 (м, 1H), 4,50 (с, 1H), 4,82-4,92 (широкий дублет, 1H), 4,92-4,96 (д, 1H), 5,50-5,55 (д. 1H), 5,61-5,68 (д, 1H), 6,25-6,37 (м, 2H), 6,47-6,55 (м, 2H), 6,71 (c, 1H), 7,23-7,57 (м, 8H), 7,57-7,64 (т, 1H), 8,00-8,07 (д, 2H).
Пример 77. Получение сложного эфира 7-(O-метоксиметил)- Δ12,13- изобаккатин III-13-(4S, 5R)-N-Cbz-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (75a,b)
Сложный эфир Δ12,13- изобаккатин III-13-(4S,5R)-N-Cbz-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (74a,b, 215 мг, 0,208 ммоля) перемешивали в метиленхлориде (1 мл) при комнатной температуре в атмосфере азота, после чего в раствор добавляли хлорметилметиловый эфир (97 мкл, 1,25 ммоля) и диизопропилэтиламин (225 мкл, 1,25 ммоля). Реакционную смесь анализировали методом тонкослойной хроматографии. Через 21 час было установлено, что реакция закончилась. Тогда вводили дополнительное количество хлорметилметилового эфира (48 мкл, 0,62 ммоля) и диизопропилэтиламина (112 мкл, 0,62 ммоля). Взаимодействие продолжалось еще 24 часа, после чего было установлено, что реакция закончилась. Реакционную смесь разбавляли метиленхлоридом и промывали 5% раствором бисульфата натрия и 5% раствором бикарбоната натрия, сушили над сульфатом натрия и выпаривали в вакууме. Остаток хроматографировали на силикагеле (20 г), производя элюирование смесью ацетона и гексана (40-6.0). Фракции объемом 5 мл собирали и анализировали
методом тонкослойной хроматографии. Фракции 17-26 соединяли и выпаривали в вакууме с образованием сложного эфира 7-(O- метоксиметил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Cbz-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (75a, b, 224 мг, выход 100%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь ацетона и гексана (40-60); Rf 0,44.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,06 (с, 3H), 1,21 (с, 3H), 1,26 (с, 3H), 1,64 (с, 3H), 2,11 (с, 3H), 2,16 (с, 3H), 2,44-2,69 (с+д, 2H), 2,70-2,88 (м, 1H), 3,23 (с, 3H), 3,57-4,04 (м, 2H), 3,80 (с, 6H), 4,14-4,28 (д, 1H), 4,28-4,38 (д, 1H), 4,43-4,54 (д, 1H), 4,55-4,84 (м, 4H), 4,84-4,96 (д, 1H), 5,34-5,44 (д, 1H), 5,44-5,53 (д, 1H), 5,67 (с, 1H), 6,30-6,58 (широкий дублет, 1H), 6,74 (широкий синглет, 3H), 7,04-7,29 (м, 4H), 7,29-7,54 (м, 7H), 7,54- 7,65 (т, 1H), 7,93-8,06 (д, 2H).
Пример 78. Получение 7-(O-метоксиметил)-13) -β- фенил изосеринил -Δ12,13- изобаккатина III (64)
Сложный эфир 7-(O-метоксиметил) -Δ12,13- изобаккатин III- 13-(4S,5R)-N-Cdz-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (75a,b, 224 мг, 0,208 ммоля) перемешивали в смеси уксусной кислоты и воды (80-20) (9 мл) при комнатной температуре в атмосфере азота. Реакционную смесь анализировали методом тонкослойной хроматографии и обнаружили, что реакция закончилась через 4,5 часа. Реакционную смесь сушили вымораживанием. Остаток очищали при помощи хроматографии на колонке из силикагеля (25 г), элюируя градиентом смесей этилацетата и гексана с соотношением от (40-60) до (60-40). Фракции объемом 7 мл собирали и анализировали методом тонкослойной хроматографии. Требуемый продукт был обнаружен во фракциях 38-60, которые объединяли и выпаривали в условиях вакуума с образованием 7-(O-метоксиметил)-13-(N-Cdz -β- фенил-изосеринил) -Δ12,13- изобаккатина III (64, 180 мг, выход 93%) в виде белого твердого вещества.
Тонкослойная хроматография, силикагель; смесь этилацетата и гексана (40-60); Rf: 0,19.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,08 (с, 3H), 1,21 (с, 3H), 1,59 (с, 3H), 1,68 (с, 3H), 1,82-2,03 (м, 2H), 2,12 (с, 3H), 2,16 (с, 3H), 2,74-2,94 (м, 2H), 3,23 (с, 3H), 3,66 (широкий синглет, 1H), 3,77-3,86 (д, 1H), 3,96- 4,10 (двойной дублет, 1H), 4,23-4,35 (д, 1H), 4,35-4,42 (д, 1H), 4,44-4,52 (д, 1H), 4,60-4,94 (м, 5H), 5,40-5,56 (м, 2H), 5,75 (с, 1H), 5,94-6,05 (д, 1H), 6,94- 7,04 (м, 2H), 7,10-7,23 (м, 3H), 7,25-7,42 (м, 9H), 7,42-7,53 (т, 2H), 7,53-7,62 (т, 1H), 8,08-8,20 (д, 2H).
Масс-спектр (FAB, m/z) (М+H)+ равен 928,3743; теоретическое значение для C51H57N1O16 равно 928,3755; 928, 896, 866, 105, 91, 43.
Пример 79. Получение 7-(O-этоксиметил)-13-(N-Cdz -β- фенил-изосеринил) -Δ12,13- изобаккатина III (69)
Сложный эфир Δ12,13- изобаккатин III-13-(4S,5R)-N-Cdz-2- (2,4-диметоксифенил) -4-фенил-5-оксазолидинкарбоновой кислоты (74a,b, 1,9 г, 1,84 ммоля) растворяли в CH2Cl2 (15 мл) и полученный раствор обрабатывали хлорметилэтиловым эфиром (850 мкл, 9,2 ммоля) и диизопропилэтиламином (2 мл, 11 ммолей). После перемешивания в течение ночи результаты тонкослойной хроматографии показали, что реакция прошла примерно на 40%. Дважды с промежутками в 24 часа вводили дополнительное количество хлорметилэтилового эфира (850 мл, 9,2 ммоля) и диизопропилэтиламина (2 мл, 11 ммолей), после чего реакционную смесь продолжали перемешивать еще в течение двух дней. На этот раз с помощью тонкослойной хроматографии было установлено, что прореагировало все исходное вещество, поэтому реакционную смесь распределяли между EtOAc и 1н. раствором HCl. Органический слой еще раз экстрагировали 5% раствором NaHCO3, а затем рассолом. Органический слой фильтровали через Na2SO4 и концентрировали в вакууме. К остатку добавляли смесь уксусной кислоты и воды (80-20) (100 мл). Через 4 часа с помощью тонкослойной хроматографии было обнаружено, что все исходное вещество прореагировало, и реакционную смесь лиофилизировали. Остаток хроматографировали на силикагеле (200 г) в смеси этилацетата и гексана (. 1-2), используя для ввода вещества CH2Cl2. Колонку элюировали 1,5 л смеси этилацетата и гексана (2-3) (2-3, 1,5 л; 1-1, 1 л; и 2-1, 500 мл). Фракции объемом 50 мл собирали. 7-(O-этоксиметил)-13-(N-Cbz -β- фенил-изосеринил) Δ12,13- изобаккатин III (69, 1,45 г, выход 82%) был обнаружен во фракциях 34-51.
Масс-спектр: теоретическое значение 942,3912; обнаружено 942, 3901.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,13 (м), 1,27 (м), 1,60 (с), 1,68 (с, 3H), 1,94 (м, 2H), 2,17 (с), 2,91 (м, 2H), 3,19 (д, 1H), 3,35 (м, 1H), 3,68 (м, 1H), 3,83 (д, 1H), 4,06 (м, 1H), 4,32 (д, 1H), 4,41 (д, 1H), 4,59 (д, 1H), 4,69 (д, 1H), 4,75 (м, 1H), 4,89 (м, 3H), 5,52 (м, 2H), 5,69 (д, 1H), 5,76 (с, 1H), 7,02 (м, 2H), 7,20 (м, 3H), 7,41-7,61 (м, 9H), 8,15 (д, 1H)
Пример 80. Получение 13-(2'-TES -β- фенил-изосеринил)- Δ12,13- изобаккатина III (76)
1-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатин III (53, 100 мг, 0,1 ммоля) перемешивали в сухом тетрагидрофуране (1 мл) и метаноле (1) при комнатной температуре в атмосфере азота, после чего к этому раствору добавляли формиат аммония (45 мг) и 10% палладий на угле (25 мг). Через 10 минут реакционную смесь охлаждали на ледяной бане и оставляли для дальнейшего взаимодействия еще на 60 минут, после чего с помощью тонкослойной хроматографии было установлено, что реакция закончилась. Реакционную смесь фильтровали через целит и промыли этилацетатом. Фильтрат, объединенный с промывочными водами, промывали 5% раствором бикарбоната натрия, сушили над сульфатом натрия и выпаривали в вакууме. Остаток дважды выпаривали с толуолом и один раз со смесью этилацетата и гексана, что позволило получить 13-(2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатин III (76, 88 мг, 100%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана (50-50): Rf; 0,67.
Спектр протонного ЯМР (CDCl3, TMS) δ 0,40-0,58 (м, 6H), 0,76-0,90 (т, 9H), 0,94 (с, 3H), 1,17 (с, 3H), 1,45 (с, 3H), 1,51 (с, 3H), 2,13 (с, 3H), 2,70 (с, 3H), 3,53- 3,63 (д, 1H), 4,13-4,35 (м, 4H), 4,76-4,87 (двойной дублет, 1H), 5,37 (с, 1H), 5,40-5,48 (д, 1H), 7,06-7,37 (м, 5H), 7,38-7,50 (т, 2H), 7,50-7,63 (т, 1H), 7,90-8,02 (д, 2H).
Пример 81. Получение 13-(N-трет-бутиламинокарбонил-2'- TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (77)
13-(2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатин III (76, 88 мг, 0,1 ммоля) перемешивали в сухом тетрагидрофуране (1 мл) при температуре 0oC в атмосфере азота. К этому раствору с помощью шприца добавляли трет-бутилизоцианат (0,02 мл). Через 5 минут реакционную смесь нагревали до комнатной температуры и анализировали методом тонкослойной хроматографии. Через 1 час реакционную смесь снова охлаждали на ледяной бане и обрабатывали трет-бутилизоцианатом (0,02 мл). Затем реакционную смесь нагревали до комнатной температуры и оставляли для дальнейшего взаимодействия на ночь, по истечении которой реакция заканчивалась. Реакционную смесь выпаривали в вакууме, а остаток хроматографировали на силикагеле (10 г). Колонку элюировали смесями этилацетата и гексана (30-70, 200 мл) и (40-60, 100 мл). Фракции объемом 3 мл собирали и анализировали методом тонкослойной хроматографии. Было установлено, что фракции 22-72 содержат чистый продукт. Их соединяли и выпаривали в вакууме с образованием 13-(N-трет-бутиламинокарбонил-2'- TES -β- фeнил-изocepинил) -Δ12,13- изoбaккaтинa III (77, 87 мг, 92%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана (40-60); Rf, 0,81.
Спектр протонного ЯМР (CDCl3, TMS) δ 0,17-0,44 (м, 6H), 0,64-0,80 (т, 9H), 1,03 (с, 3H), 2,06 (с, 9H), 1,28 (с, 3H), 1,60 (с, 3H), 1,61 (с, 3H), 1,77 (с, 1H), 1,84-1,99 (т, 1H), 2,00-2,15 (д, 1H), 2,19 (с, 3H), 2,40-2,57 (м, 1H), 2,65 (с, 3H), 2,76 (с, 2H), 2,82-2,96 (д, 1H), 3,52- 3,59 (д, 1H), 3,67-3,76 (д, 1H), 4,26- 4,43 (м, 3H), 4,46 (с, 1H), 4,59 (с, 1H), 4,89-4,99 (д, 1H), 5,15- 5,25 (д, 1H), 5,47 (с, 1H), 5,47-5,60 (м, 2H), 7,18-7,38 (м, 5H), 7,40-7,50 (т, 2H), 7,50-7,58 (т, 1H), 8,04-8,14 (д, 2H).
Пример 82. Получение 7-(O-метилтиометил)-13-(N-трет- бутиламинокарбонил-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (78)
13-(N-трет-бутиламинокарбонил-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатин III (77,87 мг, 0,091 ммоля) перемешивали в ацетонитриле (1 мл) при температуре 0oC в атмосфере азота. К этому раствору с помощью шприца добавляли диметилсульфид (0,055 мл), после чего с пятиминутными промежутками четырежды добавляли пероксид бензоила (каждая порция по 25 мг). Через 4 часа с помощью тонкослойной хроматографии было установлено, что реакция закончилась. Реакционную смесь распределяли между этилацетатом и 5% раствором бикарбоната натрия. Органический слой сушили над сульфатом натрия и выпаривали в вакууме. Остаток хроматографировали на силикагеле (10 г), элюируя смесью этилацетата и гексана (30-70). Фракции объемом 4 мл собирали и анализировали посредством тонкослойной хроматографии. Фракции 9-21 содержали чистый продукт. Их собирали и выпаривали в вакууме с образованием 7-(O- метилтиометил)-13-(N-трет-бутиламинокарбонил-2'- TES -β- фенил-изосеринил -Δ12,13- изобаккатина III (78, 73 мг, 78%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана (30-70); Rf; 0,47.
Спектр протонного ЯМР (CDCl3, TMS) δ 0,12-0,37 (м, 6H), 0,61-0,74 (r, 9H), 1,04 (с, 9H), 1,05 (с, 3H), 1,21 (с, 3H), 1,63 (с, 3H), 1,64 (с, 3H), 1,78-1,92 (т, 1H), 2,03 (с, 3H), 2,11 (с, 3H), 2,57 (с, 3H), 2,61 (с, 3H), 2,75- 2,92 (м, 2H), 3,83-3,90 (д, 1H), 4,04-4,14 (двойной дублет, 1H), 4,21-4,29 (д, 1H), 4,31-4,39 (д, 1H), 4,42-4,60 (м, 4H), 4,85-4,93 (л, 1H), 5,14-5,22 (д, 1H), 5,44-5,52 (м, 2H), 5,84 (с, 1H), 7,15-7,35 (м, 5H), 7,35-7,45 (т, 2H), 7,45-7,55 (т, 1H), 8,00-8,08 (д, 2H).
Пример 83. Получение 7-(O-метилтиометил)-13-(N-трет- бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (72)
7-(О-Метилтиометил)-13-(N-трет-бутиламинокарбонил-2'- TES -β- фенил-изосеринил) -Δ12,13- изобаккатин III (78, 73 мг, 0,071 ммоля) перемешивали в смеси уксусной кислоты и воды (80-20) (7 мл) при комнатной температуре в атмосфере азота. Результаты анализа, выполненного с помощью тонкослойной хроматографии через 1 час, показали, что реакция за кончилась, после чего реакционную смесь сушили вымораживанием. Остаток хроматографировали на силикагеле (10 г), элюируя смесью этилацетата и гексана (50-50). Фракции объемом 4 мл собирали и анализировали методом тонкослойной хроматографии. Было установлено, что фракции 12-30 содержат чистый продукт, из которого после выпаривания был получен 7-(O-метилтиометил)-13- (N-трет-бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатин III (72, 50 мг, 77%) в виде белого твердого вещества.
Тонкослойная хроматография: силикагель; смесь этилацетата и гексана (50-50); Rf: 0,24.
Спектр протонного ЯМР (CDCl3, TMS) δ 1,03 (с, 3H), 1,06 (с, 9H), 1,17 (с, 3H), 1,56 (с, 3H), 1,60 (с, 3H), 1,73- 1,87 (т, 1H), 2,02 (с, 3H), 2,09 (с, 3H), 2,48 (с, 3H), 2,52 (с, 1H), 2,69-2,86 (м, 2H), 3,76-3,84 (д, 1H), 4,00- 4,10 (двойной дублет, 1H), 4,14-4,24 (д, 1H), 4,28-4,36 (д, 1H), 4,40-4,65 (м, 4H), 4,80-4,90 (д, 1H), 5,24-5,33 (д, 1H), 5,33-5,42 (м, 1H), 5,42-5,47 (д, 1H), 5,80 (с, 1H), 7,16-7,35 (м, 5H), 7,37- 7,47 (т, 2H), 7,47-7,56 (т, 1H), 7,99-8,06 (д, 2H).
Пример 84.
Часть A. Получение 2-(3-метилбутил)диметилсилил-10- дезацетилбаккатина D (80a)
Раствор 1,04 г 10-деацетилбаккатина в 3 мл пиридина, находившийся при комнатной температуре, обрабатывали 1,03 г 2-(3- метилбутил)диметилсилилхлорида. Реакционную смесь перемешивали при комнатной температуре в течение 7 часов, после чего результаты анализа, выполненного с помощью высокоэффективной жидкостной хроматографии, показали, что исходное вещество прореагировало на 99%. Смесь выливали в воду и с помощью этилацетата выделяли требуемый продукт. Этилацетатный раствор сушили над MgSO4 и концентрировали с образованием после вакуумной сушки 1,34 г в виде пены.
Часть B. Получение 2-(3-метилбутил)диметилсилил-баккатина III (81a)
Неочищенное вещество, полученное в соответствии с методикой, приведенной в части A, растворяли в 8 мл пиридина и охлаждали до 0oC. Затем медленно добавляли ацетилхлорид (0,735 мл). Раствор превращался в густую суспензию, которую перемешивали в течение 6,5 часов при 0oC, после чего помещали на ночь в морозильную камеру с температурой -20oC. На следующее утро в реакционную смесь вливали метанол и с помощью этилацетата выделяли требуемый продукт. Этилацетатный раствор концентрировали до образования масла, а избыток пиридина удаляли азеотропной дистилляцией с толуолом. Неочищенный продукт хроматографировали на силикагеле с использованием смеси 40% этилацетата и циклогексана, что позволило получить 1,14 г (84%) 2-(3-метилбутил)диметилсилил-баккатина III.
Пример 85. Получение циклогексилдиметилсилил-10-деацетилбаккатина (80b)
К раствору 182 г 10-деацетилбаккатина в 2 мл пиридина добавляли 0,3 мл циклогексилдиметилсилилхлорида при комнатной температуре. Этот раствор перемешивали при комнатной температуре в течение 16 часов, охлаждали этанолом, выливали в воду и выделяли продукт с помощью этилацетата. Неочищенный продукт хроматографировали на силикагеле с использованием смеси 40% этилацетата и циклогексана с образованием 131 мг чистого силильного производного. (Примечание: более продолжительное время перемешивания вызывает значительное избыточное силилирование и снижает выход циклогексилдиметилсилил-10-деацетилбаккатина (80b).
Пример 86
Как было показано в примерах 84 и 85, силильные защитные группы можно вводить с помощью хорошо известных способов. См., например, работу "Protective Groups in Organic Synthesis, 2 ed.". Peter G.M. Wuts, стр. 74-83, Нью-Йорк, 1991 г., которая включена в эту заявку на патент в качестве ссылки.
В литературе указывалось, что трибутилдиметилсилил (TBDMS) нельзя ввести в баккатин III, см. сноску 13 в журнале Journal of the Americal Chemistry Society (JACS), 110, 5917 (1988). В соответствии с применявшимися до сих пор условиями реакции введение трнбутилдиметилсилила в баккатин III оказывалось безуспешным. Однако все же считается, что трибутилдиметилсилил и триизопропилсилил можно ввести в баккатин III, а также в изобаккатин III при создании условий реакции, известных в этой области.
Пример 87
Перемешанный раствор 10-деацетилбаккатина (10-DAB, 10,0 г, 0,0184 моля) в CH2Cl2 (50 мл) и пиридине (50 мл) охлаждали до - 30oC и в течение 20 минут добавляли ангидрид трифторметансульфоновой кислоты (3,85 мл, 6,4 г, 0,0229 моля). Во время добавления температуру раствора поддерживали ниже -15oC, а в течение 30 минут после добавления ее доводили до -20 - -25oC. Результаты тонкослойной хроматографии (смесь 20% AcCN и CH2Cl2), выполненной в это время, показали, что отношение требуемого продукта к исходному веществу составляет 1:3. После этого реакционную смесь перемешивали в течение двух часов при температуре 0oC. Результаты тонкослойной хроматографии показали наличие трех пятен, из которых наиболее и наименее полярные составляли меньшинство, а большую часть занимало среднеполярное пятно. На этом этапе реакционную смесь можно ацетилировать так, как описывается в примере 88, или обрабатывать так, как описывается ниже.
Реакционную смесь сначала разбавляли CH2Cl2 (2,5 мл), после чего этот раствор последовательно промывали 1 М раствором NaHSO4 (3 х 1 л), насыщенным раствором NaHCO3 (2 х 1 л) и 50% насыщенным раствором NaCl (1 л). Промывочные воды, полученные в результате каждой промывки, снова экстрагировали CH2Cl2 (по 100 мл на каждую), соединенные органические слои сушили (Na2SO4) и фильтровали. Поскольку компоненты реакционной смеси не перемешивались по силикагелю при использовании CH2Cl2 в качестве растворителя и поскольку 7-O-трифлат является практически нерастворимым, весь экстракт (3 л) сразу же вводили в колонку для испарительной хроматографии (колонка высотой 28 см с диаметром 72 мм, заполненная силикагелем в CH2Cl2). Эту колонку элюировали следующими растворителями: CH2Cl (1,5 л), 7,5% AcCN в CH2Cl2 (2 л), 10% AcCN в CH2Cl2 (2 л), 20% AcCN в CH2Cl2 (3 л) и AcCN (2 л). Фракции 20-22 (по 200 мл каждая) содержали 1,89 г (0,00233 моля, 12%) бис- трифлата. Фракции 31-37 содержали 7,57 г (0,0112 моля, 61%) соединения 82, и фракции 42-47 содержали 1,18 г (12%) выделенного 10-деацетилбаккатина.
Данные спектрального анализа для 10-деацетилбаккатин-7-O-трифлата (82):
Спектр 1H ЯМР (CDCl3, TMS) δ 8,09 (д), 7,64, 7,49 (т), 5,65 (д), 5,46 (двойной дублет), 5,43 (с), 4,94 (м), 4,37 (д), 4,18 (д), 4,00 (с), 2,31 (с), 2,10 (с), 1,91 (с), 1,10 (с).
Пример 88. Получение баккатин-III-7-О-трифлата (83=20)
К реакционной смеси по примеру 87, находившейся при 0oC, добавляли уксусный ангидрид (43,5 мл, 47,1 г, 0,461 мол). После добавления реакционный раствор нагревали на масляной бане при температуре 50oC в течение 15 минут, после чего его анализировали методом тонкослойной хроматографии, результаты которой показали, что произошло 90% превращение основного продукта в новое вещество. Реакционную смесь охлаждали на ледяной бане и прекращали реакцию добавлением воды (50 мл) через капельную воронку в течение 30 минут при температуре ниже 10oC. Эту смесь перемешивали с EtOAc (50 мл), при этом выделилось дополнительное тепло. Эту смесь вводили в EtOAc (500 мл) и промывали 5% раствором NaHSO4 (2 х 500 мл), насыщенным раствором NaHCO3 (3 х 500 мл) и насыщенным раствором NaCl (500 мл). Каждый водный слой снова экстрагировали 50 мл EtOAc. Соединенные органические экстракты сушили (Na2SO4), фильтровали и концентрировали. Неочищенный продукт (14,5 г) растворяли в CH2Cl2 (150 мл плюс две 50 мл промывки) и вводили в колонку из силикагеля для испарительной хроматографии (178 мм слой сухого материала в колонке диаметром 80 мм). Колонку элюировали CH2Cl2 (500 мл), 5% AcCN в CH2Cl2 (1 л), 7,5% AcCN в CH2Cl2 (2 л), 10% AcCN в CH2Cl2 (2 л) и AcCN (2 л). Баккатин III-7-О-трифлат (83) был обнаружен во фракциях 11-19 (7,36 г, 0,0102 моля, 55% из 10-деацетилбаккатина).
Спектр 1H ЯМР в CDCl3, аналогичен спектру, описанному для соединения 20, полученному в примере 15 из баккатина III.
Пример 89. Получение 13-кетобаккатин Ш-7-трифлата (84)
Баккатин III-7-трифлат (83, 100 мг, 0,17 ммоля) растворяли в метиленхлориде (2 мл). Полученный раствор обрабатывали диоксидом марганца (300 мг, 3,45 ммоля) и перемешивали в течение 18 часов, после чего выполняли тонкослойную хроматографию, результаты которой показали, что реакция еще не закончилась. Вводили дополнительное количество диоксида марганца (100 мг, 1,15 ммоля) и реакционную смесь перемешивали еще в течение 3 часов. Реакционную смесь за тем фильтровали через целит и концентрировали в вакууме с образованием 13-кетобаккатин III-7- трифлата (84, 90 мг).
Спектр протонного ЯМР (CDCl3, TMS) δ 1,21 (с, 3H), 1,28 (с, 3H), 1,86 (с, 3H), 2,22 (с, 3H), 2,23 (с, 3H), 2,26 (с, 3H), 2,82 (д, J = 20 Гц, 1H), 2,80-2,89 (м, 1H), 2,95 (д, 3 = 20 Гц, 1H), 4,02 (д, J = 8,6 Гц, 1H), 4,11 (д, J = 8,4, 1H), 4,38 (д, J= 8,4 Гц, 1H), 4,91 (д, J= 7,8 Гц, 1H), 5,50 (двойной дублет, 1H), 5,74 (д, J= 6,6 Гц, 1H), 6,75 (с, 1H), 7,51 (т, 2H), 7,65 (т, 1H), 8,06 (д, 2H).
Пример 91. Δ12,13- Изобаккатин III-7-трифлата (85)
В соответствии с методикой получения 7TES -Δ12,13- изобаккатина III, описанной в примере 2, но при использовании в качестве исходного вещества 13-кетобаккатин III-7-трифлата (84) был получен Δ12,13- изобаккатин III-7-трифлат (85).
Пример 92. Получение сложного эфира, 7-(O-трифторметан- сульфонил) -Δ12,13- изобаккатин III-13-(4S,5R)-N-карбобензилокси-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (86a,b)
В соответствии с методикой получения сложного эфира 7- TES -Δ12,13- изобаккатин III-13-(4S,5R-N-Cbz-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (51a,b), описанной в примере 47, но при использовании в качестве исходного вещества Δ12,13- изобаккатин III-7-трифлата (85) был получен сложный эфир 7-(O-трифторметансульфонил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Cbz-2-(2,4-диметоксифенил)- 4-фенил-5-оксазолидинкарбоновой кислоты (86a,b).
Пример 93. Получение 7-(O-трифторметансульфонил)-13-(N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатина III (87)
В соответствии с методикой получения 13-(N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатина III (52), описанной в примере 48, но при использовании в качестве исходного вещества сложного эфира 7- (O-трифторметан-сульфонил) -Δ12,13- изобаккатин III-13-(4S,5R) -N-Cbz-2-(2,4-диметоксифенил)-4-фенил-5-оксазолилинкарбоновой кислоты (86a,b) был получен 7-(O-трифторметансульфонил)-13- (N-Cbz--β-фенил-изосеринил) -Δ12,13- изобаккатин III (87).
Пример 94. Получение 7-(O-трифторметансульфонил)-13-(N- -2'-TES -β- фенилсеринил) -Δ12,13- изобаккатина III (54)
В соответствии с методикой получения 13-(N-Cbz-2'-TES β- фенил-изосеринил) -Δ12,13- изобаккатина III (53), описанной в примере 49, был получен 7-(O-трифторметансульфонил)- 13-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатин III (54). Это вещество характеризуется такими же физическими данными, полученными при анализе с помощью тонкослойной хроматографии и спектроскопии ЯМР, что и соединение 54, полученное в примере 50.
Пример 95. Получение 13-(N-Cbz-2'-TES -β- фенил-изосеринил)-7- дезокси -7β,8β- метан -Δ12,13- изобаккатина III (88)
В соответствии с методикой получения 13-(N-Cbz-2'-TES -β- фенил-изосеринил) -7-дезокси -7β,8β- метан -Δ12,13- изобаккатина III (55), описанной в примере 51, но при использовании в качестве исходного вещества 7-(O-трифторметансульфонил)- 13-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (87) вместо 7-(O-трифторметансульфонил)-13-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (54) был получен 13-(N-Cbz-2'-TES -β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатин III (88).
Пример 96. Получение 13-( β- фенил-изосеринил)-7-дезокси- -7β,8β- метан -Δ12,13- изобаккатина III (89)
В соответствии с методикой получения 13-(2'-TES -β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатина III (57), описанной в примере 52, но при использовании в качестве исходного вещества 13-(N-Cbz-2'-β- фенил-изосеринил)- 7-дезокси -7β,8β- метан -Δ12,13- изобаккатина III (88) вместо 13-(N-Cbz-2'-TES -β- фенил- изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатина III (55) был получен 13- β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатин III (89).
Пример 97. Получение 13-(N-Boc -β- фенил-изосеринил)-7- дезокси -7β,8β- метан -Δ12,13- изобаккатина III (17)
В соответствии с методикой получения 13-(N-Boc-2'-TES -β- фенил-изосеринил)-7- дезокси -7β,8β- метан -Δ12,13- изобаккатина III (8), описанной в примере 53, но при использовании в качестве исходного вещества 13-( β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатин III (89) вместо 13-(2'-TES -β- фенил- изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатина III (57) был получен 13-(N-Boc -β- фенил-изосеринил)-7- дезокси -7β,8β- метан -Δ12,13- изобаккатин III (17).
Пример 98. Получение 13(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатина III (36)
В соответствии с методикой получения 13-(N-(трет-бутил- aминoкapбoнил)-2'-TES -β- фeнил-изocepинил)-7-дeзoкcи -7β,8β- метан -Δ12,13- изобаккатина III (59), описанной в примере 55, но при использовании в качестве исходного вещества 13-( β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатина III (89) вместо 13-(2'-TES -β- фенил- изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатина III (57) был получен 13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил)-7-дезокси -7β,8β- метан -Δ12,13- изобаккатин III (36).
Пример 99. Получение 13-(N-(Cbz -β- фенил- изосеринил)-7-дезокси Δ6,7-Δ12,13- изобаккатина III (90)
В соответствии с методикой получения 13-(N-Cbz-2'-TES -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (56), описанной в примере 57, но при использовании в качестве исходного вещества 7-(O-трифторметан сульфонил)-13- (N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатина III (87) вместо 7-(O-трифторметан-сульфонил)-13-(N-Cbz-2'-TES -β- фенил-изосеринил) -Δ12,13- изобаккатина III (54) был получен 13-(N-Cbz -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатин III (90).
Пример 100. Получение 13-( β- фенил-изосеринил)-7- дезокси Δ6,7-Δ12,13- изобаккатина III (91)
В соответствии с методикой получения 13-(2'- TES -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (60), описанной в примере 58, но при использовании в качестве исходного вещества 13-(N-Cbz -β- фенил-изосеринил)-7- дезокси -Δ6,7-Δ12,13- изобаккатина III (90) вместо 13-(N-Cbz-2'-TES -β- фенил-изосеринил)-7-дeзoкcи -Δ6,7-Δ12,13- изобаккатина III (56) был получен 13-( β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатин III (91).
Пример 101. Получение 13-(N-Boc -β- фенил-изосеринил)- 7-дезокси -Δ6,7-Δ12,13- изобаккатина III (18)
В соответствии с методикой получения 13-(N-Box-2'-TES -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (61), описанной в примере 59, но при использовании в качестве исходного вещества 13-( β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (91) вместо 13-(2'-TES -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (56) был получен 13-(N-Boc -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (18).
Пример 102. Получение 13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (38)
В соответствии с методикой получения 13-(N-(трет- бутиламинокарбонил)-2'-TES -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (62), описанной в примере 61, но при использовании в качестве исходного вещества 13-( β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (91) вместо 13-(2'-TES -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (60) был получен 13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил)-7-дезокси -Δ6,7-Δ12,13- изобаккатина III (38).
Пример 103. Получение 10-деацетил-13-кето-баккатина III (93)
Реактив Джонса получали растворением диоксида хрома (10,3 г, 0,103 ммоля) в смеси концентрированной серной кислоты (8,7 мл) и воды (30 мл). Раствор 10-деацетилбаккатина III (92,23 мг, 0,043 ммоля) в ацетоне (1,6 мл) охлаждали до -50oC. К этому раствору добавляли реактив Джонса (11 мкл, 0,028 ммоля). Реакционную смесь перемешивали в течение 20 минут и охлаждали с помощью 2-пропанола. Эту смесь распределяли между этилацетатом и 5% раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и выпаривали с образованием 25 мг неочищенного продукта. Этот продукт очищали методом хроматографии на колонке из силикагеля в смесях ацетона и гексана, что позволило получить 10-деацетил- 13-кето-баккатин III (93, 5,3 мг - выход 23%). Было также выделено исходное вещество (12 мг, 52%).
Тонкослойная хроматография (силикагель GF): Rf продукта в смеси ацетона и гексана (50-50) = 0,44; Rf исходного вещества = 0,31).
Спектр протонного ЯМР (CDCl3, TMS) δ 1,19 (с, 3H), 1,14 (с, 3H), 1,47 (с, 3H), 1,47 (д, 1H), 1,75 (с, 3H), 1,85 (м, 1H), 2,10 (с, 3H), 2,20 (с, 3H), 2,60 (м, 1H), 2,68 (д, 1H), 2,97 (д, 1H), 4,02 (д, 1H), 4,15 (д, 1H), 4,26 (д, 1H), 4,30 (м, 1H), 4,35 (д, 1H), 4,95 (двойной дублет, 1H), 5,42 (д, 1H), 5,70 (д, 1H), 7,51 (м, 2H), 7,64 (м, 1H), 8,07 (д, 2H).
Пример 104. Получение 10-деацетил Δ12,13- изобаккатина III (94)
В соответствии с методикой получения 7-TES -Δ12,13- изобаккатина III (3), описанной в примере 2, но при использовании в качестве исходного вещества 10-деацетил-13-кето-баккатина III (93) вместо 13-кето-7-TES-баккатина III (2) был
получен 10-деацетил -Δ12,13- изобаккатин III (94).
Пример 105. Получение 10-деацетил-(O-трифторметан-сульфонил) -Δ12,13- изобаккатина III (95)
В соответствии с методикой получения 10-деацетил-7-(O- трифторметансульфонил)-баккатина III (82), описанной в примере 87, но при использовании в качестве исходного вещества 10-деацетил -Δ12,13- изобаккатина III (94) вместо 10-деацетил-баккатина III (79) был получен 10-деацетил-7-(O-трифторметансульфонил) -Δ12,13- изобаккатин III (95).
Пример 106. Получение 7-(O-трифторметансульфонил)- -Δ12,13- изобаккатина III (85)
В соответствии с методикой получения 7-(O-трифторметан- сульфонил)-баккатина III (83), описанной в примере 88, но при использовании в качестве исходного вещества 10-деацетил-(O- трифторметансульфонил) -Δ12,13- изобаккатина III (95) вместо 10- деацетил-7-(О-трифторметансульфонил)-баккатина III (82) был получен 7-(O-трифторметансульфонил) -Δ12,13- изобаккатин III (85).
Пример 107. Получение 10-деацетил-7-(О-метоксиметил)- баккатина III (96)
В соответствии с методикой получения сложного эфира 7-(О-метоксиметил) -Δ12,13- изобаккатин III-13-(4S,5R)-N-Cbz- 2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (75a, b), описанной в примере 77, но при использовании в качестве исходного вещества 10-деацетил-баккатина III (92) вместо сложного эфира Δ12,13- изобаккатин III-13-(4S,5R)-N- Cbz-2-(2,4-диметоксифенил) 4-фенил-5-оксазолидин-карбоновой кислоты (74a,b) был получен 10-деацетил-7-(O-метоксиметил)- баккатин III (96).
Пример 108. Получение 7-(O-метоксиметил)-баккатина III (97)
В соответствии с методикой получения 7-(O-трифторметан- сульфонил)-баккатина III (83), описанной в примере 88, но при использовании в качестве исходного вещества 10-деацетил-7-(O- метоксиметил)-баккатина III (96) вместо 10-деацетил-7- трифторметансульфонил-баккатина III (82) был получен 7-(O- метоксиметил)-баккатин III (97).
Пример 109. Получение 13-кето-7-(O-метоксиметил)-баккатина III (98)
В соответствии с методикой получения 13-кето-7-TES- баккатина III (2), описанной в примере 1, но при использовании в качестве исходного вещества 7-(O-метоксиметил)-баккатина III (97) вместо 7-TES-баккатина III (1) был получен 13-кето-7-(O- метоксиметил)-баккатин III (98).
Пример 110. Получение 7-(O-метоксиметил) -Δ12,13- изобаккатина III (99)
В соответствии с методикой получения 7-TES -Δ12,13- изобаккатина III (3), описанной в примере 2, но при использовании в качестве исходного вещества 13-кето-7-(O-метоксиметил)-баккатина III (98) вместо 13-кето-7-TES-баккатина III (2) был получен 7-(O- метоксиметил) -Δ12,13- изобаккатин III (99).
Пример 111. Получение сложного эфира 7-(O-метоксиметил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (75a,b)
В соответствии с методикой получения сложного эфира 7- TES -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (5a,b), описанной в примере 3, но при использовании в качестве исходного вещества 7-(O-метоксиметил) -Δ12,13- изобаккатина III (99) вместо 7-TES -Δ12,13- изобаккатина III (3) был получен сложный эфир 7-(O-метоксиметил) -Δ12,13- изобаккатин III-13-(4S,5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (75a,b).
Пример 112. Получение 10-деацетил-7-(O-метилтиометил)- баккатина III (100)
В соответствии с методикой получения сложного эфира 7- (O-метилтиометил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-(трет- бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (71a,b), описанной в примере 73, но при использовании в качестве исходного вещества 10-деацетил- баккатина III (92) вместо сложного эфира Δ12,13- изобаккатин III-13-(4S, 5R)-N-(трет-бутиламинокарбонил) - 2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (33a,b) был получен 10-деацетил-7-(O-метил-тиометил)-баккатин III (100).
Пример 113. Получение 7-(O-метилтиометил)-баккатина III (101)
В соответствии с методикой получения 7-(O-трифторметан сульфонил)-баккатина III (83), описанной в примере 88, но при использовании в качестве исходного вещества 10-деацетил-7-(O- метилтиометил)-баккатина III (100) вместо 10-деацетил-7-(O- трифторметансульфонил)-баккатина III (82) был получен 7-(O- метилтиометил)-баккатин III (101).
Пример 114. Получение 13-кето-7-(O-метилтиометил)-баккатина III (102)
В соответствии с методикой получения 13-кето-7-TES- баккатина III (2), описанной в примере 1, но при использовании в качестве исходного вещества 7-(O-метилтиометил)-баккатина III (101) вместо 7-TES-баккатина III (1) был получен 13-кето-7-(O- метилтиометил)-баккатин III (102).
Пример 115. Получение 7-(O-метилтиометил) -Δ12,13- изобаккатина III (103)
В соответствии с методикой получения 7-TES -Δ12,13- баккатина III (3), описанной в примере 2, но при использовании в качестве исходного вещества 13-кето-7-(O-метилтиометил)- баккатина III (102) вместо 13-кето-7-ТЕS-баккатина III (2) был получен 7-(O-метилтиометил) -Δ12,13- изобаккатин III (103).
Пример 116. Получение сложного эфира 7-(O-метилтиометил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Cbz-2-(2,4 -диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (104 a,b)
В соответствии с методикой получения сложного эфира 7- TES -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Cbz-2-(2,4-диметоксифенил)- 4-фенил-5-оксазолидинкарбоновой кислоты (51a,b), описанной в примере 47, но при использовании в качестве исходного вещества 7-(O-метилтиометил) -Δ12,13- баккатина III (103) вместо 7-TES -Δ12,13- изобаккатина III (3) был получен сложный эфир 7-(O-метилтиометил) -Δ12,13- изобаккатин III-13-(4S,5R)-N-Cbz-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (104a,b).
Пример 117. Получение 7-(O-метилтиометил)-13-(N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатина III (105)
В соответствии с методикой получения 7-(O-метилтиометил)- 13-(N-трет-бутиламинокарбонит -β- фенил-изосеринил) Δ12,13- изобаккатина III (72), описанной в примере 74, но при использовании в качестве исходного вещества сложного эфира 7-(O-метилтиометил) -Δ12,13- изобаккатина III-13-(4S,5R)-N- Cbz-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (104a,b) вместо сложного эфира 7-(O-метилтиометил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N- (трет-бутиламинокарбонил) -2-(2,4-диметоксифенил) -4 -фенил -5 - оксазолидинкарбоновой кислоты (71a, b) был получен 7-(O-метил- тиометил)-13-(N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатин III (105).
Пример 118. Получение 7-(O-метилтиометил)-13-( β- фенил- изосеринил) -Δ12,13- изобаккатина III (106)
В соответствии с методикой получения 7-(O-метоксиметил)- 13-( β- фенил-изосеринил) -Δ12,13- изобаккатина III (65), описанной в примере 65, но при использовании в качестве исходного вещества 7-(O-метилтиометил)-13-(N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатина III (105) вместо 7-(O-метоксиметил)- 13-(N-Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатина III (64) был получен 7-(O-метилтиометил)-13-(β- фенил- изосеринил) Δ12,13- изобаккатин III (106).
Пример 119. Получение 7-(O-метилтиометил)-13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатина III (107)
В соответствии с методикой получения 7-(O-метоксиметил)- 13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатина III (66), описанной в примере 66, но при использовании в качестве исходного вещества 7-(O-метилтиометил)-13-( β- фенил-изосеринил) -Δ12,13- изобаккатина III (106) вместо 7-(O- метоксиметил)-13-( β- фенил-изосеринил) -Δ12,13- изобаккатина III (65) был получен 7-(O-метилтиометил)-13-(N- Boc -β- фенил-изосеринил) Δ12,13- баккатин III (107).
Пример 120. Получение 7-(O-метилтиометил)-13-(Т-(трет- бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатина III (72)
В соответствии с методикой получения 7-(O-метоксиметил) 13-(N-(тpeт-бутилaминoкapбoнил) -β- фенил- изосеринил) -Δ12,13- изобаккатина III (67), описанной в примере 67, но при использовании в качестве исходного вещества 7-(O- метилтиометил)-13-( β- фенил-изосеринил) -Δ12,13- изобаккатина III (106) вместо 7-(O-метоксиметил)-13-( β- фенил-изосеринил) -Δ12,13- изобаккатина III (65) был получен 7-(O-метилтиометил)-13-(N- (трет-бутил-аминокарбонил)-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатин III (72).
Пример 121. Получение 10-деацетил-7-(O-метил)-баккатина III (108)
В соответствии с методикой получения 7-(О-метил)-13-(N- трет-бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (73), описанной в примере 75, но при использовании в качестве исходного вещества 10-деацетил-7-(O- метилтиометил)- баккатина III (100) вместо 7-(O-метилтиометил)-13-(N-трет- бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (72) был получен 10-деацетил-7-(О-метил)-баккатин III (108).
Пример 122. Получение 7-(О-метил)-баккатина III (109)
В соответствии с методикой получения 7-(O-трифторметан- сульфонил)-баккатина III (83), описанной в примере 88, но при использовании 10-деацетил-(O-метил)-баккатина III (108) вместо 10-деацетил-7-(O-трифторметансульфонил)-баккатина III (82) был получен 7-(O-метил)-баккатин III (109).
Пример 123. Получение 7- (О-метил) -баккатина III (109)
В соответствии с методикой получения 7-(О-метил)-13-(N- трет-бутиламинокарбонил -β- фенил-изосеринил) Δ12,13- изобаккатина III (73), описанной в примере 75, но при использовании в качестве исходного вещества 7-(O-метилтиометил)- баккатина III (101) вместо 7-(O-метилтиометил)-13-N-трет-бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (72) был получен 7-(O-метил)-баккатин III (109).
Пример 124. Получение 13-кето-7-(О-метил)-баккатина III (110)
В соответствии с методикой получения 13-кето-7-TES-баккатина III (2), описанной в примере 1, но при использовании 7-(О-метил)- баккатина III (109) вместо 7-TES-баккатина III (1) был получен 13- кето-(O-метил)-баккатин III (110).
Пример 125. Получение 7-(О-метил) -Δ12,13- изобаккатина III (111)
В соответствии с методикой получения 7-TES -Δ12,13- изобаккатина III (3), описанной в примере 2, но при использовании в качестве исходного вещества 13-кето-7-(О-метил)-баккатина III вместо 13-кето-7-TES-баккатина III (2) был
получен 7-(O-метил) -Δ12,13- изобаккатин III (111).
Пример 126. Получение сложного эфира 7-(O-метил) -Δ12,13- изобаккатин III-13-(4S,5R)-N-Cbz-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (112 a,b)
В соответствии с методикой получения сложного эфира 7- TES -Δ12,13- изобаккатин III - 13-(4S,5R)-N-Cbz-2-(2,4-диметоксифенил)- 4-фенил-5-оксазолидинкарбоновой кислоты (52a, b), описанной в примере 47, но при использовании в качестве исходного вещества 7-(O-метил) -Δ12,13- изобаккатина III (111) вместо 7-TES -Δ12,13- изобаккатина III (3) был получен сложный эфир 7-(О-метил) -Δ12,13- изобаккатин III-13-(4S,5R)-N- Cbz-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (112a,b).
Пример 127. Получение 7-(O-метил)-13-(N-Cbz -β- фенил- изосеринил) -Δ12,13- изобаккатина III (113)
В соответствии с методикой получения 7-(O-метилтиометил) -13-(N-трет-бутиламинокарбонил -β- фенил-изосеринил) Δ12,13- изобаккатина III (72), описанной в примере 74, но при использовании в качестве исходного вещества сложного эфира 7- (O-метил) -Δ12,13- изобаккатин III-13-(4S,5R)-N-Cbz-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (112a, b) вместо сложного эфира 7-(O-метилтиометил) -Δ12,13- изобаккатин III-13- (4S, 5R)-N-(трет-бутиламино-карбонил)-2-(2,4-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты (71a, b) был получен 7-(O-метил)-13-(N- Cbz -β- фенил-изосеринил) -Δ12,13- изобаккатин III (113).
Пример 128. Получение 7-(O-метил)-13-( β- фенил-изосеринил) -Δ12,13- изобаккатина III (114)
В соответствии с методикой получения 7-(O-метоксиметил) 13-( β- фенил-изосеринил) -Δ12,13- изобаккатина III (65), описанной в примере 65, но при использовании в качестве исходного вещества 7-(O-метил)-13-(N-Cbz -β- фенил-изосеринил) Δ12,13- изобаккатина III (113) вместо 7-(О-метоксифенил)-13- (N-Cbz-фенил-изосеринил) -Δ12,13- изобаккатина III (64) был получен 7-(O-метил)-13-( β- фенил-изосеринил) -Δ12,13- изобаккатин III (114).
Пример 129. Получение 7-(O-метил)-13-(N-Boc -β- фенил- изосеринил) -Δ12,13- изобаккатина III (115)
В соответствии с процедурой получения 7-(O-метоксиметил) 13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатина III (66), описанной в примере 66, но при использовании в качестве исходного вещества 7-(O-метил)-13-( β- фенил-изосеринил) Δ12,13- изобаккатина III (114) вместо 7-(O-метоксиметил)-13- ( β- фенил-изосеринил) -Δ12,13- изобаккатина III (65) был получен 7-(O-метил)-13-(N-Boc -β- фенил-изосеринил)- -Δ12,13- изобаккатин III (115).
Пример 130. Получение 7-(O-метил)-13-(N-трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатина III (73)
В соответствии с методикой получения 7-(O-метоксиметил)- 13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатина III (67), описанной в примере 67, но при использовании в качестве исходного вещества 7-(О-метил)-13- β- фенил-изосеринил) -Δ12,13- изобаккатина III (114) вместо 7-(O-метоксиметил)-13-( β- фенил-изосеринил) -Δ12,13- изобаккатина III (65) был получен 7-(О-метил)-13-(N-трет- бутиламинoкapбoнил)-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатин III (73).
Пример 131. Получение 10-деацетил-7-(O-метоксиметил)- Δ12,13- изобаккатина III (116)
В соответствии с методикой получения сложного эфира 7- (O-метоксиметил) -Δ12,13- изобаккатин III-13-(4S,5R)-N-Cbz-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (75 a, b), описанной в примере 77, но при использовании в качестве исходного вещества 10-деацетил-баккатина III (94) вместо сложного эфира Δ12,13- изобаккатин III-13- (4S,5R)-N-Cbz-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (74 a,b) был получен 10-деацетил-7-(O-метоксиметил) -Δ12,13- изобаккатин III (116).
Пример 132. Получение 7-(O-метоксиметил) -Δ12,13- изобаккатина III (99)
В соответствии с методикой получения 7-(O-трифторметан- сульфонил)-баккатина III (83), описанной в примере 88, но при использовании в качестве исходного вещества 10-деацетил- 7-(O-метоксиметил) -Δ12,13- изобаккатина III (116) вместо 10- деацетил-7-трифторметансульфонил-баккатина III (82) был получен 7-(O-метоксиметил) -Δ12,13- изобаккатин III (99).
Пример 133. Получение 10-деацетил-7-(O-метилтиометил) Δ12,13- изобаккатина III (117)
В соответствии с методикой получения сложного эфира 7-(O-метилтиометил) -Δ12,13- изобаккатин III-13-(4S,5R)-N- (трет-бутиламинокарбонил)-2-(2, 4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (71 a,b), описанной в при мере 73, но при использовании в качестве исходного вещества 10-деацетил -Δ12,13- изобаккатина III (94) вместо сложного эфира Δ12,13- изобаккатин III-13-(4S, 5R)-N-(трет- бутиламинокарбонил)-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (33 a,b) был получен 10-деацетил-7-(O-метилтиометил) -Δ12,13- изобаккатин III (117).
Пример 134. Получение 7-(O-метилтиометил) -Δ12,13- изобаккатина III (103)
В соответствии с методикой получения 7-(O-трифторметан- сульфонил)-баккатина III (83), но при использовании в качестве исходного вещества 10-деацетил-7-(O-метилтиометил) Δ12,13- изобаккатина III (117) вместо 10-деацетил-7-трифторметансульфонилбаккатина III (82) был получен 7-(O-метилтио- метил) -Δ12,13- изобаккатин III (103).
Пример 135. Получение 7-(O-метил) -Δ12,13- изобаккатина III (111)
В соответствии с методикой получения (O-метил)-13-(N- трет-бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (73), описанной в примере 75, но при использовании в качестве исходного вещества 7-(O-метилтиометил) Δ12,13- изобаккатина III (103) вместо 7-(О-метилтиометил)-13- (N-трет-бутиламинокарбонил -β- фенил-изосеринил) -Δ12,13- изобаккатина III (72) был получен 7-(O-метил) -Δ12,13- изобаккатин III (111).
Пример 136
Часть А. Оксазолидинсодержащую кислоту (2,60 г, 9,73 ммоля) помещали в круглодонную колбу и суспендировали в толуоле (20 мл). При комнатной температуре добавляли 1,3-дициклогексилкарбодиимид (960 мг, 5,65 ммоля) и перемешивали в течение 20 минут. Сначала добавляли 7-2-(3-метилбу-тил)диметил-силилокси-баккатин III (1,0 г, 1,40 ммоля) в толуоле (15 мл), а потом каталитическое количество 4-пирролидинпиридина. Эту смесь перемешивали при комнатной температуре. Через 1 час с помощью тонкослойной хроматографии было установлено, что реакция закончилась. Реакционную смесь охлаждали 20% раствором NaHCO3, (50 мл) и перемешивали при комнатной температуре в течение 2 часов. Затем ее фильтровали на крупнозернистой фритте с целью удаления дициклогексилмочевины и разделения фаз. Промывочные воды вновь экстрагировали метил-трет-бутиловым эфиром (35 мл). Соединенные органические экстракты промывали 50% раствором NaHCO3 (50 мл), рассолом (50 мл) и сушили над Na2SO4. Затем их концентрировали с образованием твердого вещества и очищали хроматографией на колонке с использованием смеси циклогексанов и этилацетата с соотношением 3:1, в результате чего был получен связанный сложный эфир 118 в виде белого твердого вещества.
Часть B. Связанный сложный эфир (1,16 г, 1,2 ммоля) помещали в круглодонную колбу и растворяли в метиловом спирте (11 мл). При комнатной температуре добавляли 1 н. раствор HCl (1,25 мл, 1,25 ммоля). Полученную смесь нагревали до температуры кипения с обратным холодильником. По истечении 2 часов кипения с обратным холодильником методом тонкослойной хроматографии было установлено, что реакция закончилась. Реакционную смесь охлаждали до комнатной температуры, добавляли водный раствор NaHCO3 (535 мг/10 мл воды) и перемешивали при комнатной температуре в течение 2 часов. Метиловый спирт удаляли в условиях вакуума, после чего эту смесь экстрагировали с помощью EtOAc (2 x 25 мл). Органические экстракты сушили над Na2SO4 и концентрировали до образования твердого вещества. С помощью тонкослойной хроматографии было установлено, что твердое вещество представляет собой смесь О-бензиловой соли и таксола. Полученное твердое вещество растворяли в небольшом количестве EtOAc, добавляли 2 капли триэтиламина и оставляли на ночь. Через 16 часов миграция прекращалась, и неочищенное твердое вещество очищали методом хроматографии на колонке с использованием смеси этилацетата и циклогексанов с соотношением 1,5:1, в результате чего был получен таксол.
Пример 137
В соответствии с методикой, описанной в примере 136, но при использовании 7-2-(3-метилбутил)диметилсилилокси Δ12,13- изобаккатина III вместо 7-2-(3-метилбутил)диметил-силилокси-баккатина III был получен Δ12,13- изотаксол.
Пример 138. Получение 7-[.0-2-(З-метилбутил))диметилсилил)-таксола (119)
Раствор 1,03 г продукта, полученного в соответствии с примером 136, часть A (соединение 118), в 12 мл AcOH и 1,5 мл воды нагревали при температуре 80oC в течение одного часа. Этот раствор охлаждали, а требуемый продукт выделяли методом хроматографии после выделения с помощью этилацетата, в результате чего было получено 680 мг соединения 119.
Способ получения A. 2'-{ [2,2,2-трихлорэтил)окси] карбонил} -Δ12,13- изотаксол был получен в соответствии со способом получения 2'{[2,2,2- трихлорэтил)окси] карбонил} таксола (Magri N.F., Kigston D. G.I.J,Org.Chem., 1986, 51, 797).
Способ получения B. 7-Метансульфонат 2'-[{(2,2,2-трихлор- этил)окси} карбонил] -Δ12,13- изотаксола
Метансульфонилхлорид (1,2 эквивалента) по каплям добавляли к раствору 2'-[{ (2,2, 2-трихлорэтид)окси}карбонил] Δ12,13- изотаксола (1 эквивалент) и пиридина (5 эквивалентов) в CH2Cl2, который перемешивали при температуре ледяной бани. Реакционную смесь оставляли для нагревания и продолжали перемешивать до тех пор, пока с помощью тонкослойной хроматографии не было установлено, что реакция закончилась. Реакционную смесь охлаждали смесью воды со льдом и экстрагировали с помощью CH2Cl2. Полученные экстракты последовательно промывали разбавленным водным раствором кислоты, разбавленным водным раствором NaHCO3 и водой, а потом сушили, фильтровали и концентрировали с получением неочищенного продукта реакции. В результате хроматографирования неочищенного продукта не силикагеле было получено указанное в заголовке чистое соединение.
Способ получения C. 2'-[{(2,2,2-трихлорэтил)окси}карбонил]- 7-дeзoкcи -7α- хлop -Δ12,13- изотаксол
Раствор 7-метансульфоната 2-[{ (2,2,2-трихлорэтил)окси} карбонил] -Δ12,13- изотаксола (1 эквивалент) в N,N- диметилформамиде перемешивали с хлоридом калия (10 эквивалентов). В реакционную смесь вводили катализатор переноса фаз и нагревали с целью увеличения скорости реакции. За ходом реакции следили с помощью тонкослойной хроматографии. В реакционную смесь добавляли воду и экстрагировали с помощью CH2Cl2. Органические экстракты сушили, фильтровали и концентрировали, а неочищенный остаток продукта реакции хроматографировали
на силикагеле, что позволило получить указанное в заголовке чистое соединение.
Способ получения D. Получение 7-дезокси -7α- хлор -Δ12,13- изотаксола
Раствор 2'-[{ (2,2,2-трихлорэтил)окси} карбонил] -7-дезокси -7α- хлор -Δ12,13- изотаксола в смеси метанола и уксусной кислоты с соотношением 9:1 перемешивали с активированным металлическим цинком при комнатной температуре. Через 90 минут из реакционной смеси фильтрованием удаляли цинк и концентрировали фильтрат при пониженном давлении. Остаток растворяли в CH2Cl2, и полученный раствор промывали 0,1 н. водным раствором HCl, 5% водным раствором NaHCO3 и водой. Водный слой еще раз экстрагировали с помощью CH2Cl2. Соединенные органические экстракты сушили (Na2SO4), фильтровали и концентрировали с образованием остатка. Этот остаток очищали хроматографией на силикагеле, что позволило получить указанное в заголовке соединение в виде твердого вещества.
Способ получения E. 7-Дезокси -7β- хлор -Δ12,13- изотаксол
Указанное в заголовке соединение было получено в соответствии с методиками, описанными в примерах A, B, C, D и E, но при использовании в качестве исходного вещества 2'-[{ (2,2,2- трихлорэтил)окси}карбонил]-7-эпи -Δ12,13- изотаксола.
В соответствии с методиками, описанными в примерах 15 и 11, но при использовании солей соответствующих металлов, таких, как бромид натрия или калия, иодид натрия или калия и азид натрия или калия, были получены следующие соединения:
7-дезокси -7α- бром -Δ12,13- изотаксол;
7-дезокси -7β- бром -Δ12,13- изотаксол;
7-дезокси -7α- иод -Δ12,13- изотаксол;
7-дезокси -7β- иод -Δ12,13- изотаксол;
7-дезокси -7α- азид -Δ12,13- изотаксол; и
7-дезокси -7β- азид -Δ12,13- изотаксол;
Соединения формулы XII, в которой R6 представляет H, R8 - метил, а R7 - атом хлора, брома или иода, можно также получить в результате взаимодействия должным образом защищенного промежуточного продукта (например, формулы 1, в которой R1 = -C6H5; R2 =-NHC(O)C6H5; R3 = H; R4 = -OTROC; R5 = H, R30 =-OCOCH3 и X7 = OH) с (C6H5)3P/X2; (C6H5)3 P/CX4 или (C6H5O)3P/X2), например, в соответствии с многочисленными примерами и экспериментальными условиями, описанными в работе Кастро Б.P., Organic Reactions, 1983, 29, стр. 1-162.
Производные 7-дезокси-7-галоген -Δ12,13- изотаксолов, в которых 2'-гидроксильная группа этерифицирована, можно получить непосредственно из требуемого 7-дезокси-7-галоген- Δ12,13- изотаксола в соответствии со способами, описанными в работе Мэтью А.Е. и др., J.Med.Chem., 1992, 35, 145; в патентах США N 4960790, N4942184 и N 5059699.
В соответствии с общими методиками, описанными Мютью и др. (см., например, патенты США N 4960790, 4924184 и 5059699), но при использовании соответствующего аналога 7-дезокси-7-галоген -Δ12,13- изотаксола можно получить следующие соединения:
2'-сукцинил-7-дезокси-7-фтор -Δ12,13- изотаксол;
Формиат 2'-( β- аланил)-7-дезокси-7-фтор -Δ12,13- изотаксола;
2'-глутарил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-[-C(O)(CH3)3C(O)NH(CH2)3N (CH3)2]-7-дезокси-7-фтор Δ12,13- изотаксол;
2'-( β- сульфопропионил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(2-сульфоэтиламино)сукцинил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(3-сульфопропиламино)сукцинил-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(триэтилсилил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(N,N-диэтиламинопропионил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(N,N-димeтилглицил)-7-дeзoкcи-7-фтop -Δ12,13- изотаксол;
2'-(глицил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-aлaнил)-7-дeзoкcи-7-фтop -Δ12,13- изотаксол;
2'-(L-лейцил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-изолейцил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-валил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-фенилаланил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-пролил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-лизил)-7-дeзoкcи-7-фтoр -Δ12,13- изотаксол;
2'-(L-глутамил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
2'-(L-аргинил)-7-дезокси-7-фтор -Δ12,13- изотаксол;
7-дeзoкcи-7-фтoр -Δ12,13- изотаксотир;
2'-cукuинил-7-дeзoкcи-7-xлoр -Δ12,13- изотаксол;
Формиат 2'-( β- аланил)-7-дезокси-7-хлор -Δ12,13- изотаксола;
2'-глутарил-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3N (CH3)2] -7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-( β- сульфопропионил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(3-сульфопропиламидо) сукцинил-7-дезокси-7- хлор -Δ12,13- изотаксол;
2'-(триэтилсилил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(N,N-диэтилaминoпpoпиoнил)-7-дeзoкcи-7-xлop -Δ12,13- изотаксол;
2'-(N,N-диметилглицил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(глицил)-7-дeзoкcи-7-xлoр -Δ12,13- изотаксол;
2'-(L-аланил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(L-лейцил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(L-изолейцил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(L-валил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(L-фенилаланил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(L-пролил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(L-лизил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(L-глутамил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
2'-(L-аргинил)-7-дезокси-7-хлор -Δ12,13- изотаксол;
7-дeзoкcи-7-xлop -Δ12,13- изотаксотир;
2'-сукцинил-7-дезокси-7-бром -Δ12,13- изотаксол;
Формиат 2'-( β- алaнил)-7-дeзoкcи-7-бpoм -Δ12,13- изотаксола;
2'-глутарил-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-C-C(O)CH2)3C(O)NH(CH2)3N (CH3)2]-7-дезокси-7-бром Δ12,13- изотаксол;
2'-( β- сульфопропионил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(триэтилсилил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(N,N-диэтиламинопропионил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(N,N-диметилглицил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(глицил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(L-aлaнил)-7-дeзoкcи-7-бpом -Δ12,13- изотаксол;
2'-(L-лейцил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(L-изолейцил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(L-вaлил)-7-дeзoкcи-7-бpoм -Δ12,13- изотаксол;
2'-(L-фeнилaлaнил)-7-дeзoкcи-7-бpoм -Δ12,13- изотаксол;
2'-(L-пpoлил)-7-дeзoкcи-7-бpoм -Δ12,13- изотаксол;
2'-(L-лизил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(L-глутамил)-7-дезокси-7-бром -Δ12,13- изотаксол;
2'-(L-аргинил)-7-дезокси-7-бром -Δ12,13- изотаксол;
7-дезокси-7-бром -Δ12,13- изотаксотир;
2'-сукцинил-7-дезокси-7-иод -Δ12,13- изотаксол;
Формиат 2'-( β-аланил)-7-дезокси-7-иод -Δ12,13- изотаксола;
2'-глутapил-7-дeзoкcи-7-иoд -Δ12,13- изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3 N(CH3)2]-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-( β- сульфопропионил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(триэтилсилил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(N,N-диэтилaминoпpoпиoнил)-7-дeзoкcи-7-иoд -Δ12,13- изотаксол;
2'-(N,N-диметилглицил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(глицил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(L-аланил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(L-лейцил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(L-изолейцил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(L-вaлил)-7-дeзoкcи-7-иoд -Δ12,13- изотаксол;
2'-(L-фенилаланил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(L-пролил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(L-лизил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(L-глутамил)-7-дезокси-7-иод -Δ12,13- изотаксол;
2'-(L-аргинил)-7-дезокси-7-иод -Δ12,13- изотаксол;
7-дезокси-7-иод -Δ12,13- изотаксотир;
и их фармацевтически приемлемые соли, если данное соединение содержит кислотную или основную функциональную группу.
Пример 138. Получение эмульсии N-дебензоил-N-(трет- бутил)-аминокарбонил-7-дезокси -7β,8β- метан-12,13-изотаксола
Отвешивали 14,5 мг пробу N-дебензоил-N-(трет-бутил) амино-карбонил-7-дезокси -7β,8β- метан-12,13-изотаксола (соединение 36) и добавляли в 0,5 г воды при ультразвуковой обработке. При перемешивании в течение четырех часов добавляли аликвоту 0,5 г масла ("миглиол 810"). К смеси масла и лекарственного средства добавляли аликвоту водной фазы, содержащую фосфолипид (яичный лецитин) и глицерин, в результате чего была получена 20% масляная эмульсия, содержащая 12,5 мг/г фосфолипида, 22,5 мг/г глицерина и 6 мг/г лекарственного средства. Эту смесь предварительно гомогенизировали путем ультразвуковой обработки до окончательного эмульгирования с помощью "эмульсифлекса ВЗ". В результате этого была получена физически стабильная эмульсия со сред ним размером частиц 240 нм (измерение производилось методом рассеяния света).
C-13 химический сдвиг в CDCl3: 202.44, 173.32, 170.01, 167.72, 140.47, 138.82, 134.48, 132.73, 130.98, 129.99, 129.77, 129.48, 129.11, 127/85. 84.98, 82.08, 79.47, 75.53, 74.01, 73.17, 59.44, 55.69, 47.51, 44.04, 29.08, 28.97, 27.47, 23.78, 23.46, 21.67, 20.87, 15.14, 14.98, 10.94, 9.57, 0.0, -2.36.
Масса : найдено 982, 4428; рассчитано 982, 4409
Пример 139. Получение эмульсии N-дебензоил-N-(трет-бутил)- аминокарбонил-7-дезокси -Δ6,7- 12,13-изотаксола (соединение 38)
Отвешивали 70 мг пробу N-дебензоил-N-(трет-бутил) амино- карбонил-7-дезокси -Δ6,7- 12,13-изотаксола (соединение 38) и добавляли к 1 г воды в процессе выполнения ультразвуковой обработки. При перемешивании в течение 36 часов добавляли аликвоту 4,0 г масла ("миглиол 810"). Смесь масла, воды и лекарственного средства центрифугировали, масляную фазу удаляли, анализировали и делили на три разные аликвоты, которые затем разбавляли маслом до концентрации 3,4, 6,9 и 13,8 мг лекарственного средства/мг масла. Аликвоты водной фазы, содержащие фосфолипид (яичный лецитин) и глицерин затем добавляли к смесям масла и лекарственного средства, в результате чего была получена 20% масляная эмульсия, содержащая 12,5 мг/г фосфолипида, 22,5 мг/г глицерина и 0,7, 1,4 или 2,8 мг/г лекарственного средства. Эту смесь предварительно гомогенизировали путем ультразвуковой обработки до окончательного эмульгирования с помощью "эмульсифлекса ВЗ". В результате этого были получены физически стабильные эмульсии со средним размером частиц 200-215 нм (измерение производилось методом рассеяния света).
Способы получения 7-эфиров -Δ12,13- изотаксола
Способ получения 1. Получение сложного эфира 7-(O-метил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-диметокси- фенил)-4-фенил-5-оксазолидинкарбоновой кислоты
Гидрид натрия (55% дисперсия в минеральном масле, 43 мг, 1 ммоль) трижды промывали безводным н-гексаном путем декантирования. При температуре 0oC добавляли раствор сложного эфира -Δ12,13- изобаккатин III-13-(4S,5R)-N-Boc-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (10а, 1 ммоль) в безводном N, N-диметилформамиде (6 мл) и полученную смесь перемешивали в течение 39 минут при комнатной температуре. Полученную смесь обрабатывали метилиодидом (82 мкл, 1,3 ммоля) и перемешивали еще в течение 60 минут. Реакционную смесь затем охлаждали 5% водным раствором хлорида аммония и экстрагировали простым эфиром. Органический слой сушили (MgSO4), а растворитель выпаривали в условиях вакуума. Остаток очищали хроматографией на силикагеле, в результате чего был получен сложный эфир 7-(O-метил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N- Boc-2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты.
См. : Banfi, L., Bernardi A.,Columbo L.,Gennari. C., Scolastico C., J. Org. Chem., 1984, 49, 3784.
Способ получения 2. Получение сложного эфира 7-(O-метил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-диметоксифенил) -4-фенил-5-оксазолилинкарбоновой кислоты
Сложный эфир -Δ12,13- изобаккатин III-(4S,5R)-N-Boc-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (10а, 1 ммоль), метилиодид (1,2 ммоля), тетрафторборат серебра (1,2 ммоля) и карбонат серебра (2 ммоля) добавляли к ацетонитрилу (5 мл), после чего полученную смесь перемешивали в течение 48 часов при комнатной температуре. Реакционную смесь затем разбавляли этилацетатом (20 мл) и фильтровали. Фильтрат экстрагировали водой, 5% водным раствором бикарбоната натрия и сушили (MgSO4), а растворитель выпаривали в вакууме. Остаток очищали хроматографией на силикагеле, в результате чего был получен сложный эфир 7-(O-метил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc- 2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновй кислоты.
См.:Bhatia S.K., Hajdu J., Tetrahedron Lett., 1987, 28,271.
Способ получения 3. Получение сложного эфира 7-(O-метил)- -Δ12,13- изобаккатин III-13-(4S, 5R)-Т-Boc-2-(2,4-димeтoкcифeнил)-4- фенил-5-оксазолидинкарбоновой кислоты
Сложный эфир -Δ12,13- изобаккатин III-13-(4S,5R)-N-Boc- 2-(2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (10а, 1 ммоль), 2,6-ди-трет-бутилпиридин (2,3 ммоля) и цианид ртути (5,8 мг, 0,023 ммоля) растворяли в метиленхлориде (4,5 мл), после чего этот раствор обрабатывали метилтрифторметансульфонатом (0,24 мл, 2,2 ммоля). Полученный раствор нагревали с обратным холодильником в течение 50 часов, а потом обрабатывали метанолом (0,2 мл). Реакционную смесь выпаривали в вакууме, а остаток очищали хроматографией на силикагеле с образованием сложного эфира 7-(O-метил) -Δ12,13- изобаккатин III-13-(4S,5R)-N-Boc-2-(2,2-диметоксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты.
См.: J.Carbohyd.Chem., 1986, 5, 115.
Удаление защитных групп метиловых эфиров
Способ получения 4. Получение 7-(O-метил)-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатина III (41)
Сложный эфир 7-(O-метил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2, 4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты (21 ммоль) перемешивали при комнатной температуре в атмосфере азота в смеси уксусной кислоты и воды (80-20) (4 мл). Реакционную смесь анализировали методом тонкослойной хроматографии, результаты которой позволили установить, что реакция закончилась через 24 часа. Реакционную смесь затем сушили вымораживанием. Неочищенный продукт очищали хроматографией на силикагеле, что позволило получить 7-(O-метил)-13-(N-Вос -β- фенил-изосеринил) -Δ12,13- изобаккатин III.
Синтез аллилового эфира
Способ получения 5. Получение сложного эфира 7-(O-аллил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты
Раствор сложного эфира -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2, 4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты (10а, 1 ммоль) в метиленхлориде обрабатывали аллил-трихлорацетимидатом (2 ммоля) и трифторметансульфокислотой (25 мкл), после чего реакционную смесь перемешивали 48 часов при комнатной температуре. Реакционную смесь фильтровали, а фильтрат промывали 5% водным раствором бикарбоната натрия. Органический слой сушили (MgSO4), а растворитель выпаривали в вакууме. Остаток очищали хроматографией на силикагеле, что позволило получить сложный эфир 7-(O-аллил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2- (2,4-диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты.
См. : Wessel Н-Р., lverson Т., Bundle D.R., J. Chem. Soc. Perkin Trans. 1., 1985, 2247.
Способ получения 6. Получение сложного эфира 7-(O-аллил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты
Гидрид натрия (55% дисперсия в минеральном масле, 43 мг, 1 ммоль) трижды промывали безводным н-гексаном путем декантирования. При температуре 0oC добавляли раствор сложного эфира -Δ12,13- изобаккатин III-13-(4S,5R)-N-Boc-2-(2,4-диметоксифенил)-4-фенил- 5-оксазолидинкарбоновой кислоты (10а, 1 ммоль) в безводном N,N- диметилформамиде (6 мл) и полученную смесь перемешивали при комнатной температуре в течение 30 минут. Полученную смесь обрабатывали аллил-бромидом (1,3 ммоля) и перемешивали еще в течение 60 минут. Реакционную смесь охлаждали 5% водным раствором хлорида аммония и экстрагировали простым эфиром. Органический слой сушили (MgSO4), а растворитель выпаривали в вакууме. Остаток очищали хроматографией на силикагеле, что позволило получить сложный эфир 7-(O-аллил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2, 4-диметоксифенил)-4-фенил-5- оксазолидинкарбоновой кислоты.
См. : Kloosterman M., de Nijs M.P., van Boom J. H.,J. Carbohyd. Chem., 1986, 2247.
Способ получения 7. Получение сложного эфира 7-(O-аллил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-димeтoксифенил)-4- фенил-5-оксазолидинкарбоновой кислоты
Трис(дибензилидинацетон)дипалладий (0,025 ммоля) и 1,4- (бис)(бифенилфосфин) бутан (0,1 ммоля) добавляли к тетрагидрофурану (2 мл) в атмосфере аргона. Этот раствор обрабатывали сложным эфиром -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Bocс-2-(2,4-диметоксифенил)- 4-фенил-5-оксазолидинкарбоновой кислоты (10а, 1 ммоль) и аллилэтилкарбонатом в тетрагидрофуране (2 мл). После перемешивания в течение 4 часов при температуре 65oC растворитель выпаривали в вакууме. Остаток очищали хроматографией на силикагеле, что позволило получить сложный эфир 7-(O- аллил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4- диметоксифенил)-4-фенил-5-оксазолидинкарбоновой кислоты.
См.:Lakhmiri R., Lhoste P., Sinou D., Tetrahedron Lett., 1989, 30, 4669.
Удаление защитной группы сложного эфира 7-(O-аллил) -Δ12,13- изобаккатин III-13-(4S, 5R)-N-Boc-2-(2,4-диметокси фенил)-4- фенил-5-оксазолидинкарбоновой кислоты
У защищенных аллиловых эфиров можно удалить защитную группу с образованием 7-(O-аллил)-13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатина III аналогично тому, как была удалена защитная группа из 7-(O-метил)-13-(N-Boc -β- фенил- изосеринил) Δ12,13- изобаккатина III в способе получения 4.
В соответствии с методикой, описанной в работе Carboni J.M., Farina V., Srinivasa R., Hauck S.I., Horowits S.B., Ringel I., J. Med. Chem., 1993, 36. 513, но при использовании исходного вещества по примерам 5, 7, 26 и Δ12,13- изотаксола были получены следующие 7-эфирные аналоги
-Δ12,13- изотаксола:
7-ацетил -Δ12,13- изотаксол;
7-ацетил -Δ12,13- изотаксотир;
7,10-диацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-ацетил -Δ12,13- изотаксол;
7-пропионил -Δ12,13- изотаксол;
7-пропионил -Δ12,13- изотаксотир;
7-пропионил-N-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-пропионил -Δ12,13- изотаксол;
7-бутирил -Δ12,13- изотаксол;
7-бутирил -Δ12,13- изотаксотир;
7-бутирил-10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-бутирил -Δ12,13- изотаксол;
7-бензоил -Δ12,13- изотаксол;
7-бензоил -Δ12,13- изотаксотир;
7-бензоил-10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-бензоил -Δ12,13- изотаксол;
7-(4-метилбензоил) -Δ12,13- изотаксол;
7-(4-метилбензоил) -Δ12,13- изотаксотир;
7-(4-метилбензоил)-10-ацетил Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(4-метилбензоил) Δ12,13- изотаксол.
В соответствии с методикой, описанной в работе Denis J-N., Greene А.Е., Guenard D., Gueritte-Vogelein F., Mangatal L., Potier P., J. Am. Chem., Soc. , 1988, 110, 5917, но при использовании исходного вещества по примерам 5, 7, 26 и Δ12,13- изотаксола были получены следующие 7-силилэфирные аналоги -Δ12,13- изотаксола:
7-(O-триметилсилил -Δ12,13- изотаксол;
7-(O-триметилсилил) -Δ12,13- изотаксотир;
7-(O-триметилсилил)-10-диацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-триметилсилил) -Δ12,13- изотаксол;
7-(O-триэтилсилил) -Δ12,13- изотаксол;
7-(O-триэтилсилил) -Δ12,13- изотаксотир;
7-(O-тpиэтилcилил)-10-диaцeтил Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-триэтилсилил) -Δ12,13- изотаксол;
7-(O-триизопропилсилил) -Δ12,13- изотаксол;
7-(O-триизопропилсилил) -Δ12,13- изотаксотир;
7-(O-триизопропилсилил)-10-диацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-триизопропилсилил) -Δ12,13- изотаксол;
7-(O-трет-бутилдиметилсилил) -Δ12,13- изотаксол;
7-(O-трет-бутилдиметилсилил) -Δ12,13- изотаксотир;
7-(O-трет-бутилдиметилсилил)-10-диацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-трет-бутилдиметилсилил) -Δ12,13- изотаксол;
7-(O-этоксиметил)-13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатин III; и
7-(О-этоксиметил)-13-(N-трет-бутиламинокарбонил) -β- фенил- изосеринил) Δ12,13- изобаккатин III.
В соответствии с методикой, описанной в работе Denis J-N., Greene A.F., Guenard D., Gueritte-Vogelein F., Mangatal L., Potier P., J. Am. Chem. Soc., 1988, 110, 5917, но при использовании исходного вещества по примерам 84 и 85 и Δ12,13- 10-DAD-изотаксола 94 были получены следующие 7-силилэфирные аналоги Δ12,13- изотаксола:
7-[O-2-(3-метилбутил)диметилсилил] -Δ12,13- изотаксол;
7-[O-2-(3-мeтилбутил)димeтилcилил] -Δ12,13- изотаксотир;
7-[O-2-(3-метилбутил)диметилсилил]-10-диацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-[O-2-(3-метил- бутил)-диметил-силил1] -Δ12,13- изотаксол;
7-(O-три-н-бутилсилил) -Δ12,13- изотаксол;
7-(O-три-н-бутилсилил) -Δ12,13- изотаксотир;
7-(O-три-н-бутилсилил)-10-диацетил -Δ12,13- изотаксотир;
N-дeбeнзoил-N-тpeт-бутилaминoкapбoнил-7-(О-три-н-бутил- силил) -Δ12,13- изотаксол;
7-(O-циклогексилдиметилсилил) -Δ12,13- изотаксол;
7-(O-циклогексилдиметилсилил) -Δ12,13- изотаксотир;
7-(O-циклогексилдиметилсилил)-10-диацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О- циклогексил-диметилсилил) -Δ12,13- -изотаксол;
7-(O-i-пропилдиэтилсилил) -Δ12,13- изотаксол;
7-(0-i-пропилдиэтилсилил) -Δ12,13- изотаксотир;
7-(O-i-пропилдиэтилсилил)-10-диацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-i-пропилдиэтилсилил) -Δ12,13- изотаксол;
7-(O-циклогептилдиметил) -Δ12,13- изотаксол;
7-(O-циклогептилдиметилсилил) -Δ12,13- изотаксотир;
7-(O-циклогептилдиметилсилил)-10-диацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-циклогептил- диметилсилил) -Δ12,13- изотаксол.
В соответствии с методикой, описанной в работе Denis J-N., Greene А.Е., Guenard D., Gueritte-Vogelein F., Mangatal L., Potier P., J. Am. Chem. Soc., 1988, 110, 5917, но при использовании исходного вещества по приме рам 84 и 85 и 10-деацетилбаккатин-изотаксола 94 были получены следующие 7-силилэфирные аналоги таксола:
7-[O-2-(3-метилбутил)диметилсилил]-таксол;
7-[O-2-(3-метилбутил)диметилсилил]-таксотир;
7-[O-2-(3-метилбутил)диметилсилил]-10-диацетил-таксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-[O-2-(3-метил- бутил)-диметилсилил]-таксол;
7-(О-три-н-бутилсилил)-таксол;
7-(О-три-н-бутилсилил)-таксотир;
7-(О-три-н-бутилсилил)-10-диацетил-таксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-трет-н-бутил-силил)-таксол;
7-(О-циклогексилдиметилсилил)-таксол;
7-(O-циклогексилдиметилсилил)-таксотир;
7-(О-циклогексилдиметил)-10-диацетил-таксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-циклогексилдиметилсилил) таксол;
7-(O-i-пропилдиэтилсилил)таксол;
7-(O-i-пропилдиэтилсилил)таксотир;
7-(O-i-пропилдиэтилсилил)-10-диацетил-таксотир;
N-дебензоил-трет-бутиламинокарбонил-7-(О-i-пропилдиэтил-силил)-таксол;
7-(О-циклогептилдиметилсилил)таксол;
7-(О-циклогептилдиметилсилил)таксотир;
7-(О-циклогептилдиметилсилил)-10-диацетил-таксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О- циклогептилдиметилсилил)-таксол.
В соответствии с процедурой, описанной в работе Magri N.F., Kingston D. G. I. , Jitrangsri С., Piccariello Т., J. Org. Chem., 1986, 51, 3239, но при использовании исходного вещества по примерам 5, 7, 26 и Δ12,13- изотаксола были получены 7-карбонатные аналоги Δ12,13- изотаксола:
7-(O-метилкарбонат) -Δ12,13- изотаксол;
7-(O-метилкарбонат) -Δ12,13- изотаксотир;
7-(O-метилкарбонат)-10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-метилкарбонат) -Δ12,13- изотаксол;
7-(O-этилкарбонат) -Δ12,13- изотаксол;
7-(O-этилкарбонат) -Δ12,13- изотаксотир;
7-(O-этилкарбонат)-10 Δ12,13- изотаксотир;
N-дебензил-N-трет-бутиламинокарбонил-7-(О-этилкарбонат) -Δ12,13- изотаксол;
7-(O-пропилкарбонат) -Δ12,13- изотаксол;
7-(O-пропилкарбонат) -Δ12,13- изотаксотир;
7-(O-пропилкарбонат)-10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-пропилкарбонат) -Δ12,13- изотаксол;
7-[O-(2,2,2-трихлорэтил)карбонат] -Δ12,13- изотаксол;
7-[O-(2,2,2-трихлорэтил)карбонат] -Δ12,13- изотаксотир;
7-[O-(2,2,2-трихлорэтил)карбонат]-10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-[O-(2,2,2-трихлорэтил)- карбонат] -Δ12,13- изотаксол;
7-[O-(2,2-дихлорэтил)карбонат] -Δ12,13- изотаксол;
7-[O-(2,2-дихлорэтил)карбонат] -Δ12,13- изотаксотир;
7-[O-(2,2-дихлорэтил)карбонат]-10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-[O-(2,2- дихлорэтил)-карбонат] -Δ12,13- изотаксол;
7-[O-(2-xлopэтил)кapбoнaт] -Δ12,13- изотаксол;
7-[O-(2-хлорэтил)карбонат] -Δ12,13- изотаксотир;
7-[O-(2-хлорэтил)карбонат]-10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-[O-(2-хлорэтил)карбонат] Δ12,13- изотаксол.
В соответствии с методикой, описанной в Европейском патенте N 524093 A1, но при использовании исходного вещества по примерам 5, 7, 26 и Δ12,13- изотаксола были получены следующие 7-карбаматные аналоги -Δ12,13- изотаксола;
7-[O-(N-метил)карбамат] -Δ12,13- изотаксола;
7-[O-(N-метил)карбамат] -Δ12,13- изотаксотир;
7-[O-(N-метил)карбамат]-10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-[O-(N-метил) карбамат -Δ12,13- изотаксол;
7-[О-(N,N-диметил)карбамат] -Δ12,13- изотаксол;
7-[O-(N,N-диметил)карбамат] -Δ12,13- изотаксотир;
7-(O-(N,N-диметил)карбамат]-10-ацетил -Δ12,13- изотаксотир;
N-дебензоил-N-трет-бутиламинокарбонил-7-[O-(N, N- диметил)-карбамат] -Δ12,13- изотаксол;
7-[O-(N-этил)кapбaмaт] -Δ12,13- изотаксол;
7-[O-(N-этил)карбамат] -Δ12,13- изотаксотир;
7-[О-(N-этил)карбамат]-10-ацетил -Δ12,13- изотаксотир;
N-дeбeнзoил-N-тpeт-бутилaминoкapбoнил-7-[O-(N-этил) карбамат] -Δ12,13- изотаксол;
7-(O-морфолинокарбонил) -Δ12,13- изотаксол;
7-(O-морфолинокарбонил] -Δ12,13- изотаксотир;
7-(O-морфолинокарбонил)-10-ацетил -Δ12,13- изотаксотир; и
N-дебензоил-N-трет-бутиламинокарбонил-7-(О-морфолинокарбонил) Δ12,13- изотаксол.
В соответствии с методикой, описанной в примерах 36 и 38, но при использовании исходного вещества по примерам 5, 7, 26 и Δ12,13- изотаксола были получены следующие 7-карбаматные аналоги Δ12,13- изотаксола:
7-(O-метил)-13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатин III;
7-(О-метил)-13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатин III;
7-(O-этил)-13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатин III;
7-(О-этил)-13-(N-(трет-бутиламинокарбонил) -β- фенил- изосеринил) -Δ12,13- изобаккатин;
7-(O-пропил)-13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатин III;
7-(О-пропил)-13-(N-трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатин III;
7-(O-аллил)-13-(N-Вос-фенил-изосеринил) -Δ12,13- изобаккатин III;
7-(О-аллил)-13-(N-(трет-бутиламинокарбонил] -β- фенил-изосеринил) Δ12,13- изобаккатин III;
7-(O-бензил)-13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатин III;
7-(О-бензил)-13-(N-(трет-бутиламинокарбонил) -β- фенил- изосеринил) -Δ12,13- изобаккатин III;
7-(O-метоксиметил)-13-(N-Boc -β- фенил-изосеринил)- -Δ12,13- изобаккатин III;
7-(О-метоксиметил)-13-(N-трет-бутиламинокарбонил) -β- фенил- изосеринил) -Δ12,13- изобаккатин III;
7-(О-метоксиэтоксиметил)-13-(N-Boc -β- фенил-изосеринил)- Δ12,13- изoбaккaтин III;
7-(О-метоксиэтоксиметил)-13-(N-(трет-бутиламинокарбонил) β- фенил-изосеринил) -Δ12,13- изобаккатин III;
7-(O-бензилоксиметил)-13-(N-Boc -β- фенил-изосеринил)- -Δ12,13- изобаккатин III;
7-(О-бензилоксиметил)-13-(N-(трет-бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатин III;
7-[O-(2,2,2-трихлорэтокси) метил)-13-(N-Boc -β- фенил- изосеринил) -Δ12,13- изобаккатин III;
7-[O-(2,2,2-трихлорэтокси) метил)-13-(N-(трет-бутиламино- кapбoнил) -β- фенил-изосеринил) -Δ12,13- изобаккатин III;
7-[O-(2,2,2-трихлорэтокси)метоксиметил)-13-(N-Boc -β- фенил-изосеринил) -Δ12,13- изобаккатин III; и
7-[O-(2,2,2-трихлорэтокси)метоксиметил)-13-(N-трет- бутиламинокарбонил) -β- фенил-изосеринил) -Δ12,13- изобаккатин III.
Таксол и другие исходные аналоги таксола хорошо известны или могут быть легко получены в соответствии с известными способами. Cм. The Chemistry of Taxol. Pharmac. Ther., т. 52, стр. 1-34, 1991 г., а также:
Патенты США N 4814470, 4857653, 4942184, 4924011, 4924012, 4960790, 5015744, 5059699, 5136060, 5157049, 4876399, 5227400, 5254580, а также публикацию по договору о патентной кооперации N WO 92/09589, заявки на Европейский патент N 90305845.1 (публикация N A2 0400971), N 89400935.6 (публикации N A1 0366841) и N 90402333.0 (публикация N
0414610 A1), N 87401669.4(A1 0253739), N 92308608.6 (A1 0534708), N 92308609.4 (A1 534709) и публикации по договору о патентной кооперации N WO 91/17977, WO 91/17976, WO 91/13066, WO 91/13053, которые включены в настоящую заявку в качестве ссылок.
Соединения по настоящему изобретению можно использовать в фармацевтических препаратах как таковые или в качестве фармацевтически приемлемых солей, в частности, нетоксичных фармацевтически приемлемых солей присоединения или пригодных основных солей. Эти соли можно получить из соединений по настоящему изобретению, содержащих кислотные или основные группы, в соответствии с известными химическими методами.
Такие соли обычно получают в результате взаимодействия свободного основания или кислоты со стехиометрическими количествами или избытком требуемой солеобразующей неорганической или органической кислоты в приемлемом растворителе или в нескольких разных растворителях. Например, свободное основание можно растворить в водном растворе соответствующей кислоты и выделить соль с помощью стандартных методов, в частности, путем выпаривания раствора. Альтернативно, свободное основание можно растворить в таком органическом растворителе, как низший спирт, простой эфир, сложный алкиловый эфир или их смеси, например метанол, этанол, простой эфир, этилацетат, раствор этилацетата в простом эфире и другие, но при обработке соответствующей кислотой с образованием нужной соли. Соль извлекают с помощью стандартных методов выделения, например путем фильтрования требуемой соли или отделения ее от раствора либо путем осаждения в результате добавления растворителя, в котором эта соль не растворяется, с последующим ее удалением.
Производные таксола по настоящему изобретению можно использовать для лечения раковых заболеваний благодаря их цитотоксическому, противоопухолевому действию. Кроме того, производные таксола по настоящему изобретению можно использовать для лечения артрита, в частности, ревматического артрита, см. Arthritis & Rheumatism, 32, 839, 1994, Nature, 368, 757 (1994), которые включены в эту заявку в качестве ссылок. Помимо этого, производные таксола по настоящему изобретению можно использовать для профилактики рестеноза артерий после пластических операций на сосудах.
Новые соединения можно вводить в виде таблеток, пилюль, порошковых смесей, капсул, инъекций, растворов, суппозиториев, эмульсий, дисперсий, пищевых добавок и в других приемлемых формах. Фармацевтический препарат, который содержит соединение по настоящему изобретению, обычно смешивают с нетоксичным фармацевтическим орагническим или неорганическим наполнителем обычно в количестве от 0,01 мг до 2500 мг или в большем количестве на дозу, предпочтительно в количестве 50-500 мг. Типичными фармацевтическими приемлемыми наполнителями являются, например, маннит, мочевина, декстраны, лактоза, картофельный и кукурузный крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли, этилцеллюлоза поли(винилпирролидон), карбонат кальция, этилолеат, изопропилмиристат, бензилбензоат, карбонат натрия, желатин, карбонат калия, кремниевая кислота и другие обычно применяемые наполнители. Фармацевтический препарат может также содержать нетоксичные вспомогательные вещества, такие, как эмульгаторы, консерванты, увлажнители и подобные вещества, в частности, монолаурат сорбита, олеат триэтаноламина, полиоксиэтиленмоностеарат, глицерилтрипальмитат, сульфокцинат диоктилнатрия и подобные вещества.
Обычный способ получения таблеток, содержащих активные агенты, состоит в первоначальном смешивании данного средства с нетоксичным связующим веществом, таким, как желатин, мазь на основе камеди, этилацетат или подобное вещество. Смешивание обычно осуществляется в стандартном V-образном смесителе и, как правило, в безводных условиях. Свежеприготовленную смесь можно спрессовать в обычной таблетирующей машине с последующим изготовлением таблеток. На свежеизготовленные таблетки может быть нанесено покрытие, либо они могут использоваться без покрытия, типичными покрытиями являются нетоксичные покрытия из шеллака, метилцеллюлозы, карнаубского воска, сополимеров стирола и малеиновой кислоты и подобных веществ. Для перорального введения предназначены таблетки, содержащие 0,01 мг, 5 мг, 25 мг, 50 мг, 500 мг и т.д. вплоть до 2500 мг лекарственного средства, которые изготавливают в соответствии с приведенным выше описанием изобретения и с помощью известных методов, а также тех, которые рассматриваются в работе Remington's Pharmaceutical Science, глава 39, Mack Publishing Co, 1965 г.
Для изготовления таблеток активное соединение, кукурузный крахмал, лактозу, дикальцийфосфат и карбонат кальция перемешивали до однородного состояния в безводных условиях в обычном V-образном смесителе. Затем готовили 10% пасту кукурузного крахмала и смешивали ее с только что приготовленной смесью до образования однородной смеси. Эту смесь пропускали через стандартное сито с мелкими отверстиями, сушили в безводной атмосфере, а затем смешивали со стеаратом кальция, прессовали в таблетки и при желании наносили на них покрытие. Другие таблетки, содержащие 10, 50, 100, 150 мг и т.д. активного средства, готовили аналогичным образом.
Приводимый ниже состав I является примером состава таблетки, включающей соединение по настоящему изобретению:
СОСТАВ I
Ингредиенты: - На таблетку, мг
Активное соединение - 50,0
Кукурузный крахмал - 15,0
Паста из кукурузного крахмала - 4,5
Карбонат кальция - 15,0
Лактоза - 67,0
Стеарат кальция - 2,0
Дикальций фосфат - 50,0
Изготовление капсул, содержащих от 10 до 2500 мг активного агента и предназначенных для перорального введения, включает смешивание активного соединения с нетоксичным наполнителем и заключение смеси в полимерную капсулу, обычно из желатина или подобного вещества. Эти капсулы могут быть мягкими, содержащими соединение в виде однородной дисперсии вместе со съедобным, совместимым наполнителем, или жесткими, содержащими в основном новое соединение в смеси с таким нетоксичным твердым веществом, как тальк, стеарат кальция, карбонат кальция или аналогичное вещество. Капсулы, содержащие 25 мг, 75 мг, 125 мг или подобное количество нового соединения, используемого отдельно или в смеси с двумя или большим количеством других соединений по настоящему изобретению, готовили, например, следующим образом:
СОСТАВ II
Ингредиенты: - На капсулу, мг
Активное соединение - 50,0
Карбонат кальция - 100,0
Лактоза, фармакопея США - 200,0
Крахмал - 130,0
Стеарат магния - 4,5
Вышеуказанные ингредиенты смешивали в стандартном смесителе, а затем вводили в выпускаемые промышленностью капсулы. При использовании активного средства в более высоких концентрациях соответственно уменьшали количество лактозы. Соединения по настоящему изобретению можно также сушить вымораживанием и при желании соединять с другими фармацевтически приемлемыми наполнителями с целью получения составов, пригодных для парентерального введения инъекций. Для такого типа введения данный состав можно получить в воде (обычной, солевом растворе) или в смеси воды и органического растворителя, такого, как пропилен- гликоль, этанол или подобное вещество.
Доза, вводимая в виде разовой, многоразовой или суточной дозы, будет, конечно, меняться в зависимости от используемого соединения по настоящему изобретению с учетом эффективности соединения, выбранного способа введения, веса и состояния больного. Вводимая доза не имеет, определенных ограничений, но обычно она представляет собой эффективное количество или эквивалентна на молярной основе фармакологически активной свободной форме, полученной из дозированного состава при метаболическом выделении активного лекарственного средства, которая необходима для достижения необходимого фармакологического и физиологического действия.
Соединения по настоящему изобретению можно вводить путем внутривенных вливаний в дозах, равных 1-500 мг для одного больного на курс лечения ракового заболевания, предпочтительно в дозах, равных 20-200 мг, причем точная доза зависит от возраста, веса и состояния больного. Примером приемлемого состава, предназначенного для инъекций, является раствор соединения по настоящему изобретению в смеси со спиртовым раствором полисорбата и дегидратированным спиртом (например, с соотношением 1:1) с последующим разбавлением 5% раствором декстрозы в воде до вливания или инъекции.
Соединения по настоящему изобретению можно вводить перорально в дозах, равных 1-500 мг для одного больного на курс лечения ракового заболевания, предпочтительно в дозах, равных 20-600 мг, причем точная доза зависит от возраста, веса и состояния больного.
Соединения формулы I (включая II, IIa, III, IIIa, IV, IVa, V, Va и IV) являются полезными для лечения таких же раковых заболеваний, при лечении которых используется таксол, в частности опухоли яичников, опухоли молочной железы и злокачественной меланомы, опухоли легких, опухоли желудка, опухоли прямой кишки, опухоли головы и шеи, и лейкоза. См., например, клиническую фармакологию таксола, представленную Эриком К. Ровински и Россом К. Доунхавером, The Clinical Pharmacology and Use of Antimicrotubule Agents in Cancer Chemotherapeutics, Pharmac.Ther.,т. 52, стр.35-84. 1991 г. Клинические и доклинические исследования с использованием таксола представлены Уильямом Дж. Шлихенмейером и Даниэлем Д. фон Хоффом в работе "Taxol: A New and Effective Anti-cancer Drug, Anti-cancer Drugs", т. 2, стр. 519-530, 1991 г.
Биологическая активность соединений 7-дезокси -7β,8β- метан -Δ12,13- изотаксола (формула II) по настоящему изобретению была подтверждена с помощью известных методов. Например, сравнение цитотоксичности соединения 17 с таксолом на раковых клетках лейкоза мыши L1210 в культуре показало, что IC90 (концентрация ингибирования 90% роста) для 7-дезокси -7β,8β- метан -Δ12,13- изотаксола сотавляла 0,017 мкг/мл, а для таксола - 0,018 мкг/мл. При выполнении in vitro аналина полимеризации тубулина по методу Ф.Гаскина и др. J. Mol, Diol., 89:737, 1974, 7-дезокси -β,8β- метан -Δ12,13- изотаксол вызывал полимеризацию тубулина in vitro при температуре 20oC аналогично действию, производимому таксолом.
Биологическая активность соединений 7-дезокси-7-галоген- изотаксола (формула III) по настоящему изобретению была подтверждена с помощью хорошо известных методов. Например, сравнение цитотоксичности соединения 16 с таксолом на клетках А2780 (рак яичников человека) в культуре показало, что IC90 (концентрация ингибирования 90% роста) для 7-дезокси-7-фтор -Δ12,13- изотаксола составляла 0,0029 мкг/мл, а для таксола - 0,017 мкг/мл.
Биологическая активность соединений по настоящему изобретению была далее подтверждена с помощью хорошо известных методов в отношении клеток рака яичников человека А2780. Результаты этого исследования приведены в таблице II. Эти результаты были получены благодаря применению хорошо известной стандартной методике (Perez R.P., O'Dwyer P.J., Handel L.M., Ozols R.F., Hamilton T. C. Int. J.Cancer, 1991, 48, 265; Alley M.C., Scudiero D.A., Monks Д. , Hursey M. L., Czewinski M.J., Fine D.L. и др., Cancer Res., 1988, 48: 589).
Биологическая активность соединений по настоящему изобретению была далее подтверждена с помощью хорошо известных методов в отношении клеток лейкоза L1210. Результаты этого исследования приведены в таблице I. Эти результаты были получены с использованием хорошо известной стандартной методики (Li L. H. , Kuentzel C.L., Murch L.L., Pschigoga L.M. и W.C. Krueger, "Comparative biological and biochemical effects of nogalamycin and its analogs on L 1210 leukemia". Cancer Res., 39:4816-4822 (1979)). Полученные результаты выражены в виде значений IC50 которые представляют концентрацию лекарственного средства, необходимую для ингибирования пролиферации клеток на 50% по сравнению с необработанными контрольными клетками. Более низкие величины определяют большую активность.
Хорошо известно, что многие опухоли человека устойчивы к воздействию химиотерапевтических средств благодаря явлению, именуемому лекарственной резистентностью (MDR). Клетки, для которых характерна лекарственная резистентность, устойчивы к воздействию целого ряда лекарственных средств, включая таксол, таксотир и другие химиотерапевтические средства, такие, как доксорубицин, винбластин и этопозид. Лекарственная резистентность, несомненно, имеет непосредственное отношение к ограниченному применению некоторых терапевтических средств, включая таксол и таксотир. Поэтому создание аналога таксола или таксотира, который способен преодолевать лекарственную резистентность клеток и уничтожать их гораздо эффективнее, чем таксол или таксотир, должно в значительной степени способствовать лечению в клинических условиях опухолей, резистентных к лекарственным средствам. Некоторые соединения, описанные в этой заявке, испытывали на способность преодолевать лекарственную резистентность и уничтожать клетки, устойчивые к действию лекарственных средств.
Был выполнен in vitro анализ, позволяющий сравнить уничтожающую способность аналогов таксола в отношении нерезистентной к лекарственным средствам линии клеток KB-3-1 и резистентной к лекарственным средствам линии клеток KB-У1 (Shen и др. 1986, J. Biol.Chem., 261:7762; Mossman T.J., 1983 Immunol. Methods 65: 55-63; Abraham и др. 1994, Cancer Res., 54:5889). Использовали клетки KB-VI с высоким содержанием P-гликопротеина, который выполнял роль насоса, откачивающего лекарственные средства (стр. 170) (Shen, и др. 1986, там же). Считается, что такое ярко выраженное действие P-гликопротеина является основным источником лекарственной резистентности этих клеток (Endicott и Ling, 1989, Ann Rev. Biochem. 58:137). Эти анализы выполняли для того, чтобы определить, могут ли какие-либо аналоги преодолевать действие P-гликопротеина и уничтожать клетки, резистентные к лекарственным средствам. Было определено значение IC50 (ингибирующая доза) для клеток KB-3-1 и KB-VI и приведено отношение показателя IC50 для клеток KB-VI к аналогичному показателю для клеток KB-3-1. Показатель IC50 служит для определения количества лекарственного средства, необходимого для уничтожения 50% клеток. Более высокое отношение (IC50 KB-VI /IC50КB-3-1) показывает, что для уничтожения резистентных клеток необходима более высокая концентрация испытуемого соединения по сравнению с количеством активного вещества, необходимого для уничтожения клеток, восприимчивых к лекарственным средствам. Соединения с высокими отношениями не способны эффективно воздействовать на механизм устойчивости к лекарственным средствам у резистентных клеток. С другой стороны, соединения с низкими отношениями способны эффективно уничтожать как резистентные, так и нерезистентные клетки, и требуют гораздо меньшего увеличения дозы для уничтожения резистентных клеток по сравнению с восприимчивыми к лекарственным средствам клетками.
Поэтому соединение с более низким отношением имеет преимущества при лечении раковых заболеваний, обеспечивая более эффективное уничтожение резистентных к лекарственным средствам клеток.
Полученные отношения представлены в приводимой ниже таблице и составляют от 20 до 5•105. Соединениями с более низкими отношениями, благодаря чему они гораздо эффективнее уничтожают резистентные к лекарственным средствам клетки, являются соединения 7, 17, 18 и 6, у которых эти отношения находятся в интервале от 34 до 300. По сравнению с ними таксол и таксотир плохо преодолевают резистентность таких клеток, характеризуясь средним отношением, равным 7570. Некоторые испытанные соединения были эффективнее таксола или таксотира в отношении замедления роста резистентной к лекарственным средствам опухоли, имплантированной мышам. Эти результаты позволяют предположить, что новые аналоги таксола могут гораздо эффективнее уничтожать резистентные опухолевые клетки у больных раком, чем таксотир, и могут качественно изменить лечение таких заболеваний.
При использовании соединения формулы I после пластических операций на сосудах пероральный способ введения является одним из способов, обеспечивающих систематическое действие. Однако, альтернативно, эти соединения можно вводить с помощью других известных способов введения лекарственных средств для обеспечения систематического действия.
Человек или животное, проходящие курс лечения, должны получать периодические дозы лекарственного средства в количествах, эффективных для предупреждения сужения сосудов в случае травмы, требующей введения обходного сосудистого шунта, микрохирургии сосудов, при рестенозе после успешной пластической операции на коронарных сосудах или трансплантации органов.
Эффективные дозы можно легко определить в соответствии с известными методами. Лекарственные дозы можно вводить перорально, парентерально или путем местного введения в область травмированных сосудов с помощью катетера. Суточную дозу лекарственного средства (0,01-200 мг/кг) можно постепенно увеличивать с учетом переносимости. Хотя предпочтительная схема приема лекарственного средства включает прием разовой суточной дозы для больных, использующих пероральный или парентеральный способ введения, меньшие дозы местного действия (1 нг/кг, 1 мг/кг), предназначенные для перорального или парентерального введения, можно вводить во время операции на сосудах с помощью местного катетера или вливания в виде соответствующего состава.
Хотя предпочтительная схема приема лекарственного средства представляет собой разовую суточную дозу, для достижения более однородного содержания лекарственного средства в сыворотке предпочтение также отдается многоразовому введению лекарственного средства (например, 4-6 раз в сутки). Если необходимо ввести 4 суточные дозы лекарственного средства, то каждая доза может содержать 50 мг/кг веса больного или большее количество активного препарата в зависимости от переносимости.
Аналогичные дозы можно использовать для лечения других млекопитающих, например в количестве 0,01-200 мг/кг/сутки.
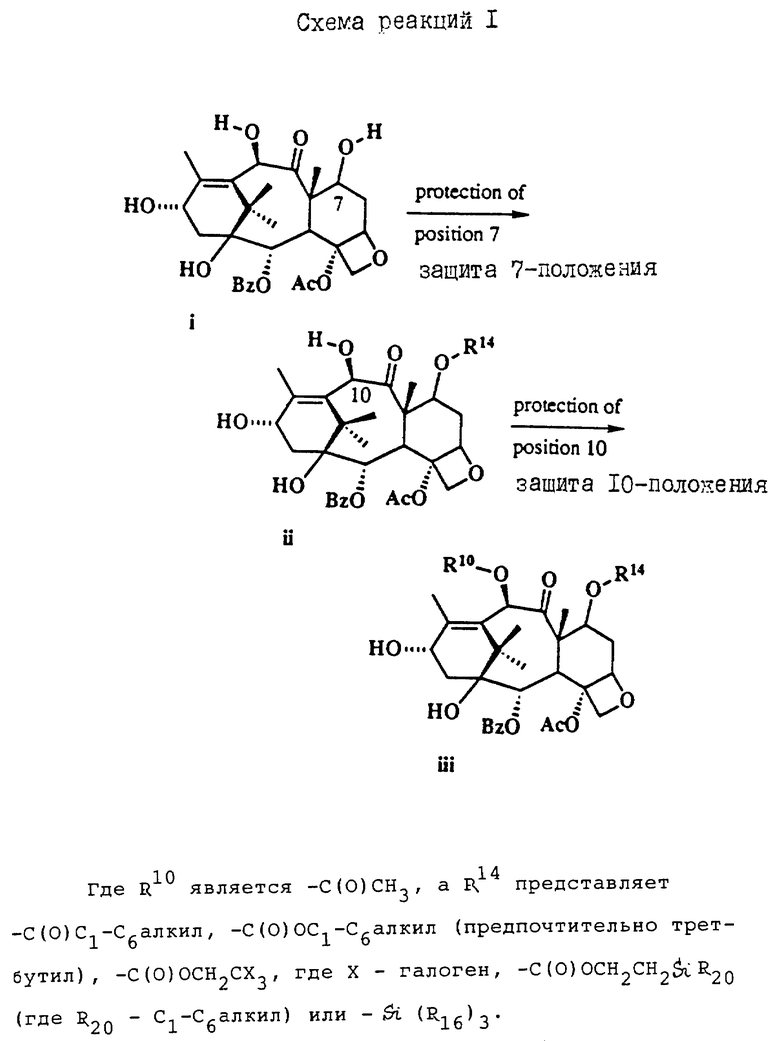
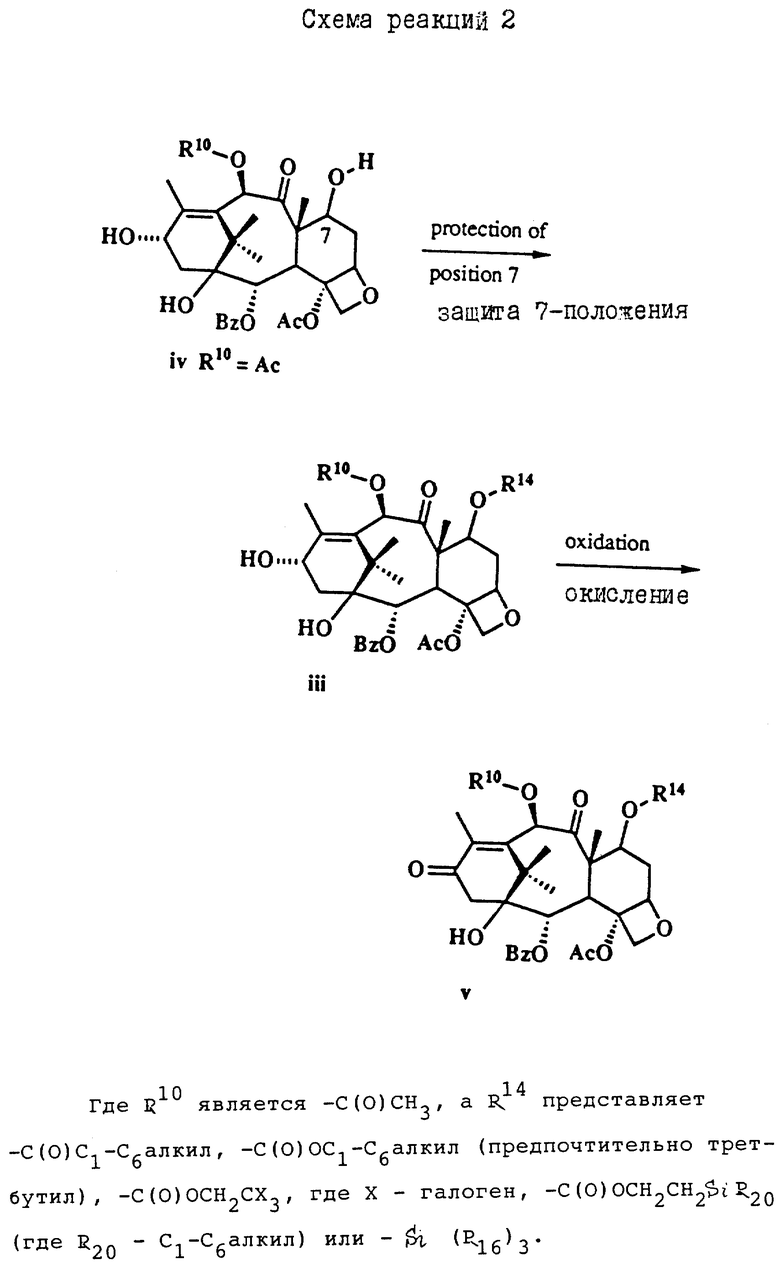
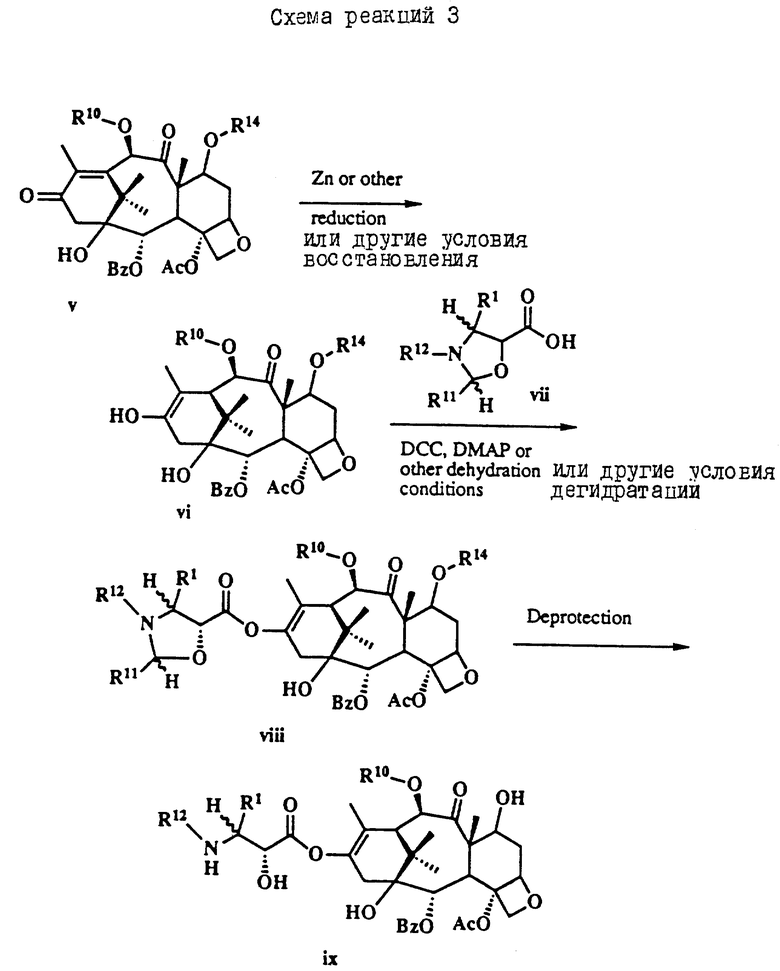
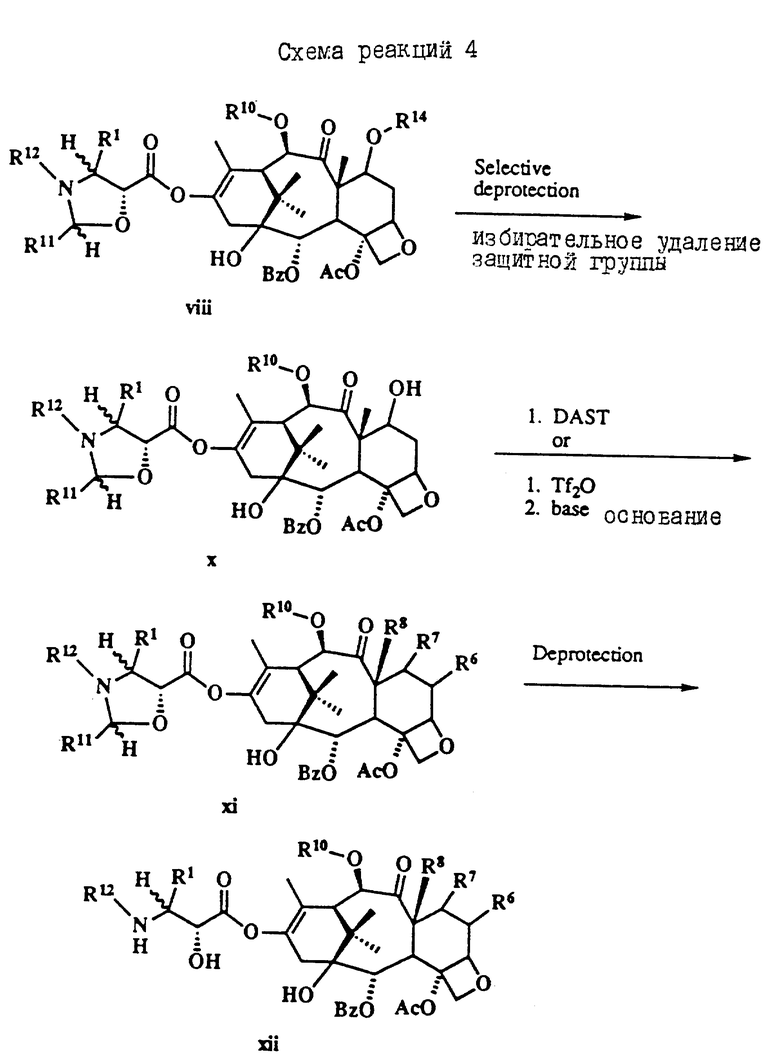
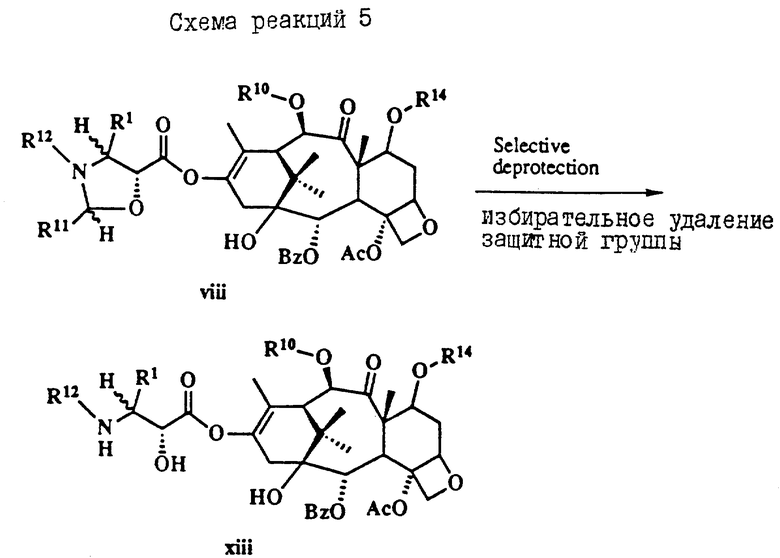
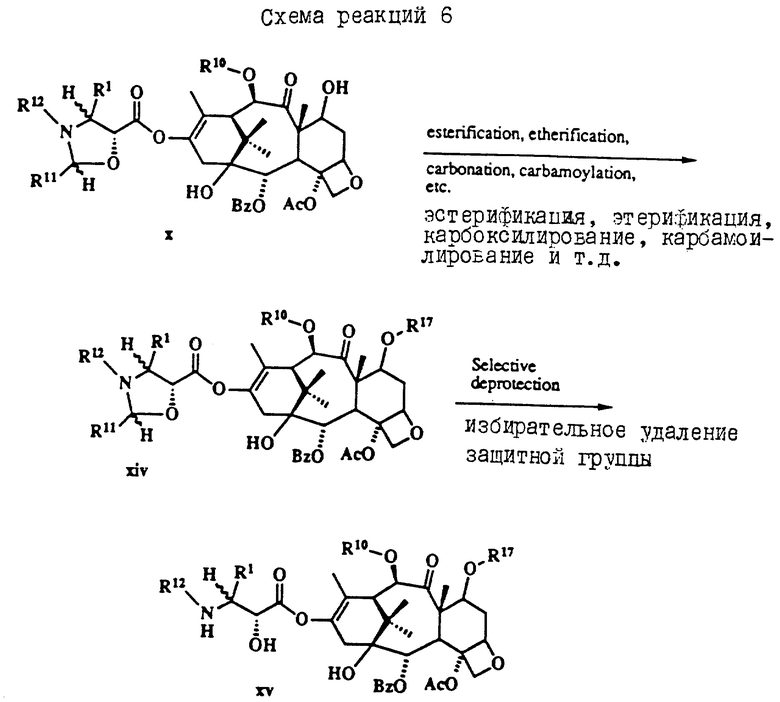


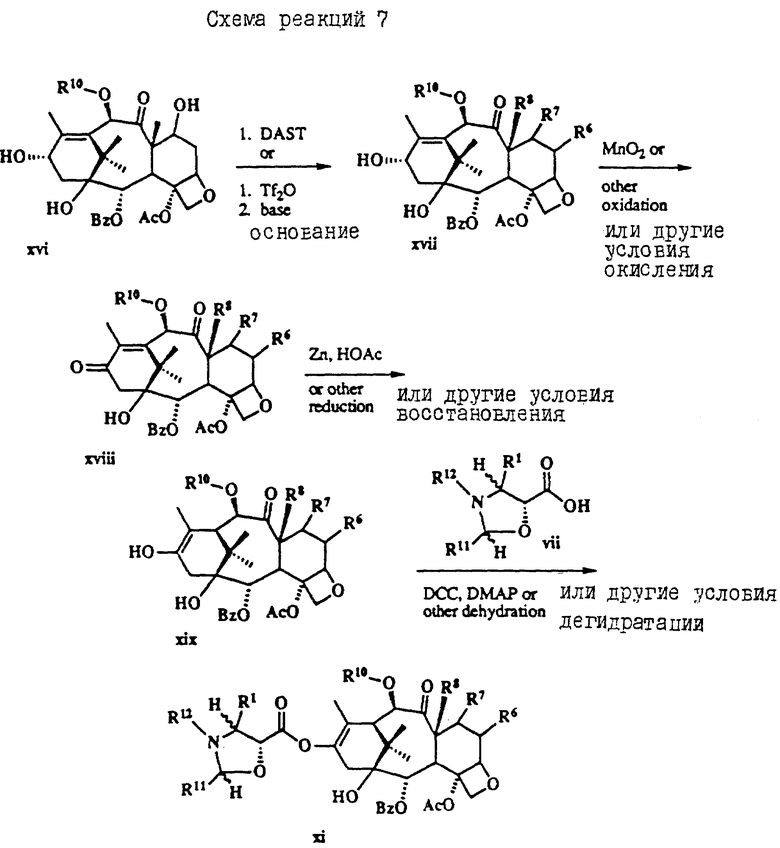
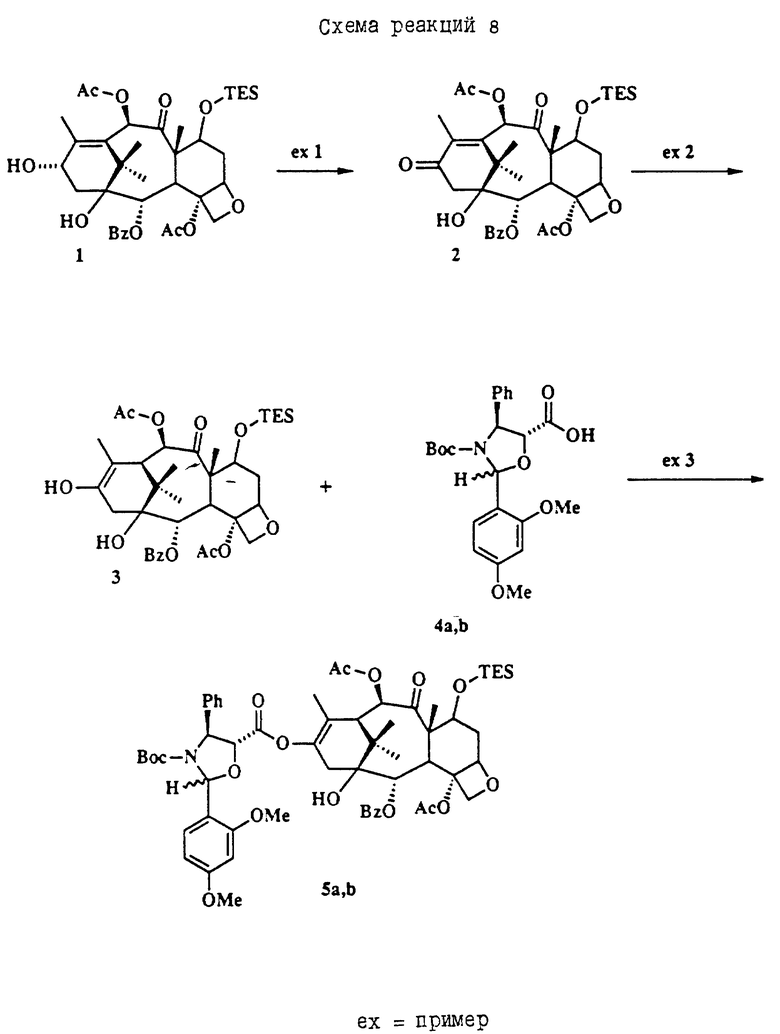
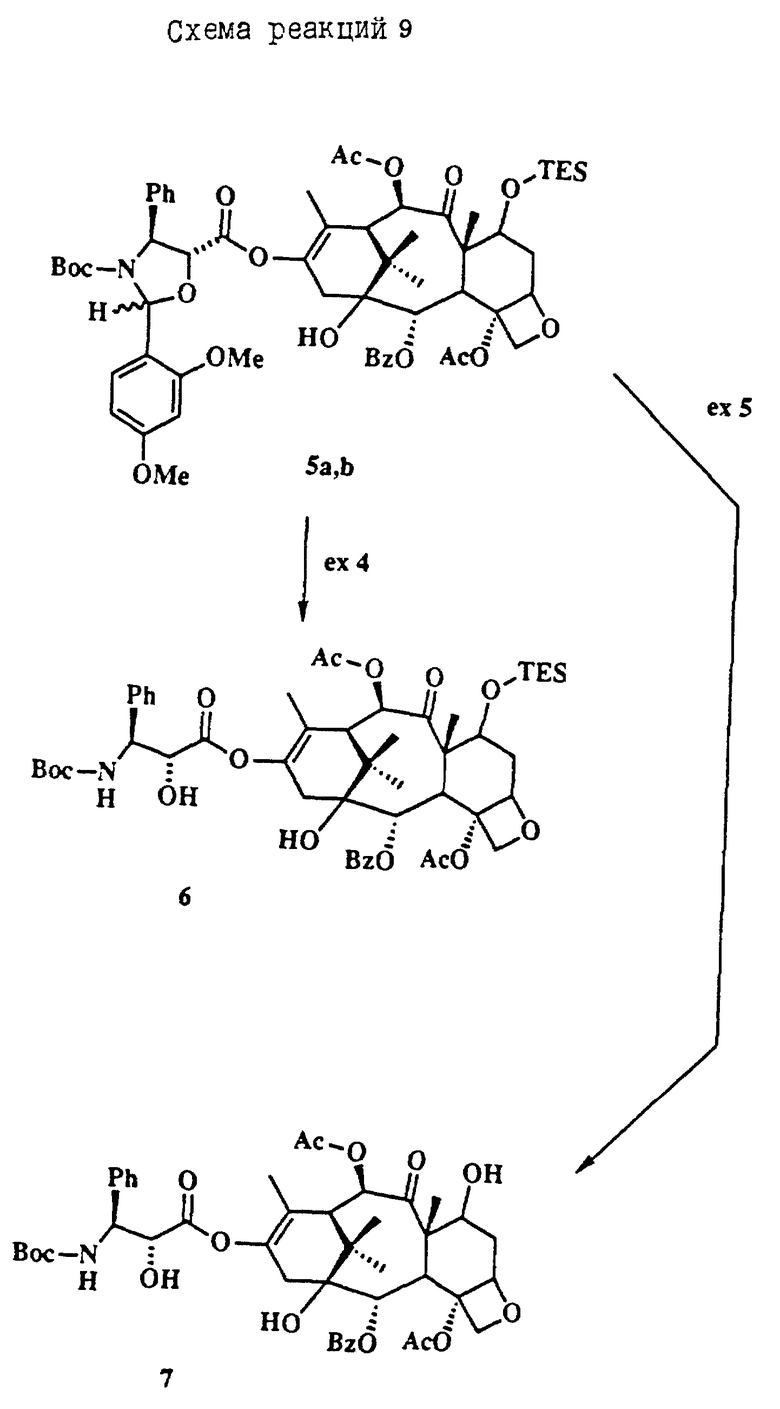
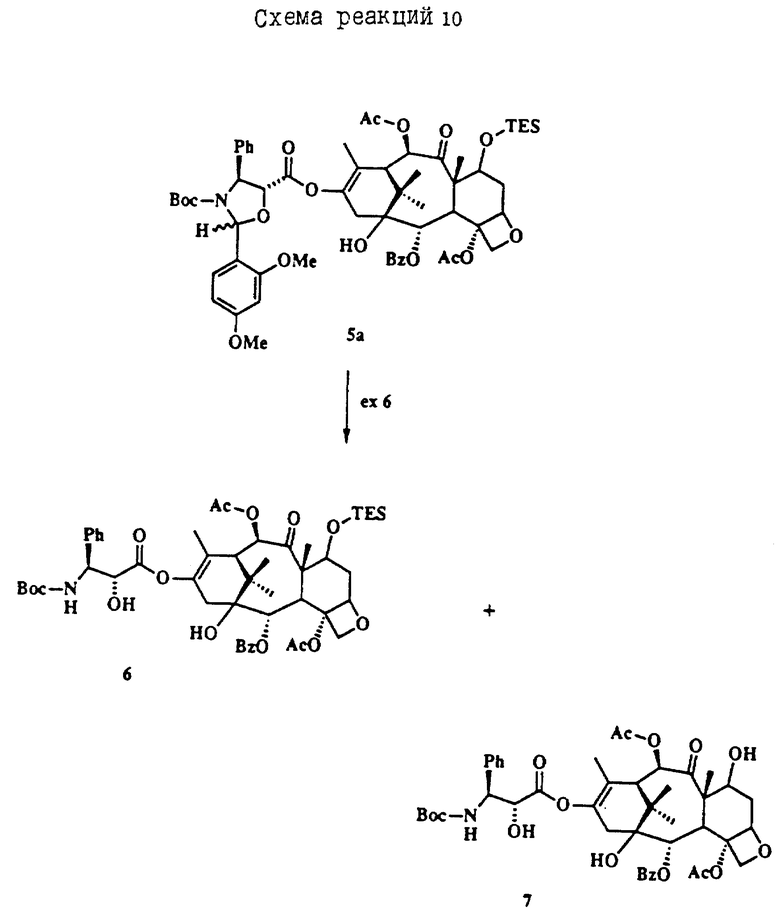
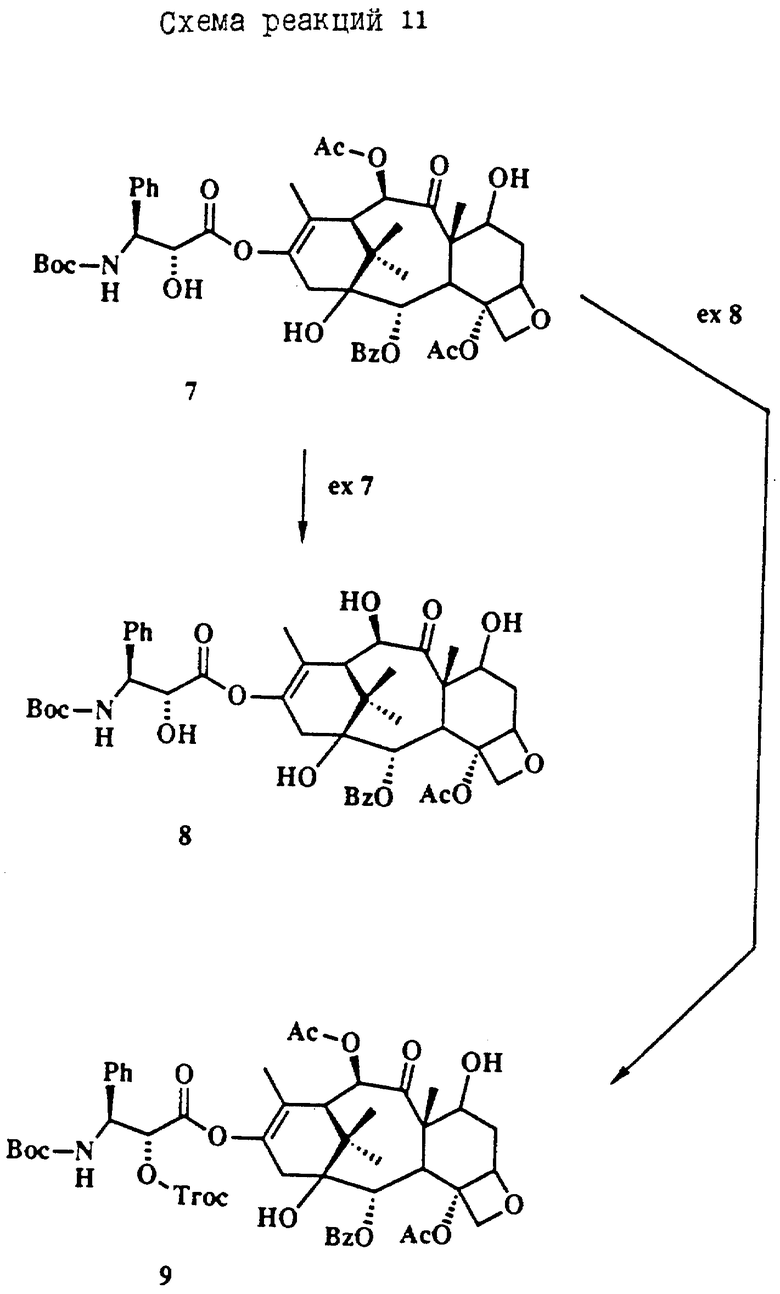
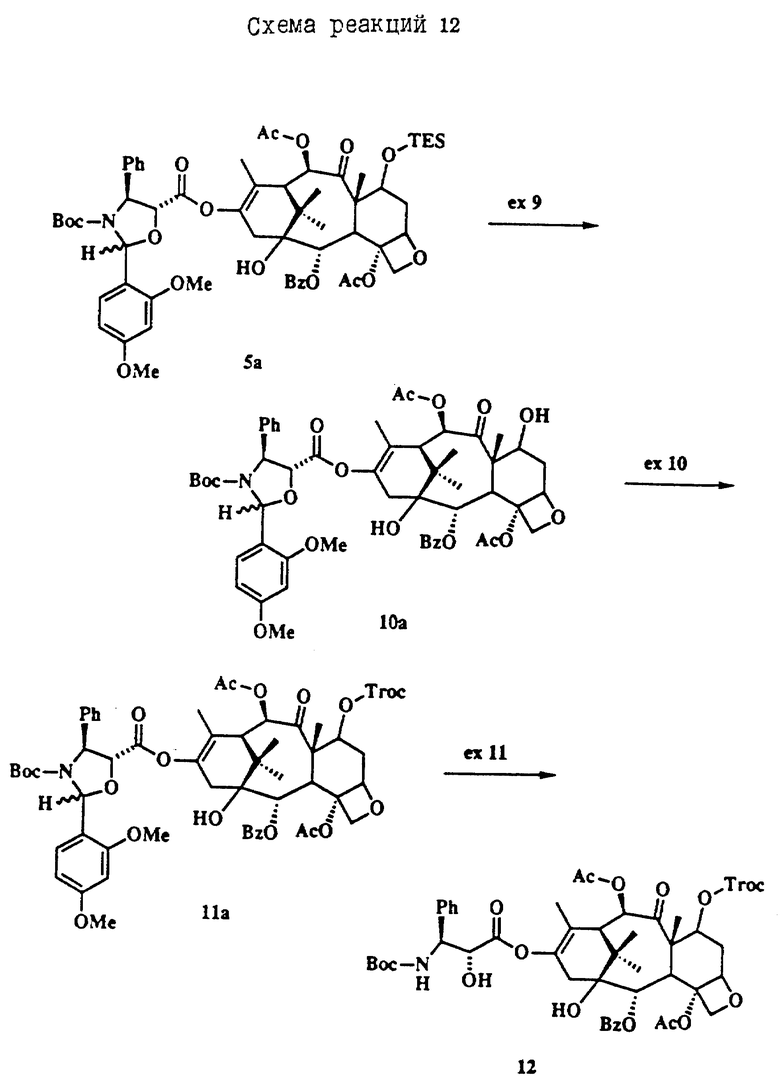
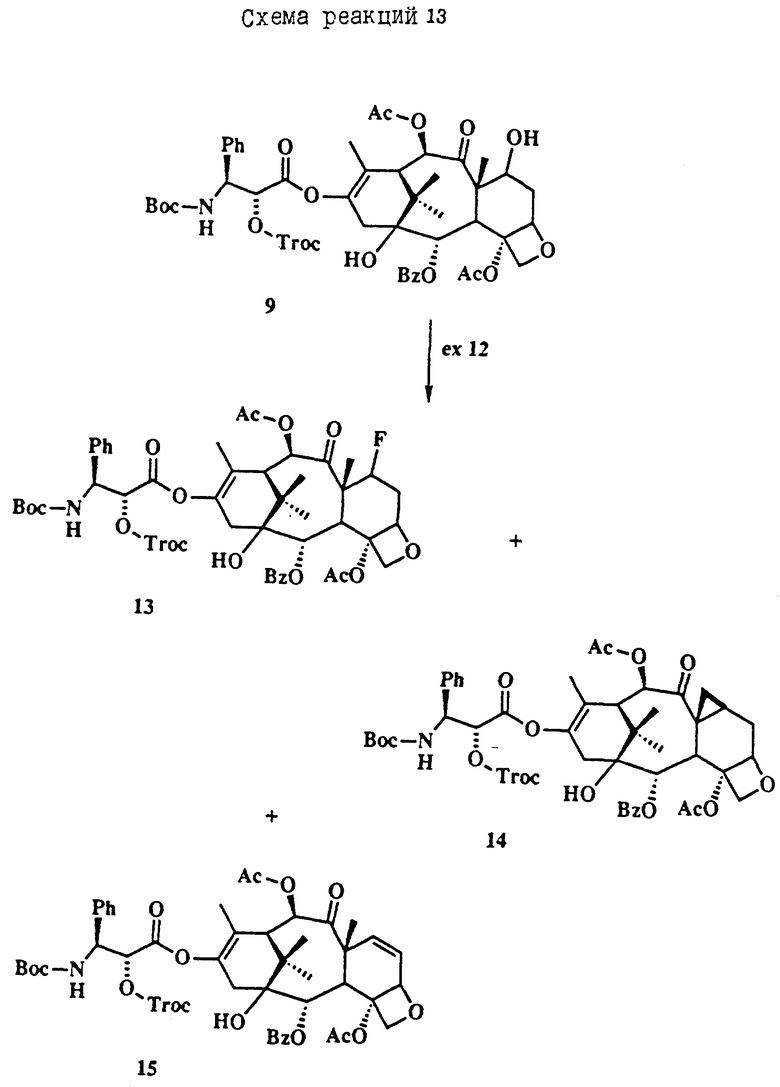
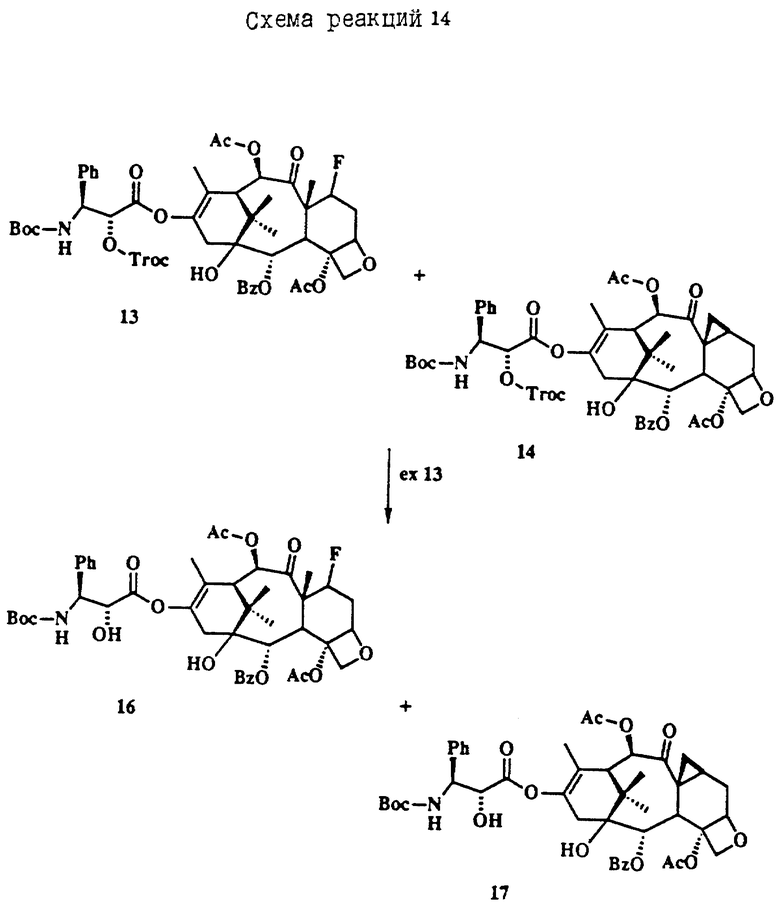
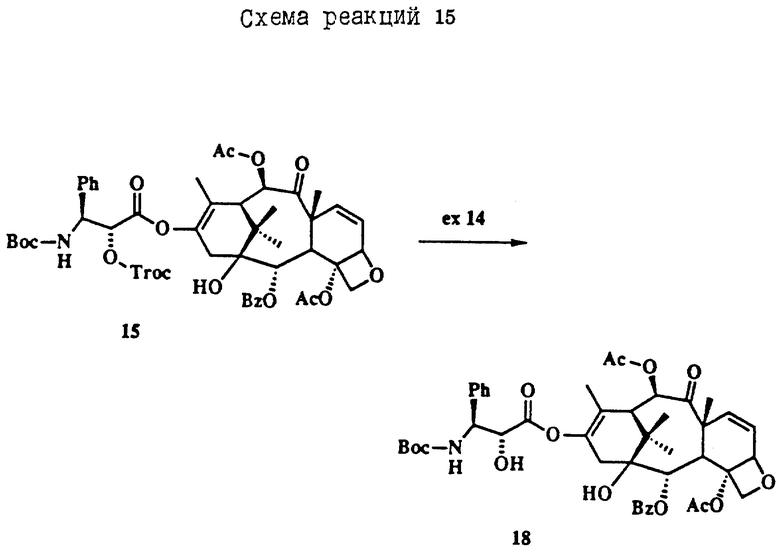
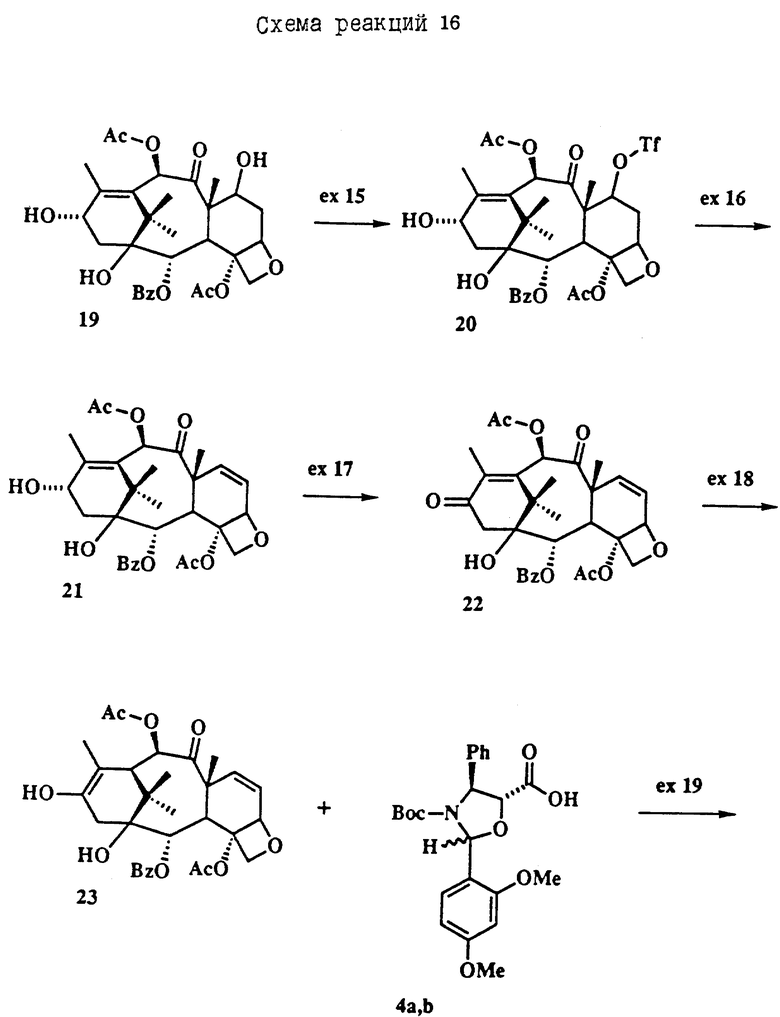
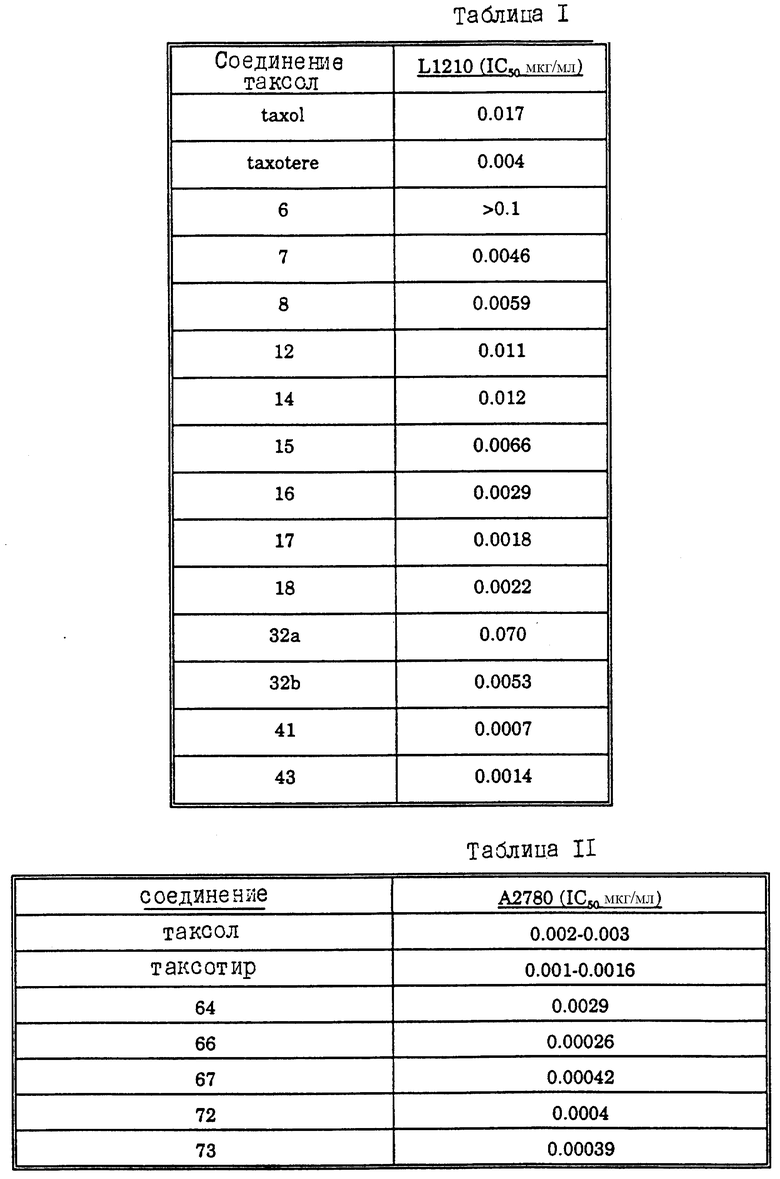
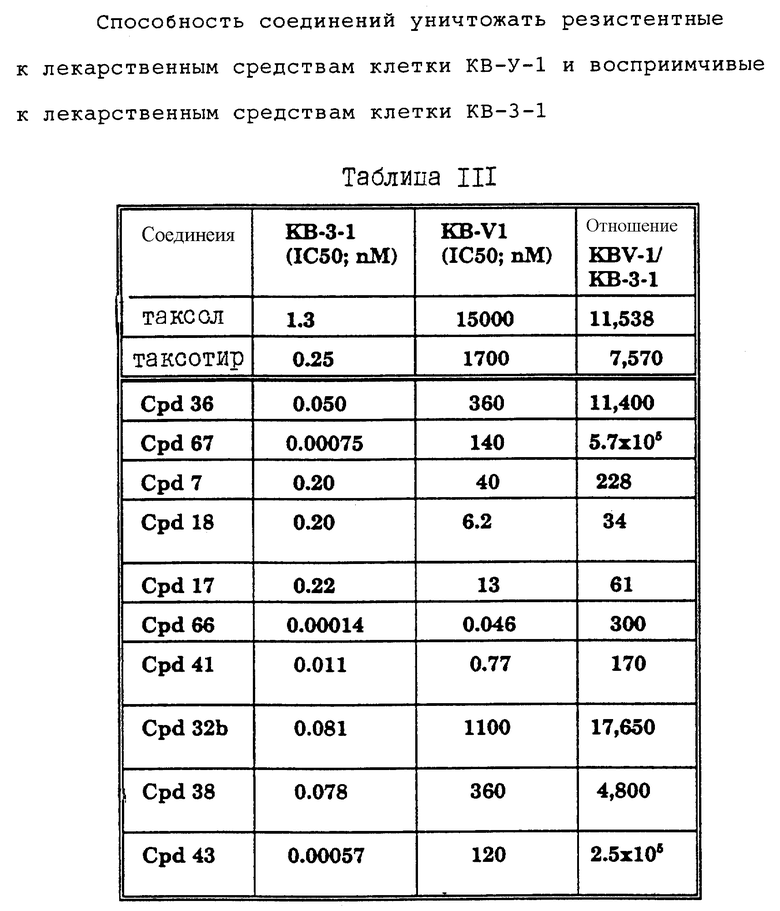
Описываются аналоги Δ12,13-изотаксола формулы I, где значения X, R1-R8 и Rза указаны в п.1 формулы изобретения. Соединения формулы I являются полезными для лечения таковых раковых заболеваний, как рак яичников человека, рак молочной железы, злокачественная меланома, рак легких, рак желудка, рак прямой кишки, рак головы и шеи, а также лейкоз, в отношении которых весьма эффективно действует таксол. Описываются также промежуточные соединения, способ получения промежуточных соединений и фармацевтическая композиция на основе соединений формулы I. 8 с и 17 з.п.ф-лы, 3 табл., 17 ил.
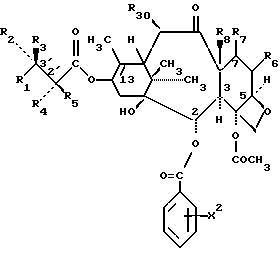
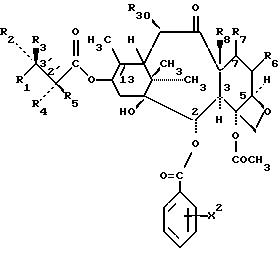
в которой X2 выбирают из группы, включающей -H, C1-C4-алкил, -C1-C3-алкокси или азид (N3);
R1 выбирают из группы, включающей фенил или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил или C1-C3-алкокси;
R2 выбирают из группы, включающей -H, -NHC(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C3-алкокси, -NHC(O)OCH2фенил, -NH2, -OH, -NHC(O)C1-C10-алкил, -NHC(O)NHC1-C10-алкил, -NHC(O)-NHPh, -NHC(O)OC1-C10-алкил;
R3 выбирают из группы, включающей -H или NHC(O)OC(CH3)3 при условии, что один из R2 и R3 является -H, оба R2 и R3 одновременно не являются -H;
R4 представляет -H или его выбирают из группы -OH или -OC(O)OCH2 C(Cl)3;
R5 означает -H или -OH при условии, что если R5 является -OH, то R4 является -H, а также при условии, что если R5 является -H, то R4 не является -H;
R6 означает -H: -H, если R7 является α-R71:β-R72, где один из R71 и R72 представляет -H, а второй из R71 и R72 представляет -X7, где X7 - галоген или азидо(-N3), и R8 является CH3;
R6 означает -H: -H, если R7 является α-H:β-R74, где R74 и R8, взятые вместе, образуют циклопропиловое кольцо,
R6 означает -H: -H, если R7 является α-R81:β-R82, где один из R81 и R82 представляет -H, а второй из R81 и R82 представляет -OH или -H, и R8 является -CH3;
R6 означает -H: -H, если R7 является α-R91:β-R92, где один из R91 и R92 представляет -H, а второй из R91 и R92 представляет -W, где W-O-C(O)C1-C10-алкил, -O-C(O)фенил, -O-C(O)фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил или галоген, -O-C(O)нафтил, -O-C(O)нафтил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил или галоген, -O-C(O)Oнафтил, -O-C(O)Oнафтил, замещенный одной, двумя, или тремя группами, представляющими собой C1-C4-алкил, -O-C(O)NHфенил, -O-C(O)NHфенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C3-алкилтио;
-Si(R16)3, где R16 - C1-C8-алкил при условии, что по крайней мере две части R16 представляют C1-C6-алкил, -O-CH2-O-C1-C6-алкил, и R8 является -CH3;
R30 представляет -H, -OH или -OC(O)CH3;
и их фармацевтически приемлемые соли, если данное соединение содержит кислородную или основную функциональную группу.
7-дезокси-Δ6,7-Δ12,13- изотаксол;
10-ацетил-7-дезокси-Δ6,7-Δ12,13-изотаксотир;
2'-сукцинил-7-дезокси-Δ6,7-Δ12,13- изотаксол;
формиат 2'-(β-аланил)-7-дезокси-Δ6,7-Δ12,13-изотаксола;
2'-глутарил-7-дезокси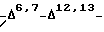 изотаксол;
изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3N(CH3)2]-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(β-сульфопропионил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(триэтилсилил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(N,N-диэтиламинопропионил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(N,N-диметилглицил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(глицил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(L-аланил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(L-лейцил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(L-изолейцил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(L-валил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(L-фенилаланил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(L-пролил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(L-лизил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(L-глутамил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
2'-(L-аргинил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
7-дезокси-Δ6,7-Δ12,13-изотаксотир;
7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-[{2,2,2-трихлорэтил)окси}карбонил]-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-сукцинил-7-дезокси-7-фтор-Δ12,13-изотаксол;
формиат 2'-(β-аланил)-7-дезокси-7-фтор-Δ12,13-изотаксола;
2'-глутарил-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3N(CH3)2]-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(β-сульфопропионил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(триэтилсилил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(N,N-диэтиламинопропионил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(N,N-диметилглицил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(глицил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(L-аланил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(L-лейцил)-7-дезокси-7-фтор изотаксол;
изотаксол;
2'-(L-изолейцил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(L-валил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(L-фенилаланил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(L-пропил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(L-лизил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(L-глутамил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
2'-(L-аргинил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-тетрагидропиран-4-илоксикарбонил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-пивалоил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-n-гексиламинокарбонил-7-дезокси-7-фтор-Δ12,13-изотаксол;
7-дезокси-7α-фтор-Δ12,13-изотаксол;
7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-[{(2,2,2-трихлорэтил)окси}карбонил]-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-[{(2,2,2-трихлорэтил)окси}карбонил]-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-сукцинил-7-дезокси-7α-фтор-Δ12,13-изотаксол;
формиат 2'-(β-аланил)-7-дезокси-7α-фтор-Δ12,13-изотаксола;
2'-глутарил-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3N(CH3)2]-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(β-сульфопропионил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7α-фторΔ12,13-изотаксол;
2'-(триэтилсилил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(N,N-диэтиламинопропионил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(N,N-диметилглицил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(глицил)-7-дезокси-7α-фтор-Δ12,13-/ изотаксол;
2'-(L-аланил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(L-лейцил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(L-изолейцил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(L-валил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(L-фенилаланил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(L-пролил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(L-лизил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(L-глутамил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-(L-аргинил)-7-дезокси-7α-фтор-Δ12,13-изотаксол;
2'-сукцинил-7-дезокси-7β-фтор-Δ12,13-изотаксол;
формиат 2'-(β-аланил)-7-дезокси-7β-фтор-Δ12,13-изотаксола;
2'-глутарил-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3(CH3)2N]-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(β-сульфопропионил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(триэтилсилил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(N,N-диэтиламинопропионил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(N,N-диметилглицил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(глицил)-7-дезокси-7β-фтор изотаксол;
изотаксол;
2'-(L-аланил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(L-лейцил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(L-изолейцил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(L-валил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(L-фенилаланил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(L-пролил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(L-лизил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(L-глутамил)-7-дезокси-7β-фтор-Δ12,13-изотаксол;
2'-(L-аргинил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-[{(2,2,2-трихлорэтил)окси}карбонил]-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-сукцинил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
формиат 2'-(β-аланил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксола;
2'-глутарил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-[-C(O)(CH2)3C(O)NH(CH2)3N(CH3)2]-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-β-сульфопропионил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(2-сульфоэтиламидо)сукцинил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(3-сульфопропиламидо)сукцинил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(триэтилсилил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(трет-бутилдиметилсилил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(N,N-диэтиламинопропионил)-7-дезокси-7β,8β-метан- изотаксол;
изотаксол;
2'-(N,N-диметилглицил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(глицил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(L-аланил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(L-лейцил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(L-изолейцил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(L-валил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(L-фенилаланил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(L-пролил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(L-лизил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(L-глутамил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
2'-(L-аргинил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
7-дезокси-7β,8β-метан-Δ12,13-изотаксотир;
N-дебензоил-N-тетрагидрофуран-3-илоксикарбонил-7-дезокси-
7β,8β-метан-Δ12,13-изотаксол,
N-дебензоил-N-(1-адамантоил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол или
N-дебензоил-N-фениламинокарбонил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол.
10-ацетил-7-дезокси-7-фтор-Δ12,13-изотаксотир;
10-ацетил-7β,8β-метан-Δ12,13-изотаксотир;
10-ацетил-7-дезокси-Δ6,7-Δ12,13-изотаксотир;
13-(N-Boc-β-фенил-изосеринил)-Δ12,13-изобаккатин III (7);
10-деацетил-13-(N-Boc-β-фенил-изосеринил)-Δ12,13-изобаккатин III (8);
7-Troc-13-(N-Boc-β-фенил-изосеринил)-Δ12,13-изобаккатин III (12);
2'-Troc-13-(N-Boc-β-фенил-изосеринил)-7-дезокси-7-фтор-Δ12,13-изобаккатин III (13);
2'-Troc-13-(N-Boc-β-фенил-изосеринил)-7-дезокси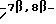 метан-Δ12,13-изобаккатин III (14);
метан-Δ12,13-изобаккатин III (14);
2'-Troc-13-(N-Boc-β-фенил-изосеринил)-7-дезокси-Δ6,7-Δ12,13-изобаккатин III (15);
13-(N-Boc-β-фенил-изосеринил)-7-дезокси-7-фтор-Δ12,13-изобаккатин III (16);
13-(N-Boc-β-фенил-изосеринил)-7-дезокси-7β,8β-метан-Δ12,13-изобаккатин III (17);
13-(N-Boc-β-фенил-изосеринил)-7-дезокси-Δ6,7-Δ12,13-изобаккатин III (18);
7-TES-13-(N-трет-бутиламинокарбонил)-β-фенил-изосеринил)-Δ12,13-изобаккатин III (32а);
13-(N-(трет-бутиламинокарбонил)-β-фенил-изосеринил)-Δ12,13-изобаккатин III (32b);
7-этоксиметил-13-(N-Boc-β-фенил-изосеринил)-Δ12,13-изобаккатин III (41) и
7-метоксиметил-13-(N-Boc-β-фенил-изосеринил)-Δ12,13-изобаккатин III (66).
N-дебензоил-N-тетрагидрофуран-3-илоксикарбонил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(1-адамантоил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-фениламинокарбонил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-трет-бутиламинокарбонил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(1-метил-1-циклогексиланоил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(1-фенил-1-циклопентаноил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-фталимидо-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-трет-бутиламинотиокарбонил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-трет-амилоксикарбонил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-неопентилоксикарбонил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(2-хлор-1,1-диметилэтил)оксикарбонил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(3-метил-3-пентил)оксикарбонил-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-тетрагидропиран-4-илоксикарбонил-7-дезокси-7-фтор изотаксол;
изотаксол;
N-дебензоил-N-пивалоил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-n-гексиламинокарбонил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-трет-бутиламинокарбонил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(1-метил-1-циклогексиланоил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(1-фенил-1-циклопентаноил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-фталимидо-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-трет-бутиламинотиокарбонил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-трет-амилоксикарбонил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-неопентилоксикарбонил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(2-хлор-1,1-диметилэтил)оксикарбонил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(3-метил-3-пентил)оксикарбонил-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-трет-бутиламинокарбонил-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-(1-метил-1-циклогексиланоил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-(1-фенил-1-циклопентаноил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-фталимидо-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-трет-бутиламинотиокарбонил-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-трет-амилоксикарбонил-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-неопентилоксикарбонил-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-(2-хлор-1,1-диметилэтил)оксикарбонил-7-дезокси-Δ6,7-Δ12,13-изотаксол; или
N-дебензоил-N-(3-метил-3-пентил)оксикарбонил-7-дезокси-Δ6,7-Δ12,13-изотаксол;
15. Соединение по п. 1, отличающееся тем, что его выбирают из группы, включающей
3'-десфенил-3'-(2-фурил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
3'-десфенил-3'-(2-тиенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
3'-десфенил-3'-(1-нафтил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
3'-десфенил-3'-(2-нафтил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
3'-десфенил-3'-(4-бромфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
3'-десфенил-3'-(3,4-метилендиоксифенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
3'-десфенил-3'-(3,4-диметоксифенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
3'-десфенил-3'-(4-нитрофенил)-7-дезокси-7β,8β-метан изотаксол;
изотаксол;
3'-десфенил-3'-(4-фторфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-бромбензоил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-метилбензоил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-метоксибензоил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-фторбензоил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси--7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7β,8β-метан-Δ12,13-изотаксол;
N-дебензоил-N-(4-метоксибензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7β,8β-метан- изотаксол;
изотаксол;
3'-десфенил-3'-(2-фурил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(2-тиенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(1-нафтил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(2-нафтил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(4-бромфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(3,4-метилендиоксифенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(3,4-диметоксифенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(4-нитрофенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(4-фторфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-бромбензоил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-метилбензоил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-метоксибензоил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-фторбензоил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-метилфенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
N-дебензоил-N-(4-метоксибензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-7-фтор-Δ12,13-изотаксол;
3'-десфенил-3'-(2-фурил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
3'-десфенил-3'-(2-тиенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
3'-десфенил-3'-(1-нафтил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
3'-десфенил-3'-(2-нафтил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
3'-десфенил-3'-(4-метоксифенил)-7-дезокси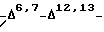 изотаксол;
изотаксол;
3'-десфенил-3'-(4-хлорфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
3'-десфенил-3'-(4-бромфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
3'-десфенил-3'-(3,4-метилендиоксифенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
3'-десфенил-3'-(3,4-диметоксифенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
3'-десфенил-3'-(4-нитрофенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
3'-десфенил-3'-(4-фторфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-(4-бромбензоил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-(4-метилбензоил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-(4-трет-бутилбензоил)-7-дезокси-Δ6,7-Δ12,13-изотаксол;
N-дебензоил-N-(4-метоксибензоил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-фторбензоил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-бромбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-фторфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-метилбензоил)-3'-десфенил-3'-(4-метоксифенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-фторбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол,
N-дебензоил-N-(4-хлорбензоил)-3'-десфенил-3'-(4-хлорфенил)-7-дезокси-Δ6,7-Δ12,13-изотаксол.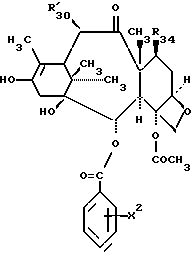
отличающееся тем, что X2 выбирают из группы, включающей -H, -C1-C4-алкил, C1-C3-алкокси, R'30 и R34, одинаковые или разные, выбирают из группы, включающей -OC(O)C1-C6-алкил, -OC(O)OC1-C6-алкил, -OC(O)OCH2CX3, где X - галоген, -OC(O)OCH2CH2SiR20 (где R20 - C1-C6-алкил) или -OSi(R16)3, где R16, одинаковые или разные, выбирают из C1-C6-алкила или цикло(C5-C8)алкила.
7-[O-2-(3-метилбутил)диметилсилил]-изобаккатин III,
7-(O-три-н-бутилсилил)-изобаккатин III,
7-(O-циклогексилдиметилсилил)-изобаккатин III, 7-(O-i-пропилдиэтилсилил)-изобаккатин III и
7-(O-циклогептилдиметилсилил)изобаккатин III.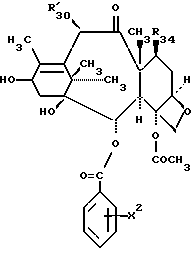
отличающееся тем, что X2 выбирают из группы, включающей -H, -C1-C4-алкил, -C1-C3-алкокси или азид (N3), R'30 и R34, одинаковые или разные, выбирают из группы, включающей -OC(O)C1-C6-алкил, -OC(O)OC1-C6-алкил, -OC(O)OCH2CX3, где X - галоген, -OC(O)OCH2CH2SiR20, где R20 - C1-C6-алкил, или -OSi(R16)3, где R16, одинаковые или разные, выбирают из C1-C6-алкила или цикло(C5-C8)алкила при условии, что по крайней мере один из R20 является вторичным алкилом или циклоалкилом.
7-[O-2-(3-метилбутил)диметилсилил]-баккатин III,
7-(O-три-н-бутилсилил)-баккатин III,
7-(O-циклогексилдиметилсилил)-баккатин III, 7-(O-i-пропилдиэтилсилил)-баккатин III и
7-(O-циклогептилдиметилсилил)-баккатин III.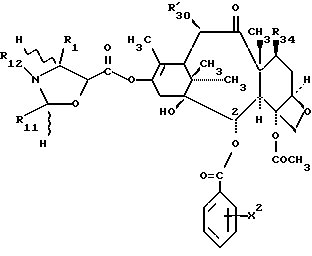
отличающийся тем, что он включает взаимодействие оксазолидинсодержащей свободной кислоты формулы 7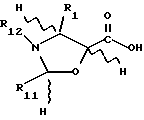
с соединением баккатина формулы 8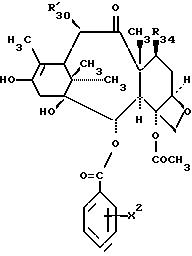
в присутствии дегидратирующего агента,
в котором R'30 и R34, одинаковые или разные, выбирают из группы, включающей -OC(O)C1-C6-алкил, -OC(O)OC1-C6-алкил, -OC(O)OCH2CX3, где X - галоген, -OC(O)OCH2CH2SiR20, где R20 - C1-C6-алкил, или -OSi(R16)3, где R16, одинаковые или разные, выбирают из C1-C6-алкила или цикло(C5-C8)алкила;
X2 выбирают из группы, включающей -H, -C1-C4-алкил, -C1-C3-алкокси или азид (N3);
R1 выбирают из группы, включающей фенил или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил или C1-C3-алкокси;
R11 - фенил, замещенный -(OC1-C2алкилом)n, где n = 1, 2, 3,
R12 - -C(O)NHC1-C10-алкил.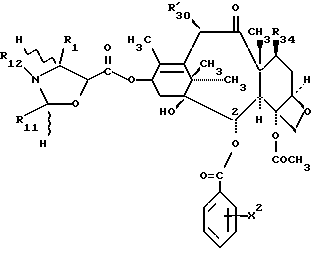
отличающийся тем, что он включает взаимодействие оксазолидинсодержащей свободной кислоты формулы 7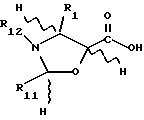
с соединением баккатина формулы 8'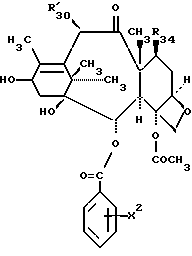
в присутствии дегидратирующего агента,
в которой R'30 и R34, одинаковые или разные, выбирают из группы, включающей -OC(O)C1-C6-алкил, -OC(O)OC1-C6-алкил, -OC(O)OCH2CX3, где X - галоген, -OC(O)OCH2CH2SiR20, где R20 - C1-C6-алкил, или -OSi(R16)3, где R16, одинаковые или разные, выбирают из C1-C6-алкила или цикло(C5-C8)алкила;
X2 выбирают из группы, включающей -H, -C1-C4-алкил, -C1-C3-алкокси или азид (N3);
R1 выбирают из группы, включающей фенил или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил или C1-C3-алкокси;
R11 - фенил, замещенный -(OC1-C2алкилом)n, где n = 1, 2, 3;
R12 - -C(O)NHC1-C10-алкил.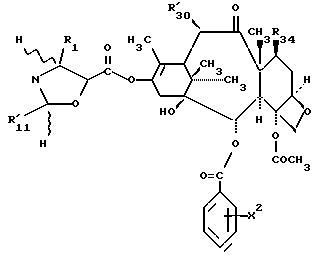
отличающийся тем, что он включает взаимодействие оксазолидинсодержащей свободной кислоты формулы 7'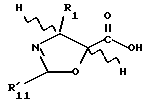
с соединением баккатина формулы 8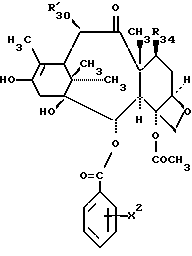
в присутствии дегидратирующего агента,
в которой R'30 и R34, одинаковые или разные, выбирают из группы, включающей -OC(O)C1-C6-алкил, -OC(O)OC1-C6-алкил, -OC(O)OCH2CX3, где X - галоген, -OC(O)OCH2CH2SiR20, где R20 - C1-C6-алкил, или -OSi(R16)3, где R16, одинаковые или разные, выбирают из C1-C6-алкила или цикло(C5-C8)алкила;
X2 выбирают из группы, включающей -H, -C1-C4-алкил, или -C1-C3-алкокси или азид (N3);
R1 выбирают из группы, включающей фенил или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил или C1-C3-алкокси;
R'11 - фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил.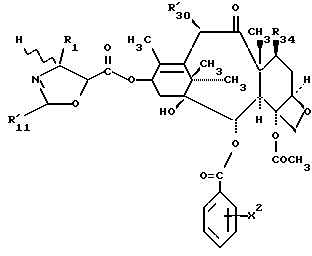
отличающийся тем, что он включает взаимодействие оксазолидинсодержащей свободной кислоты формулы 7'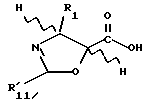
с соединением баккатина формулы 8'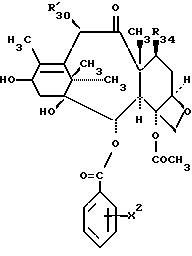
в присутствии дегидратирующего агента,
в которой R'30 и R34, одинаковые или разные, выбирают из группы, включающей -OC(O)C1-C6-алкил, -OC(O)O-C1-C6-алкил, -OC(O)OCH2CX3, где X - галоген, -OC(O)OCH2CH2SiR20, где R20 - C1-C6-алкил, или -OSi(R16)3, где R16, одинаковые или разные, выбирают из C1-C6-алкила или цикло(C5-C8)алкила;
X2 выбирают из группы, включающей -H, -C1-C4-алкил, или -C1-C3-алкокси или азид (N3);
R1 выбирают из группы, включающей фенил или фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил или C1-C3-алкокси;
R'11 - фенил, замещенный одной, двумя или тремя группами, представляющими собой C1-C4-алкил.
| WO 9010443 A, 1990 | |||
| Способ определения места повреждения и контроля неоднородностей проводов и кабелей | 1974 |
|
SU534708A1 |
| Устройство для испытания изоляции электрических кабелей | 1975 |
|
SU534709A1 |
| Лигатура | 1976 |
|
SU558959A1 |
| УСТРОЙСТВО для ГОРЯЧЕЙ НАВИВКИ ПРУЖИН из ПРУТКА | 0 |
|
SU253738A1 |
Авторы
Даты
1999-12-20—Публикация
1995-01-26—Подача