Изобретение относится к материалам и методологии контроля распространения инфекции вируса гепатита C /HCV/. Более конкретно, оно относится к полипептидам, полезным иммунологическим реагентам для обнаружения, профилактики и лечения инфекций вируса гепатита C /HCV/, а также к используемым иммунологическим анализам и наборам.
Предпосылки
HCV впервые был выделен и охарактеризован как первичная причина пост-трансфузионного ни A - ни B гепатита (NANBH) Houghton и другими. Помимо значительного объема информации по HCV, Houghton и другие, а также его коллеги раскрыли ряд общих и специфических иммунологических реагентов и методов. См., например, Houghton и др. Публикация ЕПВ N 318, 216 Houghton и др. публикация ЕПВ 388232; Choo и др. Science /1989/ 244 : 359 - 362; Kuo и др. Science /1989/ 244 : 362 - 364; Takeuchi и др. J. Gen. Virol /1990/ 71: 3027 - 3033; Takeuchi и др. Gene /1990/ 91: 287 - 291; Takeuchi и др. Nucl. Acids Res. /1990/ 18: 4626; Miyamura и др. Proc. Natl. Acad Sci. США /1990/ 87: 983 - 987 Saito и др. Proc. Natl. Acad Sci. США /1990/ 87: 6547 - 6549 Choo и др. Proc. Natl. Acad Sci. USA /1991/ 88: 2451 - 2455; Han и др. Proc. Natl. Acad Sci. США 88: 1711 - 1715, Houghton и др. Hepatology /1991/ 14: 381 - 388; Weiner и др. Proc. Natl. Acad. Sci. США /1992/ 89: 3468 - 3472. Эти публикации предлагают достаточно подробную информацию по HCV в общем, и по получению и использованию полипептидных иммунологических реагентов HCV. Поэтому для краткости раскрытие этих публикаций включено сюда ссылкой.
Другие специалисты применили и совершенствовали далее работу Houghton и др. См. , например, Highfield и др. патентная заявка Великобритании 2239245 /The Welcome Foundation Ltd.) Wang. публикация ЕПВ N 442394 /United Biomedical Inc.); Leung и др. публикация ЕПВ N 445423 /Abbott Laboratories/; Habits и др., публикация ЕПВ N 451891 /Akzo N. V./; Reyes и др., публикация PCT N WO 91/15516 /Genelabs Inc./: Maki и др. публикация ЕПВ N 468657 /Tonen Corp. / и Kamada и др. публикация ЕПВ N 469348 /Shionogi Seiyaki K.K./. См. также Matsuura и др. /1992/. J. Virology, 66; 1425, Kato и др. Proc. Natl. Acad. Sci. США /1990/ 87: 9524 - 9528: Takamizawa и др. J. Virol /1991/ 65: 1105 - 1113; Chiba и др. Proc. Natl. Acad. Sci. США /1991/ 88 4641 - 4645; Harada и др. J. Virol /1990/ 65: 3015 - 3021; Hijikata и др. Proc. Natl. Acad. Sci. США /1991/ 88: 5547 - 5551, Okamoto и др., Jpn. J. Exp. Med /1990/ 60: 167 - 177; Yuasa и др. J. Gen. Virol /1991/ 72: 2021 - 2024; Watanabe и др. Int. J. Cancer /1991/ 48: 340 - 343.
Чувствительные специфические методы скрининга и распознавания носителей HCV и зараженной HCV крови или продуктов крови представляют собой значительный шаг вперед в медицине. Посттрансфузионный гепатит /PTH/ имеет место приблизительно у 10% пациентов после переливания и 90% заражения вирусом гепатита C можно отнести к этим случаям. Основной проблемой в этом заболевании является частое развитие хронических заболеваний печени /25 - 55%/ в сравнении с другими видами гепатита, такими как тип B.
Уход за больными, а также профилактика переноса HCV с кровью или продуктами крови или при близком личном контакте требуют надежных диагностических и прогностических инструментов, таких как полипептиды HCV, чтобы обнаружить антитела на HCV. Такие полипептиды полезны также в качестве вакцин и иммунотерапевтических лечебных агентов для профилактики и/или лечения заболеваний. Поскольку HCV является относительно новым агентом, существует необходимость в определении дополнительных иммунологических реагентов, которые позволяют дальше изучать клиническую картину заболевания и эпидемиологию HCV.
Раскрытие изобретения
Заявители провели дополнительные серологические исследования по антигенам HCV и обнаружили, что иммуноанализы, использующие оболочечные антигены HCV, которые сохраняют конформационные эпитопы, гораздо эффективнее в обнаружении антител против HCV, нежели анализы, использующие те же антигены с линейными эпитопами.
Соответственно, один аспект этого изобретения представляет собой метод обнаружения антител к вирусу гепатита C /HCV/ в компоненте организма млекопитающего, который, как предполагают, содержит указанные антитела и включает контактирование указанного компонента тела с антигеном HCV, содержащим конформационный эпитоп из E1 или E2 домена HCV, в условиях, которые позволяют иммунологическую реакцию между антителами /при наличии таковых/ и антигеном, и обнаружение наличия иммунных комплексов /при наличии таковых/ указанных антител и антигенов.
В других вариантах метода антигены кодируются в E1 и/или E2 доменах или являются E1 и/или E2 антигенами. В некоторых вариантах антигены могут экспрессироваться рекомбинантным вирусом осповакцины или экспрессироваться в клетках яичника китайского хомячка (CHO). Кроме того, в некоторых вариантах изобретения включается второй антиген, состоящий из другого конформационного эпитопа.
Другой аспект изобретения представляет собой метод отбора компонентов крови на HCV до использования такой крови или компонентов крови для получения продуктов крови и он включает:
а. реакцию компонента организма от потенциального донора с антигеном HCV, содержащим конформационный эпитоп из E1 или E2 доменов HCV в условиях, которые позволяют проведение иммунологической реакции между антителами в компоненте организма /при наличии таковых/ и антигеном;
б. обнаружение комплексов, образовавшихся между антигеном и антителами, при наличии таковых, и
в. уничтожение крови или компонента крови от данного донора, если на стадии обнаружены такие комплексы.
И еще одним аспектом изобретения является иммунологический набор для обнаружения антител HCV, включающий антиген HCV, содержащий конформационный эпитоп из E1 или E2 доменов HCV, контрольные стандарты, упакованные в подходящие ампулы и инструкции для использования компонентов набора.
Краткое описание чертежей
Фиг. 1 является схемой, указывающей предполагаемые домены полипротеина HCV.
Фиг. 2 - схема, показывающая некоторые черты вектора, p C59.
Фиг. 3A, 3B и 3C показывают процент пациентов Группы I, II и III реактивных в твердофазных иммуноферментных анализах /ELISA/ против отдельных антигенов HCV.
Подробное описание изобретения
"Антиген HCV" относится к полипептиду или аналогу полипептида /например, мимитопам/, содержащим аминокислотную последовательность /и/или аминокислотные аналоги/, определяющую по меньшей мере один эпитоп HCV. Обычно последовательности, определяющие эпитоп, соответствуют аминокислотной последовательности белка HCV /либо идентично, либо через замещение аналогов остатка природной аминокислоты, которые не разрушают эпитоп/. В общем, последовательность, определяющая эпитоп, будет составлять 5 или больше аминокислот по длине, более типично 8 или больше аминокислот по длине и еще типичнее 10 или больше аминокислот. Что касается конформационных эпитопов, длина последовательности, определяющей эпитоп, может быть подвержена значительным вариациям, поскольку считается, что эти эпитопы формируются мерной конфигурацией антигена /например, укладкой/. Таким образом, аминокислот, определяющих эпитоп, может быть относительно немного по числу, но они широко разбросаны по длине молекулы /или даже по разным молекулам в случае димеров и пр./, и правильная конформация эпитопа достигается укладкой. Части антигена между остатками, определяющими эпитоп, не являются существенными для конформационной структуры эпитопа. Например, делеция или замещение этих вставочных последовательностей может не повлиять на конформационный эпитоп, при условии, что сохранены последовательности, имеющие значение для эпитопа /например, цистеины, участвующие в дисульфидной связи, сайты гликозилирования и пр./
Антигены HCV настоящего изобретения включают конформационные эпитопы из E1 и/или E2 /оболочечных/ доменов HCV. E1 домен, который, как считают, соответствует белку оболочки вируса, охватывает аминокислоты 192-383 полипротеина HCV /Публикация PCT N 091/15771, фиг. 1/. При экспрессии в системе яичника китайского хомячка /гликозилированный/ считают, что его приблизительный молекулярный вес составляет 35 кДа, как определено с помощью додецилсульфата натрия-электрофореза на полиакриламидном геле / - PACE/. Белок E2, ранее называемый NS1, как полагают, охватывает аминокислоты 384-800 полипротеина и является также оболочечным белком. При экспрессии в системе яичника китайского хомячка /гликозилированный/, он имеет истинный молекулярный вес на геле около 72 кДа. Понятно, что эти концевые участки белка являются аппроксимациями /т. е. C - конец E2 может лежать где-то в области 750-820 аминокислот/.
Следует понимать, что последовательность HCV1 изолята прототипа в вышеупомянутой заявке PCT дается только в целях иллюстрации и что в практике изобретения любой изолят HCV /см. , например, ссылки, данные в части "Предпосылки"/ является подходящим источником E1 и/или E2 последовательности.
E1 и E2 антигены, используемые в настоящем изобретении, могут быть вирусными непроцессированными белками, фактически их непроцессированными вариантами или их функциональными фрагментами /т.е. фрагментами, в которых не отсутствует последовательность, важная для образования или сохранения конформационного эпитопа/. Кроме того, антигены HCV настоящего изобретения могут также включать другие последовательности, которые не блокируют или не препятствуют образованию нужного конформационного эпитопа. Наличие или отсутствие конформационного эпитопа можно легко определить отбором нужного антигена с помощью антитела /поликлональной сыворотки или моноклональной к конформационному эпитопу/ и сравнением его реактивности с реактивностью денатурированного варианта антигена, который сохраняет только линейные эпитопы /при наличии таковых/. В таком отсеве, использующем поликлональные антитела, лучшие вначале адсорбировать поликлональную сыворотку денатурированным антигеном и посмотреть, сохраняет ли она антитела к интересующему нас антигену.
Антигены HCV настоящего изобретения можно получить любым удобным методом, который дает нужный конформационный эпитоп. Например, рекомбинантная экспрессия в клетках млекопитающего или насекомого представляет собой предпочтительный метод получения секретированных гликозилированных E1 и/или E2 антигенов в "нативной" конформации. Однако можно, как известно, в отношении белков, экспрессировать антигены в других рекомбинантных носителях и ренатурировать белок после выделения. Подразумевается, что с помощью химического синтеза можно также получить конформационные мимотопы антигена, которые перекрестно реагируют с конформационным эпитопом "нативного" антигена.
Комплексы E1 и/или E2 /также называемые агрегатами/, содержащие более одного E1 или E2 мономера, также являются предпочтительными антигенами. E1 : E1 димеры, E2 : E2 димеры и E1 : E2 гетеродимеры также все являются антигенами, которые включены в объем изобретения. Агрегаты могут включать более крупные формы и иметь молекулярные веса свыше 800 кДа.
"Полипептид слияния" означает полипептид, в котором антиген/ы/ HCV является частью одиночной непрерывной цепи аминокислот, цепи, которая не встречаются в природе. Антигены HCV могут быть непосредственно связаны друг с другом пептидными связями или разделены введением аминокислотных последовательностей. Полипептиды слияния могут также содержать последовательности аминокислот, экзогенные по отношению к HCV.
"Общая твердая матрица" означает твердый материал, с которым связываются ковалентно или нековалентными средствами, таким как гидрофобная адсорбция, отдельные антигены HCV или полипептид слияния, состоящий из антигенов HCV.
"Компонент организма" означает жидкость или ткань млекопитающего индивида /например, человекообразного, человека/, которые обычно содержат антитела, продуцируемые индивидом. Такие компоненты известны в области техники и включают без ограничения кровь, плазму, сыворотку, спинно-мозговую жидкость, лимфоидную жидкость, секреты дыхательного, кишечного или мочеполового трактов, слезы, слюну, молоко, белые кровяные клетки и миеломы. Компоненты организма включают биологические жидкости.
Термин "биологическая жидкость" относится к жидкости, полученной из организма. Некоторые биологические жидкости используются как источник других продуктов, таких как факторы коагуляции /например, Фактор VIII : C/, сывороточный альбумин, гормоны роста и других. В таких случаях важно, чтобы источник биологической жидкости был свободен от заражения вирусом, таким как HCV.
"Иммунологически реактивный" означает, что антиген, о котором идет речь, будет специфически реагировать с антителами против HCV, присутствующими в компоненте организма от зараженного HCV индивида.
"Иммунный комплекс" означает комбинацию, образованную, когда антитело связывается с эпитопом на антигене.
"E1" здесь относится к белку или полипептиду, экспрессированному в первых 400 аминокислотах полипротеина HCV, иногда его называют E- или S-белком. В своей природной форме это гликопротеин в 35 кДА, который находится в сильной ассоциации с мембраной. В большинстве природных штаммов HCV белок E1 закодирован в вирусном полипротеине следующим за C /сердцевинным/ белком. E1 белок простирается приблизительно от аминокислоты /ак/ 192 до 383 непроцессированного полипротеина. Термин "E1" здесь включает также аналоги и усеченные формы, которые иммунологически перекрестно реактивны с природным E1.
"E2" здесь относится к белку или полипептиду, экспрессированному в первых 900 аминокислотах полипротеина HCV, иногда его называют белок NS1. В своей природной форме это гликопротеин в 72 кДа, который находится в сильной ассоциации с мембраной. В большинстве природных штаммов HCV белок E2 закодирована в вирусном полипротеине, следующим за E1 белком. E2 белок простирается приблизительно от ак 384 до 820. Используемый здесь термин E2 охватывает также аналоги и усеченные формы, которые иммунологически перекрестно-реактивны с природным E2.
Термин "агрегат" здесь означает комплекс E1 и/или E2, содержащий более одного E1 или E2 мономера. E1 : E1 димеры, E2 : E2 димеры и E1 : E2 гетеродимеры все являются "агрегатами", входящими в объем этого определения. Агрегаты могут также включать более крупные формы и иметь молекулярные веса свыше 800 кДа.
Термин "очищенный" в применении к белкам здесь относится к композиции, в которой нужный белок содержит по меньшей мере 35% компонента от всего белка в композиции. Нужный белок предпочтительно включает по меньшей мере 40%, еще предпочтительнее по меньшей мере около 50%, а лучше по меньшей мере около 60%, еще лучше около 70%, 80%, 90% и лучше всего по меньшей мере около 95% компонента от всего белка. Композиция может содержать другие соединения, такие как карбогидраты, соли, липиды, растворители и другие, которые не влияют на определение процентной чистоты. "Изолированный" белок HCV представляет собой композицию белка HCV, которая является чистой по меньшей мере на 35%.
Термин "изолированный полипептид" относится к полипептиду, который практически свободен от других вирусных компонентов HCV, в частности геномного полинуклеотида HCV. Полипептидная композиция "фактически свободна" от другого компонента, если вес полипептида в композиции составляет по меньшей мере 70% от веса полипептида и другого компонента в сумме, лучше по меньшей мере около 89%, еще лучше около 90% и лучше всего 95% или больше.
Варианты реализации изобретения
Методы иммуноанализов изобретения используют антигены HCV из E1 и E2 доменов и они сохраняют конформационные эпитопы, опознаваемые антителами в сыворотке индивидов, зараженных HCV. Каждый антиген имеет по меньшей мере один конформационный эпитоп, который существует в частице HCV в природе или его зараженном продукте, как подтверждается иммунореактивностью антигена с антителами в компоненте организма зараженного HCV индивида, и потерей иммунореактивности эпитопа при денатурации антигена. Длина антигена достаточная, чтобы сохранить иммунореактивный конформационный эпитоп, ассоциированный с этим эпитопом. Объем изобретения включает более одного конформационного эпитопа на антигене. Часто природные оболочечные антигены, используемые в иммуноанализах, могут иметь почти полную длину, но могут быть усеченными, например, чтобы повысить растворимость или улучшить секрецию /т. е. делеция мембрано-связующих доменов/. В объем изобретения входит также использование как единичных антигенов, так и комбинаций или агрегатов антигенов. Таким образом, иммуноанализы могут использовать E1 эпитопы, агрегаты или комбинации природных E1 и E2. Использование антигенов с линейными эпитопами в комбинации с оболочечными конформационными эпитопами HCV также входит в объем изобретения.
Методы обнаружения наличия конформационных эпитопов известны в данной области техники и некоторые проиллюстрированы в Примерах заявки.
Если основываться на предполагаемых аминокислотах, закодированных в нуклеотидной последовательности HCV1, и других доказательствах, возможными доменами белка закодированного полибелка HCV, а также приблизительными границами являются следующие:
Предполагаемый домен - Приблизительные границы /N аминокислот/
C/ нуклеокапсидный белок/ - 1-191
E1 /белок оболочки вириона/ - 192-383
E2 /NS1/ оболочка?/ - 384-800
NS2 - 800-1050
NS3 /протеаза?/ - 1050-1650
NS4 - 1651-2100
NS5 /полимераза/ - 2100-3011 /конец/
Однако эти домены являются приблизительными. Например, граница E1 - NS2, вероятно, находится в области 750-810 и граница -NS3 - NS4 - приблизительно где-то около 1640-1650. Существует также свидетельство того, что вариант 191 ак C является предшественником, который процессируется далее /например, до около 170 ак в длину/, и что каждый из белков NS2, NS4 и NS5 дальше процессируется в два зрелых белка. Связь доменов показана на фиг. 1.
Методы получения E1 и E2 антигенов, включая антигены с природными конформациями, описаны Spaete R. и др. Yirology /1892/ 188 : 819 - 830 и в WO92/08734, которые включены сюда ссылкой. Обычно выбираются клетки носителя, которые позволяют образование природных конформационных эпитопов в экспрессированных оболочечных белках; эти клетки носителя могут включать, например, клетки животных, клетки насекомых, дрожжевые клетки и прочие.
Эукариотические носители включают дрожжи и клетки млекопитающих в культуре Saccharomyces cerevisiae и Saccharomyces carlbergensis представляют собой наиболее часто используемые дрожжевые носители и являются традиционными грибковыми носителями. Совместимые с дрожжами векторы несут маркеты, которые позволяют выбор удачных трансформантов посредством придания прототрофности ауксотрофным мутантам или устойчивости к тяжелым металлам на диких штаммах. Дрожже-совместимые векторы могут использовать 2 мк - начало репликации /Broach и др./ 1983/ Meth. Enz. 101 : 307/, комбинацию СЕN 3 и ARS1 или другие средства для обеспечения репликации, такие как последовательности, которые в результате дадут включение соответствующего фрагмента в геном клетки носителя.
Контрольные последовательности для дрожжевых векторов известны в области техники и включают промоторы для синтеза гликолитических ферментов /Hess и др. /1968/ J. Adv. Enzyme Reg 7: 149 : Holland и др./1978/ Biochemistry 17 : 4900/, с включением промотора для 3-фосфоглицераткиназы /Hitzeman 1980/ J. Biol. Chem. 255 : 2073/. Могут также включаться терминаторы, такие как те, которые получают из гена энолазы /Holland /1981/ J. Biol. Chem. 256 : 1385/. Наиболее полезными контрольными системами являются те, которые включают промотор глицеральдегид 3-фосфатдегидрогеназы /GAPDH/ или регулируемый промотор алкогольдегидрогеназы /ADH/, терминаторы, полученные также из GAPDH, и, если нужна секреция, лидерную последовательность из дрожжевого альфа-фактора. Кроме того, транскрипционная регуляторная область и транскрипционная область инициации, которые операбельно связаны, могут быть таковы, что они не ассоциируются природно в диком организме. Эти системы подробно описаны в ЕПВ 120551, опубликованной 3 октября 1984, ЕПВ 116201, опубликованной 22 августа 1984, и ЕПВ 164556, опубликованной 18 декабря 1985, все из которых выданы данному правоприемнику и включены сюда в виде ссылок.
Линии клеток млекопитающего в качестве носителей для экспрессии известны в области техники и включают многие иммортализированные клеточные линии из Коллекции культур американского типа /АТСС/, включает He а клетки, клетки яичника китайского хомячка /CHO/, клетки почти детеныша китайского хомячка /BHK/ и многие другие клеточные линии. Подходящие промоторы для клеток млекопитающих также известны в области техники и включают вирусные промоторы, такие как промотор из вируса обезьяны 40 /SV 40/ /Fiers /1978/ Nature 273 : 113/, вирусы саркомы Рауса /RSV/, аденовируса /ADV/ и вируса папилломы быка /BPV/. Клетки млекопитающих могут также требовать последовательностей терминатора и последовательностей поли A присоединения, энхансерные последовательности, которые повышают экспрессию, можно также включить, а также могут быть желательными последовательности, которые вызывают амплификацию гена. Эти последовательности известны в области техники.
Векторы, приемлемые для репликации в клетках млекопитающего, известны в области техники, и могут включать вирусные репликоны или последовательности, которые обеспечивают интеграцию соответствующих последовательностей, кодирующих NANBV эпитопы в геном носителя.
Вектором, который используется для экспрессии чужеродной ДНК и который может использоваться в приготовлении вакцины, является вирус осповакцины. В этом случае гетерологическая ДНК встраивается в геном вируса огсповакцины. Техника вставки чужеродной ДНК в геном вируса осповакцины известна в области техники и использует, например, гомологичную рекомбинацию. Гетерологичная ДНК обычно встраивается в ген, который является не существенным, например ген тимидинкиназы /tk/, что также дает селектируемый маркер. Были описаны плазмидные векторы, которые значительно облегчают конструирование рекомбинантных вирусов /см., например, Mackett и др. /1984/ J. Virol 49 : 857, Chakrabarti и др. /1985/ Mol. Cell Biol. 5 : 3403 /1987/ в GENE TRANSFER VECTORS FOR MAMMALIAN CELL /Miller and Calor, eds., Cold Spring Harbor Laboratory Cold Spring Harbor, N. Y. /стр. 10/. В этом случае экспрессия полипептид HCV имеет место в клетках или индивидах, которые иммунизированы живым рекомбинантным вирусом осповакцины.
Сегмент кДНК HCV, кодирующий нужную последовательность, встраивается в вирус осповакцины. Последовательность, кодирующая полипептид, может быть присоединена к лидерной последовательности. Лидерной последовательностью может быть последовательность для активатора плазмигогена ткани /TPA/ или из другого источника, например последовательность для бета-глобина. Гетерологичный полинуклеотид можно вставить в вирус осповакцины, который представляет собой модифицированный вариант pSC11 за счет добавления последовательности полилинкера, который содержит клонирующий сайт.
Чтобы обнаружить, экспрессируется или нет полипептид HCV вирусом осповакцины BSC1, клетки можно инфицировать рекомбинантным вектором и вырастить на слайдах для микроскопа в условиях, которые позволяют экспрессию. Затем клетки можно зафиксировать ацетоном и провести иммунофлуоресцентные анализы с использованием сыворотки, которая содержит HCV-антитела к полипептиду /ам/, закодированному в области генома HCV, из которого был получен сегмент HCV в рекомбинантном векторе экспрессии.
Другие системы для экспрессии эукариотических или вирусных геномов включают клетки насекомых и векторы, приемлемые для использования в этих клетках. Эти системы известны в области техники и включают, например, векторы для экспрессии в клетках насекомых, полученные на основе бакуловируса, вируса адерного полиэдроза Autographa californica /AcNPV/, который представляет собой вектор вирусной экспрессии, независимый от помощника. Векторы экспрессии, полученные на основе этой системы, используют обычно сильный промотор гена вирусного полиэдрина для стимуляции экспрессии гетерологичных генов. В настоящее время наиболее часто используемым вектором переноса для введения чужеродных генов в Ac PV является pAc 373.Специалистам данной области известны многие другие векторы для улучшения экспрессии. Они включают, например, pVL 985 /который изменяет инициирующий кодон полиэдрина с ATG на АТГ и который вводит 32 п.о. клонирующего сайта Bam H1 далее от АТГ, См. Luckow и Summers /1989/ Virology 17 : 31/. Хорошая экспрессия неслитых чужеродных белков обычно требует чужеродных генов, которые идеально имеют короткую лидерную последовательность, содержащую подходящие сигналы инициации трансляции, предшествующие сигналу инициации ATG. Плазмида также содержит сигнал полиаденилирования полиэдрина и устойчивый к ампициллину ген и начало репликации для отбора и размножения в E. coli.
Методы введения гетерологичной ДНК в нужный сайт бакуловируса хорошо известны специалистам данной области техники /См. Summer and Smith, Texas Agricultural Experiment Station Bulletin N 1555, Ju и др. /1987/; Smith и др. /1983/ Mol. & Cell Biol. 3 : 2156 - 2165 и Luckow и Summers /1989/ Virology 17 : 31/. Например, вставку можно сделать в ген, такой как ген полиэдрина, гомологичной рекомбинацией, вставка может быть также сделана в сайт рестрикционного фермента, сконструированный в желаемом гене бакуловируса. Вставленные последовательности могут быть теми, которые кодируют все или меняющиеся сегменты полипротеина или другие ORF, которые кодируют вирусные полипептиды.
Сигналы для посттрансляционных модификаций, таких как сигнальное расщепление пептида, протеолитическое расщепление и фосфорилирование, опознаются клетками насекомых. Сигналы, требуемые для секреции и ядерной аккумуляции, также сохраняются между клетками беспозвоночных и клетками позвоночных. Примеры сигнальных последовательностей от клеток позвоночных, которые эффективны в клетках безпозвоночных, известны в области техники, например, сигнал человеческого интерлейкина-2 /IL-2/, который является сигналом для выхода из клетки, опознается и должным образом перемещается в клетках насекомых.
Форматы иммуноанализов
E1 и E2 антигены HCV настоящего изобретения могут использоваться в любом формате анализа, который использует известный антиген для обнаружения антител. Конечно, следует избегать или модифицировать форматы, которые денатурируют интересующий нас конформационный эпитоп HCV. Общим характерным признаком всех этих анализов является то, что антиген контактирует с компонентом организма, который, как предполагают, содержит антитела HCV, в условиях, которые позволяют связываться антигену с любым таким антителом, присутствующим в компоненте. Такими условиями обычно являются физиологическая температура, pH и ионная сила, с использованием избытка антигена. Инкубация антигена с образцом сопровождается обнаружением иммунных комплексов, заключенных в антигене.
Схема иммунологических анализов может значительно варьироваться и в области техники известно много форматов. Протоколы могут, например, использовать твердые подложки или иммунопреципитацию. Большинство анализов включает использование меченого антитела или полипептида, метки могут быть, например, ферментными, флуоресцентными, хемилюминисцентными, радиоактивными или окрашенными молекулами. Анализы, которые усиливают сигналы от иммунного комплекса, также известны, такими примерами являются анализы, которые используют биотин и авидин и меченый фермент, и анализы, такие как твердофазный иммуносорбентный анализ и анализы.
Иммуноанализы могут быть без ограничения в гетерогенном или гомогенном формате и могут представлять стандартный или конкурентный тип. В гетерогенном формате полипептид обычно связан с твердой матрицей или подложкой, чтобы облегчить отделение образца от полипептида после инкубации. Примерами твердых подложек, которые используются, являются нитроцеллюлоза /например, в форме мембраны или микротитровальных лунок/, полистиреновый латекс /например, в шариках или бусинах или микротитровальных планшетах/, поливинилхлорид /например, в листах или микротитровальных лунках/, поливинилфторид /известный как Иммунлон/, диазотированная бумага, найлоновые мембраны, активированные бусины и бусины с белком A. Например, в гетерогенном формате можно использовать микротитровальные планшеты из Dynatech Immunlon 1 или Immunlon 2, или полистиреновые бусины размером 0,25 дюймов /0,63 см /Precision Plastic Ball/. Твердая подложка, содержащая антигенные полипептиды, обычно промывается после отделения ее от тестируемого образца и до обнаружения связанных антител. Как стандартный, так и конкурентный форматы известны в области техники.
В гомогенном формате тестируемый образец инкубируется комбинацией антигенов в растворе. Например, это может быть в условиях, в которые будут осаждаться какие-либо комплексы антиген-антитело, сформировавшиеся в реакции. И стандартный и конкурентный форматы известны в этой области.
В стандартном формате непосредственно контролируется количество антител HCV в комплексах антитело-антиген. Это можно провести определением того, будут ли в связи с образованием комплекса связываться меченые антиксеногенные антитела, которые распознают эпитоп на антителах против HCV.
В конкурентном формате количество антител HCV в образце выводится конкурентным воздействием на связывание известного количества меченого антитела /или другого конкурирующего лиганда/ в комплексе.
Образованные комплексы, содержащие антитело против HCV /или в случае конкурентных анализов - количество конкурирующего антитела/, обнаруживаются любой из множества известных технологий, в зависимости от формата. Например, немеченые антитела HCV в комплексе можно обнаружить, используя конъюгат антиксеногенного Ig, комплексованного с меткой /например, ферментной меткой/.
В формате анализа иммунопреципитации или агглютинации реакция между антигенами HCV и антителом образуют сетку, которая осаждается из раствора или суспензии и образует видимый слой или пленку преципитата. Если в тестируемых образцах нет антитела против HCV, никакого видимого преципитата не образуется.
На настоящий момент существует три специфических типа анализов агглютинации частиц /PA/. Эти анализы применяются в обнаружении антител на различные антигены, когда они нанесены на подложку. Одним типом этого анализа является анализ гемагглютинации, использующий красные кровяные клетки /RBC/, которые сенсибилизируются пассивно адсорбирующим антигеном /или антителом/ к RBC. Добавление антител специфического антигена, присутствующих в компонент тела, при наличии таковых, заставляет агглютинироваться RBC, покрытые очищенным антигеном.
Чтобы исключить потенциальные не- специфические реакции в анализе гемагглютинации, вместо RBC в PA можно использовать два искусственных носителя. Чаще всего используются частицы латекса. Однако можно применять и частицы желатина. Анализы, использующие любой из этих носителей, основаны на пассивной агглютинации частиц, покрытых очищенными антигенами.
E1 и E2 антигены HCV, включающие конформационные эпитопы, как правило, упаковываются в набор для использования в этих иммунологических анализах. Набор обычно содержит в отдельных контейнерах природный антиген HCV, препараты контрольного антитела /положительного и/или отрицательного/, меченое антитело, если формат анализа требует его наличия, и реактивы, образующие сигнал /например, ферментная подложка/, если метка не образует сигнал непосредственно. Природный антиген HCV может быть уже связан с твердой матрицей или находиться отдельно с реагентами для связывания его с матрицей. В набор обычно кладутся инструкции /т.е. письменные, пленки, CD-ROM и т.д./ для пользования набором.
Иммуноанализы, которые используют природный антиген HCV, полезны в отсеве крови для получения запаса, в котором будет отсутствовать потенциально инфекционный HCV. Метод получения запаса крови включает следующие этапы: реакцию компонента организма, предпочтительно крови или компонента крови от индивида, дающего кровь с природным E1 или природным E2 антигеном HCV с целью проведения иммунологической реакции между антителами HCV, при наличии таковых, и антигена HCV, обнаружение того, образуются ли в результате реакции комплексы анти-HCV антитело-антиген HCV. Кровь, предназначенная для пополнения запаса, берется от доноров, которые не дают антитела на природные антигены HCV, E1 или E2.
В случаях положительной реактивности на антиген HCV желательно повторить иммуноанализ, чтобы снизить возможность ложно-положительных результатов. Например, в крупно-масштабном скрининге крови для получения продуктов крови /например, крови для переливания, плазмы, фактора VIII, иммуноглобулина и пр. / тесты "скрининга" имеют обычно такой формат, чтобы повысить чувствительность /гарантировать, что зараженная кровь не попадет/ за счет специфичности; т. е. ложно-положительный показатель возрастает. Таким образом, как правило, на повторное тестирование отправляют тех доноров, которые "повторно реактивны", т.е. положительны в двух или более сериях иммуноанализов на донорской пробе.
Следующие примеры иллюстрируют изобретение и никоим образом не ограничивают его.
Пример 1
Конструирование PSC 59 Поли
Последовательность HCV, используемая для конструирования, была изолирована из плазмиды pC5P-1 в качестве StuI частичного/ /Bg 111 фрагмента. Этот фрагмент тянется от первого метионина полипротеина HCV-1 до аспарагиновой кислоты в позиции 966. Включенными доменами являются соответственно нуклеокапсид, C, оба предлагаемые оболочечные гликопротеина, E1 и E2, и усеченная форма NS2. Кроме того, фрагмент также содержит около 60 п.о., соответствующих этой части 5'-нетранслированной области генома HCV.
Фрагмент обрабатывался полимеразой Кленова, чтобы получить тупые концы, и затем клонировался в StuI сайт вирцеи осповакцины, PSC 59 /полученный от Д-ра Б. Мосса Национальных институтов здоровья, Bethesda, Md/. Вектор показан на фиг. 2. Как результат лигирования в полилинкерную последовательность вектора C'-конец NS2 области содержит дополнительную Pro-Tyr последовательность.
Пример 2
Получение штаммов вируса осповакцины кодирующего фрагмент полипротеина HCV, включающий E1 и E2
Отбор рекомбинантного вируса осповакцины проводился, как описано Mackett и др. в DNA Cloning т.11, Изд. D.M.Glovеr. IRL Press, Oxford, England, 1985, cnh. 191-211. Более конкретно, сливающийся монослой /6-ти сантиметровая чашка/ почечных клеток африканской зеленой мартышки, BSC40, был инфицирован диким вирусом коровьей оспы /штамм WR/ и множественным заражением/ MOI/ в 0,05. После 2-х часовой инкубации при 37oC клетки трансфицировались 25 μг поли ДНК PSC59 c использованием метода фосфата кальция. После 4-х часов инкубации среда была изменена до нормальной среды и клетки инкубировались еще 48 часов при 37oC. Клетки собирались соскребанием их с чашки и вирус высвобождался 3 циклами замораживания - оттаивания и высвобожденный вирус в клеточном лизате хранился при -80oC.
Чтобы отобрать рекомбинантный вирус, сливающийся монослой человеческих клеток 143 ТК инфицировался 2 часа клеточным лизатом в 10-кратных серийных разбавлениях. После удаления инокулята добавлялась 1% агароза в сывороточной среде, содержащей 25 μг/мл-5-бромодеоксиуридина, и клетки инкубировались 72 часа при 37oC. Бляшки можно было видеть при наложении на слой клеток 1% агарозы плюс 0,01% нейтрального красного и инкубировании клеток всю ночь при 37oC. Затем слой агарозы аккуратно снимался и слой клеток блотировался нитроцеллюлозным фильтром хозяина /Schleir и Schuell, BA 85, 0,45 μм/. Чашка с репликой фильтра хозяина была получена и зондировалась зондом гибридизации с меткой 32 P на последовательность HCV. Положительные бляшки изолировались от фильтра хозяина, помещались в 0,5 милллитровую среду, свободную от сыворотки, и дважды в течение 30 секунд обрабатывались ультразвуком. Процесс отсева повторялся дважды, чтобы очистить вирус от бляшек.
Чтобы размножить рекомбинантный вирус коровьей оспы, десять чашек /150 см2/ клеток BSC 40 инфицировались вирусным штаммом с множественным заражением в 0,5, инфицирование проводилось 2 часа при 37oC и вирусный штамм заменялся свежей средой. После 72 часов клетки собирались, суспендировались в 10 мМ Трис HCl, pH 9,0 и гомогенизировались в мельнице Уитона. Остатки клеток удалялись центрифугированием, надосадочные слои подвергались воздействию трипсина и ультразвука и аликвоты вирусных суспензий хранились при -80oC.
Пример 3
Получение E1/E2 антигенов
Один литр спиннер (spinner) клеток Hela 3 выращивались в спиннер (spinner) колбе до плотности 106 клеток на мл. Клетки инфицировались рекомбинантным вирусом осповакцины, кодирующим фрагмент полипротеина HCV, с использованием множественного заражения 1,0, инкубировались всю ночь, собирались и хранились в виде осадка клеток после центрифугирования при -80oC.
Продукт экспрессии E1/E2 очищался лизированием клеток в гипотоническом буфере с последующей экстракцией в буфере, содержащем неионный детергент. Клеточный экстракт хроматографировался на лектин /GNA/ агарозной колонне. Нужные белки элюировались из колонны метил-α - D-маннопиранозидом /Sigma Corp./ Элюированные фракции отслеживались на E1 и E2 вестерн-блоттом с использованием специфической антисыворотки против E1 или E2. Фракции, содержащие антигены, были сгруппированы и концентрированы на колонне с S-сефарозой /Pharmacia/.
Частота конечного продукта была около 70%.
Пример 4
Использование E1/E2 для иммуноанализов
Пациенты
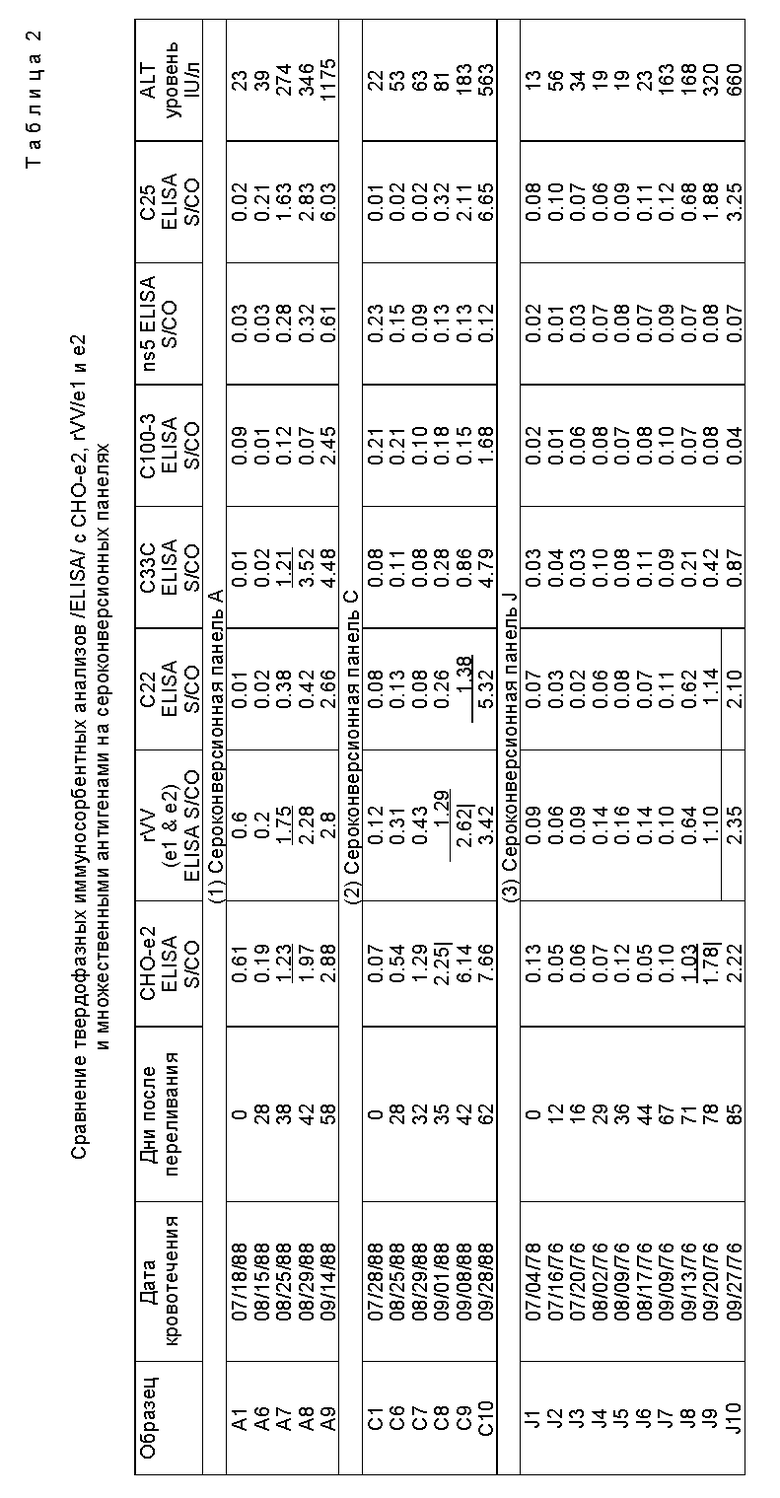
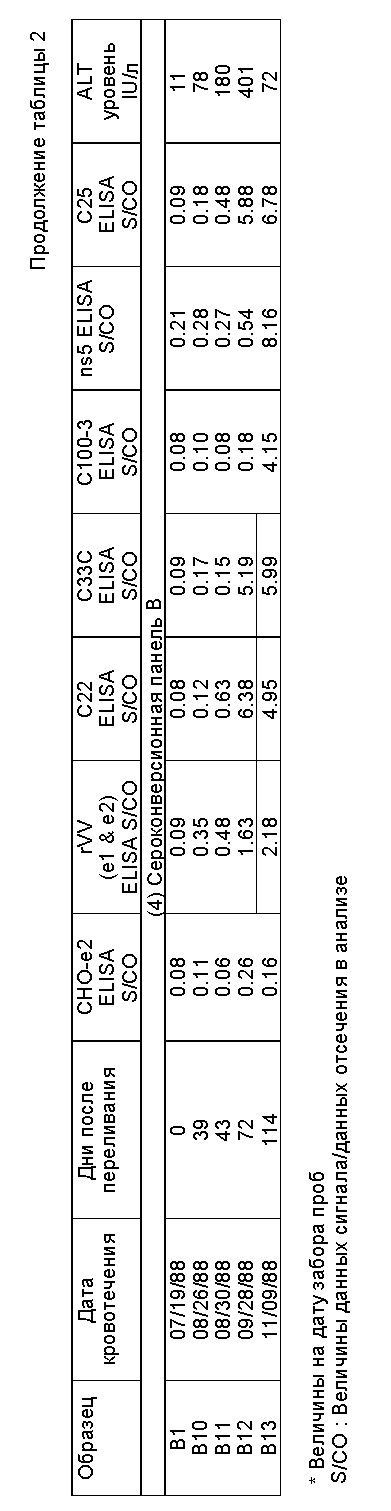
Образцы сыворотки были получены от произвольно выбранных платных доноров плазмы из восточных, западных, средне-западных и южных штатов США, которые были представлены Uniglobe Reseаrch Corporation/ Reseda, ICA/. Образцы сыворотки, представленные H.Tong /Huntington Memorial Hospital в Пасадене, Калифорния/, были получены от группы из 38 пациентов с трансфузионным хроническим ни A - ни B гепатитом и другой группы в 39 пациентов, принимающих лекарства IV с хроническим NANBH. Эти 77 пациентов не страдали другими заболеваниями печени, не были реактивы к анти- HAV и анти-HbSag, и антиядерные антитела, АНФ /ANA/ были нормальными. Три сероконверсионные панели трансфузионного HCV были получены от H.Alter/ Национальные институты здоровья, Bethesda, Maryland/ и Serologicals Incorporation at Clarkston, Georgia.
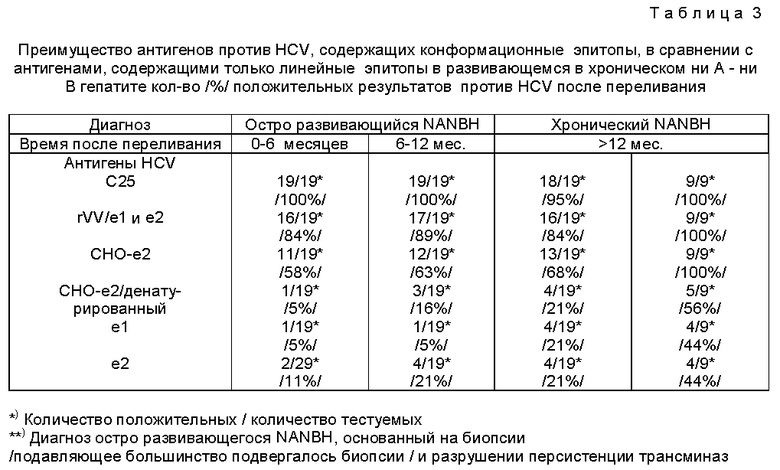
Пробы острого HCV были предоставлены Институтом Макса фон Петленко фера, Университет Мюнхена, Мюнхен, Германия/. 19 случаев острого NANBH были диагностированы на основании биопсии печени и нормальных уровнях аланин аминотрансферазы /ALT/ во время долгосрочных последующих исследований /2-11 лет/.
Экспрессия и очистка рекомбинантных антигенов HCV
C22 /119 ак/, E1/130ак/, E2/251ак/, NS5 /942 ак/ и химерный C25 /также называемый к 200/к22/ /858 ак/ антигены были экспрессированы как внутренние антигены в дрожжах S. cerevisiae как C- конечные слияния с человеческой супероксиддисмутазой /SOD/, используя методы, описанные ранее Kuo, G. и др.; Science /1989/ 244: 362-364 и Causens и др. Gene /1987/ 61: 265-272. C33C антиген /266 ак/ был экспрессирован как внутренний полипептид слияния SOD в E. coli с использованием методов, описанных ранее для синтеза 5-1-1- антигена/ см.PCT W089/046699; публикацию EПВ N 318216 и Houghton и др., Science 244: 359/1989/,которые включены сюда ссылкой/. После разрыва клеток и центрифугирования нерастворимые полипептиды слияния SOD экстрагировались из клеточного осадка либо 5M мочевины, либо 1% ДНС и очищались либо гелевой фильтрацией, либо комбинацией ионообменной хроматографии/ Q и S -сефароза/ и хроматографии с гелевой фильтрацией /Sephacryl S-300 HR/.
Нативный E1 и E2 антиген HCV, также названный rVV/ e1 и e2/, был очищен от эндоплазматического ретикулума клеток, инфицированных рекомбинантным вирусом коровьей оспы /rvv/, которые содержат полноразмерные E1 и E2 гены HCV. Очистка завершалась аффинной хроматографией с последующей ионообменной хроматографией в неденатурирующих условиях. Эти методы описаны в W092/08734, которая включена сюда ссылкой.
Нативный E2 антиген HCV, CHO-2e, был получен по Spaete и др. Virology /1992/ 188: 819 - 830. Более конкретно, клеточная линия яичника китайского хомячка, продуцирующая CHO-e2 антиген, была построена из плазмы, содержащей последовательность HCV-1, кодирующую Ala383 в Glu 661. Затем плазмида была трансфицирована в клетки CHO /яичника китайского хомячка/ для получения стабильной линии, экспрессирующей непроцессированной e2 /называемый также e2/ns 1/ антиген. Клоны, демонстрирующие высокую экспрессию, отбирались и размножались в роллерных бутылках выращиванием в DME/H21 с 10% диализированной фетальной телячьей сывороткой и обычными добавлениями плюс 1,6 μМ метотраксата. Надосадочная жидкость среды культуры собиралась и использовалась для очистки CHO-e2 антигена. Схема очистки включала аффинную и ионообменную хроматографию в не-денатурированных условиях.
Для возмущения природных e2 предполагаемых конформационных эпитопов денатурированный CHO-e2 был получен добавлением DL-дитиотрейтола /DTT/ к окончательной концентрации в 10 мм, 0,2% додецил-сульфата натрия /SDS/ и кипячением при 100oC в течение 5 минут. Все очищенные рекомбинантные антигены HCV были чистыми по меньшей мере на 90%, как показали анализ с SDS на полиакриламидном геле и окрашивание Кумасси голубым.
Твердофазные иммуноферментные анализы /ELISA/
RVV/e1 и e2/, CHO- e2 и денатурированный CHO-e2 антигены разбавлялись до оптимальной концентрации в фосфатном буферном физрастворе /PBS/ /pH 7,4/ и наносились покрытием на планшеты Immulon 1/ Dynatech, Chantilly ELISA анализы проводились следующим образом. Тестируемые пробы на планшете разбавлялись в 40 раз разбавителем образца и инкубировались 1 час при 37oC, затем промывались промывочным буфером. К каждой лунке добавлялось поликлональное козье антитело против человеческого IgG /H + L/, конъюгированное с пероксидазой хрена /HRPO/. Планшеты инкубировались 1 час при 37oC и затем промывались. Для проявления цвета пероксидазы хрена добавлялись о-фенилендиамин 2HCl/OPD/ и перекись водорода. Результаты считывались с использованием планшет-ридера на 492/620 нм. Величины отсечения данных ELISA для антигена RVV/e1 и e2/, SOD, C25, C22, C33C и ns-5 составили 0,43 плюс данные наблюдения от средней величины отрицательного контроля. Величины отсечения CHO-e2 и денатурированного CHO-e2 были 0,3 данных плюс данные от соответствующего антиген-отрицательного контроля. Величина отсечения анти- C100-3 составила 0,345 данных наблюдения плюс его средние данные отрицательного контроля.
Результаты иммуноанализа
Результаты анализов ELISA, использующих антигены, описанные выше для обнаружения антител против HCV в компонентах крови у групп пациентов США, показаны в Таблице 1.
Результаты в Таблице 1 показывают, что продуцируемые дрожжами оболочечной антигены e1 и e2 HCV гораздо менее иммунореактивны, чем рекомбинантные антигены, продуцированные в вирусе осповакцины PVV /е1 и e2/ и в клетках яичника китайского хомячка, CHO- e2. В каждой исследуемой группе реактивность продуцируемых дрожжами антигенов e1 и e2 составила 2/3 или менее активности антигенов, продуцированных в клетках животных. Следует отметить, что дрожжевые антигены e1 и e2 продуцировались в дрожжевых клетках и очищались в условиях денатурации. Таким образом получается, что в этих антигенах существуют только линейные эпитопы. В отличие от них антигены HCV, RVV /e1 и e2/ и CHO-e2 были изолированы из животных клеток носителя в неденатурирующих условиях, что обеспечило наличие природных конформационных эпитопов.
Как оказалось, рекомбинантные природные антигены HCV, экспрессированные из E1 и E2 генов в клетках, также иммунореактивны, как C33C и, возможно, C25, и более иммунореактивны, чем любой из других исследуемых антигенов. C25 представляет собой химерный полибелок, состоящий из частей полипептидов NS3, NS4 и C, слитых, как показано на фиг.1.
Роль конформационных эпитопов в стимуляции ранней реакции иммунной системы носителя оценивалась иммуноанализом сероконверсионных панелей HCV. Результаты в Таблице 2 показывают иммунореактивность природных оболочечных антигенов HCV, RVV /e1 и e2/ и CHO- e2 с образцами в трех сероконверсионных панелях. Каждый образец в панелях представляет последовательный забор крови от индивида с пост-трансфузионным ни A - ни B гепатитом /AH/. Как видно из результатов Таблицы 2, природные оболочечные антигены HCV, т.е. антигены с природными конформационными эпитопами, обнаруживают антитела, которые вырабатываются, относительно быстро в ходе заражения, по сравнению с другими тестируемыми антигенами HCV. Таким образом, эти антигены представляют собой особую ценность в иммуноанализах на диагностику заражения HCV.
В Таблице 3 представлены результаты сравнения природных антигенов HCV, экспрессированных из E1 и Е2 генов, с денатурированными антигенами. В Таблице 3 иммунореактивность с сывороткой от пациентов с остро развивающимся NANBH /ни A - ни B гепатитом/ прослеживалась во времени и сравнивалась с реактивностью сыворотки от пациентов с хроническим NANBH. Как видно из Таблицы 3, природные оболочковые антигены HCV, которые содержат как конформационные, так и линейные эпитопы, RVV /e1 и e2/ и CHO- e2, более иммунореактивны, чем антигены, содержащие только линейные эпитопы, e1 и e2 /продуцируемые в дрожжах/ и денатурированный CHO-e2. Общие наблюдения показывают, что иммунореактивность природных оболочечных антигенов HCV увеличивается в 8-9 раз у пациентов с острым заболеванием и почти в 2 раза у пациентов с хроническим NANBH. Таким образом, получается, что в основном иммунологическая реакция пациентов с развивающейся формой NANBH обязана конформационным эпитопам, а в острой форме - равным образом как конформационным, так и линейным эпитопам.
Эти исследования впервые свидетельствуют о том, что конформационные эпитопы могут участвовать в иммунологической реакции носителя на HCV.
Пример 5
Иммуноанализ E1/E2 : Сравнение иммунокомпетентных и иммуносуппрессорных пациентов
Пациенты
Исследовались три группы пациентов. Все пациенты были отрицательными на антитело к вирусу иммунодефицита человека /ВИЧ/. Группа I состояла из 20 иммунокомпетентных пациентов с трансфузионными хроническими заражениями HCV, которые кроме этого были здоровыми. Все пациенты были положительными на PHK HCV и против HCV. Группа II включала 15 пациентов на гемодиализе. Одиннадцать пациентов вначале были положительными против HCV, один подвергался трансплантации почки в течение исследования. Четыре пациента стали положительными против HCV в течение исследования. Группа III включала 17 реципиентов с почечной трансплантацией. Семь пациентов были вначале исследования представлены как положительные к PHK HCV и против HCV. Семь стали в процессе исследования положительными против HCV, двое из которых были первоначально положительны только к PHK HCV. Два пациента были положительны только к PHK HCV при представлении, оба остались положительными к PHK HCV, но отрицательными против HCV во время последующего исследования. Один пациент стал положительным на PHK HCV только во время исследования.
Сыворотки
Сыворотки собирались между июлем 1989 г. и апрелем 1992 г. и хранились в аликвотах при -70oC до тестирования. Два из четырех образцов, собранных с интервалами в 6-12 месяцев, тестировались на пациентах группы I. Два образца, собранные с интервалом в 1,5-2 года, тестировались на всех пациентах в Группе II и III, дополнительные образцы, собранные в промежуточный период, и последующие образцы также тестировались на пациентах, у которых были изменения в статусе PHK HCV и/или против HCV во втором образце.
Твердофазный иммуносорбентный анализ /ELISA/
Антигены HCV были получены, как в Примере 4, и использовались в анализе ELISA, как описано в Примере 4. В анализе N e1 и e2 вероятность ложно-положительной реакции из-за связывания с белком вируса осповакцины была снижена /i/ добавлением лизата клеток, содержащих вирус осповакцины, к разбавителю образца, чтобы служить в качестве конкурирующего агента, и /ii/ использованием реактивных образцов вируса осповакцины в качестве отрицательных контролей.
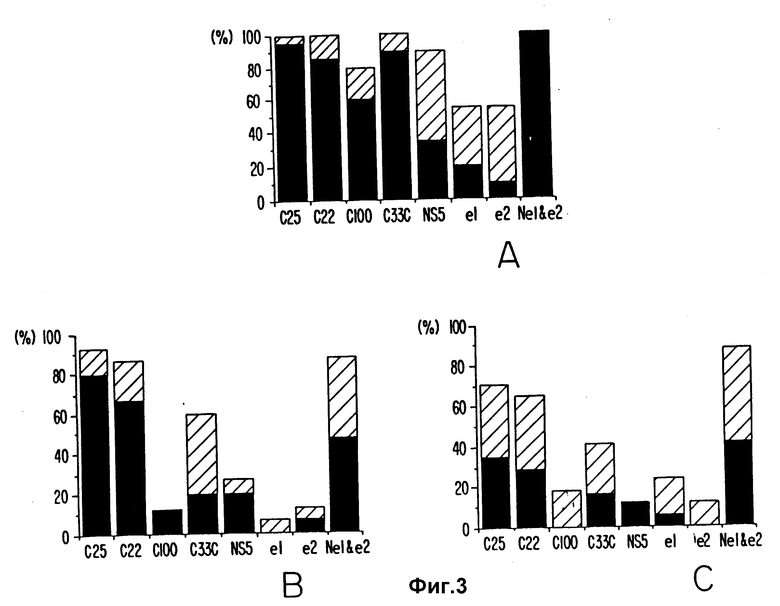
Результаты показаны на фиг. 3А-3C. Только 55% иммунокомпетентных пациентов реагировали против e1 или e2 антигенов, экспрессированных в дрожжах; но все пациенты реагировали против природных гликозилированных e1 и e2 антигенов, экспрессированных в вирусе осповакцины. Как и иммунокомпетентные пациенты, большинство пациентов с гемодиализом в группе II были реактивны к антигенам C25, C22 и N e1 и e2. Значительно меньшая часть пациентов реагировала с C100-3, C33C, NS-5, e1 и e2. В сравнении с иммунокомпетентными пациентами значительно меньшая группа III c реципиентами трансплантации почки реагировала против всех тестируемых антигенов HCV.
Все иммунокомпетентные пациенты реагировали на C25, C22 и C33C, 90% реагировали на NS-5 и 80% на C100-3. Только 55% реагировали против дрожжевых антигенов e1 и e2, но все реагировали против экспрессированных вирусов осповакцины антигенов e1 и e2, указывая на то, что оболочечные эпитопы являются конформационными и гликозилированными. 65-90% пациентов с диализом и почечной трансплантацией реагировали на C25, C22 и N e1 и e2, но только 12-60 реагировали на C100-3, C33C и NS-5. Уменьшение или потеря реактивности к антигенам вируса гепатита C наблюдались после трансплантации почки и костного мозга, причем с C25, и N e1 и e2 ее снижение было меньше.
Это позволяет предположить, что эпитопы e1 и e2 являются конформационными и в сравнении с другими антигенами HCV иммуносуппрессия минимально влияет на реактивность к этим эпитопам.


Изобретение относится к медицине и касается способа обнаружения антител, способа скрининга компонентов крови и набора для обнаружения антител с НСV. Сущность изобретения касается метода иммуноанализа с использованием оболочечных антигенов НСV, которые содержат конформационные эпитопы, реактивные по отношению к антителам в сыворотке от инфицированных индивидуумов, эти антигены обнаруживают антитела, которые не обнаруживаются денатурированными оболочечными антигенами НСV. Способ позволяет проводить скрининг крови или компонентов крови при приготовлении препаратов из крови. Изобретение также включает набор реагентов для проведения иммуноанализа, содержащий конформационные эпитопы НСV. Технический результат заключается в разработке метода, более эффективного в обнаружении антител против НСV по сравнению с линейными эпитопами. 3 с. и 10 з.п. ф-лы, 3 ил., 3 табл.
| Hosein B | |||
| et al., Proc | |||
| of National Acad | |||
| of Science, 1991, v.88, N 9, pp.3647-3651 | |||
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Остерман Л.А | |||
| Исследование биологических макромолекул электрофокусированием, иммуноэлектрофорезом и радиоизотопным и методами, Москва, Из-во Наука, 1983, стр.99 - 101. | |||
Авторы
Даты
1999-02-10—Публикация
1993-07-02—Подача