Изобретение относится к области иммуноанализа на HCV (ранее называемый не-A, не-B вирус гепатита). В частности, оно касается комбинаций антигенов HCV, позволяющих осуществлять иммуноанализы широкого диапазона на анти-HCV антитела.
Заболевание, которое ранее было известно как не-A, не-B гепатит (NANBH), считалось трансмиссивной болезнью или семейством болезней, индуцированных вирусом, которые отличались от других форм, вызванных вирусом болезней печени, включая болезни, вызванные известными вирусами гепатита, например вирусом гепатита A (HAV), вирусом гепатита B (HBV) и вирусом гепатита дельта (HDV), а также гепатита, вызванного цитомегаловирусом (CMV) или вирусом Эпштейна-Барра (EBV). NANBH был впервые обнаружен у пациентов, подвергнутых внутривенному вливанию крови. Перенос вируса от человека к шимпанзе и последовательный перенос у шимпанзе обнаружил, что заболевание NANBH вызвано переносимыми инфекционными агентами или агентом. Эпидемиологические наблюдения подтвердили, что может быть три типа NANBH: зарождаемый в воде эпидемический тип; зарождаемый в крови или парэнтерально трансмиссваный тип; и тип спорового происхождения (общеприобретенного типа). Однако до недавнего времени никакого агента переноса, ответственного за NANAH, обнаружено не было, и клинический диагноз и идентификация NANBH осуществлялись главным образом путем исключения других вирусных маркеров. Из числа методов, используемых для обнаружения путативных NANBH агентов и антител, можно назвать агаро-гелевую диффузию, противоиммуноэлектрофорез, иммунофлюоресцентную микроскопию, иммуноэлектронную микроскопию, радиоиммуноанализ, ферментно-связанный иммуносорбентный анализ. Однако ни один из этих методов анализа не был в достаточной степени чувствительным, специфическим и воспроизводимым для того, чтобы использоваться в качестве диагностического теста на NANBH.
В 1987 году ученые фирмы "Широн Корпорейшн" (владельцы данной патентной заявки) идентифицировали первую нуклеиновую кислоту, определенным образом связанную с зарождаемым в крови NANBH. Смотри, например, публикацию патента EPO N 318216; Houghton и др., Science, 244, 359 (1989 г.). В этих публикациях описывается клонирование изолята от нового вирусного класса, вируса гепатита C (HCV), прототипного изолята, который описывается в данной публикации как "HCVI". HCV является вирусом типа Флави с геномом РНК.
В патентной заявке США N 456637 (Houghton и др.), рассматриваемой здесь как библиографический материал, описывается получение различных рекомбинантных HC полипептидов путем экспрессии комплементарной ДНК (кДНК) HCV и отбор данных полипептидов на иммунологическое действие сывороткой от пациентов с HCV. Этот ограниченный отбор показал, что по меньшей мере пять испытываемых полипептидов являются очень иммуногенными; и особенно полипептиды, идентифицированные как 5-1-1, C100, C33c, CA279a и CA290a. Из этих пяти полипептидов 5-1-1 располагается в путативном NS4 домене; C100 располагается в промежутке между путативными NS3 и NS4 доменами: C33c располагается в путативном NS3 домене и CA279a и CA290a располагаются в путативном C-домене. Кроме того, данный отбор показал, что никакой одиночный испытываемый полипептид не является иммунологически активным со всеми сыворотками. В связи с этим желательны улучшенные испытания, которые бы обнаруживали реакцию полипептида со всеми или с большим числом образцов, взятых от пациентов с положительным показателем на HCV.
Заявители провели дополнительные серологические исследования на антигены HCV, которые подтвердили, что ни один одиночный HCV полипептид, идентифицированный на сегодняшний день, не является иммунологически активным со всеми сыворотками. Отсутствие одиночного полипептида, который универсально активен со всеми сыворотками от пациентов с HCV может быть обусловлено, наряду с другими факторами, непостоянством от штамма к штамму в HCV эпитопах, непостоянством гормональной реакции от пациента к пациенту и/или непостоянством серологии с определенным состоянием заболевания.
Эти дополнительно проведенные исследования также позволили заявителям идентифицировать комбинации антигенов HCV, которые обеспечивают более эффективное обнаружение антител HCV, чем одиночного HCV полипептида.
Таким образом, согласно еще одному аспекту данного изобретения предусматривается комбинация антигенов HCV, включающая:
(a) первый антиген HCV от C-домена; и
(b) по меньшей мере один дополнительный антиген HCV, выбранный из группы, включающей:
(i) антиген HCV от NS3 домена;
(ii) антиген HCV от NS4 домена;
(iii) антиген HCV от S домена и
(iv) антиген HCV от NS5 домена.
Согласно одному из аспектов данного изобретения комбинация антигенов HCV имеет форму гибридного белка, состоящего из антигенов. Согласно другому возможному аспекту данного изобретения комбинация антигенов имеет форму отдельных антигенов, связанных с общей твердой матрицей. Согласно еще одному аспекту данного изобретения, комбинация антигенов имеет форму смеси отдельных антигенов.
Следующим аспектом настоящего изобретения является способ обнаружения антител к HCV в компоненте организма млекопитающего животного, который, как ожидается, заключает в себе указанные антитела, который (способ) включает контактирование указанного компонента организма с описанной выше комбинацией антигенов HCV в условиях, допускающих реакцию антитело-антиген, и обнаружение присутствия иммунных комплексов указанных антител и указанных антигенов.
Следующим аспектом изобретения является способ обнаружения антител к HCV в компоненте организма млекопитающего, который, как ожидается, содержит в себе указанные антитела, который (способ) включает контактирование указанного компонента организма с группой антигенов HCV, одновременно или последовательно включающей:
(a) первый антиген HCV от C-домена и
(b) по меньшей мере один дополнительный антиген HCV, выбранный из числа следующих:
(i) антиген HCV от NS3 домена;
(ii) антиген HCV от NS4 домена;
(iii) антиген HCV от S домена и
(iv) антиген HCV от NS5 домена.
в условиях, допускающих реакцию антитело - антиген, и обнаружение присутствия иммунных комплексов указанных антител и указанных антигенов.
Следующим аспектом данного изобретения является комплект средств для осуществления анализа с целью обнаружения антител к HCV в компоненте организма млекопитающих животных, который, как ожидается, заключает в себе указанные антитела, который (комплект) включает упаковку из:
(a) указанной комбинации антигенов HCV;
(b) стандартных контрольных реагентов; и
(c) инструкций для осуществления анализа.
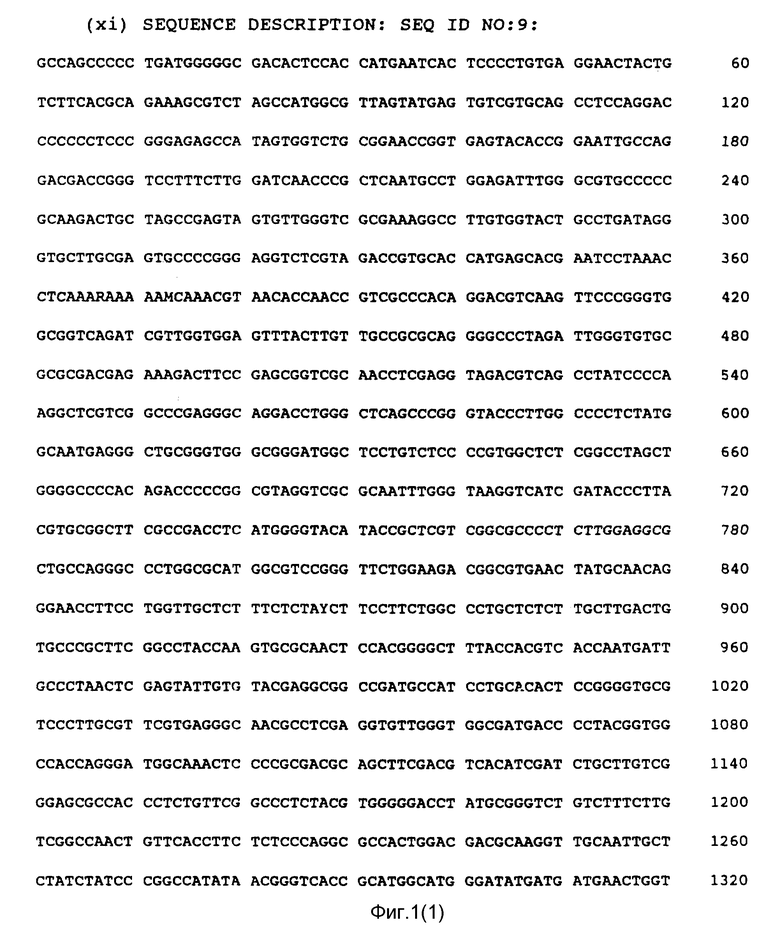
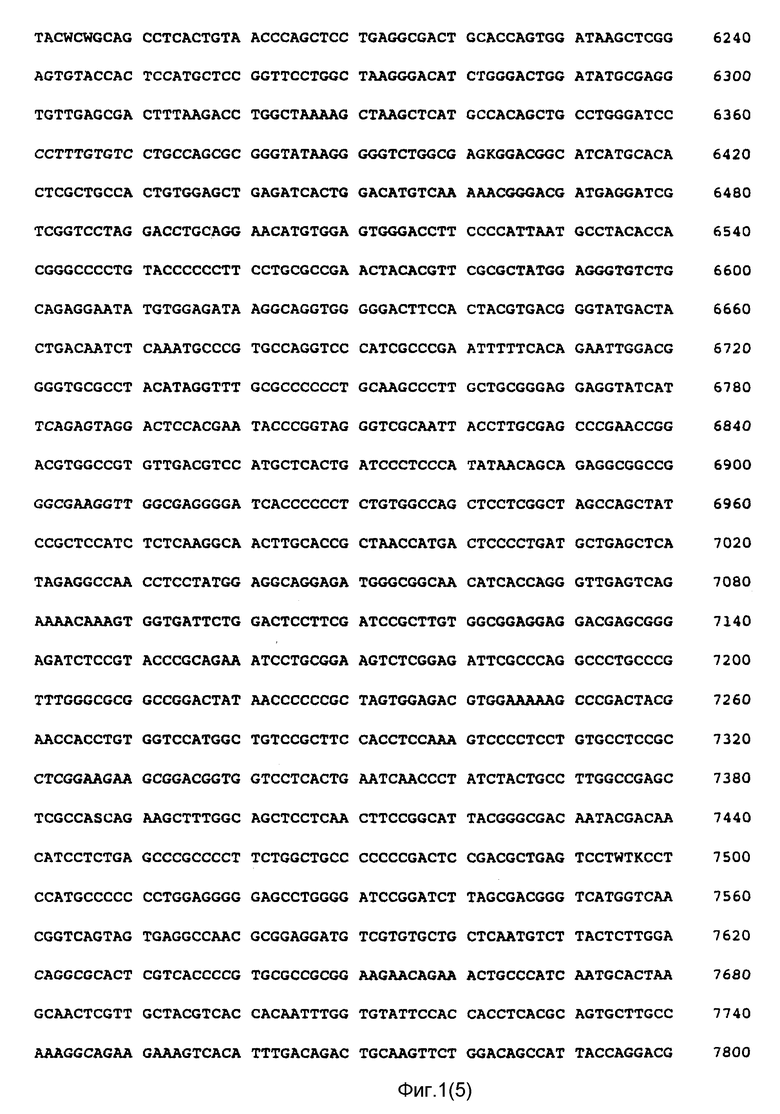
Фиг. 1 показывает нуклеотидную последовательность чувствительной и античувствительной кДНК нити полипротеина HCV и аминокислотную последовательность, кодированную чувствительной нитью (SEQ ID NO: 9) и (SEQ ID NO: 10).
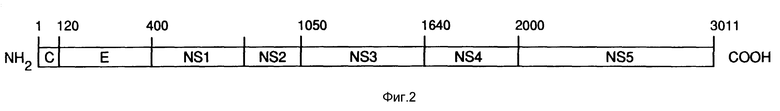
Фиг. 2 показывает схему аминокислотной последовательности, представленной на фиг. 1, иллюстрирующую путативные домены полипептида HCV.
Дефиниции.
"Антиген HCV" означает полипептид, состоящий не менее чем из 5 аминокислот, обычно не менее чем примерно из 8-10 аминокислот, который заключает в себе эпитоп, обнаруженный в изоляте HCV. Этот эпитоп является предпочтительно уникальным для HCV. Когда антиген обозначается альфа-цифровым кодом, то эпитоп взят от HCV домена с данным альфа-цифровым кодом.
Понятие "синтетический", используемое для определения антигена HCV, означает, что антиген HCV либо выделен из естественных источников, либо получен искусственно путем химического или рекомбинатного синстеза.
"Домены" - это те сегменты полипротеина HCV, показанные на фиг. 2, которые обычно соответствуют путативным структурным и неструктурным белкам HCV. Домены имеют обозначения, обычно принятые для флавивирусных белков. Положения доменов, показанные на фиг. 2, являются лишь приближенными. Название "NS" означает "неструктурные домены", название "S" - оболочковый домене и "C" - нуклеокапсидный или сердцевинный домен.
"Гибридный полипептид" - это полипептид, в котором антигены (или антиген) HCV составляют часть непрерывной цепи аминокислот, которая не является цепью естественного происхождения. Антигены HCV могут быть связаны непосредственно друг с другом пептидными связями или могут быть отделены путем вставки аминокислотных последовательностей. Гибридные полипептиды могут заключать в себе также аминокислотные последовательности экзогенные к HCV.
"Общая твердая матрица" означает твердое тело, с которым связываются отдельные антигены HCV или гибридный полипептид, состоящий из антигенов HCV, посредством ковалентных или нековалентных связей, например путем гидрофобной адсорбции.
"Компонент организма млекопитающего" означает жидкость или ткань млекопитающего животного (например, человека), которая обычно содержит антитела, образуемые этими млекопитающими животными. Каждый такой компонент известен и включает (не ограничиваясь только ими) кровь, плазму, сыворотку, спинной мозг, жидкую лимфу, продукты выделения дыхательных путей, желудочного или мочеполового тракта, слезы, слюну, молоко, белые кровяные клетки, миеломы.
Понятие "иммунологически активный" означает, что данный антиген должен специфически взаимодействовать с анти-HCV антителами, обычно присутствующими в значительной части сыворотки от индивидуумов, инфекционно зараженных HCV.
"Иммунный комплекс" - это комбинация или скопление, образуемое при связывании антитела с эпитопом на антигене.
Комбинации антигенов HCV.
На фиг. 2 показаны путативные домены полипротеина HCV. Этими доменами, от которых взяты антигены, используемые в комбинациях, являются C, S (или E), NS3, NS4 и NS5. Домен C заключает в себе нуклеокапсидный белок HCV. Он простирается от N-конца полипротеина примерно до аминокислоты 120, как показано на фиг. 1. Домен S заключает в себе белок оболочки вируса и возможно белок матрицы (M) и простирается от примерно аминокислоты 120 до аминокислоты 400, как показано на фиг. 1. Домен NS3 простирается примерно от аминокислоты 1050 до аминокислоты 1640 и составляет протеазу вируса. Домен NS4 простирается от конца NS3 до примерно аминокислоты 2000. Функция белка NS4 неизвестна на сегодняшний день. И, наконец, домен NS5 простирается примерно от аминокислоты 2000 до конца полипротеина и заключает в себе полимеразу вируса.
Последовательность, показанная на фиг. 1, представляет собой последовательность изолята HCV1. Предполагается, что последовательности других штаммов зарожденного в крови HCV могут отличаться от последовательности, показанной на рис. 1, особенно в доменах оболочки (S) и нуклеокапсида (C). Использование HCV-антигенов, имеющих такие отличающиеся последовательности, охватывается сферой действия данного изобретения, при условии, однако, что это различие незначительно снижает иммунологическую активность антигена к сыворотке от пациентов, зараженных HCV.
Как правило, антигены HCV должны заключать в себе полные или срезанные домены, при этом доменные фрагменты легко отбираются на антигенность непосредственно самими специалистами в данной области. Отдельные антигены HCV, используемые в комбинации, должны включать предпочтительно иммунодоминантный участок (то есть участок, ответственный прежде всего за иммунологическую активность полипептида) указанного домена. В случае C-домена желательно, чтобы антиген C-домена заключал в себе наибольшую часть всей последовательности домена. Особенно предпочтителен антиген, имеющий обозначение C22 (смотри пример 4). Антиген S домена заключает в себе предпочтительно гидрофобный субдомен в N-терминальном конце данного домена. Этот гидрофобный субдомен простирается примерно от аминокислоты 199 до аминокислоты 328, как показано на фиг. 1. Особенно предпочтителен антиген HCV, имеющий обозначение S2 (смотри пример 3). При желании в антиген S домена может быть включена последовательность, идущая от гидрофобного субдомена.
Предпочтительным антигеном NS3 домена является антиген под названием C33c. Этот антиген заключает в себе аминокислоты 1192 - 1457, как показано на фиг. 1. Предпочтительным антигеном NS4 является C100, который заключает в себе аминокислоты 1569 - 1931, как показано на фиг. 1. Предпочтительный антиген NS5 заключает в себе аминокислоты 2054-2464, как показано на фиг. 1.
Антиген HCV может иметь форму полипептида, состоящего полностью из аминокислотной последовательности HCV или может заключать в себе последовательность, экзогенную по отношению к HCV (то есть он может быть в форме гибридного белка, который включает экзогенную последовательность). В случае рекомбинантно продуцируемого антигена HCV продуцирование данного антигена как гибридного белка, например с SOD, альфа-фактором или убикитином (смотри патенты США общего владельца N 4751180, 4870008 и патентную заявку (США) N 390599, поданную 7 августа 1989 года, описания которых здесь рассматриваются, в которых обсуждается экспрессия SOD, альфа-фактора и убикитиновых гибридных белков), может увеличивать степень экспрессии и/или увеличения растворимости в воде данного антигена. Гибридные белки, такие как альфа-фактор и убикитиновый гибрид, подвергаются воздействию хозяина экспрессии для удаления гетерологической последовательности. Альфа-фактор является, однако, системой секреции, в то время как убикитиновые гибриды остаются в цитоплазме.
Кроме того, комбинация антигенов может быть продуцирована как гибридный белок. Так, например, непрерывный фрагмент ДНК, кодирующий C22 и C33c, может быть построен, клонирован в вектор экспрессии и использован для экспрессии гибридного белка C22 и C33c. Аналогичным образом могут быть получены гибридные белки C22 и C100; C22 и S2; C22 и антиген NS5; C22, C33c и S2; 2CC, C100 и S2, и C22, C33c, C100 и S2. Могут быть также использованы и другие заменяющие их фрагменты от приведенного домена.
Получение антигенов HCV.
Антигены HCV, отвечающие данному изобретению, продуцируются предпочтительно рекомбинантно или путем известного твердофазного синтеза. Однако они могут быть выделены также из диссоциированных HCV или частиц HCV методом хроматографии сродства с использованием антител к антигенам.
При получении рекомбинантными способами могут использоваться стандартные процедуры построения ДНК, кодирующей данный антиген, клонирования данной ДНК в векторы экспрессии, трансформации клеток хозяев, таких как бактерии, дрожжи и вредные насекомые, или клеток млекопитающих животных, и экспрессии такой ДНК для продуцирования антигена. Как указывалось ранее, может быть желательна экспрессия антигена как гибридного белка для усиления экспрессии, облегчения очистки или повышения растворимости. Специальные процедуры продуцирования типичных антигенов HCV описываются в изложенных ниже примерах и в основной патентной заявке серии N 456637.
Получение антигенов, предназначенных для использования в иммуноанализе.
Антигены HCV могут быть комбинированы путем получения их в форме гибридного белка, состоящего из двух или более антигенов, путем иммобилизации их по отдельности на общей твердой матрице, или путем их физического перемешивания. Гибридные белки антигена могут быть также иммобилизованы на твердую матрицу (связаны с ней). В данной области науки уже известны способы и средства ковалентного и нековалентного связывания белков с твердыми матрицами. Природа твердой поверхности будет различной в зависимости от типа анализа. Для анализа, осуществляемого на микротитрованных ячейках, твердой поверхностью будет стенка ячейки или микротитровальной чашки. Для анализа с использованием шариков твердой поверхностью будет являться поверхность шариков. Для анализа с использованием удлиненных частиц (то есть твердых частиц, полученных из пористого или волокнистого материала, такого как ткань или бумага) твердой поверхностью будет являться поверхность материала, из которого изготавливаются эти удлиненные частицы. При агглютинационном анализе твердой поверхностью будет являться поверхность частиц латекса или желатина. В случае, когда отдельные антигены связываются с матрицей, они могут равномерно распределяться по поверхности или распределяться в виде определенного рисунка, например полос, так что можно распознать картину связывания антигена.
Простые смеси антигенов включают антигены в любом подходящем растворителе или в диспергирующей среде.
Типы анализа с использованием комбинаций антигенов.
Антигены HCV могут использоваться фактически в любом типе анализа, где применяется известный антиген для обнаружения антител. Общей особенностью всех этих анализов является то, что антиген контактирует с компонентом организма, содержащим антитела HCV, в условиях, позволяющих антигену связываться с любым таким антителом, присутствующим в данном компоненте организма. Такими условиями обычно являются: физиологическая температура, величина pH и ионная сила при использовании избытка антигена. Инкубация антигена с образцом сопровождается обнаружением иммунных комплексов, включающих антиген.
Иммуноанализ имеет очень много разновидностей, и существует много принципов его осуществления. Так, например, иммуноанализ может осуществляться с использованием твердых носителей или путем иммуноосаждения. В большинстве анализов используется меченое антитело или полипептид; индикаторами могут быть, например, ферментные, хемилюминесцентные, радиоактивные или окрашивающие молекулы. Известны также анализы, которые усиливают сигналы от иммунного комплекса; примерами являются анализы, в которых используются биотин и авидин, и иммуноанализы с индикацией ферментом и с промежуточным средством, таким как ферментный иммуносорбентный анализ (ELISA).
Иммуноанализ может быть гетерогенным или гомогенным и может быть стандартного или конкурирующего типа. В гетерогенном анализе полипептид обычно связывается с твердой матрицей или носителем для ускорения отделения образца от полипептида после инкубации. Примерами твердых носителей, которые могут использоваться, являются нитроцеллюлоза (например, в форме мембраны или микротитровальных ячеек), поливинилхлорид (например, в форме листов или микротритровальных ячеек), полистирольный латекс (например, в форме шариков или микротитровальных чашек), поливинилиденфторид (известный как Иммулон), диазотированная бумага, найлоновые мембраны, активированные стеклянные шарики и шарики протеина A. Так, например, в гетерогенном анализе могут использоваться микротитровальные чашки "Динатех Иммулон 1 или Иммулон 2" или полистиролевые шарики размером 0,25 дюйма (6,3 мм) ("Presision Plastic Ball. "). Твердый носитель, содержащий антигенные полипептиды, обычно промывается после отделения его от испытываемого образца и до обнаружения связанных антител. В данной области науки известны уже как стандартный, так и конкурирующий методы анализа.
В гомогенном анализе испытываемый образец инкубируется с комбинацией антигенов в растворе. Так, например, это может осуществляться в таких условиях, в которых происходит осаждение любых комплексов антиген-антитело, которые образуются. Как стандартный, так и конкурирующий приемы при осуществлении данных анализов уже известны в данной области.
При осуществлении стандартного приема непосредственно измеряется количество антитела HCV, образующего комплекс антитело-антиген. Это может осуществляться путем определения того, связываются ли меченые антиксеногенные (например, античеловеческие) антитела, которые распознают эпитоп на анти-HCV антителах, за счет образования комплекса. При осуществлении конкурентного приема количество антител HCV в образце определяется по данным конкурирующего действия на связывание известного количества меченого антитела (или другого конкурирующего лиганда) в данном комплексе.
Образуемые комплексы, включающие анти-HCV антитела (или в случае конкурирующих анализов количество конкурирующего антитела) обнаруживаются любым из ряда известных способов, в зависимости от типа анализа. Так, например, немеченые антитела HCV в комплексе могут быть обнаружены с использованием конъюгата антиксеногенного Ig, образующего комплекс с индикатором (например, ферментным индикатором).
В иммуноосадительном или агглютинационном анализе в результате реакции между антигенами HCV и антителом образуется сетка, которая осаждается из раствора или суспензии и образует видимый слой или пленку осадка. Если в испытываемом образце нет никакого анти-HCV антитела, то не образуется никакого видимого на глаз осадка. Антигены HCV обычно упаковываются в форме комплекта, предназначенного для использования в данных иммуноанализах. Этот комплекс обычно содержит в отдельных емкостях комбинацию антигенов (либо уже связанных с твердой матрицей, либо разделенных реагентами для связывания с твердой матрицей), контрольные рецептуры антитела (положительные и/или отрицательные), меченое антитело, когда для данного типа анализа требуются одинаковые и генерирующие сигнал реагенты (например, ферментный субстрат), если данный индикатор не генерирует сигнал непосредственно. В данный комплект обычно включены инструкции (например, в написанном виде, в форме ленты, VCR, CD-ROM и т.д.) для осуществления анализа.
Нижеследующие примеры даются с целью иллюстрации настоящего изобретения, но не для его ограничения.
Пример 1. Синтез антигена HCV C33c.
Антиген HCV C33c содержит последовательность от домена NS3. В частности, он заключает в себе аминокислоты 1192-1457, как показано на фиг. 1. Данный антиген продуцируется в бактериях как гибридный белок человеческой супероксиддисмутазой (SOD) следующим образом. Вектор p.SOD cfI (Steiner и др., 1986 г., Virol. 58: 9) вываривается до конца вместе с EcoRI и BamHI, и образующийся фрагмент EcoRI, BamHI сшивается с указанным ниже линкером с образованием pcfIEF:
GATC CTG GAA TTC TGA TAA (послед. ID NO: 1)
GAC CTT AAG ACT АТТ ТТA A (посл. ID NO: 2)
Клон кДНК, кодирующий аминокислоты 1192-1457 и имеющий концы EcoRI, вставляется в pcfIEF, в результате чего образуется pcfIEF/C33c. Эта экспрессионная структура трансформируется в клетки D/210 E.сoli.
Данные трансформанты используются для экспрессии гибридного белка, состоящего из SOD у N-концов и внутрирамочного антигена HCV C33c у C-концов. Экспрессия осуществляется инокуляцией 1500 мл питательного бульона Luria, содержащего ампициллин (100 мкг/мл) с 15 мл ночной культуры данных трансформант. Клетки выращиваются до оптической плотности 0,3, добавляется изопропилтиогалактозид до достижения конечной концентрации 0,2 ммоль и выращивание продолжается до тех пор, пока не достигается оптическая плотность 1, и в этот момент их собирают путем центрифугирования с ускорением центрифуги 3000g при 4oC в течение 20 мин. Уплотненные клетки могут храниться при -80oC в течение нескольких месяцев.
Для очистки полипептида SOD-C33c бактериальные клетки, в которых выражается полипептид, подвергаются воздействию осмотического удара и механическому разрыву, нерастворимая фракция, содержащая SOD-C33c, извлекается и подвергается дифференциальной экстракции щелочным-NaCl раствором, и гибридный полипептид в экстракте очищается методом колончатой хроматографии с заполнением колонок S-Сефарозой и Q-Сефарозой.
Сырой экстракт, полученный в результате воздействия осмотического удара и механического разрыва, обрабатывается следующим образом: 1 г уплотненных клеток суспензируется в 10 мл раствора, содержащего 0,02 моль Трис-HCl, pH 7,5, 10 ммоль этилендиаминтетрауксусной кислоты (EDTA), 20% сахарозы, и инкубируется в течение 10 мин во льду. Затем клетки осаждаются центрифугированием при ускорении центрифуги 4000g в течение 15 мин при 4oC. После удаления поверхностного слоя клеточные осадки снова суспензируются в 10 мл буфера A1 (0,01 моль Трис. HCl, pH 7,5, 1 ммоль EDTA, 14 ммоль бета-меркаптоэтанола (BME)) и инкубируются во льду в течение 10 мин. Клетки снова осаждаются центрифугированием при ускорении центрифуги 4000g в течение 15 мин при 4oC. После удаления прозрачного поверхностного слоя (периплазматическая фракция I) клеточные осадки снова суспензируются в буфере A1, инкубируются во льду в течение 10 мин и снова центрифугируются с ускорением центрифуги 4000g в течение 15 мин при 4oC. Прозрачный поверхностный слой (периплазматическая фракция II) удаляется, и клеточный осадок снова суспензируется в 5 мл буфера A2 (0,02 моль Трис. HCl, pH 7,5, 14 ммоль BME, 1 ммоль EDTA, 1 ммоль фенилметилсульфонилфторида (PMSF)). Для разрыва клеток данная суспензия (5 мл) и 7,5 мл промытых свободной от свинца кислотой стеклянных шариков, измельченных в мельнице Dino (диаметром 0,10-0,15 мм) (получены фирмой Глен-Миллс Инк) помещаются в пробирку Falcon и подвергаются вихревому перемешиванию с максимальной скоростью в течение 2 мин, а затем охлаждаются во льду не менее 2 мин; процедуры вихревого перемешивания - охлаждения повторяются еще четыре раза. После вихревого перемешивания данная суспензия фильтруется через сцинциллируемую стеклянную воронку со слабым отсосом; стеклянные шарики промываются два раза буфером A2, и фильтрат и промывные жидкости соединяются.
Нерастворимую фракцию сырого экстракта извлекают путем центрифугирования с ускорением центрифуги 20000g в течение 15 мин при 4oC, двукратно промывают 10 мл буфера A2, снова суспензируют в 5 мл воды Milli-Q.
Фракцию, содержащую SOD-C33c, извлекают из нерастворимого материала путем добавления в данную суспензию NaOH (2 моль) и NaCl (2 моль) до конечной концентрации каждого 20 ммоль, вихревого перемешивания смеси в течение 1 мин, центрифугирования ее в центрифуге с ускорением 20000g в течение 20 мин при 4oC и сохранения поверхностного слоя.
Для очистки SOD-C33c на Сефарозе-S всплывшую фракцию доводят до конечной концентрации 6 моль мочевины, 0,05 моль Трис. HCl, pH 7,5, 14 ммоль BME, 1 ммоль EDTA. Затем эту фракцию вводят в колонку высокоскоростного потока с S-Сефарозой (1,5 • 10,0 см), которая уравновешивается с буфером B (0,05 моль Трис. HCl, pH 7,5, 14 ммоль BME, 1 ммоль EDTA). После ввода колонку промывают буфером B в количестве, равном двум объемам колонки. Проходящий через колонку поток и промывочные фракции соединяются. Скорости потока и промывки составляют 1 мл/мин; объем собранных фракций 1 мл. Для идентификации фракций, содержащих SOD-C33c, аликвоты этих фракций анализируются методом электрофореза на 10% полиакриламидных гелях, содержащих SDS, с последующим окрашиванием красителем Комасси синим. Данные фракции могут также анализироваться точечным методом Вестерна с использованием антитела к SOD. Собираются фракции, содержащие SOD-C33c.
Последующая очистка SOD-C33c осуществляется в колонке с Q-Сефарозой (1,5 • 5 см), которая уравновешивается с буфером B. Собранные фракции, содержащие SOD-C33c, полученные методом хроматографии на S-Сефарозе, вводятся в колонку. Затем колонка промывается буфером B и элюируется 60 мл градиента от 0,0 до 0,4 моль NaCl в буфере B. Скорости потока через колонку, промывки и скорость элюирования составляют 1 мл/мин; собранные фракции составляют в объеме 1 мл. Все фракции из колонки с Q-Сефарозой анализируются, как описано для колонки с S-Сефарозой. Максимум SOD-C33c, элюируемого из колонки, соответствует примерно 0,2 моль NaCl.
SOD-C33c, полученный в колонке с Q-Сефарозой, имеет степень чистоты более чем примерно 90%, что подтверждается анализом на полиакриламидных гелях SDS и методом иммуноточечного анализа с использованием моноклонального антитела к человеческому SOD.
Пример 2. Синтез антигена HCV C100.
Антиген HCV C100 заключает в себе последовательности от доменов NS3 и NS4. В частности, он заключает в себе аминокислоты 1569 - 1931, как показано на фиг. 1. Данный антиген продуцируется в дрожжах. Приготавливается фрагмент кДНК на 1270 основных пар (bp), кодирующий указанные выше аминокислоты и имеющий конец EcoRI.
Построение дрожжевого вектора экспрессии, в котором данный фрагмент сливается непосредственно с промотором S.cerevisiae ADH2/GAP, осуществляется согласно процедуре, которая включает усиление последовательности C100 с использованием метода PCR, с последующим вшиванием данной усиленной последовательности в клонирующий вектор. После клонирования последовательность C100 отделяется и вместе с последовательностью, заключающей в себе промотор ADH2/GAP, вшивается в широкий фрагмент дрожжевого вектора, в результате чего образуется дрожжевой вектор экспрессии.
Усиление PCR антигена C100 осуществляется с использованием в качестве матрицы вектора pS3-56C100m, который был выравнен в линейную последовательность путем вываривания с SalI. pS3-56, который является производным pBR322, заключает в себе экспрессионную кассету, которая состоит из гибридного дрожжевого промотора ADH2/GAPDH, расположенного до человеческого супероксидодисмутазного гена и следующего за транскрипционным терминатором альфа фактора.
Данные олигонуклеотидные праймеры, используемые для усиления, предназначены для ускорения клонирования в вектор экспрессии и для ввода трансляционного концевого кодона. В частности, новые сайты 5'-HindIII и 3'-SalI создаются с олигонуклеотидами PCR. Олигонуклеотид, содержащий сайт SalI, также кодирует двойные концевые кодоны, TAA и TGA. Олигонуклеотид, содержащий сайт HindIII, заключает в себе также нетранслированную лидерную последовательность, образованную от гена pgap63, расположенную непосредственно до кодона AUG. Ген pEco63GAPDH был описан Holland и Holland (1980 г) и Knis Kern и др., 1986 г. Последовательности праймера PCR, используемые для прямой экспрессии C100m, следующие:
5' GAC TGC TCA AGC TTC AAA ACA AAA TGC CTC ACT TTC TAT CCC AGA CAA AGC AGA CT3' (посл. ID NO: 3)
и
5' GAG TGC TCG TCG ACT CAT TAG GGG GAA ACA TGG TTC CCC CGG GAG GCG AA 3' (посл. ID NO: 4).
Усиление посредством PCR с использованием праймеров и матрицы осуществляется с помощью комплекта PCR Cetus-Perkin-Elmer и согласно указаниям изготовителя. Условия PCR следующие: 29 циклов при 94oC в течение 1 мин, 37oC в течение 2 мин, 72oC в течение 3 мин и конечная инкубация при 72oC в течение 10 мин. Данная ДНК может храниться при 4oC или -20oC в течение ночи.
После усиления продукты PCR вывариваются с HindIII и SalI. Основной продукт на 1,1 основных пар (kb) очищается путем электрофореза на геле, и элюированный очищенный продукт сшивается с большим фрагментом SalI-HindIII плазмиды pBR322. Для того чтобы выделить правильные рекомбинанты, компетентные клетки HB101 трансформируются с данными рекомбинантными вектора, и после клонирования желаемые рекомбинанты идентифицируются на основе предсказанного размера фрагментов HindIII-SalI, эксцизированных из данных клонов. Один из клонов, который заключает в себе фрагмент HindIII-SalI правильного размера, называется pBR322/C100-d. Подтверждением того, что данный клон содержит усиленную C100, является результат анализа прямой последовательности фрагмента HindIII-SalI.
Вектор экспрессии, заключающий в себе C100, строится путем сшивки фрагмента HindIII-SalI от pBR322/C100d с фрагментом BamHI-SalI на 13,1 kb от pBS24.1 и фрагментом BamHI-SalI на 1369 bp, содержащим промотор ADH2/GAP. (Последний фрагмент описывается в патенте EP0164556). Вектор pBS24.1 описывается в патентной заявке USSN 382805, поданной 19 июля 1989 года, совместного владельца. Фрагмент промотора ADH2/GAP получается путем вываривания вектора pPGAP/AG/HindIII с HindIII и BamHI с последующей очисткой фрагмента 1369 bp на геле.
Компетентные клетки HB101 трансформируются рекомбинантными векторами; правильные рекомбинанты идентифицируются посредством образования фрагмента 2464 bp и фрагмента 13,1 kb, получаемых путем вываривания клонированных векторов с BamHI и SalI. Один из клонированных правильных рекомбинантных векторов носит название pC100d#3.
Для экспрессии C100 компетентные клетки штамма Saccharomyces cerevisiae AB122 (MATaleu 2 ura 3-53 prb 1-1122 pep 4-3 prc1-407 (ur-0)) трансформируются с вектором экспрессии pC100-d#3. Трансформированные клетки высеиваются в чашках на URA-сорбите, и затем отдельные трансформанты штрихуются на чашках с Leu-.
Отдельные клоны культивируются в среде Leu-, ura- с 2% глюкозы при 30oC в течение 24-36 ч. Один литр пептонной среды дрожжевого экстракта (YEP), содержащий 2% глюкозы, инокулируется 10 мл ночной культуры, и полученная культура выращивается при 30oC со скоростью перемешивания 400 об/мин и скоростью аэрации 1 л воздуха на 1 л среды в минуту (lvvm) в течение 48 ч. Величина pH среды не регулируется. Данная культура выращивается в ферментере Bio Flo 11, изготавливаемом фирмой "Нью Брансвик Сайс Корп". После ферментации клетки выделяются и анализируются на экспрессию C100.
Анализ выраженного полипептида C100 посредством трансформированных клеток осуществляется на лизате всех клеток, и сырые экстракты приготавливаются из одиночных дрожжевых колоний, полученных из посева на чашках со средой Leu-. Клеточные лизаты и сырые экстракты анализируются методом электрофореза на пополиакриламидных гелях SDS и точечным методом Вестерна. Точки Вестерна анализируются кроличьими поликлональными антителами к полипептиду SOD-C100, выраженному в дрожжах. Предполагаемый размер полипептида C100 составляет 364 аминокислоты. Гелевый анализ данного выраженного полипептида показал, что он имеет MWt 39,9 K.
Оба метода анализа продемонстрировали, что выраженный полипептид C100 присутствует во всем клеточном лизате, но отсутствует в сырых экстрактах. Эти результаты подтверждают, что выраженный полипептид C100 может быть нерастворимым.
Пример 3. Экспрессия антигена HCV S2.
Антиген HCV S2 заключает в себе последовательность от гидрофобного N-конца домена S. Он включает аминокислоты 199-328, показанные на фиг. 1.
Процедура построения вектора экспрессии, кодирующего полипептид S2, и процедура его экспрессии в дрожжах аналогичны данным процедурам, осуществляемым для экспрессии полипептида C100, описанным в примере 2.
Матрица для реакции PCR представляет собой вектор pBR322/Pi14a, который был выравнен в линейную последовательность путем вываривания с HindIII. Pi14a представляет собой клон кДНК, который кодирует аминокислоты 199-328.
Олигонуклеотиды, используемые как затравки для усиления посредством PCR кодирующей последовательности S2, нижеследующие:
Для 5'-участка последовательности S2:
5' GAG TGC TCA AGC TTC AAA ACA AAA TGG GGC TCT ACC ACC TCA CCA ATG ATT GCC CTA AC 3'; (посл. ID NO: 5)
и для 3'-участка последовательности S2:
5' GAG TGC TCG TCG ACT CAT TAA GGG GAC CAG TTC ATC ACC ATA TCC CAT GCC AT 3' (посл. ID NO: 6)
Затравка для 5'-участка вводит сайт HindIII и инициирующий кодон ATG в усиленный продукт. Затравка для 3'-участка вводит трансляционные терминирующие кодоны и сайт SalI в данный усиленный продукт.
Условия для PCR следующие: 29 циклов с температурой 94oC в течение 1 мин, 37oC в течение 2 мин, 72oC в течение 3 мин и конечная инкубация при 72oC в течение 10 мин.
Основным продуктом реакции PCR является фрагмент 413 bp, который подвергается гелевой очистке. Этот очищенный фрагмент сшивается с большим фрагментом, полученным из pBR322, вываренного с фрагментом HindIII и SalI, в результате чего получается плазмида pBR322/S2d.
В результате сшивки фрагмента HindIII-SalI из 413 bp с фрагментом BamHI-HindIII на 1,36 kb, заключающим в себе промотор ADH2/GAP, и с большим фрагментом BamHI-SalI дрожжевого вектора PBS24.1, получаются рекомбинантные векторы, в которые клонируются. Правильные рекомбинантные векторы идентифицируются по присутствию фрагмента 1,77 kb после вываривания с BamHI и SalI. Вектор экспрессии, построенный из данной усиленной последовательности и содержащий последовательность, кодирующую S2, слитую непосредственно с промотором ADH2/GAP, идентифицируется как pS2d#9.
Пример 4. Синтез антигена HCV C.
Антиген HCV C22 является антигеном от домена C. Он включает аминокислоты 1-122, показанные на фиг. 1.
Процедура построения данного вектора экспрессии, кодирующего полипептид C, и процедура его экспрессии в дрожжах аналогичны процедурам, осуществляемым для экспрессии полипептида C100, описанным выше, за исключением следующего:
для 5'-участка последовательность C:
5' GAG TGC AGC TTC AAA ACA AAA TGA GCA CGA ATC CTA AAC CTC AAA AAA AAA AC 3' (послед. ID NO: 7)
и для 3'-участка последовательность C:
5' GAG TGC TCG TCG ACT CAT TAA CCC AAA TTG CGC GAC CTA CGC CGG GGG TCT GT 3' (посл. ID NO: 8)
Затравка для 5'-участка вводит сайт HIndIII в данный усиленный продукт, и затравка для 3'-участка вводит трансляционные инициирующие кодоны и сайт SalI. PCR осуществляется следующим образом: 29 циклов с температурой 94oC в течение 1 мин, 37oC в течение 2 мин, 72oC в течение 3 мин и конечная инкубация при 72oC в течение 10 мин.
Основным продуктом усиления PCR является полинуклеотид 381 bp. В результате сшивки этого фрагмента с большим фрагментом SalI-HindIII плазмиды pBR322 получается плазмида pBR322/C2. В результате сшивки с кодирующего фрагмента HindIII-SalI (381 bp), эксцизированного из pBR322/C2, с фрагментом BamHI HindIII (1,36 kb), содержащим промотор ADH2/GAP, и с большим фрагментом BamHI-SalI дрожжевого вектора pBS24.1, получаются рекомбинантные векторы, которые клонируются. Правильные рекомбинантные векторы идентифицируются по присутствию фрагмента 1,74 kb после вываривания с BamHI и с SalI. Вектор экспрессии, построенный из данной усиленной последовательности и заключающий в себе последовательность, кодирующую C, непосредственно слитую с промотором ADH2/GAP, идентифицируется как pC22.
Анализ выраженного полипептида C посредством трансформированных клеток осуществляется на полных клеточных лизатах и сырых экстрактах, полученных из единичных дрожжевых колоний, полученных из чашек с посевом в среде Leu-. Эти клеточные лизаты и сырые экстракты анализируются путем электрофореза на полиакриламидных гелях SDS. Полипептид C, как предполагается, заключает в себе 122 аминокислоты и согласно гелевому анализу этот выраженный полипептид имеет значение MWr примерно 13,6 kd.
Пример 5. Синтез полипептида NS5.
Данный полипептид заключает в себе последовательность от N-конца домена NS5. В частности, он включает аминокислоты от 2054 до 2464, показанные на фиг. 1. Процедура построения данного вектора экспрессии, кодирующего полипептид NS5, и процедура его экспрессии аналогичны процедурам, осуществляемым для экспрессии C33c (смотри пример 1).
Пример 6. Радиоиммуноанализ на антитела к HCV.
Антигены HCV из примеров 1-5 испытываются методом RIA на их способность обнаруживать антитела к HCV в сыворотке пациентов с клиническим диагнозом как пациенты с HCV (H--A, не-B) в сыворотке, взятой из крови здоровых доноров.
Радиоиммуноанализ (RIA) основан на способе Tsu и Herzenberg (1980), Selected methods in cellular immunology (W.H.Freeman and Co.), стр. 373-391. Обычно микротитровальные пластины (Иммулон 2, удаляемые из ячеек полоски) покрывают очищенным антигеном HCV. Эти покрытые пластинки инкубируются с образцами сыворотки или соответствующими контрольными образцами. В ходе инкубации антитело, если оно присутствует, иммунологически связывается с твердофазным антигеном. После удаления несвязанного материала и промывки микротитровальных пластин комплексы антитело - антиген NANBV обнаруживаются путем инкубации с меченым 125I овечьим античеловеческим иммуноглобулином. Несвязанное меченое антитело удаляется путем отсоса, и пластины промываются. Определяется радиоактивность в отдельных ячейках; количество связанного человеческого анти-HCV антитела пропорционально радиоактивности в ячейках.
В частности, стомикролитровые аликвоты, содержащие от 0,1 до 0,5 мкг антигена HCV в 0,125 моль буферного раствора бората натрия, pH 8,3, 0,075 моль NaCl (BBS), вводятся в каждую ячейку микротитровальной пластины (Dynatech Immulon 2 Removawell Strips). Эта микротитровальная пластина инкубируется при 4oC в течение ночи во влажной камере, после чего раствор антигена удаляется и ячейки три раза промываются BBS, содержащим 0,02% Тритона X-100 (BBST). Для предотвращения неспецифического связывания ячейки покрываются бычьим сывороточным альбумином (BSA) путем ввода 100 мкл раствора BSA (5 мг/мл) в BBS, с последующей инкубацией при комнатной температуре в течение 1 ч; после этой инкубации раствор BSA удаляется. Антигены в покрытых ячейках реагируют с сывороткой в результате добавления 100 мкл сывороточных образцов, с разбавлением 1:100 в 0,01 моль буферный раствор фосфата натрия, pH 7,2, 0,15 моль NaCl (PBS), содержащей 10 мг/мл BSA, и инкубации ячеек с данной сывороткой в течение 1 ч при 37oC. После инкубации сывороточные образцы удаляются путем отсоса и ячейки пятикратно промываются BBST. Антитело, связанное с данным антигеном, обнаруживается по связыванию меченого 125IF'(ab)2 овечьего античеловеческого IgG с покрытыми ячейками. В каждую ячейку вводятся 100-микролитровые аликвоты меченой пробы (удельная активность 5 - 20 мкКи/мкг), и пластины инкубируются при 37oC в течение 1 ч, после чего избыток пробы удаляется путем отсоса, и осуществляется пять промывок BBST. Степень радиоактивности в каждой ячейке определяется путем подсчета с помощью счетчика, обнаруживающего гамма-излучение.
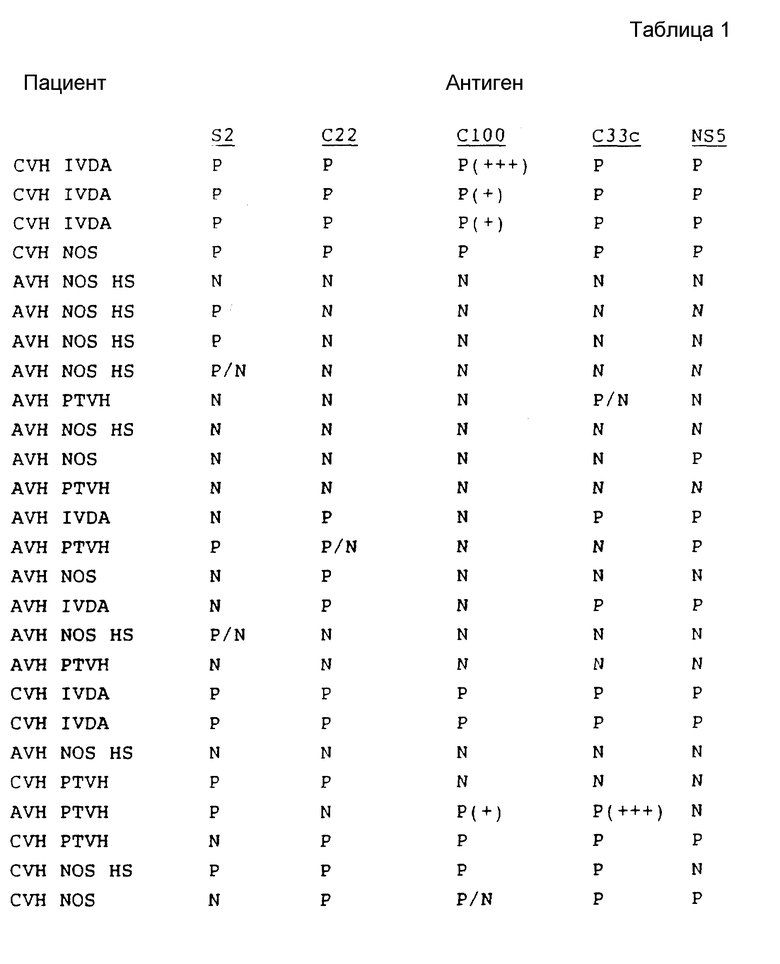
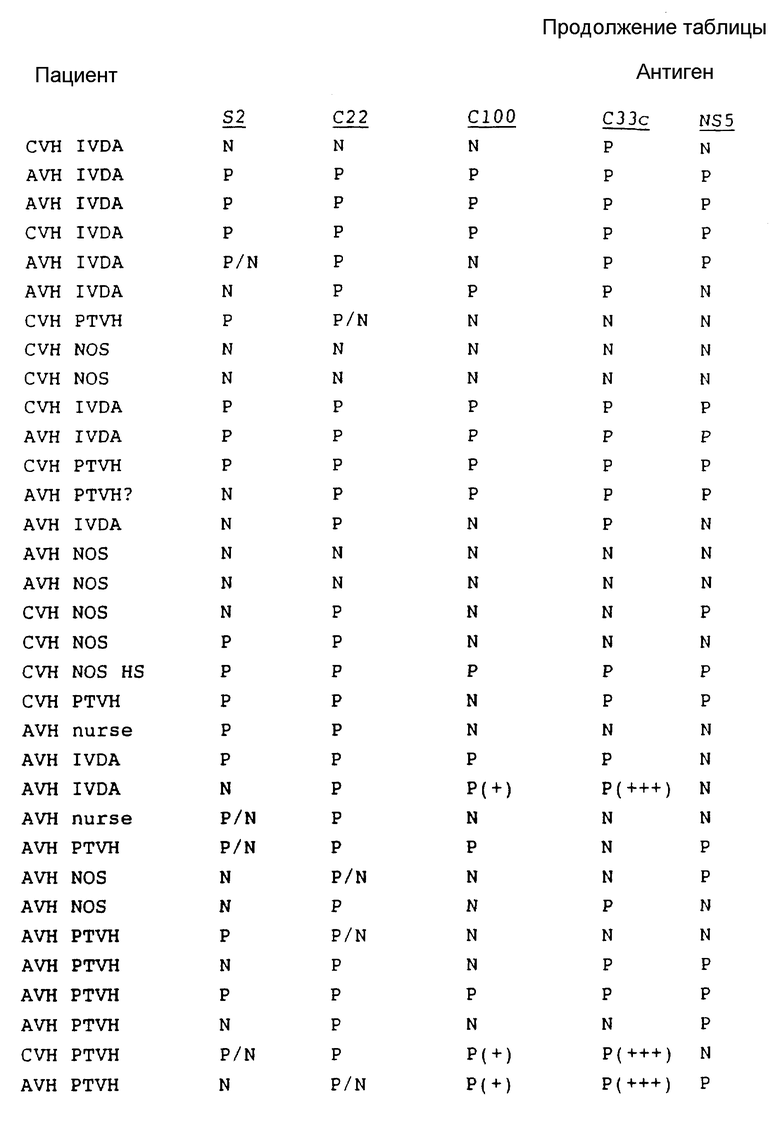
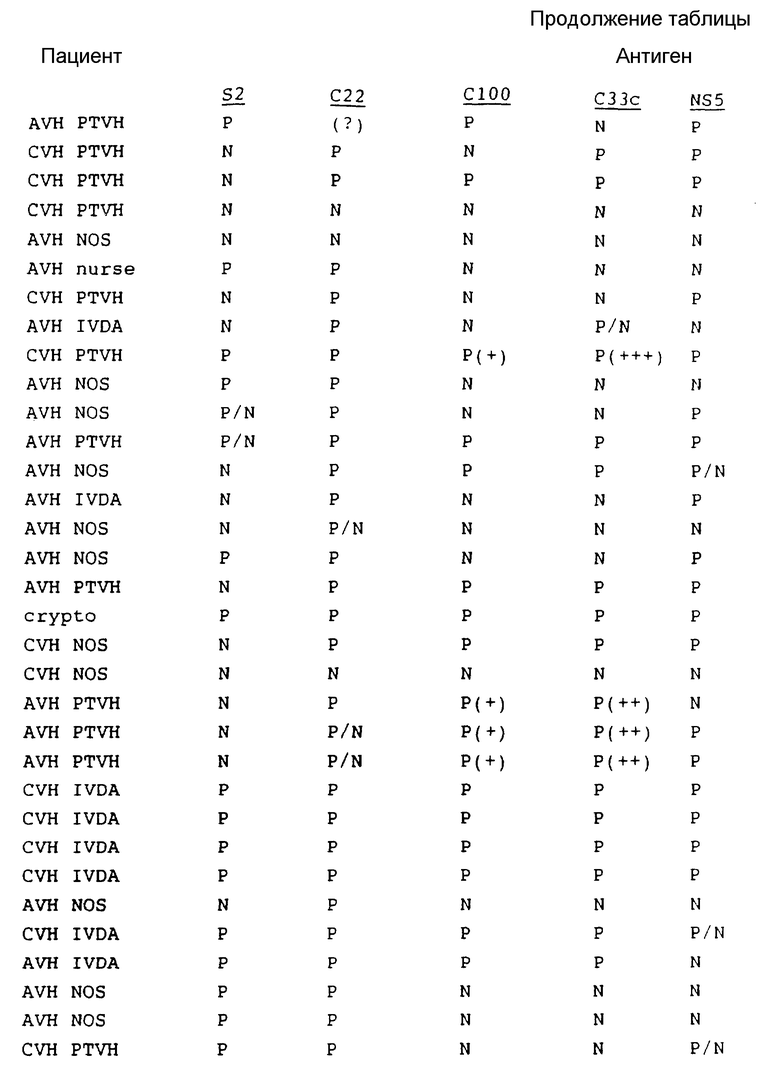
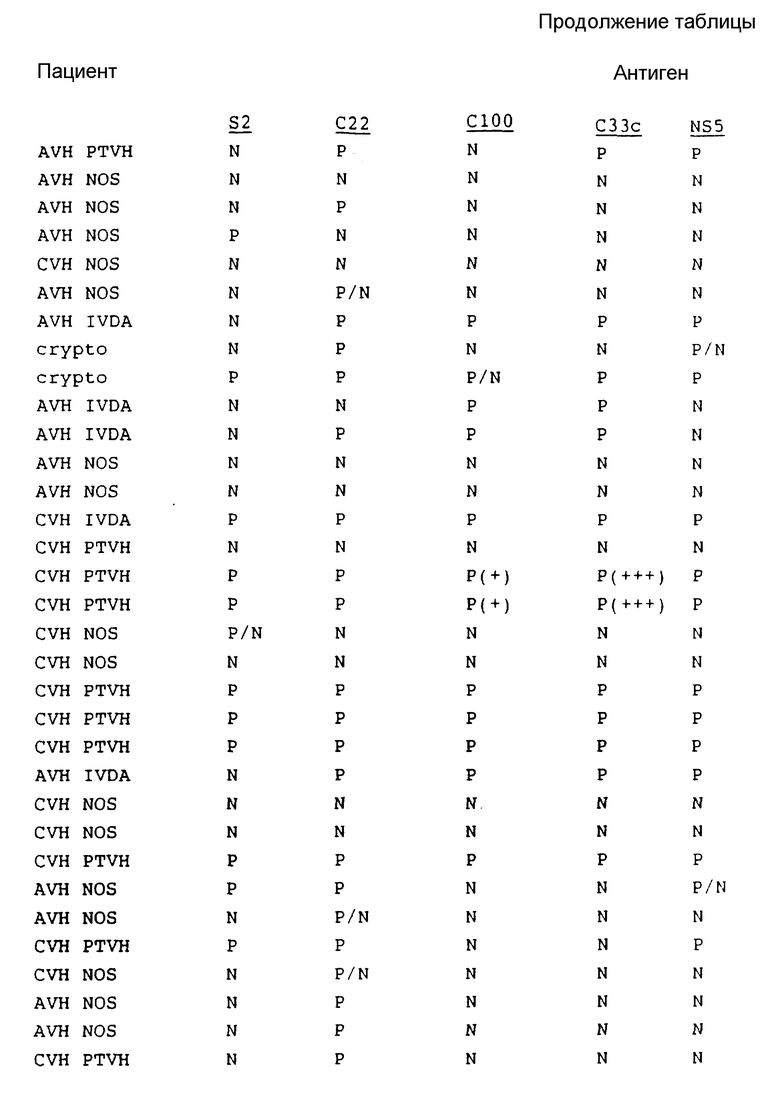
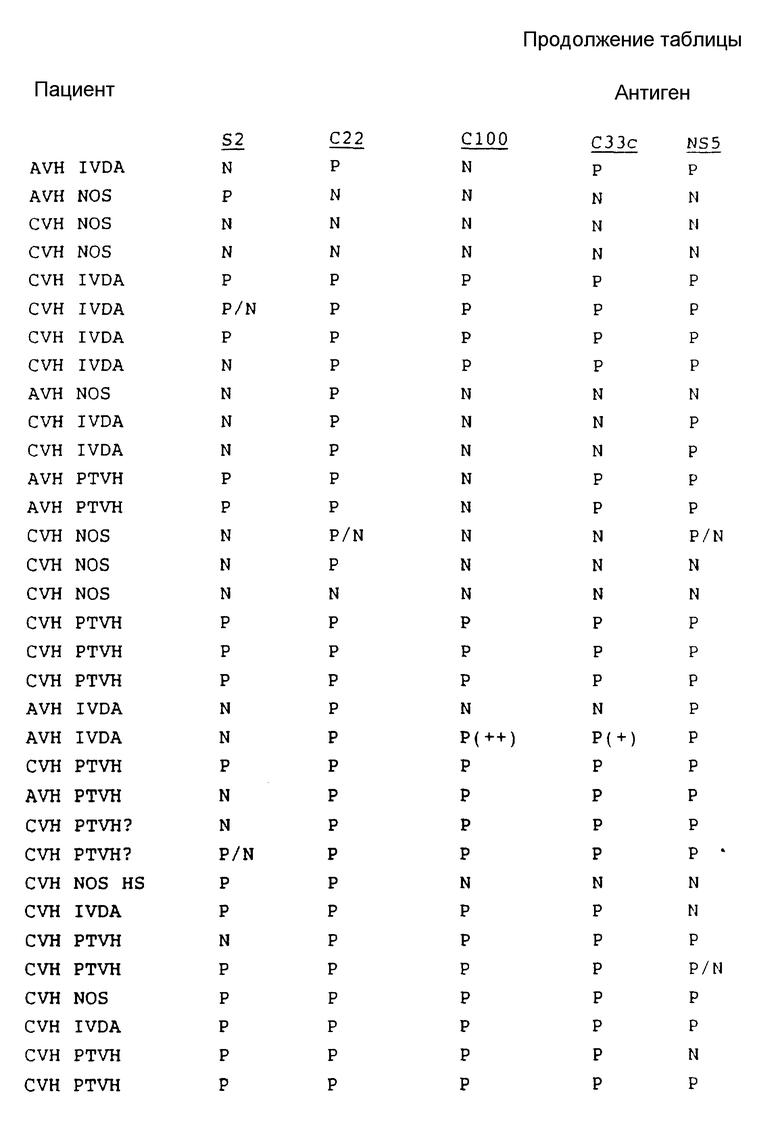
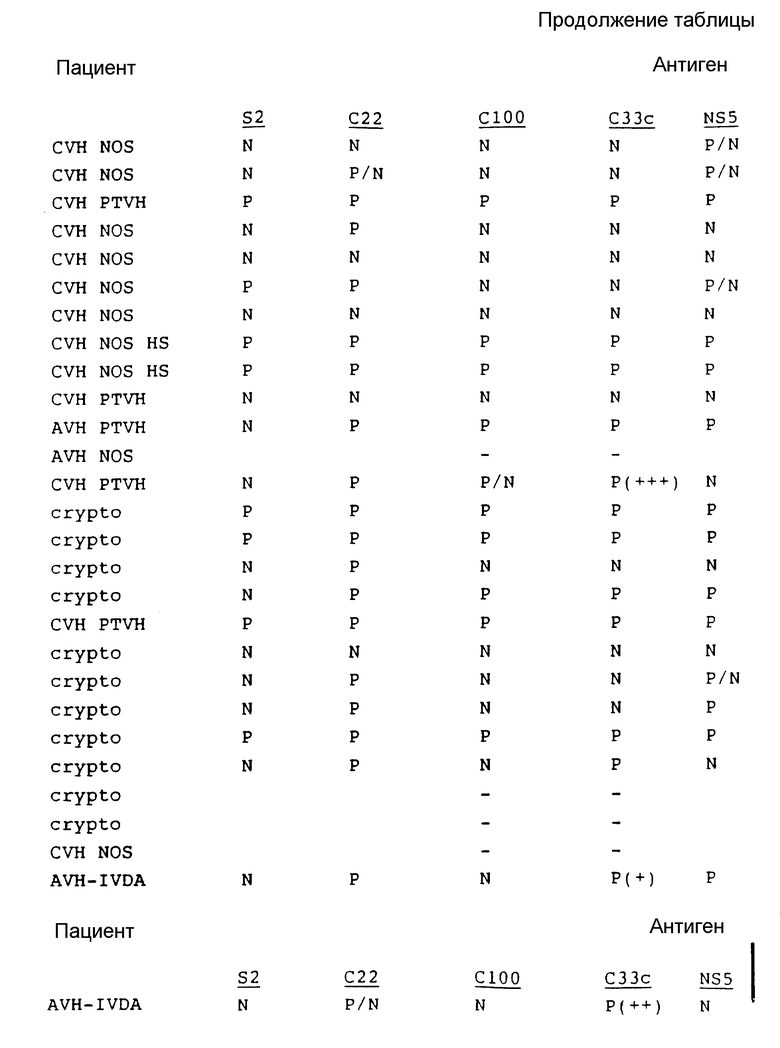
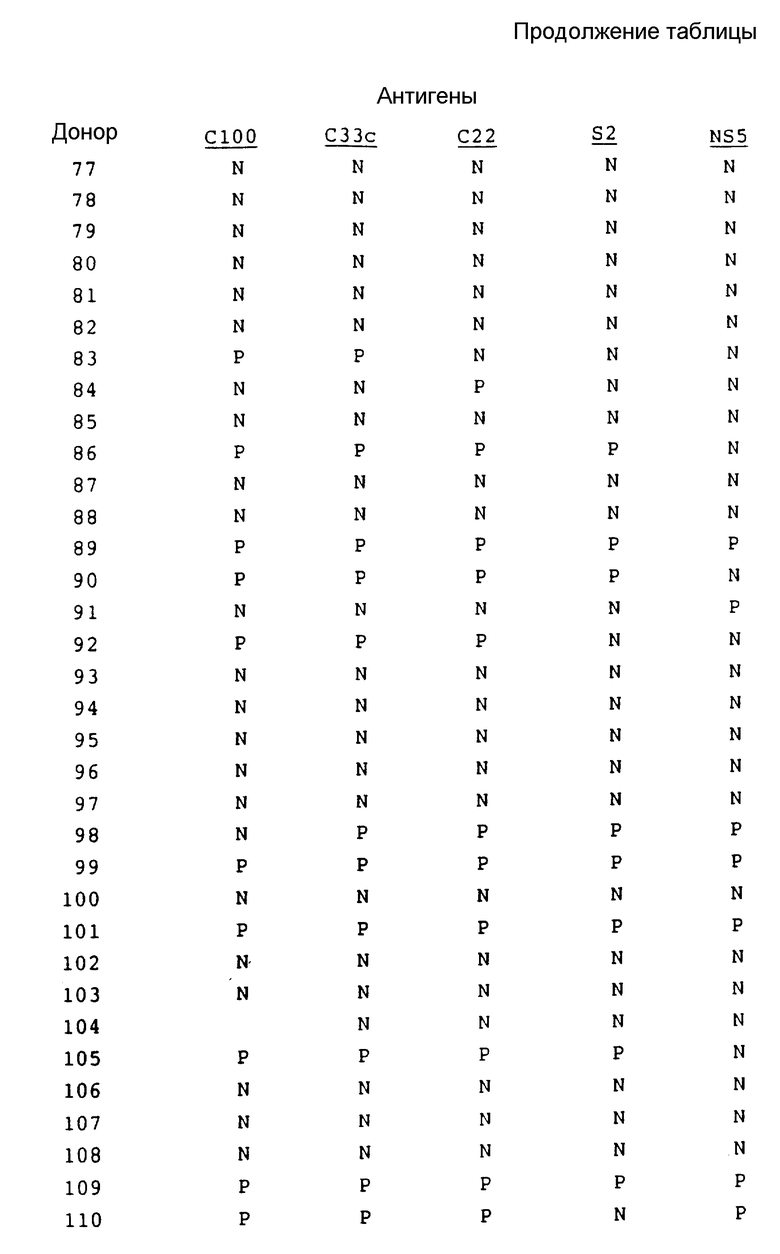
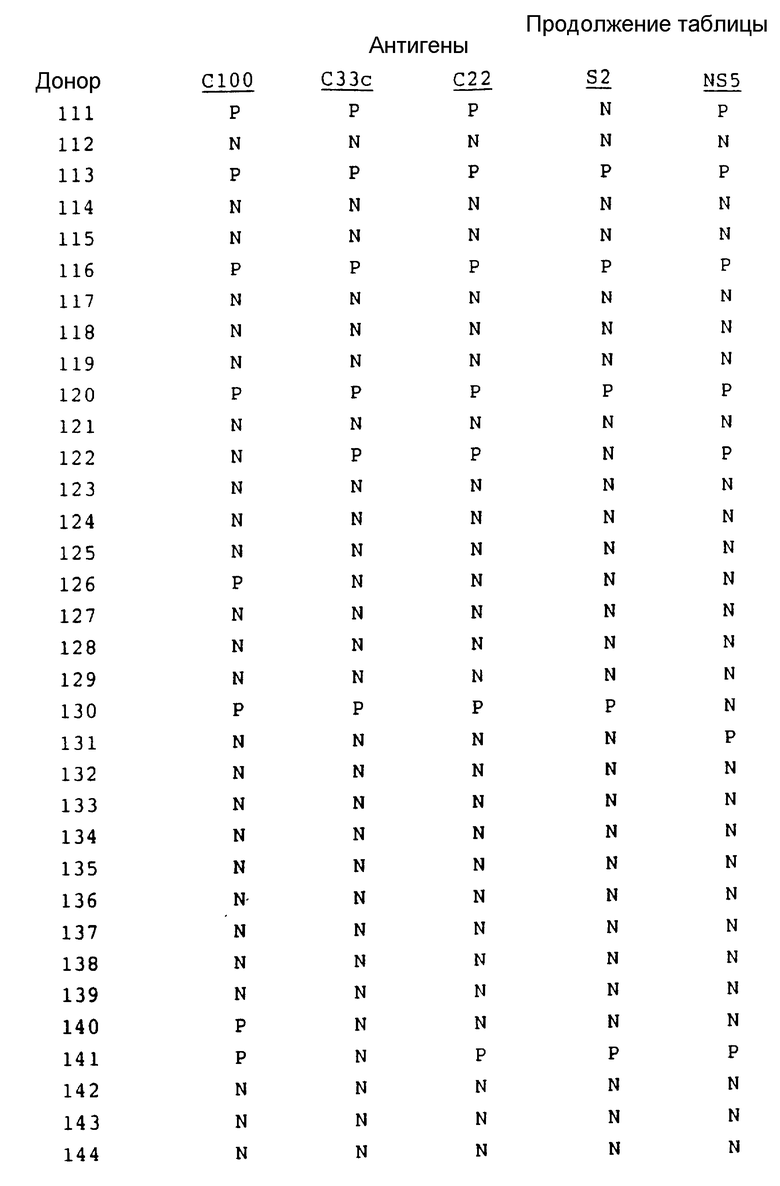
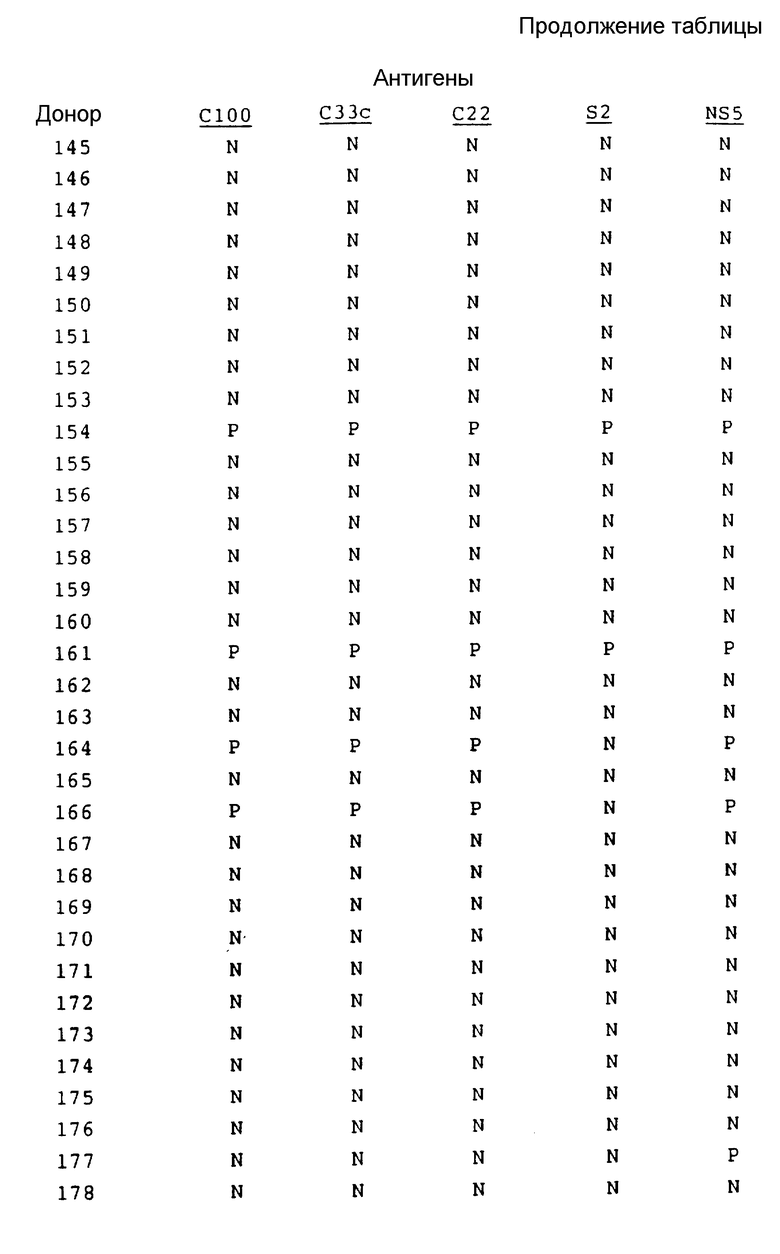
В табл. 1 представлены результаты испытаний сыворотки от пациентов, имеющих диагноз как пациентов с HCV.
Как показывают эти результаты, ни один одиночный антиген не реагирует со всеми сыворотками. C22 и C33c являются самыми активными, и S2 реагирует с некоторыми сыворотками при некоторых случаях предполагаемого острого HCV, с которыми никакой другой антиген не реагирует. На основе этих результатов можно сделать вывод, что комбинацией двух антигенов, которая обеспечит наибольший диапазон обнаружения, является комбинация C22 и C33c. Если будет желательно обнаружение максимума острых инфекций, то в данную комбинацию необходимо включить S2.
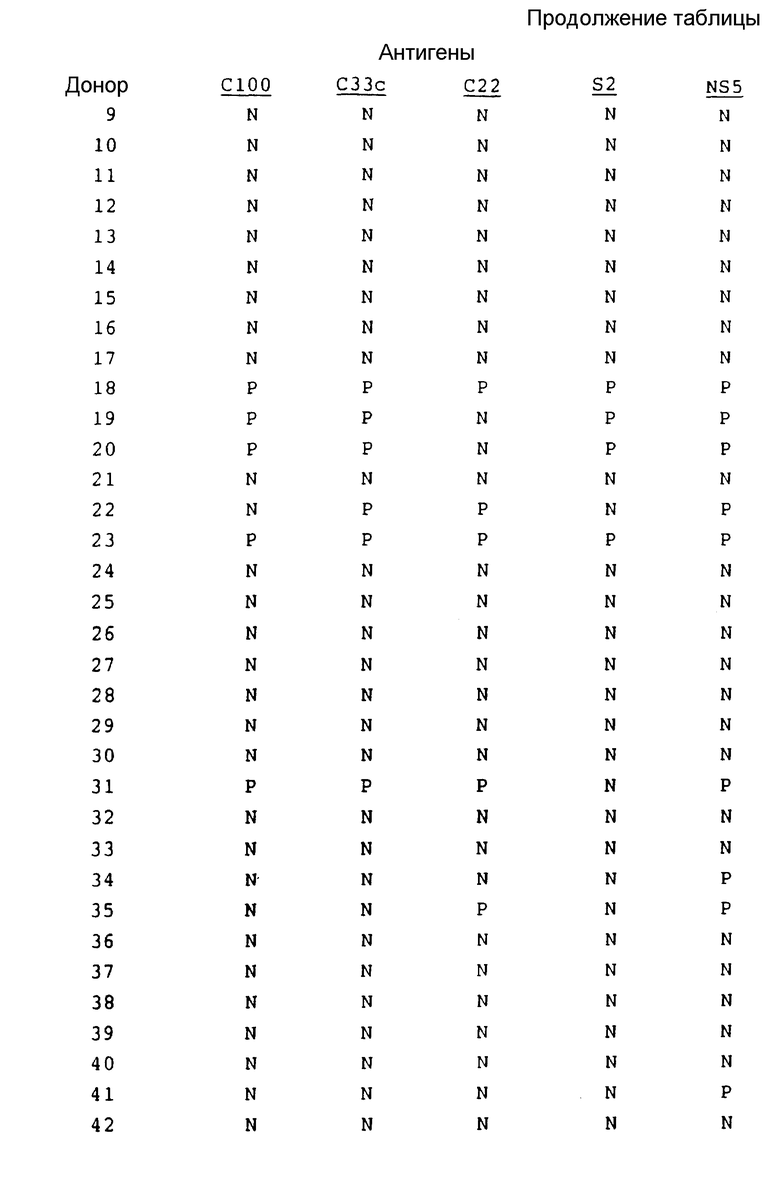
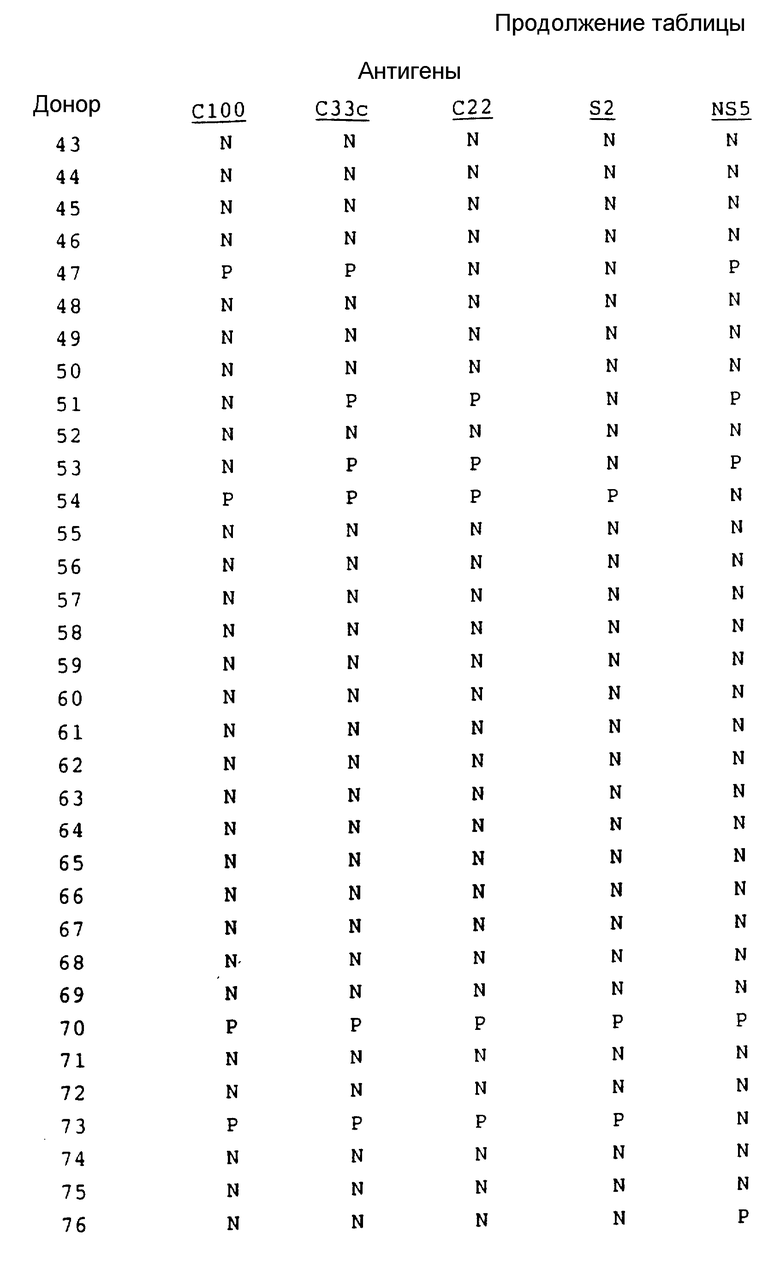
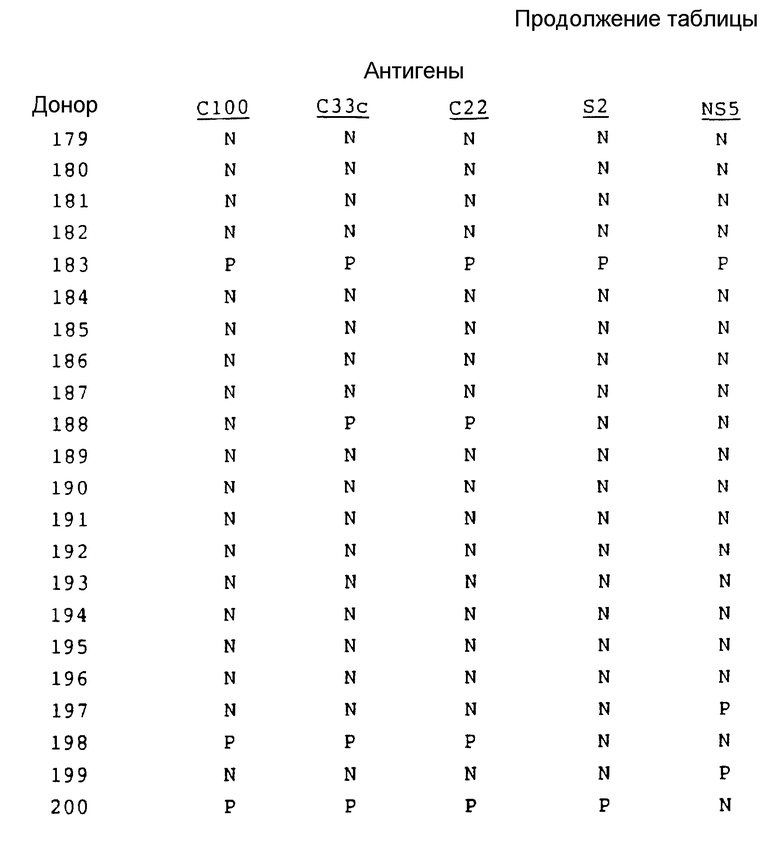
В табл. 2 представлены результаты испытания на донорах крови.
Результаты, полученные на здоровых донорах, обычно подтверждают результаты, полученные на сыворотке инфекционно зараженных пациентов.
Пример 7. Определение антител HCV методом ферментативного иммуносорбентного анализа с использованием комбинации антигенов HCV.
Пластины, покрытые комбинацией антигенов C22 и C33c, приготавливаются следующим образом. Раствор, содержащий наносимый в качестве покрытия буфер (50 ммоль борат натрия, pH 9,0), 21 мл/пластина, BSA (25 мкг/мл), C22 и C33c (2,50 мкг/мл каждый), приготавливается непосредственно до ввода на пластины Removawell Immulon I (Dynatech Corp.). После перемешивания в течение 5 мин на пластины подается 0,2 мл/ячейка раствора, на них наносится покрытие, и они инкубируются в течение 2 ч при 37oC, после чего раствор удаляется путем отсоса. Ячейки промываются один раз 400 мкл промывочного буферного раствора (100 ммоль фосфата натрия, pH 7,4, 140 ммоль хлорида натрия, 0,1% (вес/об.) казеина, 1% (вес/об. ) Тритона x-100, 0,01% (вес/об.) Тимеросаля). После удаления промывочного раствора вводят 200 мкл/ячейка последующего за покрытием раствора (10 ммоль фосфата натрия, pH 7,2, 150 ммоль хлорида натрия, 0,1% (вес/об. ) казеина, 3% сахарозы и 2 ммоль фенилметилсульфонилфторида (PMSF), пластины свободно покрываются для предотвращения испарения, и их выдерживают при комнатной температуре в течение 30 мин. Затем ячейки подвергаются отсосу для удаления раствора и подвергаются сухой лиофилизации в течение ночи без самопроизвольного нагрева. Приготовленные таким путем пластины могут храниться при 2-8oC в запаянных алюминиевых емкостях с осушителем (упаковки по 3 г Sorbit).
Для осуществления ферментативного иммуносорбентного анализа (ELISA) 20 мкл образца сыворотки или контрольного образца вводится в ячейку, содержащую 200 мкл разбавителя образца (100 ммоль фосфата натрия, pH 7,4 500 ммоль хлорида натрия, 1 ммоль EDTA, 0,1% (вес/об.) казеина, 0,01% (вес/об.) Тимеросаля, 1% (вес/об.) Тритона X-100, 100 мкг/мл дрожжевого экстракта). Пластины запаиваются и инкубируются при 37oC в течение 2 ч, после чего раствор удаляется путем отсоса, и ячейки трехкратно промываются 400 мкл промывочного буфера (фосфатосолевой буферный раствор (PBS), содержащий 0,05% Твина 20). Промытые ячейки обрабатываются 200 мкл конъюгата мышиный античеловеческий IgG - пероксидаза ложечницы приморской (HRP), содержащегося в растворе конъюгатного разбавителя орто (10 ммоль фосфата натрия, pH 7,2, 150 ммоль хлорида натрия, 50% (об/об) сыворотки бычьего эмбриона, 1% (об/об) термически обработанной лошадиной сыворотки, 1 ммоль k3Fe (CN)6, 0,05 (вес/об.) Твина 20, 0,02% (вес/об.) Тимеросаля). Обработка осуществляется в течение 1 ч при 37oC, раствор удаляется путем отсоса, и ячейки трехкратно промываются 400 мл промывочного буфера, который также удаляется путем отсоса. Для определения количества связанного ферментного конъюгата, вводится 200 мкл раствора субстрата 910 мг O-фенилендиаминдихлоргидрата на 5 мл раствора проявителя). Раствор проявителя содержит 50 ммоль цитрата натрия с pH 5,1, создаваемой посредством фосфорной кислоты, и 0,6 мкл/мл 30%-ной H2O2. Пластины, содержащие данный раствор субстрата, инкубируются в темноте в течение 30 мин при комнатной температуре, реакции прекращаются путем ввода 50 мкл/мл 4 н. серной кислоты, и определяется оптическая плотность (OD).
Аналогичным образом могут осуществляться анализы ELISA с использованием гибридных белков C22 и C33c и C22, C33c и S2, а также комбинаций C22 и C100, C22 и S2, C22 и антигена NS5, C22, C33c и S2 и C22, C100 и S2.
Модификации описанных выше приемов осуществления настоящего изобретения, которые очевидны для специалистов в области молекулярной биологии, иммунологии и смежных областях науки, не должны выходить из сферы действия данного изобретения, которая определена изложенной ниже формулой изобретения.
Перечень последовательностей.
Информация с последовательности ID NO: 1:
(i) Характеристики последовательности:
(A) Длина: 19 основных пар
(B) Тип: нуклеиновокислотный
(C) Число нитей: единственная
(D) Топология: линейная
(xi) Описание последовательности:
GATCCTGGAA TTCTGATAA
(2) Информация о последовательности ID NO: 2:
(i) Характеристики последовательности:
(A) Длина: 19 основных пар
(B) Тип: нуклеиновокислотный
(C) Число нитей: единственная
(D) Топология: линейная
(xi) Описание последовательности: ID NO: 2:
AAXXXTATCA GAATTCCAC
(2) Информация о последовательности ID NO: 3:
(i) Характеристики последовательности:
(A) Длина: 56 основных пар
(B) Тип: нуклеиновокислотный
(C) Число нитей: единственная
(D) Топология: линейная
(xi) Описание последовательности: ID NO: 3:
GAGTGCTCAA GCTTCAAAAC AAAATGGCTC ACXXXCTATC CCAGACAAAC CAGAGT
(2) Информация о последовательности ID NO: 4:
(i) Характеристики последовательности:
(A) Длина: 50 основных пар
(B) Тип: нуклеиновокислотный
(C) Число нитей: единственная
(D) Топология: линейная
(xi) Описание последовательности: ID NO: 4:
GAGTGCTCGT CGACTCATTA GGGGGAAACA TGGTTCCCCC GGGAGGCGAA
(2) Информация о последовательности ID NO: 5:
(i) Характеристики последовательности:
(A) Длина: 59 основных пар
(B) Тип: нуклеиновокислотный
(C) Число нитей: единственная
(D) Топология: линейная
(xi) Описание последовательности: ID NO: 5:
GAGTGCTCAA GCTTCAAAAC AAAATGGGGC TCTACCACGT CACCAATGAT TGCCCTACC
(2) Информация о последовательности ID NO: 6:
(i) Характеристики последовательности:
(A) Длина: 53 основные пары
(B) Тип: нуклеиновокислотный
(C) Число нитей: единственная
(D) Топология: линейная
(xi) Описание последовательности: ID NO: 6:
GAGTGCTCGT CGACTCATTA AGGGGACCAG TTCATCATCA TATCCCATGC CAT
(2) Информация о последовательности ID NO: 7:
(i) Характеристики последовательности:
(A) Длина: 53 основные пары
(B) Тип: нуклеиновокислотный
(C) Число нитей: единственная
(D) Топология: линейная
(xi) Описание последовательности: ID NO: 7:
GAGTGCAGCT TCAAAACAAA ATGAGCACGA ATCCTAAACC TCAAAAAAAA AAC
(2) Информация о последовательности ID NO: 8:
(i) Характеристики последовательности:
(A) Длина: 53 основные пары
(B) Тип: нуклеиновокислотный
(C) Число нитей: единственная
(D) Топология: линейная
(xi) Описание последовательности: ID NO: 8:
GAGTGCTCGT CGACTCATTA ACCCAAATTC CGCGACCTAC GCCGGGGGTC TGT
(2) Информация о последовательности ID NO: 9:
(i) Характеристики последовательности:
(A) Длина: 9401 основная пара
(B) Тип: нуклеиновокислотный
(C) Число нитей: неизвестно
(D) Топология: неизвестна
(ii) Молекулярный тип: ДНК (геномная)
(2) Информация о последовательности ID NO: 10:
(i) Характеристики последовательности:
(A) Длина: 3011 аминокислот
(B) Тип: аминокислотный
(C) Число нитей: неизвестно
(D) Топология: неизвестна
(ii) Молекулярный тип: белок
(ix) Характерные особенности
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 9
(D) Другая информация: (метка = Arg или Lys)
(Примечание: аминокислота 8 может быть либо Arg либо Lys)
(ix) Характерные особенности
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 11
(D) Другая информация: (примечание: данная аминокислота может быть либо Asn либо Thr)
(ix) Характерные особенности
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 176
(D) Другая информация: (примечание: данная аминокислота может быть либо Thr либо Ile)
(ix) Характерные особенности
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 334
(D) Другая информация: (примечание: данная аминокислота может быть либо Val либо Met)
(ix) Характерные особенности
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 603
(D) Другая информация: (примечание: данная аминокислота может быть либо Ile либо Leu)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 848
(D) Другая информация: (примечание: данная аминокислота может быть либо Asn либо Tyr)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 1114
(D) Другая информация: (примечание: данная аминокислота может быть либо Pro либо Ser)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 1117
(D) Другая информация: (примечание: данная аминокислота может быть либо Ser либо Thr)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 1276
(D) Другая информация: (примечание: данная аминокислота может быть либо Leu либо Pro)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 1328
(D) Другая информация: (примечание: данная аминокислота может быть либо Gly либо Val)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 1454
(D) Другая информация: (примечание: данная аминокислота может быть либо Tyr либо Cys)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 1471
(D) Другая информация: (примечание: данная аминокислота может быть либо Ser либо Thr)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 1877
(D) Другая информация: (примечание: данная аминокислота может быть либо Glu либо Gly)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 1948
(D) Другая информация: (примечание: данная аминокислота может быть либо His либо Leu)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 1949
(D) Другая информация: (примечание: данная аминокислота может быть либо Cys либо Ser)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 2021
(D) Другая информация: (примечание: данная аминокислота может быть либо Gly либо Val)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 2349
(D) Другая информация: (примечание: данная аминокислота может быть либо Thr либо Ser)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 2385
(D) Другая информация: (примечание: данная аминокислота может быть либо Phe либо Tyr)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 2386
(D) Другая информация: (примечание: данная аминокислота может быть либо Ser либо Ala)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 2502
(D) Другая информация: (примечание: данная аминокислота может быть либо Leu либо Phe)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 2690
(D) Другая информация: (примечание: данная аминокислота может быть либо Gly либо Arg)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 2921
(D) Другая информация: (примечание: данная аминокислота может быть либо Gly либо Arg)
(ix) Характерные особенности:
(A) Название - определитель: модифицированный сайт
(B) Местоположение: 2996
(D) Другая информация: (примечание: данная аминокислота может быть либо Leu либо Pro)
(xi) Описание последовательности: ID NO: 10а


















Изобретение относится к области иммуноанализа на HCV (ранее называемый не-A, не-B вирус гепатита). В частности оно касается комбинаций антигенов HCV, позволяющих осуществлять иммуноанализы широкого диапазона на HCV-антитела. Эти комбинации состоят из антигена от C-домена полипротеина HCV и по меньшей мере одного дополнительного антигена HCV как от домена NS3, домена NS4, домена S, так и от домена NS5, и они имеют форму гибридного белка, простой физической смеси или отдельных антигенов, обычно связанных с твердой матрицей. Комбинации антигенов HCV имеют более широкий диапазон иммунологической активности, чем любой одиночный антиген HCV. 5 с. и 5 з.п.ф-лы, 2 ил., 2 табл.
| US 4870008 A1, 26.09.89 | |||
| US 4751180 A1, 30.08.89 | |||
| PCT 8904669, 01.06.89 | |||
| СПОСОБ СТАБИЛИЗАЦИИ ГАЛОИДСОДЕРЖАЩИХ УГЛЕВОДОРОДОВ | 0 |
|
SU318216A1 |
Авторы
Даты
1999-05-27—Публикация
1991-03-29—Подача